Intanza 15 Mikrogramů/Kmen
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
INTANZA 15 mikrogramů/kmen injekční suspenze Vakcína proti chřipce (štěpený virion, inaktivovaný)
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Virus chřipky (inaktivovaný, štěpený) následujících kmenů*:
A/California/7/2009 (H1N1)pdm09 - varianta kmene (A/California/7/2009, NYMC X-179A) .............................................................................................................................15 mikrogramů HA**
A/Hong Kong/4801/2014 (H3N2) - varianta kmene (A/Hong Kong/4801/2014, NYMC X-263B) .............................................................................................................................15 mikrogramů HA**
B/Brisbane/60/2008 - varianta kmene (B/Brisbane/60/2008, divoký typ)..........15 mikrogramů HA**
v dávce 0,1 ml
* připravený v oplodněných slepičích vejcích ze zdravých drůbežích chovů
** hemaglutinin
Tato vakcína vyhovuje doporučení WHO (pro severní polokouli) a rozhodnutí EU pro sezónu 2016/2017.
Úplný seznam pomocných látek viz bod 6.1.
INTANZA může obsahovat rezidua vajec jako je například ovalbumin a residua neomycinu, formaldehydu a oktoxinolu 9, která jsou použita při výrobním procesu (viz bod 4.3).
3. LÉKOVÁ FORMA
Injekční suspenze.
Bezbarvá a opalescentní suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Prevence chřipky u dospělých osob ve věku 60 let a více, zvláště pokud jsou ve zvýšeném riziku přidružených komplikací.
Použití INTANZA má být v souladu s oficiálními doporučeními.
4.2 Dávkování a způsob podání
Dávkování
Osoby ve věku 60 let a více: 0,1 ml.
Pediatrická populace
Podávání INTANZA u dětí a mladistvých do 18 let se vzhledem k nedostatečným údajům o bezpečnosti a účinnosti nedoporučuje.
Způsob podání
Imunizace má být provedena intradermálně.
Doporučeným místem vpichu je oblast deltového svalu.
Opatření, která je nutno učinit před zácházením s léčivým přípravkem nebo před jeho podáním Návod k zacházení s léčivým přípravkem před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Přecitlivělost na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1, nebo na jakákoliv rezidua například vajec (ovalbumin, kuřecí bílkoviny), neomycin, formaldehyd a oktoxinol 9.
Očkování má být odloženo u pacientů s horečnatým onemocněním nebo akutní infekcí.
4.4 Zvláštní upozornění a opatření pro použití
Podobně jako u všech injekčně podávaných vakcín musí být pro případ anafylaktické reakce po podání vakcíny okamžitě k dispozici odpovídající lékařská péče a dohled (viz bod 4.8).
INTANZA nelze za žádných okolností podávat intravaskulárně.
U pacientů s endogenní nebo iatrogenní imunosupresí může být protilátková odpověď nedostatečná. Údaje o podávání INTANZA imunokompromitovaným pacientům jsou omezené.
Jestliže po podání vakcíny zůstane v místě vpichu kapalina, není nutné očkování opakovat. Interference se sérologickými testy viz bod 4.5.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce.
INTANZA může být aplikována současně s jinými vakcínami. Očkování má být provedeno do odlišných končetin. Je nutné poznamenat, že nežádoucí účinky mohou být intenzivnější.
Imunitní odpověď může být snížena u pacientů s probíhající imunosupresivní terapií.
Po očkování proti chřipce byly pozorovány falešně pozitivní výsledky sérologických testů používajících metodu ELISA k detekci protilátek proti HIV1, hepatitidě C a zejména proti HTLV1. Falešně pozitivní výsledky metody ELISA je možné vyloučit technikou Western blot. Přechodně falešně pozitivní výsledky mohou být způsobené IgM odpovědí na očkování.
4.6 Fertilita, těhotenství a kojení
Vakcína je určena pro osoby ve věku 60 let a více, proto není tato informace relevantní.
4.7 Účinky na schopnost řídit a obsluhovat stroje
INTANZA nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
a) Souhrn bezpečnostního profilu
Bezpečnost INTANZA byla hodnocena ve 3 otevřených randomizovaných klinických studiích, při nichž 3372 očkovaných dostalo injekci vakcíny INTANZA.
Bezpečnost byla hodnocena u všech osob v průběhu prvních 3 týdnů po očkování a závažné nežádoucí účinky byly sbírány po dobu šesti měsíců u 2974 osob (počet osob ve dvou ze tří klinických studií).
Po podání vakcíny se nejčastěji objevily lokální reakce v místě vpichu.
Viditelné místní reakce po intradermálním podání byly častější než po intramuskulárním podání srovnávací vakcíny s nebo bez adjuvans.
Většina reakcí spontánně odezněla do 1 až 3 dnů od nástupu.
Systémový bezpečnostní profil INTANZA je podobný jako u srovnávací vakcíny s nebo bez adjuvans podané intramuskulárně.
Po injekcích opakovaných v ročním intervalu je bezpečnostní profil INTANZA podobný jako u předchozích injekcí.
b) Tabulkový přehled nežádoucích účinků
Údaje uvedené níže shrnují četnost výskytu nežádoucích účinků, které byly zaznamenány po vakcinaci během klinických studií a během celosvětového post-marketingového sledování, a byly seřazeny podle následující klasifikace: velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000); velmi vzácné (<1/10000); není známo (z dostupných údajů nelze určit).
|
Třídy orgánových systémů |
Velmi časté |
Časté |
Méně časté |
Vzácné |
Velmi vzácné |
Neznámé |
|
Poruchy imunitního systému |
Alergické reakce zahrnující generalizované kožní reakce, zahrnující kopřivku, anafylaktickou reakci, angioedém, šok. | |||||
|
Poruchy nervového systému |
Parestezie, neuritida | |||||
|
Poruchy kůže a podkožní tkáně |
Pocení | |||||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Myalgie |
Artralgie | ||||
|
Celkové poruchy a reakce v místě aplikace |
Lokální reakce: zarudnutí*, zatvrdnutí, otok, svědění, bolest |
Nevolnost, svalový třes, horečka Lokální reakce: ekchymóza |
Únava |
* V některých případech místní zarudnutí přetrvávalo až 7 dnů
c) Možné nežádoucí účinky
Na základě zkušeností s trivalentními inaktivovanými vakcínami proti chřipce podávanými intramuskulámě nebo hlubokou subkutánní injekcí mohou být hlášeny následující nežádoucí účinky:
Poruchy krve a lymfatického systému
Přechodná trombocytopenie, přechodná lymfadenopatie
Poruchy nervového systému
Neuralgie, febrilní křeče, neurologické poruchy, jako je encefalomyelitida a syndrom Guillain-Barrého.
Cévní poruchy
Vaskulitida, vedoucí ve velmi vzácných případech k přechodnému postižení ledvin.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V
4.9 Předávkování
Je nepravděpodobné, že by předávkování mělo za následek jakýkoli neobvyklý účinek.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: vakcína proti chřipce, ATC kód: J07BB02 Imunogenita
Séroprotekce je obvykle dosaženo do 2 až 3 týdnů. Trvání postvakcinační imunity k homologním kmenům nebo kmenům blízce příbuzným k vakcinačním kmenům je různé, obvykle však 6 až 12 měsíců.
V klíčové randomizované srovnávací studii fáze III bylo podáno 2606 osobám nad 60 let věku 0,1 ml INTANZA intradermálně a 1089 osobám nad 60 let věku 0,5 ml trivalentní inaktivované vakcíny proti chřipce intramuskulámě.
V této komparativní studii byl hodnocen geometrický střední titr (GMTs), míra séroprotekce*, sérokonverze nebo signifikantní vzestup poměru** a geometrický střední poměr titrů (GMTR) pro protilátky anti-HA (měřeno HI) podle předem definovaných kritérií.
Byly získány následující údaje (hodnoty v závorkách ukazují 95% intervaly spolehlivosti):
|
Intradermálně 15^g | |||
|
A/H1N1 |
A/H3N2 |
B | |
|
A/New Caledonia/ 20/99 |
A/Wisconsin/ 67/2005 |
B/Malaysia/ 2506/2004 | |
|
N = 2585 |
N = 2586 |
N = 2582 | |
|
Geometrický střední titr (1/dil) |
81,7 (78,0 ; 85,6) |
298,0 (282 ; 315) |
39,9 (38,3 ; 41,6) |
|
Míra séroprotekce (%) * |
77,0 (75,3 ; 78,6) |
93,3 (92,3 ; 94,3) |
55,7 (53,8 ; 57,6) |
|
Sérokonverze nebo signifikantní vzestup poměru (%) ** |
38,7 (36,8 ; 40,6) |
61,3 (59,3 ; 63,1) |
36,4 (34,5 ; 38,3) |
|
Geometrický střední poměr titrů (GMTR) |
3,97 (3,77 ; 4,18) |
8,19 (7,68 ; 8,74) |
3,61 (3,47 ; 3,76) |
* Séroprotekce (ochranná hladina protilátek) = HI titry > 40
** Sérokonverze = negativní HI titr před vakcinací a HI titr > 40 po vakcinaci, signifikantní vzestup poměru = pozitivní HI titry před vakcinací a nejméně čtyřnásobné zvýšení HI titru po vakcinaci GMTR: geometrický střední poměr titrů u daného jedince (post-/pre-vakcinační titry).
INTANZA je přinejmenším stejně imunogenní jako srovnávací trivalentní inaktivovaná vakcína proti chřipce podávaná intramuskulárně pro každý ze tří kmenů chřipky u osob ve věku 60 let a více.
U všech tří kmenů chřipky byl geometrický střední titr (GMTs) u srovnávací intramuskulárně podané vakcíny v rozmezí 34,8 (1/dil) až 181,0 (1/dil), míra séroprotekce byla v rozmezí 48,9 % až 87,9 %, sérokonverze nebo signifikantní vzestup poměrů se pohybovaly v rozpětí od 30,0 % do 46,9 % a GMTR bylo 3,04x až 5,35x vyšší než HI titry před podáním vakcíny.
V randomizovaném srovnávacím hodnocení fáze III obdrželo 398 osob starších 65 let dávku 0,1 ml INTANZA podanou intradermálně, a 397 osob starších 65 let obdrželo 0,5 ml trivalentní inakativované vakcíny s adjuvans (obsahující MF-59) ve stejné dávce podávané intramuskulárně.
INTANZA je přinejmenším stejně imunogenní jako srovnávací trivalentní inaktivovaná vakcína s adjuvans (obsahující MF-59) co se týče GMT pro každý ze 3 kmenů chřipky stanoveno metodou SRH a pro 2 kmeny stanoveno metodou HI.
5.2 Farmakokinetické vlastnosti
Neuplatňuje se
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě studií na zvířatech neodhalily žádné zvláštní riziko pro člověka. Vakcína byla imunogenní u myší a králíků. Ve studiích toxicity opakovaných dávek u králíků nebyla prokázána žádná významná systémová toxicita. Jednorázové a opakované podání však vedlo k přechodnému místnímu erytému a otokům. Nebyla posuzována genotoxicita ani karcinogenní potenciál, protože tyto studie se u vakcín neprovádějí. Studie fertility a toxicity na reprodukci zvířecích samic neprokázaly žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Chlorid sodný Chlorid draselný
Dihydrát hydrogenfosforečnanu sodného Dihydrogenfosforečnan draselný Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
1 rok
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C až 8 °C). Chraňte před mrazem.
Injekční stříkačku uchovávejte ve vnějším obalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a velikost balení
0,1 ml suspenze v předplněné injekční stříkačce (sklo) s mikroinjekčním systémem, s připevněnou mikrojehlou a s elastomerovou pístovou zátkou (chlorbutyl), krytkou jehly (termoplastický elastomer a polypropylen) a ochranným krycím systémem jehly. Balení po 1, 10 nebo 20 kusech.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo jiný odpad musí být zlikvidován v souladu s místními požadavky.
Vakcína by měla před aplikací dosáhnout pokojové teploty.
Jestliže jsou v suspenzi přítomny cizorodé částice, vakcínu nepoužívejte.
Vakcínu není nutné před použitím protřepat.
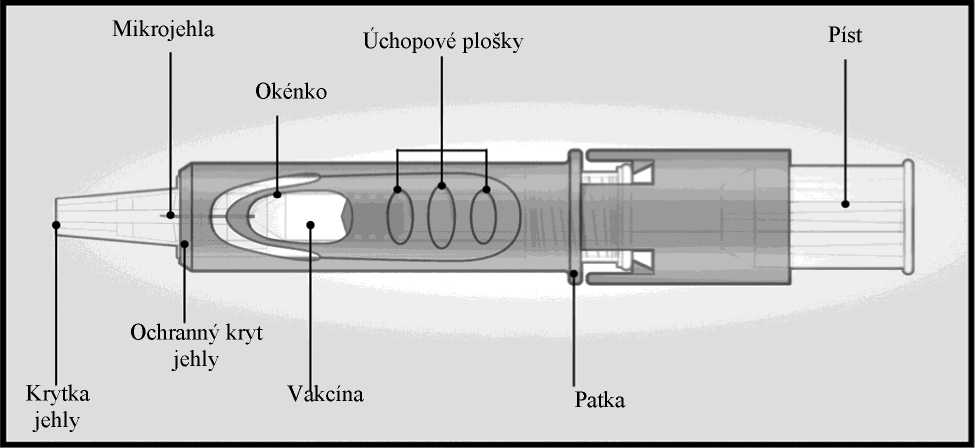
Mikroinjekční systém pro intradermální podání se skládá z předplněné injekční stříkačky s mikrojehlou (1,5 mm) a ochranným krytem jehly.
Ochranný kryt jehly je určen k překrytí mikrojehly po použití.
Mikroinjekční systém
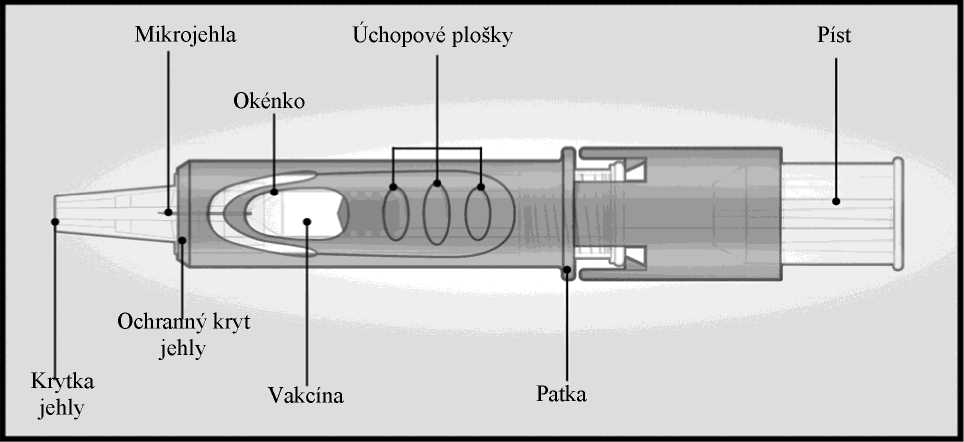
NÁVOD K POUŽITÍ
Před použitím si nejprve přečtěte návod
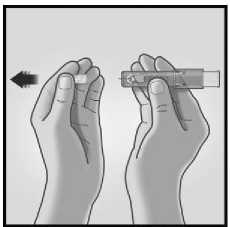
1/ SEJMĚTE KRYTKU JEHLY 2/ MIKROINJEKČNÍ SYSTÉM UCHOPTE
MEZI PALCEM A PROSTŘEDNÍČKEM
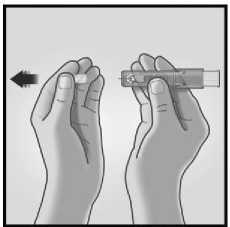
Z mikroinjekčního systému sejměte krytku jehly.
Jehlu neprofukujte.
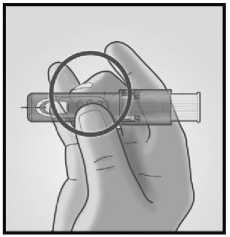
Uchopte systém přiložením palce a prostředníčku pouze na úchopové plošky: ukazováček zůstává volný.
Nedotýkejte se prsty okének.
3/ RYCHLE PŘILOŽTE JEHLU KOLMO 4/ UKAZOVÁČKEM STISKNĚTE PÍST
NA KŮŽI INJEKCE
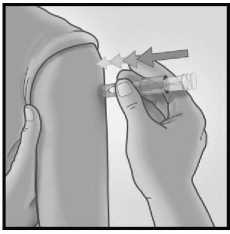
Krátkým a rychlým pohybem přiložte jehlu kolmo na kůži v oblasti deltového svalu.
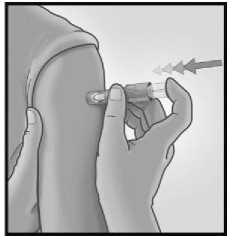
Po přiložení mikrojehly udržujte mírný tlak na povrch kůže a podejte injekci stisknutím pístu ukazováčkem. Není nutné provádět test žil.
5/ PEVNÝM STISKEM PÍSTU AKTIVUJTE OCHRANNÝ KRYT JEHLY
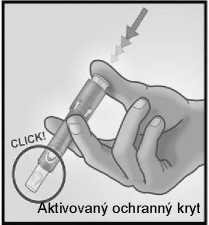
Vyjměte jehlu z kůže.
Otočte jehlu směrem od sebe a od ostatních osob.
Stejnou rukou velmi pevně stiskněte palcem píst a tím aktivujete ochranný kryt jehly.
Uslyšíte klapnutí a poté se vysune ochranný kryt, který jehlu překryje.
Použitý injekční systém neprodleně zlikvidujte v nejbližším sběrném kontejneru.
Aplikace se považuje za úspěšnou nezávisle na tom, zda pozorujete přítomnost pupenu.
Jestliže po podání vakcíny zůstane v místě vpichu tekutina, není nutné očkování opakovat.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Sanofi Pasteur MSD SNC, 162 avenue Jean Jaurěs, 69007 Lyon, Francie.
8. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/08/505/004
EU/1/08/505/005
EU/1/08/505/006
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE
Datum první registrace: 24. února 2009
Datum posledního prodloužení registrace: 24. února 2014
10. DATUM REVIZE TEXTU MM/RRRR
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury: http://www.ema.europa.eu/.
A. VÝROBCE/VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY/ BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ/ VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE/VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY/ BIOLOGICKÝCH
LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ/ VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa vvrobce/vvrobců biologické léčivé látky/ biologických léčivých látek
Sanofi Pasteur Parc Industriel dTncarville 27100 Val-de-Reuil Francie
Název a adresa výrobce odpovědného/ výrobců odpovědných za propouštění šarží
Sanofi Pasteur Parc Industriel d’Incarville 27100 Val-de-Reuil Francie
Sanofi Pasteur
Campus Mérieux
1541, avenue Marcel Mérieux
69280 Marcy l’Etoile
Francie
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
• Úřední propouštění sarzí
Podle článku 114 směrnice 2001/83/ES bude úřední propouštění šarží provádět některá státní laboratoř nebo laboratoř k tomuto účelu určená.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ TOHOTO LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
INTANZA 15 mikrogramů/kmen injekční suspenze Vakcína proti chřipce (štěpený virion, inaktivovaný) Kmeny pro sezónu 2016/2017
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Virus chřipky (inaktivovaný, štěpený) následujících kmenů: A/California/7/2009 (H1N1)pdm09 - varianta kmene A/Hong Kong/4801/2014 (H3N2) - varianta kmene B/Brisbane/60/2008 - varianta kmene 15 pg hemaglutininu na kmen v dávce 0,1 ml
Chlorid sodný, chlorid draselný, dihydrát hydrogenfosforečnanu sodného, dihydrogenfosforečnan draselný, voda na injekci.
Injekční suspenze
1 předplněná injekční stříkačka (0,1 ml) s mikroinjekčním systémem 10 předplněných injekčních stříkaček (0,1 ml) s mikroinjekčním systémem 20 předplněných injekčních stříkaček (0,1 ml) s mikroinjekčním systémem
Uchovávejte mimo dohled a dosah dětí.
Použitelné do:
Uchovávejte v chladničce. Chraňte před mrazem.
Uchovávejte injekční stříkačku ve vnějším obalu, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ.
Sanofi Pasteur MSD SNC 162 avenue Jean Jaures 69007 Lyon Francie
EU/1/08/505/004 - balení po 1 předplněné injekční stříkačce s mikroinjekčním systémem EU/1/08/505/005 - balení po 10 předplněných injekčních stříkačkách s mikroinjekčním systémem EU/1/08/505/006 - balení po 20 předplněných injekčních stříkačkách s mikroinjekčním systémem
Č.š.:
Nevyžaduje se - odůvodnění přijato.
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
PC:
SN:
NN:
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
INTANZA 15 pg/kmen 2016/2017 Vakcína proti chřipce Intradermální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP:
4. ČÍSLO ŠARŽE
Lot:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
0,1 ml
6. JINÉ
Sanofi Pasteur MSD SNC
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
INTANZA 15 mikrogramů/kmen injekční suspenze
Vakcína proti chřipce (štěpený virion, inaktivovaný).
Přečtěte si pozorně celou příbalovou informaci dříve, než dostanete tuto vakcínu, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tato vakcína byla předepsána výhradně Vám. Nedávejte ji žádné další osobě.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je INTANZA a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete INTANZA používat
3. Jak se INTANZA používá
4. Možné nežádoucí účinky
5. Jak INTANZA uchovávat
6. Obsah balení a další informace
1. Co je INTANZA a k čemu se používá
INTANZA je vakcína. Tato vakcína je doporučována k ochraně proti chřipce.
Vakcína může být podána dospělým osobám ve věku 60 let a více, zvláště pokud jsou ve zvýšeném riziku přidružených komplikací.
Po injekčním podání INTANZA začne imunitní systém (přirozená obrana organismu) vytvářet ochranu proti chřipkové infekci.
INTANZA Vás pomůže ochránit proti třem kmenům viru, které jsou obsaženy ve vakcíně, nebo dalším kmenům, které jsou k těmto kmenům blízce příbuzné. Plný účinek vakcíny se obvykle projeví za 2 až 3 týdny po očkování.
2. Čemu musíte věnovat pozornost, než začnete INTANZA používat
Nepoužívejte INTANZA:
- Jestliže jste alergický/á na:
- léčivé látky
- na kteroukoli další složku této vakcíny (uvedenou v bodě 6)
- jakoukoliv složku, která může být zastoupena ve stopovém množství jako například vejce (ovalbumin, kuřecí bílkoviny), neomycin, formaldehyd a oktoxinol 9.
- Jestliže máte horečku nebo akutní infekci, je lépe očkování odložit, dokud se neuzdravíte.
Upozornění a opatření
Před použitím INTANZA se poraďte se svým lékařem, lékarníkem nebo zdravotní sestrou.
- Před očkováním byste měli informovat lékaře, jestliže máte oslabený imunitní systém (imunosupresi) vlivem onemocnění nebo léčivých přípravků, protože vakcína nemusí v takovém případě fungovat dostatečně.
- Tuto vakcínu nelze za žádných okolností podat do cévy (intravaskulámě).
- Jestliže se z jakýchkoli důvodů máte během několika dní po očkování proti chřipce podrobit krevnímu testu, informujte, prosím, svého lékaře. Očkování by mohlo ovlivnit výsledky testů na HIV-1, virus hepatitidy C a HTLV-1.
Děti a dospívající
INTANZA není doporučeno podávat dětem nebo dospívajícím do 18 let.
Další vakcíny nebo léčivé přípravky a INTANZA
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době
užíval(a) nebo které možná budete užívat.
- Jiné vakcíny: INTANZA může být podána současně s jinými vakcínami. Očkování má být provedeno do odlišných končetin. Musí se vzít v úvahu, že nežádoucí účinky mohou být výraznější.
- Sdělte svému ošetřujícímu lékaři, jestliže jste užívali léky, které mohou snižovat imunitní reakci, například kortikosteroidy (kortizon) či léky proti rakovině (chemoterapie), nebo pokud jste podstoupili radioterapii nebo jste užívali jiné léky, které mají vliv na imunitní systém. V takovém případě se může stát, že vakcína bude mít sníženou účinnost.
Těhotenství a kojení a fertilita
Vakcína je určena pro osoby ve věku 60 let a více, proto není tato informace relevantní.
Řízení dopravních prostředků a obsluha strojů
Tato vakcína nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
3. Jak se INTANZA používá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Doporučená dávka přípravku je 0,1 ml pro osoby ve věku 60 let a více.
INTANZA vám podá lékař nebo zdravotní sestra.
INTANZA se podává jako injekce do horní vrstvy kůže (nejlépe do svalu v horní části paže).
Máte-li jakékoli další otázky, týkající se užívání této vakcíny, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tato vakcína nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Jestliže máte symptomy angioedému, měli byste neprodleně vyhledat lékaře. K těmto symptomům patří:
• Otok obličeje, jazyka nebo hltanu
• Obtížné polykání
• Kopřivka a dýchací potíže
V průběhu klinických studií a po uvedení přípravku na trh byly hlášeny tyto nežádoucí účinky při používání INTANZA.
Velmi časté reakce (mohou ovlivnit více než 1 osobu z 10)
- V místě vpichu: zarudnutí, zatvrdnutí, otok, svědění a bolest
- Bolest hlavy a svalů
Časté reakce (mohou ovlivnit až 1 osobu z 10)
- Podlitiny v místě vpichu
- Necítit se dobře, horečka (38,0 °C nebo vyšší) a svalový třes
Méně časté reakce (mohou ovlivnit až 1 osobu ze 100)
- Únava, bolest v kloubech a zvýšené pocení
Vzácné reakce (mohou ovlivnit až 1 osobu z 1000)
- Brnění nebo znecitlivění, zánět nervů, svědění a vyrážka
Reakce neznámé frekvence (frekvence nemůže být z dostupných údajů stanovena)
- Alergické reakce zahrnující kožní reakce, které se mohou rozšířit na celé tělo jako kopřivka, závažné alergické reakce (anafylaktická reakce), otok obličeje, jazyka či hltanu, potíže
s polykáním, kopřivka a dýchací potíže (angioedém), selhání oběhové soustavy (šok), které vyžaduje rychlou lékařskou pomoc.
Většina výše uvedených nežádoucích účinků vymizí bez léčby během 1-3 dnů. V některých případech zarudnutí v místě vpichu přetrvává až 7 dní.
Byly hlášeny následující nežádoucí účinky s jinými vakcínami proti chřipce. Tyto nežádoucí účinky se mohou vyskytnout po podání vakcíny INTANZA.
• Dočasné snížení počtu krevních destiček, které může vést ke vzniku podlitin nebo krvácení, dočasné otoky žláz na krku, podpaží a tříslech
• Bolesti pociťované v průběhu nervu, křeče doprovázené horečkou, poruchy nervové soustavy včetně zánětu mozku nebo míchy nebo Guillain-Barrého syndrom, který způsobuje extrémní slabost a paralýzu
• Zánětlivé onemocnění cév, které může ve velmi vzácných případech mít za následek dočasné postižení ledvin
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak INTANZA uchovávat
Uchovávejte tuto vakcínu mimo dohled a dosah dětí.
Nepoužívejte tuto vakcínu po uplynutí doby použitelnosti, uvedené na obalu za Použitelné do:. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v chladničce (2 °C až 8 °C). Chraňte před mrazem. Injekční stříkačku uchovávejte ve vnějším obalu, aby byl přípravek chráněn před světlem.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
Obsah balení a další informace
6.
Co INTANZA obsahuje
Léčivou látkou je virus chřipky (inaktivovaný, štěpený) následujících kmenů*:
A/Califomia/7/2009 (H1N1)pdm09 - varianta kmene (A/California/7/2009, NYMC X-179A). .............................................................................................................................15 mikrogramů HA**
A/Hong Kong/4801/2014 (H3N2) - varianta kmene (A/Hong Kong/4801/2014, NYMC X-263B) .............................................................................................................................15 mikrogramů HA**
B/Brisbane/60/2008 - varianta kmene (B/Brisbane/60/2008, divoký typ)..........15 mikrogramů HA**
v dávce 0,1 ml
* připravený v oplodněných slepičích vejcích ze zdravých drůbežích chovů
** hemaglutinin
Tato vakcína vyhovuje doporučení WHO (pro severní polokouli) a rozhodnutí EU pro sezónu 2016/2017.
Pomocnými látkami jsou: chlorid sodný, chlorid draselný, dihydrát hydrogenfosforečnanu sodného, dihydrogenfosforečnan draselný a voda na injekci.
Jak INTANZA vypadá a co obsahuje toto balení
Vakcína je bezbarvá opalescentní suspenze.
INTANZA je injekční suspenze v předplněné injekční stříkačce o objemu 0,1 ml s mikroinjekčním systémem v baleních po 1, 10 nebo 20 dávkách.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci: Sanofi Pasteur MSD SNC, 162 avenue Jean Jaures, 69007 Lyon, Francie.
Výrobce:
Sanofi Pasteur - Parc Industriel d’Incarville - 27100 Val-de-Reuil - Francie
Sanofi Pasteur, Campus Mérieux - 1541, avenue Marcel Mérieux - 69280 Marcy l’Etoile - Francie Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien Sanofi Pasteur MSD Tél/Tel: +32 2 726.95.84 |
Lietuva Sanofi - Aventis Lietuva, UAB Tel.: +370 5 2730967 |
|
Btarapna Sanofi Pasteur S.A: Tea.: +359 2 980 08 33 |
Luxembourg/Luxemburg Sanofi Pasteur MSD Tél: +32 2 726.95.84 |
|
Česká republika Sanofi Pasteur divize vakcín sanofi-aventis, s.r.o. Tel: +420 233 086 111 |
Magyarország sanofi-aventis zrt Tel.: +36 1 505 0055 |
|
Danmark Sanofi Pasteur MSD Tlf: +45 23 32 69 29 |
Malta Cherubino Ltd Tel.: +356 21 343270 |
|
Deutschland Sanofi Pasteur MSD GmbH Tel: +49 30 499198-0 |
Nederland Sanofi Pasteur MSD Tel: +31.23.567.96.00 |
|
Eesti Sanofi-Aventis Estonia OU Tel.: +372 627 3488 |
Norge Sanofi Pasteur MSD Tlf: +47.67.50.50.20 |
|
EXXáSa BIANEH A.E. Tqk: +30.210.8009111 |
Osterreich Sanofi Pasteur MSD GmbH Tel: +43.1.890 34 91 14 |
|
Espaňa Sanofi Pasteur MSD S.A. Tel: +34.91.371.78.00 |
Polska Sanofi Pasteur Sp. z o.o. Tel.: +48 22 280 05 00 |
|
France Sanofi Pasteur MSD SNC Tél: +33.4.37.28.40.00 |
Portugal Sanofi Pasteur MSD, SA Tel: +351 21 470 4550 |
|
Hrvatska sanofi-aventis Croatia d.o.o Tel: + 385 1 6003 400 |
Románia sanofi - aventis Romania SRL Tel.: +40(21) 317 31 36 |
|
Ireland Sanofi Pasteur MSD Ltd Tel: +353 1 468 5600 |
Slovenija ALPE s.p. Tel.: +386 (0)1 432 62 38 |
|
Island Sanofi Pasteur MSD Sími: +32.2.726.95.84 |
Slovenská republika sanofi - aventis Pharma Slovakia s.r.o. divízia vakcín Sanofi Pasteur Tel.: +421 2 33 100 100 |
|
Italia Sanofi Pasteur MSD Spa Tel: +39 06.664.09.211 |
Suomi/Finland Sanofi Pasteur MSD Puh/Tel: +358 9 565 88 30 |
|
Kónpoq r. A. Exapáxn? & Era AxS. T^A,: +357 - 22 76 62 76 |
Sverige Sanofi Pasteur MSD Tel: +46.8.564.888.60 |
|
Latvija Sanofi Aventis Latvia SIA Vakcínu nodala Tel.: +371 67114978 |
United Kingdom Sanofi Pasteur MSD Ltd Tel: +44.1.628.785.291 |
Tato příbalová informace byla naposledy revidována {MM/RRRR}.
Další zdroje informací
Podrobné informace o této vakcíně jsou uveřejněny na webových stránkách Evropské lékové agentury: http://www.ema.europa.eu/.
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
• Podobně jako u všech injekčně podávaných vakcín musí být pro případ anafylaktické reakce po podání vakcíny vždy okamžitě k dispozici odpovídající lékařská péče a dohled.
• Vakcína by měla před aplikací dosáhnout pokojové teploty.
• Jestliže jsou v suspenzi přítomny cizorodé částice, vakcínu nepoužívejte.
• Vakcínu není nutné před použitím protřepat.
• Mikroinjekční systém pro intradermální injekci se skládá z předplněné injekční stříkačky s mikrojehlou (1,5 mm) a ochranným krytem jehly.
Ochranný kryt jehly je určen k překrytí mikrojehly po použití.
Mikroinjekční systém
NÁVOD K POUŽITÍ
Před použitím si nejprve přečtěte návod
1/ SEJMĚTE KRYTKU JEHLY 2/ MIKROINJEKČNÍ SYSTÉM UCHOPTE
MEZI PALCEM A PROSTŘEDNÍČKEM
Z mikroinjekčního systému sejměte krytku jehly.
Jehlu neprofukujte.
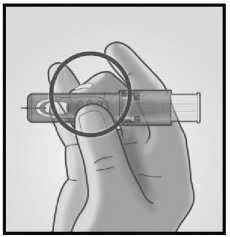
Uchopte systém přiložením palce a prostředníčku pouze na úchopové plošky: ukazováček zůstává volný.
Nedotýkejte se prsty okének.
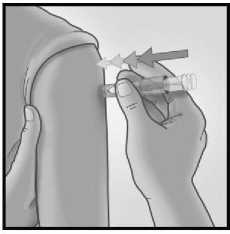
Krátkým a rychlým pohybem přiložte jehlu kolmo na kůži v oblasti deltového svalu.
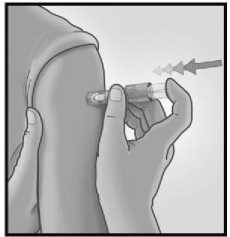
Po přiložení mikrojehly udržujte mírný tlak na povrch kůže a podejte injekci stisknutím pístu ukazováčkem. Není nutné provádět test žil.
5/ PEVNÝM STISKEM PÍSTU AKTIVUJTE OCHRANNÝ KRYT JEHLY
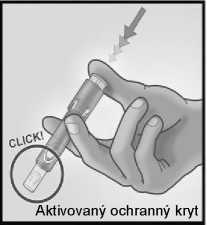
Vyjměte jehlu z kůže.
Otočte jehlu směrem od sebe a od ostatních osob.
Stejnou rukou velmi pevně stiskněte palcem píst a tím aktivujete ochranný kryt jehly.
Uslyšíte klapnutí a poté se vysune ochranný kryt, který jehlu překryje.
Použitý injekční systém neprodleně zlikvidujte v nejbližším sběrném kontejneru.
Aplikace se považuje za úspěšnou nezávisle na tom, zda pozorujete přítomnost pupenu.
Jestliže po podání vakcíny zůstane v místě vpichu tekutina, není nutné očkování opakovat.
Viz též bod 3. Jak se INTANZA používá
27