Instanyl 100 Mikrogramů/Dávka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Instanyl 50 mikrogramů/v jedné dávce, nosní sprej, roztok Instanyl 100 mikrogramů/v jedné dávce, nosní sprej, roztok Instanyl 200 mikrogramů/v jedné dávce, nosní sprej, roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Instanyl 50 mikrogramů/v jedné dávce, nosní sprej, roztok
Jeden ml roztoku obsahuje fentanyli citras, odpovídá. fentanylum 500 mikrogramů Jedna dávka (100 mikrolitrů) obsahuje fentanylum 50 mikrogramů
Instanyl 100 mikrogramů/v jedné dávce, nosní sprej, roztok
Jeden ml roztoku obsahuje fentanyli citras, odpovídá fentanylum 1 000 mikrogramů
Jedna dávka (100 mikrolitrů) obsahuje fentanylum 100 mikrogramů
Instanyl 200 mikrogramů/v jedné dávce, nosní sprej, roztok
Jeden ml roztoku obsahuje fentanyli citras, odpovídá. fentanylum 2 000 mikrogramů Jedna dávka (100 mikrolitrů) obsahuje fentanylum 200 mikrogramů
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Nosní sprej, roztok (nosní sprej) Čirý, bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Instanyl je určen pro dospělé pacienty k léčbě průlomové bolesti, kteří jsou již současně léčeni opioidy z důvodu chronické nádorové bolesti. Průlomová bolest je charakterizována jako přechodné zesílení stávající bolesti, které se může objevit na podkladě jinak kontrolovaného perzistujícího bolestivého stavu.
Dále je určen pacientům, kteří jsou již léčeni opioidy a již užívají morfin nejméně 60 mg denně perorálně, nebo fentanyl nejméně 25 mikrogramů za hodinu transdermálně, nebo oxycodein nejméně 30 mg denně nebo hydromorfon 8 mg perorálně denně nebo equianalgetickou dávku jiného opioidu po dobu jednoho týdne a déle.
4.2 Dávkování a způsob podávání
Léčba by měla být zahájena a vedena pod dohledem lékaře, který má zkušenosti s léčbou opioidy u pacientů s karcinomem. Lékař musí mít na paměti možnost zneužití fentanylu.
Dávkování
Dávka přípravku by měla být individuálně titrována pro každého pacienta, aby bylo úspěšně dosaženo dostatečné analgézie a s výskytem takových nežádoucích účinků, které jsou ještě v toleranci pacienta. Pacient musí být pečlivě sledován v průběhu titrace dávky. Titrace vyšších dávek nutně vyžaduje kontakt s lékařem.
Dávka přípravku Instanyl pro léčbu průlomové bolesti není podle klinických studií (viz bod 5.1) závislá na denní udržovací dávce opioidů.
Maximální denní dávka: Použití je možné nejvíce pro čtyři epizody průlomové bolesti, pro každou lze použít ne více než dvě dávky přípravku a ne dříve než po 10 minutách od předešlé aplikace.
Pacienti by měli vyčkat nejméně 4 hodiny, než mohou použít Instanyl při další epizodě průlomové bolesti při titraci i udržování léčby.
Titrace dávky
Před započetím titrování dávky přípravku Instanyl je předpokladem, že stávající chronická bolest je kontrolována trvalou medikací opioidy, a epizody průlomové bolesti se nevyskytují častěji než čtyřikrát denně.
Postup titrace dávky
Počáteční dávka by měla být jedna dávka 50 mikrogramů do jednoho nosního průduchu, postupně lze zvyšovat dávku podle potřeby v rozsahu dostupných dávek (50,100 a 200 mikrogramů). Jestliže není dosaženo dostatečné úlevy od bolesti, stejná dávka může být aplikována nejdříve po 10 minutách od předešlé aplikace. Každý postup titrace (síla dávky) má být hodnocen v průběhu několika epizod bolesti.
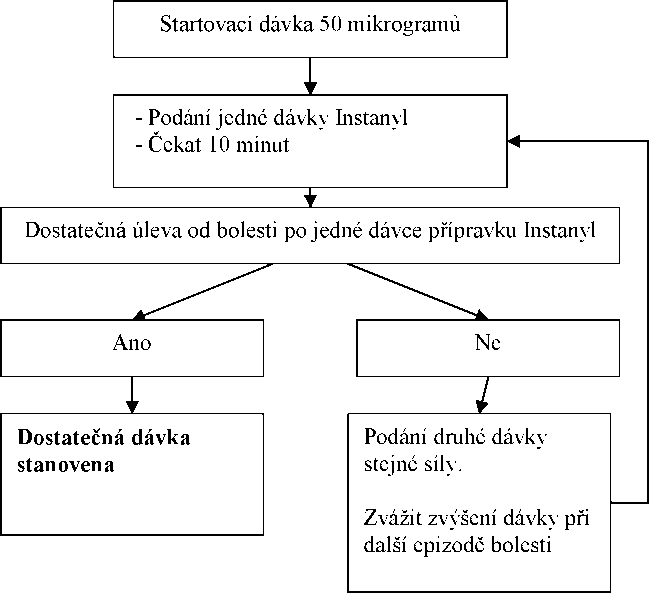
Udržovací léčba
Jestliže dojde ke stanovení dostatečné léčebné dávky podle postupu popsaného výše, pacient užívá tuto udržovací stanovenou dávku přípravku Instanyl. Jestliže pacient cítí nedostatečnou úlevu od bolesti, může být podána dodatečná dávka přípravku ve stejné síle, ne však dříve než po 10 minutách od poslední aplikace.
Upravení dávky
Obecně platí, že udržovací dávka přípravku Instanyl má být zvýšena, jestliže pacient vyžaduje více než jednu dávku k léčbě průlomové bolesti v průběhu několika za sebou následujících epizod bolesti. Úprava dávky základní opioidní léčby může být nezbytná, jestliže pacient udává více než čtyři epizody průlomové bolesti v průběhu 24 hodin.
Pokud nežádoucí účinky přetrvávají nebo jsou nesnesitelné, musí být dávka snížena nebo musí být přípravek Instanyl nahrazen jinými analgetiky.
Přerušení léčby
Léčba přípravkem Instanyl má být ihned přerušena, jestliže pacient neudává další výskyt epizod průlomové bolesti. V základní léčbě chronické bolesti je třeba dále pokračovat podle dosavadního schématu.
Jestliže je nutné přerušení veškeré opioidní léčby, musí pacient pečlivě dodržovat instrukce lékaře pro postupné ukončení léčby (sestupná titrace dávky opioidů) z důvodu snížení možnosti vzniku náhlých abstinenčních příznaků.
Zvláštní populace
Starší populace
Pro použití přípravku Instanyl u pacientů nad 65 let věku jsou dostupné jen omezené údaje o farmakokinetice, účinnosti a bezpečnosti přípravku. Starší pacienti mohou mít sníženou clearance, prodloužený poločas účinku a vyšší citlivost k fentanylu než mladší pacienti. Proto se doporučuje opatrnost při použití u starších, kachektických a oslabených pacientů.
V klinických studiích je u starších pacientů prokázána nižší účinná dávka než u pacientů mladších 65 let věku. Zvláštní opatrnost se doporučuje při dávkování přípravku Instanyl u starších pacientů.
Poškození funkce jater
Opatrnosti je třeba při podávání přípravku Instanyl při mírném až závažném poškození funkce jater (viz bod 4.4.)
Poškození funkce ledvin
Opatrnosti je třeba při podávání přípravku Instanyl při mírném až závažném poškození funkce ledvin (viz bod 4.4.)
Pediatrická populace
Dosud nebyla stanovena bezpečnost a účinnost přípravku Instanyl u dětí mladších 18 let.
Nejsou k dispozici žádná data.
Způsob podání
Instanyl je určen k nosnímu podání.
Doporučuje se, aby pacient při aplikaci přípravku Instanyl seděl nebo stál vzpřímeně.
Po každém použití nosního spreje je nutné očistit aplikátor.
Zvláštní upozornění, kterých je třeba dbát před manipulací s léčivým přípravkem nebo před jeho podáním
Před prvním použitím přípravku Instanyl, je třeba zkontrolovat, zda je nosní sprej připraven k použití. Je třeba 3 až 4 krát stisknout dávkovač nosního spreje do okamžiku, kdy se objeví jemný aerosol.
V případě, že přípravek není používán po více než sedm dní, musí být před dalším použitím jeho funkce popsaným způsobem znovu zkontrolována.
Během procesu přípravy k použití se trocha přípravku vystříkne do vzduchu. Proto je třeba pacienta poučit, aby přípravu k použití prováděl v dobře větraném prostoru a mířil směrem od sebe a dalších osob a směrem od povrchů a předmětů, se kterými by mohly přijít do kontaktu jiné osoby, zejména děti.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku uvedenou v bodě 6.1.
Pacienti bez udržovací léčby opioidy, proto zde existuje zvýšené riziko respirační deprese.
Léčba jiné akutní bolesti než bolesti průlomové.
Závažná respirační deprese nebo závažné obstrukční onemocnění plic.
Předchozí radioterapie obličeje.
Opakované epizody epistaxe (krvácení z nosu), (viz bod 4.4).
4.4 Zvláštní upozornění a opatření pro použití
Respirační deprese
U některých pacientů může podání fentanylu vyvolat klinicky významnou respirační depresi, pacient proto musí být sledován z důvodu tohoto rizika. Pacienti v léčbě bolesti, kteří podstupují trvalou terapii pomocí opiátů, jsou schopni vyvinout toleranci vůči respirační depresi a tím je nebezpečí vzniku respirační deprese u těchto pacientů sníženo. Současné užívání léčivých přípravků, které tlumí aktivitu centrálního nervového systému, může zvýšit nebezpečí vzniku respirační deprese (viz bod 4.5).
Chronické plicní onemocnění
U pacientů s chronickým obstrukčním bronchopulmonálním onemocněním může fentanyl vyvolat více závažných nežádoucích účinků. U těchto pacientů mohou opiáty snížit dechovou pohotovost a zvýšit rezistenci dýchacích cest.
Insuficience funkce ledvin nebo jater
Opatrnosti je třeba při podávání fentanylu při mírné až závažné poruše funkce jater nebo ledvin. Vliv nedostatečnosti funkce jater a ledvin na farmakokinetiku přípravku Instanyl nebyl dosud vyhodnocen; avšak, při podávání fentanylu intravenózně se ukazuje, že clearence fentanylu je alterován v důsledku snížené funkce jater a ledvin, která je způsobená změnami v metabolismu clearence a plazmatických proteinů.
Zvýšený nitrolební tlak
Opatrnosti je zapotřebí při použití fentanylu u pacientů se zvýšeným intrakraniálním tlakem, sníženým vědomím nebo v bezvědomí.
Vyšší pozornost vyžaduje rovněž používání přípravku Instanyl u pacientů s mozkovým nádorem nebo poraněním hlavy.
Srdeční onemocnění
Fentanyl může vyvolat bradykardii. Fentanyl by měl být používán s opatrností u pacientů s předchozími nebo stávajícími bradyarytmiemi.
Opioidy mohou způsobit hypotenzi, zejména u pacientů s hypovolémií. Proto je třeba opatrnosti při použití přípravku Instanyl u pacientů s hypotenzí a/nebo s hypovolémií.
Serotoninový syndrom
Opatrnost se doporučuje při současném podání přípravku Instanyl s léčivými přípravky, které ovlivňují serotonergní neurotransmiterové systémy.
K vývoji potenciálně život ohrožujícího serotoninového syndromu může dojít při současném užití se serotonergními léčivými přípravky, jako jsou selektivní inhibitory zpětného vychytávání serotoninu (SSRI) a inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI) a s léčivými přípravky, které ovlivňují metabolismus serotoninu (včetně inhibitorů monoaminooxidázy, IMAO). K tomu může dojít v rámci doporučeného dávkování.
Serotoninový syndrom může zahrnovat změny duševního stavu (např. agitovanost, halucinace, koma), nestabilitu autonomního systému (např. tachykardii, kolísání krevního tlaku, hypertermii), neuromuskulární abnormality (např. hyperreflexie, porucha koordinace, rigidita), gastrointestinální příznaky (nauzea, zvracení, průjem).
V případě podezření na serotoninový syndrom je nutno ukončit léčbu přípravkem Instanyl.
Podmínky pro nosní podání přípravku
Jestliže pacient opakovaně udává epizody epistaxe a výskyt nepříjemných pocitů v nose po použití přípravku Instanyl, je třeba zvážit jinou aplikační formu pro léčbu průlomové bolesti.
Běžné nachlazení
Celkový účinek po použití fentanylu u subjektů s běžným nachlazením, bez předchozího použití nosních slizničních vasokonstriktorů, je srovnatelný se zdravými subjekty. Pro současné použití nosních slizničních vasokonstriktorů viz bod 4.5.
Možnost zneužívání a. vznik lékové závislosti
Po opakovaném podání opioidů, například fentanylu, se může vyvinout tolerance a fyzická a/nebo psychická závislost. Výskyt iatrogenní závislosti po užívání opioidů je ale při léčbě bolesti maligního původu vzácný.
Abstinenční příznaky
Výskyt abstinenčních příznaků může být významně ovlivněn použitím opioidních antagonistů (např. naxolon), nebo smíšených opioidních agonistů/antagonistů (např. pentazocin, butorfanol, buprenorfin, nalbufin).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Souběžné podávání fentanylu se serotonergní látkou, jako je inhibitor zpětného vychytávání serotoninu (SSRI), inhibitor zpětného vychytávání serotoninu a noradrenalinu (SNRI) nebo inhibitory monoaminooxidázy (IMAO), může zvýšit riziko serotoninového syndromu, což je potenciálně život ohrožující stav.
Instanyl by neměl být používán u pacientů, kteří v průběhu předchozích 14 dnů užívali inhibitory monoaminooxidázy (IMAO), jelikož při podávání opioidních analgetik bylo zaznamenáno závažné a nepředvídatelné zesílení účinku inhibitorů MAO.
Fentanyl je metabolizován převážně prostřednictvím izoenzymu cytochromu P450 3A4 (CYP3A4), proto se mohou vyskytnout interakce při souběžném podávání přípravku Instanyl s léčivými přípravky ovlivňujícími aktivitu CYP3A4. Při současném podávání s léčivými přípravky, které indukují aktivitu 3A4 se může snížit účinnost přípravku Instanyl. Současné používání přípravku Instanyl se silnými inhibitory CYP3A4 (např. ritonavir, ketokonazol, itrakonazol, troleandomycin, klaritromycin a nelfinavir) nebo středně silnými inhibitory CYP3A4 (např. amprenavir, aprepitant, diltiazem, erytromycin, flukonazol, fosamprenavir a verapamil) může vést k zvýšení plazmatických koncentrací fentanylu, což může potenciálně vyvolat závažné nežádoucí reakce včetně fatálního respiračního útlumu.
Pacienti, kteří používají Instanyl současně se středně silnými či silnými inhibitory CYP3A4, by měli být dlouhodobě pečlivě sledováni. Zvyšování dávky je třeba provádět s opatrností.
Ve studii farmakokinetických interakcí bylo zjištěno, že při současném používání oxymetazolinu se maximální plazmatické koncentrace intranasálně podávaného fentanylu snížily asi o 50 %, zatímco čas do dosažení Cmax (Tmax) se zdvojnásobil. Tím může být snížena účinnost přípravku Instanyl. Současné používání nosních dekongestantů se nedoporučuje (viz bod 5.2)
Současné podávání jiných látek tlumících centrální nervový systém včetně opioidů, sedativ či hypnotik, celkových anestetik, fenotiazinů, trankvilizérů, myorelaxancií, antihistaminik se sedativním účinkem a alkoholu může vyvolat zesílení těchto účinků.
Nedoporučuje se současné podávání smíšených agonistů/antagonistů opioidů (např. buprenorfin, nalbufin, pentazocin). Mají totiž vysokou afinitu vůči opioidním receptorům s relativně nízkou vnitřní (intrinsic) aktivitou, a proto částečně antagonizují analgetický účinek fentanylu a mohou vyvolat abstinenční příznaky u pacientů závislých na opioidech.
Současné používání přípravku Instanyl s jinými intranasálními léčivými přípravky (kromě oxymetazolinu) nebylo v klinických studiích hodnoceno. Doporučuje se, aby při souběžné léčbě průvodních onemocnění, která lze léčit intranasální cestou, byly zváženy alternativní způsoby podávání.
4.6 Fertilita, těhotenství a kojení
Adekvátní údaje o použití fentanylu u těhotných žen nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Potenciální riziko pro člověka není známo. Instanyl by neměl být během těhotenství podáván, pokud to není nezbytně nutné.
Po dlouhodobé léčbě může fentanyl vyvolat abstinenční příznaky u novorozence. Nedoporučuje se podávat fentanyl během průběhu porodu a vybavení plodu (včetně císařského řezu), protože fentanyl prochází placentou a může vyvolat útlum dýchání u plodu. Pokud je Instanyl podán, je nutno mít k dispozici antidotum pro dítě.
Kojení
Fentanyl přechází do mateřského mléka a může vyvolávat sedaci a respirační depresi u kojeného dítěte. Kojící ženy by neměly fentanyl používat a kojení by neměly znovu zahájit dříve než 5 dní po posledním podání fentanylu.
Fertilita
Data pro hodnocení účinku na plodnost u člověka nejsou k dispozici. Ve studiích na zvířatech bylo pozorováno zhoršení plodnosti u samců i samic při sedativních dávkách (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje nebyly provedeny.
O účinku opioidních analgetik je však známo, že snižují duševní a/nebo tělesné schopnosti potřebné k řízení vozidel či obsluze strojů. Pacienti by měli být poučeni, že nemají řídit či obsluhovat stroje, pokud se u nich vyskytne ospalost, závrať, poruchy zraku či jiné nežádoucí účinky, které by mohly ovlivnit jejich schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Při použití přípravku Instanyl je třeba očekávat typické nežádoucí účinky charakteristické pro opioidy. Většina z nich obvykle ustane nebo se zmírní při kontinuálním používání přípravku. Mezi nejzávažnější nežádoucí účinky patří útlum dýchání (který může vést až k apnoi či zástavě dechu), dekompenzace oběhu, hypotenze a šok. Všichni pacienti musí být pečlivě sledováni z hlediska výskytu těchto nežádoucích účinků.
Klinické studie pro Instanyl byly vytvořeny tak, aby bylo možné vyhodnotit bezpečnost a účinnost v léčbě průlomové bolesti. Protože všichni pacienti současně užívali opioidy k léčbě jejich chronické bolesti, například morfin s prodlouženým uvolňováním nebo fentanylové náplasti, nebylo možné v konečném efektu vyhodnotit samotný účinek přípravku Instanyl. V následující tabulce jsou uvedeny nežádoucí účinky, které byly v klinických studiích Instanylu považovány přinejmenším za možná související s léčbou.
Tabulkový přehled nežádoucích účinků
Ke zhodnocení četnosti výskytu nežádoucích účinků byly použity následující kategorie: velmi časté (1>/10); časté (>1/100 až <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000) a velmi vzácné (<1/10,000), není známo (z dostupných údajů nelze určit).
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Následující nežádoucí účinky byly hlášeny při podávání Instanylu a/nebo dalších přípravků obsahujících fentanyl během klinických studií a ze zkušeností z období po uvedení přípravku na trh:
|
Třída orgánových systémů |
Časté |
Méně časté |
Není známo |
|
Psychiatrické poruchy |
Závislost, insomnie | ||
|
Poruchy nervového systému |
Spavost, závratě, bolest hlavy |
Sedace, myoklonus, parestézie, dysestezie, dysgeuzie |
Křeče |
|
Poruchy ucha a labyrintu |
Závrať (vertigo) |
Dávivé pohyby | |
|
Srdeční poruchy | |||
|
Cévní poruchy |
Zčervenání, návaly horka | ||
|
Respirační, hrudní a mediastinální poruchy |
Podráždění v hrdle |
Útlum dýchání, epistaxe, vřed v nose,výtok z nosu |
Perforace nosní přepážky |
|
Gastrointestinální poruchy |
Zácpa, zánět ústní dutiny, sucho v ústech | ||
|
Poruchy kůže a podkožní tkáně |
Hyperhidróza |
Bolesti kůže, svědění | |
|
Celkové poruchy a reakce v místě aplikace |
Pyrexie |
Únava, malátnost Periferní edém Abstinenční příznaky* | |
|
Poranění, otravy a procedurální komplikace |
Pád |
*po transmukozním podání fentanylu byly pozorovány abstinenční příznaky z vysazení opioidů, jako je nevolnost, zvracení, průjem, úzkost, zimnice, třes a pocení
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Symptomy
Očekává se, že symptomy předávkování fentanylem budou odpovídat zesíleným farmakologickým účinkům fentanylu, např. letargie, koma a těžký útlum dýchání. Dalšími symptomy mohou být hypotermie, snížený svalový tonus, bradykardie a hypotenze. Mezi projevy toxicity patří hluboká sedace, ataxie, mióza, křeče a útlum dýchání, který je hlavním symptomem.
Léčba
Ke zvládnutí útlumu dýchání je třeba zahájit okamžitá protiopatření včetně tělesné či verbální stimulace pacienta. Poté může následovat podání specifického antagonisty opioidů, např. naloxonu. Útlum dýchání po předávkování může trvat déle než účinek antagonisty opioidů. Poločas antagonisty může být krátký, proto může být nutné opakované podání nebo kontinuální infúze. Zrušení narkotického účinku může vyvolat akutní nástup bolesti a uvolnění katecholaminů.
Pokud to vyžaduje klinická situace, je třeba zajistit a udržovat průchodnost dýchacích cest, např. za použití ústního vzduchovodu či endotracheální intubace, dle potřeby je nutno podávat kyslík a zavést podpůrnou či řízenou ventilaci. Dále je nutné udržovat adekvátní tělesnou teplotu a zajistit příjem tekutin.
Jestliže dojde k závažné či přetrvávající hypotenzi, tato může vzniknout v důsledku hypovolémie. Tento stav by měl být adekvátně léčen infúzní terapií.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Analgetika, opioidy, ATC kód: N02AB03 Mechanismus účinku
Fentanyl je opioidní analgetikum, které má vazební afinitu primárně k opioidním ^-receptorům, pro které je čistým agonistou, má nízkou vazební afinitu vůči 5- a K-opioidním receptorům. Jeho základním terapeutickým účinkem je analgezie. Sekundárními farmakologickými účinky jsou útlum dýchání, bradykardie, hypotermie, zácpa, mióza, fyzická závislost a euforie.
Klinická účinnost a bezpečnost
Účinnost a bezpečnost přípravku Instanyl (50, 100 a 200 mikrogramů) byla hodnocena ve dvou randomizovaných, dvojitě zaslepených, zkřížených, placebem kontrolovaných pivotních studiích u 279 dospělých pacientů s rakovinou a tolerancí vůči opioidům (ve věku 32 až 86 let) s průlomovou bolestí (PB). Pacienti měli přibližně 1 až 4 epizody průlomové bolesti denně při nastavené udržovací opioidní terapii. Pacienti ve druhé pivotní studii se předtím již účastnili farmakokinetické studie pro Instanyl nebo první pivotní studie.
Klinické studie prokázaly účinnost a bezpečnost přípravku Instanyl. Nebyla zjištěna jednoznačná korelace mezi udržovací dávkou opioidů a dávkou přípravku Instanyl, nicméně ve druhé pivotní studii se ukázalo, že pacienti, kteří užívali nízkou udržovací dávku opioidů, obvykle dosahovali efektivní úlevy od bolesti s odpovídající nižší silou přípravku Instanyl ve srovnání s pacienty, kteří užívali vysoké udržovací dávky opioidů. Nejzřetelněji se tato tendence ukázala u pacientů, kteří nepřekročili léčebnou dávku Instanyl 50 mikrogramů.
V klinických studiích u onkologických pacientů byly nejčastěji užívané dávky 100 a 200 mikrogramů.
Všechny tři síly přípravku Instanyl prokázaly statisticky významně (p<0,001) vyšší rozdíl v intenzitě bolesti po 10 minutách (PIDJ0) ve srovnání s placebem. Navíc dosáhl Instanyl signifikantně lepšího účinku ve srovnání s placebem na zmírnění BP za 10, 20, 40 a 60 minut po podání. Výsledky souhrnného PID po 60 minutách (SPID0-60) ukázaly, že všechny síly přípravku Instanyl měly signifikantně vyšší průměrné SPID0-60 skóre ve srovnání s placebem (p<0,001), což prokazuje lepší úlevu od bolesti po podání přípravku Instanyl proti placebu v průběhu 60 minut.
Bezpečnost a účinnost přípravku Instanyl byla hodnocena u pacientů, kteří přípravek užívali při nástupu epizody průlomové bolesti. Instanyl by neměl být používán preventivně.
Klinické zkušenosti s přípravkem Instanyl u pacientů již léčených opioidy v dávce odpovídající > 500 mg/den morfinu nebo > 200 mikrogramů/hod transdermálního fentanylu jsou omezené.
Instanyl v dávkách nad 400 mikrogramů nebyl v klinických studiích hodnocen.
5.2 Farmakokinetické vlastnosti Absorpce
Fentanyl je vysoce lipofilní. Fentanyl vykazuje tříkompartmentovou distribuční kinetiku. Údaje získané u zvířat ukazují, že po vstřebání je fentanyl rychle distribuován do mozku, srdce, plic, ledvin a sleziny, a následně pomaleji redistribuován do svalů a tukové tkáně. Vazba fentanylu na proteiny krevní plazmy činí přibližně 80%. Absolutní biologická dostupnost přípravku Instanyl je asi 89 %.
Klinické údaje ukazují, že fentanyl je velmi rychle absorbován nosní sliznicí. Podávání přípravku Instanyl v jednorázových dávkách v rozmezí od 50 do 200 mikrogramů fentanylu v jedné dávce u onkologických pacientů s tolerancí vůči opioidům vedlo k rychlému dosažení hladiny Cmax 0,35 až
1.2 ng/ml. Odpovídající střední hodnota Tmax je 12-15 minut. Ve studii zaměřené na proporcionalitu dávky byly u zdravých dobrovolníků pozorovány vyšší hodnoty Tmax .
Distribuce
Po intravenózním podání fentanylu je iniciální distribuční poločas asi 6 minut a podobný poločas je pozorován po intranasálním podání přípravku Instanyl. Eliminační poločas pro Instanyl činí přibližně 3 - 4 hodin u onkologických pacientů.
Biotransformace
Fentanyl je metabolizován převážně v játrech prostřednictvím CYP3A4. Jeho hlavní metabolit norfentanyl je neaktivní.
Eliminace
Asi 75% fentanylu je vyloučeno močí, většinou ve formě neaktivních metabolitů, méně než 10 % je vyloučeno jako nezměněná léčivá látka. Asi 9 % dávky lze prokázat ve stolici, převážně ve formě metabolitů.
Linearita
Instanyl vykazuje lineární kinetiku. U zdravých subjektů byla pozorována linearita dávky v rozmezí 50 mikrogramů až 400 mikrogramů přípravku Instanyl.
Studie lékových interakcí byla provedena s nosním slizničním vasokonstriktorem (oxymetazolin). Pacienti s alergickou rýmou užívali oxymetazolin nosní sprej 1 hodinu před podáním přípravku Instanyl. Po porovnání bylo dosaženo srovnatelné biologické dostupnosti fentanylu (AUC), s použitím i bez použití oxymetazolinu, ale Cmax fentanylu se snížila a Tmax se zvýšil na dvojnásobek při podání oxymetazolinu. Celkový rozsah expozice fentanylu u subjektů s alergickou rýmou bez předchozí léčby nosním vasokonstriktorem je srovnatelný se zdravými subjekty. Současné používání nosních sizničních vasokonstriktorů se nedoporučuje (viz bod 4.5).
Bioekvivalence
Farmakokinetické studie potvrzují, že Instanyl jednodávková forma a Instanyl vícedávková forma nosního spreje jsou bioekvivalentní.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání genotoxicity a karcinogenity neodhalily žádné zvláštní riziko pro člověka.
Ve studiích fertility a raného embryonálního vývoje prováděných na potkanech byl při vysokých dávkách (300 ^g/kg/den s.c.) pozorován samci přenášený účinek, který odpovídá sedativním účinkům fentanylu ve studiích na zvířatech. Dále studie na samicích potkanů prokázaly snížení fertility a zvýšení embryonální mortality. Novější studie ukazují, že tyto účinky na embryo byly vyvolány maternální toxicitou a nikoliv přímým účinkem látky na vyvíjející se embryo. Ve studii prenatálního a postnatálního vývoje bylo procento přežití potomků signifikantně sníženo u dávek, které mírně snížily hmotnost matky. Tento účinek by mohl být buď důsledkem změněné mateřské péče, nebo přímým účinkem fentanylu na mláďata. Účinky na tělesný vývoj a chování potomků nebyly pozorovány. Teratogenní účinky nebyly prokázány.
Studie lokální snášenlivosti s přípravkem Instanyl u miniprasat prokázaly, že podávání přípravku Instanyl je dobře tolerováno.
Studie karcinogenity (26týdenní dermální alternativní biologické zkoušky na Tg.AC transgenních myších; dvouletá studie subkutánní karcinogenity na potkanech) s fentanylem neodhalily žádná
zjištění svědčící o onkogenním potenciálu. Hodnocení vzorků mozku ze studie karcinogenity u potkanů odhalilo mozkové léze u zvířat, kterým byly podávány vysoké dávky fentanyl citrátu. Význam těchto nálezů pro člověka není známý.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Dihydrát dihydrogenfosforečnanu sodného Dihydrát hydrogenfosforečnanu sodného Čištěná voda
6.2 Inkompatibility
Nejsou známy.
6.3 Doba použitelnosti
Instanyl 50 mikrogramů/v jedné dávce, nosní sprej, roztok
3 roky
Instanyl 100 mikrogramů/v jedné dávce, nosní sprej, roztok 42 měsíců
Instanyl 200 mikrogramů/v jedné dávce, nosní sprej, roztok
4 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 30 °C.
Chraňte před mrazem.
Uchovávejte lahvičku ve svislé poloze.
6.5 Druh obalu a velikost balení
Lahvička (hnědé sklo, typu 1) s dávkovacím zařízením a ochranným krytem uložená v pouzdře s dětským bezpečnostním uzávěrem.
Přípravek je dostupný v dále uvedených velikostech balení:
Instanyl 50 mikrogramů/v jedné dávce, nosní sprej, roztok
1.8 ml, které obsahuje fentanylum 0,90 mg, umožňuje uvolnit 10 dávek o síle 50 mikrogramů
2.9 ml, které obsahuje fentanylum 1,45 mg, umožňuje uvolnit 20 dávek o síle 50 mikrogramů
5.0 ml, které obsahuje fentanylum 2,50 mg, umožňuje uvolnit 40 dávek o síle 50 mikrogramů
Instanyl 100 mikrogramů/v jedné dávce, nosní sprej, roztok
1.8 ml, které obsahuje fentanylum 1,80 mg, umožňuje uvolnit 10 dávek o síle 100 mikrogramů
2.9 ml, které obsahuje fentanylum 2,90 mg, umožňuje uvolnit 20 dávek o síle 100 mikrogramů
5.0 ml, které obsahuje fentanylum 5,00 mg, umožňuje uvolnit 40 dávek o síle 100 mikrogramů
Instanyl 200 mikrogramů/v jedné dávce, nosní sprej, roztok
1.8 ml, které obsahuje fentanylum 3,60 mg, umožňuje uvolnit 10 dávek o síle 200 mikrogramů
2.9 ml, které obsahuje fentanylum 5,80 mg, umožňuje uvolnit 20 dávek o síle 200 mikrogramů
5.0 ml, které obsahuje fentanylum 10,00 mg, umožňuje uvolnit 40 dávek o síle 200 mikrogramů
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Z důvodu možného zneužití fentanylu a možného zbytku roztoku, používaný i nepoužívaný roztok v nosním spreji musí být vždy znovu uložen v pouzdře s dětským bezpečnostním uzávěrem a musí být zlikvidován v souladu s místními požadavky, nebo vrácen do lékárny.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
8. REGISTRAČNÍ ČÍSLO(A)
Instanyl 50 mikrogramů/v jedné dávce, nosní sprej, roztok EU/1/09/531/001-003
Instanyl 100 mikrogramů/v jedné dávce, nosní sprej, roztok EU/1/09/531/004-006
Instanyl 200 mikrogramů/v jedné dávce, nosní sprej, roztok EU/1/09/531/007-009
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 20. července. 2009
Datum posledního prodloužení registrace: 23. dubna. 2014
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury http://www.ema.europa.eu.
1. NÁZEV PŘÍPRAVKU
Instanyl 50 mikrogramů, nosní sprej, roztok, v jednodávkovém obalu Instanyl 100 mikrogramů, nosní sprej, roztok, v jednodávkovém obalu Instanyl 200 mikrogramů, nosní sprej, roztok, v jednodávkovém obalu
2. KVALITATIVNÍ A KVANTITATIVNÍ Složení
Instanyl 50 mikrogramů, nosní sprej, roztok, v jednodávkovém obalu
Jedno jednodávkové balení obsahuje jednu dávku (100 mikrolitrů) fentanyli citras, odpovídá
fentanylum 50 mikrogramů.
Instanyl 100 mikrogramů, nosní sprej, roztok, v jednodávkovém obalu
Jedno jednodávkové balení obsahuje jednu dávku (100 mikrolitrů) fentanyli citras, odpovídá
fentanylum 100 mikrogramů.
Instanyl 200 mikrogramů, nosní sprej, roztok, v jednodávkovém obalu
Jedno jednodávkové balení obsahuje jednu dávku (100 mikrolitrů) fentanyli citras, odpovídá
fentanylum 200 mikrogramů.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Nosní sprej, roztok (nosní sprej) Čirý, bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Instanyl je určen pro dospělé pacienty k léčbě průlomové bolesti, kteří jsou již současně léčeni opioidy z důvodu chronické nádorové bolesti. Průlomová bolest je charakterizována jako přechodné zesílení stávající bolesti, které se může objevit na podkladě jinak kontrolovaného perzistujícího bolestivého stavu.
Dále je určen pacientům, kteří jsou již léčeni opioidy a již užívají morfin nejméně 60 mg denně perorálně, nebo fentanyl nejméně 25 mikrogramů za hodinu transdermálně, nebo oxycodein nejméně 30 mg denně, nebo hydromorfon 8 mg perorálně denně, nebo equianalgetickou dávku jiného opioidu po dobu jednoho týdne a déle.
4.2 Dávkování a způsob podávání
Léčba by měla být zahájena a vedena pod dohledem lékaře, který má zkušenosti s léčbou opioidy u pacientů s karcinomem. Lékař musí mít na paměti možnost zneužití fentanylu.
Dávkování
Dávka přípravku by měla být individuálně titrována pro každého pacienta, aby bylo úspěšně dosaženo dostatečné analgézie a s výskytem takových nežádoucích účinků, které jsou ještě v toleranci pacienta. Pacient musí být pečlivě sledován v průběhu titrace dávky.
Titrace vyšších dávek nutně vyžaduje kontakt s lékařem.
Dávka přípravku Instanyl pro léčbu průlomové bolesti není podle klinických studií (viz bod 5.1) závislá na denní udržovací dávce opioidů.
Maximální denní dávka: Použití je možné nejvíce pro čtyři epizody průlomové bolesti, pro každou lze použít ne více než dvě dávky přípravku a ne dříve než po 10 minutách od předešlé aplikace.
Pacienti by měli vyčkat nejméně 4 hodiny, než mohou použít Instanyl při další epizodě průlomové bolesti při titraci i udržování léčby.
Titrace dávky
Před započetím titrování dávky přípravku Instanyl je předpokladem, že stávající chronická bolest je kontrolována trvalou medikací opioidy a epizody průlomové bolesti se nevyskytují častěji než čtyřikrát denně.
Postup titrace dávky
Počáteční dávka by měla být jedna dávka 50 mikrogramů do jednoho nosního průduchu, postupně lze zvyšovat dávku podle potřeby v rozsahu dostupných dávek (50, 100 a 200 mikrogramů). Jestliže není dosaženo dostatečné úlevy od bolesti, stejná dávka může být aplikována nejdříve po 10 minutách od předešlé aplikace. Každý postup titrace (síla dávky) má být hodnocen v průběhu několika epizod bolesti.
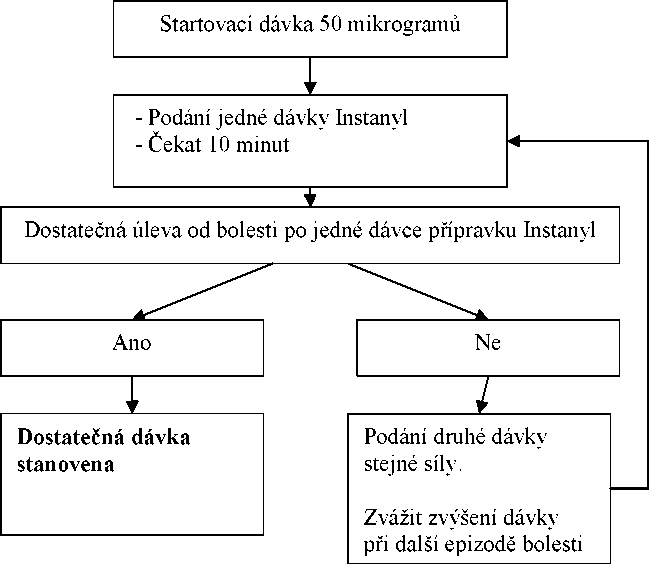
Udržovací léčba
Jestliže dojde ke stanovení dostatečné léčebné dávky podle postupu popsaného výše, pacient užívá tuto udržovací stanovenou dávku přípravku Instanyl. Jestliže pacient cítí nedostatečnou úlevu od bolesti, může být podána dodatečná dávka přípravku ve stejné síle, ne však dříve než po 10 minutách od poslední aplikace.
Upravení dávky
Obecně platí, že udržovací dávka přípravku Instanyl má být zvýšena, jestliže pacient vyžaduje více než jednu dávku k léčbě průlomové bolesti v průběhu několika za sebou následujících epizod bolesti. Úprava dávky základní opioidní léčby může být nezbytná, jestliže pacient udává více než čtyři epizody průlomové bolesti v průběhu 24 hodin.
Pokud nežádoucí účinky přetrvávají nebo jsou nesnesitelné, musí být dávka snížena nebo musí být přípravek Instanyl nahrazen jinými analgetiky.
Přerušení léčby
Léčba přípravkem Instanyl má být ihned přerušena, jestliže pacient neudává další výskyt epizod průlomové bolesti. V základní léčbě chronické bolesti je třeba dále pokračovat podle dosavadního schématu.
Jestliže je nutné přerušení veškeré opioidní léčby, musí pacient pečlivě dodržovat instrukce lékaře pro postupné ukončení léčby (sestupná titrace dávky opioidů) z důvodu snížení možnosti vzniku náhlých abstinenčních příznaků.
Zvláštní populace
Starší populace
Pro použití přípravku Instanyl u pacientů nad 65 let věku jsou dostupné jen omezené údaje o farmakokinetice, účinnosti a bezpečnosti přípravku. Starší pacienti mohou mít sníženou clearance, prodloužený poločas účinku a vyšší citlivost k fentanylu než mladší pacienti. Proto se doporučuje opatrnost při použití u starších, kachektických a oslabených pacientů.
V klinických studiích je u starších pacientů prokázána nižší účinná dávka než u pacientů mladších 65 let věku. Zvláštní opatrnost se doporučuje při dávkování přípravku Instanyl u starších pacientů.
Poškození funkce jater
Opatrnosti je třeba při podávání přípravku Instanyl při mírném až závažném poškození funkce jater (viz bod 4.4.)
Poškození funkce ledvin
Opatrnosti je třeba při podávání přípravku Instanyl při mírném až závažném poškození funkce ledvin (viz bod 4.4.)
Pediatrická populace
Dosud nebyla stanovena bezpečnost a účinnost přípravku Instanyl u dětí mladších 18 let. Nejsou k dispozici žádná data.
Způsob podání
Instanyl je určen k nosnímu podání.
Doporučuje se, aby pacient při aplikaci přípravku Instanyl seděl nebo stál vzpřímeně.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku uvedenou v bodě 6.1.
Pacienti bez udržovací léčby opioidy, proto zde existuje zvýšené riziko respirační deprese.
Léčba jiné akutní bolesti než bolesti průlomové.
Závažná respirační deprese nebo závažné obstrukční onemocnění plic Předchozí radioterapie obličeje
Opakované epizody epistaxe (krvácení z nosu), (viz bod 4.4)
4.4 Zvláštní upozornění a opatření pro použití
Respirační deprese
U některých pacientů může podání fentanylu vyvolat klinicky významnou respirační depresi, pacient proto musí být sledován z důvodu tohoto rizika. Pacienti v léčbě bolesti, kteří podstupují trvalou terapii pomocí opiátů, jsou schopni vyvinout toleranci vůči respirační depresi, a tím je nebezpečí vzniku respirační deprese u těchto pacientů sníženo. Současné užívání léčivých přípravků, které tlumí aktivitu centrálního nervového systému, může zvýšit nebezpečí vzniku respirační deprese (viz bod 4.5).
Chronické plicní onemocnění
U pacientů s chronickým obstrukčním bronchopulmonálním onemocněním může fentanyl vyvolat více závažných nežádoucích účinků. U těchto pacientů mohou opiáty snížit dechovou pohotovost a zvýšit rezistenci dýchacích cest.
Insuficience funkce ledvin nebo jater
Opatrnosti je třeba při podávání fentanylu při mírné až závažné poruše funkce jater nebo ledvin. Vliv nedostatečnosti funkce jater a ledvin na farmakokinetiku přípravku Instanyl nebyl dosud vyhodnocen; avšak při podávání fentanylu intravenózně se ukazuje, že clearence fentanylu je alterován v důsledku snížené funkce jater a ledvin, která je způsobená změnami v metabolismu clearence a plazmatických proteinů.
Zvýšený nitrolební tlak
Opatrnosti je zapotřebí při použití fentanylu u pacientů se zvýšeným intrakraniálním tlakem, sníženým vědomím nebo v bezvědomí.
Vyšší pozornost vyžaduje rovněž používání přípravku Instanyl u pacientů s mozkovým nádorem nebo poraněním hlavy.
Srdeční onemocnění
Fentanyl může vyvolat bradykardii. Fentanyl by měl být používán s opatrností u pacientů s předchozími nebo stávajícími bradyarytmiemi. Opioidy mohou způsobit hypotenzi, zejména u pacientů s hypovolémií. Proto je třeba opatrnosti při použití přípravku Instanyl u pacientů s hypotenzí a/nebo s hypovolémií.
Serotoninový syndrom
Opatrnost se doporučuje při současném podání přípravku Instanyl s léčivými přípravky, které ovlivňují serotonergní neurotransmiterové systémy.
K vývoji potenciálně život ohrožujícího serotoninového syndromu může dojít při současném užití se serotonergními léčivými přípravky, jako jsou selektivní inhibitory zpětného vychytávání serotoninu (SSRI) a inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI) a s léčivými přípravky, které ovlivňují metabolismus serotoninu (včetně inhibitorů monoaminooxidázy, IMAO). K tomu může dojít v rámci doporučeného dávkování.
Serotoninový syndrom může zahrnovat změny duševního stavu (např. agitovanost, halucinace, koma), nestabilitu autonomního systému (např. tachykardii, kolísání krevního tlaku, hypertermii), neuromuskulární abnormality (např. hyperreflexie, porucha koordinace, rigidita), gastrointestinální příznaky (nauzea, zvracení, průjem).
V případě podezření na serotoninový syndrom je nutno ukončit léčbu přípravkem Instanyl Podmínky pro nosní podání přípravku
Jestliže pacient opakovaně udává epizody epistaxe a výskyt nepříjemných pocitů v nose po použití přípravku Instanyl, je třeba zvážit jinou aplikační formu pro léčbu průlomové bolesti.
Běžné nachlazení
Celkový účinek po použití fentanylu u subjektů s běžným nachlazením bez předchozího použití nosních slizničních vasokonstriktorů je srovnatelný se zdravými subjekty. Pro současné použití nosních slizničních vasokonstriktorů viz bod 4.5.
Možnost zneužívání a. vznik lékové závislosti
Po opakovaném podání opioidů, například fentanylu, se může vyvinout tolerance a fyzická a/nebo psychická závislost. Výskyt iatrogenní závislosti po užívání opioidů je ale při léčbě bolesti maligního původu vzácný.
Abstinenční příznaky
Výskyt abstinenčních příznaků může být významně ovlivněn použitím opioidních antagonistů (např. naxolon) nebo smíšených opioidních agonistů/antagonistů (např. pentazocin, butorfanol, buprenorfin, nalbufin).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Souběžné podávání fentanylu se serotonergní látkou, jako je inhibitor zpětného vychytávání serotoninu (SSRI), inhibitor zpětného vychytávání serotoninu a noradrenalinu (SNRI) nebo inhibitory monoaminooxidázy (IMAO), může zvýšit riziko serotoninového syndromu, což je potenciálně život ohrožující stav.
Instanyl by neměl být používán u pacientů, kteří v průběhu předchozích 14 dnů užívali inhibitory monoaminooxidázy (IMAO), jelikož při podávání opioidních analgetik bylo zaznamenáno závažné a nepředvídatelné zesílení účinku inhibitorů MAO.
Fentanyl je metabolizován převážně prostřednictvím izoenzymu cytochromu P450 3A4 (CYP3A4), proto se mohou vyskytnout interakce při souběžném podávání přípravku Instanyl s léčivými přípravky ovlivňujícími aktivitu CYP3A4. Při současném podávání s léčivými přípravky, které indukují aktivitu 3A4, se může snížit účinnost přípravku Instanyl. Současné používání přípravku Instanyl se silnými inhibitory CYP3A4 (např. ritonavir, ketokonazol, itrakonazol, troleandomycin, klaritromycin a nelfinavir) nebo středně silnými inhibitory CYP3A4 (např. amprenavir, aprepitant, diltiazem, erytromycin, flukonazol, fosamprenavir a verapamil) může vést k zvýšení plazmatických koncentrací fentanylu, což může potenciálně vyvolat závažné nežádoucí reakce včetně fatálního respiračního útlumu.
Pacienti, kteří používají Instanyl současně se středně silnými či silnými inhibitory CYP3A4, by měli být dlouhodobě pečlivě sledováni. Zvyšování dávky je třeba provádět s opatrností.
Ve studii farmakokinetických interakcí bylo zjištěno, že při současném používání oxymetazolinu se maximální plazmatické koncentrace intranasálně podávaného fentanylu snížily asi o 50 %, zatímco čas do dosažení Cmax (Tmax) se zdvojnásobil. Tím může být snížena účinnost přípravku Instanyl. Současné používání nosních dekongestantů se nedoporučuje (viz bod 5.2)
Současné podávání jiných látek tlumících centrální nervový systém včetně opioidů, sedativ či hypnotik, celkových anestetik, fenotiazinů, trankvilizérů, myorelaxancií, antihistaminik se sedativním účinkem a alkoholu může vyvolat zesílení těchto účinků.
Nedoporučuje se současné podávání smíšených agonistů/antagonistů opioidů (např. buprenorfin, nalbufin, pentazocin). Mají totiž vysokou afinitu vůči opioidním receptorům s relativně nízkou vnitřní (intrinsic) aktivitou, a proto částečně antagonizují analgetický účinek fentanylu a mohou vyvolat abstinenční příznaky u pacientů závislých na opioidech.
Současné používání přípravku Instanyl s jinými intranasálními léčivými přípravky (kromě oxymetazolinu) nebylo v klinických studiích hodnoceno. Doporučuje se, aby při souběžné léčbě průvodních onemocnění, která lze léčit intranasální cestou, byly zváženy alternativní způsoby podávání.
4.6 Fertilita, těhotenství a kojení
Adekvátní údaje o použití fentanylu u těhotných žen nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Potenciální riziko pro člověka není známo. Instanyl by neměl být během těhotenství podáván, pokud to není nezbytně nutné.
Po dlouhodobé léčbě může fentanyl vyvolat abstinenční příznaky u novorozence. Nedoporučuje se podávat fentanyl během průběhu porodu a vybavení plodu (včetně císařského řezu), protože fentanyl prochází placentou a může vyvolat útlum dýchání u plodu. Pokud je Instanyl podán, je nutno mít k dispozici antidotum pro dítě.
Kojení
Fentanyl přechází do mateřského mléka a může vyvolávat sedaci a respirační depresi u kojeného dítěte. Kojící ženy by neměly fentanyl používat a kojení by neměly znovu zahájit dříve než 5 dní po posledním podání fentanylu.
Fertilita
Data pro hodnocení účinku na plodnost u člověka nejsou k dispozici. Ve studiích na zvířatech bylo pozorováno zhoršení plodnosti u samců i samic při sedativních dávkách (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje nebyly provedeny.
O účinku opioidních analgetik je však známo, že snižují duševní a/nebo tělesné schopnosti potřebné k řízení vozidel či obsluze strojů. Pacienti by měli být poučeni, že nemají řídit či obsluhovat stroje, pokud se u nich vyskytne ospalost, závrať, poruchy zraku či jiné nežádoucí účinky, které by mohly ovlivnit jejich schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Při použití přípravku Instanyl je třeba očekávat typické nežádoucí účinky charakteristické pro opioidy. Většina z nich obvykle ustane nebo se zmírní při kontinuálním používání přípravku. Mezi nejzávažnější nežádoucí účinky patří útlum dýchání (který může vést až k apnoi či zástavě dechu), dekompenzace oběhu, hypotenze a šok. Všichni pacienti musí být pečlivě sledováni z hlediska výskytu těchto nežádoucích účinků.
Klinické studie pro Instanyl byly vytvořeny tak, aby bylo možné vyhodnotit bezpečnost a účinnost v léčbě průlomové bolesti. Protože všichni pacienti současně užívali opioidy k léčbě jejich chronické bolesti, například morfin s prodlouženým uvolňováním nebo fentanylové náplasti, nebylo možné v konečném efektu vyhodnotit samotný účinek přípravku Instanyl. V následující tabulce jsou uvedeny nežádoucí účinky, které byly v klinických studiích Instanylu považovány přinejmenším za možná související s léčbou.
Tabulkový přehled nežádoucích účinků
Ke zhodnocení četnosti výskytu nežádoucích účinků byly použity následující kategorie: velmi časté (1>/10); časté (>1/100 až <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000) a velmi vzácné (<1/10,000), není známo (z dostupných údajů nelze určit).
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Následující nežádoucí účinky byly hlášeny při podávání Instanylu a/nebo dalších přípravků obsahujících fentanyl během klinických studií a ze zkušeností z období po uvedení přípravku na trh:
|
Třída orgánových systémů |
Časté |
Méně časté |
Není známo |
|
Psychiatrické poruchy |
Závislost, insomnie | ||
|
Poruchy nervového systému |
Spavost, závratě, bolest hlavy |
Sedace, myoklonus, parestézie, dysestezie, dysgeuzie |
Křeče |
|
Poruchy ucha a labyrintu |
Závrať (vertigo) |
Dávivé pohyby | |
|
Srdeční poruchy | |||
|
Cévní poruchy |
Zčervenání, návaly horka | ||
|
Respirační, hrudní a mediastinální poruchy |
Podráždění v hrdle |
Útlum dýchání, epistaxe, vřed v nose,výtok z nosu |
Perforace nosní přepážky |
|
Gastrointestinální poruchy |
Zácpa, zánět ústní dutiny, sucho v ústech | ||
|
Poruchy kůže a podkožní tkáně |
Hyperhidróza |
Bolesti kůže, svědění | |
|
Celkové poruchy a reakce v místě aplikace |
Pyrexie |
Únava, malátnost Periferní edém, Abstinenční příznaky* | |
|
Poranění, otravy a procedurální komplikace |
Pád |
*po transmukozním podání fentanylu byly pozorovány abstinenční příznaky z vysazení opioidů, jako je nevolnost, zvracení, průjem, úzkost, zimnice, třes a pocení
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Symptomy
Očekává se, že symptomy předávkování fentanylem budou odpovídat zesíleným farmakologickým účinkům fentanylu, např. letargie, koma a těžký útlum dýchání. Dalšími symptomy mohou být hypotermie, snížený svalový tonus, bradykardie a hypotenze. Mezi projevy toxicity patří hluboká sedace, ataxie, mióza, křeče a útlum dýchání, který je hlavním symptomem.
Léčba
Ke zvládnutí útlumu dýchání je třeba zahájit okamžitá protiopatření včetně tělesné či verbální stimulace pacienta. Poté může následovat podání specifického antagonisty opioidů, např. naloxonu. Útlum dýchání po předávkování může trvat déle než účinek antagonisty opioidů. Poločas antagonisty může být krátký, proto může být nutné opakované podání nebo kontinuální infúze. Zrušení narkotického účinku může vyvolat akutní nástup bolesti a uvolnění katecholaminů.
Pokud to vyžaduje klinická situace, je třeba zajistit a udržovat průchodnost dýchacích cest, např. za použití ústního vzduchovodu či endotracheální intubace, dle potřeby je nutno podávat kyslík a zavést podpůrnou či řízenou ventilaci. Dále je nutné udržovat adekvátní tělesnou teplotu a zajistit příjem tekutin.
Jestliže dojde k závažné či přetrvávající hypotenzi, tato může vzniknout v důsledku hypovolémie. Tento stav by měl být adekvátně léčen infúzní terapií.
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Analgetika, opioidy, ATC kód: N02AB03 Mechanismus účinku
Fentanyl je opioidní analgetikum, které má vazební afinitu primárně k opioidním ^-receptorům, pro které je čistým agonistou, má nízkou vazební afinitu vůči 5- a K-opioidním receptorům. Jeho základním terapeutickým účinkem je analgezie. Sekundárními farmakologickými účinky jsou útlum dýchání, bradykardie, hypotermie, zácpa, mióza, fyzická závislost a euforie.
Klinická účinnost a bezpečnost
Účinnost a bezpečnost přípravku Instanyl (50, 100 a 200 mikrogramů) byla hodnocena ve dvou randomizovaných, dvojitě zaslepených, zkřížených, placebem kontrolovaných pivotních studiích u 279 dospělých pacientů s rakovinou a tolerancí vůči opioidům (ve věku 32 až 86 let) s průlomovou bolestí (PB). Pacienti měli přibližně 1 až 4 epizody průlomové bolesti denně při nastavené udržovací opioidní terapii. Pacienti ve druhé pivotní studii se předtím již účastnili farmakokinetické studie pro Instanyl nebo první pivotní studie.
Klinické studie prokázaly účinnost a bezpečnost přípravku Instanyl. Nebyla zjištěna jednoznačná korelace mezi udržovací dávkou opioidů a dávkou přípravku Instanyl, nicméně ve druhé pivotní studii se ukázalo, že pacienti, kteří užívali nízkou udržovací dávku opioidů, obvykle dosahovali efektivní úlevy od bolesti s odpovídající nižší silou přípravku Instanyl ve srovnání s pacienty, kteří užívali vysoké udržovací dávky opioidů. Nejzřetelněji se tato tendence ukázala u pacientů, kteří nepřekročili léčebnou dávku Instanyl 50 mikrogramů.
V klinických studiích u onkologických pacientů byly nejčastěji užívané dávky 100 a 200 mikrogramů.
Všechny tři síly přípravku Instanyl prokázaly statisticky významně (p<0,001) vyšší rozdíl v intenzitě bolesti po 10 minutách (PIDJ0) ve srovnání s placebem. Navíc dosáhl Instanyl signifikantně lepšího účinku ve srovnání s placebem na zmírnění BP za 10, 20, 40 a 60 minut po podání. Výsledky souhrnného PID po 60 minutách (SPID0-60) ukázaly, že všechny síly přípravku Instanyl měly signifikantně vyšší průměrné SPID0-60 skóre ve srovnání s placebem (p<0,001), což prokazuje lepší úlevu od bolesti po podání přípravku Instanyl proti placebu v průběhu 60 minut.
Bezpečnost a účinnost přípravku Instanyl byla hodnocena u pacientů, kteří přípravek užívali při nástupu epizody průlomové bolesti. Instanyl by neměl být používán preventivně.
Klinické zkušenosti s přípravkem Instanyl u pacientů již léčených opioidy v dávce odpovídající > 500 mg/den morfinu nebo > 200 mikrogramů/hod transdermálního fentanylu jsou omezené.
Instanyl v dávkách nad 400 mikrogramů nebyl v klinických studiích hodnocen.
5.2 Farmakokinetické vlastnosti Absorpce
Fentanyl je vysoce lipofilní. Fentanyl vykazuje tříkompartmentovou distribuční kinetiku. Údaje získané u zvířat ukazují, že po vstřebání je fentanyl rychle distribuován do mozku, srdce, plic, ledvin a sleziny, a následně pomaleji redistribuován do svalů a tukové tkáně. Vazba fentanylu na proteiny krevní plazmy činí přibližně 80%. Absolutní biologická dostupnost přípravku Instanyl je asi 89 %. Klinické údaje ukazují, že fentanyl je velmi rychle absorbován nosní sliznicí. Podávání přípravku Instanyl v jednorázových dávkách v rozmezí od 50 do 200 mikrogramů fentanylu v jedné dávce u onkologických pacientů s tolerancí vůči opioidům vedlo k rychlému dosažení hladiny Cmax 0,35 až
1.2 ng/ml. Odpovídající střední hodnota Tmax je 12-15 minut. Ve studii zaměřené na proporcionalitu dávky byly u zdravých dobrovolníků pozorovány vyšší hodnoty Tmax .
Distribuce
Po intravenózním podání fentanylu je iniciální distribuční poločas asi 6 minut a podobný poločas je pozorován po intranasálním podání přípravku Instanyl. Eliminační poločas pro Instanyl činí přibližně 3 - 4 hodin u onkologických pacientů.
Biotransformace
Fentanyl je metabolizován převážně v játrech prostřednictvím CYP3A4. Jeho hlavní metabolit norfentanyl je neaktivní.
Eliminace
Asi 75% fentanylu je vyloučeno močí, většinou ve formě neaktivních metabolitů, méně než 10 % je vyloučeno jako nezměněná léčivá látka. Asi 9 % dávky lze prokázat ve stolici, převážně ve formě metabolitů.
Linearita
Instanyl vykazuje lineární kinetiku. U zdravých subjektů byla pozorována linearita dávky v rozmezí 50 mikrogramů až 400 mikrogramů přípravku Instanyl.
Studie lékových interakcí byla provedena s nosním slizničním vasokonstriktorem (oxymetazolin). Pacienti s alergickou rýmou užívali oxymetazolin nosní sprej 1 hodinu před podáním přípravku Instanyl. Po porovnání bylo dosaženo srovnatelné biologické dostupnosti fentanylu (AUC), s použitím i bez použití oxymetazolinu, ale Cmax fentanylu se snížila a Tmax se zvýšil na dvojnásobek při podání oxymetazolinu. Celkový rozsah expozice fentanylu u subjektů s alergickou rýmou bez předchozí léčby nosním vasokonstriktorem je srovnatelný se zdravými subjekty. Současné používání nosních sizničních vasokonstriktorů se nedoporučuje (viz bod 4.5).
Bioekvivalence
Farmakokinetické studie potvrzují, že Instanyl jednodávková forma a Instanyl vícedávková forma nosního spreje jsou bioekvivalentní.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity a karcinogenity neodhalily žádné zvláštní riziko pro člověka.
Ve studiích fertility a raného embryonálního vývoje prováděných na potkanech byl při vysokých dávkách (300 ^g/kg/den s.c.) pozorován samci přenášený účinek, který odpovídá sedativním účinkům fentanylu ve studiích na zvířatech. Dále studie na samicích potkanů potkanů prokázaly snížení fertility a zvýšení embryonální mortality. Novější studie ukazují, že tyto účinky na embryo byly vyvolány maternální toxicitou, nikoliv přímým účinkem látky na vyvíjející se embryo. Ve studii prenatálního a postnatálního vývoje bylo procento přežití potomků signifikantně sníženo u dávek, které mírně snížily hmotnost matky. Tento účinek by mohl být buď důsledkem změněné mateřské péče, nebo přímým účinkem fentanylu na mláďata. Účinky na tělesný vývoj a chování potomků nebyly pozorovány. Teratogenní účinky nebyly prokázány.
Studie lokální snášenlivosti s přípravkem Instanyl u miniprasat prokázaly, že podávání přípravku Instanyl je dobře tolerováno.
Studie karcinogenity (26 týdenní dermální alternativní biologické zkoušky na Tg.AC transgenních myších; dvouletá studie subkutánní karcinogenity na potkanech) s fentanylem neodhalily žádná zjištění svědčící o onkogenním potenciálu. Hodnocení vzorků mozku ze studie karcinogenity u potkanů odhalilo mozkové léze u zvířat, kterým byly podávány vysoké dávky fentanyl citrátu.
Význam těchto nálezů pro člověka není známý.
6.1 Seznam pomocných látek
Dihydrát dihydrogenfosforečnanu sodného Dihydrát hydrogenfosforečnanu sodného Čištěná voda
6.2 Inkompatibility
Nejsou známy.
6.3 Doba použitelnosti
Instanyl 50 mikrogramů, nosní sprej, roztok, v jednodávkovém obalu 23 měsíců
Instanyl 100 mikrogramů, nosní sprej, roztok, v jednodávkovém obalu 36 měsíců
Instanyl 200 mikrogramů, nosní sprej, roztok, v jednodávkovém obalu 42 měsíců
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 30 °C.
Uchovávejte blistr v krabičce. Uchovávejte ve svislé poloze.
6.5 Druh obalu a velikost balení
Jednodávkové balení se skládá z lahvičky (čiré sklo typ I) a polypropylenového obalu spreje, a je uložené v blistru s dětským bezpečnostním uzávěrem .
Velikost balení: 2, 6, 8 a 10 jednodávkových balení
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Jedno jednodávkové balení obsahuje pouze jednu dávku. Jednodávkové balení nesmí být zkoušeno před použitím.
Z důvodu možného zneužití fentanylu nepoužitá jednodávková balení nosního spreje musí být vždy znovu uložena v blistru s dětským bezpečnostním uzávěrem a musí být zlikvidována v souladu s místními požadavky, nebo vrácena do lékárny.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
8. REGISTRAČNÍ ČÍSLO(A)
Instanyl 50 mikrogramů. nosní sprej, roztok, v jednodávkovém obalu EU/1/09/531/010-013
Instanyl 100 mikrogramů. nosní sprej. roztok. v jednodávkovém obalu EU/1/09/531/014-017
Instanyl 200 mikrogramů. nosní sprej, roztok. v jednodávkovém obalu EU/1/09/531/018-021
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 20. července 2009
Datum posledního prodloužení registrace: 23. dubna 2014
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury http://www.ema.europa.eu.
NÁZEV PŘÍPRAVKU
1.
Instanyl 50 mikrogramů/v jedné dávce, nosní sprej, roztok Instanyl 100 mikrogramů/v jedné dávce, nosní sprej, roztok Instanyl 200 mikrogramů/v jedné dávce, nosní sprej, roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Instanyl 50 mikrogramů/v jedné dávce, nosní sprej, roztok
Jeden ml roztoku obsahuje fentanyli citras, odpovídá. fentanylum 500 mikrogramů Jedna dávka (100 mikrolitrů) obsahuje fentanylum 50 mikrogramů
Instanyl 100 mikrogramů/v jedné dávce, nosní sprej, roztok
Jeden ml roztoku obsahuje fentanyli citras, odpovídá fentanylum 1 000 mikrogramů
Jedna dávka (100 mikrolitrů) obsahuje fentanylum 100 mikrogramů
Instanyl 200 mikrogramů/v jedné dávce, nosní sprej, roztok
Jeden ml roztoku obsahuje fentanyli citras, odpovídá. fentanylum 2 000 mikrogramů Jedna dávka (100 mikrolitrů) obsahuje fentanylum 200 mikrogramů
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Nosní sprej, roztok (nosní sprej). DoseGuard Čirý, bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Instanyl je určen pro dospělé pacienty k léčbě průlomové bolesti, kteří jsou již současně léčeni opioidy z důvodu chronické nádorové bolesti. Průlomová bolest je charakterizována jako přechodné zesílení stávající bolesti, které se může objevit na podkladě jinak kontrolovaného perzistujícího bolestivého stavu.
Dále je určen pacientům, kteří jsou již léčeni opioidy a již užívají morfin nejméně 60 mg denně perorálně, nebo fentanyl nejméně 25 mikrogramů za hodinu transdermálně, nebo oxycodein nejméně 30 mg denně nebo hydromorfon 8 mg perorálně denně nebo equianalgetickou dávku jiného opioidu po dobu jednoho týdne a déle.
4.2 Dávkování a způsob podávání
Léčba by měla být zahájena a vedena pod dohledem lékaře, který má zkušenosti s léčbou opioidy u pacientů s karcinomem. Lékař musí mít na paměti možnost zneužití fentanylu.
Dávkování
Dávka přípravku by měla být individuálně titrována pro každého pacienta, aby bylo úspěšně dosaženo dostatečné analgézie a s výskytem takových nežádoucích účinků, které jsou ještě v toleranci pacienta. Pacient musí být pečlivě sledován v průběhu titrace dávky. Titrace vyšších dávek nutně vyžaduje kontakt s lékařem.
Dávka přípravku Instanyl pro léčbu průlomové bolesti není podle klinických studií (viz bod 5.1) závislá na denní udržovací dávce opioidů.
Maximální denní dávka: Použití je možné nejvíce pro čtyři epizody průlomové bolesti, pro každou lze použít ne více než dvě dávky přípravku a ne dříve než po 10 minutách od předešlé aplikace.
Pacienti by měli vyčkat nejméně 4 hodiny, než mohou použít Instanyl při další epizodě průlomové bolesti při titraci i udržování léčby.
Titrace dávky
Před započetím titrování dávky přípravku Instanyl je předpokladem, že stávající chronická bolest je kontrolována trvalou medikací opioidy, a epizody průlomové bolesti se nevyskytují častěji než čtyřikrát denně.
Postup titrace dávky
Počáteční dávka by měla být jedna dávka 50 mikrogramů do jednoho nosního průduchu, postupně lze zvyšovat dávku podle potřeby v rozsahu dostupných dávek (50,100 a 200 mikrogramů). Jestliže není dosaženo dostatečné úlevy od bolesti, stejná dávka může být aplikována nejdříve po 10 minutách od předešlé aplikace. Každý postup titrace (síla dávky) má být hodnocen v průběhu několika epizod bolesti.
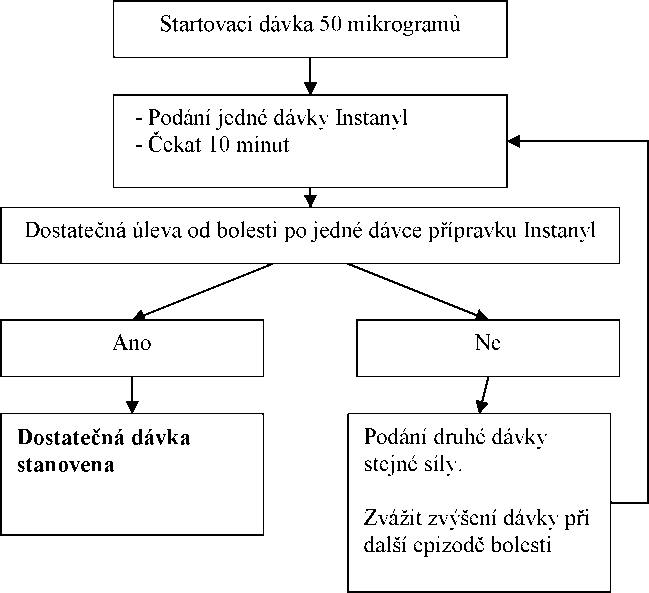
Udržovací léčba
Jestliže dojde ke stanovení dostatečné léčebné dávky podle postupu popsaného výše, pacient užívá tuto udržovací stanovenou dávku přípravku Instanyl. Jestliže pacient cítí nedostatečnou úlevu od bolesti, může být podána dodatečná dávka přípravku ve stejné síle, ne však dříve než po 10 minutách od poslední aplikace.
Upravení dávky
Obecně platí, že udržovací dávka přípravku Instanyl má být zvýšena, jestliže pacient vyžaduje více než jednu dávku k léčbě průlomové bolesti v průběhu několika za sebou následujících epizod bolesti. Úprava dávky základní opioidní léčby může být nezbytná, jestliže pacient udává více než čtyři epizody průlomové bolesti v průběhu 24 hodin.
Pokud nežádoucí účinky přetrvávají nebo jsou nesnesitelné, musí být dávka snížena nebo musí být přípravek Instanyl nahrazen jinými analgetiky.
Přerušení léčby
Léčba přípravkem Instanyl má být ihned přerušena, jestliže pacient neudává další výskyt epizod průlomové bolesti. V základní léčbě chronické bolesti je třeba dále pokračovat podle dosavadního schématu.
Jestliže je nutné přerušení veškeré opioidní léčby, musí pacient pečlivě dodržovat instrukce lékaře pro postupné ukončení léčby (sestupná titrace dávky opioidů) z důvodu snížení možnosti vzniku náhlých abstinenčních příznaků.
Zvláštní populace
Starší populace
Pro použití přípravku Instanyl u pacientů nad 65 let věku jsou dostupné jen omezené údaje o farmakokinetice, účinnosti a bezpečnosti přípravku. Starší pacienti mohou mít sníženou clearance, prodloužený poločas účinku a vyšší citlivost k fentanylu než mladší pacienti. Proto se doporučuje opatrnost při použití u starších, kachektických a oslabených pacientů.
V klinických studiích je u starších pacientů prokázána nižší účinná dávka než u pacientů mladších 65 let věku. Zvláštní opatrnost se doporučuje při dávkování přípravku Instanyl u starších pacientů.
Poškození funkce jater
Opatrnosti je třeba při podávání přípravku Instanyl při mírném až závažném poškození funkce jater (viz bod 4.4.)
Poškození funkce ledvin
Opatrnosti je třeba při podávání přípravku Instanyl při mírném až závažném poškození funkce ledvin (viz bod 4.4.)
Pediatrická populace
Dosud nebyla stanovena bezpečnost a účinnost přípravku Instanyl u dětí mladších 18 let.
Nejsou k dispozici žádná data.
Způsob podání
Instanyl je určen k nosnímu podání.
Doporučuje se, aby pacient při aplikaci přípravku Instanyl seděl nebo stál vzpřímeně.
Po každém použití nosního spreje je nutné očistit aplikátor.
Součástí Instanylu je elektronické počitadlo dávek a systém uzamčení nosního spreje na určitou dobu mezi dávkami. Tím se minimalizuje riziko náhodného předávkování, nesprávného použití nebo zneužití, a je poskytnuta pacientovi určitá jistota v souvislosti s těmito riziky. Po podání dvou dávek během 60 minut se Instanyl uzamkne na dobu 2 hodin od první užité dávky do doby, než bude možné užít další dávku.
Zvláštní upozornění, kterých je třeba dbát před manipulací s léčivým přípravkem nebo před jeho podáním
Před prvním použitím přípravku Instanyl je třeba nosní sprej připravit k použití. Je třeba 5krát stisknout dávkovač nosního spreje, což je na displeji znázorněno jako „P5“, „P4“, „P3“, „P2“ a „P1“.
Jestliže přípravek nebyl používán po dobu delší než sedm dní, je nutno před užitím další dávky nosní sprej znovu připravit k použití jedním stiskem dávkovače, což je na displeji zobrazeno jako „P“.
Během procesu přípravy k použití se trocha přípravku vystříkne do vzduchu. Proto je třeba pacienta poučit, aby přípravu k použití prováděl v dobře větraném prostoru a mířil směrem od sebe a dalších osob a směrem od povrchů a předmětů, se kterými by mohly přijít do kontaktu jiné osoby, zejména děti.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku uvedenou v bodě 6.1.
Pacienti bez udržovací léčby opioidy, proto zde existuje zvýšené riziko respirační deprese.
Léčba jiné akutní bolesti než bolesti průlomové.
Závažná respirační deprese nebo závažné obstrukční onemocnění plic.
Předchozí radioterapie obličeje.
Opakované epizody epistaxe (krvácení z nosu), (viz bod 4.4).
4.4 Zvláštní upozornění a opatření pro použití
Respirační deprese
U některých pacientů může podání fentanylu vyvolat klinicky významnou respirační depresi, pacient proto musí být sledován z důvodu tohoto rizika. Pacienti v léčbě bolesti, kteří podstupují trvalou terapii pomocí opiátů, jsou schopni vyvinout toleranci vůči respirační depresi a tím je nebezpečí vzniku respirační deprese u těchto pacientů sníženo. Současné užívání léčivých přípravků, které tlumí aktivitu centrálního nervového systému, může zvýšit nebezpečí vzniku respirační deprese (viz bod 4.5).
Chronické plicní onemocnění
U pacientů s chronickým obstrukčním bronchopulmonálním onemocněním může fentanyl vyvolat více závažných nežádoucích účinků. U těchto pacientů mohou opiáty snížit dechovou pohotovost a zvýšit rezistenci dýchacích cest.
Insuficience funkce ledvin nebo jater
Opatrnosti je třeba při podávání fentanylu při mírné až závažné poruše funkce jater nebo ledvin. Vliv nedostatečnosti funkce jater a ledvin na farmakokinetiku přípravku Instanyl nebyl dosud vyhodnocen; avšak, při podávání fentanylu intravenózně se ukazuje, že clearence fentanylu je alterován v důsledku snížené funkce jater a ledvin, která je způsobená změnami v metabolismu clearence a plazmatických proteinů.
Zvýšený nitrolební tlak
Opatrnosti je zapotřebí při použití fentanylu u pacientů se zvýšeným intrakraniálním tlakem, sníženým vědomím nebo v bezvědomí.
Vyšší pozornost vyžaduje rovněž používání přípravku Instanyl u pacientů s mozkovým nádorem nebo poraněním hlavy.
Srdeční onemocnění
Fentanyl může vyvolat bradykardii. Fentanyl by měl být používán s opatrností u pacientů s předchozími nebo stávajícími bradyarytmiemi.
Opioidy mohou způsobit hypotenzi, zejména u pacientů s hypovolémií. Proto je třeba opatrnosti při použití přípravku Instanyl u pacientů s hypotenzí a/nebo s hypovolémií.
Serotoninový syndrom
Opatrnost se doporučuje při současném podání přípravku Instanyl s léčivými přípravky, které ovlivňují serotonergní neurotransmiterové systémy.
K vývoji potenciálně život ohrožujícího serotoninového syndromu může dojít při současném užití se serotonergními léčivými přípravky, jako jsou selektivní inhibitory zpětného vychytávání serotoninu (SSRI) a inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI) a s léčivými přípravky, které ovlivňují metabolismus serotoninu (včetně inhibitorů monoaminooxidázy, IMAO). K tomu může dojít v rámci doporučeného dávkování.
Serotoninový syndrom může zahrnovat změny duševního stavu (např. agitovanost, halucinace, koma), nestabilitu autonomního systému (např. tachykardii, kolísání krevního tlaku, hypertermii),
neuromuskulámí abnormality (např. hyperreflexie, porucha koordinace, rigidita), gastrointestinální příznaky (nauzea, zvracení, průjem).
V případě podezření na serotoninový syndrom je nutno ukončit léčbu přípravkem Instanyl.
Podmínky pro nosní podání přípravku
Jestliže pacient opakovaně udává epizody epistaxe a výskyt nepříjemných pocitů v nose po použití přípravku Instanyl, je třeba zvážit jinou aplikační formu pro léčbu průlomové bolesti.
Běžné nachlazení
Celkový účinek po použití fentanylu u subjektů s běžným nachlazením, bez předchozího použití nosních slizničních vasokonstriktorů, je srovnatelný se zdravými subjekty. Pro současné použití nosních slizničních vasokonstriktorů viz bod 4.5.
Možnost zneužívání a. vznik lékové závislosti
Po opakovaném podání opioidů, například fentanylu, se může vyvinout tolerance a fyzická a/nebo psychická závislost. Výskyt iatrogenní závislosti po užívání opioidů je ale při léčbě bolesti maligního původu vzácný.
Abstinenční příznaky
Výskyt abstinenčních příznaků může být významně ovlivněn použitím opioidních antagonistů (např. naxolon), nebo smíšených opioidních agonistů/antagonistů (např. pentazocin, butorfanol, buprenorfin, nalbufin).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Souběžné podávání fentanylu se serotonergní látkou, jako je inhibitor zpětného vychytávání serotoninu (SSRI), inhibitor zpětného vychytávání serotoninu a noradrenalinu (SNRI) nebo inhibitory monoaminooxidázy (IMAO), může zvýšit riziko serotoninového syndromu, což je potenciálně život ohrožující stav.
Instanyl by neměl být používán u pacientů, kteří v průběhu předchozích 14 dnů užívali inhibitory monoaminooxidázy (IMAO), jelikož při podávání opioidních analgetik bylo zaznamenáno závažné a nepředvídatelné zesílení účinku inhibitorů MAO.
Fentanyl je metabolizován převážně prostřednictvím izoenzymu cytochromu P450 3A4 (CYP3A4), proto se mohou vyskytnout interakce při souběžném podávání přípravku Instanyl s léčivými přípravky ovlivňujícími aktivitu CYP3A4. Při současném podávání s léčivými přípravky, které indukují aktivitu 3A4 se může snížit účinnost přípravku Instanyl. Současné používání přípravku Instanyl se silnými inhibitory CYP3A4 (např. ritonavir, ketokonazol, itrakonazol, troleandomycin, klaritromycin a nelfinavir) nebo středně silnými inhibitory CYP3A4 (např. amprenavir, aprepitant, diltiazem, erytromycin, flukonazol, fosamprenavir a verapamil) může vést k zvýšení plazmatických koncentrací fentanylu, což může potenciálně vyvolat závažné nežádoucí reakce včetně fatálního respiračního útlumu.
Pacienti, kteří používají Instanyl současně se středně silnými či silnými inhibitory CYP3A4, by měli být dlouhodobě pečlivě sledováni. Zvyšování dávky je třeba provádět s opatrností.
Ve studii farmakokinetických interakcí bylo zjištěno, že při současném používání oxymetazolinu se maximální plazmatické koncentrace intranasálně podávaného fentanylu snížily asi o 50 %, zatímco čas do dosažení Cmax (Tmax) se zdvojnásobil. Tím může být snížena účinnost přípravku Instanyl. Současné používání nosních dekongestantů se nedoporučuje (viz bod 5.2)
Současné podávání jiných látek tlumících centrální nervový systém včetně opioidů, sedativ či hypnotik, celkových anestetik, fenotiazinů, trankvilizérů, myorelaxancií, antihistaminik se sedativním účinkem a alkoholu může vyvolat zesílení těchto účinků.
Nedoporučuje se současné podávání smíšených agonistů/antagonistů opioidů (např. buprenorfin, nalbufin, pentazocin). Mají totiž vysokou afinitu vůči opioidním receptorům s relativně nízkou vnitřní (intrinsic) aktivitou, a proto částečně antagonizují analgetický účinek fentanylu a mohou vyvolat abstinenční příznaky u pacientů závislých na opioidech.
Současné používání přípravku Instanyl s jinými intranasálními léčivými přípravky (kromě oxymetazolinu) nebylo v klinických studiích hodnoceno. Doporučuje se, aby při souběžné léčbě průvodních onemocnění, která lze léčit intranasální cestou, byly zváženy alternativní způsoby podávání.
4.6 Fertilita, těhotenství a kojení
Adekvátní údaje o použití fentanylu u těhotných žen nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Potenciální riziko pro člověka není známo. Instanyl by neměl být během těhotenství podáván, pokud to není nezbytně nutné.
Po dlouhodobé léčbě může fentanyl vyvolat abstinenční příznaky u novorozence. Nedoporučuje se podávat fentanyl během průběhu porodu a vybavení plodu (včetně císařského řezu), protože fentanyl prochází placentou a může vyvolat útlum dýchání u plodu. Pokud je Instanyl podán, je nutno mít k dispozici antidotum pro dítě.
Kojení
Fentanyl přechází do mateřského mléka a může vyvolávat sedaci a respirační depresi u kojeného dítěte. Kojící ženy by neměly fentanyl používat a kojení by neměly znovu zahájit dříve než 5 dní po posledním podání fentanylu.
Fertilita
Data pro hodnocení účinku na plodnost u člověka nejsou k dispozici. Ve studiích na zvířatech bylo pozorováno zhoršení plodnosti u samců i samic při sedativních dávkách (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje nebyly provedeny.
O účinku opioidních analgetik je však známo, že snižují duševní a/nebo tělesné schopnosti potřebné k řízení vozidel či obsluze strojů. Pacienti by měli být poučeni, že nemají řídit či obsluhovat stroje, pokud se u nich vyskytne ospalost, závrať, poruchy zraku či jiné nežádoucí účinky, které by mohly ovlivnit jejich schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Při použití přípravku Instanyl je třeba očekávat typické nežádoucí účinky charakteristické pro opioidy. Většina z nich obvykle ustane nebo se zmírní při kontinuálním používání přípravku. Mezi nejzávažnější nežádoucí účinky patří útlum dýchání (který může vést až k apnoi či zástavě dechu), dekompenzace oběhu, hypotenze a šok. Všichni pacienti musí být pečlivě sledováni z hlediska výskytu těchto nežádoucích účinků.
Klinické studie pro Instanyl byly vytvořeny tak, aby bylo možné vyhodnotit bezpečnost a účinnost v léčbě průlomové bolesti. Protože všichni pacienti současně užívali opioidy k léčbě jejich chronické bolesti, například morfin s prodlouženým uvolňováním nebo fentanylové náplasti, nebylo možné v konečném efektu vyhodnotit samotný účinek přípravku Instanyl. V následující tabulce jsou uvedeny nežádoucí účinky, které byly v klinických studiích Instanylu považovány přinejmenším za možná související s léčbou.
Tabulkový přehled nežádoucích účinků
Ke zhodnocení četnosti výskytu nežádoucích účinků byly použity následující kategorie: velmi časté (1>/10); časté (>1/100 až <1/10); méně časté (> 1/1000 až <1/100); vzácné (>1/10000 až <1/1000) a velmi vzácné (<1/10,000), není známo (z dostupných údajů nelze určit).
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Následující nežádoucí účinky byly hlášeny při podávání Instanylu a/nebo dalších přípravků obsahujících fentanyl během klinických studií a ze zkušeností z období po uvedení přípravku na trh:
|
Třída orgánových systémů |
Časté |
Méně časté |
Není známo |
|
Psychiatrické poruchy |
Závislost, insomnie | ||
|
Poruchy nervového systému |
Spavost, závratě, bolest hlavy |
Sedace, myoklonus, parestézie, dysestezie, dysgeuzie |
Křeče |
|
Poruchy ucha a labyrintu |
Závrať (vertigo) |
Dávivé pohyby | |
|
Srdeční poruchy | |||
|
Cévní poruchy |
Zčervenání, návaly horka | ||
|
Respirační, hrudní a mediastinální poruchy |
Podráždění v hrdle |
Útlum dýchání, epistaxe, vřed v nose,výtok z nosu |
Perforace nosní přepážky |
|
Gastrointestinální poruchy |
Zácpa, zánět ústní dutiny, sucho v ústech | ||
|
Poruchy kůže a podkožní tkáně |
Hyperhidróza |
Bolesti kůže, svědění | |
|
Celkové poruchy a reakce v místě aplikace |
Pyrexie |
Únava, malátnost Periferní edém Abstinenční příznaky* | |
|
Poranění, otravy a procedurální komplikace |
Pád |
*po transmukozním podání fentanylu byly pozorovány abstinenční příznaky z vysazení opioidů, jako je nevolnost, zvracení, průjem, úzkost, zimnice, třes a pocení
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Symptomy
Očekává se, že symptomy předávkování fentanylem budou odpovídat zesíleným farmakologickým účinkům fentanylu, např. letargie, koma a těžký útlum dýchání. Dalšími symptomy mohou být hypotermie, snížený svalový tonus, bradykardie a hypotenze. Mezi projevy toxicity patří hluboká sedace, ataxie, mióza, křeče a útlum dýchání, který je hlavním symptomem.
Léčba
Ke zvládnutí útlumu dýchání je třeba zahájit okamžitá protiopatření včetně tělesné či verbální stimulace pacienta. Poté může následovat podání specifického antagonisty opioidů, např. naloxonu. Útlum dýchání po předávkování může trvat déle než účinek antagonisty opioidů. Poločas antagonisty může být krátký, proto může být nutné opakované podání nebo kontinuální infuze. Zrušení narkotického účinku může vyvolat akutní nástup bolesti a uvolnění katecholaminů.
Pokud to vyžaduje klinická situace, je třeba zajistit a udržovat průchodnost dýchacích cest, např. za použití ústního vzduchovodu či endotracheální intubace, dle potřeby je nutno podávat kyslík a zavést podpůrnou či řízenou ventilaci. Dále je nutné udržovat adekvátní tělesnou teplotu a zajistit příjem tekutin.
Jestliže dojde k závažné či přetrvávající hypotenzi, tato může vzniknout v důsledku hypovolémie. Tento stav by měl být adekvátně léčen infúzní terapií.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Analgetika, opioidy, ATC kód: N02AB03 Mechanismus účinku
Fentanyl je opioidní analgetikum, které má vazební afinitu primárně k opioidním ^-receptorům, pro které je čistým agonistou, má nízkou vazební afinitu vůči 5- a K-opioidním receptorům. Jeho základním terapeutickým účinkem je analgezie. Sekundárními farmakologickými účinky jsou útlum dýchání, bradykardie, hypotermie, zácpa, mióza, fyzická závislost a euforie.
Klinická účinnost a bezpečnost
Účinnost a bezpečnost přípravku Instanyl (50, 100 a 200 mikrogramů) byla hodnocena ve dvou randomizovaných, dvojitě zaslepených, zkřížených, placebem kontrolovaných pivotních studiích u 279 dospělých pacientů s rakovinou a tolerancí vůči opioidům (ve věku 32 až 86 let) s průlomovou bolestí (PB). Pacienti měli přibližně 1 až 4 epizody průlomové bolesti denně při nastavené udržovací opioidní terapii. Pacienti ve druhé pivotní studii se předtím již účastnili farmakokinetické studie pro Instanyl nebo první pivotní studie.
Klinické studie prokázaly účinnost a bezpečnost přípravku Instanyl. Nebyla zjištěna jednoznačná korelace mezi udržovací dávkou opioidů a dávkou přípravku Instanyl, nicméně ve druhé pivotní studii se ukázalo, že pacienti, kteří užívali nízkou udržovací dávku opioidů, obvykle dosahovali efektivní úlevy od bolesti s odpovídající nižší silou přípravku Instanyl ve srovnání s pacienty, kteří užívali vysoké udržovací dávky opioidů. Nejzřetelněji se tato tendence ukázala u pacientů, kteří nepřekročili léčebnou dávku Instanyl 50 mikrogramů.
V klinických studiích u onkologických pacientů byly nejčastěji užívané dávky 100 a 200 mikrogramů.
Všechny tři síly přípravku Instanyl prokázaly statisticky významně (p<0,001) vyšší rozdíl v intenzitě bolesti po 10 minutách (PIDJ0) ve srovnání s placebem. Navíc dosáhl Instanyl signifikantně lepšího účinku ve srovnání s placebem na zmírnění BP za 10, 20, 40 a 60 minut po podání. Výsledky souhrnného PID po 60 minutách (SPID0-60) ukázaly, že všechny síly přípravku Instanyl měly signifikantně vyšší průměrné SPID0-60 skóre ve srovnání s placebem (p<0,001), což prokazuje lepší úlevu od bolesti po podání přípravku Instanyl proti placebu v průběhu 60 minut.
Bezpečnost a účinnost přípravku Instanyl byla hodnocena u pacientů, kteří přípravek užívali při nástupu epizody průlomové bolesti. Instanyl by neměl být používán preventivně.
Klinické zkušenosti s přípravkem Instanyl u pacientů již léčených opioidy v dávce odpovídající > 500 mg/den morfinu nebo > 200 mikrogramů/hod transdermálního fentanylu jsou omezené.
Instanyl v dávkách nad 400 mikrogramů nebyl v klinických studiích hodnocen.
5.2 Farmakokinetické vlastnosti
Absorpce
Fentanyl je vysoce lipofilní. Fentanyl vykazuje tříkompartmentovou distribuční kinetiku. Údaje získané u zvířat ukazují, že po vstřebání je fentanyl rychle distribuován do mozku, srdce, plic, ledvin a sleziny, a následně pomaleji redistribuován do svalů a tukové tkáně. Vazba fentanylu na proteiny krevní plazmy činí přibližně 80%. Absolutní biologická dostupnost přípravku Instanyl je asi 89 %. Klinické údaje ukazují, že fentanyl je velmi rychle absorbován nosní sliznicí. Podávání přípravku Instanyl v jednorázových dávkách v rozmezí od 50 do 200 mikrogramů fentanylu v jedné dávce u onkologických pacientů s tolerancí vůči opioidům vedlo k rychlému dosažení hladiny Cmax 0,35 až
1.2 ng/ml. Odpovídající střední hodnota Tmax je 12-15 minut. Ve studii zaměřené na proporcionalitu dávky byly u zdravých dobrovolníků pozorovány vyšší hodnoty Tmax .
Distribuce
Po intravenózním podání fentanylu je iniciální distribuční poločas asi 6 minut a podobný poločas je pozorován po intranasálním podání přípravku Instanyl. Eliminační poločas pro Instanyl činí přibližně 3 - 4 hodin u onkologických pacientů.
Biotransformace
Fentanyl je metabolizován převážně v játrech prostřednictvím CYP3A4. Jeho hlavní metabolit norfentanyl je neaktivní.
Eliminace
Asi 75% fentanylu je vyloučeno močí, většinou ve formě neaktivních metabolitů, méně než 10 % je vyloučeno jako nezměněná léčivá látka. Asi 9 % dávky lze prokázat ve stolici, převážně ve formě metabolitů.
Linearita
Instanyl vykazuje lineární kinetiku. U zdravých subjektů byla pozorována linearita dávky v rozmezí 50 mikrogramů až 400 mikrogramů přípravku Instanyl.
Studie lékových interakcí byla provedena s nosním slizničním vasokonstriktorem (oxymetazolin). Pacienti s alergickou rýmou užívali oxymetazolin nosní sprej 1 hodinu před podáním přípravku Instanyl. Po porovnání bylo dosaženo srovnatelné biologické dostupnosti fentanylu (AUC), s použitím i bez použití oxymetazolinu, ale Cmax fentanylu se snížila a Tmax se zvýšil na dvojnásobek při podání oxymetazolinu. Celkový rozsah expozice fentanylu u subjektů s alergickou rýmou bez předchozí léčby nosním vasokonstriktorem je srovnatelný se zdravými subjekty. Současné používání nosních sizničních vasokonstriktorů se nedoporučuje (viz bod 4.5).
Bioekvivalence
Farmakokinetické studie potvrzují, že Instanyl jednodávková forma a Instanyl vícedávková forma nosního spreje jsou bioekvivalentní.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání genotoxicity a karcinogenity neodhalily žádné zvláštní riziko pro člověka.
Ve studiích fertility a raného embryonálního vývoje prováděných na potkanech byl při vysokých dávkách (300 ^g/kg/den s.c.) pozorován samci přenášený účinek, který odpovídá sedativním účinkům fentanylu ve studiích na zvířatech. Dále studie na samicích potkanů prokázaly snížení fertility a zvýšení embryonální mortality. Novější studie ukazují, že tyto účinky na embryo byly vyvolány maternální toxicitou a nikoliv přímým účinkem látky na vyvíjející se embryo. Ve studii prenatálního a postnatálního vývoje bylo procento přežití potomků signifikantně sníženo u dávek, které mírně snížily hmotnost matky. Tento účinek by mohl být buď důsledkem změněné mateřské péče, nebo přímým
účinkem fentanylu na mláďata. Účinky na tělesný vývoj a chování potomků nebyly pozorovány. Teratogenní účinky nebyly prokázány.
Studie lokální snášenlivosti s přípravkem Instanyl u miniprasat prokázaly, že podávání přípravku Instanyl je dobře tolerováno.
Studie karcinogenity (26týdenní dermální alternativní biologické zkoušky na Tg.AC transgenních myších; dvouletá studie subkutánní karcinogenity na potkanech) s fentanylem neodhalily žádná zjištění svědčící o onkogenním potenciálu. Hodnocení vzorků mozku ze studie karcinogenity u potkanů odhalilo mozkové léze u zvířat, kterým byly podávány vysoké dávky fentanyl citrátu. Význam těchto nálezů pro člověka není známý.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Dihydrát dihydrogenfosforečnanu sodného Dihydrát hydrogenfosforečnanu sodného Čištěná voda
6.2 Inkompatibility
Nejsou známy.
6.3 Doba použitelnosti
Instanyl 50 mikrogramů/v jedné dávce, nosní sprej, roztok Instanyl 100 mikrogramů/v jedné dávce, nosní sprej, roztok Instanyl 200 mikrogramů/v jedné dávce, nosní sprej, roztok 18 měsíců
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 30 °C.
Chraňte před mrazem.
6.5 Druh obalu a velikost balení
Balení nosního spreje se skládá z polypropylenového obalu (PP) a skleněné lahvičky (hnědé sklo, typu 1) s dávkovacím zařízením. Obal je opatřen elektronickým displejem, počitadlem dávek, vestavěným uzamykacím mechanismem a dětským bezpečnostním uzávěrem.
Přípravek je dostupný v dále uvedených velikostech balení:
Instanyl 50 mikrogramů/v jedné dávce, nosní sprej, roztok. DoseGuard
2.0 ml, které obsahuje fentanylum 1,00 mg, umožňuje uvolnit 10 dávek o síle 50 mikrogramů
3.2 ml, které obsahuje fentanylum 1,60 mg, umožňuje uvolnit 20 dávek o síle 50 mikrogramů
4.3 ml, které obsahuje fentanylum 2,15 mg, umožňuje uvolnit 30 dávek o síle 50 mikrogramů
5.3 ml, které obsahuje fentanylum 2,65 mg, umožňuje uvolnit 40 dávek o síle 50 mikrogramů
Instanyl 100 mikrogramů/v jedné dávce, nosní sprej, roztok. DoseGuard
2.0 ml, které obsahuje fentanylum 2,00 mg, umožňuje uvolnit 10 dávek o síle 100 mikrogramů
3.2 ml, které obsahuje fentanylum 3,20 mg, umožňuje uvolnit 20 dávek o síle 100 mikrogramů
4.3 ml, které obsahuje fentanylum 4,30 mg, umožňuje uvolnit 30 dávek o síle 100 mikrogramů
5.3 ml, které obsahuje fentanylum 5,30 mg, umožňuje uvolnit 40 dávek o síle 100 mikrogramů
Instanyl 200 mikrogramů/v jedné dávce, nosní sprej, roztok, DoseGuard
2,0 ml, které obsahuje fentanylum 4,00 mg, umožňuje uvolnit 10 dávek o síle 200 mikrogramů
3.2 ml, které obsahuje fentanylum 6,40 mg, umožňuje uvolnit 20 dávek o síle 200 mikrogramů
4.3 ml, které obsahuje fentanylum 8,60 mg, umožňuje uvolnit 30 dávek o síle 200 mikrogramů
5.3 ml, které obsahuje fentanylum 10,60 mg, umožňuje uvolnit 40 dávek o síle 200 mikrogramů
Na trhu nemusí být všechny velikosti balení,
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Z důvodu možného zneužití fentanylu a případného zbytku roztoku musí být veškerý použitý i nepoužitý nosní sprej systematicky a odpovídajícím způsobem zlikvidován v souladu s místními požadavky, nebo vrácen do lékárny,
Obal nosního spreje obsahuje baterie, Baterie nelze vyměňovat,
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
8. REGISTRAČNÍ ČÍSLO(A)
Instanyl 50 mikrogramů/v jedné dávce, nosní sprej, roztok DoseGuard EU/1/09/531/022-025
Instanyl 100 mikrogramů/v jedné dávce, nosní sprej, roztok DoseGuard EU/1/09/531/026-029
Instanyl 200 mikrogramů/v jedné dávce, nosní sprej, roztok DoseGuard EU/1/09/531/030-033
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace:
Datum posledního prodloužení registrace:
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury http://www.ema.europa.eu.
PŘÍLOHA II
A. VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobců odpovědných za propouštění šarží pro vícedávkový nosní sprej
Takeda Nycomed AS Solbaervegen 5 NO-2409 Elverum Norsko
Takeda GmbH Robert-Bosch-Strasse 8 D - 78224 Singen Německo
Název a adresa výrobců odpovědnýchza propouštění šarží pro jednodávkový nosní sprej
Takeda Nycomed AS Solbaervegen 5 NO-2409 Elverum Norsko
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
Takeda GmbH Robert-Bosch-Strasse 8 D - 78224 Singen Německo
Název a adresa výrobce odpovědného za propouštění šarží pro vícedávkový nosní sprej DoseGuard
Takeda GmbH Robert-Bosch-Strasse 8 D - 78224 Singen Německo
V příbalové informaci léčivého přípravku musí být uveden název a adresa výrobce odpovědného za propouštění příslušné šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na zvláštní lékařský předpis a lékařský předpis s omezením (viz Příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
• Další opatření k minimalizaci rizik
Před uvedením vícedávkových a jednodávkových přípravků na trh v každém ze členských států by měl mít držitel rozhodnutí o registraci odsouhlasený konečný vzdělávací materiál příslušným národním úřadem.
Držitel rozhodnutí o registraci zajistí, že všem lékařům, lékárníkům a pacientům, u nichž se předpokládá, že budou předepisovat, vydávat nebo používat Instanyl, bude poskytnut vzdělávací materiál týkající se správného a bezpečného užívání přípravku.
Vzdělávací materiál pro pacienty by měl obsahovat následující informace:
• Návod k použití nosního spreje
• Návod k otevření a uzavření pouzdra s dětským bezpečnostním uzávěrem (v případě vícedávkového nosního spreje) nebo dětského bezpečnostního uzávěru (v případě vícedávkového nosního spreje DoseGuard) nebo k otevření blistru (v případě jednodávkového nosního spreje)
• V případě vícedávkového nosního spreje: informace o systému počítání dávek
• Nosní sprej s Instanylem lze používat pouze pokud již pacienti užívají denně jinou opioidní léčbu.
• Nosní sprej s Instanylem lze používat pouze pokud se u pacientů vyskytují epizody průlomové nádorové bolesti.
• Nepoužívat Instanyl nosní sprej k léčbě jiného druhu bolesti , jako např. při bolesti hlavy, zad nebo bolesti zubů..
• Nepoužívat Instanyl nosní sprej k léčbě více než čtyř epizod průlomové bolesti denně.
• Používat Instanyl nosní sprej smějí pacienti teprve tehdy, když obdrží přesné informace o použití a bezpečnostních opatřeních od lékaře a/nebo lékárníka.
• Vždy po použití ukládejte vícedávkový nosní sprej znovu zpět do pouzdra s dětským bezpečnostním uzávěrem.
• Vždy po použití uzavřete vícedávkový nosní sprej DoseGuard dětským bezpečnostním uzávěrem.
• Vždy uchovávejte Instanyl mimo dohled a dosah dětí, může jim uškodit. Pokud dítě náhodou užije Instanyl, může i zemřít, vyhledejte ihned lékařskou pomoc.
• S přípravkem smí zacházet pouze pacient nebo ošetřovatel, protože nosní sprej obsahuje léčivou látku, kterou vyhledávají lidé pro zneužití.
• V případě vícedávkového nosního spreje a vícedávkového nosního spreje DoseGuard musí být všechno nepoužité léčivo nebo prázdné lahvičky systematicky zlikvidovány v souladu s místními požadavky.
• V případě jednodávkového nosního spreje musí být všechno nepoužité léčivo nebo prázdné lahvičky systematicky zlikvidováno v souladu s místními požadavky.
Vzdělávací materiál pro lékaře by měl obsahovat následující informace:
• Instanyl nosní sprej mohou používat pouze lékaři, kteří mají zkušenosti, vědomosti a praktické dovednosti s léčbou opioidy u pacientů s nádorovým onemocněním.
• Instanyl nosní sprej je určen pouze k léčbě průlomové bolesti u dospělých pacientů, kteří jsou již současně léčeni udržovacími dávkami opioidů z důvodu chronické nádorové bolesti.
• Instanyl nosní sprej by neměl být používán k léčbě jiné krátkodobé bolesti ani bolestivého stavu.
• Předepisující lékař musí zajistit, aby pacient pochopil, jak užívat Instanyl správně,v souladu se souhrnem údajů o přípravku (SPC) a v souladu s příbalovou informací pro pacienta (PIL), a musí zajistit, aby si pacient nebo ošetřovatel byli vědomi rizik vyplývajících s používání přípravku Instanyl, včetně rizika předávkování, nesprávného použití, vzniku závislosti a zneužití.
• Lékař předepisující Instanyl nosní sprej musí pečlivě vybrat vhodné pacienty, pečlivě je sledovat během celé léčby a informovat je o následujícím:
• Návod k použití nosního spreje
• Návod k otevření a uzavření pouzdra s dětským bezpečnostním uzávěrem (v případě vícedávkového nosního spreje) nebo dětského bezpečnostního uzávěru (v případě vícedávkového nosního spreje DoseGuard) nebo k otevření blistru (v případě jednodávkového nosního spreje)
• Informace o stanovení potřebné dávky uvedené na obalu a ve vzdělávacím materiálu pro vícedávkový nosní sprej
• V případě vícedávkového nosního spreje a vícedávkového nosního spreje DoseGuard musí být všechno nepoužité léčivo nebo prázdné lahvičky systematicky zlikvidovány v souladu s místními požadavky.
• V případě jednodávkového nosního spreje musí být všechno nepoužité léčivo nebo prázdné lahvičky systematicky zlikvidováno v souladu s místními požadavky.
• Předepisující lékař musí používat seznam pro předepisující lékaře.
Vzdělávací materiál pro lékárníky by měl zdůraznit následující informace:
• Instanyl nosní sprej je určen a zaregistrován pouze k léčbě průlomové bolesti u dospělých pacientů, kteří jsou již současně léčeni udržovacími dávkami opioidů z důvodu chronické nádorové bolesti.
• Instanyl nosní sprej by neměl být používán k léčbě jiné krátkodobé bolesti ani bolestivého stavu.
• Lékárník si musí být vědom skutečnosti, že předpis mimo schválené indikace a podezření na zneužití nebo nesprávné použití přípravku Instanyl je třeba hlásit prostřednictvím národního systému hlášení nežádoucích účinků. Prosím zvažte konzultaci s lékařem.
• Lékárník musí být dobře obeznámen se vzdělávacími materiály o Instanyl nosním spreji předtím, než jej začne vydávat.
• Síla nosního spreje Instanyl nemůže být porovnávána s jinými přípravky s obsahem fentanylu.
• Instrukce o použití nosního spreje
• Instrukce k otevření a uzavření pouzdra s dětským bezpečnostním uzávěrem (v případě vícedávkového nosního spreje) nebo dětského bezpečnostního uzávěru (v případě vícedávkového nosního spreje DoseGuard)nebo k otevření blistru (v případě jednodávkového nosního spreje)
• Informace o stanovení potřebné dávky uvedené na obalu a ve vzdělávacím materiálu pro vícedávkový nosní sprej
• Lékárník musí informovat pacienta, aby z důvodu možného odcizení a zneužití Instanyl nosního spreje jej preventivně uchovával na bezpečném místě.
• V případě vícedávkového nosního spreje a vícedávkového nosního spreje DoseGuard musí být všechno nepoužité léčivo nebo prázdné lahvičky systematicky zlikvidovány v souladu s místními požadavky.
• V případě jednodávkového nosního spreje musí být všechno nepoužité léčivo nebo prázdné lahvičky systematicky zlikvidováno v souladu s místními požadavky.
• Lékárník musí používat seznam pro předepisující lékárníky.
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
Instanyl 50 mikrogramů/v jedné dávce, nosní sprej, roztok Fentanylum
Jeden ml roztoku obsahuje fentanyli citras, odpovídá fentanylum 500 mikrogramů Jedna dávka (100 mikrolitrů) obsahuje fentanylum 50 mikrogramů
Dále obsahuje: dihydrát dihydrogenfosforečnanu sodného, dihydrát hydrogenfosforečnanu sodného, čištěná voda
Nosní sprej, roztok 1,8 ml Nosní sprej, roztok 2,9 ml Nosní sprej, roztok 5,0 ml
1.8 ml - 10 dávek
2.9 ml - 20 dávek
5,0 ml - 40 dávek
Před použitím si přečtěte příbalovou informaci Nosní podání
Instrukce pro otevření a uzavření pouzdra:
- Uchopte pouzdro
- Odstraňte pojistku, která garantuje, že toto pouzdro nebylo ještě otevřeno
- Přiložte palec a prostředníček ze stran na pouzdro
- Zmáčkněte pouzdro směrem dovnitř za použití palce a prostředníčku
- Současně vložte druhý palec na čelní záklopku a také stiskněte směrem dovnitř
- Postupně stiskněte všechny tn body
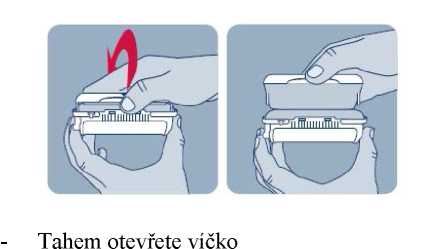
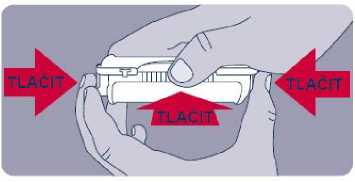
- Po použití přípravku Instanyl musí být nosní sprej vždy uložen do vnitřní úchytky a pouzdro musí být
uzavřeno
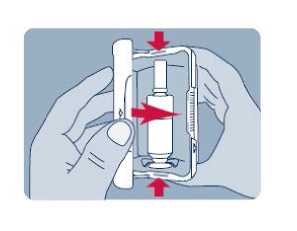
- Při zavírání pouzdra se ujistěte, že postranní stěny zapadly zpět do drážek
- Pevným tlakem dolů tlačte na stěny dokud nezaklapnou do správné pozice
Zaškrtněte jedno okénko po použití každé dávky (Zaškrtávací okénka 10, 20 nebo 40 okének)
Zaškrtněte jedno okénko po použití každé dávky
10 dávek
□□□□□□□□□□
Zaškrtněte jedno okénko po použití každé dávky
20 dávek
□ □□□□□□□□□ □ □□□□□□□□□
Zaškrtněte jedno okénko po použiti každé dávky
40 dávek
□ □□□□□□□□□ □ □□□□□□□□□ □ □□□□□□□□□ □ □□□□□□□□□
Vždy po použití ukládejte nosní sprej do pouzdra s dětským bezpečnostním uzávěrem.
Uchovávejte mimo dohled a dosah dětí.
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 30 °C. Uchovávejte lahvičku ve svislé poloze. Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
Údaje o likvidaci přípravku naleznete v příbalové informaci.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/531/001
EU/1/09/531/002
EU/1/09/531/003
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Instanyl 50
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU OZNAČENÍ/ LAHVIČKA (Vícedávkové)_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Instanyl 50 mikrogramů/ v jedné dávce, nosní sprej
Fentanylum
Nosní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
Exp:
4. ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1.8 ml - 10 dávek
2.9 ml - 20 dávek 5,0 ml - 40 dávek
6. JINÉ
Instanyl 100 mikrogramů/v jedné dávce, nosní sprej, roztok Fentanylum
Jeden ml roztoku obsahuje fentanyli citras, odpovídá fentanylum 1 000 mikrogramů Jedna dávka (100 mikrolitrů) obsahuje fentanylum 100 mikrogramů
Dále obsahuje: dihydrát dihydrogenfosforečnanu sodného, dihydrát hydrogenfosforečnanu sodného, čištěná voda
Nosní sprej, roztok 1,8 ml Nosní sprej, roztok 2,9 ml Nosní sprej, roztok 5,0 ml
1.8 ml - 10 dávek
2.9 ml - 20 dávek
5,0 ml - 40 dávek
Před použitím si přečtěte příbalovou informaci. Nosní podání
Instrukce pro otevření a uzavření pouzdra:
- Uchopte pouzdro
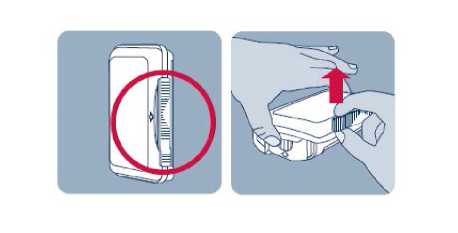
- Odstraňte pojistku, která garantuje, že toto pouzdro nebylo ještě otevřeno
- Přiložte palec a prostředníček ze stran na pouzdro
- Zmáčkněte pouzdro směrem dovnitř za použití palce a prostředníčku
- Současně vložte druhý palec na čelní záklopku a také stiskněte směrem dovnitř
- Postupně stiskněte všechny tn body
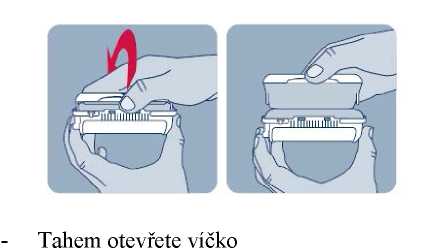
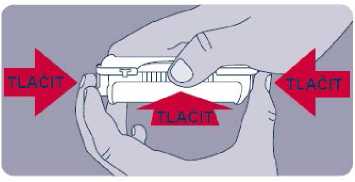
- Po použití přípravku Instanyl musí být nosní sprej vždy uložen do vnitřní úchytky a pouzdro musí být
uzavřeno
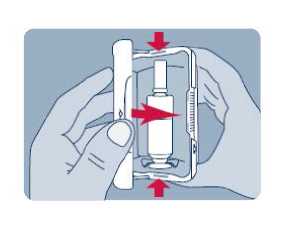
- Při zavírání pouzdra se ujistěte, že postranní stěny zapadly zpět do drážek
- Pevným tlakem dolů tlačte na stěny dokud nezaklapnou do správné pozice
Zaškrtněte jedno okénko po použití každé dávky (Zaškrtávací okénka 10, 20 nebo 40 okének)
Zaškrtněte jedno okénko po použití každé dávky
10 dávek
□□□□□□□□□□
Zaškrtněte jedno okénko po použití každé dávky
20 dávek
□□□□□□□□□□
□□□□□□□□□□
Zaškrtněte jedno okénko po použiti každé dávky
40 dávek
□ □□□□□□□□□ □ □□□□□□□□□ □ □□□□□□□□□ □ □□□□□□□□□
Vždy po použití ukládejte nosní sprej do pouzdra s dětským bezpečnostním uzávěrem.
Uchovávejte mimo dohled a dosah dětí.
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 30 °C. Uchovávejte lahvičku ve svislé poloze. Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
Údaje o likvidaci přípravku naleznete v příbalové informaci.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/531/004
EU/1/09/531/005
EU/1/09/531/006
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Instanyl 100
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU OZNAČENÍ/ LAHVIČKA (Vícedávkové)_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Instanyl 100 mikrogramů/ v jedné dávce, nosní sprej
Fentanylum
Nosní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
Exp:
4. ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1.8 ml - 10 dávek
2.9 ml - 20 dávek 5,0 ml - 40 dávek
6. JINÉ
Instanyl 200 mikrogramů/v jedné dávce, nosní sprej, roztok Fentanylum
Jeden ml roztoku obsahuje fentanyli citras, odpovídá fentanylum 2 000 mikrogramů Jedna dávka (100 mikrolitrů) obsahuje fentanylum 200 mikrogramů
Dále obsahuje: dihydrát dihydrogenfosforečnanu sodného, dihydrát hydrogenfosforečnanu sodného, čištěná voda
Nosní sprej, roztok 1,8 ml Nosní sprej, roztok 2,9 ml Nosní sprej, roztok 5,0 ml
1.8 ml - 10 dávek
2.9 ml - 20 dávek
5,0 ml - 40 dávek
Před použitím si přečtěte příbalovou informaci. Nosní podání
Instrukce pro otevření a uzavření pouzdra: - Uchopte pouzdro
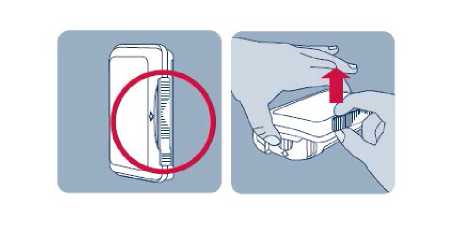
- Odstraňte pojistku, která garantuje, že toto pouzdro nebylo ještě otevřeno
- Přiložte palec a prostředníček ze stran na pouzdro
- Zmáčkněte pouzdro směrem dovnitř za použití palce a prostředníčku
- Současně vložte druhý palec na čelní záklopku a také stiskněte směrem dovnitř
- Postupně stiskněte všechny tn body
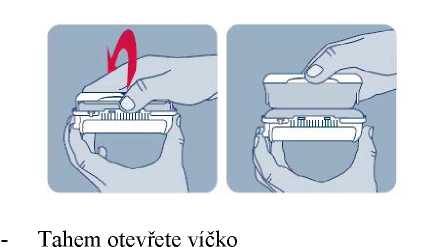
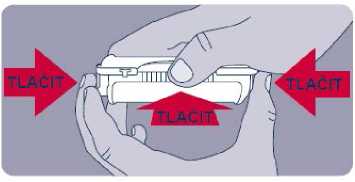
- Po použití přípravku Instanyl musí být nosní sprej vždy uložen do vnitřní úchytky a pouzdro musí být
uzavřeno
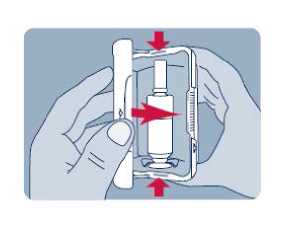
- Při zavírání pouzdra se ujistěte, že postranní stěny zapadly zpět do drážek
- Pevným tlakem dolů tlačte na stěny dokud nezaklapnou do správné pozice
Zaškrtněte jedno okénko po použití každé dávky (Zaškrtávací okénka 10, 20 nebo 40 okének)
Zaškrtněte jedno okénko po použití každé dávky
10 dávek
□□□□□□□□□□
Zaškrtněte jedno okénko po použití každé dávky
20 dávek
□ □□□□□□□□□ □ □□□□□□□□□
Zaškrtněte jedno okénko po použiti každé dávky
40 dávek
□ □□□□□□□□□ □ □□□□□□□□□ □ □□□□□□□□□ □ □□□□□□□□□
Vždy po použití ukládejte nosní sprej do pouzdra s dětským bezpečnostním uzávěrem.
Uchovávejte mimo dohled a dosah dětí.
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 30 °C. Uchovávejte lahvičku ve svislé poloze. Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
Údaje o likvidaci přípravku naleznete v příbalové informaci.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/531/007
EU/1/09/531/008
EU/1/09/531/009
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Instanyl 200
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU OZNAČENÍ/ LAHVIČKA (Vícedávkové)_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Instanyl 200 mikrogramů/ v jedné dávce, nosní sprej
Fentanylum
Nosní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
Exp:
4. ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1.8 ml - 10 dávek
2.9 ml - 20 dávek 5,0 ml - 40 dávek
6. JINÉ
Instanyl 50 mikrogramů, nosní sprej, roztok v jednodávkovém obalu Fentanylum
Jednojednodávkové balení nosního spreje obsahuje jednu dávku (100 mikrolitrů) fentanyli citras, odpovídá fentanylum 50 mikrogramů (^g).
Dále obsahuje: dihydrát dihydrogenfosforečnanu sodného, dihydrát hydrogenfosforečnanu sodného, čištěná voda
Nosní sprej, roztok
2 jednodávková balení 6 jednodávkových balení 8 jednodávkových balení 10 jednodávkových balení
Před použitím si přečtěte příbalovou informaci.
Nosní podání
Jeden sprej (obal) obsahuje pouze jednu dávku. Sprej nesmí být zkoušen před použitím.
Uchovávejte mimo dohled a dosah dětí.
Použitelné do:
Uchovávejte při teplotě do 30 °C.
Uchovávejte blistr v krabičce. Uchovávejte ve svislé poloze.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
Údaje o likvidaci přípravku naleznete v příbalové informaci.
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
EU/1/09/531/010
EU/1/09/531/011
EU/1/09/531/012
EU/1/09/531/013
Č.š.:
Instanyl 50, jedna dávka
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH NEBO STRIPECH BLISTR S DĚTSKÝM BEZPEČNOSTNÍM UZÁVĚREM (Jedna dávka)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Instanyl 50 mikrogramů, nosní sprej Fentanylum
2. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Takeda Pharma A/S
3. POUŽITELNOST
Použitelné do:
4. ČÍSLO ŠARŽE
Č.š.:
5. JINÉ
Nosní podání 1 dávka
Uchovávejte mimo dohled a dosah dětí.
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK / JEDNODÁVKOVÝ NOSNÍ SPREJ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Instanyl 50 ^g, nosní sprej
Fentanylum
Nosní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 dávka
6. JINÉ
Instanyl 100 mikrogramů, nosní sprej, roztok v jednodávkovém obalu Fentanylum
Jedno jednodávkové balení nosního spreje obsahuje jednu dávku (100 mikrolitrů) fentanyli citras, odpovídá fentanylum 100 mikrogramů (^g).
Dále obsahuje: dihydrát dihydrogenfosforečnanu sodného, dihydrát hydrogenfosforečnanu sodného, čištěná voda
Nosní sprej, roztok
2 jednodávková balení 6 jednodávkových balení 8 jednodávkových balení 10 jednodávkových balení
Před použitím si přečtěte příbalovou informaci.
Nosní podání
Jeden sprej (obal) obsahuje pouze jednu dávku. Sprej nesmí být zkoušen před použitím.
Uchovávejte mimo dohled a dosah dětí.
Použitelné do:
Uchovávejte při teplotě do 30 °C.
Uchovávejte blistr v krabičce. Uchovávejte ve svislé poloze.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
Údaje o likvidaci přípravku naleznete v příbalové informaci.
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
EU/1/09/531/014
EU/1/09/531/015
EU/1/09/531/016
EU/1/09/531/017
Č.š.:
Instanyl 100, jedna dávka
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH NEBO STRIPECH BLISTR S DĚTSKÝM BEZPEČNOSTNÍM UZÁVĚREM (Jedna dávka)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Instanyl 100 mikrogramů, nosní sprej Fentanylum
2. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Takeda Pharma A/S
3. POUŽITELNOST
Použitelné do:
4. ČÍSLO ŠARŽE
Č.š.:
5. JINÉ
Nosní podání 1 dávka
Uchovávejte mimo dohled a dosah dětí.
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK / JEDNODÁVKOVÝ NOSNÍ SPREJ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Instanyl 100 ^g, nosní sprej
Fentanylum
Nosní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Č.š.
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 dávka
6. JINÉ
Instanyl 200 mikrogramů, nosní sprej, roztok v jednodávkovém obalu Fentanylum
Jedno jednodávkové balení nosního spreje obsahuje jednu dávku (100 mikrolitrů) fentanyli citras, odpovídá fentanylum 200 mikrogramů (^g).
Dále obsahuje: dihydrát dihydrogenfosforečnanu sodného, dihydrát hydrogenfosforečnanu sodného, čištěná voda
Nosní sprej, roztok
2 jednodávková balení 6 jednodávkových balení 8 jednodávkových balení 10 jednodávkových balení
Před použitím si přečtěte příbalovou informaci.
Nosní podání
Jeden sprej (obal) obsahuje pouze jednu dávku. Sprej nesmí být zkoušen před použitím.
Uchovávejte mimo dohled a dosah dětí.
Použitelné do:
Uchovávejte při teplotě do 30 °C.
Uchovávejte blistr v krabičce. Uchovávejte ve svislé poloze.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
Údaje o likvidaci přípravku naleznete v příbalové informaci.
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
EU/1/09/531/018
EU/1/09/531/019
EU/1/09/531/020
EU/1/09/531/021
Č.š.
Instanyl 200, jedna dávka
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH NEBO STRIPECH BLISTR S DĚTSKÝM BEZPEČNOSTNÍM UZÁVĚREM (Jedna dávka)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Instanyl 200 mikrogramů, nosní sprej Fentanylum
2. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Takeda Pharma A/S
3. POUŽITELNOST
Použitelné do:
4. ČÍSLO ŠARŽE
Č.š.:
5. JINÉ
Nosní podání 1 dávka
Uchovávejte mimo dohled a dosah dětí.
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK / JEDNODÁVKOVÝ NOSNÍ SPREJ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Instanyl 200 ^g, nosní sprej
Fentanylum
Nosní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP:
4. ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 dávka
6. JINÉ
Instanyl 50 mikrogramů/v jedné dávce, nosní sprej, roztok Fentanylum
Jeden ml roztoku obsahuje fentanyli citras, odpovídá fentanylum 500 mikrogramů Jedna dávka (100 mikrolitrů) obsahuje fentanylum 50 mikrogramů
Dále obsahuje: dihydrát dihydrogenfosforečnanu sodného, dihydrát hydrogenfosforečnanu sodného, čištěná voda
DoseGuard
Nosní sprej, roztok 2,0 ml Nosní sprej, roztok 3,2 ml Nosní sprej, roztok 4,3 ml Nosní sprej, roztok 5,3 ml
10 dávek (2,0 ml)
20 dávek (3,2 ml)
30 dávek (4,3 ml)
40 dávek (5,3 ml)
Před použitím si přečtěte příbalovou informaci Nosní podání
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ

8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 30 °C. Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
Údaje o likvidaci přípravku naleznete v příbalové informaci.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/531/022
EU/1/09/531/023
EU/1/09/531/024
EU/1/09/531/025
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
Instanyl 50
Instanyl 50 mikrogramů/ v jedné dávce, nosní sprej
Fentanylum
Nosní podání
Exp:
Č.š.:
10 dávek (2,0 ml) 20 dávek (3,2 ml) 30 dávek (4,3 ml) 40 dávek (5,3 ml)
Uchovávejte mimo dohled a dosah dětí.
Nosní sprej po použití vždy uzavřete nasazením dětského bezpečnostního uzávěru.
Instanyl 100 mikrogramů/v jedné dávce, nosní sprej, roztok Fentanylum
Jeden ml roztoku obsahuje fentanyli citras, odpovídá fentanylum 1 000 mikrogramů Jedna dávka (100 mikrolitrů) obsahuje fentanylum 100 mikrogramů
Dále obsahuje: dihydrát dihydrogenfosforečnanu sodného, dihydrát hydrogenfosforečnanu sodného, čištěná voda
DoseGuard
Nosní sprej, roztok 2,0 ml Nosní sprej, roztok 3,2 ml Nosní sprej, roztok 4,3 ml Nosní sprej, roztok 5,3 ml
10 dávek (2,0 ml)
20 dávek (3,2 ml)
30 dávek (4,3 ml)
40 dávek (5,3 ml)
Před použitím si přečtěte příbalovou informaci. Nosní podání
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ

8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 30 °C. Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
Údaje o likvidaci přípravku naleznete v příbalové informaci.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/531/026
EU/1/09/531/027
EU/1/09/531/028
EU/1/09/531/029
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
Instanyl 100
Instanyl 100 mikrogramů/ v jedné dávce, nosní sprej
Fentanylum
Nosní podání
Exp:
Č.š.:
10 dávek (2,0 ml) 20 dávek (3,2 ml) 30 dávek (4,3 ml) 40 dávek (5,3 ml)
Uchovávejte mimo dohled a dosah dětí.
Nosní sprej po použití vždy uzavřete nasazením dětského bezpečnostního uzávěru.
Instanyl 200 mikrogramů/v jedné dávce, nosní sprej, roztok Fentanylum
Jeden ml roztoku obsahuje fentanyli citras, odpovídá fentanylum 2 000 mikrogramů Jedna dávka (100 mikrolitrů) obsahuje fentanylum 200 mikrogramů
Dále obsahuje: dihydrát dihydrogenfosforečnanu sodného, dihydrát hydrogenfosforečnanu sodného, čištěná voda
DoseGuard
Nosní sprej, roztok 2,0 ml Nosní sprej, roztok 3,2 ml Nosní sprej, roztok 4,3 ml Nosní sprej, roztok 5,3 ml
10 dávek (2,0 ml)
20 dávek (3,2 ml)
30 dávek (4,3 ml)
40 dávek (5,3 ml)
Před použitím si přečtěte příbalovou informaci. Nosní podání
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ

8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 30 °C. Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
Údaje o likvidaci přípravku naleznete v příbalové informaci.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/531/030
EU/1/09/531/031
EU/1/09/531/032
EU/1/09/531/033
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
Instanyl 200
Instanyl 200 mikrogramů/ v jedné dávce, nosní sprej
Fentanylum
Nosní podání
Exp:
Č.š.:
10 dávek (2,0 ml) 20 dávek (3,2 ml) 30 dávek (4,3 ml) 40 dávek (5,3 ml)
Uchovávejte mimo dohled a dosah dětí.
Nosní sprej po použití vždy uzavřete nasazením dětského bezpečnostního uzávěru.
Instanyl 50 mikrogramů/v jedné dávce, nosní sprej, roztok Instanyl 100 mikrogramů/v jedné dávce, nosní sprej, roztok Instanyl 200 mikrogramů/v jedné dávce, nosní sprej, roztok
Fentanylum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán pouze Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit,
a to i tehdy, má-li stejné známky onemocnění příznaky jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, nebo zdravotní sestře nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Instanyl a k čemu se užívá
2. Čemu musíte věnovat pozornost, než začnete Instanyl užívat
3. Jak se Instanyl užívá
4. Možné nežádoucí účinky
5 Jak Instanyl uchovávat
6. Obsah balení a další informace
1. Co je Instanyl a k čemu se používá
Instanyl obsahuje léčivou látku fentanyl a patří do skupiny silných léků proti bolesti, které se nazývají opioidy. Opioidy zabraňují přenosu bolestivých pocitů do centrálního nervového systému.
Instanyl účinkuje velmi rychle a je používán k úlevě od průlomové bolesti u dospělých pacientů trpících nádorovým onemocněním, kteří již užívají opioidy k léčbě chronické bolesti. Průlomová bolest je náhle vzniklá bolest, která se může vyskytnout, i přestože užíváte předepsané opioidy proti bolesti.
2. Čemu musíte věnovat pozornost, než začnete Instanyl užívat
Neužívejte Instanyl,
- jestliže jste alergický(á) (přecitlivělý(á)) na fentanyl nebo na kteroukoli další složku přípravku Instanyl (uvedenou v bodě 6)
- jestliže pravidelně neužíváte předepsané opioidní léčivo (např. kodein, fentanyl, hydromorfon, morfin, oxykodon, petidin) určené ke zvládnutí přetrvávající bolesti a to každý den podle pravidelného rozvrhu po dobu nejméně jednoho týdne. Jestliže tato léčiva neužíváte, nesmíte přípravek Instanyl užívat, protože může zvýšit riziko, že se vám dýchání nebezpečně zpomalí a/nebo bude mělké či dokonce přestanete dýchat.
- jestliže trpíte krátkodobou bolestí jinou než průlomovou.
- jestliže trpíte vážnými dýchacími obtížemi nebo trpíte vážným obstrukčním plicním onemocněním.
- jestliže jste dříve prodělal(a) radioterapii obličeje.
- jestliže trpíte opakovaným krvácením z nosu.
Upozornění a opatření
Před použitím přípravku Instanyl se poraďte se svým lékařem, zvláště
- jestliže trpíte dlouhodobě vážným obstrukčním plicním onemocněním, vaše dýchání se může zhoršit po použití přípravku Instanyl.
- jestliže máte problémy se srdcem, zvláště pomalý tep srdce, nízký krevní tlak, nízký objem krve.
- jestliže máte problémy s játry nebo ledvinami.
- jestliže máte problém s funkcí mozku například z důvodu nádoru mozku, z důvodu poranění hlavy nebo zvýšený nitrolební tlak.
- jestliže užíváte antidepresiva nebo antipsychotika, přečtěte si prosím bod Další léčivé přípravky a Instanyl.
- jestliže užíváte jiný nosní sprej například při běžné rýmě nebo při alergii.
Jestliže pocítíte zhoršené dýchání po použití přípravku Instanyl, je velmi důležité, abyste neprodleně vyhledal(a) lékaře nebo se dostavil(a) do nemocnice.
Jestliže trpíte opakovaným krvácením z nosu nebo nepříjemnými pocity v nose po použití přípravku Instanyl, musíte tuto skutečnost oznámit lékaři, který vám navrhne jiný způsob léčby průlomové bolesti.
Jestliže se domníváte, že se u vás projevuje závislost na Instanyl, je velmi důležité abyste o této skutečnosti informoval(a) svého lékaře.
Děti a dospívající
Instanyl by neměl být používán u dětí a dospívajících do 18 let .
Další léčivé přípravky a Instanyl
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, nebo které možná budete užívat a to i o lécích, které jsou dostupné bez lékařského předpisu.
Instanyl může mít vliv na účinek jiných léčivých přípravků nebo jeho účinek může být ovlivněn užíváním jiných léčivých přípravků.
Zvláštní opatrnost se doporučuje při užívání následujících léků:
* Všechny léky, které normálně navozují zklidnění a spánek (mají sedativní účinky), jako jsou léky na spaní, léky proti pocitu úzkosti (anxiolytika), léky proti alergii (antihistaminika) a léky na zklidnění (trankvilizéry).
Všechny léky, které mohou ovlivnit způsob metabolizmu pro Instanyl v organizmu, jako například
• ritonavir, nelfinavir, amprenavir a fosamprenavir (léky k léčbě HIV infekce);
• inhibitory CYP3A4 j ako j sou ketokonazol, itrakonazol, a flukonazol (léky k léčbě plísňových infekcí);
• troleandomycin, klaritromycin, nebo erytromycin (léky k léčbě bakteriálních infekcí);
• aprepitant (k léčbě těžké nevolnosti);
• diltiazem a verapamil (léky k léčbě vysokého krevního tlaku a srdečního onemocnění).
* Léčivé přípravky nazývané inhibitory monoaminooxidázy (IMAO), které se používají k léčbě závažných depresivních stavů, pokud jste je užíval(a) v posledních dvou týdnech.
Riziko nežádoucích účinků se zvyšuje, pokud užíváte léky, jako jsou některá antidepresiva nebo antipsychotika. Přípravek Instanyl může vzájemně reagovat s těmito léky a může u vás dojít ke změně duševního stavu (např. neklid, halucinace, koma) a k dalším účinkům, jako je zvýšení tělesné teploty nad 38 °C, zrychlený srdeční puls, nestabilní krevní tlak a zvýraznění reflexů, ztuhlost svalů, nedostatečná koordinace a/nebo příznaky v trávicím traktu (např. nevolnost, zvracení, průjem). Váš lékař vám řekne, zda je pro vás přípravek Instanyl vhodný.
Léky nazývané parciální opioidní agonisté/antagonisté např. buprenorfin, nalbufin a pentazocin (léky k léčbě bolesti). Mohl(a) byste mít příznaky syndromu z vysazení (nevolnost, zvracení, průjem, úzkost, zimnice, třes a pocení).
* Všechny léky, které se aplikují do nosu, zvláště oxymetazolin, xylometazolin a podobné léky, které se používají k úlevě od ucpaného nosu.
Užívání přípravku Instanyl s jídlem, pitím, nebo s alkoholem
Při užívání přípravku Instanyl se vyvarujte pití alkoholu, protože může zvýšit riziko výskytu nebezpečných nežádoucích účinků.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat. Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
Instanyl nesmí být používán v průběhu těhotenství, pokud lékař nerozhodne jinak.
Instanyl nesmí být používán v průběhu porodu, protože fentanyl může způsobit vážné dýchací obtíže u novorozence.
Fentanyl přechází do mateřského mléka a může vyvolávat nežádoucí účinky u kojeného dítěte. Neužívejte Instanyl, jestliže kojíte. Kojení byste neměla začít po dobu nejméně 5 dní po poslední dávce Instanylu.
Řízení dopravních prostředků a obsluha strojů
Neřiďte dopravní prostředek a neobsluhujte žádné stroje v průběhu léčby přípravkem Instanyl.
Instanyl může způsobit závrať a ospalost, které by mohly ovlivnit vaši schopnost řídit a obsluhovat stroje.
3. Jak se Instanyl užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á) poraďte se se svým lékařem nebo lékárníkem.
Dávka přípravku Instanyl je nezávislá na vaší zavedené léčbě chronické bolesti.
Pokud používáte Instanyl poprvé, lékař bude s vámi spolupracovat na stanovení dávky přípravku, která vám přinese úlevu od průlomové bolesti.
Počáteční dávkou by měla být jedna dávka 50 mikrogramů do jednoho nosního průduchu vždy, když budete mít epizodu průlomové bolesti. V průběhu stanovení dostatečné dávky vám váš lékař může doporučit použití vyšší dávky.
Jestliže není dosaženo dostatečné úlevy od průlomové bolesti po 10 minutách po první dávce, stejná dávka může být aplikována do druhého nosního průduchu.
Pro další použití přípravku pro léčbu epizody průlomové bolesti je nutné vyčkat čtyři hodiny.
Instanyl můžete použít pro léčbu maximálně čtyř epizod průlomové bolesti denně.
Jestliže máte více než čtyři epizody průlomové bolesti denně, informujte svého lékaře, který může vaši obvyklou léčbu bolesti pozměnit.
Pro přehled o počtu použitých dávek přípravku Instanyl, použijte zaškrtávací okénka v přiložené brožuře, která je uložena na vrchu pouzdra s dětským bezpečnostním uzávěrem.
Neměňte svévolně dávku přípravku Instanyl ani předepsanou léčbu bolesti. Změna léčby či dávky přípravku Instanyl musí být nastavena ve spolupráci s lékařem.
Instanyl je určen pro nosní podání.
Přečtěte si prosím návod k použití na konci této příbalové informace, kde se dozvíte, jak používat přípravek Instanyl.
Jestliže jste užil(a) více přípravku Instanyl, než jste měl(a) nebo pokud si myslíte, že někdo užil přípravek Instanyl náhodně
Jestliže jste užil(a) více přípravku Instanyl, než jste měl(a), je velmi důležité, abyste neprodleně vyhledal(a) lékaře nebo se dostavil(a) do nemocnice nebo na oddělení akutního příjmu ke zhodnocení rizika a pro instrukce jak dále postupovat.
Příznaky předávkování jsou:
Spavost, netečnost, závratě, snížení tělesné teploty, pomalý srdeční tep, obtíže při koordinaci pohybů rukou a nohou.
Ve velmi závažných případech předávkování přípravkem Instanyl může nastat bezvědomí, netečnost, křeče, a závažné dechové obtíže (velmi pomalé a mělké dýchání).
Jestliže se u vás objeví výše popsané příznaky, vyhledejte neprodleně lékařskou pomoc.
Informace pro ošetřovatelský personál
Jestliže zpozorujete u osoby, která užívá Instanyl, náhlé zpomalení životního rytmu, obtíže s dýcháním nebo máte obtíže s navázáním kontaktu:
- Musíte neodkladně volat záchrannou službu.
- Musíte se snažit do doby příjezdu záchranné služby udržet postiženou osobu při vědomí, mluvte s ní nebo s ní šetrně znovu a znovu potřásejte.
- Pokud se u postižené osoby projeví obtíže s dýcháním, musíte každých 5-10 vteřin vyzvat postiženou osobu k hlubokému nádechu.
- Pokud postižená osoba přestane dýchat, musíte zahájit resuscitaci a pokračovat v ní do příjezdu záchranné služby.
Jestliže se domníváte, že kdokoliv náhodně užil Instanyl, vyhledejte neprodleně lékařskou pomoc. Snažte se udržet postiženou osobu při vědomí do příchodu odborné pomoci.
Jestliže někdo náhodně užije Instanyl, mohou se u něj projevit podobné příznaky, jako jsou popsány výše při předávkování.
Jestliže jste zapomněl(a) užít Instanyl
Jestliže stále přicházejí záchvaty průlomové bolesti, užijte Instanyl dle doporučení lékaře.
Pokud již záchvaty průlomové bolesti ustaly, nepoužívejte Instanyl dříve než při dalším záchvatu průlomové bolesti.
Jestliže jste přestal(a) užívat Instanyl
Neužívejte Instanyl, jestliže již nenastupují záchvaty průlomové bolesti. Pokračujte ale v zavedené léčbě chronické bolesti při nádorovém onemocnění. Pokud si nejste jistý(á), zeptejte se svého lékaře, zda užíváte správné dávkování svých léků.
Jestliže přestanete užívat Instanyl, mohou se u vás projevit abstinenční příznaky (příznaky z odebrání léku) podobné nežádoucím účinkům popsaným pro Instanyl. Pokud pozorujete takové příznaky, kontaktujte svého lékaře. Lékař musí rozhodnout, zda je potřeba léčba ke zmírnění nebo odstranění abstinenčních příznaků.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Většina z nich obvykle ustane nebo se zmírní při kontinuálním používání přípravku.
Přerušte léčbu a kontaktujte ihned svého lékaře, nemocnici nebo pohotovost, jestliže:
- máte vážné dýchací obtíže
- chroptíte při dýchání
- máte záchvatovitou bolest
- máte výraznou závrať
Tyto nežádoucí účinky mohou být velmi závažné.
zhodnocení četnosti výskytu nežádoucích účinků byly použity následující kategorie: velmi časté (1>/10); časté (>1/100 až <1/10); méně časté (> 1/1000 až <1/100); vzácné (>1/10000 až <1/1000) a velmi vzácné (<1/10,000), není známo (z dostupných údajů nelze určit).
Další nežádoucí účinky hlášené po podání přípravku Instanyl:
Časté nežádoucí účinky: (vyskytují se u více než 1 z 10 pacientů ) ospalost, závratě až obtíže s udržením rovnováhy, bolest hlavy, podráždění v hrdle, nevolnost, zvracení, zčervenání, návaly horka, silné pocení.
Méně časté nežádoucí účinky: (vyskytují se až u 1 ze 100 pacientů) léková závislost, spavost, netečnost, křečovité stahy svalů, abnormální kožní citlivost často nepříjemná, změny chuti, dávivé pohyby, nízký krevní tlak, závažné problémy s dýcháním, krvácení z nosu, vřed v nose, výtok z nosu, zácpa, zánět ústní sliznice, sucho v ústech, bolest kůže, svědění kůže, horečka.
Četnost není známa: (četnost nelze z dostupných údajů určit).
Pád, průjem, křeče (záchvaty), otok paží nebo nohou, vidění a slyšení věcí a zvuků, které ve skutečnosti neexistují (halucinace), únava, malátnost, syndrom z vysazení (může se projevit výskytem následujících nežádoucích účinků: nevolnost, zvracení, průjem, úzkost, zimnice, třes a pocení).
Byly taktéž hlášeny případy, kdy u pacientů došlo k proděravění nosní přepážky - struktury, která odděluje nosní dírky.
Informujte svého lékaře, jestliže pozorujete opakovaně krvácení z nosu nebo nepříjemné pocity v nose.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Instanyl uchovávat
Léčivá látka proti bolesti v přípravku Instanyl je velmi silná a může způsobit ohrožení života u dětí.
Instanyl musí být uchováván mimo dohled a dosah dětí. Vždy ukládejte nosní sprej do pouzdra s dětským bezpečnostním uzávěrem.
Přípravek Instanyl nepoužívejte po uplynutí doby použitelnosti, uvedené na lahvičce za textem Použitelné do:. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte při teplotě do 30 °C. Nosní sprej uchovávejte ve svislé poloze. Chraňte před mrazem. Jestliže dojde ke zmrznutí nosního spreje Instanyl, pumpička může prasknout. Jestliže není jisté, jak byla pumpička uchovávána, je nutné správnou funkci pumpičky zkontrolovat před použitím.
Instanyl, který má uplynulou dobu použitelnosti nebo který již není dále potřebný, může stále obsahovat léčivo, které je škodlivé pro ostatní, zvláště pro děti. Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Všechen použitý i nepoužitý nosní sprej musí být zlikvidován v souladu s místními požadavky nebo vrácen do lékárny v pouzdře s dětským bezpečnostním uzávěrem. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co Instanyl nosní sprej, roztok obsahuje
Léčivou látkou je fentanylum
50 mikrogramů/v jedné dávce: Jeden ml roztoku obsahuje fentanyli citras, odpovídá fentanylum 500 mikrogramů. Jedna dávka/vstřik (100 mikrolitrů) obsahuje fentanylum 50 mikrogramů 100 mikrogramů/v jedné dávce: Jeden ml roztoku obsahuje fentanyli citras, odpovídá. fentanylum
1 000 mikrogramů. Jedna dávka/vstřik (100 mikrolitrů) obsahuje fentanylum 100 mikrogramů 200 mikrogramů/v jedné dávce: Jeden ml roztoku obsahuje fentanyli citras, odpovídá fentanylum
2 000 mikrogramů. Jedna dávka/vstřik (100 mikrolitrů) obsahuje fentanylum 200 mikrogramů
Pomocnými látkami jsou: Dihydrát dihydrogenfosforečnanu sodného, dihydrát hydrogenfosforečnanu sodného, čištěná voda.
Jak Instanyl vypadá a co obsahuje toto balení
Instanyl je nosní sprej, roztok. Roztok je čirý, bezbarvý. Je plněn do lahvičky z hnědého skla s dávkovací pumpičkou.
Nosní sprej je dodáván v pouzdře s dětským bezpečnostním uzávěrem ve třech rozdílných velikostech balení: 1,8 ml (odpovídá 10 dávkám), 2,9 ml (odpovídá 20 dávkám), 5,0 ml (odpovídá 40 dávkám). Na trhu nemusí být všechny velikosti balení.
Barevné označení na obalu je odlišné pro každou sílu přípravku Instanyl:
50 mikrogramů/v jedné dávce: oranžové
100 mikrogramů/v jedné dávce: fialové
200 mikrogramů/v jedné dávce: zelenkavo-modré
Držitel rozhodnutí o registraci a výrobce
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
Výrobce
Takeda Nycomed AS Solbaervegen 5 N-2409 Elverum Norsko
Takeda GmbH Robert-Bosch-Strasse 8 D - 78224 Singen Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien/Luxembourg/ Lietuva
Luxemburg Takeda, UAB
Takeda Belgium Tel.: +370 521 09 070
Tel./Tél.: +32 2 464 06 11 takeda-belgium@takeda.com
Btarapna
Magyarország
Takeda Pharma Kft. Tel.: +361 2707030
TaKega EtnrapHa Ten.: + 359 2 958 27 36
|
Česká republika Takeda Pharmaceuticals Czech Republic s.r.o. Tel.: + 420 234 722 722 |
Malta / Kúnpoq Takeda Pharma A/S Tel./ TqA.: +45 46 77 11 11 |
|
Danmark Takeda Pharma A/S Tlf./TeL: +45 46 77 11 11 |
Nederland Takeda Nederland bv Tel.: +31 23 56 68 777 |
|
Deutschland Takeda GmbH Tel.: +49 (0) 800 825 3325 |
Norge Takeda Nycomed AS Tlf.: +47 6676 3030 infonorge@takeda.com |
|
Eesti Takeda Pharma AS Tel.: +372 6177 669 info@takeda.ee |
Osterreich Takeda Pharma Ges.m.b.H. Tel.: +43 (0) 800 20 80 50 |
|
EXláSa TAKEDA EAAAI A.E. TqA.: +30 210 6387800 gr.info@takeda.com |
Polska Takeda Polska Sp. z o.o. Tel.: +48 22 608 13 00 |
|
Espaňa Takeda Farmacéutica Espana S.A. Tel.: +34 917 14 99 00 spain@takeda.com |
Portugal Takeda Farmaceuticos Portugal, Lda. Tel.: + 351 21 120 1457 |
|
France Takeda France S.A.S Tel.: +33 1 46 25 16 16 |
Románia Takeda Pharmaceuticals SRL Tel.: +40 21 335 03 91 |
|
Hrvatska Takeda Pharmaceuticals Croatia d.o.o Tel: +385 1 377 88 96 |
Slovenija Takeda GmbH Podružnica Slovenija Tel.: +386 (0) 59 082 480 |
|
Ireland Takeda Products Ireland Ltd. Tel.: +353 (0) 1 6420021 |
Slovenská republika Takeda Pharmaceuticals Slovakia s.r.o Tel.: +421 (2) 20 602 600 |
|
Ísland Vistor hf. Tel.: +354 535 7000 vistor@vistor.is |
Suomi/Finland Takeda Oy Puh./Tel.: +358 20 746 5000 infoposti@takeda.com |
|
Italia Grunenthal Italia S.r.l. Tel.: +39 02 4305 1 |
Sverige Takeda Pharma AB Tel.: +46 8 731 28 00 infosweden@takeda.com |
United Kingdom
Latvija
Takeda Latvia SIA Tel.: +371 67840082
Takeda UK Ltd
Tel.: +44 (0)1628 537 900
Tato příbalová informace byla naposledy revidována {MM.RRRR}
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury http://www.ema.europa.eu.
NÁVOD K POUŽITÍ NOSNÍHO SPREJE INSTANYL
Přečtěte si prosím pečlivě následující pokyny, ve kterých je uvedeno, jak se Instanyl nosní sprej používá.
- Před prvním použitím přípravku: Je třeba 3až 4 krát stisknout pumpičku nosního spreje do okamžiku, kdy se objeví jemný aerosol. Je důležité vyhnout se při této činnosti nasměrování aerosolu k ostatním lidem v okolí.
V případě, že není přípravek používán více než 7 dní, je třeba před dalším použitím jedenkrát stříknout naprázdno do vzduchu.
- Během procesu přípravy se trocha přípravku vystříkne do vzduchu. Proto dbejte na následující:
- Přípravu k použití j e třeba provádět v dobře větraném prostoru.
- Nemiřte nosním sprejem na sebe ani na jiné osoby.
- Nemiřte na povrchy a předměty, se kterými by mohly přijít do kontaktu další osoby, zejména děti. Instanyl má být používán následovně:
- Vyčistěte si nos, pokud máte pocit ucpání nebo máte rýmu.
- Při použití přípravku musíte sedět nebo stát ve vzpřímené pozici.
- Sejměte ochranný kryt z nosního spreje.
- Držte sprej ve svislé poloze.
- Lehce předsuňte hlavu dopředu.
- Uzavřete tlakem prstu ze strany jeden nosní otvor a zasuňte konec spreje přímo do druhého nosního otvoru (do hloubky zhruba 1 cm). Nezáleží na tom, který nosní otvor zvolíte. Pokud si musíte vzít druhou dávku po 10 minutách, abyste dosáhli dostatečné úlevy od bolesti, tato druhá dávka by měla být podána do druhého nosního otvoru.
- Zmáčkněte jedenkrát rychle pumpičku a současně se nadechujte nosem. Je možné, že dávku v nose nebudete cítit, ale píst stlačený nahoru je znakem toho, že j ste dávku dostali.
- Vždy po použití uložte Instanyl do pouzdra s dětským bezpečnostním uzávěrem.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Instanyl 50 mikrogramů, nosní sprej, roztok v jednodávkovém obalu Instanyl 100 mikrogramů, nosní sprej, roztok v jednodávkovém obalu Instanyl 200 mikrogramů, nosní sprej, roztok v jednodávkovém obalu
Fentanylum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán pouze Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, nebo zdravotní sestře nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Instanyl a k čemu se užívá
2. Čemu musíte věnovat pozornost, než začnete Instanyl užívat
3. Jak se Instanyl užívá
4. Možné nežádoucí účinky
5 Jak Instanyl uchovávat
6. Obsah balení a další informace
1. Co je Instanyl a k čemu se používá
Instanyl obsahuje léčivou látku fentanyl a patří do skupiny silných léků proti bolesti, které se nazývají opioidy. Opioidy zabraňují přenosu bolestivých pocitů do centrálního nervového systému.
Instanyl účinkuje velmi rychle a je používán k úlevě od průlomové bolesti u dospělých pacientů trpících nádorovým onemocněním, kteří již užívají opioidy k léčbě chronické bolesti. Průlomová bolest je náhle vzniklá bolest, která se může vyskytnout, i přestože užíváte předepsané opioidy proti bolesti.
2. Čemu musíte věnovat pozornost, než začnete Instanyl užívat
Neužívejte Instanyl,
- jestliže jste alergický(á) (přecitlivělý(á)) na fentanyl nebo na kteroukoli další složku přípravku Instanyl (uvedenou v bodě 6).
- jestliže pravidelně neužíváte předepsané opioidní léčivo (např. kodein, fentanyl, hydromorfon, morfin, oxykodon, petidin) určené ke zvládnutí přetrvávající bolesti a to každý den podle pravidelného rozvrhu po dobu nejméně jednoho týdne. Jestliže tato léčiva neužíváte, nesmíte přípravek Instanyl užívat, protože může zvýšit riziko, že se vám dýchání nebezpečně zpomalí a/nebo bude mělké či dokonce přestanete dýchat.
- jestliže trpíte krátkodobou bolestí jinou než průlomovou.
- jestliže trpíte vážnými dýchacími obtížemi nebo trpíte vážným obstrukčním plicním onemocněním.
- jestliže jste dříve prodělal(a) radioterapii obličeje.
- jestliže trpíte opakovaným krvácením z nosu.
Upozornění a opatření
Před použitím přípravku Instanyl se poraďte se svým lékařem, zvláště
- jestliže trpíte dlouhodobě vážným obstrukčním plicním onemocněním, vaše dýchání se může zhoršit po použití přípravku Instanyl.
- jestliže máte problémy se srdcem, zvláště pomalý tep srdce, nízký krevní tlak nízký objem krve.
- jestliže máte problémy s játry nebo ledvinami.
- jestliže máte problém s funkcí mozku například z důvodu nádoru mozku, z důvodu poranění hlavy nebo zvýšený nitrolební tlak.
- jestliže užíváte antidepresiva nebo antipsychotika, přečtěte si prosím část Další léčivé přípravky a Instanyl.
- jestliže užíváte jiný nosní sprej například při běžné rýmě nebo při alergii.
Jestliže pocítíte zhoršené dýchání po použití přípravku Instanyl, je velmi důležité, abyste neprodleně vyhledal(a) lékaře nebo se dostavil(a) do nemocnice.
Jestliže trpíte opakovaným krvácením z nosu nebo nepříjemnými pocity v nose po použití přípravku Instanyl, musíte tuto skutečnost oznámit lékaři, který vám navrhne jiný způsob léčby průlomové bolesti.
Jestliže se domníváte, že se u vás projevuje závislost na Instanyl, je velmi důležité, abyste o této skutečnosti informoval(a) svého lékaře.
Děti a dospívající
Instanyl by neměl být používán u dětí a dospívajících do 18 let .
Další léčivé přípravky a Instanyl
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, nebo které možná budete užívat, a to i o lécích, které jsou dostupné bez lékařského předpisu.
Instanyl může mít vliv na účinek jiných léčivých přípravků nebo jeho účinek může být ovlivněn užíváním jiných léčivých přípravků.
Zvláštní opatrnost se doporučuje při užívání následujících léků:
- všechny léky, které normálně navozují zklidnění a spánek (mají sedativní účinky), jako jsou léky na spaní, léky proti pocitu úzkosti (anxiolytika), léky proti alergii (antihistaminika) a léky na zklidnění (trankvilizéry).
- Všechny léky, které mohou ovlivnit způsob metabolizmu pro Instanyl v organizmu, jako například
• ritonavir, nelfinavir, amprenavir a fosamprenavir (léky k léčbě HIV infekce);
• inhibitory CYP3A4, jako jsou ketokonazol, itrakonazol, a flukonazol (léky k léčbě plísňových infekcí);
• troleandomycin, klaritromycin, nebo erytromycin (léky k léčbě bakteriálních infekcí);
• aprepitant (k léčbě těžké nevolnosti);
• diltiazem a verapamil (léky k léčbě vysokého krevního tlaku a srdečního onemocnění).
- Léčivé přípravky nazývané inhibitory monoaminooxidázy (IMAO), které se používají k léčbě závažných depresivních stavů, pokud jste je užíval(a) v posledních dvou týdnech.
- Riziko nežádoucích účinků se zvyšuj e, pokud užíváte léky, j ako j sou některá antidepresiva nebo antipsychotika. Přípravek Instanyl může vzájemně reagovat s těmito léky a můžete u vás dojít ke změně duševního stavu (např. neklid, halucinace, koma) a k jiným účinkům, jako je zvýšení tělesné teploty nad 38 °C, zrychlený srdeční puls, nestabilní krevní tlak a zvýraznění reflexů, ztuhlost svalů, nedostatečná koordinace a/nebo příznaky v trávicím traktu (např. nevolnost, zvracení, průjem). Váš lékař vám sdělí, zda je pro vás přípravek Instanyl vhodný.
- Léky nazývané parciální opioidní agonisté/antagonisté např. buprenorfin, nalbufin a pentazocin (léky k léčbě bolesti). Mohl(a) byste mít příznaky syndromu z vysazení (nevolnost, zvracení, průjem, úzkost, zimnice, třes a pocení).
- Všechny léky, které se aplikují do nosu, zvláště oxymetazolin, xylometazolin a podobné léky, které se používají k úlevě od ucpaného nosu.
Užívání přípravku Instanyl s jídlem, pitím, nebo s alkoholem
Při užívání přípravku Instanyl se vyvarujte pití alkoholu, protože může zvýšit riziko výskytu nebezpečných nežádoucích účinků.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat. Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoli lék.
Instanyl nesmí být používán v průběhu těhotenství, pokud lékař nerozhodne jinak.
Instanyl nesmí být používán v průběhu porodu, protože fentanyl může způsobit vážné dýchací obtíže u novorozence.
Fentanyl přechází do mateřského mléka a může vyvolávat nežádoucí účinky u kojeného dítěte. Neužívejte Instanyl, jestliže kojíte. Kojení byste neměla začít po dobu nejméně 5 dní po poslední dávce Instanylu.
Řízení dopravních prostředků a obsluha strojů
Neřiďte dopravní prostředek a neobsluhujte žádné stroje v průběhu léčby přípravkem Instanyl. Instanyl může způsobit závrať a ospalost, které by mohly ovlivnit vaši schopnost řídit a obsluhovat stroje.
3. Jak se Instanyl užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Dávka přípravku Instanyl je nezávislá na vaší zavedené léčbě chronické bolesti.
Pokud používáte Instanyl poprvé, lékař bude s vámi spolupracovat na stanovení dávky přípravku, která vám přinese úlevu od průlomové bolesti.
Počáteční dávkou by měla být jedna dávka 50 mikrogramů do jednoho nosního průduchu vždy, když budete mít epizodu průlomové bolesti. V průběhu stanovení dostatečné dávky vám váš lékař může doporučit použití vyšší dávky.
Jestliže není dosaženo dostatečné úlevy od průlomové bolesti po 10 minutách po první dávce, stejná dávka může být aplikována do druhého nosního průduchu.
Pro další použití přípravku pro léčbu epizody průlomové bolesti je nutné vyčkat čtyři hodiny. Instanyl můžete použít pro léčbu maximálně čtyř epizod průlomové bolesti denně.
Jestliže máte více než čtyři epizody průlomové bolesti denně, informujte svého lékaře, který může vaši obvyklou léčbu bolesti pozměnit.
Neměňte svévolně dávku přípravku Instanyl ani předepsanou léčbu bolesti. Změna léčby či dávky přípravku Instanyl musí být nastavena ve spolupráci s lékařem.
Instanyl je určen pro nosní podání.
Přečtěte si prosím návod k použití na konci této příbalové informace, kde se dozvíte, jak používat přípravek Instanyl.
Jestliže jste užil(a) více přípravku Instanyl, než jste měl(a), nebo pokud si myslíte, že někdo užil přípravek Instanyl náhodně
Jestliže jste užil(a) více přípravku Instanyl, než jste měl(a), je velmi důležité, abyste neprodleně vyhledal(a) lékaře nebo se dostavil(a) do nemocnice nebo na oddělení akutního příjmu ke zhodnocení rizika a pro instrukce, jak dále postupovat.
Příznaky předávkování jsou:
Spavost, netečnost, závratě, snížení tělesné teploty, pomalý srdeční tep, obtíže při koordinaci pohybů rukou a nohou.
Ve velmi závažných případech předávkování přípravkem Instanyl může nastat bezvědomí, netečnost, křeče a závažné dechové obtíže (velmi pomalé a mělké dýchání).
Jestliže se u vás objeví výše popsané příznaky,vyhledejte neprodleně lékařskou pomoc.
Informace pro ošetřovatelský personál
Jestliže zpozorujete u osoby, která užívá Instanyl, náhlé zpomalení životního rytmu, obtíže s dýcháním nebo máte obtíže s navázáním kontaktu:
- Musíte neodkladně volat záchrannou službu.
- Musíte se snažit do doby příjezdu záchranné služby udržet postiženou osobu při vědomí, mluvte s ní nebo s ní šetrně znovu a znovu potřásejte.
- Pokud se u postižené osoby projeví obtíže s dýcháním, každých 5-10 vteřin musíte vyzvat postiženou osobu k hlubokému nádechu.
- Pokud postižená osoba přestane dýchat, musíte zahájit resuscitaci a pokračovat v ní do příjezdu záchranné služby.
Jestliže se domníváte, že kdokoli náhodně užil Instanyl, vyhledejte neprodleně lékařskou pomoc. Snažte se udržet postiženou osobu při vědomí do příchodu odborné pomoci.
Jestliže někdo náhodně užije Instanyl, mohou se u něj projevit podobné příznaky, jako jsou popsány výše při předávkování.
Jestliže jste zapomněl(a) užít Instanyl
Jestliže stále přicházejí záchvaty průlomové bolesti, užijte Instanyl dle doporučení lékaře.
Pokud již záchvaty průlomové bolesti ustaly, nepoužívejte Instanyl dříve než při dalším záchvatu průlomové bolesti.
Jestliže jste přestal(a) užívat Instanyl
Neužívejte Instanyl, jestliže již nenastupují záchvaty průlomové bolesti. Pokračujte ale v zavedené léčbě chronické bolesti při nádorovém onemocnění. Pokud si nejste jistý(á), zeptejte se svého lékaře, zda užíváte správné dávkování svých léků.
Jestliže přestanete užívat Instanyl, mohou se u vás projevit abstinenční příznaky (příznaky z odebrání léku) podobné nežádoucím účinkům popsaným pro Instanyl. Pokud pozorujete takové příznaky, kontaktujte svého lékaře. Lékař musí rozhodnout, zda je potřeba léčba ke zmírnění nebo odstranění abstinenčních příznaků.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Většina z nich obvykle ustane nebo se zmírní při kontinuálním používání přípravku.
Přerušte léčbu a kontaktujte ihned svého lékaře pohotovost nemocnici, nebo pohotovost jestliže:
- máte vážné dýchací obtíže
- chroptíte při dýchání
- máte záchvatovitou bolest
- máte výraznou závrať
Tyto nežádoucí účinky mohou být velmi závažné.
zhodnocení četnosti výskytu nežádoucích účinků byly použity následující kategorie: velmi časté (1>/10); časté (>1/100 až <1/10); méně časté (> 1/1000 až <1/100); vzácné (>1/10000 až <1/1000) a velmi vzácné (<1/10,000), není známo (z dostupných údajů nelze určit).
Další nežádoucí účinky hlášené po podání přípravku Instanyl:
Časté nežádoucí účinky: (vyskytují se u více než 1 z 10 pacientů) ospalost, závratě až obtíže s udržením rovnováhy, bolest hlavy, podráždění v hrdle, nevolnost, zvracení, zčervenání, návaly horka, silné pocení.
Méně časté nežádoucí účinky: (vyskytují se až u 1 z 100 pacientů) léková závislost, spavost, netečnost, křečovité stahy svalů, abnormální kožní citlivost často nepříjemná, změny chuti, dávivé pohyby, nízký krevní tlak, závažné problémy s dýcháním, krvácení z nosu, vřed v nose, výtok z nosu, zácpa, zánět ústní sliznice, sucho v ústech, bolest kůže, svědění kůže, horečka.
Četnost není známa: (četnost nelze z dostupných údajů určit)
Pád, průjem, křeče (záchvaty), otok paží nebo nohou, vidění a slyšení věcí a zvuků, které ve skutečnosti neexistují (halucinace), únava, malátnost, syndrom z vysazení (může se projevit výskytem následujících nežádoucích účinků: nevolnost, zvracení, průjem, úzkost, zimnice, třes a pocení).
Byly taktéž hlášeny případy, kdy u pacientů došlo k proděravění nosní přepážky - struktury, která odděluje nosní dírky.
Informujte svého lékaře, jestliže pozorujete opakovaně krvácení z nosu nebo nepříjemné pocity v nose.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak jednodávkové balení Instanyl uchovávat
Léčivá látka proti bolesti v přípravku Instanyl je velmi silná a může způsobit ohrožení života u dětí.
Instanyl musí být uchováván mimo dohled a dosah dětí. Vždy ukládejte nosní sprej do pouzdra odolného proti nežádoucímu vniknutí dětí.
Přípravek Instanyl nepoužívejte po uplynutí doby použitelnosti uvedené na krabičce a jednodávkovém obalu za textem Použitelné do:. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Uchovávejte při teplotě do 30 °C. Uchovávejte blistr v krabičce. Uchovávejte ve svislé poloze.
Instanyl, který má uplynulou dobu použitelnosti nebo který již není dále potřebný, může stále obsahovat léčivo, které je škodlivé pro ostatní, zvláště pro děti. Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Všechna nepoužitá jednodávková balení musí být vždy znovu uložena v blistru s dětským bezpečnostním uzávěrem odolném proti nežádoucímu vniknutí dětí a zlikvidována v souladu s místními požadavky, nebo vrácena do lékárny.
Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co Instanyl nosní sprej, roztok obsahuje
Léčivou látkou je fentanylum. Obsah je:
50 mikrogramů: 1 dávka (100 mikrolitrů) obsahuje fentanyli citras, odpovídá fentanylum 50 mikrogramů.
100 mikrogramů: 1 dávka (100 mikrolitrů) obsahuje fentanyli citras, odpovídá fentanylum 100 mikrogramů.
200 mikrogramů: 1 dávka (100 mikrolitrů) obsahuje fentanyli citras, odpovídá fentanylum 200 mikrogramů.
Pomocnými látkami jsou dihydrát dihydrogenfosforečnanu sodného, dihydrát hydrogenfosforečnanu sodného, čištěná voda.
Jak Instanyl vypadá a co obsahuje toto jednodávkové balení
Instanyl je nosní sprej, roztok v jednodávkovém obalu. Roztok je čirý a bezbarvý.
Jedno jednodávkové balení obsahuje 1 dávku přípravku Instanyl a je dodáváno v blistru odolném proti nežádoucímu vniknutí dětí. Instanyl je na trh dodáván v rozdílných velikostech 2, 6, 8 a 10 jednodávkových balení.
Na trhu nemusí být všechny velikosti balení.
Barevné označení na obalu je odlišné pro každou sílu přípravku Instanyl:
50 mikrogramů je oranžové.
100 mikrogramů je fialové.
200 mikrogramů je zelenkavo-modré.
Držitel rozhodnutí o registraci
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
Výrobce
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
Takeda Nycomed AS Solbaervegen 5 N-2409 Elverum Norsko
Takeda GmbH Robert-Bosch-Strasse 8 D - 78224 Singen Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien/Luxembourg/ Luxemburg Takeda Belgium Tel./Tél.: +32 2 464 06 11 takeda-belgium@takeda.com |
Lietuva Takeda, UAB Tel.: +370 521 09 070 |
|
BtnrapHH TaKega Etnrapna Ten.: + 359 2 958 27 36 |
Magyarország Takeda Pharma Kft. Tel.: +361 2707030 |
|
Česká republika Takeda Pharmaceuticals Czech Republic s.r.o. Tel.: + 420 234 722 722 |
Malta / Kúnpoq Takeda Pharma A/S Tel./ Tnk.: +45 46 77 11 11 |
|
Danmark Takeda Pharma A/S Tlf./TeL: +45 46 77 11 11 |
Nederland Takeda Nederland bv Tel.: +31 23 56 68 777 |
|
Deutschland Takeda GmbH Tel.: +49 (0) 800 825 3325 |
Norge Takeda Nycomed AS Tlf.: +47 6676 3030 infonorge@takeda.com |
|
Eesti Takeda Pharma AS Tel.: +372 6177 669 info@takeda.ee |
Osterreich Takeda Pharma Ges.m.b.H. Tel.: +43 (0) 800 20 80 50 |
|
ElláSa TAKEDA EAAAI A.E. Tnk.: +30 210 6387800 gr.info@takeda.com |
Polska Takeda Polska Sp. z o.o. Tel.: +48 22 608 13 00 |
|
Espaňa Takeda Farmacéutica Espana S.A. Tel.: +34 917 14 99 00 spain@takeda.com |
Portugal Takeda Farmaceuticos Portugal, Lda. Tel.: + 351 21 120 1457 |
|
France Takeda France S.A.S Tel.: + 33 1 46 25 16 16 |
Románia Takeda Pharmaceuticals SRL Tel.: +40 21 335 03 91 |
|
Hrvatska Takeda Pharmaceuticals Croatia d.o.o Tel: +385 1 377 88 96 |
Slovenija Takeda GmbH Podružnica Slovenija Tel.: +386 (0) 59 082 480 |
|
Ireland Takeda Products Ireland Ltd. Tel.: +353 (0) 1 6420021 |
Slovenská republika Takeda Pharmaceuticals Slovakia s.r.o Tel.: +421 (2) 20 602 600 |
Suomi/Finland
Takeda Oy
Puh./Tel.: +358 20 746 5000 infoposti@takeda.com
Italia
Grunenthal Italia S.r.l. Tel.: +39 02 4305 1
Sverige
Takeda Pharma AB Tel.: +46 8 731 28 00 infosweden@takeda.com
Latvija
Takeda Latvia SIA Tel.: +371 67840082
United Kingdom
Takeda UK Ltd
Tel.: +44 (0)1628 537 900
Tato příbalová informace byla naposledy revidována {MM.RRRR}
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury: http://www.ema.europa.eu
NÁVOD K POUŽITÍ PŘÍPRAVKU INSTANYL JEDNODÁVKOVÝ NOSNÍ SPREJ
Přečtěte si prosím pečlivě následující pokyny, ve kterých je uvedeno, jak se Instanyl jednodávkový nosní sprej používá.
• Každé jednodávkové balení je zataveno v blistru s dětským bezpečnostním uzávěrem. Neotevírejte blistr dříve, než jste připraveni sprej použít. Jedno jednodávkové balení obsahuje pouze jednu dávku přípravku Instanyl. Sprej nesmí být zkoušen před použitím.
• K otevření přestřihněte nůžkami blistr podél linie (nad symbolem nůžek). Uchopte okraj fólie, odlepte ji a vyjměte nosní sprej.
• Vyčistěte si nos, pokud máte pocit ucpání nosu nebo máte rýmu.
• Jemně uchopte jednodávkový obal tak, že palcem podpíráte píst ve spodní části spreje a ukazováček a prostředníček máte položeny po obou stranách vrchní části spreje (viz obrázek). Ještě píst nestlačujte.

• Uzavřete tlakem ukazováčku druhé ruky ze strany jeden nosní otvor a zasuňte konec spreje přímo do druhého nosního otvoru (do hloubky zhruba 1 cm). Nezáleží na tom, který nosní otvor zvolíte. Pokud si musíte vzít druhou dávku po 10 minutách, abyste dosáhli dostatečné úlevy od bolesti, tato druhá dávky by měla být podána do druhého nosního otvoru.

• Pro uvolnění dávky pevně stlačte palcem píst směrem nahoru a současně se jemně nadechujte nosem a poté odstraňte nosní sprej z nosu. Je možné, že dávku v nose nebudete cítit, ale píst stlačený nahoru je znakem toho, že jste dávku dostali.
Vaše jednodávkové balení je nyní prázdné.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Instanyl 50 mikrogramů/v jedné dávce, nosní sprej, roztok Instanyl 100 mikrogramů/v jedné dávce, nosní sprej, roztok Instanyl 200 mikrogramů/v jedné dávce, nosní sprej, roztok
Fentanylum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán pouze Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit,
a to i tehdy, má-li stejné známky onemocnění příznaky jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, nebo zdravotní sestře nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Instanyl a k čemu se užívá
2. Čemu musíte věnovat pozornost, než začnete Instanyl užívat
3. Jak se Instanyl užívá
4. Možné nežádoucí účinky
5 Jak Instanyl uchovávat
6. Obsah balení a další informace
1. Co je Instanyl a k čemu se používá
Instanyl obsahuje léčivou látku fentanyl a patří do skupiny silných léků proti bolesti, které se nazývají opioidy. Opioidy zabraňují přenosu bolestivých pocitů do centrálního nervového systému.
Instanyl účinkuje velmi rychle a je používán k úlevě od průlomové bolesti u dospělých pacientů trpících nádorovým onemocněním, kteří již užívají opioidy k léčbě chronické bolesti. Průlomová bolest je náhle vzniklá bolest, která se může vyskytnout, i přestože užíváte předepsané opioidy proti bolesti.
2. Čemu musíte věnovat pozornost, než začnete Instanyl užívat
Neužívejte Instanyl,
- jestliže jste alergický(á) (přecitlivělý(á)) na fentanyl nebo na kteroukoli další složku přípravku Instanyl (uvedenou v bodě 6)
- jestliže pravidelně neužíváte předepsané opioidní léčivo (např. kodein, fentanyl, hydromorfon, morfin, oxykodon, petidin) určené ke zvládnutí přetrvávající bolesti a to každý den podle pravidelného rozvrhu po dobu nejméně jednoho týdne. Jestliže tato léčiva neužíváte, nesmíte přípravek Instanyl užívat, protože může zvýšit riziko, že se vám dýchání nebezpečně zpomalí a/nebo bude mělké či dokonce přestanete dýchat.
- jestliže trpíte krátkodobou bolestí jinou než průlomovou.
- jestliže trpíte vážnými dýchacími obtížemi nebo trpíte vážným obstrukčním plicním onemocněním.
- jestliže jste dříve prodělal(a) radioterapii obličeje.
- jestliže trpíte opakovaným krvácením z nosu.
Upozornění a opatření
Před použitím přípravku Instanyl se poraďte se svým lékařem, zvláště
- jestliže trpíte dlouhodobě vážným obstrukčním plicním onemocněním, vaše dýchání se může zhoršit po použití přípravku Instanyl.
- jestliže máte problémy se srdcem, zvláště pomalý tep srdce, nízký krevní tlak, nízký objem krve.
- jestliže máte problémy s játry nebo ledvinami.
- jestliže máte problém s funkcí mozku například z důvodu nádoru mozku, z důvodu poranění hlavy nebo zvýšený nitrolební tlak.
- jestliže užíváte antidepresiva nebo antipsychotika, přečtěte si prosím bod Další léčivé přípravky a Instanyl.
- jestliže užíváte jiný nosní sprej například při běžné rýmě nebo při alergii.
Jestliže pocítíte zhoršené dýchání po použití přípravku Instanyl, je velmi důležité, abyste neprodleně vyhledal(a) lékaře nebo se dostavil(a) do nemocnice.
Jestliže trpíte opakovaným krvácením z nosu nebo nepříjemnými pocity v nose po použití přípravku Instanyl, musíte tuto skutečnost oznámit lékaři, který vám navrhne jiný způsob léčby průlomové bolesti.
Jestliže se domníváte, že se u vás projevuje závislost na Instanyl, je velmi důležité abyste o této skutečnosti informoval(a) svého lékaře.
Děti a dospívající
Instanyl by neměl být používán u dětí a dospívajících do 18 let .
Další léčivé přípravky a Instanyl
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, nebo které možná budete užívat a to i o lécích, které jsou dostupné bez lékařského předpisu.
Instanyl může mít vliv na účinek jiných léčivých přípravků nebo jeho účinek může být ovlivněn užíváním jiných léčivých přípravků.
Zvláštní opatrnost se doporučuje při užívání následujících léků:
- Všechny léky, které normálně navozují zklidnění a spánek (mají sedativní účinky), jako jsou léky na spaní, léky proti pocitu úzkosti (anxiolytika), léky proti alergii (antihistaminika) a léky na zklidnění (trankvilizéry).
- Všechny léky, které mohou ovlivnit způsob metabolizmu pro Instanyl v organizmu, jako například
• ritonavir, nelfinavir, amprenavir a fosamprenavir (léky k léčbě HIV infekce);
• inhibitory CYP3A4 j ako j sou ketokonazol, itrakonazol, a flukonazol (léky k léčbě plísňových infekcí);
• troleandomycin, klaritromycin, nebo erytromycin (léky k léčbě bakteriálních infekcí);
• aprepitant (k léčbě těžké nevolnosti);
• diltiazem a verapamil (léky k léčbě vysokého krevního tlaku a srdečního onemocnění).
- Léčivé přípravky nazývané inhibitory monoaminooxidázy (IMAO), které se používají k léčbě závažných depresivních stavů, pokud jste je užíval(a) v posledních dvou týdnech.
- Riziko nežádoucích účinků se zvyšuje, pokud užíváte léky, jako jsou některá antidepresiva nebo antipsychotika. Přípravek Instanyl může vzájemně reagovat s těmito léky a může u vás dojít ke změně duševního stavu (např. neklid, halucinace, koma) a k dalším účinkům, jako je zvýšení tělesné teploty nad 38 °C, zrychlený srdeční puls, nestabilní krevní tlak a zvýraznění reflexů, ztuhlost svalů, nedostatečná koordinace a/nebo příznaky v trávicím traktu (např. nevolnost, zvracení, průjem). Váš lékař vám řekne, zda je pro vás přípravek Instanyl vhodný.
- Léky nazývané parciální opioidní agonisté/antagonisté např. buprenorfin, nalbufin a pentazocin (léky k léčbě bolesti). Mohl(a) byste mít příznaky syndromu z vysazení (nevolnost, zvracení, průjem, úzkost, zimnice, třes a pocení).
- Všechny léky, které se aplikují do nosu, zvláště oxymetazolin, xylometazolin a podobné léky, které se používají k úlevě od ucpaného nosu.
Užívání přípravku Instanyl s jídlem, pitím, nebo s alkoholem
Při užívání přípravku Instanyl se vyvarujte pití alkoholu, protože může zvýšit riziko výskytu nebezpečných nežádoucích účinků.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat. Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
Instanyl nesmí být používán v průběhu těhotenství, pokud lékař nerozhodne jinak.
Instanyl nesmí být používán v průběhu porodu, protože fentanyl může způsobit vážné dýchací obtíže u novorozence.
Fentanyl přechází do mateřského mléka a může vyvolávat nežádoucí účinky u kojeného dítěte. Neužívejte Instanyl, jestliže kojíte. Kojení byste neměla začít po dobu nejméně 5 dní po poslední dávce Instanylu.
Řízení dopravních prostředků a obsluha strojů
Neřiďte dopravní prostředek a neobsluhujte žádné stroje v průběhu léčby přípravkem Instanyl.
Instanyl může způsobit závrať a ospalost, které by mohly ovlivnit vaši schopnost řídit a obsluhovat stroje.
3. Jak se Instanyl užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á) poraďte se se svým lékařem nebo lékárníkem.
Dávka přípravku Instanyl je nezávislá na vaší zavedené léčbě chronické bolesti.
Pokud používáte Instanyl poprvé, lékař bude s vámi spolupracovat na stanovení dávky přípravku, která vám přinese úlevu od průlomové bolesti.
Počáteční dávkou by měla být jedna dávka 50 mikrogramů do jednoho nosního průduchu vždy, když budete mít epizodu průlomové bolesti. V průběhu stanovení dostatečné dávky vám váš lékař může doporučit použití vyšší dávky.
Jestliže není dosaženo dostatečné úlevy od průlomové bolesti po 10 minutách po první dávce, stejná dávka může být aplikována do druhého nosního průduchu.
Pro další použití přípravku pro léčbu epizody průlomové bolesti je nutné vyčkat čtyři hodiny.
Instanyl můžete použít pro léčbu maximálně čtyř epizod průlomové bolesti denně.
Jestliže máte více než čtyři epizody průlomové bolesti denně, informujte svého lékaře, který může vaši obvyklou léčbu bolesti pozměnit.
Neměňte svévolně dávku přípravku Instanyl ani předepsanou léčbu bolesti. Změna léčby či dávky přípravku Instanyl musí být nastavena ve spolupráci s lékařem.
Součástí Instanylu je elektronické počitadlo dávek a systém uzamčení nosního spreje na určitou dobu mezi dávkami, které snižují riziko předávkování a pomáhají vám přípravek používat správně.
Počitadlo dávek umožňuje vám i vašemu lékaři sledování a úpravu vašeho užívání. Poté, co byly během 60 minut užity dvě dávky, Instanyl se uzamkne na 2 hodiny od užití první dávky do doby, než bude možné užít dávku další.
Instanyl je určen pro nosní podání.
Přečtěte si prosím návod k použití na konci této příbalové informace, kde se dozvíte, jak používat nosní sprej.
Jestliže jste užil(a) více přípravku Instanyl, než jste měl(a) nebo pokud si myslíte, že někdo užil přípravek Instanyl náhodně
Jestliže jste užil(a) více přípravku Instanyl, než jste měl(a), je velmi důležité, abyste neprodleně vyhledal(a) lékaře nebo se dostavil(a) do nemocnice nebo na oddělení akutního příjmu ke zhodnocení rizika a pro instrukce jak dále postupovat.
Příznaky předávkování jsou:
Spavost, netečnost, závratě, snížení tělesné teploty, pomalý srdeční tep, obtíže při koordinaci pohybů rukou a nohou.
Ve velmi závažných případech předávkování přípravkem Instanyl může nastat bezvědomí, netečnost, křeče, a závažné dechové obtíže (velmi pomalé a mělké dýchání).
Jestliže se u vás objeví výše popsané příznaky, vyhledejte neprodleně lékařskou pomoc.
Informace pro ošetřovatelský personál
Jestliže zpozorujete u osoby, která užívá Instanyl, náhlé zpomalení životního rytmu, obtíže s dýcháním nebo máte obtíže s navázáním kontaktu:
- Musíte neodkladně volat záchrannou službu.
- Musíte se snažit do doby příjezdu záchranné služby udržet postiženou osobu při vědomí, mluvte s ní nebo s ní šetrně znovu a znovu potřásejte.
- Pokud se u postižené osoby projeví obtíže s dýcháním, musíte každých 5-10 vteřin vyzvat postiženou osobu k hlubokému nádechu.
- Pokud postižená osoba přestane dýchat, musíte zahájit resuscitaci a pokračovat v ní do příjezdu záchranné služby.
Jestliže se domníváte, že kdokoliv náhodně užil Instanyl, vyhledejte neprodleně lékařskou pomoc. Snažte se udržet postiženou osobu při vědomí do příchodu odborné pomoci.
Jestliže někdo náhodně užije Instanyl, mohou se u něj projevit podobné příznaky, jako jsou popsány výše při předávkování.
Jestliže jste zapomněl(a) užít Instanyl
Jestliže stále přicházejí záchvaty průlomové bolesti, užijte Instanyl dle doporučení lékaře.
Pokud již záchvaty průlomové bolesti ustaly, nepoužívejte Instanyl dříve než při dalším záchvatu průlomové bolesti.
Jestliže jste přestal(a) užívat Instanyl
Neužívejte Instanyl, jestliže již nenastupují záchvaty průlomové bolesti. Pokračujte ale v zavedené léčbě chronické bolesti při nádorovém onemocnění. Pokud si nejste jistý(á), zeptejte se svého lékaře, zda užíváte správné dávkování svých léků.
Jestliže přestanete užívat Instanyl, mohou se u vás projevit abstinenční příznaky (příznaky z odebrání léku) podobné nežádoucím účinkům popsaným pro Instanyl. Pokud pozorujete takové příznaky, kontaktujte svého lékaře. Lékař musí rozhodnout, zda je potřeba léčba ke zmírnění nebo odstranění abstinenčních příznaků.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
Možné nežádoucí účinky
4.
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Většina z nich obvykle ustane nebo se zmírní při kontinuálním používání přípravku.
Přerušte léčbu a kontaktujte ihned svého lékaře, nemocnici nebo pohotovost, jestliže:
* máte vážné dýchací obtíže
* chroptíte při dýchání
* máte záchvatovitou bolest
* máte výraznou závrať
Tyto nežádoucí účinky mohou být velmi závažné.
zhodnocení četnosti výskytu nežádoucích účinků byly použity následující kategorie: velmi časté (1>/10); časté (>1/100 až <1/10); méně časté (> 1/1000 až <1/100); vzácné (>1/10000 až <1/1000) a velmi vzácné (<1/10,000), není známo (z dostupných údajů nelze určit).
Další nežádoucí účinky hlášené po podání přípravku Instanyl:
Časté nežádoucí účinky: (vyskytují se u více než 1 z 10 pacientů ) ospalost, závratě až obtíže s udržením rovnováhy, bolest hlavy, podráždění v hrdle, nevolnost, zvracení, zčervenání, návaly horka, silné pocení.
Méně časté nežádoucí účinky: (vyskytují se až u 1 ze 100 pacientů) léková závislost, spavost, netečnost, křečovité stahy svalů, abnormální kožní citlivost často nepříjemná, změny chuti, dávivé pohyby, nízký krevní tlak, závažné problémy s dýcháním, krvácení z nosu, vřed v nose, výtok z nosu, zácpa, zánět ústní sliznice, sucho v ústech, bolest kůže, svědění kůže, horečka.
Četnost není známa: (četnost nelze z dostupných údajů určit).
Pád, průjem, křeče (záchvaty), otok paží nebo nohou, vidění a slyšení věcí a zvuků, které ve skutečnosti neexistují (halucinace), únava, malátnost, syndrom z vysazení (může se projevit výskytem následujících nežádoucích účinků: nevolnost, zvracení, průjem, úzkost, zimnice, třes a pocení).
Byly taktéž hlášeny případy, kdy u pacientů došlo k proděravění nosní přepážky - struktury, která odděluje nosní dírky.
Informujte svého lékaře, jestliže pozorujete opakovaně krvácení z nosu nebo nepříjemné pocity v nose.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Instanyl uchovávat
Léčivá látka proti bolesti v přípravku Instanyl je velmi silná a může způsobit ohrožení života u dětí. Instanyl musí být uchováván mimo dohled a dosah dětí. Nosní sprej po použití vždy uzavřete dětským bezpečnostním uzávěrem.
Přípravek Instanyl nepoužívejte po uplynutí doby použitelnosti, uvedené na lahvičce za textem Použitelné do:. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte při teplotě do 30 °C. Chraňte před mrazem. Jestliže dojde ke zmrznutí nosního spreje Instanyl, pumpička může prasknout. Jestliže není jisté, jak byla pumpička uchovávána, je nutné správnou funkci pumpičky zkontrolovat před použitím.
Instanyl, který má uplynulou dobu použitelnosti nebo který již není dále potřebný, může stále obsahovat léčivo, které je škodlivé pro ostatní, zvláště pro děti.
X Tento přístroj je označen v souladu se směrnicí EU o odpadních elektrických a elektronických zařízeních (OEEZ). Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Všechen použitý i nepoužitý nosní sprej musí být systematicky zlikvidován v souladu s místními požadavky nebo vrácen do lékárny. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.

6. Obsah balení a další informace
Co Instanyl nosní sprej, roztok obsahuje
Léčivou látkou je fentanylum
50 mikrogramů/v jedné dávce: Jeden ml roztoku obsahuje fentanyli citras, odpovídá fentanylum 500 mikrogramů. Jedna dávka/vstřik (100 mikrolitrů) obsahuje fentanylum 50 mikrogramů 100 mikrogramů/v jedné dávce: Jeden ml roztoku obsahuje fentanyli citras, odpovídá. fentanylum
1 000 mikrogramů. Jedna dávka/vstřik (100 mikrolitrů) obsahuje fentanylum 100 mikrogramů 200 mikrogramů/v jedné dávce: Jeden ml roztoku obsahuje fentanyli citras, odpovídá fentanylum
2 000 mikrogramů. Jedna dávka/vstřik (100 mikrolitrů) obsahuje fentanylum 200 mikrogramů
Pomocnými látkami jsou: Dihydrát dihydrogenfosforečnanu sodného, dihydrát hydrogenfosforečnanu sodného, čištěná voda.
Jak Instanyl vypadá a co obsahuje toto balení
Instanyl DoseGuard je nosní sprej, roztok. Roztok je čirý, bezbarvý. Je dodáván jako nosní sprej s dávkovací pumpičkou, elektronickým displejem, počitadlem dávek, vestavěným uzamykacím mechanismem a s dětským bezpečnostním uzávěrem.
Nosní sprej je dodáván ve čtyřech různých velikostech balení: 2,0 ml (odpovídá 10 dávkám), 3,2 ml (odpovídá 20 dávkám), 4,3 ml (odpovídá 30 dávkám) a 5,3 ml (odpovídá 40 dávkám).
Na trhu nemusí být všechny velikosti balení.
Barevné označení na obalu je odlišné pro každou sílu přípravku Instanyl:
50 mikrogramů/v jedné dávce: oranžové
100 mikrogramů/v jedné dávce: fialové
200 mikrogramů/v jedné dávce: zelenkavo-modré
Držitel rozhodnutí o registraci a výrobce
Takeda Pharma A/S Dybendal Alle 10 DK-2630 Taastrup Dánsko
Výrobce
Takeda GmbH Robert-Bosch-Strasse 8 D - 78224 Singen Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien/Luxembourg/ Luxemburg Takeda Belgium Tel./Tél.: +32 2 464 06 11 takeda-belgium@takeda.com |
Lietuva Takeda, UAB Tel.: +370 521 09 070 |
|
BtnrapHH TaKega Etnrapna Ten.: + 359 2 958 27 36 |
Magyarország Takeda Pharma Kft. Tel.: +361 2707030 |
|
Česká republika Takeda Pharmaceuticals Czech Republic s.r.o. Tel.: + 420 234 722 722 |
Malta / Kúnpoq Takeda Pharma A/S Tel./ Tnk.: +45 46 77 11 11 |
|
Danmark Takeda Pharma A/S Tlf./TeL: +45 46 77 11 11 |
Nederland Takeda Nederland bv Tel.: +31 23 56 68 777 |
|
Deutschland Takeda GmbH Tel.: +49 (0) 800 825 3325 |
Norge Takeda Nycomed AS Tlf.: +47 6676 3030 infonorge@takeda.com |
|
Eesti Takeda Pharma AS Tel.: +372 6177 669 info@takeda.ee |
Osterreich Takeda Pharma Ges.m.b.H. Tel.: +43 (0) 800 20 80 50 |
|
ElláSa TAKEDA EAAAI A.E. Tnk.: +30 210 6387800 gr.info@takeda.com |
Polska Takeda Polska Sp. z o.o. Tel.: +48 22 608 13 00 |
|
Espaňa Takeda Farmacéutica Espana S.A. Tel.: +34 917 14 99 00 spain@takeda.com |
Portugal Takeda Farmaceuticos Portugal, Lda. Tel.: + 351 21 120 1457 |
|
France Takeda France S.A.S Tel.: +33 1 46 25 16 16 |
Románia Takeda Pharmaceuticals SRL Tel.: +40 21 335 03 91 |
|
Hrvatska Takeda Pharmaceuticals Croatia d.o.o Tel: +385 1 377 88 96 |
Slovenija Takeda GmbH Podružnica Slovenija Tel.: +386 (0) 59 082 480 |
|
Ireland Takeda Products Ireland Ltd. Tel.: +353 (0) 1 6420021 |
Slovenská republika Takeda Pharmaceuticals Slovakia s.r.o Tel.: +421 (2) 20 602 600 |
Suomi/Finland
Takeda Oy
Puh./Tel.: +358 20 746 5000 infoposti@takeda.com
Italia
Grunenthal Italia S.r.l. Tel.: +39 02 4305 1
Sverige
Takeda Pharma AB Tel.: +46 8 731 28 00 infosweden@takeda.com
Latvija
Takeda Latvia SIA Tel.: +371 67840082
United Kingdom
Takeda UK Ltd
Tel.: +44 (0)1628 537 900
Tato příbalová informace byla naposledy revidována {MM.RRRR}
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury http://www.ema.europa.eu.
NÁVOD K POUŽITÍ INSTANYLU
Přečtěte si prosím pečlivě následující pokyny, ve kterých je uvedeno, jak se Instanyl nosní sprej používá.
Instanyl nosní sprej obsahuje:
- vestavěný uzamykací mechanismus, který určuje, jak často lze nosní sprej použít
- dětský bezpečnostní uzávěr, který musí být nasazen, když se nosní sprej nepoužívá
- elektronický displej, který
° zobrazuje pokyny o počtu stisků pumpičky, kterými se sprej naplní ° zobrazuje počet zbývajících dávek
° ukazuje, zda je nosní sprej uzamčen, nebo připraven k použití

Jak sejmout a znovu nasadit dětský bezpečnostní uzávěr

Dětský bezpečnostní uzávěr sejmete tak, že zatlačíte na obě strany uzávěru a poté otočíte uzávěrem proti směru hodinových ručiček a zvednete jej.
Dětský bezpečnostní uzávěr opět nasadíte tak, že jej položíte na nosní sprej a otočíte jím ve směru hodinových ručiček.
Po použití nosní sprej vždy uzavřete nasazením dětského bezpečnostního uzávěru.
Příprava Instanylu nosního spreje



Před prvním použitím nosního spreje je třeba 5krát stisknout pumpičku (připravit sprej k použití), aby byla k dispozici plná dávka Instanylu.
Během procesu přípravy se trocha přípravku vystříkne do vzduchu. Proto dbejte na následující:
Přípravu k použití je třeba provádět v dobře větraném prostoru.
Nemiřte nosním sprejem na sebe ani na jiné osoby.
Nemiřte na povrchy a předměty, se kterými by mohly přijít do kontaktu další osoby, zejména děti.
1. Stiskněte bílé tlačítko na straně nosního spreje. Rozsvítí se displej a na něm se zobrazí údaj „P5“.
2. Nosní sprej držte ve svislé poloze a jednou vystříkněte do vzduchu. Nyní se na displeji zobrazí údaj „P4“ a objeví se symbol zámku.
3. Jakmile začne symbol zámku blikat, stiskněte bílé tlačítko na straně a symbol zámku z displeje zmizí.
4. Podržte nosní sprej ve svislé poloze a znovu vystříkněte do vzduchu. Nyní se na displeji zobrazí údaj „P3“ a symbol zámku.
5. Tento postup opakujte s údaji „P2“ a „P1“ (stiskněte bílé tlačítko a pumpičku), až se na displeji zobrazí počet dávek v nosním spreji (tj. 10, 20, 30 nebo 40 dávek) a blikající symbol zámku.
Nosní sprej je nyní připraven k použití.
V závislosti na druhu nosního spreje může být výchozím údajem číslo 10, 20, 30 nebo 40.
Jak se Instanyl nosní sprej používá
Nosní sprej lze použít jen tehdy, když na displeji není zobrazen symbol zámku.

1.
Vysmrkejte se, pokud máte pocit ucpaného nosu nebo máte rýmu.
Seďte nebo stůjte ve vzpřímené poloze.
Nosní sprej držte ve svislé poloze.
Stiskněte bílé tlačítko na straně nosního spreje (blikající symbol zámku zmizí).
Hlavu nakloňte mírně dopředu.
Uzavřete tlakem prstu ze strany jeden nosní otvor a aplikátor spreje zasuňte do druhého nosního otvoru.
Dvěma prsty současně stiskněte jednou pumpičku úplně dolů a přitom se nadechujte nosem.
Po úplném stisknutí pumpičky a vystříknutí dávky nosního spreje uslyšíte „kliknutí“.
Na displeji se zobrazí číslo o jedno nižší a krátce se objeví symbol zámku.
10. Jestliže po 10 minutách potřebujete pro úlevu od bolesti druhou dávku Instanylu, zopakujte kroky 1 až 7 s druhou nosní dírkou.
Nezapomeňte aplikátor nosního spreje po použití očistit čistým papírovým ubrouskem, který pak vyhodíte.
11.
Před stiskem pumpičky nosního spreje nezapomeňte stisknout bílé tlačítko na jeho straně.
Po použití nikdy nezapomeňte nasadit dětský bezpečnostní uzávěr zpět a nosní sprej uzavřít.

Na každou epizodu průlomové bolesti umožňuje nosní sprej aplikaci až dvou dávek přípravku.
Po druhé dávce během 1 hodiny se nosní sprej uzamkne. Na displeji se zobrazí symbol zámku společně se symbolem odpočítávacích hodin, což znázorňuje zbývající dobu uzamčení (každá černá značka odpovídá 10 minutám).
Po uplynutí této doby začne symbol zámku blikat.
Nosní sprej je nyní připraven k použití, pokud nastane další epizoda průlomové bolesti.
Před léčbou další epizody průlomové bolesti byste měli počkat 4 hodiny.
Instanyl můžete použít k léčbě až 4 epizod průlomové bolesti denně. Jestliže máte více než 4 epizody průlomové bolesti denně, informujte svého lékaře, který může vaši obvyklou léčbu bolesti pozměnit.
Jestliže se na displeji zobrazí „0“ a symbol zámku, je nosní sprej prázdný.
Nevyhazujte Instanyl do odpadních vod nebo domácího odpadu. Všechen použitý i nepoužitý nosní sprej musí být systematicky zlikvidován v souladu s místními požadavky nebo vrácen do lékárny. Zeptejte se svého lékárníka.
|
0 1 |
Jestliže jste Instanyl déle než 7 dní nepoužívali, je nutné ho před užitím další dávky znovu připravit k použití jedním vystříknutím. To je signalizováno písmenem „P“ na displeji. Během procesu přípravy se trocha přípravku vystříkne do vzduchu. Proto dbejte na následující: Přípravu k použití je třeba provádět v dobře větraném prostoru. Nemiřte nosním sprejem na sebe ani na jiné osoby. Nemiřte na povrchy a předměty, se kterými by mohly přijít do kontaktu další osoby, zejména děti. Po provedení přípravy se na displeji zobrazí počet zbývajících dávek a nosní sprej je opět připraven k použití. | ||
|
Q c J |
Jestliže se na displeji zobrazí symbol baterie, znamená to, že baterie bude brzy vybitá. Počet dávek na displeji se změní na „5“ To je přibližný počet dávek, které jsou v nosním spreji k dispozici, než bude baterie příliš vybitá a displej zhasne. Jestliže se na displeji zobrazí symbol baterie, doporučujeme, abyste kontaktovali svého lékaře, který vám předepíše nový sprej. |
Symboly na Vysvětlení
elektronickém
displeji

Před použitím nosního spreje je nutno 5krát stisknout pumpičku (připravit nosní sprej k použití) (viz bod „Příprava Instanylu nosního spreje“). Po každém stisku pumpičky displej zobrazí číslo o jedno nižší než předchozí (P5, P4, P3, P2 a P1). Nosní sprej je připraven k použití, když se na displeji zobrazí počet dávek (tj. 10, 20, 30 nebo 40 dávek).
Před přípravou k použití si prosím přečtěte bezpečnostní pokyny uvedené výše.



Nosní sprej se nepoužíval po dobu 7 nebo více dní.
Po opětovné přípravě nosního spreje k použití jedním vystříknutím symbol „P“ z displeje zmizí.
Před přípravou k použití si prosím přečtěte bezpečnostní pokyny uvedené výše
Symbol ZÁMKU
Nosní sprej je uzamčen a nelze jej používat.
Po uplynutí doby uzamčení spreje začne symbol zámku blikat. Po stisku bílého tlačítka na straně nosního spreje symbol z displeje zmizí.
Symbol ODPOČÍTÁVACÍCH HODIN Znázorňuje, kolik času z doby uzamčení ještě zbývá.
Odpočítávací hodiny odpočítávají sestupně. Každá černá značka odpovídá 10 minutám. Maximální doba uzamčení je 2 hodiny.
Symbol ODPOČÍTÁVACÍCH HODIN je zobrazen společně se symbolem ZÁMKU.
Počet dávek, které v nosním spreji zbývají. Po každém užití dávky se na displeji zobrazí číslo o jedno nižší. V závislosti na druhu nosního spreje může být výchozím údajem číslo 10, 20, 30 nebo 40.
Symbol BATERIE
Baterie bude brzy vybitá. Počet dávek na displeji se změní na 5. To je přibližný počet dávek, které jsou v nosním spreji k dispozici, než bude baterie příliš vybitá a displej zhasne. Baterii nelze vyměnit a je třeba si obstarat nový nosní sprej.
Jestliže zjistíte, že nosní sprej nefunguje tak, jak je uvedeno v „Návodu k použití“, obraťte se prosím na svého lékaře nebo lékárníka.
105