Hyqvia 100 Mg/Ml
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
HyQvia 100 mg/ml - infuzní roztok k subkutánnímu podání
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Přípravek HyQvia je jednotka o dvou injekčních lahvičkách tvořená jednou injekční lahvičkou immunoglobulinum humanum normale (imunní globulin 10% nebo IG 10%) a jednou injekční lahvičkou hyaluronidasum humanum biosyntheticum (rHuPH20).
Normální lidský imunoglobulin (SCIg)
Jeden ml obsahuje:
Normální lidský imunoglobulin 100 mg
(o čistotě alespoň 98 % IgG)
Jedna injekční lahvička o objemu 25 ml obsahuje: Jedna injekční lahvička o objemu 50 ml obsahuje: Jedna injekční lahvička o objemu 100 ml obsahuje Jedna injekční lahvička o objemu 200 ml obsahuje Jedna injekční lahvička o objemu 300 ml obsahuje
Rozložení podtříd IgG (přibližné hodnoty):
IgG: > 56,9 %
IgG2 > 26,6 %
IgG3 > 3,4 %
IgG4 > 1,7 %
immunoglobulinum humanum normale 2,5 g immunoglobulinum humanum normale 5 g immunoglobulinum humanum normale 10 g immunoglobulinum humanum normale 20 g immunoglobulinum humanum normale 30 g
Maximální obsah IgA je 140 mikrogramů/ml.
Vytvořeno z plazmy lidských dárců.
Pomocné látky se známým účinkem:
• Rekombinantní lidská hyaluronidáza (rHuPH20)
Rekombinantní lidská hyaluronidáza je purifikovaný glykoprotein o 447 aminokyselinách produkovaný buňkami vaječníku čínského křečíka (CHO) technologií rekombinantní DNA.
• Sodík (jako chlorid a jako fosforečnan).
Celkový obsah sodíku v rekombinantní lidské hyaluronidáze je 4,03 mg/ml.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Infuzní roztok (infuze).
IG 10% je čirý nebo lehce opalizující a bezbarvý či bledě žlutý roztok. Rekombinantní lidská hyaluronidáza je čirý bezbarvý roztok.
KLINICKÉ ÚDAJE
4.
4.1 Terapeutické indikace
Substituční terapie dospělých, dětí a dospívajících (0-18 let) u:
• syndromů primární imunodeficience s narušenou tvorbou protilátek (viz bod 4.4),
• hypogamaglobulinemie a rekurentních bakteriálních infekcí u pacientů s chronickou lymfatickou leukemií (CLL), u nichž selhala profylaktická antibiotika nebo jsou kontraindikována,
• hypogamaglobulinemie a rekurentních bakteriálních infekcí u pacientů s mnohočetným myelomem (MM),
• hypogamaglobulinemie u pacientů před a po alogenní transplantaci hematopoetických kmenových buněk (hematopoietic stem cell transplantation, HSCT).
4.2 Dávkování a způsob podání
Substituční terapie by měla být zahájena a monitorována lékařem zkušeným v léčbě imunodeficience. Dávkování
Dávka a dávkovací režim závisí na indikaci.
Substituční terapie
Léčivý přípravek by se měl podávat subkutánní cestou.
Při substituční terapii je dávka u každého pacienta individuální, závisí totiž na konkrétní farmakokinetice a klinické odpovědi. Následující dávkovací režimy jsou pouze orientační.
Pacienti dosud neléčení imunoglobuliny
Dávka potřebná k dosažení minimální hladiny 6 g/l v rovnovážném stavu je řádově
0,4-0,8g/kg tělesné hmotnosti na měsíc. Dávkovací interval k udržení hladin v rovnovážném stavu se
liší v rozmezí 2-4 týdny.
Minimální hladiny v rovnovážném stavu by měly být měřeny a hodnoceny ve spojení s incidencí infekce. Ke snížení frekvence infekce může být nezbytné zvýšit dávkování a snažit se o vyšší minimální hladiny v rovnovážném stavu (> 6 g/l).
Při zahájení léčby se doporučuje léčebné intervaly prvních infuzí postupně prodlužovat od jedné dávky jednou týdně až po jednu dávku za 3 nebo 4 týdny. Kumulativní měsíční dávka IG 10% by měla být rozdělena do jednotýdenních, dvoutýdenních atd. dávek podle naplánovaných léčebných intervalů přípravkem HyQvia.
Pacienti dříve léčení imunoglobulinem podávaným intravenózně
U pacientů, kteří přecházejí přímo z intravenózního podávání imunoglobulinu nebo kteří dříve dostávali porovnatelnou intravenózní dávku imunoglobulinu, by měl být léčivý přípravek podáván ve stejné dávce a se stejnou četností jako jejich předchozí intravenózní imunoglobulinová léčba.
Pokud byli dříve pacienti na 3týdenním dávkovacím režimu, zvýšení intervalu na 4 týdny lze dosáhnout podáváním stejných týdenních ekvivalentů.
Pacienti dříve léčení subkutánně podávaným imunoglobulinem
U pacientů, jimž je aktuálně podáván imunoglobulin subkutánně, je úvodní dávka přípravku HyQvia stejná jako u subkutánní léčby, lze ji však přizpůsobit 3 - až 4týdennímu intervalu.První infuze přípravku HyQvia měla být podána jeden týden po poslední léčbě předchozím imunoglobulinem.
Pediatrická populace
Dávkování u dětí a dospívajících (0-18 let) se neliší od dávkování u dospělých, neboť dávkování v každé indikaci je dáno tělesnou hmotností a upravuje se podle klinického výsledku výše zmíněného onemocnění. V současnosti dostupné údaje jsou popsány v bodech 4.8, 5.1 a 5.2.
Způsob podání
• Tento přípravek je určen pouze k subkutánnímu podání, nepodávejte ho intravenózně.
• Před podáním zrakem zkontrolujte obě složky přípravku HyQvia, zda u nich nedošlo ke změně zbarvení a neobsahují částice.
• Chlazený přípravek nechte před použitím vytemperovat na pokojovou teplotu. Nepoužívejte zařízení pro ohřev včetně mikrovlnné trouby.
• Neprotřepávejte.
• Tento léčivý přípravek obsahuje dvě injekční lahvičky. Nemíchejte složky tohoto léčivého přípravku.
Každá injekční lahvička IG 10% je dodávána s odpovídajícím množstvím rekombinantní lidské hyaluronidázy, viz informace uvedené v tabulce níže. Obsah injekční lahvičky s rekombinantní lidskou hyaluronidázou by měl být podán celý bez ohledu na to, zda se podává celý obsah injekční lahvičky s IG 10%, či nikoli. Obě složky léčivého přípravku se musí podat jedna po druhé stejnou jehlou počínaje rekombinantní lidskou hyaluronidázou následovanou IG 10%, dle postupu popsaného níže.
|
Aplikační schéma přípravku HyQvia | ||
|
Rekombinantní lidská hyaluronidáza |
Normální lidský imunoglobulin 10% | |
|
Objem (ml) |
Protein (gramů) |
Objem (ml) |
|
1,25 |
2,5 |
25 |
|
2,5 |
5 |
50 |
|
5 |
10 |
100 |
|
10 |
20 |
200 |
|
15 |
30 |
300 |
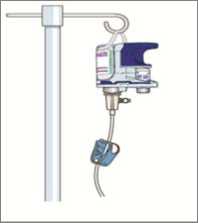
V případě, že je subkutánní infuze přípravku HyQvia zamýšlena pro domácí léčbu, měl by ji zahájit a monitorovat lékař se zkušenostmi s vedením pacientů při domácí léčbě. Pacienta je třeba poučit o infuzních technikách, použití infuzní pumpy nebo injektomatu, o vedení deníku léčby, o rozpoznání možných závažných nežádoucích účinků a o tom, jak postupovat, v případě, že se tyto účinky objeví.
Přípravek HyQvia lze použít k podání plné terapeutické dávky do jednoho nebo dvou míst až každé čtyři týdny. Upravte frekvenci a počet míst aplikace infuze na základě objemu, celkové doby infuze a snášenlivosti tak, aby pacient dostával stejnou týdenní odpovídající dávku. Pokud pacient dávku vynechá, podejte vynechanou dávku co možná nejdříve a poté pokračujte v plánovaných aplikacích.
Obě složky tohoto léčivého přípravku by se měly podávat infuzí různou rychlostí, infuzní pumpou se setem se subkutánní jehlou, která má velikost alespoň 24 gauge, s možností titrovat průtok nahoru a dolů. U injekční lahvičky velikosti 1,25 ml s rekombinantní lidskou hyaluronidázou použijte k natažení obsahu injekční lahvičky jehlu o velikosti 18-22 gauge, abyste zabránili protlačení zátky skrz či odříznutí malé části zátky jehlou (tzv. „coring“). U všech ostatních velikostí injekční lahvičky lze k natažení obsahu lahvičky použít prostředek s jehlou nebo bez jehly.
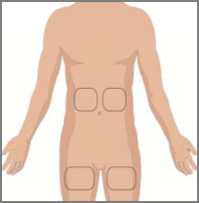
Doporučené místo (místa) aplikace infuze léčivého přípravku jsou střední až horní oblast břicha a stehna. Pokud jsou k aplikaci infuze použita dvě místa, měla by se nacházet na opačných stranách těla. Vyhýbejte se kostním výčnělkům či zjizveným oblastem. Přípravek nesmí být aplikován do místa s infekcí nebo akutním zánětem ani do jeho okolí kvůli nebezpečí rozšíření lokální infekce.
Rekombinantní lidskou hyaluronidázu se doporučuje podávat konstantní rychlostí a rychlost aplikace IG 10% by se neměla zvyšovat nad doporučenou rychlost, především pak ne tehdy, pokud pacienti s léčbou přípravkem HyQvia zrovna začali.
První plná dávka roztoku rekombinantní lidské hyaluronidázy se aplikuje rychlostí 1 až 2 ml za minutu na jedno místo aplikace nebo podle snášenlivosti. Podejte plnou dávku IG 10% pro jedno místo stejným setem se subkutánní jehlou do 10 minut od podání rekombinantní lidské hyaluronidázy.
Doporučují se následující rychlosti infuze IG 10%:
|
Pacienti < 40 kg |
Pacienti > 40 kg | |||
|
Interval/minut |
První dvě infuze (ml/hod) |
Následující 2-3 infuze (ml/hod) |
První dvě infuze (ml/hod) |
Následující 2-3 infuze (ml/hod) |
|
10 minut |
5 |
10 |
10 |
10 |
|
10 minut |
10 |
20 |
30 |
30 |
|
10 minut |
20 |
40 |
60 |
120 |
|
10 minut |
40 |
80 |
120 |
240 |
|
Zbytek infuze |
80 |
160 |
240 |
300 |
Jestliže pacient snáší počáteční infuze v plné dávce na místo aplikace a při maximální rychlosti, může se dle přání lékaře a pacienta zvážit zvýšení rychlosti následných infuzí.
Návod k použití tohoto léčivého přípravku je uveden v bodě 6.6.
4.3 Kontraindikace
Přípravek HyQvia se nesmí podávat intravenózně ani intramuskulárně.
Hypersenzitivita na léčivou látku (IgG) nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 (viz bod 4.4).
Hypersenzitivita na lidské imunoglobuliny, zejména ve velmi vzácných případech deficitu IgA, kdy má pacient proti IgA protilátky.
Známá systémová hypersenzitivita na hyaluronidázu nebo rekombinantní lidskou hyaluronidázu.
4.4 Zvláštní upozornění a opatření pro použití
Pokud je přípravek HyQvia náhodně aplikován do žíly, může u pacienta vyvolat šok.
Používejte doporučené rychlosti infuze uvedené v bodě 4.2. Pacienty je nutné důsledně sledovat v průběhu celé infuze, a to především pacienty začínající s léčbou.
Určité nežádoucí účinky se mohou objevovat častěji u pacientů, kteří dostávají normální lidský imunoglobulin poprvé nebo (ve vzácných případech) jej mění nebo pokud uběhla dlouhá doba od předchozí infuze.
Potenciálním komplikacím je často možné předejít následujícími opatřeními:
• podáváním přípravku zpočátku pomalu (viz bod 4.2).
• zajištěním pečlivého monitorování výskytu jakýchkoli příznaků u pacientů v průběhu celé infuze. Případný výskyt nežádoucích účinků během první infuze a během jedné hodiny po první infuzi je třeba sledovat zvláště u pacientů dosud neléčených normálním lidským imunoglobulinem, pacientů převedených z alternativního přípravku nebo u pacientů, u kterých od předchozí infuze uběhl delší časový úsek.
Všechny ostatní pacienty je nutné sledovat po dobu alespoň 20 minut po podání.
• Pokud je léčba aplikována doma, měl by být k dispozici dohled jiné zodpovědné osoby pro případ, že bude nutné řešit nežádoucí účinky nebo přivolat pomoc, vyskytne-li se závažný nežádoucí účinek. Pacienti, kteří si přípravek aplikují sami doma, a/nebo jejich dohled by měli být rovněž vyškoleni v rozpoznání časných známek reakcí přecitlivělosti.
V případě nežádoucích účinků je nutné buď snížit rychlost podávání infuze, nebo ji úplně zastavit. Potřebná léčba závisí na povaze a závažnosti nežádoucího účinku. V případě šoku okamžitě ukončete infuzi a zahajte u pacienta léčbu šoku.
V klinických studiích nebyly pozorovány žádné chronické změny kůže. Pacientům je však třeba připomenout, aby hlásili jakýkoli chronický zánět, uzlíky nebo zánět, který se objeví v místě infuze a trvá déle než několik dnů.
Hypersenzitivita na IG 10%
Pravé reakce přecitlivělosti jsou vzácné. Může k nim docházet především u pacientů s protilátkami proti IgA,které je třeba léčit se zvláštní opatrností. Pacienti s protilátkami proti IgA, u nichž zůstává léčba subkutánně podávanými přípravky IgG jedinou možností, by měli být léčeni přípravkem HyQvia pouze pod pečlivým lékařským dohledem.
Normální lidský imunoglobulin může vzácně vyvolat pokles krevního tlaku s anafylaktickou reakcí, a to dokonce i u pacientů, kteří předchozí léčbu normálním lidským imunoglobulinem tolerovali.
• Pokud u pacienta hrozí vysoké riziko alergické reakce, přípravek by měl být podáván pouze tehdy, je-li pro případ život ohrožujících reakcí dostupná podpůrná péče.
• Pacienty je nutné informovat o časných známkách anafylaxe/hypersenzitivity (kopřivka, svědění, generalizovaná kopřivka, tíseň na hrudi, sípot a hypotenze).
• V závislosti na závažnosti související reakce a na léčebných postupech je možné tomuto typu reakce předejít premedikací.
• Pokud je známa anafylaktická reakce nebo závažná hypersenzitivita na lidský imunoglobulin, je nutné to uvést do záznamů pacienta.
Hypersenzitivita na rekombinantní lidskou hyaluronidázu
Jakékoli podezření na reakci podobnou alergické nebo anafylaktické reakci po podání rekombinantní lidské hyaluronidázy vyžaduje okamžité přerušení infuze a - podle konkrétní potřeby - zahájení standardního léčebného postupu.
Imunogenicita rekombinantní lidské hyaluronidázy
U pacientů léčených přípravkem HyQvia v klinických studiích byl hlášen vznik jiných než neutralizačních protilátek proti rekombinantní lidské hyaluronidáze. Existuje možnost, že takové protilátky budou zkříženě reagovat s endogenní hyaluronidázou PH20, o níž je známo, že je exprimována ve varlatech, epididymis a spermiích dospělých mužů. Není známo, zda mají tyto protilátky nějaký klinický význam u lidí.
Tromboembolismus
S použitím imunoglobulinů byly spojeny arteriální a venózní tromboembolické příhody, včetně infarktu myokardu, mozkové příhody, hluboké žilní trombózy a plicní embolie. Před použitím imunoglobulinů musí být pacienti dostatečně hydratováni. U pacientů s preexistujícími rizikovými faktory výskytu tromboembolické příhody (charakteristikami pacientů v této skupině může být např. pokročilý věk, hypertenze, diabetes mellitus a anamnéza cévního onemocnění nebo trombotických příhod, získané nebo dědičné trombofilní poruchy, dlouhodobá mobilizace, těžká hypovolemie a onemocnění, která zvyšují viskozitu krve), je třeba postupovat s opatrností.
Sledujte, zda nedochází ke známkám a příznakům trombózy a vyšetřete viskozitu krve u pacientů s rizikem hyperviskozity. K trombóze může dojít i v nepřítomnosti známých rizikových faktorů. Pacienti by měli být poučeni o prvních příznacích tromboembolických příhod, včetně dýchavičnosti, bolesti a otoku končetin, fekálních neurologických deficitů a bolesti na hrudi. Měli by být také instruováni, aby neprodleně po nástupu těchto příznaků kontaktovali svého lékaře.
Hemolytická anémie
Imunoglobulinové přípravky obsahují protilátky proti krevním skupinám (např. A, B, D), které se mohou chovat jako hemolyziny. Tyto protilátky se vážou na erytrocyty (ery) (což lze detekovat jako pozitivitu přímého antiglobulinového testu [PAT (přímý Coombsův test)]) a vzácně mohou způsobit hemolýzu. Příjemci imunoglobulinových přípravků by měli být sledováni, zda se u nich neprojeví klinické známky a příznaky hemolýzy.
Akutní renální selhání
U pacientů léčených intravenózními imunoglobuliny byly hlášeny závažné renální nežádoucí účinky, zejména v případě přípravků obsahujících sacharózu (přípravek HyQvia neobsahuje sacharózu).
Syndrom aseptické meningitidy (AMS)
Ve spojení s intravenózní a subkutánní imunoglobulinovou léčbou byl hlášen výskyt syndromu aseptické meningitidy. Příznaky obvykle začaly do několika hodin až 2 dnů po podání imunoglobulinové léčby. Pacienti by měli být informováni o prvních příznacích, které zahrnují silnou bolest hlavy, ztuhlost krku, ospalost, horečku, fotofobii, nevolnost a zvracení. Přerušení imunoglobulinové léčby může vést k remisi AMS bez následků do několika dnů. Studie s mozkomíšním mokem jsou často pozitivní s pleocytózou až několik tisíc buněk na mm3, především z řad granulocytů, a se zvýšením hladin proteinů až na několik stovek mg/dl.
AMS se může častěji objevovat ve spojitosti s vysokodávkovou (2 g/kg) intravenózní imunoglobulinovou léčbou. V údajích získaných po uvedení přípravku na trh nebyla pozorována žádná zjevná korelace mezi AMS a vyššími dávkami. Vyšší výskyt AMS byl pozorován u žen.
Důležité informace o některých složkách přípravku HyQvia
Přípravek HyQvia neobsahuje cukry.
Složka IG 10% obsahuje stopová množství sodíku. Rekombinantní lidská hyaluronidáza obsahuje 4,03 mg sodíku na ml, s maximální denní dávkou přibližně 120 mg. To je třeba brát v úvahu u pacientů na dietě s řízeným obsahem sodíku.
Interference se sérologickými testy
Po imunoglobulinové infuzi může mít přechodný vzestup různých pasivně přenášených protilátek v krvi pacienta za následek zavádějící pozitivní výsledky sérologických testů.
Pasivní přenos protilátek proti povrchovým antigenům erytrocytů (např. A, B, D) může interferovat s některými sérologickými testy na protilátky proti erytrocytům, např. přímý antiglobulinový test (PAT, přímý Coombsův test).
Infuze imunoglobulinových přípravků mohou vést k falešně pozitivním výsledkům analýz k diagnostice plísňových infekcí, které závisí na detekci beta-D-glukanů. Tento stav může přetrvávat týdny po infuzi přípravku.
Přenosná agens
Normální lidský imunoglobulin a lidský sérový albumin (stabilizátor rekombinantní lidské hyaluronidázy) se vyrábějí z lidské plazmy. Standardní opatření zabraňující přenosu infekce v souvislosti s používáním léčivých přípravků vyrobených z lidské krve nebo plazmy zahrnují pečlivý výběr dárců, testování jednotlivých odběrů krve a plazmatických poolů na specifické ukazatele infekce a určité výrobní kroky, při nichž jsou inaktivovány nebo odstraněny viry. Přes všechna tato opatření při přípravě léčivých přípravků vyráběných z lidské krve nebo plazmy nelze riziko přenosu infekce zcela vyloučit. Toto se vztahuje také na neznámé a nově vznikající viry a jiné typy patogenů.
Přijatá opatření jsou považována za účinná u tzv. obalených virů, například u viru lidské imunodeficience (HIV), viru hepatitidy B (HBV) a viru hepatitidy C (HCV), a u neobalených virů hepatitidy A (HAV) a parvoviru B19.
Klinické nálezy potvrzují, že k přenosu viru hepatitidy typu A nebo parvoviru B19 pomocí imunoglobulinů nedochází, a předpokládá se, že obsah protilátek významně přispívá k protivirové ochraně.
Důrazně se doporučuje zaznamenat při každém podání přípravku HyQvia pacientovi název a číslo šarže přípravku, aby bylo možné zpětně přiřadit k pacientovi číslo použité šarže.
Pediatrická populace
Uvedená upozornění a opatření platí jako pro dospělé, tak pro děti.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Živé atenuované virové vakcíny
Aplikace imunoglobulinu může na dobu nejméně 6 týdnů a nejvýše 3 měsíců narušit účinnost živých atenuovaných virových vakcín, jako jsou spalničky, zarděnky, příušnice a plané neštovice. Po aplikaci tohoto léčivého přípravku je třeba vyčkat 3 měsíce před vakcinací živou atenuovanou vakcínou.
V případě spalniček může toto narušení účinnosti trvat až 1 rok. Proto je potřeba u pacientů očkovaných vakcínou proti spalničkám zkontrolovat stav protilátek.
Pediatrická populace
Uvedené interakce platí jako pro dospělé, tak pro děti.
4.6 Fertilita, těhotenství a kojení
Bezpečnost tohoto léčivého přípravku při podávání těhotným ženám nebyla stanovena v kontrolovaných klinických hodnoceních, a proto by se měl tento přípravek podávat těhotným ženám a kojícím matkám pouze s opatrností. Bylo prokázáno, že imunoglobulinové přípravky prochází placentou, ve třetím trimestru stoupající měrou. Klinické zkušenosti s imunoglobuliny naznačují, že není třeba očekávat žádné škodlivé účinky na průběh těhotenství nebo na plod a novorozence.
Byly provedeny studie vývojové a reprodukční toxicity rekombinantní lidské hyaluronidázy u myší a králíků. S protilátkami anti-rHuPH20 nebyly spojeny žádné nežádoucí účinky na březost a vývoj plodu. V těchto studiích byly mateřské protilátky proti rekombinantní lidské hyaluronidáze přeneseny do potomka in utero. Účinky protilátek proti složce rekombinantní lidské hyaluronidázy přípravku HyQvia na lidské embryo nebo na vývoj lidského plodu nejsou v současnosti známy (viz bod 5.3).
Pokud žena otěhotní, měl by ji ošetřující lékař požádat, aby se zapojila do registru těhotných.
Kojení
Imunoglobuliny se vylučují do lidského mateřského mléka a mohou přispět k ochraně novorozence před patogeny, které do těla vstupují sliznicemi.
Fertilita
V současnosti nejsou k dispozici žádné klinické údaje o bezpečnosti přípravku HyQvia s ohledem na fertilitu.
Klinické zkušenosti s imunoglobuliny nenaznačují, že by IG 10% měl negativní vliv na fertilitu.
Studie na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky rekombinantní lidské hyaluronidázy na reprodukční potenciál při dávkách používaných k usnadnění aplikace IG 10%
(viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Schopnost řídit a obsluhovat stroje může být narušena některými nežádoucími účinky spojenými s přípravkem HyQvia. Pacienti, kteří během léčby některé nežádoucí účinky prodělají, by měli počkat, až tyto odezní, než začnou řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nejčastěji hlášené nežádoucí účinky (NÚ) přípravku HyQvia jsou lokální reakce. Nejčastěji hlášenými systémovými NÚ byly bolest hlavy, únava a pyrexie. Většina NÚ byla mírná až středně závažná.
Normální lidský imunoglobulin
Příležitostně se mohou objevit nežádoucí účinky, jako je třesavka, bolest hlavy, závratě, horečka, zvracení, alergické reakce, nevolnost, artralgie, nízký krevní tlak a středně závažná bolest dolní poloviny zad.
Vzácně může normální lidský imunoglobulin způsobit náhlý pokles krevního tlaku a v izolovaných případech anafylaktický šok, a to i u pacientů, kteří při předchozí aplikaci přípravku nejevili žádné známky hypersenzitivity.
Často se mohou vyskytnout lokální reakce v místech infuze: zduření, bolestivost, erytém, indurace, lokální zahřátí, svědění, zhmoždění a vyrážka.
V souvislosti s lidským normálním imunoglobulinem byly pozorovány případy přechodné aseptické meningitidy, přechodné hemolytické reakce, zvýšení hladin kreatininu v séru a/nebo akutní renální selhání (viz bod 4.4).
Při intravenózní a subkutánní aplikaci imunoglobulinových přípravků byly vzácně pozorovány tromboembolické reakce, např. infarkt myokardu, mozková příhoda, plicní embolie a hluboká žilní trombóza.
Rekombinantní lidská hyaluronidáza
Nej častější nežádoucí účinky uváděné během postmarketingového užívání rekombinantní lidské hyaluronidázy v podobném složení podávané subkutánně za účelem disperze a absorpce subkutánně aplikovaných tekutin nebo léčivých přípravků byly mírné lokální reakce v místě infuze jako např. erytém a bolest. V souvislosti s aplikací velkého objemu subkutánních tekutin byl nej častěji hlášen otok.
Protilátky proti rekombinantní lidské hyaluronidáze
Celkem u 13 z 83 pacientů, kteří se účastnili pivotní studie, se vytvořily protilátky schopné navázat se na rekombinantní lidskou hyaluronidázu (rHuPH20) alespoň jednou během klinické studie. Tyto protilátky nebyly schopny lidskou rekombinantní hyaluronidázu neutralizovat. Nelze prokázat žádnou časovou souvislost mezi nežádoucími účinky a přítomností protilátek anti-rHuPH20. U pacientů, u nichž došlo k vytvoření protilátek proti rekombinantní lidské hyaluronidáze, nedošlo ke zvýšení incidence ani závažnosti nežádoucích účinků.
Seznam nežádoucích účinků v tabulce
Bezpečnost přípravku HyQvia byla hodnocena ve 4 klinických studiích
(160602, 160603, 160902 a 161101) u 124 jedinečných pacientů s pánevním zánětlivým
onemocněním, kteří dostali 3202 infuzí.
Níže uvedená tabulka je vytvořena podle klasifikace tříd orgánových systémů MedDRA (SOC a preferovaný termín).
Četnosti na jednu infuzi byly stanoveny s použitím následujícího pravidla: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
|
Četnost nežádoucích účinků (N |
Ú) u přípravku HyQvia | |||
|
Třída orgánových systémů, MedDRA (SOC) |
Velmi časté (>1/10) |
Časté (>1/100 až <1/10) |
Méně časté (>1/1 000 až <1/100) |
Vzácné (>1/10 000 až <1/1 000) |
|
Gastrointestinální poruchy |
Zvracení, nevolnost, bolest břicha (včetně bolesti a citlivosti horní a dolní poloviny břicha), průjem |
Břišní distenze | ||
|
Celkové poruchy a reakce v místě aplikace |
Lokální reakce (celkové)a Bolest v místě infuze (včetně diskomfortu, citlivosti, bolesti třísla) |
Lokální reakce (celkové): Erytém v místě infuze, zduření v místě infuze (včetně lokálního zduření a otoku), pruritus v místě infuze (včetně vulvovaginálního pruritu) Pyrexie, astenické stavy (včetně astenie, únavy, letargie, malátnosti) |
Lokální reakce (celkové): Vyblednutí místa infuze, zhmožděnina v místě infuze (včetně hematomu, krvácení), hmota v místě infuze (včetně uzlíku), teplo v místě infuze, indurace v místě infuze, edém závislý na gravitaci / zduření genitálub (včetně edému genitálu, zduření scrota a vulvovaginálního zduření) Edém (včetně periferního, zduření), třesavka, hyperhidróza |
Pálivý pocit |
|
Vyšetření |
Přímý Coombsův test pozitivní | |||
|
Četnost nežádoucích účinků (N |
Ú) u přípravku HyQvia | |||
|
Třída orgánových systémů, MedDRA (SOC) |
Velmi časté (>1/10) |
Časté (>1/100 až <1/10) |
Méně časté (>1/1 000 až <1/100) |
Vzácné (>1/10 000 až <1/1 000) |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Myalgie, muskuloskeletální bolest hrudníku |
Artralgie, bolest zad, bolest v končetině | ||
|
Poruchy nervového systému |
Migréna, závrať |
Parestezie | ||
|
Poruchy kůže a podkožní tkáně |
Erytém, vyrážka (včetně erytematózní, papulózní, makulopapulózní), pruritus, kopřivka | |||
|
Cévní poruchy |
Hypertenze, krevní tlak zvýšený | |||
|
Poruchy ledvin a močových cest |
Hemosiderinurie | |||
a Následující NÚ nejsou uvedeny, avšak byly rovněž započítány do četnosti lokálních reakcí: pocit horka, parestezie v místě infuze.
b Edém závislý na gravitaci / zduření genitálu byly pozorovány po podání přípravky do dolních kvadrantů břicha.
Kromě nežádoucích účinků zaznamenaných v klinických hodnoceních, byly po uvedení přípravku na trh hlášeny tyto nežádoucí účinky (četnost těchto účinků není známa (z dostupných údajů nelze určit)): Poruchy imunitního systému: přecitlivělost
Celkové poruchy a reakce v místě aplikace: onemocnění podobající se chřipce
Kromě výše uvedených nežádoucích účinků byly u subkutánně podávaných imunoglobulinových přípravků hlášeny tyto další nežádoucí účinky:
anafylaktický šok, anafylaktická/anafylaktoidní reakce, tremor, tachykardie, hypotenze, zrudnutí, bledost, chladná akra končetin, dyspnoe, parestezie orální, otok obličeje, alergická dermatitida, muskuloskeletální ztuhlost, kopřivka v místě injekce, vyrážka v místě injekce, zvýšená alaninaminotransferáza.
Popis vybraných nežádoucích účinků
Mezi lokálními reakcemi pozorovanými během pivotní klinické studie bylo (u většiny infuzí) mírné zduření místa aplikace kvůli velkým objemům aplikovaným infuzí, obecně však nebylo považováno za nežádoucí účinek, pokud nezpůsobovalo pocit nepohodlí. Pouze dva případy lokálních nežádoucích účinků byly závažné - jeden případ bolesti v místě infuze a jeden případ zduření v místě infuze. Došlo ke dvěma případům přechodného otoku genitálu; jeden z nich byl považován za závažný, kdy došlo k difuzi léčivého přípravku z místa infuze v břiše. Nebyly pozorovány žádné kožní změny, které by v průběhu klinické studie neodezněly.
Pediatrická populace
Výsledky klinických studií ukázaly, že bezpečnostní profily u pediatrické populace jsou podobné těm pozorovaným u dospělé populace (včetně povahy, četnosti, závažnosti a reverzibility nežádoucích účinků).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Následky předávkování nejsou známy.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina (normální lidský imunoglobulin): imunní séra a imunoglobuliny: imunoglobuliny, normální lidské, ATC kód: J06BA
Mechanismus účinku
Složka IG 10% poskytuje léčebný účinek tohoto léčivého přípravku. Rekombinantní lidská hyaluronidáza usnadňuje disperzi a absorpci IG 10%.
Normální lidský imunoglobulin obsahuje převážně imunoglobulin G (IgG) se širokým spektrem opsonizujících a neutralizačních protilátek proti infekčním agens.
Normální lidský imunoglobulin obsahuje IgG protilátky přítomné v normální populaci. Obvykle se připravuje z nashromážděné lidské plazmy od nejméně 1 000 dárců. Distribuci podtříd IgG má v podobném poměru, jaký je v nativní lidské plazmě. Adekvátní dávky normálního lidského imunoglobulinu mohou zvýšit abnormálně nízké hladiny IgG do jejich normálního rozmezí.
Rekombinantní lidská hyaluronidáza je rozpustná rekombinantní forma lidské hyaluronidázy, která zvyšuje propustnost podkožní tkáně dočasnou depolymerizací hyaluronanu. Hyaluronan je polysacharid nacházející se v mezibuněčné hmotě pojivové tkáně. Je depolymerován přirozeně se vyskytujícím enzymem hyaluronidázou. Na rozdíl od stabilních strukturních složek intersticiální matrix má hyaluronan velmi rychlý obrat s poločasem přibližně 0,5 dnů. Rekombinantní lidská hyaluronidáza přípravku HyQvia působí místně. Účinky hyaluronidázy jsou reverzibilní a permeabilita podkožní tkáně se obnoví do 24 až 48 hodin.
Klinická účinnost a bezpečnost
Účinnost a bezpečnost přípravku HyQvia byla vyhodnocena ve studii fáze 3 (160603) u 83 pacientů s pánevním zánětlivým onemocněním. Pacienti byli léčeni přípravkem HyQvia ve 3 - nebo 4týdenních léčebných intervalech po celkovou dobu 12 měsíců (po krátkém období titrace). Dávka přípravku HyQvia se zakládala na předchozí léčbě intravenózním IG 10% (320 až 1 000 mg/kg tělesné hmotnosti /4 týdny) a byla individuálně uzpůsobena, aby byly v průběhu studie zajištěny adekvátní hladiny IgG.
Výsledky studie ukázaly četnost ověřených akutních závažných bakteriálních infekcí za rok během léčby přípravkem HyQvia 0,025 (horní limit jednostranného 99% konfidenčního intervalu 0,046). Celková četnost infekcí byla menší během podávání přípravku HyQvia než během tříměsíční intravenózní aplikace IG 10%: bodový odhad četnosti všech infekcí za rok byl 2,97 (95%
CI: 2,51 až 3,47) u přípravku HyQvia a 4,51 (95% CI: 3,50 až 5,69) u nitrožilních infuzí IG 10%.
Téměř všichni pacienti byli schopni dosáhnout stejného dávkového intervalu přípravku HyQvia, jaký měli u intravenózní aplikace. Sedmdesát osm (78) z 83 (94 %) pacientů dosáhlo stejného 3 - nebo 4týdenního dávkování; u jednoho pacienta bylo změněno 4týdenní dávkování na 3týdenní, u jednoho pacienta bylo změněno 4týdenní dávkování na 2týdenní a u jednoho pacienta bylo změněno 3týdenní dávkování na 2týdenní (2 pacienti odstoupili během období titrace).
Medián míst infuze za měsíc u přípravku HyQvia byl 1,09, což je o něco méně než medián míst intravenózní infuze IG 10% použitých v této studii (1,34) a podstatně méně než medián míst infuze ve studii subkutánní aplikace IG 10% (21,43).
Celkem 66 pacientů, kteří dokončili pivotní studii fáze 3, se zúčastnilo prodloužené studie (160902) hodnotící dlouhodobou bezpečnost, snášenlivost a účinnost přípravku HyQvia u pánevního zánětlivého onemocnění. Celková kombinovaná expozice pacientů s pánevním zánětlivým onemocněním v obou studiích byla 187,69 paciento-roků; nejdelší expozice činila u dospělých pacientů 3,8 roku a u pediatrických pacientů 3,3 roky.
Pediatrická populace
Přípravek HyQvia byl hodnocen u 24 pediatrických pacientů, včetně 13 pacientů ve věku mezi 4 a <12 lety a 11 pacientů ve věku mezi 12 a <18 lety, kteří byli léčeni až 3,3 roky s celkovou zkušeností, pokud jde o bezpečnost, odpovídající 48,66 paciento-rokům (jak je popsáno v části Klinická účinnost a bezpečnost). Mezi pediatrickými pacienty a dospělými nebyly pozorovány žádné znatelné rozdíly ve farmakodynamických účincích ani v účinnosti či bezpečnosti přípravku HyQvia. Viz body 4.2 a 4.8.
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem HyQvia u jedné nebo více podskupin pediatrické populace v léčbě primárního imunodeficitu jako modelu pro substituční léčbu. Informace o použití u dětí viz bod 4.2.
5.2 Farmakokinetické vlastnosti
Po subkutánním podání přípravku HyQvia jsou dosaženy vrcholové hladiny IgG v séru v oběhu příjemce za přibližně 3 až 5 dnů.
Údaje z klinických studií přípravku HyQvia ukazují, že minimální sérové hladiny IgG v rovnovážném stavu lze udržet dávkovacími režimy 320 až 1 000 mg/kg tělesné hmotnosti/4 týdny podávané v intervalech 3 až 4 týdnů.
Farmakokinetika přípravku HyQvia byla vyhodnocena v klinické studii u pacientů s pánevním zánětlivým onemocněním ve věku 12 let a starších. Farmakokinetické výsledky jsou uvedeny v tabulce níže spolu s údaji týkajícími se intravenózní aplikace IG 10% získanými ve stejné studii.
IgG a komplexy IgG jsou odbourávány v buňkách retikuloendoteliálního systému.
|
Farmakokinetické parametry přípravku HyQvia v porovnání s intravenózní aplikací IG 10% | ||
|
Parametr |
HyQvia Medián (95% Cl) N = 60 |
i.v. IG 10% Medián (95% Cl) N = 68 |
|
Cmax [g/l] |
15,5 (14,5; 17,1) |
21,9 (20,7; 23,9) |
|
Cmin [g/l] |
10,4 (9,4 až 11,2) |
10,1 (9,5 až 10,9) |
|
AUC za týden [g*dny/l] |
90,52 (83,8 až 98,4) |
93,9 (89,1 až 102,1) |
|
Tmax [dny] |
5,0 (3,3 až 5,1) |
0,1 (0,1 až 0,1) |
|
Zřejmá clearance nebo clearance [ml/kg/den] |
1,6 (1,4 až 1,79) |
1,4 (1,2 až 1,4) |
|
Průměrný poločas v plazmě [dny] |
45,3 (41,0 až 60,2) |
35,7 (32,4 až 40,4) |
Pediatrická populace
V klinické studii s přípravkem HyQvia nebyly v minimálních plazmatických hladinách IgG v rovnovážném stavu u dospělých a pediatrických pacientů pozorovány žádné rozdíly.
5.3 Předklinické údaje vztahující se k bezpečnosti
Imunoglobuliny jsou normální složkou lidského těla.
Bezpečnost IG 10% byla prokázána v několika neklinických studiích. Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti a toxicity neodhalily žádné zvláštní riziko pro člověka. Studie toxicity po opakovaném podávání, genotoxicity a reprodukční toxicity u zvířat jsou neproveditelné v důsledku indukce rozvoje protilátek proti heterologním proteinům a jejich rušivého vlivu.
Nebyly provedeny dlouhodobé studie na zvířatech k hodnocení kancerogenního nebo mutagenního potenciálu rekombinantní lidské hyaluronidázy. Nebyly pozorovány žádné nežádoucí účinky na fertilitu u myší, králíků a opic makaka jávského vystavených protilátkám, které se vážou na rekombinantní lidskou hyaluronidázu a druhově specifickou hyaluronidázu. U samců a samic morčat imunizovaných tak, aby vytvářeli protilátky proti hyaluronidáze, byla pozorována reverzibilní infertilita. Protilátky proti hyaluronidáze však neovlivňovaly reprodukci po imunizaci myší, králíků, ovcí ani opic makaka jávského. Účinky protilátek, které se vážou na rekombinantní lidskou hyaluronidázu, na fertilitu člověka nejsou známy.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Injekční lahvička normálního lidského imunoglobulinu (IG 10%)
Glycin
Voda na injekce
Injekční lahvička rekombinantní lidské hyaluronidázy (rHuPH20)
Chlorid sodný Hydrogenfosforečnan sodný Lidský albumin Dinatrium-edetát (EDTA)
Chlorid vápenatý
Hydroxid sodný (pro úpravu pH)
Kyselina chlorovodíková (pro úpravu pH)
Voda na injekce
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
3 roky.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte injekční lahvičky v krabičce, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
Injekční lahvička normálního lidského imunoglobulinu (IG 10%)
25, 50, 100, 200 nebo 300 ml roztoku v injekční lahvičce (sklo typu I) se zátkou (bromobutylová pryž).
Injekční lahvička rekombinantní lidské hyaluronidázy (rHuPH20)
1,25, 2,5, 5, 10 nebo 15 ml roztoku v injekční lahvičce (sklo typu I) se zátkou (chlorobutylová pryž). Velikost balení:
Jedna injekční lahvička IG 10% a jedna injekční lahvička rekombinantní lidské hyaluronidázy v jednotce se dvěma lahvičkami.
Na trhu nemusí být k dispozici všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Přípravek je před použitím třeba zahřát na pokojovou teplotu. Nepoužívejte zařízení pro ohřev včetně mikrovlnné trouby.
IG 10% je čirý nebo lehce opalizující a bezbarvý či bledě žlutý roztok. Rekombinantní lidská hyaluronidáza je čirý bezbarvý roztok.
Injekční lahvičky je nutné před podáním zkontrolovat zrakem, zda neobsahují částice, nebo nedošlo ke změně zabarvení. Roztoky, které jsou zakalené nebo obsahují usazeniny, se nesmí používat.
Neprotřepávejte.
Složky přípravku HyQvia před aplikací nemíchejte.
K odstranění rekombinantní lidské hyaluronidázy z injekčních lahviček nepoužívejte přístupová zařízení s odvzdušněním.
K přípravě a aplikaci přípravku HyQvia používejte aseptickou techniku. V případech, kdy je k získání potřebné dávky infuze potřeba více než jedna injekční lahvička léčivého přípravku IG 10% nebo rekombinantní lidské hyaluronidázy, měly by být IG 10% nebo rekombinantní lidská hyaluronidáza před aplikací připraveny samostatně do příslušných zásobníků na roztok. Částečně použité injekční lahvičky musí být zlikvidovány.
Veškerý nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Baxalta Innovations GmbH Industriestrasse 67 A-1221 Vídeň, Rakousko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/13/840/001
EU/1/13/840/002
EU/1/13/840/003
EU/1/13/840/004
EU/1/13/840/005
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 16. května 2013
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu.
A. VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY/ IOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY/BIOLOGICKÝCH LÉČIVÝCH LÁTEK A
VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobců biologické léčivé látky/biologických léčivých látek
Baxalta Belgium Manufacturing SA Boulevard René Branquart 80 B-7860 Lessines Belgie
Název a adresa výrobců odpovědných za propouštění šarží
Baxalta Belgium Manufacturing SA Boulevard René Branquart 80 B-7860 Lessines Belgie
Baxter SA
Boulevard René Branquart 80
B-7860 Lessines
Belgie
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
TTV 1 ř V, V ř V V r
• Úřední propouštění sarzí
Podle článku 114 směrnice 2001/83/ES bude úřední propouštění šarží provádět některá státní laboratoř nebo laboratoř k tomuto účelu určená.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ OBAL (2,5 G, 5 G, 10 G, 20 G A 30 G)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
HyQvia 100 mg/ml - infuzní roztok k subkutánnímu podání Immunoglobulinum humanum normale
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Injekční lahvička s normálním lidským imunoglobulinem: 100 mg/ml, nejméně 98 % je IgG Maximální obsah imunoglobulinu A (IgA): 140 mikrogramů/ml.
3. SEZNAM POMOCNÝCH LÁTEK
Injekční lahvička s normálním lidským imunoglobulinem: glycin, voda na injekce.
Injekční lahvička s_rekombinantní lidskou hyaluronidázou: lidská hyaluronidáza. Chlorid sodný, hydrogenfosforečnan sodný, lidský albumin, dinatrium-edetát, chlorid vápenatý, voda na injekce. Další informace viz příbalová informace.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Infuzní roztok k subkutánnímu podání
1 injekční lahvička normálního lidského imunoglobulinu
2.5 g/25 ml 5 g/50 ml 10 g/100 ml 20 g/200 ml 30 g/300 ml
1 injekční lahvička rekombinantní lidské hyaluronidázy 1,25 ml
2.5 ml 5 ml 10 ml 15 ml
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Pouze k subkutánnímu podání.
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Neprotřepávejte.
Dvě dodávané injekční lahvičky před aplikací nemíchejte. Rekombinantní lidskou hyaluronidázu podejte infuzí jako první.
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte injekční lahvičky v krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Baxalta Innovations GmbH A-1221 Vídeň, Rakousko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/840/001 2,5 g/25 ml EU/1/13/840/002 5 g/50 ml EU/1/13/840/003 10 g/100 ml EU/1/13/840/004 20 g/200 ml EU/1/13/840/005 30 g/300 ml
13. ČÍSLO ŠARŽE
č.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16 INFORMACE V BRAILLOVĚ PÍSMU
HyQvia 100 mg/ml
ŠTÍTEK INJEKČNÍ LAHVIČKY NORMÁLNÍHO LIDSKÉHO IMUNOGLOBULINU (5 G, 10 G, 20 G A 30 G)_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
HyQvia 100 mg/ml - infuze k subkutánnímu podání Immunoglobulinum humanum normale
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Imunoglobulin: 100 mg/ml, nejméně 98 % je IgG Maximální obsah imunoglobulinu A (IgA): 140 mikrogramů/ml.
3. SEZNAM POMOCNÝCH LÁTEK
Glycin, voda na injekce.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Infuze k subkutánnímu podání. 1 injekční lahvička 5 g/50 ml 10 g/100 ml 20 g/200 ml 30 g/300 ml
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Pouze subkutánní podání.
Podejte jako 2. infuzi.
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte injekční lahvičku v krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Baxalta Innovations GmbH A-1221 Vídeň, Rakousko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/840/002 5 g/50 ml EU/1/13/840/003 10 g/100 ml EU/1/13/840/004 20 g/200 ml EU/1/13/840/005 30 g/300 ml
13. ČÍSLO ŠARŽE
č.s.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
ŠTÍTEK INJEKČNÍ LAHVIČKY NORMÁLNÍHO LIDSKÉHO IMUNOGLOBULINU (2,5 G)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
HyQvia 100mg/ml - infuze k subkutánnímu podání Immunoglobulinum humanum normale Pouze s.c. podání.
2. ZPŮSOB PODÁNÍ
Podejte jako 2. infuzi.
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
Použitelné do:
4. ČÍSLO ŠARŽE
č.s.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
2,5 g/25 ml
6. JINÉ
ŠTÍTEK INJEKČNÍ LAHVIČKY REKOMBINANTNÍ LIDSKÉ HYALURONIDÁZY (2,5 ML, 5 ML, 10 ML, 15 ML)_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Infuze k subkutánnímu podání přípravku HyQvia
Hyaluronidasum
Pouze subkutánní podání.
2. ZPŮSOB PODÁNÍ
Podejte jako 1. infuzi.
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
Použitelné do:
4. ČÍSLO ŠARŽE
č.s.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
2,5 ml 5 ml 10 ml 15 ml
6. JINÉ
ŠTÍTEK INJEKČNÍ LAHVIČKY REKOMBINANTNÍ LIDSKÉ HYALURONIDÁZY (1,25 ML)_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Infuze k subkutánnímu podání přípravku HyQvia
Hyaluronidasum
Pouze s.c. podání.
2. ZPŮSOB PODÁNÍ
Podejte jako 1. infuzi.
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
Použitelné do:
4. ČÍSLO ŠARŽE
č.s.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1,25 ml
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: Informace pro uživatele
HyQvia 100 mg/ml - infuzní roztok k subkutánnímu podání Immunoglobulinum humanum normale
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí
ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek HyQvia a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek HyQvia používat
3. Jak se přípravek HyQvia používá
4. Možné nežádoucí účinky
5. Jak přípravek HyQvia uchovávat
6. Obsah balení a další informace
1. Co je přípravek HyQvia a k čemu se používá Co je přípravek HyQvia
Přípravek HyQvia obsahuje dva infuzní roztoky pro aplikaci (kapačkou) pod kůži (subkutánní neboli s.c. infuze). Přípravek je dodáván jako balení obsahující jednu injekční lahvičku normálního lidského imunoglobulinu 10% (léčivá látka) a jednu injekční lahvičku rekombinantní lidské hyaluronidázy (látka, která pomáhá normálnímu lidskému imunoglobulinu 10% proniknout do krve).
Normální lidský imunoglobulin 10% patří do třídy léků zvaných „normální lidské imunoglobuliny“. Imunoglobuliny jsou rovněž známy jako protilátky a nacházejí se v krvi zdravých lidí. Protilátky jsou součástí imunitního systému (přirozené obrany těla) a pomáhají Vašemu tělu bojovat s infekcemi.
Jak přípravek HyQvia funguje
Imunoglobuliny obsažené v injekční lahvičce byly připraveny z krve zdravých lidí. Lék funguje zcela stejným způsobem jako imunoglobuliny přirozeně přítomné v krvi. Rekombinantní lidská hyaluronidáza je bílkovina, která imunoglobulinům pomáhá při infuzi (kapačkou) pod kůži k dosažení krevního řečiště.
K čemu se přípravek HyQvia používá
Přípravek HyQvia se používá u pacientů s oslabeným imunitním systémem, kteří nemají v krvi dostatek protilátek a jsou náchylní k častým infekcím. Pravidelné a dostatečné dávky přípravku HyQvia mohou navýšit abnormálně nízké hladiny imunoglobulinů v krvi na normální úroveň (substituční léčba).
Přípravek HyQvia je předepisován jako substituční léčba pacientům, kteří nemají dostatečné protilátky, mezi něž patří tyto skupiny:
• pacienti s vrozenou neschopností nebo sníženou schopností vytvářet protilátky (primární imunodeficity),
• pacienti s určitým typem rakoviny krve (chronická lymfocytární leukemie), který vede
k nedostatečné tvorbě protilátek a opakovaným infekcím, pokud selhala preventivní léčba antibiotiky,
• pacienti s konkrétní rakovinou kostní dřeně (mnohočetný myelom) a nedostatečnou tvorbou protilátek s opakovanými infekcemi, u nichž nedošlo k odpovědi na vakcínu proti určitým bakteriím (pneumokoky),
• pacienti s nízkou tvorbou protilátek před transplantací buněk kostní dřeně od jiné osoby a po ní.
2. Čemu musíte věnovat pozornost, než začnete přípravek HyQvia používat
Přípravek HyQvia NEVSTŘIKUJTE ani NEPODÁVEJTE INFUZÍ:
- jestliže jste alergický(á) na imunoglobuliny, hyaluronidázu, rekombinantní hyaluronidázu nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6. „Obsah balení a další informace“).
- pokud máte v krvi protilátky proti imunoglobulinu A (IgA). To může nastat, pokud trpíte deficitem IgA. Jelikož přípravek HyQvia obsahuje stopová množství IgA, můžete dostat alergickou reakci.
- do cév (intravenózně).
Upozornění a opatření
Než přípravek HyQvia dostanete nebo použijete, je nutné zvážit následující upozornění a opatření. Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo zdravotní sestry.
Těhotenství, kojení a plodnost
Účinek dlouhodobého užívání rekombinantní lidské hyaluronidázy na těhotenství, kojení a plodnost není v současnosti znám. Přípravek HyQvia by měl být užíván těhotnými ani kojícími ženami pouze po poradě s lékařem. Pokud během užívání přípravku HyQvia otěhotníte, měla byste se svým lékařem dále probrat možnost účasti v registru těhotných, aby mohly být získány údaje o Vašem těhotenství a o vývoji Vašeho dítěte. Účelem tohoto registru je shromažďování údajů; tyto údaje budou sdíleny pouze s orgány ochrany veřejného zdraví zodpovědnými za sledování bezpečnosti tohoto přípravku. Účast v registru je dobrovolná.
Alergické reakce
Můžete být alergičtí na imunoglobuliny, aniž byste o tom věděli. Alergické reakce, jako je náhlý pokles krevního tlaku nebo anafylaktický šok (rychlý pokles krevního tlaku s dalšími příznaky, jako je otok hrdla, ztížené dýchání či kožní vyrážka), jsou vzácné, ale občas mohou nastat, i když jste dříve s podobnou léčbou problémy neměli. Pokud trpíte deficitem IgA s protilátkami proti IgA, existuje u Vás zvýšené riziko alergických reakcí. Mezi příznaky nebo symptomy těchto vzácných alergických reakcí patří:
- pocit závrati, závrativost nebo mdloba;
- kožní vyrážka a svědění, otok v ústech nebo krku, ztížené dýchání, sípot;
- abnormální srdeční frekvence, bolest na hrudi, promodrání rtů nebo prstů na rukou a nohou;
- rozmazané vidění.
Váš lékař nebo zdravotní sestra Vám nejprve podají přípravek HyQvia pomalou infuzí a důkladně vás budou v průběhu prvních infuzí sledovat, aby jakákoli alergická reakce byla okamžitě zjištěna a zaléčena.
► Pokud během infuze zaznamenáte některý z těchto příznaků, okamžitě uvědomte svého lékaře nebo zdravotní sestru. On nebo ona rozhodnou, zda rychlost infuze zpomalit nebo ji úplně zastavit.
Rychlost infuze
Je velmi důležité podávat lék v infuzi správnou rychlostí. Váš lékař nebo zdravotní sestra Vám poradí, jakou rychlost při infuzi přípravku HyQvia doma použít (viz bod 3. „Jak se přípravek HyQvia používá“).
Sledování během infuze
Určité nežádoucí účinky se mohou objevovat častěji, pokud:
- dostáváte přípravek HyQvia poprvé;
- jste dostávali jiný imunoglobulin a byli jste převedeni na přípravek HyQvia;
- uběhl dlouhý interval (např. více než 2 nebo 3 intervaly infuze) od poslední aplikace přípravku HyQvia.
► V takových případech budete během první infuze a první hodinu po zastavení infuze důkladněji sledování.
Ve všech ostatních případech byste během prvních několika infuzí měli být sledováni během infuze a alespoň 20 minut po aplikaci přípravku HyQvia.
Domácí léčba
Před zahájením domácí léčby si musíte určit osobu, která na vás bude dohlížet. Vy i tato dohlížející osoba budete vyškoleni v rozpoznání časných známek nežádoucích účinků, především alergických reakcí. Tato dohlížející osoba Vám pomůže sledovat případné nežádoucí účinky. V průběhu infuze musíte hlídat případné první příznaky vedlejších účinků (další podrobnosti najdete v bodě 4. „Možné nežádoucí účinky“).
► Pokud se u Vás některé z nežádoucích účinků objeví, Vy nebo Váš dohled musíte ihned zastavit infuzi a obrátit se na lékaře.
► Pokud se u Vás vyskytne závažný nežádoucí účinek, musíte Vy nebo Vaše dohlížející osoba ihned vyhledat lékařskou pohotovost.
Rozšíření lokalizovaných infekcí
Přípravek HyQvia neaplikujte do infikované nebo zarudlé oteklé oblasti kůže ani do jejího okolí, neboť by mohlo dojít k rozšíření infekce.
V klinických studiích nebyly pozorovány žádné dlouhodobé (chronické) změny kůže. Jakýkoli dlouhodobý zánět, bulky (uzlíky) nebo zánět, které se objeví v místě infuze a trvají déle než několik dnů, je třeba nahlásit lékaři.
Účinky na krevní testy
Přípravek HyQvia obsahuje mnoho různých protilátek a některé z nich mohou ovlivňovat krevní testy (sérologické testy).
► Před jakýmkoli krevním testem sdělte svému lékaři, že jste léčeni přípravkem HyQvia. Informace o zdroji materiálu pro přípravek HyQvia
Normální lidský imunoglobulin 10% přípravku HyQvia a lidský sérový albumin (složka rekombinantní lidské hyaluronidázy) se vyrábějí z lidské plazmy (kapalné části krve). Při výrobě léků z lidské krve a plazmy se používají určitá opatření, která brání přenesení případné infekce na pacienty. Mezi tato opatření patří:
- pečlivý výběr dárců krve a plazmy, který vyloučí, aby se možní přenašeči infekce stali dárci;
- testování každé darované a zásobní plazmy na přítomnost virů/infekcí.
Zpracování krve a plazmy při výrobě těchto produktů rovněž zahrnuje určité kroky, při nichž dojde k inaktivaci nebo odstranění virů. Přes všechna tato opatření při přípravě léků vyráběných z lidské krve či plazmy nelze riziko přenosu infekce zcela vyloučit. To platí i pro jakékoli neznámé nebo vznikající viry či jiné infekce.
Opatření přijatá při výrobě přípravku HyQvia jsou považována za účinná u obalených virů, jako je například virus lidské imunodeficience (HIV), virus hepatitidy B a virus hepatitidy C, a neobalených virů hepatitidy typu A a parvoviru B19.
Imunoglobuliny nejsou spojovány s infekcemi virem hepatitidy A či parvovirem B19, a to pravděpodobně proto, že protilátky proti těmto infekcím, které jsou obsaženy v přípravku HyQvia, mají ochranný charakter.
Při každém použití přípravku HyQvia důrazně doporučujeme zaznamenat si do deníku léčby následující údaje:
- datum aplikace,
- číslo šarže léku,
- aplikovaný objem, rychlost průtoku, počet a umístění míst infuze.
Děti a dospívající
Pro děti a dospívající (0-18 let) platí stejné indikace, dávka a četnost infuzí, jako pro dospělé.
Další léčivé přípravky a HyQvia
Informujte svého lékaře, lékárníka nebo zdravotní sestru o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Očkování
Přípravek HyQvia může snížit účinek některých virových vakcín, jako jsou např. spalničky, zarděnky, příušnice a plané neštovice (živé virové vakcíny). Proto bude po aplikaci přípravku HyQvia nutné před podáním některých těchto vakcín až 3 měsíce počkat. Vakcínou proti spalničkám budete moci být očkováni až 1 rok po aplikaci přípravku HyQvia.
► Prosím sdělte svému lékaři nebo zdravotní sestře provádějícím očkování, že jste léčeni přípravkem HyQvia.
Řízení dopravních prostředků a obsluha strojů
U pacientů se během léčby přípravkem HyQvia mohou vyskytnout nežádoucí účinky (např. Závrať nebo nevolnost), které mohou ovlivňovat jejich schopnost řídit dopravní prostředky a obsluhovat stroje. Pokud se tak stane, měli byste počkat, dokud účinky neodezní.
Přípravek HyQvia obsahuje sodík.
Rekombinantní lidská hyaluronidáza přípravku HyQvia obsahuje malé množství sodíku (4,03 mg na ml). Tato informace může být důležitá u pacientů, kteří jsou na dietě s kontrolovaným příjmem sodíku.
3. Jak se přípravek HyQvia používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem.
Přípravek HyQvia musí být aplikován infuzí pod kůži (subkutánní neboli s.c. podání).
Léčbu přípravkem HyQvia zahájí Váš lékař nebo zdravotní sestra, ale jakmile dostanete několik prvních infuzí pod lékařským dohledem a byli jste (Vy a/nebo Váš dohled) řádně vyškoleni, může Vám být umožněno užívat lék doma. Vy a Váš lékař společně rozhodnete, zda můžete přípravek HyQvia užívat doma. Léčbu přípravkem HyQvia doma nezahajujte, dokud nedostanete úplné pokyny.
Dávkování
Váš lékař vypočítá správnou dávku na základě Vaší tělesné hmotnosti, veškeré předchozí léčby, kterou jste dostávali, a Vaší odpovědi na léčbu. Doporučená počáteční dávka je taková, která dodá 400 až 800 mg účinné látky na kg tělesné hmotnosti za měsíc. Na začátku budete dostávat jednu čtvrtinu této dávky v týdenních intervalech. Ta se bude s dalšími infuzemi postupně zvyšovat na větší dávky v 3 - až 4týdenních intervalech. Někdy může Váš lékař doporučit vyšší dávky rozdělit a podat je současně do dvou různých míst. Váš lékař může rovněž dávku upravit v závislosti na Vaší odpovědi na léčbu.
Zahájení léčby
Vaše léčba bude zahájena lékařem nebo zdravotní sestrou se zkušenostmi v léčbě pacientů s oslabeným imunitním systémem a ve vedení pacientů k domácí léčbě. V průběhu infuze a nejméně 1 hodinu po jejím zastavení budete pečlivě sledováni, aby se zjistilo, jak léčivo snášíte.
Na začátku použije Váš lékař nebo zdravotní sestra pomalou rychlost infuze a v průběhu první infuze a dalších infuzí budou tuto rychlost postupně zvyšovat. Jakmile Vám lékař nebo zdravotní sestra určí správnou dávku a rychlost infuze, mohou Vám povolit, abyste léčbu užívali sami doma.
Domácí léčba Budete instruováni o:
- infuzních technikách bez přítomnosti choroboplodných zárodků (asepse),
- použití infuzní pumpy nebo injektomatu (dle potřeby),
- vedení deníku léčby,
- opatřeních prováděných v případě výskytu závažných nežádoucích účinků.
Všechny pokyny lékaře týkající se dávky, rychlosti infuze a rozvrhu infuzí přípravku HyQvia musíte důsledně dodržovat, aby mohla být Vaše léčba úspěšná.
|
Pacienti < 40 kg |
Pacienti > 40 kg | |||
|
Interval/minut |
První dvě infuze (ml/hod) |
Následující 2-3 infuze (ml/hod) |
První dvě infuze (ml/hod) |
Následující 2-3 infuze (ml/hod) |
|
10 minut |
5 |
10 |
10 |
10 |
|
10 minut |
10 |
20 |
30 |
30 |
|
10 minut |
20 |
40 |
60 |
120 |
|
10 minut |
40 |
80 |
120 |
240 |
|
Zbytek infuze |
80 |
160 |
240 |
300 |
Jestliže jste použil(a) více přípravku HyQvia, než jste měl(a)
Pokud si myslíte, že jste užil(a) více přípravku HyQvia, než jste měl(a), promluvte si co nejdříve se svým lékařem.
Jestliže jste zapomněl(a) použít přípravek HyQvia
Nezdvojnásobujte následující infuzní dávku přípravku HyQvia, abyste nahradil(a) vynechanou dávku. Pokud si myslíte, že byla dávka vynechána, promluvte si co nejdříve se svým lékařem.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
1
Vyjměte přípravek HyQvia z krabice:
• Nechejte injekční lahvičky ohřát na pokojovou teplotu.
To může trvat až 60 minut. Nepoužívejte zařízení pro ohřev včetně mikrovlnné trouby.
• Přípravek HyQvia nezahřívejte ani neprotřepávejte.
• Před použitím každou injekční lahvičku přípravku HyQvia zkontrolujte:
• Datum použitelnosti: Po uplynutí data použitelnosti nesmí být přípravek aplikován.
• Barva:
o Rekombinantní lidská hyaluronidáza by měla být čirá a bezbarvá.
o Normální lidský imunoglobulin 10% by měl být čirý a bezbarvý nebo bledě žlutý. o Pokud je tekutina zakalená nebo obsahuje částice, roztok nepoužívejte.
• Víčko: Ochranné víčko se nachází na jednotce
se dvěma injekčními lahvičkami. Pokud přípravek _nemá víčko, nepoužívejte jej._
2
Připravte si všechny pomůcky:
Nachystejte si všechny potřeby k infuzi. Mezi ty patří následující: jednotka (jednotky) se dvěma injekčními lahvičkami přípravku HyQvia, pomůcky na infuzi (set se subkutánní jehlou, zásobník na roztok (vak nebo stříkačka), sterilní průhledný obvaz a náplast, hadičky pumpy, převodní zařízení, stříkačky, gáza a náplast), nádoba na ostré předměty, elektromechanická infuzní pumpa s variabilní rychlostí, záznamník léčby a další pomůcky podle potřeby._
Připravte si čistou pracovní plochu.
Umyjte si ruce:
Umyjte si důkladně ruce. Umístěte všechny shromážděné potřeby a otevřete je dle pokynů zdravotníka.
Otevřete jednotku se dvěma injekčními lahvičkami přípravku
HyQvia:
• Sejměte modrá ochranná víčka, čímž odkryjete zátky injekčních lahviček.
• Před převedením složky rekombinantní lidské hyaluronidázy přípravku HyQvia otřete zátku každé injekční lahvičky alkoholovým tamponem a nechte na vzduchu oschnout
_(alespoň 30 vteřin)._

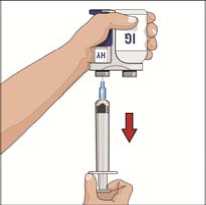
Připravte si injekční lahvičku rekombinantní lidské
hyaluronidázy (HY):
• Vyjměte z obalu menší sterilní stříkačku a připojte ji k hrotu nebo jehle bez odvzdušnění (zařízení).
• Zatáhněte za píst a naplňte menší stříkačku vzduchem, jehož množství odpovídá množství rekombinantní lidské hyaluronidázy v injekční lahvičce označené (injekčních lahvičkách označených) zkratkou HY.
• Sejměte z převodního zařízení s jehlou/bez odvzdušnění víčko.
• Zaveďte hrot převodního zařízení s jehlou/bez odvzdušnění doprostřed zátky injekční lahvičky a zatlačte přímo dolů. Vtlačte do injekční lahvičky vzduch.
• Otočte injekční lahvičku dnem vzhůru, převodní zařízení s jehlou/bez odvzdušnění ponechejte v injekční lahvičce. Hrot stříkačky bude směřovat nahoru.
• Natáhněte celý obsah rekombinantní lidské hyaluronidázy do stříkačky.
• Pokud je na Vaši dávku potřeba více než jedna injekční lahvička rekombinantní lidské hyaluronidázy, opakujte krok 6.
• Pokud je to možné, nakombinujte veškerou rekombinantní lidskou hyaluronidázu potřebnou na celou dávku IgG do stejné stříkačky.
• Nasměrujte špičku stříkačky nahoru a odstraňte všechny vzduchové bubliny (to by mělo jíst snadno poté, co jste stříkačku otočili a poklepali na ni prstem). Pomalu a opatrně
_zatlačte na píst a odstraňte tak veškerý zbývající vzduch.
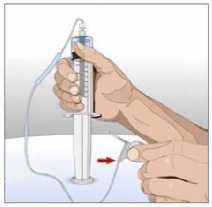
Připravte si set s jehlou a rekombinantní lidskou
hyaluronidázou (HY):
• Připojte stříkačku naplněnou rekombinantní lidskou hyaluronidázou k setu s jehlou
• Zatlačte na píst menší stříkačky, čímž odstraníte vzduch, a naplňte set s jehlou až po křidélka jehly rekombinantní lidskou hyaluronidázou.
• Poznámka: Váš zdravotník Vám může doporučit
použití konektoru „Y“ (na více než jedno místo) nebo jinou konfiguraci setu s jehlou.
9.
Připravte si injekční lahvičku normálního lidského imunoglobulinu 10%:
• Před převedením 10% imunoglobulinové složky přípravku HyQvia otřete zátku každé injekční lahvičky alkoholovým tamponem, pokud je tak uvedeno, a nechte na vzduchu oschnout (alespoň 30 vteřin).
• Normální lidský imunoglobulin 10% přípravku HyQvia lze podat v infuzi dvěma způsoby:
o nahromaděním obsahu injekčních lahviček do větší
stříkačky (a) nebo infuzního vaku (b) podle pokynů zdravotníka v závislosti na tom, zda má být použita infuzní pumpa s variabilní rychlostí; nebo o přímo z injekční lahvičky označené zkratkou IG (c).
Zaveďte hrot hadiček pumpy s odzvdušněním nebo hrot a jehlu s odvzdušněním do injekční lahvičky (lahviček) normálního lidského imunoglobulinu 10%. Naplňte hadičky aplikační pumpy a dejte je stranou, dokud nebude podána rekombinantní lidská hyaluronidáza.
• Pokud je na plnou dávku potřeba více než jedna injekční lahvička, nabodněte další injekční lahvičky poté, co je zcela
_aplikována první lahvička._
Naprogramujte infuzní pumpu s variabilní rychlostí:
Dodržujte pokyny výrobce k přípravě infuzní pumpy s variabilní rychlostí.
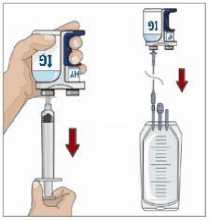
(c)
Naprogramujte rychlosti infuze normálního lidského
imunoglobulinu 10% podle pokynů zdravotníka._
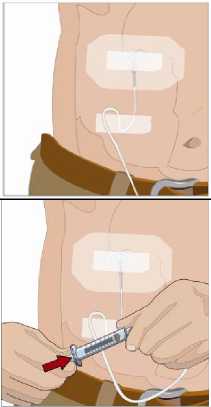
Připravte si místo infuze:
• Vyberte si místo (místa) infuze ve střední nebo horní části břicha nebo na stehnu. Umístění místa infuze - viz obrázek. o Pokud dostanete pokyn, abyste si infuzi aplikovali
u dávek nad 600 ml do dvou míst, vyberte si místa na opačných stranách těla.
• Vyhýbejte se oblastem s kostními výběžky, viditelným cévám, jizvám a všem oblastem se zánětem nebo infekcí.
• Střídejte místa infuze výběrem opačných stran těla mezi budoucími infuzemi.
• Když dostanete pokyn od svého zdravotníka, očistěte místo (místa) infuze alkoholovým tamponem. Nechejte je oschnout (nejméně 30 sekund).
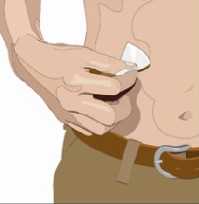
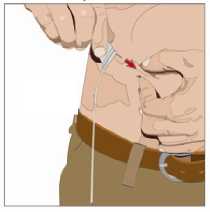
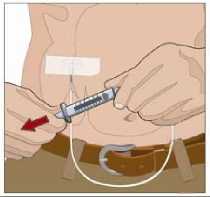
11. Zaveďte jehlu:
• Sejměte kryt jehly. Pevně uchopte a stiskněte mezi dvěma prsty alespoň 2 až 2,5 cm kůže.
• Celou jehlu až ke křidélkům zaveďte rychlým pohybem přímo do kůže pod úhlem 90 stupňů. Křidélka jehly by měla ležet rovně na kůži.
• Zajistěte jehlu na místě sterilní náplastí.
• Opakujte tento krok, pokud máte druhé místo infuze.
Úhel k pokožce 90
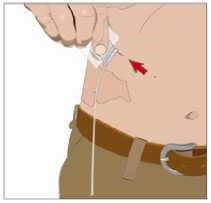
13. Upevněte jehlu ke kůži:
• Zajistěte jehlu (jehly) na místě - umístěte přes ni sterilní průhledný obvaz.
• V průběhu infuze občas zkontroluje místo (místa) infuze, zda nedošlo k posunu nebo prosaku.
14. Podejte nejprve infuzi rekombinantní lidské hyaluronidázy:
• Pomalu stiskněte píst menší stříkačky s rekombinantní lidskou hyaluronidázou s počáteční rychlostí přibližně 1 až 2 ml za minutu na místo infuze a zvyšujte dle snášenlivosti.
• Používáte-li pumpu, naprogramujte ji, aby podávala infuzi rekombinantní lidské hyaluronidázy s počáteční rychlostí 1 60 až 120 ml/hodinu na místo infuze a zvyšujte
_rychlost dle snášenlivosti._
15. Podejte normální lidský imunoglobulin 10%:
Po infuzi veškerého obsahu menší stříkačky (rekombinantní lidské hyaluronidázy) vyjměte stříkačku z plastového těla jehlového setu. Připojte hadičky pumpy nebo větší stříkačku s normálním lidským imunoglobulinem 10% k jehlovému setu.
Aplikujte normální lidský imunoglobulin 10% rychlostí _předepsanou Vaším zdravotníkem._
16. Když je infuze dokončena, propláchněte hadičky pumpy, pokud dostanete pokyn zdravotníka:
• Dostanete-li pokyn od zdravotníka, připojte vak
s fyziologickým roztokem k hadičce pumpy/jehlovému setu, aby se normální lidský imunoglobulin 10% protlačil až ke _křidélkům jehly._
17. Vyjměte jehlový set:
• Vyjměte jehlový set uvolněním krytí na všech jeho okrajích.
• Vytáhněte křidélka jehly přímo nahoru a ven.
• Opatrně přitiskněte malý kousek gázy na místo po vpichu jehly a překryjte ochranným krytím.
• Vyhoďte jehlu (jehly) do nádoby na ostré předměty.
o Zlikvidujte nádobu na ostré předměty podle pokynů
_dodaných s nádobou nebo kontaktujte zdravotníka.
|
18. Zaznamenejte infuzi: | |
|
• Sundejte odlepitelný štítek z injekční lahvičky přípravku | |
|
HyQvia, který obsahuje číslo šarže výrobku a datum | |
|
použitelnosti, a umístěte tento štítek do svého | |
|
záznamníku/deníku léčby. | |
|
• Zapište datum, čas, dávku, místo (místa) infuze | |
|
(jako pomůcku při střídání míst aplikace) a jakoukoli | |
|
reakci po každé infuzi. | |
|
• Vyhoďte veškerý nepoužitý výrobek v injekční lahvičce | |
|
a jednorázové součásti dle instrukcí, které Vám poskytl | |
|
Váš zdravotník. | |
|
• Dle domluvy podávejte svému lékaři všechny | |
|
potřebné informace. |
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Určité nežádoucí účinky, jako jsou bolest hlavy, třesavka nebo bolesti těla, se mohou zpomalením rychlosti infuze zmírnit.
Závažné nežádoucí účinky
Infuze léků, jako je přípravek HyQvia, mohou někdy vést k závažným, ale vzácným alergickým reakcím. Může u Vás dojít k náhlému poklesu krevního tlaku a v izolovaných případech k anafylaktickému šoku. Lékaři jsou si těchto možných nežádoucích účinků vědomi a budou Vás při několika prvních infuzích i určitou dobu po nich pečlivě sledovat.
Mezi typické příznaky nebo symptomy patří:
pocit závrati, závrativost nebo mdloba; kožní vyrážka a svědění, otok v ústech nebo krku, ztížené dýchání, sípot; abnormální srdeční frekvence, bolest na hrudi, promodrání rtů nebo prstů na rukou a nohou; rozmazané vidění.
• Pokud během infuze zaznamenáte některý z těchto příznaků, okamžitě uvědomte svého lékaře nebo zdravotní sestru.
• Pokud užíváte přípravek HyQvia doma, musíte provést infuzi za přítomnosti určené dohlížející osoby, která Vám pomůže dávat pozor na alergické reakce, zastaví infuzi a podle potřeby přivolá pomoc.
• Podívejte se prosím také na bod 2 této příbalové informace týkající se rizik alergických reakcí a používání přípravku HyQvia doma.
Velmi časté nežádoucí účinky (mohou se vyskytnout u více než 1 z 10 infuzí):
Bolest v místě infuze, včetně mírného až středního pocitu nepohodlí a citlivosti. Tyto reakce obvykle do několika dnů odezní.
Časté nežádoucí účinky (mohou se vyskytnout až u 1z 10 infuzí):
Reakce v místě infuze: Tyto reakce zahrnují zarudnutí, otok, svědění, zvtrdnutí a vyrážku v místě infuze. Tyto reakce obvykle do několika dnů odezní. Bolesti hlavy, únava, nevolnost, zvracení, průjem, bolest břicha, bolest svalů nebo kloubů, bolest na hrudi, horečka, pocit slabosti nebo se pacient necítí dobře.
Méně časté nežádoucí účinky (mohou se vyskytnout až u 1 ze 100 infuzí):
Zimnice, migréna, zvýšení krevního tlaku, závrať, nadmutí břicha, kožní vyrážka / alergická vyrážka / zarudnutí, svědění, bolest na hrudi, v rukou a/nebo nohou, otok genitálu (kvůli rozšíření otoku z místa infuze), otok nohou, chodidel a kotníků, pozitivní krevní testy na protilátky.
Četnost není známa (z dostupných údajů nelze určit):
Přecitlivělost a onemocnění podobající se chřipce.
Nežádoucí účinky pozorované u podobných léků
Následující nežádoucí účinky byly pozorovány u infuzí léků podobných normálnímu lidskému imunoglobulinu 10% podávaných pod kůži (subkutánně). Ačkoli tyto nežádoucí účinky nebyly dosud u přípravku HyQvia pozorovány, je možné, že někdo užívající přípravek HyQvia je může dostat: Chvění, brnění v ústech, rychlé bušení srdce, alergické reakce, zrudnutí nebo bledost, pocit chladu rukou a chodidel, dýchavičnost, otok obličeje, nadměrné pocení, ztuhlost svalů, změna funkčních jaterních testů (zvýšená alaninaminotransferáza).
Následující vzácné nežádoucí účinky byly pozorovány u pacientů užívajících léky podobné normálnímu lidskému imunoglobulinu 10% podávané do žíly (intravenózně). Tyto účinky nebyly u přípravku HyQvia pozorovány, ale existuje malá pravděpodobnost, že někdo užívající přípravek HyQvia je může dostat:
Krevní sraženiny v cévách (tromboembolické reakce) vedoucí k srdečnímu infarktu, mozkové příhodě, blokádě hlubokých žil nebo cév zásobujících plíce (plicní embolie), renální poruchy nebo selhání, zánět mozkových obalů (aseptická meningitida), destrukce červených krvinek (hemolýza).
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek HyQvia uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku a obalu za značkou Použitelné do. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
Neprotřepávejte.
Uchovávejte injekční lahvičky v krabičce, aby byl přípravek chráněn před světlem.
Nepoužívejte tento léčivý přípravek, pokud jsou roztoky zakalené nebo obsahují částice nebo sraženiny.
Po otevření zlikvidujte veškeré nepoužité roztoky v injekčních lahvičkách.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
Obsah balení a další informace
6.
Co přípravek HyQvia obsahuje
Přípravek HyQvia je jednotka se dvěma injekčními lahvičkami obsahující:
- roztok rekombinantní lidské hyaluronidázy (Krok 1 přípravku HyQvia/Podejte jako první infuzi) a
- roztok normálního lidského imunoglobulinu 10% (Krok 2 přípravku HyQvia/Podejte jako druhou infuzi).
Obsah každé injekční lahvičky je popsán níže:
1. Rekombinantní lidská hyaluronidáza
Tato injekční lahvička obsahuje rekombinantní lidskou hyaluronidázu.
Další složky jsou chlorid sodný, hydrogenfosforečnan sodný, lidský albumin, disodium-edetát, chlorid vápenatý a voda na injekce (viz také bod 2. „Přípravek HyQvia obsahuje sodík“).
2. Normální lidský imunoglobulin 10%
Jeden ml roztoku v této injekční lahvičce obsahuje 100 mg normálního lidského imunoglobulinu, z nějž je nejméně 98 % imunoglobulin G (IgG).
Léčivou látkou přípravku HyQvia je normální lidský imunoglobulin. Tento léčivý přípravek obsahuje stopová množství imunoglobulinu A (IgA) (ne více než 140 mikrogramů/ml, 37 mikrogramů v průměru).
Dalšími složkami této injekční lahvičky jsou glycin a voda na injekce.
Jak přípravek HyQvia vypadá a co obsahuje toto balení
Přípravek HyQvia je dodáván jako balení obsahující:
- jednu skleněnou injekční lahvičku rekombinantní lidské hyaluronidázy a
- jednu skleněnou injekční lahvičku normálního lidského imunoglobulinu 10%.
Rekombinantní lidská hyaluronidáza je čirý a bezbarvý roztok.
Normální lidský imunoglobulin 10% je čirý a bezbarvý nebo bledě žlutý roztok.
K dispozici jsou následující velikosti balení:
|
Rekombinantní lidská hyaluronidáza |
Normální lidský imunoglobulin 10% | |
|
Objem (ml) |
Protein (gramů) |
Objem (ml) |
|
1,25 |
2,5 |
25 |
|
2,5 |
5 |
50 |
|
5 |
10 |
100 |
|
10 |
20 |
200 |
|
15 |
30 |
300 |
Na trhu nemusí být k dispozici všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobci
Držitel rozhodnutí o registraci:
Baxalta Innovations GmbH Industriestrasse 67 A-1221 Vídeň Rakousko
Výrobci:
Baxalta Belgium Manufacturing SA Boulevard René Branquart 80 B-7860 Lessines Belgie
Baxter SA
Boulevard René Branquart 80
B-7860 Lessines
Belgie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci
|
Belgie/Belgique/Belgien Baxalta Belgium SPRL Tél./Tel.: +32 2 892 62 00 |
Lietuva UAB Baxalta Lithuania Tel.: +370 852102822 |
|
Etarapnu EaKcaara Etarapna EOOfl Tea.: + 359 2 980 84 82 |
Luxembourg/Luxemburg Baxalta Belgium SPRL Tél./Tel.: +32 2 892 62 00 |
|
Česká republika Baxalta Czech spol.s r.o. Tel.: +420 225379700 |
Magyarország Baxalta Hungary Kft. Tel.: +36 1 202 1981 |
|
Danmark Baxalta Denmark A/S Tlf.: +45 32 70 12 00 |
Malta Baxalta UK Limited Tel.: +44 1 635 798 777 |
|
Deutschland Baxalta Deutschland GmbH Tel.: +49 89 262077-011 |
Nederland Baxalta Netherlands B.V. Tel.: +31 30 799 27 77 |
|
Eesti OU Baxalta Estonia Tel.: +372 6 515 140 |
Norge Baxalta Norway AS Tlf.: +47 22 585 000 |
|
EkXáSa Baxalta Hellas TqL: +30-210-27 80 000 |
Osterreich Baxalta Osterreich GmbH Tel.: +43 (0)1 20100-0 |
|
Espaňa Baxalta Spain S.L. Tel.: +34 91 790 42 22 |
Polska Baxalta Poland Sp. z o.o. Tel.: +48 22 223 03 00 |
|
France Baxalta France SAS Tél.: +33 1 70 96 06 00 |
Portugal Baxalta Portugal, Unipessoal, Lda. Tel.: +351 21 122 03 00 |
|
Hrvatska Baxalta d.o.o. Tel.: +386 1 420 1680 |
Románia Baxalta S.R.L. Tel.: +40 31 860 6200 |
|
Ireland Baxalta UK Limited Tel.: +44 1 635 798 777 |
Slovenija Baxalta d.o.o. Tel.: +386 1 420 1680 |
|
Ísland Icepharma hf. Sími: + 354-540-8000 |
Slovenská republika Baxalta Slovakia s.r.o. Tel.: +421 2 3211 5581 |
|
Italia Baxalta Italy S.r.l. Tel.: +39 06 45224 600 |
Suomi/Finland Baxalta Finland Oy Puh/Tel.: +358 201478200 |
|
Kónpoq Baxalta Hellas T nk.: +30-210-27 80 000 |
Sverige Baxalta Sweden AB Tel.: +46 8 50 53 26 00 |
|
Latvija SIA Baxter Latvia Tel.: +371 67784784 |
United Kingdom Baxalta UK Limited Tel.: +44 1 635 798 777 |
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese: http://www.ema.europa.eu.
44