Humalog 100 Iu/Ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Humalog 100 IU/ml, injekční roztok v injekční lahvičce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Humalog je sterilní, čirý, bezbarvý vodný roztok.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinum lisprum (původem z rekombinantní DNA produkované E.coli). Jeden obal obsahuje 10 ml, což odpovídá 1 000 U insulinum lisprum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Humalog je určen k léčbě dospělých a dětí s diabetem mellitus, kteří vyžadují inzulin k udržení normální glukózové homeostázy. Rovněž je indikován k iniciální stabilizaci diabetes mellitus.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem, v souladu s potřebami pacienta.
Humalog může být podán krátce před jídlem nebo v případě nutnosti záhy po jídle. Humalog by měl být aplikován pouze subkutánní injekcí nebo kontinuální subkutánní infúzí pomocí pumpy (viz bod 4.2), avšak může být, i když to není doporučováno, podán také intramuskulárně. V případě potřeby může být podán i intravenózně, např. je-li třeba kontrolovat glykémii při ketoacidóze, akutních onemocněních nebo během operace či v pooperačním období.
Místy subkutánního podání by měly být horní části paží, stehna, hýždě nebo břicho.Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Humalogu je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy.
Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Humalog účinkuje po subkutánním podání rychle a kratší dobu (2-5 hodin) ve srovnání s normálním lidským inzulinem. Tento rychlý nástup účinku dovoluje podávání injekce Humalogu (nebo bolusu Humalogu v případě kontinuální subkutánní infuze) velmi krátce před jídlem nebo po jídle. Časový průběh aktivity jakéhokoliv inzulinu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Rychlejší nástup účinku inzulinu lispro ve srovnání s normálním lidským inzulinem je zachován nezávisle na místě vpichu. Stejně jako u všech inzulinových přípravků závisí trvání účinku Humalogu na dávce, místě vpichu,krevním zásobení, teplotě a fyzické aktivitě.
Humalog může být dle rady lékaře aplikován v kombinaci s déle působícím inzulinem nebo s deriváty sulfonylurey.
Užití Humalogu v inzulínových infúzních pumpách
K infúzím inzulinu lispro je možno použít pouze určité inzulinové infúzní pumpy s označením CE. Před infuzí inzulinu lispro je třeba prostudovat instrukce výrobce, abyste se ujistili o vhodnosti dané pumpy. Řiďte se návodem k používání infuzní pumpy. Spolu s pumpou používejte správný zásobník a správný katetr. Infúzní set (katetr a kanyla) má být vyměňován podle pokynů uvedených v informaci o produktu dodané společně s infúzním setem. V případě hypoglykémie by měla být infuze přerušena až do odeznění hypoglykémie. Naměříte-li si výrazně nízké nebo opakovaně nízké hladiny glukózy v krvi, upozorněte svého lékaře a zvažte, zda není nutno infúzi inzulinu zpomalit či zastavit. Porucha pumpy nebo zneprůchodnění infúzního setu může způsobit náhlý vzestup hladiny glukózy. V případě podezření, že je průtok inzulinu přerušen, se řiďte pokyny v návodu k obsluze, případně uvědomte svého lékaře. Při používání inzulinové infúzní pumpy by nesmí být Humalog mísen s jinými inzuliny.
Intravenózní aplikace inzulinu
Intravenózní aplikace inzulinu lispro má být prováděna podle běžné klinické praxe, např. intravenózním bolusem nebo infuzí. Je nutná častá kontrola hladiny glukózy v krvi.
Infuzní roztok o koncentraci od 0,1 IU/ml do 1,0 IU/ml inzulinu lispro v 0,9% NaCl nebo 5% sacharóze je stabilní za pokojové teploty po dobu 48 hodin. Před zahájením infuze je doporučeno infuzní soupravu prostříknout.
4.3 Kontraindikace
Přecitlivělost na inzulin lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky ( výrobce), typu (regular, NPH, lente, aj.),druhu (zvířecí, lidský, analog lidského inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování. Každý pacient, který užívá kombinaci rychle působícího a bazálního inzulinu, musí optimalizovat dávkování obou těchto typů inzulinu k dosažení lepší kontroly glykémie po celý den, zejména v noci a na lačno.
Krátkodobě působící Humalog natáhněte do stříkačky jako první, aby se zabránilo kontaminaci lahvičky déle působícím inzulinem. Inzuliny smějí být míseny do zásoby nebo bezprostředně před použitím pouze na doporučení lékaře. Pokaždé postupujte stejným způsobem.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malý počet pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Užití neadekvátních dávek nebo přerušení léčby obzvlášť u inzulindependentních pacientů může vést k hyperglykémii a diabetické ketoacidóze, které jsou potenciálně letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulínu. U pacientů s chronickou jatemí insuficiencí může zvýšení inzulínové rezistence vést k vyšší potřebě inzulínu.
Potřeba inzulinu může být zvýšena během nemoci nebo při emocionálním rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po požití potravy může zvýšit riziko hypoglykémie. Nástup hypoglykémie v případě užití rychle působícího analogu humánního inzulinu může být z důvodu jeho farmakodynamiky rychlejší než při užití normálního lidského inzulinu.
Humalog by měl být u dětí přednostně použit pouze v případě, kdy je přínosem jeho rychlý nástup účinku, např. načasování injekce vzhledem k jídlu.
Kombinace přípravku Humalog s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Humalog.
Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulinu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako jsou perorální antidiabetika, salicyláty (například Acylpyrin, Aspirin), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Při užívání jiných léčiv podávaných současně s Humalogem by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
Kojící diabetičky mohou potřebovat úpravu dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být porušena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie.
Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti. Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu. Tento stav obvykle ustoupí během několika dnů nebo týdnů. V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000),ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulinem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože sérová hladina krevního cukru je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinu v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy nebo jiného cukru nebo produktu obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním uhlovodanů, pokud se pacient dostatečně zotavuje. Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, glukagon by měl být aplikován intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: rychle působící analog humánního inzulínu. ATC kód: A10AB04
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Inzulin lispro má rychlý nástup účinku (přibližně 15 minut) a tím umožňuje v porovnání s normálním inzulinem (aplikace 30 až 45 minut před jídlem) podání velmi krátce před jídlem nebo po jídle (interval od 0 do 15 minut). Nástup účinku inzulinu lispro je rychlý a doba aktivity kratší (2 až 5 hodin) ve srovnání s normálním inzulinem.
Klinické studie s pacienty s diabetem typu 1 nebo 2 prokázaly nižší výskyt postprandiální hyperglykémie u inzulinu lispro ve srovnání s normálním lidským inzulinem.
Stejně jako u všech inzulinových přípravků může být časový průběh aktivity inzulinu lispro odlišný u různých individuí nebo odlišný v různých časových obdobích u stejných individuí v závislosti na místě injekce, krevním zásobení, teplotě a fyzické aktivitě. Typický průběh aktivity v čase po subkutánní injekci ilustruje následující graf.
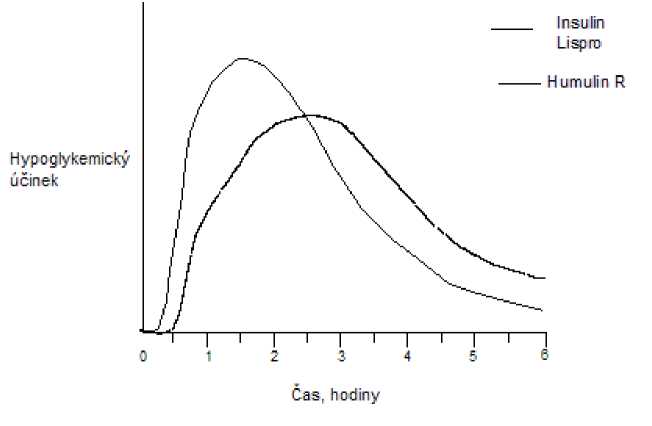
Graf odráží relativní množství glukózy v závislosti na čase potřebné k udržení celkové plasmatické glukózové koncentrace testovaného subjektu blízko hladinám nalačno a je indikátorem efektu těchto inzulinů na glukózový metabolismus v průběhu času.
Byly provedeny klinické studie u dětí (61 dětí ve věku 2 až 11 let) a u dětí a mladistvých (481 pacientů ve věku 9 až 19 let ) srovnávající inzulin lispro a normální lidský inzulin. Farmakodynamický profil inzulinu lispro u dětí je podobný jako farmakodynamický profil pozorovaný u dospělých.
Podávání inzulinu lispro subkutánní infuzní pumpou způsobuje nižší hladiny glykovaného hemoglobinu než při užití normálního lidského inzulinu. V dvojitě slepé překřížené studii došlo ke snížení hladiny glykovaného hemoglobinu po 12 týdnech o 0,37 procentního bodu u inzulinu lispro ve srovnání se snížením o 0,03 procentního bodu u normálního lidského inzulinu (p=0,004).
U pacientů s diabetem typu 2 s maximálními dávkami derivátů sulfonylurey studie ukázaly, že při kombinaci s inzulinem lispro se významně sníží hladina HbA1C ve srovnání se samotnou sulfonylureou. Snížení hladiny HbA1C lze očekávat rovněž při kombinaci s jinými přípravky inzulinu, např. normálním nebo isofan inzulinem.
Klinické studie s pacienty s diabetem typu 1 a 2 prokázaly nižší počet nočních hypoglykémií s inzulinem lispro ve srovnání s normálním lidským inzulinem. V některých studiích byl nižší počet nočních hypoglykémií spojen se zvýšeným počtem denních hypoglykémií.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Farmakokinetika inzulinu lispro odpovídá látce, která je rychle absorbována a dosahuje nejvyšších plasmatických hladin v době od 30 do 70 minut po subkutánní injekci. Při zvažování klinické relevance této kinetiky je třeba prozkoumat křivky utilizace glukózy ( viz 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován mnohem rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
metakresol [3,15 mg/ml] glycerol
heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Humalog nesmí být mísen se zvířecími inzuliny nebo inzuliny jiného výrobce.
Humalog nesmí být mísen s jinými přípravky kromě těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti
Neotevřená lahvička 3 roky.
Po _prvním užití 28 dnů
6.4 Zvláštní opatření pro uchovávání
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Neotevřená lahvička
Uchovávejte v chladničce (2°C - 8°C ).
Po _prvním užití
Uchovávejte v chladničce (2°C - 8°C ) nebo při teplotě do 30°C.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Roztok je plněn do injekčních lahviček z křemenného skla typ I utěsněných butylovou nebo halobutylovou zátkou a zabezpečených hliníkovým krytem. K ošetření zátky může být použit dimethicon nebo silikonová emulze.
Na trhu nemusí být všechny velikosti balení.
1x10 ml Humalog injekční lahvička.
2x10 ml Humalog injekční lahvička.
5x(1x10) ml Humalog injekční lahvička.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Injekční lahvičku používejte s vhodnou stříkačkou označenou 100 U.
a) Příprava dávky
Zkontrolujte Humalog. Roztok by měl být čirý a bezbarvý. Nepoužívejte Humalog, pokud se jeví zakalený, zahuštěný nebo lehce zabarvený nebo pokud jsou v něm viditelné pevné částice.
i) Humalog
1. Umyjte si ruce.
2. Načínáte-li novou injekční lahvičku, odstraňte ochranný plastový kryt, ale neodstraňujte zátku.
3. Jestliže léčebný režim vyžaduje injekci bazálního inzulinu i Humalogu zároveň, mohou být tyto dva inzuliny smíchány v injekční stříkačce. Pokud inzuliny mícháte, sledujte instrukce pro mísení, které následují v bodě ii a 6.2.
4. Do stříkačky natáhněte množství vzduchu shodné s množstvím Humalogu , které budete aplikovat. Horní část injekční lahvičky otřete tamponem napuštěným v lihu. Jehlu vbodněte do gumové horní části lahvičky Humalogu a vzduch ze stříkačky vtlačte do lahvičky.
5. Lahvičku se stříkačkou otočte dnem vzhůru. Držte je pevně v jedné ruce.
6. Přesvědčte se, že je špička jehly v Humalogu a potřebnou dávku natáhněte do stříkačky.
7. Předtím, než vytáhnete jehlu z lahvičky, se přesvědčte, zda ve stříkačce nejsou vzduchové bubliny, které snižují množství Humalogu v ní. Pokud jsou bubliny přítomny, držte stříkačku vzhůru a poklepávejte na její stěnu, dokud bubliny nevyplavou nahoru. Vytlačte je ze stříkačky pístem ven a natáhněte správnou dávku.
8. Vytáhněte jehlu z lahvičky a položte ji tak, aby se jehla ničeho nedotýkala.
ii) Míchání Humalogu s déle působícími humánními inzuliny (viz bod 6.2).
1. Humalog smí být mísen s déle působícími humánními inzuliny pouze na doporučení lékaře.
2. Do stříkačky natáhněte množství vzduchu odpovídající dávce déle působícího inzulinu. Vbodněte jehlu do lahvičky s déle působícím inzulinem a injikujte vzduch dovnitř. Jehlu vytáhněte ven.
3. Nyní stejným způsobem injikujte vzduch do lahvičky s Humalogem, ale nevytahujte jehlu.
4. Otočte lahvičku i se stříkačkou dnem vzhůru.
5. Ujistěte se, že špička jehly je v Humalogu a natáhněte správnou dávku do stříkačky.
6. Předtím, než vytáhnete jehlu z lahvičky, se přesvědčte, zda ve stříkačce nejsou vzduchové bubliny, které snižují množství Humalogu v ní. Pokud jsou bubliny přítomny, držte stříkačku vzhůru a poklepávejte na její stěnu, dokud bubliny nevyplavou nahoru. Vytlačte je ze stříkačky ven a natáhněte správnou dávku.
7. Vytáhněte jehlu z lahvičky s Humalogem a vbodněte ji do lahvičky s déle působícím inzulinem. Otočte lahvičku i se stříkačkou dnem vzhůru. Lahvičku i stříkačku držte pevně
v jedné ruce a lehce jimi potřásejte. Ujistěte se, že špička jehly je ponořena v inzulinu a poté natáhněte dávku déle působícího inzulinu.
8. Vytáhněte jehlu z lahvičky a položte stříkačku tak, aby se jehla ničeho nedotýkala.
b) Aplikace dávky
1. Vyberte místo vpichu.
2. Očistěte kůži podle pokynů.
3. Stabilizujte kůži tak, že ji buďto napnete, nebo vytvoříte větší kožní řasu. Jehlu vbodněte do kůže a aplikujte Humalog podle instrukce.
4. Vytáhněte jehlu a místo vpichu několik sekund jemně tiskněte. Místo nemasírujte.
5. Jehlu a stříkačku bezpečně znehodnoťte.
6. Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito v průměru vícekrát než jednou za měsíc.
c) Mísení inzulinů
Nemíchejte inzulin v lahvičkách s inzulinem v zásobních vložkách. Viz bod 6.2.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/96/007/002 1x10 ml Humalog injekční lahvička
EU/1/96/007/020 2x10 ml Humalog injekční lahvička
EU/1/96/007/021 5x(1x10 ml) Humalog injekční lahvička
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 30. dubna 1996 Datum prodloužení registrace: 30. dubna 2006
10. DATUM REVIZE TEXTU
NÁZEV PŘÍPRAVKU
1.
Humalog 100 IU/ml, injekční roztok v zásobní vložce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Humalog je sterilní, čirý, bezbarvý vodný roztok.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinum lisprum (původem z rekombinantní DNA produkované E.coli). Jeden obal obsahuje 3 ml, což odpovídá 300 U insulinum lisprum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Humalog je určen k léčbě dospělých a dětí s diabetem mellitus, kteří vyžadují inzulin k udržení normální glukózové homeostázy. Rovněž je indikován k iniciální stabilizaci diabetes mellitus.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem, v souladu s potřebami pacienta.
Humalog může být podán krátce před jídlem nebo po jídle. Humalog by měl být aplikován pouze subkutánní injekcí nebo kontinuální subkutánní infuzí pomocí pumpy (viz bod 4.2), avšak může být, i když to není doporučováno, podán také intramuskulárně. V případě potřeby může být podán i intravenózně, např. je-li třeba kontrolovat glykémii při ketoacidóze, akutních onemocněních nebo během operace či v pooperačním období.
Místy subkutánního podání by měly být horní části paží, stehna, hýždě nebo břicho.Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Humalogu je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy.
Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Humalog účinkuje po subkutánním podání rychle a kratší dobu (2-5 hodin) ve srovnání s normálním lidským inzulinem. Tento rychlý nástup účinku dovoluje podávání injekce Humalogu (nebo bolusu Humalogu v případě kontinuální subkutánní infúze) velmi krátce před jídlem nebo po jídle. Časový průběh aktivity jakéhokoliv inzulinu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Rychlejší nástup účinku inzulinu lispro ve srovnání s normálním lidským inzulinem je zachován nezávisle na místě vpichu. Stejně jako u všech inzulinových přípravků závisí trvání účinku Humalogu na dávce, místě vpichu,krevním zásobení, teplotě a fyzické aktivitě.
Humalog může být dle rady lékaře aplikován v kombinaci s déle působícím inzulinem nebo s deriváty sulfonylurey.
Užití Humalogu v inzulínových infúzních pumpách
K infúzím inzulinu lispro je možno použít pouze určité inzulinové infuzní pumpy s označením CE. Před infuzí inzulinu lispro je třeba prostudovat instrukce výrobce, abyste se ujistili o vhodnosti dané pumpy. Řiďte se návodem k používání infuzní pumpy. Spolu s pumpou používejte správný zásobník a správný katetr. Infúzní set (katetr a kanyla) má být vyměňován podle pokynů uvedených v informaci o produktu dodané společně s infuzním setem. V případě hypoglykémie by měla být infuze přerušena až do odeznění hypoglykémie. Naměříte-li si výrazně nízké nebo opakovaně nízké hladiny glukózy v krvi, upozorněte svého lékaře a zvažte, zda není nutno infúzi inzulinu zpomalit či zastavit. Porucha pumpy nebo inf.setu může způsobit náhlý vzestup hladiny glukózy. V případě podezření, že je průtok inzulinu přerušen, se řiďte pokyny v návodu k obsluze, případně uvědomte svého lékaře. Při používání inzulinové infúzní pumpy nesmí být Humalog mísen s jinými inzuliny.
Intravenózní aplikace inzulinu.
Intravenózní aplikace inzulinu lispro má být prováděna podle běžné klinické praxe, např. intravenózním bolusem nebo infuzí. Je nutná častá kontrola hladiny glukózy v krvi.
Infuzní roztok o koncentraci od 0,1 IU/ml do 1,0 IU/ml inzulinu lispro v 0,9% NaCl nebo 5% sacharóze je stabilní za pokojové teploty po dobu 48 hodin. Před zahájením infuze je doporučeno infuzní soupravu prostříknout.
4.3 Kontraindikace
Přecitlivělost na inzulin lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky ( výrobce), typu (regular, NPH, lente, aj.),druhu (zvířecí, lidský, analog lidského inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování. Každý pacient, který užívá kombinaci rychle působícího a bazálního inzulinu, musí optimalizovat dávkování obou těchto typů inzulinu k dosažení lepší kontroly glykémie po celý den, zejména v noci a na lačno.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malý počet pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Užití neadekvátních dávek nebo přerušení léčby obzvlášť u inzulindependentních pacientů může vést k hyperglykémii a diabetické ketoacidóze, které jsou potenciálně letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo při emocionálním rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po požití potravy může zvýšit riziko hypoglykémie.
Nástup hypoglykémie v případě užití rychle působícího analogu humánního inzulínu může být z důvodu jeho farmakodynamiky rychlejší než při užití normálního lidského inzulínu.
Je-li předepsána injekční lahvička 40 IU/ml, nenatahujte inzulín ze zásobní vložky 100 IU/ml pomocí 40 IU/ml stříkačky.
Humalog by měl být u dětí přednostně použit pouze v případě, kdy je přínosem jeho rychlý nástup účinku, např. načasování injekce vzhledem k jídlu.
Kombinace přípravku Humalog s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Humalog.
Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem, a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulinu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako jsou perorální antidiabetika, salicyláty (například Acylpyrin, Aspirin), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Při užívání jiných léčiv podávaných současně s Humalogem by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
Kojící diabetičky mohou potřebovat úpravu dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být porušena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie.
Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu. Tento stav obvykle ustoupí během několika dnů nebo týdnů. V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000),ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulinem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože sérová hladina krevního cukru je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinu v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy nebo jiného cukru nebo produktu obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním uhlovodanů, pokud se pacient dostatečně zotavuje. Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, glukagon by měl být aplikován intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: rychle působící analog humánního inzulínu. ATC kód: A10AB04
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Inzulin lispro má rychlý nástup účinku (přibližně 15 minut) a tím umožňuje v porovnání s normálním inzulinem (aplikace 30 až 45 minut před jídlem) podání velmi krátce před jídlem nebo po jídle (interval od 0 do 15 minut). Nástup účinku inzulinu lispro je rychlý a doba aktivity kratší (2 až 5 hodin) ve srovnání s normálním inzulinem.
Klinické studie s pacienty s diabetem typu 1 nebo 2 prokázaly nižší výskyt postprandiální hyperglykémie u inzulinu lispro ve srovnání s normálním lidským inzulinem.
Stejně jako u všech inzulinových přípravků může být časový průběh aktivity inzulinu lispro odlišný u různých individuí nebo odlišný v různých časových obdobích u stejných individuí v závislosti na místě injekce, krevním zásobení, teplotě a fyzické aktivitě. Typický průběh aktivity v čase po subkutánní injekci ilustruje následující graf.
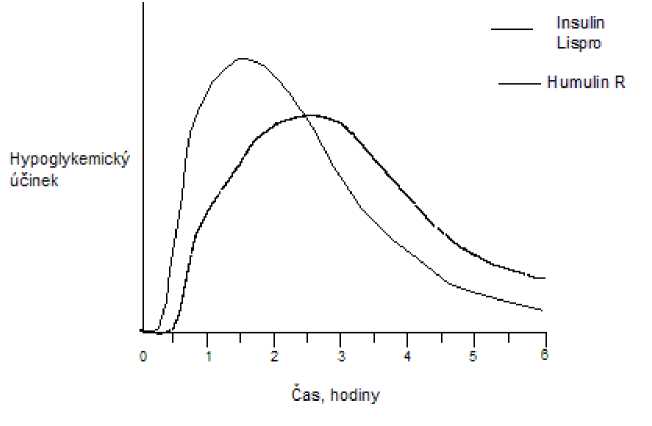
Graf odráží relativní množství glukózy v závislosti na čase potřebné k udržení celkové plasmatické glukózové koncentrace testovaného subjektu blízko hladinám nalačno a je indikátorem efektu těchto inzulinů na glukózový metabolismus v průběhu času.
Byly provedeny klinické studie u dětí (61 dětí ve věku 2 až 11 let) a u dětí a mladistvých (481 pacientů ve věku 9 až 19 let ) srovnávající inzulin lispro a normální lidský inzulin. Farmakodynamický profil inzulinu lispro u dětí je podobný jako farmakodynamický profil pozorovaný u dospělých.
Podávání inzulinu lispro subkutánní infúzní pumpou způsobuje nižší hladiny glykovaného hemoglobinu než při užití normálního lidského inzulinu. V dvojitě slepé překřížené studii došlo ke snížení hladiny glykovaného hemoglobinu po 12 týdnech o 0,37 procentního bodu u inzulinu lispro ve srovnání se snížením o 0,03 procentního bodu u normálního lidského inzulinu (p=0,004).
U pacientů s diabetem typu 2 s maximálními dávkami derivátů sulfonylurey studie ukázaly, že při kombinaci s inzulinem lispro se významně sníží hladina HbA1C ve srovnání se samotnou sulfonylureou. Snížení hladiny HbA1C lze očekávat rovněž při kombinaci s jinými přípravky inzulinu, např. normálním nebo isofan inzulinem.
Klinické studie s pacienty s diabetem typu 1 a 2 prokázaly nižší počet nočních hypoglykémií s inzulinem lispro ve srovnání s normálním lidským inzulinem. V některých studiích byl nižší počet nočních hypoglykémií spojen se zvýšeným počtem denních hypoglykémií.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Farmakokinetika inzulinu lispro odpovídá látce, která je rychle absorbována a dosahuje nejvyšších plasmatických hladin v době od 30 do 70 minut po subkutánní injekci. Při zvažování klinické relevance této kinetiky je třeba prozkoumat křivky utilizace glukózy ( viz 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován mnohem rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
metakresol [3,15 mg/ml]
glycerol, heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Humalog nesmí být mísen se zvířecími inzuliny nebo inzuliny jiného výrobce.
6.3 Doba použitelnosti
Nepoužitá zásobní vložka 3 roky.
Po založení zásobní vložky 28 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužitá zásobní vložka
Uchovávejte v chladničce (2°C - 8°C). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po založení zásobní vložky
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zváštní vybavení pro použití, podání nebo implantaci
Roztok je plněn do zásobních vložek z křemenného skla typ I utěsněných butylovou nebo halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze.
Na trhu nemusí být všechny velikosti balení.
5x3 ml Humalog zásobní vložky pro 3ml pero 2x(5x3 ml) Humalog zásobní vložky pro 3ml pero
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem, a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
Humalog zásobní vložky mají být používány s pery označenými CE na doporučení výrobce pera.
a) Příprava dávky
Zkontrolujte Humalog. Měl by být čirý a bezbarvý. Nepoužívejte Humalog, pokud se jeví zakalený, zahuštěný nebo lehce zabarvený nebo pokud jsou v něm viditelné pevné částice.
Následuje obecný popis použití. U každého jednotlivého pera je nutno respektovat instrukce od výrobce k založení zásobní vložky, připojení jehly a aplikaci injekce inzulinu.
b) Aplikace dávky
1. Umyjte si ruce.
2. Vyberte místo vpichu.
3. Očistěte kůži podle instrukcí.
4. Odstraňte vněj ší ochranný kryt j ehly.
5. Stabilizujte kůži tak, že ji buďto napnete nebo vytvoříte větší kožní řasu. Jehlu vbodněte podle instrukce
6. Zmáčkněte dávkovací tlačítko.
7. Vytáhněte jehlu a místo vpichu několik sekund jemně stiskněte. Místo nemasírujte.
8. S pomocí vnějšího ochranného krytu jehlu odšroubujte a bezpečně znehodnoťte.
9. Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito v průměru víckrát než jednou za měsíc.
c) Mísení inzulinů
Nemíchejte inzulin v lahvičkách s inzulinem v zásobních vložkách. Viz bod 6.2.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/96/007/004 5x3 ml Humalog zásobní vložky pro 3ml pero
EU/1/96/007/023 2x(5x3 ml) Humalog zásobní vložky pro 3ml pero
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 30. dubna 1996 Datum prodloužení registrace: 30. dubna 2006
10. DATUM REVIZE TEXTU
NÁZEV PŘÍPRAVKU
1.
Humalog Mix25 100 IU/ml injekční suspenze v injekční lahvičce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Humalog Mix25 je bílá, sterilní suspenze.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinum lisprum (původem z rekombinantní DNA produkované E.coli).
Jeden obal obsahuje 10 ml, což odpovídá 1 000 U insulinum lisprum.
Humalog Mix25 obsahuje 25% roztoku insulinum lisprum a 75% suspenze insulinum lisprum isophanum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Humalog Mix25 je určen k léčbě pacientů s diabetem mellitus, kteří potřebují inzulin k udržení normální glukózové homeostázy.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem v souladu s potřebami pacienta.
Humalog Mix25 může být podán krátce před jídlem, v případě nutnosti může být Humalog Mix25 podán i bezprostředně po jídle. Humalog Mix25 má být aplikován pouze subkutánní injekcí, za žádných okolností nesmí být Humalog Mix25 podán intravenózně.
Umístění vpichů by mělo být v horní části paží, na stehnech, hýždích nebo břiše. Místa vpichu mají být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Humalog Mix25 je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Po subkutánní aplikaci Humalog Mix25 dochází k rychlému nástupu účinku Humalog Mix25 a časnému dosažení jeho vrcholu. To umožňuje podání Humalog Mix25 v těsné časové souvislosti s jídlem. Trvání účinku složky inzulin lispro protamin suspenze (BASAL) přípravku Humalog Mix25 je velice podobné účinku bazálního inzulinu (NPH). Časový průběh aktivity jakéhokoliv inzulinu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Stejně jako u všech inzulínových přípravků závisí trvání účinku Humalog Mix25 na dávce, místě vpichu,krevním zásobení, teplotě a fyzické aktivitě.
4.3 Kontraindikace
Přecitlivělost na inzulín lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Humalog Mix25 nesmí být za žádných okolností podán intravenózně.
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente, aj.), druhu (zvířecí, humánní, analog humánního inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malé množství pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Použití nedostatečných dávek nebo přerušení léčby, zvláště u inzulin-dependentních diabetiků, může vést k hyperglykémii a diabetické ketoacidóze; stavům, které mohou být letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo vlivem emocionálních rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po jídle může zvýšit riziko hypoglykémie.
Podání inzulinu lispro dětem mladším 12 let by mělo být zváženo pouze v případě očekávaného přínosu v porovnání s normálním inzulinem.
Kombinace přípravku Humalog Mix25 s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Humalog Mix25. Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulinu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulínu může být snížena při podávání léků s hypoglykemickým účinkem, jako j sou perorální antidiabetika, salicyláty (například kys. acetylsalicylová), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Mísení Humalog Mix25 s jinými inzuliny nebylo zkoumáno.
Při užívání jiných léčiv podávaných současně s Humalog Mix25 by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
U kojících diabetiček může vzniknout potřeba úpravy dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být zhoršena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu.Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000), ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulinem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože glykémie je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinové aktivity v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy, jiného cukru nebo výrobku obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním sacharidů, pokud se pacient dostatečně zotavuje.
Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, měl by být aplikován glukagon intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: ATC kód: A10AD04
Humalog Mix25 je předmísená suspenze, obsahující inzulin lispro (rychle působící analog humánního inzulinu) a inzulin lispro protamin suspenzi (střednědobě působící analog humánního inzulinu).
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Rychlý nástup účinku inzulinu lispro (přibližně 15 minut) umožňuje jeho podání v těsné časové souvislosti s jídlem (v rozmezí 0 až 15 minut kolem jídla) ve srovnání s běžným rychle působícím inzulinem (30 až 45 minut před jídlem). Po subkutánní aplikaci Humalog Mix25 dochází k rychlému nástupu účinku a časnému dosažení jeho vrcholu. Profil účinku přípravku Humalog BASAL je velice podobný účinku bazálního inzulinu (NPH) a přetrvává přibližně 15 hodin.
Klinické studie s pacienty s diabetem typu 1 nebo 2 prokázaly nižší výskyt postprandiální hyperglykémie u Humalogu Mix25 ve srovnání se směsí normálního lidského inzulinu 30/70. V jedné klinické studii došlo k malému (0,38 mmol/l) zvýšení noční hladiny glukózy v krvi ( 3:00).
Na následujícím obrázku je zobrazena farmakodynamika Humalogu Mix25 a BASAL.
Hypoglykemická
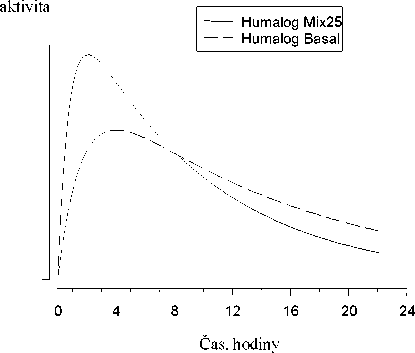
Výše uvedený graf ukazuje v čase relativní množství glukózy potřebné k udržení glykémie blízko hodnot nalačno. Je indikátorem účinku výše uvedených inzulinů na metabolismus glukózy v čase.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
Ve dvou 8měsíčních otevřených zkřížených studiích u pacientůs diabetem 2. typu, kteří dosud nebyli léčeni inzulinem, nebo si již aplikovali inzulin jednou nebo dvakrát denně, byli pacienti randomizováni ke 4 měsícům léčby Humalogem Mix25 (užívaným dvakrát denně s metforminem) a inzulinem glargin (užívaným jednou denně s metforminem) v náhodném pořadí. Detailní informace lze nalézt v následující tabulce.
|
Pacienti dosud neléčení inzulinem n=78 |
Pacienti již dříve léčení inzulinem n=97 | |
|
Průměrná celková denní dávka inzulinu při ukončení léčby |
0,63 U/kg |
0,42 U/kg |
|
Redukce hemoglobinu A1c1 |
1,30% (průměr při zahájení léčby 8,7%) |
1,00% (průměr při zahájení léčby 8,5%) |
|
Redukce průměrné kombinované ranní /večerní 2hodinové postprandiální glykémie1 |
3,46 mM |
2,48 mM |
|
Redukce průměrné glykémie nalačno1 |
0,55 mM |
0,65 mM |
|
Výskyt hypoglykémie při ukončení léčby |
25% |
25% |
|
Váhový přírůstek2 |
2,33 kg |
0,96 kg |
1
2
od výchozího stavu do ukončení léčby přípravkem Humalog Mix25
u pacientů užívajících přípravek Humalog Mix25 v průběhu první fáze překřížené léčby
5.2 Farmakokinetické vlastnosti
Dle farmakokinetických vlastností je inzulin lispro sloučenina, která se rychle vstřebává a dosahuje maximálních hladin v krvi 30 až 70 minut po subkutánním podání. Farmakokinetika inzulin lispro protamin suspenze se neliší od střednědobě působících inzulinů jako je NPH. Farmakokinetika přípravku Humalog Mix25 reprezentuje individuální farmakokinetické vlastnosti jeho dvou složek. Vezmeme-li v úvahu klinický význam těchto kinetik, je vhodnější zkoumat křivky utilizace glukózy. (viz bod 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován mnohem rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Protamin-sulfát
metakresol [1,76 mg/ml]
fenol [0,80 mg/ml], glycerol
heptahydrát hydrogenfosforečnanu sodného
oxid zinečnatý, voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Mísení Humalog Mix25 s jinými inzuliny nebylo zkoumáno. Pro nedostatek studií nesmí být tento přípravek mísen s jinými léky.
6.3 Doba použitelnosti
Neotevřená lahvička 3 roky.
Po _prvním užití 28 dnů
6.4 Zvláštní opatření pro uchovávání
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Neotevřená lahvička
Uchovávejte v chladničce (2°C - 8°C ).
Po _prvním užití
Uchovávejte v chladničce (2°C - 8°C ) nebo při teplotě do 30°C.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Suspenze je plněna do injekčních lahviček z křemenného skla typ I utěsněných butylovou nebo halobutylovou zátkou a zabezpečených hliníkovým krytem. K ošetření zátky může být použit dimethicon nebo silikonová emulze.
1 x 10 ml Humalog Mix25 injekční lahvička.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Injekční lahvičky mají být používány se stříkačkou odpovídající velikosti (značení 100U).
a) Příprava dávky
Bezprostředně před použitím by injekční lahvičky obsahující Humalog Mix25 měly být promíchány válením v dlaních k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování. Lahvičky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně lahvičky, která tím získává matový vzhled.
Humalog Mix25
1. Umyjte si ruce.
2. Načínáte-li novou injekční lahvičku, odstraňte ochranné plastové víčko, ale neodstraňujte zátku.
2. Do stříkačky natáhněte množství vzduchu shodné s množstvím Humalog Mix25, které budete aplikovat. Zátku injekční lahvičky otřete tamponem napuštěným v lihu. Jehlu vbodněte do lahvičky Humalog Mix25 a vzduch ze stříkačky vtlačte do lahvičky.
4. Lahvičku se stříkačkou otočte dnem vzhůru. Držte je pevně v jedné ruce.
5. Přesvědčte se, že je špička jehly v Humalog Mix25 a potřebnou dávku natáhněte do stříkačky.
6. Před vytažením jehly z lahvičky zkontrolujte, zda nejsou ve stříkačce bubliny, dávka Humalog Mix25 by byla nižší. V takovém případě držte stříkačku vzhůru a poklepávejte na její stěnu, dokud bubliny nevyplavou nahoru. Vytlačte je ze stříkačky ven a natáhněte správnou dávku.
7. Vytáhněte stříkačku z lahvičky a položte ji tak, aby se jehla ničeho nedotýkala.
b) Aplikace dávky
1. Vyberte místo vpichu.
2. Očistěte kůži, jak jste byli poučeni.
3. Stabilizujte kůži tak, že ji buďto napnete nebo vytvoříte větší kožní řasu. Jehlu vbodněte do kůže a aplikujte dávku podle instrukce.
4. Vytáhněte jehlu a místo vpichu několik sekund jemně tiskněte. Místo nemasírujte.
5. Jehlu a stříkačku bezpečně znehodnoťte.
6. Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito v průměru vícekrát než jednou za měsíc.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLO
EU/1/96/007/005
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 30. dubna 1996 Datum prodloužení registrace: 30. dubna 2006
10. DATUM REVIZE TEXTU
NÁZEV PŘÍPRAVKU
1.
Humalog Mix25 100 IU/ml injekční suspenze v zásobní vložce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Humalog Mix25 je bílá, sterilní suspenze.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinům lisprum (původem z rekombinantní DNA produkované E.coli).
Jeden obal obsahuje 3 ml, což odpovídá 300 U insulinum lisprum.
Humalog Mix25 obsahuje 25% roztoku insulinum lisprum a 75% suspenze insulinum lisprum isophanum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Humalog Mix25 je určen k léčbě pacientů s diabetem mellitus, kteří potřebují inzulin k udržení normální glukózové homeostázy.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem v souladu s potřebami pacienta.
Humalog Mix25 může být podán krátce před jídlem, v případě nutnosti může být Humalog Mix25 podán i bezprostředně po jídle. Humalog Mix25 má být aplikován pouze subkutánní injekcí, za žádných okolností nesmí být Humalog Mix25 podán intravenózně.
Umístění vpichů by mělo být v horní části paží, na stehnech, hýždích nebo břiše. Místa vpichu mají být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Humalog Mix25 je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Po subkutánní aplikaci Humalog Mix25 dochází k rychlému nástupu účinku Humalogu a časnému dosažení jeho vrcholu. To umožňuje podání Humalog Mix25 v těsné časové souvislosti s jídlem. Trvání účinku složky inzulin lispro protamin suspenze (BASAL) přípravku Humalog Mix25 je velice podobné účinku bazálního inzulinu (NPH).
Časový průběh aktivity jakéhokoliv inzulínu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Stejně jako u všech inzulínových přípravků závisí trvání účinku Humalog Mix25 na dávce, místě vpichu, krevním zásobení, teplotě a fyzické aktivitě.
4.3 Kontraindikace
Přecitlivělost na inzulín lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Humalog Mix25 nesmí být za žádných okolností podán intravenózně.
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente, aj.), druhu (zvířecí, humánní, analog humánního inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malé množství pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Použití nedostatečných dávek nebo přerušení léčby, zvláště u inzulin-dependentních diabetiků, může vést k hyperglykémii a diabetické ketoacidóze; stavům, které mohou být letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo vlivem emocionálních rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po jídle může zvýšit riziko hypoglykémie.
Podání inzulinu lispro dětem mladším 12 let by mělo být zváženo pouze v případě očekávaného přínosu v porovnání s normálním inzulinem.
Kombinace přípravku Humalog Mix25 s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Humalog Mix25. Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem, a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulínu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako jsou perorální antidiabetika, salicyláty (například kys. acetylsalicylová), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Mísení Humalog Mix25 s jinými inzuliny nebylo zkoumáno.
Při užívání jiných léčiv podávaných současně s Humalog Mix25 by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
U kojících diabetiček může vzniknout potřeba úpravy dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být zhoršena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu.Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000), ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulínem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože glykémie je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinové aktivity v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy, jiného cukru nebo výrobku obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním sacharidů, pokud se pacient dostatečně zotavuje.
Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, měl by být aplikován glukagon intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: ATC kód: A10AD04
Humalog Mix25 je předmísená suspenze, obsahující inzulin lispro (rychle působící analog humánního inzulinu) a inzulin lispro protamin suspenzi (střednědobě působící analog humánního inzulinu).
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Rychlý nástup účinku inzulinu lispro (přibližně 15 minut) umožňuje jeho podání v těsné časové souvislosti s jídlem (v rozmezí 0 až 15 minut kolem jídla) ve srovnání s běžným rychle působícím inzulinem (30 až 45 minut před jídlem). Po subkutánní aplikaci Humalog Mix25 dochází k rychlému nástupu účinku a časnému dosažení jeho vrcholu. Profil účinku přípravku Humalog BASAL je velice podobný účinku bazálního inzulinu (NPH) a přetrvává přibližně 15 hodin.
Klinické studie s pacienty s diabetem typu 1 nebo 2 prokázaly nižší výskyt postprandiální hyperglykémie u Humalogu Mix25 ve srovnání se směsí normálního lidského inzulinu 30/70. V jedné klinické studii došlo k malému (0,38 mmol/l) zvýšení noční hladiny glukózy v krvi ( 3:00).
Na následujícím obrázku je zobrazena farmakodynamika Humalogu Mix25 a BASAL.
Hypoglykemická
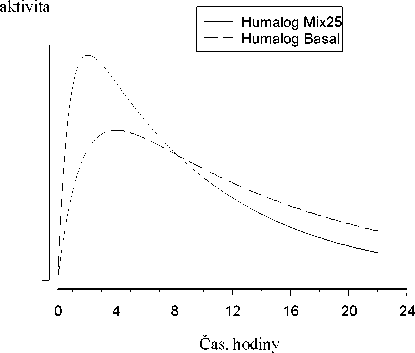
Výše uvedený graf ukazuje v čase relativní množství glukózy potřebné k udržení glykémie blízko hodnot nalačno. Je indikátorem účinku výše uvedených inzulinů na metabolismus glukózy v čase.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
Ve dvou 8měsíčních otevřených zkřížených studiích u pacientů s diabetem 2. typu, kteří dosud nebyli léčeni inzulinem, nebo si již aplikovali inzulin jednou nebo dvakrát denně, byli pacienti randomizováni ke 4 měsícům léčby Humalogem Mix25 (užívaným dvakrát denně s metforminem) a inzulinem glargin (užívaným jednou denně s metforminem) v náhodném pořadí. Detailní informace lze nalézt v následující tabulce.
|
Pacienti dosud neléčení inzulinem n=78 |
Pacienti již dříve léčení inzulinem n=97 | |
|
Průměrná celková denní dávka inzulinu při ukončení léčby |
0,63 U/kg |
0,42 U/kg |
|
Redukce hemoglobinu A1c1 |
1,30% (průměr při zahájení léčby 8,7%) |
1,00% (průměr při zahájení léčby 8,5%) |
|
Redukce průměrné kombinované ranní /večerní 2hodinové postprandiální glykémie1 |
3,46 mM |
2,48 mM |
|
Redukce průměrné glykémie nalačno1 |
0,55 mM |
0,65 mM |
|
Výskyt hypoglykémie při ukončení léčby |
25% |
25% |
|
Váhový přírůstek2 |
2,33kg |
0,96 kg |
1
2
od výchozího stavu do ukončení léčby přípravkem Humalog Mix25
u pacientů užívajících přípravek Humalog Mix25 v průběhu první fáze překřížené léčby
5.2 Farmakokinetické vlastnosti
Dle farmakokinetických vlastností je inzulín lispro sloučenina, která se rychle vstřebává a dosahuje maximálních hladin v krvi 30 až 70 minut po subkutánním podání. Farmakokinetika inzulin lispro protamin suspenze se neliší od střednědobě působících inzulinů jako je NPH. Farmakokinetika přípravku Humalog Mix25 reprezentuje individuální farmakokinetické vlastnosti jeho dvou složek. Vezmeme-li v úvahu klinický význam těchto kinetik, je vhodnější zkoumat křivky utilizace glukózy. (viz bod 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován mnohem rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Protamin-sulfát
metakresol [1,76 mg/ml]
fenol [0,80 mg/ml], glycerol
heptahydrát hydrogenfosforečnanu sodného
oxid zinečnatý
voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Mísení Humalog Mix25 s jinými inzuliny nebylo zkoumáno. Pro nedostatek studií nesmí být tento přípravek mísen s jinými léky.
6.3 Doba použitelnosti
Nepoužitá zásobní vložka 3 roky.
Po založení zásobní vložky 28 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužitá zásobní vložka
Uchovávejte v chladničce (2°C - 8°C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po založení zásobní vložky
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Suspenze je plněna do zásobních vložek z křemenného skla typ I utěsněných butylovou nebo halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze.
Na trhu nemusí být všechny velikosti balení.
5x 3 ml Humalog Mix25 zásobní vložky do 3ml pera 2x(5x3 ml) Humalog Mix25 zásobní vložky do 3ml pera
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem, a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
Humalog Mix25 zásobní vložky mají být používány s pery označenými CE na doporučení výrobce pera.
a) Příprava dávky
Bezprostředně před použitím by zásobní vložky obsahující Humalog Mix25 měly být desetkrát promíchány válením v dlaních a desetkrát převráceny o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování.
Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled.
V zásobní vložce nelze míchat Humalog Mix25 s jinými inzulíny. Vložky nelze znovu plnit.
Následuje obecný popis použití. U každého jednotlivého pera je nutno respektovat instrukce od výrobce k založení zásobní vložky, připojení jehly a aplikaci injekce inzulinu.
b) Aplikace dávky
1. Umyjte si ruce.
2. Vyberte místo vpichu.
3. Očistěte kůži, jak jste byli poučeni.
4. Odstraňte vněj ší kryt j ehly.
5. Stabilizujte kůži tak, že ji buď napnete, nebo vytvoříte větší kožní řasu. Jehlu vbodněte podle instrukce.
6. Zmáčkněte dávkovací tlačítko.
7. Vytáhněte jehlu a místo vpichu několik vteřin jemně stiskněte. Místo nemasírujte.
8. S pomocí vnějšího krytu jehlu odšroubujte a bezpečně znehodnoťte.
9. Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito v průměru víckrát než jednou za měsíc.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/96/007/008 5x3 ml Humalog Mix25 zásobní vložky do 3ml pera
EU/1/96/007/024 2x(5x3 ml) Humalog Mix25 zásobní vložky do 3ml pera
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 30. dubna 1996 Datum prodloužení registrace: 30. dubna 2006
10. DATUM REVIZE TEXTU
NÁZEV PŘÍPRAVKU
1.
Humalog Mix50 100 IU/ml injekční suspenze v injekční lahvičce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Humalog Mix50 je bílá, sterilní suspenze.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinum lisprum (původem z rekombinantní DNA produkované E.coli).
Jeden obal obsahuje 10 ml, což odpovídá 1 000 U insulinum lisprum.
Humalog Mix50 obsahuje 50% roztoku insulinum lisprum a 50% suspenze insulinum lisprum isophanum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Humalog Mix50je určen k léčbě pacientů s diabetem mellitus, kteří potřebují inzulin k udržení normální glukózové homeostázy.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem v souladu s potřebami pacienta.
Humalog Mix50 může být podán krátce před jídlem, v případě nutnosti může být Humalog Mix50 podán i bezprostředně po jídle. Humalog Mix50 má být aplikován pouze subkutánní injekcí, za žádných okolností nesmí být Humalog Mix50 podán intravenózně.
Umístění vpichů by mělo být v horní části paží, na stehnech, hýždích nebo břiše. Místa vpichu mají být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Humalog Mix50 je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Po subkutánní aplikaci Humalog Mix50 dochází k rychlému nástupu účinku Humalogu a časnému dosažení jeho vrcholu. To umožňuje podání Humalog Mix50 v těsné časové souvislosti s jídlem. Trvání účinku složky inzulin lispro protamin suspenze (BASAL) přípravku Humalog Mix50 je velice podobné účinku bazálního inzulinu (NPH).
Časový průběh aktivity jakéhokoliv inzulínu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Stejně jako u všech inzulínových přípravků závisí trvání účinku Humalog Mix50 na dávce, místě vpichu,krevním zásobení, teplotě a fyzické aktivitě.
4.3 Kontraindikace
Přecitlivělost na inzulín lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Humalog Mix50 nesmí být za žádných okolností podán intravenózně.
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente, aj.), druhu (zvířecí, humánní, analog humánního inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malé množství pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Použití nedostatečných dávek nebo přerušení léčby, zvláště u inzulin-dependentních diabetiků, může vést k hyperglykémii a diabetické ketoacidóze; stavům, které mohou být letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo vlivem emocionálních rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po jídle může zvýšit riziko hypoglykémie.
Podání inzulinu lispro dětem mladším 12 let by mělo být zváženo pouze v případě očekávaného přínosu v porovnání s normálním inzulinem.
Kombinace přípravku Humalog Mix50 s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Humalog Mix50. Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulinu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulínu může být snížena při podávání léků s hypoglykemickým účinkem, jako j sou perorální antidiabetika, salicyláty (například kys. acetylsalicylová), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Mísení Humalog Mix50 s jinými inzuliny nebylo zkoumáno.
Při užívání jiných léčiv podávaných současně s Humalog Mix50 by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
U kojících diabetiček může vzniknout potřeba úpravy dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být zhoršena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu.Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000), ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulinem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože glykémie je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinové aktivity v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy, jiného cukru nebo výrobku obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním sacharidů, pokud se pacient dostatečně zotavuje.
Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, měl by být aplikován glukagon intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: ATC kód: A10AD04.
Humalog Mix50 je předmísená suspenze, obsahující inzulin lispro (rychle působící analog humánního inzulinu) a inzulin lispro protamin suspenzi (střednědobě působící analog humánního inzulinu).
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Rychlý nástup účinku inzulinu lispro (přibližně 15 minut) umožňuje jeho podání v těsné časové souvislosti s jídlem (v rozmezí 0 až 15 minut kolem jídla) ve srovnání s běžným rychle působícím inzulinem (30 až 45 minut před jídlem). Po subkutánní aplikaci Humalog Mix50 dochází k rychlému nástupu účinku a časnému dosažení jeho vrcholu. Profil účinku přípravku Humalog BASAL je velice podobný účinku bazálního inzulinu (NPH) a přetrvává přibližně 15 hodin.
Na následujícím obrázku je zobrazena farmakodynamika Humalogu Mix50 a BASAL.
Hypoglykemická aktivita
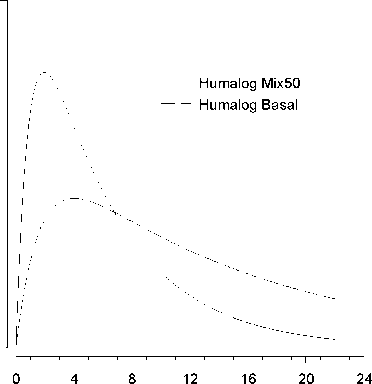
Čas, hodiny
Výše uvedený graf ukazuje v čase relativní množství glukózy potřebné k udržení glykémie blízko hodnot nalačno. Je indikátorem účinku výše uvedených inzulinů na metabolismus glukózy v čase.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Dle farmakokinetických vlastností je inzulin lispro sloučenina, která se rychle vstřebává a dosahuje maximálních hladin v krvi 30 až 70 minut po subkutánním podání. Farmakokinetika inzulin lispro protamin suspenze se neliší od střednědobě působících inzulinů jako je NPH. Farmakokinetika přípravku Humalog Mix50 reprezentuje individuální farmakokinetické vlastnosti jeho dvou složek. Vezmeme-li v úvahu klinický význam těchto kinetik, je vhodnější zkoumat křivky utilizace glukózy. (viz bod 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován mnohem rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Protamin-sulfát metakresol [2,20 mg/ml] fenol [1,00 mg/ml] glycerol
heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Mísení Humalog Mix50 s jinými inzuliny nebylo zkoumáno. Pro nedostatek studií nesmí být tento přípravek mísen s jinými léky.
6.3 Doba použitelnosti
Neotevřená lahvička 2 roky.
Po _prvním užití 28 dnů
6.4 Zvláštní opatření pro uchovávání
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Neotevřená lahvička
Uchovávejte v chladničce (2°C - 8°C ).
Po _prvním užití
Uchovávejte v chladničce (2°C - 8°C ) nebo při teplotě do 30°C.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Suspenze je plněna do injekčních lahviček z křemenného skla typ I utěsněných butylovou nebo halobutylovou zátkou a zabezpečených hliníkovým krytem. K ošetření zátky může být použit dimethicon nebo silikonová emulze.
1 x 10 ml Humalog Mix50 injekční lahvička.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Injekční lahvičky mají být používány se stříkačkou odpovídající velikosti (značení 100U).
Bezprostředně před použitím by injekční lahvičky obsahující Humalog Mix50 měly být promíchány válením v dlaních k promísení inzulínu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování. Lahvičky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně lahvičky, která tím získává matový vzhled.
Humalog Mix50
1. Umyjte si ruce.
2. Načínáte-li novou injekční lahvičku, odstraňte ochranné plastové víčko, ale neodstraňujte zátku.
3. Do stříkačky natáhněte množství vzduchu shodné s množstvím Humalog Mix50, které budete aplikovat. Zátku injekční lahvičky otřete tamponem napuštěným v lihu. Jehlu vbodněte
do lahvičky Humalog Mix50 a vzduch ze stříkačky vtlačte do lahvičky.
4. Lahvičku se stříkačkou otočte dnem vzhůru. Držte je pevně v jedné ruce.
5. Přesvědčte se, že je špička jehly v Humalog Mix50 a potřebnou dávku natáhněte do stříkačky.
6. Před vytažením jehly z lahvičky zkontrolujte, zda nejsou ve stříkačce bubliny, dávka Humalog Mix50 by byla nižší. V takovém případě držte stříkačku vzhůru a poklepávejte na její stěnu, dokud bubliny nevyplavou nahoru. Vytlačte je ze stříkačky ven a natáhněte správnou dávku.
7. Vytáhněte stříkačku z lahvičky a položte ji tak, aby se jehla ničeho nedotýkala. b) Aplikace dávky
1. Vyberte místo vpichu.
2. Očistěte kůži jak j ste byli poučeni.
3. Stabilizujte kůži tak, že ji buďto napnete nebo vytvoříte větší kožní řasu. Jehlu vbodněte do kůže a aplikujte dávku podle instrukce.
4. Vytáhněte jehlu a místo vpichu několik sekund jemně tiskněte. Místo nemasírujte.
5. Jehlu a stříkačku bezpečně znehodnoťte.
6. Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito v průměru vícekrát než jednou za měsíc.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLO
EU/1/96/007/019
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 30. dubna 1996 Datum prodloužení registrace: 30.dubna 2006
10. DATUM REVIZE TEXTU
NÁZEV PŘÍPRAVKU
1.
Humalog Mix50 100 IU/ml injekční suspenze v zásobní vložce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Humalog Mix50 je bílá, sterilní suspenze.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinům lisprum (původem z rekombinantní DNA produkované E.coli).
Jeden obal obsahuje 3 ml, což odpovídá 300 U insulinum lisprum.
Humalog Mix50 obsahuje 50% roztoku insulinum lisprum a 50% suspenze insulinum lisprum isophanum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Humalog Mix50 je určen k léčbě pacientů s diabetem mellitus, kteří potřebují inzulin k udržení normální glukózové homeostázy.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem v souladu s potřebami pacienta.
Humalog Mix50 může být podán krátce před jídlem, v případě nutnosti může být Humalog Mix50 podán i bezprostředně po jídle. Humalog Mix50 má být aplikován pouze subkutánní injekcí, za žádných okolností nesmí být Humalog Mix50 podán intravenózně.
Umístění vpichů by mělo být v horní části paží, na stehnech, hýždích nebo břiše. Místa vpichu mají být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Humalog Mix50 je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Po subkutánní aplikaci Humalog Mix50 dochází k rychlému nástupu účinku Humalogu a časnému dosažení jeho vrcholu. To umožňuje podání Humalog Mix50 v těsné časové souvislosti s jídlem. Trvání účinku složky inzulin lispro protamin suspenze (BASAL) přípravku Humalog Mix50 je velice podobné účinku bazálního inzulinu (NPH).
Časový průběh aktivity jakéhokoliv inzulínu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Stejně jako u všech inzulínových přípravků závisí trvání účinku Humalog Mix50 na dávce, místě vpichu,krevním zásobení, teplotě a fyzické aktivitě.
4.3 Kontraindikace
Přecitlivělost na inzulín lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Humalog Mix50 nesmí být za žádných okolností podán intravenózně.
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente, aj.), druhu (zvířecí, humánní, analog humánního inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malé množství pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Použití nedostatečných dávek nebo přerušení léčby, zvláště u inzulin-dependentních diabetiků, může vést k hyperglykémii a diabetické ketoacidóze; stavům, které mohou být letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo vlivem emocionálních rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po jídle může zvýšit riziko hypoglykémie.
Podání inzulinu lispro dětem mladším 12 let by mělo být zváženo pouze v případě očekávaného přínosu v porovnání s normálním inzulinem.
Kombinace přípravku Humalog Mix50 s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Humalog Mix50. Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem, a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulínu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako jsou perorální antidiabetika, salicyláty (například kys. acetylsalicylová), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Mísení Humalog Mix50 s jinými inzuliny nebylo zkoumáno.
Při užívání jiných léčiv podávaných současně s Humalog Mix50 by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
U kojících diabetiček může vzniknout potřeba úpravy dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být zhoršena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu.Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000), ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulínem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože glykémie je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinové aktivity v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy, jiného cukru nebo výrobku obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním sacharidů, pokud se pacient dostatečně zotavuje.
Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, měl by být aplikován glukagon intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: ATC kód: A10AD04.
Humalog Mix50 je předmísená suspenze, obsahující inzulin lispro (rychle působící analog humánního inzulinu) a inzulin lispro protamin suspenzi (střednědobě působící analog humánního inzulinu).
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Rychlý nástup účinku inzulinu lispro (přibližně 15 minut) umožňuje jeho podání v těsné časové souvislosti s jídlem (v rozmezí 0 až 15 minut kolem jídla) ve srovnání s běžným rychle působícím inzulinem (30 až 45 minut před jídlem). Po subkutánní aplikaci Humalog Mix50 dochází k rychlému nástupu účinku a časnému dosažení jeho vrcholu. Profil účinku přípravku Humalog BASAL je velice podobný účinku bazálního inzulinu (NPH) a přetrvává přibližně 15 hodin.
Na následujícím obrázku je zobrazena farmakodynamika Humalogu Mix50 a BASAL.
Hypoglykemická
aktivita
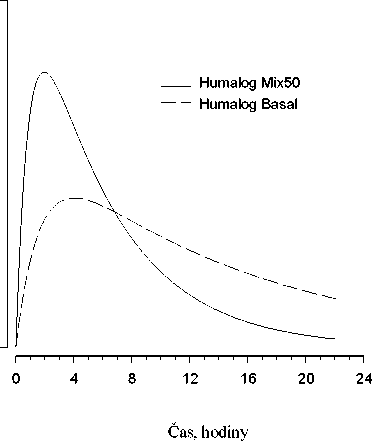
Výše uvedený graf ukazuje v čase relativní množství glukózy potřebné k udržení glykémie blízko hodnot nalačno. Je indikátorem účinku výše uvedených inzulinů na metabolismus glukózy v čase.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Dle farmakokinetických vlastností je inzulin lispro sloučenina, která se rychle vstřebává a dosahuje maximálních hladin v krvi 30 až 70 minut po subkutánním podání. Farmakokinetika inzulin lispro protamin suspenze se neliší od střednědobě působících inzulinů jako je NPH. Farmakokinetika přípravku Humalog Mix50 reprezentuje individuální farmakokinetické vlastnosti jeho dvou složek. Vezmeme-li v úvahu klinický význam těchto kinetik, je vhodnější zkoumat křivky utilizace glukózy. (viz bod 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován mnohem rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Protamin-sulfát metakresol [2,20 mg/ml] fenol [1,00 mg/ml] glycerol
heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Mísení Humalog Mix50 s jinými inzuliny nebylo zkoumáno. Pro nedostatek studií nesmí být tento přípravek mísen s jinými léky.
6.3 Doba použitelnosti
Nepoužitá zásobní vložka 3 roky.
Po založení zásobní vložky 28 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužitá zásobní vložka
Uchovávejte v chladničce (2°C - 8°C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po založení zásobní vložky
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Suspenze je plněna do zásobních vložek z křemenného skla typ I utěsněných butylovou nebo halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze.
Na trhu nemusí být všechny velikosti balení.
5x3 ml Humalog Mix50 zásobní vložky do 3ml pera 2x(5x3 ml) Humalog Mix50 zásobní vložky do 3ml pera
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem, a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
Humalog Mix50 zásobní vložky mají být používány s pery označenými CE na doporučení výrobce pera.
a) Příprava dávky
Bezprostředně před použitím by zásobní vložky obsahující Humalog Mix50 měly být desetkrát promíchány válením v dlaních a desetkrát převráceny o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování.
Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled.
V zásobní vložce nelze míchat Humalog Mix50 s jinými inzuliny. Vložky nelze znovu plnit.
Následuje obecný popis použití. U každého jednotlivého pera je nutno respektovat instrukce od výrobce k založení zásobní vložky, připojení jehly a aplikaci injekce inzulinu.
b) Aplikace dávky
1. Umyjte si ruce.
2. Vyberte místo vpichu.
3. Očistěte kůži, jak jste byli poučeni.
4. Odstraňte vněj ší kryt j ehly.
5. Stabilizujte kůži tak, že ji buď napnete, nebo vytvoříte větší kožní řasu. Jehlu vbodněte podle instrukce.
6. Zmáčkněte dávkovací tlačítko.
7. Vytáhněte jehlu a místo vpichu několik vteřin jemně stiskněte. Místo nemasírujte.
8. S pomocí vnějšího krytu jehlu odšroubujte a bezpečně znehodnoťte.
9. Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito v průměru víckrát než jednou za měsíc.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/96/007/006 5x3 ml Humalog Mix50 zásobní vložky do 3ml pera
EU/1/96/007/025 2x(5x3 ml) Humalog Mix50 zásobní vložky do 3ml pera
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 30. dubna 1996 Datum prodloužení registrace: 30. dubna 2006
10. DATUM REVIZE TEXTU
NÁZEV PŘÍPRAVKU
1.
Humalog BASAL 100 IU/ml injekční suspenze v zásobní vložce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Humalog BASAL je bílá, sterilní suspenze.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100U (odpovídá 3,5 mg) insulinům lisprum (původem z rekombinantní DNA produkované E.coli).
Jeden obal obsahuje 3 ml, což odpovídá 300U insulinum lisprum.
Humalog BASAL obsahuje suspenzi insulinum lisprum isophanum.
Úplný seznam pomocných látek viz. bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Humalog BASAL je určen k léčbě pacientů s diabetem mellitus, kteří potřebují inzulin k udržení normální glukózové homeostázy.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem v souladu s potřebami pacienta.
Humalog BASAL může být míchán nebo být podán v kombinaci s Humalogem Humalog BASAL má být aplikován pouze subkutánní injekcí, za žádných okolností nesmí být Humalog BASAL podán intravenózně.
Umístění vpichů by mělo být v horní části paží, na stehnech, hýždích nebo břiše. Místa vpichu mají být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Humalogu BASAL je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Trvání účinku Humalogu BASAL je velice podobné účinku bazálního inzulinu (NPH) přibližně po dobu 15 hod. Časový průběh aktivity jakéhokoliv inzulinu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Stejně jako u všech inzulinových přípravků závisí trvání účinku Humalogu BASAL na dávce, místě vpichu,krevním zásobení, teplotě a fyzické aktivitě.
4.3 Kontraindikace
Přecitlivělost na inzulin lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Humalog BASAL nesmí být za žádných okolností podán intravenózně.
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente aj.), druhu (zvířecí, humánní, analog humánního inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malé množství pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Použití nedostatečných dávek nebo přerušení léčby, zvláště u inzulin-dependentních diabetiků, může vést k hyperglykémii a diabetické ketoacidóze; stavům, které mohou být letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo vlivem emocionálních rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po jídle může zvýšit riziko hypoglykémie.
Podání inzulinu lispro dětem mladším 12 let by mělo být zváženo pouze v případě očekávaného přínosu v porovnání s normálním inzulinem.
Kombinace přípravku Humalog BASAL s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Humalog BASAL. Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem, a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulinu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulínu může být snížena při podávání léků s hypoglykemickým účinkem, jako j sou perorální antidiabetika, salicyláty (například kys. acetylsalicylová), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Mísení Humalogu BASAL s jinými inzuliny než Humalog nebylo zkoumáno.
Při užívání jiných léčiv podávaných současně s Humalogem BASAL by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
U kojících diabetiček může vzniknout potřeba úpravy dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být zhoršena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu.Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000), ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulinem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože glykémie je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinové aktivity v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy, jiného cukru nebo výrobku obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním sacharidů, pokud se pacient dostatečně zotavuje.
Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, měl by být aplikován glukagon intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: střednědobě působící analog humánního inzulinu. ATC kód: A10AC04 Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Profil účinku přípravku Humalog BASAL je velice podobný účinku bazálního inzulinu (NPH) a přetrvává přibližně 15 hodin.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Humalog BASAL má prodloužený absorpční profil, kdy je maximální koncentrace inzulinu dosaženo přibližně 6 hodin po podání. Vezmeme-li v úvahu klinický význam těchto kinetik, je vhodnější zkoumat křivky utilizace glukózy.
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován mnohem rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Protamin-sulfát metakresol [1,76 mg/ml] fenol [0,80 mg/ml] glycerol
heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Mísení Humalogu BASAL s jinými inzuliny než Humalog nebylo zkoumáno. Tento přípravek nesmí být mísen s jinými léky než je Humalog.
6.3 Doba použitelnosti
Nepoužitá zásobní vložka 2 roky.
Po založení zásobní vložky 21 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužitá zásobní vložka
Uchovávejte v chladničce (2°C - 8°C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po založení zásobní vložky
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Suspenze je plněna do zásobních vložek z křemenného skla typ I utěsněných butylovou nebo halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze.
Na trhu nemusí být všechny velikosti balení.
5x3 ml Humalog BASAL zásobní vložky do 3ml pera 2x (5x3 ml) Humalog BASAL zásobní vložky do 3ml pera
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze jedním pacientem, a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
Humalog BASAL zásobní vložky mají být používány s pery označenými CE podle doporučení výrobce pera.
a) Příprava dávky
Bezprostředně před použitím by zásobní vložky obsahující Humalog BASAL měly být desetkrát promíchány válením v dlaních a desetkrát převráceny o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování.
Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled.
V zásobní vložce nelze míchat Humalog BASAL s jinými inzuliny. Vložky nelze znovu plnit.
Následuje obecný popis použití. U každého jednotlivého pera je nutno respektovat instrukce od výrobce k založení zásobní vložky, připojení jehly a aplikaci injekce inzulinu.
b) Aplikace dávky
1. Umyjte si ruce.
2. Vyberte místo vpichu.
3. Očistěte kůži, jak jste byli poučeni.
4. Odstraňte vněj ší kryt j ehly.
5. Stabilizujte kůži tak, že ji buď napnete, nebo vytvoříte větší kožní řasu. Jehlu vbodněte podle instrukce.
6. Zmáčkněte dávkovací tlačítko.
7. Vytáhněte jehlu a místo vpichu několik vteřin jemně stiskněte. Místo nemasírujte.
8. S pomocí vnějšího krytu jehlu odšroubujte a bezpečně znehodnoťte.
9. Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito v průměru víckrát než jednou za měsíc.
c) Míchání inzulínů
Inzulíny v injekčních lahvičkách nemíchejte s inzulíny v zásobních vložkách. Víz. bod 6.2.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/96/007/010 5x3 ml Humalog BASAL zásobní vložky do 3ml pera EU/1/96/007/029 2x (5x3 ml) Humalog BASAL zásobní vložky do 3ml pera
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 30. dubna 1996 Datum prodloužení registrace: 30. dubna 2006
10. DATUM REVIZE TEXTU
NÁZEV PŘÍPRAVKU
1.
Humalog 100 IU/ml KwikPen, injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Humalog KwikPen je sterilní, čirý, bezbarvý vodný roztok.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinum lisprum (původem z rekombinantní DNA produkované E.coli). Jeden obal obsahuje 3 ml, což odpovídá 300 U insulinum lisprum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Humalog KwikPen je určen k léčbě dospělých a dětí s diabetem mellitus, kteří vyžadují inzulin k udržení normální glukózové homeostázy. Humalog KwikPen je rovněž indikován k iniciální stabilizaci diabetes mellitus.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem, v souladu s potřebami pacienta.
Humalog může být podán krátce před jídlem nebo v případě nutnosti záhy po jídle. Humalog by měl být aplikován pouze subkutánní injekcí nebo kontinuální subkutánní infúzí pomocí pumpy (viz bod 4.2), avšak může být, i když to není doporučováno, podán také intramuskulárně. V případě potřeby může být podán i intravenózně, např. je-li třeba kontrolovat glykémii při ketoacidóze, akutních onemocněních nebo během operace či v pooperačním období.
Místy subkutánního podání by měly být horní části paží, stehna, hýždě nebo břicho.Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Humalogu KwikPen je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Humalog KwikPen účinkuje po subkutánním podání rychle a kratší dobu (2-5 hodin) ve srovnání s normálním lidským inzulinem. Tento rychlý nástup účinku dovoluje podávání injekce Humalogu (nebo bolusu Humalogu v případě kontinuální subkutánní infuze) velmi krátce před jídlem nebo po jídle. Časový průběh aktivity jakéhokoliv inzulinu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Rychlejší nástup účinku inzulinu lispro ve srovnání s normálním lidským inzulinem je zachován nezávisle na místě vpichu. Stejně jako u všech inzulínových přípravků závisí trvání účinku Humalogu KwikPen na dávce, místě vpichu,krevním zásobení, teplotě a fyzické aktivitě.
Humalog může být dle rady lékaře aplikován v kombinaci s déle působícím inzulínem nebo s deriváty sulfonylurey.
Užití Humalogu v inzulinových infúzních pumpách
K infúzím inzulinu lispro je možno použít pouze určité inzulinové infúzní pumpy s označením CE. Před infuzí inzulinu lispro je třeba prostudovat instrukce výrobce, abyste se ujistili o vhodnosti dané pumpy. Řiďte se návodem k používání infuzní pumpy. Spolu s pumpou používejte správný zásobník a správný katetr. Infúzní set (katetr a kanyla) má být vyměňován podle pokynů uvedených v informaci o produktu dodané společně s infúzním setem. V případě hypoglykémie by měla být infúze přerušena až do odeznění hypoglykémie. Naměříte-li si výrazně nízké nebo opakovaně nízké hladiny glukózy v krvi, upozorněte svého lékaře a zvažte, zda není nutno infúzi inzulinu zpomalit či zastavit. Porucha pumpy nebo zneprůchodnění infúzního setu může způsobit náhlý vzestup hladiny glukózy.
V případě podezření, že je průtok inzulinu přerušen, se řiďte pokyny v návodu k obsluze, případně uvědomte svého lékaře. Při používání inzulinové infúzní pumpy nesmí být Humalog mí sen s jinými inzuliny.
Intravenózní aplikace inzulinu
Intravenózní aplikace insulinu lispro má být prováděna podle běžné klinické praxe, např. intravenózním bolusem nebo infuzí. Je nutná častá kontrola hladiny glukózy v krvi.
Infuzní roztok o koncentraci od 0,1 IU/ml do 1,0 IU/ml insulinu lispro v 0,9% NaCl nebo 5% sacharóze je stabilní za pokojové teploty po dobu 48 hodin. Před zahájením infuze je doporučeno infuzní soupravu prostříknout.
4.3 Kontraindikace
Přecitlivělost na inzulin lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky ( výrobce), typu (regular, NPH, lente, aj.),druhu (zvířecí, lidský, analog lidského inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování. Každý pacient, který užívá kombinaci rychle působícího a bazálního inzulinu, musí optimalizovat dávkování obou těchto typů inzulinu k dosažení lepší kontroly glykémie po celý den, zejména v noci a na lačno.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malý počet pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Užití neadekvátních dávek nebo přerušení léčby obzvlášť u inzulindependentních pacientů může vést k hyperglykémii a diabetické ketoacidóze, které jsou potenciálně letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulínu může být zvýšena během nemoci nebo při emocionálním rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po požití potravy může zvýšit riziko hypoglykémie. Nástup hypoglykémie v případě užití rychle působícího analogu humánního inzulínu může být z důvodu jeho farmakodynamiky rychlejší než při užití normálního lidského inzulínu.
Humalog by měl být u dětí přednostně použit pouze v případě, kdy je přínosem jeho rychlý nástup účinku, např. načasování injekce vzhledem k jídlu.
Kombinace přípravku Humalog s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Humalog.
Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulinu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako jsou perorální antidiabetika, salicyláty (například Acylpyrin, Aspirin), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Při užívání jiných léčiv podávaných současně s Humalogem KwikPen by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
Kojící diabetičky mohou potřebovat úpravu dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být porušena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie.
Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu. Tento stav obvykle ustoupí během několika dnů nebo týdnů. V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000),ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulinem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože sérová hladina krevního cukru je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinu v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy nebo jiného cukru nebo produktu obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním uhlovodanů, pokud se pacient dostatečně zotavuje. Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, glukagon by měl být aplikován intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: rychle působící analog humánního inzulínu. ATC kód: A10AB04.
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Insulin lispro má rychlý nástup účinku (přibližně 15 minut) a tím umožňuje v porovnání s normálním inzulinem (aplikace 30 až 45 minut před jídlem) podání velmi krátce před jídlem nebo po jídle (interval od 0 do 15 minut). Nástup účinku inzulinu lispro je rychlý a doba aktivity kratší (2 až 5 hodin) ve srovnání s normálním inzulinem.
Klinické studie s pacienty s diabetem typu 1 nebo 2 prokázaly nižší výskyt postprandiální hyperglykémie u inzulinu lispro ve srovnání s normálním lidským inzulinem.
Stejně jako u všech inzulinových přípravků může být časový průběh aktivity inzulinu lispro odlišný u různých individuí nebo odlišný v různých časových obdobích u stejných individuí v závislosti na místě injekce, krevním zásobení, teplotě a fyzické aktivitě. Typický průběh aktivity v čase po subkutánní injekci ilustruje následující graf.

Graf odráží relativní množství glukózy v závislosti na čase potřebné k udržení celkové plasmatické glukózové koncentrace testovaného subjektu blízko hladinám nalačno a je indikátorem efektu těchto inzulinů na glukózový metabolismus v průběhu času.
Byly provedeny klinické studie u dětí (61 dětí ve věku 2 až 11 let) a u dětí a mladistvých (481 pacientů ve věku 9 až 19 let ) srovnávající inzulin lispro a normální lidský inzulin. Farmakodynamický profil inzulinu lispro u dětí je podobný jako farmakodynamický profil pozorovaný u dospělých.
Podávání insulinu lispro subkutánní infuzní pumpou způsobuje nižší hladiny glykovaného hemoglobinu než při užití normálního lidského inzulinu. V dvojitě slepé překřížené studii došlo ke snížení hladiny glykovaného hemoglobinu po 12 týdnech o 0,37 procentního bodu u inzulinu lispro ve srovnání se snížením o 0,03 procentního bodu u normálního lidského inzulinu (p=0,004).
U pacientů s diabetem typu 2 s maximálními dávkami derivátů sulfonylurey studie ukázaly, že při kombinaci s inzulinem lispro se významně sníží hladina HbA1C ve srovnání se samotnou sulfonylureou. Snížení hladiny HbA1C lze očekávat rovněž při kombinaci s jinými přípravky inzulinu, např. normálním nebo isofan inzulinem.
Klinické studie s pacienty s diabetem typu 1 a 2 prokázaly nižší počet nočních hypoglykémií s inzulinem lispro ve srovnání s normálním lidským inzulinem. V některých studiích byl nižší počet nočních hypoglykémií spojen se zvýšeným počtem denních hypoglykémií.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Farmakokinetika insulinu lispro odpovídá látce, která je rychle absorbována a dosahuje nejvyšších plasmatických hladin v době od 30 do 70 minut po subkutánní injekci. Při zvažování klinické relevance této kinetiky je třeba prozkoumat křivky utilizace glukózy ( viz 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován mnohem rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
metakresol [3,15 mg/ml] glycerol
heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Humalog nesmí být mísen se zvířecími inzuliny nebo inzuliny jiného výrobce.
6.3 Doba použitelnosti
Nepoužité předplněné pero 3 roky.
Po _prvním užití 28 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužité předplněné pero
Uchovávejte v chladničce (2°C - 8°C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po _prvním užití
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Předplněné pero nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Roztok je plněn do zásobních vložek z křemenného skla typ I utěsněných butylovou nebo halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze.
3 ml zásobní vložky jsou součástí předplněného dávkovače k jednorázovému užití, nazývaným „KwikPen“. Jehly nejsou obsaženy.
Na trhu nemusí být všechny velikosti balení.
5x3 ml Humalog 100 IU/ml KwikPen 2x(5x3 ml) Humalog 100 IU/ml KwikPen
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
Zkontrolujte Humalog injekční roztok. Měl by být čirý a bezbarvý. Nepoužívejte Humalog, pokud se jeví zakalený, zahuštěný nebo lehce zabarvený nebo pokud jsou v něm viditelné pevné částice.
a) Zacházení s předplněným perem
Před zahájením používání pera KwikPen je nutné pečlivě prostudovat Návod k použití, který je součástí příbalové informace. Pero KwikPen musí být používáno podle pokynů v tomto návodu.
b) Mísení inzulinů
Nemíchejte inzulin v lahvičkách s inzulinem v zásobních vložkách. Viz bod 6.2.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/96/007/031 5x3 ml Humalog 100 IU/ml Kwik Pen
EU/1/96/007/032 2x(5x3 ml) Humalog 100 IU/ml Kwik Pen
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 30. dubna 1996 Datum prodloužení registrace: 30. dubna 2006
10. DATUM REVIZE TEXTU
NÁZEV PŘÍPRAVKU
1.
Humalog Mix25 100 IU/ml KwikPen injekční suspenze
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Humalog Mix25 je bílá, sterilní suspenze.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinům lisprum (původem z rekombinantní DNA produkované E.coli).
Jeden obal obsahuje 3 ml, což odpovídá 300 U insulinum lisprum.
Humalog Mix25 obsahuje 25% roztoku insulinum lisprum a 75% suspenze insulinum lisprum isophanum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Humalog Mix25 je určen k léčbě pacientů s diabetem mellitus, kteří potřebují inzulin k udržení normální glukózové homeostázy.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem v souladu s potřebami pacienta.
Humalog Mix25 může být podán krátce před jídlem, v případě nutnosti může být Humalog Mix25 podán i bezprostředně po jídle. Humalog Mix25 má být aplikován pouze subkutánní injekcí, za žádných okolností nesmí být Humalog Mix25 podán intravenózně.
Umístění vpichů by mělo být v horní části paží, na stehnech, hýždích nebo břiše. Místa vpichu mají být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Humalog Mix25 je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Po subkutánní aplikaci Humalog Mix25 dochází k rychlému nástupu účinku Humalogu a časnému dosažení jeho vrcholu. To umožňuje podání Humalog Mix25 v těsné časové souvislosti s jídlem. Trvání účinku složky inzulin lispro protamin suspenze (BASAL) přípravku Humalog Mix25 je velice podobné účinku bazálního inzulinu (NPH).
Časový průběh aktivity jakéhokoliv inzulínu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Stejně jako u všech inzulínových přípravků závisí trvání účinku Humalog Mix25 na dávce, místě vpichu,krevním zásobení, teplotě a fyzické aktivitě.
4.3 Kontraindikace
Přecitlivělost na inzulín lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Humalog Mix25 nesmí být za žádných okolností podán intravenózně.
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente, aj.), druhu (zvířecí, humánní, analog humánního inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malé množství pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Použití nedostatečných dávek nebo přerušení léčby, zvláště u inzulin-dependentních diabetiků, může vést k hyperglykémii a diabetické ketoacidóze; stavům, které mohou být letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo vlivem emocionálních rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po jídle může zvýšit riziko hypoglykémie.
Podání inzulinu lispro dětem mladším 12 let by mělo být zváženo pouze v případě očekávaného přínosu v porovnání s normálním inzulinem.
Kombinace přípravku Humalog Mix25 s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Humalog Mix25. Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulínu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako jsou perorální antidiabetika, salicyláty (například kys. acetylsalicylová), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Mísení Humalog Mix25 s jinými inzuliny nebylo zkoumáno.
Při užívání jiných léčiv podávaných současně s Humalog Mix25 KwikPen by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
U kojících diabetiček může vzniknout potřeba úpravy dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být zhoršena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu.Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000), ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulínem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože glykémie je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinové aktivity v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy, jiného cukru nebo výrobku obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním sacharidů, pokud se pacient dostatečně zotavuje.
Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, měl by být aplikován glukagon intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: ATC kód: A10AD04
Humalog Mix25 je předmísená suspenze, obsahující inzulin lispro (rychle působící analog humánního inzulinu) a inzulin lispro protamin suspenzi (střednědobě působící analog humánního inzulinu).
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Rychlý nástup účinku inzulinu lispro (přibližně 15 minut) umožňuje jeho podání v těsné časové souvislosti s jídlem (v rozmezí 0 až 15 minut kolem jídla) ve srovnání s běžným rychle působícím inzulinem (30 až 45 minut před jídlem). Po subkutánní aplikaci Humalog Mix25 dochází k rychlému nástupu účinku a časnému dosažení jeho vrcholu. Profil účinku přípravku Humalog BASAL je velice podobný účinku bazálního inzulinu (NPH) a přetrvává přibližně 15 hodin.
Klinické studie s pacienty s diabetem typu 1 nebo 2 prokázaly nižší výskyt postprandiální hyperglykémie u Humalogu Mix25 ve srovnání se směsí normálního lidského inzulinu 30/70. V jedné klinické studii došlo k malému (0,38 mmol/l) zvýšení noční hladiny glukózy v krvi ( 3:00).
Na následujícím obrázku je zobrazena farmakodynamika Humalogu Mix25 a BASAL.
Hypoglykemická
aktivita

Výše uvedený graf ukazuje v čase relativní množství glukózy potřebné k udržení glykémie blízko hodnot nalačno. Je indikátorem účinku výše uvedených inzulinů na metabolismus glukózy v čase.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
Ve dvou 8měsíčních otevřených zkřížených studiích u pacientů s diabetem 2. typu, kteří dosud nebyli léčeni inzulinem, nebo si již aplikovali inzulin jednou nebo dvakrát denně, byli pacienti randomizováni ke 4 měsícům léčby Humalogem Mix25 (užívaným dvakrát denně s metforminem) a inzulinem glargin (užívaným jednou denně s metforminem) v náhodném pořadí. Detailní informace lze nalézt v následující tabulce.
|
Pacienti dosud neléčení inzulinem n=78 |
Pacienti již dříve léčení inzulinem n=97 | |
|
Průměrná celková denní dávka inzulinu při ukončení léčby |
0,63 U/kg |
0,42 U/kg |
|
Redukce hemoglobinu A1c1 |
1,30% (průměr při zahájení léčby 8,7%) |
1,00% (průměr při zahájení léčby 8,5%) |
|
Redukce průměrné kombinované ranní /večerní 2hodinové postprandiální glykémie1 |
3,46 mM |
2,48 mM |
|
Redukce průměrné glykémie nalačno1 |
0,55 mM |
0,65 mM |
|
Výskyt hypoglykémie při ukončení léčby |
25% |
25% |
|
Váhový přírůstek2 |
2,33 kg |
0,96 kg |
1
2
od výchozího stavu do ukončení léčby přípravkem Humalog Mix25
u pacientů užívajících přípravek Humalog Mix25 v průběhu první fáze překřížené léčby
5.2 Farmakokinetické vlastnosti
Dle farmakokinetických vlastností je inzulín lispro sloučenina, která se rychle vstřebává a dosahuje maximálních hladin v krvi 30 až 70 minut po subkutánním podání. Farmakokinetika inzulin lispro protamin suspenze se neliší od střednědobě působících inzulinů jako je NPH. Farmakokinetika přípravku Humalog Mix25 reprezentuje individuální farmakokinetické vlastnosti jeho dvou složek. Vezmeme-li v úvahu klinický význam těchto kinetik, je vhodnější zkoumat křivky utilizace glukózy (viz bod 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován mnohem rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Protamin-sulfát metakresol [1,76 mg/ml] fenol [0,80 mg/ml] glycerol
heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý
voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Mísení Humalog Mix25 s jinými inzuliny nebylo zkoumáno. Pro nedostatek studií nesmí být tento přípravek mísen s jinými léky.
6.3 Doba použitelnosti
Nepoužité předplněné pero 3 roky.
Po _prvním užití 28 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužité _ předplněné _ pero
Uchovávejte v chladničce (2°C - 8°C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po _prvním užití
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Předplněné pero nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Suspenze je plněna do zásobních vložek z křemenného skla typ I utěsněných butylovou nebo halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze. 3 ml zásobní vložky jsou součástí předplněného dávkovače k jednorázovému užití, nazývaného „KwikPen“. Jehly nejsou obsaženy.
Na trhu nemusí být všechny velikosti balení.
5x3 ml Humalog Mix25 100 IU/ml KwikPen 2x(5x3 ml) Humalog Mix25 100 IU/ml KwikPen
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
Bezprostředně před použitím by dávkovač KwikPen měl být desetkrát promíchán válením v dlaních a desetkrát převrácen o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování.
Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled.
Zacházení s předplněným perem
Před zahájením používání pera KwikPen je nutné pečlivě prostudovat Návod k použití, který je součástí příbalové informace. Pero KwikPen musí být používáno podle pokynů v tomto návodu.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
8. REGISTRAČNÍ ČÍSLA
EU/1/96/007/033 5x3 ml Humalog Mix25 100 IU/ml KwikPen
EU/1/96/007/034 2x(5x3ml) Humalog Mix25 100 IU/ml KwikPen
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 30. dubna 1996 Datum prodloužení registrace: 30. dubna 2006
10. DATUM REVIZE TEXTU
NÁZEV PŘÍPRAVKU
1.
Humalog Mix50 100 IU/ml KwikPen injekční suspenze
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Humalog Mix50 je bílá, sterilní suspenze.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinum lisprum (původem z rekombinantní DNA produkované E.coli).
Jeden obal obsahuje 3 ml, což odpovídá 300 U insulinum lisprum.
Humalog Mix50 obsahuje 50% roztoku insulinum lisprum a 50% suspenze insulinum lisprum isophanum.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Humalog Mix50 je určen k léčbě pacientů s diabetem mellitus, kteří potřebují inzulin k udržení normální glukózové homeostázy.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem v souladu s potřebami pacienta.
Humalog Mix50 může být podán krátce před jídlem, v případě nutnosti může být Humalog Mix50 podán i bezprostředně po jídle. Humalog Mix50 má být aplikován pouze subkutánní injekcí, za žádných okolností nesmí být Humalog Mix50 podán intravenózně.
Umístění vpichů by mělo být v horní části paží, na stehnech, hýždích nebo břiše. Místa vpichu mají být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Humalog Mix50 je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Po subkutánní aplikaci Humalog Mix50 dochází k rychlému nástupu účinku Humalogu a časnému dosažení jeho vrcholu. To umožňuje podání Humalog Mix50 v těsné časové souvislosti s jídlem. Trvání účinku složky inzulin lispro protamin suspenze (BASAL) přípravku Humalog Mix50 je velice podobné účinku bazálního inzulinu (NPH).
Časový průběh aktivity jakéhokoliv inzulínu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Stejně jako u všech inzulínových přípravků závisí trvání účinku Humalog Mix50 na dávce, místě vpichu,krevním zásobení, teplotě a fyzické aktivitě.
4.3 Kontraindikace
Přecitlivělost na inzulín lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Humalog Mix50 nesmí být za žádných okolností podán intravenózně.
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente, aj.), druhu (zvířecí, humánní, analog humánního inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malé množství pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Použití nedostatečných dávek nebo přerušení léčby, zvláště u inzulin-dependentních diabetiků, může vést k hyperglykémii a diabetické ketoacidóze; stavům, které mohou být letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo vlivem emocionálních rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po jídle může zvýšit riziko hypoglykémie.
Podání inzulinu lispro dětem mladším 12 let by mělo být zváženo pouze v případě očekávaného přínosu v porovnání s normálním inzulinem.
Kombinace přípravku Humalog Mix50 s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Humalog Mix50. Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulínu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako j sou perorální antidiabetika, salicyláty (například kys. acetylsalicylová), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Mísení Humalog Mix50 s jinými inzuliny nebylo zkoumáno.
Při užívání jiných léčiv podávaných současně s Humalog Mix50 Kwikpen by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
U kojících diabetiček může vzniknout potřeba úpravy dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být zhoršena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu.Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000), ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulínem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože glykémie je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinové aktivity v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy, jiného cukru nebo výrobku obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním sacharidů, pokud se pacient dostatečně zotavuje.
Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, měl by být aplikován glukagon intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: ATC kód: A10AD04
Humalog Mix50 je předmísená suspenze, obsahující inzulin lispro (rychle působící analog humánního inzulinu) a inzulin lispro protamin suspenzi (střednědobě působící analog humánního inzulinu).
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Rychlý nástup účinku inzulinu lispro (přibližně 15 minut) umožňuje jeho podání v těsné časové souvislosti s jídlem (v rozmezí 0 až 15 minut kolem jídla) ve srovnání s běžným rychle působícím inzulinem (30 až 45 minut před jídlem). Po subkutánní aplikaci Humalog Mix50 dochází k rychlému nástupu účinku a časnému dosažení jeho vrcholu. Profil účinku přípravku Humalog BASAL je velice podobný účinku bazálního inzulinu (NPH) a přetrvává přibližně 15 hodin.
Na následujícím obrázku je zobrazena farmakodynamika Humalogu Mix50 a BASAL.

Hypoglykemická
aktivita
Výše uvedený graf ukazuje v čase relativní množství glukózy potřebné k udržení glykémie blízko hodnot nalačno. Je indikátorem účinku výše uvedených inzulinů na metabolismus glukózy v čase.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Dle farmakokinetických vlastností je inzulin lispro sloučenina, která se rychle vstřebává a dosahuje maximálních hladin v krvi 30 až 70 minut po subkutánním podání. Farmakokinetika inzulin lispro protamin suspenze se neliší od střednědobě působících inzulinů jako je NPH. Farmakokinetika přípravku Humalog Mix50 reprezentuje individuální farmakokinetické vlastnosti jeho dvou složek. Vezmeme-li v úvahu klinický význam těchto kinetik, je vhodnější zkoumat křivky utilizace glukózy. (viz bod 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován mnohem rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Protamin-sulfát metakresol [2,20 mg/ml] fenol [1,00 mg/ml] glycerol
heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Mísení Humalog Mix50 s jinými inzuliny nebylo zkoumáno. Pro nedostatek studií nesmí být tento přípravek mísen s jinými léky.
6.3 Doba použitelnosti
Nepoužité _ předplněné _ pero 3 roky.
Po _prvním užití 28 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužité _ předplněné _ pero
Uchovávejte v chladničce (2°C - 8°C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po _prvním užití
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Předplněné pero nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Suspenze je plněna do zásobních vložek z křemenného skla typ I utěsněných butylovou nebo halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze. 3 ml zásobní vložky jsou součástí předplněného dávkovače k jednorázovému užití, nazývaného „KwikPen“ Jehly nejsou obsaženy.
Na trhu nemusí být všechny velikosti balení.
5x3 ml Humalog Mix50 100 IU/ml KwikPen 2x(5x3 ml) Humalog Mix50 100 IU/ml KwikPen
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
Bezprostředně před použitím by dávkovač KwikPen měl být desetkrát promíchán válením v dlaních a desetkrát převrácen o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování.
Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled.
Zacházení s předplněným perem
Před zahájením používání pera KwikPen je nutné pečlivě prostudovat Návod k použití, který je součástí příbalové informace. Pero KwikPen musí být používáno podle pokynů v tomto návodu.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/96/007/035 5x3 ml Humalog Mix50 100 IU/ml KwikPen
EU/1/96/007/036 2x(5x3 ml) Humalog Mix50 100 IU/ml KwikPen
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 30. dubna 1996 Datum prodloužení registrace: 30. dubna 2006
10. DATUM REVIZE TEXTU
NÁZEV PŘÍPRAVKU
1.
Humalog BASAL 100 IU/ml KwikPen injekční suspenze
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2.1. Obecný popis
Humalog BASAL je bílá, sterilní suspenze.
2.2. Kvalitativní a kvantitativní složení
1 ml obsahuje 100 U (odpovídá 3,5 mg) insulinům lisprum (původem z rekombinantní DNA produkované E.coli).
Jeden obal obsahuje 3 ml, což odpovídá 300 U insulinum lisprum.
Humalog BASAL obsahuje suspenzi insulinum lisprum isophanum.
Úplný seznam pomocných látek viz. bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Humalog BASAL je určen k léčbě pacientů s diabetem mellitus, kteří potřebují inzulin k udržení normální glukózové homeostázy.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem v souladu s potřebami pacienta.
Humalog BASAL může být míchán nebo být podán v kombinaci s Humalogem. Humalog BASAL má být aplikován pouze subkutánní injekcí, za žádných okolností nesmí být Humalog BASAL podán intravenózně.
Umístění vpichů by mělo být v horní části paží, na stehnech, hýždích nebo břiše. Místa vpichu mají být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci Humalogu BASAL je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Trvání účinku Humalogu BASAL je velice podobné účinku bazálního inzulinu (NPH) přibližně po dobu 15 hod. Časový průběh aktivity jakéhokoliv inzulinu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Stejně jako u všech inzulinových přípravků závisí trvání účinku Humalogu BASAL na dávce, místě vpichu,krevním zásobení, teplotě a fyzické aktivitě.
4.3 Kontraindikace
Přecitlivělost na inzulin lispro nebo na některou ze složek přípravku.
Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Humalog BASAL nesmí být za žádných okolností podán intravenózně.
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente aj.), druhu (zvířecí, humánní, analog humánního inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování.
Intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání betablokátorů mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malé množství pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Použití nedostatečných dávek nebo přerušení léčby, zvláště u inzulin-dependentních diabetiků, může vést k hyperglykémii a diabetické ketoacidóze; stavům, které mohou být letální.
Potřeba inzulinu může být snížena při renální insuficienci. Potřeba inzulinu může být snížena u pacientů s jaterním poškozením z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jaterní insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Potřeba inzulinu může být zvýšena během nemoci nebo vlivem emocionálních rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po jídle může zvýšit riziko hypoglykémie.
Podání inzulinu lispro dětem mladším 12 let by mělo být zváženo pouze v případě očekávaného přínosu v porovnání s normálním inzulinem.
Kombinace přípravku Humalog BASAL s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Humalog BASAL. Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulinu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin).
Potřeba inzulínu může být snížena při podávání léků s hypoglykemickým účinkem, jako j sou perorální antidiabetika, salicyláty (například kys. acetylsalicylová), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta blokátory, oktreotid nebo alkohol.
Mísení Humalogu BASAL s jinými inzuliny nebylo zkoumáno.
Při užívání jiných léčiv podávaných současně s Humalogem BASAL 100 IU/ml KwikPen by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
U kojících diabetiček může vzniknout potřeba úpravy dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být zhoršena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Nejčastějším nežádoucím účinkem inzulinové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu.Tento stav obvykle ustoupí během několika dnů nebo týdnů.
V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou. Systémová alergie, která je vzácná (1/10 000 až <1/1 000)ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
Byly hlášeny případy edémů v průběhu léčby inzulinem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože glykémie je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinové aktivity v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy, jiného cukru nebo výrobku obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním sacharidů, pokud se pacient dostatečně zotavuje.
Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, měl by být aplikován glukagon intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: střednědobě působící analog humánního inzulinu.
ATC kód: A10AC04.
Primárním účinkem inzulinu lispro je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Profil účinku přípravku Humalog BASAL je velice podobný účinku bazálního inzulinu (NPH) a přetrvává přibližně 15 hodin.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu byly dodržovány v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Humalog BASAL má prodloužený absorpční profil, kdy je maximální koncentrace inzulinu dosaženo přibližně 6 hodin po podání. Vezmeme-li v úvahu klinický význam těchto kinetik, je vhodnější zkoumat křivky utilizace glukózy.
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí byly farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem dodrženy a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován mnohem rychleji než normální lidský inzulin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulinové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulinu lispro na inzulinový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Inzulin lispro nezpůsobuje zhoršení fertility, není embryotoxický a teratogenní ve studiích na zvířatech.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Protamin-sulfát metakresol [1,76 mg/ml] fenol [0,80 mg/ml] glycerol
heptahydrát hydrogenfosforečnanu sodného oxid zinečnatý voda na injekci
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě pH na 7,0-7,8.
6.2 Inkompatibility
Mísení Humalogu BASAL s jinými inzuliny než Humalog nebylo zkoumáno. Tento přípravek nesmí být mísen s jinými léky než je Humalog.
6.3 Doba použitelnosti
Nepoužité _ předplněné _ pero 2 roky.
Po prvním užití 21 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužité _ předplněné _ pero
Uchovávejte v chladničce (2°C - 8°C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po _prvním užití
Uchovávejte při teplotě do 30°C. Chraňte před chladem. Předplněné pero nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci
Suspenze je plněna do zásobních vložek z křemenného skla typ I utěsněných butylovou nebo halobutylovou diskovitou zátkou a pístem a zabezpečených hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze. 3 ml zásobní vložky jsou součástí předplněného dávkovače k jednorázovému užití, nazývaného KwikPen. Jehly nejsou obsaženy.
Na trhu nemusí být všechny velikosti balení.
5x3 ml Humalog BASAL 100 IU/ml KwikPen 2x (5x3 ml) Humalog BASAL 100 IU/ml KwikPen
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
Bezprostředně před použitím by dávkovač KwikPen měl být desetkrát promíchán válením v dlaních a desetkrát převrácen o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování.
Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled.
Zacházení s předplněným perem
Před zahájením používání pera KwikPen je nutné pečlivě prostudovat Návod k použití, který je součástí příbalové informace. Pero KwikPen musí být používáno podle pokynů v tomto návodu.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/96/007/037 5x3 ml Humalog BASAL 100 IU/ml KwikPen
EU/1/96/007/038 2x (5x3 ml) Humalog BASAL 100 IU/ml KwikPen
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 30. dubna 1996 Datum prodloužení registrace: 30. dubna 2006
10. DATUM REVIZE TEXTU
NÁZEV PŘÍPRAVKU
1.
Humalog 200 jednotek /ml injekční roztok v předplněném peru
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml roztoku obsahuje 200 jednotek (odpovídá 6,9 mg) insulinům lisprum*. Jedno pero obsahuje 600 jednotek inzulinu lispro ve 3 ml roztoku.
* produkováno E. coli technologií rekombinantní DNA.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok. KwikPen. Čirý, bezbarvý vodný roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Humalog KwikPen je určen k léčbě dospělých s diabetem mellitem, kteří vyžadují inzulin k udržení normální glukózové homeostázy. Humalog 200 jednotek/ml KwikPen je rovněž indikován k iniciální stabilizaci onemocnění diabetes mellitus.
4.2 Dávkování a způsob podání
Dávkování
Dávkování musí být určeno lékařem, v souladu s potřebami pacienta.
Humalog může být podán krátce před jídlem. V případě nutnosti může být Humalog podán záhy po jídle.
Humalog účinkuje po subkutánním podání rychle a po kratší dobu (2-5 hodin) ve srovnání s normálním lidským inzulinem. Tento rychlý nástup účinku dovoluje podávání injekce přípravku Humalog velmi krátce před jídlem nebo po jídle. Časový průběh aktivity jakéhokoliv inzulinu se může významně lišit u různých osob nebo u jedné osoby v různých časových obdobích. Rychlejší nástup účinku inzulinu lispro ve srovnání s normálním lidským inzulinem je zachován nezávisle na místě vpichu.Trvání účinku přípravku Humalog závisí na dávce, místě vpichu,krevním zásobení, teplotě a fyzické aktivitě.
Humalog může být dle doporučení lékaře aplikován v kombinaci s déle působícím inzulinem nebo s léčivými přípravky obsahujícími sulfonylureu.
Humalog 100 jednotek/ml KwikPen a Humalog 200 jednotek/ml KwikPen
Humalog KwikPen je k dispozici ve dvou silách, U obou se požadovaná dávka nastavuje v jednotkách. Obě předplněná pera Humalog 100 jednotek/ml KwikPen a Humalog 200 jednotek/ml KwikPen aplikují v jedné injekci od 1 do 60 jednotek po jedné jednotce. Počet jednotek se zobrazuje v dávkovacím okénku pera bez ohledu na sílu přípravku a při převodu pacienta na novou sílu není potřeba žádná konverze dávky.
Humalog 200 jednotek/ml by měl být vyhrazen pro léčbu pacientů s diabetem, kteří potřebují denní dávky vyšší než 20 jednotek rychle účinkujícího inzulinu. Roztok inzulinu lispro s obsahem 200 jednotek/ml nesmí být přetahován z předplněného pera (pero KwikPen) nebo mísen s jakýmkoliv jiným inzulínem (viz bod 4.4 a bod 6.2).
Zvláštní skupiny pacientů
Renální insuficience
Potřeba inzulínu může být při renální insuficienci snížena.
Jaterní insuficience
Potřeba inzulinu může být snížena u pacientů s jatemí insuficiencí z důvodů nižší kapacity pro glukoneogenezi a zhoršeného odbourávání inzulinu. U pacientů s chronickou jatemí insuficiencí může zvýšení inzulinové rezistence vést k vyšší potřebě inzulinu.
Způsob podání
Humalog 200 jednotek/ml KwikPen injekční roztok se podává subkutánně.
Místy subkutánního podání jsou horní části paží, stehna, hýždě nebo břicho. Místa vpichu je třeba měnit rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci přípravku Humalog je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nesmí masírovat. Pacient musí být řádně poučen o správné technice aplikace.
Humalog 200 jednotek/ml KwikPen injekční roztok se nesmí používat v inzulinové infúzní pumpě. Humalog 200 jednotek/ml KwikPen injekční roztok se nesmí používat intravenózně.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Hypoglykémie.
4.4 Zvláštní upozornění a opatření pro použití
Převedení pacienta na jiný typ nebo značku inzulinu
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (regular, NPH, lente, aj.), druhu (zvířecí, lidský, analog lidského inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování. Každý pacient, který užívá kombinaci rychle působícího a bazálního inzulinu, musí optimalizovat dávkování obou těchto typů inzulinu k dosažení lepší kontroly glykémie po celý den, zejména v noci a na lačno.
Hypoglykémie a hyperglykémie
Dlouhodobá léčba diabetu, intenzifikovaná inzulinová terapie, diabetická neuropatie nebo užívání léčivých přípravků, jako j sou betablokátory, mohou změnit nebo zmírnit varovné příznaky hypoglykémie.
Malý počet pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od příznaků, které zažili při použití předchozího inzulinu. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Užití neadekvátních dávek nebo přerušení léčby obzvlášť u inzulindependentních pacientů může vést k hyperglykémii a diabetické ketoacidóze, které jsou potenciálně letální.
Potřeba inzulinu a úprava dávky
Potřeba inzulinu může být zvýšena během nemoci nebo při emocionálním rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají větší fyzickou aktivitu nebo mění svou obvyklou dietu. Cvičení okamžitě po požití potravy může zvýšit riziko hypoglykémie. Nástup hypoglykémie v případě užití rychle působícího analogu humánního inzulinu může být z důvodu jeho farmakodynamiky rychlejší než při užití normálního lidského inzulinu.
Kombinace přípravku Humalog s pioglitazonem:
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tuto skutečnost je třeba vzít v úvahu, pokud je zvažována kombinovaná léčba pioglitazonem a přípravkem Humalog.
Pokud se podává kombinovaná léčba, u pacientů je třeba sledovat, zda se neobjevují známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčbu pioglitazonem je třeba přerušit, pokud dojde k jakémukoliv zhoršení srdečních příznaků.
Návod k použití a pokyny pro zacházení
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
Předcházení chybám v medikaci při užívání inzulinu lispro (200 jednotek/ml) v předplněném peru: Injekční roztok inzulinu lispro o obsahu 200 jednotek/ml nesmí být z předplněného pera KwikPen přenášen do injekční stříkačky. Značení na inzulinové stříkačce nebude měřit dávku správně. Předávkování může způsobit závažnou hypoglykémii. Injekční roztok inzulinu lispro o koncentraci 200 jednotek/ml nesmí být z předplněného pera KwikPen přetahován do žádné jiné inzulinové aplikační pomůcky včetné inzulinových infúzních pump.
Pacient musí být poučen a nutnosti vždy před každou aplikací injekce zkontrolovat štítek inzulinu, aby se vyloučila nechtěná záměna rozdílných sil přípravku Humalog a jiných inzulinových přípravků.
Pomocné látky
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) v jedná dávce, tj. „zanedbatelné množství sodíku“.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Potřeba inzulinu může být zvýšena léky s hyperglykemickým účinkem, jako jsou perorální kontraceptiva, kortikosteroidy nebo hormonální substituce při léčbě poruch štítné žlázy, danazol, beta-2-mimetika (například ritodrin, salbutamol, terbutalin).
Potřeba inzulinu může být snížena při podávání léků s hypoglykemickým účinkem, jako jsou perorální antidiabetika, salicyláty (například Acylpyrin, Aspirin), sulfonamidy, některá antidepresiva (inhibitory monoaminooxidázy, selektivní inhibitory zpětného vychytávání serotoninu), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, beta-blokátory, oktreotid nebo alkohol.
Při užívání jiných léčivých přípravků podávaných současně s Humalogem 200 jednotek/ml KwikPen by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o použití u velkého počtu těhotných nesvědčí o nepříznivém vlivu inzulinu lispro na těhotenství nebo plod či novorozence.
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientky léčené inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem je třeba poučit o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují. Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
Kojení
Kojící diabetičky mohou potřebovat úpravu dávky inzulínu, diety nebo obojího.
Fertilita
Ve studiích na zvířatech inzulin lispro nezpůsoboval zhoršení fertility (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být narušena v důsledku hypoglykémie. To může představovat riziko v situacích specielně vyžadujících výše uvedené schopnosti (např. schopnost řídit nebo obsluhovat stroje).
Pacienta je třeba poučit o nutnosti zabránit hypoglykémii během řízení. To je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté epizody hypoglykémie. Za těchto okolností je třeba pečlivě zvážit vhodnost řízení motorových vozidel.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nejčastějším nežádoucím účinkem terapie inzulinem lispro u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti.
Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů, jako je intenzita tělesné námahy nebo dieta, není uvedena četnost výskytu hypoglykémie.
Tabulkový přehled nežádoucích účinků
V níže uvedené tabulce jsou shrnuty nežádoucí účinky z klinických studií v terminologii preferované MedDRA dle orgánových tříd a řazeny sestupně podle frekvence výskytu (velmi časté: >1/10; časté: >1/100 až <1/10; méně časté: >1/1000 až <1/100; vzácné: >1/10000 až <1/1000; velmi vzácné: <1/10000).
U každé skupiny frekvence výskytu jsou nežádoucí účinky řazeny sestupně podle míry závažnosti.
Orgánová třída Velmi časté Časté Méně časté Vzácné Velmi
MedDRA vzácné
Poruchy imunitního systému
Poruchy kůže a podkožní tkáně
Popis vybraných nežádoucích účinků
Lokální přecitlivělost
Lokální přecitlivělost je u pacientů častá. Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu. Tento stav obvykle ustoupí během několika dnů nebo týdnů. V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou.
Systémová alergie
Systémová alergie, která je vzácná, ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit výsev vyrážky po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život.
Lipodystrofie
Lipodystrofie v místě aplikace injekce je méně častá.
Edém
Byly hlášeny případy edémů v průběhu léčby inzulinem, zejména pokud došlo ke zlepšení předchozího špatného metabolického stavu intenzifikací inzulinové terapie.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože sérová hladina krevního cukru je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinu v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy nebo jiného cukru nebo produktu obsahujícího sacharidy.
Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním uhlovodanů, pokud se pacient dostatečně zotavuje. Pacienti, kteří nereagují na glukagon, musí dostat infúzi glukózy intravenózně.
Pokud je pacient v komatu, glukagon je třeba aplikovat intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: léčiva k terapii diabetu, inzuliny a analogy k injekční aplikaci, rychle působící, ATC kód: A10AB04.
Primárním účinkem inzulinu lispro je regulace metabolismu glukózy.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogenezy, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Insulin lispro má rychlý nástup účinku (přibližně 15 minut), a tím umožňuje v porovnání s normálním inzulínem (aplikace 30 až 45 minut před jídlem) podání velmi krátce před jídlem nebo po jídle (interval od 0 do 15 minut). Nástup účinku inzulinu lispro je rychlý a doba aktivity kratší (2 až 5 hodin) ve srovnání s normálním inzulinem.
Klinické studie s pacienty s diabetem typu 1 nebo 2 prokázaly nižší výskyt postprandiální hyperglykémie u inzulinu lispro ve srovnání s normálním lidským inzulinem.
Časový průběh aktivity inzulinu lispro může být odlišný u různých individuí nebo odlišný v různých časových obdobích u stejných individuí v závislosti na místě injekce, krevním zásobení, teplotě a fyzické aktivitě. Typický průběh aktivity v čase po subkutánní injekci ilustruje následující graf.
Obrázek 1:

Graf (obrázek 1) odráží relativní množství glukózy v závislosti na čase potřebné k udržení celkové plazmatické glukózové koncentrace testovaného subjektu blízko hladinám nalačno a je indikátorem účinku těchto inzulinů (100 jednotek/ml) na metabolismus glukózy v průběhu času.
Farmakodynamické odpovědi inzulinu lispro u injekčního roztoku 200 jednotek/ml jsou podobné odpovědím pro injekční roztok inzulinu lispro 100 jednotek/ml po subkutanním podání jednorázové dávky 20 jednotek zdravým subjektům, jak je ukázáno v grafu níže (obrázek 2).

Čas (hod)
Obrázek (graf) 2: Průměrná aritmetická rychlost infúze glukózy oproti časovému profilu po subkutánním podání 20 jednotek inzulínu lispro 200 jednotek/ml nebo inzulínu lispro 100 jednotek/ml
U pacientů s diabetem typu 2 užívajícím maximální dávky derivátů sulfonylurey studie ukázaly, že při kombinaci s inzulinem lispro se významně sníží hladina HbA1C ve srovnání s užívaním samotné sulfonylurey. Snížení hladiny HbA1C lze očekávat rovněž při kombinaci s jinými přípravky inzulinu, např. normálním nebo isofan inzulinem.
Klinické studie s pacienty s diabetem typu 1 a 2 prokázaly nižší počet nočních hypoglykémií s inzulinem lispro ve srovnání s normálním lidským inzulinem. V některých studiích byl nižší počet nočních hypoglykémií spojen se zvýšeným počtem denních hypoglykémií.
Glukodynamická odpověď na inzulin lispro není ovlivněna jaterní nebo renální insuficiencí. Glukodynamické rozdíly mezi inzulinem lispro a normálním lidským inzulinem měřené v průběhu glukosového clampu se neměnily v celém širokém spektru renálních funkcí.
Bylo prokázáno, že inzulin lispro je molárně ekvivalentní s lidským inzulinem, ale jeho účinek nastupuje rychleji a má kratší dobu trvání.
5.2 Farmakokinetické vlastnosti
Farmakokinetika insulinu lispro odpovídá látce, která je rychle absorbována a dosahuje nejvyšších hladin v plazmě v době od 30 do 70 minut po subkutánním podání. Při zvažování klinické relevance této kinetiky je třeba prozkoumat křivky utilizace glukózy ( viz 5.1).
Inzulin lispro je u pacientů s renální insuficiencí absorbován mnohem rychleji než normální lidský inzulin. U pacientů s diabetem typu 2 v celém širokém spektru všech renálních funkcí se farmakokinetické diference mezi inzulinem lispro a normálním lidským inzulinem neměnily a ukázaly se nezávislými na renálních funkcích. Inzulin lispro je u pacientů s jaterní insuficiencí absorbován a eliminován mnohem rychleji než normální lidský inzulin.
Po subkutánním podání jednorázové dávky 20 jednotek byl u zdravých subjektů injekční roztok inzulinu lispro 200 jednotek/ml bioekvivalentní injekčnímu roztoku inzulinu lispro 100 jednotek/ml. U obou sil byl podobný také čas dosažení maximální koncentrace.
5.3 Předklinické údaje vztahující se k bezpečnosti
Při testech provedených in vitro, zahrnujících vazbu na inzulínové receptory a účinky na rostoucí buňky, se inzulin lispro choval způsobem, který velmi připomínal humánní inzulin. Studie též prokázaly, že disociace vazby inzulínu lispro na inzulínový receptor je totožná s humánním inzulinem. Akutní, jeden měsíc a dvanáct měsíců trvající toxikologické studie neprokázaly žádné významné toxické účinky.
Ve studiích na zvířatech inzulin lispro nezpůsoboval zhoršení fertility, nebyl embryotoxický a teratogenní.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
metakresol glycerol trometamol oxid zinečnatý voda na injekci
kyselina chlorovodíková a hydroxid sodný (k úpravě pH).
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s žádným jiným inzulinem nebo jiným léčivým přípravkem. Injekční roztok nesmí být ředěn.
6.3 Doba použitelnosti
Nepoužité _ předplněné _ pero 3 roky.
Po prvním použití 28 dnů
6.4 Zvláštní opatření pro uchovávání
Nepoužité _ předplněné _ pero
Uchovávejte v chladničce (2 °C - 8 °C ). Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Po _ prvním _ použití
Uchovávejte při teplotě do 30 °C. Chraňte před chladem. Předplněné pero nesmí být uchováváno s nasazenou jehlou.
6.5 Druh obalu a obsah balení
Zásobní vložky ze skla typu I utěsněné chlorobutylovou diskovitou zátkou a pístem a zabezpečené hliníkovým krytem. K ošetření pístu a/nebo skla vložky může být použit dimethicon nebo silikonová emulze. 3ml zásobní vložky, které obsahují 600 jednotek inzulinu lispro (200 jednotek/ml), jsou součástí předplněného dávkovače k jednorázovému použití, nazývaného „KwikPen“ Jehly nejsou obsaženy.
1 předplněné pero 3 ml
2 předplněná pera 3 ml 5 předplněných per 3 ml
Multipack obsahující 10 (2 balení po 5) předplněných per 3 ml Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Návod k použití přípravku a zacházení s ním
Pro prevenci přenosu infekce musí být jedno pero používáno pouze jedním pacientem, a to i v případě, že je vyměněna jehla.
Injekční roztok přípravku Humalog by měl by být čirý a bezbarvý. Přípravek Humalog se nesmí používat, pokud se jeví zakalený, zahuštěný nebo lehce zabarvený nebo pokud jsou v něm viditelné pevné částice.
Zacházení s předplněným perem
Před zahájením používání pera KwikPen je nutné pečlivě prostudovat Návod k použití, který je součástí příbalové informace. Pero KwikPen musí být používáno podle pokynů v tomto návodu.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
8. REGISTRAČNÍ ČÍSLA
EU/1/96/007/039
EU/1/96/007/040
EU/1/96/007/041
EU/1/96/007/042
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 30. dubna 1996 Datum prodloužení registrace: 30. dubna 2006
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobců biologické léčivé látky
Fermentation: Eli Lilly and Company, Lilly Technology Center Building 333 and 324, Indianapolis, Indiana, USA
Lilly del Caribe, Inc., Puerto Rico Industrial Park, 12.3 KM (PR05), 65th Infantry Road, Carolina, Puerto Rico 00985
Granule Recovery: Eli Lilly and Company, Lilly Technology Center Building 130, Indianapolis, Indiana, USA
Lilly del Caribe, Inc., Puerto Rico Industrial Park, 12.3 KM (PR05), 65th Infantry Road, Carolina, Puerto Rico 00985
Název a adresa výrobců odpovědných za propouštění šarží Injekční lahvičky (pouze Humalog Mix 50)
Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
Lilly Pharma Fertigung und Distribution GmbH & Co. KG, Teichweg 3, 35396 Giessen, Německo.
Injekční lahvičky kromě přípravku Humalog Mix50
Lilly S.A., Avda. de la Industria 30, 28108 Alcobendas, Madrid, Španělsko.
Zásobní vložky
Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
Zásobní vložky kromě přípravků Humalog BASAL
Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
Pera „KwikPen" (100 jednotek/ml)
Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
Lilly Pharma Fertigung und Distribution GmbH & Co. KG, Teichweg 3, 35396 Giessen, Německo.
Pera „KwikPen" (100 jednotek/ml) mimo přípravků Humalog BASAL KwikPen
Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
Pera ..KwikPen" (200 jednotek/ml)
Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
• Další opatření k minimalizaci rizik (Humalog 200 jednotek/ml)
Před uvedením přípravku na trh poskytne držitel rozhodnutí o registraci všem cílovým lékařům, sestrám, u kterých se předpokládá účast v léčbě diabetických pacientů, a v případě potřeby i lékárníkům s předpokladem vydávání přípravku Humalog edukační materiál pro zdravotnické pracovníky (DHPC) a Edukační materiál pro pacienty.
Cílová skupina komunikace a podmínky distribuce těchto materiálů budou odsouhlaseny na úrovni členského státu. Před uvedením přípravku na trh musí držitel rozhodnutí o registraci dohodnout s národní autoritou členského státu konečný text Edukačního materiálu pro zdravotnické pracovníky (DHCP) a obsah Edukačního materiálu pro pacienty včetně způsobu předání těchto informací.
DHPC a Edukační materiál pro pacienty jsou určeny ke zdůraznění skutečnosti, že přípravek Humalog je nyní dostupný ve dvou silách a bude popisovat klíčové rozdíly v designu balení a předplněného pera, aby se minimalizovalo riziko chyby v medikaci a záměně mezi rozdílnými silami přípravku Humalog.
Držitel rozhodnutí o registraci zajistí, aby zdravotničtí pracovníci byli informováni, o nutnosti proškolit všechny pacienti, kterým byl přípravek Humalog předepsán, ve správném používání předplněného pera dříve, než je jim přípravek Humalog předepsán nebo vydán.
DHPC by měl zdůraznit tyto klíčové prvky:
• Humalog je nyní dostupný ve 2 silách
• Klíčové znaky designu balení a předplněného pera
• Při předepisování přípravku nutnost ověření, že na lékařském předpisu je uvedena správná síla přípravku
• Humalog nesmí být použán mimo předplněné pero
• Při převádění z přípravku Humalog 100 jednotek na 200 jednotek nedochází ke konverzi dávky
• Chyby v medikaci nebo jakékoli nežádoucí účinky mají být hlášeny
Edukační materiál pro pacienty by měl zdůraznit tyto klíčové prvky:
• Humalog je nyní dostupný ve 2 silách
• Klíčové znaky designu balení a předplněného pera
• Humalog nesmí být použán mimo předplněné pero
• Při převádění z přípravku Humalog 100 jednotek na 200 jednotek nedochází ke konverzi dávky
• Před každou inj ekcí j e nutné zkontrolovat počet nastavených jednotek
• Při vyzvednutí v lékárně je nutné zkontrolovat název, typ a sílu inzulinu
• Chyby v medikaci nebo jakékoli nežádoucí účinky mají být hlášeny
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
SKLÁDAČKA TEXT (1 LAHVIČKA)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog 100 IU/ml, injekční roztok v injekční lahvičce insulinům lisprum (původem z rDNA)
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
insulinům lisprum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem jako konzervantem ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok 1x10 ml injekční lahvička
5. ZPŮSOB A CESTY PODÁNÍ
Podkožní nebo nitrožilní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
8. POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Lahvička po prvním použití může být užívána 28 dnů. Používané lahvičky mají být uchovávány za teploty do 30°C.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/96/007/002 13 ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis 15 NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
SKLÁDAČKA TEXT (2 LAHVIČKY)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
|
Humalog 100 IU/ml, injekční roztok v insulinum lisprum (původem z rDNA) |
injekční lahvičce |
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
insulinum lisprum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem jako konzervantem ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok 2x10 ml injekční lahvička
5 ZPŮSOB A CESTY PODÁNÍ
Podkožní nebo nitrožilní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI 8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Lahvička po prvním použití může být užívána 28 dnů. Používané lahvičky mají být uchovávány za teploty do 30°C.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/96/007/020 13 ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis 15 NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
SKLÁDAČKA TEXT (5X1 LAHVIČKA)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
|
Humalog 100 IU/ml, injekční roztok v insulinum lisprum (původem z rDNA) |
injekční lahvičce |
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
insulinum lisprum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem jako konzervantem ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok Součást multipaku 5x(1x10 ml) injekční lahvička. Neprodávat jednotlivě.
5 ZPŮSOB A CESTY PODÁNÍ
Podkožní nebo nitrožilní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI 8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Lahvička po prvním použití může být užívána 28 dnů. Používané lahvičky mají být uchovávány za teploty do 30°C.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/96/007/021 13 ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis 15 NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTY PODÁNÍ
Humalog 100 IU/ml, injekční roztok v injekční lahvičce
Insulinům lisprum
Podkožní nebo nitrožilní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
10 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA TEXT (5x3 ml zásobní vložky)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
|
Humalog 100 IU/ml, injekční roztok v insulinum lisprum (původem z rDNA) |
zásobní vložce |
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
insulinum lisprum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem jako konzervantem ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok 5x3 ml zásobní vložky
5 ZPŮSOB A CESTY PODÁNÍ
Podkožní nebo nitrožilní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI Tyto zásobní vložky jsou pro užití pouze v 3 ml perech.
Je-li předepsána injekční lahvička 40 IU/ml, nenatahujte inzulin ze zásobní vložky 100 IU/ml pomocí 40 IU/ml stříkačky.
8. POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 28 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/96/007/004 13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ (Zde odtrhněte.)
BALENÍ JE OTEVŘENO.
16. INFORMACE V BRAILLOVE PÍSMU
Humalog
SKLÁDAČKA TEXT (2 x 5x3 ml zásobní vložky)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
|
Humalog 100 IU/ml, injekční roztok v insulinum lisprum (původem z rDNA) |
zásobní vložce |
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
insulinum lisprum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem jako konzervantem ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok
Součást multipaku 2x(5x3 ml) zásobní vložky. Neprodávat jednotlivě.
5 ZPŮSOB A CESTY PODÁNÍ
Podkožní nebo nitrožilní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI Tyto zásobní vložky jsou pro užití pouze v 3 ml perech.
Je-li předepsána injekční lahvička 40 IU/ml, nenatahujte inzulin ze zásobní vložky 100 IU/ml pomocí 40 IU/ml stříkačky.
8. POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 28 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/96/007/023 13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ (Zde odtrhněte.)
BALENÍ JE OTEVŘENO.
16. INFORMACE V BRAILLOVE PÍSMU
Humalog
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTY PODÁNÍ
Humalog 100 IU/ml, injekční roztok v zásobní vložce
Insulinům lisprum
Podkožní nebo nitrožilní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA TEXT
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog Mix25 100 IU/ml injekční suspenze v injekční lahvičce
25% insulinům lisprum a 75% suspenze insulinum lisprum isophanum (původem z rDNA)
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
25% insulinum lisprum a 75% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze 1x10 ml v injekční lahvičce
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI Pečlivě promíchejte. Viz vložená příbalová informace.
8. POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Lahvička po prvním použití může být užívána 28 dnů. Používané lahvičky mají být uchovávány za teploty do 30°C.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/96/007/005 13 ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis 15 NÁVOD K POUŽITÍ
16 INFORMACE V BRAILLOVĚ PÍSMU
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Humalog Mix25 100 IU/ml injekční suspenze v injekční lahvičce 25% insulinům lisprum a 75% suspenze insulinům lisprum isophanum subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
10 ml (3,5 mg/ml) EU/1/96/007/005
6. JINÉ
SKLÁDAČKA TEXT (5x3 ml zásobní vložky)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog Mix25 100 IU/ml injekční suspenze v zásobní vložce
25% insulinum lisprum a 75% suspenze insulinum lisprum isophanum (původem z rDNA)
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
25% insulinum lisprum a 75% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze 5x3 ml v zásobní vložce
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
Tyto zásobní vložky jsou pro užití pouze v 3 ml perech.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 28 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/96/007/008
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
(Zde odtrhněte .)BALENÍ JE OTEVŘENO
16. INFORMACE V BRAILLOVE PÍSMU
Humalog Mix25
SKLÁDAČKA TEXT (2 x 5 x 3 ml zásobní vložky)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog Mix25 100 IU/ml injekční suspenze v zásobní vložce
25% insulinum lisprum a 75% suspenze insulinum lisprum isophanum (původem z rDNA)
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
25% insulinum lisprum a 75% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| Součást dvojitého balení 2x(5x3 ml) zásobní vložky. Neprodávat odděleně.
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
Tyto zásobní vložky jsou pro užití pouze v 3 ml perech.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 28 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/96/007/024
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
(Zde odtrhněte)
BALENÍ JE OTEVŘENO
16. INFORMACE V BRAILLOVE PÍSMU
Humalog Mix25
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Humalog Mix25 100 IU/ml injekční suspenze v zásobní vložce 25% insulinum lisprum a 75% suspenze insulinum lisprum isophanum Subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA TEXT
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog Mix50 100 IU/ml injekční suspenze v injekční lahvičce
50% insulinům lisprum a 50% suspenze insulinum lisprum isophanum (původem z rDNA)
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
50% insulinum lisprum a 50% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze 1x10 ml v injekční lahvičce
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI Pečlivě promíchejte. Viz vložená příbalová informace.
8. POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Lahvička po prvním použití může být užívána 28 dnů. Používané lahvičky mají být uchovávány za teploty do 30°C.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/96/007/019 13 ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis 15 NÁVOD K POUŽITÍ
16 INFORMACE V BRAILLOVĚ PÍSMU
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Humalog Mix50 100 IU/ml injekční suspenze v injekční lahvičce 50% insulinům lisprum a 50% suspenze insulinům lisprum isophanum Subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
10 ml (3,5 mg/ml) EU/1/96/007/019
6. JINÉ
SKLÁDAČKA TEXT (5x3 ml zásobní vložky)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog Mix50 100 IU/ml injekční suspenze v zásobní vložce
50% insulinum lisprum a 50% suspenze insulinům lisprum isophanum (původem z rDNA)
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
50% insulinum lisprum a 50% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze 5x3 ml v zásobní vložce
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
Tyto zásobní vložky jsou pro užití pouze v 3 ml perech.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 28 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/96/007/006
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
(Zde odtrhněte.)
BALENÍ JE OTEVŘENO.
16. INFORMACE V BRAILLOVE PÍSMU
Humalog Mix50
SKLÁDAČKA TEXT (2 x 5 x 3 ml zásobní vložky)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog Mix50 100 IU/ml injekční suspenze v zásobní vložce
50% insulinum lisprum a 50% suspenze insulinům lisprum isophanum (původem z rDNA)
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
50% insulinum lisprum a 50% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| Součást dvojitého balení 2x(5x3 ml) zásobní vložky. Neprodávat odděleně.
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
Tyto zásobní vložky jsou pro užití pouze v 3 ml perech.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 28 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/96/007/025
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
(Zde odtrhněte)
BALENÍ JE OTEVŘENO
16. INFORMACE V BRAILLOVE PÍSMU
Humalog Mix50
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Humalog Mix50 100 IU/ml injekční suspenze v zásobní vložce 50% insulinum lisprum a 50% suspenze insulinum lisprum isophanum Subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA (5x3 ml zásobní vložky)
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog BASAL 100 IU/ml injekční suspenze v zásobní vložce suspenze insulinům lisprum isophanum (původem z rDNA)
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
suspenze insulinum lisprum isophanum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje protamin sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze 5x3 ml zásobní vložky
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz. vložená příbalová informace.
Tyto zásobní vložky jsou pro užití pouze v 3 ml perech.
8. POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 21 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/96/007/010
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
(Zde odtrhněte)
BALENÍ JE OTEVŘENO
16. INFORMACE V BRAILLOVE PÍSMU
Humalog BASAL
SKLÁDAČKA (2x 5x3 ml zásobní vložky)
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog BASAL 100 IU/ml injekční suspenze v zásobní vložce suspenze insulinům lisprum isophanum (původem z rDNA)
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
suspenze insulinum lisprum isophanum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje protamin sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| Součást multipaku 2x(5x3 ml) zásobní náplně. Neprodávat jednotlivě.
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz. vložená příbalová informace.
Tyto zásobní vložky jsou pro užití pouze v 3 ml perech.
8. POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Zásobní vložka po prvním použití může být užívána 21 dnů. Po založení do pera mají být zásobní vložka a pero uchovávány za teploty do 30°C a nemají být uchovávány v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/96/007/029
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
(Zde odtrhněte)
BALENÍ JE OTEVŘENO
16. INFORMACE V BRAILLOVE PÍSMU
Humalog BASAL
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Humalog BASAL 100 IU/ml injekční suspenze v zásobní vložce suspenze insulinům lisprum isophanum (původem z rDNA) Subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4. ČÍSLO SARZE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA TEXT (5x3 ml pera)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog 100 IU/ml KwikPen, injekční roztok insulinům lisprum (původem z rDNA)
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
insulinum lisprum (původem z rDNA) |
100U/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem jako konzervantem ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok 5x3 ml předplněná pera
5. ZPŮSOB A CESTY PODÁNÍ
Podkožní nebo nitrožilní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI 8. POUŽITELNOST
EXP {MM/RRRR}
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno až 28 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/96/007/031 13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15. NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Humalog KwikPen
SKLÁDAČKA TEXT (2x 5 x 3 ml pera)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog 100 IU/ml KwikPen, injekční roztok insulinům lisprum (původem z rDNA)
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
insulinum lisprum (původem z rDNA) |
100U/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem jako konzervantem ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok Součást multipaku 2x(5x3 ml) předplněná pera. Neprodávat jednotlivě.
5. ZPŮSOB A CESTY PODÁNÍ
Podkožní nebo nitrožilní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI 8. POUŽITELNOST
EXP {MM/RRRR}
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno až 28 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12 REGISTRAČNÍ ČÍSLO
EU/1/96/007/032 13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15. NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Humalog KwikPen
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTY PODÁNÍ
Humalog 100 IU/ml KwikPen, injekční roztok
Insulinům lisprum
Podkožní nebo nitrožilní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA TEXT (5x3 ml pera)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog Mix25 100 IU/ml KwikPen injekční suspenze
25% insulinům lisprum a 75% suspenze insulinům lisprum isophanum (původem z rDNA)
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
25% insulinum lisprum a 75% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| 5x3 ml předplněná pera
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno až 28 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V.
Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
12. REGISTRAČNÍ ČÍSLO
EU/1/96/007/033
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Humalog Mix25 KwikPen
SKLÁDAČKA TEXT (2 x 5 x 3 ml pera)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog Mix25 100 IU/ml KwikPen injekční suspenze
25% insulinům lisprum a 75% suspenze insulinům lisprum isophanum (původem z rDNA)
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
25% insulinum lisprum a 75% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| Součást multipaku 2x(5x3 ml) předplněná pera. Neprodávat jednotlivě.
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno až 28 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V.
Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
12. REGISTRAČNÍ ČÍSLO
EU/1/96/007/034
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Humalog Mix25 KwikPen
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Humalog Mix25 100 IU/ml KwikPen injekční suspenze
25% insulinům lisprum a 75% suspenze insulinům lisprum isophanum
Subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA TEXT (5x3 ml pera)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog Mix50 100 IU/ml KwikPen injekční suspenze
50% insulinům lisprum a 50% suspenze insulinům lisprum isophanum (původem z rDNA)
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
50% insulinum lisprum a 50% suspenze insulinům lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| 5x3 ml předplněná pera
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno až 28 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V.
Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
12. REGISTRAČNÍ ČÍSLO
EU/1/96/007/035
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Humalog Mix50 KwikPen
SKLÁDAČKA TEXT (2 x 5 x 3 ml pera)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog Mix50 100 IU/ml KwikPen injekční suspenze
50% insulinům lisprum a 50% suspenze insulinům lisprum isophanum (původem z rDNA)
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
50% insulinum lisprum a 50% suspenze insulinum lisprum isophanum (původem z rDNA) 100 IU/ml (3,5 mg/ml)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje protamin sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| Součást multipaku 2x(5x3 ml) předplněná pera. Neprodávat jednotlivě.
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI
Pečlivě promíchejte. Viz vložená příbalová informace.
8 POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno až 28 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V.
Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
12. REGISTRAČNÍ ČÍSLO
EU/1/96/007/036
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Humalog Mix50 KwikPen
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Humalog Mix50 100 IU/ml KwikPen injekční suspenze
50% insulinům lisprum a 50% suspenze insulinům lisprum isophanum
Subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4 ČÍSLO ŠARŽE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
SKLÁDAČKA (5x3 ml pera)
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog BASAL 100 IU/ml KwikPen injekční suspenze suspenze insulinům lisprum isophanum (původem z rDNA)
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
suspenze insulinum lisprum isophanum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje protamin sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| 5x3 ml předplněná pera
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI Pečlivě promíchejte. Viz. vložená příbalová informace.
8. POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno 21 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V.
Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
12. REGISTRAČNÍ ČÍSLO
EU/1/96/007/037
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Humalog BASAL KwikPen
SKLÁDAČKA (2 x 5x3 ml pera)
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog BASAL 100 IU/ml KwikPen injekční suspenze suspenze insulinům lisprum isophanum (původem z rDNA)
|
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK | |
|
suspenze insulinum lisprum isophanum (původem z rDNA) |
100 IU/ml (3,5 mg/ml) |
|
3. SEZNAM POMOCNÝCH LÁTEK | |
Obsahuje protamin sulfát, glycerol, oxid zinečnatý, heptahydrát hydrogenfosforečnanu sodného s metakresolem a fenolem jako konzervanty ve vodě na injekci.
Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH
Injekční suspenze| Součást multipaku 2x(5x3 ml) předplněná pera. Neprodávat jednotlivě.
5. ZPŮSOB A CESTA PODÁNÍ
Podkožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
Uchovávejte mimo dosah a dohled dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
DŮLEŽITÉ: ČTĚTE VLOŽENOU PŘÍBALOVOU INFORMACI Pečlivě promíchejte. Viz. vložená příbalová informace.
8. POUŽITELNOST
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být užíváno 21 dnů. Používané pero má být uchováváno za teploty do 30°C a nemá být uchováváno v chladničce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V.
Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
12. REGISTRAČNÍ ČÍSLO
EU/1/96/007/038
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15 NÁVOD K POUŽITÍ
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
16. INFORMACE V BRAILLOVE PÍSMU
Humalog BASAL KwikPen
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Humalog BASAL 100 IU/ml KwikPen injekční suspenze suspenze insulinům lisprum isophanum (původem z rDNA) Subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP {MM/RRRR)
4. ČÍSLO SARZE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
3 ml (3,5 mg/ml)
6. JINÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA KwikPen, balení obsahující 1, 2 a 5 per
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog 200 jednotek/ml injekční roztok v předplněném peru insulinům lisprum
2 OBSAH LÉČIVÉ LÁTKY
Jeden ml roztoku obsahuje 200 jednotek insulinům lisprum (odpovídá 6,9 mg)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje glycerol, oxid zinečnatý, trometamol, metakresola vodu na injekci. Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok. KwikPen
1 pero 3 ml
2 pera 3 ml 5 per 3 ml
5. ZPŮSOB A CESTY PODÁNÍ
Před použití si přečtěte příbalovou informaci. Subkutánní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Používejte pouze v tomto peru, jinak může dojít k závažnému předávkování.
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být používáno až 28 dnů. Používané pero uchovávejte při teplotě do 30 °C a chraňte před chladem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11 NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V.
Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
12. REGISTRAČNÍ ČÍSLO
EU/1/96/007/039 1pero
EU/1/96/007/040 2 pera
EU/1/96/007/041 5 per
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15. NÁVOD K POUŽITÍ 16. INFORMACE V BRAILLOVE PÍSMU
Humalog 200 jednotek/ml
VNITŘNÍ KRABIČKA (bez blue boxu) součást multipacku - KwikPen
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog 200 jednotek/ml injekční roztok v předplněném peru insulinům lisprum
2 OBSAH LÉČIVÉ LÁTKY
Jeden ml roztoku obsahuje 200 jednotek insulinům lisprum (odpovídá 6,9 mg).
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje glycerol, oxid zinečnatý, trometamol, metakresola vodu na injekci. Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok. KwikPen.
Multipak: 5 per 3 ml. Součást multipaku, neprodávat zvlášť.
5. ZPŮSOB A CESTY PODÁNÍ
Před použití si přečtěte příbalovou informaci Subkutánní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Používejte pouze v tomto peru, jinak může dojít k závažnému předávkování.
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být používáno až 28 dnů. Používané pero uchovávejte při teplotě do 30 °C a chraňte před chladem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11 NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V.
Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
12. REGISTRAČNÍ ČÍSLO
EU/1/96/007/042
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15. NÁVOD K POUŽITÍ 16. INFORMACE V BRAILLOVE PÍSMU
Humalog 200 jednotek/ml
VNĚJŠÍ KARBIČKA (s blue boxem) multipack - KwikPen
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Humalog 200 jednotek/ml injekční roztok v předplněném peru insulinům lisprum
2 OBSAH LÉČIVÉ LÁTKY
Jeden ml roztoku obsahuje 200 jednotek insulinům lisprum (odpovídá 6,9 mg)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje glycerol, oxid zinečnatý, trometamol, metakresola vodu na injekci. Kyselina chlorovodíková a hydroxid sodný mohou být použity k úpravě kyselosti.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok. KwikPen.
Multipak: 10 (2 balení po 5) per 3 ml.
5. ZPŮSOB A CESTY PODÁNÍ
Před použití si přečtěte příbalovou informaci Subkutánní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Používejte pouze v tomto peru, jinak může dojít k závažnému předávkování.
Je-li uzávěr poškozen před prvním použitím, kontaktujte lékárníka.
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Pero po prvním použití může být používáno až 28 dnů. Používané pero uchovávejte při teplotě do 30 °C a chraňte před chladem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11 NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V.
Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
12. REGISTRAČNÍ ČÍSLO
EU/1/96/007/042
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15. NÁVOD K POUŽITÍ 16. INFORMACE V BRAILLOVE PÍSMU
Humalog 200 jednotek/ml
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITRNÍM OBALU ŠTÍTEK na peru
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTY PODÁNÍ
Humalog 200 jednotek/ml KwikPen, injekční roztok Insulinům lisprum Subkutánní podání
2 ZPŮSOB PODÁNÍ
3 POUŽITELNOST
EXP
4. ČÍSLO SARZE
Č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK 3 ml
6. JINÉ
POUŽÍVEJTE POUZE V TOMTO PERU, JINAK MŮZe DOJÍT K ZÁVAŽNÉMU PŘEDÁVKOVÁNÍ.
Humalog 100 IU/ml, injekční roztok v injekční lahvičce insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Humalog a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog užívat
3. Jak se přípravek Humalog užívá
4. Možné nežádoucí účinky
5. Jak přípravek Humalog uchovávat
6. Obsah balení a další informace
1. Co je přípravek Humalog a k čemu se používá
Přípravek Humalog se používá k léčbě diabetu. Díky lehce pozměněné molekule inzulinu má přípravek Humalog rychlejší účinek než normální lidský inzulin.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Humalog je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem působí přípravek Humalog velmi rychle a po kratší dobu (2-5 hodin). Za normálních okolností byste měli užívat Humalog v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Humalog v kombinaci s déle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
Humalog je vhodný pro děti a dospělé. Humalog může být u dětí použit v případě, kdy je oproti normálnímu lidskému inzulinu přínosem jeho rychlý nástup účinku, např. načasování injekce vzhledem k jídlu.
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog užívat
NEUŽÍVEJTE přípravek Humalog
. máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Humalog, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže
v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Humalog
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného vychytávání serotoninu),
• danazol,
• některé inhibitory angiotensin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření “).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
Jak se přípravek Humalog užívá
3.
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulínu označený
na krabičce a lahvičce. Ujistěte se, že jste obdrželi lékařem doporučený Humalog.
Vždy užívejte přípravek Humalog přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte
se se svým lékařem.
Dávkování
• Za normálních okolností byste si měli aplikovat Humalog v rozmezí 15 minut kolem jídla. V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Humalog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Humalog podávejte podkožně. Nitrosvalové podání je možné pouze po doporučení lékařem.
Příprava Humalogu
• Humalog je již rozpuštěný ve vodě, nemusíte ho proto míchat. Použijte ho pouze pokud vypadá jako voda. Musí být čirý, bezbarvý a nesmí obsahovat pevné částice. Před každou aplikací lahvičku zkontrolujte.
Aplikace Humalogu
• Nejprve si umyjte ruce.
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Očistěte gumový uzávěr lahvičky, ale neodstraňujte ho.
• Použijte čistou sterilní stříkačku a jehlu. Jehlu vbodněte do lahvičky a natáhněte potřebné množství Humalogu podle instrukce lékaře. Jehly a stříkačky s nikým nesdílejte.
• Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci
ponechte jehlu v kůži po dobu 5 sekund. Tím se ujistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni. Není důležité, které místo pro aplikaci použijete, zda horní část paže, stehno, zadek nebo břicho.
Humalog vždy účinkuje rychleji než normální lidský inzulin.
• Váš lékař vás informuje, zda si máte Humalog míchat s jiným lidským inzulinem. Pokud si
musíte aplikovat směs, natáhněte Humalog do stříkačky jako první před déle působícím inzulinem. Směs si aplikujte ihned po přípravě. Postupujte vždy stejným způsobem.
Za normálních okolností byste neměli míchat Humalog s jinou směsí lidského inzulinu. Nikdy byste neměli Humalog míchat s inzuliny jiného výrobce nebo se zvířecími inzuliny.
• Humalog si nesmíte aplikovat nitrožilně. Aplikujte si ho dle rady lékaře či sestry. Nitrožilně vám může Humalog podat pouze lékař. Udělá to jen za zvláštních okolností jako je chirurgický výkon nebo v případě, že jste nemocní a hladina glukózy ve vaší krvi je velmi vysoká.
Použití Humalogu v infúzních pumpách
• K infúzím Humalogu je možno použít pouze určité inzulinové infúzní pumpy s označením CE. Před infúzí inzulinu lispro si v instrukcích výrobce ověřte vhodnost infúzní pumpy. Při jejich používání se řiďte návodem k obsluze inzulinové pumpy.
• Spolu s pumpou používejte správný zásobník a katetr.
• Výměna infuzního setu (katetru a kanyly) musí být provedena podle pokynů uvedených v
informaci o produktu dodané společně s infúzním setem.
• V případě hypoglykémie by měla být infuze přerušena až do jejího odeznění. Naměříte-li si výrazně nízké nebo opakovaně nízké hladiny glukózy v krvi, upozorněte svého lékaře a zvažte, zda není nutno infúzi zpomalit či zastavit.
• Porucha pumpy nebo ucpání infúzního setu může způsobit náhlý vzestup hladiny glukózy. V případě podezření, že je průtok inzulínu přerušen, se řiďte pokyny v návodu k obsluze, případně uvědomte svého lékaře.
• Při používání infuzní pumpy by neměl být Humalog mísen s jinými inzulíny.
Jestliže jste užil(a) více přípravku Humalog, než jste měl(a)
Jestliže jste užil(a) více přípravku Humalog, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi. Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Humalog
Jestliže si podáte menší dávku přípravku Humalog než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Humalogu.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Humalog
Jestliže si podáte menší dávku přípravku Humalog než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Humalog nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Humalogu, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1,000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Humalogu nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Humalog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky jsou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
Jak přípravek Humalog uchovávat
5.
Před prvním použitím uchovávejte přípravek Humalog v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem.
Používanou lahvičku uchovávejte v chladničce (2°C - 8°C) nebo při pokojové teplotě do 30°C a po 28 dnech ji znehodnoťte. Nevystavujte ji nadměrnému teplu nebo přímému slunečnímu svitu.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte Humalog, pokud je zabarvený nebo pokud jsou v něm viditelné pevné částice. Použijte ho pouze pokud vypadá jako voda. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Humalog 100 IU/ml, injekční roztok v injekční lahvičce obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami přípravku Humalog jsou metakresol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti roztoku mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Humalog vypadá a co obsahuje toto balení
Přípravek Humalog 100 IU/ml, injekční roztok je sterilní, čirý, bezbarvý vodný roztok a obsahuje 100 mezinárodních jednotek inzulinu lispro v jednom mililitru (100 IU/ml) injekčního roztoku. Jedna lahvička obsahuje 1 000 jednotek (10 mililitrů). Humalog 100 IU/ml, injekční roztok v lahvičkách je balen po 1 nebo 2 lahvičkách nebo v multipaku po 5x1 lahvičce. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Humalog 100 IU/ml, injekční roztok v lahvičkách jsou:
• Lilly S.A., Avda. de la Industria 30, 28108 Alcobendas, Madrid, Španělsko.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci. Belgique/Belgie/Belgien Lietuva
Eli Lilly Benelux S.A./N.V. Eli Lilly Holdings Limited atstovybé
Tél/Tel: + 32-(0)2 548 84 84 Tel. +370 (5) 2649600
|
Btarapna Tn "Ean Ruru HegepaaHg" E.B. - Etarapna Ten. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 6000 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Lilly Deutschland GmbH Tel. + 49-(0) 6172 273 2222 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXáSa OAPMAIEPB-AIAAY A.E.B.E. Tr^: +30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Ísland Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
|
Kúnpoq Phadisco Ltd Tr^: +357 22 715000 |
Sverige Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800 |
|
Latvija Eli Lilly Holdings Limited parstavnieciba Latvija Tel: +371 67364000 |
United Kingdom Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000 |
Tato příbalová informace byla naposledy revidována{MM.RRRR}.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Humalog 100 IU/ml, injekční roztok v zásobní vložce insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Humalog a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog užívat
3. Jak se přípravek Humalog užívá
4. Možné nežádoucí účinky
5. Jak přípravek Humalog uchovávat
6. Obsah balení a další informace
1. Co je přípravek Humalog a k čemu se používá
Přípravek Humalog se používá k léčbě diabetu. Díky lehce pozměněné molekule inzulinu má přípravek Humalog rychlejší účinek než normální lidský inzulin.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Humalog je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem působí přípravek Humalog velmi rychle a po kratší dobu (2-5 hodin). Za normálních okolností byste měli užívat Humalog v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Humalog v kombinaci s déle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
Humalog je vhodný pro děti a dospělé. Humalog může být u dětí použit v případě, kdy je oproti normálnímu lidskému inzulinu přínosem jeho rychlý nástup účinku, např. načasování injekce vzhledem k jídlu.
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog užívat
NEUŽÍVEJTE přípravek Humalog
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Humalog, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže
v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• Je-li předepsána injekční lahvička 40 IU/ml, nenatahujte insulin ze zásobní vložky 100 IU/ml pomocí 40 IU/ml stříkačky.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Humalog
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného vychytávání serotoninu),
• danazol,
• některé inhibitory angiotensin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření“).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
Jak se přípravek Humalog užívá
3.
Zásobní vložku 3 ml používejte pouze s 3ml perem. Nepoužívejte s 1,5 ml perem.
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulínu označený
na krabičce a na zásobní vložce. Ujistěte se, že jste obdrželi lékařem doporučený Humalog.
Vždy užívejte přípravek Humalog přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte
se se svým lékařem. Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze
Vámi, a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
Dávkování
• Za normálních okolností byste si měli aplikovat Humalog v rozmezí 15 minut kolem jídla. V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Humalog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Humalog podávejte podkožně. Nitrosvalové podání je možné pouze po doporučení lékařem.
Příprava Humalogu
• Humalog je již rozpuštěný ve vodě, nemusíte ho proto míchat. Použijte ho pouze pokud vypadá jako voda. Musí být čirý, bezbarvý a nesmí obsahovat pevné částice. Před každou aplikací lahvičku zkontrolujte.
Příprava pera k použití
• Nejprve si umyjte ruce. Otřete gumový uzávěr zásobní vložky dezinfekčním prostředkem.
• Zásobní vložky Humalogu smíte užívat pouze s odpovídajícími pery označenými CE. Ujistěte se, prosím, že Humalog nebo Lilly zásobní vložky jsou zmíněny v příbalovém letáčku pera, které užíváte. Zásobní vložka 3 ml se hodí pouze k 3ml peru.
• Dodržujte instrukce uvedené v letáčku u pera. Vložte zásobní vložku do pera.
• Nastavte dávku na 1 nebo 2 jednotky. Poté podržte pero špičkou jehly vzhůru a poklepávejte na stěnu pera, až vyplavou nahoru bublinky vzduchu, které mohou být přítomny. S perem stále směřujícím jehlou vzhůru mačkejte injekční mechanismus tak dlouho, dokud kapka Humalogu nevyjde z jehly. V peru stále ještě mohou zůstat malé vzduchové bublinky, které jsou neškodné. Je-li však vzduchová bublina příliš veliká, může být dávka méně přesná.
Aplikace Humalogu
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím se ujistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni. Není důležité, které místo pro aplikaci použijete, zda horní část paže, stehno, zadek nebo břicho. Humalog vždy účinkuje rychleji než normální lidský inzulin.
• Humalog si nesmíte aplikovat nitrožilně. Aplikujte si ho dle rady lékaře či sestry. Nitrožilně vám může Humalog podat pouze lékař. Udělá to jen za zvláštních okolností jako je chirurgický výkon nebo v případě, že jste nemocní a hladina glukózy ve vaší krvi je velmi vysoká.
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera. Tím zůstane Humalog sterilní a obsah zásobní vložky nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt. Ponechte zásobní vložku v peru.
Další dávky
• Před každou další injekcí nastavte 1 nebo 2 jednotky a s perem směřujícím jehlou vzhůru mačkejte injekční mechanismus dokud nevyjde kapka Humalogu z jehly. Na stupnici po straně zásobní vložky můžete sledovat, kolik Humalogu vám zbývá. Vzdálenost mezi jednotlivými znaménky na stupnici je asi 20 jednotek. Není-li v zásobní vložce dostatečné množství pro dávku, zásobní vložku vyměňte.
Nemíchejte žádný jiný inzulin v zásobní vložce Humalog. Je-li zásobní vložka prázdná, znovu ji neužívejte.
Použití Humalogu v infúzních pumpách
• K infúzím Humalogu je možno použít pouze určité inzulinové infúzní pumpy s označením CE. Před infúzí inzulinu lispro si v instrukcích výrobce ověřte vhodnost infúzní pumpy. Při jejich používání se řiďte návodem k obsluze.
• Spolu s pumpou používejte správný zásobník a katetr.
• Výměna infuzního setu (katetru a kanyly) musí být provedena podle pokynů uvedených v informaci o produktu dodané společně s infúzním setem.
• V případě hypoglykémie by měla být infúze přerušena až do jejího odeznění. Naměříte-li si výrazně nízké nebo opakovaně nízké hladiny glukózy v krvi, upozorněte svého lékaře a zvažte, zda není nutno infúzi zpomalit či zastavit.
• Porucha pumpy nebo ucpání infúzního setu může způsobit náhlý vzestup hladiny glukózy. V případě podezření, že je průtok inzulinu přerušen, se řiďte pokyny v návodu k obsluze, případně uvědomte svého lékaře.
• Při používání infúzní pumpy by neměl být Humalog mísen s jinými inzuliny.
Jestliže jste užil(a) více přípravku Humalog, než jste měl(a)
Jestliže jste užil(a) více přípravku Humalog, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi. Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Humalog
Jestliže si podáte menší dávku přípravku Humalog než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Humalogu nebo pero a zásobní vložky pro případ, že se vaše pero nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Humalog
Jestliže si podáte menší dávku přípravku Humalog než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
Možné nežádoucí účinky
4.
Podobně jako všechny léky, může mít i přípravek Humalog nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulínu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Humalogu, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1,000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Humalogu nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Humalog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky jsou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Humalog uchovávat
Před prvním použitím uchovávejte přípravek Humalog v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem.
Používanou zásobní vložku uchovávejte při pokojové teplotě (15°- 30°C) a po 28 dnech ji znehodnoťte. Nevystavujte ji nadměrnému teplu nebo přímému slunečnímu svitu. Pero nebo používané zásobní vložky neuchovávejte v chladničce. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte Humalog, pokud je zabarvený nebo pokud jsou v něm viditelné pevné částice. Použijte ho pouze pokud vypadá jako voda. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Humalog 100 IU/ml, injekční roztok v zásobní vložce obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami přípravku Humalog jsou metakresol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti roztoku mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Humalog vypadá a co obsahuje toto balení
Přípravek Humalog 100 IU/ml, injekční roztok je sterilní, čirý, bezbarvý vodný roztok a obsahuje 100 mezinárodních jednotek inzulínu lispro v jednom mililitru (100 IU/ml) injekčního roztoku. Jedna zásobní vložka obsahuje 300 jednotek (3 mililitry). Zásobní vložky jsou baleny po 5 nebo ve dvojitém balení po 2 x 5. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Humalog 100 IU/ml, injekční roztok v zásobních vložkách jsou:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
• Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Belgique/Belgie/Belgien
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Eunrapnu
Tn "Enn Hmuh HegepnaHg" E.B. - Etnrapna Ten. + 359 2 491 41 40
Česká republika ELI LILLY ČR, s.r.o.
Tel: + 420 234 664 111
Danmark
Eli Lilly Danmark A/S Tlf: +45 45 26 6000
Deutschland
Lilly Deutschland GmbH Tel. + 49-(0) 6172 273 2222
Eesti
Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280
EkXúda
OAPMAIEPB-AIAAY A.E.B.E.
Tr|^: +30 210 629 4600
Espaňa Lilly S.A.
Tel: + 34-91 663 50 00 France
Lilly France S.A.S.
Tél: +33-(0) 1 55 49 34 34
Lietuva
Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600
Luxembourg/Luxemburg
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Magyarország
Lilly Hungária Kft.
Tel: + 36 1 328 5100
Malta
Charles de Giorgio Ltd.
Tel: + 356 25600 500
Nederland
Eli Lilly Nederland B.V.
Tel: + 31-(0) 30 60 25 800
Norge
Eli Lilly Norge A.S.
Tlf: + 47 22 88 18 00
Osterreich
Eli Lilly Ges. m.b.H.
Tel: + 43-(0) 1 711 780
Polska
Eli Lilly Polska Sp. z o.o.
Tel: +48 (0) 22 440 33 00
Portugal
Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600
Hrvatska
Eli Lilly Hrvatska d.o.o.
Tel: +385 1 2350 999
Ireland
Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377
Island
Icepharma hf.
Sími + 354 540 8000
Italia
Eli Lilly Italia S.p.A.
Tel: + 39- 055 42571
Kúrcpog
Phadisco Ltd Tr|7,: +357 22 715000
Latvija
Eli Lilly Holdings Limited párstávniecib; Tel: +371 67364000
Románia
Eli Lilly Románia S.R.L.
Tel: + 40 21 4023000
Slovenija
Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10
Slovenská republika
Eli Lilly Slovakia, s.r.o.
Tel: + 421 220 663 111
Suomi/Finland
Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250
Sverige
Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800
United Kingdom
ijá Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000
Tato příbalová informace byla naposledy revidována{MM.RRRR}.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Humalog Mix25 100 IU/ml, injekční suspenze v injekční lahvičce
insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Humalog Mix25 a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog Mix25 užívat
3. Jak se přípravek Humalog Mix25 užívá
4. Možné nežádoucí účinky
5. Jak přípravek Humalog Mix25 uchovávat
6. Obsah balení a další informace
1. Co je přípravek Humalog Mix25 a k čemu se používá
Přípravek Humalog Mix25 se používá k léčbě diabetu. Humalog Mix25 je předmísená suspenze. Její účinnou látkou je inzulin lispro. 25% inzulinu lispro obsaženého v Humalogu Mix25 je rozpuštěno ve vodě a díky lehce pozměněné molekule inzulinu má rychlejší účinek než normální lidský inzulin. 75% inzulinu lispro v Humalogu Mix25 je ve formě suspenze s protamin-sulfátem, tím je jeho účinek prodloužen.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Humalog Mix25 je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem má Humalog Mix25 velmi rychlý a dlouhodobější účinek. Za normálních okolností byste měli užívat Humalog Mix25 v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Humalog Mix25 v kombinaci s déle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog Mix25 užívat
NEUŽÍVEJTE přípravek Humalog Mix25
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Humalog Mix25, než jste měl(a)..
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Humalog Mix25
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření“).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
3. Jak se přípravek Humalog Mix25 užívá
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulinu označený na krabičce a na lahvičce. Ujistěte se, že jste obdrželi lékařem doporučený Humalog Mix25.
Vždy užívejte přípravek Humalog Mix25 přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem.
Dávkování
• Za normálních okolností byste si měli aplikovat Humalog Mix25 v rozmezí 15 minut kolem jídla. V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Humalog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Humalog Mix25 podávejte podkožně. Jinou cestu aplikace byste neměli používat. Za žádných okolností nesmí být Humalog Mix25 podán nitrožilně.
Příprava Humalog Mix25
• Před použitím by měly být lahvičky obsahující Humalog Mix25 promíchány válením v dlaních k docílení rovnoměrného zákalu nebo mléčného zbarvení. Netřepejte se zásobní vložkou příliš rázně, protože to může způsobit zpěnění, které by mohlo ovlivnit správné odměření dávky. Lahvičky by měly být často kontrolovány a neměly by být použity, tvoří-li se v inzulinu shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně lahvičky, která tím získává matový vzhled. Před každou aplikací lahvičku zkontrolujte.
Aplikace dávky Humalog Mix25
• Nejprve si umyjte ruce.
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Očistěte gumový uzávěr lahvičky, ale neodstraňujte ho.
• Použijte čistou sterilní stříkačku a jehlu. Jehlu vbodněte do lahvičky a natáhněte potřebné množství přípravku Humalog Mix25 podle instrukce lékaře. Jehly a stříkačky s nikým nesdílejte.
• Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím se ujistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni.
Jestliže jste užil(a) více přípravku Humalog Mix25, než jste měl(a)
Jestliže jste užil(a) více přípravku Humalog Mix25, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi.
Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Humalog Mix25
Jestliže si podáte menší dávku přípravku Humalog Mix25 než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla,abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Humalog Mix25.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Humalog Mix25
Jestliže si podáte menší dávku přípravku Humalog Mix25 než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Humalog Mix25 nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Humalog Mix25, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1,000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetu
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Humalog Mix25 nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Humalog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky jsou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Humalog Mix25 uchovávat
Před prvním použitím uchovávejte přípravek Humalog Mix25 v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem. Používanou lahvičku uchovávejte v chladničce (2°C - 8°C) nebo při pokojové teplotě do 30°C a po 28 dnech ji znehodnoťte. Nevystavujte ji nadměrnému teplu nebo přímému slunečnímu svitu.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte přípravek Humalog Mix25 tvoří-li se v lahvičce shluky inzulinu nebo pokud pevné bílé částice ulpívají na dně nebo stěně lahvičky, která tím získává matový vzhled. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Humalog Mix25 100 IU/ml injekční suspenze v injekční lahvičce obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami přípravku Humalog Mix25 jsou protamin-sulfát, metakresol, fenol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Humalog Mix25 100 IU/ml injekční suspenze vypadá a co obsahuje toto balení
Přípravek Humalog Mix25 100 IU/ml je bílá, sterilní injekční suspenze a obsahuje 100 mezinárodních jednotek inzulinu lispro v jednom mililitru (100 IU/ml) injekční suspenze. 25% inzulinu lispro obsaženého v Humalogu Mix25 je rozpuštěno ve vodě. 75% inzulinu lispro v Humalogu Mix25 je ve formě suspenze s protamin-sulfátem. Jedna lahvička obsahuje 1 000 jednotek (10 mililitrů). Humalog Mix25 100 IU/ml, injekční suspenze v lahvičkách je v balení po 1 lahvičce.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Humalog Mix25 100 IU/ml, injekční suspenze v lahvičkách jsou:
• Lilly S.A., Avda. de la Industria 30, 28108 Alcobendas, Madrid, Španělsko.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Lietuva
Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600
Luxembourg/Luxemburg
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Magyarország
Lilly Hungária Kft.
Tel: + 36 1 328 5100
Malta
Charles de Giorgio Ltd.
Tel: + 356 25600 500
Nederland
Eli Lilly Nederland B.V.
Tel: + 31-(0) 30 60 25 800
Norge
Eli Lilly Norge A.S.
Tlf: + 47 22 88 18 00
Belgique/Belgie/Belgien
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Etarapnu
Tn "Enu Hunu HegepaaHg" E.B. - Etnrapua Tea. + 359 2 491 41 40
Česká republika ELI LILLY ČR, s.r.o.
Tel: + 420 234 664 111
Danmark
Eli Lilly Danmark A/S Tlf: +45 45 26 6000
Deutschland
Lilly Deutschland GmbH Tel. + 49-(0) 6172 273 2222
Eesti
Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280
EkXába Osterreich
OAPMAIEPB-AIAAY A.E.B.E. Eli Lilly Ges. m.b.H.
Tr|k: +30 210 629 4600 Tel: + 43-(0) 1 711 780
Polska
Espaňa
|
Lilly S.A. Tel: + 34-91 663 50 00 |
Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Ísland Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
|
Kúnpoq Phadisco Ltd Tpk: +357 22 715000 |
Sverige Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800 |
|
Latvija Eli Lilly Holdings Limited parstavnieciba Latvija Tel: +371 67364000 |
United Kingdom Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000 |
Tato příbalová informace byla naposledy revidována{MM.RRRR}.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Humalog Mix25 100 IU/ml, injekční suspenze v zásobní vložce insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Humalog Mix25 a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog Mix25 užívat
3. Jak se přípravek Humalog Mix25 užívá
4. Možné nežádoucí účinky
5. Jak přípravek Humalog Mix25 uchovávat
6. Obsah balení a další informace
1. Co je přípravek Humalog Mix25 a k čemu se používá
Přípravek Humalog Mix25 se používá k léčbě diabetu. Humalog Mix25 je předmísená suspenze. Její účinnou látkou je inzulin lispro. 25% inzulinu lispro obsaženého v Humalogu Mix25 je rozpuštěno ve vodě a díky lehce pozměněné molekule inzulinu má rychlejší účinek než normální lidský inzulin. 75% inzulinu lispro v Humalogu Mix25 je ve formě suspenze s protamin-sulfátem, tím je jeho účinek prodloužen.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Humalog Mix25 je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem má Humalog Mix25 velmi rychlý a dlouhodobější účinek. Za normálních okolností byste měli užívat Humalog Mix25 v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Humalog Mix25 v kombinaci s déle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog Mix25 užívat
NEUŽÍVEJTE přípravek Humalog Mix25
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Humalog Mix 25, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Humalog Mix25
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného
vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo j ste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření “).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
3. Jak se přípravek Humalog Mix25 užívá
Zásobní vložku 3 ml používejte pouze s 3ml perem. Nepoužívejte s 1,5ml perem.
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulínu označený na krabičce a na zásobní vložce. Ujistěte se, že jste obdrželi lékařem doporučený Humalog Mix25.
Vždy užívejte přípravek Humalog Mix25 přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem. Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze Vámi, a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
Dávkování
• Za normálních okolností byste si měli aplikovat Humalog Mix25 v rozmezí 15 minut kolem jídla. V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Humalog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Humalog Mix25 podávejte podkožně. Jinou cestu aplikace byste neměli používat. Za žádných okolností nesmí být Humalog Mix25 podán nitrožilně.
Příprava Humalog Mix25
• Bezprostředně před použitím by zásobní vložky obsahující Humalog Mix25 měly být desetkrát promíchány válením v dlaních a desetkrát převráceny o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování. Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled. Před každou aplikací vložku zkontrolujte.
Příprava pera k použití
• Nejprve si umyjte ruce. Otřete gumový uzávěr zásobní vložky dezinfekčním prostředkem.
• Zásobní vložky Humalog Mix25 smíte užívat pouze s odpovídajícími pery označenými CE. Ujistěte se, prosím, že Humalog nebo Lilly zásobní vložky jsou zmíněny v příbalovém letáčku pera, které užíváte. Zásobní vložka 3 ml se hodí pouze k 3ml peru.
• Dodržujte instrukce uvedené v letáčku u pera. Vložte zásobní vložku do pera.
• Nastavte dávku na 1 nebo 2 jednotky. Poté podržte pero špičkou jehly vzhůru a poklepávejte na stěnu pera, až vyplavou nahoru bublinky vzduchu, které mohou být přítomny. S perem stále směřujícím jehlou vzhůru mačkejte injekční mechanismus tak dlouho, dokud kapka Humalogu nevyjde z jehly. V peru stále ještě mohou zůstat malé vzduchové bublinky, které jsou neškodné. Je-li však vzduchová bublina příliš veliká, může být dávka méně přesná.
Aplikace Humalog Mix25
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím se ujistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera. Tím zůstane Humalog Mix25 sterilní a obsah zásobní vložky nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt. Ponechte zásobní vložku v peru.
Další dávky
• Před každou další injekcí nastavte 1 nebo 2 jednotky a s perem směřujícím jehlou vzhůru mačkejte injekční mechanismus dokud nevyjde kapka Humalog Mix25 z jehly. Na stupnici po straně zásobní vložky můžete sledovat, kolik Humalogu vám zbývá. Vzdálenost mezi jednotlivými znaménky na stupnici je asi 20 jednotek. Není-li v zásobní vložce dostatečné množství pro dávku, zásobní vložku vyměňte.
Nemíchejte žádný jiný inzulin v zásobní vložce Humalog Mix25. Je-li zásobní vložka prázdná, znovu ji neužívejte.
Jestliže jste užil(a) více přípravku Humalog Mix25, než jste měl(a)
Jestliže jste užil(a) více přípravku Humalog Mix25, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi.
Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Humalog Mix25
Jestliže si podáte menší dávku přípravku Humalog Mix25 než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla,abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Humalogu Mix25 nebo pero a zásobní vložky pro případ, že se vaše pero nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Humalog Mix25
Jestliže si podáte menší dávku přípravku Humalog Mix25 než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Humalog Mix25 nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Humalog Mix25, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1,000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Humalog Mix25 nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Humalog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky jsou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulínu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Humalog Mix25 uchovávat
Před prvním použitím uchovávejte přípravek Humalog Mix25 v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem.
Používanou zásobní vložku uchovávejte při pokojové teplotě (15° - 30°C) a po 28 dnech ji znehodnoťte. Nevystavujte ji nadměrnému teplu nebo přímému slunečnímu svitu. Pero nebo používané zásobní vložky neuchovávejte v chladničce. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte přípravek Humalog Mix25 tvoří-li se v zásobní vložce shluky inzulinu nebo pokud pevné bílé částice ulpívají na dně nebo stěně zásobní vložky, která tím získává matový vzhled. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Humalog Mix25 100 IU/ml injekční suspenze v zásobní složce obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami přípravku Humalog Mix25 jsou protamin-sulfát, metakresol, fenol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Humalog Mix25 100 IU/ml injekční suspenze vypadá a co obsahuje toto balení
Přípravek Humalog Mix25 100 IU/ml je bílá, sterilní injekční suspenze a obsahuje 100 mezinárodních jednotek inzulinu lispro v jednom mililitru (100 IU/ml) injekční suspenze. 25% inzulinu lispro obsaženého v Humalogu Mix25 je rozpuštěno ve vodě. 75% inzulinu lispro v Humalogu Mix25 je ve formě suspenze s protamin-sulfátem. Jedna zásobní vložka obsahuje 300 jednotek (3 mililitry). Zásobní vložky jsou baleny po 5 nebo ve dvojitém balení po 2 x 5. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Humalog Mix25 100 IU/ml, injekční suspenze v zásobních vložkách jsou:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
• Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
|
Belgique/Belgie/Belgien Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
Lietuva Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600 |
|
Etarapna Tn "Ean Hnán HegepaaHg" E.B. - Etarapna Ten. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 6000 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Lilly Deutschland GmbH Tel. + 49-(0) 6172 273 2222 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXáda OAPMAIEPB-AIAAY A.E.B.E. Tr|T.: +30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Ísland Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
Kúrcpog
Phadisco Ltd Tr^: +357 22 715000
Sverige
Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800
Latvija United Kingdom
Eli Lilly Holdings Limited parstavnieciba Latvija Eli Lilly and Company Limited Tel: +371 67364000 Tel: + 44-(0) 1256 315000
Tato příbalová informace byla naposledy revidována{MM.RRRR}.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Humalog Mix50 100 IU/ml, injekční suspenze v injekční lahvičce
insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Humalog Mix50 a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog Mix50 užívat
3. Jak se přípravek Humalog Mix50 užívá
4. Možné nežádoucí účinky
5. Jak přípravek Humalog Mix50 uchovávat
6. Obsah balení a další informace
1. Co je přípravek Humalog Mix50 a k čemu se používá
Přípravek Humalog Mix50 se používá k léčbě diabetu. Humalog Mix50 je předmísená suspenze. Její účinnou látkou je inzulin lispro. 50% inzulinu lispro obsaženého v Humalogu Mix50 je rozpuštěno ve vodě a díky lehce pozměněné molekule inzulinu má rychlejší účinek než normální lidský inzulin. 50% inzulinu lispro v Humalogu Mix50 je ve formě suspenze s protamin-sulfátem, tím je jeho účinek prodloužen.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Humalog Mix50 je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem má Humalog Mix50 velmi rychlý a dlouhodobější účinek. Za normálních okolností byste měli užívat Humalog Mix50 v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Humalog Mix50 v kombinaci s déle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog Mix50 užívat
NEUŽÍVEJTE přípravek Humalog Mix50
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Humalog Mix50, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Humalog Mix50
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného
vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření “).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
3. Jak se přípravek Humalog Mix50 užívá
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulinu označený na krabičce a na lahvičce. Ujistěte se, že jste obdrželi lékařem doporučený Humalog Mix50.
Vždy užívejte přípravek Humalog Mix50 přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem.
Dávkování
• Za normálních okolností byste si měli aplikovat Humalog Mix50 v rozmezí 15 minut kolem jídla. V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Humalog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Humalog Mix50 podávejte podkožně. Jinou cestu aplikace byste neměli používat. Za žádných okolností nesmí být Humalog Mix50 podán nitrožilně.
Příprava Humalog Mix50
• Před použitím by měly být lahvičky obsahující Humalog Mix50 promíchány válením v dlaních k docílení rovnoměrného zákalu nebo mléčného zbarvení. Netřepejte se zásobní vložkou příliš rázně, protože to může způsobit zpěnění, které by mohlo ovlivnit správné odměření dávky. Lahvičky by měly být často kontrolovány a neměly by být použity, tvoří-li se v inzulinu shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně lahvičky, která tím získává matový vzhled. Před každou aplikací lahvičku zkontrolujte.
Aplikace dávky Humalog Mix50
• Nejprve si umyjte ruce.
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Očistěte gumový uzávěr lahvičky, ale neodstraňujte ho.
• Použijte čistou sterilní stříkačku a jehlu. Jehlu vbodněte do lahvičky a natáhněte potřebné množství přípravku Humalog Mix50 podle instrukce lékaře. Jehly a stříkačky s nikým nesdílejte.
• Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím se ujistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni.
Jestliže jste užil(a) více přípravku Humalog Mix50, než jste měl(a)
Jestliže jste užil(a) více přípravku Humalog Mix50, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi.
Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Humalog Mix50
Jestliže si podáte menší dávku přípravku Humalog Mix50 než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Humalog Mix50.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Humalog Mix50
Jestliže si podáte menší dávku přípravku Humalog Mix50 než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulínu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Humalog Mix50 nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Humalog Mix50, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1,000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetu
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Humalog Mix50 nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Humalog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky j sou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Humalog Mix50 uchovávat
Před prvním použitím uchovávejte přípravek Humalog Mix50 v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem. Používanou lahvičku uchovávejte v chladničce (2°C - 8°C) nebo při pokojové teplotě do 30°C a po 28 dnech ji znehodnoťte. Nevystavujte ji nadměrnému teplu nebo přímému slunečnímu svitu.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte přípravek Humalog Mix50 tvoří-li se v lahvičce shluky inzulinu nebo pokud pevné bílé částice ulpívají na dně nebo stěně lahvičky, která tím získává matový vzhled. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Humalog Mix50 100 IU/ml injekční suspenze v injekční lahvičce obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami přípravku Humalog Mix50 jsou protamin-sulfát, metakresol, fenol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Humalog Mix50 100 IU/ml injekční suspenze vypadá a co obsahuje toto balení
Přípravek Humalog Mix50 100 IU/ml je bílá, sterilní injekční suspenze a obsahuje 100 mezinárodních jednotek v jednom mililitru (100 IU/ml) injekční suspenze. 50% inzulinu lispro obsaženého v Humalogu Mix50 je rozpuštěno ve vodě. 50% inzulinu lispro v Humalogu Mix50 je ve formě suspenze s protamin-sulfátem. Jedna lahvička obsahuje 1 000 jednotek (10 mililitrů). Humalog Mix50 100 IU/ml, injekční suspenze v lahvičkách je v balení po 1 lahvičce.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Humalog Mix50 100 IU/ml, injekční suspenze v lahvičkách jsou:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
• Lilly Pharma Fertigung und Distribution GmbH & Co. KG, Teichweg 3, 35396 Giessen, Německo.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Lietuva
Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600
Luxembourg/Luxemburg
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Magyarország
Lilly Hungária Kft.
Tel: + 36 1 328 5100
Malta
Charles de Giorgio Ltd.
Tel: + 356 25600 500
Nederland
Eli Lilly Nederland B.V.
Tel: + 31-(0) 30 60 25 800
Norge
Eli Lilly Norge A.S.
Tlf: + 47 22 88 18 00
Belgique/Belgie/Belgien
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Etarapnu
Tn "Enu Hunu HegepaaHg" E.B. - Etnrapua Tea. + 359 2 491 41 40
Česká republika ELI LILLY ČR, s.r.o.
Tel: + 420 234 664 111
Danmark
Eli Lilly Danmark A/S Tlf: +45 45 26 6000
Deutschland
Lilly Deutschland GmbH Tel. + 49-(0) 6172 273 2222
Eesti
Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280
EkXába Osterreich
OAPMAIEPB-AIAAY A.E.B.E. Eli Lilly Ges. m.b.H.
Tr|k: +30 210 629 4600 Tel: + 43-(0) 1 711 780
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Ísland Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
|
Kúrcpog Phadisco Ltd TpA.: +357 22 715000 |
Sverige Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800 |
|
Latvija Eli Lilly Holdings Limited párstávnieciba Latvija Tel: +371 67364000 |
United Kingdom Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000 |
Tato příbalová informace byla naposledy revidována{MM.RRRR}.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Humalog Mix50 100 IU/ml, injekční suspenze v zásobní vložce insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Humalog Mix50 a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog Mix50 užívat
3. Jak se přípravek Humalog Mix50 užívá
4. Možné nežádoucí účinky
5. Jak přípravek Humalog Mix50 uchovávat
6. Obsah balení a další alší informace
1. Co je přípravek Humalog Mix50 a k čemu se používá
Přípravek Humalog Mix50 se používá k léčbě diabetu. Humalog Mix50 je předmísená suspenze. Její účinnou látkou je inzulin lispro. 50% inzulinu lispro obsaženého v Humalogu Mix50 je rozpuštěno ve vodě a díky lehce pozměněné molekule inzulinu má rychlejší účinek než normální lidský inzulin. 50% inzulinu lispro v Humalogu Mix50 je ve formě suspenze s protamin-sulfátem, tím je jeho účinek prodloužen.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Humalog Mix50 je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem má Humalog Mix50 velmi rychlý a dlouhodobější účinek. Za normálních okolností byste měli užívat Humalog Mix50 v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Humalog Mix50 v kombinaci s déle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog Mix50 užívat
NEUŽÍVEJTE přípravek Humalog Mix50
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Humalog Mix50, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Humalog Mix50
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného
vychytávání serotoninu),
• danazol
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření“).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
3. Jak se přípravek Humalog Mix50 užívá
Zásobní vložku 3 ml používejte pouze s 3ml perem. Nepoužívejte s 1,5 ml perem.
Vždy užívejte přípravek Humalog Mix50 přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem. Pro prevenci přenosu infekce musí být jedna zásobní vložka používána pouze Vámi, a to i v případě, že je jehla měněna při každém použití aplikační pomůcky.
Dávkování
• Za normálních okolností byste si měli aplikovat Humalog Mix50 v rozmezí 15 minut kolem jídla. V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Humalog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Humalog Mix50 podávejte podkožně. Jinou cestu aplikace byste neměli používat. Za žádných okolností nesmí být Humalog Mix50 podán nitrožilně.
Příprava Humalog Mix50
• Bezprostředně před použitím by zásobní vložky obsahující Humalog Mix50 měly být desetkrát promíchány válením v dlaních a desetkrát převráceny o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování. Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled. Před každou aplikací vložku zkontrolujte.
Příprava pera k použití
• Nejprve si umyjte ruce. Otřete gumový uzávěr zásobní vložky dezinfekčním prostředkem.
• Zásobní vložky Humalog Mix50 smíte užívat pouze s odpovídajícími pery označenými CE. Ujistěte se, prosím, že Humalog nebo Lilly zásobní vložky jsou zmíněny v příbalovém letáčku pera, které užíváte. Zásobní vložka 3 ml se hodí pouze k3 ml peru.
• Dodržujte instrukce uvedené v letáčku u pera. Vložte zásobní vložku do pera.
• Nastavte dávku na 1 nebo 2 jednotky. Poté podržte pero špičkou jehly vzhůru a poklepávejte na stěnu pera, až vyplavou nahoru bublinky vzduchu, které mohou být přítomny. S perem stále směřujícím jehlou vzhůru mačkejte injekční mechanismus tak dlouho, dokud kapka Humalogu nevyjde z jehly. V peru stále ještě mohou zůstat malé vzduchové bublinky, které jsou neškodné. Je-li však vzduchová bublina příliš veliká, může být dávka méně přesná.
Aplikace Humalog Mix50
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím se ujistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera. Tím zůstane Humalog Mix50 sterilní a obsah zásobní vložky nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt. Ponechte zásobní vložku v peru.
Další dávky
• Před každou další injekcí nastavte 1 nebo 2 jednotky a s perem směřujícím jehlou vzhůru mačkejte injekční mechanismus dokud nevyjde kapka Humalog Mix50 z jehly. Na stupnici po straně zásobní vložky můžete sledovat, kolik Humalogu vám zbývá. Vzdálenost mezi jednotlivými znaménky na stupnici je asi 20 jednotek. Není-li v zásobní vložce dostatečné množství pro dávku, zásobní vložku vyměňte.
Nemíchejte žádný jiný inzulin v zásobní vložce Humalog Mix50. Je-li zásobní vložka prázdná, znovu ji neužívejte.
Jestliže jste užil(a) více přípravku Humalog Mix50, než jste měl(a)
Jestliže jste užil(a) více přípravku Humalog Mix50, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi.
Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Humalog Mix50
Jestliže si podáte menší dávku přípravku Humalog Mix50 než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Humalogu Mix50 nebo pero a zásobní vložky pro případ, že se vaše pero nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Humalog Mix50
Jestliže si podáte menší dávku přípravku Humalog Mix50 než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Humalog Mix50 nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Humalog Mix50, okamžitě informujte svého lékaře.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Humalog Mix50 nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Humalog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky jsou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulínu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Humalog Mix50 uchovávat
Před prvním použitím uchovávejte přípravek Humalog Mix50 v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem.
Používanou zásobní vložku uchovávejte při pokojové teplotě (15° - 30°C) a po 28 dnech ji znehodnoťte. Nevystavujte ji nadměrnému teplu nebo přímému slunečnímu svitu. Pero nebo používané zásobní vložky neuchovávejte v chladničce. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte přípravek Humalog Mix50 tvoří-li se v zásobní vložce shluky inzulínu nebo pokud pevné bílé částice ulpívají na dně nebo stěně zásobní vložky, která tím získává matový vzhled. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Humalog Mix50 100 IU/ml injekční suspenze v zásobní složce obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami přípravku Humalog Mix50 jsou protamin-sulfát, metakresol, fenol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Humalog Mix50 100 IU/ml injekční suspenze vypadá a co obsahuje toto balení
Přípravek Humalog Mix50 100 IU/ml je bílá, sterilní injekční suspenze a obsahuje 100 mezinárodních jednotek v jednom mililitru (100 IU/ml) injekční suspenze. 50% inzulinu lispro obsaženého v Humalogu Mix50 je rozpuštěno ve vodě. 50% inzulinu lispro v Humalogu Mix50 je ve formě suspenze s protamin-sulfátem. Jedna zásobní vložka obsahuje 300 jednotek (3 mililitry). Zásobní vložky jsou baleny po 5 nebo ve dvojitém balení po 2 x 5. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Humalog Mix50 100 IU/ml, injekční suspenze v zásobních vložkách jsou:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
• Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
|
Belgique/Belgie/Belgien Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
Lietuva Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600 |
|
Etarapnu Tn "Eau Hunu HegepaaHg" E.B. - Etarapua Ten. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 6000 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Lilly Deutschland GmbH Tel. + 49-(0) 6172 273 2222 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXáda OAPMAIEPB-AIAAY A.E.B.E. Tr|T.: +30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Ísland Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
Kúrcpog
Phadisco Ltd Tr^: +357 22 715000
Sverige
Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800
Latvija United Kingdom
Eli Lilly Holdings Limited parstavnieciba Latvija Eli Lilly and Company Limited Tel: +371 67364000 Tel: + 44-(0) 1256 315000
Tato příbalová informace byla naposledy revidována{MM.RRRR}.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Humalog BASAL 100 IU/ml, injekční suspenze v zásobní vložce insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Humalog BASAL a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog BASAL užívat
3. Jak se přípravek Humalog BASAL užívá
4. Možné nežádoucí účinky
5. Jak přípravek Humalog BASAL uchovávat
6. Obsah balení a další informace
1. Co je přípravek Humalog BASAL a k čemu se používá
Přípravek Humalog BASAL se používá k léčbě diabetu. Jeho účinnou látkou je inzulin lispro. Inzulin lispro v Humalogu BASAL je ve formě suspenze s protamin-sulfátem, tím je jeho účinek prodloužen.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Humalog BASAL je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem má Humalog BASAL dlouhodobější účinek.
Je možné, že vám lékař doporučí užívat Humalog BASAL v kombinaci s rychle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog BASAL užívat
NEUŽÍVEJTE přípravek Humalog BASAL
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Humalog BASAL, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulínu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Humalog BASAL
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného
vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření“).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
3. Jak se přípravek Humalog BASAL užívá
Zásobní vložku 3 ml používejte pouze s 3ml perem. Nepoužívejte s 1,5ml perem.
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulinu označený na krabičce a na zásobní vložce. Ujistěte se, že jste obdrželi lékařem doporučený Humalog BASAL.
Vždy užívejte přípravek Humalog BASAL přesně podle pokynů svého lékaře. Pokud si nejste jistý/á,
poraďte se se svým lékařem nebo lékárníkem. Pro prevenci přenosu infekce musí být jedna zásobní
vložka používána pouze Vámi, a to i v případě, že je jehla měněna při každém použití aplikační
pomůcky.
Dávkování
• Za normálních okolností byste si měli aplikovat Humalog BASAL jako svůj bazální inzulin (NPH). Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Humalog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Humalog BASAL podávejte podkožně. Jinou cestu aplikace byste neměli používat. Za žádných okolností nesmí být Humalog BASAL podán nitrožilně.
Příprava Humalog BASAL
• Bezprostředně před použitím by zásobní vložky obsahující Humalog BASAL měly být desetkrát promíchány válením v dlaních a desetkrát převráceny o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování. Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled. Před každou aplikací vložku zkontrolujte.
Příprava pera k použití
• Nejprve si umyjte ruce. Otřete gumový uzávěr zásobní vložky dezinfekčním prostředkem.
• Zásobní vložky Humalog BASAL smíte užívat pouze s odpovídajícími pery označenými CE. Ujistěte se, prosím, že Humalog nebo Lilly zásobní vložky jsou zmíněny v příbalovém letáčku pera, které užíváte. Zásobní vložka 3 ml se hodí pouze k 3ml peru.
• Dodržujte instrukce uvedené v letáčku u pera. Vložte zásobní vložku do pera.
• Nastavte dávku na 1 nebo 2 jednotky. Poté podržte pero špičkou jehly vzhůru a poklepávejte na stěnu pera, až vyplavou nahoru bublinky vzduchu, které mohou být přítomny. S perem stále směřujícím jehlou vzhůru mačkejte injekční mechanismus tak dlouho, dokud kapka Humalogu nevyjde z jehly. V peru stále ještě mohou zůstat malé vzduchové bublinky, které jsou neškodné. Je-li však vzduchová bublina příliš veliká, může být dávka méně přesná.
Aplikace Humalog BASAL
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím se ujistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera. Tím zůstane Humalog BASAL sterilní a obsah zásobní vložky nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt. Ponechte zásobní vložku v peru.
Další dávky
• Před každou další injekcí nastavte 1 nebo 2 jednotky a s perem směřujícím jehlou vzhůru mačkejte injekční mechanismus dokud nevyjde kapka Humalog BASAL z jehly. Na stupnici po straně zásobní vložky můžete sledovat, kolik Humalogu vám zbývá. Vzdálenost mezi
jednotlivými znaménky na stupnici je asi 20 jednotek. Není-li v zásobní vložce dostatečné množství pro dávku, zásobní vložku vyměňte.
Nemíchejte žádný jiný inzulin v zásobní vložce Humalog BASAL. Je-li zásobní vložka prázdná, znovu ji neužívejte.
Jestliže jste užil(a) více přípravku Humalog BASAL, než jste měl(a)
Jestliže jste užil(a) více přípravku Humalog BASAL, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi.
Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Humalog BASAL
Jestliže si podáte menší dávku přípravku Humalog BASAL než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Humalogu BASAL nebo pero a zásobní vložky pro případ, že se vaše pero nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Humalog BASAL
Jestliže si podáte menší dávku přípravku Humalog BASAL než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Humalog BASAL nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Humalog BASAL, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1,000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulínem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Humalog BASAL nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Humalog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky jsou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulínu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Humalog BASAL uchovávat
Před prvním použitím uchovávejte přípravek Humalog BASAL v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem.
Používanou zásobní vložku uchovávejte při pokojové teplotě (15° - 30°C) a po 21 dnech ji znehodnoťte .Nevystavujte ji nadměrnému teplu nebo přímému slunečnímu svitu. Pero nebo používané zásobní vložky neuchovávejte v chladničce. Pero se založenou zásobní vložkou nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte přípravek Humalog BASAL tvoří-li se v zásobní vložce shluky inzulinu nebo pokud pevné bílé částice ulpívají na dně nebo stěně zásobní vložky, která tím získává matový vzhled. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Humalog BASAL 100 IU/ml injekční suspenze v zásobní složce obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami přípravku Humalog BASAL jsou protamin-sulfát, metakresol, fenol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Humalog BASAL 100 IU/ml injekční suspenze vypadá a co obsahuje toto balení
Přípravek Humalog BASAL 100 IU/ml je bílá, sterilní injekční suspenze obsahuje 100 mezinárodních jednotek v jednom mililitru (100 IU/ml) injekční suspenze. Inzulin lispro v Humalogu BASAL je ve formě suspenze s protamin-sulfátem. Jedna zásobní vložka obsahuje 300 jednotek (3 mililitry). Zásobní vložky jsou baleny po 5 nebo ve dvojitém balení po 2 x 5. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Humalog BASAL 100 IU/ml, injekční suspenze v zásobních vložkách jsou:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Lietuva
Belgique/Belgie/Belgien
Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84
Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600
|
Bt^rapnn Tn "Enn Hunn HegepnaHg" E.B. - Etnrapnn Ten. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 6000 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Lilly Deutschland GmbH Tel. + 49-(0) 6172 273 2222 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXába OAPMAIEPB-AIAAY A.E.B.E. Tr|^: +30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Island Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
|
Kúnpoq Phadisco Ltd Tr|^: +357 22 715000 |
Sverige Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800 |
Latvija United Kingdom
Eli Lilly Holdings Limited parstavnieciba Latvija Eli Lilly and Company Limited Tel: +371 67364000 Tel: + 44-(0) 1256 315000
Tato příbalová informace byla naposledy revidována{MM.RRRR}.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Humalog 100 IU/ml KwikPen, injekční roztok insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Humalog KwikPen a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog KwikPen užívat
3. Jak se přípravek Humalog KwikPen užívá
4. Možné nežádoucí účinky
5. Jak přípravek Humalog KwikPen uchovávat
6. Obsah balení a další informace
1. Co je přípravek Humalog KwikPen a k čemu se používá
Přípravek Humalog KwikPen se používá k léčbě diabetu. Díky lehce pozměněné molekule inzulinu má rychlejší účinek než normální lidský inzulin.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Humalog je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem působí velmi rychle a po kratší dobu (2-5 hodin). Za normálních okolností byste měli užívat Humalog v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Humalog KwikPen v kombinaci s déle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
Humalog je vhodný pro děti a dospělé. Humalog může být u dětí použit v případě, kdy je oproti normálnímu lidskému inzulinu přínosem jeho rychlý nástup účinku, např. načasování injekce vzhledem k jídlu.
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog KwikPen užívat
NEUŽÍVEJTE přípravek Humalog KwikPen
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat. (viz bod 3 Jestliže jste užil(a) více přípravku Humalog, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže
v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Hulalog KwikPen
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného
vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření “).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
Jak se přípravek Humalog KwikPen užívá
3.
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulínu označený na krabičce a přepdlněném peru. Ujistěte se, že jste obdrželi lékařem doporučený Humalog KwikPen .
Vždy užívejte přípravek Humalog KwikPen přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem. Pro prevenci možného přenosu infekce musí být jedno pero používáno pouze Vámi, a to i v případě, že je vyměněna jehla.
Dávkování
• Za normálních okolností byste si měli aplikovat Humalog v rozmezí 15 minut kolem jídla. V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Humalog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Humalog podávejte podkožně. Nitrosvalové podání je možné pouze po doporučení lékařem.
Příprava Humalog KwikPen
• Humalog je již rozpuštěný ve vodě, nemusíte ho proto míchat. Použijte ho pouze pokud vypadá jako voda. Musí být čirý, bezbarvý a nesmí obsahovat pevné částice. Před každou aplikací lahvičku zkontrolujte.
Příprava pera KwikPen k použití (viz Návod k použití)
• Nejprve si umyjte ruce.
• Přečtěte si návod jak užívat předplněná inzulinová pera. Řiďte se pečlivě pokyny návodu. Následují některá upozornění.
• Užívejte čistou jehlu. (Jehly nejsou součástí pera).
• Před každým použitím pero KwikPen prostříkněte. Tak se přesvědčíte, že inzulin prochází jehlou a že jste odstranili vzduchové bubliny. Malé bubliny, které mohou zůstat v peru, jsou neškodné .Jsou-li však bubliny velké, mohou ovlivnit velikost dávky.
Aplikace Humalog KwikPen
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím se ujistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni. Není důležité, které místo pro aplikaci použijete, zda horní část paže, stehno, zadek nebo břicho. Humalog vždy účinkuje rychleji než normální lidský inzulin.
• Humalog si nesmíte aplikovat nitrožilně. Aplikujte si ho dle rady lékaře či sestry. Nitrožilně vám může Humalog podat pouze lékař. Udělá to jen za zvláštních okolností jako je chirurgický výkon nebo v případě, že jste nemocní a hladina glukózy ve vaší krvi je velmi vysoká.
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera KwikPen. Tím zůstane inzulin sterilní a nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt.
Další dávky
• Při každém užití pera KwikPen použijte novou jehlu.Před každou aplikací odstraňte vzduchové bubliny. Podržíte-li pero jehlou vzhůru, uvidíte, kolik inzulinu v peru KwikPen ještě zbývá. Na stupnici zásobní vložky můžete sledovat, kolik jednotek zbývá.
• Nemíchejte žádný jiný inzulin v peru k jednorázovému použití. Je-li pero KwikPen prázdné, znovu ho neužívejte. Pero bezpečně znehodnoťte - lékárník nebo zdravotní sestra vám poskytne instrukce.
Použití Humalogu v infúzních pumpách
• K infúzím Humalogu je možno použít pouze určité inzulinové infúzní pumpy s označením CE. Před infúzí inzulinu lispro si v instrukcích výrobce ověřte vhodnost infúzní pumpy. Při jejich používání se řiďte návodem k obsluze.
• Spolu s pumpou používejte správný zásobník a katetr.
• Výměna infuzního setu (katetru a kanyly) musí být provedena podle pokynů uvedených v informaci o produktu dodané společně s infuzním setem.
• V případě hypoglykémie by měla být infúze přerušena až do jejího odeznění. Naměříte-li si výrazně nízké nebo opakovaně nízké hladiny glukózy v krvi, upozorněte svého lékaře a zvažte, zda není nutno infúzi zpomalit či zastavit.
• Porucha pumpy nebo ucpání infúzního setu může způsobit náhlý vzestup hladiny glukózy. V případě podezření, že je průtok inzulinu přerušen, se řiďte pokyny v návodu k obsluze, případně uvědomte svého lékaře.
• Při používání infúzní pumpy by neměl být Humalog mísen s jinými inzuliny.
Jestliže jste užil(a) více přípravku Humalog, než jste měl(a)
Jestliže jste užil(a) více přípravku Humalog, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi. Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Humalog
Jestliže si podáte menší dávku přípravku Humalog než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Humalogu nebo pero a zásobní vložky pro případ, že se vaše pero KwikPen nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Humalog
Jestliže si podáte menší dávku přípravku Humalog než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Humalog nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Humalogu, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1,000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Humalogu nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Humalog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo • máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky jsou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Humalog KwikPen uchovávat
Před prvním použitím uchovávejte přípravek Humalog KwikPen v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem.
Používané pero Humalog KwikPen uchovávejte při pokojové teplotě (15° - 30°C) a po 28 dnech jej znehodnoťte. Nevystavujte jej nadměrnému teplu nebo přímému slunečnímu svitu. Používané pero KwikPen neuchovávejte v chladničce. Pero KwikPen nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek Humalog KwikPen nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte Humalog KwikPen , pokud je zabarvený nebo pokud jsou v něm viditelné pevné částice. Použijte ho pouze pokud vypadá jako voda. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Humalog KwikPen 100 IU/ml, injekční roztok obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami přípravku Humalog KwikPen jsou metakresol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti roztoku mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Humalog KwikPen vypadá a co obsahuje toto balení
Přípravek Humalog 100 IU/ml KwikPen, injekční roztok je sterilní, čirý, bezbarvý vodný roztok a obsahuje 100 mezinárodních jednotek inzulinu lispro v jednom mililitru (100 IU/ml). Jedno pero Humalog KwikPen obsahuje 300 jednotek (3 mililitry). Humalog KwikPen je balen po 5 nebo v multipaku po 2x5 předplněných perech. Na trhu nemusí být všechny velikosti balení.
Humalog v předplněném peru je stejný jako Humalog zásobní vložky. V předplněném peru KwikPen je zásobní vložka zabudována. Předplněné pero nelze po vyprázdnění znovu použít.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Humalog 100 IU/ml KwikPen, injekční roztok:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
• Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
• Lilly Pharma Fertigung und Distribution GmbH & Co. KG, Teichweg 3, 35396 Giessen, Německo.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Belgique/Belgie/Belgien
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Etarapnu
Tn "Eau Hnan HegepaaHg" E.B. - Etarapua Tea. + 359 2 491 41 40
Česká republika ELI LILLY ČR, s.r.o.
Tel: + 420 234 664 111
Danmark
Eli Lilly Danmark A/S Tlf: +45 45 26 6000
Deutschland
Lilly Deutschland GmbH Tel. + 49-(0) 6172 273 2222
Eesti
Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280
ELXáda
OAPMAIEPB-AIAAY A.E.B.E.
Tr|7,: +30 210 629 4600
Espaňa Lilly S.A.
Tel: + 34-91 663 50 00 France
Lilly France S.A.S.
Tél: +33-(0) 1 55 49 34 34
Hrvatska
Eli Lilly Hrvatska d.o.o.
Tel: +385 1 2350 999
Lietuva
Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600
Luxembourg/Luxemburg
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Magyarország
Lilly Hungária Kft.
Tel: + 36 1 328 5100
Malta
Charles de Giorgio Ltd.
Tel: + 356 25600 500
Nederland
Eli Lilly Nederland B.V.
Tel: + 31-(0) 30 60 25 800
Norge
Eli Lilly Norge A.S.
Tlf: + 47 22 88 18 00
Osterreich
Eli Lilly Ges. m.b.H.
Tel: + 43-(0) 1 711 780
Polska
Eli Lilly Polska Sp. z o.o.
Tel: +48 (0) 22 440 33 00
Portugal
Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600
Románia
Eli Lilly Románia S.R.L.
Tel: + 40 21 4023000
Latvija
Eli Lilly Holdings Limited parstavnieciba Latvija
Tel: +371 67364000
United Kingdom
Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000
Island
Icepharma hf.
Slovenská republika
Eli Lilly Slovakia, s.r.o.
Sími + 354 540 8000
Tel: + 421 220 663 111
Ireland
Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377
Slovenija
Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10
Italia
Eli Lilly Italia S.p.A. Tel: + 39- 055 42571
Suomi/Finland
Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250
Kúrcpog
Phadisco Ltd
T r(k: +357 22 715000
Sverige
Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800
Tato příbalová informace byla naposledy revidována {MM.RRRR}.
NÁVOD K OBSLUZE
Níže si prosím přečtěte Návod k obsluze.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Humalog Mix25 100 IU/ml KwikPen , injekční suspenze insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí
ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Humalog Mix25 KwikPen a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog Mix25 KwikPen užívat
3. Jak se přípravek Humalog Mix25 KwikPen užívá
4. Možné nežádoucí účinky
5. Jak přípravek Humalog Mix25 Kwikpen uchovávat
6. Obsah balení a další informace
1. Co je přípravek Humalog Mix25 KwikPen a k čemu se používá
Přípravek Humalog Mix25 KwikPen se používá k léčbě diabetu. Humalog Mix25 KwikPen je předmísená suspenze. Její účinnou látkou je inzulin lispro. 25% inzulinu lispro obsaženého v Humalogu Mix25 KwikPen je rozpuštěno ve vodě a díky lehce pozměněné molekule inzulinu má rychlejší účinek než normální lidský inzulin. 75% inzulinu lispro v Humalogu Mix25 KwikPen je ve formě suspenze s protamin-sulfátem, tím je jeho účinek prodloužen.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Humalog Mix25 je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem má Humalog Mix25 velmi rychlý a dlouhodobější účinek. Za normálních okolností byste měli užívat Humalog Mix25 v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Humalog Mix25 KwikPen v kombinaci s déle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog Mix25 KwikPen užívat
NEUŽÍVEJTE přípravek Humalog Mix25 KwikPen
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Humalog Mix25, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Humalog Mix25 KwikPen
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného
vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření “).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulínu označený na krabičce a na předplněném peru. Ujistěte se, že jste obdrželi lékařem doporučený Humalog Mix25 KwikPen .
Vždy užívejte přípravek Humalog Mix25 KwikPen přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem. Pro prevenci možného přenosu infekce musí být jedno pero používáno pouze Vámi, a to i v případě, že je vyměněna jehla.
Dávkování
• Za normálních okolností byste si měli aplikovat Humalog Mix25 v rozmezí 15 minut kolem jídla. V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Humalog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Humalog Mix25 podávejte podkožně. Jinou cestu aplikace byste neměli používat. Za žádných okolností nesmí být Humalog Mix25 podán nitrožilně.
Příprava Humalog Mix25 KwikPen
• Bezprostředně před použitím by pero KwikPen mělo být desetkrát převaleno v dlaních a desetkrát převráceno o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování. Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled. Před každou aplikací vložku zkontrolujte.
Příprava pera KwikPen k použití(viz Návod k použití)
• Nejprve si umyjte ruce.
• Přečtěte si návod jak užívat předplněná inzulinová pera. Řiďte se pečlivě pokyny návodu. Následují některá upozornění.
• Užívejte čistou jehlu. (Jehly nejsou součástí pera).
• Před každým použitím pero KwikPen prostříkněte. Tak se přesvědčíte, že inzulin prochází jehlou a že jste z pera KwikPen odstranili vzduchové bubliny. Malé bubliny, které mohou zůstat v peru, jsou neškodné .Jsou-li však bubliny velké, mohou ovlivnit velikost dávky.
Aplikace Humalog Mix25
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím se ujistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera KwikPen. Tím zůstane inzulin sterilní a nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt.
Další dávky
• Při každém užití pera KwikPen použijte novou jehlu. Před každou aplikací odstraňte vzduchové bubliny. Podržíte-li pero jehlou dolů, uvidíte, kolik inzulinu v peru KwikPen ještě zbývá. Na stupnici zásobní vložky můžete sledovat, kolik jednotek zbývá.
• Nemíchejte žádný jiný inzulin v peru k jednorázovému použití. Je-li pero KwikPen prázdné, znovu ho neužívejte. Pero bezpečně znehodnoťte - lékárník nebo zdravotní sestra vám poskytne instrukce.
Jestliže jste užil(a) více přípravku Humalog Mix25, než jste měl(a)
Jestliže jste užil(a) více přípravku Humalog Mix25, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi.
Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Humalog Mix25
Jestliže si podáte menší dávku přípravku Humalog Mix25 než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Humalogu Mix25 nebo pero a zásobní vložky pro případ, že se vaše pero KwikPen nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Humalog Mix25
Jestliže si podáte menší dávku přípravku Humalog Mix25 než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Humalog Mix25 nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Humalog Mix25, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1,000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Humalog Mix25 nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Humalog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky jsou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
Před prvním použitím uchovávejte přípravek Humalog Mix25 KwikPen v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem.
Používané pero Humalog Mix25 KwikPen uchovávejte při pokojové teplotě (15° - 30°C) a po 28 dnech jej znehodnoťte. Nevystavujte jej nadměrnému teplu nebo přímému slunečnímu svitu. Používané pero Kwikpen neuchovávejte v chladničce. Pero KwikPen nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek Humalog Mix25 KwikPen nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte přípravek Humalog Mix25 KwikPen tvoří-li se v zásobní vložce shluky inzulinu nebo pokud pevné bílé částice ulpívají na dně nebo stěně zásobní vložky, která tím získává matový vzhled. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Humalog Mix25 100 IU/ml KwikPen , injekční suspenze obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami přípravku Humalog Mix25 KwikPen jsou protamin-sulfát, metakresol, fenol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Humalog Mix25 100 IU/ml KwikPen , injekční suspenze vypadá a co obsahuje toto balení
Přípravek Humalog Mix25 100 IU/ml KwikPen je bílá, sterilní injekční suspenze a obsahuje 100 mezinárodních jednotek v jednom mililitru (100 IU/ml) injekční suspenze. 25% inzulinu lispro obsaženého v Humalogu Mix25 je rozpuštěno ve vodě. 75% inzulinu lispro v Humalogu Mix25 je ve formě suspenze s protamin-sulfátem. Jedno pero Humalog Mix25 KwikPen obsahuje 300 jednotek (3 mililitry). Humalog Mix25 KwikPen je balen po 5 nebo v multipaku po 2x5 předplněných perech. Na trhu nemusí být všechny velikosti balení. Humalog Mix25 v předplněném peru Kwikpen je stejný jako Humalog Mix25 zásobní vložky. V předplněném peru KwikPen je zásobní vložka zabudována. Předplněné pero KwikPen nelze po vyprázdnění znovu použít.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Humalog Mix25 100 IU/ml KwikPen , injekční suspenze jsou:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
• Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
• Lilly Pharma Fertigung und Distribution GmbH & Co. KG, Teichweg 3, 35396 Giessen, Německo.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
|
Belgique/Belgie/Belgien Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
Lietuva Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600 |
|
Bt^rapnn Tn "Enn Hunn HegepnaHg" E.B. - Etnrapna Ten. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 6000 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Lilly Deutschland GmbH Tel. + 49-(0) 6172 273 2222 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXáSa OAPMAIEPB-AIAAY A.E.B.E. Tr|^: +30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Ísland Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
Kúrcpog
Phadisco Ltd
T r(k: +357 22 715000
Sverige
Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800
Latvija
Eli Lilly Holdings Limited párstavnieciba Latvija
Tel: +371 67364000
United Kingdom
Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000
Tato příbalová informace byla naposledy revidována {MM.RRRR}.
NÁVOD K OBSLUZE
Níže si prosím přečtěte Návod k obsluze.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Humalog Mix50 100 IU/ml KwikPen , injekční suspenze insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí
ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Humalog Mix50 KwikPen a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog Mix50 KwikPen užívat
3. Jak se přípravek Humalog Mix50 KwikPen užívá
4. Možné nežádoucí účinky
5. Jak přípravek Humalog Mix50 KwikPen uchovávat
6. Obsah balení a další informace
1. Co je přípravek Humalog Mix50 KwikPen a k čemu se používá
Přípravek Humalog Mix50 KwikPen se používá k léčbě diabetu. Humalog Mix50 KwikPen je předmísená suspenze. Její účinnou látkou je inzulin lispro. 50% inzulinu lispro obsaženého v Humalogu Mix50 KwikPen je rozpuštěno ve vodě a díky lehce pozměněné molekule inzulinu má rychlejší účinek než normální lidský inzulin. 50% inzulinu lispro v Humalogu Mix50 KwikPen je ve formě suspenze s protamin-sulfátem, tím je jeho účinek prodloužen.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Humalog Mix50 je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem má Humalog Mix50 velmi rychlý a dlouhodobější účinek. Za normálních okolností byste měli užívat Humalog Mix50 v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Humalog Mix50 KwikPen v kombinaci s déle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog Mix50 KwikPen užívat
NEUŽÍVEJTE přípravek Humalog Mix50 KwikPen
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Humalog Mix50, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Humalog Mix 50 KwikPen
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin), betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného
vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatření“).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
3. Jak se přípravek Humalog Mix50 KwikPen užívá
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulinu označený na krabičce a na předplněném peru. Ujistěte se, že jste obdrželi lékařem doporučený Humalog Mix50 KwikPen .
Dávkování
• Za normálních okolností byste si měli aplikovat Humalog Mix50 v rozmezí 15 minut kolem jídla. V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Humalog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Humalog Mix50 podávejte podkožně. Jinou cestu aplikace byste neměli používat. Za žádných okolností nesmí být Humalog Mix50 podán nitrožilně.
Příprava Humalog Mix50 KwikPen
• Bezprostředně před použitím by pero KwikPen mělo být desetkrát převaleno v dlaních a desetkrát převráceno o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování. Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled. Před každou aplikací vložku zkontrolujte.
Příprava pera KwikPen k použití (viz Návod k použití)
• Nejprve si umyjte ruce.
• Přečtěte si návod jak užívat předplněná inzulinová pera. Řiďte se pečlivě pokyny návodu. Následují některá upozornění.
• Užívejte čistou jehlu. (Jehly nejsou součástí pera).
• Před každým použitím pero KwikPen prostříkněte. Tak se přesvědčíte, že inzulin prochází jehlou a že jste z pera KwikPen odstranili vzduchové bubliny. Malé bubliny, které mohou zůstat v peru KwikPen, jsou neškodné .Jsou-li však bubliny velké, mohou ovlivnit velikost dávky.
Aplikace Humalog Mix50
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím se ujistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera KwikPen. Tím zůstane inzulin sterilní a nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt.
Další dávky
• Při každém užití pera KwikPen použijte novou jehlu. Před každou aplikací odstraňte vzduchové bubliny. Podržíte-li pero jehlou dolů, uvidíte, kolik inzulinu v peru KwikPen ještě zbývá. Na stupnici zásobní vložky můžete sledovat, kolik jednotek zbývá.
• Nemíchejte žádný jiný inzulin v peru k jednorázovému použití. Je-li pero KwikPen prázdné, znovu ho neužívejte. Pero bezpečně znehodnoťte - lékárník nebo zdravotní sestra vám poskytne instrukce.
Jestliže jste užil(a) více přípravku Humalog Mix50, než jste měl(a)
Jestliže jste užil(a) více přípravku Humalog Mix50, než jste měl(a), může dojít ke snížení hladiny
cukru v krvi. Zkontrolujte si hladinu cukru v krvi.
Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Humalog Mix50
Jestliže si podáte menší dávku přípravku Humalog Mix50 než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Humalogu Mix50 nebo pero a zásobní vložky pro případ, že se vaše pero KwikPen nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Humalog Mix50
Jestliže si podáte menší dávku přípravku Humalog Mix50 než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Humalog Mix50 nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Humalog Mix50, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1,000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Humalog Mix50 nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Humalog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky jsou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Humalog Mix50 KwikPen uchovávat
Před prvním použitím uchovávejte přípravek Humalog Mix50 KwikPen v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem.
Používané pero Humalog Mix50 KwikPen uchovávejte při pokojové teplotě (15° - 30°C) a po 28 dnech jej znehodnoťte. Nevystavujte jej nadměrnému teplu nebo přímému slunečnímu svitu. Používané pero KwikPen neuchovávejte v chladničce. Pero KwikPen nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek Humalog Mix50 KwikPen nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte přípravek Humalog Mix50 KwikPen tvoří-li se v zásobní vložce shluky inzulinu nebo pokud pevné bílé částice ulpívají na dně nebo stěně zásobní vložky, která tím získává matový vzhled. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Humalog Mix50 100 IU/ml KwikPen , injekční suspenze obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami přípravku Humalog Mix50 KwikPen jsou protamin-sulfát, metakresol, fenol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Humalog Mix50 100 IU/ml KwikPen , injekční suspenze vypadá a co obsahuje toto balení
Přípravek Humalog Mix50 100 IU/ml KwikPen je bílá, sterilní injekční suspenze a obsahuje 100 mezinárodních jednotek v jednom mililitru (100 IU/ml) injekční suspenze. 50% inzulinu lispro obsaženého v Humalogu Mix50 je rozpuštěno ve vodě. 50% inzulinu lispro v Humalogu Mix50 je ve formě suspenze s protamin-sulfátem. Jedno pero Humalog Mix50 KwikPen obsahuje 300 jednotek (3 mililitry). Humalog Mix50 KwikPen je balen po 5 nebo v multipaku po 2x5 předplněných perech. Na trhu nemusí být všechny velikosti balení. Humalog Mix50 KwikPen v předplněném peru je stejný jako Humalog Mix50 zásobní vložky. V předplněném peru KwikPen je zásobní vložka zabudována. Předplněné pero KwikPen nelze po vyprázdnění znovu použít.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Humalog Mix50 100 IU/ml KwikPen , injekční suspenze jsou:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
• Eli Lilly Italia S.p.A., Via A. Gramsci 731-733, 50019 Sesto Fiorentino, Florence, Itálie.
• Lilly Pharma Fertigung und Distribution GmbH & Co. KG, Teichweg 3, 35396 Giessen, Německo.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci. Belgique/Belgie/Belgien Lietuva
Eli Lilly Benelux S.A./N.V. Eli Lilly Holdings Limited atstovybé
Tél/Tel: + 32-(0)2 548 84 84 Tel. +370 (5) 2649600
|
Btarapna Tn "Ean Ruru HegepaaHg" E.B. - Etarapna Ten. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 6000 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Lilly Deutschland GmbH Tel. + 49-(0) 6172 273 2222 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXáSa OAPMAIEPB-AIAAY A.E.B.E. Tr^: +30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Ísland Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
|
Kúnpoq Phadisco Ltd Tr^: +357 22 715000 |
Sverige Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800 |
|
Latvija Eli Lilly Holdings Limited parstavnieciba Latvija Tel: +371 67364000 |
United Kingdom Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000 |
Tato příbalová informace byla naposledy revidována {MM.RRRR}.
NÁVOD K OBSLUZE
Níže si prosím přečtěte Návod k obsluze.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Humalog BASAL 100 IU/ml KwikPen , injekční suspenze insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Humalog BASAL KwikPen a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog BASAL KwikPen užívat
3. Jak se přípravek Humalog BASAL KwikPen užívá
4. Možné nežádoucí účinky
5. Jak přípravek Humalog BASAL KwikPen uchovávat
6. Obsah balení a další informace
1. Co je přípravek Humalog BASAL KwikPen a k čemu se používá
Přípravek Humalog BASAL KwikPen se používá k léčbě diabetu. Jeho účinnou látkou je inzulin lispro. Inzulin lispro v Humalogu BASAL KwikPen je ve formě suspenze s protamin-sulfátem, tím je jeho účinek prodloužen.
Pokud vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Humalog BASAL je náhražkou vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem má Humalog BASAL dlouhodobější účinek.
Je možné, že vám lékař doporučí užívat Humalog BASAL v kombinaci s rychle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem. Pokud měníte typ inzulinu, buďte velice opatrní.
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog BASAL KwikPen užívat
NEUŽÍVEJTE přípravek Humalog BASAL KwikPen
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat (viz bod 3 Jestliže jste užil(a) více přípravku Humalog BASAL, než jste měl(a).
- jestliže jste alergický/á (přecitlivělý/á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
• Je-li hladina cukru ve vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete níže v textu. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle
• Pijete-li alkohol, může se množství inzulinu, které potřebujete, rovněž změnit.
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost, nebo rychlý nárůst tělesné hmotnosti, nebo místní otoky.
Další léčivé přípravky a přípravek Humalog BASAL KwikPen
Vaše potřeba inzulinu může být změněna, pokud berete
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika,
• kyselinu acetylsalicylovou,
• sulfonamidy,
• oktreotid,
• “beta-2 mimetika” (např. ritodrin, salbutamol nebo terbutalin),
• betablokátory, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného
vychytávání serotoninu),
• danazol,
• některé inhibitory angiotenzin konvertujícího enzymu (ACE) (např. kaptopril, enalapril) a
• blokátory receptorů angiotenzinu II.
Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu (viz bod „Upozornění a opatřeníí“).
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizí
3. Jak se přípravek Humalog BASAL KwikPen užívá
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulinu označený na krabičce a na předplněném peru. Ujistěte se, že jste obdrželi lékařem doporučený Humalog BASAL KwikPen .
Dávkování
• Za normálních okolností byste si měli aplikovat Humalog BASAL jako váš bazální inzulin. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Humalog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Humalog BASAL podávejte podkožně. Jinou cestu aplikace byste neměli používat. Za žádných okolností nesmí být Humalog BASAL podán nitrožilně.
Příprava Humalog BASAL KwikPen
• Bezprostředně před použitím by pero KwikPen mělo být desetkrát převaleno v dlaních a desetkrát převráceno o 180° k promísení inzulinu a docílení rovnoměrného zákalu nebo mléčného zabarvení. Pokud se tak nestane, je nutno opakovat výše zmíněný postup, než se obsah promísí. Zásobní vložky obsahují malý skleněný korálek usnadňující míchání. Příliš rázné třepání se nedoporučuje, protože může způsobit zpěnění, které by mohlo ovlivnit správné dávkování. Zásobní vložky by měly být často kontrolovány a neměly by být použity, pokud inzulin tvoří shluky nebo pokud pevné bílé částice ulpívají na dně nebo stěně vložky, která tím získává matový vzhled. Před každou aplikací vložku zkontrolujte.
Příprava pera KwikPen k použití (viz Návod k použití)
• Nejprve si umyjte ruce.
• Přečtěte si návod jak užívat předplněná inzulinová pera. Řiďte se pokyny návodu. Následují některá upozornění.
• Užívejte čistou jehlu. (Jehly nejsou součástí pera).
• Před každým použitím pero KwikPen prostříkněte. Tak se přesvědčíte, že inzulin prochází jehlou a že jste z pera KwikPen odstranili vzduchové bubliny. Malé bubliny, které mohou zůstat v peru, jsou neškodné .Jsou-li však bubliny velké, mohou ovlivnit velikost dávky.
Aplikace Humalog BASAL
• Před aplikací injekce dobře očistěte kůži podle rady lékaře. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Neaplikujte injekci do žíly. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím se ujistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte pomocí vnějšího krytu jehlu z pera KwikPen. Tím zůstane inzulin sterilní a nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt.
Další dávky
• Při každém užití pera KwikPen použijte novou jehlu. Před každou aplikací odstraňte vzduchové bubliny. Podržíte-li pero jehlou dolů, uvidíte, kolik inzulinu v peru KwikPen ještě zbývá. Na stupnici zásobní vložky můžete sledovat, kolik jednotek zbývá.
• Nemíchejte žádný jiný inzulin v peru k jednorázovému použití. Je-li pero KwikPen prázdné, znovu ho neužívejte. Pero bezpečně znehodnoťte - lékárník nebo zdravotní sestra vám poskytne instrukce.
Jestliže jste užil(a) více přípravku Humalog BASAL, než jste měl(a)
Jestliže jste užil(a) více přípravku Humalog BASAL, než jste měl(a), může dojít ke snížení hladiny
cukru v krvi. Zkontrolujte si hladinu cukru v krvi.
Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se váš stav zhorší, začne se vám hůře dýchat a vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Humalog BASAL
Jestliže si podáte menší dávku přípravku Humalog BASAL než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, nevolnost, zvracení, dehydrataci, bezvědomí, kóma nebo dokonce smrt (viz A a B v bodě „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Humalogu BASAL nebo pero a zásobní vložky pro případ, že se vaše pero KwikPen nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy s sebou noste cukr.
Jestliže jste přestal(a) užívat přípravek Humalog BASAL
Jestliže si podáte menší dávku přípravku Humalog BASAL než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulinu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Humalog BASAL nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Místní alergie je častá (>1/100 a <1/10). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Celková alergie je vzácná (>1/10 000 a <1/1 000). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• obtíže s dechem • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Humalog BASAL, okamžitě informujte svého lékaře.
Lipodystrofie (ztenčování kůže) je méně častá (> 1/1,000 a <1/100). Všimnete-li si ztenčování nebo propadnutí kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny případy výskytu otoků (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetů
A. Hypoglykémie
Hypoglykémie ("hypo”-nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Humalog BASAL nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se vám změnila potřeba inzulinu; nebo
• zhorší-li se vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi.
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, ve kterých by hypoglykémie ohrožovala vás nebo ostatní (např. řízení motorového vozidla).
B. Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”-příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Humalog nebo jiný inzulin;
• podáte-li si méně inzulinu než vám lékař doporučil;
• pokud jíte mnohem více než vám dieta povoluje nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První symptomy nastupují pomalu, po mnoho hodin nebo dní. Příznaky mohou být následující:
• ospalost • nechutenství
• zarudnutí v obličeji • ovocná příchuť dechu
• žízeň • nevolnost
Závažnými příznaky jsou obtíže s dechem a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
C. Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Humalog BASAL KwikPen uchovávat
Před prvním použitím uchovávejte přípravek Humalog BASAL KwikPen v chladničce při teplotě (2°C - 8°C). Chraňte před mrazem.
Používané pero Humalog BASAL KwikPen uchovávejte při pokojové teplotě (15° - 30°C) a po 21 dnech jej znehodnoťte. Nevystavujte jej nadměrnému teplu nebo přímému slunečnímu svitu. Používané pero KwikPen neuchovávejte v chladničce. Pero KwikPen nesmí být uchováváno s nasazenou jehlou.
Přípravek uchovávejte mimo dosah a dohled dětí.
Přípravek Humalog BASAL KwikPen nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte přípravek Humalog BASAL KwikPen tvoří-li se v zásobní vložce shluky inzulinu nebo pokud pevné bílé částice ulpívají na dně nebo stěně zásobní vložky, která tím získává matový vzhled. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Humalog BASAL 100 IU/ml KwikPen , injekční suspenze obsahuje
- Léčivou látkou je inzulin lispro. Inzulin lispro je vyráběn v laboratoři procesem nazývaným “rekombinantní DNA technologie”. Je to pozměněná forma lidského inzulinu a jde tudíž o typ odlišný od jiných lidských a zvířecích inzulinů. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
- Pomocnými látkami přípravku Humalog BASAL KwikPen jsou protamin-sulfát, metakresol, fenol, glycerol, heptahydrát hydrogenfosforečnanu sodného, oxid zinečnatý a voda na injekci. K úpravě kyselosti mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Humalog BASAL 100 IU/ml KwikPen , injekční suspenze vypadá a co obsahuje toto balení
Přípravek Humalog BASAL 100 IU/ml KwikPen je bílá, sterilní injekční suspenze a obsahuje 100 mezinárodních jednotek v jednom mililitru (100 IU/ml) injekční suspenze. Inzulin lispro v Humalogu BASAL je ve formě suspenze s protamin-sulfátem. Jedno pero Humalog BASAL KwikPen obsahuje 300 jednotek (3 mililitry). Humalog BASAL KwikPen je balen po 5 nebo v multipaku po 2x5 předplněných perech. Na trhu nemusí být všechny velikosti balení. Humalog BASAL KwikPen v předplněném peru je stejný jako Humalog BASAL zásobní vložky. V předplněném peru KwikPen je zásobní vložka zabudována. Předplněné pero KwikPen nelze po vyprázdnění znovu použít.
Držitel rozhodnutí o registraci a výrobce
Výrobci přípravku Humalog BASAL 100 IU/ml KwikPen, injekční suspenze jsou:
• Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
• Lilly Pharma Fertigung und Distribution GmbH & Co. KG, Teichweg 3, 35396 Giessen, Německo.
Držitelem rozhodnutí o registraci je: Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci. Belgique/Belgie/Belgien Lietuva
Eli Lilly Benelux S.A./N.V. Eli Lilly Holdings Limited atstovybé
Tél/Tel: + 32-(0)2 548 84 84 Tel. +370 (5) 2649600
|
Btarapna Tn "Ean Ruru HegepaaHg" E.B. - Etarapna Ten. + 359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 6000 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Lilly Deutschland GmbH Tel. + 49-(0) 6172 273 2222 |
Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXáSa OAPMAIEPB-AIAAY A.E.B.E. Tr^: +30 210 629 4600 |
Osterreich Eli Lilly Ges. m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Ísland Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
|
Kúnpoq Phadisco Ltd Tr^: +357 22 715000 |
Sverige Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800 |
|
Latvija Eli Lilly Holdings Limited parstavnieciba Latvija Tel: +371 67364000 |
United Kingdom Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000 |
Tato příbalová informace byla naposledy revidována {MM.RRRR}.
NÁVOD K OBSLUZE
Níže si prosím přečtěte Návod k obsluze.
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
NÁVOD K OBSLUZE
KwikPen™ Inzulínové pero

Lilly
PŘED POUŽITÍM SI PROSÍM PŘEČTĚTE TENTO NÁVOD
Úvod
Pero KwikPen™ je navrženo pro jednoduché použití. Je to jednorázové pero obsahující 3 ml (300 jednotek) inzulínu 100 IU/ml. V jedné injekci můžete aplikovat dávku od 1 do 60 jednotek inzulínu. Dávku můžete nastavovat po jedné jednotce. V případě, že nastavíte příliš mnoho jednotek inzulinu, můžete dávku opravit, aniž by při tom došlo ke ztrátě inzulinu.
Před používáním pera KwikPen si pečlivě přečtěte celý návod k použití a řiďte se pečlivě jeho pokyny. V případě nedodržení přesného postupu si můžete aplikovat příliš velkou nebo příliš malou dávku inzulinu.
Vaše pero KwikPen můžete pro aplikaci injekce používat pouze Vy osobně. Své pero ani jehly s nikým nesdílejte, jinak se vystavujete přenosu nákaz. Pro každou injekci použijte novou jehlu.
Jestliže se Vám zdá pero nebo některá jeho část poškozená, pero NEPOUŽÍVEJTE. Vždy s sebou noste náhradní pero pro případ ztráty nebo poškození.
Pero není určeno osobám nevidomým nebo osobám s poškozeným zrakem, pokud jim nemůže pomoci
osoba, která je s obsluhou pera seznámena.
Příprava pera KwikPen
Důležitá upozornění
• Čtěte a dodržujte pokyny z příbalové informace inzulinu.
• Před každou injekcí na etiketě zkontrolujte dobu použitelnosti pera a přesvědčte se, že používáte správný typ inzulinu. Etiketu z pera neodstraňujte.
Poznámka: Barva dávkovacího tlačítka Vašeho pera KwikPen odpovídá barevnému označení na etiketě a je specifická pro jednotlivé typy inzulinu. V tomto návodu je dávkovací tlačítko zobrazeno jako šedé. Tělo pera je modré a označuje, že pero obsahuje některý z přípravků Humalog.
Rozlišení barvy dávkovacího tlačítka podle typu:
|
• |
G |
• |
• |
|
Humalog |
Humalog Mix25 |
Humalog Mix50 |
Humalog Basal |
• Ošetřující lékař vám předepsal inzulin, který je pro vás nejvhodnější. Jakékoliv změny v inzulínové léčbě by měly být prováděny pouze pod dohledem lékaře.
• Pro použití s perem KwikPen jsou doporučeny jehly firmy Becton, Dickinson and Company (BD).
• Před použitím pera se ujistěte, že je jehla úplně dotažena.
• Pro případ potřeby si tyto pokyny uschovejte.
Často kladené otázky týkající se přípravy pera KwikPen
• Jak by můj inzulin měl vypadat? Některé inzuliny jsou zakalené, zatímco jiné jsou čiré. Kontrolu svého konkrétního inzulinu proveďte podle jeho popisu v příbalovém letáku.
• Co bych měl/a dělat v případě, že je moje předepsaná dávka vyšší než 60 jednotek? Pokud je vaše předepsaná dávka vyšší než 60 jednotek inzulinu, může být zapotřebí více injekcí, nebo se můžete spojit se svým lékařem.
• Proč bych měl/a pro každou injekci použít novou jehlu? Jestliže je jehla používána opakovaně, můžete si podat chybnou dávku inzulinu, ucpat jehlu, ucpat pero nebo získat infekci, protože není zajištěna sterilita.
• Co bych měl/a dělat v případě, že si nejsem jistý/á, kolik v náplni zbývá inzulinu? Obraťte pero dolů koncem, na který se připojuje jehla.Stupnice na průhledné části držáku náplně vám ukáže přibližný počet zbývajících jednotek. Tento údaj NEPOUŽÍVEJTE k odměření dávky inzulinu.
• Co bych měl/a dělat, když nemohu sundat kryt pera? Kryt pera sundejte přímým tahem. Jestliže máte potíže se sundáním krytu, jemně krytem pro srovnání pootočte tam a zpět a potom kryt sundejte přímým tahem.
Prostříknutí pera KwikPen
Důležitá upozornění
• Pero před každou injekcí prostříkněte. Aby bylo pero připraveno k podání dávky, musí být před každou injekcí prostříknuto tak, aby byl zjevný vytékající proud inzulinu.
• Jestliže pero neprostříknete tak, aby byl zjevný vytékající proud inzulinu, můžete si aplikovat příliš velkou nebo příliš malou dávku inzulinu.
Často kladené otázky týkající se prostříknutí pera
• Proč bych měl prostříknout pero před každou injekcí?
1. Zajišťuje, že pero je správně připraveno.
2. Ověřuje, že po zmáčknutí dávkovacího tlačítka bude z jehly vytékat proud inzulinu.
3. Odstraňuje vzduch, který se v průběhu normálního používání mohl nahromadit v jehle nebo zásobní vložce s inzulinem.
• Co bych měl/a udělat, pokud nemohu při prostřikování pera KwikPen úplně zmáčknout dávkovací tlačítko?
1. Nasaďte novou jehlu.
2. Prostříkněte pero.
• Co bych měl/a udělat, pokud v zásobní vložce vidím vzduchové bubliny? Potřebujete prostříknout pero. Neuchovávejte pero s nasazenou jehlou, může to způsobit hromadění vzduchových bublin v zásobní vložce s inzulinem. Malá vzduchová bublinka neovlivní dávku a můžete pokračovat v aplikaci dávky jako obvykle.
Podání dávky
Důležitá upozornění
• Dodržujte pokyny správné injekční techniky doporučené vaším ošetřujícím lékařem.
• Podání úplné dávky zajistíte tak, že stisknete dávkovací tlačítko a před vytažením jehly z kůže je držíte stisknuté, dokud pomalu nenapočítáte do 5. Pokud z pera vytéká inzulin, nebyla jehla
v kůži držena dostatečně dlouho.
• Kapka inzulinu na špičce jehly je normální. Neovlivní velikost dávky.
• Pero neumožňuje nastavit vyšší dávka, než je množství inzulinu zbývající v peru.
• Pokud si nejste jisti, zda jste si podali celou dávku, nepodávejte si další dávku. Kontaktujte společnost Lilly nebo svého lékaře.
• Pokud je vaše předepsaná dávka vyšší než počet jednotek zbývajících v peru, můžete si buď podat množství zbývající v současném peru a pro podání další části dávky použít nové pero nebo podat celou dávku novým perem.
• Nezkoušejte si podat dávku otáčením dávkovacího tlačítka. Dávku si NEPODÁTE otáčením dávkovacího tlačítka. Aby byla dávka podána, musíte ZMÁČKNOUT injekční tlačítko kolmo dolů.
• V průběhu aplikace se nepokoušejte změnit nastavenou dávku.
• Zde popsané způsoby zacházení s jehlami nenahrazují místní normy pro zacházení s tímto materiálem.
• Po ukončení každé injekce odstraňte jehlu.
Často kladené otázky týkající se podání dávky
• Proč je obtížné stlačit injekční tlačítko při aplikaci injekce?
1. Jehla může být ucpaná. Zkuste nasadit novou jehlu. Když to uděláte, můžete vidět z jehly vytékat inzulin. Prostříkněte pero.
2. Při rychlém stlačení injekčního tlačítka se může toto tlačítko mačkat obtížněji. Pomalejší stlačení může být snadnější.
3. Při použití jehly s větším průměrem jde injekční tlačítko zmáčknou snadněji. Poraďte se se svým lékařem, jaké jehly jsou pro vás nejlepší.
4. Jestliže žádný z těchto postupů nepomůže, může být nutné pero vyměnit.
• Co bych měl/a udělat, pokud je pero KwikPen ucpané? Pero je ucpané, pokud je obtížné aplikovat nebo nastavit dávku. Pro zprůchodnění pera:
1. Nasaďte novou jehlu. Když to uděláte, můžete vidět z jehly vytékat inzulin.
2. Prostříkněte pero.
3. Nastavte dávku a aplikujte ji.
Nepokoušejte se pero promazat, mohl by se poškodit jeho mechanismus.
Dávkovací tlačítko může jít zmáčknout těžce tehdy, jestliže je vnitřek pera znečištěn cizorodými
látkami (nečistoty, prach, jídlo, inzulin nebo jiné tekutiny). Vyvarujte se znečištění vnitřku pera
cizorodými látkami.
• Proč inzulin vytéká z jehly po ukončení aplikace dávky? Mohl/a jste vytáhnout jehlu z kůže příliš rychle.
1. Ujistěte se, že v dávkovacím okénku vidíte symbol 0.
2. Při aplikaci příští dávky injekční tlačítko držte pevně stlačené a před vytažením jehly pomalu počítejte do 5.
• Co bych měl/a udělat, pokud je nastavena dávka a dávkovací tlačítko bylo nedopatřením zmáčknuto bez nasazené jehly?
1. Nastavte pero zpět na nulu.
2. Nasaďte novou jehlu.
3. Prostříkněte pero.
4. Nastavte dávku a aplikujte ji.
• Co bych měl/a dělat, pokud jsem nastavil/a chybnou dávku (příliš vysokou nebo příliš nízkou)? Otočením dávkovacího tlačítka tam nebo zpět dávku opravíte.
• Co bych měl/a dělat, pokud z jehly vytéká inzulin v průběhu nastavování nebo opravování dávky? Dávku si neaplikujte, protože nemusí být kompletní. Nastavte pero zpět na 0 a znovu jej prostříkněte (viz Běžné užívání část “Prostříknutí pera KwikPen”, kroky 2 B-D). Nastavte dávku a aplikujte ji.
• Co bych měl/a dělat, pokud nemohu nastavit celou předepsanou dávku? Pero neumožňuje nastavení větší dávky, než je zbývající počet jednotek inzulinu v zásobní vložce. Např., pokud budete potřebovat 31 jednotek a v zásobní vložce jich zbývá pouze 25, vice než 25 jednotek nebudete moci nastavit. Nesnažte se nastavit pero za tuto hodnotu. Pokud v peru zůstává pouze neúplná dávka, máte tyto možnosti:
1. Podat část dávky a pro podání zbyvající dávky použít nové pero.
nebo
2. Použít nové pero na podání celé dávky.
• Proč nemohu nastavit dávku a použít malé množství inzulinu, které zůstává v zásobní vložce? Pero je navrženo k podání nejméně 300 jednotek inzulinu. Konstrukce pera nedovoluje zásobní vložku zcela vyprázdnit, protože zbývající malé množství inzulinu nemůže být podáno přesně.
Uchovávání a likvidace
Důležitá upozornění
• Před prvním použitím uchovávejte pero v ledničce (2°C - 8°C). Nepoužívejte pero, pokud bylo zmrazeno.
• Pero uchovávejte při pokojové teplotě a chraňte je před teplem a světlem.
• Neuchovávejte pero s nasazenou jehlou. Pokud je jehla ponechána na peru, inzulin může z pera vytékat, vysrážet se v jehle a tím ji ucpat, nebo se v zásobní vložce mohou tvořit vzduchové bubliny.
• Úplné pokyny k uchovávání inzulinu naleznete v příbalové informaci.
• Po prvním použití by pero nemělo být použito po uplynutí doby uvedené v příbalové informaci.
• Použité jehly vyhoďte do uzavíratelné nádoby, která nejde propíchnout nebo podle pokynů lékaře.
• Použitá pera znehodnoťte bez nasazené jehly podle pokynů lékaře.
• Plnou nádobku na jehly nevyhazujte do nádoby na recyklovatelný odpad.
• Informujte se u svého lékaře nebo lékárníka o místních možnostech, jak nádobku správně zlikvidovat.
• Zde popsané způsoby zacházení s jehlami nenahrazují místní normy pro zacházení s tímto materiálem.
• Pero uchovávejte mimo dosah dětí.
Jestliže máte jakékoliv dotazy nebo problémy se svým perem KwikPen, kontaktujte svého
lékaře.
Příprava
Části pera Komplet pera KwikPen a jehly * prodáváno zvlášť
Části jehly
(Jehly nejsou součástí balení)
Papíro
vá
fólie
Části pera KwikPen
Spona krytu

i
Etiketa pera Ukazatel dávk

Vnější Vnitřní Jehla
kryt kryt
jehly jehly
Kryt pera Pryžový uzávěr
Držák
zásobní
vložky
Tělo
pera
Dávk ovací tlačítk o
Dávkovací
okénko
Rozlišení barvy dávkovacího tlačítka podle typu:
|
• |
© |
• |
0 |
|
Humalog |
Humalog Mix25 |
Humalog Mix50 |
Humalog Basal |
Běžné užívání Před každou injekcí dodržujte následující pokyny 1. Příprava pera KwikPen
A.


Neodstraňujte z pera etiketu.
Ujistěte se, že jste zkontroloval/a:
• typ inzulinu
• datum použitelnosti
• vzhled
Upozornění: Vždy zkontrolujte etiketu pera a ujistěte se, že používáte správný typ inzulinu.
odstraňte kryt pera. Krytem neotáčejte.

Pouze pro
zakalené
inzuliny:
10x pero zlehka poválejte v dlaních. Dále pero 10x převraťte. Promísení je důležité a zajistí, že si aplikujete správnou dávku. Inzulin by měl vypadat rovnoměrně promísený.
C.

Vezměte novou jehlu.
Z vnějšího krytu jehly odstraňte papírovou fólii.
Otřete malý pryžový uzávěr na konci držáku zásobní vložky tamponem s desinfekcí.
D.

Nasaďte jehlu s vnějším krytem přímo na pero.
Jehlu
našroubujte do dotažení.
2. Prostříknutí pera KwikPen
Upozornění: Pokud neprostříknete pero před každou injekcí tak, aby byl zjevný vytékající proud inzulínu, můžete si aplikovat příliš velkou nebo příliš malou dávku inzulínu.

Odstraňte vněj ší kryt jehly. Nevyhazujte jej.
Odstraňte vnitřní kryt jehly a vyhoďte jej.
Otáčením dávkovacího tlačítka nastavte 2 jednotky.
Otočte pero jehlou nahoru.
Poklepávejte na držák zásobní vložky tak, aby se vzduch shromáždil nahoře.
D.
• S jehlou směrem nahoru stiskněte dávkovací tlačítko nadoraz až se v dávkovacím okénku objeví 0.
• Držte dávkovací tlačítko a pomalu počítejte do 5.
• Prostříknutí je dokončeno, pokud ze špičky jehly vytéká proud inzulínu.
• Pokud se proud inzulinu neobjeví, opakujte až čtyřikrát kroky 2B až 2D.

Pozn: Pokud nevidíte vytékat proud inzulinu ze špičky jehly a nastavení pera je obtížnější, vyměňte jehlu a prostříkněte pero.
3.Podání dávky A.

B.


C.


Pozn.:
Zkontrolováním číslice 0 v dávkovacím okénku se ujistěte, že jste si podal/a celou dávku.
|
Pozn: pero neumožňuje nastavení vyšší | |
|
dávky než je zbývající počet jednotek v | |
|
peru. | |
|
Pokud si nejste jisti, zda jste si podali | |
|
celou dávku, nepodávejte si další dávku. |
Pro podání celé dávky držte tlačítko zmáčknuté a pomalu počítejte do 5.
Vytáhněte jehlu z kůže.
Nastavte požadovanou dávku otáčením dávkovacího tlačítka. Jestliže nastavíte příliš vysokou dávku, můžete ji opravit otočením dávkovacího tlačítka zpět.
Příklad:
10 jednotek.

Příklad:
15 jednotek.

Proveďte vpich injekční technikou podle poučení vašeho lékaře.
Přiložte palec na injekční tlačítko a pevně je stiskněte, dokud se nezastaví.
Na jehlu opatrně nasaďte vnější kryt.
Pozn: Po každé injekci odstraňte jehlu, předejdete tím vnikání vzduchu do zásobní vložky. Neuchovávejte pero s nasazenou jehlou.
Jehlu
s nasazeným krytem odstraňte odšroubováním a znehodnoťte ji podle rady vašeho lékaře.

Nasaďte zpět kryt pera přímým zatlačením.
Sudé hodnoty jsou zobrazeny na tlačítku. Liché hodnoty jsou zobrazeny jako celé čáry mezi sudými čísly.
Příbalová informace: informace pro uživatele
Humalog 200 jednotek/ml, injekční roztok v předplněném peru insulinům lisprum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Humalog 200 jednotek/ml KwikPen a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog 200 jednotek/ml KwikPen užívat
3. Jak se přípravek Humalog 200 jednotek/ml KwikPen užívá
4. Možné nežádoucí účinky
5. Jak přípravek Humalog 200 jednotek/ml KwikPen uchovávat
6. Obsah balení a další informace
1. Co je přípravek Humalog 200 jednotek/ml KwikPen a k čemu se používá
Přípravek Humalog 200 jednotek/ml KwikPen se používá k léčbě diabetu. Díky lehce pozměněnému inzulinu lispro oproti normálnímu lidskému inzulinu má Humalog rychlejší účinek. Inzulin lispro je blízký lidskému inzulinu, což je přirozený hormon tvořený ve slinivce břišní.
Pokud Vaše slinivka břišní netvoří dostatečné množství inzulinu k udržení normální hladiny cukru v krvi, máte onemocnění, které se nazývá diabetes (cukrovka). Humalog je náhražkou Vašeho vlastního inzulinu. Používá se k dlouhodobé kontrole hladiny cukru v krvi. Ve srovnání s rozpustným inzulinem působí velmi rychle a po kratší dobu (2-5 hodin). Za normálních okolností byste měli užívat Humalog v rozmezí 15 minut kolem jídla.
Je možné, že vám lékař doporučí užívat Humalog 200 jednotek/ml KwikPen v kombinaci s déle působícím inzulinem. U každého typu inzulinu najdete jinou příbalovou informaci. Neměňte si sami inzulin bez konzultace se svým lékařem.
Humalog 200 jednotek/ml by měl být vyhrazen pro léčbu dospělých pacientů s diabetem, kteří potřebují denní dávky vyšší než 20 jednotek rychle účinkujícího inzulinu.
2. Čemu musíte věnovat pozornost, než začnete přípravek Humalog 200 jednotek/ml KwikPen užívat
NEUŽÍVEJTE přípravek Humalog 200 jednotek/ml KwikPen
- jestliže jste alergický(á) na inzulin lispro nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
- máte-li podezření na hypoglykémii (nízká hladina cukru v krvi). Dále v tomto textu najdete rady, jak se při mírné hypoglykémii zachovat. (viz bod 3 Jestliže jste užil(a) více přípravku Humalog, než jste měl(a).
Upozornění a opatření
• Injekční roztok Humalog 200 jednotek/ml v předplněném peru (KwikPen) musí být aplikován POUZE tímto předplněným perem. Nepřenášejte inzulin lispro ze svého přípravku Humalog 200 jednotek/ml KwikPen do injekční stříkačky. Značení na inzulínové stříkačce nebude měřit dávku správně. Může pak dojít k závažnému předávkování, které způsobí snížení hladiny cukru v krvi a může ohrozit Váš život. Nepřenášejte inzulin ze svého přípravku Humalog 200 jednotek/ml KwikPen do žádného jiného prostředku k dávkování inzulinu, jako jsou inzulínové pumpy.
• NEMÍCHEJTE přípravek Humalog 200 jednotek/ml injekční roztok v předplněném peru (KwikPen) s žádným jiným inzulinem nebo jiným léčivým přípravkem. Injekční roztok přípravku Humalog 200 jednotek/ml nesmí být ředěn.
• Je-li hladina cukru ve Vaší krvi dobře udržována současnou léčbou inzulinem, nemusíte nutně zaregistrovat varovné příznaky klesajícího cukru v krvi. Popis varovných příznaků najdete v bodě 4 této příbalové informace. Musíte pečlivě přemýšlet o tom, kdy přijímáte potravu, jak často můžete vykonávat fyzickou aktivitu a co všechno zvládnete. Také si musíte často kontrolovat hladinu cukru v krvi.
• V některých případech pacienti, kteří měli hypoglykémii po převedení ze zvířecího na lidský inzulin, udávali, že časné varovné příznaky byly odlišné a méně zřetelné. Máte-li často hypoglykémie nebo je hůře rozpoznáváte, poraďte se, prosím, se svým lékařem.
Odpovíte-li ANO na některou z následujících otázek, sdělte to svému lékaři.
- Byl/a jste v poslední době nemocen/nemocná?
- Trpíte onemocněním ledvin nebo jater?
- Vykonáváte větší fyzickou aktivitu než obvykle?
• Plánujete-li cestu do zahraničí, sdělte to svému lékaři. Časový rozdíl mezi zeměmi může znamenat změnu časového rytmu aplikace inzulinu a příjmu potravy oproti tomu, když jste doma.
• U některých pacientů s dlouho trvajícím diabetem 2. typu a srdečním onemocněním nebo předchozí mozkovou příhodou, kteří byli léčeni pioglitazonem a inzulinem, došlo k rozvoji srdečního selhání. Co nejdříve informujte svého lékaře, pokud se u Vás objeví příznaky srdečního selhání, jako je neobvyklá dušnost nebo rychlý nárůst tělesné hmotnosti nebo místní otoky.
Další léčivé přípravky a přípravek Humalog 200 jednotek/ml KwikPen
Vaše potřeba inzulinu může být změněna, pokud užíváte
• antikoncepční tablety,
• kortikosteroidy,
• substituční hormonální terapii při léčbě poruch štítné žlázy,
• perorální antidiabetika (např. metformin, akarboza, sloučeniny sulfonylmočoviny, pioglitazon,
empagliflozin, inhibitory DPP-4, jako je sitagliptin nebo saxagliptin),
• kyselinu acetylsalicylovou (Acylpyrin, Anopyrin apod.),
• sulfonamidy,
• analoga somatodtatinu (jako je oktreotid, používaný k léčbě vzácných stavů, při kterých tělo
produkuje příliš mnoho růstového hormonu),
• „beta-2 mimetika”, jako je salbutamol nebo terbutalin, určená k léčbě astmatu, nebo ritodrin,
používaný pro zastavení předčasného porodu,
• beta-blokátory k léčbě vysokého tlaku, nebo
• některá antidepresiva (inhibitory monoaminooxidázy nebo selektivní inhibitory zpětného
vychytávání serotoninu),
• danazol (přípravek ovlivňující ovulaci),
• některé inhibitory angiotenzin konvertujícího enzymu (ACE), které se používají k léčbě
některých srdečních onemocnění nebo k léčbě vysokého krevního tlaku (např. kaptopril,
enalapril) a
• specifické léčivé přípravky užívané k léčbě vysokého krevního tlaku, poškození ledvin
z důvodu diabetu a některých srdečních potíží (blokátory receptorů angiotenzinu II).
Prosím, informujte svého lékaře o všech lécích, které užíváte, které jste užíval(a) v nedávné době, nebo které možná budete užívat (viz také bod „Upozornění a opatření1“).
Přípravek Humalog s alkoholem
Hladiny cukru v krvi mohou po požití alkoholu buď stoupat, nebo klesat. Z tohoto důvodu se může měnit množství inzulinu, které potřebujete.
Těhotenství a kojení
Jste těhotná, těhotenství zvažujete nebo kojíte? Množství inzulinu, které obvykle potřebujete, klesá během prvních tří měsíců těhotenství a zvyšuje se během zbývajících šesti měsíců. Pokud kojíte, bude zřejmě nutné změnit příjem inzulinu nebo vaše dietní návyky. Poraďte se proto se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost koncentrace a reakce může být snížena, máte-li hypoglykémii. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro Vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů). Poraďte se s lékařem o možnosti řídit motorové vozidlo v případě, že:
• máte časté hypoglykémie
• varovné příznaky hypoglykémie jsou snížené nebo zcela vymizelé
3. Jak se přípravek Humalog 200 jednotek/ml KwikPen užívá
Pokaždé, když dostanete přípravek v lékárně, zkontrolujte název a typ inzulinu označený na krabičce a přepdlněném peru. Ujistěte se, že jste obdrželi lékařem předepsaný Humalog 200 jednotek/ml KwikPen.
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem. Pro prevenci možného přenosu infekce musí být jedno pero používáno pouze Vámi, a to i v případě, že je vyměněna jehla.
Humalog 200 jednotek/ml je určen pro pacienty, kteří užívají denní dávku rychle účinkujícího inzulinu vyšší než 20 jednotek.
Nepřenášejte inzulin lispro ze svého přípravku Humalog 200 jednotek/ml KwikPen do injekční stříkačky. Značení na inzulinové stříkačce nebude měřit dávku správně. Může pak dojít k závažnému předávkování, které způsobí snížení hladiny cukru v krvi a může ohrozit Váš život.
Nepoužívejte přípravek Humalog 200 jednotek/ml Kwikpen injekční roztok v inzulinové infuzní pumpě.
Dávkování
• Za normálních okolností byste si měli aplikovat Humalog v rozmezí 15 minut kolem jídla. V případě nutnosti ho lze podat brzy po jídle. Váš lékař vám musí sdělit, jaké přesné množství si máte podávat, kdy a jak často. Tyto instrukce jsou určeny jen pro vás. Přesně se jimi řiďte a pravidelně navštěvujte diabetickou poradnu.
• Pokud měníte typ inzulinu (například z lidského nebo zvířecího inzulinu na přípravek Humalog), mohou se dávky změnit. Tato změna může nastat jen při aplikaci první injekce nebo se dávky mohou měnit postupně po několik týdnů či měsíců.
• Přípravek Humalog podávejte podkožně (subkutánně).
Příprava Humalog 200 jednotek/ml KwikPen
• Humalog je již rozpuštěný ve vodě, nemusíte ho proto míchat. Použijte ho, pouze pokud vypadá jako voda. Musí být čirý, bezbarvý a nesmí obsahovat pevné částice. Před každou aplikací injekci zkontrolujte.
Příprava pera KwikPen k použití (viz Návod k použití)
• Nejprve si umyjte ruce.
• Přečtěte si návod, jak používat toto předplněné inzulinové pero. Řiďte se pečlivě pokyny v návodu. Následují některá upozornění.
• Používejte čistou jehlu. (Jehly nejsou součástí pera).
• Před každým použitím pero KwikPen prostříkněte. Tak se přesvědčíte, že inzulin prochází jehlou a že jste odstranili vzduchové bubliny. Malé bubliny, které mohou zůstat v peru, jsou neškodné .Jsou-li však bubliny velké, mohou ovlivnit velikost dávky inzulinu.
Aplikace přípravku Humalog KwikPen
• Před aplikací injekce dobře očistěte kůži, jak Vám bylo ukázáno. Vbodněte jehlu pod kůži tak, jak jste byli poučeni. Po aplikaci ponechte jehlu v kůži po dobu 5 sekund. Tím se ujistíte, že jste si podali celou dávku. Místo vpichu nemasírujte. Dbejte na to, abyste si dávku aplikovali alespoň 1 cm od místa poslední aplikace, a místa vpichu měňte rotačním způsobem tak, jak jste byli poučeni. Není důležité, které místo pro aplikaci použijete, zda horní část paže, stehno, hýždě nebo břicho. Humalog vždy účinkuje rychleji než normální lidský inzulin.
• Nepodávejte přípravek Humalog 200 jednotek/ml KwikPen injekční roztok přímo do žíly (intravenózně).
Po aplikaci injekce
• Okamžitě po aplikaci injekce sejměte jehlu pomocí vnějšího krytu z pera KwikPen. Tím zůstane inzulin sterilní a nebude unikat. Také tím zabráníte přístupu vzduchu zpět do pera a ucpání jehly. Nesdílejte s nikým jehly. Nesdílejte s nikým pero. Na pero nasaďte ochranný kryt.
Další dávky
• Při každém použití pera KwikPen použijte novou jehlu.Před každou aplikací odstraňte vzduchové bubliny. Podržíte-li pero jehlou vzhůru, uvidíte, kolik inzulinu v peru KwikPen ještě zbývá.
• Je-li pero KwikPen prázdné, znovu ho nepoužívejte. Pero bezpečně znehodnoťte - lékárník nebo zdravotní sestra vám poskytne instrukce.
Jestliže jste užil(a) více přípravku Humalog, než jste měl(a)
Jestliže jste užil(a) více přípravku Humalog, než jste měl(a), může dojít ke snížení hladiny cukru v krvi. Zkontrolujte si hladinu cukru v krvi. Máte-li nízkou hladinu cukru v krvi (mírnou hypoglykémii), užijte tablety glukózy, cukr nebo sladký nápoj, dále pak ovoce nebo sušenky a poté odpočívejte. Tím se často podaří překlenout mírnou hypoglykémii nebo lehké předávkování inzulinem. Pokud se Váš stav zhorší, začne se Vám hůře dýchat a Vaše pokožka zbledne, okamžitě zavolejte lékaře. Podání glukagonu může vyřešit i poměrně těžkou hypoglykémii. Po aplikaci glukagonu užijte glukózu nebo cukr. Pokud glukagon nezabere, budete muset být hospitalizováni. Konzultujte svého lékaře ohledně glukagonu.
Jestliže jste zapomněl(a) užít přípravek Humalog
Jestliže si podáte menší dávku přípravku Humalog, než potřebujete, může se hladina cukru v krvi zvýšit. Zkontrolujte si hladinu cukru v krvi.
Nejsou-li hypoglykémie (nízká hladina cukru) nebo hyperglykémie (vysoká hladina cukru) náležitě léčeny, mohou být velmi závažné a mohou způsobit bolesti hlavy, pocit nevolnosti, zvracení, ztrátu tekutin (dehydrataci), bezvědomí, kóma nebo dokonce smrt (viz bod 4 „Možné nežádoucí účinky“).
Tři jednoduchá pravidla, abyste se vyhnuli hypoglykémii a hyperglykémii, jsou:
• Vždy u sebe mějte náhradní stříkačky a lahvičku Humalogu 100 jednotek/ml nebo pero a zásobní vložky pro případ, že se vaše pero KwikPen nebo zásobní vložky poškodí nebo je ztratíte.
• Vždy u sebe noste průkaz diabetika.
• Vždy u sebe noste cukr.
Jestliže jste přestal(a) užívat přípravek Humalog
Jestliže si podáte menší dávku přípravku Humalog, než potřebujete, může se hladina cukru v krvi zvýšit. Neměňte si sami dávku inzulínu bez konzultace se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Závažná alergie je vzácná (může se vyskytnout až u 1 z 1000 pacientů). Příznaky mohou být následující:
• vyrážka po celém těle • pokles krevního tlaku
• dušnost • zrychlený tep srdce
• sípavé dýchání • pocení
Domníváte-li se, že máte tuto alergii na inzulin při používání Humalogu, okamžitě kontaktujte lékaře.
Místní alergie je častá (může se vyskytnout až i 1 z 10 pacientů). U některých osob dojde v oblasti vpichu injekce inzulinu k zarudnutí, otoku nebo svědění. Tyto příznaky obvykle samovolně vymizí během několika dní až týdnů. Pokud u vás tyto příznaky nastanou, informujte svého lékaře.
Lipodystrofie (ztlušťování nebo dolíčkování kůže) je méně častá (může se vyskytnout až u 1 ze 100 pacientů). Všimnete-li si ztluštění nebo dolíčkování kůže v místě vpichu, sdělte to svému lékaři.
Byly hlášeny otoky (např. otoky paží, kotníků, zadržování tekutin), zvláště na začátku léčby inzulinem nebo při změně léčby pro lepší úpravu hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Časté problémy diabetu
Hypoglykémie
Hypoglykémie ("hypo”- nízká hladina cukru v krvi) znamená, že není dostatek cukru v krvi. Jejími příčinami mohou být:
• podáte-li si příliš velkou dávku Humalogu nebo jiného inzulinu;
• vynecháte-li jídlo nebo se s ním opozdíte nebo změníte svou dietu;
• máte-li nadměrnou fyzickou aktivitu nebo pracujete příliš těžce bezprostředně před jídlem nebo po jídle;
• onemocníte-li infekčním nebo jiným onemocněním (zvláště provázeným průjmem nebo zvracením);
• pokud se změnila Vaše potřeba inzulinu; nebo
• zhorší-li se Vaše onemocnění ledvin nebo jater.
Alkohol a některé léky mohou mít vliv na hladinu cukru v krvi (viz bod 2).
První příznaky nízké hladiny cukru v krvi obvykle nastupují rychle a mohou zahrnovat následující obtíže:
• únava • zrychlená srdeční činnost
• nervozita nebo třes • nevolnost
• bolest hlavy • studený pot
Pokud si nejste jisti, zda poznáte varovné příznaky, vyhněte se situacím, jako je řízení vozidla, ve kterých by hypoglykémie ohrožovala Vás nebo ostatní.
Hyperglykémie a diabetická ketoacidóza
Hyperglykémie ("hyper”- příliš vysoká hladina cukru v krvi) znamená, že váš organismus nemá dostatek inzulinu. Jejími příčinami mohou být:
• opomenete-li si podat Humalog nebo jiný inzulin;
• podáte-li si méně inzulinu, než vám lékař doporučil;
• pokud jíte mnohem více, než vám dieta povoluje, nebo
• máte-li horečku, infekční onemocnění nebo emocionální stres.
Hyperglykémie může vést k diabetické ketoacidóze. První příznaky nastupují pomalu, po mnoho
|
hodin nebo dní. Příznaky mohou být následující: • ospalost |
• | |
|
• zarudnutí v obličeji |
• |
ovocný zápach dechu |
|
• žízeň |
• |
Závažnými příznaky jsou dušnost a zrychlená srdeční činnost. Okamžitě vyhledejte lékařskou pomoc.
Onemocnění
Pokud jste onemocněli, zvláště pociťujete-li nevolnost, může se množství inzulinu, které potřebujete, změnit. Inzulin potřebujete stále, i když nepřijímáte potravu jako za normálních okolností.
Zkontrolujte si moč nebo krev a o nemoci informujte svého lékaře.
5. Jak přípravek Humalog 200 jednotek/ml KwikPen uchovávat
Přípravek uchovávejte mimo dohled a dosah dětí.
Přípravek Humalog 200 jednotek/ml KwikPen nepoužívejte po uplynutí doby použitelnosti vyznačené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Před prvním použitím uchovávejte přípravek Humalog 200 jednotek/ml KwikPen v chladničce při teplotě (2 °C - 8 °C). Chraňte před mrazem.
Používané pero Humalog 200 jednotek/ml KwikPen uchovávejte při pokojové teplotě (15 °C - 30 °C) a po 28 dnech jej znehodnoťte. Nevystavujte jej nadměrnému teplu nebo přímému slunečnímu svitu. Používané pero KwikPen neuchovávejte v chladničce (chraňte před chladem). Pero KwikPen nesmí být uchováváno s nasazenou jehlou.
Nepoužívejte Humalog 200 jednotek/ml KwikPen, pokud je roztok zabarvený nebo pokud jsou v něm viditelné pevné částice. Použijte ho, pouze pokud vypadá jako voda. Vzhled přípravku zkontrolujte před každou aplikací injekce.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Humalog KwikPen 200 jednotek/ml, injekční roztok obsahuje
- Léčivou látkou je inzulin lispro. Jeden ml roztoku obsahuje 200 jednotek (IU) inzulínu lispro. Jedno předplněné pero (3 ml) obsahuje 600 jednotek (IU) inzulínu lispro.
- Pomocnými látkami přípravku Humalog 200 jednotek/ml KwikPen jsou metakresol, glycerol, trometamol, oxid zinečnatý a voda na injekci. K úpravě kyselosti roztoku mohl být použit hydroxid sodný nebo kyselina chlorovodíková.
Jak přípravek Humalog 200 jednotek/ml KwikPen vypadá a co obsahuje toto balení
Přípravek Humalog 200 jednotek/ml KwikPen, injekční roztok je sterilní, čirý, bezbarvý vodný roztok a obsahuje 200 mezinárodních jednotek inzulinu lispro v jednom mililitru (200 jednotek/ml). Jedno pero Humalog 200 jednotek/ml KwikPen obsahuje 600 jednotek (3 mililitry). Humalog 200 jednotek/ml KwikPen je balen po 1, 2 nebo 5 předplněných perech nebo v multipaku po 2x5 předplněných perech. Na trhu nemusí být všechny velikosti balení. V předplněném peru KwikPen je zásobní vložka zabudována. Předplněné pero nelze po vyprázdnění znovu použít.
Držitel rozhodnutí o registraci
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko.
Výrobce
Lilly France S.A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francie.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Lietuva
Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600
Luxembourg/Luxemburg
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Magyarország
Lilly Hungária Kft.
Tel: + 36 1 328 5100
Malta
Charles de Giorgio Ltd.
Tel: + 356 25600 500
Nederland
Eli Lilly Nederland B.V.
Tel: + 31-(0) 30 60 25 800 Norge
Eli Lilly Norge A.S.
Tlf: + 47 22 88 18 00
Osterreich
Eli Lilly Ges. m.b.H.
Tel: + 43-(0) 1 711 780
Belgique/Belgie/Belgien
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Bt^rapnn
Tn "Enu Hunu HegepnaHg" E.B. - Etnrapua Ten. + 359 2 491 41 40
Česká republika ELI LILLY ČR, s.r.o.
Tel: + 420 234 664 111
Danmark
Eli Lilly Danmark A/S Tlf: +45 45 26 6000
Deutschland
Lilly Deutschland GmbH Tel. + 49-(0) 6172 273 2222
Eesti
Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6817 280
EkXába
OAPMAIEPB-AIAAY A.E.B.E. T^: +30 210 629 4600
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France S.A.S. Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal - Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) 1 580 00 10 |
|
Island Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
|
Kúnpoq Phadisco Ltd TpL +357 22 715000 |
Sverige Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800 |
|
Latvija Eli Lilly Holdings Limited parstavnieciba Latvija Tel: +371 67364000 |
United Kingdom Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000 |
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/.
NÁVOD K OBSLUZE
Humalog 200 jednotek/ml injekční roztok v předplněném peru
Insulinům lisprum

PŘED POUŽITÍM SI PROSÍM PŘEČTĚTE TENTO NÁVOD
A POUŽÍVEJTE POUZE V TOMTO PERU, JINAK MŮŽE DOJÍT K ZÁVAŽNÉMU PŘEDÁVKOVM
Před použitím přípravku Humalog 200 jednotek/ml KwikPen injekční roztok si pečlivě přečtěte návod k obsluze a přečtěte si jej pokaždé, když dostanete další přípravek Humalog 200 jednotek/ml KwikPen. Může obsahovat nové informace. Tyto informace nenahrazují konzultaci s Vaším lékařem o Vašem zdravotním stavu nebo Vaší léčbě.
Humalog® 200 jednotek/ml KwikPen (“pero”) je jednorázové předplněné pero obsahující 3 ml (600 jednotek, 200 jednotek/ml) injekčního roztoku inzulinu lispro. Jedním perem si můžete podat více dávek. Dávka na peru se nastavuje po jedné jednotce. V jedné injekci můžete aplikovat dávku od 1 do 60 jednotek. Je-li Vaše dávka vyšší než 60 jednotek, budete si potřebovat podat víc než jednu injekci. Při podání injekce se píst pohybuje jen velmi málo a vy jeho pohyb nemusíte zaznamenat. Píst se dostane na konec zásobní vložky pouze v případě, že využíváte všech 600 jednotek v peru.
Toto pero je konstruováno tak, že Vám umožní podat si více dávek než jiná pera, která jste možná v minulosti používal(a). Nastavte si svoji obvyklou dávku tak, jak Vás instruoval Váš lékař.
Humalog KwikPen je dostupné ve dvou silách, 100 jednotek/ml and 200 jednotek/ml. Aplikujte si Humalog 200 jednotek/ml POUZE svým perem. NEPŘENÁŠEJTE inzulin ze svého pera do jiné inzulinové aplikační pomůcky. Injekční stříkačky a inzulinové pumpy nebudou dávkovat inzulin 200 jednotek/ml správně. Může dojít k závažnému předávkování, které zapříčiní velmi nízké hladiny cukru v krvi, které mohou ohrozit Váš život.
Své pero nesdílejte s jinými osobami ani v případě, že jste vyměnil(a) jehlu. Jehly nepoužívejte opakovaně ani je nesdílejte s jinými osobami. Mohl(a) byste na ně přenést infekci nebo od nich infekci dostat.
Pero není určeno osobám nevidomým nebo osobám s poškozeným zrakem, pokud jim nemůže pomoci osoba, která je s obsluhou pera seznámena.
Části pera KwikPen
Kryt pera
Držák zásobní vložky Štítek
Ukazatel dávky

Části jehly
(Jehly nejsou součástí balení) Jehla
Dávkovací tlačítko s vínově červeným kroužkem


Jak rozlišíte Vaše pero Humalog 200 jednotek/ml KwikPen:
- Barva pera: Tmavě šedá
- Dávkovací tlačítko: Tmavě šedé s koncovým vínově červeným kroužkem
- Štítek: Vínově červený, “200 jednotek/ml” ve žlutém poli.
Žluté varování na držáku zásobní vložky
K podání injekce potřebujete:
• Humalog 200 jednotek/ml KwikPen
• Jehlu kompatibilní s perem KwikPen (doporučeny jsou jehly BD [Becton, Dickinson and Company])
• Tampon s dezinfekcí
Jehly a tampon s dezinfekcí nejsou součástí balení.
Příprava pera
• Umyjte si ruce mýdlem a vodou.
• Zkontrolujte štítek pera a přesvědčte se, že používáte správný typ inzulínu. Je to zvlášť důležité, používáte-li víc než 1 typ inzulinu.
• Nepoužívejte pero, pokud již uplynula doba jeho použitelnosti uvedená na štítku pera nebo pokud uplynulo vice než 28 dní od jeho prvního použití.
• Pro každou injekci použijte novou jehlu. Tím pomůžete předejít infekcím a případnému ucpání jehel.
Krok 1:
Přímým tahem odstraňte kryt pera.
• Neodstraňujte z pera štítek.
Tamponem s dezinfekcí otřete pryžový uzávěr.
Přípravek Humalog 200 jednotek/ml injekční roztok by měl být čirý a bezbarvý. Nepoužívejte jej, jestliže je zakalený, zbarvený nebo obsahuje částice nebo shluky.


POUŽÍVEJTE POUZE V TOMTO PERU, JINAK MŮŽE DOJÍT K ZÁVAŽNÉMU PŘEDÁVKOVÁNÍ
Krok 2:
Vezměte novou jehlu.
Z vnějšího krytu jehly odstraňte papírovou fólii.

Krok 3:
Nasaďte jehlu s vnějším krytem přímo na pero a jehlu našroubujte do dotažení.
Krok 4:
Odstraňte vnější kryt jehly. Nevyhazujte jej. Odstraňte vnitřní kryt jehly a vyhoďte jej.
r

Ponechte
V_
Vyhoďte
..V
Prostříknutí pera
Pero prostříkněte před každou injekcí.
• Prostříknutí pera odstraní vzduch z jehly a ze zásobní vložky , který se tam mohl nahromadit v
průběhu normálního používání a zajistí správné fungování pera.
• Pokud neprostříknete pero před každou injekcí, můžete si aplikovat příliš velkou nebo příliš
malou dávku inzulinu.
Krok 5:
K prostříknutí pera nastavte otáčením dávkovacího tlačítka 2 jednotky.

Krok 6:
Otočte pero jehlou nahoru. Poklepávejte jemně na držák zásobní vložky tak, aby se vzduch shromáždil nahoře.

Krok 7:
S jehlou směrem nahoru stiskněte dávkovací tlačítko nadoraz, až se v dávkovacím okénku objeví „0”. Držte dávkovací tlačítko stlačené a pomalu počítejte do 5.
• Na špičce jehly byste měl(a) vidět inzulin.
- Pokud nevidíte inzulin, opakujte kroky prostříknutí, ale ne víc než 8 krát.
- Pokud stále nevidíte inzulin, vyměňte jehlu a opakujte kroky prostříknutí.
Malé vzduchové bublinky jsou normální a neovlivní velikost Vaší dávky.


Nastavení dávky
Toto pero bylo zkonstruováno tak, aby se podávaná dávka ukazovala v dávkovacím okénku. Nastavte si svoji obvyklou dávku tak, jak Vás instruoval Váš lékař.
• V jedné injekci můžete aplikovat dávku od 1 do 60 jednotek.
• Potřebujete-li dávku vyšší než je 60 jednotek, budete si muset podat více než jednu injekci.
- Potřebujete-li pomoc s rozhodnutím, jak svou dávku rozdělit, zeptejte se svého lékaře.
- Pro každou injekci použijte novou jehlu a zopakujte prostříknutí pera.
Krok 8:
Nastavte požadovanou dávku otáčením dávkovacího tlačítka. Ukazatel dávky by měl zobrazovat Vaši dávku.
• Dávka na peru se nastavuje po jedné jednotce.
• Při otáčení dávkovací tlačítko slyšitelně kliká.
• NENASTAVUJTE si velikost dávky počítáním kliků, mohl(a) byste si nastavit špatnou dávku.
• Dávka může být opravena otáčením dávkovacího tlačítka oběma směry, dokud není nastavena správná dávka, která se zobrazí na ukazateli dávky.
• Sudé hodnoty j sou na číselníku natištěny.
• Liché hodnoty jsou po čísle 1 zobrazeny jako celé čáry.
Číslici v dávkovacím okénku vždy zkontrolujte, abyste se ujistil(a), že jste si nastavil(a) správnou dávku.


(Příklad: v dávkovacím okénku je 12 jednotek)

(Příklad: v dávkovacím okénku je 25 jednotek)
• Pero neumožňuje nastavení větší dávky, než je zbývající počet jednotek v peru.
• Potřebujete-li si podat dávku vyšší, než je zbývající počet jednotek v peru, můžete buď:
- podat si množství, které ve Vašem peru zbývá, a pro podání zbývající dávky použít nové pero, nebo
- použít nové pero na podání celé dávky.
Podání dávky
• Injekci inzulínu podejte tak, jak Vám to ukázal Váš lékař.
• S každou injekcí měňte (rotujte) místo vpichu, kam injekci podáváte.
• Nepokoušejte se o úpravu dávky v průběhu jejího podání.
Krok 9:
Vyberte místo vpichu.
Přípravek Humalog 200 jednotek/ml injekční roztok se podává v injekci pod kůži (subkutánně) do oblasti břicha, hýždí, stehen nebo horní části paží.
Před aplikací injekce si otřete kůži tamponem s dezinfekcí a než si podáte injekci nechte kůži oschnout.

Krok 10:
Vpíchněte jehlu do kůže.
Stiskněte dávkovací tlačítko a dokud se pohybuje, tiskněte jej.
Dávkovací tlačítko držte stále zmáčknuté a pomalu napočítejte do
5, teprve pak jehlu vytáhněte.

Nesnažte se podat si inzulin otáčením dávkovacího tlačítka. K podání inzulinu otáčením dávkovacího
tlačítka NEDOJDE. Krok 11:
Vytáhněte jehlu z kůže.
• Kapka inzulinu na špičce j ehly j e normální. Velikost Vaší dávky neovlivní.
• Zkontrolujte číslici v dávkovacím okénku.Vidíte-li v dávkovacím okénku „0”, podal(a) jste si celou dávku, kterou jste si nastavil(a).
• Pokud v dávkovacím okénku číslici „0” nevidíte, nenastavujte novou dávku. Vpíchněte jehlu do kůže a dokončete injekci.
• Pokud se stále domníváte, že jste si nepodal(a) celou dávku, kterou jste pro injekci nastavil(a), nezačínejte znovu ani tuto injekci neopakujte. Sledujte svou hladinu cukru tak, jak Vás instruoval Váš lékař.


Při podání injekce se píst pohybuje jen velmi málo a vy jeho pohyb nemusíte zaznamenat.
Objeví-li se na kůži po vytažení jehly krev, jemně stlačte místo vpichu kouskem gázy nebo tamponem s dezinfekcí. Místo netřete.
Po podání injekce
Krok 12:
Opatrně vraťte na jehlu vnější kryt jehly.

Krok 13:
Jehlu s nasazeným krytem odstraňte odšroubováním a znehodnoťte ji podle pokynů níže (viz bod Likvidace per a jehel).
Neuchovávejte pero s nasazenou jehlou, předejdete tím vytékání, ucpání jehly a vnikání vzduchu do pera.

Krok 14:
Sponu krytu s ukazatelem dávky natočte do zákrytu a přímým zatlačením nasaďte zpět kryt pera.

Likvidace per a jehel
• Použité jehly vyhoďte do nádoby na ostré předměty nebo do nádoby z tvrdého plastu s bezpečnostním víčkem. Jehly nevyhazujte přímo do domovního odpadu.
• Použité pero můžete po odstranění jehly vyhodit do domovního odpadu.
• Nádobu na j ehly nerecyklujte.
• Zeptejte se svého lékaře nebo lékárníka na možnosti správné likvidace nádoby s jehlami.
• Pokyny pro zacházení s jehlami nemají nahrazovat místní, zdravotnické nebo institucionální předpisy.
Uchovávání pera Nepoužívaná pera
• Nepoužitá pera uchovávejte v chladničce od 2 °C do 8 °C.
• Chraňte přípravek Humalog 200 jednotek/ml injekční roztok před mrazem. Pokud došlo k jeho zmrznutí, nepoužívejte jej.
• Nepoužitá pera můžete použít do data použitelnosti, uvedeného na obalu, pokud bylo pero uchováváno v chladničce.
Používané pero
• Pero, které právě používáte, uchovávejte při pokojové teplotě (do 30 °C) mimo přímé teplo a světlo.
• Po 28 dnech používané pero zlikvidujte, a to i v případě, že je v něm ještě inzulin.
Obecné informace o bezpečném a účinném používání Vašeho pera
• Uchovávejte pero a jehly mimo dohled a dosah dětí.
• Pero nepoužívejte, vypadá-li pero nebo některá jeho část rozbitá či zničená.
• Vždy při sobě noste náhradní pero pro případ ztráty nebo poruchy Vašeho pera.
Řešení problémů
• Nemůžete-li sundat z pera kryt, jemně krytem pera otáčejte tam a zpět a pak kryt sundejte přímým tahem.
• Jde-li dávkovací tlačítko stlačit těžce;
- Pomalejší stlačování dávkovacího tlačítka injekci usnadní.
- Jehla může být ucpaná. Nasaďte novou jehlu a pero prostříkněte.
- Do vnitřku pera se mohl dostat prach, jídlo nebo kapalina. Pero zlikvidujte a vezměte si pero nové.
• Nepřenášejte inzulin z pera do injekční stříkačky nebo do inzulínové pumpy. Může dojít k závažnému předávkování.
Máte-li nějaké otázky nebo problémy s přípravkem Humalog 200 jednotek/ml KwikPen, pro pomoc kontaktujte svého lékaře nebo místní zastoupení společnosti Lilly.
Datum revize textu:
272