Hemangiol 3,75 Mg/Ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
HEMANGIOL 3,75 mg/ml, perorální roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 ml roztoku obsahuje propranololi hydrochloridum 4,28 mg, což odpovídá 3,75 mg propranololové báze. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Perorální roztok
Čirý, bezbarvý až světle žlutý perorální roztok s ovocnou vůní.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek HEMANGIOL je indikován k léčbě proliferujícího infantilního hemangiomu vyžadujícího systémovou terapii:
• hemangiomu ohrožujícího život nebo funkčnost,
• exulcerovaného hemangiomu s bolestivostí a/nebo nereagujícího na jednoduchá opatření k ošetření ran,
• hemangiomu s rizikem trvalých jizev nebo znetvoření.
Léčbu je nutno zahájit u kojenců od 5 týdnů do 5 měsíců věku (viz bod 4.2).
4.2 Dávkování a způsob podání
Léčbu přípravkem HEMANGIOL mají zavádět lékaři, kteří mají zkušenost s diagnostikováním, léčbou a sledováním infantilního hemangiomu, v kontrolovaném klinickém prostředí, kde jsou k dispozici adekvátní prostředky k řešení nežádoucích účinků, včetně situací vyžadujících naléhavá opatření.
Dávkování
Dávkování je vyjádřeno v propranololové bázi.
Doporučená zahajovací dávka je 1 mg/kg/den, rozdělená do dvou samostatných dávek po 0,5 mg/kg. Doporučuje se zvyšovat dávku až na terapeutickou dávku pod lékařským dohledem takto: 1 mg/kg/den po dobu 1 týdne, poté 2 mg/kg/den po dobu 1 týdne a posléze 3 mg/kg/den jako udržovací dávku.
Terapeutická dávka je 3 mg/kg/den, podávaná ve dvou samostatných dávkách po 1,5 mg/kg, jedné ráno a jedné pozdě odpoledne, s časovým intervalem nejméně 9 hodin mězi dvěma podáními. Léčivý přípravek je nutno podat během nebo bezprostředně po krmení.
Pokud dítě nejí nebo zvrací, doporučuje se dávku vynechat.
Pokud dítě dávku vyplivne nebo nepožije všechen lék, nemá být podána před následující plánovanou dávkou žádná další dávka.
Během titrační fáze musí každé zvýšení dávky řídit a sledovat lékař za stejných podmínek jako při podávání úvodní dávky. Po titrační fázi bude lékař dávku upravovat podle změn tělesné hmotnosti dítěte.
Klinické monitorování stavu dítěte a úpravu dávky je nutno provádět nejméně jednou měsíčně.
Délka trvání léčby:
Přípravek HEMANGIOL je nutno podávat po dobu 6 měsíců.
Ukončení léčby nevyžaduje postupné snižování dávky.
U menší části pacientů, u nichž se po ukončení léčby znovu objeví symptomy, lze znovu zahájit léčbu za stejných podmínek s uspokojivou odezvou.
Zvláštní skupiny pacientů
V důsledku absence údajů o klinické účinnosti a bezpečnosti nesmí být přípravek HEMANGIOL podáván dětem mladším 5 týdnů.
Údaje o klinické účinnosti a bezpečnosti zjištěné z klinických hodnocení přípravku HEMANGIOL, které jsou nutné k tomu, aby bylo možno doporučit zahájení jeho podávání dětem starším 5 měsíců, nejsou k dispozici.
Kojenci s poruchou fúnkce jater nebo ledvin
Jelikož nejsou k dispozici údaje, nedoporučuje se podávat přípravek kojencům s poruchou funkce jater nebo ledvin (viz bod 4.4).
Způsob podání Perorální podání
Přípravek HEMANGIOL musí být podáván během krmení nebo bezprostředně po krmení, aby se zabránilo riziku vzniku hypoglykémie. Musí být podáván přímo do úst dítěte pomocí stříkačky pro perorální podání se stupnicí, kalibrovanou na mg propranololové báze, dodávanou spolu s lahvičkou perorálního roztoku (viz návod k použití v bodu 3 příbalové informace pro pacienty).
Lahvičku před podáváním neprotřepávejte.
Je-li to nezbytné, lze léčivý přípravek rozpustit v malém množství kojeneckého mléka nebo jablečné a/nebo pomerančové šťávy podle věku dítěte. Nedávejte léčivý přípravek do plné láhve.
Léčivý přípravek lze smíchat s jednou čajovou lžičkou (cca 5 ml) mléka určeného pro děti s tělesnou hmotností do 5 kg nebo s jednou polévkovou lžící (cca 15 ml) mléka nebo ovocné šťávy pro děti s tělesnou hmotností nad 5 kg a podat v kojenecké láhvi. Směs se musí podat do 2 hodin.
Přípravek HEMANGIOL a krmení musí podávat stejná osoba, aby se zabránilo riziku hypoglykémie. Pokud je zapojeno více osob, dobrá komunikace je zásadní pro zajištění bezpečnosti dítěte.
4.3 Kontraindikace
• Předčasně narozené děti, které nedosáhly korigovaného věku 5 týdnů (korigovaný věk se vypočte odečtením počtu týdnů prematurity od skutečného věku)
• Kojené děti, pokud je matka léčena léčivými přípravky kontraindikovanými pro propranolol
• Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
• Astma nebo bronchospasmus v anamnéze
• Atrioventrikulární blok druhého nebo třetího stupně
• Onemocnění sinusového uzlu (včetně sinoatriální blokády)
|
Věk |
0-3 měsíce |
3-6 měsíců |
6-12 měsíců |
|
Srdeční tep (údery/min) |
100 |
90 |
80 |
• Bradykardie nižší než tyto hodnoty:___
• Krevní tlak nižší než tyto hodnoty:
|
Věk |
0-3 měsíce |
3-6 měsíců |
6-12 měsíců |
|
Krevní tlak (mm/Hg) |
65/45 |
70/50 |
80/55 |
• Kardiogenní šok
• Selhání srdce, které není zvládnuto medikací
• Prinzmetalova angína
• Závažné poruchy periferní arteriální cirkulace (Raynaudův fenomén)
• Kojenci náchylní k hypoglykémii
• Feochromocytom
4.4 Zvláštní upozornění a opatření pro použití
Zahájení léčby
Před zahájením léčby propranololem je nutno provést screening rizik souvisejících s užíváním propranololu. Je nutno analyzovat anamnézu a provést komplexní klinické vyšetření, včetně vyšetření srdeční frekvence a auskultace srdce a plic.
V případě podezření na srdeční abnormalitu je nutno vyhledat před zahájením léčby poradu odborného lékaře k určení veškerých skrytých kontraindikací.
V případě akutní bronchopulmonální abnormality je nutno zahájení léčby odložit.
Kardiovaskulární poruchy
Propranolol může v důsledku svého farmakologického účinku způsobovat nebo zhoršovat bradykardii nebo abnormality krevního tlaku. Bradykardie musí být diagnostikována při zpomalení srdečního tepu o více než 30 tepů za minutu v porovnání s výchozí hodnotou. Bradykardie je definována jako srdeční frekvence nižší než tyto hodnoty:
|
Věk |
0 - 3 měsíce |
3 - 6 měsíců |
6 - 12 měsíců |
|
Srdeční frekvence (počet tepů/min) |
100 |
90 |
80 |
Po prvním podání a po každém zvýšení dávky je nutno provádět nejméně každou hodinu alespoň po dobu 2 hodin kontrolu klinického stavu, včetně měření krevního tlaku a srdeční frekvence. V případě symptomatické bradykardie nebo bradykardie nižší než 80 tepů za minutu je nutno okamžitě vyhledat poradu odborného lékaře.
Pokud se během léčby objeví závažná a/nebo symptomatická bradykardie nebo hypotenze, je nutno léčbu přerušit a vyhledat poradu odborného lékaře.
Hypoglykémie
Propranolol zabraňuje odpovědi endogenních katecholaminů na hypoglykémii. Maskuje adrenergní varovné příznaky hypoglykémie, zejména tachykardii, třes, úzkost a hlad. Může zhoršit hypoglykémii u dětí, zejména v případě vynechání jídla, zvracení nebo předávkování.
Epizody hypoglykemie spojené s užíváním propranololu se mohou ve výjimečných případech projevit jako záchvaty křečí a/nebo kóma.
Pokud se objeví klinické příznaky hypoglykémie, je nutno dát dítěti pít cukrový roztok a dočasně zastavit léčbu. Dítě je nutno náležitě monitorovat, dokud symptomy nezmizí.
U dětí s diabetem je nutno zvýšit monitorování glukózy v krvi.
Respirační poruchy
V případě infekce dolních cest dýchacích provázené dušností a sípáním je nutno léčbu dočasně přerušit. Lze podávat beta-2-agonisty a inhalační kortikosteroidy. O opětovném podávání propranololu lze uvažovat, až se dítě plně uzdraví, v případě opakování je nutno léčbu trvale ukončit.
V případě izolovaného bronchospasmu je nezbytné léčbu trvale ukončit.
Srdeční selhání:
Stimulace sympatiku může být nepostradatelnou součástí léčby podporující cirkulační funkce u pacientů s kongestivním srdečním selháním a její inhibice beta-blokádou může přivodit závažnější selhání.
Syndrom PHACE
Jsou k dispozici jen velmi omezené údaje o bezpečnosti propranololu u pacientů se syndromem PHACE. Propranolol může zvýšit riziko cévní mozkové příhody u pacientů se syndromem PHACE se závažnými cerebrovaskulárními anomáliemi, k níž dojde poklesem krevního tlaku a snížením průtoku okludovanými, úzkými nebo stenotickými cévami.
Kojenci s rozsáhlým obličejovým infantilním hemangiomem musí být důkladně vyšetřeni z hlediska potenciální arteriopatie související se syndromem PHACE, a to pomocí magneticko-rezonanční angiografie hlavy a krku a zobrazení srdce včetně aortálního oblouku před zahájením léčby propanololem.
Je nutné vyhledat odbornou konzultaci.
Kojení:
Propranolol prochází do mateřského mléka. Matky léčené propranololem, které kojí své děti, musí informovat svého ošetřujícího lékaře.
Selhání jater nebo ledvin
Propranolol je metabolizován v játrech a vylučován ledvinami. Vzhledem k tomu, že nejsou k dispozici údaje při užití u dětí z této skupiny, není propranolol doporučován při poruše funkce ledvin nebo jater (viz bod 4.2).
Hypersenzitivita
U pacientů s pravděpodobností závažné anafylaktické reakce bez ohledu na její původ, zejména na jódované kontrastní látky, může léčba beta-blokátory vést ke zhoršení reakce a k rezistenci na její léčbu obvyklými dávkami adrenalinu.
Celková anestézie
Beta-blokátory budou mít za následek oslabení reflexní tachykardie a zvýšení rizika hypotenze. Anesteziologa je nutno upozornit na fakt, že pacient je léčen beta-blokátory.
Je-li u pacienta plánován chirurgický zákrok, musí být léčba beta-blokátory přerušena alespoň 48 hodin před zákrokem.
Hyperkalémie
U pacientů s rozsáhlým exulcerovaným hemangiomem byly hlášeny případy hyperkalémie. U těchto pacientů je nutno monitorovat elektrolyty.
Psoriáza
U pacientů trpících psoriázou bylo hlášeno zhoršení onemocnění při léčbě beta-blokátory. Proto je nutno pečlivě zvážit potřebu léčby.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Jelikož neexistují specifické studie u dětí, jsou interakce s jinými léčivými přípravky známy pouze u dospělých. V případě kombinací je nutno zvažovat dvě následující situace (které se navzájem nevylučují):
• kojenci, kterým je podáván jakýkoli jiný léčivý přípravek, zejména ty, které jsou uvedeny dále
• kojenci kojení matkami, které užívají jakýkoli jiný léčivý přípravek, zejména ty, které jsou uvedeny dále. V takovém případě je nutno prodiskutovat potřebu zastavit kojení.
Jakákoli zhoršená tolerance propranololu vyžaduje pečlivý klinický dohled.
Současné užívání se nedoporučuje
Blokátorv kalciových kanálů vyvolávající bradvkardii (diltiazem, verapamil, bepridil)
Společné podávání s propranololem může způsobit poruchu srdeční automacie (excesivní bradykardii, sinusovou zástavu), poruchy sinoatriálního a atrioventrikulárního vedení a zvýšené riziko ventrikulárních arytmií (torsades de pointes) společně se selháním srdce.
Tuto kombinaci lze podávat pouze pod pečlivým klinickým a EKG dohledem, zejména při zahájení léčby. Interakce vyžadující obezřetnost Kardiovaskulární léčivé přípravky
Antiarvtmika
• Propafenon má negativní inotropní a beta-blokující vlastnosti, které mohou působit aditivně k vlastnostem propranololu navzdory potvrzující studii prováděné na zdravých dobrovolnících.
• Metabolismus propranololu je tlumen současným podáváním chinidinu, které vede k dvoj - až trojnásobnému zvýšení koncentrace v krvi a k vyšším stupňům klinické beta-blokády.
• Amiodaron je antiarytmický přípravek s negativně chronotropními vlastnostmi, které mohou působit aditivně k vlastnostem pozorovaným u P-blokátorů, jako je propranolol. V důsledku potlačení sympatického kompenzačního mechanismu lze očekávat poruchy srdeční automacie a vedení vzruchu.
• Metabolismus intravenózně podaného lidokainu je tlumen současným podáváním propranololu, což má za následek 25% zvýšení koncentrace lidokainu. Po současném podání propranololu byla hlášena toxicita lidokainu (neurologické a srdeční nežádoucí příhody).
Digitalisové glykosidy
Digitalisové glykosidy i beta-blokátory zpomalují atrioventrikulární vedení vzruchu a zpomalují srdeční frekvenci. Současné užívání může zvyšovat riziko bradykardie.
Dihydropyridiny
Je nutno postupovat obezřetně v případě, kdy je pacientům užívajícím beta-blokátory podáván dihydropyridin. Oba přípravky mohou vyvolat v důsledku aditivních inotropních účinků hypotenzi a/nebo selhání srdce u pacientů, jejichž srdeční funkce je částečně kontrolována. Současné užívání při nadměrné distální vasodilataci může snížit reflexní odezvu sympatiku.
Antihypertenziva (inhibitory ACE, antagonisté receptorů angiotensinu II, diuretika, alfa-blokátory bez ohledu na indikaci, centrálně působící antihypertenziva, reserpin apod.)
Léky snižující arteriální tlak podávané v kombinaci s beta-blokátory mohou způsobovat nebo zvyšovat hypotenzi, zvláště ortostatickou. Co se týče centrálně působících antihypertenziv, mohou beta-blokátory zhoršovat rebound hypertenzi po náhlém vysazení klonidinu. Léčbu propranololem je nutno zastavit několik dní před vysazením klonidinu.
Nekardiovaskulární léčivé přípravky
Kortikosteroidy
Pacienti s infantilním hemangiomem mohou být vystaveni zvýšenému riziku, pokud byli nebo pokud jsou současně léčeni kortikosteroidy, protože adrenální suprese může způsobit ztrátu protiregulační odpovědi kortizolu a zvýšit riziko hypoglykémie. To platí také u dětí kojených matkami léčenými vysokými dávkami nebo dlouhodobě kortikosteroidy.
Nesteroidní protizánětlivá léčiva
Bylo hlášeno, že nesteroidní protizánětlivá léčiva (NSAIDs) tlumí antihypertenzní účinek beta-blokátorů.
Léky vyvolávající ortostatickou hypotenzi
Léky, které vyvolávají ortostatickou hypotenzi (deriváty nitrátů, inhibitory fosfodiesterázy typu 5, tricyklická antidepresiva, antipsychotika, dopaminergní agonisté, levodopa, amifostin, baklofen...) mohou mít aditivní účinky k účinkům beta-blokátorů.
Induktory enzymů
Společné podávání propranololu s induktory enzymů, například s rifampicinem nebo fenobarbitalem, může snižovat krevní hladiny propranololu.
Antidiabetika
Všechny beta-blokátory mohou maskovat některé symptomy hypoglykémie: palpitace a tachykardii.
Užívání propranololu spolu s antidiabetiky u pacientů s diabetem vyžaduje obezřetnost, protože může prodlužovat odpověď na inzulín. V takovém případě informujte ošetřujícího lékaře a zvyšte sledování hladin krevního cukru, zejména při zahájení léčby.
Hypolipidemika
Současné podávání cholestyraminu nebo kolestipolu s propranololem vedlo až k 50% poklesu koncentrací propranololu.
Halogenovaná anestetika
Mohou při užívání s propranololem snižovat kontraktilitu myokardu a vaskulární kompenzaci. Beta-mimetika mohou být používána jako látky působící proti beta-blokádě.
4.6 Fertilita, těhotenství a kojení
Těhotenství:
Není relevantní.
Kojení:
Kojící matky: viz bod 4.4 a bod 4.5.
Fertilita:
I když byly publikovány určité reverzibilní účinky na samčí a samičí fertilitu u dospělých potkanů, jimž byly podávány vysoké dávky propranololu, studie provedená na juvenilních zvířatech neprokázala žádný vliv na fertilitu (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Není relevantní.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nejčastěji hlášené nežádoucí účinky z klinických hodnocení proliferujícího infantilního hemangiomu u kojenců léčených přípravkem HEMANGIOL byly poruchy spánku, zhoršení infekcí dýchacího ústrojí, jako je bronchitis a bronchiolitis spojená s kašlem a horečkou, průjem a zvracení.
Nežádoucí účinky hlášené celosvětově v rámci programu „compassionate use“ a v literatuře se týkaly hypoglykémie (a souvisejících příhod, jako je hypoglykemický záchvat) a zhoršení infekcí dýchacího ústrojí s dechovou tísní.
Přehled nežádoucích účinků v tabulce
Následující tabulka uvádí nežádoucí účinky hlášené bez ohledu na velikost dávky a délku léčby, jež se projevily ve třech klinických studiích se 435 pacienty léčenými přípravkem HEMANGIOL v dávce 1 mg/kg/den nebo 3 mg/kg/den po dobu nejdéle 6 měsíců.
Četnost je stanovena podle následující konvence: velmi časté (> 1/10), časté (> 1/100 až < 1/10); méně časté (> 1/1 000 až < 1/100); vzácné (> 1/10 000 až < 1/1000); velmi vzácné (< 1/10 000); není známo (z dostupných údajů nelze určit). S ohledem na velikost databáze klinického hodnocení nejsou zastoupené kategorie „vzácné“ a „velmi vzácné“.
V každé třídě orgánových systémů jsou nežádoucí účinky uvedeny v pořadí podle snižující se závažnosti.
Velmi časté Časté Méně časté Není známo
|
Infekce a infestace |
Bronchitis |
Bronchiolitis | |
|
Poruchy metabolismu a výživy |
Snížená chuť k jídlu | ||
|
Psychiatrické poruchy |
Poruchy spánku |
Neklid, noční můry Iritabilita | |
|
Poruchy nervového systému |
Spavost |
Záchvaty křečí při hypoglykémii | |
|
Srdeční poruchy |
AV blokáda |
Bradykardie | |
|
Cévní poruchy |
Chlad periferních částí těla |
Vazokonstrikce Raynaudův fenomén | |
|
Respirační, |
Bronchospasmus |
hrudní a
mediastinální
poruchy
|
Gastrointestinální |
Zácpa | ||
|
poruchy |
Bolesti břicha | ||
|
Poruchy kůže a |
Erytém |
Urtikárie | |
|
podkožní tkáně |
Alopecie |
|
Velmi časté |
Časté |
Méně časté |
Není známo | |
|
Vyšetření |
Snížený krevní tlak |
Snížená hladina glukózy v krvi Pokles srdeční frekvence Neutropenie |
Agranulocytóza Hyperkalémie |
Popis vybraných nežádoucích účinků
Co se týče infekcí dolních cest dýchacích, jako je bronchitis nebo bronchiolitis, bylo u pacientů léčených přípravkem HEMANGIOL pozorováno zhoršení symptomů (včetně bronchospasmu) následkem bronchokonstrikčního účinku propranololu. Tyto účinky jen vzácně vedly k definitivnímu ukončení léčby (viz bod 4.4).
Poruchy spánku odpovídaly nespavosti, špatné kvalitě spánku a hypersomnii. Ostatní poruchy centrálního nervového systému byly pozorovány hlavně v časných fázích léčby.
Průjem byl hlášen často a nebyl vždy spojován s infekčním gastrointestinálním onemocněním. Zdá se, že výskyt průjmu závisí na dávce mezi 1 až 3 mg/kg/den. Žádný z hlášených případů neměl závažnou intenzitu a nevedl k ukončení léčby.
Kardiovaskulární příhody hlášené během klinických studií byly asymptomatické. Během čtyřhodinového kardiovaskulárního monitorování v titračních dnech bylo po podání léčivé látky pozorováno zpomalení srdeční frekvence (o cca 7 tepů za minutu) a pokles systolického krevního tlaku (o méně než 3 mmHg).
Jeden případ atrioventrikulární srdeční blokády druhého stupně u pacienta s preexistující poruchou vedení vzruchu vedl k definitivnímu ukončení léčby. V literatuře byly publikovány izolované případy symptomatické bradykardie a hypotenze.
Pokles krevního cukru pozorovaný v průběhu klinických studií byl asymptomatický. Několik případů hypoglykémie se souvisejícím hypoglykemickým záchvatem bylo však hlášeno během programu „compassionate use“ a publikováno v literatuře, zejména v případě vynechání jídla při současně probíhajícím onemocnění (viz bod 4.4).
Riziko hypoglykémie může zvýšit současná léčba systémovými kortikosteroidy (viz bod 4.5).
Hyperkalémie byla hlášena v literatuře u několika málo pacientů s rozsáhlým exulcerovaným hemangiomem (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Toxicita beta-blokátorů navazuje na jejich léčebné účinky:
• Srdeční symptomy lehké až středně těžké otravy představuje zpomalená srdeční frekvence a hypotenze. U závažnější otravy se mohou objevit atrioventrikulární blokády, opožďování intraventrikulárního vedení a kongestivní srdeční selhání.
• Bronchospasmus se může objevit zejména u pacientů s astmatem.
• Může se objevit hypoglykémie a její příznaky (třes, tachykardie) mohou být maskovány jinými klinickými účinky toxicity beta-blokátorů.
Propranolol je vysoce rozpustný v tucích a může procházet hematoencefalickou bariérou a způsobovat křeče. Podpůrná opatření a léčba:
Pacient musí být připojen k srdečnímu monitoru, je třeba sledovat vitální známky, duševní stav a hladinu glukózy v krvi. Je třeba podávat nitrožilně tekutiny k léčbě hypotenze a atropin při bradykardii. Pokud pacient náležitě nereaguje na nitrožilní tekutiny, je nutno zvážit podání glukagonu a poté katecholaminů. Bronchospasmus lze léčit isoproterenolem a aminofylinem.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: beta-blokátor, neselektivní, ATC kód: C07AA05 Mechanismus účinku
Potenciální mechanismus účinku propranololu na proliferující infantilní hemangiom popsaný v literatuře může zahrnovat různé mechanismy, které spolu úzce souvisí:
• lokální hemodynamický účinek (vazokonstrikce, která je klasickým důsledkem beta-adrenergní blokády a snížení perfuze lézí infantilního hemangiomu);
• antiangiogenní účinek (pokles proliferace vaskulárních endoteliálních buněk, snížení neovaskularizace a formování vaskulárních tubulů, snížení vylučování matrixové metaloproteinázy 9);
• účinek spouštějící apoptózu kapilárních endoteliálních buněk;
• omezení signální dráhy VEGF i bFGF a následně omezení angiogeneze/proliferace.
Farmakodynamické účinky
Propranolol je beta-blokátor charakterizovaný třemi farmakologickými vlastnostmi:
• absencí kardioselektivní beta-1-lytické aktivity,
• antiarytmickým účinkem,
• nepřítomností parciální agonistické aktivity (nebo vlastní sympatomimetické aktivity).
Klinická účinnost a bezpečnost týkající se pediatrické populace
Účinnost propranololu u kojenců (ve věku 5 týdnů až 5 měsíců při zahájení léčby) s proliferujícím infantilním hemangiomem vyžadujícím systémovou léčbu byla doložena ve fázi II/III pivotní randomizované, placebem kontrolované, multicentrické adaptivní studie s podáváním různých dávek s cílem porovnat čtyři režimy podávání propranololu (1 nebo 3 mg/kg/den po dobu 3 nebo 6 měsíců) s placebem (dvojitě zaslepená studie).
Léčba byla podávána 456 subjektům (401 z nich užívalo propranolol v dávce 1 nebo 3 mg/kg/den po dobu 3 nebo 6 měsíců; 55 z nich dostávalo placebo), včetně titrační fáze delší než 3 týdny. 70 % pacientů (71,3 % ženského pohlaví; 37 % ve věku 35-90 dní a 63 % ve věku 91-150 dní) mělo cílový hemangiom na hlavě a většina infantilních hemangiomů (89 %) byla lokalizována.
Úspěch léčby byl definován jako úplné nebo téměř úplné odléčení cílového hemangiomu, což bylo hodnoceno zaslepenými centralizovanými nezávislými posudky podle fotografií z 24. týdne při absenci předčasného ukončení léčby.
Režim podávání 3 mg/kg/den během 6 měsíců (zvolený na konci fáze II studie) dosáhl 60,4% úspěšnost v porovnání s 3,6% úspěšností placeba (hodnota p < 0,0001). U podskupin podle věku (35-90 dní/91-150 dní), pohlaví a umístění hemangiomu (hlava/tělo) nebyly identifikovány rozdíly v odpovědi na propranolol. Zlepšení hemangiomu bylo pozorováno po 5 týdnech léčby propranololem u 88 % pacientů.
11,4 % pacientů muselo být po přerušení léčby opětovně léčeno.
Z etických důvodů souvisejících s použitím placeba nebyl účinek demonstrován u pacientů s vysoce rizikovým hemangiomem. Doklady o účinnosti propranololu pacientů s vysoce rizikovým hemangiomem jsou k dispozici v literatuře i ve specifickém programu „compassionate use“ s použitím přípravku HEMANGIOL.
Retrospektivní studie ukázala, že menší část pacientů (12 %) vyžadovala opětovné zahájení systémové léčby. Při zahájení léčby byla u většiny pacientů pozorována uspokojivá odezva.
5.2 Farmakokinetické vlastnosti
Dospělí
Absorpce a distribuce
Propranolol je po perorálním podání téměř úplně absorbován. Prochází však extenzivním prvotním metabolismem v játrech a v průměru pouze 25 % propranololu se dostává do systémové cirkulace.
Maximální koncentrace v plazmě nastávají 1 až 4 hodiny po perorálním podání. Podávání potravin bohatých na bílkoviny zvyšuje biologickou dostupnost propranololu o zhruba 50 %, aniž by došlo ke změně času do dosažení maximální koncentrace.
Propranolol je substrátem pro intestinální efluxní transportér, P-glykoprotein (P-gp). Studie však naznačují, že P-gp neomezuje dávku pro intestinální absorpci propranololu v rámci obvyklého terapeutického rozpětí dávek.
Zhruba 90 % cirkulujícího propranololu je vázáno na plazmatické bílkoviny (albumin a kyselý alfa-1 glykoprotein). Distribuční objem propranololu činí zhruba 4 l/kg. Propranolol proniká hematoencefalickou bariérou a placentou a přechází do mateřského mléka.
Biotransformace a eliminace
Propranolol je metabolizován třemi primárními cestami: aromatická hydroxylace (hlavně 4-hydroxylace), N-dealkylace následovaná další oxidací vedlejšího řetězce a přímá glukuronidace. Procentní podíly těchto cest na celkovém metabolismu činí 42 %, 41 % a 17 % v uvedeném pořadí, avšak se značnou variabilitou u jednotlivých osob. Čtyři hlavní konečné metabolity jsou propranolol-glukuronid, kyselina naftyl-oxymléčná a kyselina glukuronová, sulfátové konjugáty 4-hydroxypropranololu. Studie in vitro naznačily, že do metabolismu propranololu jsou zapojeny CYP2D6 (aromatická hydroxylace), CYP1A2 (řetězová oxidace) a v menší míře CYP2C19.
U zdravých subjektů nebyl pozorován žádný rozdíl mezi silnými a slabými metabolizátory CYP2D6 stran perorální clearance nebo poločasu eliminace.
Plazmatický poločas propranololu je 3 až 6 hodin. Méně než 1 % dávky je vylučováno v podobě nezměněné látky močí.
Pediatrická _ populace
Farmakokinetika opakovaného podávání přípravku HEMANGIOL v dávce 3 mg/kg/den rozdělené do 2 dávek byla zkoumána u 19 kojenců ve věku 35 až 150 dní při zahájení léčby. Farmakokinetické hodnocení bylo provedeno v ustáleném stavu, po 1 a 3 měsících léčby.
Propranolol byl rychle absorbován, maximální plazmatické koncentrace bylo dosaženo obvykle 2 hodiny po podání s odpovídající střední hodnotou cca 79 ng/ml bez ohledu na stáří kojence.
Střední hodnota zjevné perorální clearance činila 2,71 l/h/kg u kojenců ve věku 65 - 120 dní a 3,27 l/h/kg u kojenců ve věku 181 - 240 dní. Po korekci podle tělesné hmotnosti byly primární farmakokinetické parametry pro propranolol (např. plazmatická clearance) určené u kojenců podobné hodnotám zjištěným u dospělých, publikovaným v literatuře.
Byl kvantifikován metabolit 4-hydroxypropranololu a jeho expozice v plazmě činí méně než 7 % expozice mateřské látky.
Během této farmakokinetické studie, do níž byli zařazeni kojenci s hemangiomy ohrožujícími funkci, hemangiomy v určitých anatomických lokalitách, kde často zanechávají trvalé jizvy nebo deformity, velkými obličejovými hemangiomy, menšími hemangiomy na exponovaných místech, závažnými exulcerovanými hemangiomy a stopkatými hemangiomy, byla účinnost rovněž zkoumána jako druhotné hodnotící kritérium. Léčba propranololem vedla k rychlému zlepšení (během 7-14 dnů) u všech pacientů a odléčení cílového hemangiomu bylo pozorováno u 36,4 % pacientů do 3 měsíců.
5.3 Předklinické údaje vztahující se k bezpečnosti
Propranolol je po podání akutní dávky u zvířat považován za mírně toxické léčivo s perorální LD50 cca 600 mg/kg. Hlavní účinky hlášené po opakovaném podání propranololu dospělým a juvenilním potkanům byly přechodné snížení tělesné hmotnosti a přírůstku tělesné hmotnosti spojené s přechodným snížením hmotnosti orgánů. Tyto účinky byly po ukončení léčby zcela reverzibilní.
Ve studiích výživového podávání, v němž byl myším a potkanům podáván propranolol-hydrochlorid až po dobu 18 měsíců v dávkách až 150 mg/kg/den, nebyla v souvislosti s podáváním této léčivé látky zaznamenána žádná tumorigeneze.
Přestože byly některé údaje dvojznačné, lze na základě veškerých dostupných údajů in vitro a in vivo dospět k závěru, že propranolol nemá genotoxický potenciál.
Propranolol podávaný do dělohy dospělých potkaních samic je silný protiimplantační činitel v dávce > 4 mg na jedno zvíře, přičemž tyto účinky jsou reverzibilní. Opakované podávání propranololu dospělým potkaním samcům ve vysokých dávkách (> 7,5 mg/kg) vyvolávalo histopatologické léze varlat, nadvarlat a semenných váčků, pokles pohyblivosti spermií, koncentrace buněk spermií, hladiny testosteronu v plazmě a značné zvýšení výskytu abnormalit hlaviček a bičíků spermií. Tyto účinky po ukončení léčby obecně zcela vymizely. Podobné výsledky byly získány po intratestikulárním podávání a při použití modelů in vitro. Avšak při studii prováděné na juvenilních zvířatech po celou dobu vývoje odpovídající kojeneckému věku, dětství a dospívání nebyl zjištěn žádný účinek na samčí a samičí fertilitu (viz bod 4.6).
Potenciální účinky propranololu na vývoj juvenilních potkanů byly posouzeny po každodenním perorálním podávání od 4. dne po narození (PND 4) do PND 21 v dávkách 0, 10, 20 nebo 40 mg/kg/den.
Mortalita s neznámým (i když nepravděpodobným) vztahem k léčbě byla pozorována při dávce 40 mg/kg/den, což vedlo ke stanovení celkového NOAEL pro juvenilní toxicitu 20 mg/kg/den.
Až do nejvyšší dávky 40 mg/kg/den nebyly zjištěny žádné účinky související s propranololem ani toxikologicky významné účinky na reprodukční vývoj, růst a neurologický vývoj, což vede k bezpečnostním limitům 1,2 u samic a 2,9 u samců, na základě průměrné expozice účinkům propranololu při PND 21.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
• Hyetelóza
• Dihydrát sodné soli sacharinu
• Jahodové aroma (obsahuje propylenglykol)
• Vanilkové aroma (obsahuje propylenglykol)
• Monohydrát kyseliny citrónové
• Čištěná voda
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
Před otevřením: 3 roky.
Po prvním otevření: 2 měsíce.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte lahvičku v původní krabičce, aby byl přípravek chráněn před světlem.
Chraňte před mrazem.
Mezi jednotlivými podáváními uchovávejte lahvičku a stříkačku společně v krabičce.
6.5 Druh obalu a obsah balení
120 ml roztoku v hnědé skleněné lahvičce s polyethylenovou vložkou nízké hustoty a dětským bezpečnostním polypropylenovým šroubovacím uzávěrem, dodáváno spolu s polypropylenovou stříkačkou pro perorální podání kalibrovanou v mg propranololové báze.
Velikost balení: 1.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
PIERRE FABRE DERMATOLOGIE 45 place Abel Gance F- 92100 Boulogne Francie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/14/919/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 23 duben 2014
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
PŘÍLOHA II
A. VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného/výrobců odpovědných za propouštění šarží Farmea
10, rue Bouché Thomas ZAC ďOrgemont F-49000 Angers Francie
PIERRE FABRE MEDICAMENT PRODUCTION - CHATEAURENARD Site SIMAPHAC, Zone Industrielle de Chateaurenard 45220 CHATEAURENARD Francie
PIERRE FABRE MEDICAMENT PRODUCTION Site PROGIPHARM, Rue du Lycée
45500 GIEN Francie
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
• Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předloží první pravidelně aktualizovanou zprávu o bezpečnosti pro tento léčivý přípravek do 8 měsíců od jeho registrace. Držitel rozhodnutí o registraci dále předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
• Další opatření k minimalizaci rizik
Držitel rozhodnutí o registraci předloží vzdělávací balíček k navrženým indikacím, zacílený na veškeré poskytovatele zdravotní péče, u nichž se předpokládá, že budou připravovat a podávat HEMANGIOL dětem. Tento vzdělávací balíček je zaměřen na zvýšení povědomí o potenciálních rizicích hypotenze, bradykardie a bronchospasmu po podání HEMANGIOLu a na poskytnutí doporučení, jak monitorovat/léčit tato rizika.
Cílem balíčku je také instruovat poskytovatele zdravotní péče, jak správně krmit děti během léčby, aby se předešlo riziku hypoglykémie.
Držitel rozhodnutí o registraci je před distribucí vzdělávacího balíčku povinen nechat schválit národní kompetentní autoritou obsah a formát tohoto edukačního materiálu spolu s plánem komunikace. Vzdělávací balíček musí být možno distribuovat před uvedením nové indikace (léčba proliferujícího infantilního hemangiomu) v příslušném členském státě.
Edukační materiály pro poskytovatele zdravotní péče léčící děti pomocí HEMANGIOLu musí zahrnovat následující klíčové bezpečnostní prvky:
• Informace o podmínkách, za kterých nesmí být HEMANGIOL podáván
• Informace týkající se správného postupu přípravy a podávání přípravku zahrnující:
- Pokyny, jak připravit roztok HEMANGIOLu
- Doporučení, jak krmit dítě během léčby
- Informace, jak detekovat a léčit jakékoli známky hypoglykémie během léčby HEMANGIOLem
- Pokyny, kdy přerušit podávání HEMANGIOLu
• Potřeba sledování následujících známek a příznaků a potřeba vyhledání odborného zdravotnického pracovníka, pokud se tyto známky a příznaky objeví po podání léčby:
- Týkající se bradykardie a hypotenze: únava, studenost (povrchu těla), bledost, namodralá kůže a malátnost/mdloby.
- Týkající se hypoglykémie: vedlejší příznaky, jako je bledost, únava, pocení, třes, bušení srdce, úzkost, hlad, obtížné probouzení; hlavní příznaky, jako je nadměrná spavost, snížená reaktivita, nedostatečný příjem potravy, pokles tělesné teploty, křeče (záchvaty), krátké výpadky dýchání, ztráta vědomí
PŘÍLOHA III
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU PAPÍROVÁ KRABIČKA/LAHVIČKY
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
HEMANGIOL 3,75 mg/ml, perorální roztok Propranololum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
1 ml roztoku obsahuje propranololi hydrochloridum 4,28 mg, což odpovídá propranololum 3,75 mg.
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Perorální roztok.
120 ml.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Perorální podání.
Před použitím si přečtěte příbalovou informaci.
Používejte s přiloženou stříkačkou pro perorální podání kalibrovanou v mg propranololu. Nepoužívejte žádnou jinou odměrku.
Lahvičku před použitím neprotřepávejte.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
Přípravek je nutno spotřebovat do 2 měsíců po prvním otevření.
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte lahvičku v krabičce, aby byl přípravek chráněn před světlem.
Mezi jednotlivými podáváními uchovávejte lahvičku a stříkačku společně v krabičce. Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH
PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
PIERRE FABRE DERMATOLOGIE
45 place Abel Gance F- 92100 Boulogne Francie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/14/919/001
13. ČÍSLO ŠARŽE
Č. šarže:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
HEMANGIOL
Příbalová informace: informace pro uživatele
HEMANGIOL 3,75 mg/ml, perorální roztok
Propranololum
Přečtěte si pozorně celou příbalovou informaci dříve, než Vaše dítě začne tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka nebo zdravotní sestry.
• Tento přípravek byl předepsán výhradně Vašemu dítěti. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vaše dítě.
• Pokud se u Vašeho dítěte vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek HEMANGIOL a k čemu se používá
2. Čemu musíte věnovat pozornost, než Vaše dítě začne přípravek HEMANGIOL užívat
3. Jak se přípravek HEMANGIOL užívá
4. Možné nežádoucí účinky
5. Jak přípravek HEMANGIOL uchovávat
6. Obsah balení a další informace
1. Co je přípravek HEMANGIOL a k čemu se používá Co je přípravek HEMANGIOL
Název léčivého přípravku je HEMANGIOL. Léčivou látkou je propranolol.
Propranolol náleží do skupiny léčivých látek známých jako beta-blokátory.
K čemu se přípravek používá
Tento přípravek se používá k léčení choroby nazývané hemangiom. Hemangiom je shluk krevních cév, které vytvořily bulku na povrchu nebo pod povrchem kůže. Hemangiom může být povrchový nebo hloubkový. Občas se označuje jako „jahodové znaménko“, protože jeho povrch trochu připomíná jahodu.
Léčba HEMANGIOLem se zahajuje u kojenců ve věku 5 týdnů až 5 měsíců v následujících případech:
- když umístění a/nebo rozsah lézí (chorobných ložisek) ohrožuje život nebo funkčnost (mohlo by dojít k poškození životně důležitých orgánů nebo smyslů, například zraku nebo sluchu);
- jedná-li se o exulcerovaný (zvředovatělý) a bolestivý hemangiom a/nebo o hemangiom, který nereaguje na běžná opatření k ošetřování ran;
- v případě rizika vzniku trvalých jizev nebo znetvoření.
2. Čemu musíte věnovat pozornost, než Vaše dítě začne užívat přípravek HEMANGIOL
Nepodávejte přípravek HEMANGIOL,
pokud Vaše dítě:
• je předčasně narozené a nedosáhlo korigovaného věku 5 týdnů (korigovaný věk je věk, kterého by předčasně narozené dítě právě dosáhlo, kdyby se narodilo v termínu)
• je alergické na propranolol nebo na kteroukoli z pomocných látek tohoto přípravku (uvedených v bodě 6). K alergické reakci může patřit vyrážka, svědění nebo dušnost.
• má astma nebo obtíže s dýcháním v anamnéze
• má pomalý srdeční tep na svůj věk. Pokud si nejste jistý(á), poraďte se se svým lékařem.
• má srdeční poruchu (například poruchy srdečního rytmu nebo selhání srdce)
• má velmi nízký krevní tlak
• má oběhové problémy, které způsobují necitlivost a zblednutí prstů na rukou a nohou
• má sklon k nízké hladině krevního cukru
• má vysoký krevní tlak způsobený nádorem na nadledvinách, který je označován jako „feochromocytom“.
Pokud své dítě kojíte a pokud užíváte přípravky, které nesmí být užívány spolu s přípravkem HEMANGIOL (Viz „Pokud kojíte své dítě“ a „Další léčivé přípravky a přípravek HEMANGIOL“), nedávejte mu tento léčivý přípravek.
Upozornění a opatření
Dříve, než Vaše dítě začne dostávat přípravek HEMANGIOL, sdělte ošetřujícímu lékaři:
• pokud má Vaše dítě problémy s játry nebo ledvinami. Tento léčivý přípravek se nedoporučuje při poruše funkce jater nebo ledvin,
• pokud Vaše dítě někdy mělo alergickou reakci. Alergická reakce může zahrnovat vyrážku, svědění nebo dušnost,
• pokud má Vaše dítě psoriázu (lupénku; kožní choroba, která se projevuje zarudlými suchými ploškami ztluštělé kůže), protože tento léčivý přípravek může tento stav zhoršit,
• pokud má Vaše dítě diabetes (cukrovku): v takovém případě je nutno častěji sledovat hladiny cukru v krvi dítěte.
• Pokud má Vaše dítě PHACE syndrom (kombinace hemangiomu a cévních abnormalit zahrnujících mozkové krevní cévy), jelikož tento léčivý přípravek může zvyšovat riziko cévní mozkové příhody.
Důležité příznaky, které je nutno sledovat při podávání přípravku HEMANGIOL
Riziko hypotenze a brachykardie (pomalý srdeční rytmus)
Přípravek HEMANGIOL může způsobovat pokles krevního tlaku (hypotenzi) a zpomalení srdečního rytmu (bradykardii). Proto bude Vaše dítě pečlivě klinicky sledováno a bude mu monitorována srdeční činnost po dobu 2 hodin po podání první dávky nebo po zvýšení dávky. Poté bude ošetřující lékař vyšetřovat Vaše dítě pravidelně během léčby.
Ihned kontaktujte svého lékaře, má-li Vaše dítě při užívání přípravku HEMANGIOL příznaky, _jako je únava, chlad, bledost, namodralé zbarvení kůže nebo mdloby._
Rizika hypoglykémie
Tento léčivý přípravek může maskovat varovné příznaky hypoglykémie (známé také jako nízká hladina krevního cukru), pokud dítě nejí, zvrací nebo v případě předávkování. Tyto příznaky mohou být:
• méně závažné: bledost, únava, pocení, třes, bušení srdce, úzkost, hlad, obtíže při probouzení
• závažné: nadměrná spavost, snížená odezva na vnější podněty, špatné přijímání potravy, pokles tělesné
teploty, křeče (záchvaty), krátkodobé výpadky dýchání, ztráta vědomí.
Aby se zabránilo riziku hypoglykémie, musí být Vaše dítě během léčby pravidelně krmeno. Pokud Vaše dítě nechce jíst, objeví se u něho jiné onemocnění nebo zvrací, doporučuje se dávku vynechat. NEDÁVEJTE SVÉMU DÍTĚTI PŘÍPRAVEK HEMANGIOL, DOKUD NEBUDE ZNOVU SPRÁVNĚ KRMENO.
Má-li Vaše dítě při užívání přípravku HEMANGIOL jakékoli příznaky hypoglykémie, pokud možno podejte ústy tekutinu obsahující cukr a pokud tyto příznaky přetrvávají, neprodleně kontaktujte ošetřujícího lékaře nebo jeďte rovnou do nemocnice._
Rizika bronchospasmu
Zastavte léčbu a neprodleně kontaktujte ošetřujícího lékaře, pokud po podání přípravku HEMANGIOL svému dítěti pozorujete příznaky, které naznačují bronchospasmus (dočasné zúžení průdušek, které vede k obtížím při dýchání): kašel, rychlé nebo ztížené dýchání nebo sípání, což může i nemusí doprovázet namodralá barva kůže.
Riziko hyperkalémie
Při rozsáhlém zvředovatělém hemangiomu může HEMANGIOL zvyšovat hladinu draslíku v krvi (hyperkalémie). V takovém případě bude třeba Vašemu dítěti kontrolovat hladiny draslíku v krvi.
Má-li se Vaše dítě podrobit celkové anestézii
Sdělte ošetřujícímu lékaři, že dítě užívá přípravek HEMANGIOL. Důvodem je, že Vašemu dítěti může klesnout tlak, budou-li mu při užívání tohoto přípravku podána anestetika (viz „Další léčivé přípravky a přípravek HEMANGIOL“). Může být zapotřebí vysadit přípravek HEMANGIOL nejméně 48 hodin před anestézií.
Pokud kojíte své dítě
• sdělte to ošetřujícímu lékaři, než začnete dítěti tento přípravek podávat.
• Nepodávejte tento přípravek svému dítěti, jestliže užíváte léky, které nesmí být s HEMANGIOLem
užívány (viz „Další léčivé přípravky a přípravek HEMANGIOL“).
Další léčivé přípravky a přípravek HEMANGIOL
• Sdělte ošetřujícímu lékaři, lékárníkovi nebo zdravotní sestře, jestliže podáváte nebo jste nedávno
podal(a) dítěti jiné léčivé přípravky. Je to nutné proto, že přípravek HEMANGIOL může měnit způsob, jakým léčivé přípravky fungují, a některé přípravky mohou mít vliv na působení přípravku HEMANGIOL.
• Navíc pokud kojíte své dítě, je důležité informovat ošetřujícího lékaře, lékárníka nebo zdravotní sestru o tom, které léky Vy sama užíváte, protože mohou pronikat do mateřského mléka a ovlivňovat léčbu dítěte. Váš lékař Vám poradí, zda máte přerušit kojení nebo ne.
V případě, že kojíte, Vašemu ošetřujícímu lékaři nebo lékárníkovi zejména sdělte, pokud Vaše dítě nebo Vy užíváte:
• Léky k léčbě cukrovky,
• Léky na srdeční problémy nebo na problémy týkající se krevních cév, například na nepravidelný srdeční
tep, bolest na hrudi nebo angínu pectoris, na vysoký krevní tlak a selhání srdce,
• Léky proti úzkosti a depresi a proti závažnějším psychickým problémům a epilepsii,
• Léky proti tuberkulóze,
• Léky proti bolesti a zánětům,
• Léky ke snižování tuků v krvi,
• Léky užívané jako anestetika.
Máte-li jakékoli další dotazy, obraťte se na svého lékaře nebo lékárníka.
3. Jak se přípravek HEMANGIOL užívá
Léčba Vašeho dítěte byla započata lékařem se zkušenostmi v diagnostice, léčbě a péči o infantilní hemangiom.
Vždy podávejte tento léčivý přípravek svému dítěti přesně podle pokynů Vašeho ošetřujícího lékaře nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Nikdy neměňte sám/sama dávku, kterou podáváte svému dítěti. Každé zvýšení dávky nebo její úpravu podle tělesné hmotnosti dítěte musí provést Váš lékař.
Dávka
• Dávkování vychází z tělené hmotnosti Vašeho dítěte.
• Úvodní dávka je 1 mg/kg/den, rozdělená do dvou dávek (0,5 mg/kg, jedna ráno a jedna pozdě odpoledne), s časovým intervalem nejméně 9 hodin mezi dvěma dávkami.
• Doporučená dávka přípravku je 3 mg/kg/den, rozdělená na dvě dávky po 1,5 mg/kg, dosahovaná postupně s týdenním zvyšováním pod lékařským dohledem (1 mg/kg/den po první týden, poté
2 mg/kg/den po dobu druhého týdne a posléze 3 mg/kg/den do dokončení léčby).
Jak přípravek HEMANGIOL Vašemu dítěti podávat
• Přípravek se musí podávat během krmení nebo bezprostředně po krmení.
• Dávku je nutno vždy odměřit pomocí stříkačky pro perorální podání (podání ústy) dodávané s lahvičkou.
• Podávejte přípravek HEMANGIOL přímo do úst dítěte stříkačkou pro perorální podání dodávanou spolu lahvičkou. V případě potřeby můžete přípravek rozpustit v malém množství mléka určeného pro kojence nebo v jedné polévkové lžíci jablečné nebo pomerančové šťávy vhodné pro daný věk dítěte a dát jej dítěti v kojenecké láhvi. Nedávejte přípravek do plné lahve mléka nebo ovocné šťávy.
Pro děti s tělesnou hmotností do 5 kg lze dávku smíchat s jednou čajovou lžičkou (cca 5 ml) mléka. Pro děti s tělesnou hmotností nad 5 kg lze dávku smíchat s jednou polévkovou lžící (cca 15 ml) mléka nebo ovocné šťávy.
Směs použijte do dvou hodin od přípravy.
• Krmte dítě pravidelně, abyste se vyvaroval(a) delší doby, kdy je dítě bez jídla.
• Pokud Vaše dítě nejí nebo zvrací, doporučuje se dávku vynechat.
• Pokud dítě dávku vyplivne nebo pokud si nejste jistý(á), zda požilo všechen přípravek, nedávejte mu další dávku a počkejte na následující plánovanou dávku.
• Přípravek HEMANGIOL a krmení musí podávat stejná osoba, aby se zabránilo riziku hypoglykémie.
Pokud se jedná o odlišné osoby, dobrá komunikace je důležitá k zajištění bezpečnosti Vašeho dítěte.
Návod k použití:
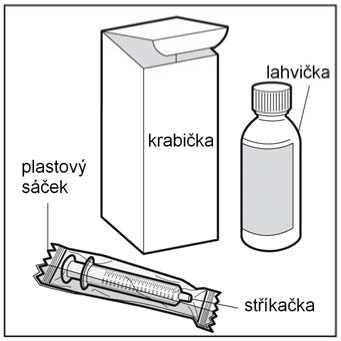
• Krok 1. Vyjměte jednotlivé položky z krabičky
Krabička obsahuje tyto položky, které budete potřebovat k podávání léku:
- skleněnou lahvičku obsahující 120 ml perorálního roztoku propranololu
- stříkačku pro perorální podání se stupnicí v mg dodávanou s tímto léčivým přípravkem Vyjměte lahvičku a stříkačku pro perorální podání z krabičky a vyjměte stříkačku z plastového sáčku.
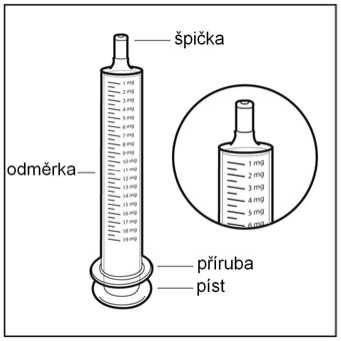
• Krok 2. Zkontrolujte dávku
Zkontrolujte dávku přípravku HEMANGIOL v miligramech (mg) předepsanou Vaším lékařem. Najděte toto číslo na stříkačce pro perorální podání.
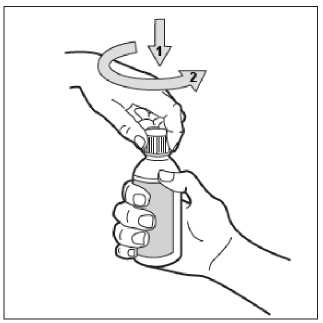
• Krok 3. Otevřete lahvičku
Lahvička je dodávána s uzávěrem s dětskou pojistkou. Otevře se takto: stlačte plastový uzávěr a současně jím otočte proti směru hodinových ručiček (vlevo).
Hlavičku před použitím neprotřepávejte.
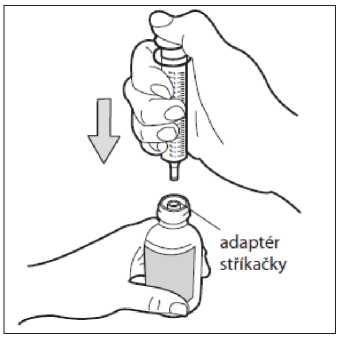
• Krok 4. Vložte stříkačku
Zasuňte špičku stříkačky pro perorální podání do lahvičky ve svislé pozici a stlačte píst úplně dolů. Neodstraňujte adaptér stříkačky z hrdla lahvičky.
Používejte pouze stříkačku pro perorální podání dodávanou s přípravkem k měření a podávání dávky. Nepoužívejte lžíci ani jinou odměrku.
• Krok 5: Odeberte dávku
Jakmile zasunete stříkačku, obraťte lahvičku dnem vzhůru. Vytáhněte píst stříkačky k údaji o počtu mg, který potřebujete.
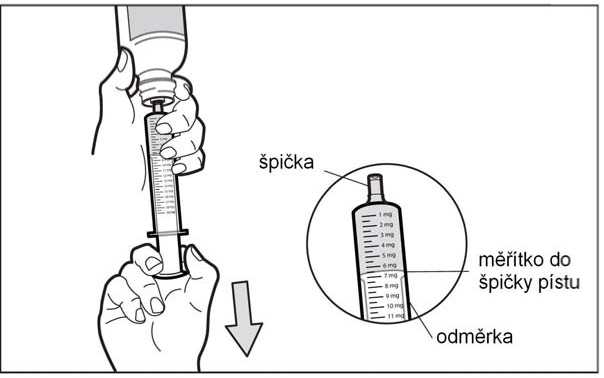
• Krok 6: Zkontrolujte výskyt vzduchových bublin
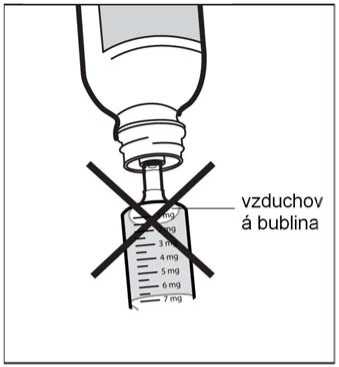
Pokud ve stříkačce uvidíte vzduchové bubliny, držte stříkačku ve svislé poloze, stlačte píst zpět tak daleko, abyste zcela vytlačil(a) velké vzduchové bubliny, a upravte zpět na dávku předepsanou Vaším lékařem.
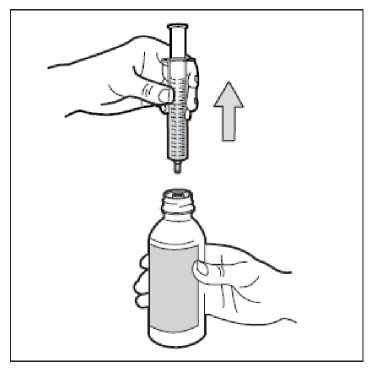
• Krok 7. Vyjměte stříkačku
Obraťte lahvičku do svislé polohy a vyjměte celou stříkačku z lahvičky. Buďte opatrní, abyste během tohoto kroku nestlačili píst.
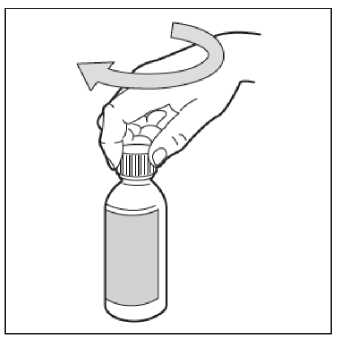
• Krok 8. Uzavřete lahvičku
Uzavřete plastový uzávěr otočením po směru hodinových ručiček (doprava)
• Krok 9. Podejte přípravek HEMANGIOL svému dítěti
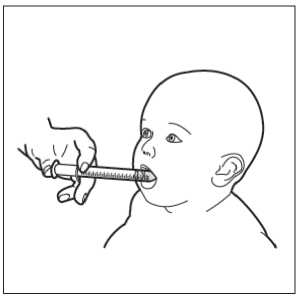
Vložte stříkačku dítěti do úst a umístěte ji proti vnitřní straně tváře.
Nyní můžete pomalu vstřikovat přípravek HEMANGIOL ze stříkačky přímo do úst dítěte.
Nepokládejte dítě ihned po podání.
• Krok 10: Vyčistěte stříkačku
Stříkačku nerozebírejte. Prázdnou stříkačku vypláchněte po každém použití ve sklenici čisté vody:
1- Vezměte sklenici čisté vody
2- Vtáhněte píst
3- Vylijte vodu do umyvadla
4- Toto čištění opakujte třikrát.
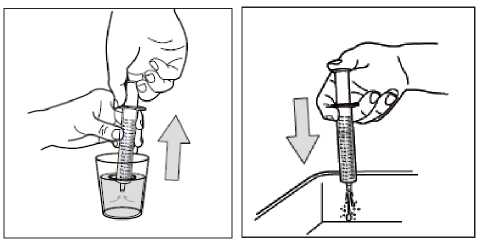
K čištění nepoužívejte žádný přípravek na bázi mýdla nebo alkoholu. Vnější stranu utřete do sucha. Nedávejte stříkačku do sterilizátoru nebo myčky nádobí.
Uchovávejte lahvičku a stříkačku společně v krabičce do dalšího použití na bezpečném místě, kde ji Vaše dítě nemůže zahlédnout nebo kde se k ní nemůže dostat. Po využívání léku v lahvičce stříkačku zlikvidujte.
Jestliže jste dal(a) svému dítěti více přípravku HEMANGIOL, než jste měl(a)
Pokud jste dal(a) svému dítěti více přípravku HEMANGIOL, než jste měl(a), poraďte se neprodleně se svým lékařem.
Jestliže jste zapomněl(a) dát přípravek HEMANGIOL svému dítěti
Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku. Pokračujte v léčbě s obvyklou frekvencí: jedna dávka ráno a jedna dávka pozdě odpoledne.
Jestliže jste přestala(a) dávat přípravek HEMANGIOL svému dítěti
Přípravek HEMANGIOL lze vysadit okamžitě na konci léčby.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Po podání HEMANGIOLu je nutno sledovat výskyt důležitých varovných známek možných nežádoucích účinků, jako je nízký krevní tlak, pomalý srdeční tep, nízká hladina cukru v krvi a bronchospasmus (zúžení průdušek). Podívejte se, prosím, do části 2 této příbalové informace.
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Velmi časté nežádoucí účinky (mohou se vyskytnout u více než 1 z 10 osob)
• Bronchitis (zánět průdušek),
• Poruchy spánku (nespavost, špatná kvalita spánku a obtíže při probouzení),
• Průjem a zvracení.
Časté nežádoucí účinky (mohou se vyskytnout až u 1 z 10 osob)
• Bronchospasmus (dušnost),
• Bronchiolitis (zánět průdušinek s dušností a sípotem na prsou, s kašlem a horečkou),
• Snížený krevní tlak,
• Snížená chuť k jídlu,
• Neklid, noční můry, podrážděnost,
• Spavost,
• Chladné končetiny,
• Zácpa, bolesti břicha
• Erytém (zčervenání kůže),
Méně časté nežádoucí účinky (mohou se vyskytnout až u 1 ze 100 osob)
• Poruchy srdeční vodivosti nebo rytmu (pomalý nebo nepravidelný srdeční tep),
• Kopřivka (alergická kožní reakce), alopecie (vypadávání vlasů),
• Snížené hladiny krevního cukru,
• Pokles počtu bílých krvinek.
Frekvence (četnost) následujících nežádoucích účinků není známa (z dostupných údajů ji nelze určit)
• Křeče (záchvaty) související s hypoglykémií (abnormálně nízkou hladinou krevního cukru),
• Bradykardie (abnormálně pomalý srdeční tep),
• Nízký krevní tlak,
• Velmi nízká hladina bílých krvinek, které bojují proti infekcím
• Oběhové problémy způsobující necitlivost a zblednutí prstů na rukou a nohou
• Zvýšená hladina draslíku v krvi
Hlášení nežádoucích účinků
Pokud se u Vašeho dítěte vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímoprostřednictvímnárodního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek HEMANGIOL uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Chraňte před mrazem.. Uchovávejte lahvičku v krabičce, aby byl přípravek chráněn před světlem. Mezi jednotlivými podáváními uchovávejte lahvičku a stříkačku společně v krabičce.
Nepoužívejte tento léčivý přípravek po uplynutí doby použitelnosti uvedené na lahvičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Léčivý přípravek je nutno spotřebován do 2 měsíců po prvním otevření.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
Obsah balení a další informace
6.
Co přípravek HEMANGIOL obsahuje
• Léčivou látkou je propranololum. Jeden ml přípravku obsahuje propranololi hydrochloridum 4,28 mg, což odpovídá propranololum 3,75 mg.
• Pomocnými látkami jsou hyetelóza, dihydrát sodné soli sacharinu, jahodové aroma (obsahuje propylenglykol), vanilkové aroma (obsahuje propylenglykol), monohydrát kyseliny citrónové, čištěná voda.
Jak přípravek HEMANGIOL vypadá a co obsahuje toto balení
• HEMANGIOL je čirý, bezbarvý až světle žlutý perorální roztok s ovocnou vůní.
• Dodává se v hnědé skleněné lahvičce o objemu 120 ml s dětským bezpečnostním šroubovacím
uzávěrem. Krabička obsahuje 1 lahvičku.
• S každou lahvičkou je dodávána polypropylenová stříkačka pro perorální podání se stupnicí v mg
propranololu.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci PIERRE FABRE DERMATOLOGIE
45 Place Abel Gance 92100 BOULOGNE FRANCIE
Výrobce
FARMEA
10 rue Bouché Thomas ZAC Sud d’Orgemont 49000 ANGERS FRANCIE
nebo
PIERRE FABRE MEDICAMENT PRODUCTION
Site SIMAPHAC, Zone Industrielle de Chateaurenard
45220 CHATEAURENARD
FRANCIE
nebo
PIERRE FABRE MEDICAMENT PRODUCTION
Site PROGIPHARM, Rue du Lycée
45500 GIEN
FRANCIE
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Tato příbalová informace byla naposledy revidována.
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
29