Glivec 50 Mg
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Glivec 50 mg tvrdé tobolky
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tobolka obsahuje 50 mg imatinibum (jako imatinibi mesilas). Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tvrdá tobolka
Bílý až žlutý prášek ve světle žlutých až oranžově žlutých neprůhledných tobolkách označených
„NVR SH“.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Glivec je indikován k léčbě
• dospělých a dětských pacientů s nově diagnostikovanou Philadelphia chromozom (bcr-abl) pozitivní (Ph+) chronickou myeloidní leukemií (CML), u kterých není transplantace kostní dřeně považována za léčbu první volby.
• dospělých a dětských pacientů s Ph+ CML s chronickou fází onemocnění, u kterých selhala léčba interferonem-alfa, nebo kteří jsou v akcelerované fázi onemocnění nebo v blastické krizi.
• dospělých a dětských pacientů s nově diagnostikovanou Philadelphia chromozom pozitivní akutní lymfatickou leukemií (Ph+ ALL) doplněnou chemoterapií.
• dospělých pacientů s recidivující nebo refrakterní Ph+ ALL jako monoterapie.
• dospělých pacientů s myelodysplastickým/myeloproliferativním onemocněním (MDS/MPD) spojeným se změnou genu receptoru pro růstový faktor krevních destiček (PDGFR).
• dospělých pacientů se syndromem pokročilé hypereozinofilie (HES) a/nebo chronickou eozinofilní leukemií (CEL) s přeskupením FIP1L1-PDGFRa.
Účinek Glivecu na výsledek transplantace kostní dřeně nebyl stanoven.
Glivec je indikován
• k léčbě dospělých pacientů s Kit (CD 117) pozitivními inoperabilními a/nebo metastatickými maligními stromálními nádory zažívacího traktu (GIST).
• k adjuvantní léčbě dospělých pacientů s významným rizikem recidivy po resekci Kit (CD117)-pozitivního GIST nádoru. Pacienti s nízkým nebo velmi nízkým rizikem recidivy by neměli adjuvantní léčbu podstoupit.
• k léčbě dospělých pacientů s inoperabilním dermatofibrosarkomem protuberans (DFSP) a dospělých pacientů s rekurentním a/nebo metastatickým DFSP, kteří nejsou způsobilí operace.
U dospělých a dětských pacientů je účinnost Glivecu hodnocena podle stupně celkové hematologické a cytogenetické odpovědi a přežívání bez progrese onemocnění u CML, podle stupně hematologické a cytogenetické odpovědi u Ph+ ALL, MDS/MPD, podle stupně hematologické odpovědi u HES/CEL a podle stupně objektivní odpovědi u dospělých pacientů s inoperabilním a/nebo metastatickým GIST a DFSP a na základě přežití bez návratu onemocnění u adjuvantní léčby GIST. Zkušenosti s Glivecem u pacientů s MDS/MPD spojeným se změnou genu receptoru PDGFR jsou velmi omezené (viz bod 5.1). Kromě nově diagnostikované chronické fáze CML nej sou k dispozici žádné kontrolované studie, které by prokázaly klinický přínos nebo prodloužené přežití u těchto uvedených onemocnění.
4.2 Dávkování a způsob podání
Léčbu by měl zahájit lékař s odpovídajícími zkušenostmi v léčbě pacientů s hematologickými malignitami a maligními sarkomy.
Předepsaná dávka by měla být podávána perorálně s jídlem a zapíjena velkou sklenicí vody, aby se minimalizovalo riziko gastrointestinálního podráždění. Dávky 400 mg nebo 600 mg by měly být podávány jednou denně, zatímco dávka 800 mg by měla být podávána rozděleně na 400 mg dvakrát denně ráno a večer. Pro pacienty (děti), kteří nemohou polykat celé tobolky je možné naředit celý obsah tobolky ve sklenici neperlivé vody nebo v jablečnému džusu. Protože ve studiích na zvířatech byla prokázána reprodukční toxicita a možné riziko pro lidský plod není známé, je nutné ženám ve fertilním věku doporučit při otevírání tobolek zvýšenou opatrnost, tak aby nedošlo k inhalaci prášku nebo ke kontaktu prášku s kůží a očima (viz bod 4.6). Po manipulaci s otevřenou tobolkou je nutné si okamžitě umýt ruce.
Dávkování u CML u dospělých pacientů
Doporučená dávka Glivecu je pro dospělé pacienty v chronické fázi CML 400 mg/den. Chronická fáze CML je definována dosažením všech následujících kriterií: blasty v krvi a kostní dřeni < 15%, basofily v periferní krvi < 20%, krevní destičky > 100 x 109/l.
U dospělých pacientů s akcelerovanou fází je doporučená dávka Glivecu 600 mg/den. Akcelerovaná fáze onemocnění je určena přítomností kteréhokoli z následujících projevů: blasty v krvi nebo kostní dřeni > 15% ale < 30%, blasty a promyelocyty v krvi nebo kostní dřeni > 30% (za předpokladu < 30% blastů), basofily v periferní krvi > 20%, krevní destičky < 100 x 109/l bez vztahu k léčbě.
U dospělých pacientů v blastické krizi je doporučená dávka Glivecu 600 mg/den. Blastická krize je definována počtem blastů v krvi nebo kostní dřeni > 30% nebo extramedulárním postižením jiným než hepatosplenomegalií.
Trvání léčby: V klinických studiích pokračovala léčba Glivecem do progrese onemocnění. Efekt zastavení léčby po dosažení kompletní cytogenetické odpovědi nebyl zkoumán.
U pacientů v chronické fázi onemocnění je možno uvažovat o vzestupu dávky ze 400 mg na 600 mg nebo 800 mg, u pacientů s akcelerovanou fází onemocnění nebo v blastické krizi je možné zvýšit dávku ze 600 mg na maximum 800 mg (podáváno 2krát denně 400 mg), při absenci závažných nežádoucích účinků nebo závažné neutropenii či trombocytopenii nesouvisející s leukemií, za následujících okolností: při progresi onemocnění (kdykoliv); pokud nebylo ani po 3 měsících léčby dosaženo uspokojivé hematologické odpovědi; pokud nebylo po 12 měsících léčby dosaženo cytogenetické odpovědi; nebo při ztrátě předtím dosažené hematologické a/nebo cytogenetické odpovědi. Při zvyšování podávané dávky by měli být pacienti pečlivě sledováni pro možnost zvýšeného výskytu nežádoucích reakcí při vyšších dávkách.
Dávkování u CML u dětí
Dávkování pro děti by mělo být stanoveno podle tělesného povrchu (mg/m2). Dávka 340 mg/m2 denně se doporučuje dětem s chronickou fází CML nebo v pokročilé fázi CML (nepřekročit celkovou dávku 800 mg). Lék může být podáván jednou denně nebo může být celková denní dávka rozdělena do dvou částí - jedna ráno a druhá večer. Doporučené dávkování je v současnosti založeno na malém počtu dětských pacientů (viz body 5.1 a 5.2). S léčbou dětí do 2 let věku nejsou zkušenosti.
U dětí je možno uvažovat o vzestupu dávky z 340 mg/m2 denně na 570 mg/m2 denně (nepřekročit celkovou dávku 800 mg) při absenci závažných nežádoucích účinků nebo závažné neutropenii či trombocytopenii nesouvisející s leukemií za následujících okolností: při progresi onemocnění (kdykoliv), pokud nebylo ani po 3 měsících léčby dosaženo uspokojivé hematologické odpovědi, pokud nebylo po 12 měsících léčby dosaženo cytogenetické odpovědi, nebo při ztrátě před tím dosažené hematologické a/nebo cytogenetické odpovědi. Při zvyšování podávané dávky by měli být pacienti pečlivě sledováni pro možnost zvýšeného výskytu nežádoucích reakcí při vyšších dávkách.
Dávkování u Ph+ ALL u dospělých pacientů
U dospělých pacientů s Ph+ ALL je doporučená dávka Glivecu 600 mg/den. Hematologičtí odborníci pro léčbu tohoto onemocnění by měli terapii sledovat během všech fází péče.
Léčebný režim: Podle dosavadních údajů byla prokázána účinnost a bezpečnost Glivecu u dospělých pacientů s nově diagnostikovanou Ph+ ALL, pokud se podával v dávce 600 mg/den v kombinaci s chemoterapií v indukční fázi, v konsolidační a udržovací fázi po chemoterapii (viz bod 5.1). Délka léčby Glivecem se může lišit s vybraným léčebným programem, ale obecně delší expozice Glivecu přináší lepší výsledky.
Pro dospělé pacienty s recidivující nebo refrakterní Ph+ ALL je monoterapie Glivecem při dávce 600 mg/den bezpečná, účinná a může být podávána, dokud se neobjeví progrese onemocnění.
Dávkování u Ph+ ALL u dětí
Dávkování pro děti má být stanoveno podle tělesného povrchu (mg/m2). U dětí s Ph+ ALL se doporučuje dávka 340 mg/m2 denně (nepřekročit celkovou dávku 600 mg).
Dávkování u MDS/MPD
U dospělých pacientů s MDS/MPD je doporučená dávka Glivecu 400 mg/den.
Trvání léčby: V jediné dosud provedené klinické studii pokračovala léčba Glivecem do progrese onemocnění (viz bod 5.1). V čase analýzy byl medián trvání léčby 47 měsíců (24 dnů - 60 měsíců).
Dávkování u HES/CEL
U dospělých pacientů s HES/CEL je doporučená dávka Glivecu 100 mg/den.
Zvýšení dávky ze 100 mg na 400 mg lze zvažovat při absenci nežádoucích účinků léčiva, a jestliže je při hodnocení léčby prokázána nedostatečná odpověď na léčbu.
Léčba by měla pokračovat tak dlouho, dokud je pro pacienta přínosná.
Dávkování u GIST
U dospělých pacientů s inoperabilním a/nebo metastatickým maligním GIST je doporučená dávka Glivecu 400 mg/den.
Existuje pouze omezené množství údajů o účinku zvýšení dávky ze 400 mg na 600 mg nebo 800 mg u pacientů s progresí při užívání nižší dávky (viz bod 5.1).
Trvání léčby: v klinických studiích pokračovala léčba pacientů s GIST do progrese onemocnění. V době analýzy byl medián trvání léčby 7 měsíců (7 dní až 13 měsíců). Efekt zastavení léčby po dosažení odpovědi nebyl studován.
Doporučená dávka Glivecu pro adjuvantní léčbu dospělých pacientů po resekci GIST je 400 mg/den. Optimální délka trvání léčby dosud není stanovena. Délka léčby v klinických studiích, které byly podkladem pro tuto indikaci, byla 36 měsíců (viz bod 5.1).
Dávkování u DFSP
U dospělých pacientů s DFSP je doporučená dávka Glivecu 800 mg/den.
Úprava dávkování pro nežádoucí účinky
Nehematologické nežádoucí účinky
Jestliže se při léčbě Glivecem vyskytnou závažné nehematologické nežádoucí účinky, musí být léčba do jejich zvládnutí přerušena. Potom může být léčba přiměřeně obnovena v závislosti na počáteční závažnosti příhody.
Při zvýšení hladiny bilirubinu > 3násobek stanoveného horního limitu normálu (IULN) nebo při zvýšení hladin jaterních transamináz > 5násobek IULN by měla by být léčba Glivecem přerušena, dokud se hladiny bilirubinu nevrátí k < 1,5násobku IULN a hladiny transamináz k < 2,5násobku IULN. Léčba Glivecem potom může pokračovat nižšími denními dávkami. U dospělých by měla být dávka snížena ze 400 na 300 mg nebo ze 600 na 400 mg nebo z 800 mg na 600 mg a u dětí ze 340 na 260 mg/m2/den.
Hematologické nežádoucí účinky
Při závažné neutropenii nebo trombocytopenii se doporučuje snížení dávky nebo přerušení léčby tak, jak je uvedeno v následující tabulce.
Úprava dávkování při neutropenii nebo trombocytopenii:
|
HES/CEL (zahajovací dávka 100 mg) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem na úroveň předchozí dávky (tj. před vážnými nežádoucími reakcemi). |
|
Chronická fáze CML, MDS/MPD a GIST (zahajovací dávka 400 mg) HES/CEL (dávka 400 mg) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem na úroveň předchozí dávky (tj. před vážnými nežádoucími reakcemi). 3. V případě opakování ANC < 1,0 x 109/l a/nebo krevních destiček k < 50 x 109/l, opakujte bod 1 a léčbu Glivecem obnovte sníženou dávkou 300 mg. |
|
Chronická fáze CML u dětí (dávka 340 mg/m2) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem na úroveň předchozí dávky (tj. před vážnými nežádoucími reakcemi). 3. V případě opakování ANC < 1,0 x109/l a/nebo krevních destiček < 50 x109/l, opakujte bod 1 a léčbu Glivecem obnovte sníženou dávkou 260 mg/m2. |
|
Akcelerovaná fáze CML a blastická krize a Ph+ ALL (počáteční dávka 600 mg) |
aANC < 0,5 x 109/l a/nebo krevní destičky < 10 x 109/l |
1. Zjistěte, zda cytopenie souvisí s leukemií (aspirací kostní dřeně nebo biopsií). 2. Pokud cytopenie nesouvisí s leukemií, snižte dávku Glivecu na 400 mg. 3. Pokud cytopenie přetrvává po 2 týdny, snižte dále dávku na 300 mg. 4. Pokud cytopenie přetrvává po 4 týdny a stále nesouvisí s leukemií, přerušte podávání Glivecu dokud není ANC > 1 x 109/l a krevní destičky > 20 x 109/l, potom obnovte léčbu dávkou 300 mg. |
|
Akcelerovaná fáze CML a blastická krize u dětí (počáteční dávka 340 mg/m2) |
aANC < 0,5 x 109/l a/nebo krevní destičky < 10 x 109/l |
1. Zjistěte, zda cytopenie souvisí s leukemií (aspirací kostní dřeně nebo biopsií). 2. Pokud cytopenie nesouvisí s leukemií, snižte dávku Glivecu na 260 mg/m2. 3. Pokud cytopenie přetrvává po 2 týdny, snižte dále dávku na 200 mg/m2. 4. Pokud cytopenie přetrvává po 4 týdny a stále nesouvisí s leukemií, přerušte podávání Glivecu, dokud není ANC > 1 x 109/l a krevní destičky > 20 x 109/l, potom obnovte léčbu dávkou 200 mg/m2. |
|
DFSP (při dávce 800 mg) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem v dávce 600 mg. 3. V případě opakování ANC < 1,0 x 109/l a/nebo krevních destiček k < 50 x 109/l, opakujte bod 1 a léčbu Glivecem obnovte se sníženou dávkou 400 mg. |
|
ANC = absolutní počet neutrofilů a výskyt nejméně po 1 měsíci léčby | ||
Zvláštní populace
Užití u dětí: Nejsou žádné zkušenosti s podáváním u dětí s CML mladších než 2 roky a u dětí s Ph+ ALL mladších než 1 rok (viz bod 5.1). Zkušenosti u dětí s MDS/MPD, DFSP, GIST a HES/CEL jsou velmi omezené.
Bezpečnost a účinnost imatinibu u dětí mladších než 18 let s MDS/MPD, DFSP, GIST a HES/CEL nebyla v klinických studiích stanovena. V současnosti dostupné publikované údaje jsou shrnuty v bodě 5.1, ale na jejich základě nelze učinit žádná doporučení ohledně dávkování.
Jaterní nedostatečnost: Imatinib je metabolizován především játry. Pacientům s mírnou, středně těžkou nebo těžkou dysfunkcí jater by měla být podávána minimální doporučená dávka 400 mg denně. Dávka může být snížena, pokud není tolerována (viz body 4.4, 4.8 a 5.2).
Klasifikace dysfunkce jater:
|
Dysfunkce jater |
Vyšetření jaterních funkcí |
|
Mírná |
Celkový bilirubin: = 1,5 ULN AST: > ULN (může být normální nebo < ULN, pokud celkový bilirubin je > ULN) |
|
Středně těžká |
Celkový bilirubin: > 1,5—3,0 ULN AST: jakákoliv |
|
Těžká |
Celkový bilirubin: > 3-10 ULN AST: jakákoliv |
ULN = horní hranice normy AST = aspartátaminotransferáza
Ledvinná nedostatečnost: U pacientů s dysfunkcí ledvin nebo u dialyzovaných pacientů má být použita počáteční minimální dávka 400 mg denně. U těchto pacientů se však doporučuje opatrnost. Pokud dávka není tolerována, může být snížena. Pokud je tolerována, může být v případě nedostatečné účinnosti zvýšena (viz bod 4.4 a 5.2).
Starší lidé: U starších lidí nebyla farmakokinetika imatinibu cíleně studována. V klinických studiích, které zahrnovaly 20% pacientů ve věku 65 let a starších, nebyly u dospělých pacientů pozorovány významné rozdíly ve farmakokinetice v závislosti na věku. U starších lidí není nutné doporučovat zvláštní dávkování.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Pokud je Glivec podáván společně s jinými léčivými přípravky, je možné očekávat lékové interakce. Při užívání Glivecu s inhibitory proteáz, azolovými antimykotiky, některými makrolidy (viz bod 4.5), substráty CYP3A4 s úzkým terapeutickým rozpětím (např. cyklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin, fentanyl, alfentanil, terfanadin, bortezomib, docetaxel, chinidin) nebo warfarinem a jinými deriváty kumarinu je nutné dbát opatrnosti (viz bod 4.5).
Souběžné užívání imatinibu a léčivých přípravků, které indukují CYP3A4 (např. dexamethason, fenytoin, karbamazepin, rifampicin, fenobarbital nebo Hypericum perforatum, také známé jako třezalka tečkovaná) mohou významně snižovat hladinu Glivecu a potenciálně zvyšovat riziko selhání léčby Proto by se mělo zabránit souběžnému užívání silných induktorů CYP3A4 a imatinibu (viz bod 4.5).
Hypotyreóza
Během léčby Glivecem byly hlášeny klinické případy hypotyreózy u pacientů, kterým byla provedena tyreoidektomie a kteří byli substitučně léčeni levothyroxinem (viz bod 4.5). U těchto pacientů je třeba důkladně kontrolovat hladiny tyreotropního hormonu (TSH).
Hepatotoxicita
Glivec je metabolizován převážně játry a pouze 13% je vylučováno ledvinami. U pacientů s dysfunkcí jater (mírnou, středně závažnou nebo závažnou) by měl být pečlivě sledován počet krevních elementů v periferní krvi a jaterní enzymy (viz body 4.2, 4.8 a 5.2). Je nutné si uvědomit, že pacienti s GIST mohou mít jaterní metastázy, které mohou vést ke zhoršení jaterních funkcí.
Při léčbě imatinibem byly pozorovány případy jaterního poškození včetně jaterního selhání a jaterní nekrózy. Pokud bylo podávání imatinibu kombinováno s vysokodávkovými chemoterapeutickými režimy, byl zjištěn nárůst závažných jaterních reakcí. Jaterní funkce by měly být pečlivě monitorovány, jestliže se imatinib kombinuje s chemoterapeutickými režimy, o kterých je také známo, že bývají spojeny s poruchou jaterních funkcí (viz bod 4.5 a 4.8).
Retence tekutin
Výskyt závažné retence tekutin (pleurální výpotek, edém, plicní edém, ascites, povrchový edém) byl hlášen přibližně u 2,5% nově diagnostikovaných pacientů s CML užívajících Glivec. Proto se velice doporučuje pravidelné vážení pacientů. Neočekávaný, rychlý nárůst tělesné hmotnosti by měl být pečlivě vyšetřen, a pokud je to nezbytné, měla by být zavedena příslušná podpůrná a léčebná opatření. V klinických studiích byl zvýšený výskyt těchto příhod u starších lidí a u pacientů se srdečním onemocněním v anamnéze. Proto je nutné pacientům se srdeční dysfunkcí věnovat zvýšenou pozornost.
Pacienti se srdečním onemocněním
Pacienti se srdečním onemocněním, s rizikovými faktory vzniku srdečního selhání nebo renálním selháním v anamnéze by měli být pečlivě sledováni, a každý pacient s příznaky nebo projevy shodnými s příznaky srdečního nebo renálního selhání by mělo být vyšetřen a léčen.
U pacientů s hypereosinofilním syndromem (HES) s okultní infiltrací HES buněk do myokardu byly ojedinělé případy kardiogenního šoku či dysfunkce levé komory spojeny s degranulací HES buněk po zahájení léčby imatinibem. Dle hlášení byl stav reverzibilní při podávání systémových kortikosteroidů, zavedení opatření k podpoře cirkulace a dočasném vysazení imatinibu. Protože byly hlášeny méně časté kardiální nežádoucí účinky při podávání Glivecu, mělo by být před zahájením léčby pečlivě zváženo stanovení prospěchu/rizika léčby imatinibem u pacientů s HES/CEL.
Myelodysplastické/myeloproliferativní onemocnění se změnou genu receptoru PDGFR by mohlo být spojeno s vysokými hladinami eosinofilů. Proto by se mělo před podáním Glivecu pacientům s HES/CEL a pacientům s MDS/MPD spojeným s vysokými hladinami eosinofilů zvážit vyšetření odborníkem kardiologem, provedení echokardiogramu a stanovení troponinu v séru. Pokud je výsledek kteréhokoli vyšetření abnormální, mělo by být zváženo vyšetření odborníkem kardiologem a profylaktické podávání systémových kortikosteroidů (1-2 mg/kg) po dobu jednoho až dvou týdnů souběžně se zahájením léčby imatinibem.
Gastrointestinální krvácení
Ve studii u pacientů s inoperabilním a/nebo metastatickým GIST bylo hlášeno jak gastrointestinální, tak i intratumorózní krvácení (viz bod 4.8). Na základě dostupných údajů nebyly identifikovány žádné predispoziční faktory (např.velikost nádoru, lokalizace nádoru, poruchy koagulace), které by zařadily pacienty s GIST do skupiny s vyšším rizikem kteréhokoli typu krvácení. Protože je zvýšená vaskularizace a sklon ke krvácivosti součástí povahy a klinického průběhu GIST, měl by být u všech pacientů použit standardní postup pro monitorování a zvládání krvácení.
V postmarketingovém období byla u pacientů s CML, ALL a jinými onemocněními hlášena také gastrická antrální vaskulární ektázie (GAVE), vzácný typ gastrointestinálního krvácení (viz bod 4.8).
V případě potřeby může být léčba přípravkem Glivec ukončena.
Syndrom nádorového rozpadu
Před započetím léčby přípravkem Glivec je doporučená úprava klinicky významné dehydratace a léčba vysokých hladin kyseliny močové z důvodu možného výskytu syndromu nádorového rozpadu (TLS) (viz bod 4.8).
Reaktivace hepatitidy B
U pacientů, kteří jsou chronickými nosiči hepatitidy B, dochází k reaktivaci po zahájení léčby inhibitory tyrosinkinázy bcr-abl. Některé případy vyústily v akutní selhání jater nebo ve fulminantní hepatitidu vedoucí k transplantaci jater nebo došlo k úmrtí pacienta.
Před zahájením léčby přípravkem GLIVEC mají být pacienti vyšetřeni na infekci HBV. Před zahájením léčby u pacientů s pozitivní sérologií hepatitidy B (včetně těch s aktivním onemocněním) a u pacientů, u kterých v průběhu léčby vyjde pozitivní test infekce HBV, je třeba se obrátit na odborníky na onemocnění jater a léčbu hepatitidy B. Nosiči HBV, kteří potřebují léčbu přípravkem GLIVEC, mají být po celou dobu léčby a několik měsíců po jejím ukončení pečlivě sledováni s ohledem na možný výskyt známek a příznaků aktivní infekce HBV (viz bod 4.8).
Laboratorní testy
Během léčby Glivecem musí být pravidelně vyšetřován kompletní krevní obraz. Léčba Glivecem u pacientů s CML byla doprovázena výskytem neutropenie nebo trombocytopenie. Avšak výskyt těchto cytopenií pravděpodobně souvisí se stádiem léčeného onemocnění a byl častější u pacientů s akcelerovanou fází CML nebo v blastické krizi než u pacientů s chronickou fází CML. Léčba Glivecem může být přerušena nebo dávky mohou být sníženy, jak je doporučeno viz bod 4.2.
U pacientů užívajících Glivec by měly být pravidelně monitorovány jaterní funkce (transaminázy, bilirubin, alkalická fosfatáza).
U pacientů s poruchou renálních funkcí je expozice imatinibem v plazmě patrně vyšší, než u pacientů s normální funkcí ledvin, pravděpodobně v důsledku zvýšené hladiny alfa-acid glycoproteinu (AGP) a vazby imatinibu na proteiny u těchto pacientů. Pacientům s renální nedostatečností by se měla podávat minimální zahajovací dávka. Pacienti se závažnou renální nedostatečností by měli být léčeni s opatrností. Pokud není dávka imatinibu tolerována, může být snížena (viz body 4.2 a 5.2).
Dlouhodobá léčba imatinibem může být spojená s klinicky významným omezením renálních funkcí. Proto mají být renální funkce před zahájením léčby imatinibem vyhodnoceny a během léčby pečlivě sledovány, pozornost má být věnována pacientům, u nichž se projevují rizikové faktory pro renální dysfunkci. Pokud je zjištěna renální dysfunkce, musí být předepsána vhodná opatření a léčba, která je v souladu se standardními léčebnými doporučeními.
Pediatrická populace
U dětí a jedinců v prepubertálním věku (preadolescentů) užívajících imatinib byly hlášené případy retardace růstu. Dlouhodobé účinky prodloužené léčby imatinibem na růst dětí nejsou známé. Proto je doporučené pečlivé sledování růstu dětí léčených imatinibem (viz bod 4.8).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Léčivé látky, které mohou zvyšovat koncentraci imatinibu v plazmě:
Látky, které inhibují aktivitu izoenzymu CYP3A4 cytochromu P450 (např. inhibitory proteáz jako je indinavir, lopinavir/ritonavir, ritonavir, sachinavir, telaprevir, nelfinavir, boceprevir; azolová antimykotika zahrnující ketokonazol, itrakonazol, posakonazol, vorikonazol; některé makrolidy jako je erythromycin, klarithromycin a telithromycin) by mohly snižovat metabolismus a zvyšovat koncentraci imatinibu. Při souběžné jednotlivé dávce ketokonazolu (inhibitoru CYP3A4) zdravým jedincům bylo pozorováno významné zvýšení účinku imatinibu (průměrná Cmax imatinibu vzrostla o 26% a AUC o 40%). Při podávání Glivecu s inhibitory skupiny CYP3A4 je nutná opatrnost.
Léčivé látky, které mohou snižovat koncentraci imatinibu v plazmě:
Látky, které indukují aktivitu CYP3A4 (např. dexamethason, fenytoin, karbamazepin, rifampicin, fenobarbital, fosfenytoin, primidon nebo Hypericum perforatum, známé také jako třezalka tečkovaná) mohou významně snižovat působení Glivecu a potenciálně zvyšovat riziko selhání léčby. Předchozí léčba opakovaným podáním rifampicinu 600 mg následovaná jednorázovou dávkou 400 mg Glivecu měla za následek snížení Cmax nejméně o 54% a AUC^) o 74% ve srovnání s hodnotami bez předchozí léčby rifampicinem. Podobné výsledky byly pozorovány u pacientů s maligními gliomy, kteří byli léčeni Glivecem a užívali antiepileptické léky (EIAEDs) jako např. karbamazepin, oxkarbazepin a fenytoin, které indukovaly příslušné jaterní enzymy. Došlo ke snížení AUC imatinibu v plazmě o 73% oproti pacientům, kteří neužívali EIAEDs. Mělo by se zabránit souběžnému užívání rifampicinu nebo jiných silných induktorů CYP3A4 a imatinibu.
Léčivé látky, jejichž koncentrace v plazmě by mohla být ovlivněna Glivecem
Imatinib zvyšuje průměrnou Cmax simvastatinu 2krát a AUC simvastatinu (CYP3A4 substrát) 3,5krát, což znamená, že je CYP3A4 inhibován imatinibem. Při podávání Glivecu se substráty CYP3A4 s úzkým terapeutickým oknem se proto doporučuje opatrnost (např. cyklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin, fentanyl, alfentanil, terfenadin, bortezomib, docetaxel a chinidin). Glivec může zvyšovat plazmatickou koncentraci jiných léků metabolizovaných CYP3A4 (např. triazolo-benzodiazepinů, dihydropyridinových blokátorů kalciových kanálů, některých inhibitorů HMG-CoA reduktázy, tj. statinů, atd.).
Vzhledem ke známému zvýšenému riziku krvácení spojenému s užíváním imatinibu (např. hemoragie) by měli pacienti vyžadující antikoagulační léčbu místo kumarinových derivátů, jako je warfarin, dostávat nízkomolekulární nebo standardní heparin.
In vitro Glivec inhibuje aktivitu izoenzymu CYP2D6 cytochromu P450 v koncentraci podobné té, která ovlivňuje aktivitu CYP3A4. Imatinib v dávce 400 mg dvakrát denně působil inhibičně na metabolismus metoprololu zprostředkovaný CYP2D6; došlo ke zvýšení Cmax a AUC metoprololu o přibližně 23% (90% CI [1,16-1,30]).Zdá se, že při souběžném podávání imatinibu se substráty CYP2D6 není nutno upravovat dávkování, doporučuje se však věnovat zvýšenou pozornost substrátům CYP2D6 s úzkým terapeutickým oknem, jako je např. metoprolol. U pacientů léčených metoprololem je nutno zvážit klinické monitorování.
In vitro Glivec inhibuje O-glukuronidaci paracetamolu s Ki hodnotou 58,5 mikromol/l. Tato_inhibice nebyla zjištěna po podání Glivecu 400 mg a paracetamolu 1000 mg in vivo. Vyšší dávky Glivecu a paracetamolu nebyly studovány.
Obezřetnost by proto měla být uplatněna při souběžném užívání vyšších dávek Glivecu a paracetamolu.
U pacientů s tyreoidektomií léčených levothyroxinem, může být plazmatická expozice levothyroxinu snížena, pokud se podává spolu s Glivecem (viz bod 4.4). Proto se doporučuje opatrnost. Nicméně mechanismus pozorované interakce v současnosti není znám.
U pacientů s Ph+ ALL existují klinické zkušenosti souběžného podávání Glivecu a chemoterapie (viz bod 5.1), avšak lékové interakce mezi imatinibem a chemoterapeutickými režimy nejsou dobře známy. Nežádoucí účinky imatinibu jako jaterní toxicita, myelosuprese a další se mohou zvyšovat, podle hlášení souběžné užívání s L-asparaginázou by mohlo být spojeno se zvýšením jaterní toxicity (viz bod 4.8). Proto je třeba zvláštní opatrnosti, pokud se Glivec užívá v kombinaci.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku
Ženám ve fertilním věku musí být doporučeno užívání účinné antikoncepce během léčby.
K dispozici jsou omezené údaje o podávání imatinibu těhotným ženámi. Studie na zvířatech však prokázaly reprodukční toxicitu (viz bod 5.3). Potenciální riziko pro plod není známé. Glivec lze v těhotenství použít pouze pokud je to nezbytně nutné. Pokud je během těhotenství užíván, pacientka musí být informována o možném riziku pro plod.
Kojení
O vylučování imatinibu do mateřského mléka jsou jen omezené informace. Studie na dvou kojících ženách ukázaly, že jak imatinib, tak jeho aktivní metabolit může být vylučován do mateřského mléka. Koeficient mléko/plazma imatinibu a jeho metabolitu zkoumaný u jedné pacientky byl stanoven 0,5 pro imatinib a 0,9 pro jeho metabilit, což nasvědčuje zvýšenému vylučováním metabolitu do mléka. Zvážíme-li kombinovanou koncentraci imatinibu a jeho metabolitu a maximální denní příjem mléka kojenci, byla by očekávaná celková expozice nízká (přibližně 10% terapeutické dávky). Nicméně, jelikož účinky expozice nízké dávce imatinibu u kojenců nejsou známé, neměly by ženy užívající imatinib kojit.
Fertilita
Fertilita u samců a samic potkanů nebyla v neklinických studiích ovlivněna (viz bod 5.3). Studie u pacientů užívajících Glivec zabývající se jeho účinky na fertilitu a spermatogenezi nebyly provedeny. Pacienti, kteří se obávají o svou fertilitu během léčby Glivecem, by se měli poradit se svým lékařem.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacienti by měli být upozorněni, že se u nich mohou během léčby imatinibem vyskytnout nežádoucí účinky, jako jsou závratě, neostré vidění nebo ospalost. Proto se při řízení nebo obsluze strojů doporučuje zvýšená opatrnost.
4.8 Nežádoucí účinky
U pacientů s pokročilým stadiem malignit se může vyskytovat řada různorodých zdravotních potíží vyvolaných základním onemocněním, jeho progresí nebo množstvím souběžně užívaných léčivých přípravků, což ztěžuje stanovení příčinné souvislosti výskytu nežádoucích reakcí.
Během klinického hodnocení léku u CML musela být z důvodu nežádoucích reakcí, které byly v příčinné souvislosti s podáváním léku, léčba přerušena pouze u 2,4% nově diagnostikovaných pacientů, u 4% pacientů v pozdní chronické fázi po selhání léčby interferonem, u 4% pacientů v akcelerované fázi po selhání léčby interferonem a u 5% pacientů v blastické krizi po selhání léčby interferonem. U pacientů s GIST bylo podávání hodnoceného léku přerušeno pro nežádoucí reakce související s lékem u 4% pacientů.
Nežádoucí účinky byly ve všech indikacích podobné, s výjimkou dvou reakcí. U pacientů s CML byla častěji pozorována myelosuprese než u pacientů s GIST, pravděpodobně způsobené základním onemocněním. Ve studii u pacientů s inoperabilním a/nebo metastatickým GIST se u 7 (5%) pacientů vyskytl CTC stupeň 3/4 GI krvácení (3 pacienti), krvácení do nádoru (3 pacienti) nebo obojí (1 pacient). Lokalizace GI nádorů může být zdrojem krvácení do zažívacího traktu (viz bod 4.4). Krvácení do zažívacího traktu nebo z nádoru může být někdy velmi vážné, v některých případech až fatální. Nejčastěji hlášené (> 10%) nežádoucí reakce vyvolané lékem v obou souborech byly mírná nauzea, zvracení, průjem, bolesti břicha, únava, svalové bolesti, svalové křeče a vyrážka. Povrchové otoky byly společným nálezem ve všech studiích a byly popisovány hlavně jako otoky kolem očí nebo otoky dolních končetin. Tyto otoky však byly jen vzácně závažné a bylo možné je zvládnout diuretiky, jinou podpůrnou léčbou nebo snížením dávky Glivecu.
Pokud se imatinib kombinoval s vysokou dávkou chemoterapie u pacientů s Ph+ ALL, byla pozorována přechodná jaterní toxicita ve formě zvýšení transamináz a hyperbilirubinemie. Při použití omezených údajů z bezpečnostních databází se dosud hlášené nežádoucí účinky u dětí shodují se známým bezpečnostním profilem u dospělých pacientů s Ph+ ALL. Databáze týkající se bezpečnosti u dětí s Ph+ ALL je velmi omezená, protože nebyly zjistěné nové bezpečnostní události.
Různorodé nežádoucí účinky, jako je pleurální výpotek, ascites, plicní edém a rychlý přírůstek tělesné hmotnosti s nebo bez superficiálních otoků, je možné souhrnně popsat jako „retence tekutin“. Tyto nežádoucí reakce je možné obvykle zvládnout dočasným vysazením Glivecu a diuretiky a jinou vhodnou podpůrnou léčbou. Avšak některé z těchto reakcí mohou být velmi závažné nebo život ohrožující a několik pacientů s blastickou krizí zemřelo s komplexním klinickým nálezem zahrnujícím pleurální výpotek, městnavé srdeční selhání a selhání ledvin. V klinických studiích nebyly u dětí pozorovány specificky odlišné nežádoucí účinky.
Nežádoucí účinky
Nežádoucí účinky, které se vyskytly častěji než v ojedinělých případech jsou uvedeny níže podle orgánové klasifikace a frekvence výskytu. Kategorie frekvencí výskytu jsou definovány podle následujících pravidel jako: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
V každé skupině četností jsou nežádoucí účinky seřazeny podle četnosti od nejčastější.
Nežádoucí účinky a četnost jejich výskytu jsou uvedené v Tabulce 1.
Tabulka 1 Přehled nežádoucích účinků v tabulce
|
Infekce a infestace | |
|
Méně časté: |
Herpes zoster, herpes simplex, nasofaryngitida, pneumonie1, sinusitida, celulitida, infekce horních cest dýchacích, chřipka, infekce močových cest, gastroenteritida, sepse |
|
Vzácné: |
Plísňové infekce |
|
Není známo: |
Reaktivace hepatitidy B* |
|
Novotvary benigní, maligní, a blíže neurčené (zahrnující cysty a polypy) | |
|
Vzácné: |
Syndrom nádorového rozpadu |
|
Není známo: |
Krvácení do tumoru/nekróza tumoru* |
|
Poruchy imunitního systému | |
|
Není známo: |
Anafylaktický šok* |
|
Poruchy krve a lymfatického systému | |
|
Velmi časté: |
Neutropenie, trombocytopenie, anemie |
|
Časté: |
Pancytopenie, febrilní neutropenie |
|
Méně časté: |
Trombocytemie, lymfopenie, útlum kostní dřeně, eozinofilie, lymfadenopatie |
|
Vzácné: |
Hemolytická anemie |
|
Poruchy metabolismu a výživy | |
|
Časté: | |
|
Méně časté: |
Hypokalemie, zvýšená chuť k jídlu, hypofosfatemie, snížená chuť k jídlu, dehydratace, dna, hyperurikemie, hyperkalcemie, hyperglykemie, hyponatremie |
|
Vzácné: |
Hyperkalemie, hypomagnezémie |
|
Psychiatrické poruchy | |
|
Časté: | |
|
Méně časté: | |
|
Vzácné: |
Stav zmatenosti |
|
Poruchy nervového systému | |
|
Velmi časté: |
Bolesti hlavy2 |
|
Časté: |
Závratě, parestezie, porucha chutě, hypestezie |
|
Méně časté: |
Migréna, somnolence, synkopa, periferní neuropatie, zhoršení paměti, ischias, syndrom neklidných nohou, třes, mozkové krvácení |
|
Vzácné: |
Zvýšený intrakraniální tlak, křeče, optická neuritida |
|
Není známo: |
Cerebrální edém* |
|
Poruchy oka | |
|
Časté: |
Otok očních víček, zvýšené slzení, krvácení do spojivky, konjunktivitida, syndrom suchého oka, rozmazané vidění |
|
Méně časté: |
Podráždění očí, bolesti očí, edém očnice, krvácení do bělimy, krvácení do sítnice, blefaritida, makulární edém |
|
Není známo: |
Krvácení do sklivce* |
|
Poruchy ucha a labyrintu | |
|
Méně časté: |
Vertigo, tinitus, ztráta sluchu |
|
Srdeční poruchy | |
|
Méně časté: |
Palpitace, tachykardie, městnavé srdeční selhání3, plicní edém |
|
Vzácné: |
Arytmie, atriální fibrilace, srdeční zástava, infarkt myokardu, angina pectoris, perikardiální výpotek |
|
Není známo: |
Perikarditida*, srdeční tamponáda* |
|
Cévní poruchy4 | |
|
Časté: |
Zrudnutí, krvácení |
|
Méně časté: |
Hypertenze, hematomy, subdurální hematom, periferní chlad, hypotenze, Raynaudův fenomén |
|
Není známo: |
T rombóza/ embolie * |
|
Respirační, hrudní a mediastinální poruchy | |
|
Časté: | |
|
Méně časté: |
Pleurální výpotek5, bolesti hrtanu/hltanu, faryngitida |
|
Vzácné: |
Bolest pohrudnice, plicní fibróza, plicní hypertenze, krvácení do plic |
|
Není známo: |
Akutní respirační selhání10*, intersticiální plicní onemocnění* |
|
Gastrointestinální poruchy | |
|
Velmi časté: | |
|
Časté: |
Nadýmání, rozpětí břicha, gastro-ezofageální reflux, zácpa, sucho v ústech, gastritida |
|
Méně časté: |
Stomatitida, ulcerace v ústech, gastrointestinální krvácení7, říhání, meléna, ezofagitida, ascites, žaludeční ulcerace, hematemeze, cheilitida, dysfagie, pankreatitida |
|
Vzácné: |
Kolitida, ileus, zánětlivé střevní onemocnění |
|
Není známo: |
Ileus/neprůchodnost střev*, gastrointestinální perforace*, divertikulitida*, gastrická antrální vaskulární ektázie (GAVE)* |
|
Poruchy jater a žlučových cest | |
|
Časté: |
Zvýšení jaterních enzymů |
|
Méně časté: |
Hyperbilirubinemie, hepatitida, žloutenka |
|
Vzácné: |
Jaterní selhání8, jaterní nekróza |
|
Poruchy kůže a podkožní tkáně | |
|
Velmi časté: |
Periorbitální edém, dermatitida/ekzém/vyrážka |
|
Časté: |
Pruritus, otok obličeje, suchá pleť, erytém, alopecie, noční pocení, reakce fotosensitivity |
|
Méně časté: |
Pustulózní vyrážka, zhmožděniny, zvýšené pocení, urtikarie, ekchymóza, zvýšená tendence k tvorbě podlitin, hypotrichóza, hypopigmentace kůže, exfoliativní dermatitida, lámání nehtů, folikulitida, petechie, lupénka, purpura, hyperpigmentace kůže, výsev puchýřků |
|
Vzácné: |
Akutní febrilní neutrofilní dermatóza (Sweet’s syndrome), ztráta barvy nehtů, angioneurotický edém, puchýřkovitá vyrážka, multiformní erytém, leukocytoklastická vaskulitida, Stevens-Johnsonův syndrom, akutní generalizovaná exantematózní pustulóza (AGEP) |
|
Není známo: |
Syndrom palmoplantární erytrodysestezie*, lichenoidní keratóza*, lichen planus*, toxická epidermální nekrolýza*, poléková vyrážka s eozinofilií a systémovými příznaky (DRESS)* |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | |
|
Velmi časté: |
Svalové křeče a záchvaty křečí, muskuloskeletární bolesti včetně myalgie, artralgie, bolesti kostí9 |
|
Časté: |
Otoky kloubů |
|
Méně časté: |
Kloubní a svalová ztuhlost |
|
Vzácné: |
Svalová slabost, artritida, rabdomyolýza/myopatie |
|
Není známo: |
Avaskulární nekróza/nekróza kyčle*, retardace růstu u dětí* |
|
Poruchy ledvin a močových cest | |
|
Méně časté: |
Bolesti ledvin, hematurie, akutní selhání ledvin, zvýšená frekvence močení |
|
Není známo: |
Chronické selhání ledvin |
|
Poruchy reprodukčního systému a prsu | |
|
Méně časté: |
Gynekomastie, erektilní dysfunkce, menoragie, nepravidelná menstruace, poruchy sexuální funkce, bolesti bradavek, zvětšení prsou, edém skrota |
|
Vzácné: |
Hemoragické žluté tělísko/hemoragické cysty na vaječní cích |
|
Celkové poruchy a reakce v místě aplikace | |
|
Velmi časté: |
Zadržování tekutin a edémy, únava |
|
Časté: |
Slabost, pyrexie, anasarka, mrazení, ztuhlost |
|
Méně časté: | |
|
Vyšetření | |
|
Velmi časté: |
Zvýšení hmotnosti |
|
Časté: |
Snížení hmotnosti |
|
Méně časté: |
Zvýšení koncentrace kreatininu v krvi, zvýšení kreatinfosfokinázy v krvi, zvýšení laktátdehydrogenázy v krvi, zvýšení alkalické fosfatázy v krvi |
|
Vzácné: |
Zvýšení amylázy v krvi |
* Tyto typy reakcí byly hlášeny po uvedení přípravku Glivec na trhu. Jsou zde zahrnuta spontánní hlášení nežádoucích účinků a také závažné nežádoucí účinky z pokračujících studií, programů rozšířeného přístupu k léčivému přípravku, studií klinické farmakologie a výzkumných studií v dosud neschválených indikacích. Protože tyto reakce jsou hlášeny z populace neurčitého rozsahu, není vždy možné spolehlivě odhadnout jejich četnost výskytu nebo stanovit kauzální vztah vůči expozici imatinibem.
1 Pneumonie byla nejčastěji hlášena u pacientů s transformovanou CML a u pacientů s GIST.
2 Bolesti hlavy byly nejčastější u pacientů s GIST.
3 Na podkladě hodnocení pacientoroků byly srdeční příhody včetně městnavého srdečního selhání pozorovány častěji u pacientů s transformovanou CML než u pacientů s chronickou CML.
4 Zrudnutí bylo nejčastější u pacientů s GIST a krvácení (hematomy, hemoragie) bylo nejčastější u pacientů s GIST a s transformovanou CML (CML-AP a CML-BC).
5 Pleurální výpotek byl častěji hlášen u pacientů s GIST a u pacientů s transformovanou CML (CML-AP a CML-BC) než u pacientů s chronickou CML.
6+7 Bolesti břicha a gastrointestinální krvácení byly nejčastěji pozorovány u pacientů s GIST.
8 Bylo hlášeno několik fatálních případů jaterního selhání a jaterních nekróz.
9 Muskuloskeletární bolesti a související příhody byly častěji pozorovány u pacientů s CML než u pacientů s GIST.
10 Fatální případy byly hlášeny u pacientů s pokročilým onemocněním, závažnými infekcemi, závažnou neutropenií a jinými závažnými konkomitantními stavy.
Změny hodnot laboratorních vyšetření Hematologie
U CML byly cytopenie, zvláště neutropenie a trombocytopenie, shodným nálezem ve všech studiích, s náznakem vyššího výskytu při vysokých dávkách > 750 mg (fáze I studie). Výskyt cytopenií byl však jasně závislý na stádiu onemocnění. Frekvence výskytu stupně 3 nebo 4 neutropenií (ANC
< 1,0 x 109/l) a trombocytopenií (počet destiček < 50 x 109/l) byly 4x a 6x častější v blastické krizi a akcelerované fázi onemocnění (59-64% pro neutropenii a 44-63% pro trombocytopenii) ve srovnání s nově diagnostikovanými pacienty s chronickou fází CML (16,7% neutropenií a 8,9% trombocytopenií). U nově diagnostikovaných pacientů s chronickou fází CML byl stupeň 4 neutropenie (ANC < 0,5 x 109/l) pozorován u 3,6% a trombocytopenie (počet destiček < 10 x 109/l) u
< 1% pacientů. Medián trvání neutropenické a trombocytopenické příhody byl obvykle v rozmezí od 2 do 3 týdnů a od 3 do 4 týdnů. Tyto příhody je možné obvykle zvládnout buď snížením dávky nebo
přerušením léčby Glivecem, ale ve vzácných případech mohou vést k trvalému přerušení léčby. U dětských pacientů s CML byla nejčastějším pozorovaným hematologickým nežádoucím účinkem cytopenie stupně 3 nebo 4, která zahrnovala neutropenii, trombocytopenii a anemii. Většinou se objevily během prvních několika měsíců léčby.
Ve studii u pacientů s inoperabilním a/nebo metastatickým GIST byl popsán stupeň 3 anemie u 5,4% a stupeň 4 u 0,7% pacientů, které mohly souviset, alespoň u některých pacientů, s gastrointestinálním krvácením nebo krvácením do nádoru. Stupeň 3 neutropenie byl pozorován u 7,5% pacientů a stupeň 4 u 2,7% pacientů a stupeň 3 trombocytopenie byl u 0,7% pacientů. U žádného pacienta se nevyvinul stupeň 4 trombocytopenie. Snížení počtu bílých krvinek (WBC) a neutrofilů se objevilo hlavně během prvních šesti týdnů léčby, potom zůstávaly hodnoty relativně stabilní.
Biochemie
Závažné zvýšení hodnot transamináz (< 5%) nebo bilirubinu (< 1%) bylo pozorováno u pacientů s CML a obvykle je bylo možné zvládnout snížením dávky nebo přerušením léčby (medián trvání těchto příhod byl přibližně jeden týden). Léčba byla z důvodů abnormálních laboratorních hodnot jaterních testů trvale přerušena u méně než 1% pacientů s CML. U pacientů s GIST (studie B2222), bylo pozorováno zvýšení ALT (alaninaminotransferáza) stupně 3 nebo 4 u 6,8% a zvýšení AST (aspartátaminotransferáza) stupně 3 nebo 4 u 4,8%. Zvýšení bilirubinu bylo méně než 3%.
Byly to případy cytolytické a cholestatické hepatitidy a jaterního selhání; některé z nich byly fatální, včetně jednoho pacienta užívajícího vysoké dávky paracetamolu.
Popis vybraných nežádoucích účinků
Reaktivace hepatitidy B
V souvislosti s tyrosinkinázou bcr-abl byla zaznamenána reaktivace hepatitidy B. Některé případy vyústily v akutní selhání jater nebo ve fulminantní hepatitidu vedoucí k transplantaci jater nebo došlo k úmrtí pacienta (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Zkušenosti s dávkami vyššími než doporučená terapeutická dávka jsou omezené. Jednotlivé případy předávkování Glivecem byly hlášeny spontánně a v literatuře. V případě předávkování by měl být pacient pozorován a odpovídajícím způsobem léčen podpůrnou léčbou. Obecně byl v těchto případech hlášen výsledek „zlepšený“ nebo „vyléčený“. Následující příhody byly hlášeny při podání různých rozmezí dávky:
Dospělá populace
1200 až 1600 mg (délka trvání 1 až 10 dní): Nauzea, zvracení, průjem,vyrážka, zrudnutí kůže, edém, otoky, únava, svalové křeče, trombocytopenie, pancytopenie, bolest břicha, bolest hlavy, snížená chuť k jídlu.
1800 až 3200 mg (dosáhlo až 3200 mg denně po dobu 6 dnů): Slabost, myalgie, zvýšená hodnota kreatinfosfokinázy, zvýšená hodnota bilirubinu, gastrointestinální bolest.
6400 mg (jednotlivá dávka): V literatuře hlášený případ jednoho pacienta, u kterého se objevila nauzea, zvracení, bolest břicha, pyrexie, otok obličeje, snížený počet neutrocytů, zvýšení hodnot transamináz.
8 až 10 g (jednotlivá dávka): Bylo hlášené zvracení a gastrointestinální bolest.
Pediatrická populace
U 3letého chlapce, kterému byla podána jednotlivá dávka 400 mg, se objevilo zvracení, průjem a anorexie, u dalšího 3letého chlapce, kterému byla podána jednotlivá dávka 980 mg, byl zjištěn snížený počet bílých krvinek a průjem.
V případě předávkování by měl být pacient pozorován a vhodně léčen podpůrnou léčbou.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: inhibitor protein-tyrosinkinázy, ATC kód: L01XE01 Mechanismus účinku
Imatinib je nízkomolekulární inhibitor tyrosinkinázy, který účinně inhibuje aktivitu BCR-ABL tyrosinkinázy (TK) a dalších receptorových tyrosinkináz: KIT, receptor pro růstový faktor kmenových buněk (SCF, stem cell factor) kódovaný protoonkogenem c-Kit, receptory discoidinové domény (DDR1 and DDR2), receptor kolonie stimulujícího faktoru (CSF-1R) a receptory pro destičkový růstový faktor alfa a beta (PDGFR-alfa a PDGFR-beta). Imatinib také může inhibovat buněčné procesy, na kterých se tyto receptorové kinázy podílí.
Farmakodynamické účinky
Imatinib je inhibitor tyrosinkinázy, který účinně inhibuje Bcr-Abl tyrosinkinázu na buněčné úrovni in vitro i in vivo. Látka selektivně inhibuje proliferaci a indukuje apoptózu u Bcr-Abl pozitivních buněčných linií, stejně jako u čerstvých leukemických buněk od pacientů s CML s pozitivním Philadelphia chromozomem a od pacientů s akutní lymfoblastickou leukemií (ALL).
In vivo byl na zvířecích modelech s Bcr-Abl pozitivními nádorovými buňkami při monoterapii pozorován protinádorový účinek této látky.
Imatinib je také inhibitor receptorů tyrosinkinázy pro růstový faktor destiček - platelet-derived growth factor (PDGF), PDGF-R, faktoru kmenových buněk - stem cell factor (SCF), c-Kit, a inhibuje PDGF-a SCF-zprostředkované buněčné pochody. In vitro, imatinib inhibuje proliferaci a indukuje apoptózu gastrointestinálních stromálních nádorových buněk (GIST), které mají schopnost aktivovat kit mutaci. Konstitutivní aktivace receptorů pro PDGF či Abl proteinu tyrosinkinázy jako následek spojení rozdílných partnerských proteinů či konstitutivní produkce PDGF zřejmě hraj í roli v patogenezi MDS/MPD, HES/CEL a DFSP. Imatinib inhibuje signalizaci a proliferaci buněk ovlivňovaných porušenou regulací aktivity PDGFR a Abl kinázy.
Klinické studie u chronické myeloidní leukemie
Účinnost Glivecu je založena na míře celkové hematologické a cytologické odpovědi a doby přežití bez progrese onemocnění. Kromě nově diagnostikované chronické fáze CML nejsou k dispozici kontrolované klinické studie, které by demonstrovaly klinický přínos, jako je zlepšení projevů onemocnění nebo prodloužení přežití.
Tři velké, mezinárodní, otevřené, nekontrolované studie fáze II byly provedeny u pacientů s pozitivním Philadelphia chromozomem (Ph+) s pokročilou CML, blastickou nebo akcelerovanou fází onemocnění, jinými Ph+ leukemiemi nebo s CML v chronické fázi, ale kde selhala předchozí léčba interferonem-alpha (IFN). Jedna velká, otevřená, multicentrická, mezinárodní randomizovaná studie fáze III byla provedena u pacientů s nově diagnostikovanou Ph+ CML. Navíc děti byly léčeny ve dvou studiích fáze I a v jedné studii fáze II.
Ve všech klinických studiích bylo 38-40% pacientů ve věku > 60 let a 10-12% pacientů bylo ve věku > 70 let.
Chronická fáze, nově diagnostikovaná: Studie fáze III u dospělých pacientů srovnávala léčbu Glivecem v monoterapii s kombinovanou léčbou interferonem-alpha (IFN) a cytarabinem (Ara-C). Bylo dovoleno, aby pacienti, u kterých nebylo dosaženo léčebné odpovědi (chybění kompletní hematologické odpovědi (CHR) v 6. měsíci, zvýšení počtu bílých krvinek, bez velké cytogenetické odpovědi (MCyR) ve 24. měsíci), se ztrátou odpovědi (CHR nebo MCyR) nebo se závažnou intolerancí léčby, byli převedeni do alternativního ramene léčby. V rameni s Glivecem byli pacienti léčeni dávkou 400 mg denně. V rameni s IFN byli pacienti léčeni s cílovou dávkou IFN 5 MIU/m2/den subkutánně v kombinaci se subkutánním podáním Ara-C 20 mg/m2/den po 10 dnů/měsíc.
Celkem bylo randomizováno 1 106 pacientů, 553 do každého ramene. Výchozí charakteristiky byly mezi oběma rameny dobře vyvážené. Medián věku byl 51 let (rozmezí 18-70 let), 21,9% pacientů bylo ve věku > 60 let. Bylo zde 59% mužů a 41% žen; 89,9% pacientů bylo bílé pleti a 4,7% černé pleti. Po sedmi letech od zařazení posledního pacienta byl medián trvání léčby v první linii 82 měsíců v rameni s Glivecem a 8 měsíců v rameni s IFN. Medián trvání léčby v druhé linii byl 64 měsíců v rameni s Glivecem. Souhrnně u pacientů,léčených Glivecem v první linii byla průměrná podávaná denní dávka 406 ± 76 mg. Primárním cílovým parametrem účinnosti ve studii bylo přežití bez progrese onemocnění. Progrese byla definována jako jakákoliv z následujících událostí: progrese do akcelerované fáze nebo blastické krize, úmrtí, ztráta CHR nebo MCyR, nebo u pacientů, kteří nedosáhli CHR, zvýšení počtu bílých krvinek navzdory přiměřené léčbě. Velká cytogenetická odpověď, hematologická odpověď, molekulární odpověď (hodnocení minimálního reziduálního onemocnění) doba do akcelerované fáze nebo blastické krize a přežívání j sou hlavními sekundárními cílovými parametry. Údaje o odpovědích jsou uvedeny v Tabulce 2.
Tabulka 2 Odpovědi na léčbu ve studii u nově diagnostikované CML (84měsíční data)
|
(Nejlepší míra odpovědi) |
Glivec n=553 |
IFN+Ara-C n=553 |
|
Hematologická odpověď | ||
|
Míra CHR n (%) |
534 (96,6%)* |
313 (56,6%)* |
|
[95% CI] |
[94,7%, 97,9%] |
[52,4%, 60,8%] |
|
Cytogenetická odpověď | ||
|
Velká odpověď n (%) |
490 (88,6%)* |
129 (23,3%)* |
|
[95% CI] |
[85,7%, 91,1%] |
[19,9%, 27,1%] |
|
Kompletní CyR n (%) |
456 (82,5%)* |
64 (11,6%)* |
|
Parciální CyR n (%) |
34 (6,1%) |
65 (11,8%) |
|
Molekulární odpověď** | ||
|
Velká odpověď ve 12. měsíci (%) |
153/305=50,2% |
8/83=9,6% |
|
Velká odpověď ve 24. měsíci (%) |
73/104=70,2% |
3/12=25% |
|
Velká odpověď v 84. měsíci (%) |
102/116=87,9% |
3/4=75% |
* p<0,001, Fischerův test významnosti
** procenta molekulární odpovědi jsou založená na dostupných vzorcích
Kritéria hematologické odpovědi (všechny odpovědi byly potvrzeny po > 4 týdnech):
Bílé krvinky < 10 x 109/l, krevní destičky < 450 x 109/l, myelocyty+metamyelocyty < 5% v krvi, žádné blasty a promyelocyty v krvi, basofily < 20%, žádné extramedulární postižení Kriteria cytogenetické odpovědi: kompletní (0% Ph+ metafáze), parciální (1-35%), malá (36-65%) nebo minimální (66-95%). Velká odpověď (0-35%) kombinuje obě odpovědi - kompletní a parciální. Kritéria velké molekulární odpovědi: v periferní krvi > 3-logaritmové snížení množství Bcr-Abl transkriptů (měřeno pomocí testu kvantitativní polymerázové řetězové reakce (PCR) reverzní transkriptázy v reálném čase) proti standardizované výchozí hodnotě._
Míra kompletní hematologické odpovědi, velké cytogenetické odpovědi a kompletní cytogenetické odpovědi na první linii léčby byla stanovena použitím Kaplan-Meierova postupu, pro který byly nedosažené odpovědi vyřazeny v den posledního vyšetření. S použitím tohoto postupu se stanovená kumulativní míra odpovědi v první linii léčby Glivecem zlepšila od 12. měsíce léčby do 84. měsíce léčby následovně: CHR z 96,4% na 98,4% a CCyR z 69,5% na 87,2%.
Při 7letém sledování bylo v rameni s Glivecem 93 (16,8%) příhod progrese: v 37 (6,7%) případech se jednalo o progresi do akcelerované fáze/blastické krize, v 31 (5,6%) o ztrátu MCyR, v 15 (2,7%) o ztrátu CHR nebo zvýšení WBC a v 10 (1,8%) o úmrtí nesouvisejících s CML. Naproti tomu bylo v rameni s IFN+Ara-C 165 (29,8%) příhod, z nichž 130 se vyskytlo během léčby IFN+Ara-C v první linii.
Odhadovaný podíl pacientů bez progrese do akcelerované fáze nebo blastické krize v 84. měsíci byl významně vyšší v rameni s Glivecem ve srovnání s ramenem s IFN (92,5% proti 85,1%, p<0,001). Roční míra progrese do akcelerované fáze nebo blastické krize se v průběhu léčby snižovala a ve čtvrtém a pátém roce byla menší než 1% za rok. Odhadovaná míra přežití bez progrese v 84. měsíci byla 81,2% v rameni s Glivecem a 60,6% u kontrolní skupiny (p<0,001). Roční míra progrese jakéhokoli typu se pro Glivec rovněž snižovala s časem.
Celkem ve skupině s Glivecem zemřelo 71 pacientů (12,8%) a 85 pacientů (15,4%) ve skupině s IFN+Ara-C. V 84. měsíci bylo celkové přežití ve skupině s Glivecem 86,4% (83, 90) oproti 83,3% (80, 87) ve skupině s IFN+Ara-C, (p=0,073, log-rank test). Cílový parametr „doba do výskytu příhody“ je výrazně ovlivněn vysokým podílem převedení z léčby IFN+Ara-C na léčbu Glivecem. Vliv léčby Glivecem na přežití v chronické fázi onemocnění nově diagnostikované CML byl dále zkoumán v retrospektivní analýze výše uvedených údajů o Glivecu s původními údaji z jiné studie fáze III, kde byl použit stejný léčebný režim IFN+Ara-C (n=325). V této retrospektivní analýze byly prokázány lepší výsledky celkového přežití (p<0,001) při podávání Glivecu oproti IFN+Ara-C; během 42 měsíců zemřelo 47 (8,5%) pacientů s Glivecem oproti 63 (19,4%) pacientům s IFN+Ara-C.
U pacientů léčených Glivecem měl stupeň dosažené cytogenetické odpovědi a molekulární odpovědi jednoznačný vliv na dlouhodobé výsledky léčby. Zatímco 96% (93%) pacientů s CCyR (PCyR) ve 12. měsíci, bylo v 84. měsíci bez progrese do akcelerované fáze/blastické krize, bylo bez progrese do pokročilé CML v 84 měsících pouze 81% pacientů bez MCyR ve 12 měsících (p<0,001 celkově, p=0,25 mezi CCyR a PCyR). U pacientů s nejméně 3-log redukcí Bcr-Abl transkriptů ve 12 měsících léčby, byla pravděpodobnost setrvání bez progrese do akcelerované fáze/blastické krize v 84 měsících 99%. Podobná zjištění byla shledána v analýze 18 měsíců léčby.
V této studii bylo povolené zvýšení dávky ze 400 mg denně na 600 mg denně, a potom ze 600 mg denně na 800 mg denně. Po 42 měsících sledování došlo u 11 pacientů k potvrzené ztrátě jejich cytogenetické odpovědi (během 4 týdnů). Z těchto 11 pacientů byla u 4 zvýšena dávka až na 800 mg denně, dva z nich znovu dosáhli cytogenetické odpovědi (jeden částečné a jeden kompletní, ten později dosáhl také molekulární odpovědi). Zatímco u 7 pacientů, kterým nebyla zvýšena dávka, pouze jeden dosáhl kompletní cytogenetické odpovědi. Procento výskytu některých nežádoucích účinků bylo vyšší u 40 pacientů, kterým byla dávka zvýšena na 800 mg denně, ve srovnání s populací pacientů před zvýšením dávky (n=551). Častější nežádoucí účinky zahrnovaly gastrointestinální krvácení, konjunktivitidu a zvýšení transamináz a bilirubinu. Další nežádoucí účinky byly hlášeny
s menší nebo se stejnou frekvencí.
Chronická fáze, selhání léčby interferonem: 532 dospělých pacientů bylo léčeno úvodní dávkou 400 mg. Pacienti byli rozděleni do tří hlavních kategorií: hematologické selhání (29%), cytogenetické selhání (35%), nebo intolerance interferonu (36%). Medián doby, po kterou pacienti užívali předchozí léčbu IFN v dávce > 25 x 106 IU/týden, byl 14 měsíců a všichni byli v pozdní chronické fázi, medián doby od diagnózy byl 32 měsíců. Základním parametrem účinnosti ve studii byla míra velké cytogenetické odpovědi (kompletní a parciální odpověď, 0 až 35% Ph+ metafází v kostní dřeni).
V této studii dosáhlo 65% pacientů velké cytogenetické odpovědi, která byla kompletní u 53% (potvrzeno 43%) pacientů (Tabulka 3). Kompletní hematologické odpovědi bylo dosaženo u 95% pacientů.
Akcelerovaná fáze: Do studie bylo zařazeno 235 dospělých pacientů s akcelerovanou fází onemocnění. Léčba prvních 77 pacientů byla zahájena dávkou 400 mg, následně byl protokol doplněn a dovoloval podání vyšších dávek, zahajovací dávka pro zbývajících 158 pacientů byla 600 mg.
Základním parametrem účinnosti byla míra hematologické odpovědi, udávaná jako buď kompletní hematologická odpověď, žádný průkaz leukemie (tj. vymizení blastů z kostní dřeně a krve, ale bez úplné obnovy periferní krve jako při kompletní odpovědi), nebo návrat do chronické fáze CML. Potvrzené hematologické odpovědi bylo dosaženo u 71,5% pacientů (Tabulka 3). Důležité je, že 27,7% pacientů dosáhlo také hlavní cytogenetické odpovědi, která byla kompletní u 20,4% (potvrzena u 16%) pacientů. U pacientů léčených dávkou 600 mg, byl aktuální odhad mediánu přežití bez progrese 22,9 měsíců a celkového přežití 42,5 měsíce.
Myeloidní blastická krize: Do studie bylo zařazeno 260 pacientů s myeloidní blastickou krizí. 95 (37%) pacientů mělo předchozí chemoterapii buď pro akcelerovanou fázi nebo blastickou krizi („předléčení pacienti“), zatímco 165 (63%) pacientů nebylo dosud léčeno („neléčení pacienti“). Léčba prvních 37 pacientů byla zahájena dávkou 400 mg, následně byl protokol doplněn a dovoloval podání vyšších dávek, zahajovací dávka pro zbývajících 223 pacientů byla 600 mg.
Základním parametrem účinnosti, při použití stejných kritérií jako ve studii u akcelerované fáze, byla míra dosažení hematologické odpovědi, popisovaná buď jako kompletní hematologická odpověď, žádný průkaz leukemie, nebo návrat do chronické fáze CML. V této studii dosáhlo 31% pacientů hematologické odpovědi (36% u dříve neléčených pacientů a 22% u dříve léčených pacientů). Míra dosažených odpovědi byla vyšší u pacientů léčených dávkou 600 mg (33%) ve srovnání s pacienty, kteří dostávali dávku 400 mg (16%, p=0,0220). Aktuální odhadovaný medián přežití dříve neléčených pacientů byl 7,7 měsíců a předléčených pacientů byl 4,7 měsíců.
Lymfoidní blastická krize: Do studie fáze I byl zařazen omezený počet pacientů (n=10). Míra dosažené hematologické odpovědi byla 70% s trváním 2-3 měsíce.
Tabulka 3 Odpovědi ve studiích dospělých pacientů s CML
|
Studie 0110 37měsíční data Chronická fáze, IFN selhání (n=532) |
Studie 0109 40,5měsíční data Akcelerovaná fáze (n=235) |
Studie 0102 38měsíční data Myeloidní blastická krize (n=260) | |
|
% pacientů (CI95%) | |||
|
Hematologická odpověď1 Kompletní hematologická odpověď (CHR) Bez průkazu leukemie (NEL) Návrat do chronické fáze (RTC) |
95% (92,3-96,3) 95% Neaplikovatelné Neaplikovatelné |
71% (65,3-77,2) 42% 12% 17% |
31% (25,2-36,8) 8% 5% 18% |
|
Velká cytogenetická odpověď2 Kompletní (Potvrzeno3) [95% CI] Parciální |
65% (61,2-69,5) 53% (43%) [38,6-47,2] 12% |
28% (22,0-33,9) 20% (16%) [11,3-21,0] 7% |
15% (11,2-20,4) 7% (2%) [0,6-4,4] 8% |
|
1 Kritéria hematologické odpovědi (všechny odpovědi byly potvrzeny za > 4 týdny): CHR Studie 0110 [Počet bílých krvinek < 10 x 109/l, krevní destičky < 450 x 109/l, myelocyty+metamyelocyty < 5% v krvi, žádné blasty ani promyelocyty v krvi, basofily < 20%, žádné extramedulární postižení] a ve studiích 0102 a 0109 [ANC > 1,5 x 109/l, krevní destičky > 100 x 109/l, žádné blasty v krvi, BM blasty < 5% a žádné extramedulární postižení] NEL stejná kritéria jako pro CHR ale ANC > 1 x 109/l a destičky > 20 x 109/l (0102 a 0109 pouze) RTC < 15% blastů v BM a PB, < 30% blastů+promyelocytů v BM a PB, < 20% basofilů v PB, žádné jiné extramedulární postižení než ve slezině a játrech (pouze pro 0102 a 0109). BM = Kostní dřeň, PB = periferní krev 2 Kritéria cytogenetické odpovědi: Velká odpověď se skládá jak z kompletní tak i parciální odpovědi: kompletní (0% Ph+ metafáze), parciální (1-35%) 3 Kompletní cytogenetická odpověď potvrzena druhým cytogenetickým hodnocením kostní dřeně provedeným nejméně jeden měsíc po počátečním vyšetření kostní dřeně. | |||
Pediatričtí pacienti: Do studie fáze I zvyšování dávky bylo zahrnuto celkem 26 dětských pacientů ve věku < 18 let buď s chronickou fází CML (n=11) nebo CML v blastické krizi nebo Ph+ akutními leukemiemi (n=15). Byla to populace silně předléčených pacientů, protože 46% bylo dříve léčeno BMT a 73% dostávalo předchozí mnohočetnou chemoterapii. Pacienti byli léčeni dávkami Glivecu 260 mg/m2/den (n=5), 340 mg/m2/den (n=9), 440 mg/m2/den (n=7) a 570 mg/m2/den (n=5). Z 9 pacientů s chronickou fází CML a dostupnými cytogenetickými údaji, dosáhli 4 (44%) kompletní a 3 (33%) parciální cytogenetické odpovědi, míra MCyR 77%.
Do otevřené, multicentrické, jednoramenné studie fáze II bylo zařazeno celkem 51 pediatrických pacientů s nově diagnostikovanou neléčenou CML v chronické fázi. Pacienti byli léčeni Glivecem 340 mg/m2/den bez přerušení při absenci dávku limitující toxicity. Léčba Glivecem vyvolala rychlou odpověď u nově diagnostikovaných dětských pacientů s CML s CHR 78% po 8 týdnech léčby. Vysoká míra CHR byla doprovázena rozvojem kompletní cytogenetické odpovědi (CCyR) u 65%, což je srovnatelné s výsledky pozorovanými u dospělých pacientů. Dodatečně parciální cytogenetická odpověď (PCyR) byla pozorována u 16%, McyR 81%. U většiny pacientů, kteří dosáhli kompletní cytogenetické odpovědi (CCyR), se CCyR vyvinula mezi 3. a 10. měsícem léčby s mediánem času do dosažení odpovědi 5,6 měsíců podle Kaplan-Meierova odhadu.
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s Glivecem u všech podskupin pediatrické populace s Philadelphia chromozom pozitivní (translokace bcr-abl) chronickou myeloidní leukemií (informace o použití u dětí viz bod 4.2).
Klinické studie u Ph+ ALL
Nově diagnostikovaná Ph+ ALL: V kontrolované studii (ADE10), ve které byl porovnáván imatinib s indukční chemoterapií u 55 nově diagnostikovaných pacientů ve věku 55 let a starších, imatinib podávaný jako monoterapie navodil významně vyšší míru kompletních hematologických odpovědí než chemoterapie (96,3% vs. 50%; p=0,0001). Podání imatinibu jako záchranné terapie pacientům, kteří neodpovídali na chemoterapii nebo jejichž odpověď na chemoterapii byla nedostatečná, vedlo u 9 pacientů (81,8%) z celkového počtu 11 pacientů k dosažení kompletní hematologické odpovědi. Tento klinický účinek byl po 2 týdnech léčby spojen s vyšší redukcí bcr-abl transkriptů u pacientů léčených imatinibem než v rameni s chemoterapií (p=0,02). Po fázi indukce všichni pacienti dostávali imatinib a konsolidační chemoterapii (viz Tabulka 4) a po 8 týdnech byly hladiny bcr-abl transkriptů stejné v obou ramenech. Jak se očekávalo na základě designu studie, nebyl pozorován žádný rozdíl v době trvání remise, v přežití bez známek onemocnění nebo celkovém přežití, ačkoliv pacienti s kompletní molekulární odpovědí a trvajícím minimálním reziduálním onemocněním měli lepší výsledek, pokud šlo o dobu trvání remise (p=0,01) a přežití bez známek onemocnění (p=0,02).
Výsledky pozorované ve skupině 211 nově diagnostikovaných pacientů s Ph+ ALL ve čtyřech nekontrolovaných klinických studiích (AAU02, ADE04, AJP01 a AUS01) jsou shodné s výsledky popsanými výše. Podávání imatinibu v kombinaci s indukční chemoterapií (viz Tabulka 4) vedlo k dosažení kompletní hematologické odpovědi u 93% (147 ze 158 hodnotitelných pacientů) a k dosažení velké cytogenetické odpovědi u 90% (19 z 21 hodnotitelných pacientů). Míra kompletní molekulární odpovědi byla 48% (49 z 102 hodnotitelných pacientů). Ve dvou studiích (AJP01 a AUS01) přežití bez známek onemocnění (DFS) a celkové přežití (OS) konstantně převyšovaly 1 rok a tyto výsledky byly lepší oproti historickým kontrolám. (DFS p<0,001; OS p<0,01).
Tabulka 4 Chemoterapeutický režim užívaný v kombinaci s imatinibem
|
Studie ADE10 | |
|
Prefáze |
DEX 10 mg/m2 perorálně, den 1-5; CP 200 mg/m2 i.v., den 3, 4, 5; MTX 12 mg intratekálně, den 1 |
|
Indukce remise |
DEX 10 mg/m2 perorálně, den 6-7, 13-16; VCR 1 mg i.v., den 7, 14; IDA 8 mg/m2 i.v. (0,5 h), den 7, 8, 14, 15; CP 500 mg/m2 i.v.(1 h) den 1; Ara-C 60 mg/m2 i.v., den 22-25, 29-32 |
|
Konsolidační terapie |
MTX 500 mg/m2 i.v. (24 h), den 1, 15; |
|
I, iii, V |
6-MP 25 mg/m2 perorálně, den 1-20 |
|
Konsolidační terapie |
Ara-C 75 mg/m2 i.v. (1 h), den 1-5; |
|
II, IV |
VM26 60 mg/m2 i.v. (1 h), den 1-5 |
|
Indukční terapie (de novo Ph+ ALL) |
Daunorubicin 30 mg/m2 i.v., den 1-3, 15-16; VCR 2 mg celková dávka i.v., den 1, 8, 15, 22; CP 750 mg/m2 i.v., den 1, 8; Prednison 60 mg/m2 perorálně, den 1-7, 15-21; IDA 9 mg/m2 perorálně, den 1-28; MTX 15 mg intratekálně, den 1, 8, 15, 22; Ara-C 40 mg intratekálně, den 1, 8, 15, 22; Methylprednisolon 40 mg intratekálně, den 1, 8, 15, 22 |
|
Konsolidace (de novo Ph+ ALL) |
Ara-C 1 000 mg/m2/12 h i.v.(3 h), den 1-4; Mitoxantron 10 mg/m2 i.v. den 3-5; MTX 15 mg intratekálně, den 1; Methylprednisolon 40 mg intratekálně, den 1 |
Studie ADE04
|
Prefáze |
DEX 10 mg/m2 perorálně, den 1-5; CP 200 mg/m2 i.v., den 3-5; MTX 15 mg intratekálně, den 1 |
|
Indukční terapie I |
DEX 10 mg/m2 perorálně, den 1-5; VCR 2 mg i.v., den 6, 13, 20; Daunorubicin 45 mg/m2 i.v., den 6-7, 13-14 |
|
Indukční terapie II |
CP 1 g/m2 i.v. (1 h), den 26, 46; Ara-C 75 mg/m2 i.v. (1 h), den 28-31, 35-38, 42-45; 6-MP 60 mg/m2 perorálně, den 26-46 |
|
Konsolidační terapie |
DEX 10 mg/m2 perorálně, den 1-5; vindesin 3 mg/m2 i.v., den 1; MTX 1,5 g/m2 i.v. (24 h), den 1; Etoposid 250 mg/m2 i.v. (1 h) den 4-5; Ara-C 2x 2 g/m2 i.v. (3 h, q 12 h), den 5 |
Studie AJP01
|
Indukční terapie |
CP 1,2 g/m2 i.v. (3 h), den 1; Daunorubicin 60 mg/m2 i.v. (1 h), den 1-3; Vinkristin 1,3 mg/m2 i.v., den 1, 8, 15, 21; Prednisolon 60 mg/m2/den perorálně |
|
Konsolidační terapie |
Alternativní chemoterapeutický postup: vysoká dávka chemoterapie s MTX 1 g/m2 i.v. (24 h), den 1, a Ara-C 2 g/m2 i.v. (q 12 h), den 2-3, po 4 cyklech |
|
Udržovací terapie |
VCR 1,3 g/m2 i.v., den 1; Prednisolon 60 mg/m2 perorálně, den 1-5 |
Indukční- Hyper-CVAD režim: CP 300 mg/m2 i.v. (3 h, q 12 h), den 1-3;
konsolidační terapie Vinkristin 2 mg i.v., den 4, 11;
Doxorubicin 50 mg/m2 i.v. (24 h), den 4;
DEX 40 mg/den po dnech 1-4 a 11-14, střídavě s MTX 1 g/m2 i.v. (24 h), den 1, Ara-C 1 g/m2 i.v. (2 h, q 12 h), den 2-3 (celkově 8 léčebných kúr)
Udržovací terapie VCR 2 mg i.v. měsíčně po dobu 13 měsíců;
Prednisolon 200 mg perorálně, 5 dnů za měsíc po dobu 13 měsíců Všechny léčebné režimy zahrnují podávání kortikosteroidů pro profylaxi postižení CNS.
Ara-C: cytosin arabinosid; CP: cyclofosfamid; DEX: dexamethason; MTX: methotrexát; 6-MP: 6-merkaptopurin; VM26: teniposid; VCR: vinkristin; IDA: idarubicin; i.v.: intravenózně
Pediatričtí pacienti: Do otevřené, multicentrické, nerandomizované studie I2301 fáze III se sekvenčními kohortami bylo zařazeno celkem 93 pediatrických, dospívajících a mladých dospělých pacientů (od 1 do 22 let věku) s Ph+ ALL, kteří byli léčeni Glivecem (340 mg/m2/den) v kombinaci s intenzivní chemoterapií po indukční terapii. Glivec byl podáván intermitentně v kohortách 1-5 s prodlužujícím se trváním a časnějším zahájením léčby Glivecem; kohorta 1 používala nejnižší intenzitu a kohorta 5 používala nejvyšší intenzitu Glivecu (nejdelší trvání ve dnech s kontinuálním dávkováním Glivecu již během prvních léčebných cyklů chemoterapie). Kontinuální denní časná expozice Glivecem v průběhu léčby v kombinaci s chemoterapií u pacientů v kohortě 5 (n=50) zlepšila 4leté přežití bez událostí (EFS) v porovnání s historickými kontrolami (n=120), které používaly standardní chemoterapii bez Glivecu (69,6 % oproti 31,6 %). Odhadované 4leté celkové přežití v pacientské kohortě 5 bylo 83,6 % v porovnání s 44,8% u historické kontroly. 20 pacientům z 50 (40 %) v kohortě 5 byla provedena transplantace hematopoetických kmenových buněk.
Tabulka 5 Chemoterapeutické režimy používané ve studii I2301 v kombinaci s imatinibem
|
Konsolidační cyklus 1 (3 týdny) |
VP-16 (100 mg/m2/den, IV): dny 1-5 Ifosfamid (1,8 g/m2/den, IV): dny 1-5 MESNA (360 mg/m2/dávka q3h, x 8 dávky/den, IV): dny 1-5 G-CSF (5 pg/kg, SC): dny 6-15 nebo do ANC > 1500 po dosažení nejnižší hodnoty IT léčba methotrexátem (přizpůsobená věku): POUZE den 1 Trojnásobná IT léčba (přizpůsobená věku): den 8, 15 |
|
Konsolidační cyklus 2 (3 týdny) |
Methotrexát (5 g/m2 v průběhu 24 hodin, IV): den 1 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2 a 3 Trojnásobná IT léčba (přizpůsobená věku): den 1 ARA-C (3 g/m2/dávku q 12 h x 4, IV): dny 2 a 3 G-CSF (5 pg/kg, SC): dny 4-13 nebo do ANC > 1500 po dosažení nejnižší hodnoty |
|
Reindukční cyklus 1 (3 týdny) |
VCR (1,5 mg/m2/den, IV): dny 1, 8, a 15 DAUN (45 mg/m2/den jako bolus, IV): dny 1 a 2 CPM (250 mg/m2/dávku q12h x 4 dávky, IV): dny 3 a 4 PEG-ASP (2500 IU/m2, IM): den 4 G-CSF (5 pg/kg, SC): dny 5-14 nebo do ANC > 1500 po dosažení nejnižší hodnoty Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 15 DEX (6 mg/m2/den, PO): dny 1-7 a 15-21 |
|
Intenzifikační cyklus 1 (9 týdnů) |
Methotrexát (5 g/m2 v průběhu 24 hodin, IV): dny 1 a 15 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2, 3, 16, a 17 Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 22 VP-16 (100 mg/m2/den, IV): dny 22-26 CPM (300 mg/m2/den, IV): dny 22-26 MESNA (150 mg/m2/den, IV): dny 22-26 G-CSF (5 pg/kg, SC): dny 27-36 nebo do ANC > 1500 po dosažení nejnižší hodnoty ARA-C (3 g/m2, q12h, IV): dny 43, 44 L-ASP (6000 IU/m2, IM): den 44 |
|
Reindukční cyklus 2 (3 týdny) |
VCR (1,5 mg/m2/den, IV): dny 1, 8 a 15 DAUN (45 mg/m2/den jako bolus, IV): dny 1 a 2 CPM (250 mg/m2/dávku q12h x 4 dávky, iv): dny 3 a 4 PEG-ASP (2500 IU/m2, IM): den 4 G-CSF (5 pg/kg, SC): dny 5-14 nebo do ANC > 1500 po dosažení nejnižší hodnoty Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 15 DEX (6 mg/m2/den, PO): dny 1-7 a 15-21 |
|
Intenzifikační cyklus 2 (9 týdnů) |
Methotrexát (5 g/m2 v průběhu 24 hodin, IV): dny 1 a 15 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2, 3, 16 a 17 Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 22 VP-16 (100 mg/m2/den, IV): dny 22-26 CPM (300 mg/m2/den, IV): dny 22-26 MESNA (150 mg/m2/den, IV): dny 22-26 G-CSF (5 pg/kg, SC): dny 27-36 nebo do ANC > 1500 post nadir ARA-C (3 g/m2, q12h, IV): dny 43, 44 L-ASP (6000 IU/m2, IM): den 44 |
|
Udržovací terapie (8týdenní cykly) Cykly 1-4 |
MTX (5 g/m2 v průběhu 24 hodin, IV): den 1 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2 a 3 Trojnásobná IT léčba (přizpůsobená věku): dny 1, 29 VCR (1,5 mg/m2, IV): dny 1, 29 DEX (6 mg/m2/den PO): dny 1-5; 29-33 6-MP (75 mg/m2/den, PO): dny 8-28 Methotrexát (20 mg/m2/týden, PO): dny 8, 15, 22 VP-16 (100 mg/m2, IV): dny 29-33 CPM (300 mg/m2, IV): dny 29-33 MESNA IV dny 29-33 G-CSF (5 pg/kg, SC): dny 34-43 |
|
Udržovací terapie (8týdenní cykly) Cyklus 5 |
Ozařování krania (pouze Blok 5) 12 Gy v 8 frakcích pro všechny pacienty s CNS1 a CNS2 v diagnóze 18 Gy v 10 frakcích pro pacienty s CNS3 v diagnóze VCR (1,5 mg/m2/den, IV): dny 1, 29 DEX (6 mg/m2/den, PO): dny 1-5; 29-33 6-MP (75 mg/m2/den, PO): dny 11-56 (Vysazení 6-MP během 6-10 dní ozařování krania počínaje prvním dnem cyklu 5. Započněte léčbu 6-MP první den po dokončení ozařování krania.) Methotrexát (20 mg/m2/týden, PO): dny 8, 15, 22, 29, 36, 43, 50 |
|
Udržovací terapie |
VCR (1,5 mg/m2/den, IV): dny 1, 29 |
|
(8týdenní cykly) |
DEX (6 mg/m2/den, PO): dny 1-5; 29-33 |
|
Cykly 6-12 |
6-MP (75 mg/m2/den, PO): dny 1-56 |
|
Methotrexát (20 mg/m2/týden, PO): dny 1, 8, 15, 22, 29, 36, 43, 50 |
G-CSF = růstový hormon pro granulocytámí řadu leukocytů, VP-16 = etoposid, MTX = methotrexát, IV = intravenózní, SC = subkutánní, IT = intratekální, PO = perorální, IM = intramuskulární, ARA-C = cytarabin, CPM = cyklofosfamid, VCR = vinkristin, DEX = dexamethason, DAUN = daunorubicin, 6-MP = 6-merkaptopurin, E.Coli L-ASP = L-asparagináza, PEG-ASP = PEG asparagináza, MESNA= natrium-2-sulfanylethan -1- sulfonát, iii= nebo pokud je hladina MTX do < 0,1 pM, q6h = každých 6 hodin, Gy= Gray
Studie AIT07 byla multicentrická, otevřená, randomizovaná studie fáze II/III, do které bylo zahrnuto 128 pacientů (1 mladší 18 let věku) léčených imatinibem v kombinaci s chemoterapií. Bezpečnostní data z této studie se zdají být v souladu s bezpečnostním profilem imatinibu u Ph+ ALL pacientů.
Recidivující/refrakterníPh+ ALL: Při podávání imatinibu v monoterapii pacientům s recidivující/refrakterní Ph+ ALL, bylo dosaženo ve skupině 53 hodnotitelných pacientů z celkového počtu 411 pacientů hematologické odpovědi ve 30% (v 9% kompletní) a velké cytogenetické odpovědi ve 23%. (Upozornění - z celkového počtu 411 pacientů bylo 353 pacientů léčeno v rámci programu rozšířeného přístupu k léčbě bez sběru dat primární odpovědi), Medián trvání doby do progrese u celkové populace 411 pacientů s recidivující/refrakterní Ph+ ALL byl v rozmezí mezi 2,6 až 3,1 měsíců, medián doby celkového přežití u 401 hodnotitelných pacientů byl v rozmezí od
4,9 do 9 měsíců. Údaje byly podobné, když byly znovu analyzovány po zahrnutí pouze pacientů ve věku 55 let a starších.
Klinické studie u MDS/MPD
Zkušenosti s Glivecem v této indikaci jsou velmi omezené a jsou založené na míře hematologické a cytogenetické odpovědi. Neexistují žádné kontrolované studie, které by prokázaly klinický prospěch nebo zvýšené přežití. V otevřené, multicentrické klinické studii fáze II (study B2225) byl Glivec zkoušen u různých populací pacientů s život ohrožujícími onemocněními spojenými s aktivitou Abl, Kit nebo PDGFR tyrosinkináz. Do této studie bylo zařazeno 7 pacientů s MDS/MPD, kteří byli léčeni Glivecem 400 mg denně. U tří pacientů byla přítomna kompletní hematologická odpověď (CHR) a jeden pacient dosáhl parciální hematologické odpovědi (PHR). V době původní analýzy tři ze čtyř pacientů s detekovanými mutacemi genu PDGFR dosáhli hematologické odpovědi (2 CHR a 1 PHR). Věk těchto pacientů byl v rozmezí od 20 do 72 let. Ve 13 publikacích bylo hlášeno dalších 24 pacientů s MDS/MPD. 21 pacientů bylo léčeno Glivecem 400 mg denně, zatímco další 3 pacienti byli léčeni nižšími dávkami. U 11 pacientů byla zjištěna změna genu PDGFR, 9 z nich dosáhlo CHR a 1 PHR. Věk těchto pacientů byl v rozmezí od 2 do 79 let. V poslední uveřejněné aktualizované informaci bylo uvedeno, že 6 z těchto 11 pacientů zůstalo v cytogenetické remisi (v rozmezí 32-38 měsíců). Ve stejné publikaci byly uvedeny údaje dlouhodobého sledování 12 pacientů s MDS/MPD s mutací genu PDGFR (5 pacientů ze studie B2225). Tito pacienti byli léčeni Glivecem v mediánu 47 měsíců (v rozmezí 24 dnů - 60 měsíců). U 6 pacientů přesáhlo nyní sledování 4 roky. Jedenáct pacientů dosáhlo rychlé CHR; deset dosáhlo kompletního vymizení cytogenetických abnormalit a dle měření RT-PCR snížení nebo vymizení fúzních transkriptů. Hematologické odpovědi byly zachovány v mediánu 49 měsíců (v rozmezí 19-60) a cytogenetické odpovědi v mediánu 47 měsíců (v rozmezí 16-59). Celkové přežití bylo 65 měsíců od stanovení diagnózy (v rozmezí 25-234). Podávání Glivecu pacientům bez genetické translokace obecně nevede k žádnému zlepšení.
U pediatrických pacientů s MDS/MPD nebyly provedeny kontrolované klinické studie. Ve 4 publikacích bylo hlášeno pět (5) pacientů s MDS/MPD spojenými s přestavbou genu PDGFR. Věk těchto pacientů se pohyboval v rozmezí 3 měsíce až 4 roky a imatinib byl podáván v dávce 50 mg denně nebo v dávkách v rozmezí 92,5 až 340 mg/m2 denně. Všichni pacienti dosáhli kompletní hematologické odpovědi, cytogenetické odpovědi a/nebo klinické odpovědi.
Klinické studie u HES/CEL
V otevřené, multicentrické klinické studii fáze II (studie B2225) byl Glivec zkoušen u různých populací pacientů s život ohrožujícími onemocněními spojenými s aktivitou Abl, Kit nebo PDGFR tyrosinkináz. V této studii 14 pacientů s HES/CEL bylo léčeno Glivecem 100 mg až 1 000 mg denně. Dalších 162 pacientů s HES/CEL uvedených ve 35 zveřejněných kazuistikách bylo léčeno Glivecem v dávkách 75 mg až 800 mg denně. Cytogenetické abnormality byly hodnoceny u 117 z celkové populace 176 pacientů. U 61 pacientů z těchto 117 byla zjištěna fúzní kináza FIP1L1-PDGFRa. Ve třech dalších publikovaných kazuistikách byli uvedeni čtyři pacienti s HES s pozitivní fúzní kinázou FIP1L1-PDGFRa. Všech 65 pacientů s pozitivní fúzní kinázou FIP1L1-PDGFRa dosáhlo CHR, která se udržela po dobu několika měsíců (v rozmezí 1+ až 44+ měsíců, cenzorováno v době hlášení). Podle posledních publikovaných hlášení 21 z těchto 65 pacientů také dosáhlo kompletní molekulární remise s mediánem délky sledování 28 měsíců (v rozmezí 13-67 měsíců). Věk těchto pacientů byl v rozmezí od 25 do 72 let.Dodatečně bylo investigátory hlášeno v kazuistikách symptomatologické zlepšení a zlepšení dysfunkcí dalších orgánů. Zlepšení byla hlášena u poruch funkce srdeční, nervové, kožní/podkožní, respirační/hrudní/mediastinální, muskuloskeletální/pojivové/vaskulární a gastrointestinální orgánové soustavy.
U pediatrických pacientů s HES/CEL nebyly provedeny kontrolované klinické studie. Ve 3 publikacích byli hlášeni tři (3) pacienti s HES/CEL spojenými s přestavbou genu PDGFR. Věk těchto pacientů se pohyboval v rozmezí 2 až 16 let a imatinib byl podáván v dávce 300 mg/m2 denně anebo v dávkách v rozmezí 200 až 400 mg denně. Všichni pacienti dosáhli kompletní hematologické odpovědi, kompletní cytogenetické odpovědi a/nebo kompletní klinické odpovědi.
Klinické studie u pacientů s inoperabilním a/nebo metastatickým GIST
Jedna otevřená, randomizovaná nekontrolovaná mezinárodní studie fáze II byla provedena u pacientů s inoperabilním nebo metastatickým maligním gastrointestinálním stromálním nádorem (GIST). Do studie bylo zařazeno 147 pacientů a randomizováno užívat buď 400 mg nebo 600 mg jednou denně perorálně po dobu až 36 měsíců. Tito pacienti byli ve věku od 18 až 83 let a byla u nich stanovena diagnóza Kit-pozitivní maligní GIST, který byl inoperabilní a/nebo metastazující. Rutinně bylo prováděno imunohistochemické vyšetření pomocí Kit protilátek (A-4502, králičí polyklonální antisérum, 1:100; DAKO Corporation, Carpinteria, CA) metodou nalezení antigenu podle analýzy avidin-biotin-peroxidázového komplexu.
Primární průkaz účinnosti byl založen na míře objektivní odpovědi. U nádorů byla vyžadována měřitelnost v alespoň jednom ložisku onemocnění a charakter odpovědi byl založen na kriteriích Southwestern Oncology Group (SWOG). Výsledky jsou uvedeny v Tabulce 6.
Tabulka 6 Nejlepší odpovědi nádoru ve studii STIB2222 (GIST)
|
Nejlepší odpověď |
Všechny dávky (n=147) 400 mg (n=73) 600 mg (n=74) n (%) |
|
Kompletní odpověď |
1 (0,7) |
|
Parciální odpověď |
98 (66,7) |
|
Stabilní onemocnění |
23 (15,6) |
|
Progresivní onemocnění |
18 (12,2) |
|
Nehodnotitelé |
5 (3,4) |
|
Neznámo |
2 (1,4) |
Nebyly nalezeny rozdíly v míře odpovědí mezi dvěma skupinami s rozdílným dávkováním. Významný počet pacientů, kteří měli stabilní onemocnění v době interim analýzy, dosáhl částečné odpovědi při delší léčbě (medián doby sledování 31 měsíců). Medián času do odpovědi byl 13 týdnů (95% CI 1223). Medián času do selhání léčby u pacientů s odpovědí byl 122 týdnů (95% CI 106-147), zatímco v celé studijní populaci to byly 84 týdny (95% CI 71-109). Medián celkového přežití nebyl dosažen. Odhad pro přežití po 36 měsících sledování podle Kaplan-Meiera je 68%.
Ve dvou klinických studiích (studie B2222 a studie S0033) byla denní dávka Glivecu zvyšována na 800 mg u pacientů, u kterých onemocnění progredovalo při nižších denních dávkách 400 nebo 600 mg. Denní dávka byla zvýšena na 800 mg u celkově 103 pacientů; 6 pacientů dosáhlo po zvýšení dávky částečné odpovědi a u 21 pacientů došlo ke stabilizaci onemocnění, což představuje klinický prospěch 26%. Z dostupných bezpečnostních dat nevyplývá, že by zvýšení dávky na 800 mg denně u pacientů s progresí onemocnění při nižších dávkách 400 mg nebo 600 mg denně mělo vliv na bezpečnostní profil Glivecu.
Klinické studie u adjuvantní léčby GIST
Glivec byl studován v adjuvantní léčbě v multicentrické, dvojitě slepé, prospektivní, placebem kontrolované studii fáze III (Z9001), která zahrnovala 773 pacientů. Věkové rozmezí pacientů bylo 18 až 91 let. Byli zařazeni pacienti s histologickou diagnózou primárního GIST s imunochemicky potvrzenou expresí Kit proteinu a velikostí nádoru > 3 cm v maximálním rozměru, s úplnou makroskopickou resekcí primárního GIST během 14-70 dnů před zařazením do studie. Po resekci primárního GIST byli pacienti randomizováni do jednoho ze dvou ramen: Glivec podávaný v dávkách 400 mg/den nebo odpovídající placebo po dobu jednoho roku.
Primárním cílovým parametrem studie bylo přežití bez návratu onemocnění (RFS) definované jako doba od data randomizace do data návratu onemocnění nebo smrti z jakékoli příčiny.
Glivec významně prodloužil RFS, ve skupině s Glivecem bylo po dobu 38 měsíců bez návratu onemocnění 75% pacientů, oproti 20 měsícům u pacientů ve skupině s placebem (95% CI, [30-nelze určit]; respektive[14-nelze určit]); (relativní riziko = 0,398 [0,259 - 0,610], p< 0,0001). Po jednom roce byl celkový RFS významně lepší pro Glivec (97,7%) oproti placebu (82,3%), (p< 0,0001). Riziko recidivy onemocnění tak bylo sníženo o přibližně 89% v porovnání s placebem (relativní riziko = 0,113 [0,049 - 0,264]).
Riziko recidivy u pacientů po operaci primárního GIST nádoru bylo retrospektivně vyhodnoceno na základě těchto prognostických faktorů: velikost nádoru, mitotický index, umístění nádoru. Hodnoty mitotického indexu byly dostupné pro 556 ze 713 pacientů intention-to-treat (ITT) populace. Výsledky analýzy podskupin podle klasifikace rizika Národního ústavu zdraví USA (NIH) a Ústavu patologie ozbrojených sil USA (AFIP) jsou shrnuty v Tabulce 7. Nebyl pozorován přínos ve skupině s nízkým a velmi nízkým rizikem. Nebyl pozorován přínos pro celkové přežití.
Tabulka 7 Souhrn analýz RFS studie Z9001podle klasifikace rizika NIH and AFIP
|
Kritéri a rizika |
Stupeň rizika |
% pacientů |
Počet příhod / Počet pacientů |
Celkové relativní riziko (95 %CI)* |
Míra RFS (%) | |
|
12 měsíců |
24 měsíců | |||||
|
Glivec vs placebo |
Glivec vs placebo |
Glivec vs placebo | ||||
|
Nízké |
29,5 |
0/86 vs. 2/90 |
N.E. |
100 vs. 98,7 |
100 vs. 95,5 | |
|
NIH |
Střední |
25,7 |
4/75 vs. 6/78 |
0,59 (0,17; 2,10) |
100 vs. 94,8 |
97,8 vs. 89,5 |
|
Vysoké |
44,8 |
21/140 vs. 51/127 |
0,29 (0,18; 0,49) |
94,8 vs. 64,0 |
80,7 vs. 46,6 | |
|
Velmi nízké |
20,7 |
0/52 vs. 2/63 |
N.E. |
100 vs. 98,1 |
100 vs. 93,0 | |
|
Nízké |
25,0 |
2/70 vs. 0/69 |
N.E. |
100 vs. 100 |
97,8 vs. 100 | |
|
AFIP |
Střední |
24,6 |
2/70 vs. 11/67 |
0,16 (0,03; 0,70) |
97,9 vs. 90,8 |
97,9 vs. 73,3 |
|
Vysoké |
29,7 |
16/84 vs. 39/81 |
0,27 (0,15; 0,48) |
98,7 vs. 56,1 |
79,9 vs. 41,5 | |
|
* včetně follow-up periody; NE - ne |
ze určit | |||||
Druhá multicentrická otevřená studie fáze III (SSG XVIII/AIO) porovnávala výsledky léčby Glivecem v dávce 400 mg/den po dobu 12 měsíců oproti 36 měsícům u pacientů po chirurgické resekci GIST a s jedním z následujících parametrů: průměr tumoru > 5 cm a počet mitóz > 5/50 zorných polí ve velkém zvětšení (high power fields, HPF) nebo průměr tumoru > 10 cm a jakýkoli počet mitóz nebo tumor jakékoli velikosti s počtem mitóz > 10/50 HPF nebo tumory s rupturou do peritonální dutiny. Ve studii bylo randomizováno a informovaný souhlas podepsalo celkem 397 pacientů (199 pacientů v rameni s 12měsíční léčbou a 198 pacientů v rameni s 36měsíční léčbou), jejichž průměrný věk byl 61 let (rozmezí 22 až 84 let). Medián doby sledování byl 54 měsíců (od data randomizace do data ukončení), s celkovou dobou 83 měsíců mezi prvním randomizovaným pacientem a ukončením studie.
Primárním cílovým parametrem účinnosti studie bylo přežití bez návratu onemocnění (RFS) definované jako doba od data randomizace do data návratu onemocnění nebo smrti z jakékoli příčiny.
36měsíční léčba Glivecem významně prodlužila RFS oproti 12měsíční léčbě Glivecem (s celkovým poměrem rizik (HR) = 0,46 [0,32, 0,65], p<0,0001) (Tabulka 8, Obrázek 1).
Třicet šest (36) měsíců léčby Glivecem významně prodloužilo celkové přežití (OS) v porovnání s 12 měsíci léčby Glivecem (HR = 0,45 [0,22; 0,89], p=0,0187) (Tabulka 8, Obrázek 2).
Déletrvající léčba (> 36 měsíců) může prodloužit dobu do výskytu dalších recidiv; vliv těchto zjištění na celkové přežití nicméně zůstává neznámý.
Celkový počet úmrtí byl 25 v rameni s 12měsíční léčbou a 12 v rameni s 36měsíční léčbou.
36měsíční léčbou imatinibem bylo dosaženo lepších výsledků oproti 12měsíční léčbě v ITT analýze, tj. zahrnující celou studijní populaci. V plánované analýze podskupin podle typu mutace byl poměr rizika přežití bez rekurence pro 36měsíční léčbu pacientů s mutací exonu 11 0,35 [95% CI: 0,22,
0,56]. Pro jiné podskupiny s méně častými mutacemi nelze z důvodu nízkého počtu sledovaných případů vyvodit žádné závěry.
Tabulka 8 12měsíční a 36měsíční léčba Glivecem (studie SSGXVIII/AIO)
|
rameno s 12měsíční léčbou |
rameno s 36měsíční léčbou | |
|
RFS |
%(CI) |
%(CI) |
|
12 měsíců |
93,7 (89,2-96,4) |
95,9 (91,9-97,9) |
|
24 měsíců |
75,4 (68,6-81,0) |
90,7 (85,6-94,0) |
|
36 měsíců |
60,1 (52,5-66,9) |
86,6 (80,8-90,8) |
|
48 měsíců |
52,3 (44,0-59,8) |
78,3 (70,8-84,1) |
|
60 měsíců |
47,9 (39,0-56,3) |
65,6 (56,1-73,4) |
|
Přežití 36 měsíců |
94,0 (89,5-96,7) |
96,3 (92,4-98,2) |
|
48 měsícůs |
87,9 (81,1-92,3) |
95,6 (91,2-97,8) |
|
60 měsíců |
81,7 (73,0-87,8) |
92,0 (85,3-95,7) |
Obrázek 1 Odhad primárního přežití bez návratu onemocnění podle Kaplan-Meiera (ITT populace)
Pravděpodobnost přežití bez návratu onemocnění
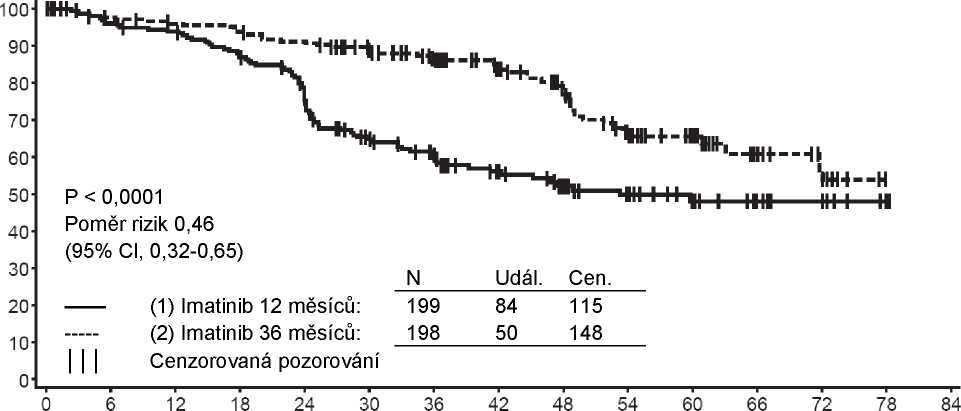
Doba přežití v měsících
V riziku: Události
|
137:46 |
105:65 |
88:72 |
61:77 |
49:81 |
36:83 |
27:84 |
14:84 |
10:84 |
2:84 0:84 |
|
173:18 |
152:22 |
133:25 |
102:29 |
82:35 |
54:46 |
39:47 |
21:49 |
8:50 |
0:50 |
(1) 199:0 182:8 177:12 163:25
(2) 198:0 189:5 184:8 181:11
Doba přežití v měsících
V riziku: Události
0:25
Obrázek 2 Odhad celkového přežití podle Kaplan-Meiera (ITT populace)
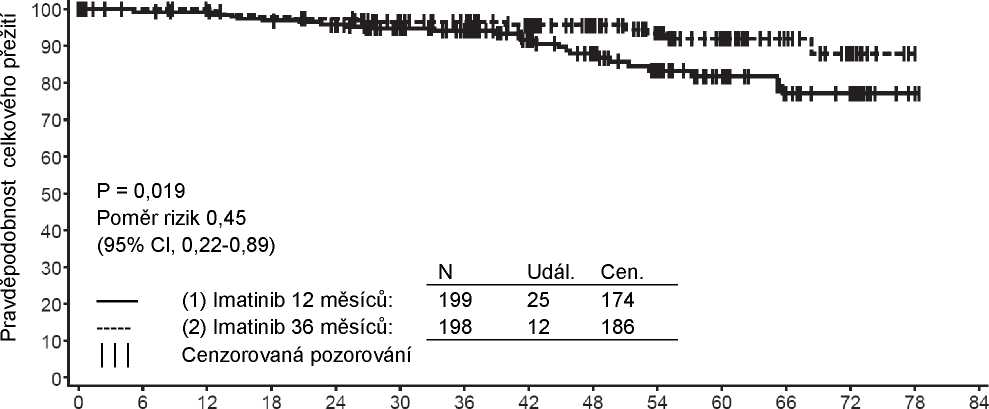
(1) 199:0 190:2 188:2 183:6 176:8 156:10 140:11 105:14 87:18 64:22 46:23 27:25 20:25 2:25
(2) 198:0 196:0 192:0 187:4 184:5 164:7 152:7 119:8 100:8 76:10 56:11 31:11 13:12 0:12
U pediatrických pacientů s c-Kit pozitivním GIST nebyly provedeny kontrolované klinické studie.
V 7 publikacích bylo hlášeno sedmnáct (17) pacientů s GIST (s Kit nebo bez Kit a s mutacemi PDGFR nebo bez mutací PDGFR). Věk těchto pacientů se pohyboval v rozmezí 8 až 18 let a imatinib byl podáván adjuvantně i pro metastatické onemocnění v dávkách v rozmezí 300 až 800 mg denně.
U většiny léčených pacientů s GIST nebyla k dispozici data potvrzující c-kit nebo mutace PDGFR, což mohlo vést k různým klinickým výsledkům.
Klinické studie u DFSP
Byla provedena otevřená, multicentrická klinická studie fáze II (studie B2225) zahrnující 12 pacientů s DFSP léčených Glivecem 800 mg denně. Věk pacientů s DFSP byl v rozmezí 23 až 75 roků; DFSP byl metastatický, lokálně recidivující po primárním chirurgickém vynětí a v době zařazení do studie vyhodnocen jako inoperabilní.Primární důkaz účinnosti byl založen na míře objektivní odpovědi.
Z 12 zařazených pacientů jich 9 odpovědělo: 1 kompletně a 8 parciálně. Tři pacienti s parciální odpovědí byli následně po provedené operaci interpretováni jako bez známek onemocnění. Medián doby trvání léčby ve studii B2225 byl 6,2 měsíce, s maximem doby trvání 24,3 měsíců. Dalších 6 pacientů s DFSP léčených Glivecem bylo publikováno v 5 kazuistikách, věk těchto pacientů byl v rozmezí 18 měsíců až 49 let. Dospělí pacienti uvedení v publikované literatuře byli léčeni dávkou Glivecu buď 400 mg (4 případy) nebo 800 mg (1 případ) denně. Odpovědělo pět (5) pacientů,
3 kompletně a 2 parciálně. Medián doby trvání léčby v publikované literatuře je v rozmezí 4 týdnů až více než 20 měsíců. Translokace t(17:22)[(q22:q13)] nebo její genový produkt byl přítomen téměř u všech pacientů odpovídajících na léčbu Glivecem.
U pediatrických pacientů s DFSP nebyly provedeny kontrolované klinické studie. Ve 3 publikacích bylo hlášeno pět (5) pacientů s DFSP a přestavbou PDGFR genu. Věk pacientů se pohyboval od narození do 14 let a imatinib byl podáván v dávce 50 mg denně nebo v dávkách v rozmezí 400 až 520 mg/m2 denně. Všichni pacienti dosáhli částečné a/nebo kompletní odpovědi.
Farmakokinetika Glivecu
Farmakokinetika Glivecu byla hodnocena v rozmezí dávek 25 až 1 000 mg. Farmakokinetický profil léku v plazmě byl analyzován 1., 7. nebo 28. den, kdy koncentrace v plazmě dosáhla rovnovážného stavu.
Absorpce
Průměrná absolutní biologická dostupnost tobolky je 98%. Po perorálním podání byla mezi pacienty vysoká variabilita v hladinách AUC imatinibu v plazmě. Při podání léku s tučným jídlem, byla míra absorpce imatinibu snížena jen minimálně (11% snížení Cmax a prodloužení tmax o 1,5 h), s malým zmenšením AUC (7,4%), ve srovnání s podáním nalačno. Ovlivnění absorpce léku předchozí gastrointestinální operací nebylo studováno.
Distribuce
V klinicky relevantních koncentracích imatinibu došlo v pokusech in vitro k vazbě na plazmatické proteiny přibližně v 95%, převážně na albumin a alfa-1- kyselý-glykoprotein, s malou vazbou na lipoproteiny.
Biotransformace
Hlavním cirkulujícím metabolitem je u člověka N-demethylovaný derivát piperazinu, který měl in vitro podobnou účinnost jako mateřská látka. Zjištěná plazmatická AUC tohoto metabolitu byla pouze 16% AUC imatinibu. Vazba N-demetylovaného metabolitu na plazmatické bílkoviny je podobná vazebné schopnosti mateřské látky.
Imatinib a N-demethylovaný metabolit činily dohromady přibližně 65% cirkulující radioaktivity (AUC(0-48h)). Zbývající cirkulující radioaktivita byla tvořena množstvím minoritních metabolitů.
Výsledky studií in vitro ukázaly, že CYP3A4 je u lidí hlavním enzymem cytochromu P450, který katalyzuje biotransformaci imatinibu. Z řady potenciálně souběžně podávaných léků (paracetamol, aciklovir, alopurinol, amfotericin, cytarabin, erytromycin, flukonazol, hydroxyurea, norfloxacin, penicillin V) pouze erytromycin (IC50 5 0 pM) a flukonazol (IC50 118 pM) inhibovaly metabolismus imatinibu v rozsahu, který by mohl být klinicky významný.
In vitro bylo zjištěno, že imatinib je kompetitivním inhibitorem markrových substrátů pro CYP2C9, CYP2D6 a CYP3A4/5. Ki hodnoty v lidských jaterních mikrosomech byly 27, 7,5 a 7,9 pmol/l. Maximální plazmatické koncentrace imatinibu u pacientů jsou 2-4 pmol/l, tudíž je možná inhibice metabolismu zprostředkovaného CYP2D6 a/nebo CYP3A4/5 souběžně podávaných léků. Imatinib neinterferuje s biotranformací 5-fluorouracilu, ale inhibuje metabolismus paklitaxelu, což je výsledkem kompetitivní inhibice CYP2C8 (Ki = 34,7 pM). Odpovídající hodnota Ki je daleko vyšší než očekávané plazmatické hladiny imatinibu u pacientů a tudíž se neočekávají interakce při souběžném podávání 5-fluorouracilu nebo paklitaxelu a imatinibu.
Eliminace z organismu
Na základě sledování vylučování radioaktivních sloučenin(y) po perorálním podání 14C-značeného imatinibu bylo přibližně 81% dávky nalezeno v průběhu 7 dnů ve stolici (68% dávky) a v moči (13% dávky). V nezměněné formě bylo vyloučeno 25% dávky (5% močí, 20% stolicí), zbytek činily metabolity.
Farmakokinetika v plazmě
Po perorálním podání zdravým dobrovolníkům byl t./2 přibližně 18 hodin, to znamená, že podávání jednou denně je dostačující. Zvyšování průměrné hodnoty AUC se stoupající dávkou bylo lineární a závislé na dávce v rozmezí dávek 25-1 000 mg imatinibu po perorálním podání. Po opakovaném podání nebyly při dávkování jednou denně nalezeny změny v kinetice imatinibu a akumulace v rovnovážném stavu činila 1,5-2,5násobek.
Farmakokinetika u pacientů s GIST
U pacientů s GIST byla v rovnovážném stavu při stejné dávce (400 mg denně) 1,5krát vyšší expozice než ta, která byla pozorována u pacientů s CML. Na základě předběžné analýzy farmakokinetiky v populaci pacientů s GIST zde byly nalezeny tři proměnné (albumin, bílé krvinky a bilirubin), které měly statisticky významnou souvislost s farmakokinetikou imatinibu. Snížení hodnot albuminu bylo příčinou poklesu clearance (CL/f); a vyšší hodnoty počtu bílých krvinek vedly ke snížení CL/f. Tato souvislost však není dostatečně výrazná, aby opravňovala k úpravě dávkování. V této skupině pacientů by mohla přítomnost metastáz v játrech mít za následek jaterní insuficienci a redukci metabolismu.
Populační farmakokinetika
Na základě analýzy farmakokinetiky v populaci pacientů s CML bylo zjištěno, že věk jen málo ovlivnil distribuční objem (12% zvýšení u pacientů starších > 65 let). Tyto změny nejsou považovány za klinicky významné. Vliv tělesné hmotnosti na clearance imatinibu je následující: u pacientů s tělesnou hmotností 50 kg je možné očekávat průměrnou clearance 8,5 l/h, zatímco u pacientů vážících 100 kg clearance stoupne na 11,8 l/h. Tyto změny nejsou dostačující, aby opravňovaly k úpravě dávkování podle hmotnosti. V kinetice imatinibu není rozdíl mezi muži a ženami.
Farmakokinetika u dětí
Obdobně jako u dospělých pacientů byl imatinib po perorálním podání rychle absorbován i u dětských pacientů ve studii fáze I i fáze II. Dávkami 260 a 340 mg/m2/den bylo u dětí dosaženo stejné účinnosti jako u dospělých dávkami 400 mg a 600 mg. Při srovnání AUC(0-24) 8. den s 1. dnem při dávce 340 mg/m2/den hladina ukázala 1,7násobnou akumulaci léku po opakovaném podávání jednou denně.
Na základě poolovaných farmakokinetických analýz populací pediatrických pacientů s hematologickými poruchami (CML, Ph+ALL, nebo jinými hematologickými poruchami léčenými imatinibem) roste clearance imatinibu se zvyšujícím se povrchem těla (BSA). Po úpravě vlivu BSA neměly další demografické ukazatele, jako je věk, tělesná hmotnost a body mass index, klinicky významný vliv na expozici imatinibem. Analýzy potvrdily, že expozice imatinibem u pediatrických pacientů užívajících 260 mg/m2 jednou denně (nepřevyšující 400 mg jednou denně) nebo 340 mg/m2 jednou denně (nepřevyšující 600 mg jednou denně) byly podobné jako u dospělých pacientů, kteří užívali imatinib v dávce 400 mg nebo 600 mg jednou denně.
Zhoršená funkce orgánů
Imatinib a jeho metabolity nejsou ve významném množství vylučovány ledvinami. U pacientů s mírnou a středně závažnou nedostatečností renální funkce se ukázalo, že mají vyšší plazmatickou expozici než pacienti s normální funkcí ledvin. Zvýšení je přibližně 1,5- až 2násobné, což odpovídá 1,5násobku zvýšení plazmatického AGP, na který se imatinib silně váže. Clearance volného imatinibu je pravděpodobně obdobná u pacientů s renální nedostatečností a u pacientů s normální funkcí ledvin vzhledem k tomu, že vylučování ledvinami představuje pouze vedlejší cestu eliminace imatinibu (viz bod 4.2 a 4.4).
Ačkoli výsledky farmakokinetických analýz ukázaly, že je zde značný rozdíl mezi jedinci, střední expozice imatinibu se nezvýšila u pacientů s různými stupni dysfunkce jater ve srovnání s pacienty s normální funkcí jater (viz body 4.2, 4.4 a 4.8).
Předklinický profil bezpečnosti imatinibu byl stanoven na potkanech, psech, opicích a králících.
Při studiu toxicity po opakovaném podání byly pozorovány mírné až středně závažné hematologické změny u potkanů, psů, a opic doprovázené změnami v kostní dřeni u potkanů a psů.
U potkanů a psů byly cílovým orgánem játra. U obou druhů zvířat bylo pozorováno mírné až střední zvýšení transamináz a mírný pokles cholesterolu, triglyceridů, celkových proteinů a hladiny albuminu. V játrech potkanů nebyly nalezeny žádné histopatologické změny. Závažné toxické změny se zvýšením jaterních enzymů, hepatocelulární nekrózou, nekrózou žlučových cest a hyperplazií žlučovodu byly pozorovány u psů léčených po 2 týdny.
U opic byla po dvou týdnech léčby pozorována nefrotoxicita, s ložiskovou mineralizací a dilatací renálních tubulů a tubulární nefrózou. U několika zvířat bylo pozorováno zvýšení urey v krvi (BUN) a kreatininu. U potkanů byla po dávkách > 6 mg/kg ve 13týdenní studii pozorována hyperplazie přechodového epitelu renální papily a močového měchýře, beze změn parametrů v séru nebo moči. Při chronické léčbě imatinibem byl pozorován četnější výskyt oportunních infekcí.
Ve 39týdenní studii u opic nebyla při nejnižší dávce 15 mg/kg, odpovídající přibližně jedné třetině maximální humánní dávky 800 mg stanovené podle tělesného povrchu, stanovena hladina bez nežádoucích účinků -NOAEL (No Observed Adverse Effect Level). U těchto zvířat došlo ke zhoršení normálně potlačené malárie.
Ve studiích in vitro na bakteriálních buňkách (Amesův test), na savčích buňkách (myší lymfomové buňky) ani ve studiích in vivo u potkanů mikronukleárním testem nebyla zjištěna genotoxicita imatinibu. Pozitivní genotoxický účinek imatinibu byl zjištěn v testu in vitro na savčích buňkách (ovariální buňky křečka čínského) na klastogenicitu (chromozomální aberaci) za přítomnosti metabolické aktivace. Dva meziprodukty výrobního procesu, které jsou také přítomny ve finálním výrobku, měly pozitivní Amesův test na mutagenicitu. Jeden z těchto meziproduktů byl také pozitivní při testování na myších lymfomových buňkách.
Ve studii fertility byla potkaním samcům po dobu 70 dnů před připuštěním podávána dávka 60 mg/kg, která přibližně odpovídá maximální klinické dávce 800 mg/den, stanovené podle tělesného povrchu. Byl zjištěn úbytek hmotnosti varlat a nadvarlat a sníženo procento pohyblivých spermií. Tento účinek nebyl pozorován při dávce < 20 mg/kg. Mírné až střední snížení spermatogeneze bylo také pozorováno u psů po perorálních dávkách > 30 mg/kg. Pokud byl imatinib podáván samicím potkanů 14 dnů před připuštěním a až do 6. dne březosti nebylo ovlivněno ani zabřeznutí ani počet březích samic. Po podávání dávky 60 mg/kg, došlo u samic potkanů k významným postimplantačním ztrátám plodů a snížení počtu živých plodů. Tento účinek nebyl pozorován v dávkách < 20 mg/kg.
Ve studii pre a postnatálního vývoje u potkanů po perorálním podání 45 mg/kg/den byl 14. nebo 15. den zabřeznutí pozorován rudý výtok z vagíny. Při stejné dávce stoupnul počet mrtvě narozených mláďat stejně jako počet uhynulých po narození mezi 0. až 4. dnem. U mláďat z vrhu Fj, byla při stejné dávce nižší průměrná tělesná hmotnost od narození až do usmrcení a počet mláďat ve vrhu byl také snížen. Fertilita Fi nebyla ovlivněna po dávce 45 mg/kg/den, zatímco počet resorbovaných plodů stoupl a klesl počet živě narozených mláďat. Dle hodnocení No Observed Effect Level (NOEL) byla pro mateřská zvířata a F1 generaci mláďat bezpečná dávka 15 mg/kg/den (jedna čtvrtina maximální lidské dávky 800 mg).
Imatinib byl teratogenní, pokud byl podáván potkanům během organogeneze v dávkách > 100 mg/kg, přibližně odpovídající maximální klinické dávce 800 mg/den, stanovené podle tělesného povrchu. Teratogenní účinky zahrnovaly exencefalii nebo encefalokelu, absenci nebo redukci frontálních kostí a absenci parietálních kostí. Tyto účinky nebyly pozorovány při dávkách < 30 mg/kg.
V toxikologické studii zaměřené na juvenilní vývoj potkanů (den 10 až 70 post partum) nebyly zjištěné nové cílové orgány ve srovnání se zjištěnými cílovými orgány u dospělých potkanů.
V toxikologické studii zaměřené na juvenilní jedince byly pozorovány účinky na růst, zpoždění otevření vaginy a oddělení předkožky při přibližně 0,3 až 2násobku průměrné pediatrické expozice při nejvyšší doporučené dávce 340 mg/m2. Dále byla u juvenilních zvířat (ve fázi odstavení) zjištěna mortalita při přibližně 2násobku průměrné pediatrické expozice při nejvyšší doporučené dávce
340 mg/m2.
Výsledky 2leté studie kancerogenity u potkanů, kterým byl podáván imatinib v dávce 15, 30 a 60 mg/kg/den ukázaly statisticky významné snížení délky života u samců při dávce 60 mg/kg/den a u samic při dávce > 30 mg/kg/den. Histopatologická vyšetření jako hlavní příčinu smrti nebo důvodu pro utracení zvířat odhalily kardiomyopatii (u obou pohlaví), chronickou progresivní nefropatii (u samic) a papilomy předkožkové žlázky. Cílovými orgány, pokud se týká neoplastických změn, byly ledviny, močový měchýř, uretra, předkožková a klitoridální žlázka, tenké střevo, příštítná tělíska, nadledvinky a nesekretorická část žaludeční stěny.
Byly zaznamenány případy vzniku papilomů/karcinomů předkožkové/klitoridální žlázky při dávce od 30 mg/kg/den a více, což reprezentuje přibližně 0,5násobek dávky 400 mg/den běžně užívané u člověka (podle AUC), nebo 0,3násobek dávky 800 mg/den užívané u člověka, a 0,4násobek dávky 340 mg/m2/den u dětí (podle AUC). Dle hodnocení No Observed Effect Level (NOEL) byla bezpečná dávka 15 mg/kg/den. Renální adenom/karcinom a papilom močového měchýře a uretry, adenokarcinomy tenkého střeva, adenomy příštítných tělísek, benigní a maligní medulární tumory nadledvinek a papilomy/karcinomy nesekretorické části žaludeční stěny byly pozorovány při dávce 60 mg/kg/den, což reprezentuje přibližně 1,7násobek dávky 400 mg/den běžně užívané u člověka (podle AUC) nebo dávku 800 mg/den běžně užívané u člověka, a 1,2násobek dávky 340 mg/m2/den u dětí (podle AUC). Dle hodnocení No Observed Effect Level (NOEL) byla bezpečná dávka 30 mg/kg/den.
Mechanismus a závažnost těchto nálezů ze studie kancerogenity u potkanů není ještě u člověka objasněn.
Non-neoplastické léze neprokázané v dřívějších předklinických studiích se vyskytovaly v kardiovaskulárním systému, pankreatu, endokrinních orgánech a zubech. Nejdůležitější změny zahrnovaly srdeční hypertrofii a dilataci, vedoucí k příznakům srdeční nedostatečnosti u některých zvířat.
Účinná látka imatinib představuje environmentální ohrožení pro organismy v sedimentu.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Obsah tobolek: Mikrokrystalická celulosa
Krospovidon Magnesium-stearát Koloidní bezvodý oxid křemičitý
Tobolky: Želatina
Žlutý oxid železitý (E172)
Oxid titaničitý (E171)
Tiskařský inkoust: Červený oxid železitý (E172)
Šelak
Sojový lecithin
6.2 Inkompatibility Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Neuchovávejte při teplotě nad 30°C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
6.5 Druh obalu a obsah balení PVC/aluminium blistry
Balení obsahuje 30 tobolek.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/01/198/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 07. listopad 2001
Datum posledního prodloužení registrace: 07. listopad 2006
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Glivec 100 mg tvrdé tobolky
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tobolka obsahuje 100 mg imatinibum (jako imatinibi mesilas). Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tvrdá tobolka
Bílý až žlutý prášek v oranžových až šedooranžových neprůhledných tobolkách označených
„NVR SI“
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Glivec je indikován k léčbě
• dospělých a dětských pacientů s nově diagnostikovanou Philadelphia chromozom (bcr-abl) pozitivní (Ph+) chronickou myeloidní leukemií (CML), u kterých není transplantace kostní dřeně považována za léčbu první volby.
• dospělých a dětských pacientů s Ph+ CML s chronickou fází onemocnění, u kterých selhala léčba interferonem-alfa, nebo kteří jsou v akcelerované fázi onemocnění nebo v blastické krizi.
• dospělých a dětských pacientů s nově diagnostikovanou Philadelphia chromozom pozitivní akutní lymfatickou leukemií (Ph+ ALL) doplněnou chemoterapií.
• dospělých pacientů s recidivující nebo refrakterní Ph+ ALL jako monoterapie.
• dospělých pacientů s myelodysplastickým/myeloproliferativním onemocněním (MDS/MPD) spojeným se změnou genu receptoru pro růstový faktor krevních destiček (PDGFR).
• dospělých pacientů se syndromem pokročilé hypereozinofilie (HES) a/nebo chronickou eozinofilní leukemií (CEL) s přeskupením FIP1L1-PDGFRa.
Účinek Glivecu na výsledek transplantace kostní dřeně nebyl stanoven.
Glivec je indikován
• k léčbě dospělých pacientů s Kit (CD 117) pozitivními inoperabilními a/nebo metastatickými maligními stromálními nádory zažívacího traktu (GIST).
• k adjuvantní léčbě dospělých pacientů s významným rizikem recidivy po resekci Kit (CD117)-pozitivního GIST nádoru. Pacienti s nízkým nebo velmi nízkým rizikem recidivy by neměli adjuvantní léčbu podstoupit.
• k léčbě dospělých pacientů s inoperabilním dermatofibrosarkomem protuberans (DFSP) a dospělých pacientů s rekurentním a/nebo metastatickým DFSP, kteří nejsou způsobilí operace.
U dospělých a dětských pacientů je účinnost Glivecu hodnocena podle stupně celkové hematologické a cytogenetické odpovědi a přežívání bez progrese onemocnění u CML, podle stupně hematologické a cytogenetické odpovědi u Ph+ ALL, MDS/MPD, podle stupně hematologické odpovědi u HES/CEL a podle stupně objektivní odpovědi u dospělých pacientů s inoperabilním a/nebo metastatickým GIST a DFSP a na základě přežití bez návratu onemocnění u adjuvantní léčby GIST. Zkušenosti s Glivecem u pacientů s MDS/MPD spojeným se změnou genu receptoru PDGFR jsou velmi omezené (viz bod 5.1). Kromě nově diagnostikované chronické fáze CML nej sou k dispozici žádné kontrolované studie, které by prokázaly klinický přínos nebo prodloužené přežití u těchto uvedených onemocnění.
4.2 Dávkování a způsob podání
Léčbu by měl zahájit lékař s odpovídajícími zkušenostmi v léčbě pacientů s hematologickými malignitami a maligními sarkomy.
Předepsaná dávka by měla být podávána perorálně s jídlem a zapíjena velkou sklenicí vody, aby se minimalizovalo riziko gastrointestinálního podráždění. Dávky 400 mg nebo 600 mg by měly být podávány jednou denně, zatímco dávka 800 mg by měla být podávána rozděleně na 400 mg dvakrát denně ráno a večer. Pro pacienty (děti), kteří nemohou polykat celé tobolky je možné naředit celý obsah tobolky ve sklenici neperlivé vody nebo v jablečnému džusu. Protože ve studiích na zvířatech byla prokázána reprodukční toxicita a možné riziko pro lidský plod není známé, je nutné ženám ve fertilním věku doporučit při otevírání tobolek zvýšenou opatrnost, tak aby nedošlo k inhalaci prášku nebo ke kontaktu prášku s kůží a očima (viz bod 4.6). Po manipulaci s otevřenou tobolkou je nutné si okamžitě umýt ruce.
Dávkování u CML u dospělých pacientů
Doporučená dávka Glivecu je pro dospělé pacienty v chronické fázi CML 400 mg/den. Chronická fáze CML je definována dosažením všech následujících kriterií: blasty v krvi a kostní dřeni < 15%, basofily v periferní krvi < 20%, krevní destičky > 100 x 109/l.
U dospělých pacientů s akcelerovanou fází je doporučená dávka Glivecu 600 mg/den. Akcelerovaná fáze onemocnění je určena přítomností kteréhokoli z následujících projevů: blasty v krvi nebo kostní dřeni > 15% ale < 30%, blasty a promyelocyty v krvi nebo kostní dřeni > 30% (za předpokladu < 30% blastů), basofily v periferní krvi > 20%, krevní destičky < 100 x 109/l bez vztahu k léčbě.
U dospělých pacientů v blastické krizi je doporučená dávka Glivecu 600 mg/den. Blastická krize je definována počtem blastů v krvi nebo kostní dřeni > 30% nebo extramedulárním postižením jiným než hepatosplenomegalií.
Trvání léčby: V klinických studiích pokračovala léčba Glivecem do progrese onemocnění. Efekt zastavení léčby po dosažení kompletní cytogenetické odpovědi nebyl zkoumán.
U pacientů v chronické fázi onemocnění je možno uvažovat o vzestupu dávky ze 400 mg na 600 mg nebo 800 mg, u pacientů s akcelerovanou fází onemocnění nebo v blastické krizi je možné zvýšit dávku ze 600 mg na maximum 800 mg (podáváno 2krát denně 400 mg), při absenci závažných nežádoucích účinků nebo závažné neutropenii či trombocytopenii nesouvisející s leukemií, za následujících okolností: při progresi onemocnění (kdykoliv); pokud nebylo ani po 3 měsících léčby dosaženo uspokojivé hematologické odpovědi; pokud nebylo po 12 měsících léčby dosaženo cytogenetické odpovědi; nebo při ztrátě předtím dosažené hematologické a/nebo cytogenetické odpovědi. Při zvyšování podávané dávky by měli být pacienti pečlivě sledováni pro možnost zvýšeného výskytu nežádoucích reakcí při vyšších dávkách.
Dávkování u CML u dětí
Dávkování pro děti by mělo být stanoveno podle tělesného povrchu (mg/m2). Dávka 340 mg/m2 denně se doporučuje dětem s chronickou fází CML nebo v pokročilé fázi CML (nepřekročit celkovou dávku 800 mg). Lék může být podáván jednou denně nebo může být celková denní dávka rozdělena do dvou částí - jedna ráno a druhá večer. Doporučené dávkování je v současnosti založeno na malém počtu dětských pacientů (viz body 5.1 a 5.2). S léčbou dětí do 2 let věku nejsou zkušenosti.
U dětí je možno uvažovat o vzestupu dávky z 340 mg/m2 denně na 570 mg/m2 denně (nepřekročit celkovou dávku 800 mg) při absenci závažných nežádoucích účinků nebo závažné neutropenii či trombocytopenii nesouvisející s leukemií za následujících okolností: při progresi onemocnění (kdykoliv), pokud nebylo ani po 3 měsících léčby dosaženo uspokojivé hematologické odpovědi, pokud nebylo po 12 měsících léčby dosaženo cytogenetické odpovědi, nebo při ztrátě před tím dosažené hematologické a/nebo cytogenetické odpovědi. Při zvyšování podávané dávky by měli být pacienti pečlivě sledováni pro možnost zvýšeného výskytu nežádoucích reakcí při vyšších dávkách.
Dávkování u Ph+ ALL u dospělých pacientů
U dospělých pacientů s Ph+ ALL je doporučená dávka Glivecu 600 mg/den. Hematologičtí odborníci pro léčbu tohoto onemocnění by měli terapii sledovat během všech fází péče.
Léčebný režim: Podle dosavadních údajů byla prokázána účinnost a bezpečnost Glivecu u dospělých pacientů s nově diagnostikovanou Ph+ ALL, pokud se podával v dávce 600 mg/den v kombinaci s chemoterapií v indukční fázi, v konsolidační a udržovací fázi po chemoterapii (viz bod 5.1). Délka léčby Glivecem se může lišit s vybraným léčebným programem, ale obecně delší expozice Glivecu přináší lepší výsledky.
Pro dospělé pacienty s recidivující nebo refrakterní Ph+ ALL je monoterapie Glivecem při dávce 600 mg/den bezpečná, účinná a může být podávána, dokud se neobjeví progrese onemocnění.
Dávkování u Ph+ ALL u dětí
Dávkování pro děti má být stanoveno podle tělesného povrchu (mg/m2). U dětí s Ph+ ALL se doporučuje dávka 340 mg/m2 denně (nepřekročit celkovou dávku 600 mg).
Dávkování u MDS/MPD
U dospělých pacientů s MDS/MPD je doporučená dávka Glivecu 400 mg/den.
Trvání léčby: V jediné dosud provedené klinické studii pokračovala léčba Glivecem do progrese onemocnění (viz bod 5.1). V čase analýzy byl medián trvání léčby 47 měsíců (24 dnů - 60 měsíců).
Dávkování u HES/CEL
U dospělých pacientů s HES/CEL je doporučená dávka Glivecu 100 mg/den.
Zvýšení dávky ze 100 mg na 400 mg lze zvažovat při absenci nežádoucích účinků léčiva, a jestliže je při hodnocení léčby prokázána nedostatečná odpověď na léčbu.
Léčba by měla pokračovat tak dlouho, dokud je pro pacienta přínosná.
Dávkování u GIST
U dospělých pacientů s inoperabilním a/nebo metastatickým maligním GIST je doporučená dávka Glivecu 400 mg/den.
Existuje pouze omezené množství údajů o účinku zvýšení dávky ze 400 mg na 600 mg nebo 800 mg u pacientů s progresí při užívání nižší dávky (viz bod 5.1).
Trvání léčby: v klinických studiích pokračovala léčba pacientů s GIST do progrese onemocnění. V době analýzy byl medián trvání léčby 7 měsíců (7 dní až 13 měsíců). Efekt zastavení léčby po dosažení odpovědi nebyl studován.
Doporučená dávka Glivecu pro adjuvantní léčbu dospělých pacientů po resekci GIST je 400 mg/den. Optimální délka trvání léčby dosud není stanovena. Délka léčby v klinických studiích, které byly podkladem pro tuto indikaci, byla 36 měsíců (viz bod 5.1).
Dávkování u DFSP
U dospělých pacientů s DFSP je doporučená dávka Glivecu 800 mg/den.
Úprava dávkování pro nežádoucí účinky
Nehematologické nežádoucí účinky
Jestliže se při léčbě Glivecem vyskytnou závažné nehematologické nežádoucí účinky, musí být léčba do jejich zvládnutí přerušena. Potom může být léčba přiměřeně obnovena v závislosti na počáteční závažnosti příhody.
Při zvýšení hladiny bilirubinu > 3násobek stanoveného horního limitu normálu (IULN) nebo při zvýšení hladin jaterních transamináz > 5násobek IULN by měla by být léčba Glivecem přerušena, dokud se hladiny bilirubinu nevrátí k < 1,5násobku IULN a hladiny transamináz k < 2,5násobku IULN. Léčba Glivecem potom může pokračovat nižšími denními dávkami. U dospělých by měla být dávka snížena ze 400 na 300 mg nebo ze 600 na 400 mg nebo z 800 mg na 600 mg a u dětí ze 340 na 260 mg/m2/den.
Hematologické nežádoucí účinky
Při závažné neutropenii nebo trombocytopenii se doporučuje snížení dávky nebo přerušení léčby tak, jak je uvedeno v následující tabulce.
Úprava dávkování při neutropenii nebo trombocytopenii:
|
HES/CEL (zahajovací dávka 100 mg) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem na úroveň předchozí dávky (tj. před vážnými nežádoucími reakcemi). |
|
Chronická fáze CML, MDS/MPD a GIST (zahajovací dávka 400 mg) HES/CEL (dávka 400 mg) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem na úroveň předchozí dávky (tj. před vážnými nežádoucími reakcemi). 3. V případě opakování ANC < 1,0 x 109/l a/nebo krevních destiček k < 50 x 109/l, opakujte bod 1 a léčbu Glivecem obnovte sníženou dávkou 300 mg. |
|
Chronická fáze CML u dětí (dávka 340 mg/m2) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem na úroveň předchozí dávky (tj. před vážnými nežádoucími reakcemi). 3. V případě opakování ANC < 1,0 x109/l a/nebo krevních destiček < 50 x109/l, opakujte bod 1 a léčbu Glivecem obnovte sníženou dávkou 260 mg/m2. |
|
Akcelerovaná fáze CML a blastická krize a Ph+ ALL (počáteční dávka 600 mg) |
aANC < 0,5 x 109/l a/nebo krevní destičky < 10 x 109/l |
1. Zjistěte, zda cytopenie souvisí s leukemií (aspirací kostní dřeně nebo biopsií). 2. Pokud cytopenie nesouvisí s leukemií, snižte dávku Glivecu na 400 mg. 3. Pokud cytopenie přetrvává po 2 týdny, snižte dále dávku na 300 mg. 4. Pokud cytopenie přetrvává po 4 týdny a stále nesouvisí s leukemií, přerušte podávání Glivecu dokud není ANC > 1 x 109/l a krevní destičky > 20 x 109/l, potom obnovte léčbu dávkou 300 mg. |
|
Akcelerovaná fáze CML a blastická krize u dětí (počáteční dávka 340 mg/m2) |
aANC < 0,5 x 109/l a/nebo krevní destičky < 10 x 109/l |
1. Zjistěte, zda cytopenie souvisí s leukemií (aspirací kostní dřeně nebo biopsií). 2. Pokud cytopenie nesouvisí s leukemií, snižte dávku Glivecu na 260 mg/m2. 3. Pokud cytopenie přetrvává po 2 týdny, snižte dále dávku na 200 mg/m2. 4. Pokud cytopenie přetrvává po 4 týdny a stále nesouvisí s leukemií, přerušte podávání Glivecu, dokud není ANC > 1 x 109/l a krevní destičky > 20 x 109/l, potom obnovte léčbu dávkou 200 mg/m2. |
|
DFSP (při dávce 800 mg) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem v dávce 600 mg. 3. V případě opakování ANC < 1,0 x 109/l a/nebo krevních destiček k < 50 x 109/l, opakujte bod 1 a léčbu Glivecem obnovte se sníženou dávkou 400 mg. |
|
ANC = absolutní počet neutrofilů a výskyt nejméně po 1 měsíci léčby | ||
Zvláštní populace
Užití u dětí: Nejsou žádné zkušenosti s podáváním u dětí s CML mladších než 2 roky a u dětí s Ph+ ALL mladších než 1 rok (viz bod 5.1). Zkušenosti u dětí s MDS/MPD, DFSP, GIST a HES/CEL jsou velmi omezené.
Bezpečnost a účinnost imatinibu u dětí mladších než 18 let s MDS/MPD, DFSP, GIST a HES/CEL nebyla v klinických studiích stanovena. V současnosti dostupné publikované údaje jsou shrnuty v bodě 5.1, ale na jejich základě nelze učinit žádná doporučení ohledně dávkování.
Jaterní nedostatečnost: Imatinib je metabolizován především játry. Pacientům s mírnou, středně těžkou nebo těžkou dysfunkcí jater by měla být podávána minimální doporučená dávka 400 mg denně. Dávka může být snížena, pokud není tolerována (viz body 4.4, 4.8 a 5.2).
Klasifikace dysfunkce jater:
|
Dysfunkce jater |
Vyšetření jaterních funkcí |
|
Mírná |
Celkový bilirubin: = 1,5 ULN AST: > ULN (může být normální nebo < ULN, pokud celkový bilirubin je > ULN) |
|
Středně těžká |
Celkový bilirubin: > 1,5—3,0 ULN AST: jakákoliv |
|
Těžká |
Celkový bilirubin: > 3-10 ULN AST: jakákoliv |
ULN = horní hranice normy AST = aspartátaminotransferáza
Ledvinná nedostatečnost: U pacientů s dysfunkcí ledvin nebo u dialyzovaných pacientů má být použita počáteční minimální dávka 400 mg denně. U těchto pacientů se však doporučuje opatrnost. Pokud dávka není tolerována, může být snížena. Pokud je tolerována, může být v případě nedostatečné účinnosti zvýšena (viz bod 4.4 a 5.2).
Starší lidé: U starších lidí nebyla farmakokinetika imatinibu cíleně studována. V klinických studiích, které zahrnovaly 20% pacientů ve věku 65 let a starších, nebyly u dospělých pacientů pozorovány významné rozdíly ve farmakokinetice v závislosti na věku. U starších lidí není nutné doporučovat zvláštní dávkování.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Pokud je Glivec podáván společně s jinými léčivými přípravky, je možné očekávat lékové interakce. Při užívání Glivecu s inhibitory proteáz, azolovými antimykotiky, některými makrolidy (viz bod 4.5), substráty CYP3A4 s úzkým terapeutickým rozpětím (např. cyklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin, fentanyl, alfentanil, terfanadin, bortezomib, docetaxel, chinidin) nebo warfarinem a jinými deriváty kumarinu je nutné dbát opatrnosti (viz bod 4.5).
Souběžné užívání imatinibu a léčivých přípravků, které indukují CYP3A4 (např. dexamethason, fenytoin, karbamazepin, rifampicin, fenobarbital nebo Hypericum perforatum, také známé jako třezalka tečkovaná) mohou významně snižovat hladinu Glivecu a potenciálně zvyšovat riziko selhání léčby Proto by se mělo zabránit souběžnému užívání silných induktorů CYP3A4 a imatinibu (viz bod 4.5).
Hypotyreóza
Během léčby Glivecem byly hlášeny klinické případy hypotyreózy u pacientů, kterým byla provedena tyreoidektomie a kteří byli substitučně léčeni levothyroxinem (viz bod 4.5). U těchto pacientů je třeba důkladně kontrolovat hladiny tyreotropního hormonu (TSH).
Hepatotoxicita
Glivec je metabolizován převážně játry a pouze 13% je vylučováno ledvinami. U pacientů s dysfunkcí jater (mírnou, středně závažnou nebo závažnou) by měl být pečlivě sledován počet krevních elementů v periferní krvi a jaterní enzymy (viz body 4.2, 4.8 a 5.2). Je nutné si uvědomit, že pacienti s GIST mohou mít jaterní metastázy, které mohou vést ke zhoršení jaterních funkcí.
Při léčbě imatinibem byly pozorovány případy jaterního poškození včetně jaterního selhání a jaterní nekrózy. Pokud bylo podávání imatinibu kombinováno s vysokodávkovými chemoterapeutickými režimy, byl zjištěn nárůst závažných jaterních reakcí. Jaterní funkce by měly být pečlivě monitorovány, jestliže se imatinib kombinuje s chemoterapeutickými režimy, o kterých je také známo, že bývají spojeny s poruchou jaterních funkcí (viz bod 4.5 a 4.8).
Retence tekutin
Výskyt závažné retence tekutin (pleurální výpotek, edém, plicní edém, ascites, povrchový edém) byl hlášen přibližně u 2,5% nově diagnostikovaných pacientů s CML užívajících Glivec. Proto se velice doporučuje pravidelné vážení pacientů. Neočekávaný, rychlý nárůst tělesné hmotnosti by měl být pečlivě vyšetřen, a pokud je to nezbytné, měla by být zavedena příslušná podpůrná a léčebná opatření.
V klinických studiích byl zvýšený výskyt těchto příhod u starších lidí a u pacientů se srdečním onemocněním v anamnéze. Proto je nutné pacientům se srdeční dysfunkcí věnovat zvýšenou pozornost.
Pacienti se srdečním onemocněním
Pacienti se srdečním onemocněním, s rizikovými faktory vzniku srdečního selhání nebo renálním selháním v anamnéze by měli být pečlivě sledováni, a každý pacient s příznaky nebo projevy shodnými s příznaky srdečního nebo renálního selhání by mělo být vyšetřen a léčen.
U pacientů s hypereosinofilním syndromem (HES) s okultní infiltrací HES buněk do myokardu byly ojedinělé případy kardiogenního šoku či dysfunkce levé komory spojeny s degranulací HES buněk po zahájení léčby imatinibem. Dle hlášení byl stav reverzibilní při podávání systémových kortikosteroidů, zavedení opatření k podpoře cirkulace a dočasném vysazení imatinibu. Protože byly hlášeny méně časté kardiální nežádoucí účinky při podávání Glivecu, mělo by být před zahájením léčby pečlivě zváženo stanovení prospěchu/rizika léčby imatinibem u pacientů s HES/CEL.
Myelodysplastické/myeloproliferativní onemocnění se změnou genu receptoru PDGFR by mohlo být spojeno s vysokými hladinami eosinofilů. Proto by se mělo před podáním Glivecu pacientům s HES/CEL a pacientům s MDS/MPD spojeným s vysokými hladinami eosinofilů zvážit vyšetření odborníkem kardiologem, provedení echokardiogramu a stanovení troponinu v séru. Pokud je výsledek kteréhokoli vyšetření abnormální, mělo by být zváženo vyšetření odborníkem kardiologem a profylaktické podávání systémových kortikosteroidů (1-2 mg/kg) po dobu jednoho až dvou týdnů souběžně se zahájením léčby imatinibem.
Gastrointestinální krvácení
Ve studii u pacientů s inoperabilním a/nebo metastatickým GIST bylo hlášeno jak gastrointestinální, tak i intratumorózní krvácení (viz bod 4.8). Na základě dostupných údajů nebyly identifikovány žádné predispoziční faktory (např.velikost nádoru, lokalizace nádoru, poruchy koagulace), které by zařadily pacienty s GIST do skupiny s vyšším rizikem kteréhokoli typu krvácení. Protože je zvýšená vaskularizace a sklon ke krvácivosti součástí povahy a klinického průběhu GIST, měl by být u všech pacientů použit standardní postup pro monitorování a zvládání krvácení.
V postmarketingovém období byla u pacientů s CML, ALL a jinými onemocněními hlášena také gastrická antrální vaskulární ektázie (GAVE), vzácný typ gastrointestinálního krvácení (viz bod 4.8).
V případě potřeby může být léčba přípravkem Glivec ukončena.
Syndrom nádorového rozpadu
Před započetím léčby přípravkem Glivec je doporučená úprava klinicky významné dehydratace a léčba vysokých hladin kyseliny močové z důvodu možného výskytu syndromu nádorového rozpadu (TLS) (viz bod 4.8).
Reaktivace hepatitidy B
U pacientů, kteří jsou chronickými nosiči hepatitidy B, dochází k reaktivaci po zahájení léčby inhibitory tyrosinkinázy bcr-abl. Některé případy vyústily v akutní selhání jater nebo ve fulminantní hepatitidu vedoucí k transplantaci jater nebo došlo k úmrtí pacienta.
Před zahájením léčby přípravkem GLIVEC mají být pacienti vyšetřeni na infekci HBV. Před zahájením léčby u pacientů s pozitivní sérologií hepatitidy B (včetně těch s aktivním onemocněním) a u pacientů, u kterých v průběhu léčby vyjde pozitivní test infekce HBV, je třeba se obrátit na odborníky na onemocnění jater a léčbu hepatitidy B. Nosiči HBV, kteří potřebují léčbu přípravkem GLIVEC, mají být po celou dobu léčby a několik měsíců po jejím ukončení pečlivě sledováni s ohledem na možný výskyt známek a příznaků aktivní infekce HBV (viz bod 4.8).
Laboratorní testy
Během léčby Glivecem musí být pravidelně vyšetřován kompletní krevní obraz. Léčba Glivecem u pacientů s CML byla doprovázena výskytem neutropenie nebo trombocytopenie. Avšak výskyt těchto cytopenií pravděpodobně souvisí se stádiem léčeného onemocnění a byl častější u pacientů s akcelerovanou fází CML nebo v blastické krizi než u pacientů s chronickou fází CML. Léčba Glivecem může být přerušena nebo dávky mohou být sníženy, jak je doporučeno viz bod 4.2.
U pacientů užívajících Glivec by měly být pravidelně monitorovány jaterní funkce (transaminázy, bilirubin, alkalická fosfatáza).
U pacientů s poruchou renálních funkcí je expozice imatinibem v plazmě patrně vyšší, než u pacientů s normální funkcí ledvin, pravděpodobně v důsledku zvýšené hladiny alfa-acid glycoproteinu (AGP) a vazby imatinibu na proteiny u těchto pacientů. Pacientům s renální nedostatečností by se měla podávat minimální zahajovací dávka. Pacienti se závažnou renální nedostatečností by měli být léčeni s opatrností. Pokud není dávka imatinibu tolerována, může být snížena (viz body 4.2 a 5.2).
Dlouhodobá léčba imatinibem může být spojená s klinicky významným omezením renálních funkcí. Proto mají být renální funkce před zahájením léčby imatinibem vyhodnoceny a během léčby pečlivě sledovány, pozornost má být věnována pacientům, u nichž se projevují rizikové faktory pro renální dysfunkci. Pokud je zjištěna renální dysfunkce, musí být předepsána vhodná opatření a léčba, která je v souladu se standardními léčebnými doporučeními.
Pediatrická populace
U dětí a jedinců v prepubertálním věku (preadolescentů) užívajících imatinib byly hlášené případy retardace růstu. Dlouhodobé účinky prodloužené léčby imatinibem na růst dětí nejsou známé. Proto je doporučené pečlivé sledování růstu dětí léčených imatinibem (viz bod 4.8).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Léčivé látky, které mohou zvyšovat koncentraci imatinibu v plazmě:
Látky, které inhibují aktivitu izoenzymu CYP3A4 cytochromu P450 (např. inhibitory proteáz jako je indinavir, lopinavir/ritonavir, ritonavir, sachinavir, telaprevir, nelfinavir, boceprevir; azolová antimykotika zahrnující ketokonazol, itrakonazol, posakonazol, vorikonazol; některé makrolidy jako je erythromycin, klarithromycin a telithromycin) by mohly snižovat metabolismus a zvyšovat koncentraci imatinibu. Při souběžné jednotlivé dávce ketokonazolu (inhibitoru CYP3A4) zdravým jedincům bylo pozorováno významné zvýšení účinku imatinibu (průměrná Cmax imatinibu vzrostla o 26% a AUC o 40%). Při podávání Glivecu s inhibitory skupiny CYP3A4 je nutná opatrnost.
Léčivé látky, které mohou snižovat koncentraci imatinibu v plazmě:
Látky, které indukují aktivitu CYP3A4 (např. dexamethason, fenytoin, karbamazepin, rifampicin, fenobarbital, fosfenytoin, primidon nebo Hypericum perforatum, známé také jako třezalka tečkovaná) mohou významně snižovat působení Glivecu a potenciálně zvyšovat riziko selhání léčby. Předchozí léčba opakovaným podáním rifampicinu 600 mg následovaná jednorázovou dávkou 400 mg Glivecu měla za následek snížení Cmax nejméně o 54% a AUC(0-<X)) o 74% ve srovnání s hodnotami bez předchozí léčby rifampicinem. Podobné výsledky byly pozorovány u pacientů s maligními gliomy, kteří byli léčeni Glivecem a užívali antiepileptické léky (EIAEDs) jako např. karbamazepin, oxkarbazepin a fenytoin, které indukovaly příslušné jaterní enzymy. Došlo ke snížení AUC imatinibu v plazmě o 73% oproti pacientům, kteří neužívali EIAEDs. Mělo by se zabránit souběžnému užívání rifampicinu nebo jiných silných induktorů CYP3A4 a imatinibu.
Léčivé látky, jejichž koncentrace v plazmě by mohla být ovlivněna Glivecem
Imatinib zvyšuje průměrnou Cmax simvastatinu 2krát a AUC simvastatinu (CYP3A4 substrát) 3,5krát, což znamená, že je CYP3A4 inhibován imatinibem. Při podávání Glivecu se substráty CYP3A4 s úzkým terapeutickým oknem se proto doporučuje opatrnost (např. cyklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin, fentanyl, alfentanil, terfenadin, bortezomib, docetaxel a chinidin). Glivec může zvyšovat plazmatickou koncentraci jiných léků metabolizovaných CYP3A4 (např. triazolo-benzodiazepinů, dihydropyridinových blokátorů kalciových kanálů, některých inhibitorů HMG-CoA reduktázy, tj. statinů, atd.).
Vzhledem ke známému zvýšenému riziku krvácení spojenému s užíváním imatinibu (např. hemoragie) by měli pacienti vyžadující antikoagulační léčbu místo kumarinových derivátů, jako je warfarin, dostávat nízkomolekulární nebo standardní heparin.
In vitro Glivec inhibuje aktivitu izoenzymu CYP2D6 cytochromu P450 v koncentraci podobné té, která ovlivňuje aktivitu CYP3A4. Imatinib v dávce 400 mg dvakrát denně působil inhibičně na metabolismus metoprololu zprostředkovaný CYP2D6; došlo ke zvýšení Cmax a AUC metoprololu o přibližně 23% (90% CI [1,16-1,30]).Zdá se, že při souběžném podávání imatinibu se substráty CYP2D6 není nutno upravovat dávkování, doporučuje se však věnovat zvýšenou pozornost substrátům CYP2D6 s úzkým terapeutickým oknem, jako je např. metoprolol. U pacientů léčených metoprololem je nutno zvážit klinické monitorování.
In vitro Glivec inhibuje O-glukuronidaci paracetamolu s Ki hodnotou 58,5 mikromol/l. Tato_inhibice nebyla zjištěna po podání Glivecu 400 mg a paracetamolu 1000 mg in vivo. Vyšší dávky Glivecu a paracetamolu nebyly studovány.
Obezřetnost by proto měla být uplatněna při souběžném užívání vyšších dávek Glivecu a paracetamolu.
U pacientů s tyreoidektomií léčených levothyroxinem, může být plazmatická expozice levothyroxinu snížena, pokud se podává spolu s Glivecem (viz bod 4.4). Proto se doporučuje opatrnost. Nicméně mechanismus pozorované interakce v současnosti není znám.
U pacientů s Ph+ ALL existují klinické zkušenosti souběžného podávání Glivecu a chemoterapie (viz bod 5.1), avšak lékové interakce mezi imatinibem a chemoterapeutickými režimy nejsou dobře známy. Nežádoucí účinky imatinibu jako jaterní toxicita, myelosuprese a další se mohou zvyšovat, podle hlášení souběžné užívání s L-asparaginázou by mohlo být spojeno se zvýšením jaterní toxicity (viz bod 4.8). Proto je třeba zvláštní opatrnosti, pokud se Glivec užívá v kombinaci.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku
Ženám ve fertilním věku musí být doporučeno užívání účinné antikoncepce během léčby.
K dispozici jsou omezené údaje o podávání imatinibu těhotným ženámi. Studie na zvířatech však prokázaly reprodukční toxicitu (viz bod 5.3). Potenciální riziko pro plod není známé. Glivec lze v těhotenství použít pouze pokud je to nezbytně nutné. Pokud je během těhotenství užíván, pacientka musí být informována o možném riziku pro plod.
Kojení
O vylučování imatinibu do mateřského mléka jsou jen omezené informace. Studie na dvou kojících ženách ukázaly, že jak imatinib, tak jeho aktivní metabolit může být vylučován do mateřského mléka. Koeficient mléko/plazma imatinibu a jeho metabolitu zkoumaný u jedné pacientky byl stanoven 0,5 pro imatinib a 0,9 pro jeho metabilit, což nasvědčuje zvýšenému vylučováním metabolitu do mléka. Zvážíme-li kombinovanou koncentraci imatinibu a jeho metabolitu a maximální denní příjem mléka kojenci, byla by očekávaná celková expozice nízká (přibližně 10% terapeutické dávky). Nicméně, jelikož účinky expozice nízké dávce imatinibu u kojenců nejsou známé, neměly by ženy užívající imatinib kojit.
Fertilita
Fertilita u samců a samic potkanů nebyla v neklinických studiích ovlivněna (viz bod 5.3). Studie u pacientů užívajících Glivec zabývající se jeho účinky na fertilitu a spermatogenezi nebyly provedeny. Pacienti, kteří se obávají o svou fertilitu během léčby Glivecem, by se měli poradit se svým lékařem.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacienti by měli být upozorněni, že se u nich mohou během léčby imatinibem vyskytnout nežádoucí účinky, jako jsou závratě, neostré vidění nebo ospalost. Proto se při řízení nebo obsluze strojů doporučuje zvýšená opatrnost.
4.8 Nežádoucí účinky
U pacientů s pokročilým stadiem malignit se může vyskytovat řada různorodých zdravotních potíží vyvolaných základním onemocněním, jeho progresí nebo množstvím souběžně užívaných léčivých přípravků, což ztěžuje stanovení příčinné souvislosti výskytu nežádoucích reakcí.
Během klinického hodnocení léku u CML musela být z důvodu nežádoucích reakcí, které byly v příčinné souvislosti s podáváním léku, léčba přerušena pouze u 2,4% nově diagnostikovaných pacientů, u 4% pacientů v pozdní chronické fázi po selhání léčby interferonem, u 4% pacientů v akcelerované fázi po selhání léčby interferonem a u 5% pacientů v blastické krizi po selhání léčby interferonem. U pacientů s GIST bylo podávání hodnoceného léku přerušeno pro nežádoucí reakce související s lékem u 4% pacientů.
Nežádoucí účinky byly ve všech indikacích podobné, s výjimkou dvou reakcí. U pacientů s CML byla častěji pozorována myelosuprese než u pacientů s GIST, pravděpodobně způsobené základním onemocněním. Ve studii u pacientů s inoperabilním a/nebo metastatickým GIST se u 7 (5%) pacientů vyskytl CTC stupeň 3/4 GI krvácení (3 pacienti), krvácení do nádoru (3 pacienti) nebo obojí (1 pacient). Lokalizace GI nádorů může být zdrojem krvácení do zažívacího traktu (viz bod 4.4). Krvácení do zažívacího traktu nebo z nádoru může být někdy velmi vážné, v některých případech až fatální. Nejčastěji hlášené (> 10%) nežádoucí reakce vyvolané lékem v obou souborech byly mírná nauzea, zvracení, průjem, bolesti břicha, únava, svalové bolesti, svalové křeče a vyrážka. Povrchové otoky byly společným nálezem ve všech studiích a byly popisovány hlavně jako otoky kolem očí nebo otoky dolních končetin. Tyto otoky však byly jen vzácně závažné a bylo možné je zvládnout diuretiky, jinou podpůrnou léčbou nebo snížením dávky Glivecu.
Pokud se imatinib kombinoval s vysokou dávkou chemoterapie u pacientů s Ph+ ALL, byla pozorována přechodná jaterní toxicita ve formě zvýšení transamináz a hyperbilirubinemie. Při použití omezených údajů z bezpečnostních databází se dosud hlášené nežádoucí účinky u dětí shodují se známým bezpečnostním profilem u dospělých pacientů s Ph+ ALL. Databáze týkající se bezpečnosti u dětí s Ph+ ALL je velmi omezená, protože nebyly zjistěné nové bezpečnostní události.
Různorodé nežádoucí účinky, jako je pleurální výpotek, ascites, plicní edém a rychlý přírůstek tělesné hmotnosti s nebo bez superficiálních otoků, je možné souhrnně popsat jako „retence tekutin“. Tyto nežádoucí reakce je možné obvykle zvládnout dočasným vysazením Glivecu a diuretiky a jinou vhodnou podpůrnou léčbou. Avšak některé z těchto reakcí mohou být velmi závažné nebo život ohrožující a několik pacientů s blastickou krizí zemřelo s komplexním klinickým nálezem zahrnujícím pleurální výpotek, městnavé srdeční selhání a selhání ledvin. V klinických studiích nebyly u dětí pozorovány specificky odlišné nežádoucí účinky.
Nežádoucí účinky
Nežádoucí účinky, které se vyskytly častěji než v ojedinělých případech jsou uvedeny níže podle orgánové klasifikace a frekvence výskytu. Kategorie frekvencí výskytu jsou definovány podle následujících pravidel jako: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
V každé skupině četností jsou nežádoucí účinky seřazeny podle četnosti od nejčastější.
Nežádoucí účinky a četnost jejich výskytu jsou uvedené v Tabulce 1.
Tabulka 1 Přehled nežádoucích účinků v tabulce
|
Infekce a infestace | |
|
Méně časté: |
Herpes zoster, herpes simplex, nasofaryngitida, pneumonie1, sinusitida, celulitida, infekce horních cest dýchacích, chřipka, infekce močových cest, gastroenteritida, sepse |
|
Vzácné: |
Plísňové infekce |
|
Není známo: |
Reaktivace hepatitidy B* |
|
Novotvary benigní, maligní, a blíže neurčené (zahrnující cysty a polypy) | |
|
Vzácné: |
Syndrom nádorového rozpadu |
|
Není známo: |
Krvácení do tumoru/nekróza tumoru* |
|
Poruchy imunitního systému | |
|
Není známo: |
Anafylaktický šok* |
|
Poruchy krve a lymfatického systému | |
|
Velmi časté: |
Neutropenie, trombocytopenie, anemie |
|
Časté: |
Pancytopenie, febrilní neutropenie |
|
Méně časté: |
Trombocytemie, lymfopenie, útlum kostní dřeně, eozinofilie, lymfadenopatie |
|
Vzácné: |
Hemolytická anemie |
|
Poruchy metabolismu a výživy | |
|
Časté: | |
|
Méně časté: |
Hypokalemie, zvýšená chuť k jídlu, hypofosfatemie, snížená chuť k jídlu, dehydratace, dna, hyperurikemie, hyperkalcemie, hyperglykemie, hyponatremie |
|
Vzácné: |
Hyperkalemie, hypomagnezémie |
|
Psychiatrické poruchy | |
|
Časté: | |
|
Méně časté: | |
|
Vzácné: |
Stav zmatenosti |
|
Poruchy nervového systému | |
|
Velmi časté: |
Bolesti hlavy2 |
|
Časté: |
Závratě, parestezie, porucha chutě, hypestezie |
|
Méně časté: |
Migréna, somnolence, synkopa, periferní neuropatie, zhoršení paměti, ischias, syndrom neklidných nohou, třes, mozkové krvácení |
|
Vzácné: |
Zvýšený intrakraniální tlak, křeče, optická neuritida |
|
Není známo: |
Cerebrální edém* |
|
Poruchy oka | |
|
Časté: |
Otok očních víček, zvýšené slzení, krvácení do spojivky, konjunktivitida, syndrom suchého oka, rozmazané vidění |
|
Méně časté: |
Podráždění očí, bolesti očí, edém očnice, krvácení do bělimy, krvácení do sítnice, blefaritida, makulární edém |
|
Není známo: |
Krvácení do sklivce* |
|
Poruchy ucha a labyrintu | |
|
Méně časté: |
Vertigo, tinitus, ztráta sluchu |
|
Srdeční poruchy | |
|
Méně časté: |
Palpitace, tachykardie, městnavé srdeční selhání3, plicní edém |
|
Vzácné: |
Arytmie, atriální fibrilace, srdeční zástava, infarkt myokardu, angina pectoris, perikardiální výpotek |
|
Není známo: |
Perikarditida*, srdeční tamponáda* |
|
Cévní poruchy4 | |
|
Časté: |
Zrudnutí, krvácení |
|
Méně časté: |
Hypertenze, hematomy, subdurální hematom, periferní chlad, hypotenze, Raynaudův fenomén |
|
Není známo: |
T rombóza/ embolie* |
|
Respirační, hrudní a mediastinální poruchy | |
|
Časté: | |
|
Méně časté: |
Pleurální výpotek5, bolesti hrtanu/hltanu, faryngitida |
|
Vzácné: |
Bolest pohrudnice, plicní fibróza, plicní hypertenze, krvácení do plic |
|
Není známo: |
Akutní respirační selhání10*, intersticiální plicní onemocnění* |
|
Gastrointestinální poruchy | |
|
Velmi časté: | |
|
Časté: |
Nadýmání, rozpětí břicha, gastro-ezofageální reflux, zácpa, sucho v ústech, gastritida |
|
Méně časté: |
Stomatitida, ulcerace v ústech, gastrointestinální krvácení7, říhání, meléna, ezofagitida, ascites, žaludeční ulcerace, hematemeze, cheilitida, dysfagie, pankreatitida |
|
Vzácné: |
Kolitida, ileus, zánětlivé střevní onemocnění |
|
Není známo: |
Ileus/neprůchodnost střev*, gastrointestinální perforace*, divertikulitida*, gastrická antrální vaskulární ektázie (GAVE)* |
|
Poruchy jater a žlučových cest | |
|
Časté: |
Zvýšení jaterních enzymů |
|
Méně časté: |
Hyperbilirubinemie, hepatitida, žloutenka |
|
Vzácné: |
Jaterní selhání8, jaterní nekróza |
|
Poruchy kůže a podkožní tkáně | |
|
Velmi časté: |
Periorbitální edém, dermatitida/ekzém/vyrážka |
|
Časté: |
Pruritus, otok obličeje, suchá pleť, erytém, alopecie, noční pocení, reakce fotosensitivity |
|
Méně časté: |
Pustulózní vyrážka, zhmožděniny, zvýšené pocení, urtikarie, ekchymóza, zvýšená tendence k tvorbě podlitin, hypotrichóza, hypopigmentace kůže, exfoliativní dermatitida, lámání nehtů, folikulitida, petechie, lupénka, purpura, hyperpigmentace kůže, výsev puchýřků |
|
Vzácné: |
Akutní febrilní neutrofilní dermatóza (Sweet’s syndrome), ztráta barvy nehtů, angioneurotický edém, puchýřkovitá vyrážka, multiformní erytém, leukocytoklastická vaskulitida, Stevens-Johnsonův syndrom, akutní generalizovaná exantematózní pustulóza (AGEP) |
|
Není známo: |
Syndrom palmoplantární erytrodysestezie*, lichenoidní keratóza*, lichen planus*, toxická epidermální nekrolýza*, poléková vyrážka s eozinofilií a systémovými příznaky (DRESS)* |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | |
|
Velmi časté: |
Svalové křeče a záchvaty křečí, muskuloskeletární bolesti včetně myalgie, artralgie, bolesti kostí9 |
|
Časté: |
Otoky kloubů |
|
Méně časté: |
Kloubní a svalová ztuhlost |
|
Vzácné: |
Svalová slabost, artritida, rabdomyolýza/myopatie |
|
Není známo: |
Avaskulární nekróza/nekróza kyčle*, retardace růstu u dětí* |
|
Poruchy ledvin a močových cest | |
|
Méně časté: |
Bolesti ledvin, hematurie, akutní selhání ledvin, zvýšená frekvence močení |
|
Není známo: |
Chronické selhání ledvin |
|
Poruchy reprodukčního systému a prsu | |
|
Méně časté: |
Gynekomastie, erektilní dysfunkce, menoragie, nepravidelná menstruace, poruchy sexuální funkce, bolesti bradavek, zvětšení prsou, edém skrota |
|
Vzácné: |
Hemoragické žluté tělísko/hemoragické cysty na vaječní cích |
|
Celkové poruchy a reakce v místě aplikace | |
|
Velmi časté: |
Zadržování tekutin a edémy, únava |
|
Časté: |
Slabost, pyrexie, anasarka, mrazení, ztuhlost |
|
Méně časté: | |
|
Vyšetření | |
|
Velmi časté: |
Zvýšení hmotnosti |
|
Časté: |
Snížení hmotnosti |
|
Méně časté: |
Zvýšení koncentrace kreatininu v krvi, zvýšení kreatinfosfokinázy v krvi, zvýšení laktátdehydrogenázy v krvi, zvýšení alkalické fosfatázy v krvi |
|
Vzácné: |
Zvýšení amylázy v krvi |
* Tyto typy reakcí byly hlášeny po uvedení přípravku Glivec na trhu. Jsou zde zahrnuta spontánní hlášení nežádoucích účinků a také závažné nežádoucí účinky z pokračujících studií, programů rozšířeného přístupu k léčivému přípravku, studií klinické farmakologie a výzkumných studií v dosud neschválených indikacích. Protože tyto reakce jsou hlášeny z populace neurčitého rozsahu, není vždy možné spolehlivě odhadnout jejich četnost výskytu nebo stanovit kauzální vztah vůči expozici imatinibem.
1 Pneumonie byla nejčastěji hlášena u pacientů s transformovanou CML a u pacientů s GIST.
2 Bolesti hlavy byly nejčastější u pacientů s GIST.
3 Na podkladě hodnocení pacientoroků byly srdeční příhody včetně městnavého srdečního selhání pozorovány častěji u pacientů s transformovanou CML než u pacientů s chronickou CML.
4 Zrudnutí bylo nejčastější u pacientů s GIST a krvácení (hematomy, hemoragie) bylo nejčastější u pacientů s GIST a s transformovanou CML (CML-AP a CML-BC).
5 Pleurální výpotek byl častěji hlášen u pacientů s GIST a u pacientů s transformovanou CML (CML-AP a CML-BC) než u pacientů s chronickou CML.
6+7 Bolesti břicha a gastrointestinální krvácení byly nejčastěji pozorovány u pacientů s GIST.
8 Bylo hlášeno několik fatálních případů jaterního selhání a jaterních nekróz.
9 Muskuloskeletární bolesti a související příhody byly častěji pozorovány u pacientů s CML než u pacientů s GIST.
10 Fatální případy byly hlášeny u pacientů s pokročilým onemocněním, závažnými infekcemi, závažnou neutropenií a jinými závažnými konkomitantními stavy.
Změny hodnot laboratorních vyšetření Hematologie
U CML byly cytopenie, zvláště neutropenie a trombocytopenie, shodným nálezem ve všech studiích, s náznakem vyššího výskytu při vysokých dávkách > 750 mg (fáze I studie). Výskyt cytopenií byl však jasně závislý na stádiu onemocnění. Frekvence výskytu stupně 3 nebo 4 neutropenií (ANC
< 1,0 x 109/l) a trombocytopenií (počet destiček < 50 x 109/l) byly 4x a 6x častější v blastické krizi a akcelerované fázi onemocnění (59-64% pro neutropenii a 44-63% pro trombocytopenii) ve srovnání s nově diagnostikovanými pacienty s chronickou fází CML (16,7% neutropenií a 8,9% trombocytopenií). U nově diagnostikovaných pacientů s chronickou fází CML byl stupeň 4 neutropenie (ANC < 0,5 x 109/l) pozorován u 3,6% a trombocytopenie (počet destiček < 10 x 109/l) u
< 1% pacientů. Medián trvání neutropenické a trombocytopenické příhody byl obvykle v rozmezí od 2 do 3 týdnů a od 3 do 4 týdnů. Tyto příhody je možné obvykle zvládnout buď snížením dávky nebo přerušením léčby Glivecem, ale ve vzácných případech mohou vést k trvalému přerušení léčby. U dětských pacientů s CML byla nejčastějším pozorovaným hematologickým nežádoucím účinkem cytopenie stupně 3 nebo 4, která zahrnovala neutropenii, trombocytopenii a anemii. Většinou se objevily během prvních několika měsíců léčby.
Ve studii u pacientů s inoperabilním a/nebo metastatickým GIST byl popsán stupeň 3 anemie u 5,4% a stupeň 4 u 0,7% pacientů, které mohly souviset, alespoň u některých pacientů, s gastrointestinálním krvácením nebo krvácením do nádoru. Stupeň 3 neutropenie byl pozorován u 7,5% pacientů a stupeň 4 u 2,7% pacientů a stupeň 3 trombocytopenie byl u 0,7% pacientů. U žádného pacienta se nevyvinul stupeň 4 trombocytopenie. Snížení počtu bílých krvinek (WBC) a neutrofilů se objevilo hlavně během prvních šesti týdnů léčby, potom zůstávaly hodnoty relativně stabilní.
Biochemie
Závažné zvýšení hodnot transamináz (< 5%) nebo bilirubinu (< 1%) bylo pozorováno u pacientů s CML a obvykle je bylo možné zvládnout snížením dávky nebo přerušením léčby (medián trvání těchto příhod byl přibližně jeden týden). Léčba byla z důvodů abnormálních laboratorních hodnot jaterních testů trvale přerušena u méně než 1% pacientů s CML. U pacientů s GIST (studie B2222), bylo pozorováno zvýšení ALT (alaninaminotransferáza) stupně 3 nebo 4 u 6,8% a zvýšení AST (aspartátaminotransferáza) stupně 3 nebo 4 u 4,8%. Zvýšení bilirubinu bylo méně než 3%.
Byly to případy cytolytické a cholestatické hepatitidy a jaterního selhání; některé z nich byly fatální, včetně jednoho pacienta užívajícího vysoké dávky paracetamolu.
Popis vybraných nežádoucích účinků
Reaktivace hepatitidy B
V souvislosti s tyrosinkinázou bcr-abl byla zaznamenána reaktivace hepatitidy B. Některé případy vyústily v akutní selhání jater nebo ve fulminantní hepatitidu vedoucí k transplantaci jater nebo došlo k úmrtí pacienta (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Zkušenosti s dávkami vyššími než doporučená terapeutická dávka jsou omezené. Jednotlivé případy předávkování Glivecem byly hlášeny spontánně a v literatuře. V případě předávkování by měl být pacient pozorován a odpovídajícím způsobem léčen podpůrnou léčbou. Obecně byl v těchto případech hlášen výsledek „zlepšený“ nebo „vyléčený“. Následující příhody byly hlášeny při podání různých rozmezí dávky:
Dospělá populace
1200 až 1600 mg (délka trvání 1 až 10 dní): Nauzea, zvracení, průjem,vyrážka, zrudnutí kůže, edém, otoky, únava, svalové křeče, trombocytopenie, pancytopenie, bolest břicha, bolest hlavy, snížená chuť k jídlu.
1800 až 3200 mg (dosáhlo až 3200 mg denně po dobu 6 dnů): Slabost, myalgie, zvýšená hodnota kreatinfosfokinázy, zvýšená hodnota bilirubinu, gastrointestinální bolest.
6400 mg (jednotlivá dávka): V literatuře hlášený případ jednoho pacienta, u kterého se objevila nauzea, zvracení, bolest břicha, pyrexie, otok obličeje, snížený počet neutrocytů, zvýšení hodnot transamináz.
8 až 10 g (jednotlivá dávka): Bylo hlášené zvracení a gastrointestinální bolest.
Pediatrická populace
U 3letého chlapce, kterému byla podána jednotlivá dávka 400 mg, se objevilo zvracení, průjem a anorexie, u dalšího 3letého chlapce, kterému byla podána jednotlivá dávka 980 mg, byl zjištěn snížený počet bílých krvinek a průjem.
V případě předávkování by měl být pacient pozorován a vhodně léčen podpůrnou léčbou.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: inhibitor protein-tyrosinkinázy, ATC kód: L01XE01 Mechanismus účinku
Imatinib je nízkomolekulární inhibitor tyrosinkinázy, který účinně inhibuje aktivitu BCR-ABL tyrosinkinázy (TK) a dalších receptorových tyrosinkináz: KIT, receptor pro růstový faktor kmenových buněk (SCF, stem cell factor) kódovaný protoonkogenem c-Kit, receptory discoidinové domény (DDR1 and DDR2), receptor kolonie stimulujícího faktoru (CSF-1R) a receptory pro destičkový růstový faktor alfa a beta (PDGFR-alfa a PDGFR-beta). Imatinib také může inhibovat buněčné procesy, na kterých se tyto receptorové kinázy podílí.
Farmakodynamické účinky
Imatinib je inhibitor tyrosinkinázy, který účinně inhibuje Bcr-Abl tyrosinkinázu na buněčné úrovni in vitro i in vivo. Látka selektivně inhibuje proliferaci a indukuje apoptózu u Bcr-Abl pozitivních buněčných linií, stejně jako u čerstvých leukemických buněk od pacientů s CML s pozitivním Philadelphia chromozomem a od pacientů s akutní lymfoblastickou leukemií (ALL).
In vivo byl na zvířecích modelech s Bcr-Abl pozitivními nádorovými buňkami při monoterapii pozorován protinádorový účinek této látky.
Imatinib je také inhibitor receptorů tyrosinkinázy pro růstový faktor destiček - platelet-derived growth factor (PDGF), PDGF-R, faktoru kmenových buněk - stem cell factor (SCF), c-Kit, a inhibuje PDGF-a SCF-zprostředkované buněčné pochody. In vitro, imatinib inhibuje proliferaci a indukuje apoptózu gastrointestinálních stromálních nádorových buněk (GIST), které mají schopnost aktivovat kit mutaci. Konstitutivní aktivace receptorů pro PDGF či Abl proteinu tyrosinkinázy jako následek spojení rozdílných partnerských proteinů či konstitutivní produkce PDGF zřejmě hrají roli v patogenezi MDS/MPD, HES/CEL a DFSP. Imatinib inhibuje signalizaci a proliferaci buněk ovlivňovaných porušenou regulací aktivity PDGFR a Abl kinázy.
Klinické studie u chronické myeloidní leukemie
Účinnost Glivecu je založena na míře celkové hematologické a cytologické odpovědi a doby přežití bez progrese onemocnění. Kromě nově diagnostikované chronické fáze CML nejsou k dispozici kontrolované klinické studie, které by demonstrovaly klinický přínos, jako je zlepšení projevů onemocnění nebo prodloužení přežití.
Tři velké, mezinárodní, otevřené, nekontrolované studie fáze II byly provedeny u pacientů s pozitivním Philadelphia chromozomem (Ph+) s pokročilou CML, blastickou nebo akcelerovanou fází onemocnění, jinými Ph+ leukemiemi nebo s CML v chronické fázi, ale kde selhala předchozí léčba interferonem-alpha (IFN). Jedna velká, otevřená, multicentrická, mezinárodní randomizovaná studie fáze III byla provedena u pacientů s nově diagnostikovanou Ph+ CML. Navíc děti byly léčeny ve dvou studiích fáze I a v jedné studii fáze II.
Ve všech klinických studiích bylo 38-40% pacientů ve věku > 60 let a 10-12% pacientů bylo ve věku > 70 let.
Chronická fáze, nově diagnostikovaná: Studie fáze III u dospělých pacientů srovnávala léčbu Glivecem v monoterapii s kombinovanou léčbou interferonem-alpha (IFN) a cytarabinem (Ara-C). Bylo dovoleno, aby pacienti, u kterých nebylo dosaženo léčebné odpovědi (chybění kompletní hematologické odpovědi (CHR) v 6. měsíci, zvýšení počtu bílých krvinek, bez velké cytogenetické odpovědi (MCyR) ve 24. měsíci), se ztrátou odpovědi (CHR nebo MCyR) nebo se závažnou intolerancí léčby, byli převedeni do alternativního ramene léčby. V rameni s Glivecem byli pacienti léčeni dávkou 400 mg denně. V rameni s IFN byli pacienti léčeni s cílovou dávkou IFN 5 MIU/m2/den subkutánně v kombinaci se subkutánním podáním Ara-C 20 mg/m2/den po 10 dnů/měsíc.
Celkem bylo randomizováno 1 106 pacientů, 553 do každého ramene. Výchozí charakteristiky byly mezi oběma rameny dobře vyvážené. Medián věku byl 51 let (rozmezí 18-70 let), 21,9% pacientů bylo ve věku > 60 let. Bylo zde 59% mužů a 41% žen; 89,9% pacientů bylo bílé pleti a 4,7% černé pleti. Po sedmi letech od zařazení posledního pacienta byl medián trvání léčby v první linii 82 měsíců v rameni s Glivecem a 8 měsíců v rameni s IFN. Medián trvání léčby v druhé linii byl 64 měsíců v rameni s Glivecem. Souhrnně u pacientů,léčených Glivecem v první linii byla průměrná podávaná denní dávka 406 ± 76 mg. Primárním cílovým parametrem účinnosti ve studii bylo přežití bez progrese onemocnění. Progrese byla definována jako jakákoliv z následujících událostí: progrese do akcelerované fáze nebo blastické krize, úmrtí, ztráta CHR nebo MCyR, nebo u pacientů, kteří nedosáhli CHR, zvýšení počtu bílých krvinek navzdory přiměřené léčbě. Velká cytogenetická odpověď, hematologická odpověď, molekulární odpověď (hodnocení minimálního reziduálního onemocnění) doba do akcelerované fáze nebo blastické krize a přežívání jsou hlavními sekundárními cílovými parametry. Údaje o odpovědích jsou uvedeny v Tabulce 2.
Tabulka 2 Odpovědi na léčbu ve studii u nově diagnostikované CML (84měsíční data)
|
(Nejlepší míra odpovědi) |
Glivec n=553 |
IFN+Ara-C n=553 |
|
Hematologická odpověď | ||
|
Míra CHR n (%) |
534 (96,6%)* |
313 (56,6%)* |
|
[95% CI] |
[94,7%, 97,9%] |
[52,4%, 60,8%] |
|
Cytogenetická odpověď | ||
|
Velká odpověď n (%) |
490 (88,6%)* |
129 (23,3%)* |
|
[95% CI] |
[85,7%, 91,1%] |
[19,9%, 27,1%] |
|
Kompletní CyR n (%) |
456 (82,5%)* |
64 (11,6%)* |
|
Parciální CyR n (%) |
34 (6,1%) |
65 (11,8%) |
|
Molekulární odpověď** | ||
|
Velká odpověď ve 12. měsíci (%) |
153/305=50,2% |
8/83=9,6% |
|
Velká odpověď ve 24. měsíci (%) |
73/104=70,2% |
3/12=25% |
|
Velká odpověď v 84. měsíci (%) |
102/116=87,9% |
3/4=75% |
* p<0,001, Fischerův test významnosti
** procenta molekulární odpovědi jsou založená na dostupných vzorcích
Kritéria hematologické odpovědi (všechny odpovědi byly potvrzeny po > 4 týdnech):
Bílé krvinky < 10 x 109/l, krevní destičky < 450 x 109/l, myelocyty+metamyelocyty < 5% v krvi, žádné blasty a promyelocyty v krvi, basofily < 20%, žádné extramedulární postižení Kriteria cytogenetické odpovědi: kompletní (0% Ph+ metafáze), parciální (1-35%), malá (36-65%) nebo minimální (66-95%). Velká odpověď (0-35%) kombinuje obě odpovědi - kompletní a parciální. Kritéria velké molekulární odpovědi: v periferní krvi > 3-logaritmové snížení množství Bcr-Abl transkriptů (měřeno pomocí testu kvantitativní polymerázové řetězové reakce (PCR) reverzní transkriptázy v reálném čase) proti standardizované výchozí hodnotě._
Míra kompletní hematologické odpovědi, velké cytogenetické odpovědi a kompletní cytogenetické odpovědi na první linii léčby byla stanovena použitím Kaplan-Meierova postupu, pro který byly nedosažené odpovědi vyřazeny v den posledního vyšetření. S použitím tohoto postupu se stanovená kumulativní míra odpovědi v první linii léčby Glivecem zlepšila od 12. měsíce léčby do 84. měsíce léčby následovně: CHR z 96,4% na 98,4% a CCyR z 69,5% na 87,2%.
Při 7letém sledování bylo v rameni s Glivecem 93 (16,8%) příhod progrese: v 37 (6,7%) případech se jednalo o progresi do akcelerované fáze/blastické krize, v 31 (5,6%) o ztrátu MCyR, v 15 (2,7%) o ztrátu CHR nebo zvýšení WBC a v 10 (1,8%) o úmrtí nesouvisejících s CML. Naproti tomu bylo v rameni s IFN+Ara-C 165 (29,8%) příhod, z nichž 130 se vyskytlo během léčby IFN+Ara-C v první linii.
Odhadovaný podíl pacientů bez progrese do akcelerované fáze nebo blastické krize v 84. měsíci byl významně vyšší v rameni s Glivecem ve srovnání s ramenem s IFN (92,5% proti 85,1%, p<0,001). Roční míra progrese do akcelerované fáze nebo blastické krize se v průběhu léčby snižovala a ve čtvrtém a pátém roce byla menší než 1% za rok. Odhadovaná míra přežití bez progrese v 84. měsíci byla 81,2% v rameni s Glivecem a 60,6% u kontrolní skupiny (p<0,001). Roční míra progrese jakéhokoli typu se pro Glivec rovněž snižovala s časem.
Celkem ve skupině s Glivecem zemřelo 71 pacientů (12,8%) a 85 pacientů (15,4%) ve skupině s IFN+Ara-C. V 84. měsíci bylo celkové přežití ve skupině s Glivecem 86,4% (83, 90) oproti 83,3% (80, 87) ve skupině s IFN+Ara-C, (p=0,073, log-rank test). Cílový parametr „doba do výskytu příhody“ je výrazně ovlivněn vysokým podílem převedení z léčby IFN+Ara-C na léčbu Glivecem. Vliv léčby Glivecem na přežití v chronické fázi onemocnění nově diagnostikované CML byl dále zkoumán v retrospektivní analýze výše uvedených údajů o Glivecu s původními údaji z jiné studie fáze III, kde byl použit stejný léčebný režim IFN+Ara-C (n=325). V této retrospektivní analýze byly prokázány lepší výsledky celkového přežití (p<0,001) při podávání Glivecu oproti IFN+Ara-C; během 42 měsíců zemřelo 47 (8,5%) pacientů s Glivecem oproti 63 (19,4%) pacientům s IFN+Ara-C.
U pacientů léčených Glivecem měl stupeň dosažené cytogenetické odpovědi a molekulární odpovědi jednoznačný vliv na dlouhodobé výsledky léčby. Zatímco 96% (93%) pacientů s CCyR (PCyR) ve 12. měsíci, bylo v 84. měsíci bez progrese do akcelerované fáze/blastické krize, bylo bez progrese do pokročilé CML v 84 měsících pouze 81% pacientů bez MCyR ve 12 měsících (p<0,001 celkově, p=0,25 mezi CCyR a PCyR). U pacientů s nejméně 3-log redukcí Bcr-Abl transkriptů ve 12 měsících léčby, byla pravděpodobnost setrvání bez progrese do akcelerované fáze/blastické krize v 84 měsících 99%. Podobná zjištění byla shledána v analýze 18 měsíců léčby.
V této studii bylo povolené zvýšení dávky ze 400 mg denně na 600 mg denně, a potom ze 600 mg denně na 800 mg denně. Po 42 měsících sledování došlo u 11 pacientů k potvrzené ztrátě jejich cytogenetické odpovědi (během 4 týdnů). Z těchto 11 pacientů byla u 4 zvýšena dávka až na 800 mg denně, dva z nich znovu dosáhli cytogenetické odpovědi (jeden částečné a jeden kompletní, ten později dosáhl také molekulární odpovědi). Zatímco u 7 pacientů, kterým nebyla zvýšena dávka, pouze jeden dosáhl kompletní cytogenetické odpovědi. Procento výskytu některých nežádoucích účinků bylo vyšší u 40 pacientů, kterým byla dávka zvýšena na 800 mg denně, ve srovnání s populací pacientů před zvýšením dávky (n=551). Častější nežádoucí účinky zahrnovaly gastrointestinální krvácení, konjunktivitidu a zvýšení transamináz a bilirubinu. Další nežádoucí účinky byly hlášeny s menší nebo se stejnou frekvencí.
Chronická fáze, selhání léčby interferonem: 532 dospělých pacientů bylo léčeno úvodní dávkou 400 mg. Pacienti byli rozděleni do tří hlavních kategorií: hematologické selhání (29%), cytogenetické selhání (35%), nebo intolerance interferonu (36%). Medián doby, po kterou pacienti užívali předchozí léčbu IFN v dávce > 25 x 106 IU/týden, byl 14 měsíců a všichni byli v pozdní chronické fázi, medián doby od diagnózy byl 32 měsíců. Základním parametrem účinnosti ve studii byla míra velké cytogenetické odpovědi (kompletní a parciální odpověď, 0 až 35% Ph+ metafází v kostní dřeni).
V této studii dosáhlo 65% pacientů velké cytogenetické odpovědi, která byla kompletní u 53% (potvrzeno 43%) pacientů (Tabulka 3). Kompletní hematologické odpovědi bylo dosaženo u 95% pacientů.
Akcelerovaná fáze: Do studie bylo zařazeno 235 dospělých pacientů s akcelerovanou fází onemocnění. Léčba prvních 77 pacientů byla zahájena dávkou 400 mg, následně byl protokol doplněn a dovoloval podání vyšších dávek, zahajovací dávka pro zbývajících 158 pacientů byla 600 mg.
Základním parametrem účinnosti byla míra hematologické odpovědi, udávaná jako buď kompletní hematologická odpověď, žádný průkaz leukemie (tj. vymizení blastů z kostní dřeně a krve, ale bez úplné obnovy periferní krve jako při kompletní odpovědi), nebo návrat do chronické fáze CML. Potvrzené hematologické odpovědi bylo dosaženo u 71,5% pacientů (Tabulka 3). Důležité je, že 27,7% pacientů dosáhlo také hlavní cytogenetické odpovědi, která byla kompletní u 20,4% (potvrzena u 16%) pacientů. U pacientů léčených dávkou 600 mg, byl aktuální odhad mediánu přežití bez progrese 22,9 měsíců a celkového přežití 42,5 měsíce.
Myeloidní blastická krize: Do studie bylo zařazeno 260 pacientů s myeloidní blastickou krizí. 95 (37%) pacientů mělo předchozí chemoterapii buď pro akcelerovanou fázi nebo blastickou krizi („předléčení pacienti“), zatímco 165 (63%) pacientů nebylo dosud léčeno („neléčení pacienti“). Léčba prvních 37 pacientů byla zahájena dávkou 400 mg, následně byl protokol doplněn a dovoloval podání vyšších dávek, zahajovací dávka pro zbývajících 223 pacientů byla 600 mg.
Základním parametrem účinnosti, při použití stejných kritérií jako ve studii u akcelerované fáze, byla míra dosažení hematologické odpovědi, popisovaná buď jako kompletní hematologická odpověď, žádný průkaz leukemie, nebo návrat do chronické fáze CML. V této studii dosáhlo 31% pacientů hematologické odpovědi (36% u dříve neléčených pacientů a 22% u dříve léčených pacientů). Míra dosažených odpovědi byla vyšší u pacientů léčených dávkou 600 mg (33%) ve srovnání s pacienty, kteří dostávali dávku 400 mg (16%, p=0,0220). Aktuální odhadovaný medián přežití dříve neléčených pacientů byl 7,7 měsíců a předléčených pacientů byl 4,7 měsíců.
Lymfoidní blastická krize: Do studie fáze I byl zařazen omezený počet pacientů (n=10). Míra dosažené hematologické odpovědi byla 70% s trváním 2-3 měsíce.
Tabulka 3 Odpovědi ve studiích dospělých pacientů s CML
|
Studie 0110 37měsíční data Chronická fáze, IFN selhání (n=532) |
Studie 0109 40,5měsíční data Akcelerovaná fáze (n=235) |
Studie 0102 38měsíční data Myeloidní blastická krize (n=260) | |
|
% pacientů (CI95%) | |||
|
Hematologická odpověď1 Kompletní hematologická odpověď (CHR) Bez průkazu leukemie (NEL) Návrat do chronické fáze (RTC) |
95% (92,3-96,3) 95% Neaplikovatelné Neaplikovatelné |
71% (65,3-77,2) 42% 12% 17% |
31% (25,2-36,8) 8% 5% 18% |
|
Velká cytogenetická odpověď2 Kompletní (Potvrzeno3) [95% CI] Parciální |
65% (61,2-69,5) 53% (43%) [38,6-47,2] 12% |
28% (22,0-33,9) 20% (16%) [11,3-21,0] 7% |
15% (11,2-20,4) 7% (2%) [0,6-4,4] 8% |
|
1 Kritéria hematologické odpovědi (všechny odpovědi byly potvrzeny za > 4 týdny): CHR Studie 0110 [Počet bílých krvinek < 10 x 109/l, krevní destičky < 450 x 109/l, myelocyty+metamyelocyty < 5% v krvi, žádné blasty ani promyelocyty v krvi, basofily < 20%, žádné extramedulární postižení] a ve studiích 0102 a 0109 [ANC > 1,5 x 109/l, krevní destičky > 100 x 109/l, žádné blasty v krvi, BM blasty < 5% a žádné extramedulární postižení] NEL stejná kritéria jako pro CHR ale ANC > 1 x 109/l a destičky > 20 x 109/l (0102 a 0109 pouze) RTC < 15% blastů v BM a PB, < 30% blastů+promyelocytů v BM a PB, < 20% basofilů v PB, žádné jiné extramedulární postižení než ve slezině a játrech (pouze pro 0102 a 0109). BM = Kostní dřeň, PB = periferní krev 2 Kritéria cytogenetické odpovědi: Velká odpověď se skládá jak z kompletní tak i parciální odpovědi: kompletní (0% Ph+ metafáze), parciální (1-35%) 3 Kompletní cytogenetická odpověď potvrzena druhým cytogenetickým hodnocením kostní dřeně provedeným nejméně jeden měsíc po počátečním vyšetření kostní dřeně. | |||
Pediatričtí pacienti: Do studie fáze I zvyšování dávky bylo zahrnuto celkem 26 dětských pacientů ve věku < 18 let buď s chronickou fází CML (n=11) nebo CML v blastické krizi nebo Ph+ akutními leukemiemi (n=15). Byla to populace silně předléčených pacientů, protože 46% bylo dříve léčeno BMT a 73% dostávalo předchozí mnohočetnou chemoterapii. Pacienti byli léčeni dávkami Glivecu 260 mg/m2/den (n=5), 340 mg/m2/den (n=9), 440 mg/m2/den (n=7) a 570 mg/m2/den (n=5). Z 9 pacientů s chronickou fází CML a dostupnými cytogenetickými údaji, dosáhli 4 (44%) kompletní a 3 (33%) parciální cytogenetické odpovědi, míra MCyR 77%.
Do otevřené, multicentrické, jednoramenné studie fáze II bylo zařazeno celkem 51 pediatrických pacientů s nově diagnostikovanou neléčenou CML v chronické fázi. Pacienti byli léčeni Glivecem 340 mg/m2/den bez přerušení při absenci dávku limitující toxicity. Léčba Glivecem vyvolala rychlou odpověď u nově diagnostikovaných dětských pacientů s CML s CHR 78% po 8 týdnech léčby. Vysoká míra CHR byla doprovázena rozvojem kompletní cytogenetické odpovědi (CCyR) u 65%, což je srovnatelné s výsledky pozorovanými u dospělých pacientů. Dodatečně parciální cytogenetická odpověď (PCyR) byla pozorována u 16%, McyR 81%. U většiny pacientů, kteří dosáhli kompletní cytogenetické odpovědi (CCyR), se CCyR vyvinula mezi 3. a 10. měsícem léčby s mediánem času do dosažení odpovědi 5,6 měsíců podle Kaplan-Meierova odhadu.
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s Glivecem u všech podskupin pediatrické populace s Philadelphia chromozom pozitivní (translokace bcr-abl) chronickou myeloidní leukemií (informace o použití u dětí viz bod 4.2).
Klinické studie u Ph+ ALL
Nově diagnostikovaná Ph+ ALL: V kontrolované studii (ADE10), ve které byl porovnáván imatinib s indukční chemoterapií u 55 nově diagnostikovaných pacientů ve věku 55 let a starších, imatinib podávaný jako monoterapie navodil významně vyšší míru kompletních hematologických odpovědí než chemoterapie (96,3% vs. 50%; p=0,0001). Podání imatinibu jako záchranné terapie pacientům, kteří neodpovídali na chemoterapii nebo jejichž odpověď na chemoterapii byla nedostatečná, vedlo u 9 pacientů (81,8%) z celkového počtu 11 pacientů k dosažení kompletní hematologické odpovědi. Tento klinický účinek byl po 2 týdnech léčby spojen s vyšší redukcí bcr-abl transkriptů u pacientů léčených imatinibem než v rameni s chemoterapií (p=0,02). Po fázi indukce všichni pacienti dostávali imatinib a konsolidační chemoterapii (viz Tabulka 4) a po 8 týdnech byly hladiny bcr-abl transkriptů stejné v obou ramenech. Jak se očekávalo na základě designu studie, nebyl pozorován žádný rozdíl v době trvání remise, v přežití bez známek onemocnění nebo celkovém přežití, ačkoliv pacienti s kompletní molekulární odpovědí a trvajícím minimálním reziduálním onemocněním měli lepší výsledek, pokud šlo o dobu trvání remise (p=0,01) a přežití bez známek onemocnění (p=0,02).
Výsledky pozorované ve skupině 211 nově diagnostikovaných pacientů s Ph+ ALL ve čtyřech nekontrolovaných klinických studiích (AAU02, ADE04, AJP01 a AUS01) jsou shodné s výsledky popsanými výše. Podávání imatinibu v kombinaci s indukční chemoterapií (viz Tabulka 4) vedlo k dosažení kompletní hematologické odpovědi u 93% (147 ze 158 hodnotitelných pacientů) a k dosažení velké cytogenetické odpovědi u 90% (19 z 21 hodnotitelných pacientů). Míra kompletní molekulární odpovědi byla 48% (49 z 102 hodnotitelných pacientů). Ve dvou studiích (AJP01 a AUS01) přežití bez známek onemocnění (DFS) a celkové přežití (OS) konstantně převyšovaly 1 rok a tyto výsledky byly lepší oproti historickým kontrolám. (DFS p<0,001; OS p<0,01).
Tabulka 4 Chemoterapeutický režim užívaný v kombinaci s imatinibem
|
Studie ADE10 | |
|
Prefáze |
DEX 10 mg/m2 perorálně, den 1-5; CP 200 mg/m2 i.v., den 3, 4, 5; MTX 12 mg intratekálně, den 1 |
|
Indukce remise |
DEX 10 mg/m2 perorálně, den 6-7, 13-16; VCR 1 mg i.v., den 7, 14; IDA 8 mg/m2 i.v. (0,5 h), den 7, 8, 14, 15; CP 500 mg/m2 i.v.(1 h) den 1; Ara-C 60 mg/m2 i.v., den 22-25, 29-32 |
|
Konsolidační terapie |
MTX 500 mg/m2 i.v. (24 h), den 1, 15; |
|
I, iii, V |
6-MP 25 mg/m2 perorálně, den 1-20 |
|
Konsolidační terapie |
Ara-C 75 mg/m2 i.v. (1 h), den 1-5; |
|
II, IV |
VM26 60 mg/m2 i.v. (1 h), den 1-5 |
|
Indukční terapie (de novo Ph+ ALL) |
Daunorubicin 30 mg/m2 i.v., den 1-3, 15-16; VCR 2 mg celková dávka i.v., den 1, 8, 15, 22; CP 750 mg/m2 i.v., den 1, 8; Prednison 60 mg/m2 perorálně, den 1-7, 15-21; IDA 9 mg/m2 perorálně, den 1-28; MTX 15 mg intratekálně, den 1, 8, 15, 22; Ara-C 40 mg intratekálně, den 1, 8, 15, 22; Methylprednisolon 40 mg intratekálně, den 1, 8, 15, 22 |
|
Konsolidace (de novo Ph+ ALL) |
Ara-C 1 000 mg/m2/12 h i.v.(3 h), den 1-4; Mitoxantron 10 mg/m2 i.v. den 3-5; MTX 15 mg intratekálně, den 1; Methylprednisolon 40 mg intratekálně, den 1 |
Studie ADE04
|
Prefáze |
DEX 10 mg/m2 perorálně, den 1-5; CP 200 mg/m2 i.v., den 3-5; MTX 15 mg intratekálně, den 1 |
|
Indukční terapie I |
DEX 10 mg/m2 perorálně, den 1-5; VCR 2 mg i.v., den 6, 13, 20; Daunorubicin 45 mg/m2 i.v., den 6-7, 13-14 |
|
Indukční terapie II |
CP 1 g/m2 i.v. (1 h), den 26, 46; Ara-C 75 mg/m2 i.v. (1 h), den 28-31, 35-38, 42-45; 6-MP 60 mg/m2 perorálně, den 26-46 |
|
Konsolidační terapie |
DEX 10 mg/m2 perorálně, den 1-5; vindesin 3 mg/m2 i.v., den 1; MTX 1,5 g/m2 i.v. (24 h), den 1; Etoposid 250 mg/m2 i.v. (1 h) den 4-5; Ara-C 2x 2 g/m2 i.v. (3 h, q 12 h), den 5 |
Studie AJP01
|
Indukční terapie |
CP 1,2 g/m2 i.v. (3 h), den 1; Daunorubicin 60 mg/m2 i.v. (1 h), den 1-3; Vinkristin 1,3 mg/m2 i.v., den 1, 8, 15, 21; Prednisolon 60 mg/m2/den perorálně |
|
Konsolidační terapie |
Alternativní chemoterapeutický postup: vysoká dávka chemoterapie s MTX 1 g/m2 i.v. (24 h), den 1, a Ara-C 2 g/m2 i.v. (q 12 h), den 2-3, po 4 cyklech |
|
Udržovací terapie |
VCR 1,3 g/m2 i.v., den 1; Prednisolon 60 mg/m2 perorálně, den 1-5 |
Indukční- Hyper-CVAD režim: CP 300 mg/m2 i.v. (3 h, q 12 h), den 1-3;
konsolidační terapie Vinkristin 2 mg i.v., den 4, 11;
Doxorubicin 50 mg/m2 i.v. (24 h), den 4;
DEX 40 mg/den po dnech 1-4 a 11-14, střídavě s MTX 1 g/m2 i.v. (24 h), den 1, Ara-C 1 g/m2 i.v. (2 h, q 12 h), den 2-3 (celkově 8 léčebných kúr)
Udržovací terapie VCR 2 mg i.v. měsíčně po dobu 13 měsíců;
Prednisolon 200 mg perorálně, 5 dnů za měsíc po dobu 13 měsíců Všechny léčebné režimy zahrnují podávání kortikosteroidů pro profylaxi postižení CNS.
Ara-C: cytosin arabinosid; CP: cyclofosfamid; DEX: dexamethason; MTX: methotrexát; 6-MP: 6-merkaptopurin; VM26: teniposid; VCR: vinkristin; IDA: idarubicin; i.v.: intravenózně
Pediatričtí pacienti: Do otevřené, multicentrické, nerandomizované studie I2301 fáze III se sekvenčními kohortami bylo zařazeno celkem 93 pediatrických, dospívajících a mladých dospělých pacientů (od 1 do 22 let věku) s Ph+ ALL, kteří byli léčeni Glivecem (340 mg/m2/den) v kombinaci s intenzivní chemoterapií po indukční terapii. Glivec byl podáván intermitentně v kohortách 1-5 s prodlužujícím se trváním a časnějším zahájením léčby Glivecem; kohorta 1 používala nejnižší intenzitu a kohorta 5 používala nejvyšší intenzitu Glivecu (nejdelší trvání ve dnech s kontinuálním dávkováním Glivecu již během prvních léčebných cyklů chemoterapie). Kontinuální denní časná expozice Glivecem v průběhu léčby v kombinaci s chemoterapií u pacientů v kohortě 5 (n=50) zlepšila 4leté přežití bez událostí (EFS) v porovnání s historickými kontrolami (n=120), které používaly standardní chemoterapii bez Glivecu (69,6 % oproti 31,6 %). Odhadované 4leté celkové přežití v pacientské kohortě 5 bylo 83,6 % v porovnání s 44,8% u historické kontroly. 20 pacientům z 50 (40 %) v kohortě 5 byla provedena transplantace hematopoetických kmenových buněk.
Tabulka 5 Chemoterapeutické režimy používané ve studii I2301 v kombinaci s imatinibem
|
Konsolidační cyklus 1 (3 týdny) |
VP-16 (100 mg/m2/den, IV): dny 1-5 Ifosfamid (1,8 g/m2/den, IV): dny 1-5 MESNA (360 mg/m2/dávka q3h, x 8 dávky/den, IV): dny 1-5 G-CSF (5 pg/kg, SC): dny 6-15 nebo do ANC > 1500 po dosažení nejnižší hodnoty IT léčba methotrexátem (přizpůsobená věku): POUZE den 1 Trojnásobná IT léčba (přizpůsobená věku): den 8, 15 |
|
Konsolidační cyklus 2 (3 týdny) |
Methotrexát (5 g/m2 v průběhu 24 hodin, IV): den 1 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2 a 3 Trojnásobná IT léčba (přizpůsobená věku): den 1 ARA-C (3 g/m2/dávku q 12 h x 4, IV): dny 2 a 3 G-CSF (5 pg/kg, SC): dny 4-13 nebo do ANC > 1500 po dosažení nejnižší hodnoty |
|
Reindukční cyklus 1 (3 týdny) |
VCR (1,5 mg/m2/den, IV): dny 1, 8, a 15 DAUN (45 mg/m2/den jako bolus, IV): dny 1 a 2 CPM (250 mg/m2/dávku q12h x 4 dávky, IV): dny 3 a 4 PEG-ASP (2500 IU/m2, IM): den 4 G-CSF (5 pg/kg, SC): dny 5-14 nebo do ANC > 1500 po dosažení nejnižší hodnoty Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 15 DEX (6 mg/m2/den, PO): dny 1-7 a 15-21 |
|
Intenzifikační cyklus 1 (9 týdnů) |
Methotrexát (5 g/m2 v průběhu 24 hodin, IV): dny 1 a 15 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2, 3, 16, a 17 Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 22 VP-16 (100 mg/m2/den, IV): dny 22-26 CPM (300 mg/m2/den, IV): dny 22-26 MESNA (150 mg/m2/den, IV): dny 22-26 G-CSF (5 pg/kg, SC): dny 27-36 nebo do ANC > 1500 po dosažení nejnižší hodnoty ARA-C (3 g/m2, q12h, IV): dny 43, 44 L-ASP (6000 IU/m2, IM): den 44 |
|
Reindukční cyklus 2 (3 týdny) |
VCR (1,5 mg/m2/den, IV): dny 1, 8 a 15 DAUN (45 mg/m2/den jako bolus, IV): dny 1 a 2 CPM (250 mg/m2/dávku q12h x 4 dávky, iv): dny 3 a 4 PEG-ASP (2500 IU/m2, IM): den 4 G-CSF (5 pg/kg, SC): dny 5-14 nebo do ANC > 1500 po dosažení nejnižší hodnoty Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 15 DEX (6 mg/m2/den, PO): dny 1-7 a 15-21 |
|
Intenzifikační cyklus 2 (9 týdnů) |
Methotrexát (5 g/m2 v průběhu 24 hodin, IV): dny 1 a 15 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2, 3, 16 a 17 Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 22 VP-16 (100 mg/m2/den, IV): dny 22-26 CPM (300 mg/m2/den, IV): dny 22-26 MESNA (150 mg/m2/den, IV): dny 22-26 G-CSF (5 pg/kg, SC): dny 27-36 nebo do ANC > 1500 post nadir ARA-C (3 g/m2, q12h, IV): dny 43, 44 L-ASP (6000 IU/m2, IM): den 44 |
|
Udržovací terapie (8týdenní cykly) Cykly 1-4 |
MTX (5 g/m2 v průběhu 24 hodin, IV): den 1 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2 a 3 Trojnásobná IT léčba (přizpůsobená věku): dny 1, 29 VCR (1,5 mg/m2, IV): dny 1, 29 DEX (6 mg/m2/den PO): dny 1-5; 29-33 6-MP (75 mg/m2/den, PO): dny 8-28 Methotrexát (20 mg/m2/týden, PO): dny 8, 15, 22 VP-16 (100 mg/m2, IV): dny 29-33 CPM (300 mg/m2, IV): dny 29-33 MESNA IV dny 29-33 G-CSF (5 pg/kg, SC): dny 34-43 |
|
Udržovací terapie (8týdenní cykly) Cyklus 5 |
Ozařování krania (pouze Blok 5) 12 Gy v 8 frakcích pro všechny pacienty s CNS1 a CNS2 v diagnóze 18 Gy v 10 frakcích pro pacienty s CNS3 v diagnóze VCR (1,5 mg/m2/den, IV): dny 1, 29 DEX (6 mg/m2/den, PO): dny 1-5; 29-33 6-MP (75 mg/m2/den, PO): dny 11-56 (Vysazení 6-MP během 6-10 dní ozařování krania počínaje prvním dnem cyklu 5. Započněte léčbu 6-MP první den po dokončení ozařování krania.) Methotrexát (20 mg/m2/týden, PO): dny 8, 15, 22, 29, 36, 43, 50 |
|
Udržovací terapie |
VCR (1,5 mg/m2/den, IV): dny 1, 29 |
|
(8týdenní cykly) |
DEX (6 mg/m2/den, PO): dny 1-5; 29-33 |
|
Cykly 6-12 |
6-MP (75 mg/m2/den, PO): dny 1-56 |
|
Methotrexát (20 mg/m2/týden, PO): dny 1, 8, 15, 22, 29, 36, 43, 50 |
G-CSF = růstový hormon pro granulocytámí řadu leukocytů, VP-16 = etoposid, MTX = methotrexát, IV = intravenózní, SC = subkutánní, IT = intratekální, PO = perorální, IM = intramuskulární, ARA-C = cytarabin, CPM = cyklofosfamid, VCR = vinkristin, DEX = dexamethason, DAUN = daunorubicin, 6-MP = 6-merkaptopurin, E.Coli L-ASP = L-asparagináza, PEG-ASP = PEG asparagináza, MESNA= natrium-2-sulfanylethan -1- sulfonát, iii= nebo pokud je hladina MTX do < 0,1 pM, q6h = každých 6 hodin, Gy= Gray
Studie AIT07 byla multicentrická, otevřená, randomizovaná studie fáze II/III, do které bylo zahrnuto 128 pacientů (1 mladší 18 let věku) léčených imatinibem v kombinaci s chemoterapií. Bezpečnostní data z této studie se zdají být v souladu s bezpečnostním profilem imatinibu u Ph+ ALL pacientů.
Recidivující/refrakterníPh+ ALL: Při podávání imatinibu v monoterapii pacientům s recidivující/refrakterní Ph+ ALL, bylo dosaženo ve skupině 53 hodnotitelných pacientů z celkového počtu 411 pacientů hematologické odpovědi ve 30% (v 9% kompletní) a velké cytogenetické odpovědi ve 23%. (Upozornění - z celkového počtu 411 pacientů bylo 353 pacientů léčeno v rámci programu rozšířeného přístupu k léčbě bez sběru dat primární odpovědi), Medián trvání doby do progrese u celkové populace 411 pacientů s recidivující/refrakterní Ph+ ALL byl v rozmezí mezi
2,6 až 3,1 měsíců, medián doby celkového přežití u 401 hodnotitelných pacientů byl v rozmezí od
4,9 do 9 měsíců. Údaje byly podobné, když byly znovu analyzovány po zahrnutí pouze pacientů ve věku 55 let a starších.
Klinické studie u MDS/MPD
Zkušenosti s Glivecem v této indikaci jsou velmi omezené a jsou založené na míře hematologické a cytogenetické odpovědi. Neexistují žádné kontrolované studie, které by prokázaly klinický prospěch nebo zvýšené přežití. V otevřené, multicentrické klinické studii fáze II (study B2225) byl Glivec zkoušen u různých populací pacientů s život ohrožujícími onemocněními spojenými s aktivitou Abl, Kit nebo PDGFR tyrosinkináz. Do této studie bylo zařazeno 7 pacientů s MDS/MPD, kteří byli léčeni Glivecem 400 mg denně. U tří pacientů byla přítomna kompletní hematologická odpověď (CHR) a jeden pacient dosáhl parciální hematologické odpovědi (PHR). V době původní analýzy tři ze čtyř pacientů s detekovanými mutacemi genu PDGFR dosáhli hematologické odpovědi (2 CHR a 1 PHR). Věk těchto pacientů byl v rozmezí od 20 do 72 let. Ve 13 publikacích bylo hlášeno dalších 24 pacientů s MDS/MPD. 21 pacientů bylo léčeno Glivecem 400 mg denně, zatímco další 3 pacienti byli léčeni nižšími dávkami. U 11 pacientů byla zjištěna změna genu PDGFR, 9 z nich dosáhlo CHR a 1 PHR. Věk těchto pacientů byl v rozmezí od 2 do 79 let. V poslední uveřejněné aktualizované informaci bylo uvedeno, že 6 z těchto 11 pacientů zůstalo v cytogenetické remisi (v rozmezí 32-38 měsíců). Ve stejné publikaci byly uvedeny údaje dlouhodobého sledování 12 pacientů s MDS/MPD s mutací genu PDGFR (5 pacientů ze studie B2225). Tito pacienti byli léčeni Glivecem v mediánu 47 měsíců (v rozmezí 24 dnů - 60 měsíců). U 6 pacientů přesáhlo nyní sledování 4 roky. Jedenáct pacientů dosáhlo rychlé CHR; deset dosáhlo kompletního vymizení cytogenetických abnormalit a dle měření RT-PCR snížení nebo vymizení fúzních transkriptů. Hematologické odpovědi byly zachovány v mediánu 49 měsíců (v rozmezí 19-60) a cytogenetické odpovědi v mediánu 47 měsíců (v rozmezí 16-59). Celkové přežití bylo 65 měsíců od stanovení diagnózy (v rozmezí 25-234). Podávání Glivecu pacientům bez genetické translokace obecně nevede k žádnému zlepšení.
U pediatrických pacientů s MDS/MPD nebyly provedeny kontrolované klinické studie. Ve 4 publikacích bylo hlášeno pět (5) pacientů s MDS/MPD spojenými s přestavbou genu PDGFR. Věk těchto pacientů se pohyboval v rozmezí 3 měsíce až 4 roky a imatinib byl podáván v dávce 50 mg denně nebo v dávkách v rozmezí 92,5 až 340 mg/m2 denně. Všichni pacienti dosáhli kompletní hematologické odpovědi, cytogenetické odpovědi a/nebo klinické odpovědi.
Klinické studie u HES/CEL
V otevřené, multicentrické klinické studii fáze II (studie B2225) byl Glivec zkoušen u různých populací pacientů s život ohrožujícími onemocněními spojenými s aktivitou Abl, Kit nebo PDGFR tyrosinkináz. V této studii 14 pacientů s HES/CEL bylo léčeno Glivecem 100 mg až 1 000 mg denně. Dalších 162 pacientů s HES/CEL uvedených ve 35 zveřejněných kazuistikách bylo léčeno Glivecem v dávkách 75 mg až 800 mg denně. Cytogenetické abnormality byly hodnoceny u 117 z celkové populace 176 pacientů. U 61 pacientů z těchto 117 byla zjištěna fuzní kináza FIP1L1-PDGFRa. Ve třech dalších publikovaných kazuistikách byli uvedeni čtyři pacienti s HES s pozitivní fuzní kinázou FIP1L1-PDGFRa. Všech 65 pacientů s pozitivní fúzní kinázou FIP1L1-PDGFRa dosáhlo CHR, která se udržela po dobu několika měsíců (v rozmezí 1+ až 44+ měsíců, cenzorováno v době hlášení). Podle posledních publikovaných hlášení 21 z těchto 65 pacientů také dosáhlo kompletní molekulární remise s mediánem délky sledování 28 měsíců (v rozmezí 13-67 měsíců). Věk těchto pacientů byl v rozmezí od 25 do 72 let.Dodatečně bylo investigátory hlášeno v kazuistikách symptomatologické zlepšení a zlepšení dysfunkcí dalších orgánů. Zlepšení byla hlášena u poruch funkce srdeční, nervové, kožní/podkožní, respirační/hrudní/mediastinální, muskuloskeletální/pojivové/vaskulární a gastrointestinální orgánové soustavy.
U pediatrických pacientů s HES/CEL nebyly provedeny kontrolované klinické studie. Ve 3 publikacích byli hlášeni tři (3) pacienti s HES/CEL spojenými s přestavbou genu PDGFR. Věk těchto pacientů se pohyboval v rozmezí 2 až 16 let a imatinib byl podáván v dávce 300 mg/m2 denně anebo v dávkách v rozmezí 200 až 400 mg denně. Všichni pacienti dosáhli kompletní hematologické odpovědi, kompletní cytogenetické odpovědi a/nebo kompletní klinické odpovědi.
Klinické studie u pacientů s inoperabilním a/nebo metastatickým GIST
Jedna otevřená, randomizovaná nekontrolovaná mezinárodní studie fáze II byla provedena u pacientů s inoperabilním nebo metastatickým maligním gastrointestinálním stromálním nádorem (GIST). Do studie bylo zařazeno 147 pacientů a randomizováno užívat buď 400 mg nebo 600 mg jednou denně perorálně po dobu až 36 měsíců. Tito pacienti byli ve věku od 18 až 83 let a byla u nich stanovena diagnóza Kit-pozitivní maligní GIST, který byl inoperabilní a/nebo metastazující. Rutinně bylo prováděno imunohistochemické vyšetření pomocí Kit protilátek (A-4502, králičí polyklonální antisérum, 1:100; DAKO Corporation, Carpinteria, CA) metodou nalezení antigenu podle analýzy avidin-biotin-peroxidázového komplexu.
Primární průkaz účinnosti byl založen na míře objektivní odpovědi. U nádorů byla vyžadována měřitelnost v alespoň jednom ložisku onemocnění a charakter odpovědi byl založen na kriteriích Southwestern Oncology Group (SWOG). Výsledky jsou uvedeny v Tabulce 6.
Tabulka 6 Nejlepší odpovědi nádoru ve studii STIB2222 (GIST)
|
Nejlepší odpověď |
Všechny dávky (n=147) 400 mg (n=73) 600 mg (n=74) n (%) |
|
Kompletní odpověď |
1 (0,7) |
|
Parciální odpověď |
98 (66,7) |
|
Stabilní onemocnění |
23 (15,6) |
|
Progresivní onemocnění |
18 (12,2) |
|
Nehodnotitelé |
5 (3,4) |
|
Neznámo |
2 (1,4) |
Nebyly nalezeny rozdíly v míře odpovědí mezi dvěma skupinami s rozdílným dávkováním. Významný počet pacientů, kteří měli stabilní onemocnění v době interim analýzy, dosáhl částečné odpovědi při delší léčbě (medián doby sledování 31 měsíců). Medián času do odpovědi byl 13 týdnů (95% CI 1223). Medián času do selhání léčby u pacientů s odpovědí byl 122 týdnů (95% CI 106-147), zatímco v celé studijní populaci to byly 84 týdny (95% CI 71-109). Medián celkového přežití nebyl dosažen. Odhad pro přežití po 36 měsících sledování podle Kaplan-Meiera je 68%.
Ve dvou klinických studiích (studie B2222 a studie S0033) byla denní dávka Glivecu zvyšována na 800 mg u pacientů, u kterých onemocnění progredovalo při nižších denních dávkách 400 nebo 600 mg. Denní dávka byla zvýšena na 800 mg u celkově 103 pacientů; 6 pacientů dosáhlo po zvýšení dávky částečné odpovědi a u 21 pacientů došlo ke stabilizaci onemocnění, což představuje klinický prospěch 26%. Z dostupných bezpečnostních dat nevyplývá, že by zvýšení dávky na 800 mg denně u pacientů s progresí onemocnění při nižších dávkách 400 mg nebo 600 mg denně mělo vliv na bezpečnostní profil Glivecu.
Klinické studie u adjuvantní léčby GIST
Glivec byl studován v adjuvantní léčbě v multicentrické, dvojitě slepé, prospektivní, placebem kontrolované studii fáze III (Z9001), která zahrnovala 773 pacientů. Věkové rozmezí pacientů bylo 18 až 91 let. Byli zařazeni pacienti s histologickou diagnózou primárního GIST s imunochemicky potvrzenou expresí Kit proteinu a velikostí nádoru > 3 cm v maximálním rozměru, s úplnou makroskopickou resekcí primárního GIST během 14-70 dnů před zařazením do studie. Po resekci primárního GIST byli pacienti randomizováni do jednoho ze dvou ramen: Glivec podávaný v dávkách 400 mg/den nebo odpovídající placebo po dobu jednoho roku.
Primárním cílovým parametrem studie bylo přežití bez návratu onemocnění (RFS) definované jako doba od data randomizace do data návratu onemocnění nebo smrti z jakékoli příčiny.
Glivec významně prodloužil RFS, ve skupině s Glivecem bylo po dobu 38 měsíců bez návratu onemocnění 75% pacientů, oproti 20 měsícům u pacientů ve skupině s placebem (95% CI, [30-nelze určit]; respektive[14-nelze určit]); (relativní riziko = 0,398 [0,259 - 0,610], p< 0,0001). Po jednom roce byl celkový RFS významně lepší pro Glivec (97,7%) oproti placebu (82,3%), (p< 0,0001). Riziko recidivy onemocnění tak bylo sníženo o přibližně 89% v porovnání s placebem (relativní riziko = 0,113 [0,049 - 0,264]).
Riziko recidivy u pacientů po operaci primárního GIST nádoru bylo retrospektivně vyhodnoceno na základě těchto prognostických faktorů: velikost nádoru, mitotický index, umístění nádoru. Hodnoty mitotického indexu byly dostupné pro 556 ze 713 pacientů intention-to-treat (ITT) populace. Výsledky analýzy podskupin podle klasifikace rizika Národního ústavu zdraví USA (NIH) a Ústavu patologie ozbrojených sil USA (AFIP) jsou shrnuty v Tabulce 7. Nebyl pozorován přínos ve skupině s nízkým a velmi nízkým rizikem. Nebyl pozorován přínos pro celkové přežití.
Tabulka 7 Souhrn analýz RFS studie Z9001podle klasifikace rizika NIH and AFIP
|
Kritéri a rizika |
Stupeň rizika |
% pacientů |
Počet příhod / Počet pacientů |
Celkové relativní riziko (95 %CI)* |
Míra RFS (%) | |
|
12 měsíců |
24 měsíců | |||||
|
Glivec vs placebo |
Glivec vs placebo |
Glivec vs placebo | ||||
|
Nízké |
29,5 |
0/86 vs. 2/90 |
N.E. |
100 vs. 98,7 |
100 vs. 95,5 | |
|
NIH |
Střední |
25,7 |
4/75 vs. 6/78 |
0,59 (0,17; 2,10) |
100 vs. 94,8 |
97,8 vs. 89,5 |
|
Vysoké |
44,8 |
21/140 vs. 51/127 |
0,29 (0,18; 0,49) |
94,8 vs. 64,0 |
80,7 vs. 46,6 | |
|
Velmi nízké |
20,7 |
0/52 vs. 2/63 |
N.E. |
100 vs. 98,1 |
100 vs. 93,0 | |
|
Nízké |
25,0 |
2/70 vs. 0/69 |
N.E. |
100 vs. 100 |
97,8 vs. 100 | |
|
AFIP |
Střední |
24,6 |
2/70 vs. 11/67 |
0,16 (0,03; 0,70) |
97,9 vs. 90,8 |
97,9 vs. 73,3 |
|
Vysoké |
29,7 |
16/84 vs. 39/81 |
0,27 (0,15; 0,48) |
98,7 vs. 56,1 |
79,9 vs. 41,5 | |
|
* včetně follow-up periody; NE - ne |
ze určit | |||||
Druhá multicentrická otevřená studie fáze III (SSG XVIII/AIO) porovnávala výsledky léčby Glivecem v dávce 400 mg/den po dobu 12 měsíců oproti 36 měsícům u pacientů po chirurgické resekci GIST a s jedním z následujících parametrů: průměr tumoru > 5 cm a počet mitóz > 5/50 zorných polí ve velkém zvětšení (high power fields, HPF) nebo průměr tumoru > 10 cm a jakýkoli počet mitóz nebo tumor jakékoli velikosti s počtem mitóz > 10/50 HPF nebo tumory s rupturou do peritonální dutiny. Ve studii bylo randomizováno a informovaný souhlas podepsalo celkem 397 pacientů (199 pacientů v rameni s 12měsíční léčbou a 198 pacientů v rameni s 36měsíční léčbou), jejichž průměrný věk byl 61 let (rozmezí 22 až 84 let). Medián doby sledování byl 54 měsíců (od data randomizace do data ukončení), s celkovou dobou 83 měsíců mezi prvním randomizovaným pacientem a ukončením studie.
Primárním cílovým parametrem účinnosti studie bylo přežití bez návratu onemocnění (RFS) definované jako doba od data randomizace do data návratu onemocnění nebo smrti z jakékoli příčiny.
36měsíční léčba Glivecem významně prodlužila RFS oproti 12měsíční léčbě Glivecem (s celkovým poměrem rizik (HR) = 0,46 [0,32, 0,65], p<0,0001) (Tabulka 8, Obrázek 1).
Třicet šest (36) měsíců léčby Glivecem významně prodloužilo celkové přežití (OS) v porovnání s 12 měsíci léčby Glivecem (HR = 0,45 [0,22; 0,89], p=0,0187) (Tabulka 8, Obrázek 2).
Déletrvající léčba (> 36 měsíců) může prodloužit dobu do výskytu dalších recidiv; vliv těchto zjištění na celkové přežití nicméně zůstává neznámý.
Celkový počet úmrtí byl 25 v rameni s 12měsíční léčbou a 12 v rameni s 36měsíční léčbou.
36měsíční léčbou imatinibem bylo dosaženo lepších výsledků oproti 12měsíční léčbě v ITT analýze, tj. zahrnující celou studijní populaci. V plánované analýze podskupin podle typu mutace byl poměr rizika přežití bez rekurence pro 36měsíční léčbu pacientů s mutací exonu 11 0,35 [95% CI: 0,22,
0,56]. Pro jiné podskupiny s méně častými mutacemi nelze z důvodu nízkého počtu sledovaných případů vyvodit žádné závěry.
Tabulka 8 12měsíční a 36měsíční léčba Glivecem (studie SSGXVIII/AIO)
|
rameno s 12měsíční léčbou |
rameno s 36měsíční léčbou | |
|
RFS |
%(CI) |
%(CI) |
|
12 měsíců |
93,7 (89,2-96,4) |
95,9 (91,9-97,9) |
|
24 měsíců |
75,4 (68,6-81,0) |
90,7 (85,6-94,0) |
|
36 měsíců |
60,1 (52,5-66,9) |
86,6 (80,8-90,8) |
|
48 měsíců |
52,3 (44,0-59,8) |
78,3 (70,8-84,1) |
|
60 měsíců |
47,9 (39,0-56,3) |
65,6 (56,1-73,4) |
|
Přežití 36 měsíců |
94,0 (89,5-96,7) |
96,3 (92,4-98,2) |
|
48 měsícůs |
87,9 (81,1-92,3) |
95,6 (91,2-97,8) |
|
60 měsíců |
81,7 (73,0-87,8) |
92,0 (85,3-95,7) |
Obrázek 1 Odhad primárního přežití bez návratu onemocnění podle Kaplan-Meiera (ITT populace)
Pravděpodobnost přežití bez návratu onemocnění

Doba přežití v měsících
V riziku: Události
|
137:46 |
105:65 |
88:72 |
61:77 |
49:81 |
36:83 |
27:84 |
14:84 |
10:84 |
2:84 0:84 |
|
173:18 |
152:22 |
133:25 |
102:29 |
82:35 |
54:46 |
39:47 |
21:49 |
8:50 |
0:50 |
(1) 199:0 182:8 177:12 163:25
(2) 198:0 189:5 184:8 181:11
Doba přežití v měsících
V riziku: Události
0:25
Obrázek 2 Odhad celkového přežití podle Kaplan-Meiera (ITT populace)

(1) 199:0 190:2 188:2 183:6 176:8 156:10 140:11 105:14 87:18 64:22 46:23 27:25 20:25 2:25
(2) 198:0 196:0 192:0 187:4 184:5 164:7 152:7 119:8 100:8 76:10 56:11 31:11 13:12 0:12
U pediatrických pacientů s c-Kit pozitivním GIST nebyly provedeny kontrolované klinické studie.
V 7 publikacích bylo hlášeno sedmnáct (17) pacientů s GIST (s Kit nebo bez Kit a s mutacemi PDGFR nebo bez mutací PDGFR). Věk těchto pacientů se pohyboval v rozmezí 8 až 18 let a imatinib byl podáván adjuvantně i pro metastatické onemocnění v dávkách v rozmezí 300 až 800 mg denně.
U většiny léčených pacientů s GIST nebyla k dispozici data potvrzující c-kit nebo mutace PDGFR, což mohlo vést k různým klinickým výsledkům.
Klinické studie u DFSP
Byla provedena otevřená, multicentrická klinická studie fáze II (studie B2225) zahrnující 12 pacientů s DFSP léčených Glivecem 800 mg denně. Věk pacientů s DFSP byl v rozmezí 23 až 75 roků; DFSP byl metastatický, lokálně recidivující po primárním chirurgickém vynětí a v době zařazení do studie vyhodnocen jako inoperabilní.Primární důkaz účinnosti byl založen na míře objektivní odpovědi.
Z 12 zařazených pacientů jich 9 odpovědělo: 1 kompletně a 8 parciálně. Tři pacienti s parciální odpovědí byli následně po provedené operaci interpretováni jako bez známek onemocnění. Medián doby trvání léčby ve studii B2225 byl 6,2 měsíce, s maximem doby trvání 24,3 měsíců. Dalších 6 pacientů s DFSP léčených Glivecem bylo publikováno v 5 kazuistikách, věk těchto pacientů byl v rozmezí 18 měsíců až 49 let. Dospělí pacienti uvedení v publikované literatuře byli léčeni dávkou Glivecu buď 400 mg (4 případy) nebo 800 mg (1 případ) denně. Odpovědělo pět (5) pacientů,
3 kompletně a 2 parciálně. Medián doby trvání léčby v publikované literatuře je v rozmezí 4 týdnů až více než 20 měsíců. Translokace t(17:22)[(q22:q13)] nebo její genový produkt byl přítomen téměř u všech pacientů odpovídajících na léčbu Glivecem.
U pediatrických pacientů s DFSP nebyly provedeny kontrolované klinické studie. Ve 3 publikacích bylo hlášeno pět (5) pacientů s DFSP a přestavbou PDGFR genu. Věk pacientů se pohyboval od narození do 14 let a imatinib byl podáván v dávce 50 mg denně nebo v dávkách v rozmezí 400 až 520 mg/m2 denně. Všichni pacienti dosáhli částečné a/nebo kompletní odpovědi.
Farmakokinetika Glivecu
Farmakokinetika Glivecu byla hodnocena v rozmezí dávek 25 až 1 000 mg. Farmakokinetický profil léku v plazmě byl analyzován 1., 7. nebo 28. den, kdy koncentrace v plazmě dosáhla rovnovážného stavu.
Absorpce
Průměrná absolutní biologická dostupnost tobolky je 98%. Po perorálním podání byla mezi pacienty vysoká variabilita v hladinách AUC imatinibu v plazmě. Při podání léku s tučným jídlem, byla míra absorpce imatinibu snížena jen minimálně (11% snížení Cmax a prodloužení tmax o 1,5 h), s malým zmenšením AUC (7,4%), ve srovnání s podáním nalačno. Ovlivnění absorpce léku předchozí gastrointestinální operací nebylo studováno.
Distribuce
V klinicky relevantních koncentracích imatinibu došlo v pokusech in vitro k vazbě na plazmatické proteiny přibližně v 95%, převážně na albumin a alfa-1- kyselý-glykoprotein, s malou vazbou na lipoproteiny.
Biotransformace
Hlavním cirkulujícím metabolitem je u člověka N-demethylovaný derivát piperazinu, který měl in vitro podobnou účinnost jako mateřská látka. Zjištěná plazmatická AUC tohoto metabolitu byla pouze 16% AUC imatinibu. Vazba N-demetylovaného metabolitu na plazmatické bílkoviny je podobná vazebné schopnosti mateřské látky.
Imatinib a N-demethylovaný metabolit činily dohromady přibližně 65% cirkulující radioaktivity (AUC(0-48h)). Zbývající cirkulující radioaktivita byla tvořena množstvím minoritních metabolitů.
Výsledky studií in vitro ukázaly, že CYP3A4 je u lidí hlavním enzymem cytochromu P450, který katalyzuje biotransformaci imatinibu. Z řady potenciálně souběžně podávaných léků (paracetamol, aciklovir, alopurinol, amfotericin, cytarabin, erytromycin, flukonazol, hydroxyurea, norfloxacin, penicillin V) pouze erytromycin (IC50 5 0 pM) a flukonazol (IC50 118 pM) inhibovaly metabolismus imatinibu v rozsahu, který by mohl být klinicky významný.
In vitro bylo zjištěno, že imatinib je kompetitivním inhibitorem markrových substrátů pro CYP2C9, CYP2D6 a CYP3A4/5. Ki hodnoty v lidských jaterních mikrosomech byly 27, 7,5 a 7,9 pmol/l. Maximální plazmatické koncentrace imatinibu u pacientů jsou 2-4 pmol/l, tudíž je možná inhibice metabolismu zprostředkovaného CYP2D6 a/nebo CYP3A4/5 souběžně podávaných léků. Imatinib neinterferuje s biotranformací 5-fluorouracilu, ale inhibuje metabolismus paklitaxelu, což je výsledkem kompetitivní inhibice CYP2C8 (Ki = 34,7 pM). Odpovídající hodnota Ki je daleko vyšší než očekávané plazmatické hladiny imatinibu u pacientů a tudíž se neočekávají interakce při souběžném podávání 5-fluorouracilu nebo paklitaxelu a imatinibu.
Eliminace z organismu
Na základě sledování vylučování radioaktivních sloučenin(y) po perorálním podání 14C-značeného imatinibu bylo přibližně 81% dávky nalezeno v průběhu 7 dnů ve stolici (68% dávky) a v moči (13% dávky). V nezměněné formě bylo vyloučeno 25% dávky (5% močí, 20% stolicí), zbytek činily metabolity.
Farmakokinetika v plazmě
Po perorálním podání zdravým dobrovolníkům byl t./2 přibližně 18 hodin, to znamená, že podávání jednou denně je dostačující. Zvyšování průměrné hodnoty AUC se stoupající dávkou bylo lineární a závislé na dávce v rozmezí dávek 25-1 000 mg imatinibu po perorálním podání. Po opakovaném podání nebyly při dávkování jednou denně nalezeny změny v kinetice imatinibu a akumulace v rovnovážném stavu činila 1,5-2,5násobek.
Farmakokinetika u pacientů s GIST
U pacientů s GIST byla v rovnovážném stavu při stejné dávce (400 mg denně) 1,5krát vyšší expozice než ta, která byla pozorována u pacientů s CML. Na základě předběžné analýzy farmakokinetiky v populaci pacientů s GIST zde byly nalezeny tři proměnné (albumin, bílé krvinky a bilirubin), které měly statisticky významnou souvislost s farmakokinetikou imatinibu. Snížení hodnot albuminu bylo příčinou poklesu clearance (CL/f); a vyšší hodnoty počtu bílých krvinek vedly ke snížení CL/f. Tato souvislost však není dostatečně výrazná, aby opravňovala k úpravě dávkování. V této skupině pacientů by mohla přítomnost metastáz v játrech mít za následek jaterní insuficienci a redukci metabolismu.
Populační farmakokinetika
Na základě analýzy farmakokinetiky v populaci pacientů s CML bylo zjištěno, že věk jen málo ovlivnil distribuční objem (12% zvýšení u pacientů starších > 65 let). Tyto změny nejsou považovány za klinicky významné. Vliv tělesné hmotnosti na clearance imatinibu je následující: u pacientů s tělesnou hmotností 50 kg je možné očekávat průměrnou clearance 8,5 l/h, zatímco u pacientů vážících 100 kg clearance stoupne na 11,8 l/h. Tyto změny nejsou dostačující, aby opravňovaly k úpravě dávkování podle hmotnosti. V kinetice imatinibu není rozdíl mezi muži a ženami.
Farmakokinetika u dětí
Obdobně jako u dospělých pacientů byl imatinib po perorálním podání rychle absorbován i u dětských pacientů ve studii fáze I i fáze II. Dávkami 260 a 340 mg/m2/den bylo u dětí dosaženo stejné účinnosti jako u dospělých dávkami 400 mg a 600 mg. Při srovnání AUC(0-24) 8. den s 1. dnem při dávce 340 mg/m2/den hladina ukázala 1,7násobnou akumulaci léku po opakovaném podávání jednou denně.
Na základě poolovaných farmakokinetických analýz populací pediatrických pacientů s hematologickými poruchami (CML, Ph+ALL, nebo jinými hematologickými poruchami léčenými imatinibem) roste clearance imatinibu se zvyšujícím se povrchem těla (BSA). Po úpravě vlivu BSA neměly další demografické ukazatele, jako je věk, tělesná hmotnost a body mass index, klinicky významný vliv na expozici imatinibem. Analýzy potvrdily, že expozice imatinibem u pediatrických pacientů užívajících 260 mg/m2 jednou denně (nepřevyšující 400 mg jednou denně) nebo 340 mg/m2 jednou denně (nepřevyšující 600 mg jednou denně) byly podobné jako u dospělých pacientů, kteří užívali imatinib v dávce 400 mg nebo 600 mg jednou denně.
Zhoršená funkce orgánů
Imatinib a jeho metabolity nejsou ve významném množství vylučovány ledvinami. U pacientů s mírnou a středně závažnou nedostatečností renální funkce se ukázalo, že mají vyšší plazmatickou expozici než pacienti s normální funkcí ledvin. Zvýšení je přibližně 1,5- až 2násobné, což odpovídá 1,5násobku zvýšení plazmatického AGP, na který se imatinib silně váže. Clearance volného imatinibu je pravděpodobně obdobná u pacientů s renální nedostatečností a u pacientů s normální funkcí ledvin vzhledem k tomu, že vylučování ledvinami představuje pouze vedlejší cestu eliminace imatinibu (viz bod 4.2 a 4.4).
Ačkoli výsledky farmakokinetických analýz ukázaly, že je zde značný rozdíl mezi jedinci, střední expozice imatinibu se nezvýšila u pacientů s různými stupni dysfunkce jater ve srovnání s pacienty s normální funkcí jater (viz body 4.2, 4.4 a 4.8).
Předklinický profil bezpečnosti imatinibu byl stanoven na potkanech, psech, opicích a králících.
Při studiu toxicity po opakovaném podání byly pozorovány mírné až středně závažné hematologické změny u potkanů, psů, a opic doprovázené změnami v kostní dřeni u potkanů a psů.
U potkanů a psů byly cílovým orgánem játra. U obou druhů zvířat bylo pozorováno mírné až střední zvýšení transamináz a mírný pokles cholesterolu, triglyceridů, celkových proteinů a hladiny albuminu. V játrech potkanů nebyly nalezeny žádné histopatologické změny. Závažné toxické změny se zvýšením jaterních enzymů, hepatocelulární nekrózou, nekrózou žlučových cest a hyperplazií žlučovodu byly pozorovány u psů léčených po 2 týdny.
U opic byla po dvou týdnech léčby pozorována nefrotoxicita, s ložiskovou mineralizací a dilatací renálních tubulů a tubulární nefrózou. U několika zvířat bylo pozorováno zvýšení urey v krvi (BUN) a kreatininu. U potkanů byla po dávkách > 6 mg/kg ve 13týdenní studii pozorována hyperplazie přechodového epitelu renální papily a močového měchýře, beze změn parametrů v séru nebo moči. Při chronické léčbě imatinibem byl pozorován četnější výskyt oportunních infekcí.
Ve 39týdenní studii u opic nebyla při nejnižší dávce 15 mg/kg, odpovídající přibližně jedné třetině maximální humánní dávky 800 mg stanovené podle tělesného povrchu, stanovena hladina bez nežádoucích účinků -NOAEL (No Observed Adverse Effect Level). U těchto zvířat došlo ke zhoršení normálně potlačené malárie.
Ve studiích in vitro na bakteriálních buňkách (Amesův test), na savčích buňkách (myší lymfomové buňky) ani ve studiích in vivo u potkanů mikronukleárním testem nebyla zjištěna genotoxicita imatinibu. Pozitivní genotoxický účinek imatinibu byl zjištěn v testu in vitro na savčích buňkách (ovariální buňky křečka čínského) na klastogenicitu (chromozomální aberaci) za přítomnosti metabolické aktivace. Dva meziprodukty výrobního procesu, které jsou také přítomny ve finálním výrobku, měly pozitivní Amesův test na mutagenicitu. Jeden z těchto meziproduktů byl také pozitivní při testování na myších lymfomových buňkách.
Ve studii fertility byla potkaním samcům po dobu 70 dnů před připuštěním podávána dávka 60 mg/kg, která přibližně odpovídá maximální klinické dávce 800 mg/den, stanovené podle tělesného povrchu. Byl zjištěn úbytek hmotnosti varlat a nadvarlat a sníženo procento pohyblivých spermií. Tento účinek nebyl pozorován při dávce < 20 mg/kg. Mírné až střední snížení spermatogeneze bylo také pozorováno u psů po perorálních dávkách > 30 mg/kg. Pokud byl imatinib podáván samicím potkanů 14 dnů před připuštěním a až do 6. dne březosti nebylo ovlivněno ani zabřeznutí ani počet březích samic. Po podávání dávky 60 mg/kg, došlo u samic potkanů k významným postimplantačním ztrátám plodů a snížení počtu živých plodů. Tento účinek nebyl pozorován v dávkách < 20 mg/kg.
Ve studii pre a postnatálního vývoje u potkanů po perorálním podání 45 mg/kg/den byl 14. nebo 15. den zabřeznutí pozorován rudý výtok z vagíny. Při stejné dávce stoupnul počet mrtvě narozených mláďat stejně jako počet uhynulých po narození mezi 0. až 4. dnem. U mláďat z vrhu Fj, byla při stejné dávce nižší průměrná tělesná hmotnost od narození až do usmrcení a počet mláďat ve vrhu byl také snížen. Fertilita Fj nebyla ovlivněna po dávce 45 mg/kg/den, zatímco počet resorbovaných plodů stoupl a klesl počet živě narozených mláďat. Dle hodnocení No Observed Effect Level (NOEL) byla pro mateřská zvířata a F1 generaci mláďat bezpečná dávka 15 mg/kg/den (jedna čtvrtina maximální lidské dávky 800 mg).
Imatinib byl teratogenní, pokud byl podáván potkanům během organogeneze v dávkách > 100 mg/kg, přibližně odpovídající maximální klinické dávce 800 mg/den, stanovené podle tělesného povrchu. Teratogenní účinky zahrnovaly exencefalii nebo encefalokelu, absenci nebo redukci frontálních kostí a absenci parietálních kostí. Tyto účinky nebyly pozorovány při dávkách < 30 mg/kg.
V toxikologické studii zaměřené na juvenilní vývoj potkanů (den 10 až 70 post partum) nebyly zjištěné nové cílové orgány ve srovnání se zjištěnými cílovými orgány u dospělých potkanů.
V toxikologické studii zaměřené na juvenilní jedince byly pozorovány účinky na růst, zpoždění otevření vaginy a oddělení předkožky při přibližně 0,3 až 2násobku průměrné pediatrické expozice při nejvyšší doporučené dávce 340 mg/m2. Dále byla u juvenilních zvířat (ve fázi odstavení) zjištěna mortalita při přibližně 2násobku průměrné pediatrické expozice při nejvyšší doporučené dávce
340 mg/m2.
Výsledky 2leté studie kancerogenity u potkanů, kterým byl podáván imatinib v dávce 15, 30 a 60 mg/kg/den ukázaly statisticky významné snížení délky života u samců při dávce 60 mg/kg/den a u samic při dávce > 30 mg/kg/den. Histopatologická vyšetření jako hlavní příčinu smrti nebo důvodu pro utracení zvířat odhalily kardiomyopatii (u obou pohlaví), chronickou progresivní nefropatii (u samic) a papilomy předkožkové žlázky. Cílovými orgány, pokud se týká neoplastických změn, byly ledviny, močový měchýř, uretra, předkožková a klitoridální žlázka, tenké střevo, příštítná tělíska, nadledvinky a nesekretorická část žaludeční stěny.
Byly zaznamenány případy vzniku papilomů/karcinomů předkožkové/klitoridální žlázky při dávce od 30 mg/kg/den a více, což reprezentuje přibližně 0,5násobek dávky 400 mg/den běžně užívané u člověka (podle AUC), nebo 0,3násobek dávky 800 mg/den užívané u člověka, a 0,4násobek dávky 340 mg/m2/den u dětí (podle AUC). Dle hodnocení No Observed Effect Level (NOEL) byla bezpečná dávka 15 mg/kg/den. Renální adenom/karcinom a papilom močového měchýře a uretry, adenokarcinomy tenkého střeva, adenomy příštítných tělísek, benigní a maligní medulární tumory nadledvinek a papilomy/karcinomy nesekretorické části žaludeční stěny byly pozorovány při dávce 60 mg/kg/den, což reprezentuje přibližně 1,7násobek dávky 400 mg/den běžně užívané u člověka (podle AUC) nebo dávku 800 mg/den běžně užívané u člověka, a 1,2násobek dávky 340 mg/m2/den u dětí (podle AUC). Dle hodnocení No Observed Effect Level (NOEL) byla bezpečná dávka 30 mg/kg/den.
Mechanismus a závažnost těchto nálezů ze studie kancerogenity u potkanů není ještě u člověka objasněn.
Non-neoplastické léze neprokázané v dřívějších předklinických studiích se vyskytovaly v kardiovaskulárním systému, pankreatu, endokrinních orgánech a zubech. Nejdůležitější změny zahrnovaly srdeční hypertrofii a dilataci, vedoucí k příznakům srdeční nedostatečnosti u některých zvířat.
Účinná látka imatinib představuje environmentální ohrožení pro organismy v sedimentu.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Obsah tobolek: Mikrokrystalická celulosa
Krospovidon Magnesium-stearát Koloidní bezvodý oxid křemičitý
Tobolky: Želatina
Červený oxid železitý (E172)
Žlutý oxid železitý (E172)
Oxid titaničitý (E171)
Tiskařský inkoust: Červený oxid železitý (E172)
Šelak
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Neuchovávejte při teplotě nad 30°C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
6.5 Druh obalu a obsah balení
PVC/aluminium blistry
Balení obsahuje 24, 48, 96, 120, 180 tobolek.
Na trhu nemusí být k dispozici všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními
požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/01/198/002-006
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 07. listopad 2001
Datum posledního prodloužení registrace: 07. listopad 2006
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Glivec 100 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna potahovaná tableta obsahuje 100 mg imatinibum (jako imatinibi mesilas). Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta
Velmi tmavě žluté až hnědooranžové kulaté potahované tablety na jedné straně označené „NVR“ a „SA“ s půlící rýhou na straně druhé.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Glivec je indikován k léčbě
• dospělých a dětských pacientů s nově diagnostikovanou Philadelphia chromozom (bcr-abl) pozitivní (Ph+) chronickou myeloidní leukemií (CML), u kterých není transplantace kostní dřeně považována za léčbu první volby.
• dospělých a dětských pacientů s Ph+ CML s chronickou fází onemocnění, u kterých selhala léčba interferonem-alfa, nebo kteří jsou v akcelerované fázi onemocnění nebo v blastické krizi.
• dospělých a dětských pacientů s nově diagnostikovanou Philadelphia chromozom pozitivní akutní lymfatickou leukemií (Ph+ ALL) doplněnou chemoterapií.
• dospělých pacientů s recidivující nebo refrakterní Ph+ ALL jako monoterapie.
• dospělých pacientů s myelodysplastickým/myeloproliferativním onemocněním (MDS/MPD) spojeným se změnou genu receptoru pro růstový faktor krevních destiček (PDGFR).
• dospělých pacientů se syndromem pokročilé hypereozinofilie (HES) a/nebo chronickou eozinofilní leukemií (CEL) s přeskupením FIP1L1-PDGFRa.
Účinek Glivecu na výsledek transplantace kostní dřeně nebyl stanoven.
Glivec je indikován
• k léčbě dospělých pacientů s Kit (CD 117) pozitivními inoperabilními a/nebo metastatickými maligními stromálními nádory zažívacího traktu (GIST).
• k adjuvantní léčbě dospělých pacientů s významným rizikem recidivy po resekci Kit (CD117)-pozitivního GIST nádoru. Pacienti s nízkým nebo velmi nízkým rizikem recidivy by neměli adjuvantní léčbu podstoupit.
• k léčbě dospělých pacientů s inoperabilním dermatofibrosarkomem protuberans (DFSP) a dospělých pacientů s rekurentním a/nebo metastatickým DFSP, kteří nejsou způsobilí operace.
U dospělých a dětských pacientů je účinnost Glivecu hodnocena podle stupně celkové hematologické a cytogenetické odpovědi a přežívání bez progrese onemocnění u CML, podle stupně hematologické a cytogenetické odpovědi u Ph+ ALL, MDS/MPD, podle stupně hematologické odpovědi u HES/CEL a podle stupně objektivní odpovědi u dospělých pacientů s inoperabilním a/nebo metastatickým GIST a DFSP a na základě přežití bez návratu onemocnění u adjuvantní léčby GIST. Zkušenosti s Glivecem u pacientů s MDS/MPD spojeným se změnou genu receptoru PDGFR jsou velmi omezené (viz bod 5.1). Kromě nově diagnostikované chronické fáze CML nej sou k dispozici žádné kontrolované studie, které by prokázaly klinický přínos nebo prodloužené přežití u těchto uvedených onemocnění.
4.2 Dávkování a způsob podání
Léčbu by měl zahájit lékař s odpovídajícími zkušenostmi v léčbě pacientů s hematologickými malignitami a maligními sarkomy.
Pro dávku 400 mg a vyšší (viz doporučené dávkování níže) jsou dostupné 400 mg tablety (nedělitelné).
Předepsaná dávka by měla být podávána perorálně s jídlem a zapíjena velkou sklenicí vody, aby se minimalizovalo riziko gastrointestinálního podráždění. Dávky 400 mg nebo 600 mg by měly být podávány jednou denně, zatímco dávka 800 mg by měla být podávána rozděleně na 400 mg dvakrát denně ráno a večer.
Pacientům, kteří nemohou polykat celé potahované tablety je možné tablety rozpustit ve sklenici neperlivé vody nebo jablečného džusu. Požadovaný počet tablet by měl být dán do odpovídajícího množství nápoje (přibližně 50 ml pro 100 mg tabletu a 200 ml pro 400 mg tabletu) a zamíchán lžící. Suspenze musí být požita neprodleně po kompletním rozpadnutí tablety(tablet).
Dávkování u CML u dospělých pacientů
Doporučená dávka Glivecu je pro dospělé pacienty v chronické fázi CML 400 mg/den. Chronická fáze CML je definována dosažením všech následujících kriterií: blasty v krvi a kostní dřeni < 15%, basofily v periferní krvi < 20%, krevní destičky > 100 x 109/l.
U dospělých pacientů s akcelerovanou fází je doporučená dávka Glivecu 600 mg/den. Akcelerovaná fáze onemocnění je určena přítomností kteréhokoli z následujících projevů: blasty v krvi nebo kostní dřeni > 15% ale < 30%, blasty a promyelocyty v krvi nebo kostní dřeni > 30% (za předpokladu < 30% blastů), basofily v periferní krvi > 20%, krevní destičky < 100 x 109/l bez vztahu k léčbě.
U dospělých pacientů v blastické krizi je doporučená dávka Glivecu 600 mg/den. Blastická krize je definována počtem blastů v krvi nebo kostní dřeni > 30% nebo extramedulárním postižením jiným než hepatosplenomegalií.
Trvání léčby: V klinických studiích pokračovala léčba Glivecem do progrese onemocnění. Efekt zastavení léčby po dosažení kompletní cytogenetické odpovědi nebyl zkoumán.
U pacientů v chronické fázi onemocnění je možno uvažovat o vzestupu dávky ze 400 mg na 600 mg nebo 800 mg, u pacientů s akcelerovanou fází onemocnění nebo v blastické krizi je možné zvýšit dávku ze 600 mg na maximum 800 mg (podáváno 2krát denně 400 mg), při absenci závažných nežádoucích účinků nebo závažné neutropenii či trombocytopenii nesouvisející s leukemií, za následujících okolností: při progresi onemocnění (kdykoliv); pokud nebylo ani po 3 měsících léčby dosaženo uspokojivé hematologické odpovědi; pokud nebylo po 12 měsících léčby dosaženo cytogenetické odpovědi; nebo při ztrátě předtím dosažené hematologické a/nebo cytogenetické odpovědi. Při zvyšování podávané dávky by měli být pacienti pečlivě sledováni pro možnost zvýšeného výskytu nežádoucích reakcí při vyšších dávkách.
Dávkování u CML u dětí
Dávkování pro děti by mělo být stanoveno podle tělesného povrchu (mg/m2). Dávka 340 mg/m2 denně se doporučuje dětem s chronickou fází CML nebo v pokročilé fázi CML (nepřekročit celkovou dávku 800 mg). Lék může být podáván jednou denně nebo může být celková denní dávka rozdělena do dvou částí - jedna ráno a druhá večer. Doporučené dávkování je v současnosti založeno na malém počtu dětských pacientů (viz body 5.1 a 5.2). S léčbou dětí do 2 let věku nejsou zkušenosti.
U dětí je možno uvažovat o vzestupu dávky z 340 mg/m2 denně na 570 mg/m2 denně (nepřekročit celkovou dávku 800 mg) při absenci závažných nežádoucích účinků nebo závažné neutropenii či trombocytopenii nesouvisející s leukemií za následujících okolností: při progresi onemocnění (kdykoliv), pokud nebylo ani po 3 měsících léčby dosaženo uspokojivé hematologické odpovědi, pokud nebylo po 12 měsících léčby dosaženo cytogenetické odpovědi, nebo při ztrátě před tím dosažené hematologické a/nebo cytogenetické odpovědi. Při zvyšování podávané dávky by měli být pacienti pečlivě sledováni pro možnost zvýšeného výskytu nežádoucích reakcí při vyšších dávkách.
Dávkování u Ph+ ALL u dospělých pacientů
U dospělých pacientů s Ph+ ALL je doporučená dávka Glivecu 600 mg/den. Hematologičtí odborníci pro léčbu tohoto onemocnění by měli terapii sledovat během všech fází péče.
Léčebný režim: Podle dosavadních údajů byla prokázána účinnost a bezpečnost Glivecu u dospělých pacientů s nově diagnostikovanou Ph+ ALL, pokud se podával v dávce 600 mg/den v kombinaci s chemoterapií v indukční fázi, v konsolidační a udržovací fázi po chemoterapii (viz bod 5.1). Délka léčby Glivecem se může lišit s vybraným léčebným programem, ale obecně delší expozice Glivecu přináší lepší výsledky.
Pro dospělé pacienty s recidivující nebo refrakterní Ph+ ALL je monoterapie Glivecem při dávce 600 mg/den bezpečná, účinná a může být podávána, dokud se neobjeví progrese onemocnění.
Dávkování u Ph+ ALL u dětí
Dávkování pro děti má být stanoveno podle tělesného povrchu (mg/m2). U dětí s Ph+ ALL se doporučuje dávka 340 mg/m2 denně (nepřekročit celkovou dávku 600 mg).
Dávkování u MDS/MPD
U dospělých pacientů s MDS/MPD je doporučená dávka Glivecu 400 mg/den.
Trvání léčby: V jediné dosud provedené klinické studii pokračovala léčba Glivecem do progrese onemocnění (viz bod 5.1). V čase analýzy byl medián trvání léčby 47 měsíců (24 dnů - 60 měsíců).
Dávkování u HES/CEL
U dospělých pacientů s HES/CEL je doporučená dávka Glivecu 100 mg/den.
Zvýšení dávky ze 100 mg na 400 mg lze zvažovat při absenci nežádoucích účinků léčiva, a jestliže je při hodnocení léčby prokázána nedostatečná odpověď na léčbu.
Léčba by měla pokračovat tak dlouho, dokud je pro pacienta přínosná.
Dávkování u GIST
U dospělých pacientů s inoperabilním a/nebo metastatickým maligním GIST je doporučená dávka Glivecu 400 mg/den.
Existuje pouze omezené množství údajů o účinku zvýšení dávky ze 400 mg na 600 mg nebo 800 mg u pacientů s progresí při užívání nižší dávky (viz bod 5.1).
Trvání léčby: v klinických studiích pokračovala léčba pacientů s GIST do progrese onemocnění. V době analýzy byl medián trvání léčby 7 měsíců (7 dní až 13 měsíců). Efekt zastavení léčby po dosažení odpovědi nebyl studován.
Doporučená dávka Glivecu pro adjuvantní léčbu dospělých pacientů po resekci GIST je 400 mg/den. Optimální délka trvání léčby dosud není stanovena. Délka léčby v klinických studiích, které byly podkladem pro tuto indikaci, byla 36 měsíců (viz bod 5.1).
Dávkování u DFSP
U dospělých pacientů s DFSP je doporučená dávka Glivecu 800 mg/den.
Úprava dávkování pro nežádoucí účinky
Nehematologické nežádoucí účinky
Jestliže se při léčbě Glivecem vyskytnou závažné nehematologické nežádoucí účinky, musí být léčba do jejich zvládnutí přerušena. Potom může být léčba přiměřeně obnovena v závislosti na počáteční závažnosti příhody.
Při zvýšení hladiny bilirubinu > 3násobek stanoveného horního limitu normálu (IULN) nebo při zvýšení hladin jaterních transamináz > 5násobek IULN by měla by být léčba Glivecem přerušena, dokud se hladiny bilirubinu nevrátí k < 1,5násobku IULN a hladiny transamináz k < 2,5násobku IULN. Léčba Glivecem potom může pokračovat nižšími denními dávkami. U dospělých by měla být dávka snížena ze 400 na 300 mg nebo ze 600 na 400 mg nebo z 800 mg na 600 mg a u dětí ze 340 na 260 mg/m2/den.
Hematologické nežádoucí účinky
Při závažné neutropenii nebo trombocytopenii se doporučuje snížení dávky nebo přerušení léčby tak, jak je uvedeno v následující tabulce.
Úprava dávkování při neutropenii nebo trombocytopenii:
|
HES/CEL (zahajovací dávka 100 mg) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem na úroveň předchozí dávky (tj. před vážnými nežádoucími reakcemi). |
|
Chronická fáze CML, MDS/MPD a GIST (zahajovací dávka 400 mg) HES/CEL (dávka 400 mg) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem na úroveň předchozí dávky (tj. před vážnými nežádoucími reakcemi). 3. V případě opakování ANC < 1,0 x 109/l a/nebo krevních destiček k < 50 x 109/l, opakujte bod 1 a léčbu Glivecem obnovte sníženou dávkou 300 mg. |
|
Chronická fáze CML u dětí (dávka 340 mg/m2) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem na úroveň předchozí dávky (tj. před vážnými nežádoucími reakcemi). 3. V případě opakování ANC < 1,0 x109/l a/nebo krevních destiček < 50 x109/l, opakujte bod 1 a léčbu Glivecem obnovte sníženou dávkou 260 mg/m2. |
|
Akcelerovaná fáze CML a blastická krize a Ph+ ALL (počáteční dávka 600 mg) |
aANC < 0,5 x 109/l a/nebo krevní destičky < 10 x 109/l |
1. Zjistěte, zda cytopenie souvisí s leukemií (aspirací kostní dřeně nebo biopsií). 2. Pokud cytopenie nesouvisí s leukemií, snižte dávku Glivecu na 400 mg. 3. Pokud cytopenie přetrvává po 2 týdny, snižte dále dávku na 300 mg. 4. Pokud cytopenie přetrvává po 4 týdny a stále nesouvisí s leukemií, přerušte podávání Glivecu dokud není ANC > 1 x 109/l a krevní destičky > 20 x 109/l, potom obnovte léčbu dávkou 300 mg. |
|
Akcelerovaná fáze CML a blastická krize u dětí (počáteční dávka 340 mg/m2) |
aANC < 0,5 x 109/l a/nebo krevní destičky < 10 x 109/l |
1. Zjistěte, zda cytopenie souvisí s leukemií (aspirací kostní dřeně nebo biopsií). 2. Pokud cytopenie nesouvisí s leukemií, snižte dávku Glivecu na 260 mg/m2. 3. Pokud cytopenie přetrvává po 2 týdny, snižte dále dávku na 200 mg/m2. 4. Pokud cytopenie přetrvává po 4 týdny a stále nesouvisí s leukemií, přerušte podávání Glivecu, dokud není ANC > 1 x 109/l a krevní destičky > 20 x 109/l, potom obnovte léčbu dávkou 200 mg/m2. |
|
DFSP (při dávce 800 mg) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem v dávce 600 mg. 3. V případě opakování ANC < 1,0 x 109/l a/nebo krevních destiček k < 50 x 109/l, opakujte bod 1 a léčbu Glivecem obnovte se sníženou dávkou 400 mg. |
|
ANC = absolutní počet neutrofilů a výskyt nejméně po 1 měsíci léčby | ||
Zvláštní populace
Užití u dětí: Nejsou žádné zkušenosti s podáváním u dětí s CML mladších než 2 roky a u dětí s Ph+ ALL mladších než 1 rok (viz bod 5.1). Zkušenosti u dětí s MDS/MPD, DFSP, GIST a HES/CEL jsou velmi omezené.
Bezpečnost a účinnost imatinibu u dětí mladších než 18 let s MDS/MPD, DFSP, GIST a HES/CEL nebyla v klinických studiích stanovena. V současnosti dostupné publikované údaje jsou shrnuty v bodě 5.1, ale na jejich základě nelze učinit žádná doporučení ohledně dávkování.
Jaterní nedostatečnost: Imatinib je metabolizován především játry. Pacientům s mírnou, středně těžkou nebo těžkou dysfunkcí jater by měla být podávána minimální doporučená dávka 400 mg denně. Dávka může být snížena, pokud není tolerována (viz body 4.4, 4.8 a 5.2).
Klasifikace dysfunkce jater:
|
Dysfunkce jater |
Vyšetření jaterních funkcí |
|
Mírná |
Celkový bilirubin: = 1,5 ULN AST: > ULN (může být normální nebo < ULN, pokud celkový bilirubin je > ULN) |
|
Středně těžká |
Celkový bilirubin: > 1,5—3,0 ULN AST: jakákoliv |
|
Těžká |
Celkový bilirubin: > 3-10 ULN AST: jakákoliv |
ULN = horní hranice normy AST = aspartátaminotransferáza
Ledvinná nedostatečnost: U pacientů s dysfunkcí ledvin nebo u dialyzovaných pacientů má být použita počáteční minimální dávka 400 mg denně. U těchto pacientů se však doporučuje opatrnost. Pokud dávka není tolerována, může být snížena. Pokud je tolerována, může být v případě nedostatečné účinnosti zvýšena (viz bod 4.4 a 5.2).
Starší lidé: U starších lidí nebyla farmakokinetika imatinibu cíleně studována. V klinických studiích, které zahrnovaly 20% pacientů ve věku 65 let a starších, nebyly u dospělých pacientů pozorovány významné rozdíly ve farmakokinetice v závislosti na věku. U starších lidí není nutné doporučovat zvláštní dávkování.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Pokud je Glivec podáván společně s jinými léčivými přípravky, je možné očekávat lékové interakce. Při užívání Glivecu s inhibitory proteáz, azolovými antimykotiky, některými makrolidy (viz bod 4.5), substráty CYP3A4 s úzkým terapeutickým rozpětím (např. cyklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin, fentanyl, alfentanil, terfanadin, bortezomib, docetaxel, chinidin) nebo warfarinem a jinými deriváty kumarinu je nutné dbát opatrnosti (viz bod 4.5).
Souběžné užívání imatinibu a léčivých přípravků, které indukují CYP3A4 (např. dexamethason, fenytoin, karbamazepin, rifampicin, fenobarbital nebo Hypericum perforatum, také známé jako třezalka tečkovaná) mohou významně snižovat hladinu Glivecu a potenciálně zvyšovat riziko selhání léčby Proto by se mělo zabránit souběžnému užívání silných induktorů CYP3A4 a imatinibu (viz bod 4.5).
Hypotyreóza
Během léčby Glivecem byly hlášeny klinické případy hypotyreózy u pacientů, kterým byla provedena tyreoidektomie a kteří byli substitučně léčeni levothyroxinem (viz bod 4.5). U těchto pacientů je třeba důkladně kontrolovat hladiny tyreotropního hormonu (TSH).
Hepatotoxicita
Glivec je metabolizován převážně játry a pouze 13% je vylučováno ledvinami. U pacientů s dysfunkcí jater (mírnou, středně závažnou nebo závažnou) by měl být pečlivě sledován počet krevních elementů v periferní krvi a jaterní enzymy (viz body 4.2, 4.8 a 5.2). Je nutné si uvědomit, že pacienti s GIST mohou mít jaterní metastázy, které mohou vést ke zhoršení jaterních funkcí.
Při léčbě imatinibem byly pozorovány případy jatemího poškození včetně jatemího selhání a jatemí nekrózy. Pokud bylo podávání imatinibu kombinováno s vysokodávkovými chemoterapeutickými režimy, byl zjištěn nárůst závažných jaterních reakcí. Jaterní funkce by měly být pečlivě monitorovány, jestliže se imatinib kombinuje s chemoterapeutickými režimy, o kterých je také známo, že bývají spojeny s poruchou jaterních funkcí (viz bod 4.5 a 4.8).
Retence tekutin
Výskyt závažné retence tekutin (pleurální výpotek, edém, plicní edém, ascites, povrchový edém) byl hlášen přibližně u 2,5% nově diagnostikovaných pacientů s CML užívajících Glivec. Proto se velice doporučuje pravidelné vážení pacientů. Neočekávaný, rychlý nárůst tělesné hmotnosti by měl být pečlivě vyšetřen, a pokud je to nezbytné, měla by být zavedena příslušná podpůrná a léčebná opatření.
V klinických studiích byl zvýšený výskyt těchto příhod u starších lidí a u pacientů se srdečním onemocněním v anamnéze. Proto je nutné pacientům se srdeční dysfunkcí věnovat zvýšenou pozornost.
Pacienti se srdečním onemocněním
Pacienti se srdečním onemocněním, s rizikovými faktory vzniku srdečního selhání nebo renálním selháním v anamnéze by měli být pečlivě sledováni, a každý pacient s příznaky nebo projevy shodnými s příznaky srdečního nebo renálního selhání by mělo být vyšetřen a léčen.
U pacientů s hypereosinofilním syndromem (HES) s okultní infiltrací HES buněk do myokardu byly ojedinělé případy kardiogenního šoku či dysfunkce levé komory spojeny s degranulací HES buněk po zahájení léčby imatinibem. Dle hlášení byl stav reverzibilní při podávání systémových kortikosteroidů, zavedení opatření k podpoře cirkulace a dočasném vysazení imatinibu. Protože byly hlášeny méně časté kardiální nežádoucí účinky při podávání Glivecu, mělo by být před zahájením léčby pečlivě zváženo stanovení prospěchu/rizika léčby imatinibem u pacientů s HES/CEL.
Myelodysplastické/myeloproliferativní onemocnění se změnou genu receptoru PDGFR by mohlo být spojeno s vysokými hladinami eosinofilů. Proto by se mělo před podáním Glivecu pacientům s HES/CEL a pacientům s MDS/MPD spojeným s vysokými hladinami eosinofilů zvážit vyšetření odborníkem kardiologem, provedení echokardiogramu a stanovení troponinu v séru. Pokud je výsledek kteréhokoli vyšetření abnormální, mělo by být zváženo vyšetření odborníkem kardiologem a profylaktické podávání systémových kortikosteroidů (1-2 mg/kg) po dobu jednoho až dvou týdnů souběžně se zahájením léčby imatinibem.
Gastrointestinální krvácení
Ve studii u pacientů s inoperabilním a/nebo metastatickým GIST bylo hlášeno jak gastrointestinální, tak i intratumorózní krvácení (viz bod 4.8). Na základě dostupných údajů nebyly identifikovány žádné predispoziční faktory (např.velikost nádoru, lokalizace nádoru, poruchy koagulace), které by zařadily pacienty s GIST do skupiny s vyšším rizikem kteréhokoli typu krvácení. Protože je zvýšená vaskularizace a sklon ke krvácivosti součástí povahy a klinického průběhu GIST, měl by být u všech pacientů použit standardní postup pro monitorování a zvládání krvácení.
V postmarketingovém období byla u pacientů s CML, ALL a jinými onemocněními hlášena také gastrická antrální vaskulární ektázie (GAVE), vzácný typ gastrointestinálního krvácení (viz bod 4.8).
V případě potřeby může být léčba přípravkem Glivec ukončena.
Syndrom nádorového rozpadu
Před započetím léčby přípravkem Glivec je doporučená úprava klinicky významné dehydratace a léčba vysokých hladin kyseliny močové z důvodu možného výskytu syndromu nádorového rozpadu (TLS) (viz bod 4.8).
Reaktivace hepatitidy B
U pacientů, kteří jsou chronickými nosiči hepatitidy B, dochází k reaktivaci po zahájení léčby inhibitory tyrosinkinázy bcr-abl. Některé případy vyústily v akutní selhání jater nebo ve fulminantní hepatitidu vedoucí k transplantaci jater nebo došlo k úmrtí pacienta.
Před zahájením léčby přípravkem GLIVEC mají být pacienti vyšetřeni na infekci HBV. Před zahájením léčby u pacientů s pozitivní sérologií hepatitidy B (včetně těch s aktivním onemocněním) a u pacientů, u kterých v průběhu léčby vyjde pozitivní test infekce HBV, je třeba se obrátit na odborníky na onemocnění jater a léčbu hepatitidy B. Nosiči HBV, kteří potřebují léčbu přípravkem GLIVEC, mají být po celou dobu léčby a několik měsíců po jejím ukončení pečlivě sledováni s ohledem na možný výskyt známek a příznaků aktivní infekce HBV (viz bod 4.8).
Laboratorní testy
Během léčby Glivecem musí být pravidelně vyšetřován kompletní krevní obraz. Léčba Glivecem u pacientů s CML byla doprovázena výskytem neutropenie nebo trombocytopenie. Avšak výskyt těchto cytopenií pravděpodobně souvisí se stádiem léčeného onemocnění a byl častější u pacientů s akcelerovanou fází CML nebo v blastické krizi než u pacientů s chronickou fází CML. Léčba Glivecem může být přerušena nebo dávky mohou být sníženy, jak je doporučeno viz bod 4.2.
U pacientů užívajících Glivec by měly být pravidelně monitorovány jaterní funkce (transaminázy, bilirubin, alkalická fosfatáza).
U pacientů s poruchou renálních funkcí je expozice imatinibem v plazmě patrně vyšší, než u pacientů s normální funkcí ledvin, pravděpodobně v důsledku zvýšené hladiny alfa-acid glycoproteinu (AGP) a vazby imatinibu na proteiny u těchto pacientů. Pacientům s renální nedostatečností by se měla podávat minimální zahajovací dávka. Pacienti se závažnou renální nedostatečností by měli být léčeni s opatrností. Pokud není dávka imatinibu tolerována, může být snížena (viz body 4.2 a 5.2).
Dlouhodobá léčba imatinibem může být spojená s klinicky významným omezením renální ch funkcí. Proto mají být renální funkce před zahájením léčby imatinibem vyhodnoceny a během léčby pečlivě sledovány, pozornost má být věnována pacientům, u nichž se projevují rizikové faktory pro renální dysfunkci. Pokud je zjištěna renální dysfunkce, musí být předepsána vhodná opatření a léčba, která je v souladu se standardními léčebnými doporučeními.
Pediatrická populace
U dětí a jedinců v prepubertálním věku (preadolescentů) užívajících imatinib byly hlášené případy retardace růstu. Dlouhodobé účinky prodloužené léčby imatinibem na růst dětí nejsou známé. Proto je doporučené pečlivé sledování růstu dětí léčených imatinibem (viz bod 4.8).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Léčivé látky, které mohou zvyšovat koncentraci imatinibu v plazmě:
Látky, které inhibují aktivitu izoenzymu CYP3A4 cytochromu P450 (např. inhibitory proteáz jako je indinavir, lopinavir/ritonavir, ritonavir, sachinavir, telaprevir, nelfinavir, boceprevir; azolová antimykotika zahrnující ketokonazol, itrakonazol, posakonazol, vorikonazol; některé makrolidy jako je erythromycin, klarithromycin a telithromycin) by mohly snižovat metabolismus a zvyšovat koncentraci imatinibu. Při souběžné jednotlivé dávce ketokonazolu (inhibitoru CYP3A4) zdravým jedincům bylo pozorováno významné zvýšení účinku imatinibu (průměrná Cmax imatinibu vzrostla o 26% a AUC o 40%). Při podávání Glivecu s inhibitory skupiny CYP3A4 je nutná opatrnost.
Léčivé látky, které mohou snižovat koncentraci imatinibu v plazmě:
Látky, které indukují aktivitu CYP3A4 (např. dexamethason, fenytoin, karbamazepin, rifampicin, fenobarbital, fosfenytoin, primidon nebo Hypericum perforatum, známé také jako třezalka tečkovaná) mohou významně snižovat působení Glivecu a potenciálně zvyšovat riziko selhání léčby. Předchozí léčba opakovaným podáním rifampicinu 600 mg následovaná jednorázovou dávkou 400 mg Glivecu měla za následek snížení Cmax nejméně o 54% a AUC(0-<X)) o 74% ve srovnání s hodnotami bez předchozí léčby rifampicinem. Podobné výsledky byly pozorovány u pacientů s maligními gliomy, kteří byli léčeni Glivecem a užívali antiepileptické léky (EIAEDs) jako např. karbamazepin, oxkarbazepin a fenytoin, které indukovaly příslušné jaterní enzymy. Došlo ke snížení AUC imatinibu v plazmě o 73% oproti pacientům, kteří neužívali EIAEDs. Mělo by se zabránit souběžnému užívání rifampicinu nebo jiných silných induktorů CYP3A4 a imatinibu.
Léčivé látky, jejichž koncentrace v plazmě by mohla být ovlivněna Glivecem
Imatinib zvyšuje průměrnou Cmax simvastatinu 2krát a AUC simvastatinu (CYP3A4 substrát) 3,5krát, což znamená, že je CYP3A4 inhibován imatinibem. Při podávání Glivecu se substráty CYP3A4 s úzkým terapeutickým oknem se proto doporučuje opatrnost (např. cyklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin, fentanyl, alfentanil, terfenadin, bortezomib, docetaxel a chinidin). Glivec může zvyšovat plazmatickou koncentraci jiných léků metabolizovaných CYP3A4 (např. triazolo-benzodiazepinů, dihydropyridinových blokátorů kalciových kanálů, některých inhibitorů HMG-CoA reduktázy, tj. statinů, atd.).
Vzhledem ke známému zvýšenému riziku krvácení spojenému s užíváním imatinibu (např. hemoragie) by měli pacienti vyžadující antikoagulační léčbu místo kumarinových derivátů, jako je warfarin, dostávat nízkomolekulární nebo standardní heparin.
In vitro Glivec inhibuje aktivitu izoenzymu CYP2D6 cytochromu P450 v koncentraci podobné té, která ovlivňuje aktivitu CYP3A4. Imatinib v dávce 400 mg dvakrát denně působil inhibičně na metabolismus metoprololu zprostředkovaný CYP2D6; došlo ke zvýšení Cmax a AUC metoprololu o přibližně 23% (90% CI [1,16-1,30]).Zdá se, že při souběžném podávání imatinibu se substráty CYP2D6 není nutno upravovat dávkování, doporučuje se však věnovat zvýšenou pozornost substrátům CYP2D6 s úzkým terapeutickým oknem, jako je např. metoprolol. U pacientů léčených metoprololem je nutno zvážit klinické monitorování.
In vitro Glivec inhibuje O-glukuronidaci paracetamolu s Ki hodnotou 58,5 mikromol/l. Tato_inhibice nebyla zjištěna po podání Glivecu 400 mg a paracetamolu 1000 mg in vivo. Vyšší dávky Glivecu a paracetamolu nebyly studovány.
Obezřetnost by proto měla být uplatněna při souběžném užívání vyšších dávek Glivecu a paracetamolu.
U pacientů s tyreoidektomií léčených levothyroxinem, může být plazmatická expozice levothyroxinu snížena, pokud se podává spolu s Glivecem (viz bod 4.4). Proto se doporučuje opatrnost. Nicméně mechanismus pozorované interakce v současnosti není znám.
U pacientů s Ph+ ALL existují klinické zkušenosti souběžného podávání Glivecu a chemoterapie (viz bod 5.1), avšak lékové interakce mezi imatinibem a chemoterapeutickými režimy nejsou dobře známy. Nežádoucí účinky imatinibu jako jaterní toxicita, myelosuprese a další se mohou zvyšovat, podle hlášení souběžné užívání s L-asparaginázou by mohlo být spojeno se zvýšením jaterní toxicity (viz bod 4.8). Proto je třeba zvláštní opatrnosti, pokud se Glivec užívá v kombinaci.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku
Ženám ve fertilním věku musí být doporučeno užívání účinné antikoncepce během léčby.
K dispozici jsou omezené údaje o podávání imatinibu těhotným ženámi. Studie na zvířatech však prokázaly reprodukční toxicitu (viz bod 5.3). Potenciální riziko pro plod není známé. Glivec lze v těhotenství použít pouze pokud je to nezbytně nutné. Pokud je během těhotenství užíván, pacientka musí být informována o možném riziku pro plod.
Kojení
O vylučování imatinibu do mateřského mléka jsou jen omezené informace. Studie na dvou kojících ženách ukázaly, že jak imatinib, tak jeho aktivní metabolit může být vylučován do mateřského mléka. Koeficient mléko/plazma imatinibu a jeho metabolitu zkoumaný u jedné pacientky byl stanoven 0,5 pro imatinib a 0,9 pro jeho metabilit, což nasvědčuje zvýšenému vylučováním metabolitu do mléka. Zvážíme-li kombinovanou koncentraci imatinibu a jeho metabolitu a maximální denní příjem mléka kojenci, byla by očekávaná celková expozice nízká (přibližně 10% terapeutické dávky). Nicméně, jelikož účinky expozice nízké dávce imatinibu u kojenců nejsou známé, neměly by ženy užívající imatinib kojit.
Fertilita
Fertilita u samců a samic potkanů nebyla v neklinických studiích ovlivněna (viz bod 5.3). Studie u pacientů užívajících Glivec zabývající se jeho účinky na fertilitu a spermatogenezi nebyly provedeny. Pacienti, kteří se obávají o svou fertilitu během léčby Glivecem, by se měli poradit se svým lékařem.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacienti by měli být upozorněni, že se u nich mohou během léčby imatinibem vyskytnout nežádoucí účinky, jako jsou závratě, neostré vidění nebo ospalost. Proto se při řízení nebo obsluze strojů doporučuje zvýšená opatrnost.
4.8 Nežádoucí účinky
U pacientů s pokročilým stadiem malignit se může vyskytovat řada různorodých zdravotních potíží vyvolaných základním onemocněním, jeho progresí nebo množstvím souběžně užívaných léčivých přípravků, což ztěžuje stanovení příčinné souvislosti výskytu nežádoucích reakcí.
Během klinického hodnocení léku u CML musela být z důvodu nežádoucích reakcí, které byly v příčinné souvislosti s podáváním léku, léčba přerušena pouze u 2,4% nově diagnostikovaných pacientů, u 4% pacientů v pozdní chronické fázi po selhání léčby interferonem, u 4% pacientů v akcelerované fázi po selhání léčby interferonem a u 5% pacientů v blastické krizi po selhání léčby interferonem. U pacientů s GIST bylo podávání hodnoceného léku přerušeno pro nežádoucí reakce související s lékem u 4% pacientů.
Nežádoucí účinky byly ve všech indikacích podobné, s výjimkou dvou reakcí. U pacientů s CML byla častěji pozorována myelosuprese než u pacientů s GIST, pravděpodobně způsobené základním onemocněním. Ve studii u pacientů s inoperabilním a/nebo metastatickým GIST se u 7 (5%) pacientů vyskytl CTC stupeň 3/4 GI krvácení (3 pacienti), krvácení do nádoru (3 pacienti) nebo obojí (1 pacient). Lokalizace GI nádorů může být zdrojem krvácení do zažívacího traktu (viz bod 4.4). Krvácení do zažívacího traktu nebo z nádoru může být někdy velmi vážné, v některých případech až fatální. Nejčastěji hlášené (> 10%) nežádoucí reakce vyvolané lékem v obou souborech byly mírná nauzea, zvracení, průjem, bolesti břicha, únava, svalové bolesti, svalové křeče a vyrážka. Povrchové otoky byly společným nálezem ve všech studiích a byly popisovány hlavně jako otoky kolem očí nebo otoky dolních končetin. Tyto otoky však byly jen vzácně závažné a bylo možné je zvládnout diuretiky, jinou podpůrnou léčbou nebo snížením dávky Glivecu.
Pokud se imatinib kombinoval s vysokou dávkou chemoterapie u pacientů s Ph+ ALL, byla pozorována přechodná jaterní toxicita ve formě zvýšení transamináz a hyperbilirubinemie. Při použití omezených údajů z bezpečnostních databází se dosud hlášené nežádoucí účinky u dětí shodují se známým bezpečnostním profilem u dospělých pacientů s Ph+ ALL. Databáze týkající se bezpečnosti u dětí s Ph+ ALL je velmi omezená, protože nebyly zjistěné nové bezpečnostní události.
Různorodé nežádoucí účinky, jako je pleurální výpotek, ascites, plicní edém a rychlý přírůstek tělesné hmotnosti s nebo bez superficiálních otoků, je možné souhrnně popsat jako „retence tekutin“ Tyto nežádoucí reakce je možné obvykle zvládnout dočasným vysazením Glivecu a diuretiky a jinou vhodnou podpůrnou léčbou. Avšak některé z těchto reakcí mohou být velmi závažné nebo život ohrožující a několik pacientů s blastickou krizí zemřelo s komplexním klinickým nálezem zahrnujícím pleurální výpotek, městnavé srdeční selhání a selhání ledvin. V klinických studiích nebyly u dětí pozorovány specificky odlišné nežádoucí účinky.
Nežádoucí účinky
Nežádoucí účinky, které se vyskytly častěji než v ojedinělých případech jsou uvedeny níže podle orgánové klasifikace a frekvence výskytu. Kategorie frekvencí výskytu jsou definovány podle následujících pravidel jako: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
V každé skupině četností jsou nežádoucí účinky seřazeny podle četnosti od nejčastější.
Nežádoucí účinky a četnost jejich výskytu jsou uvedené v Tabulce 1.
Tabulka 1 Přehled nežádoucích účinků v tabulce
|
Infekce a infestace | |
|
Méně časté: |
Herpes zoster, herpes simplex, nasofaryngitida, pneumonie1, sinusitida, celulitida, infekce horních cest dýchacích, chřipka, infekce močových cest, gastroenteritida, sepse |
|
Vzácné: |
Plísňové infekce |
|
Není známo: |
Reaktivace hepatitidy B* |
|
Novotvary benigní, maligní, a blíže neurčené (zahrnující cysty a polypy) | |
|
Vzácné: |
Syndrom nádorového rozpadu |
|
Není známo: |
Krvácení do tumoru/nekróza tumoru* |
|
Poruchy imunitního systému | |
|
Není známo: |
Anafylaktický šok* |
|
Poruchy krve a lymfatického systému | |
|
Velmi časté: |
Neutropenie, trombocytopenie, anemie |
|
Časté: |
Pancytopenie, febrilní neutropenie |
|
Méně časté: |
Trombocytemie, lymfopenie, útlum kostní dřeně, eozinofilie, lymfadenopatie |
|
Vzácné: |
Hemolytická anemie |
|
Poruchy metabolismu a výživy | |
|
Časté: | |
|
Méně časté: |
Hypokalemie, zvýšená chuť k jídlu, hypofosfatemie, snížená chuť k jídlu, dehydratace, dna, hyperurikemie, hyperkalcemie, hyperglykemie, hyponatremie |
|
Vzácné: |
Hyperkalemie, hypomagnezémie |
|
Psychiatrické poruchy | |
|
Časté: | |
|
Méně časté: | |
|
Vzácné: |
Stav zmatenosti |
|
Poruchy nervového systému | |
|
Velmi časté: |
Bolesti hlavy2 |
|
Časté: |
Závratě, parestezie, porucha chutě, hypestezie |
|
Méně časté: |
Migréna, somnolence, synkopa, periferní neuropatie, zhoršení paměti, ischias, syndrom neklidných nohou, třes, mozkové krvácení |
|
Vzácné: |
Zvýšený intrakraniální tlak, křeče, optická neuritida |
|
Není známo: |
Cerebrální edém* |
|
Poruchy oka | |
|
Časté: |
Otok očních víček, zvýšené slzení, krvácení do spojivky, konjunktivitida, syndrom suchého oka, rozmazané vidění |
|
Méně časté: |
Podráždění očí, bolesti očí, edém očnice, krvácení do bělimy, krvácení do sítnice, blefaritida, makulární edém |
|
Není známo: |
Krvácení do sklivce* |
|
Poruchy ucha a labyrintu | |
|
Méně časté: |
Vertigo, tinitus, ztráta sluchu |
|
Srdeční poruchy | |
|
Méně časté: |
Palpitace, tachykardie, městnavé srdeční selhání3, plicní edém |
|
Vzácné: |
Arytmie, atriální fibrilace, srdeční zástava, infarkt myokardu, angina pectoris, perikardiální výpotek |
|
Není známo: |
Perikarditida*, srdeční tamponáda* |
|
Cévní poruchy4 | |
|
Časté: |
Zrudnutí, krvácení |
|
Méně časté: |
Hypertenze, hematomy, subdurální hematom, periferní chlad, hypotenze, Raynaudův fenomén |
|
Není známo: |
T rombóza/ embolie* |
|
Respirační, hrudní a mediastinální poruchy | |
|
Časté: | |
|
Méně časté: |
Pleurální výpotek5, bolesti hrtanu/hltanu, faryngitida |
|
Vzácné: |
Bolest pohrudnice, plicní fibróza, plicní hypertenze, krvácení do plic |
|
Není známo: |
Akutní respirační selhání10*, intersticiální plicní onemocnění* |
|
Gastrointestinální poruchy | |
|
Velmi časté: | |
|
Časté: |
Nadýmání, rozpětí břicha, gastro-ezofageální reflux, zácpa, sucho v ústech, gastritida |
|
Méně časté: |
Stomatitida, ulcerace v ústech, gastrointestinální krvácení7, říhání, meléna, ezofagitida, ascites, žaludeční ulcerace, hematemeze, cheilitida, dysfagie, pankreatitida |
|
Vzácné: |
Kolitida, ileus, zánětlivé střevní onemocnění |
|
Není známo: |
Ileus/neprůchodnost střev*, gastrointestinální perforace*, divertikulitida*, gastrická antrální vaskulární ektázie (GAVE)* |
|
Poruchy jater a žlučových cest | |
|
Časté: |
Zvýšení jatemích enzymů |
|
Méně časté: |
Hyperbilirubinemie, hepatitida, žloutenka |
|
Vzácné: |
Jatemí selhání8, jatemí nekróza |
|
Poruchy kůže a podkožní tkáně | |
|
Velmi časté: |
Periorbitální edém, dermatitida/ekzém/vyrážka |
|
Časté: |
Pruritus, otok obličeje, suchá pleť, erytém, alopecie, noční pocení, reakce fotosensitivity |
|
Méně časté: |
Pustulózní vyrážka, zhmožděniny, zvýšené pocení, urtikarie, ekchymóza, zvýšená tendence k tvorbě podlitin, hypotrichóza, hypopigmentace kůže, exfoliativní dermatitida, lámání nehtů, folikulitida, petechie, lupénka, purpura, hyperpigmentace kůže, výsev puchýřků |
|
Vzácné: |
Akutní febrilní neutrofilní dermatóza (Sweet’s syndrome), ztráta barvy nehtů, angioneurotický edém, puchýřkovitá vyrážka, multiformní erytém, leukocytoklastická vaskulitida, Stevens-Johnsonův syndrom, akutní generalizovaná exantematózní pustulóza (AGEP) |
|
Není známo: |
Syndrom palmoplantární erytrodysestezie*, lichenoidní keratóza*, lichen planus*, toxická epidermální nekrolýza*, poléková vyrážka s eozinofilií a systémovými příznaky (DRESS)* |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | |
|
Velmi časté: |
Svalové křeče a záchvaty křečí, muskuloskeletární bolesti včetně myalgie, artralgie, bolesti kostí9 |
|
Časté: |
Otoky kloubů |
|
Méně časté: |
Kloubní a svalová ztuhlost |
|
Vzácné: |
Svalová slabost, artritida, rabdomyolýza/myopatie |
|
Není známo: |
Avaskulární nekróza/nekróza kyčle*, retardace růstu u dětí* |
|
Poruchy ledvin a močových cest | |
|
Méně časté: |
Bolesti ledvin, hematurie, akutní selhání ledvin, zvýšená frekvence močení |
|
Není známo: |
Chronické selhání ledvin |
|
Poruchy reprodukčního systému a prsu | |
|
Méně časté: |
Gynekomastie, erektilní dysfunkce, menoragie, nepravidelná menstruace, poruchy sexuální funkce, bolesti bradavek, zvětšení prsou, edém skrota |
|
Vzácné: |
Hemoragické žluté tělísko/hemoragické cysty na vaječní cích |
|
Celkové poruchy a reakce v místě aplikace | |
|
Velmi časté: |
Zadržování tekutin a edémy, únava |
|
Časté: |
Slabost, pyrexie, anasarka, mrazení, ztuhlost |
|
Méně časté: | |
|
Vyšetření | |
|
Velmi časté: |
Zvýšení hmotnosti |
|
Časté: |
Snížení hmotnosti |
|
Méně časté: |
Zvýšení koncentrace kreatininu v krvi, zvýšení kreatinfosfokinázy v krvi, zvýšení laktátdehydrogenázy v krvi, zvýšení alkalické fosfatázy v krvi |
|
Vzácné: |
Zvýšení amylázy v krvi |
* Tyto typy reakcí byly hlášeny po uvedení přípravku Glivec na trhu. Jsou zde zahrnuta spontánní hlášení nežádoucích účinků a také závažné nežádoucí účinky z pokračujících studií, programů rozšířeného přístupu k léčivému přípravku, studií klinické farmakologie a výzkumných studií v dosud neschválených indikacích. Protože tyto reakce jsou hlášeny z populace neurčitého rozsahu, není vždy možné spolehlivě odhadnout jejich četnost výskytu nebo stanovit kauzální vztah vůči expozici imatinibem.
1 Pneumonie byla nejčastěji hlášena u pacientů s transformovanou CML a u pacientů s GIST.
2 Bolesti hlavy byly nejčastější u pacientů s GIST.
3 Na podkladě hodnocení pacientoroků byly srdeční příhody včetně městnavého srdečního selhání pozorovány častěji u pacientů s transformovanou CML než u pacientů s chronickou CML.
4 Zrudnutí bylo nejčastější u pacientů s GIST a krvácení (hematomy, hemoragie) bylo nejčastější u pacientů s GIST a s transformovanou CML (CML-AP a CML-BC).
5 Pleurální výpotek byl častěji hlášen u pacientů s GIST a u pacientů s transformovanou CML (CML-AP a CML-BC) než u pacientů s chronickou CML.
6+7 Bolesti břicha a gastrointestinální krvácení byly nejčastěji pozorovány u pacientů s GIST.
8 Bylo hlášeno několik fatálních případů jaterního selhání a jaterních nekróz.
9 Muskuloskeletární bolesti a související příhody byly častěji pozorovány u pacientů s CML než u pacientů s GIST.
10 Fatální případy byly hlášeny u pacientů s pokročilým onemocněním, závažnými infekcemi, závažnou neutropenií a jinými závažnými konkomitantními stavy.
Změny hodnot laboratorních vyšetření Hematologie
U CML byly cytopenie, zvláště neutropenie a trombocytopenie, shodným nálezem ve všech studiích, s náznakem vyššího výskytu při vysokých dávkách > 750 mg (fáze I studie). Výskyt cytopenií byl však jasně závislý na stádiu onemocnění. Frekvence výskytu stupně 3 nebo 4 neutropenií (ANC
< 1,0 x 109/l) a trombocytopenií (počet destiček < 50 x 109/l) byly 4x a 6x častější v blastické krizi a akcelerované fázi onemocnění (59-64% pro neutropenii a 44-63% pro trombocytopenii) ve srovnání s nově diagnostikovanými pacienty s chronickou fází CML (16,7% neutropenií a 8,9% trombocytopenií). U nově diagnostikovaných pacientů s chronickou fází CML byl stupeň 4 neutropenie (ANC < 0,5 x 109/l) pozorován u 3,6% a trombocytopenie (počet destiček < 10 x 109/l) u
< 1% pacientů. Medián trvání neutropenické a trombocytopenické příhody byl obvykle v rozmezí od 2 do 3 týdnů a od 3 do 4 týdnů. Tyto příhody je možné obvykle zvládnout buď snížením dávky nebo přerušením léčby Glivecem, ale ve vzácných případech mohou vést k trvalému přerušení léčby. U dětských pacientů s CML byla nejčastějším pozorovaným hematologickým nežádoucím účinkem cytopenie stupně 3 nebo 4, která zahrnovala neutropenii, trombocytopenii a anemii. Většinou se objevily během prvních několika měsíců léčby.
Ve studii u pacientů s inoperabilním a/nebo metastatickým GIST byl popsán stupeň 3 anemie u 5,4% a stupeň 4 u 0,7% pacientů, které mohly souviset, alespoň u některých pacientů, s gastrointestinálním krvácením nebo krvácením do nádoru. Stupeň 3 neutropenie byl pozorován u 7,5% pacientů a stupeň 4 u 2,7% pacientů a stupeň 3 trombocytopenie byl u 0,7% pacientů. U žádného pacienta se nevyvinul stupeň 4 trombocytopenie. Snížení počtu bílých krvinek (WBC) a neutrofilů se objevilo hlavně během prvních šesti týdnů léčby, potom zůstávaly hodnoty relativně stabilní.
Biochemie
Závažné zvýšení hodnot transamináz (< 5%) nebo bilirubinu (< 1%) bylo pozorováno u pacientů s CML a obvykle je bylo možné zvládnout snížením dávky nebo přerušením léčby (medián trvání těchto příhod byl přibližně jeden týden). Léčba byla z důvodů abnormálních laboratorních hodnot jaterních testů trvale přerušena u méně než 1% pacientů s CML. U pacientů s GIST (studie B2222), bylo pozorováno zvýšení ALT (alaninaminotransferáza) stupně 3 nebo 4 u 6,8% a zvýšení AST (aspartátaminotransferáza) stupně 3 nebo 4 u 4,8%. Zvýšení bilirubinu bylo méně než 3%.
Byly to případy cytolytické a cholestatické hepatitidy a jaterního selhání; některé z nich byly fatální, včetně jednoho pacienta užívajícího vysoké dávky paracetamolu.
Popis vybraných nežádoucích účinků
Reaktivace hepatitidy B
V souvislosti s tyrosinkinázou bcr-abl byla zaznamenána reaktivace hepatitidy B. Některé případy vyústily v akutní selhání jater nebo ve fulminantní hepatitidu vedoucí k transplantaci jater nebo došlo k úmrtí pacienta (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Zkušenosti s dávkami vyššími než doporučená terapeutická dávka jsou omezené. Jednotlivé případy předávkování Glivecem byly hlášeny spontánně a v literatuře. V případě předávkování by měl být pacient pozorován a odpovídajícím způsobem léčen podpůrnou léčbou. Obecně byl v těchto případech hlášen výsledek „zlepšený“ nebo „vyléčený“. Následující příhody byly hlášeny při podání různých rozmezí dávky:
Dospělá populace
1200 až 1600 mg (délka trvání 1 až 10 dní): Nauzea, zvracení, průjem,vyrážka, zrudnutí kůže, edém, otoky, únava, svalové křeče, trombocytopenie, pancytopenie, bolest břicha, bolest hlavy, snížená chuť k jídlu.
1800 až 3200 mg (dosáhlo až 3200 mg denně po dobu 6 dnů): Slabost, myalgie, zvýšená hodnota kreatinfosfokinázy, zvýšená hodnota bilirubinu, gastrointestinální bolest.
6400 mg (jednotlivá dávka): V literatuře hlášený případ jednoho pacienta, u kterého se objevila nauzea, zvracení, bolest břicha, pyrexie, otok obličeje, snížený počet neutrocytů, zvýšení hodnot transamináz.
8 až 10 g (jednotlivá dávka): Bylo hlášené zvracení a gastrointestinální bolest.
Pediatrická populace
U 3letého chlapce, kterému byla podána jednotlivá dávka 400 mg, se objevilo zvracení, průjem a anorexie, u dalšího 3letého chlapce, kterému byla podána jednotlivá dávka 980 mg, byl zjištěn snížený počet bílých krvinek a průjem.
V případě předávkování by měl být pacient pozorován a vhodně léčen podpůrnou léčbou.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: inhibitor protein-tyrosinkinázy, ATC kód: L01XE01 Mechanismus účinku
Imatinib je nízkomolekulární inhibitor tyrosinkinázy, který účinně inhibuje aktivitu BCR-ABL tyrosinkinázy (TK) a dalších receptorových tyrosinkináz: KIT, receptor pro růstový faktor kmenových buněk (SCF, stem cell factor) kódovaný protoonkogenem c-Kit, receptory discoidinové domény (DDR1 and DDR2), receptor kolonie stimulujícího faktoru (CSF-1R) a receptory pro destičkový růstový faktor alfa a beta (PDGFR-alfa a PDGFR-beta). Imatinib také může inhibovat buněčné procesy, na kterých se tyto receptorové kinázy podílí.
Farmakodynamické účinky
Imatinib je inhibitor tyrosinkinázy, který účinně inhibuje Bcr-Abl tyrosinkinázu na buněčné úrovni in vitro i in vivo. Látka selektivně inhibuje proliferaci a indukuje apoptózu u Bcr-Abl pozitivních buněčných linií, stejně jako u čerstvých leukemických buněk od pacientů s CML s pozitivním Philadelphia chromozomem a od pacientů s akutní lymfoblastickou leukemií (ALL).
In vivo byl na zvířecích modelech s Bcr-Abl pozitivními nádorovými buňkami při monoterapii pozorován protinádorový účinek této látky.
Imatinib je také inhibitor receptorů tyrosinkinázy pro růstový faktor destiček - platelet-derived growth factor (PDGF), PDGF-R, faktoru kmenových buněk - stem cell factor (SCF), c-Kit, a inhibuje PDGF-a SCF-zprostředkované buněčné pochody. In vitro, imatinib inhibuje proliferaci a indukuje apoptózu gastrointestinálních stromálních nádorových buněk (GIST), které mají schopnost aktivovat kit mutaci. Konstitutivní aktivace receptorů pro PDGF či Abl proteinu tyrosinkinázy jako následek spojení rozdílných partnerských proteinů či konstitutivní produkce PDGF zřejmě hrají roli v patogenezi MDS/MPD, HES/CEL a DFSP. Imatinib inhibuje signalizaci a proliferaci buněk ovlivňovaných porušenou regulací aktivity PDGFR a Abl kinázy.
Klinické studie u chronické myeloidní leukemie
Účinnost Glivecu je založena na míře celkové hematologické a cytologické odpovědi a doby přežití bez progrese onemocnění. Kromě nově diagnostikované chronické fáze CML nejsou k dispozici kontrolované klinické studie, které by demonstrovaly klinický přínos, jako je zlepšení projevů onemocnění nebo prodloužení přežití.
Tři velké, mezinárodní, otevřené, nekontrolované studie fáze II byly provedeny u pacientů s pozitivním Philadelphia chromozomem (Ph+) s pokročilou CML, blastickou nebo akcelerovanou fází onemocnění, jinými Ph+ leukemiemi nebo s CML v chronické fázi, ale kde selhala předchozí léčba interferonem-alpha (IFN). Jedna velká, otevřená, multicentrická, mezinárodní randomizovaná studie fáze III byla provedena u pacientů s nově diagnostikovanou Ph+ CML. Navíc děti byly léčeny ve dvou studiích fáze I a v jedné studii fáze II.
Ve všech klinických studiích bylo 38-40% pacientů ve věku > 60 let a 10-12% pacientů bylo ve věku > 70 let.
Chronická fáze, nově diagnostikovaná: Studie fáze III u dospělých pacientů srovnávala léčbu Glivecem v monoterapii s kombinovanou léčbou interferonem-alpha (IFN) a cytarabinem (Ara-C). Bylo dovoleno, aby pacienti, u kterých nebylo dosaženo léčebné odpovědi (chybění kompletní hematologické odpovědi (CHR) v 6. měsíci, zvýšení počtu bílých krvinek, bez velké cytogenetické odpovědi (MCyR) ve 24. měsíci), se ztrátou odpovědi (CHR nebo MCyR) nebo se závažnou intolerancí léčby, byli převedeni do alternativního ramene léčby. V rameni s Glivecem byli pacienti léčeni dávkou 400 mg denně. V rameni s IFN byli pacienti léčeni s cílovou dávkou IFN 5 MIU/m2/den subkutánně v kombinaci se subkutánním podáním Ara-C 20 mg/m2/den po 10 dnů/měsíc.
Celkem bylo randomizováno 1 106 pacientů, 553 do každého ramene. Výchozí charakteristiky byly mezi oběma rameny dobře vyvážené. Medián věku byl 51 let (rozmezí 18-70 let), 21,9% pacientů bylo ve věku > 60 let. Bylo zde 59% mužů a 41% žen; 89,9% pacientů bylo bílé pleti a 4,7% černé pleti. Po sedmi letech od zařazení posledního pacienta byl medián trvání léčby v první linii 82 měsíců v rameni s Glivecem a 8 měsíců v rameni s IFN. Medián trvání léčby v druhé linii byl 64 měsíců v rameni s Glivecem. Souhrnně u pacientů,léčených Glivecem v první linii byla průměrná podávaná denní dávka 406 ± 76 mg. Primárním cílovým parametrem účinnosti ve studii bylo přežití bez progrese onemocnění. Progrese byla definována jako jakákoliv z následujících událostí: progrese do akcelerované fáze nebo blastické krize, úmrtí, ztráta CHR nebo MCyR, nebo u pacientů, kteří nedosáhli CHR, zvýšení počtu bílých krvinek navzdory přiměřené léčbě. Velká cytogenetická odpověď, hematologická odpověď, molekulární odpověď (hodnocení minimálního reziduálního onemocnění) doba do akcelerované fáze nebo blastické krize a přežívání jsou hlavními sekundárními cílovými parametry. Údaje o odpovědích jsou uvedeny v Tabulce 2.
Tabulka 2 Odpovědi na léčbu ve studii u nově diagnostikované CML (84měsíční data)
|
(Nejlepší míra odpovědi) |
Glivec n=553 |
IFN+Ara-C n=553 |
|
Hematologická odpověď | ||
|
Míra CHR n (%) |
534 (96,6%)* |
313 (56,6%)* |
|
[95% CI] |
[94,7%, 97,9%] |
[52,4%, 60,8%] |
|
Cytogenetická odpověď | ||
|
Velká odpověď n (%) |
490 (88,6%)* |
129 (23,3%)* |
|
[95% CI] |
[85,7%, 91,1%] |
[19,9%, 27,1%] |
|
Kompletní CyR n (%) |
456 (82,5%)* |
64 (11,6%)* |
|
Parciální CyR n (%) |
34 (6,1%) |
65 (11,8%) |
|
Molekulární odpověď** | ||
|
Velká odpověď ve 12. měsíci (%) |
153/305=50,2% |
8/83=9,6% |
|
Velká odpověď ve 24. měsíci (%) |
73/104=70,2% |
3/12=25% |
|
Velká odpověď v 84. měsíci (%) |
102/116=87,9% |
3/4=75% |
* p<0,001, Fischerův test významnosti
** procenta molekulární odpovědi jsou založená na dostupných vzorcích
Kritéria hematologické odpovědi (všechny odpovědi byly potvrzeny po > 4 týdnech):
Bílé krvinky < 10 x 109/l, krevní destičky < 450 x 109/l, myelocyty+metamyelocyty < 5% v krvi, žádné blasty a promyelocyty v krvi, basofily < 20%, žádné extramedulární postižení Kriteria cytogenetické odpovědi: kompletní (0% Ph+ metafáze), parciální (1-35%), malá (36-65%) nebo minimální (66-95%). Velká odpověď (0-35%) kombinuje obě odpovědi - kompletní a parciální. Kritéria velké molekulární odpovědi: v periferní krvi > 3-logaritmové snížení množství Bcr-Abl transkriptů (měřeno pomocí testu kvantitativní polymerázové řetězové reakce (PCR) reverzní transkriptázy v reálném čase) proti standardizované výchozí hodnotě._
Míra kompletní hematologické odpovědi, velké cytogenetické odpovědi a kompletní cytogenetické odpovědi na první linii léčby byla stanovena použitím Kaplan-Meierova postupu, pro který byly nedosažené odpovědi vyřazeny v den posledního vyšetření. S použitím tohoto postupu se stanovená kumulativní míra odpovědi v první linii léčby Glivecem zlepšila od 12. měsíce léčby do 84. měsíce léčby následovně: CHR z 96,4% na 98,4% a CCyR z 69,5% na 87,2%.
Při 7letém sledování bylo v rameni s Glivecem 93 (16,8%) příhod progrese: v 37 (6,7%) případech se jednalo o progresi do akcelerované fáze/blastické krize, v 31 (5,6%) o ztrátu MCyR, v 15 (2,7%) o ztrátu CHR nebo zvýšení WBC a v 10 (1,8%) o úmrtí nesouvisejících s CML. Naproti tomu bylo v rameni s IFN+Ara-C 165 (29,8%) příhod, z nichž 130 se vyskytlo během léčby IFN+Ara-C v první linii.
Odhadovaný podíl pacientů bez progrese do akcelerované fáze nebo blastické krize v 84. měsíci byl významně vyšší v rameni s Glivecem ve srovnání s ramenem s IFN (92,5% proti 85,1%, p<0,001). Roční míra progrese do akcelerované fáze nebo blastické krize se v průběhu léčby snižovala a ve čtvrtém a pátém roce byla menší než 1% za rok. Odhadovaná míra přežití bez progrese v 84. měsíci byla 81,2% v rameni s Glivecem a 60,6% u kontrolní skupiny (p<0,001). Roční míra progrese jakéhokoli typu se pro Glivec rovněž snižovala s časem.
Celkem ve skupině s Glivecem zemřelo 71 pacientů (12,8%) a 85 pacientů (15,4%) ve skupině s IFN+Ara-C. V 84. měsíci bylo celkové přežití ve skupině s Glivecem 86,4% (83, 90) oproti 83,3% (80, 87) ve skupině s IFN+Ara-C, (p=0,073, log-rank test). Cílový parametr „doba do výskytu příhody“ je výrazně ovlivněn vysokým podílem převedení z léčby IFN+Ara-C na léčbu Glivecem. Vliv léčby Glivecem na přežití v chronické fázi onemocnění nově diagnostikované CML byl dále zkoumán v retrospektivní analýze výše uvedených údajů o Glivecu s původními údaji z jiné studie fáze III, kde byl použit stejný léčebný režim IFN+Ara-C (n=325). V této retrospektivní analýze byly prokázány lepší výsledky celkového přežití (p<0,001) při podávání Glivecu oproti IFN+Ara-C; během 42 měsíců zemřelo 47 (8,5%) pacientů s Glivecem oproti 63 (19,4%) pacientům s IFN+Ara-C.
U pacientů léčených Glivecem měl stupeň dosažené cytogenetické odpovědi a molekulární odpovědi jednoznačný vliv na dlouhodobé výsledky léčby. Zatímco 96% (93%) pacientů s CCyR (PCyR) ve 12. měsíci, bylo v 84. měsíci bez progrese do akcelerované fáze/blastické krize, bylo bez progrese do pokročilé CML v 84 měsících pouze 81% pacientů bez MCyR ve 12 měsících (p<0,001 celkově, p=0,25 mezi CCyR a PCyR). U pacientů s nejméně 3-log redukcí Bcr-Abl transkriptů ve 12 měsících léčby, byla pravděpodobnost setrvání bez progrese do akcelerované fáze/blastické krize v 84 měsících 99%. Podobná zjištění byla shledána v analýze 18 měsíců léčby.
V této studii bylo povolené zvýšení dávky ze 400 mg denně na 600 mg denně, a potom ze 600 mg denně na 800 mg denně. Po 42 měsících sledování došlo u 11 pacientů k potvrzené ztrátě jejich cytogenetické odpovědi (během 4 týdnů). Z těchto 11 pacientů byla u 4 zvýšena dávka až na 800 mg denně, dva z nich znovu dosáhli cytogenetické odpovědi (jeden částečné a jeden kompletní, ten později dosáhl také molekulární odpovědi). Zatímco u 7 pacientů, kterým nebyla zvýšena dávka, pouze jeden dosáhl kompletní cytogenetické odpovědi. Procento výskytu některých nežádoucích účinků bylo vyšší u 40 pacientů, kterým byla dávka zvýšena na 800 mg denně, ve srovnání s populací pacientů před zvýšením dávky (n=551). Častější nežádoucí účinky zahrnovaly gastrointestinální krvácení, konjunktivitidu a zvýšení transamináz a bilirubinu. Další nežádoucí účinky byly hlášeny s menší nebo se stejnou frekvencí.
Chronická fáze, selhání léčby interferonem: 532 dospělých pacientů bylo léčeno úvodní dávkou 400 mg. Pacienti byli rozděleni do tří hlavních kategorií: hematologické selhání (29%), cytogenetické selhání (35%), nebo intolerance interferonu (36%). Medián doby, po kterou pacienti užívali předchozí léčbu IFN v dávce > 25 x 106 IU/týden, byl 14 měsíců a všichni byli v pozdní chronické fázi, medián doby od diagnózy byl 32 měsíců. Základním parametrem účinnosti ve studii byla míra velké cytogenetické odpovědi (kompletní a parciální odpověď, 0 až 35% Ph+ metafází v kostní dřeni).
V této studii dosáhlo 65% pacientů velké cytogenetické odpovědi, která byla kompletní u 53% (potvrzeno 43%) pacientů (Tabulka 3). Kompletní hematologické odpovědi bylo dosaženo u 95% pacientů.
Akcelerovaná fáze: Do studie bylo zařazeno 235 dospělých pacientů s akcelerovanou fází onemocnění. Léčba prvních 77 pacientů byla zahájena dávkou 400 mg, následně byl protokol doplněn a dovoloval podání vyšších dávek, zahajovací dávka pro zbývajících 158 pacientů byla 600 mg.
Základním parametrem účinnosti byla míra hematologické odpovědi, udávaná jako buď kompletní hematologická odpověď, žádný průkaz leukemie (tj. vymizení blastů z kostní dřeně a krve, ale bez úplné obnovy periferní krve jako při kompletní odpovědi), nebo návrat do chronické fáze CML. Potvrzené hematologické odpovědi bylo dosaženo u 71,5% pacientů (Tabulka 3). Důležité je, že 27,7% pacientů dosáhlo také hlavní cytogenetické odpovědi, která byla kompletní u 20,4% (potvrzena u 16%) pacientů. U pacientů léčených dávkou 600 mg, byl aktuální odhad mediánu přežití bez progrese 22,9 měsíců a celkového přežití 42,5 měsíce.
Myeloidní blastická krize: Do studie bylo zařazeno 260 pacientů s myeloidní blastickou krizí. 95 (37%) pacientů mělo předchozí chemoterapii buď pro akcelerovanou fázi nebo blastickou krizi („předléčení pacienti1“), zatímco 165 (63%) pacientů nebylo dosud léčeno („neléčení pacienti“). Léčba prvních 37 pacientů byla zahájena dávkou 400 mg, následně byl protokol doplněn a dovoloval podání vyšších dávek, zahajovací dávka pro zbývajících 223 pacientů byla 600 mg.
Základním parametrem účinnosti, při použití stejných kritérií jako ve studii u akcelerované fáze, byla míra dosažení hematologické odpovědi, popisovaná buď jako kompletní hematologická odpověď, žádný průkaz leukemie, nebo návrat do chronické fáze CML. V této studii dosáhlo 31% pacientů hematologické odpovědi (36% u dříve neléčených pacientů a 22% u dříve léčených pacientů). Míra dosažených odpovědi byla vyšší u pacientů léčených dávkou 600 mg (33%) ve srovnání s pacienty, kteří dostávali dávku 400 mg (16%, p=0,0220). Aktuální odhadovaný medián přežití dříve neléčených pacientů byl 7,7 měsíců a předléčených pacientů byl 4,7 měsíců.
Lymfoidní blastická krize: Do studie fáze I byl zařazen omezený počet pacientů (n=10). Míra dosažené hematologické odpovědi byla 70% s trváním 2-3 měsíce.
Tabulka 3 Odpovědi ve studiích dospělých pacientů s CML
|
Studie 0110 37měsíční data Chronická fáze, IFN selhání (n=532) |
Studie 0109 40,5měsíční data Akcelerovaná fáze (n=235) |
Studie 0102 38měsíční data Myeloidní blastická krize (n=260) | |
|
% pacientů (CI95%) | |||
|
Hematologická odpověď1 Kompletní hematologická odpověď (CHR) Bez průkazu leukemie (NEL) Návrat do chronické fáze (RTC) |
95% (92,3-96,3) 95% Neaplikovatelné Neaplikovatelné |
71% (65,3-77,2) 42% 12% 17% |
31% (25,2-36,8) 8% 5% 18% |
|
Velká cytogenetická odpověď2 Kompletní (Potvrzeno3) [95% CI] Parciální |
65% (61,2-69,5) 53% (43%) [38,6-47,2] 12% |
28% (22,0-33,9) 20% (16%) [11,3-21,0] 7% |
15% (11,2-20,4) 7% (2%) [0,6-4,4] 8% |
|
1 Kritéria hematologické odpovědi (všechny odpovědi byly potvrzeny za > 4 týdny): CHR Studie 0110 [Počet bílých krvinek < 10 x 109/l, krevní destičky < 450 x 109/l, myelocyty+metamyelocyty < 5% v krvi, žádné blasty ani promyelocyty v krvi, basofily < 20%, žádné extramedulární postižení] a ve studiích 0102 a 0109 [ANC > 1,5 x 109/l, krevní destičky > 100 x 109/l, žádné blasty v krvi, BM blasty < 5% a žádné extramedulární postižení] NEL stejná kritéria jako pro CHR ale ANC > 1 x 109/l a destičky > 20 x 109/l (0102 a 0109 pouze) RTC < 15% blastů v BM a PB, < 30% blastů+promyelocytů v BM a PB, < 20% basofilů v PB, žádné jiné extramedulární postižení než ve slezině a játrech (pouze pro 0102 a 0109). BM = Kostní dřeň, PB = periferní krev 2 Kritéria cytogenetické odpovědi: Velká odpověď se skládá jak z kompletní tak i parciální odpovědi: kompletní (0% Ph+ metafáze), parciální (1-35%) 3 Kompletní cytogenetická odpověď potvrzena druhým cytogenetickým hodnocením kostní dřeně provedeným nejméně jeden měsíc po počátečním vyšetření kostní dřeně. | |||
Pediatričtí pacienti: Do studie fáze I zvyšování dávky bylo zahrnuto celkem 26 dětských pacientů ve věku < 18 let buď s chronickou fází CML (n=11) nebo CML v blastické krizi nebo Ph+ akutními leukemiemi (n=15). Byla to populace silně předléčených pacientů, protože 46% bylo dříve léčeno BMT a 73% dostávalo předchozí mnohočetnou chemoterapii. Pacienti byli léčeni dávkami Glivecu 260 mg/m2/den (n=5), 340 mg/m2/den (n=9), 440 mg/m2/den (n=7) a 570 mg/m2/den (n=5). Z 9 pacientů s chronickou fází CML a dostupnými cytogenetickými údaji, dosáhli 4 (44%) kompletní a 3 (33%) parciální cytogenetické odpovědi, míra MCyR 77%.
Do otevřené, multicentrické, jednoramenné studie fáze II bylo zařazeno celkem 51 pediatrických pacientů s nově diagnostikovanou neléčenou CML v chronické fázi. Pacienti byli léčeni Glivecem 340 mg/m2/den bez přerušení při absenci dávku limitující toxicity. Léčba Glivecem vyvolala rychlou odpověď u nově diagnostikovaných dětských pacientů s CML s CHR 78% po 8 týdnech léčby. Vysoká míra CHR byla doprovázena rozvojem kompletní cytogenetické odpovědi (CCyR) u 65%, což je srovnatelné s výsledky pozorovanými u dospělých pacientů. Dodatečně parciální cytogenetická odpověď (PCyR) byla pozorována u 16%, McyR 81%. U většiny pacientů, kteří dosáhli kompletní cytogenetické odpovědi (CCyR), se CCyR vyvinula mezi 3. a 10. měsícem léčby s mediánem času do dosažení odpovědi 5,6 měsíců podle Kaplan-Meierova odhadu.
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s Glivecem u všech podskupin pediatrické populace s Philadelphia chromozom pozitivní (translokace bcr-abl) chronickou myeloidní leukemií (informace o použití u dětí viz bod 4.2).
Klinické studie u Ph+ ALL
Nově diagnostikovaná Ph+ ALL: V kontrolované studii (ADE10), ve které byl porovnáván imatinib s indukční chemoterapií u 55 nově diagnostikovaných pacientů ve věku 55 let a starších, imatinib podávaný jako monoterapie navodil významně vyšší míru kompletních hematologických odpovědí než chemoterapie (96,3% vs. 50%; p=0,0001). Podání imatinibu jako záchranné terapie pacientům, kteří neodpovídali na chemoterapii nebo jejichž odpověď na chemoterapii byla nedostatečná, vedlo u 9 pacientů (81,8%) z celkového počtu 11 pacientů k dosažení kompletní hematologické odpovědi. Tento klinický účinek byl po 2 týdnech léčby spojen s vyšší redukcí bcr-abl transkriptů u pacientů léčených imatinibem než v rameni s chemoterapií (p=0,02). Po fázi indukce všichni pacienti dostávali imatinib a konsolidační chemoterapii (viz Tabulka 4) a po 8 týdnech byly hladiny bcr-abl transkriptů stejné v obou ramenech. Jak se očekávalo na základě designu studie, nebyl pozorován žádný rozdíl v době trvání remise, v přežití bez známek onemocnění nebo celkovém přežití, ačkoliv pacienti s kompletní molekulární odpovědí a trvajícím minimálním reziduálním onemocněním měli lepší výsledek, pokud šlo o dobu trvání remise (p=0,01) a přežití bez známek onemocnění (p=0,02).
Výsledky pozorované ve skupině 211 nově diagnostikovaných pacientů s Ph+ ALL ve čtyřech nekontrolovaných klinických studiích (AAU02, ADE04, AJP01 a AUS01) jsou shodné s výsledky popsanými výše. Podávání imatinibu v kombinaci s indukční chemoterapií (viz Tabulka 4) vedlo k dosažení kompletní hematologické odpovědi u 93% (147 ze 158 hodnotitelných pacientů) a k dosažení velké cytogenetické odpovědi u 90% (19 z 21 hodnotitelných pacientů). Míra kompletní molekulární odpovědi byla 48% (49 z 102 hodnotitelných pacientů). Ve dvou studiích (AJP01 a AUS01) přežití bez známek onemocnění (DFS) a celkové přežití (OS) konstantně převyšovaly 1 rok a tyto výsledky byly lepší oproti historickým kontrolám. (DFS p<0,001; OS p<0,01).
Tabulka 4 Chemoterapeutický režim užívaný v kombinaci s imatinibem
|
Studie ADE10 | |
|
Prefáze |
DEX 10 mg/m2 perorálně, den 1-5; CP 200 mg/m2 i.v., den 3, 4, 5; MTX 12 mg intratekálně, den 1 |
|
Indukce remise |
DEX 10 mg/m2 perorálně, den 6-7, 13-16; VCR 1 mg i.v., den 7, 14; IDA 8 mg/m2 i.v. (0,5 h), den 7, 8, 14, 15; CP 500 mg/m2 i.v.(1 h) den 1; Ara-C 60 mg/m2 i.v., den 22-25, 29-32 |
|
Konsolidační terapie |
MTX 500 mg/m2 i.v. (24 h), den 1, 15; |
|
I, iii, V |
6-MP 25 mg/m2 perorálně, den 1-20 |
|
Konsolidační terapie |
Ara-C 75 mg/m2 i.v. (1 h), den 1-5; |
|
II, IV |
VM26 60 mg/m2 i.v. (1 h), den 1-5 |
|
Indukční terapie (de novo Ph+ ALL) |
Daunorubicin 30 mg/m2 i.v., den 1-3, 15-16; VCR 2 mg celková dávka i.v., den 1, 8, 15, 22; CP 750 mg/m2 i.v., den 1, 8; Prednison 60 mg/m2 perorálně, den 1-7, 15-21; IDA 9 mg/m2 perorálně, den 1-28; MTX 15 mg intratekálně, den 1, 8, 15, 22; Ara-C 40 mg intratekálně, den 1, 8, 15, 22; Methylprednisolon 40 mg intratekálně, den 1, 8, 15, 22 |
|
Konsolidace (de novo Ph+ ALL) |
Ara-C 1 000 mg/m2/12 h i.v.(3 h), den 1-4; Mitoxantron 10 mg/m2 i.v. den 3-5; MTX 15 mg intratekálně, den 1; Methylprednisolon 40 mg intratekálně, den 1 |
Studie ADE04
|
Prefáze |
DEX 10 mg/m2 perorálně, den 1-5; CP 200 mg/m2 i.v., den 3-5; MTX 15 mg intratekálně, den 1 |
|
Indukční terapie I |
DEX 10 mg/m2 perorálně, den 1-5; VCR 2 mg i.v., den 6, 13, 20; Daunorubicin 45 mg/m2 i.v., den 6-7, 13-14 |
|
Indukční terapie II |
CP 1 g/m2 i.v. (1 h), den 26, 46; Ara-C 75 mg/m2 i.v. (1 h), den 28-31, 35-38, 42-45; 6-MP 60 mg/m2 perorálně, den 26-46 |
|
Konsolidační terapie |
DEX 10 mg/m2 perorálně, den 1-5; vindesin 3 mg/m2 i.v., den 1; MTX 1,5 g/m2 i.v. (24 h), den 1; Etoposid 250 mg/m2 i.v. (1 h) den 4-5; Ara-C 2x 2 g/m2 i.v. (3 h, q 12 h), den 5 |
Studie AJP01
|
Indukční terapie |
CP 1,2 g/m2 i.v. (3 h), den 1; Daunorubicin 60 mg/m2 i.v. (1 h), den 1-3; Vinkristin 1,3 mg/m2 i.v., den 1, 8, 15, 21; Prednisolon 60 mg/m2/den perorálně |
|
Konsolidační terapie |
Alternativní chemoterapeutický postup: vysoká dávka chemoterapie s MTX 1 g/m2 i.v. (24 h), den 1, a Ara-C 2 g/m2 i.v. (q 12 h), den 2-3, po 4 cyklech |
|
Udržovací terapie |
VCR 1,3 g/m2 i.v., den 1; Prednisolon 60 mg/m2 perorálně, den 1-5 |
Indukční- Hyper-CVAD režim: CP 300 mg/m2 i.v. (3 h, q 12 h), den 1-3;
konsolidační terapie Vinkristin 2 mg i.v., den 4, 11;
Doxorubicin 50 mg/m2 i.v. (24 h), den 4;
DEX 40 mg/den po dnech 1-4 a 11-14, střídavě s MTX 1 g/m2 i.v. (24 h), den 1, Ara-C 1 g/m2 i.v. (2 h, q 12 h), den 2-3 (celkově 8 léčebných kúr)
Udržovací terapie VCR 2 mg i.v. měsíčně po dobu 13 měsíců;
Prednisolon 200 mg perorálně, 5 dnů za měsíc po dobu 13 měsíců Všechny léčebné režimy zahrnují podávání kortikosteroidů pro profylaxi postižení CNS.
Ara-C: cytosin arabinosid; CP: cyclofosfamid; DEX: dexamethason; MTX: methotrexát; 6-MP: 6-merkaptopurin; VM26: teniposid; VCR: vinkristin; IDA: idarubicin; i.v.: intravenózně
Pediatričtí pacienti: Do otevřené, multicentrické, nerandomizované studie I2301 fáze III se sekvenčními kohortami bylo zařazeno celkem 93 pediatrických, dospívajících a mladých dospělých pacientů (od 1 do 22 let věku) s Ph+ ALL, kteří byli léčeni Glivecem (340 mg/m2/den) v kombinaci s intenzivní chemoterapií po indukční terapii. Glivec byl podáván intermitentně v kohortách 1-5 s prodlužujícím se trváním a časnějším zahájením léčby Glivecem; kohorta 1 používala nejnižší intenzitu a kohorta 5 používala nejvyšší intenzitu Glivecu (nejdelší trvání ve dnech s kontinuálním dávkováním Glivecu již během prvních léčebných cyklů chemoterapie). Kontinuální denní časná expozice Glivecem v průběhu léčby v kombinaci s chemoterapií u pacientů v kohortě 5 (n=50) zlepšila 4leté přežití bez událostí (EFS) v porovnání s historickými kontrolami (n=120), které používaly standardní chemoterapii bez Glivecu (69,6 % oproti 31,6 %). Odhadované 4leté celkové přežití v pacientské kohortě 5 bylo 83,6 % v porovnání s 44,8% u historické kontroly. 20 pacientům z 50 (40 %) v kohortě 5 byla provedena transplantace hematopoetických kmenových buněk.
Tabulka 5 Chemoterapeutické režimy používané ve studii I2301 v kombinaci s imatinibem
|
Konsolidační cyklus 1 (3 týdny) |
VP-16 (100 mg/m2/den, IV): dny 1-5 Ifosfamid (1,8 g/m2/den, IV): dny 1-5 MESNA (360 mg/m2/dávka q3h, x 8 dávky/den, IV): dny 1-5 G-CSF (5 pg/kg, SC): dny 6-15 nebo do ANC > 1500 po dosažení nejnižší hodnoty IT léčba methotrexátem (přizpůsobená věku): POUZE den 1 Trojnásobná IT léčba (přizpůsobená věku): den 8, 15 |
|
Konsolidační cyklus 2 (3 týdny) |
Methotrexát (5 g/m2 v průběhu 24 hodin, IV): den 1 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2 a 3 Trojnásobná IT léčba (přizpůsobená věku): den 1 ARA-C (3 g/m2/dávku q 12 h x 4, IV): dny 2 a 3 G-CSF (5 pg/kg, SC): dny 4-13 nebo do ANC > 1500 po dosažení nejnižší hodnoty |
|
Reindukční cyklus 1 (3 týdny) |
VCR (1,5 mg/m2/den, IV): dny 1, 8, a 15 DAUN (45 mg/m2/den jako bolus, IV): dny 1 a 2 CPM (250 mg/m2/dávku q12h x 4 dávky, IV): dny 3 a 4 PEG-ASP (2500 IU/m2, IM): den 4 G-CSF (5 pg/kg, SC): dny 5-14 nebo do ANC > 1500 po dosažení nejnižší hodnoty Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 15 DEX (6 mg/m2/den, PO): dny 1-7 a 15-21 |
|
Intenzifikační cyklus 1 (9 týdnů) |
Methotrexát (5 g/m2 v průběhu 24 hodin, IV): dny 1 a 15 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2, 3, 16, a 17 Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 22 VP-16 (100 mg/m2/den, IV): dny 22-26 CPM (300 mg/m2/den, IV): dny 22-26 MESNA (150 mg/m2/den, IV): dny 22-26 G-CSF (5 pg/kg, SC): dny 27-36 nebo do ANC > 1500 po dosažení nejnižší hodnoty ARA-C (3 g/m2, q12h, IV): dny 43, 44 L-ASP (6000 IU/m2, IM): den 44 |
|
Reindukční cyklus 2 (3 týdny) |
VCR (1,5 mg/m2/den, IV): dny 1, 8 a 15 DAUN (45 mg/m2/den jako bolus, IV): dny 1 a 2 CPM (250 mg/m2/dávku q12h x 4 dávky, iv): dny 3 a 4 PEG-ASP (2500 IU/m2, IM): den 4 G-CSF (5 pg/kg, SC): dny 5-14 nebo do ANC > 1500 po dosažení nejnižší hodnoty Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 15 DEX (6 mg/m2/den, PO): dny 1-7 a 15-21 |
|
Intenzifikační cyklus 2 (9 týdnů) |
Methotrexát (5 g/m2 v průběhu 24 hodin, IV): dny 1 a 15 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2, 3, 16 a 17 Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 22 VP-16 (100 mg/m2/den, IV): dny 22-26 CPM (300 mg/m2/den, IV): dny 22-26 MESNA (150 mg/m2/den, IV): dny 22-26 G-CSF (5 pg/kg, SC): dny 27-36 nebo do ANC > 1500 post nadir ARA-C (3 g/m2, q12h, IV): dny 43, 44 L-ASP (6000 IU/m2, IM): den 44 |
|
Udržovací terapie (8týdenní cykly) Cykly 1-4 |
MTX (5 g/m2 v průběhu 24 hodin, IV): den 1 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2 a 3 Trojnásobná IT léčba (přizpůsobená věku): dny 1, 29 VCR (1,5 mg/m2, IV): dny 1, 29 DEX (6 mg/m2/den PO): dny 1-5; 29-33 6-MP (75 mg/m2/den, PO): dny 8-28 Methotrexát (20 mg/m2/týden, PO): dny 8, 15, 22 VP-16 (100 mg/m2, IV): dny 29-33 CPM (300 mg/m2, IV): dny 29-33 MESNA IV dny 29-33 G-CSF (5 pg/kg, SC): dny 34-43 |
|
Udržovací terapie (8týdenní cykly) Cyklus 5 |
Ozařování krania (pouze Blok 5) 12 Gy v 8 frakcích pro všechny pacienty s CNS1 a CNS2 v diagnóze 18 Gy v 10 frakcích pro pacienty s CNS3 v diagnóze VCR (1,5 mg/m2/den, IV): dny 1, 29 DEX (6 mg/m2/den, PO): dny 1-5; 29-33 6-MP (75 mg/m2/den, PO): dny 11-56 (Vysazení 6-MP během 6-10 dní ozařování krania počínaje prvním dnem cyklu 5. Započněte léčbu 6-MP první den po dokončení ozařování krania.) Methotrexát (20 mg/m2/týden, PO): dny 8, 15, 22, 29, 36, 43, 50 |
|
Udržovací terapie |
VCR (1,5 mg/m2/den, IV): dny 1, 29 |
|
(8týdenní cykly) |
DEX (6 mg/m2/den, PO): dny 1-5; 29-33 |
|
Cykly 6-12 |
6-MP (75 mg/m2/den, PO): dny 1-56 |
|
Methotrexát (20 mg/m2/týden, PO): dny 1, 8, 15, 22, 29, 36, 43, 50 |
G-CSF = růstový hormon pro granulocytámí řadu leukocytů, VP-16 = etoposid, MTX = methotrexát, IV = intravenózní, SC = subkutánní, IT = intratekální, PO = perorální, IM = intramuskulární, ARA-C = cytarabin, CPM = cyklofosfamid, VCR = vinkristin, DEX = dexamethason, DAUN = daunorubicin, 6-MP = 6-merkaptopurin, E.Coli L-ASP = L-asparagináza, PEG-ASP = PEG asparagináza, MESNA= natrium-2-sulfanylethan -1- sulfonát, iii= nebo pokud je hladina MTX do < 0,1 pM, q6h = každých 6 hodin, Gy= Gray
Studie AIT07 byla multicentrická, otevřená, randomizovaná studie fáze II/III, do které bylo zahrnuto 128 pacientů (1 mladší 18 let věku) léčených imatinibem v kombinaci s chemoterapií. Bezpečnostní data z této studie se zdají být v souladu s bezpečnostním profilem imatinibu u Ph+ ALL pacientů.
Recidivující/refrakterníPh+ ALL: Při podávání imatinibu v monoterapii pacientům s recidivující/refrakterní Ph+ ALL, bylo dosaženo ve skupině 53 hodnotitelných pacientů z celkového počtu 411 pacientů hematologické odpovědi ve 30% (v 9% kompletní) a velké cytogenetické odpovědi ve 23%. (Upozornění - z celkového počtu 411 pacientů bylo 353 pacientů léčeno v rámci programu rozšířeného přístupu k léčbě bez sběru dat primární odpovědi), Medián trvání doby do progrese u celkové populace 411 pacientů s recidivující/refrakterní Ph+ ALL byl v rozmezí mezi
2,6 až 3,1 měsíců, medián doby celkového přežití u 401 hodnotitelných pacientů byl v rozmezí od
4,9 do 9 měsíců. Údaje byly podobné, když byly znovu analyzovány po zahrnutí pouze pacientů ve věku 55 let a starších.
Klinické studie u MDS/MPD
Zkušenosti s Glivecem v této indikaci jsou velmi omezené a jsou založené na míře hematologické a cytogenetické odpovědi. Neexistují žádné kontrolované studie, které by prokázaly klinický prospěch nebo zvýšené přežití. V otevřené, multicentrické klinické studii fáze II (study B2225) byl Glivec zkoušen u různých populací pacientů s život ohrožujícími onemocněními spojenými s aktivitou Abl, Kit nebo PDGFR tyrosinkináz. Do této studie bylo zařazeno 7 pacientů s MDS/MPD, kteří byli léčeni Glivecem 400 mg denně. U tří pacientů byla přítomna kompletní hematologická odpověď (CHR) a jeden pacient dosáhl parciální hematologické odpovědi (PHR). V době původní analýzy tři ze čtyř pacientů s detekovanými mutacemi genu PDGFR dosáhli hematologické odpovědi (2 CHR a 1 PHR). Věk těchto pacientů byl v rozmezí od 20 do 72 let. Ve 13 publikacích bylo hlášeno dalších 24 pacientů s MDS/MPD. 21 pacientů bylo léčeno Glivecem 400 mg denně, zatímco další 3 pacienti byli léčeni nižšími dávkami. U 11 pacientů byla zjištěna změna genu PDGFR, 9 z nich dosáhlo CHR a 1 PHR. Věk těchto pacientů byl v rozmezí od 2 do 79 let. V poslední uveřejněné aktualizované informaci bylo uvedeno, že 6 z těchto 11 pacientů zůstalo v cytogenetické remisi (v rozmezí 32-38 měsíců). Ve stejné publikaci byly uvedeny údaje dlouhodobého sledování 12 pacientů s MDS/MPD s mutací genu PDGFR (5 pacientů ze studie B2225). Tito pacienti byli léčeni Glivecem v mediánu 47 měsíců (v rozmezí 24 dnů - 60 měsíců). U 6 pacientů přesáhlo nyní sledování 4 roky. Jedenáct pacientů dosáhlo rychlé CHR; deset dosáhlo kompletního vymizení cytogenetických abnormalit a dle měření RT-PCR snížení nebo vymizení fúzních transkriptů. Hematologické odpovědi byly zachovány v mediánu 49 měsíců (v rozmezí 19-60) a cytogenetické odpovědi v mediánu 47 měsíců (v rozmezí 16-59). Celkové přežití bylo 65 měsíců od stanovení diagnózy (v rozmezí 25-234). Podávání Glivecu pacientům bez genetické translokace obecně nevede k žádnému zlepšení.
U pediatrických pacientů s MDS/MPD nebyly provedeny kontrolované klinické studie. Ve 4 publikacích bylo hlášeno pět (5) pacientů s MDS/MPD spojenými s přestavbou genu PDGFR. Věk těchto pacientů se pohyboval v rozmezí 3 měsíce až 4 roky a imatinib byl podáván v dávce 50 mg denně nebo v dávkách v rozmezí 92,5 až 340 mg/m2 denně. Všichni pacienti dosáhli kompletní hematologické odpovědi, cytogenetické odpovědi a/nebo klinické odpovědi.
Klinické studie u HES/CEL
V otevřené, multicentrické klinické studii fáze II (studie B2225) byl Glivec zkoušen u různých populací pacientů s život ohrožujícími onemocněními spojenými s aktivitou Abl, Kit nebo PDGFR tyrosinkináz. V této studii 14 pacientů s HES/CEL bylo léčeno Glivecem 100 mg až 1 000 mg denně. Dalších 162 pacientů s HES/CEL uvedených ve 35 zveřejněných kazuistikách bylo léčeno Glivecem v dávkách 75 mg až 800 mg denně. Cytogenetické abnormality byly hodnoceny u 117 z celkové populace 176 pacientů. U 61 pacientů z těchto 117 byla zjištěna fuzní kináza FIP1L1-PDGFRa. Ve třech dalších publikovaných kazuistikách byli uvedeni čtyři pacienti s HES s pozitivní fúzní kinázou FIP1L1-PDGFRa. Všech 65 pacientů s pozitivní fúzní kinázou FIP1L1-PDGFRa dosáhlo CHR, která se udržela po dobu několika měsíců (v rozmezí 1+ až 44+ měsíců, cenzorováno v době hlášení). Podle posledních publikovaných hlášení 21 z těchto 65 pacientů také dosáhlo kompletní molekulární remise s mediánem délky sledování 28 měsíců (v rozmezí 13-67 měsíců). Věk těchto pacientů byl v rozmezí od 25 do 72 let.Dodatečně bylo investigátory hlášeno v kazuistikách symptomatologické zlepšení a zlepšení dysfunkcí dalších orgánů. Zlepšení byla hlášena u poruch funkce srdeční, nervové, kožní/podkožní, respirační/hrudní/mediastinální, muskuloskeletální/pojivové/vaskulární a gastrointestinální orgánové soustavy.
U pediatrických pacientů s HES/CEL nebyly provedeny kontrolované klinické studie. Ve 3 publikacích byli hlášeni tři (3) pacienti s HES/CEL spojenými s přestavbou genu PDGFR. Věk těchto pacientů se pohyboval v rozmezí 2 až 16 let a imatinib byl podáván v dávce 300 mg/m2 denně anebo v dávkách v rozmezí 200 až 400 mg denně. Všichni pacienti dosáhli kompletní hematologické odpovědi, kompletní cytogenetické odpovědi a/nebo kompletní klinické odpovědi.
Klinické studie u pacientů s inoperabilním a/nebo metastatickým GIST
Jedna otevřená, randomizovaná nekontrolovaná mezinárodní studie fáze II byla provedena u pacientů s inoperabilním nebo metastatickým maligním gastrointestinálním stromálním nádorem (GIST). Do studie bylo zařazeno 147 pacientů a randomizováno užívat buď 400 mg nebo 600 mg jednou denně perorálně po dobu až 36 měsíců. Tito pacienti byli ve věku od 18 až 83 let a byla u nich stanovena diagnóza Kit-pozitivní maligní GIST, který byl inoperabilní a/nebo metastazující. Rutinně bylo prováděno imunohistochemické vyšetření pomocí Kit protilátek (A-4502, králičí polyklonální antisérum, 1:100; DAKO Corporation, Carpinteria, CA) metodou nalezení antigenu podle analýzy avidin-biotin-peroxidázového komplexu.
Primární průkaz účinnosti byl založen na míře objektivní odpovědi. U nádorů byla vyžadována měřitelnost v alespoň jednom ložisku onemocnění a charakter odpovědi byl založen na kriteriích Southwestern Oncology Group (SWOG). Výsledky jsou uvedeny v Tabulce 6.
Tabulka 6 Nejlepší odpovědi nádoru ve studii STIB2222 (GIST)
|
Nejlepší odpověď |
Všechny dávky (n=147) 400 mg (n=73) 600 mg (n=74) n (%) |
|
Kompletní odpověď |
1 (0,7) |
|
Parciální odpověď |
98 (66,7) |
|
Stabilní onemocnění |
23 (15,6) |
|
Progresivní onemocnění |
18 (12,2) |
|
Nehodnotitelé |
5 (3,4) |
|
Neznámo |
2 (1,4) |
Nebyly nalezeny rozdíly v míře odpovědí mezi dvěma skupinami s rozdílným dávkováním. Významný počet pacientů, kteří měli stabilní onemocnění v době interim analýzy, dosáhl částečné odpovědi při delší léčbě (medián doby sledování 31 měsíců). Medián času do odpovědi byl 13 týdnů (95% CI 1223). Medián času do selhání léčby u pacientů s odpovědí byl 122 týdnů (95% CI 106-147), zatímco v celé studijní populaci to byly 84 týdny (95% CI 71-109). Medián celkového přežití nebyl dosažen. Odhad pro přežití po 36 měsících sledování podle Kaplan-Meiera je 68%.
Ve dvou klinických studiích (studie B2222 a studie S0033) byla denní dávka Glivecu zvyšována na 800 mg u pacientů, u kterých onemocnění progredovalo při nižších denních dávkách 400 nebo 600 mg. Denní dávka byla zvýšena na 800 mg u celkově 103 pacientů; 6 pacientů dosáhlo po zvýšení dávky částečné odpovědi a u 21 pacientů došlo ke stabilizaci onemocnění, což představuje klinický prospěch 26%. Z dostupných bezpečnostních dat nevyplývá, že by zvýšení dávky na 800 mg denně u pacientů s progresí onemocnění při nižších dávkách 400 mg nebo 600 mg denně mělo vliv na bezpečnostní profil Glivecu.
Klinické studie u adjuvantní léčby GIST
Glivec byl studován v adjuvantní léčbě v multicentrické, dvojitě slepé, prospektivní, placebem kontrolované studii fáze III (Z9001), která zahrnovala 773 pacientů. Věkové rozmezí pacientů bylo 18 až 91 let. Byli zařazeni pacienti s histologickou diagnózou primárního GIST s imunochemicky potvrzenou expresí Kit proteinu a velikostí nádoru > 3 cm v maximálním rozměru, s úplnou makroskopickou resekcí primárního GIST během 14-70 dnů před zařazením do studie. Po resekci primárního GIST byli pacienti randomizováni do jednoho ze dvou ramen: Glivec podávaný v dávkách 400 mg/den nebo odpovídající placebo po dobu jednoho roku.
Primárním cílovým parametrem studie bylo přežití bez návratu onemocnění (RFS) definované jako doba od data randomizace do data návratu onemocnění nebo smrti z jakékoli příčiny.
Glivec významně prodloužil RFS, ve skupině s Glivecem bylo po dobu 38 měsíců bez návratu onemocnění 75% pacientů, oproti 20 měsícům u pacientů ve skupině s placebem (95% CI, [30-nelze určit]; respektive[14-nelze určit]); (relativní riziko = 0,398 [0,259 - 0,610], p< 0,0001). Po jednom roce byl celkový RFS významně lepší pro Glivec (97,7%) oproti placebu (82,3%), (p< 0,0001). Riziko recidivy onemocnění tak bylo sníženo o přibližně 89% v porovnání s placebem (relativní riziko = 0,113 [0,049 - 0,264]).
Riziko recidivy u pacientů po operaci primárního GIST nádoru bylo retrospektivně vyhodnoceno na základě těchto prognostických faktorů: velikost nádoru, mitotický index, umístění nádoru. Hodnoty mitotického indexu byly dostupné pro 556 ze 713 pacientů intention-to-treat (ITT) populace. Výsledky analýzy podskupin podle klasifikace rizika Národního ústavu zdraví USA (NIH) a Ústavu patologie ozbrojených sil USA (AFIP) jsou shrnuty v Tabulce 7. Nebyl pozorován přínos ve skupině s nízkým a velmi nízkým rizikem. Nebyl pozorován přínos pro celkové přežití.
Tabulka 7 Souhrn analýz RFS studie Z9001podle klasifikace rizika NIH and AFIP
|
Kritéri a rizika |
Stupeň rizika |
% pacientů |
Počet příhod / Počet pacientů |
Celkové relativní riziko (95 %CI)* |
Míra RFS (%) | |
|
12 měsíců |
24 měsíců | |||||
|
Glivec vs placebo |
Glivec vs placebo |
Glivec vs placebo | ||||
|
Nízké |
29,5 |
0/86 vs. 2/90 |
N.E. |
100 vs. 98,7 |
100 vs. 95,5 | |
|
NIH |
Střední |
25,7 |
4/75 vs. 6/78 |
0,59 (0,17; 2,10) |
100 vs. 94,8 |
97,8 vs. 89,5 |
|
Vysoké |
44,8 |
21/140 vs. 51/127 |
0,29 (0,18; 0,49) |
94,8 vs. 64,0 |
80,7 vs. 46,6 | |
|
Velmi nízké |
20,7 |
0/52 vs. 2/63 |
N.E. |
100 vs. 98,1 |
100 vs. 93,0 | |
|
Nízké |
25,0 |
2/70 vs. 0/69 |
N.E. |
100 vs. 100 |
97,8 vs. 100 | |
|
AFIP |
Střední |
24,6 |
2/70 vs. 11/67 |
0,16 (0,03; 0,70) |
97,9 vs. 90,8 |
97,9 vs. 73,3 |
|
Vysoké |
29,7 |
16/84 vs. 39/81 |
0,27 (0,15; 0,48) |
98,7 vs. 56,1 |
79,9 vs. 41,5 | |
|
* včetně follow-up periody; NE - ne |
ze určit | |||||
Druhá multicentrická otevřená studie fáze III (SSG XVIII/AIO) porovnávala výsledky léčby Glivecem v dávce 400 mg/den po dobu 12 měsíců oproti 36 měsícům u pacientů po chirurgické resekci GIST a s jedním z následujících parametrů: průměr tumoru > 5 cm a počet mitóz > 5/50 zorných polí ve velkém zvětšení (high power fields, HPF) nebo průměr tumoru > 10 cm a jakýkoli počet mitóz nebo tumor jakékoli velikosti s počtem mitóz > 10/50 HPF nebo tumory s rupturou do peritonální dutiny. Ve studii bylo randomizováno a informovaný souhlas podepsalo celkem 397 pacientů (199 pacientů v rameni s 12měsíční léčbou a 198 pacientů v rameni s 36měsíční léčbou), jejichž průměrný věk byl 61 let (rozmezí 22 až 84 let). Medián doby sledování byl 54 měsíců (od data randomizace do data ukončení), s celkovou dobou 83 měsíců mezi prvním randomizovaným pacientem a ukončením studie.
Primárním cílovým parametrem účinnosti studie bylo přežití bez návratu onemocnění (RFS) definované jako doba od data randomizace do data návratu onemocnění nebo smrti z jakékoli příčiny.
36měsíční léčba Glivecem významně prodlužila RFS oproti 12měsíční léčbě Glivecem (s celkovým poměrem rizik (HR) = 0,46 [0,32, 0,65], p<0,0001) (Tabulka 8, Obrázek 1).
Třicet šest (36) měsíců léčby Glivecem významně prodloužilo celkové přežití (OS) v porovnání s 12 měsíci léčby Glivecem (HR = 0,45 [0,22; 0,89], p=0,0187) (Tabulka 8, Obrázek 2).
Déletrvající léčba (> 36 měsíců) může prodloužit dobu do výskytu dalších recidiv; vliv těchto zjištění na celkové přežití nicméně zůstává neznámý.
Celkový počet úmrtí byl 25 v rameni s 12měsíční léčbou a 12 v rameni s 36měsíční léčbou.
36měsíční léčbou imatinibem bylo dosaženo lepších výsledků oproti 12měsíční léčbě v ITT analýze, tj. zahrnující celou studijní populaci. V plánované analýze podskupin podle typu mutace byl poměr rizika přežití bez rekurence pro 36měsíční léčbu pacientů s mutací exonu 11 0,35 [95% CI: 0,22,
0,56]. Pro jiné podskupiny s méně častými mutacemi nelze z důvodu nízkého počtu sledovaných případů vyvodit žádné závěry.
Tabulka 8 12měsíční a 36měsíční léčba Glivecem (studie SSGXVIII/AIO)
|
rameno s 12měsíční léčbou |
rameno s 36měsíční léčbou | |
|
RFS |
%(CI) |
%(CI) |
|
12 měsíců |
93,7 (89,2-96,4) |
95,9 (91,9-97,9) |
|
24 měsíců |
75,4 (68,6-81,0) |
90,7 (85,6-94,0) |
|
36 měsíců |
60,1 (52,5-66,9) |
86,6 (80,8-90,8) |
|
48 měsíců |
52,3 (44,0-59,8) |
78,3 (70,8-84,1) |
|
60 měsíců |
47,9 (39,0-56,3) |
65,6 (56,1-73,4) |
|
Přežití 36 měsíců |
94,0 (89,5-96,7) |
96,3 (92,4-98,2) |
|
48 měsícůs |
87,9 (81,1-92,3) |
95,6 (91,2-97,8) |
|
60 měsíců |
81,7 (73,0-87,8) |
92,0 (85,3-95,7) |
Obrázek 1 Odhad primárního přežití bez návratu onemocnění podle Kaplan-Meiera (ITT populace)
Pravděpodobnost přežití bez návratu onemocnění

Doba přežití v měsících
V riziku: Události
|
137:46 |
105:65 |
88:72 |
61:77 |
49:81 |
36:83 |
27:84 |
14:84 |
10:84 |
2:84 0:84 |
|
173:18 |
152:22 |
133:25 |
102:29 |
82:35 |
54:46 |
39:47 |
21:49 |
8:50 |
0:50 |
(1) 199:0 182:8 177:12 163:25
(2) 198:0 189:5 184:8 181:11
Doba přežití v měsících
V riziku: Události
0:25
Obrázek 2 Odhad celkového přežití podle Kaplan-Meiera (ITT populace)

(1) 199:0 190:2 188:2 183:6 176:8 156:10 140:11 105:14 87:18 64:22 46:23 27:25 20:25 2:25
(2) 198:0 196:0 192:0 187:4 184:5 164:7 152:7 119:8 100:8 76:10 56:11 31:11 13:12 0:12
U pediatrických pacientů s c-Kit pozitivním GIST nebyly provedeny kontrolované klinické studie.
V 7 publikacích bylo hlášeno sedmnáct (17) pacientů s GIST (s Kit nebo bez Kit a s mutacemi PDGFR nebo bez mutací PDGFR). Věk těchto pacientů se pohyboval v rozmezí 8 až 18 let a imatinib byl podáván adjuvantně i pro metastatické onemocnění v dávkách v rozmezí 300 až 800 mg denně.
U většiny léčených pacientů s GIST nebyla k dispozici data potvrzující c-kit nebo mutace PDGFR, což mohlo vést k různým klinickým výsledkům.
Klinické studie u DFSP
Byla provedena otevřená, multicentrická klinická studie fáze II (studie B2225) zahrnující 12 pacientů s DFSP léčených Glivecem 800 mg denně. Věk pacientů s DFSP byl v rozmezí 23 až 75 roků; DFSP byl metastatický, lokálně recidivující po primárním chirurgickém vynětí a v době zařazení do studie vyhodnocen jako inoperabilní.Primární důkaz účinnosti byl založen na míře objektivní odpovědi.
Z 12 zařazených pacientů jich 9 odpovědělo: 1 kompletně a 8 parciálně. Tři pacienti s parciální odpovědí byli následně po provedené operaci interpretováni jako bez známek onemocnění. Medián doby trvání léčby ve studii B2225 byl 6,2 měsíce, s maximem doby trvání 24,3 měsíců. Dalších 6 pacientů s DFSP léčených Glivecem bylo publikováno v 5 kazuistikách, věk těchto pacientů byl v rozmezí 18 měsíců až 49 let. Dospělí pacienti uvedení v publikované literatuře byli léčeni dávkou Glivecu buď 400 mg (4 případy) nebo 800 mg (1 případ) denně. Odpovědělo pět (5) pacientů,
3 kompletně a 2 parciálně. Medián doby trvání léčby v publikované literatuře je v rozmezí 4 týdnů až více než 20 měsíců. Translokace t(17:22)[(q22:q13)] nebo její genový produkt byl přítomen téměř u všech pacientů odpovídajících na léčbu Glivecem.
U pediatrických pacientů s DFSP nebyly provedeny kontrolované klinické studie. Ve 3 publikacích bylo hlášeno pět (5) pacientů s DFSP a přestavbou PDGFR genu. Věk pacientů se pohyboval od narození do 14 let a imatinib byl podáván v dávce 50 mg denně nebo v dávkách v rozmezí 400 až 520 mg/m2 denně. Všichni pacienti dosáhli částečné a/nebo kompletní odpovědi.
Farmakokinetika Glivecu
Farmakokinetika Glivecu byla hodnocena v rozmezí dávek 25 až 1 000 mg. Farmakokinetický profil léku v plazmě byl analyzován 1., 7. nebo 28. den, kdy koncentrace v plazmě dosáhla rovnovážného stavu.
Absorpce
Průměrná absolutní biologická dostupnost imatinibu byla 98%. Po perorálním podání byla mezi pacienty vysoká variabilita v hladinách AUC imatinibu v plazmě. Při podání léku s tučným jídlem, byla míra absorpce imatinibu snížena jen minimálně (11% snížení Cmax a prodloužení tmax o 1,5 h), s malým zmenšením AUC (7,4%), ve srovnání s podáním nalačno. Ovlivnění absorpce léku předchozí gastrointestinální operací nebylo studováno.
Distribuce
V klinicky relevantních koncentracích imatinibu došlo v pokusech in vitro k vazbě na plazmatické proteiny přibližně v 95%, převážně na albumin a alfa-1- kyselý-glykoprotein, s malou vazbou na lipoproteiny.
Biotransformace
Hlavním cirkulujícím metabolitem je u člověka N-demethylovaný derivát piperazinu, který měl in vitro podobnou účinnost jako mateřská látka. Zjištěná plazmatická AUC tohoto metabolitu byla pouze 16% AUC imatinibu. Vazba N-demetylovaného metabolitu na plazmatické bílkoviny je podobná vazebné schopnosti mateřské látky.
Imatinib a N-demethylovaný metabolit činily dohromady přibližně 65% cirkulující radioaktivity (AUC(0-48h)). Zbývající cirkulující radioaktivita byla tvořena množstvím minoritních metabolitů.
Výsledky studií in vitro ukázaly, že CYP3A4 je u lidí hlavním enzymem cytochromu P450, který katalyzuje biotransformaci imatinibu. Z řady potenciálně souběžně podávaných léků (paracetamol, aciklovir, alopurinol, amfotericin, cytarabin, erytromycin, flukonazol, hydroxyurea, norfloxacin, penicillin V) pouze erytromycin (IC50 5 0 pM) a flukonazol (IC50 118 pM) inhibovaly metabolismus imatinibu v rozsahu, který by mohl být klinicky významný.
In vitro bylo zjištěno, že imatinib je kompetitivním inhibitorem markrových substrátů pro CYP2C9, CYP2D6 a CYP3A4/5. Ki hodnoty v lidských jaterních mikrosomech byly 27, 7,5 a 7,9 pmol/l. Maximální plazmatické koncentrace imatinibu u pacientů jsou 2-4 pmol/l, tudíž je možná inhibice metabolismu zprostředkovaného CYP2D6 a/nebo CYP3A4/5 souběžně podávaných léků. Imatinib neinterferuje s biotranformací 5-fluorouracilu, ale inhibuje metabolismus paklitaxelu, což je výsledkem kompetitivní inhibice CYP2C8 (Ki = 34,7 pM). Odpovídající hodnota Ki je daleko vyšší než očekávané plazmatické hladiny imatinibu u pacientů a tudíž se neočekávají interakce při souběžném podávání 5-fluorouracilu nebo paklitaxelu a imatinibu.
Eliminace z organismu
Na základě sledování vylučování radioaktivních sloučenin(y) po perorálním podání 14C-značeného imatinibu bylo přibližně 81% dávky nalezeno v průběhu 7 dnů ve stolici (68% dávky) a v moči (13% dávky). V nezměněné formě bylo vyloučeno 25% dávky (5% močí, 20% stolicí), zbytek činily metabolity.
Farmakokinetika v plazmě
Po perorálním podání zdravým dobrovolníkům byl t./2 přibližně 18 hodin, to znamená, že podávání jednou denně je dostačující. Zvyšování průměrné hodnoty AUC se stoupající dávkou bylo lineární a závislé na dávce v rozmezí dávek 25-1 000 mg imatinibu po perorálním podání. Po opakovaném podání nebyly při dávkování jednou denně nalezeny změny v kinetice imatinibu a akumulace v rovnovážném stavu činila 1,5-2,5násobek.
Farmakokinetika u pacientů s GIST
U pacientů s GIST byla v rovnovážném stavu při stejné dávce (400 mg denně) 1,5krát vyšší expozice než ta, která byla pozorována u pacientů s CML. Na základě předběžné analýzy farmakokinetiky v populaci pacientů s GIST zde byly nalezeny tři proměnné (albumin, bílé krvinky a bilirubin), které měly statisticky významnou souvislost s farmakokinetikou imatinibu. Snížení hodnot albuminu bylo příčinou poklesu clearance (CL/f); a vyšší hodnoty počtu bílých krvinek vedly ke snížení CL/f. Tato souvislost však není dostatečně výrazná, aby opravňovala k úpravě dávkování. V této skupině pacientů by mohla přítomnost metastáz v játrech mít za následek jaterní insuficienci a redukci metabolismu.
Populační farmakokinetika
Na základě analýzy farmakokinetiky v populaci pacientů s CML bylo zjištěno, že věk jen málo ovlivnil distribuční objem (12% zvýšení u pacientů starších > 65 let). Tyto změny nejsou považovány za klinicky významné. Vliv tělesné hmotnosti na clearance imatinibu je následující: u pacientů s tělesnou hmotností 50 kg je možné očekávat průměrnou clearance 8,5 l/h, zatímco u pacientů vážících 100 kg clearance stoupne na 11,8 l/h. Tyto změny nejsou dostačující, aby opravňovaly k úpravě dávkování podle hmotnosti. V kinetice imatinibu není rozdíl mezi muži a ženami.
Farmakokinetika u dětí
Obdobně jako u dospělých pacientů byl imatinib po perorálním podání rychle absorbován i u dětských pacientů ve studii fáze I i fáze II. Dávkami 260 a 340 mg/m2/den bylo u dětí dosaženo stejné účinnosti jako u dospělých dávkami 400 mg a 600 mg. Při srovnání AUC(0-24) 8. den s 1. dnem při dávce 340 mg/m2/den hladina ukázala 1,7násobnou akumulaci léku po opakovaném podávání jednou denně.
Na základě poolovaných farmakokinetických analýz populací pediatrických pacientů s hematologickými poruchami (CML, Ph+ALL, nebo jinými hematologickými poruchami léčenými imatinibem) roste clearance imatinibu se zvyšujícím se povrchem těla (BSA). Po úpravě vlivu BSA neměly další demografické ukazatele, jako je věk, tělesná hmotnost a body mass index, klinicky významný vliv na expozici imatinibem. Analýzy potvrdily, že expozice imatinibem u pediatrických pacientů užívajících 260 mg/m2 jednou denně (nepřevyšující 400 mg jednou denně) nebo 340 mg/m2 jednou denně (nepřevyšující 600 mg jednou denně) byly podobné jako u dospělých pacientů, kteří užívali imatinib v dávce 400 mg nebo 600 mg jednou denně.
Zhoršená funkce orgánů
Imatinib a jeho metabolity nejsou ve významném množství vylučovány ledvinami. U pacientů s mírnou a středně závažnou nedostatečností renální funkce se ukázalo, že mají vyšší plazmatickou expozici než pacienti s normální funkcí ledvin. Zvýšení je přibližně 1,5- až 2násobné, což odpovídá 1,5násobku zvýšení plazmatického AGP, na který se imatinib silně váže. Clearance volného imatinibu je pravděpodobně obdobná u pacientů s renální nedostatečností a u pacientů s normální funkcí ledvin vzhledem k tomu, že vylučování ledvinami představuje pouze vedlejší cestu eliminace imatinibu (viz bod 4.2 a 4.4).
Ačkoli výsledky farmakokinetických analýz ukázaly, že je zde značný rozdíl mezi jedinci, střední expozice imatinibu se nezvýšila u pacientů s různými stupni dysfunkce jater ve srovnání s pacienty s normální funkcí jater (viz body 4.2, 4.4 a 4.8).
Předklinický profil bezpečnosti imatinibu byl stanoven na potkanech, psech, opicích a králících.
Při studiu toxicity po opakovaném podání byly pozorovány mírné až středně závažné hematologické změny u potkanů, psů, a opic doprovázené změnami v kostní dřeni u potkanů a psů.
U potkanů a psů byly cílovým orgánem játra. U obou druhů zvířat bylo pozorováno mírné až střední zvýšení transamináz a mírný pokles cholesterolu, triglyceridů, celkových proteinů a hladiny albuminu. V játrech potkanů nebyly nalezeny žádné histopatologické změny. Závažné toxické změny se zvýšením jaterních enzymů, hepatocelulární nekrózou, nekrózou žlučových cest a hyperplazií žlučovodu byly pozorovány u psů léčených po 2 týdny.
U opic byla po dvou týdnech léčby pozorována nefrotoxicita, s ložiskovou mineralizací a dilatací renálních tubulů a tubulární nefrózou. U několika zvířat bylo pozorováno zvýšení urey v krvi (BUN) a kreatininu. U potkanů byla po dávkách > 6 mg/kg ve 13týdenní studii pozorována hyperplazie přechodového epitelu renální papily a močového měchýře, beze změn parametrů v séru nebo moči. Při chronické léčbě imatinibem byl pozorován četnější výskyt oportunních infekcí.
Ve 39týdenní studii u opic nebyla při nejnižší dávce 15 mg/kg, odpovídající přibližně jedné třetině maximální humánní dávky 800 mg stanovené podle tělesného povrchu, stanovena hladina bez nežádoucích účinků -NOAEL (No Observed Adverse Effect Level). U těchto zvířat došlo ke zhoršení normálně potlačené malárie.
Ve studiích in vitro na bakteriálních buňkách (Amesův test), na savčích buňkách (myší lymfomové buňky) ani ve studiích in vivo u potkanů mikronukleárním testem nebyla zjištěna genotoxicita imatinibu. Pozitivní genotoxický účinek imatinibu byl zjištěn v testu in vitro na savčích buňkách (ovariální buňky křečka čínského) na klastogenicitu (chromozomální aberaci) za přítomnosti metabolické aktivace. Dva meziprodukty výrobního procesu, které jsou také přítomny ve finálním výrobku, měly pozitivní Amesův test na mutagenicitu. Jeden z těchto meziproduktů byl také pozitivní při testování na myších lymfomových buňkách.
Ve studii fertility byla potkaním samcům po dobu 70 dnů před připuštěním podávána dávka 60 mg/kg, která přibližně odpovídá maximální klinické dávce 800 mg/den, stanovené podle tělesného povrchu. Byl zjištěn úbytek hmotnosti varlat a nadvarlat a sníženo procento pohyblivých spermií. Tento účinek nebyl pozorován při dávce < 20 mg/kg. Mírné až střední snížení spermatogeneze bylo také pozorováno u psů po perorálních dávkách > 30 mg/kg. Pokud byl imatinib podáván samicím potkanů 14 dnů před připuštěním a až do 6. dne březosti nebylo ovlivněno ani zabřeznutí ani počet březích samic. Po podávání dávky 60 mg/kg, došlo u samic potkanů k významným postimplantačním ztrátám plodů a snížení počtu živých plodů. Tento účinek nebyl pozorován v dávkách < 20 mg/kg.
Ve studii pre a postnatálního vývoje u potkanů po perorálním podání 45 mg/kg/den byl 14. nebo 15. den zabřeznutí pozorován rudý výtok z vagíny. Při stejné dávce stoupnul počet mrtvě narozených mláďat stejně jako počet uhynulých po narození mezi 0. až 4. dnem. U mláďat z vrhu Fj, byla při stejné dávce nižší průměrná tělesná hmotnost od narození až do usmrcení a počet mláďat ve vrhu byl také snížen. Fertilita Fj nebyla ovlivněna po dávce 45 mg/kg/den, zatímco počet resorbovaných plodů stoupl a klesl počet živě narozených mláďat. Dle hodnocení No Observed Effect Level (NOEL) byla pro mateřská zvířata a F1 generaci mláďat bezpečná dávka 15 mg/kg/den (jedna čtvrtina maximální lidské dávky 800 mg).
Imatinib byl teratogenní, pokud byl podáván potkanům během organogeneze v dávkách > 100 mg/kg, přibližně odpovídající maximální klinické dávce 800 mg/den, stanovené podle tělesného povrchu. Teratogenní účinky zahrnovaly exencefalii nebo encefalokelu, absenci nebo redukci frontálních kostí a absenci parietálních kostí. Tyto účinky nebyly pozorovány při dávkách < 30 mg/kg.
V toxikologické studii zaměřené na juvenilní vývoj potkanů (den 10 až 70 post partum) nebyly zjištěné nové cílové orgány ve srovnání se zjištěnými cílovými orgány u dospělých potkanů.
V toxikologické studii zaměřené na juvenilní jedince byly pozorovány účinky na růst, zpoždění otevření vaginy a oddělení předkožky při přibližně 0,3 až 2násobku průměrné pediatrické expozice při nejvyšší doporučené dávce 340 mg/m2. Dále byla u juvenilních zvířat (ve fázi odstavení) zjištěna mortalita při přibližně 2násobku průměrné pediatrické expozice při nejvyšší doporučené dávce
340 mg/m2.
Výsledky 2leté studie kancerogenity u potkanů, kterým byl podáván imatinib v dávce 15, 30 a 60 mg/kg/den ukázaly statisticky významné snížení délky života u samců při dávce 60 mg/kg/den a u samic při dávce > 30 mg/kg/den. Histopatologická vyšetření jako hlavní příčinu smrti nebo důvodu pro utracení zvířat odhalily kardiomyopatii (u obou pohlaví), chronickou progresivní nefropatii (u samic) a papilomy předkožkové žlázky. Cílovými orgány, pokud se týká neoplastických změn, byly ledviny, močový měchýř, uretra, předkožková a klitoridální žlázka, tenké střevo, příštítná tělíska, nadledvinky a nesekretorická část žaludeční stěny.
Byly zaznamenány případy vzniku papilomů/karcinomů předkožkové/klitoridální žlázky při dávce od 30 mg/kg/den a více, což reprezentuje přibližně 0,5násobek dávky 400 mg/den běžně užívané u člověka (podle AUC), nebo 0,3násobek dávky 800 mg/den užívané u člověka, a 0,4násobek dávky 340 mg/m2/den u dětí (podle AUC). Dle hodnocení No Observed Effect Level (NOEL) byla bezpečná dávka 15 mg/kg/den. Renální adenom/karcinom a papilom močového měchýře a uretry, adenokarcinomy tenkého střeva, adenomy příštítných tělísek, benigní a maligní medulární tumory nadledvinek a papilomy/karcinomy nesekretorické části žaludeční stěny byly pozorovány při dávce 60 mg/kg/den, což reprezentuje přibližně 1,7násobek dávky 400 mg/den běžně užívané u člověka (podle AUC) nebo dávku 800 mg/den běžně užívané u člověka, a 1,2násobek dávky 340 mg/m2/den u dětí (podle AUC). Dle hodnocení No Observed Effect Level (NOEL) byla bezpečná dávka 30 mg/kg/den.
Mechanismus a závažnost těchto nálezů ze studie kancerogenity u potkanů není ještě u člověka objasněn.
Non-neoplastické léze neprokázané v dřívějších předklinických studiích se vyskytovaly v kardiovaskulárním systému, pankreatu, endokrinních orgánech a zubech. Nejdůležitější změny zahrnovaly srdeční hypertrofii a dilataci, vedoucí k příznakům srdeční nedostatečnosti u některých zvířat.
Účinná látka imatinib představuje environmentální ohrožení pro organismy v sedimentu.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Jádro tablety:
Mikrokrystalická celulosa Krospovidon Hypromelosa Magnesium-stearát Bezvodý oxid křemičitý
Potahová vrstva tablety:
Červený oxid železitý (E172)
Žlutý oxid železitý (E172)
Makrogol
Mastek
Hypromelosa
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Neuchovávejte při teplotě nad 30°C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
6.5 Druh obalu a obsah balení PVC/aluminium blistry
Balení obsahuje 20, 60, 120 nebo 180 potahovaných tablet.
Na trhu nemusí být k dispozici všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/01/198/007
EU/1/01/198/008
EU/1/01/198/011
EU/1/01/198/012
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 07. listopad 2001
Datum posledního prodloužení registrace: 07. listopad 2006
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Glivec 400 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna potahovaná tableta obsahuje 400 mg imatinibum (jako imatinibi mesilas). Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta
Velmi tmavě žluté až hnědooranžové oválné bikonvexní, potahované tablety se zkosenými okraji s vyraženým „glivec“ na jedné straně.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Glivec je indikován k léčbě
• dospělých a dětských pacientů s nově diagnostikovanou Philadelphia chromozom (bcr-abl) pozitivní (Ph+) chronickou myeloidní leukemií (CML), u kterých není transplantace kostní dřeně považována za léčbu první volby.
• dospělých a dětských pacientů s Ph+ CML s chronickou fází onemocnění, u kterých selhala léčba interferonem-alfa, nebo kteří jsou v akcelerované fázi onemocnění nebo v blastické krizi.
• dospělých a dětských pacientů s nově diagnostikovanou Philadelphia chromozom pozitivní akutní lymfatickou leukemií (Ph+ ALL) doplněnou chemoterapií.
• dospělých pacientů s recidivující nebo refrakterní Ph+ ALL jako monoterapie.
• dospělých pacientů s myelodysplastickým/myeloproliferativním onemocněním (MDS/MPD) spojeným se změnou genu receptoru pro růstový faktor krevních destiček (PDGFR).
• dospělých pacientů se syndromem pokročilé hypereozinofilie (HES) a/nebo chronickou eozinofilní leukemií (CEL) s přeskupením FIP1L1-PDGFRa.
Účinek Glivecu na výsledek transplantace kostní dřeně nebyl stanoven.
Glivec je indikován
• k léčbě dospělých pacientů s Kit (CD 117) pozitivními inoperabilními a/nebo metastatickými maligními stromálními nádory zažívacího traktu (GIST).
• k adjuvantní léčbě dospělých pacientů s významným rizikem recidivy po resekci Kit (CD117)-pozitivního GIST nádoru. Pacienti s nízkým nebo velmi nízkým rizikem recidivy by neměli adjuvantní léčbu podstoupit.
• k léčbě dospělých pacientů s inoperabilním dermatofibrosarkomem protuberans (DFSP) a dospělých pacientů s rekurentním a/nebo metastatickým DFSP, kteří nejsou způsobilí operace.
U dospělých a dětských pacientů je účinnost Glivecu hodnocena podle stupně celkové hematologické a cytogenetické odpovědi a přežívání bez progrese onemocnění u CML, podle stupně hematologické a cytogenetické odpovědi u Ph+ ALL, MDS/MPD, podle stupně hematologické odpovědi u HES/CEL a podle stupně objektivní odpovědi u dospělých pacientů s inoperabilním a/nebo metastatickým GIST a DFSP a na základě přežití bez návratu onemocnění u adjuvantní léčby GIST. Zkušenosti s Glivecem u pacientů s MDS/MPD spojeným se změnou genu receptoru PDGFR jsou velmi omezené (viz bod 5.1). Kromě nově diagnostikované chronické fáze CML nej sou k dispozici žádné kontrolované studie, které by prokázaly klinický přínos nebo prodloužené přežití u těchto uvedených onemocnění.
4.2 Dávkování a způsob podání
Léčbu by měl zahájit lékař s odpovídajícími zkušenostmi v léčbě pacientů s hematologickými malignitami a maligními sarkomy.
Pro dávky jiné než 400 mg a 800 mg (viz doporučené dávkování níže) jsou dostupné 100 mg (dělitelné) tablety.
Předepsaná dávka by měla být podávána perorálně s jídlem a zapíjena velkou sklenicí vody, aby se minimalizovalo riziko gastrointestinálního podráždění. Dávky 400 mg nebo 600 mg by měly být podávány jednou denně, zatímco dávka 800 mg by měla být podávána rozděleně na 400 mg dvakrát denně ráno a večer.
Pacientům, kteří nemohou polykat celé potahované tablety je možné tablety rozpustit ve sklenici minerální vody nebo jablečného džusu. Požadovaný počet tablet by měl být dán do odpovídajícího množství nápoje (přibližně 50 ml pro 100 mg tablety a 200 ml pro 400 mg tablety) a zamíchán lžící. Suspenze musí být požita neprodleně po kompletním rozpadnutí tablety(tablet).
Dávkování u CML u dospělých pacientů
Doporučená dávka Glivecu je pro dospělé pacienty v chronické fázi CML 400 mg/den. Chronická fáze CML je definována dosažením všech následujících kriterií: blasty v krvi a kostní dřeni < 15%, basofily v periferní krvi < 20%, krevní destičky > 100 x 109/l.
U dospělých pacientů s akcelerovanou fází je doporučená dávka Glivecu 600 mg/den. Akcelerovaná fáze onemocnění je určena přítomností kteréhokoli z následujících projevů: blasty v krvi nebo kostní dřeni > 15% ale < 30%, blasty a promyelocyty v krvi nebo kostní dřeni > 30% (za předpokladu < 30% blastů), basofily v periferní krvi > 20%, krevní destičky < 100 x 109/l bez vztahu k léčbě.
U dospělých pacientů v blastické krizi je doporučená dávka Glivecu 600 mg/den. Blastická krize je definována počtem blastů v krvi nebo kostní dřeni > 30% nebo extramedulárním postižením jiným než hepatosplenomegalií.
Trvání léčby: V klinických studiích pokračovala léčba Glivecem do progrese onemocnění. Efekt zastavení léčby po dosažení kompletní cytogenetické odpovědi nebyl zkoumán.
U pacientů v chronické fázi onemocnění je možno uvažovat o vzestupu dávky ze 400 mg na 600 mg nebo 800 mg, u pacientů s akcelerovanou fází onemocnění nebo v blastické krizi je možné zvýšit dávku ze 600 mg na maximum 800 mg (podáváno 2krát denně 400 mg), při absenci závažných nežádoucích účinků nebo závažné neutropenii či trombocytopenii nesouvisející s leukemií, za následujících okolností: při progresi onemocnění (kdykoliv); pokud nebylo ani po 3 měsících léčby dosaženo uspokojivé hematologické odpovědi; pokud nebylo po 12 měsících léčby dosaženo cytogenetické odpovědi; nebo při ztrátě předtím dosažené hematologické a/nebo cytogenetické odpovědi. Při zvyšování podávané dávky by měli být pacienti pečlivě sledováni pro možnost zvýšeného výskytu nežádoucích reakcí při vyšších dávkách.
Dávkování u CML u dětí
Dávkování pro děti by mělo být stanoveno podle tělesného povrchu (mg/m2). Dávka 340 mg/m2 denně se doporučuje dětem s chronickou fází CML nebo v pokročilé fázi CML (nepřekročit celkovou dávku 800 mg). Lék může být podáván jednou denně nebo může být celková denní dávka rozdělena do dvou částí - jedna ráno a druhá večer. Doporučené dávkování je v současnosti založeno na malém počtu dětských pacientů (viz body 5.1 a 5.2). S léčbou dětí do 2 let věku nejsou zkušenosti.
U dětí je možno uvažovat o vzestupu dávky z 340 mg/m2 denně na 570 mg/m2 denně (nepřekročit celkovou dávku 800 mg) při absenci závažných nežádoucích účinků nebo závažné neutropenii či trombocytopenii nesouvisející s leukemií za následujících okolností: při progresi onemocnění (kdykoliv), pokud nebylo ani po 3 měsících léčby dosaženo uspokojivé hematologické odpovědi, pokud nebylo po 12 měsících léčby dosaženo cytogenetické odpovědi, nebo při ztrátě před tím dosažené hematologické a/nebo cytogenetické odpovědi. Při zvyšování podávané dávky by měli být pacienti pečlivě sledováni pro možnost zvýšeného výskytu nežádoucích reakcí při vyšších dávkách.
Dávkování u Ph+ ALL u dospělých pacientů
U dospělých pacientů s Ph+ ALL je doporučená dávka Glivecu 600 mg/den. Hematologičtí odborníci pro léčbu tohoto onemocnění by měli terapii sledovat během všech fází péče.
Léčebný režim: Podle dosavadních údajů byla prokázána účinnost a bezpečnost Glivecu u dospělých pacientů s nově diagnostikovanou Ph+ ALL, pokud se podával v dávce 600 mg/den v kombinaci s chemoterapií v indukční fázi, v konsolidační a udržovací fázi po chemoterapii (viz bod 5.1). Délka léčby Glivecem se může lišit s vybraným léčebným programem, ale obecně delší expozice Glivecu přináší lepší výsledky.
Pro dospělé pacienty s recidivující nebo refrakterní Ph+ ALL je monoterapie Glivecem při dávce 600 mg/den bezpečná, účinná a může být podávána, dokud se neobjeví progrese onemocnění.
Dávkování u Ph+ ALL u dětí
Dávkování pro děti má být stanoveno podle tělesného povrchu (mg/m2). U dětí s Ph+ ALL se doporučuje dávka 340 mg/m2 denně (nepřekročit celkovou dávku 600 mg).
Dávkování u MDS/MPD
U dospělých pacientů s MDS/MPD je doporučená dávka Glivecu 400 mg/den.
Trvání léčby: V jediné dosud provedené klinické studii pokračovala léčba Glivecem do progrese onemocnění (viz bod 5.1). V čase analýzy byl medián trvání léčby 47 měsíců (24 dnů - 60 měsíců).
Dávkování u HES/CEL
U dospělých pacientů s HES/CEL je doporučená dávka Glivecu 100 mg/den.
Zvýšení dávky ze 100 mg na 400 mg lze zvažovat při absenci nežádoucích účinků léčiva, a jestliže je při hodnocení léčby prokázána nedostatečná odpověď na léčbu.
Léčba by měla pokračovat tak dlouho, dokud je pro pacienta přínosná.
Dávkování u GIST
U dospělých pacientů s inoperabilním a/nebo metastatickým maligním GIST je doporučená dávka Glivecu 400 mg/den.
Existuje pouze omezené množství údajů o účinku zvýšení dávky ze 400 mg na 600 mg nebo 800 mg u pacientů s progresí při užívání nižší dávky (viz bod 5.1).
Trvání léčby: v klinických studiích pokračovala léčba pacientů s GIST do progrese onemocnění. V době analýzy byl medián trvání léčby 7 měsíců (7 dní až 13 měsíců). Efekt zastavení léčby po dosažení odpovědi nebyl studován.
Doporučená dávka Glivecu pro adjuvantní léčbu dospělých pacientů po resekci GIST je 400 mg/den. Optimální délka trvání léčby dosud není stanovena. Délka léčby v klinických studiích, které byly podkladem pro tuto indikaci, byla 36 měsíců (viz bod 5.1).
Dávkování u DFSP
U dospělých pacientů s DFSP je doporučená dávka Glivecu 800 mg/den.
Úprava dávkování pro nežádoucí účinky
Nehematologické nežádoucí účinky
Jestliže se při léčbě Glivecem vyskytnou závažné nehematologické nežádoucí účinky, musí být léčba do jejich zvládnutí přerušena. Potom může být léčba přiměřeně obnovena v závislosti na počáteční závažnosti příhody.
Při zvýšení hladiny bilirubinu > 3násobek stanoveného horního limitu normálu (IULN) nebo při zvýšení hladin jaterních transamináz > 5násobek IULN by měla by být léčba Glivecem přerušena, dokud se hladiny bilirubinu nevrátí k < 1,5násobku IULN a hladiny transamináz k < 2,5násobku IULN. Léčba Glivecem potom může pokračovat nižšími denními dávkami. U dospělých by měla být dávka snížena ze 400 na 300 mg nebo ze 600 na 400 mg nebo z 800 mg na 600 mg a u dětí ze 340 na 260 mg/m2/den.
Hematologické nežádoucí účinky
Při závažné neutropenii nebo trombocytopenii se doporučuje snížení dávky nebo přerušení léčby tak, jak je uvedeno v následující tabulce.
|
HES/CEL (zahajovací dávka 100 mg) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem na úroveň předchozí dávky (tj. před vážnými nežádoucími reakcemi). |
|
Chronická fáze CML, MDS/MPD a GIST (zahajovací dávka 400 mg) HES/CEL (dávka 400 mg) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem na úroveň předchozí dávky (tj. před vážnými nežádoucími reakcemi). 3. V případě opakování ANC < 1,0 x 109/l a/nebo krevních destiček k < 50 x 109/l, opakujte bod 1 a léčbu Glivecem obnovte sníženou dávkou 300 mg. |
|
Chronická fáze CML u dětí (dávka 340 mg/m2) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem na úroveň předchozí dávky (tj. před vážnými nežádoucími reakcemi). 3. V případě opakování ANC < 1,0 x109/l a/nebo krevních destiček < 50 x109/l, opakujte bod 1 a léčbu Glivecem obnovte sníženou dávkou 260 mg/m2. |
|
Akcelerovaná fáze CML a blastická krize a Ph+ ALL (počáteční dávka 600 mg) |
aANC < 0,5 x 109/l a/nebo krevní destičky < 10 x 109/l |
1. Zjistěte, zda cytopenie souvisí s leukemií (aspirací kostní dřeně nebo biopsií). 2. Pokud cytopenie nesouvisí s leukemií, snižte dávku Glivecu na 400 mg. 3. Pokud cytopenie přetrvává po 2 týdny, snižte dále dávku na 300 mg. 4. Pokud cytopenie přetrvává po 4 týdny a stále nesouvisí s leukemií, přerušte podávání Glivecu dokud není ANC > 1 x 109/l a krevní destičky > 20 x 109/l, potom obnovte léčbu dávkou 300 mg. |
|
Akcelerovaná fáze CML a blastická krize u dětí (počáteční dávka 340 mg/m2) |
aANC < 0,5 x 109/l a/nebo krevní destičky < 10 x 109/l |
1. Zjistěte, zda cytopenie souvisí s leukemií (aspirací kostní dřeně nebo biopsií). 2. Pokud cytopenie nesouvisí s leukemií, snižte dávku Glivecu na 260 mg/m2. 3. Pokud cytopenie přetrvává po 2 týdny, snižte dále dávku na 200 mg/m2. 4. Pokud cytopenie přetrvává po 4 týdny a stále nesouvisí s leukemií, přerušte podávání Glivecu, dokud není ANC > 1 x 109/l a krevní destičky > 20 x 109/l, potom obnovte léčbu dávkou 200 mg/m2. |
|
DFSP (při dávce 800 mg) |
ANC < 1,0 x 109/l a/nebo krevní destičky < 50 x 109/l |
1. Přerušte podávání Glivecu, dokud není ANC > 1,5 x 109/l a krevní destičky > 75 x 109/l. 2. Obnovte léčbu Glivecem v dávce 600 mg. 3. V případě opakování ANC < 1,0 x 109/l a/nebo krevních destiček k < 50 x 109/l, opakujte bod 1 a léčbu Glivecem obnovte se sníženou dávkou 400 mg. |
|
ANC = absolutní počet neutrofilů a výskyt nejméně po 1 měsíci léčby | ||
Zvláštní populace
Užití u dětí: Nejsou žádné zkušenosti s podáváním u dětí s CML mladších než 2 roky a u dětí s Ph+ ALL mladších než 1 rok (viz bod 5.1). Zkušenosti u dětí s MDS/MPD, DFSP, GIST a HES/CEL jsou velmi omezené.
Bezpečnost a účinnost imatinibu u dětí mladších než 18 let s MDS/MPD, DFSP, GIST a HES/CEL nebyla v klinických studiích stanovena. V současnosti dostupné publikované údaje jsou shrnuty v bodě 5.1, ale na jejich základě nelze učinit žádná doporučení ohledně dávkování.
Jaterní nedostatečnost: Imatinib je metabolizován především játry. Pacientům s mírnou, středně těžkou nebo těžkou dysfunkcí jater by měla být podávána minimální doporučená dávka 400 mg denně. Dávka může být snížena, pokud není tolerována (viz body 4.4, 4.8 a 5.2).
Klasifikace dysfunkce jater:
|
Dysfunkce jater |
Vyšetření jaterních funkcí |
|
Mírná |
Celkový bilirubin: = 1,5 ULN AST: > ULN (může být normální nebo < ULN, pokud celkový bilirubin je > ULN) |
|
Středně těžká |
Celkový bilirubin: > 1,5—3,0 ULN AST: jakákoliv |
|
Těžká |
Celkový bilirubin: > 3-10 ULN AST: jakákoliv |
ULN = horní hranice normy AST = aspartátaminotransferáza
Ledvinná nedostatečnost: U pacientů s dysfunkcí ledvin nebo u dialyzovaných pacientů má být použita počáteční minimální dávka 400 mg denně. U těchto pacientů se však doporučuje opatrnost. Pokud dávka není tolerována, může být snížena. Pokud je tolerována, může být v případě nedostatečné účinnosti zvýšena (viz bod 4.4 a 5.2).
Starší lidé: U starších lidí nebyla farmakokinetika imatinibu cíleně studována. V klinických studiích, které zahrnovaly 20% pacientů ve věku 65 let a starších, nebyly u dospělých pacientů pozorovány významné rozdíly ve farmakokinetice v závislosti na věku. U starších lidí není nutné doporučovat zvláštní dávkování.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Pokud je Glivec podáván společně s jinými léčivými přípravky, je možné očekávat lékové interakce. Při užívání Glivecu s inhibitory proteáz, azolovými antimykotiky, některými makrolidy (viz bod 4.5), substráty CYP3A4 s úzkým terapeutickým rozpětím (např. cyklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin, fentanyl, alfentanil, terfanadin, bortezomib, docetaxel, chinidin) nebo warfarinem a jinými deriváty kumarinu je nutné dbát opatrnosti (viz bod 4.5).
Souběžné užívání imatinibu a léčivých přípravků, které indukují CYP3A4 (např. dexamethason, fenytoin, karbamazepin, rifampicin, fenobarbital nebo Hypericum perforatum, také známé jako třezalka tečkovaná) mohou významně snižovat hladinu Glivecu a potenciálně zvyšovat riziko selhání léčby Proto by se mělo zabránit souběžnému užívání silných induktorů CYP3A4 a imatinibu (viz bod 4.5).
Hypotyreóza
Během léčby Glivecem byly hlášeny klinické případy hypotyreózy u pacientů, kterým byla provedena tyreoidektomie a kteří byli substitučně léčeni levothyroxinem (viz bod 4.5). U těchto pacientů je třeba důkladně kontrolovat hladiny tyreotropního hormonu (TSH).
Hepatotoxicita
Glivec je metabolizován převážně játry a pouze 13% je vylučováno ledvinami. U pacientů s dysfunkcí jater (mírnou, středně závažnou nebo závažnou) by měl být pečlivě sledován počet krevních elementů v periferní krvi a jaterní enzymy (viz body 4.2, 4.8 a 5.2). Je nutné si uvědomit, že pacienti s GIST mohou mít jaterní metastázy, které mohou vést ke zhoršení jaterních funkcí.
Při léčbě imatinibem byly pozorovány případy jaterního poškození včetně jaterního selhání a jaterní nekrózy. Pokud bylo podávání imatinibu kombinováno s vysokodávkovými chemoterapeutickými režimy, byl zjištěn nárůst závažných jaterních reakcí. Jaterní funkce by měly být pečlivě monitorovány, jestliže se imatinib kombinuje s chemoterapeutickými režimy, o kterých je také známo, že bývají spojeny s poruchou jaterních funkcí (viz bod 4.5 a 4.8).
Retence tekutin
Výskyt závažné retence tekutin (pleurální výpotek, edém, plicní edém, ascites, povrchový edém) byl hlášen přibližně u 2,5% nově diagnostikovaných pacientů s CML užívajících Glivec. Proto se velice doporučuje pravidelné vážení pacientů. Neočekávaný, rychlý nárůst tělesné hmotnosti by měl být pečlivě vyšetřen, a pokud je to nezbytné, měla by být zavedena příslušná podpůrná a léčebná opatření. V klinických studiích byl zvýšený výskyt těchto příhod u starších lidí a u pacientů se srdečním onemocněním v anamnéze. Proto je nutné pacientům se srdeční dysfunkcí věnovat zvýšenou pozornost.
Pacienti se srdečním onemocněním
Pacienti se srdečním onemocněním, s rizikovými faktory vzniku srdečního selhání nebo renálním selháním v anamnéze by měli být pečlivě sledováni, a každý pacient s příznaky nebo projevy shodnými s příznaky srdečního nebo renálního selhání by mělo být vyšetřen a léčen.
U pacientů s hypereosinofilním syndromem (HES) s okultní infiltrací HES buněk do myokardu byly ojedinělé případy kardiogenního šoku či dysfunkce levé komory spojeny s degranulací HES buněk po zahájení léčby imatinibem. Dle hlášení byl stav reverzibilní při podávání systémových kortikosteroidů, zavedení opatření k podpoře cirkulace a dočasném vysazení imatinibu. Protože byly hlášeny méně časté kardiální nežádoucí účinky při podávání Glivecu, mělo by být před zahájením léčby pečlivě zváženo stanovení prospěchu/rizika léčby imatinibem u pacientů s HES/CEL.
Myelodysplastické/myeloproliferativní onemocnění se změnou genu receptoru PDGFR by mohlo být spojeno s vysokými hladinami eosinofilů. Proto by se mělo před podáním Glivecu pacientům s HES/CEL a pacientům s MDS/MPD spojeným s vysokými hladinami eosinofilů zvážit vyšetření odborníkem kardiologem, provedení echokardiogramu a stanovení troponinu v séru. Pokud je výsledek kteréhokoli vyšetření abnormální, mělo by být zváženo vyšetření odborníkem kardiologem a profylaktické podávání systémových kortikosteroidů (1-2 mg/kg) po dobu jednoho až dvou týdnů souběžně se zahájením léčby imatinibem.
Gastrointestinální krvácení
Ve studii u pacientů s inoperabilním a/nebo metastatickým GIST bylo hlášeno jak gastrointestinální, tak i intratumorózní krvácení (viz bod 4.8). Na základě dostupných údajů nebyly identifikovány žádné predispoziční faktory (např.velikost nádoru, lokalizace nádoru, poruchy koagulace), které by zařadily pacienty s GIST do skupiny s vyšším rizikem kteréhokoli typu krvácení. Protože je zvýšená vaskularizace a sklon ke krvácivosti součástí povahy a klinického průběhu GIST, měl by být u všech pacientů použit standardní postup pro monitorování a zvládání krvácení.
V postmarketingovém období byla u pacientů s CML, ALL a jinými onemocněními hlášena také gastrická antrální vaskulární ektázie (GAVE), vzácný typ gastrointestinálního krvácení (viz bod 4.8).
V případě potřeby může být léčba přípravkem Glivec ukončena.
Syndrom nádorového rozpadu
Před započetím léčby přípravkem Glivec je doporučená úprava klinicky významné dehydratace a léčba vysokých hladin kyseliny močové z důvodu možného výskytu syndromu nádorového rozpadu (TLS) (viz bod 4.8).
Reaktivace hepatitidy B
U pacientů, kteří jsou chronickými nosiči hepatitidy B, dochází k reaktivaci po zahájení léčby inhibitory tyrosinkinázy bcr-abl. Některé případy vyústily v akutní selhání jater nebo ve fulminantní hepatitidu vedoucí k transplantaci jater nebo došlo k úmrtí pacienta.
Před zahájením léčby přípravkem GLIVEC mají být pacienti vyšetřeni na infekci HBV. Před zahájením léčby u pacientů s pozitivní sérologií hepatitidy B (včetně těch s aktivním onemocněním) a u pacientů, u kterých v průběhu léčby vyjde pozitivní test infekce HBV, je třeba se obrátit na odborníky na onemocnění jater a léčbu hepatitidy B. Nosiči HBV, kteří potřebují léčbu přípravkem GLIVEC, mají být po celou dobu léčby a několik měsíců po jejím ukončení pečlivě sledováni s ohledem na možný výskyt známek a příznaků aktivní infekce HBV (viz bod 4.8).
Laboratorní testy
Během léčby Glivecem musí být pravidelně vyšetřován kompletní krevní obraz. Léčba Glivecem u pacientů s CML byla doprovázena výskytem neutropenie nebo trombocytopenie. Avšak výskyt těchto cytopenií pravděpodobně souvisí se stádiem léčeného onemocnění a byl častější u pacientů s akcelerovanou fází CML nebo v blastické krizi než u pacientů s chronickou fází CML. Léčba Glivecem může být přerušena nebo dávky mohou být sníženy, jak je doporučeno viz bod 4.2.
U pacientů užívajících Glivec by měly být pravidelně monitorovány jaterní funkce (transaminázy, bilirubin, alkalická fosfatáza).
U pacientů s poruchou renálních funkcí je expozice imatinibem v plazmě patrně vyšší, než u pacientů s normální funkcí ledvin, pravděpodobně v důsledku zvýšené hladiny alfa-acid glycoproteinu (AGP) a vazby imatinibu na proteiny u těchto pacientů. Pacientům s renální nedostatečností by se měla podávat minimální zahajovací dávka. Pacienti se závažnou renální nedostatečností by měli být léčeni s opatrností. Pokud není dávka imatinibu tolerována, může být snížena (viz body 4.2 a 5.2).
Dlouhodobá léčba imatinibem může být spojená s klinicky významným omezením renálních funkcí. Proto mají být renální funkce před zahájením léčby imatinibem vyhodnoceny a během léčby pečlivě sledovány, pozornost má být věnována pacientům, u nichž se projevují rizikové faktory pro renální dysfunkci. Pokud je zjištěna renální dysfunkce, musí být předepsána vhodná opatření a léčba, která je v souladu se standardními léčebnými doporučeními.
Pediatrická populace
U dětí a jedinců v prepubertálním věku (preadolescentů) užívajících imatinib byly hlášené případy retardace růstu. Dlouhodobé účinky prodloužené léčby imatinibem na růst dětí nejsou známé. Proto je doporučené pečlivé sledování růstu dětí léčených imatinibem (viz bod 4.8).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Léčivé látky, které mohou zvyšovat koncentraci imatinibu v plazmě:
Látky, které inhibují aktivitu izoenzymu CYP3A4 cytochromu P450 (např. inhibitory proteáz jako je indinavir, lopinavir/ritonavir, ritonavir, sachinavir, telaprevir, nelfinavir, boceprevir; azolová antimykotika zahrnující ketokonazol, itrakonazol, posakonazol, vorikonazol; některé makrolidy jako je erythromycin, klarithromycin a telithromycin) by mohly snižovat metabolismus a zvyšovat koncentraci imatinibu. Při souběžné jednotlivé dávce ketokonazolu (inhibitoru CYP3A4) zdravým jedincům bylo pozorováno významné zvýšení účinku imatinibu (průměrná Cmax imatinibu vzrostla o 26% a AUC o 40%). Při podávání Glivecu s inhibitory skupiny CYP3A4 je nutná opatrnost.
Léčivé látky, které mohou snižovat koncentraci imatinibu v plazmě:
Látky, které indukují aktivitu CYP3A4 (např. dexamethason, fenytoin, karbamazepin, rifampicin, fenobarbital, fosfenytoin, primidon nebo Hypericum perforatum, známé také jako třezalka tečkovaná) mohou významně snižovat působení Glivecu a potenciálně zvyšovat riziko selhání léčby. Předchozí léčba opakovaným podáním rifampicinu 600 mg následovaná jednorázovou dávkou 400 mg Glivecu měla za následek snížení Cmax nejméně o 54% a AUC^) o 74% ve srovnání s hodnotami bez předchozí léčby rifampicinem. Podobné výsledky byly pozorovány u pacientů s maligními gliomy, kteří byli léčeni Glivecem a užívali antiepileptické léky (EIAEDs) jako např. karbamazepin, oxkarbazepin a fenytoin, které indukovaly příslušné jaterní enzymy. Došlo ke snížení AUC imatinibu v plazmě o 73% oproti pacientům, kteří neužívali EIAEDs. Mělo by se zabránit souběžnému užívání rifampicinu nebo jiných silných induktorů CYP3A4 a imatinibu.
Léčivé látky, jejichž koncentrace v plazmě by mohla být ovlivněna Glivecem
Imatinib zvyšuje průměrnou Cmax simvastatinu 2krát a AUC simvastatinu (CYP3A4 substrát) 3,5krát, což znamená, že je CYP3A4 inhibován imatinibem. Při podávání Glivecu se substráty CYP3A4 s úzkým terapeutickým oknem se proto doporučuje opatrnost (např. cyklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin, fentanyl, alfentanil, terfenadin, bortezomib, docetaxel a chinidin). Glivec může zvyšovat plazmatickou koncentraci jiných léků metabolizovaných CYP3A4 (např. triazolo-benzodiazepinů, dihydropyridinových blokátorů kalciových kanálů, některých inhibitorů HMG-CoA reduktázy, tj. statinů, atd.).
Vzhledem ke známému zvýšenému riziku krvácení spojenému s užíváním imatinibu (např. hemoragie) by měli pacienti vyžadující antikoagulační léčbu místo kumarinových derivátů, jako je warfarin, dostávat nízkomolekulární nebo standardní heparin.
In vitro Glivec inhibuje aktivitu izoenzymu CYP2D6 cytochromu P450 v koncentraci podobné té, která ovlivňuje aktivitu CYP3A4. Imatinib v dávce 400 mg dvakrát denně působil inhibičně na metabolismus metoprololu zprostředkovaný CYP2D6; došlo ke zvýšení Cmax a AUC metoprololu o přibližně 23% (90% CI [1,16-1,30]).Zdá se, že při souběžném podávání imatinibu se substráty CYP2D6 není nutno upravovat dávkování, doporučuje se však věnovat zvýšenou pozornost substrátům CYP2D6 s úzkým terapeutickým oknem, jako je např. metoprolol. U pacientů léčených metoprololem je nutno zvážit klinické monitorování.
In vitro Glivec inhibuje O-glukuronidaci paracetamolu s Ki hodnotou 58,5 mikromol/l. Tato_inhibice nebyla zjištěna po podání Glivecu 400 mg a paracetamolu 1000 mg in vivo. Vyšší dávky Glivecu a paracetamolu nebyly studovány.
Obezřetnost by proto měla být uplatněna při souběžném užívání vyšších dávek Glivecu a paracetamolu.
U pacientů s tyreoidektomií léčených levothyroxinem, může být plazmatická expozice levothyroxinu snížena, pokud se podává spolu s Glivecem (viz bod 4.4). Proto se doporučuje opatrnost. Nicméně mechanismus pozorované interakce v současnosti není znám.
U pacientů s Ph+ ALL existují klinické zkušenosti souběžného podávání Glivecu a chemoterapie (viz bod 5.1), avšak lékové interakce mezi imatinibem a chemoterapeutickými režimy nejsou dobře známy. Nežádoucí účinky imatinibu jako jaterní toxicita, myelosuprese a další se mohou zvyšovat, podle hlášení souběžné užívání s L-asparaginázou by mohlo být spojeno se zvýšením jaterní toxicity (viz bod 4.8). Proto je třeba zvláštní opatrnosti, pokud se Glivec užívá v kombinaci.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku
Ženám ve fertilním věku musí být doporučeno užívání účinné antikoncepce během léčby.
K dispozici jsou omezené údaje o podávání imatinibu těhotným ženámi. Studie na zvířatech však prokázaly reprodukční toxicitu (viz bod 5.3). Potenciální riziko pro plod není známé. Glivec lze v těhotenství použít pouze pokud je to nezbytně nutné. Pokud je během těhotenství užíván, pacientka musí být informována o možném riziku pro plod.
Kojení
O vylučování imatinibu do mateřského mléka jsou jen omezené informace. Studie na dvou kojících ženách ukázaly, že jak imatinib, tak jeho aktivní metabolit může být vylučován do mateřského mléka. Koeficient mléko/plazma imatinibu a jeho metabolitu zkoumaný u jedné pacientky byl stanoven 0,5 pro imatinib a 0,9 pro jeho metabilit, což nasvědčuje zvýšenému vylučováním metabolitu do mléka. Zvážíme-li kombinovanou koncentraci imatinibu a jeho metabolitu a maximální denní příjem mléka kojenci, byla by očekávaná celková expozice nízká (přibližně 10% terapeutické dávky). Nicméně, jelikož účinky expozice nízké dávce imatinibu u kojenců nejsou známé, neměly by ženy užívající imatinib kojit.
Fertilita
Fertilita u samců a samic potkanů nebyla v neklinických studiích ovlivněna (viz bod 5.3). Studie u pacientů užívajících Glivec zabývající se jeho účinky na fertilitu a spermatogenezi nebyly provedeny. Pacienti, kteří se obávají o svou fertilitu během léčby Glivecem, by se měli poradit se svým lékařem.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacienti by měli být upozorněni, že se u nich mohou během léčby imatinibem vyskytnout nežádoucí účinky, jako jsou závratě, neostré vidění nebo ospalost. Proto se při řízení nebo obsluze strojů doporučuje zvýšená opatrnost.
4.8 Nežádoucí účinky
U pacientů s pokročilým stadiem malignit se může vyskytovat řada různorodých zdravotních potíží vyvolaných základním onemocněním, jeho progresí nebo množstvím souběžně užívaných léčivých přípravků, což ztěžuje stanovení příčinné souvislosti výskytu nežádoucích reakcí.
Během klinického hodnocení léku u CML musela být z důvodu nežádoucích reakcí, které byly v příčinné souvislosti s podáváním léku, léčba přerušena pouze u 2,4% nově diagnostikovaných pacientů, u 4% pacientů v pozdní chronické fázi po selhání léčby interferonem, u 4% pacientů v akcelerované fázi po selhání léčby interferonem a u 5% pacientů v blastické krizi po selhání léčby interferonem. U pacientů s GIST bylo podávání hodnoceného léku přerušeno pro nežádoucí reakce související s lékem u 4% pacientů.
Nežádoucí účinky byly ve všech indikacích podobné, s výjimkou dvou reakcí. U pacientů s CML byla častěji pozorována myelosuprese než u pacientů s GIST, pravděpodobně způsobené základním onemocněním. Ve studii u pacientů s inoperabilním a/nebo metastatickým GIST se u 7 (5%) pacientů vyskytl CTC stupeň 3/4 GI krvácení (3 pacienti), krvácení do nádoru (3 pacienti) nebo obojí (1 pacient). Lokalizace GI nádorů může být zdrojem krvácení do zažívacího traktu (viz bod 4.4). Krvácení do zažívacího traktu nebo z nádoru může být někdy velmi vážné, v některých případech až fatální. Nejčastěji hlášené (> 10%) nežádoucí reakce vyvolané lékem v obou souborech byly mírná nauzea, zvracení, průjem, bolesti břicha, únava, svalové bolesti, svalové křeče a vyrážka. Povrchové otoky byly společným nálezem ve všech studiích a byly popisovány hlavně jako otoky kolem očí nebo otoky dolních končetin. Tyto otoky však byly jen vzácně závažné a bylo možné je zvládnout diuretiky, jinou podpůrnou léčbou nebo snížením dávky Glivecu.
Pokud se imatinib kombinoval s vysokou dávkou chemoterapie u pacientů s Ph+ ALL, byla pozorována přechodná jaterní toxicita ve formě zvýšení transamináz a hyperbilirubinemie. Při použití omezených údajů z bezpečnostních databází se dosud hlášené nežádoucí účinky u dětí shodují se známým bezpečnostním profilem u dospělých pacientů s Ph+ ALL. Databáze týkající se bezpečnosti u dětí s Ph+ ALL je velmi omezená, protože nebyly zjistěné nové bezpečnostní události.
Různorodé nežádoucí účinky, jako je pleurální výpotek, ascites, plicní edém a rychlý přírůstek tělesné hmotnosti s nebo bez superficiálních otoků, je možné souhrnně popsat jako „retence tekutin“ Tyto nežádoucí reakce je možné obvykle zvládnout dočasným vysazením Glivecu a diuretiky a jinou vhodnou podpůrnou léčbou. Avšak některé z těchto reakcí mohou být velmi závažné nebo život ohrožující a několik pacientů s blastickou krizí zemřelo s komplexním klinickým nálezem zahrnujícím pleurální výpotek, městnavé srdeční selhání a selhání ledvin. V klinických studiích nebyly u dětí pozorovány specificky odlišné nežádoucí účinky.
Nežádoucí účinky
Nežádoucí účinky, které se vyskytly častěji než v ojedinělých případech jsou uvedeny níže podle orgánové klasifikace a frekvence výskytu. Kategorie frekvencí výskytu jsou definovány podle následujících pravidel jako: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
V každé skupině četností jsou nežádoucí účinky seřazeny podle četnosti od nejčastější.
Nežádoucí účinky a četnost jejich výskytu jsou uvedené v Tabulce 1.
Tabulka 1 Přehled nežádoucích účinků v tabulce
|
Infekce a infestace | |
|
Méně časté: |
Herpes zoster, herpes simplex, nasofaryngitida, pneumonie1, sinusitida, celulitida, infekce horních cest dýchacích, chřipka, infekce močových cest, gastroenteritida, sepse |
|
Vzácné: |
Plísňové infekce |
|
Není známo: |
Reaktivace hepatitidy B* |
|
Novotvary benigní, maligní, a blíže neurčené (zahrnující cysty a polypy) | |
|
Vzácné: |
Syndrom nádorového rozpadu |
|
Není známo: |
Krvácení do tumoru/nekróza tumoru* |
|
Poruchy imunitního systému | |
|
Není známo: |
Anafylaktický šok* |
|
Poruchy krve a lymfatického systému | |
|
Velmi časté: |
Neutropenie, trombocytopenie, anemie |
|
Časté: |
Pancytopenie, febrilní neutropenie |
|
Méně časté: |
Trombocytemie, lymfopenie, útlum kostní dřeně, eozinofilie, lymfadenopatie |
|
Vzácné: |
Hemolytická anemie |
|
Poruchy metabolismu a výživy | |
|
Časté: | |
|
Méně časté: |
Hypokalemie, zvýšená chuť k jídlu, hypofosfatemie, snížená chuť k jídlu, dehydratace, dna, hyperurikemie, hyperkalcemie, hyperglykemie, hyponatremie |
|
Vzácné: |
Hyperkalemie, hypomagnezémie |
|
Psychiatrické poruchy | |
|
Časté: | |
|
Méně časté: | |
|
Vzácné: |
Stav zmatenosti |
|
Poruchy nervového systému | |
|
Velmi časté: |
Bolesti hlavy2 |
|
Časté: |
Závratě, parestezie, porucha chutě, hypestezie |
|
Méně časté: |
Migréna, somnolence, synkopa, periferní neuropatie, zhoršení paměti, ischias, syndrom neklidných nohou, třes, mozkové krvácení |
|
Vzácné: |
Zvýšený intrakraniální tlak, křeče, optická neuritida |
|
Není známo: |
Cerebrální edém* |
|
Poruchy oka | |
|
Časté: |
Otok očních víček, zvýšené slzení, krvácení do spojivky, konjunktivitida, syndrom suchého oka, rozmazané vidění |
|
Méně časté: |
Podráždění očí, bolesti očí, edém očnice, krvácení do bělimy, krvácení do sítnice, blefaritida, makulární edém |
|
Není známo: |
Krvácení do sklivce* |
|
Poruchy ucha a labyrintu | |
|
Méně časté: |
Vertigo, tinitus, ztráta sluchu |
|
Srdeční poruchy | |
|
Méně časté: |
Palpitace, tachykardie, městnavé srdeční selhání3, plicní edém |
|
Vzácné: |
Arytmie, atriální fibrilace, srdeční zástava, infarkt myokardu, angina pectoris, perikardiální výpotek |
|
Není známo: |
Perikarditida*, srdeční tamponáda* |
|
Cévní poruchy4 | |
|
Časté: |
Zrudnutí, krvácení |
|
Méně časté: |
Hypertenze, hematomy, subdurální hematom, periferní chlad, hypotenze, Raynaudův fenomén |
|
Není známo: |
T rombóza/ embolie* |
|
Respirační, hrudní a mediastinální poruchy | |
|
Časté: | |
|
Méně časté: |
Pleurální výpotek5, bolesti hrtanu/hltanu, faryngitida |
|
Vzácné: |
Bolest pohrudnice, plicní fibróza, plicní hypertenze, krvácení do plic |
|
Není známo: |
Akutní respirační selhání10*, intersticiální plicní onemocnění* |
|
Gastrointestinální poruchy | |
|
Velmi časté: | |
|
Časté: |
Nadýmání, rozpětí břicha, gastro-ezofageální reflux, zácpa, sucho v ústech, gastritida |
|
Méně časté: |
Stomatitida, ulcerace v ústech, gastrointestinální krvácení7, říhání, meléna, ezofagitida, ascites, žaludeční ulcerace, hematemeze, cheilitida, dysfagie, pankreatitida |
|
Vzácné: |
Kolitida, ileus, zánětlivé střevní onemocnění |
|
Není známo: |
Ileus/neprůchodnost střev*, gastrointestinální perforace*, divertikulitida*, gastrická antrální vaskulární ektázie (GAVE)* |
|
Poruchy jater a žlučových cest | |
|
Časté: |
Zvýšení jaterních enzymů |
|
Méně časté: |
Hyperbilirubinemie, hepatitida, žloutenka |
|
Vzácné: |
Jaterní selhání8, jaterní nekróza |
|
Poruchy kůže a podkožní tkáně | |
|
Velmi časté: |
Periorbitální edém, dermatitida/ekzém/vyrážka |
|
Časté: |
Pruritus, otok obličeje, suchá pleť, erytém, alopecie, noční pocení, reakce fotosensitivity |
|
Méně časté: |
Pustulózní vyrážka, zhmožděniny, zvýšené pocení, urtikarie, ekchymóza, zvýšená tendence k tvorbě podlitin, hypotrichóza, hypopigmentace kůže, exfoliativní dermatitida, lámání nehtů, folikulitida, petechie, lupénka, purpura, hyperpigmentace kůže, výsev puchýřků |
|
Vzácné: |
Akutní febrilní neutrofilní dermatóza (Sweet’s syndrome), ztráta barvy nehtů, angioneurotický edém, puchýřkovitá vyrážka, multiformní erytém, leukocytoklastická vaskulitida, Stevens-Johnsonův syndrom, akutní generalizovaná exantematózní pustulóza (AGEP) |
|
Není známo: |
Syndrom palmoplantární erytrodysestezie*, lichenoidní keratóza*, lichen planus*, toxická epidermální nekrolýza*, poléková vyrážka s eozinofilií a systémovými příznaky (DRESS)* |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | |
|
Velmi časté: |
Svalové křeče a záchvaty křečí, muskuloskeletární bolesti včetně myalgie, artralgie, bolesti kostí9 |
|
Časté: |
Otoky kloubů |
|
Méně časté: |
Kloubní a svalová ztuhlost |
|
Vzácné: |
Svalová slabost, artritida, rabdomyolýza/myopatie |
|
Není známo: |
Avaskulární nekróza/nekróza kyčle*, retardace růstu u dětí* |
|
Poruchy ledvin a močových cest | |
|
Méně časté: |
Bolesti ledvin, hematurie, akutní selhání ledvin, zvýšená frekvence močení |
|
Není známo: |
Chronické selhání ledvin |
|
Poruchy reprodukčního systému a prsu | |
|
Méně časté: |
Gynekomastie, erektilní dysfunkce, menoragie, nepravidelná menstruace, poruchy sexuální funkce, bolesti bradavek, zvětšení prsou, edém skrota |
|
Vzácné: |
Hemoragické žluté tělísko/hemoragické cysty na vaječnících |
|
Celkové poruchy a reakce v místě aplikace | |
|
Velmi časté: |
Zadržování tekutin a edémy, únava |
|
Časté: |
Slabost, pyrexie, anasarka, mrazení, ztuhlost |
|
Méně časté: | |
|
Vyšetření | |
|
Velmi časté: |
Zvýšení hmotnosti |
|
Časté: |
Snížení hmotnosti |
|
Méně časté: |
Zvýšení koncentrace kreatininu v krvi, zvýšení kreatinfosfokinázy v krvi, zvýšení laktátdehydrogenázy v krvi, zvýšení alkalické fosfatázy v krvi |
|
Vzácné: |
Zvýšení amylázy v krvi |
* Tyto typy reakcí byly hlášeny po uvedení přípravku Glivec na trhu. Jsou zde zahrnuta spontánní hlášení nežádoucích účinků a také závažné nežádoucí účinky z pokračujících studií, programů rozšířeného přístupu k léčivému přípravku, studií klinické farmakologie a výzkumných studií v dosud neschválených indikacích. Protože tyto reakce jsou hlášeny z populace neurčitého rozsahu, není vždy možné spolehlivě odhadnout jejich četnost výskytu nebo stanovit kauzální vztah vůči expozici imatinibem.
1 Pneumonie byla nejčastěji hlášena u pacientů s transformovanou CML a u pacientů s GIST.
2 Bolesti hlavy byly nejčastější u pacientů s GIST.
3 Na podkladě hodnocení pacientoroků byly srdeční příhody včetně městnavého srdečního selhání pozorovány častěji u pacientů s transformovanou CML než u pacientů s chronickou CML.
4 Zrudnutí bylo nejčastější u pacientů s GIST a krvácení (hematomy, hemoragie) bylo nejčastější u pacientů s GIST a s transformovanou CML (CML-AP a CML-BC).
5 Pleurální výpotek byl častěji hlášen u pacientů s GIST a u pacientů s transformovanou CML (CML-AP a CML-BC) než u pacientů s chronickou CML.
6+7 Bolesti břicha a gastrointestinální krvácení byly nejčastěji pozorovány u pacientů s GIST.
8 Bylo hlášeno několik fatálních případů jaterního selhání a jaterních nekróz.
9 Muskuloskeletární bolesti a související příhody byly častěji pozorovány u pacientů s CML než u pacientů s GIST.
10 Fatální případy byly hlášeny u pacientů s pokročilým onemocněním, závažnými infekcemi, závažnou neutropenií a jinými závažnými konkomitantními stavy.
Změny hodnot laboratorních vyšetření Hematologie
U CML byly cytopenie, zvláště neutropenie a trombocytopenie, shodným nálezem ve všech studiích, s náznakem vyššího výskytu při vysokých dávkách > 750 mg (fáze I studie). Výskyt cytopenií byl však jasně závislý na stádiu onemocnění. Frekvence výskytu stupně 3 nebo 4 neutropenií (ANC
< 1,0 x 109/l) a trombocytopenií (počet destiček < 50 x 109/l) byly 4x a 6x častější v blastické krizi a akcelerované fázi onemocnění (59-64% pro neutropenii a 44-63% pro trombocytopenii) ve srovnání s nově diagnostikovanými pacienty s chronickou fází CML (16,7% neutropenií a 8,9% trombocytopenií). U nově diagnostikovaných pacientů s chronickou fází CML byl stupeň 4 neutropenie (ANC < 0,5 x 109/l) pozorován u 3,6% a trombocytopenie (počet destiček < 10 x 109/l) u
< 1% pacientů. Medián trvání neutropenické a trombocytopenické příhody byl obvykle v rozmezí od 2 do 3 týdnů a od 3 do 4 týdnů. Tyto příhody je možné obvykle zvládnout buď snížením dávky nebo přerušením léčby Glivecem, ale ve vzácných případech mohou vést k trvalému přerušení léčby. U dětských pacientů s CML byla nejčastějším pozorovaným hematologickým nežádoucím účinkem cytopenie stupně 3 nebo 4, která zahrnovala neutropenii, trombocytopenii a anemii. Většinou se objevily během prvních několika měsíců léčby.
Ve studii u pacientů s inoperabilním a/nebo metastatickým GIST byl popsán stupeň 3 anemie u 5,4% a stupeň 4 u 0,7% pacientů, které mohly souviset, alespoň u některých pacientů, s gastrointestinálním krvácením nebo krvácením do nádoru. Stupeň 3 neutropenie byl pozorován u 7,5% pacientů a stupeň 4 u 2,7% pacientů a stupeň 3 trombocytopenie byl u 0,7% pacientů. U žádného pacienta se nevyvinul stupeň 4 trombocytopenie. Snížení počtu bílých krvinek (WBC) a neutrofilů se objevilo hlavně během prvních šesti týdnů léčby, potom zůstávaly hodnoty relativně stabilní.
Biochemie
Závažné zvýšení hodnot transamináz (< 5%) nebo bilirubinu (< 1%) bylo pozorováno u pacientů s CML a obvykle je bylo možné zvládnout snížením dávky nebo přerušením léčby (medián trvání těchto příhod byl přibližně jeden týden). Léčba byla z důvodů abnormálních laboratorních hodnot jaterních testů trvale přerušena u méně než 1% pacientů s CML. U pacientů s GIST (studie B2222), bylo pozorováno zvýšení ALT (alaninaminotransferáza) stupně 3 nebo 4 u 6,8% a zvýšení AST (aspartátaminotransferáza) stupně 3 nebo 4 u 4,8%. Zvýšení bilirubinu bylo méně než 3%.
Byly to případy cytolytické a cholestatické hepatitidy a jaterního selhání; některé z nich byly fatální, včetně jednoho pacienta užívajícího vysoké dávky paracetamolu.
Popis vybraných nežádoucích účinků
Reaktivace hepatitidy B
V souvislosti s tyrosinkinázou bcr-abl byla zaznamenána reaktivace hepatitidy B. Některé případy vyústily v akutní selhání jater nebo ve fulminantní hepatitidu vedoucí k transplantaci jater nebo došlo k úmrtí pacienta (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Zkušenosti s dávkami vyššími než doporučená terapeutická dávka jsou omezené. Jednotlivé případy předávkování Glivecem byly hlášeny spontánně a v literatuře. V případě předávkování by měl být pacient pozorován a odpovídajícím způsobem léčen podpůrnou léčbou. Obecně byl v těchto případech hlášen výsledek „zlepšený“ nebo „vyléčený“. Následující příhody byly hlášeny při podání různých rozmezí dávky:
Dospělá populace
1200 až 1600 mg (délka trvání 1 až 10 dní): Nauzea, zvracení, průjem,vyrážka, zrudnutí kůže, edém, otoky, únava, svalové křeče, trombocytopenie, pancytopenie, bolest břicha, bolest hlavy, snížená chuť k jídlu.
1800 až 3200 mg (dosáhlo až 3200 mg denně po dobu 6 dnů): Slabost, myalgie, zvýšená hodnota kreatinfosfokinázy, zvýšená hodnota bilirubinu, gastrointestinální bolest.
6400 mg (jednotlivá dávka): V literatuře hlášený případ jednoho pacienta, u kterého se objevila nauzea, zvracení, bolest břicha, pyrexie, otok obličeje, snížený počet neutrocytů, zvýšení hodnot transamináz.
8 až 10 g (jednotlivá dávka): Bylo hlášené zvracení a gastrointestinální bolest.
Pediatrická populace
U 3letého chlapce, kterému byla podána jednotlivá dávka 400 mg, se objevilo zvracení, průjem a anorexie, u dalšího 3letého chlapce, kterému byla podána jednotlivá dávka 980 mg, byl zjištěn snížený počet bílých krvinek a průjem.
V případě předávkování by měl být pacient pozorován a vhodně léčen podpůrnou léčbou.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: inhibitor protein-tyrosinkinázy, ATC kód: L01XE01 Mechanismus účinku
Imatinib je nízkomolekulámí inhibitor tyrosinkinázy, který účinně inhibuje aktivitu BCR-ABL tyrosinkinázy (TK) a dalších receptorových tyrosinkináz: KIT, receptor pro růstový faktor kmenových buněk (SCF, stem cell factor) kódovaný protoonkogenem c-Kit, receptory discoidinové domény (DDR1 and DDR2), receptor kolonie stimulujícího faktoru (CSF-1R) a receptory pro destičkový růstový faktor alfa a beta (PDGFR-alfa a PDGFR-beta). Imatinib také může inhibovat buněčné procesy, na kterých se tyto receptorové kinázy podílí.
Farmakodynamické účinky
Imatinib je inhibitor tyrosinkinázy, který účinně inhibuje Bcr-Abl tyrosinkinázu na buněčné úrovni in vitro i in vivo. Látka selektivně inhibuje proliferaci a indukuje apoptózu u Bcr-Abl pozitivních buněčných linií, stejně jako u čerstvých leukemických buněk od pacientů s CML s pozitivním Philadelphia chromozomem a od pacientů s akutní lymfoblastickou leukemií (ALL).
In vivo byl na zvířecích modelech s Bcr-Abl pozitivními nádorovými buňkami při monoterapii pozorován protinádorový účinek této látky.
Imatinib je také inhibitor receptorů tyrosinkinázy pro růstový faktor destiček - platelet-derived growth factor (PDGF), PDGF-R, faktoru kmenových buněk - stem cell factor (SCF), c-Kit, a inhibuje PDGF-a SCF-zprostředkované buněčné pochody. In vitro, imatinib inhibuje proliferaci a indukuje apoptózu gastrointestinálních stromálních nádorových buněk (GIST), které mají schopnost aktivovat kit mutaci. Konstitutivní aktivace receptorů pro PDGF či Abl proteinu tyrosinkinázy jako následek spojení rozdílných partnerských proteinů či konstitutivní produkce PDGF zřejmě hrají roli v patogenezi MDS/MPD, HES/CEL a DFSP. Imatinib inhibuje signalizaci a proliferaci buněk ovlivňovaných porušenou regulací aktivity PDGFR a Abl kinázy.
Klinické studie u chronické myeloidní leukemie
Účinnost Glivecu je založena na míře celkové hematologické a cytologické odpovědi a doby přežití bez progrese onemocnění. Kromě nově diagnostikované chronické fáze CML nejsou k dispozici kontrolované klinické studie, které by demonstrovaly klinický přínos, jako je zlepšení projevů onemocnění nebo prodloužení přežití.
Tři velké, mezinárodní, otevřené, nekontrolované studie fáze II byly provedeny u pacientů s pozitivním Philadelphia chromozomem (Ph+) s pokročilou CML, blastickou nebo akcelerovanou fází onemocnění, jinými Ph+ leukemiemi nebo s CML v chronické fázi, ale kde selhala předchozí léčba interferonem-alpha (IFN). Jedna velká, otevřená, multicentrická, mezinárodní randomizovaná studie fáze III byla provedena u pacientů s nově diagnostikovanou Ph+ CML. Navíc děti byly léčeny ve dvou studiích fáze I a v jedné studii fáze II.
Ve všech klinických studiích bylo 38-40% pacientů ve věku > 60 let a 10-12% pacientů bylo ve věku > 70 let.
Chronická fáze, nově diagnostikovaná: Studie fáze III u dospělých pacientů srovnávala léčbu Glivecem v monoterapii s kombinovanou léčbou interferonem-alpha (IFN) a cytarabinem (Ara-C). Bylo dovoleno, aby pacienti, u kterých nebylo dosaženo léčebné odpovědi (chybění kompletní hematologické odpovědi (CHR) v 6. měsíci, zvýšení počtu bílých krvinek, bez velké cytogenetické odpovědi (MCyR) ve 24. měsíci), se ztrátou odpovědi (CHR nebo MCyR) nebo se závažnou intolerancí léčby, byli převedeni do alternativního ramene léčby. V rameni s Glivecem byli pacienti léčeni dávkou 400 mg denně. V rameni s IFN byli pacienti léčeni s cílovou dávkou IFN 5 MIU/m2/den subkutánně v kombinaci se subkutánním podáním Ara-C 20 mg/m2/den po 10 dnů/měsíc.
Celkem bylo randomizováno 1 106 pacientů, 553 do každého ramene. Výchozí charakteristiky byly mezi oběma rameny dobře vyvážené. Medián věku byl 51 let (rozmezí 18-70 let), 21,9% pacientů bylo ve věku > 60 let. Bylo zde 59% mužů a 41% žen; 89,9% pacientů bylo bílé pleti a 4,7% černé pleti. Po sedmi letech od zařazení posledního pacienta byl medián trvání léčby v první linii 82 měsíců v rameni s Glivecem a 8 měsíců v rameni s IFN. Medián trvání léčby v druhé linii byl 64 měsíců v rameni s Glivecem. Souhrnně u pacientů,léčených Glivecem v první linii byla průměrná podávaná denní dávka 406 ± 76 mg. Primárním cílovým parametrem účinnosti ve studii bylo přežití bez progrese onemocnění. Progrese byla definována jako jakákoliv z následujících událostí: progrese do akcelerované fáze nebo blastické krize, úmrtí, ztráta CHR nebo MCyR, nebo u pacientů, kteří nedosáhli CHR, zvýšení počtu bílých krvinek navzdory přiměřené léčbě. Velká cytogenetická odpověď, hematologická odpověď, molekulární odpověď (hodnocení minimálního reziduálního onemocnění) doba do akcelerované fáze nebo blastické krize a přežívání jsou hlavními sekundárními cílovými parametry. Údaje o odpovědích jsou uvedeny v Tabulce 2.
Tabulka 2 Odpovědi na léčbu ve studii u nově diagnostikované CML (84měsíční data)
|
(Nejlepší míra odpovědi) |
Glivec n=553 |
IFN+Ara-C n=553 |
|
Hematologická odpověď | ||
|
Míra CHR n (%) |
534 (96,6%)* |
313 (56,6%)* |
|
[95% CI] |
[94,7%, 97,9%] |
[52,4%, 60,8%] |
|
Cytogenetická odpověď | ||
|
Velká odpověď n (%) |
490 (88,6%)* |
129 (23,3%)* |
|
[95% CI] |
[85,7%, 91,1%] |
[19,9%, 27,1%] |
|
Kompletní CyR n (%) |
456 (82,5%)* |
64 (11,6%)* |
|
Parciální CyR n (%) |
34 (6,1%) |
65 (11,8%) |
|
Molekulární odpověď** | ||
|
Velká odpověď ve 12. měsíci (%) |
153/305=50,2% |
8/83=9,6% |
|
Velká odpověď ve 24. měsíci (%) |
73/104=70,2% |
3/12=25% |
|
Velká odpověď v 84. měsíci (%) |
102/116=87,9% |
3/4=75% |
* p<0,001, Fischerův test významnosti
** procenta molekulární odpovědi jsou založená na dostupných vzorcích
Kritéria hematologické odpovědi (všechny odpovědi byly potvrzeny po > 4 týdnech):
Bílé krvinky < 10 x 109/l, krevní destičky < 450 x 109/l, myelocyty+metamyelocyty < 5% v krvi, žádné blasty a promyelocyty v krvi, basofily < 20%, žádné extramedulární postižení Kriteria cytogenetické odpovědi: kompletní (0% Ph+ metafáze), parciální (1-35%), malá (36-65%) nebo minimální (66-95%). Velká odpověď (0-35%) kombinuje obě odpovědi - kompletní a parciální. Kritéria velké molekulární odpovědi: v periferní krvi > 3-logaritmové snížení množství Bcr-Abl transkriptů (měřeno pomocí testu kvantitativní polymerázové řetězové reakce (PCR) reverzní transkriptázy v reálném čase) proti standardizované výchozí hodnotě._
Míra kompletní hematologické odpovědi, velké cytogenetické odpovědi a kompletní cytogenetické odpovědi na první linii léčby byla stanovena použitím Kaplan-Meierova postupu, pro který byly nedosažené odpovědi vyřazeny v den posledního vyšetření. S použitím tohoto postupu se stanovená
kumulativní míra odpovědi v první linii léčby Glivecem zlepšila od 12. měsíce léčby do 84. měsíce léčby následovně: CHR z 96,4% na 98,4% a CCyR z 69,5% na 87,2%.
Při 7letém sledování bylo v rameni s Glivecem 93 (16,8%) příhod progrese: v 37 (6,7%) případech se jednalo o progresi do akcelerované fáze/blastické krize, v 31 (5,6%) o ztrátu MCyR, v 15 (2,7%) o ztrátu CHR nebo zvýšení WBC a v 10 (1,8%) o úmrtí nesouvisejících s CML. Naproti tomu bylo v rameni s IFN+Ara-C 165 (29,8%) příhod, z nichž 130 se vyskytlo během léčby IFN+Ara-C v první linii.
Odhadovaný podíl pacientů bez progrese do akcelerované fáze nebo blastické krize v 84. měsíci byl významně vyšší v rameni s Glivecem ve srovnání s ramenem s IFN (92,5% proti 85,1%, p<0,001). Roční míra progrese do akcelerované fáze nebo blastické krize se v průběhu léčby snižovala a ve čtvrtém a pátém roce byla menší než 1% za rok. Odhadovaná míra přežití bez progrese v 84. měsíci byla 81,2% v rameni s Glivecem a 60,6% u kontrolní skupiny (p<0,001). Roční míra progrese jakéhokoli typu se pro Glivec rovněž snižovala s časem.
Celkem ve skupině s Glivecem zemřelo 71 pacientů (12,8%) a 85 pacientů (15,4%) ve skupině s IFN+Ara-C. V 84. měsíci bylo celkové přežití ve skupině s Glivecem 86,4% (83, 90) oproti 83,3% (80, 87) ve skupině s IFN+Ara-C, (p=0,073, log-rank test). Cílový parametr „doba do výskytu příhody“ je výrazně ovlivněn vysokým podílem převedení z léčby IFN+Ara-C na léčbu Glivecem. Vliv léčby Glivecem na přežití v chronické fázi onemocnění nově diagnostikované CML byl dále zkoumán v retrospektivní analýze výše uvedených údajů o Glivecu s původními údaji z jiné studie fáze III, kde byl použit stejný léčebný režim IFN+Ara-C (n=325). V této retrospektivní analýze byly prokázány lepší výsledky celkového přežití (p<0,001) při podávání Glivecu oproti IFN+Ara-C; během 42 měsíců zemřelo 47 (8,5%) pacientů s Glivecem oproti 63 (19,4%) pacientům s IFN+Ara-C.
U pacientů léčených Glivecem měl stupeň dosažené cytogenetické odpovědi a molekulární odpovědi jednoznačný vliv na dlouhodobé výsledky léčby. Zatímco 96% (93%) pacientů s CCyR (PCyR) ve 12. měsíci, bylo v 84. měsíci bez progrese do akcelerované fáze/blastické krize, bylo bez progrese do pokročilé CML v 84 měsících pouze 81% pacientů bez MCyR ve 12 měsících (p<0,001 celkově, p=0,25 mezi CCyR a PCyR). U pacientů s nejméně 3-log redukcí Bcr-Abl transkriptů ve 12 měsících léčby, byla pravděpodobnost setrvání bez progrese do akcelerované fáze/blastické krize v 84 měsících 99%. Podobná zjištění byla shledána v analýze 18 měsíců léčby.
V této studii bylo povolené zvýšení dávky ze 400 mg denně na 600 mg denně, a potom ze 600 mg denně na 800 mg denně. Po 42 měsících sledování došlo u 11 pacientů k potvrzené ztrátě jejich cytogenetické odpovědi (během 4 týdnů). Z těchto 11 pacientů byla u 4 zvýšena dávka až na 800 mg denně, dva z nich znovu dosáhli cytogenetické odpovědi (jeden částečné a jeden kompletní, ten později dosáhl také molekulární odpovědi). Zatímco u 7 pacientů, kterým nebyla zvýšena dávka, pouze jeden dosáhl kompletní cytogenetické odpovědi. Procento výskytu některých nežádoucích účinků bylo vyšší u 40 pacientů, kterým byla dávka zvýšena na 800 mg denně, ve srovnání s populací pacientů před zvýšením dávky (n=551). Častější nežádoucí účinky zahrnovaly gastrointestinální krvácení, konjunktivitidu a zvýšení transamináz a bilirubinu. Další nežádoucí účinky byly hlášeny s menší nebo se stejnou frekvencí.
Chronická fáze, selhání léčby interferonem: 532 dospělých pacientů bylo léčeno úvodní dávkou 400 mg. Pacienti byli rozděleni do tří hlavních kategorií: hematologické selhání (29%), cytogenetické selhání (35%), nebo intolerance interferonu (36%). Medián doby, po kterou pacienti užívali předchozí léčbu IFN v dávce > 25 x 106 IU/týden, byl 14 měsíců a všichni byli v pozdní chronické fázi, medián doby od diagnózy byl 32 měsíců. Základním parametrem účinnosti ve studii byla míra velké cytogenetické odpovědi (kompletní a parciální odpověď, 0 až 35% Ph+ metafází v kostní dřeni).
V této studii dosáhlo 65% pacientů velké cytogenetické odpovědi, která byla kompletní u 53% (potvrzeno 43%) pacientů (Tabulka 3). Kompletní hematologické odpovědi bylo dosaženo u 95% pacientů.
Akcelerovaná fáze: Do studie bylo zařazeno 235 dospělých pacientů s akcelerovanou fází onemocnění. Léčba prvních 77 pacientů byla zahájena dávkou 400 mg, následně byl protokol doplněn a dovoloval podání vyšších dávek, zahajovací dávka pro zbývajících 158 pacientů byla 600 mg.
Základním parametrem účinnosti byla míra hematologické odpovědi, udávaná jako buď kompletní hematologická odpověď, žádný průkaz leukemie (tj. vymizení blastů z kostní dřeně a krve, ale bez úplné obnovy periferní krve jako při kompletní odpovědi), nebo návrat do chronické fáze CML. Potvrzené hematologické odpovědi bylo dosaženo u 71,5% pacientů (Tabulka 3). Důležité je, že 27,7% pacientů dosáhlo také hlavní cytogenetické odpovědi, která byla kompletní u 20,4% (potvrzena u 16%) pacientů. U pacientů léčených dávkou 600 mg, byl aktuální odhad mediánu přežití bez progrese 22,9 měsíců a celkového přežití 42,5 měsíce.
Myeloidní blastická krize: Do studie bylo zařazeno 260 pacientů s myeloidní blastickou krizí. 95 (37%) pacientů mělo předchozí chemoterapii buď pro akcelerovanou fázi nebo blastickou krizi („předléčení pacienti“), zatímco 165 (63%) pacientů nebylo dosud léčeno („neléčení pacienti“). Léčba prvních 37 pacientů byla zahájena dávkou 400 mg, následně byl protokol doplněn a dovoloval podání vyšších dávek, zahajovací dávka pro zbývajících 223 pacientů byla 600 mg.
Základním parametrem účinnosti, při použití stejných kritérií jako ve studii u akcelerované fáze, byla míra dosažení hematologické odpovědi, popisovaná buď jako kompletní hematologická odpověď, žádný průkaz leukemie, nebo návrat do chronické fáze CML. V této studii dosáhlo 31% pacientů hematologické odpovědi (36% u dříve neléčených pacientů a 22% u dříve léčených pacientů). Míra dosažených odpovědi byla vyšší u pacientů léčených dávkou 600 mg (33%) ve srovnání s pacienty, kteří dostávali dávku 400 mg (16%, p=0,0220). Aktuální odhadovaný medián přežití dříve neléčených pacientů byl 7,7 měsíců a předléčených pacientů byl 4,7 měsíců.
Lymfoidní blastická krize: Do studie fáze I byl zařazen omezený počet pacientů (n=10). Míra dosažené hematologické odpovědi byla 70% s trváním 2-3 měsíce.
Tabulka 3 Odpovědi ve studiích dospělých pacientů s CML
|
Studie 0110 37měsíční data Chronická fáze, IFN selhání (n=532) |
Studie 0109 40,5měsíční data Akcelerovaná fáze (n=235) |
Studie 0102 38měsíční data Myeloidní blastická krize (n=260) | |
|
% pacientů (CI95%) | |||
|
Hematologická odpověď1 Kompletní hematologická odpověď (CHR) Bez průkazu leukemie (NEL) Návrat do chronické fáze (RTC) |
95% (92,3-96,3) 95% Neaplikovatelné Neaplikovatelné |
71% (65,3-77,2) 42% 12% 17% |
31% (25,2-36,8) 8% 5% 18% |
|
Velká cytogenetická odpověď2 Kompletní (Potvrzeno3) [95% CI] Parciální |
65% (61,2-69,5) 53% (43%) [38,6-47,2] 12% |
28% (22,0-33,9) 20% (16%) [11,3-21,0] 7% |
15% (11,2-20,4) 7% (2%) [0,6-4,4] 8% |
|
1 Kritéria hematologické odpovědi (všechny odpovědi byly potvrzeny za > 4 týdny): CHR Studie 0110 [Počet bílých krvinek < 10 x 109/l, krevní destičky < 450 x 109/l, myelocyty+metamyelocyty < 5% v krvi, žádné blasty ani promyelocyty v krvi, basofily < 20%, žádné extramedulární postižení] a ve studiích 0102 a 0109 [ANC > 1,5 x 109/l, krevní destičky > 100 x 109/l, žádné blasty v krvi, BM blasty < 5% a žádné extramedulární postižení] NEL stejná kritéria jako pro CHR ale ANC > 1 x 109/l a destičky > 20 x 109/l (0102 a 0109 pouze) RTC < 15% blastů v BM a PB, < 30% blastů+promyelocytů v BM a PB, < 20% basofilů v PB, žádné jiné extramedulární postižení než ve slezině a játrech (pouze pro 0102 a 0109). BM = Kostní dřeň, PB = periferní krev 2 Kritéria cytogenetické odpovědi: Velká odpověď se skládá jak z kompletní tak i parciální odpovědi: kompletní (0% Ph+ metafáze), parciální (1-35%) 3 Kompletní cytogenetická odpověď potvrzena druhým cytogenetickým hodnocením kostní dřeně provedeným nejméně jeden měsíc po počátečním vyšetření kostní dřeně. | |||
Pediatričtí pacienti: Do studie fáze I zvyšování dávky bylo zahrnuto celkem 26 dětských pacientů ve věku < 18 let buď s chronickou fází CML (n=11) nebo CML v blastické krizi nebo Ph+ akutními leukemiemi (n=15). Byla to populace silně předléčených pacientů, protože 46% bylo dříve léčeno BMT a 73% dostávalo předchozí mnohočetnou chemoterapii. Pacienti byli léčeni dávkami Glivecu 260 mg/m2/den (n=5), 340 mg/m2/den (n=9), 440 mg/m2/den (n=7) a 570 mg/m2/den (n=5). Z 9 pacientů s chronickou fází CML a dostupnými cytogenetickými údaji, dosáhli 4 (44%) kompletní a 3 (33%) parciální cytogenetické odpovědi, míra MCyR 77%.
Do otevřené, multicentrické, jednoramenné studie fáze II bylo zařazeno celkem 51 pediatrických pacientů s nově diagnostikovanou neléčenou CML v chronické fázi. Pacienti byli léčeni Glivecem 340 mg/m2/den bez přerušení při absenci dávku limitující toxicity. Léčba Glivecem vyvolala rychlou odpověď u nově diagnostikovaných dětských pacientů s CML s CHR 78% po 8 týdnech léčby.
Vysoká míra CHR byla doprovázena rozvojem kompletní cytogenetické odpovědi (CCyR) u 65%, což je srovnatelné s výsledky pozorovanými u dospělých pacientů. Dodatečně parciální cytogenetická odpověď (PCyR) byla pozorována u 16%, McyR 81%. U většiny pacientů, kteří dosáhli kompletní cytogenetické odpovědi (CCyR), se CCyR vyvinula mezi 3. a 10. měsícem léčby s mediánem času do dosažení odpovědi 5,6 měsíců podle Kaplan-Meierova odhadu.
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s Glivecem u všech podskupin pediatrické populace s Philadelphia chromozom pozitivní (translokace bcr-abl) chronickou myeloidní leukemií (informace o použití u dětí viz bod 4.2).
Klinické studie u Ph+ ALL
Nově diagnostikovaná Ph+ ALL: V kontrolované studii (ADE10), ve které byl porovnáván imatinib s indukční chemoterapií u 55 nově diagnostikovaných pacientů ve věku 55 let a starších, imatinib podávaný jako monoterapie navodil významně vyšší míru kompletních hematologických odpovědí než chemoterapie (96,3% vs. 50%; p=0,0001). Podání imatinibu jako záchranné terapie pacientům, kteří neodpovídali na chemoterapii nebo jejichž odpověď na chemoterapii byla nedostatečná, vedlo u 9 pacientů (81,8%) z celkového počtu 11 pacientů k dosažení kompletní hematologické odpovědi. Tento klinický účinek byl po 2 týdnech léčby spojen s vyšší redukcí bcr-abl transkriptů u pacientů léčených imatinibem než v rameni s chemoterapií (p=0,02). Po fázi indukce všichni pacienti dostávali imatinib a konsolidační chemoterapii (viz Tabulka 4) a po 8 týdnech byly hladiny bcr-abl transkriptů stejné v obou ramenech. Jak se očekávalo na základě designu studie, nebyl pozorován žádný rozdíl v době trvání remise, v přežití bez známek onemocnění nebo celkovém přežití, ačkoliv pacienti s kompletní molekulární odpovědí a trvajícím minimálním reziduálním onemocněním měli lepší výsledek, pokud šlo o dobu trvání remise (p=0,01) a přežití bez známek onemocnění (p=0,02).
Výsledky pozorované ve skupině 211 nově diagnostikovaných pacientů s Ph+ ALL ve čtyřech nekontrolovaných klinických studiích (AAU02, ADE04, AJP01 a AUS01) jsou shodné s výsledky popsanými výše. Podávání imatinibu v kombinaci s indukční chemoterapií (viz Tabulka 4) vedlo k dosažení kompletní hematologické odpovědi u 93% (147 ze 158 hodnotitelných pacientů) a k dosažení velké cytogenetické odpovědi u 90% (19 z 21 hodnotitelných pacientů). Míra kompletní molekulární odpovědi byla 48% (49 z 102 hodnotitelných pacientů). Ve dvou studiích (AJP01 a AUS01) přežití bez známek onemocnění (DFS) a celkové přežití (OS) konstantně převyšovaly 1 rok a tyto výsledky byly lepší oproti historickým kontrolám. (DFS p<0,001; OS p<0,01).
Tabulka 4 Chemoterapeutický režim užívaný v kombinaci s imatinibem
Studie ADE10
|
Prefáze |
DEX 10 mg/m2 perorálně, den 1-5; CP 200 mg/m2 i.v., den 3, 4, 5; MTX 12 mg intratekálně, den 1 |
|
Indukce remise |
DEX 10 mg/m2 perorálně, den 6-7, 13-16; VCR 1 mg i.v., den 7, 14; IDA 8 mg/m2 i.v. (0,5 h), den 7, 8, 14, 15; CP 500 mg/m2 i.v.(1 h) den 1; Ara-C 60 mg/m2 i.v., den 22-25, 29-32 |
|
Konsolidační terapie I, III, V |
MTX 500 mg/m2 i.v. (24 h), den 1, 15; 6-MP 25 mg/m2 perorálně, den 1-20 |
|
Konsolidační terapie II, IV |
Ara-C 75 mg/m2 i.v. (1 h), den 1-5; VM26 60 mg/m2 i.v. (1 h), den 1-5 |
Studie AAU02
|
Indukční terapie (de novo Ph+ ALL) |
Daunorubicin 30 mg/m2 i.v., den 1-3, 15-16; VCR 2 mg celková dávka i.v., den 1, 8, 15, 22; CP 750 mg/m2 i.v., den 1, 8; Prednison 60 mg/m2 perorálně, den 1-7, 15-21; IDA 9 mg/m2 perorálně, den 1-28; MTX 15 mg intratekálně, den 1, 8, 15, 22; Ara-C 40 mg intratekálně, den 1, 8, 15, 22; Methylprednisolon 40 mg intratekálně, den 1, 8, 15, 22 |
|
Konsolidace (de novo Ph+ ALL) |
Ara-C 1 000 mg/m2/12 h i.v.(3 h), den 1-4; Mitoxantron 10 mg/m2 i.v. den 3-5; MTX 15 mg intratekálně, den 1; Methylprednisolon 40 mg intratekálně, den 1 |
Studie ADE04
|
Prefáze |
DEX 10 mg/m2 perorálně, den 1-5; CP 200 mg/m2 i.v., den 3-5; MTX 15 mg intratekálně, den 1 |
|
Indukční terapie I |
DEX 10 mg/m2 perorálně, den 1-5; VCR 2 mg i.v., den 6, 13, 20; Daunorubicin 45 mg/m2 i.v., den 6-7, 13-14 |
|
Indukční terapie II |
CP 1 g/m2 i.v. (1 h), den 26, 46; Ara-C 75 mg/m2 i.v. (1 h), den 28-31, 35-38, 42-45; 6-MP 60 mg/m2 perorálně, den 26-46 |
|
Konsolidační terapie |
DEX 10 mg/m2 perorálně, den 1-5; vindesin 3 mg/m2 i.v., den 1; MTX 1,5 g/m2 i.v. (24 h), den 1; Etoposid 250 mg/m2 i.v. (1 h) den 4-5; Ara-C 2x 2 g/m2 i.v. (3 h, q 12 h), den 5 |
Studie AJP01
|
Indukční terapie |
CP 1,2 g/m2 i.v. (3 h), den 1; Daunorubicin 60 mg/m2 i.v. (1 h), den 1-3; Vinkristin 1,3 mg/m2 i.v., den 1, 8, 15, 21; Prednisolon 60 mg/m2/den perorálně |
|
Konsolidační terapie |
Alternativní chemoterapeutický postup: vysoká dávka chemoterapie s MTX 1 g/m2 i.v. (24 h), den 1, a Ara-C 2 g/m2 i.v. (q 12 h), den 2-3, po 4 cyklech |
|
Udržovací terapie |
VCR 1,3 g/m2 i.v., den 1; Prednisolon 60 mg/m2 perorálně, den 1-5 |
Studie AUS01
|
Indukční- konsolidační terapie |
Hyper-CVAD režim: CP 300 mg/m2 i.v. (3 h, q 12 h), den 1-3; Vinkristin 2 mg i.v., den 4, 11; Doxorubicin 50 mg/m2 i.v. (24 h), den 4; DEX 40 mg/den po dnech 1-4 a 11-14, střídavě s MTX 1 g/m2 i.v. (24 h), den 1, Ara-C 1 g/m2 i.v. (2 h, q 12 h), den 2-3 (celkově 8 léčebných kúr) |
|
Udržovací terapie |
VCR 2 mg i.v. měsíčně po dobu 13 měsíců; Prednisolon 200 mg perorálně, 5 dnů za měsíc po dobu 13 měsíců |
Všechny léčebné režimy zahrnují podávání kortikosteroidů pro profylaxi postižení CNS
Ara-C: cytosin arabinosid; CP: cyclofosfamid; DEX: dexamethason; MTX: methotrexát; 6-MP 6-merkaptopurin; VM26: teniposid; VCR: vinkristin; IDA: idarubicin; i.v.: intravenózně
Pediatričtí pacienti: Do otevřené, multicentrické, nerandomizované studie I2301 fáze III se sekvenčními kohortami bylo zařazeno celkem 93 pediatrických, dospívajících a mladých dospělých pacientů (od 1 do 22 let věku) s Ph+ ALL, kteří byli léčeni Glivecem (340 mg/m2/den) v kombinaci s intenzivní chemoterapií po indukční terapii. Glivec byl podáván intermitentně v kohortách 1-5 s prodlužujícím se trváním a časnějším zahájením léčby Glivecem; kohorta 1 používala nejnižší intenzitu a kohorta 5 používala nejvyšší intenzitu Glivecu (nejdelší trvání ve dnech s kontinuálním dávkováním Glivecu již během prvních léčebných cyklů chemoterapie). Kontinuální denní časná expozice Glivecem v průběhu léčby v kombinaci s chemoterapií u pacientů v kohortě 5 (n=50) zlepšila 4leté přežití bez událostí (EFS) v porovnání s historickými kontrolami (n=120), které používaly standardní chemoterapii bez Glivecu (69,6 % oproti 31,6 %). Odhadované 4leté celkové přežití v pacientské kohortě 5 bylo 83,6 % v porovnání s 44,8% u historické kontroly. 20 pacientům z 50 (40 %) v kohortě 5 byla provedena transplantace hematopoetických kmenových buněk.
Tabulka 5 Chemoterapeutické režimy používané ve studii I2301 v kombinaci s imatinibem
|
Konsolidační cyklus 1 (3 týdny) |
VP-16 (100 mg/m2/den, IV): dny 1-5 Ifosfamid (1,8 g/m2/den, IV): dny 1-5 MESNA (360 mg/m2/dávka q3h, x 8 dávky/den, IV): dny 1-5 G-CSF (5 gg/kg, SC): dny 6-15 nebo do ANC > 1500 po dosažení nejnižší hodnoty IT léčba methotrexátem (přizpůsobená věku): POUZE den 1 Trojnásobná IT léčba (přizpůsobená věku): den 8, 15 |
|
Konsolidační cyklus 2 (3 týdny) |
Methotrexát (5 g/m2 v průběhu 24 hodin, IV): den 1 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2 a 3 Trojnásobná IT léčba (přizpůsobená věku): den 1 ARA-C (3 g/m2/dávku q 12 h x 4, IV): dny 2 a 3 G-CSF (5 gg/kg, SC): dny 4-13 nebo do ANC > 1500 po dosažení nejnižší hodnoty |
|
Reindukční cyklus 1 (3 týdny) |
VCR (1,5 mg/m2/den, IV): dny 1, 8, a 15 DAUN (45 mg/m2/den jako bolus, IV): dny 1 a 2 CPM (250 mg/m2/dávku q12h x 4 dávky, IV): dny 3 a 4 PEG-ASP (2500 IU/m2, IM): den 4 G-CSF (5 gg/kg, SC): dny 5-14 nebo do ANC > 1500 po dosažení nejnižší hodnoty Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 15 DEX (6 mg/m2/den, PO): dny 1-7 a 15-21 |
|
Intenzifikační cyklus 1 (9 týdnů) |
Methotrexát (5 g/m2 v průběhu 24 hodin, IV): dny 1 a 15 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2, 3, 16, a 17 Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 22 VP-16 (100 mg/m2/den, IV): dny 22-26 CPM (300 mg/m2/den, IV): dny 22-26 MESNA (150 mg/m2/den, IV): dny 22-26 G-CSF (5 gg/kg, SC): dny 27-36 nebo do ANC > 1500 po dosažení nejnižší hodnoty ARA-C (3 g/m2, q12h, IV): dny 43, 44 L-ASP (6000 IU/m2, IM): den 44 |
|
Reindukční cyklus 2 (3 týdny) |
VCR (1,5 mg/m2/den, IV): dny 1, 8 a 15 DAUN (45 mg/m2/den jako bolus, IV): dny 1 a 2 CPM (250 mg/m2/dávku q12h x 4 dávky, iv): dny 3 a 4 PEG-ASP (2500 IU/m2, IM): den 4 G-CSF (5 pg/kg, SC): dny 5-14 nebo do ANC > 1500 po dosažení nejnižší hodnoty Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 15 DEX (6 mg/m2/den, PO): dny 1-7 a 15-21 |
|
Intenzifikační cyklus 2 (9 týdnů) |
Methotrexát (5 g/m2 v průběhu 24 hodin, IV): dny 1 a 15 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2, 3, 16 a 17 Trojnásobná IT léčba (přizpůsobená věku): dny 1 a 22 VP-16 (100 mg/m2/den, IV): dny 22-26 CPM (300 mg/m2/den, IV): dny 22-26 MESNA (150 mg/m2/den, IV): dny 22-26 G-CSF (5 pg/kg, SC): dny 27-36 nebo do ANC > 1500 post nadir ARA-C (3 g/m2, q12h, IV): dny 43, 44 L-ASP (6000 IU/m2, IM): den 44 |
|
Udržovací terapie (8týdenní cykly) Cykly 1-4 |
MTX (5 g/m2 v průběhu 24 hodin, IV): den 1 Leukovorin (75 mg/m2 ve 36. hodině, IV; 15 mg/m2 IV nebo PO q6h x 6 dávek)iii: dny 2 a 3 Trojnásobná IT léčba (přizpůsobená věku): dny 1, 29 VCR (1,5 mg/m2, IV): dny 1, 29 DEX (6 mg/m2/den PO): dny 1-5; 29-33 6-MP (75 mg/m2/den, PO): dny 8-28 Methotrexát (20 mg/m2/týden, PO): dny 8, 15, 22 VP-16 (100 mg/m2, IV): dny 29-33 CPM (300 mg/m2, IV): dny 29-33 MESNA IV dny 29-33 G-CSF (5 pg/kg, SC): dny 34-43 |
|
Udržovací terapie (8týdenní cykly) Cyklus 5 |
Ozařování krania (pouze Blok 5) 12 Gy v 8 frakcích pro všechny pacienty s CNS1 a CNS2 v diagnóze 18 Gy v 10 frakcích pro pacienty s CNS3 v diagnóze VCR (1,5 mg/m2/den, IV): dny 1, 29 DEX (6 mg/m2/den, PO): dny 1-5; 29-33 6-MP (75 mg/m2/den, PO): dny 11-56 (Vysazení 6-MP během 6-10 dní ozařování krania počínaje prvním dnem cyklu 5. Započněte léčbu 6-MP první den po dokončení ozařování krania.) Methotrexát (20 mg/m2/týden, PO): dny 8, 15, 22, 29, 36, 43, 50 |
|
Udržovací terapie (8týdenní cykly) Cykly 6-12 |
VCR (1,5 mg/m2/den, IV): dny 1, 29 DEX (6 mg/m2/den, PO): dny 1-5; 29-33 6-MP (75 mg/m2/den, PO): dny 1-56 Methotrexát (20 mg/m2/týden, PO): dny 1, 8, 15, 22, 29, 36, 43, 50 |
G-CSF = růstový hormon pro granulocytámí řadu leukocytů, VP-16 = etoposid, MTX = methotrexát, IV = intravenózní, SC = subkutánní, IT = intratekální, PO = perorální, IM = intramuskulární, ARA-C = cytarabin, CPM = cyklofosfamid, VCR = vinkristin, DEX = dexamethason, DAUN = daunorubicin, 6-MP = 6-merkaptopurin, E.Coli L-ASP = L-asparagináza, PEG-ASP = PEG asparagináza, MESNA= natrium-2-sulfanylethan -1- sulfonát, iii= nebo pokud je hladina MTX do < 0,1 pM, q6h = každých 6 hodin, Gy= Gray
Studie AIT07 byla multicentrická, otevřená, randomizovaná studie fáze II/III, do které bylo zahrnuto 128 pacientů (1 mladší 18 let věku) léčených imatinibem v kombinaci s chemoterapií. Bezpečnostní data z této studie se zdají být v souladu s bezpečnostním profilem imatinibu u Ph+ ALL pacientů.
Recidivující/refrakterníPh+ ALL: Při podávání imatinibu v monoterapii pacientům s recidivující/refrakterní Ph+ ALL, bylo dosaženo ve skupině 53 hodnotitelných pacientů z celkového počtu 411 pacientů hematologické odpovědi ve 30% (v 9% kompletní) a velké cytogenetické odpovědi ve 23%. (Upozornění - z celkového počtu 411 pacientů bylo 353 pacientů léčeno v rámci programu rozšířeného přístupu k léčbě bez sběru dat primární odpovědi), Medián trvání doby do progrese u celkové populace 411 pacientů s recidivující/refrakterní Ph+ ALL byl v rozmezí mezi
2,6 až 3,1 měsíců, medián doby celkového přežití u 401 hodnotitelných pacientů byl v rozmezí od
4,9 do 9 měsíců. Údaje byly podobné, když byly znovu analyzovány po zahrnutí pouze pacientů ve věku 55 let a starších.
Klinické studie u MDS/MPD
Zkušenosti s Glivecem v této indikaci jsou velmi omezené a jsou založené na míře hematologické a cytogenetické odpovědi. Neexistují žádné kontrolované studie, které by prokázaly klinický prospěch nebo zvýšené přežití. V otevřené, multicentrické klinické studii fáze II (study B2225) byl Glivec zkoušen u různých populací pacientů s život ohrožujícími onemocněními spojenými s aktivitou Abl, Kit nebo PDGFR tyrosinkináz. Do této studie bylo zařazeno 7 pacientů s MDS/MPD, kteří byli léčeni Glivecem 400 mg denně. U tří pacientů byla přítomna kompletní hematologická odpověď (CHR) a jeden pacient dosáhl parciální hematologické odpovědi (PHR). V době původní analýzy tři ze čtyř pacientů s detekovanými mutacemi genu PDGFR dosáhli hematologické odpovědi (2 CHR a 1 PHR). Věk těchto pacientů byl v rozmezí od 20 do 72 let. Ve 13 publikacích bylo hlášeno dalších 24 pacientů s MDS/MPD. 21 pacientů bylo léčeno Glivecem 400 mg denně, zatímco další 3 pacienti byli léčeni nižšími dávkami. U 11 pacientů byla zjištěna změna genu PDGFR, 9 z nich dosáhlo CHR a 1 PHR. Věk těchto pacientů byl v rozmezí od 2 do 79 let. V poslední uveřejněné aktualizované informaci bylo uvedeno, že 6 z těchto 11 pacientů zůstalo v cytogenetické remisi (v rozmezí 32-38 měsíců). Ve stejné publikaci byly uvedeny údaje dlouhodobého sledování 12 pacientů s MDS/MPD s mutací genu PDGFR (5 pacientů ze studie B2225). Tito pacienti byli léčeni Glivecem v mediánu 47 měsíců (v rozmezí 24 dnů - 60 měsíců). U 6 pacientů přesáhlo nyní sledování 4 roky. Jedenáct pacientů dosáhlo rychlé CHR; deset dosáhlo kompletního vymizení cytogenetických abnormalit a dle měření RT-PCR snížení nebo vymizení fúzních transkriptů. Hematologické odpovědi byly zachovány v mediánu 49 měsíců (v rozmezí 19-60) a cytogenetické odpovědi v mediánu 47 měsíců (v rozmezí 16-59). Celkové přežití bylo 65 měsíců od stanovení diagnózy (v rozmezí 25-234). Podávání Glivecu pacientům bez genetické translokace obecně nevede k žádnému zlepšení.
U pediatrických pacientů s MDS/MPD nebyly provedeny kontrolované klinické studie. Ve 4 publikacích bylo hlášeno pět (5) pacientů s MDS/MPD spojenými s přestavbou genu PDGFR. Věk těchto pacientů se pohyboval v rozmezí 3 měsíce až 4 roky a imatinib byl podáván v dávce 50 mg denně nebo v dávkách v rozmezí 92,5 až 340 mg/m2 denně. Všichni pacienti dosáhli kompletní hematologické odpovědi, cytogenetické odpovědi a/nebo klinické odpovědi.
Klinické studie u HES/CEL
V otevřené, multicentrické klinické studii fáze II (studie B2225) byl Glivec zkoušen u různých populací pacientů s život ohrožujícími onemocněními spojenými s aktivitou Abl, Kit nebo PDGFR tyrosinkináz. V této studii 14 pacientů s HES/CEL bylo léčeno Glivecem 100 mg až 1 000 mg denně. Dalších 162 pacientů s HES/CEL uvedených ve 35 zveřejněných kazuistikách bylo léčeno Glivecem v dávkách 75 mg až 800 mg denně. Cytogenetické abnormality byly hodnoceny u 117 z celkové populace 176 pacientů. U 61 pacientů z těchto 117 byla zjištěna fuzní kináza FIP1L1-PDGFRa. Ve třech dalších publikovaných kazuistikách byli uvedeni čtyři pacienti s HES s pozitivní fuzní kinázou FIP1L1-PDGFRa. Všech 65 pacientů s pozitivní fuzní kinázou FIP1L1-PDGFRa dosáhlo CHR, která se udržela po dobu několika měsíců (v rozmezí 1+ až 44+ měsíců, cenzorováno v době hlášení). Podle posledních publikovaných hlášení 21 z těchto 65 pacientů také dosáhlo kompletní molekulární remise s mediánem délky sledování 28 měsíců (v rozmezí 13-67 měsíců). Věk těchto pacientů byl v rozmezí od 25 do 72 let.Dodatečně bylo investigátory hlášeno v kazuistikách symptomatologické zlepšení a zlepšení dysfunkcí dalších orgánů. Zlepšení byla hlášena u poruch funkce srdeční, nervové, kožní/podkožní, respirační/hrudní/mediastinální, muskuloskeletální/pojivové/vaskulámí a gastrointestinální orgánové soustavy.
U pediatrických pacientů s HES/CEL nebyly provedeny kontrolované klinické studie. Ve 3 publikacích byli hlášeni tři (3) pacienti s HES/CEL spojenými s přestavbou genu PDGFR. Věk těchto pacientů se pohyboval v rozmezí 2 až 16 let a imatinib byl podáván v dávce 300 mg/m2 denně anebo v dávkách v rozmezí 200 až 400 mg denně. Všichni pacienti dosáhli kompletní hematologické odpovědi, kompletní cytogenetické odpovědi a/nebo kompletní klinické odpovědi.
Klinické studie u pacientů s inoperabilním a/nebo metastatickým GIST
Jedna otevřená, randomizovaná nekontrolovaná mezinárodní studie fáze II byla provedena u pacientů s inoperabilním nebo metastatickým maligním gastrointestinálním stromálním nádorem (GIST). Do studie bylo zařazeno 147 pacientů a randomizováno užívat buď 400 mg nebo 600 mg jednou denně perorálně po dobu až 36 měsíců. Tito pacienti byli ve věku od 18 až 83 let a byla u nich stanovena diagnóza Kit-pozitivní maligní GIST, který byl inoperabilní a/nebo metastazující. Rutinně bylo prováděno imunohistochemické vyšetření pomocí Kit protilátek (A-4502, králičí polyklonální antisérum, 1:100; DAKO Corporation, Carpinteria, CA) metodou nalezení antigenu podle analýzy avidin-biotin-peroxidázového komplexu.
Primární průkaz účinnosti byl založen na míře objektivní odpovědi. U nádorů byla vyžadována měřitelnost v alespoň jednom ložisku onemocnění a charakter odpovědi byl založen na kriteriích Southwestern Oncology Group (SWOG). Výsledky jsou uvedeny v Tabulce 6.
Tabulka 6 Nejlepší odpovědi nádoru ve studii STIB2222 (GIST)
|
Nejlepší odpověď |
Všechny dávky (n=147) 400 mg (n=73) 600 mg (n=74) n (%) |
|
Kompletní odpověď |
1 (0,7) |
|
Parciální odpověď |
98 (66,7) |
|
Stabilní onemocnění |
23 (15,6) |
|
Progresivní onemocnění |
18 (12,2) |
|
Nehodnotitelé |
5 (3,4) |
|
Neznámo |
2 (1,4) |
Nebyly nalezeny rozdíly v míře odpovědí mezi dvěma skupinami s rozdílným dávkováním. Významný počet pacientů, kteří měli stabilní onemocnění v době interim analýzy, dosáhl částečné odpovědi při delší léčbě (medián doby sledování 31 měsíců). Medián času do odpovědi byl 13 týdnů (95% CI 1223). Medián času do selhání léčby u pacientů s odpovědí byl 122 týdnů (95% CI 106-147), zatímco v celé studijní populaci to byly 84 týdny (95% CI 71-109). Medián celkového přežití nebyl dosažen. Odhad pro přežití po 36 měsících sledování podle Kaplan-Meiera je 68%.
Ve dvou klinických studiích (studie B2222 a studie S0033) byla denní dávka Glivecu zvyšována na 800 mg u pacientů, u kterých onemocnění progredovalo při nižších denních dávkách 400 nebo 600 mg. Denní dávka byla zvýšena na 800 mg u celkově 103 pacientů; 6 pacientů dosáhlo po zvýšení dávky částečné odpovědi a u 21 pacientů došlo ke stabilizaci onemocnění, což představuje klinický prospěch 26%. Z dostupných bezpečnostních dat nevyplývá, že by zvýšení dávky na 800 mg denně u pacientů s progresí onemocnění při nižších dávkách 400 mg nebo 600 mg denně mělo vliv na bezpečnostní profil Glivecu.
Klinické studie u adjuvantní léčby GIST
Glivec byl studován v adjuvantní léčbě v multicentrické, dvojitě slepé, prospektivní, placebem kontrolované studii fáze III (Z9001), která zahrnovala 773 pacientů. Věkové rozmezí pacientů bylo 18 až 91 let. Byli zařazeni pacienti s histologickou diagnózou primárního GIST s imunochemicky potvrzenou expresí Kit proteinu a velikostí nádoru > 3 cm v maximálním rozměru, s úplnou makroskopickou resekcí primárního GIST během 14-70 dnů před zařazením do studie. Po resekci primárního GIST byli pacienti randomizováni do jednoho ze dvou ramen: Glivec podávaný v dávkách 400 mg/den nebo odpovídající placebo po dobu jednoho roku.
Primárním cílovým parametrem studie bylo přežití bez návratu onemocnění (RFS) definované jako doba od data randomizace do data návratu onemocnění nebo smrti z jakékoli příčiny.
Glivec významně prodloužil RFS, ve skupině s Glivecem bylo po dobu 38 měsíců bez návratu onemocnění 75% pacientů, oproti 20 měsícům u pacientů ve skupině s placebem (95% CI, [30-nelze určit]; respektive[14-nelze určit]); (relativní riziko = 0,398 [0,259 - 0,610], p< 0,0001). Po jednom roce byl celkový RFS významně lepší pro Glivec (97,7%) oproti placebu (82,3%), (p< 0,0001). Riziko recidivy onemocnění tak bylo sníženo o přibližně 89% v porovnání s placebem (relativní riziko = 0,113 [0,049 - 0,264]).
Riziko recidivy u pacientů po operaci primárního GIST nádoru bylo retrospektivně vyhodnoceno na základě těchto prognostických faktorů: velikost nádoru, mitotický index, umístění nádoru. Hodnoty mitotického indexu byly dostupné pro 556 ze 713 pacientů intention-to-treat (ITT) populace.
Výsledky analýzy podskupin podle klasifikace rizika Národního ústavu zdraví USA (NIH) a Ústavu patologie ozbrojených sil USA (AFIP) jsou shrnuty v Tabulce 7. Nebyl pozorován přínos ve skupině s nízkým a velmi nízkým rizikem. Nebyl pozorován přínos pro celkové přežití.
Tabulka 7 Souhrn analýz RFS studie Z9001podle klasifikace rizika NIH and AFIP
|
Kritéri a rizika |
Stupeň rizika |
% pacientů |
Počet příhod / Počet pacientů |
Celkové relativní riziko (95 %CI)* |
Míra RFS (%) | |
|
12 měsíců |
24 měsíců | |||||
|
Glivec vs placebo |
Glivec vs placebo |
Glivec vs placebo | ||||
|
Nízké |
29,5 |
0/86 vs. 2/90 |
N.E. |
100 vs. 98,7 |
100 vs. 95,5 | |
|
NIH |
Střední |
25,7 |
4/75 vs. 6/78 |
0,59 (0,17; 2,10) |
100 vs. 94,8 |
97,8 vs. 89,5 |
|
Vysoké |
44,8 |
21/140 vs. 51/127 |
0,29 (0,18; 0,49) |
94,8 vs. 64,0 |
80,7 vs. 46,6 | |
|
Velmi nízké |
20,7 |
0/52 vs. 2/63 |
N.E. |
100 vs. 98,1 |
100 vs. 93,0 | |
|
Nízké |
25,0 |
2/70 vs. 0/69 |
N.E. |
100 vs. 100 |
97,8 vs. 100 | |
|
AFIP |
Střední |
24,6 |
2/70 vs. 11/67 |
0,16 (0,03; 0,70) |
97,9 vs. 90,8 |
97,9 vs. 73,3 |
|
Vysoké |
29,7 |
16/84 vs. 39/81 |
0,27 (0,15; 0,48) |
98,7 vs. 56,1 |
79,9 vs. 41,5 | |
|
* včetně follow-up periody; NE - ne |
ze určit | |||||
Druhá multicentrická otevřená studie fáze III (SSG XVIII/AIO) porovnávala výsledky léčby Glivecem v dávce 400 mg/den po dobu 12 měsíců oproti 36 měsícům u pacientů po chirurgické resekci GIST a s jedním z následujících parametrů: průměr tumoru > 5 cm a počet mitóz > 5/50 zorných polí ve velkém zvětšení (high power fields, HPF) nebo průměr tumoru > 10 cm a jakýkoli počet mitóz nebo tumor jakékoli velikosti s počtem mitóz > 10/50 HPF nebo tumory s rupturou do peritonální dutiny. Ve studii bylo randomizováno a informovaný souhlas podepsalo celkem 397 pacientů (199 pacientů v rameni s 12měsíční léčbou a 198 pacientů v rameni s 36měsíční léčbou), jejichž průměrný věk byl 61 let (rozmezí 22 až 84 let). Medián doby sledování byl 54 měsíců (od data randomizace do data ukončení), s celkovou dobou 83 měsíců mezi prvním randomizovaným pacientem a ukončením studie.
Primárním cílovým parametrem účinnosti studie bylo přežití bez návratu onemocnění (RFS) definované jako doba od data randomizace do data návratu onemocnění nebo smrti z jakékoli příčiny.
36měsíční léčba Glivecem významně prodlužila RFS oproti 12měsíční léčbě Glivecem (s celkovým poměrem rizik (HR) = 0,46 [0,32, 0,65], p<0,0001) (Tabulka 8, Obrázek 1).
Třicet šest (36) měsíců léčby Glivecem významně prodloužilo celkové přežití (OS) v porovnání s 12 měsíci léčby Glivecem (HR = 0,45 [0,22; 0,89], p=0,0187) (Tabulka 8, Obrázek 2).
Déletrvající léčba (> 36 měsíců) může prodloužit dobu do výskytu dalších recidiv; vliv těchto zjištění na celkové přežití nicméně zůstává neznámý.
Celkový počet úmrtí byl 25 v rameni s 12měsíční léčbou a 12 v rameni s 36měsíční léčbou.
36měsíční léčbou imatinibem bylo dosaženo lepších výsledků oproti 12měsíční léčbě v ITT analýze, tj. zahrnující celou studijní populaci. V plánované analýze podskupin podle typu mutace byl poměr rizika přežití bez rekurence pro 36měsíční léčbu pacientů s mutací exonu 11 0,35 [95% CI: 0,22,
0,56]. Pro jiné podskupiny s méně častými mutacemi nelze z důvodu nízkého počtu sledovaných případů vyvodit žádné závěry.
Tabulka 8 12měsíční a 36měsíční léčba Glivecem (studie SSGXVIII/AIO)
|
rameno s 12měsíční léčbou |
rameno s 36měsíční léčbou | |
|
’S |
%(CI) |
%(CI) |
|
12 měsíců |
93,7 (89,2-96,4) |
95,9 (91,9-97,9) |
|
24 měsíců |
75,4 (68,6-81,0) |
90,7 (85,6-94,0) |
|
36 měsíců |
60,1 (52,5-66,9) |
86,6 (80,8-90,8) |
|
48 měsíců |
52,3 (44,0-59,8) |
78,3 (70,8-84,1) |
|
60 měsíců ežití |
47,9 (39,0-56,3) |
65,6 (56,1-73,4) |
|
36 měsíců |
94,0 (89,5-96,7) |
96,3 (92,4-98,2) |
|
48 měsícůs |
87,9 (81,1-92,3) |
95,6 (91,2-97,8) |
|
60 měsíců |
81,7 (73,0-87,8) |
92,0 (85,3-95,7) |
Obrázek 1 Odhad primárního přežití bez návratu onemocnění podle Kaplan-Meiera (ITT populace)
>(D
C
O
o

V riziku: Události
(1) 199:0 182:8 177:12 163:25 137:46 105:65 88:72 61:77 49:81 36:83 27:84 14:84 10:84 2:84 0:84
(2) 198:0 189:5 184:8 181:11 173:18 152:22 133:25 102:29 82:35 54:46 39:47 21:49 8:50 0:50
Obrázek 2 Odhad celkového přežití podle Kaplan-Meiera (ITT populace)

Doba přežití v měsících
|
V riziku: Události (1) 199:0 190:2 |
188:2 |
183:6 |
176:8 |
156:10 |
140:11 |
105:14 |
87:18 |
64:22 |
46:23 |
27:25 |
20:25 |
2:25 0:25 |
|
(2) 198:0 196:0 |
192:0 |
187:4 |
184:5 |
164:7 |
152:7 |
119:8 |
100:8 |
76:10 |
56:11 |
31:11 |
13:12 |
0:12 |
U pediatrických pacientů s c-Kit pozitivním GIST nebyly provedeny kontrolované klinické studie.
V 7 publikacích bylo hlášeno sedmnáct (17) pacientů s GIST (s Kit nebo bez Kit a s mutacemi PDGFR nebo bez mutací PDGFR). Věk těchto pacientů se pohyboval v rozmezí 8 až 18 let a imatinib byl podáván adjuvantně i pro metastatické onemocnění v dávkách v rozmezí 300 až 800 mg denně.
U většiny léčených pacientů s GIST nebyla k dispozici data potvrzující c-kit nebo mutace PDGFR, což mohlo vést k různým klinickým výsledkům.
Klinické studie u DFSP
Byla provedena otevřená, multicentrická klinická studie fáze II (studie B2225) zahrnující 12 pacientů s DFSP léčených Glivecem 800 mg denně. Věk pacientů s DFSP byl v rozmezí 23 až 75 roků; DFSP byl metastatický, lokálně recidivující po primárním chirurgickém vynětí a v době zařazení do studie vyhodnocen jako inoperabilní.Primární důkaz účinnosti byl založen na míře objektivní odpovědi.
Z 12 zařazených pacientů jich 9 odpovědělo: 1 kompletně a 8 parciálně. Tři pacienti s parciální odpovědí byli následně po provedené operaci interpretováni jako bez známek onemocnění. Medián doby trvání léčby ve studii B2225 byl 6,2 měsíce, s maximem doby trvání 24,3 měsíců. Dalších 6 pacientů s DFSP léčených Glivecem bylo publikováno v 5 kazuistikách, věk těchto pacientů byl v rozmezí 18 měsíců až 49 let. Dospělí pacienti uvedení v publikované literatuře byli léčeni dávkou Glivecu buď 400 mg (4 případy) nebo 800 mg (1 případ) denně. Odpovědělo pět (5) pacientů,
3 kompletně a 2 parciálně. Medián doby trvání léčby v publikované literatuře je v rozmezí 4 týdnů až více než 20 měsíců. Translokace t(17:22)[(q22:q13)] nebo její genový produkt byl přítomen téměř u všech pacientů odpovídajících na léčbu Glivecem.
U pediatrických pacientů s DFSP nebyly provedeny kontrolované klinické studie. Ve 3 publikacích bylo hlášeno pět (5) pacientů s DFSP a přestavbou PDGFR genu. Věk pacientů se pohyboval od narození do 14 let a imatinib byl podáván v dávce 50 mg denně nebo v dávkách v rozmezí 400 až 520 mg/m2 denně. Všichni pacienti dosáhli částečné a/nebo kompletní odpovědi.
5.2 Farmakokinetické vlastnosti
Farmakokinetika Glivecu
Farmakokinetika Glivecu byla hodnocena v rozmezí dávek 25 až 1 000 mg. Farmakokinetický profil léku v plazmě byl analyzován 1., 7. nebo 28. den, kdy koncentrace v plazmě dosáhla rovnovážného stavu.
Absorpce
Průměrná absolutní biologická dostupnost imatinibu byla 98%. Po perorálním podání byla mezi pacienty vysoká variabilita v hladinách AUC imatinibu v plazmě. Při podání léku s tučným jídlem, byla míra absorpce imatinibu snížena jen minimálně (11% snížení Cmax a prodloužení tnax o 1,5 h), s malým zmenšením AUC (7,4%), ve srovnání s podáním nalačno. Ovlivnění absorpce léku předchozí gastrointestinální operací nebylo studováno.
Distribuce
V klinicky relevantních koncentracích imatinibu došlo v pokusech in vitro k vazbě na plazmatické proteiny přibližně v 95%, převážně na albumin a alfa-1- kyselý-glykoprotein, s malou vazbou na lipoproteiny.
Biotransformace
Hlavním cirkulujícím metabolitem je u člověka N-demethylovaný derivát piperazinu, který měl in vitro podobnou účinnost jako mateřská látka. Zjištěná plazmatická AUC tohoto metabolitu byla pouze 16% AUC imatinibu. Vazba N-demetylovaného metabolitu na plazmatické bílkoviny je podobná vazebné schopnosti mateřské látky.
Imatinib a N-demethylovaný metabolit činily dohromady přibližně 65% cirkulující radioaktivity (AUC(0.48h}). Zbývající cirkulující radioaktivita byla tvořena množstvím minoritních metabolitů.
Výsledky studií in vitro ukázaly, že CYP3A4 je u lidí hlavním enzymem cytochromu P450, který katalyzuje biotransformaci imatinibu. Z řady potenciálně souběžně podávaných léků (paracetamol, aciklovir, alopurinol, amfotericin, cytarabin, erytromycin, flukonazol, hydroxyurea, norfloxacin, penicillin V) pouze erytromycin (IC50 5 0 ^M) a flukonazol (IC50 118 ^M) inhibovaly metabolismus imatinibu v rozsahu, který by mohl být klinicky významný.
In vitro bylo zjištěno, že imatinib je kompetitivním inhibitorem markrových substrátů pro CYP2C9, CYP2D6 a CYP3A4/5. Ki hodnoty v lidských jaterních mikrosomech byly 27, 7,5 a 7,9 ^mol/l. Maximální plazmatické koncentrace imatinibu u pacientů jsou 2-4 ^.mol/l, tudíž je možná inhibice metabolismu zprostředkovaného CYP2D6 a/nebo CYP3A4/5 souběžně podávaných léků. Imatinib neinterferuje s biotranformací 5-fluorouracilu, ale inhibuje metabolismus paklitaxelu, což je výsledkem kompetitivní inhibice CYP2C8 (Ki = 34,7 ^M). Odpovídající hodnota Ki je daleko vyšší než očekávané plazmatické hladiny imatinibu u pacientů a tudíž se neočekávají interakce při souběžném podávání 5-fluorouracilu nebo paklitaxelu a imatinibu.
Eliminace z organismu
Na základě sledování vylučování radioaktivních sloučenin(y) po perorálním podání 14C-značeného imatinibu bylo přibližně 81% dávky nalezeno v průběhu 7 dnů ve stolici (68% dávky) a v moči (13% dávky). V nezměněné formě bylo vyloučeno 25% dávky (5% močí, 20% stolicí), zbytek činily metabolity.
Farmakokinetika v plazmě
Po perorálním podání zdravým dobrovolníkům byl t./2 přibližně 18 hodin, to znamená, že podávání jednou denně je dostačující. Zvyšování průměrné hodnoty AUC se stoupající dávkou bylo lineární a závislé na dávce v rozmezí dávek 25-1 000 mg imatinibu po perorálním podání. Po opakovaném podání nebyly při dávkování jednou denně nalezeny změny v kinetice imatinibu a akumulace v rovnovážném stavu činila 1,5-2,5násobek.
Farmakokinetika u pacientů s GIST
U pacientů s GIST byla v rovnovážném stavu při stejné dávce (400 mg denně) 1,5krát vyšší expozice než ta, která byla pozorována u pacientů s CML. Na základě předběžné analýzy farmakokinetiky v populaci pacientů s GIST zde byly nalezeny tři proměnné (albumin, bílé krvinky a bilirubin), které měly statisticky významnou souvislost s farmakokinetikou imatinibu. Snížení hodnot albuminu bylo příčinou poklesu clearance (CL/f); a vyšší hodnoty počtu bílých krvinek vedly ke snížení CL/f. Tato souvislost však není dostatečně výrazná, aby opravňovala k úpravě dávkování. V této skupině pacientů by mohla přítomnost metastáz v játrech mít za následek jaterní insuficienci a redukci metabolismu.
Populační farmakokinetika
Na základě analýzy farmakokinetiky v populaci pacientů s CML bylo zjištěno, že věk jen málo ovlivnil distribuční objem (12% zvýšení u pacientů starších > 65 let). Tyto změny nejsou považovány za klinicky významné. Vliv tělesné hmotnosti na clearance imatinibu je následující: u pacientů s tělesnou hmotností 50 kg je možné očekávat průměrnou clearance 8,5 l/h, zatímco u pacientů vážících 100 kg clearance stoupne na 11,8 l/h. Tyto změny nejsou dostačující, aby opravňovaly k úpravě dávkování podle hmotnosti. V kinetice imatinibu není rozdíl mezi muži a ženami.
Farmakokinetika u dětí
Obdobně jako u dospělých pacientů byl imatinib po perorálním podání rychle absorbován i u dětských pacientů ve studii fáze I i fáze II. Dávkami 260 a 340 mg/m2/den bylo u dětí dosaženo stejné účinnosti jako u dospělých dávkami 400 mg a 600 mg. Při srovnání AUC(0-24) 8. den s 1. dnem při dávce 340 mg/m2/den hladina ukázala 1,7násobnou akumulaci léku po opakovaném podávání jednou denně.
Na základě poolovaných farmakokinetických analýz populací pediatrických pacientů s hematologickými poruchami (CML, Ph+ALL, nebo jinými hematologickými poruchami léčenými imatinibem) roste clearance imatinibu se zvyšujícím se povrchem těla (BSA). Po úpravě vlivu BSA neměly další demografické ukazatele, jako je věk, tělesná hmotnost a body mass index, klinicky významný vliv na expozici imatinibem. Analýzy potvrdily, že expozice imatinibem u pediatrických pacientů užívajících 260 mg/m2 jednou denně (nepřevyšující 400 mg jednou denně) nebo 340 mg/m2 jednou denně (nepřevyšující 600 mg jednou denně) byly podobné jako u dospělých pacientů, kteří užívali imatinib v dávce 400 mg nebo 600 mg jednou denně.
Zhoršená funkce orgánů
Imatinib a jeho metabolity nejsou ve významném množství vylučovány ledvinami. U pacientů s mírnou a středně závažnou nedostatečností renální funkce se ukázalo, že mají vyšší plazmatickou expozici než pacienti s normální funkcí ledvin. Zvýšení je přibližně 1,5- až 2násobné, což odpovídá 1,5násobku zvýšení plazmatického AGP, na který se imatinib silně váže. Clearance volného imatinibu je pravděpodobně obdobná u pacientů s renální nedostatečností a u pacientů s normální funkcí ledvin vzhledem k tomu, že vylučování ledvinami představuje pouze vedlejší cestu eliminace imatinibu (viz bod 4.2 a 4.4).
Ačkoli výsledky farmakokinetických analýz ukázaly, že je zde značný rozdíl mezi jedinci, střední expozice imatinibu se nezvýšila u pacientů s různými stupni dysfunkce jater ve srovnání s pacienty s normální funkcí jater (viz body 4.2, 4.4 a 4.8).
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinický profil bezpečnosti imatinibu byl stanoven na potkanech, psech, opicích a králících.
Při studiu toxicity po opakovaném podání byly pozorovány mírné až středně závažné hematologické změny u potkanů, psů, a opic doprovázené změnami v kostní dřeni u potkanů a psů.
U potkanů a psů byly cílovým orgánem játra. U obou druhů zvířat bylo pozorováno mírné až střední zvýšení transamináz a mírný pokles cholesterolu, triglyceridů, celkových proteinů a hladiny albuminu. V játrech potkanů nebyly nalezeny žádné histopatologické změny. Závažné toxické změny se zvýšením jaterních enzymů, hepatocelulární nekrózou, nekrózou žlučových cest a hyperplazií žlučovodu byly pozorovány u psů léčených po 2 týdny.
U opic byla po dvou týdnech léčby pozorována nefrotoxicita, s ložiskovou mineralizací a dilatací renálních tubulů a tubulární nefrózou. U několika zvířat bylo pozorováno zvýšení urey v krvi (BUN) a kreatininu. U potkanů byla po dávkách > 6 mg/kg ve 13týdenní studii pozorována hyperplazie přechodového epitelu renální papily a močového měchýře, beze změn parametrů v séru nebo moči. Při chronické léčbě imatinibem byl pozorován četnější výskyt oportunních infekcí.
Ve 39týdenní studii u opic nebyla při nejnižší dávce 15 mg/kg, odpovídající přibližně jedné třetině maximální humánní dávky 800 mg stanovené podle tělesného povrchu, stanovena hladina bez nežádoucích účinků -NOAEL (No Observed Adverse Effect Level). U těchto zvířat došlo ke zhoršení normálně potlačené malárie.
Ve studiích in vitro na bakteriálních buňkách (Amesův test), na savčích buňkách (myší lymfomové buňky) ani ve studiích in vivo u potkanů mikronukleárním testem nebyla zjištěna genotoxicita imatinibu. Pozitivní genotoxický účinek imatinibu byl zjištěn v testu in vitro na savčích buňkách (ovariální buňky křečka čínského) na klastogenicitu (chromozomální aberaci) za přítomnosti metabolické aktivace. Dva meziprodukty výrobního procesu, které jsou také přítomny ve finálním výrobku, měly pozitivní Amesův test na mutagenicitu. Jeden z těchto meziproduktů byl také pozitivní při testování na myších lymfomových buňkách.
Ve studii fertility byla potkaním samcům po dobu 70 dnů před připuštěním podávána dávka 60 mg/kg, která přibližně odpovídá maximální klinické dávce 800 mg/den, stanovené podle tělesného povrchu. Byl zjištěn úbytek hmotnosti varlat a nadvarlat a sníženo procento pohyblivých spermií. Tento účinek nebyl pozorován při dávce < 20 mg/kg. Mírné až střední snížení spermatogeneze bylo také pozorováno u psů po perorálních dávkách > 30 mg/kg. Pokud byl imatinib podáván samicím potkanů 14 dnů před připuštěním a až do 6. dne březosti nebylo ovlivněno ani zabřeznutí ani počet březích samic. Po podávání dávky 60 mg/kg, došlo u samic potkanů k významným postimplantačním ztrátám plodů a snížení počtu živých plodů. Tento účinek nebyl pozorován v dávkách < 20 mg/kg.
Ve studii pre a postnatálního vývoje u potkanů po perorálním podání 45 mg/kg/den byl 14. nebo 15. den zabřeznutí pozorován rudý výtok z vagíny. Při stejné dávce stoupnul počet mrtvě narozených mláďat stejně jako počet uhynulých po narození mezi 0. až 4. dnem. U mláďat z vrhu F1, byla při stejné dávce nižší průměrná tělesná hmotnost od narození až do usmrcení a počet mláďat ve vrhu byl také snížen. Fertilita F1 nebyla ovlivněna po dávce 45 mg/kg/den, zatímco počet resorbovaných plodů stoupl a klesl počet živě narozených mláďat. Dle hodnocení No Observed Effect Level (NOEL) byla pro mateřská zvířata a F1 generaci mláďat bezpečná dávka 15 mg/kg/den (jedna čtvrtina maximální lidské dávky 800 mg).
Imatinib byl teratogenní, pokud byl podáván potkanům během organogeneze v dávkách > 100 mg/kg, přibližně odpovídající maximální klinické dávce 800 mg/den, stanovené podle tělesného povrchu. Teratogenní účinky zahrnovaly exencefalii nebo encefalokelu, absenci nebo redukci frontálních kostí a absenci parietálních kostí. Tyto účinky nebyly pozorovány při dávkách < 30 mg/kg.
V toxikologické studii zaměřené na juvenilní vývoj potkanů (den 10 až 70 post partum) nebyly zjištěné nové cílové orgány ve srovnání se zjištěnými cílovými orgány u dospělých potkanů.
V toxikologické studii zaměřené na juvenilní jedince byly pozorovány účinky na růst, zpoždění otevření vaginy a oddělení předkožky při přibližně 0,3 až 2násobku průměrné pediatrické expozice při nejvyšší doporučené dávce 340 mg/m2. Dále byla u juvenilních zvířat (ve fázi odstavení) zjištěna mortalita při přibližně 2násobku průměrné pediatrické expozice při nejvyšší doporučené dávce
340 mg/m2.
Výsledky 2leté studie kancerogenity u potkanů, kterým byl podáván imatinib v dávce 15, 30 a 60 mg/kg/den ukázaly statisticky významné snížení délky života u samců při dávce 60 mg/kg/den a u samic při dávce > 30 mg/kg/den. Histopatologická vyšetření jako hlavní příčinu smrti nebo důvodu pro utracení zvířat odhalily kardiomyopatii (u obou pohlaví), chronickou progresivní nefropatii (u samic) a papilomy předkožkové žlázky. Cílovými orgány, pokud se týká neoplastických změn, byly ledviny, močový měchýř, uretra, předkožková a klitoridální žlázka, tenké střevo, příštítná tělíska, nadledvinky a nesekretorická část žaludeční stěny.
Byly zaznamenány případy vzniku papilomů/karcinomů předkožkové/klitoridální žlázky při dávce od 30 mg/kg/den a více, což reprezentuje přibližně 0,5násobek dávky 400 mg/den běžně užívané u člověka (podle AUC), nebo 0,3násobek dávky 800 mg/den užívané u člověka, a 0,4násobek dávky 340 mg/m2/den u dětí (podle AUC). Dle hodnocení No Observed Effect Level (NOEL) byla bezpečná dávka 15 mg/kg/den. Renální adenom/karcinom a papilom močového měchýře a uretry, adenokarcinomy tenkého střeva, adenomy příštítných tělísek, benigní a maligní medulární tumory nadledvinek a papilomy/karcinomy nesekretorické části žaludeční stěny byly pozorovány při dávce 60 mg/kg/den, což reprezentuje přibližně 1,7násobek dávky 400 mg/den běžně užívané u člověka (podle AUC) nebo dávku 800 mg/den běžně užívané u člověka, a 1,2násobek dávky 340 mg/m2/den u dětí (podle AUC). Dle hodnocení No Observed Effect Level (NOEL) byla bezpečná dávka 30 mg/kg/den.
Mechanismus a závažnost těchto nálezů ze studie kancerogenity u potkanů není ještě u člověka objasněn.
Non-neoplastické léze neprokázané v dřívěj ších předklinických studiích se vyskytovaly v kardiovaskulárním systému, pankreatu, endokrinních orgánech a zubech. Nejdůležitější změny zahrnovaly srdeční hypertrofii a dilataci, vedoucí k příznakům srdeční nedostatečnosti u některých zvířat.
Účinná látka imatinib představuje environmentální ohrožení pro organismy v sedimentu.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Jádro tablety:
Mikrokrystalická celulosa Krospovidon Hypromelosa Magnesium-stearát Bezvodý oxid křemičitý
Potahová vrstva tablety:
Červený oxid železitý (E172)
Žlutý oxid železitý (E172)
Makrogol
Mastek
Hypromelosa
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Neuchovávejte při teplotě nad 30°C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
6.5 Druh obalu a obsah balení
PVDC/aluminium blistry
Balení obsahuje 10, 30 nebo 90 potahovaných tablet.
Na trhu nemusí být k dispozici všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/01/198/009
EU/1/01/198/010
EU/1/01/198/013
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 07. listopad 2001
Datum posledního prodloužení registrace: 07. listopad 2006
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Novartis Pharma GmbH Roonstrasse 25 D-90429 Norimberk Německo
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz Příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
• Povinnost uskutečnit poregistrační opatření
Držitel rozhodnutí o registraci uskuteční v daném termínu níže uvedená opatření:
|
Popis |
Termín splnění |
|
Vést observační registr sběru dat o účinnosti a bezpečnosti u nově diagnostikovaných pediatrických pacientů s Ph+ akutní lymfoblastickou leukemií (ALL) léčených chemoterapií + imatinibem ± HSCT. Podání finálního reportu o studii. |
30/06/2022 |
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Glivec 50 mg tvrdé tobolky Imatinibum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna tobolka obsahuje 50 mg imatinibu (jako mesilát).
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
30 tvrdých tobolek
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Perorální podání. Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Užívejte pouze podle doporučení lékaře.
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Neuchovávejte při teplotě nad 30°C. Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/01/198/001
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Glivec 50 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Glivec 50 mg tobolky Imatinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Glivec 100 mg tvrdé tobolky Imatinibum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna tobolka obsahuje 100 mg imatinibu (jako mesilát).
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
24 tvrdých tobolek 48 tvrdých tobolek 96 tvrdých tobolek 120 tvrdých tobolek 180 tvrdých tobolek
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Perorální podání. Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Užívejte pouze podle doporučení lékaře.
8. POUŽITELNOST
Neuchovávejte při teplotě nad 30°C. Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
|
EU/1/01/198/002 |
24 tobolek |
|
EU/1/01/198/003 EU/1/01/198/004 |
48 tobolek 96 tobolek |
|
EU/1/01/198/005 EU/1/01/198/006 |
120 tobolek 180 tobolek |
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Glivec 100 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Glivec 100 mg tobolky Imatinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Glivec 100 mg potahované tablety Imatinibum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna potahovaná tableta obsahuje 100 mg imatinibu (jako mesilát).
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
20 potahovaných tablet 60 potahovaných tablet 120 potahovaných tablet 180 potahovaných tablet
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Perorální podání. Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Užívejte pouze podle doporučení lékaře.
8. POUŽITELNOST
Neuchovávejte při teplotě nad 30°C. Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
|
EU/1/01/198/007 |
20 tablet |
|
EU/1/01/198/008 |
60 tablet |
|
EU/1/01/198/011 EU/1/01/198/012 |
120 tablet 180 tablet |
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Glivec 100 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Glivec 100 mg tablety Imatinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Glivec 400 mg potahované tablety Imatinibum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna potahovaná tableta obsahuje 400 mg imatinibu (jako mesilát).
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
10 potahovaných tablet 30 potahovaných tablet 90 potahovaných tablet
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Perorální podání. Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Užívejte pouze podle doporučení lékaře.
8. POUŽITELNOST
Neuchovávejte při teplotě nad 30°C. Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/01/198/009 10 tablet
EU/1/01/198/010 30 tablet
EU/1/01/198/013 90 tablet
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Glivec 400 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Glivec 400 mg tablety Imatinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
Glivec 50 mg tvrdé tobolky
Imatinibum
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Glivec a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Glivec užívat
3. Jak se Glivec užívá
4. Možné nežádoucí účinky
5. Jak Glivec uchovávat
6. Obsah balení a další informace
1. Co je Glivec a k čemu se používá
Glivec je lék obsahující léčivou látku imatinib. Tento lék tlumí růst abnormálních buněk u níže uvedených onemocnění, zahrnujících některé typy nádorů.
Glivec se užívá k léčbě dospělých a dětí s:
- Chronickou myeloidní leukemií (CML). Leukemie je nádorové onemocnění bílých krvinek. Bílé krvinky obvykle pomáhají organismu bojovat proti infekci. Chronická myeloidní leukemie je forma leukemie, při které určité abnormální bílé krvinky (nazvané myeloidní buňky) začnou růst nekontrolovaně.
- Philadelphia chromozom pozitivní akutní lymfatickou leukemií (Ph-pozitivní ALL).
Leukemie je nádorové onemocnění bílých krvinek. Tyto bílé krvinky obvykle pomáhají tělu bojovat proti infekci. Akutní lymfatická leukemie je forma leukemie, při které určité abnormální bílé krvinky (nazvané lymfoblasty) začnou nekontrolovaně růst. Glivec tlumí růst těchto buněk.
Glivec se také užívá k léčbě dospělých s:
- Myelodysplatickým/myeloproliferativním onemocněním (MDS/MPD). Jde o onemocnění krve, při kterém některé bílé krvinky začnou růst nekontrolovaně. Glivec tlumí růst těchto buněk u některého typu těchto onemocnění.
- Syndromem hypereozinofilie (HES) a/nebo chronickou eozinofilní leukemií (CEL). Jsou to krevní onemocnění, při nichž určité krvinky (nazvané eozinofily) začnou růst nekontrolovaně. Glivec tlumí růst těchto buněk u některého typu těchto onemocnění.
- Zhoubnými, stromálními nádory zažívacího traktu (GIST). GIST je nádorové onemocnění žaludku a střev. Vzniká nekontrolovaným růstem podpůrné tkáně těchto orgánů.
- Dermatofibrosarkomem protuberans (DFSP). DFSP je nádorové onemocnění pojivové tkáně, při kterém některé buňky začnou růst nekontrolovaně. Glivec tlumí růst těchto buněk.
V následujícím textu této příbalové informace budeme pro tato onemocnění používat zkratky
Jestliže máte nějaké dotazy, jak Glivec působí, nebo proč byl tento lék předepsán právě Vám, zeptejte
se svého lékaře.
2. Čemu musíte věnovat pozornost, než začnete Glivec užívat
Glivec Vám bude předepsán pouze lékařem, který má zkušenosti s léčbou nádorového onemocnění krve nebo solidních nádorů (pevných ohraničených nádorů).
Dodržujte pečlivě všechna doporučení lékaře, i když se budou lišit od obecných informací uvedených v této příbalové informaci.
Neužívejte Glivec:
- jestliže jste alergický(á) na imatinib nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Pokud se Vás to týká, oznamte to svému lékaři, aniž byste Glivec užíval(a).
Jestliže si myslíte, že můžete být alergický(á) ale nejste si tím jistý(á), požádejte lékaře o radu. Upozornění a opatření
Před užitím Glivecu se poraďte se svým lékařem:
- když máte nebo jste v minulosti měl(a) zdravotní potíže s játry, ledvinami nebo se srdcem
- jestliže užíváte levothyroxine z důvodu odstranění Vaší štítné žlázy.
- pokud j ste někdy měl (a) infekční hepatitidu B (žloutenka typu B) nebo toto onemocnění máte v současné době. Přípravek GLIVEC může hepatitidu B znovu aktivovat, což může v některých případech vést k úmrtí. Před zahájením léčby lékař pacienty pečlivě vyšetří s ohledem na možný výskyt známek této infekce.
Jestliže se Vás cokoliv z výše uvedeného týká, oznamte to lékaři před užíváním Glivecu.
Pokud začnete velmi rychle přibývat na váze během léčby Glivecem, sdělte to ihned svému lékaři. Glivec může způsobit zadržování vody ve Vašem těle (závažnou retenci tekutin).
Během užívání Glivecu bude Váš lékař pravidelně sledovat, zda lék účinkuje. Také Vám bude pravidelně kontrolován krevní obraz a tělesná hmotnost.
Děti a dospívající
Glivec je také léčba pro děti s CML. Nejsou žádné zkušenosti s podáváním u dětí s CML mladších než 2 roky. Zkušenosti s podáváním u dětí s Ph-pozitivní ALL jsou omezené a u dětí s MDS/MPD, DFSP, GIST a HES/CEL jsou velmi omezené.
U některých dětí a dospívajících, kteří užívají Glivec, se může projevit pomalejší tělesný růst, než je běžné. Lékař bude sledovat růst při pravidelných návštěvách.
Další léčivé přípravky a Glivec
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat, a to i o lécích, které jsou dostupné bez lékařského předpisu (jako je paracetamol), včetně léčivých rostlin (jako je třezalka tečkovaná). Některé léky, pokud jsou užívány společně s Glivecem, mohou účinek Glivecu ovlivňovat. Mohou zvýšit nebo naopak snížit účinnost Glivecu, což vede buď ke zvýšení jeho nežádoucích účinků nebo ke snížení jeho účinnosti. Stejně tak může Glivec ovlivňovat i některé jiné léky.
Informujte svého lékaře, pokud užíváte léky zamezující tvorbě krevních sraženin.
Těhotenství, kojení a fertilita
- Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat.
- Užívání Glivecu během těhotenství se nedoporučuje, pokud to není nezbytně nutné, protože může poškodit Vaše dítě. Váš lékař Vám vysvětlí možná rizika užívání Glivecu během těhotenství.
- Ženám, které by mohly otěhotnět, se doporučuje během léčby účinná antikoncepce.
- Během léčby Glivecem nekojte.
- Pacienti, kteří se obávají o svou fertilitu během užívání Glivecu, by se měli poradit se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Při užívání tohoto léku můžete pociťovat závrať nebo ospalost nebo neostře vidět, Pokud se to stane, neřiďte nebo neobsluhujte žádné přístroje nebo stroje, dokud se nebudete opět cítit dobře.
3. Jak se Glivec užívá
Váš lékař Vám předepsal Glivec, protože máte závažné onemocnění. Glivec Vám může pomoci v boji proti tomuto stavu.
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Je důležité pokračovat v léčbě tak dlouho, jak Vám lékař nebo lékárník sdělí. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Nepřerušujte užívání Glivecu, dokud Vám to Váš lékař neřekne. Pokud nemůžete užívat lék podle pokynů Vašeho lékaře nebo si myslíte, že ho již nepotřebujete, kontaktujte okamžitě svého lékaře.
Kolik Glivecu máte užívat
Použití u dospělých
Váš lékař Vám přesně sdělí, kolik tobolek Glivecu máte užívat.
- Jestliže jste léčen(a) pro CML:
Podle stavu Vašeho onemocnění je obvyklá počáteční dávka 400 mg nebo 600 mg.
- 400 mg užitých jako 8 tobolek jednou denně
- 600 mg užitých jako 12 tobolek jednou denně.
- Jestliže jste léčen(a) pro GIST:
Počáteční dávka je 400 mg užitá jako 8 tobolek jednou denně.
Pro CML a GIST může Váš lékař podle Vaší odpovědi na léčbu předepsat zvýšení nebo snížení dávky. Jestliže je Vaše denní dávka 800 mg (16 tobolek), měl(a) byste užívat 8 tobolek ráno a 8 tobolek večer.
- Jestliže jste léčen(a) pro Ph-pozitivní ALL:
Počáteční dávka je 600 mg užitá jako 12 tobolek jednou denně.
- Jestliže jste léčen(a) pro MDS/MPD:
Počáteční dávka je 400 mg užitá jako 8 tobolek jednou denně.
- Jestliže jste léčen(a) pro HES/CEL:
Počáteční dávka je 100 mg užitá jako 2 tobolky jednou denně. Podle Vaší odpovědi na léčbu může Váš lékař zvážit zvýšení dávky na 400 mg podáním 8 tobolek jednou denně.
- Jestliže jste léčen(a) pro DFSP:
Dávka je 800 mg denně (16 tobolek), užitá jako 8 tobolek ráno a 8 tobolek večer.
Použití u dětí a dospívajících
Lékař Vám řekne, kolik tobolek Glivecu by mělo být podáno Vašemu dítěti. Množství podaného Glivecu závisí na zdravotním stavu Vašeho dítěte, na jeho tělesné hmotnosti a výšce. Celková podaná denní dávka u dětí nesmí překročit dávku 800 mg pro CML a 600 mg pro Ph-pozitivní ALL. Léčba může být Vašemu dítěti podávána buď jednou denně, nebo může být dávka rozdělena do dvou podání (polovina dávky ráno a polovina večer).
Kdy a jak užívat Glivec
- Glivec užívejte s jídlem. Můžete tak předejít žaludečním potížím při užívání Glivecu.
- Tobolky polykejte celé a zapijte je velkou sklenicí vody. Tobolky neotevírejte ani nedrťte, pokud nemáte potíže s polykáním (např. u dětí).
- Pokud nejste schopný(á) tobolku spolknout, můžete ji otevřít a rozpustit prášek ve sklenici neperlivé vody nebo jablečného džusu.
- Jestliže jste žena a jste těhotná, nebo můžete být těhotná a otevíráte tobolky, měla byste
s obsahem manipulovat velmi opatrně, tak abyste zabránila kontaktu s kůží a očima nebo inhalaci. Po otevření tobolky byste si měla okamžitě umýt ruce.
Jak dlouho se Glivec užívá
Glivec užívejte denně tak dlouho, jak Vám lékař sdělí.
Jestliže jste užil(a) více Glivecu, než jte měl(a)
Jestliže jste nedopatřením užil(a) příliš mnoho tobolek, sdělte to ihned svému lékaři. Můžete potřebovat lékařskou pomoc. Přineste balení léku sebou.
Jestliže jste zapomněl(a) užít Glivec
- Jestliže jste zapomněl užít dávku, užijte ji ihned, jakmile si ten den vzpomenete. Pokud se však blíží doba další dávky, vynechte zapomenutou dávku.
- Poté pokračujte v obvyklém rozvrhu.
- Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. Ty jsou obvykle mírné až středně závažné.
Některé nežádoucí účinky mohou být závažné. Informujte okamžitě svého lékaře, pokud se u Vás projeví.
Velmi časté (mohou postihnout více než 1 z 10 lidí) nebo časté nežádoucí účinky (mohou postihnout až 1 z 10 lidí):
• Rychlý přírůstek na váze. Glivec může způsobit zadržování vody v těle (závažná retence tekutin).
• Příznaky infekce, jako je horečka, silná zimnice, bolesti v krku nebo vřídky v ústech. Glivec může snižovat počet bílých krvinek v krvi, a tak u Vás může snáze dojít k infekci.
• Neočekávané krvácení nebo výskyt modřin (bez Vašeho zavinění).
Méně časté (mohou postihnout až 1 ze 100 lidí) nebo vzácné nežádoucí účinky (mohou postihnout až 1 z 1000 lidí):
• Bolest na hrudi, nepravidelný srdeční tep (příznaky srdečních potíží).
• Kašel, ztížené nebo bolestivé dýchání (příznaky plicních potíží).
• Točení hlavy, závratě nebo mdloby (příznaky nízkého krevního tlaku).
• Pocit na zvracení, se ztrátou chuti k jídlu, tmavě zabarvená moč, žloutnutí kůže nebo očního bělma (příznaky jaterních potíží).
• Vyrážka, červená kůže s puchýřky na rtech, očích, kůži nebo v ústech, olupování kůže, horečka, zčervenání nebo nachová místa na kůži, svědění, pocit pálení, puchýřkovitá vyrážka (příznaky kožních potíží).
• Silné bolesti břicha, krev ve zvratcích, stolici nebo v moči, černá stolice (příznaky potíží zažívacího traktu).
• Závažný pokles výdeje moči, pocit žízně (příznaky potíží ledvin).
• Pocit nevolnosti (nauzea) s průjmem a zvracením, bolest břicha nebo horečka (příznaky střevních potíží).
• Silné bolesti hlavy, slabost nebo ochromení končetin nebo obličeje, potíže s mluvením, náhlá ztráta vědomí (příznaky potíží nervového systému jako je krvácení nebo otoky uvnitř lebky/mozku).
• Bledá kůže, pocit únavy a dušnost a tmavá moč (příznaky malého množství červených krvinek).
• Bolesti očí nebo zhoršené vidění, krvácení do očí.
• Bolest v kyčlích nebo potíže při chůzi.
• Necitlivé nebo studené prsty na rukou i nohou (příznaky Raynaudova syndromu).
• Náhlé otoky a zčervenání kůže (příznaky kožní infekce zvané celulitida).
• Potíže se sluchem.
• Svalová slabost a svalové křeče s abnormálním srdečním rytmem (příznaky změn hladiny draslíku v krvi).
• Podlitiny.
• Bolest žaludku s pocitem nevolnosti (nauzea).
• Svalové křeče s horečkou, rudohnědou močí, bolestí svalů nebo svalovou ochablostí (příznaky svalových potíží).
• Bolest pánve někdy spojená s nevolností a zvracením, s neočekávaným vaginálním (poševním) krvácením, pocit závrati,nebo mdloby z důvodu nízkého krevního tlaku (příznaky potíží Vašich vaječníků nebo dělohy).
• Nevolnost, zkrácený dech, nepravidelný srdeční tep, zakalená moč, únava a/nebo kloubní potíže spojené s neobvyklými výsledky laboratorních testů (např. vysoká hladina draslíku, kyseliny močové a vápníku a nízké hladiny fosforu v krvi).
Není známo (četnost z dostupných údajů nelze určit):
• Kombinace závažné rozsáhlé vyrážky, pocitu nevolnosti, horečky, vysokého počtu určitého typu bílých krvinek či žlutá barva kůže nebo očí (příznaky žloutenky) s dušností, bolestí/nepříjemným pocitem na hrudi, výrazným snížením objemu moči a pocitem žízně atd. (příznaky alergické reakce spojené s léčbou).
• Chronické selhání ledvin.
• Recidiva (reaktivace) hepatitidy B, pokud jste v minulosti měl(a) toto onemocnění (infekce jater).
Pokud se u Vás projeví jakýkoli z výše uvedených nežádoucích účinků, oznamte to okamžitě svému
lékaři.
Jiné nežádoucí účinky mohou zahrnovat:
Velmi časté (mohou postihnout více než 1 z 10 lidí):
• Bolesti hlavy nebo pocit únavy.
• Pocit nevolnosti (nauzea), slabost (zvracení), průjem nebo porucha zažívání.
• Vyrážka.
• Svalové křeče nebo bolesti kloubů, svalů a kostí.
• Otoky, jako např. otoky kolem kotníků nebo oteklé oči.
• Zvýšení hmotnosti.
Jestliže Vás cokoliv z tohoto závažně postihne, sdělte to svému lékaři.
Časté (mohou postihnout až 1 z 10 lidí):
• Nechutenství, ztráta hmotnosti nebo porušení chuti k jídlu.
• Pocit závratě a slabosti.
• Potíže se spánkem (nespavost).
• Výtok z očí se svěděním, zarudnutí a otoky (zánět spojivek), zvýšená produkce slz nebo neostré vidění.
• Krvácení z nosu.
• Bolesti nebo zduření břicha, nadýmání, pálení žáhy nebo zácpa.
• Svědění.
• Neobvyklá ztráta vlasů nebo j ej ich prořídnutí.
• Znecitlivění rukou nebo nohou.
• Vřídky v ústech.
• Bolesti kloubů s otoky.
• Sucho v ústech, suchá pleť nebo suché oči.
• Snížená nebo zvýšená citlivost kůže.
• Návaly horka, mrazení nebo noční pocení.
Jestliže Vás cokoliv z tohoto závažně postihne, sdělte to svému lékaři.
Není známo (četnost z dostupných údajů nelze určit):
• Zčervenání a/nebo otoky dlaní rukou a chodidel, které mohou být doprovázené pocitem brnění a pálení.
• Zpomalení růstu u dětí a dospívajících.
Jestliže Vás cokoliv z tohoto závážně postihne, sdělte to svému lékaři.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Glivec uchovávat
• Uchovávejte tento přípravek mimo dohled a dosah dětí.
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce.
• Neuchovávejte při teplotě nad 30°C.
• Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
• Nepoužívejte, jestliže je obal poškozený nebo zaznamenáte známky jeho porušení.
• Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co Glivec obsahuje
- Léčivou látkou je imatinibi mesilas. Jedna tobolka Glivecu obsahuje 50 mg imatinibu (jako mesylát).
- Dalšími složkami j sou mikrokrystalická celulosa, krospovidon, magnesium-stearát, bezvodý oxid křemičitý. Tobolka je složena z želatiny, žlutého oxidu železitého (E172) a oxidu titaničitého (E171). Tiskařský inkoust je složen z červeného oxidu železitého (E172), šelaku, sojového lecithinu.
Jak Glivec vypadá a co obsahuje toto balení
Glivec 50 mg tvrdé tobolky jsou světle žluté až oranžově žluté a označené „NVR SH“. Obsahují bílý
až žlutý prášek.
Dodává se v balení, které obsahuje 30 tobolek.
Držitel rozhodnutí o registraci
Novartis Europharm Limited
Frimley Business Park
Camberley GU16 7SR
Velká Británie
Výrobce
Novartis Pharma GmbH Roonstrasse 25 D-90429 Norimberk Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci
|
Belgie/Belgique/Belgien Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
Lietuva Novartis Pharma Services Inc. Tel: +370 5 269 16 50 |
|
Btarapna Novartis Pharma Services Inc. Tea.: +359 2 489 98 28 |
Luxembourg/Luxemburg Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
|
Česká republika Novartis s.r.o. Tel: +420 225 775 111 |
Magyarország Novartis Hungária Kft. Pharma Tel.: +36 1 457 65 00 |
|
Danmark Novartis Healthcare A/S Tlf: +45 39 16 84 00 |
Malta Novartis Pharma Services Inc. Tel: +356 2122 2872 |
|
Deutschland Novartis Pharma GmbH Tel: +49 911 273 0 |
Nederland Novartis Pharma B.V. Tel: +31 26 37 82 555 |
|
Eesti Novartis Pharma Services Inc. Tel: +372 66 30 810 |
Norge Novartis Norge AS Tlf: +47 23 05 20 00 |
|
EXlába Novartis (Hellas) A.E.B.E. T^: +30 210 281 17 12 |
Osterreich Novartis Pharma GmbH Tel: +43 1 86 6570 |
|
Espaňa Novartis Farmacéutica, S.A. Tel: +34 93 306 42 00 |
Polska Novartis Poland Sp. z o.o. Tel.: +48 22 375 4888 |
|
France Novartis Pharma S.A.S. Tél: +33 1 55 47 66 00 |
Portugal Novartis Farma - Produtos Farmaceuticos, S.A Tel: +351 21 000 8600 |
|
Hrvatska Novartis Hrvatska d.o.o. Tel. +385 1 6274 220 |
Románia Novartis Pharma Services Romania SRL Tel: +40 21 31299 01 |
|
Ireland Novartis Ireland Limited Tel: +353 1 260 12 55 |
Slovenija Novartis Pharma Services Inc. Tel: +386 1 300 75 50 |
Island
Vistor hf.
Sími: +354 535 7000 Italia
Novartis Farma S.p.A.
Tel: +39 02 96 54 1
Kórcpog
Novartis Pharma Services Inc. Tr(k: +357 22 690 690
Latvija
Novartis Pharma Services Inc. Tel: +371 67 887 070
Slovenská republika
Novartis Slovakia s.r.o.
Tel: +421 2 5542 5439
Suomi/Finland
Novartis Finland Oy Puh/Tel: +358 (0)10 6133 200
Sverige
Novartis Sverige AB Tel: +46 8 732 32 00
United Kingdom
Novartis Pharmaceuticals UK Ltd. Tel: +44 1276 698370
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku j sou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
Příbalová informace: informace pro uživatele
Glivec 100 mg tvrdé tobolky
Imatinibum
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Glivec a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Glivec užívat
3. Jak se Glivec užívá
4. Možné nežádoucí účinky
5. Jak Glivec uchovávat
6. Obsah balení a další informace
1. Co je Glivec a k čemu se používá
Glivec je lék obsahující léčivou látku imatinib. Tento lék tlumí růst abnormálních buněk u níže uvedených onemocnění, zahrnujících některé typy nádorů.
Glivec se užívá k léčbě dospělých a dětí s:
- Chronickou myeloidní leukemií (CML). Leukemie je nádorové onemocnění bílých krvinek. Bílé krvinky obvykle pomáhají organismu bojovat proti infekci. Chronická myeloidní leukemie je forma leukemie, při které určité abnormální bílé krvinky (nazvané myeloidní buňky) začnou růst nekontrolovaně.
- Philadelphia chromozom pozitivní akutní lymfatickou leukemií (Ph-pozitivní ALL).
Leukemie je nádorové onemocnění bílých krvinek. Tyto bílé krvinky obvykle pomáhají tělu bojovat proti infekci. Akutní lymfatická leukemie je forma leukemie, při které určité abnormální bílé krvinky (nazvané lymfoblasty) začnou nekontrolovaně růst. Glivec tlumí růst těchto buněk.
Glivec se také užívá k léčbě dospělých s:
- Myelodysplatickým/myeloproliferativním onemocněním (MDS/MPD). Jde o onemocnění krve, při kterém některé bílé krvinky začnou růst nekontrolovaně. Glivec tlumí růst těchto buněk u některého typu těchto onemocnění.
- Syndromem hypereozinofilie (HES) a/nebo chronickou eozinofilní leukemií (CEL). Jsou to krevní onemocnění, při nichž určité krvinky (nazvané eozinofily) začnou růst nekontrolovaně. Glivec tlumí růst těchto buněk u některého typu těchto onemocnění.
- Zhoubnými, stromálními nádory zažívacího traktu (GIST). GIST je nádorové onemocnění žaludku a střev. Vzniká nekontrolovaným růstem podpůrné tkáně těchto orgánů.
- Dermatofibrosarkomem protuberans (DFSP). DFSP je nádorové onemocnění pojivové tkáně, při kterém některé buňky začnou růst nekontrolovaně. Glivec tlumí růst těchto buněk.
V následujícím textu této příbalové informace budeme pro tato onemocnění používat zkratky
Jestliže máte nějaké dotazy, jak Glivec působí, nebo proč byl tento lék předepsán právě Vám, zeptejte
se svého lékaře.
2. Čemu musíte věnovat pozornost, než začnete Glivec užívat
Glivec Vám bude předepsán pouze lékařem, který má zkušenosti s léčbou nádorového onemocnění krve nebo solidních nádorů (pevných ohraničených nádorů).
Dodržujte pečlivě všechna doporučení lékaře, i když se budou lišit od obecných informací uvedených v této příbalové informaci.
Neužívejte Glivec:
- jestliže jste alergický(á) na imatinib nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Pokud se Vás to týká, oznamte to svému lékaři, aniž byste Glivec užíval(a).
Jestliže si myslíte, že můžete být alergický(á) ale nejste si tím jistý(á), požádejte lékaře o radu. Upozornění a opatření
Před užitím Glivecu se poraďte se svým lékařem:
- když máte nebo jste v minulosti měl(a) zdravotní potíže s játry, ledvinami nebo se srdcem
- jestliže užíváte levothyroxine z důvodu odstranění Vaší štítné žlázy.
- pokud j ste někdy měl (a) infekční hepatitidu B (žloutenka typu B) nebo toto onemocnění máte v současné době. Přípravek GLIVEC může hepatitidu B znovu aktivovat, což může v některých případech vést k úmrtí. Před zahájením léčby lékař pacienty pečlivě vyšetří s ohledem na možný výskyt známek této infekce.
Jestliže se Vás cokoliv z výše uvedeného týká, oznamte to lékaři před užíváním Glivecu.
Pokud začnete velmi rychle přibývat na váze během léčby Glivecem, sdělte to ihned svému lékaři. Glivec může způsobit zadržování vody ve Vašem těle (závažnou retenci tekutin).
Během užívání Glivecu bude Váš lékař pravidelně sledovat, zda lék účinkuje. Také Vám bude pravidelně kontrolován krevní obraz a tělesná hmotnost.
Děti a dospívající
Glivec je také léčba pro děti s CML. Nejsou žádné zkušenosti s podáváním u dětí s CML mladších než 2 roky. Zkušenosti s podáváním u dětí s Ph-pozitivní ALL jsou omezené a u dětí s MDS/MPD, DFSP, GIST a HES/CEL jsou velmi omezené.
U některých dětí a dospívajících, kteří užívají Glivec, se může projevit pomalejší tělesný růst, než je běžné. Lékař bude sledovat růst při pravidelných návštěvách.
Další léčivé přípravky a Glivec
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat, a to i o lécích, které jsou dostupné bez lékařského předpisu (jako je paracetamol), včetně léčivých rostlin (jako je třezalka tečkovaná). Některé léky, pokud jsou užívány společně s Glivecem, mohou účinek Glivecu ovlivňovat. Mohou zvýšit nebo naopak snížit účinnost Glivecu, což vede buď ke zvýšení jeho nežádoucích účinků nebo ke snížení jeho účinnosti. Stejně tak může Glivec ovlivňovat i některé jiné léky.
Informujte svého lékaře, pokud užíváte léky zamezující tvorbě krevních sraženin.
Těhotenství, kojení a fertilita
- Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat.
- Užívání Glivecu během těhotenství se nedoporučuje, pokud to není nezbytně nutné, protože může poškodit Vaše dítě. Váš lékař Vám vysvětlí možná rizika užívání Glivecu během těhotenství.
- Ženám, které by mohly otěhotnět, se doporučuje během léčby účinná antikoncepce.
- Během léčby Glivecem nekojte.
- Pacienti, kteří se obávají o svou fertilitu během užívání Glivecu, by se měli poradit se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Při užívání tohoto léku můžete pociťovat závrať nebo ospalost nebo neostře vidět, Pokud se to stane, neřiďte nebo neobsluhujte žádné přístroje nebo stroje, dokud se nebudete opět cítit dobře.
3. Jak se Glivec užívá
Váš lékař Vám předepsal Glivec, protože máte závažné onemocnění. Glivec Vám může pomoci v boji proti tomuto stavu.
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Je důležité pokračovat v léčbě tak dlouho, jak Vám lékař nebo lékárník sdělí. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Nepřerušujte užívání Glivecu, dokud Vám to Váš lékař neřekne. Pokud nemůžete užívat lék podle pokynů Vašeho lékaře nebo si myslíte, že ho již nepotřebujete, kontaktujte okamžitě svého lékaře.
Kolik Glivecu máte užívat
Použití u dospělých
Váš lékař Vám přesně sdělí, kolik tobolek Glivecu máte užívat.
- Jestliže jste léčen(a) pro CML:
Podle stavu Vašeho onemocnění je obvyklá počáteční dávka 400 mg nebo 600 mg.
- 400 mg užitých jako 4 tobolky jednou denně
- 600 mg užitých jako 6 tobolek jednou denně.
- Jestliže jste léčen(a) pro GIST:
Počáteční dávka je 400 mg užitá jako 4 tobolky jednou denně.
Pro CML a GIST může Váš lékař podle Vaší odpovědi na léčbu předepsat zvýšení nebo snížení dávky. Jestliže je Vaše denní dávka 800 mg (8 tobolek), měl(a) byste užívat 4 tobolky ráno a 4 tobolky večer.
- Jestliže jste léčen(a) pro Ph-pozitivní ALL:
Počáteční dávka je 600 mg užitá jako 6 tobolek jednou denně.
- Jestliže jste léčen(a) pro MDS/MPD:
Počáteční dávka je 400 mg užitá jako 4 tobolky jednou denně.
- Jestliže jste léčen(a) pro HES/CEL:
Počáteční dávka je 100 mg užitá jako jedna tobolka jednou denně. Podle Vaší odpovědi na léčbu může Váš lékař zvážit zvýšení dávky na 400 mg užitých jako 4 tobolky jednou denně.
- Jestliže jste léčen(a) pro DFSP:
Dávka je 800 mg denně (8 tobolek), užitá jako 4 tobolky ráno a 4 tobolky večer.
Použití u dětí a dospívajících
Lékař Vám řekne, kolik tobolek Glivecu by mělo být podáno Vašemu dítěti. Množství podaného Glivecu závisí na zdravotním stavu Vašeho dítěte, na jeho tělesné hmotnosti a výšce. Celková podaná denní dávka u dětí nesmí překročit dávku 800 mg pro CML a 600 mg pro Ph-pozitivní ALL. Léčba může být Vašemu dítěti podávána buď jednou denně, nebo může být dávka rozdělena do dvou podání (polovina dávky ráno a polovina večer).
Kdy a jak užívat Glivec
- Glivec užívejte s jídlem. Můžete tak předejít žaludečním potížím při užívání Glivecu.
- Tobolky polykejte celé a zapijte je velkou sklenicí vody. Tobolky neotevírejte ani nedrťte, pokud nemáte potíže s polykáním (např. u dětí).
- Pokud nejste schopný(á) tobolku spolknout, můžete ji otevřít a rozpustit prášek ve sklenici neperlivé vody nebo jablečného džusu.
- Jestliže jste žena a jste těhotná, nebo můžete být těhotná a otevíráte tobolky, měla byste
s obsahem manipulovat velmi opatrně, tak abyste zabránila kontaktu s kůží a očima nebo inhalaci. Po otevření tobolky byste si měla okamžitě umýt ruce.
Jak dlouho se Glivec užívá
Glivec užívejte denně tak dlouho, jak Vám lékař sdělí.
Jestliže jste užil(a) více Glivecu, než jte měl(a)
Jestliže jste nedopatřením užil(a) příliš mnoho tobolek, sdělte to ihned svému lékaři. Můžete potřebovat lékařskou pomoc. Přineste balení léku sebou.
Jestliže jste zapomněl(a) užít Glivec
- Jestliže jste zapomněl užít dávku, užijte ji ihned, jakmile si ten den vzpomenete. Pokud se však blíží doba další dávky, vynechte zapomenutou dávku.
- Poté pokračujte v obvyklém rozvrhu.
- Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. Ty jsou obvykle mírné až středně závažné.
Některé nežádoucí účinky mohou být závažné. Informujte okamžitě svého lékaře, pokud se u Vás projeví.
Velmi časté (mohou postihnout více než 1 z 10 lidí) nebo časté nežádoucí účinky (mohou postihnout až 1 z 10 lidí):
• Rychlý přírůstek na váze. Glivec může způsobit zadržování vody v těle (závažná retence tekutin).
• Příznaky infekce, jako je horečka, silná zimnice, bolesti v krku nebo vřídky v ústech. Glivec může snižovat počet bílých krvinek v krvi, a tak u Vás může snáze dojít k infekci.
• Neočekávané krvácení nebo výskyt modřin (bez Vašeho zavinění).
Méně časté (mohou postihnout až 1 ze 100 lidí) nebo vzácné nežádoucí účinky (mohou postihnout až 1 z 1000 lidí):
• Bolest na hrudi, nepravidelný srdeční tep (příznaky srdečních potíží).
• Kašel, ztížené nebo bolestivé dýchání (příznaky plicních potíží).
• Točení hlavy, závratě nebo mdloby (příznaky nízkého krevního tlaku).
• Pocit na zvracení, se ztrátou chuti k jídlu, tmavě zabarvená moč, žloutnutí kůže nebo očního bělma (příznaky jaterních potíží).
• Vyrážka, červená kůže s puchýřky na rtech, očích, kůži nebo v ústech, olupování kůže, horečka, zčervenání nebo nachová místa na kůži, svědění, pocit pálení, puchýřkovitá vyrážka (příznaky kožních potíží).
• Silné bolesti břicha, krev ve zvratcích, stolici nebo v moči, černá stolice (příznaky potíží zažívacího traktu).
• Závažný pokles výdeje moči, pocit žízně (příznaky potíží ledvin).
• Pocit nevolnosti (nauzea) s průjmem a zvracením, bolest břicha nebo horečka (příznaky střevních potíží).
• Silné bolesti hlavy, slabost nebo ochromení končetin nebo obličeje, potíže s mluvením, náhlá ztráta vědomí (příznaky potíží nervového systému jako je krvácení nebo otoky uvnitř lebky/mozku).
• Bledá kůže, pocit únavy a dušnost a tmavá moč (příznaky malého množství červených krvinek).
• Bolesti očí nebo zhoršené vidění, krvácení do očí.
• Bolest v kyčlích nebo potíže při chůzi.
• Necitlivé nebo studené prsty na rukou i nohou (příznaky Raynaudova syndromu).
• Náhlé otoky a zčervenání kůže (příznaky kožní infekce zvané celulitida).
• Potíže se sluchem.
• Svalová slabost a svalové křeče s abnormálním srdečním rytmem (příznaky změn hladiny
draslíku v krvi).
• Podlitiny.
• Bolest žaludku s pocitem nevolnosti (nauzea).
• Svalové křeče s horečkou, rudohnědou močí, bolestí svalů nebo svalovou ochablostí (příznaky svalových potíží).
• Bolest pánve někdy spojená s nevolností a zvracením, s neočekávaným vaginálním (poševním) krvácením, pocit závrati,nebo mdloby z důvodu nízkého krevního tlaku (příznaky potíží Vašich vaječníků nebo dělohy).
• Nevolnost, zkrácený dech, nepravidelný srdeční tep, zakalená moč, únava a/nebo kloubní potíže spojené s neobvyklými výsledky laboratorních testů (např. vysoká hladina draslíku, kyseliny močové a vápníku a nízké hladiny fosforu v krvi).
Není známo (četnost z dostupných údajů nelze určit):
• Kombinace závažné rozsáhlé vyrážky, pocitu nevolnosti, horečky, vysokého počtu určitého typu bílých krvinek či žlutá barva kůže nebo očí (příznaky žloutenky) s dušností, bolestí/nepříjemným pocitem na hrudi, výrazným snížením objemu moči a pocitem žízně atd. (příznaky alergické reakce spojené s léčbou).
• Chronické selhání ledvin.
• Recidiva (reaktivace) hepatitidy B, pokud jste v minulosti měl(a) toto onemocnění (infekce jater).
Pokud se u Vás projeví jakýkoli z výše uvedených nežádoucích účinků, oznamte to okamžitě svému
lékaři.
Jiné nežádoucí účinky mohou zahrnovat:
Velmi časté (mohou postihnout více než 1 z 10 lidí):
• Bolesti hlavy nebo pocit únavy.
• Pocit nevolnosti (nauzea), slabost (zvracení), průjem nebo porucha zažívání.
• Vyrážka.
• Svalové křeče nebo bolesti kloubů, svalů a kostí.
• Otoky, jako např. otoky kolem kotníků nebo oteklé oči.
• Zvýšení hmotnosti.
Jestliže Vás cokoliv z tohoto závažně postihne, sdělte to svému lékaři.
Časté (mohou postihnout až 1 z 10 lidí):
• Nechutenství, ztráta hmotnosti nebo porušení chuti k jídlu.
• Pocit závratě a slabosti.
• Potíže se spánkem (nespavost).
• Výtok z očí se svěděním, zarudnutí a otoky (zánět spojivek), zvýšená produkce slz nebo neostré vidění.
• Krvácení z nosu.
• Bolesti nebo zduření břicha, nadýmání, pálení žáhy nebo zácpa.
• Svědění.
• Neobvyklá ztráta vlasů nebo j ej ich prořídnutí.
• Znecitlivění rukou nebo nohou.
• Vřídky v ústech.
• Bolesti kloubů s otoky.
• Sucho v ústech, suchá pleť nebo suché oči.
• Snížená nebo zvýšená citlivost kůže.
• Návaly horka, mrazení nebo noční pocení.
Jestliže Vás cokoliv z tohoto závažně postihne, sdělte to svému lékaři.
Není známo (četnost z dostupných údajů nelze určit):
• Zčervenání a/nebo otoky dlaní rukou a chodidel, které mohou být doprovázené pocitem brnění a pálení.
• Zpomalení růstu u dětí a dospívajících.
Jestliže Vás cokoliv z tohoto závážně postihne, sdělte to svému lékaři.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Glivec uchovávat
• Uchovávejte tento přípravek mimo dohled a dosah dětí.
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce.
• Neuchovávejte při teplotě nad 30°C.
• Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
• Nepoužívejte, jestliže je obal poškozený nebo zaznamenáte známky jeho porušení.
• Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co Glivec obsahuje
- Léčivou látkou je imatinibi mesilas. Jedna tobolka Glivecu obsahuje 100 mg imatinibu (jako mesylát).
- Dalšími složkami jsou mikrokrystalická celulosa, krospovidon, magnesium-stearát, bezvodý oxid křemičitý. Tobolka je složena z želatiny, červeného oxidu železitého (E172), žlutého oxidu železitého (E172) a oxidu titaničitého (E171). Tiskařský inkoust je složen z červeného oxidu železitého (E172) a šelaku.
Jak Glivec vypadá a co obsahuje toto balení
Glivec 100 mg tvrdé tobolky jsou oranžové až šedooranžové a označené „NVR SI“. Obsahují bílý až
žlutý prášek.
Dodává se v balení, které obsahuje 24, 48, 96, 120 nebo 180 tobolek, ale na trhu nemusí být dostupné
všechny velikosti.
Držitel rozhodnutí o registraci
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
Výrobce
Novartis Pharma GmbH Roonstrasse 25 D-90429 Norimberk Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci
|
Belgie/Belgique/Belgien Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
Lietuva Novartis Pharma Services Inc. Tel: +370 5 269 16 50 |
|
Bt^rapnn Novartis Pharma Services Inc. Ten.: +359 2 489 98 28 |
Luxembourg/Luxemburg Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
|
Česká republika Novartis s.r.o. Tel: +420 225 775 111 |
Magyarország Novartis Hungária Kft. Pharma Tel.: +36 1 457 65 00 |
|
Danmark Novartis Healthcare A/S Tlf: +45 39 16 84 00 |
Malta Novartis Pharma Services Inc. Tel: +356 2122 2872 |
|
Deutschland Novartis Pharma GmbH Tel: +49 911 273 0 |
Nederland Novartis Pharma B.V. Tel: +31 26 37 82 555 |
|
Eesti Novartis Pharma Services Inc. Tel: +372 66 30 810 |
Norge Novartis Norge AS Tlf: +47 23 05 20 00 |
|
EXlába Novartis (Hellas) A.E.B.E. TpA,: +30 210 281 17 12 |
Osterreich Novartis Pharma GmbH Tel: +43 1 86 6570 |
|
Espaňa Novartis Farmacéutica, S.A. Tel: +34 93 306 42 00 |
Polska Novartis Poland Sp. z o.o. Tel.: +48 22 375 4888 |
|
France Novartis Pharma S.A.S. Tél: +33 1 55 47 66 00 |
Portugal Novartis Farma - Produtos Farmaceuticos, S.A Tel: +351 21 000 8600 |
|
Hrvatska Novartis Hrvatska d.o.o. Tel. +385 1 6274 220 |
Románia Novartis Pharma Services Romania SRL Tel: +40 21 31299 01 |
|
Ireland Novartis Ireland Limited Tel: +353 1 260 12 55 |
Slovenija Novartis Pharma Services Inc. Tel: +386 1 300 75 50 |
|
Island Vistor hf. Sími: +354 535 7000 |
Slovenská republika Novartis Slovakia s.r.o. Tel: +421 2 5542 5439 |
|
Italia Novartis Farma S.p.A. Tel: +39 02 96 54 1 |
Suomi/Finland Novartis Finland Oy Puh/Tel: +358 (0)10 6133 200 |
|
Kúnpoq Novartis Pharma Services Inc. TpA,: +357 22 690 690 |
Sverige Novartis Sverige AB Tel: +46 8 732 32 00 |
|
Latvija Novartis Pharma Services Inc. Tel: +371 67 887 070 |
United Kingdom Novartis Pharmaceuticals UK Ltd. Tel: +44 1276 698370 |
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
Příbalová informace: informace pro uživatele
Glivec 100 mg potahované tablety
Imatinibum
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Glivec a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Glivec užívat
3. Jak se Glivec užívá
4. Možné nežádoucí účinky
5. Jak Glivec uchovávat
6. Obsah balení a další informace
1. Co je Glivec a k čemu se používá
Glivec je lék obsahující léčivou látku imatinib. Tento lék tlumí růst abnormálních buněk u níže uvedených onemocnění, zahrnujících některé typy nádorů.
Glivec se užívá k léčbě dospělých a dětí s:
- Chronickou myeloidní leukemií (CML). Leukemie je nádorové onemocnění bílých krvinek. Bílé krvinky obvykle pomáhají organismu bojovat proti infekci. Chronická myeloidní leukemie je forma leukemie, při které určité abnormální bílé krvinky (nazvané myeloidní buňky) začnou růst nekontrolovaně.
- Philadelphia chromozom pozitivní akutní lymfatickou leukemií (Ph-pozitivní ALL).
Leukemie je nádorové onemocnění bílých krvinek. Tyto bílé krvinky obvykle pomáhají tělu bojovat proti infekci. Akutní lymfatická leukemie je forma leukemie, při které určité abnormální bílé krvinky (nazvané lymfoblasty) začnou nekontrolovaně růst. Glivec tlumí růst těchto buněk.
Glivec se také užívá k léčbě dospělých s:
- Myelodysplatickým/myeloproliferativním onemocněním (MDS/MPD). Jde o onemocnění krve, při kterém některé bílé krvinky začnou růst nekontrolovaně. Glivec tlumí růst těchto buněk u některého typu těchto onemocnění.
- Syndromem hypereozinofilie (HES) a/nebo chronickou eozinofilní leukemií (CEL). Jsou to krevní onemocnění, při nichž určité krvinky (nazvané eozinofily) začnou růst nekontrolovaně. Glivec tlumí růst těchto buněk u některého typu těchto onemocnění.
- Zhoubnými, stromálními nádory zažívacího traktu (GIST). GIST je nádorové onemocnění žaludku a střev. Vzniká nekontrolovaným růstem podpůrné tkáně těchto orgánů.
- Dermatofibrosarkomem protuberans (DFSP). DFSP je nádorové onemocnění pojivové tkáně, při kterém některé buňky začnou růst nekontrolovaně. Glivec tlumí růst těchto buněk.
V následujícím textu této příbalové informace budeme pro tato onemocnění používat zkratky
Jestliže máte nějaké dotazy, jak Glivec působí, nebo proč byl tento lék předepsán právě Vám, zeptejte
se svého lékaře.
2. Čemu musíte věnovat pozornost, než začnete Glivec užívat
Glivec Vám bude předepsán pouze lékařem, který má zkušenosti s léčbou nádorového onemocnění krve nebo solidních nádorů (pevných ohraničených nádorů).
Dodržujte pečlivě všechna doporučení lékaře, i když se budou lišit od obecných informací uvedených v této příbalové informaci.
Neužívejte Glivec:
- jestliže jste alergický(á) na imatinib nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Pokud se Vás to týká, oznamte to svému lékaři, aniž byste Glivec užíval(a).
Jestliže si myslíte, že můžete být alergický(á) ale nejste si tím jistý(á), požádejte lékaře o radu. Upozornění a opatření
Před užitím Glivecu se poraďte se svým lékařem:
- když máte nebo jste v minulosti měl(a) zdravotní potíže s játry, ledvinami nebo se srdcem
- jestliže užíváte levothyroxine z důvodu odstranění Vaší štítné žlázy.
- pokud j ste někdy měl (a) infekční hepatitidu B (žloutenka typu B) nebo toto onemocnění máte v současné době. Přípravek GLIVEC může hepatitidu B znovu aktivovat, což může v některých případech vést k úmrtí. Před zahájením léčby lékař pacienty pečlivě vyšetří s ohledem na možný výskyt známek této infekce.
Jestliže se Vás cokoliv z výše uvedeného týká, oznamte to lékaři před užíváním Glivecu.
Pokud začnete velmi rychle přibývat na váze během léčby Glivecem, sdělte to ihned svému lékaři. Glivec může způsobit zadržování vody ve Vašem těle (závažnou retenci tekutin).
Během užívání Glivecu bude Váš lékař pravidelně sledovat, zda lék účinkuje. Také Vám bude pravidelně kontrolován krevní obraz a tělesná hmotnost.
Děti a dospívající
Glivec je také léčba pro děti s CML. Nejsou žádné zkušenosti s podáváním u dětí s CML mladších než 2 roky. Zkušenosti s podáváním u dětí s Ph-pozitivní ALL jsou omezené a u dětí s MDS/MPD, DFSP, GIST a HES/CEL jsou velmi omezené.
U některých dětí a dospívajících, kteří užívají Glivec, se může projevit pomalejší tělesný růst, než je běžné. Lékař bude sledovat růst při pravidelných návštěvách.
Další léčivé přípravky a Glivec
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat, a to i o lécích, které jsou dostupné bez lékařského předpisu (jako je paracetamol), včetně léčivých rostlin (jako je třezalka tečkovaná). Některé léky, pokud jsou užívány společně s Glivecem, mohou účinek Glivecu ovlivňovat. Mohou zvýšit nebo naopak snížit účinnost Glivecu, což vede buď ke zvýšení jeho nežádoucích účinků nebo ke snížení jeho účinnosti. Stejně tak může Glivec ovlivňovat i některé jiné léky.
Informujte svého lékaře, pokud užíváte léky zamezující tvorbě krevních sraženin.
Těhotenství, kojení a fertilita
- Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat.
- Užívání Glivecu během těhotenství se nedoporučuje, pokud to není nezbytně nutné, protože může poškodit Vaše dítě. Váš lékař Vám vysvětlí možná rizika užívání Glivecu během těhotenství.
- Ženám, které by mohly otěhotnět, se doporučuje během léčby účinná antikoncepce.
- Během léčby Glivecem nekojte.
- Pacienti, kteří se obávají o svou fertilitu během užívání Glivecu, by se měli poradit se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Při užívání tohoto léku můžete pociťovat závrať nebo ospalost nebo neostře vidět, Pokud se to stane, neřiďte nebo neobsluhujte žádné přístroje nebo stroje, dokud se nebudete opět cítit dobře.
3. Jak se Glivec užívá
Váš lékař Vám předepsal Glivec, protože máte závažné onemocnění. Glivec Vám může pomoci v boji proti tomuto stavu.
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Je důležité pokračovat v léčbě tak dlouho, jak Vám lékař nebo lékárník sdělí. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Nepřerušujte užívání Glivecu, dokud Vám to Váš lékař neřekne. Pokud nemůžete užívat lék podle pokynů Vašeho lékaře nebo si myslíte, že ho již nepotřebujete, kontaktujte okamžitě svého lékaře.
Kolik Glivecu máte užívat
Použití u dospělých
Váš lékař Vám přesně sdělí, kolik tablet Glivecu máte užívat.
- Jestliže jste léčen(a) pro CML:
Podle stavu Vašeho onemocnění je obvyklá počáteční dávka 400 mg nebo 600 mg.
- 400 mg užitých jako 4 tablety jednou denně,
- 600 mg užitých jako 6 tablet jednou denně.
- Jestliže jste léčen(a) pro GIST:
Počáteční dávka je 400 mg užitá jako 4 tablety jednou denně.
Pro CML a GIST může Váš lékař podle Vaší odpovědi na léčbu předepsat zvýšení nebo snížení dávky. Jestliže je Vaše denní dávka 800 mg (8 tablet), měl(a) byste užívat 4 tablety ráno a 4 tablety večer.
- Jestliže jste léčen(a) pro Ph-pozitivní ALL:
Počáteční dávka je 600 mg užitá jako 6 tablet jednou denně.
- Jestliže jste léčen(a) pro MDS/MPD:
Počáteční dávka je 400 mg užitá jako 4 tablety jednou denně.
- Jestliže jste léčen(a) pro HES/CEL:
Počáteční dávka 100 mg užitá jako jedna tableta jednou denně. Podle Vaší odpovědi na léčbu může Váš lékař zvážit zvýšení dávky na 400 mg užité jako 4 tablety jednou denně.
- Jestliže jste léčen(a) pro DFSP:
Dávka je 800 mg denně (8 tablet) užitá jako 4 tablety ráno a 4 tablety večer.
Použití u dětí a dospívajících
Lékař Vám řekne, kolik tablet Glivecu by mělo být podáno Vašemu dítěti užívat. Množství podaného Glivecu závisí na zdravotním stavu Vašeho dítěte, na jeho tělesné hmostnosti a výšce. Celková podaná denní dávka u dětí nesmí překročit dávku 800 mg pro CML a 600 mg pro Ph-pozitivní ALL. Léčba může být Vašemu dítěti podávána buď jednou denně, nebo může být dávka rozdělena do dvou podání (polovina dávky ráno a polovina večer).
Kdy a jak užívat Glivec
- Glivec užívejte s jídlem. Můžete tak předejít žaludečním potížím při užívání Glivecu.
- Tablety polykejte celé a zapijte je velkou sklenicí vody.
Jestliže nemůžete tablety polykat celé, můžete je rozpustit ve sklenici neperlivé vody nebo v jablečném džusu.
• Použijte přibližně 50 ml pro každou 100 mg tabletu.
• Míchejte lžící, dokud se tablety zcela nerozpustí.
• Když je tableta rozpuštěná, vypijte ihned celý obsah sklenice. Stopy rozpuštěných tablet mohou zůstat na sklenici.
Jak dlouho se Glivec užívá
Glivec užívejte denně tak dlouho, jak Vám lékař sdělí.
Jestliže jste užil(a) více Glivecu, než jste měl(a)
Jestliže jste nedopatřením užil(a) příliš mnoho tablet, sdělte to ihned svému lékaři. Můžete potřebovat lékařskou pomoc. Přineste balení léku sebou.
Jestliže jste zapomněl(a) užít Glivec
- Jestliže jste zapomněl užít dávku, užijte ji ihned, jakmile si vzpomenete. Pokud se však blíží doba další dávky, vynechte zapomenutou dávku.
- Poté pokračujte v obvyklém rozvrhu.
- Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. Ty jsou obvykle mírné až středně závažné.
Některé nežádoucí účinky mohou být závažné. Informujte okamžitě svého lékaře, pokud se u Vás projeví.
Velmi časté (mohou postihnout více než 1 z 10 lidí) nebo časté nežádoucí účinky (mohou postihnout až 1 z 10 lidí):
• Rychlý přírůstek na váze. Glivec může způsobit zadržování vody v těle (závažná retence tekutin).
• Příznaky infekce, jako je horečka, silná zimnice, bolesti v krku nebo vřídky v ústech. Glivec může snižovat počet bílých krvinek v krvi, a tak u Vás může snáze dojít k infekci.
• Neočekávané krvácení nebo výskyt modřin (bez Vašeho zavinění).
Méně časté (mohou postihnout až 1 ze 100 lidí) nebo vzácné nežádoucí účinky (mohou postihnout až 1 z 1000 lidí):
• Bolest na hrudi, nepravidelný srdeční tep (příznaky srdečních potíží).
• Kašel, ztížené nebo bolestivé dýchání (příznaky plicních potíží).
• Točení hlavy, závratě nebo mdloby (příznaky nízkého krevního tlaku).
• Pocit na zvracení, se ztrátou chuti k jídlu, tmavě zabarvená moč, žloutnutí kůže nebo očního bělma (příznaky jaterních potíží).
• Vyrážka, červená kůže s puchýřky na rtech, očích, kůži nebo v ústech, olupování kůže, horečka, zčervenání nebo nachová místa na kůži, svědění, pocit pálení, puchýřkovitá vyrážka (příznaky kožních potíží).
• Silné bolesti břicha, krev ve zvratcích, stolici nebo v moči, černá stolice (příznaky potíží zažívacího traktu).
• Závažný pokles výdeje moči, pocit žízně (příznaky potíží ledvin).
• Pocit nevolnosti (nauzea) s průjmem a zvracením, bolest břicha nebo horečka (příznaky střevních potíží).
• Silné bolesti hlavy, slabost nebo ochromení končetin nebo obličeje, potíže s mluvením, náhlá ztráta vědomí (příznaky potíží nervového systému jako je krvácení nebo otoky uvnitř lebky/mozku).
• Bledá kůže, pocit únavy a dušnost a tmavá moč (příznaky malého množství červených krvinek).
• Bolesti očí nebo zhoršené vidění, krvácení do očí.
• Bolest v kyčlích nebo potíže při chůzi.
• Necitlivé nebo studené prsty na rukou i nohou (příznaky Raynaudova syndromu).
• Náhlé otoky a zčervenání kůže (příznaky kožní infekce zvané celulitida).
• Potíže se sluchem.
• Svalová slabost a svalové křeče s abnormálním srdečním rytmem (příznaky změn hladiny draslíku v krvi).
• Podlitiny.
• Bolest žaludku s pocitem nevolnosti (nauzea).
• Svalové křeče s horečkou, rudohnědou močí, bolestí svalů nebo svalovou ochablostí (příznaky svalových potíží).
• Bolest pánve někdy spojená s nevolností a zvracením, s neočekávaným vaginálním (poševním) krvácením, pocit závrati,nebo mdloby z důvodu nízkého krevního tlaku (příznaky potíží Vašich vaječníků nebo dělohy).
• Nevolnost, zkrácený dech, nepravidelný srdeční tep, zakalená moč, únava a/nebo kloubní potíže spojené s neobvyklými výsledky laboratorních testů (např. vysoká hladina draslíku, kyseliny močové a vápníku a nízké hladiny fosforu v krvi).
Není známo (četnost z dostupných údajů nelze určit):
• Kombinace závažné rozsáhlé vyrážky, pocitu nevolnosti, horečky, vysokého počtu určitého typu bílých krvinek či žlutá barva kůže nebo očí (příznaky žloutenky) s dušností, bolestí/nepříjemným pocitem na hrudi, výrazným snížením objemu moči a pocitem žízně atd. (příznaky alergické reakce spojené s léčbou).
• Chronické selhání ledvin.
• Recidiva (reaktivace) hepatitidy B, pokud jste v minulosti měl(a) toto onemocnění (infekce jater).
Pokud se u Vás projeví jakýkoli z výše uvedených nežádoucích účinků, oznamte to okamžitě svému
lékaři.
Jiné nežádoucí účinky mohou zahrnovat:
Velmi časté (mohou postihnout více než 1 z 10 lidí):
• Bolesti hlavy nebo pocit únavy.
• Pocit nevolnosti (nauzea), slabost (zvracení), průjem nebo porucha zažívání.
• Vyrážka.
• Svalové křeče nebo bolesti kloubů, svalů a kostí.
• Otoky, jako např. otoky kolem kotníků nebo oteklé oči.
• Zvýšení hmotnosti.
Jestliže Vás cokoliv z tohoto závažně postihne, sdělte to svému lékaři.
Časté (mohou postihnout až 1 z 10 lidí):
• Nechutenství, ztráta hmotnosti nebo porušení chuti k jídlu.
• Pocit závratě a slabosti.
• Potíže se spánkem (nespavost).
• Výtok z očí se svěděním, zarudnutí a otoky (zánět spojivek), zvýšená produkce slz nebo neostré vidění.
• Krvácení z nosu.
• Bolesti nebo zduření břicha, nadýmání, pálení žáhy nebo zácpa.
• Svědění.
• Neobvyklá ztráta vlasů nebo j ej ich prořídnutí.
• Znecitlivění rukou nebo nohou.
• Vřídky v ústech.
• Bolesti kloubů s otoky.
• Sucho v ústech, suchá pleť nebo suché oči.
• Snížená nebo zvýšená citlivost kůže.
• Návaly horka, mrazení nebo noční pocení.
Jestliže Vás cokoliv z tohoto závažně postihne, sdělte to svému lékaři.
Není známo (četnost z dostupných údajů nelze určit):
• Zčervenání a/nebo otoky dlaní rukou a chodidel, které mohou být doprovázené pocitem brnění a pálení.
• Zpomalení růstu u dětí a dospívajících.
Jestliže Vás cokoliv z tohoto závážně postihne, sdělte to svému lékaři.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Glivec uchovávat
• Uchovávejte tento přípravek mimo dohled a dosah dětí.
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce.
• Neuchovávejte při teplotě nad 30°C.
• Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
• Nepoužívejte, jestliže je obal poškozený nebo zaznamenáte známky jeho porušení.
• Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co Glivec obsahuje
- Léčivou látkou je imatinibi mesilas. Jedna tableta Glivecu obsahuje 100 mg imatinibu (jako mesylát).
- Dalšími složkami jsou mikrokrystalická celulosa, krospovidon, hypromelosa, magnesium-stearát, bezvodý oxid křemičitý.
- Potahová vrstva tablety je vyrobena z červeného oxidu železitého (E172), žlutého oxidu železitého (E172), makrogolu, mastku a hypromelosy.
Jak Glivec vypadá a co obsahuje toto balení
Glivec 100 mg potahované tablety jsou velmi tmavě žluté až hnědooranžové kulaté potahované
tablety. Jsou na jedné straně označené „NVR“ a „SA“ s půlící rýhou na straně druhé.
Dodává se v balení, které obsahuje 20, 60, 120 nebo 180 tablet, ale na trhu nemusí být dostupné
všechny velikosti.
Držitel rozhodnutí o registraci
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
Výrobce
Novartis Pharma GmbH Roonstrasse 25 D-90429 Norimberk Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci
|
Belgie/Belgique/Belgien Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
Lietuva Novartis Pharma Services Inc. Tel: +370 5 269 16 50 |
|
Bt^rapnn Novartis Pharma Services Inc. Ten.: +359 2 489 98 28 |
Luxembourg/Luxemburg Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
|
Česká republika Novartis s.r.o. Tel: +420 225 775 111 |
Magyarország Novartis Hungária Kft. Pharma Tel.: +36 1 457 65 00 |
|
Danmark Novartis Healthcare A/S Tlf: +45 39 16 84 00 |
Malta Novartis Pharma Services Inc. Tel: +356 2122 2872 |
|
Deutschland Novartis Pharma GmbH Tel: +49 911 273 0 |
Nederland Novartis Pharma B.V. Tel: +31 26 37 82 555 |
|
Eesti Novartis Pharma Services Inc. Tel: +372 66 30 810 |
Norge Novartis Norge AS Tlf: +47 23 05 20 00 |
|
EXlába Novartis (Hellas) A.E.B.E. TpA,: +30 210 281 17 12 |
Osterreich Novartis Pharma GmbH Tel: +43 1 86 6570 |
|
Espaňa Novartis Farmacéutica, S.A. Tel: +34 93 306 42 00 |
Polska Novartis Poland Sp. z o.o. Tel.: +48 22 375 4888 |
|
France Novartis Pharma S.A.S. Tél: +33 1 55 47 66 00 |
Portugal Novartis Farma - Produtos Farmaceuticos, S.A Tel: +351 21 000 8600 |
|
Hrvatska Novartis Hrvatska d.o.o. Tel. +385 1 6274 220 |
Románia Novartis Pharma Services Romania SRL Tel: +40 21 31299 01 |
|
Ireland Novartis Ireland Limited Tel: +353 1 260 12 55 |
Slovenija Novartis Pharma Services Inc. Tel: +386 1 300 75 50 |
|
Island Vistor hf. Sími: +354 535 7000 |
Slovenská republika Novartis Slovakia s.r.o. Tel: +421 2 5542 5439 |
|
Italia Novartis Farma S.p.A. Tel: +39 02 96 54 1 |
Suomi/Finland Novartis Finland Oy Puh/Tel: +358 (0)10 6133 200 |
|
Kúnpoq Novartis Pharma Services Inc. TpA,: +357 22 690 690 |
Sverige Novartis Sverige AB Tel: +46 8 732 32 00 |
|
Latvija Novartis Pharma Services Inc. Tel: +371 67 887 070 |
United Kingdom Novartis Pharmaceuticals UK Ltd. Tel: +44 1276 698370 |
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
Příbalová informace: informace pro uživatele
Glivec 400 mg potahované tablety
Imatinibum
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Glivec a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Glivec užívat
3. Jak se Glivec užívá
4. Možné nežádoucí účinky
5. Jak Glivec uchovávat
6. Obsah balení a další informace
1. Co je Glivec a k čemu se používá
Glivec je lék obsahující léčivou látku imatinib. Tento lék tlumí růst abnormálních buněk u níže uvedených onemocnění, zahrnujících některé typy nádorů.
Glivec se užívá k léčbě dospělých a dětí s:
- Chronickou myeloidní leukemií (CML). Leukemie je nádorové onemocnění bílých krvinek. Bílé krvinky obvykle pomáhají organismu bojovat proti infekci. Chronická myeloidní leukemie je forma leukemie, při které určité abnormální bílé krvinky (nazvané myeloidní buňky) začnou růst nekontrolovaně.
- Philadelphia chromozom pozitivní akutní lymfatickou leukemií (Ph-pozitivní ALL).
Leukemie je nádorové onemocnění bílých krvinek. Tyto bílé krvinky obvykle pomáhají tělu bojovat proti infekci. Akutní lymfatická leukemie je forma leukemie, při které určité abnormální bílé krvinky (nazvané lymfoblasty) začnou nekontrolovaně růst. Glivec tlumí růst těchto buněk.
Glivec se také užívá k léčbě dospělých s:
- Myelodysplatickým/myeloproliferativním onemocněním (MDS/MPD). Jde o onemocnění krve, při kterém některé bílé krvinky začnou růst nekontrolovaně. Glivec tlumí růst těchto buněk u některého typu těchto onemocnění.
- Syndromem hypereozinofilie (HES) a/nebo chronickou eozinofilní leukemií (CEL). Jsou to krevní onemocnění, při nichž určité krvinky (nazvané eozinofily) začnou růst nekontrolovaně. Glivec tlumí růst těchto buněk u některého typu těchto onemocnění.
- Zhoubnými, stromálními nádory zažívacího traktu (GIST). GIST je nádorové onemocnění žaludku a střev. Vzniká nekontrolovaným růstem podpůrné tkáně těchto orgánů.
- Dermatofibrosarkomem protuberans (DFSP). DFSP je nádorové onemocnění pojivové tkáně, při kterém některé buňky začnou růst nekontrolovaně. Glivec tlumí růst těchto buněk.
V následujícím textu této příbalové informace budeme pro tato onemocnění používat zkratky
Jestliže máte nějaké dotazy, jak Glivec působí, nebo proč byl tento lék předepsán právě Vám, zeptejte
se svého lékaře.
2. Čemu musíte věnovat pozornost, než začnete Glivec užívat
Glivec Vám bude předepsán pouze lékařem, který má zkušenosti s léčbou nádorového onemocnění krve nebo solidních nádorů (pevných ohraničených nádorů).
Dodržujte pečlivě všechna doporučení lékaře, i když se budou lišit od obecných informací uvedených v této příbalové informaci.
Neužívejte Glivec:
- jestliže jste alergický(á) na imatinib nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Pokud se Vás to týká, oznamte to svému lékaři, aniž byste Glivec užíval(a).
Jestliže si myslíte, že můžete být alergický(á) ale nejste si tím jistý(á), požádejte lékaře o radu. Upozornění a opatření
Před užitím Glivecu se poraďte se svým lékařem:
- když máte nebo jste v minulosti měl(a) zdravotní potíže s játry, ledvinami nebo se srdcem
- jestliže užíváte levothyroxine z důvodu odstranění Vaší štítné žlázy.
- pokud j ste někdy měl (a) infekční hepatitidu B (žloutenka typu B) nebo toto onemocnění máte v současné době. Přípravek GLIVEC může hepatitidu B znovu aktivovat, což může v některých případech vést k úmrtí. Před zahájením léčby lékař pacienty pečlivě vyšetří s ohledem na možný výskyt známek této infekce.
Jestliže se Vás cokoliv z výše uvedeného týká, oznamte to lékaři před užíváním Glivecu.
Pokud začnete velmi rychle přibývat na váze během léčby Glivecem, sdělte to ihned svému lékaři. Glivec může způsobit zadržování vody ve Vašem těle (závažnou retenci tekutin).
Během užívání Glivecu bude Váš lékař pravidelně sledovat, zda lék účinkuje. Také Vám bude pravidelně kontrolován krevní obraz a tělesná hmotnost.
Děti a dospívající
Glivec je také léčba pro děti s CML. Nejsou žádné zkušenosti s podáváním u dětí s CML mladších než 2 roky. Zkušenosti s podáváním u dětí s Ph-pozitivní ALL jsou omezené a u dětí s MDS/MPD, DFSP, GIST a HES/CEL jsou velmi omezené.
U některých dětí a dospívajících, kteří užívají Glivec, se může projevit pomalejší tělesný růst, než je běžné. Lékař bude sledovat růst při pravidelných návštěvách.
Další léčivé přípravky a Glivec
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat, a to i o lécích, které jsou dostupné bez lékařského předpisu (jako je paracetamol), včetně léčivých rostlin (jako je třezalka tečkovaná). Některé léky, pokud jsou užívány společně s Glivecem, mohou účinek Glivecu ovlivňovat. Mohou zvýšit nebo naopak snížit účinnost Glivecu, což vede buď ke zvýšení jeho nežádoucích účinků nebo ke snížení jeho účinnosti. Stejně tak může Glivec ovlivňovat i některé jiné léky.
Informujte svého lékaře, pokud užíváte léky zamezující tvorbě krevních sraženin.
Těhotenství, kojení a fertilita
- Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat.
- Užívání Glivecu během těhotenství se nedoporučuje, pokud to není nezbytně nutné, protože může poškodit Vaše dítě. Váš lékař Vám vysvětlí možná rizika užívání Glivecu během těhotenství.
- Ženám, které by mohly otěhotnět, se doporučuje během léčby účinná antikoncepce.
- Během léčby Glivecem nekojte.
- Pacienti, kteří se obávají o svou fertilitu během užívání Glivecu, by se měli poradit se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Při užívání tohoto léku můžete pociťovat závrať nebo ospalost nebo neostře vidět, Pokud se to stane, neřiďte nebo neobsluhujte žádné přístroje nebo stroje, dokud se nebudete opět cítit dobře.
3. Jak se Glivec užívá
Váš lékař Vám předepsal Glivec, protože máte závažné onemocnění. Glivec Vám může pomoci v boji proti tomuto stavu.
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Je důležité pokračovat v léčbě tak dlouho, jak Vám lékař nebo lékárník sdělí. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Nepřerušujte užívání Glivecu, dokud Vám to Váš lékař neřekne. Pokud nemůžete užívat lék podle pokynů Vašeho lékaře nebo si myslíte, že ho již nepotřebujete, kontaktujte okamžitě svého lékaře.
Kolik Glivecu máte užívat
Použití u dospělých
Váš lékař Vám přesně sdělí, kolik tablet Glivecu máte užívat.
- Jestliže jste léčen(a) pro CML:
Podle stavu Vašeho onemocnění je obvyklá počáteční dávka 400 mg nebo 600 mg.
- 400 mg užitých jako jedna tableta jednou denně,
- 600 mg užitých j ako j edna 400 mg tableta a dvě 100 mg tablety jednou denně.
- Jestliže jste léčen(a) pro GIST:
Počáteční dávka je 400 mg užitá jako jedna tableta jednou denně.
Pro CML a GIST může Váš lékař podle Vaší odpovědi na léčbu předepsat zvýšení nebo snížení dávky. Jestliže je Vaše denní dávka 800 mg (2 tablety), měl(a) byste užívat jednu tabletu ráno a druhou tabletu večer.
- Jestliže jste léčen(a) pro Ph-pozitivní ALL:
Počáteční dávka je 600 mg užitá jako jedna 400 mg tableta a dvě 100 mg tablety jednou denně.
- Jestliže jste léčen(a) pro MDS/MPD:
Počáteční dávka je 400 mg užitá jako jedna tableta jednou denně.
- Jestliže jste léčen(a) pro HES/CEL:
Počáteční dávka 100 mg užitá jako jedna 100 mg tableta jednou denně. Podle Vaší odpovědi na léčbu může Váš lékař zvážit zvýšení dávky na 400 mg užitých jako jedna tableta 400 mg jednou denně.
- Jestliže jste léčen(a) pro DFSP:
Dávka je 800 mg denně (2 tablety) užitá jako jedna tableta ráno a druhá tableta večer.
Použití u dětí a dospívajících
Lékař Vám řekne, kolik tablet Glivecu by mělo být podáno Vašemu dítěti užívat. Množství podaného Glivecu závisí na zdravotním stavu Vašeho dítěte, na jeho tělesné hmostnosti a výšce. Celková podaná denní dávka u dětí nesmí překročit dávku 800 mg pro CML a 600 mg pro Ph-pozitivní ALL. Léčba může být Vašemu dítěti podávána buď jednou denně, nebo může být dávka rozdělena do dvou podání (polovina dávky ráno a polovina večer).
Kdy a jak užívat Glivec
- Glivec užívejte s jídlem. Můžete tak předejít žaludečním potížím při užívání Glivecu.
- Tablety polykejte celé a zapijte je velkou sklenicí vody.
Jestliže nemůžete tablety polykat celé, můžete je rozpustit ve sklenici neperlivé vody nebo v jablečném džusu.
• Použijte přibližně 200 ml pro každou 400 mg tabletu.
• Míchejte lžící, dokud se tablety zcela nerozpustí.
• Když je tableta rozpuštěná, vypijte ihned celý obsah sklenice. Stopy rozpuštěných tablet mohou zůstat na sklenici.
Jak dlouho se Glivec užívá
Glivec užívejte denně tak dlouho, jak Vám lékař sdělí.
Jestliže jste užil(a) více Glivecu, než jste měl(a)
Jestliže jste nedopatřením užil(a) příliš mnoho tablet, sdělte to ihned svému lékaři. Můžete potřebovat lékařskou pomoc. Přineste balení léku sebou.
Jestliže jste zapomněl(a) užít Glivec
- Jestliže jste zapomněl užít dávku, užijte ji ihned, jakmile si vzpomenete. Pokud se však blíží doba další dávky, vynechte zapomenutou dávku.
- Poté pokračujte v obvyklém rozvrhu.
- Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. Ty jsou obvykle mírné až středně závažné.
Některé nežádoucí účinky mohou být závažné. Informujte okamžitě svého lékaře, pokud se u Vás projeví.
Velmi časté (mohou postihnout více než 1 z 10 lidí) nebo časté nežádoucí účinky (mohou postihnout až 1 z 10 lidí):
• Rychlý přírůstek na váze. Glivec může způsobit zadržování vody v těle (závažná retence tekutin).
• Příznaky infekce, jako je horečka, silná zimnice, bolesti v krku nebo vřídky v ústech. Glivec může snižovat počet bílých krvinek v krvi, a tak u Vás může snáze dojít k infekci.
• Neočekávané krvácení nebo výskyt modřin (bez Vašeho zavinění).
Méně časté (mohou postihnout až 1 ze 100 lidí) nebo vzácné nežádoucí účinky (mohou postihnout až 1 z 1000 lidí):
• Bolest na hrudi, nepravidelný srdeční tep (příznaky srdečních potíží).
• Kašel, ztížené nebo bolestivé dýchání (příznaky plicních potíží).
• Točení hlavy, závratě nebo mdloby (příznaky nízkého krevního tlaku).
• Pocit na zvracení, se ztrátou chuti k jídlu, tmavě zabarvená moč, žloutnutí kůže nebo očního bělma (příznaky jaterních potíží).
• Vyrážka, červená kůže s puchýřky na rtech, očích, kůži nebo v ústech, olupování kůže, horečka, zčervenání nebo nachová místa na kůži, svědění, pocit pálení, puchýřkovitá vyrážka (příznaky kožních potíží).
• Silné bolesti břicha, krev ve zvratcích, stolici nebo v moči, černá stolice (příznaky potíží zažívacího traktu).
• Závažný pokles výdeje moči, pocit žízně (příznaky potíží ledvin).
• Pocit nevolnosti (nauzea) s průjmem a zvracením, bolest břicha nebo horečka (příznaky střevních potíží).
• Silné bolesti hlavy, slabost nebo ochromení končetin nebo obličeje, potíže s mluvením, náhlá ztráta vědomí (příznaky potíží nervového systému jako je krvácení nebo otoky uvnitř lebky/mozku).
• Bledá kůže, pocit únavy a dušnost a tmavá moč (příznaky malého množství červených krvinek).
• Bolesti očí nebo zhoršené vidění, krvácení do očí.
• Bolest v kyčlích nebo potíže při chůzi.
• Necitlivé nebo studené prsty na rukou i nohou (příznaky Raynaudova syndromu).
• Náhlé otoky a zčervenání kůže (příznaky kožní infekce zvané celulitida).
• Potíže se sluchem.
• Svalová slabost a svalové křeče s abnormálním srdečním rytmem (příznaky změn hladiny
draslíku v krvi).
• Podlitiny.
• Bolest žaludku s pocitem nevolnosti (nauzea).
• Svalové křeče s horečkou, rudohnědou močí, bolestí svalů nebo svalovou ochablostí (příznaky svalových potíží).
• Bolest pánve někdy spojená s nevolností a zvracením, s neočekávaným vaginálním (poševním) krvácením, pocit závrati,nebo mdloby z důvodu nízkého krevního tlaku (příznaky potíží Vašich vaječníků nebo dělohy).
• Nevolnost, zkrácený dech, nepravidelný srdeční tep, zakalená moč, únava a/nebo kloubní potíže spojené s neobvyklými výsledky laboratorních testů (např. vysoká hladina draslíku, kyseliny močové a vápníku a nízké hladiny fosforu v krvi).
Není známo (četnost z dostupných údajů nelze určit):
• Kombinace závažné rozsáhlé vyrážky, pocitu nevolnosti, horečky, vysokého počtu určitého typu bílých krvinek či žlutá barva kůže nebo očí (příznaky žloutenky) s dušností, bolestí/nepříjemným pocitem na hrudi, výrazným snížením objemu moči a pocitem žízně atd. (příznaky alergické reakce spojené s léčbou).
• Chronické selhání ledvin.
• Recidiva (reaktivace) hepatitidy B, pokud jste v minulosti měl(a) toto onemocnění (infekce jater).
Pokud se u Vás projeví jakýkoli z výše uvedených nežádoucích účinků, oznamte to okamžitě svému
lékaři.
Jiné nežádoucí účinky mohou zahrnovat:
Velmi časté (mohou postihnout více než 1 z 10 lidí):
• Bolesti hlavy nebo pocit únavy.
• Pocit nevolnosti (nauzea), slabost (zvracení), průjem nebo porucha zažívání.
• Vyrážka.
• Svalové křeče nebo bolesti kloubů, svalů a kostí.
• Otoky, jako např. otoky kolem kotníků nebo oteklé oči.
• Zvýšení hmotnosti.
Jestliže Vás cokoliv z tohoto závažně postihne, sdělte to svému lékaři.
Časté (mohou postihnout až 1 z 10 lidí):
• Nechutenství, ztráta hmotnosti nebo porušení chuti k jídlu.
• Pocit závratě a slabosti.
• Potíže se spánkem (nespavost).
• Výtok z očí se svěděním, zarudnutí a otoky (zánět spojivek), zvýšená produkce slz nebo neostré vidění.
• Krvácení z nosu.
• Bolesti nebo zduření břicha, nadýmání, pálení žáhy nebo zácpa.
• Svědění.
• Neobvyklá ztráta vlasů nebo j ej ich prořídnutí.
• Znecitlivění rukou nebo nohou.
• Vřídky v ústech.
• Bolesti kloubů s otoky.
• Sucho v ústech, suchá pleť nebo suché oči.
• Snížená nebo zvýšená citlivost kůže.
• Návaly horka, mrazení nebo noční pocení.
Jestliže Vás cokoliv z tohoto závažně postihne, sdělte to svému lékaři.
Není známo (četnost z dostupných údajů nelze určit):
• Zčervenání a/nebo otoky dlaní rukou a chodidel, které mohou být doprovázené pocitem brnění a pálení.
• Zpomalení růstu u dětí a dospívajících.
Jestliže Vás cokoliv z tohoto závážně postihne, sdělte to svému lékaři.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Glivec uchovávat
• Uchovávejte tento přípravek mimo dohled a dosah dětí.
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce.
• Neuchovávejte při teplotě nad 30°C.
• Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
• Nepoužívejte, jestliže je obal poškozený nebo zaznamenáte známky jeho porušení.
• Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co Glivec obsahuje
- Léčivou látkou je imatinibi mesilas. Jedna tableta Glivecu obsahuje 400 mg imatinibu (jako mesylát).
- Dalšími složkami jsou mikrokrystalická celulosa, krospovidon, hypromelosa, magnesium-stearát, bezvodý oxid křemičitý.
- Potahová vrstva tablety je vyrobena z červeného oxidu železitého (E172), žlutého oxidu železitého (E172), makrogolu, mastku a hypromelosy.
Jak Glivec vypadá a co obsahuje toto balení
Glivec 400 mg potahované tablety jsou velmi tmavě žluté až hnědooranžové oválné potahované
tablety. Jsou označené „glivec“ na jedné straně.
Dodává se v balení, které obsahuje 10, 30 nebo 90 tablet, ale na trhu nemusí být dostupné všechny
velikosti.
Držitel rozhodnutí o registraci
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
Výrobce
Novartis Pharma GmbH Roonstrasse 25 D-90429 Norimberk Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci
|
Belgie/Belgique/Belgien Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
Lietuva Novartis Pharma Services Inc. Tel: +370 5 269 16 50 |
|
Bt^rapnn Novartis Pharma Services Inc. Ten.: +359 2 489 98 28 |
Luxembourg/Luxemburg Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
|
Česká republika Novartis s.r.o. Tel: +420 225 775 111 |
Magyarország Novartis Hungária Kft. Pharma Tel.: +36 1 457 65 00 |
|
Danmark Novartis Healthcare A/S Tlf: +45 39 16 84 00 |
Malta Novartis Pharma Services Inc. Tel: +356 2122 2872 |
|
Deutschland Novartis Pharma GmbH Tel: +49 911 273 0 |
Nederland Novartis Pharma B.V. Tel: +31 26 37 82 555 |
|
Eesti Novartis Pharma Services Inc. Tel: +372 66 30 810 |
Norge Novartis Norge AS Tlf: +47 23 05 20 00 |
|
EXlába Novartis (Hellas) A.E.B.E. TpA,: +30 210 281 17 12 |
Osterreich Novartis Pharma GmbH Tel: +43 1 86 6570 |
|
Espaňa Novartis Farmacéutica, S.A. Tel: +34 93 306 42 00 |
Polska Novartis Poland Sp. z o.o. Tel.: +48 22 375 4888 |
|
France Novartis Pharma S.A.S. Tél: +33 1 55 47 66 00 |
Portugal Novartis Farma - Produtos Farmaceuticos, S.A Tel: +351 21 000 8600 |
|
Hrvatska Novartis Hrvatska d.o.o. Tel. +385 1 6274 220 |
Románia Novartis Pharma Services Romania SRL Tel: +40 21 31299 01 |
|
Ireland Novartis Ireland Limited Tel: +353 1 260 12 55 |
Slovenija Novartis Pharma Services Inc. Tel: +386 1 300 75 50 |
|
Island Vistor hf. Sími: +354 535 7000 |
Slovenská republika Novartis Slovakia s.r.o. Tel: +421 2 5542 5439 |
|
Italia Novartis Farma S.p.A. Tel: +39 02 96 54 1 |
Suomi/Finland Novartis Finland Oy Puh/Tel: +358 (0)10 6133 200 |
|
Kúnpoq Novartis Pharma Services Inc. TpA,: +357 22 690 690 |
Sverige Novartis Sverige AB Tel: +46 8 732 32 00 |
|
Latvija Novartis Pharma Services Inc. Tel: +371 67 887 070 |
United Kingdom Novartis Pharmaceuticals UK Ltd. Tel: +44 1276 698370 |
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
202