Giotrif 50 Mg
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
GIOTRIF 20 mg potahované tablety GIOTRIF 30 mg potahované tablety GIOTRIF 40 mg potahované tablety GIOTRIF 50 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ GIOTRIF 20 mg potahované tablety
Jedna potahovaná tableta obsahuje afatinibum 20 mg (ve formě afatinibi dimaleas).
Pomocná látka se známým účinkem: Jedna potahovaná tableta obsahuje 118 mg laktosy (ve formě monohydrátu).
GIOTRIF 30 mg potahované tablety
Jedna potahovaná tableta obsahuje afatinibum 30 mg (ve formě afatinibi dimaleas).
Pomocná látka se známým účinkem: Jedna potahovaná tableta obsahuje 176 mg laktosy (ve formě monohydrátu).
GIOTRIF 40 mg potahované tablety
Jedna potahovaná tableta obsahuje afatinibum 40 mg (ve formě afatinibi dimaleas).
Pomocná látka se známým účinkem: Jedna potahovaná tableta obsahuje 235 mg laktosy (ve formě monohydrátu).
GIOTRIF 50 mg potahované tablety
Jedna potahovaná tableta obsahuje afatinibum 50 mg (ve formě afatinibi dimaleas).
Pomocná látka se známým účinkem: Jedna potahovaná tableta obsahuje 294 mg laktosy (ve formě monohydrátu).
Úplný seznam pomocných látek, viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta (tableta).
GIOTRIF 20 mg potahované tablety
Bílá až nažloutlá kulatá bikonvexní potahovaná tableta se zkoseným okrajem, s vyraženým kódem „T20“ na jedné straně a logem společnosti Boehringer Ingelheim na straně druhé.
GIOTRIF 30 mg potahované tablety
Tmavě modrá kulatá bikonvexní potahovaná tableta se zkoseným okrajem, s vyraženým kódem „T30“ na jedné straně a logem společnosti Boehringer Ingelheim na straně druhé.
GIOTRIF 40 mg potahované tablety
Světle modrá kulatá bikonvexní potahovaná tableta se zkoseným okrajem, s vyraženým kódem „T40“ na jedné straně a logem společnosti Boehringer Ingelheim na straně druhé.
GIOTRIF 50 mg potahované tablety
Tmavě modrá oválná bikonvexní potahovaná tableta s vyraženým kódem „T50“ na jedné straně a logem společnosti Boehringer Ingelheim na straně druhé.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
GIOTRIF je indikován jako monoterapie k léčbě
• dospělých pacientů s lokálně pokročilým nebo metastatickým nemalobuněčným karcinomem plic (NSCLC) s aktivačními mutacemi receptoru pro epidermální růstový faktor (EGFR) dosud neléčených EGFR TKI;
• lokálně pokročilým nebo metastatickým NSCLC se skvamózní histologií progredujícím při léčbě chemoterapií na bázi platiny nebo po této terapii (viz bod 5.1).
4.2 Dávkování a způsob podání
Léčba přípravkem GIOTRIF musí být zahájena a dozorována lékařem se zkušenostmi s protinádorovou léčbou.
Před zahájením léčby přípravkem GIOTRIF je třeba určit mutační stav EGFR (viz bod 4.4).
Dávkování
Doporučená dávka je 40 mg jednou denně.
Tento léčivý přípravek je nutno užívat bez potravy. Potrava nesmí být konzumována nejméně 3 hodiny před užitím přípravku a nejméně 1 hodinu po něm (viz body 4.5 a 5.2).
V léčbě přípravkem GIOTRIF je nutno pokračovat až do případné progrese onemocnění nebo do vzniku nesnášenlivosti léčby pacientem (viz dále tabulka 1).
Stupňování dávky
Stupňování dávky k maximu 50 mg/den lze zvažovat u pacientů, kteří tolerují úvodní dávku 40 mg/den (tj. neobjevil se u nich průjem, kožní vyrážka, stomatitida či jiné nežádoucí účinky CTCAE se stupněm > 1) během prvního cyklu léčby (21 dnů u NSCLC s mutací EGFR a 28 dnů u skvamózního NSCLC). Dávka se nesmí stupňovat u pacientů s dřívějším snížením dávky.
Maximální denní dávka je 50 mg.
Úprava dávky z důvodu nežádoucích účinků
Symptomatické nežádoucí účinky (například závažný či přetrvávající průjem nebo kožní nežádoucí účinky) lze úspěšně zvládnout přerušením léčby a snížením dávky nebo vysazením léčby přípravkem GIOTRIF, jak uvádí tabulka 1 (viz body 4.4 a 4.8).
Tabulka 1: Informace o úpravě dávky z důvodu nežádoucích účinků
|
CTCAEa nežádoucí účinek |
Doporučené dávkování | |
|
Stupeň 1 nebo stupeň 2 |
Bez přerušeníb |
Bez úpravy dávky |
|
Stupeň 2 (dlouhotrvající0 nebo nesnesitelný) nebo stupeň > 3 |
Přerušit do dosažení stupně 0/1b |
Znovu zahájit dávkou sníženou o 10 mgd |
a NCI obvyklá terminologická kritéria nežádoucích účinků
b V případě vzniku průjmu je třeba ihned podat antidiaroika (například loperamid) a pokračovat v jejich podávání při trvání průjmu, dokud neustane. c > 48 hodin trvání průjmu a/nebo > 7 dní kožní vyrážky
d Jestliže pacient netoleruje 20 mg/den, je nutno zvážit trvalé vysazení přípravku GIOTRIF
Je třeba uvažovat o intersticiálním plicním onemocnění (ILD), pokud se u pacienta rozvíjí akutní nebo zhoršující se respirační příznaky a v takovém případě je nutno léčbu přerušit až do získání výsledků příslušných vyšetření. Pokud je diagnostikováno ILD, je nutno podávání přípravku GIOTRIF přerušit a zahájit příslušnou léčbu podle potřeby (viz bod 4.4).
Opomenutá dávka
Pokud pacient zapomene užít dávku přípravku, je třeba ji užít tentýž den, jakmile si na ni pacient vzpomene. Pokud však má užít další plánovanou dávku již za méně než 8 hodin, pak je třeba opomenutou dávku vynechat.
Podávání inhibitorů glykoproteinu P (P-gp inhibitorů)
Pokud je nutné podávání inhibitorů glykoproteinu P, je třeba jejich dávku podávat střídavě, t.j. dávka inhibitoru P-gp se musí podat tak dlouho od podání dávky přípravku GIOTRIF, jak je to možné. To znamená nejlépe 6 hodin (pro P-gp inhibitory podávané dvakrát denně) nebo 12 hodin (pro P-gp inhibitory podávané jednou denně) od podání přípravku GIOTRIF (viz bod 4.5).
Pacienti s poruchou funkce ledvin
Bezpečnost, farmakokinetika a účinnost tohoto přípravku nebyly zkoumány ve studii k tomu určené u pacientů s poruchou funkce ledvin. Úprava úvodní dávky není nutná u pacientů s mírnou nebo středně závažnou poruchou funkce ledvin. Léčba u pacientů s těžkou poruchou funkce ledvin (clearance kreatininu < 30 ml/min) se nedoporučuje (viz bod 5.2).
Pacienti s poruchou funkce jater
Expozice vůči afatinibu není významně změněna u pacientů s mírnou (Child Pugh A) nebo středně závažnou (Child Pugh B) poruchou funkce jater (viz bod 5.2). Úprava úvodní dávky není nutná u pacientů s mírnou nebo středně závažnou poruchou funkce jater. Přípravek nebyl zkoumán u pacientů s těžkou (Child Pugh C) poruchou funkce jater. Léčba se u této populace nedoporučuje (viz bod 4.4).
Pediatrická populace
Neexistuje žádné odpovídající použití přípravku GIOTRIF u pediatrické populace v indikaci NSCLC. Proto se léčba dětí nebo dospívajících tímto přípravkem nedoporučuje.
Způsob podání
Léčivý přípravek je indikován pro perorální podání. Tablety je nutno spolknout vcelku a zapít vodou. Pokud není možné spolknout tablety celé, lze tablety rozpustit přibližně ve 100 ml pitné vody nesycené oxidem uhličitým. Žádné jiné tekutiny nelze použít. Tabletu je nutno vhodit do vody bez rozdrcení a příležitostně s ní míchat až po dobu 15 minut, dokud se nerozpadne na velice malé částice. Tuto disperzi je nutno ihned zkonzumovat. Sklenici je třeba vypláchnout pomocí přibližně 100 ml vody, kterou je také nutno zkonzumovat. Disperzi lze rovněž podávat cestou gastrické sondy.
4.3 Kontraindikace
Hypersenzitivita na afatinib nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití Hodnocení mutačního stavu EGFR
Při hodnocení mutačního stavu EGFR u pacienta je důležité zvolit dobře validovanou a komplexní metodologii, aby nedocházelo k falešně negativním nebo falešně pozitivním výsledkům.
Během léčby přípravkem GIOTRIF byl hlášen průjem, včetně závažného průjmu (viz bod 4.8). Průjem může mít za následek dehydrataci se zhoršením funkce ledvin nebo bez něj, což ve vzácných případech mělo až fatální následky. Průjem obvykle nastal během prvních 2 týdnů léčby. Průjem stupně 3 se nejčastěji vyskytoval v prvních 6 týdnech léčby.
Při průjmu jsou důležitá proaktivní opatření, která zahrnují adekvátní hydrataci kombinovanou s podáním antidiaroik zejména v prvních 6 týdnech léčby a je nutno je zahájit již při prvních známkách průjmu. Antidiaroika (například loperamid) je nutno podávat, a pokud je to nezbytné, jejich dávku je třeba zvyšovat až k nejvyšší schválené doporučené dávce. Antidiaroika musí mít pacienti pohotově k dispozici tak, aby bylo možno léčbu zahájit při prvních známkách průjmu a pokračovat v ní, dokud průjmovité stolice neustanou po dobu 12 hodin. Pacienti se závažným průjmem mohou vyžadovat přerušení podávání, snížení dávky nebo vysazení léčby přípravkem GIOTRIF (viz bod 4.2). Pacienti, u kterých nastala dehydratace, mohou vyžadovat intravenózní podání elektrolytů a tekutin.
Kožní nežádoucí účinky
U pacientů léčených tímto přípravkem byla hlášena kožní vyrážka/akné (viz bod 4.8). Obecně se vyrážka projevuje jako erytematózní a akneiformní, mírná nebo středně závažná, a může se vyskytnout nebo se zhoršit v oblastech kůže, které jsou vystaveny slunečnímu záření. U pacientů, kteří jsou vystaveni slunečnímu záření, je vhodný ochranný oděv a použití krémů s ochranným faktorem proti slunečnímu záření. Časná intervence (jako jsou emoliencia či antibiotika) může v případě kožních reakcí podpořit nepřerušenou léčbu přípravkem GIOTRIF. Pacienti se závažnými kožními reakcemi mohou také vyžadovat dočasné přerušení léčby, snížení dávky (viz bod 4.2), dodatečnou léčebnou intervenci a odeslání ke specialistovi s odbornou erudicí v ošetřování těchto dermatologických účinků.
Byly hlášeny stavy se vznikem bul, puchýřů nebo s exfoliací kůže, včetně vzácných případů připomínajících Stevens-Johnsonův syndrom. Léčba přípravkem musí být přerušena nebo vysazena, pokud se u pacienta vyvíjí závažné bulózní, puchýřnaté nebo exfoliativní kožní postižení (viz bod 4.8).
Ženské pohlaví, nižší tělesná hmotnost a existující porucha funkce ledvin Vyšší expozice vůči afatinibu byla pozorována u žen, u pacientů s nižší tělesnou hmotností a u pacientů s existující poruchou funkce ledvin (viz bod 5.2). To může vést k vyššímu riziku vývoje nežádoucích účinků, zejména průjmu, vyrážky/akné a stomatitidy. U pacientů s těmito rizikovými faktory se doporučuje přísnější sledování.
Intersticiální plicní nemoc (ILD)
U pacientů užívajících GIOTRIF k léčbě NSCLC se objevily zprávy o ILD nebo nežádoucích účincích připomínajících ILD (jako je infiltrace plic, pneumonitida, syndrom akutní respirační tísně ARDS, alergická alveolitida), a to včetně fatálních příhod. Nežádoucí účinky podobné ILD byly hlášeny u 0,7 % pacientů léčených přípravkem GIOTRIF ve všech klinických hodnoceních (včetně 0,5 % pacientů s nežádoucími účinky podobnými ILD se stupněm CTCAE 3 a vyšším). Pacienti s anamnézou ILD nebyli studováni.
K vyloučení ILD je třeba pečlivě zhodnotit všechny pacienty s akutním rozvojem a/nebo s nevysvětleným zhoršením plicních příznaků (dušnost, kašel, horečka). Léčba přípravkem musí být přerušena až do vyšetření těchto příznaků. Pokud je diagnostikováno ILD, je třeba podávání přípravku GIOTRIF trvale přerušit a zahájit příslušnou léčbu podle potřeby (viz bod 4.2).
Těžká porucha funkce jater
Jaterní selhání, včetně fatálních, byla hlášena během léčby tímto přípravkem u méně než 1 % pacientů. Zavádějící faktory u těchto pacientů zahrnovaly předchozí jaterní onemocnění a/nebo komorbidity spojené s progresí základního maligního onemocnění. U pacientů s předchozím jaterním onemocněním se doporučuje periodické vyšetřování jaterních testů. V pivotních studiích bylo zvýšení hodnot alaninaminotransferázy (ALT) a aspartátaminotransferázy (AST) stupně 3 pozorováno u 2,4 % (LUX-Lung 3) a 1,6 % (LUX-Lung 8) pacientů s nor^uální^ui výchozí^ui hodnota^ui jaterních testů, kteří byli léčeni dávkou 40 mg/den. Ve studii LUX-Lung 3 bylo zvýšení ALT/AST stupně 3 přibližně 3,5násobné u pacientů s abnormálními výchozími hodnotami jaterních testů. Ve studii LUX-Lung 8 se u pacientů s abnormálními výchozími jaterními testy nevyskytovala žádná zvýšení ALT/AST stupně 3 (viz bod 4.8). Může nastat nutnost přerušit podávání přípravku u pacientů se zhoršením funkce jater (viz bod 4.2). U pacientů, u kterých dojde k vývoji závažného zhoršení funkce jater během užívání přípravku GIOTRIF, je nutno léčbu přerušit.
Keratitida
Příznaky, jako je akutní nebo zhoršující se oční zánět, slzení, citlivost na světlo, rozmazané vidění, bolest očí a/nebo zčervenání oka, je třeba okamžitě řešit za pomoci oftalmologa. Pokud je potvrzena diagnóza ulcerózní keratitidy, je třeba léčbu přerušit nebo vysadit. Pokud je diagnostikována keratitida, je nutno pečlivě zvážit výhody a rizika pokračování léčby. Přípravek je nutno podávat s opatrností u pacientů s anamnézou keratitidy, ulcerózní keratitidy nebo závažné suchosti očí. Rizikovým faktorem pro vznik keratitidy a ulcerací je také používání kontaktních čoček (viz bod 4.8).
Funkce levé komory
S inhibicí HER2 byla spojena dysfunkce levé srdeční komory. Na základě dostupných údajů z klinických studií neexistují žádné náznaky, že tento léčivý přípravek vyvolává nežádoucí účinek na srdeční kontraktilitu. Přípravek však nebyl zkoumán u pacientů s abnormální ejekční frakcí levé komory (LVEF) nebo u pacientů s významnou kardiální anamnézou. U pacientů s kardiálními rizikovými faktory a u pacientů se stavy, které mohou ejekční frakci levé komory ovlivnit, je nutno zvážit monitoraci stavu srdce, a to včetně zhodnocení LVEF při počátečním vyšetření a během léčby. U pacientů, u kterých dojde během léčby k vývoji významných kardiálních potíží nebo příznaků, je nutno zvážit monitorování stavu srdce a to včetně zhodnocení LVEF.
U pacientů, jejichž hodnota ejekční frakce je nižší než místní dolní hranice normy, je nutno zvážit konzultaci kardiologa, stejně jako přerušení léčby přípravkem nebo její vysazení.
Interakce s glykoproteinem P (P-gp)
Současná léčba silnými induktory P-gp může snížit expozici vůči afatinibu (viz bod 4.5).
Laktosa
Tento léčivý přípravek obsahuje laktosu. Pacienti se vzácnými dědičnými stavy s intolerancí galaktosy, vrozeným deficitem laktázy nebo s malabsorpcí glukosy a galaktosy by tento přípravek neměli užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Interakce s transportními systémy léčiv
Účinky inhibitorů glykoproteinu P (P-gp) a proteinu BCRP (breast cancer resistance protein) na afatinib
In vitro studie ukázaly, že afatinib je substrátem P-gp a BCRP. Když byl podáván silný inhibitor P-gp a BCRP ritonavir (200 mg dvakrát denně po dobu 3 dnů) 1 hodinu před jednotlivou dávkou 20 mg přípravku GIOTRIF, zvýšila se expozice vůči afatinibu o 48 % (plocha pod křivkou (AUC^)) a 39 % (maximální plazmatická koncentrace (Cmax)). Naproti tomu, když byl ritonavir podán současně respektive 6 hodin po dávce 40 mg přípravku GIOTRIF, byla relativní biologická dostupnost afatinibu 119 % (AUCo-<X)) a 104 % (Cmax), respektive 111 % (AUC0-OT) a 105 % (Cmax). Proto se doporučuje podávat dávku silných inhibitorů P-gp (včetně ritonaviru, cyklosporinu A, ketokonazolu, itrakonazolu, erythromycinu, verapamilu, chinidinu, takrolimu, nelfinaviru, sachinaviru, amiodaronu a dalších) střídavě, nejlépe 6 hodin nebo 12 hodin od podání přípravku GIOTRIF (viz bod 4.2).
Účinky induktorů P-gp na afatinib
Předcházející léčba rifampicinem (600 mg jednou denně po dobu 7 dní), který je silným induktorem P-gp, snížila plazmatickou expozici vůči afatinibu o 34 % (AUC0-OT) a 22 % (Cmax) po podání jednotlivé 40 mg dávky přípravku GIOTRIF. Silné induktory P-gp (včetně rifampicinu, karbamazepinu, fenytoinu, fenobarbitalu nebo třezalky tečkované (Hypericum perforatum) a dalších) mohou snížit expozici vůči afatinibu (viz bod 4.4).
Účinky afatinibu na substráty P-gp
Na podkladě in vitro údajů je afatinib středně silným inhibitorem P-gp. Podle klinických údajů se však považuje za nepravděpodobné, že by léčba přípravkem GIOTRIF vedla ke změnám plazmatických koncentrací jiných substrátů P-gp.
Interakce s proteinem BCRP
In vitro studie svědčily o tom, že afatinib je substrátem a inhibitorem transportního proteinu BCRP. Afatinib může zvýšit biologickou dostupnost perorálně podávaných substrátů pro BCRP (včetně rosuvastatinu, sulfasalazinu a dalších).
Účinek potravy na afatinib
Současné podávání jídla s vysokým obsahem tuku spolu s přípravkem GIOTRIF vedlo k významnému snížení expozice vůči afatinibu asi o 50 % pokud jde o Cmax a o 39 % pokud jde o AUC0-<X). Přípravek je nutno podávat bez potravy (viz body 4.2 a 5.2).
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku
Jako preventivní opatření musí být ženám ve fertilním věku doporučena opatření bránící vzniku těhotenství během léčby přípravkem GIOTRIF. Je třeba používat odpovídající antikoncepční metody a to během léčby a nejméně 1 měsíc po poslední dávce.
Mechanisticky vzato mají všechny léčivé přípravky cílené na EGFR potenciál způsobit poškození plodu.
Studie s afatinibem provedené u zvířat nenaznačily přímé nebo nepřímé škodlivé účinky s ohledem na reprodukční toxicitu (viz bod 5.3). Studie u zvířat nevykázaly žádné známky teratogenity až do úrovně letálních dávek pro matky. Nepříznivé změny byly omezeny na hladiny toxických dávek. Systémová expozice dosažená u zvířat se však pohybovala ve stejném rozmezí nebo na nižších hladinách, než byly hladiny pozorované u pacientů (viz bod 5.3).
Neexistují žádné nebo jen omezené údaje o použití toho léčivého přípravku u těhotných žen. Riziko pro člověka je tudíž neznámé. Pokud je přípravek GIOTRIF podáván během těhotenství nebo pokud pacientka otěhotní během nebo po užívání přípravku GIOTRIF, musí být informována o potenciálním riziku pro plod.
Kojení
Dostupné farmakokinetické údaje u zvířat prokázaly vylučování afatinibu do mléka (viz bod 5.3). Na základě toho je pravděpodobné, že se afatinib vylučuje do lidského mateřského mléka. Riziko pro kojené dítě nelze vyloučit. Matkám je nutno doporučit, aby při užívání přípravku nekojily.
Fertilita
Studie fertility u lidí nebyly s afatinibem provedeny. Dostupné neklinické toxikologické údaje ukázaly účinky na reprodukční orgány ve vyšších dávkách. Proto nelze nepříznivé účinky přípravku na fertilitu člověka vyloučit.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek GIOTRIF má jen malý vliv na schopnost řídit a obsluhovat stroje. Během léčby byly u některých pacientů hlášeny oční nežádoucí účinky (konjunktivitida, suché oči, keratitida) (viz bod 4.8), které mohou ovlivnit schopnost pacienta řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Typy nežádoucích účinků byly obecně spojeny s inhibičním mechanismem účinku afatinibu na receptor pro epidermální růstový faktor (EGFR). Souhrn všech nežádoucích účinků je uveden v tabulce 2. Nejčastějšími nežádoucími účinky byly průjem a nežádoucí příhody se vztahem ke kůži (viz bod 4.4), dále stomatitida a paronychie (viz také tabulka 3 a 4). Snížení dávky (viz bod 4.2) vedlo celkově k nižší frekvenci častých nežádoucích účinků.
U pacientů léčených jednou denně přípravkem GIOTRIF v dávce 40 mg se snížení dávky z důvodu nežádoucích účinků vyskytlo u 57 % pacientů ve studii LUX-Lung 3 a u 25 % pacientů ve studii LUX-Lung 8. Vysazení léčby z důvodu nežádoucích účinků průjmu a vyrážky/akné bylo 1,3 % respektive 0 % ve studii LUX-Lung 3 a 3,8 % respektive 2,0 % ve studii LUX-Lung 8.
Nežádoucí účinky podobné ILD byly hlášeny u 0,7 % pacientů léčených afatinibem. Bulózní, puchýřnaté a exfoliativní kožní projevy byly hlášeny, včetně vzácných případů podezření na Stevens-Johnsonův syndrom, i když v těchto případech byla možná alternativní etiologie (viz bod 4.4).
Tabulkový přehled nežádoucích účinků
Tabulka 2 shrnuje četnosti nežádoucích účinků ze všech studií NSCLC s denním podáváním přípravku GIOTRIF v dávce 40 mg nebo 50 mg ve formě monoterapie. Pro klasifikaci četností nežádoucích účinků se užívají následující termíny: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1000 až < 1/100); vzácné (> 1/10 000 až < 1/1000); velmi vzácné (< 1/10 000). V každé skupině četnosti jsou nežádoucí účinky uvedeny v pořadí podle klesající závažnosti.
Tabulka 2: Přehled nežádoucích účinků podle kategorie četnosti
|
Orgánový systém |
Velmi časté (> 1/10) |
Časté (> 1/100 až < 1/10) |
Méně časté (> 1/1000 až < 1/100) |
|
Infekce a infestace |
Paronychie1 |
Cystitida | |
|
Poruchy metabolismu a výživy |
Pokles chuti k jídlu |
Dehydratace Hypokalemie | |
|
Poruchy nervového systému |
Dysgeuzie | ||
|
Poruchy oka |
Konjunktivitida Suché oči |
Keratitida | |
|
Respirační, hrudní a mediastinální poruchy |
Epistaxe |
Rinorea |
Intersticiální plicní nemoc |
|
Gastrointestinální poruchy |
Stomatitida2 |
Cheilitida |
Pankreatitida |
|
Poruchy jater a žlučových cest |
Zvýšení alanin-aminotransferázy Zvýšení aspartát-aminotransferázy | ||
|
Poruchy kůže a podkožní tkáně |
Vyrážka3 Akneiformní dermatitida4 Pruritus5 Suchá kůže6 |
Syndrom palmo-plantární erytrodysestézie | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Svalové spasmy | ||
|
Poruchy ledvin a močových cest |
Porucha renální funkce/renální selhání | ||
|
Celkové poruchy a reakce v místě aplikace |
Pyrexie | ||
|
Vyšetření |
Pokles tělesné hmotnosti |
1 Zahrnuje paronychie, infekce nehtu, infekce nehtového lůžka
2 Zahrnuje stomatitidu, aftózní stomatitidu, zánět sliznice, ulcerace úst, eroze ústní sliznice, slizniční eroze, ulcerace sliznice
3 Zahrnuje skupinu preferovaných termínů vyrážky
4 Zahrnuje akné, pustulózní akné, akneiformní dermatitidu
5 Zahrnuje pruritus, generalizovaný pruritus
6 Zahrnuje suchou kůži, popraskanou kůži
Popis vybraných nežádoucích účinků
Velmi časté nežádoucí účinky, které se ve studii LUX-Lung 3 u pacientů léčených přípravkem GIOTRIF vyskytly nejméně v 10 %, jsou v tabulce 3 shrnuty podle kritérií stupně toxicity NCI-CTC (National Cancer Institute-Common Toxicity Criteria).
Tabulka 3: Velmi časté nežádoucí účinky ve studii LUX-Lung 3
|
GIOTRIF (40 mg/den) n=229 |
Pemetrexed/ Cisplatina n=111 | |||||
|
Stupeň NCI-CTC |
Jakýkoliv |
3 |
4 |
Jakýkoli |
3 |
4 |
|
stupeň |
v stupeň | |||||
|
Preferovaný termín MedDRA |
0/ % |
% |
% |
0/ % |
% |
% |
|
Infekce a infestace | ||||||
|
Paronychie1 |
57,6 |
11,4 |
0 |
0 |
0 |
0 |
|
Poruchy metabolismu a výživy | ||||||
|
Pokles chuti k jídlu |
20,5 |
3,1 |
0 |
53,2 |
2,7 |
0 |
|
Respirační, hrudní a mediastinální poruchy | ||||||
|
Epistaxe |
13,1 |
0 |
0 |
0,9 |
0,9 |
0 |
|
Gastrointestinální poruchy | ||||||
|
95,2 |
14,4 |
0 |
15,3 |
0 |
0 | |
|
Stomatitida2 |
69,9 |
8,3 |
0,4 |
13,5 |
0,9 |
0 |
|
Cheilitida |
12,2 |
0 |
0 |
0,9 |
0 |
0 |
|
Poruchy kůže a podkožní tkáně | ||||||
|
70,3 |
14 |
0 |
6,3 |
0 |
0 | |
|
Akneiformní dermatitida4 |
34,9 |
2,6 |
0 |
0 |
0 |
0 |
|
Suchá kůže5 |
29,7 |
0,4 |
0 |
1,8 |
0 |
0 |
|
Pruritus6 |
19,2 |
0,4 |
0 |
0,9 |
0 |
0 |
|
Vyšetření | ||||||
|
Pokles tělesné hmotnosti |
10,5 |
0 |
0 |
9,0 |
0 |
0 |
1 Zahrnuje paronychie, infekce nehtu, infekce nehtového lůžka
2 Zahrnuje stomatitidu, aftózní stomatitidu, zánět sliznice, ulcerace úst, eroze ústní sliznice, slizniční eroze, ulcerace sliznice
3 Zahrnuje skupinu preferovaných termínů vyrážky
4 Zahrnuje akné, pustulózní akné, akneiformní dermatitidu
5 Zahrnuje suchou kůži, popraskanou kůži
6 Zahrnuje pruritus, generalizovaný pruritus
Abnormality jaterních testů
U pacientů užívajících přípravek GIOTRIF 40 mg byly pozorovány abnormality jaterních testů (včetně zvýšení ALT a AST). Tato zvýšení byla zejména přechodná a nevedla k vysazení léčby. Stupeň 2 (> 2,5 až 5,0násobek horní hranice normálních hodnot (HHNH)) zvýšení ALT se vyskytl u < 8 % pacientů léčených tímto přípravkem. Stupeň 3 (> 5,0 až 20,0násobek HHNH) zvýšení se vyskytl u < 4 % pacientů léčených přípravkem GIOTRIF (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
Popis vybraných nežádoucích účinků
V tabulce 4 jsou podle stupně závažnosti dle kritérií toxicity NCI-CTC (National Cancer Institute-Common Toxicity Criteria) shrnuty velmi časté nežádoucí účinky, které se ve studii LUX-Lung 8 vyskytly u nejméně 10 % pacientů léčených přípravkem GIOTRIF.
Tabulka 4: Velmi časté nežádoucí účinky ve studii LUX-Lung 8*
|
GIOTRIF (40 mg/den) N=392 |
erlotinib N=395 | |||||
|
Stupeň NCI-CTC |
Jakýkoliv |
3 |
4 |
Jakýkoliv |
3 |
4 |
|
stupeň |
stupeň | |||||
|
Preferovaný termín MedDRA |
0/ /O |
% |
% |
0/ % |
% |
% |
|
Infekce a infestace | ||||||
|
Paronychie1 |
11,0 |
0,5 |
0 |
5,1 |
0,3 |
0 |
|
Poruchy metabolismu a výživy | ||||||
|
Pokles chuti k jídlu |
24,7 |
3,1 |
0 |
26,1 |
2,0 |
0 |
|
Gastrointestinální poruchy | ||||||
|
74,7 |
9,9 |
0,8 |
41,3 |
3,0 |
0,3 | |
|
Stomatitida2 |
30,1 |
4,1 |
0 |
10,6 |
0,5 |
0 |
|
20,7 |
1,5 |
0 |
16,2 |
1,0 |
0,3 | |
|
Poruchy kůže a podkožní tkáně | ||||||
|
60,7 |
5,4 |
0 |
56,7 |
8,1 |
0 | |
|
Akneiformní dermatitida4 |
14,0 |
1,3 |
0 |
18,0 |
2,5 |
0 |
*Uvedeny jsou četnosti výskytu nežádoucích účinků bez ohledu na příčinnu jejich vzniku
1 Zahrnuje paronychie, infekce nehtu, infekce nehtového lůžka
2 Zahrnuje stomatitidu, aftózní stomatitidu, zánět sliznice, ulcerace úst, eroze ústní sliznice, slizniční eroze, ulcerace sliznice
3 Zahrnuje skupinu preferovaných termínů vyrážky
4 Zahrnuje akné, pustulózní akné, akneiformní dermatitidu
Abnormality j aterních testů
U pacientů užívajících přípravek GIOTRIF 40 mg byly pozorovány abnormality jaterních testů (včetně zvýšení ALT a AST). Tato zvýšení byla převážně přechodná a nevedla k vysazení léčby. Stupeň 2 zvýšení ALT se vyskytl u 1 % a stupeň 3 zvýšení u 0,8 % pacientů léčených přípravkem GIOTRIF (viz bod 4.4).
4.9 Předávkování
Příznaky
Nejvyšší dávka afatinibu zkoumaná u omezeného počtu pacientů v klinických studiích fáze I byla 160 mg jednou denně po dobu 3 dní a 100 mg jednou denně po dobu 2 týdnů. Nežádoucí účinky pozorované při těchto dávkách byly primárně kožní (vyrážka/akné) a gastrointestinální (zejména průjem). Předávkování u 2 zdravých dospívajících včetně požití 360 mg afatinibu v obou případech (představovalo součást požití směsi léků) bylo spojeno s nežádoucími příhodami - s nauzeou, zvracením, celkovou slabostí, závratí, bolestmi hlavy, bolestmi břicha a zvýšením amylázy (< 1,5-násobek HHNH). Oba jedinci se z těchto nežádoucích příhod zotavili.
Léčba
Neexistuje žádné specifické antidotum pro případ předávkování tímto léčivým přípravkem. V případě podezření na předávkování je nutno přípravek GIOTRIF vysadit a zahájit podpůrnou péči.
Pokud je to indikováno, lze dosáhnout eliminace nevstřebaného afatinibu zvracením nebo laváží žaludku.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: cytostatika, inhibitory proteinkináz, ATC kód: L01XE13. Mechanizmus účinku
Afatinib je účinný a selektivní ireverzibilní blokátor receptorové rodiny ErbB. Afatinib se na tyto receptory kovalentně váže a tím ireverzibilně blokuje signalizaci zprostředkovanou všemi homo- a heterodimery, které vytvářejí jednotliví členové rodiny receptorů ErbB - EGFR (ErbB1), HER2 (ErbB2), ErbB3 a ErbB4.
Farmakodynamické účinky
K malignímu fenotypu přispívá aberantní signalizace ErbB spouštěná mutacemi receptorů a/nebo amplifikací a/nebo nadměrnou expresí ligandu. Mutace EGFR definuje určitý molekulární podtyp plicního karcinomu.
V neklinických modelech onemocnění s deregulací drah ErbB monoterapie afatinibem blokuje efektivně signalizaci přes ErbB receptor, což má za následek inhibici růstu nádoru nebo regresi nádoru. Na léčbu afatinibem při neklinickém i klinickém použití jsou zvláště citlivé nemalobuněčné plicní karcinomy s běžnými aktivačními mutacemi EGFR (Del 19, L858R) a s několika méně běžnými mutacemi EGFR v exonu 18 (G719X) a exonu 21 (L861Q).
Afatinib si udržuje významnou protinádorovou aktivitu u buněčných linií NSCLC in vitro a/nebo u nádorových modelů in vivo (modely s xenotransplantáty či transgenní modely), které řídí zmutované izoformy EGFR, jako je T790M nebo T854A, u kterých je známa rezistence vůči reverzibilním inhibitorům EGFR erlotinibu a gefitinibu. Klinicky byla prokázána aktivita také u tumorů nesoucích mutaci T790M v exonu 20. Omezená neklinická a/nebo klinická aktivita byla pozorována u nemalobuněčných plicních karcinomů s mutacemi typu inzerce v exonu 20.
Klinická účinnost a bezpečnost
Přípravek GIOTRIF u pacientů s nemalobuněčným karcinomem plic (NSCLC) s mutacemi EGFR
LUX-Lung 3
Při nasazení v první linii byla účinnost a bezpečnost přípravku GIOTRIF hodnocena u pacientů s lokálně pokročilým nebo metastatickým NSCLC (ve stadiu IIIB nebo IV) a s pozitivitou mutací EGFR v globální randomizované multicentrické otevřené studii. U pacientů byl prováděn screening na přítomnost 29 různých mutací EGFR za použití metody na bázi polymerázové řetězové reakce (PCR) (TheraScreen®: EGFR29 Mutation Kit, Qiagen Manchester Ltd). Pacienti byli randomizováni (2:1) k léčbě buď přípravkem GIOTRIF 40 mg jednou denně nebo k léčbě až 6 cykly pemetrexedu/cisplatiny.
Mezi randomizovanými pacienty bylo 65 % žen, medián věku byl 61 let, výchozí hodnocení stavu výkonnosti ECOG bylo 0 (39 %) nebo 1 (61 %), 26 % pacientů bylo kavkazské rasy a 72 % tvořili Asiaté. 89 % pacientů mělo často se vyskytující mutace EGFR (Del 19 nebo L858R).
Primárním cílovým parametrem bylo přežívání bez progrese (= PFS = progression free survival) podle nezávislého hodnocení; sekundární cílové parametry zahrnovaly celkové přežití a výskyt objektivní
odpovědi. V době analýzy, 14. listopadu 2013, 176 pacientů (76,5 %) v ramenu s afatinibem a 70 pacientů (60,9 %) v ramenu s chemoterapií uvádělo příhodu přispívající k analýze přežívání bez progrese, tj. progrese onemocnění, jak ji stanovila centrální nezávislá kontrola, nebo úmrtí. Výsledky účinnosti jsou uvedeny na obrázku 1 a v tabulkách 5 a 6.
LUX-Lung 6
Účinnost a bezpečnost přípravku GIOTRIF byla hodnocena v randomizované, multicentrické, otevřené studii u asijských pacientů pozitivních na mutace v EGFR s lokálně pokročilým nebo metastázujícím adenokarcinomem plic ve stadiu IIIB nebo IV. Podobně jako u LUX-Lung 3 podstoupili pacienti s dosud neléčeným NSCLC screeningové vyšetření na mutace v EGFR za použití TheraScreen®: EGFR29 Mutation Kit (Qiagen Manchester Ltd). Mezi randomizovanými pacienty bylo 65 % žen, medián věku byl 58 let a všichni pacienti byli asijského původu. Pacienti s často se vyskytujícími mutacemi v EGFR představovali 89 % studijní populace.
Primárním cílovým parametrem bylo přežívání bez progrese, jak jej vyhodnotilo centrální nezávislé posouzení; sekundární cílové parametry zahrnovaly celkové přežití a ORR.
Obě studie prokázaly významné zlepšení přežívání bez progrese u pacientů pozitivních na mutace v EGFR léčených přípravkem GIOTRIF v porovnání s chemoterapií. Výsledky účinnosti jsou shrnuty na obrázku 1 (LUX-Lung 3) a v tabulkách 5 a 6 (LUX-Lung 3 a 6). Tabulka 6 ukazuje výsledky podskupin pacientů se dvěma častými mutacemi EGFR - Del 19 a L858R.
Obrázek 1: Kaplan-Meierova křivka přežívání bez progrese (= PFS = progression free survival) podle nezávislého hodnocení a podle léčebných skupin ve studii LUX-Lung 3 (celková populace)
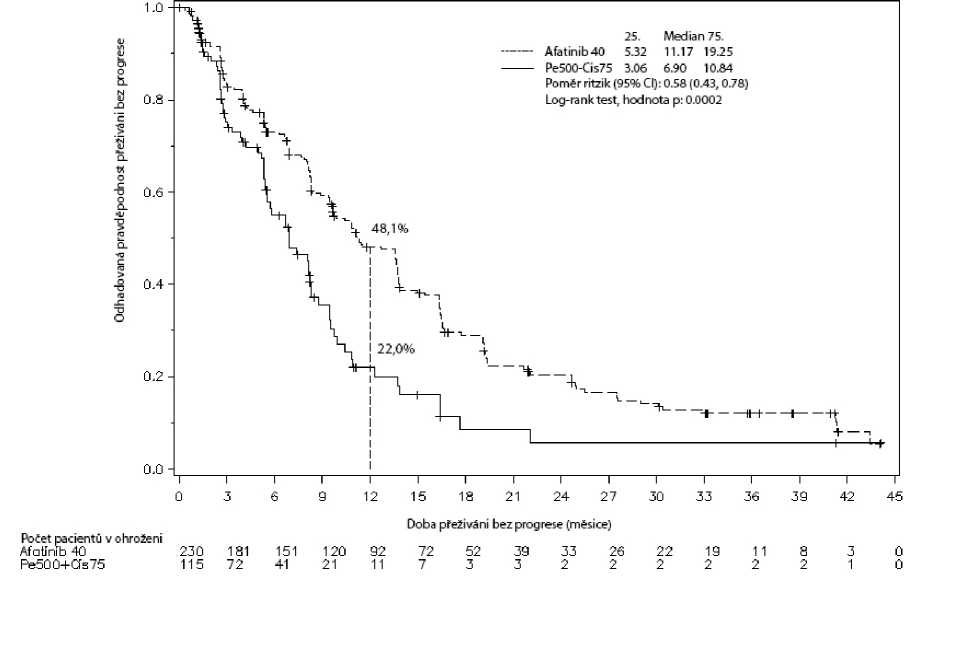
Tabulka 5: Výsledky účinnosti přípravku GIOTRIF oproti pemetrexedu/cisplatině (studie LUX-Lung 3), gemcitabinu/cisplatině (LUX-Lung 6) (nezávislé hodnocení)
|
LUX-Lung 3 |
LUX-Lung 6 | |||
|
GIOTRIF |
Pemetrexed/ |
GIOTRIF |
Gemcitabin/ | |
|
(n=230) |
Cisplatina (n=115) |
(n=242) |
Cisplatina (n=122) | |
|
Přežití bez progrese Měsíce (medián) |
11,2 |
6,9 |
11,0 |
5,6 |
|
Poměr rizik (HR) |
0,58 |
0,28 | ||
|
(95% CI) |
(0,43-0,78) |
(0,20-0,39) | ||
|
Hodnota p1 |
0,0002 |
<0,0001 | ||
|
Jednoroční výskyt PFS |
48,1 % |
22,0 % |
46,7 % |
2,1 % |
|
Výskyt objektivní odpovědi (CR+PR)2 |
56,5 % |
22,6 % |
67,8 % |
23,0 % |
|
Poměr šancí (OR) |
4,80 |
7,57 | ||
|
(95% CI) |
(2,89-8,08) |
(4,52-12,68) | ||
|
Hodnota p1 |
<0,0001 |
<0,0001 | ||
|
Celkové přežití (OS) Měsíce (medián) |
28,2 |
28,2 |
23,1 |
23,5 |
|
Poměr rizik (HR) |
0,88 |
0,93 | ||
|
(95% CI) |
(0,66-1,17) |
(0,72-1,22) | ||
|
Hodnota p1 |
0,3850 |
0,6137 | ||
1 Hodnota p pro PFS/OS na základě stratifikovaného log-rank testu; hodnota p pro výskyt objektivní odpovědi na základě logistické regrese 1 CR=kompletní odpověď; PR=částečná odpověď
Tabulka 6: Výsledky účinnosti přežívání bez progrese a celkového přežití s přípravkem GIOTRIF oproti pemetrexedu/cisplatině (studie LUX-Lung 3), gemcitabinu/cisplatině (studie LUX-Lung 6) v předem definovaných podskupinách s mutacemi Del 19 a L858R v EGFR (nezávislé hodnocení).
|
LUX-Lung 3 |
LUX |
-Lung 6 | ||
|
GIOTRIF |
Pemetrexed/ |
GIOTRIF |
Gemcitabin/ | |
|
Del 19 |
(n=112) |
Cisplatina (n=57) |
(n=124) |
Cisplatina (n=62) |
|
Přežití bez progrese Měsíce (medián) |
13,8 |
5,6 |
13,1 |
5,6 |
|
Poměr rizik (HR) |
0,26 |
0,20 | ||
|
(95% CI) |
(0,17-0,42) |
(0,13-0,33) | ||
|
Hodnota p1 |
<0,0001 |
<0,0001 | ||
|
Celkové přežití Měsíce (medián) |
33,3 |
21,1 |
31,4 |
18,4 |
|
Poměr rizik (HR) |
0,54 |
0,64 | ||
|
(95% CI) |
(0,36-0,79) |
(0,44-0,94) | ||
|
Hodnota p1 |
0,0015 |
0,0229 | ||
|
GIOTRIF |
Pemetrexed/ |
GIOTRIF |
Gemcitabin/ | |
|
L858R |
(n=91) |
Cisplatina (n=47) |
(n=92) |
Cisplatina (n=46) |
|
Přežití bez progrese Měsíce (medián) |
10,8 |
8,1 |
9,6 |
5,6 |
|
Poměr rizik (HR) |
0,75 |
0,31 | ||
|
(95% CI) |
(0,48-1,19) |
(0,19-0,52) | ||
|
Hodnota p1 |
0,2191 |
<0,0001 | ||
|
Celkové přežití (OS) Měsíce (medián) |
27,6 |
40,3 |
19,6 |
24,3 |
|
Poměr rizik (HR) |
1,30 |
1,22 | ||
|
(95% CI) |
(0,80-2,11) |
(0,81-1,83) | ||
|
Hodnota p1 |
0,2919 |
0,3432 | ||
1 Hodnota p pro PFS/OS na základě stratifikovaného log-rank testu
V předem definované podskupině běžných mutací (kombinace Del 19 a L858R) byl ve studii LUX-Lung 3 medián přežívání bez progrese (PFS) u přípravku GIOTRIF 13,6 měsíce oproti
6,9 měsíce u chemoterapie (poměr rizik HR 0,48; 95% CI 0,35-0,66; p<0,0001; n=307) a ve studii LUX-Lung 6 to bylo 11,0 měsíců oproti 5,6 měsíce (poměr rizik HR 0,24; 95% CI 0,17-0,35; p<0,0001, n=324).
Přínos v PFS byl provázen zlepšením příznaků souvisejících s onemocněním a oddálením času do zhoršení (viz tabulka 7). Průměrná skóre v průběhu času pro celkovou kvalitu života, celkový zdravotní stav a fyzické, funkční, kognitivní, sociální a emocionální fungování byly významně lepší u přípravku GIOTRIF.
|
LUX-Lung 3 | |||
|
Bolest | |||
|
% zlepšených pacientůa |
67 % vs. 60 %; p=0,2133 |
65 % vs. 50 %; p=0,0078 |
60 % vs. 48 %; p=0,0427 |
|
Oddálení střední doby do zhoršení (v měsících) ab |
27,0 vs. 8,0 HR 0,60; p=0,0062 |
10,4 vs. 2,9 HR 0,68; p=0,0129 |
4,2 vs. 3,1 HR 0,83; p=0,1882 |
|
LUX-Lung 6 | |||
|
Bolest | |||
|
% zlepšených pacientůa |
76 % vs. 55 %; p=0,0003 |
71 % vs. 48 %; p<0,0001 |
65 % vs. 47 %; p=0,0017 |
|
Oddálení střední doby do zhoršení (v měsících) ab |
31,1 vs. 10,3 HR 0,46; p=0,0001 |
7,7 vs. 1,7 HR 0,53; p<0,0001 |
6,9 vs. 3,4 HR 0,70; p=0,0220 |
a hodnoty uvedeny pro přípravek GIOTRIF oproti chemoterapii, hodnota p založena na logistické regresi b Hodnota p dobu do zhoršení na základě stratifikovaného log-rank testu
LUX-Lung 2
LUX-Lung 2 byla jednoramenná studie fáze II u 129 EGFR TKI dosud neléčených pacientů s plicním adenokarcinomem s mutacemi EGFR ve stadiu IIIB nebo IV. Pacienti byli zařazeni do léčby první linie (n=61) nebo druhé linie (n=68) (tj. po selhání jednoho předcházejícího režimu chemoterapie).
U 61 pacientů léčených v první linii byla potvrzena míra objektivní odpovědi ORR 65,6 % a míra kontroly onemocnění DCR byla 86,9 % podle nezávislého hodnocení. Medián přežívání bez progrese PFS byl 12,0 měsíců podle nezávislého hodnocení. Podobně vysoká byla účinnost ve skupině pacientů, kteří dostali předcházející chemoterapii (n=68; ORR 57,4 %; medián PFS podle nezávislého hodnocení 8 měsíců). Aktualizovaný medián celkového přežití pro první a druhou linii byl 31,7 měsíce, respektive 23,6 měsíce.
Přípravek GIOTRIF u pacientů s NSCLC skvamózní histologie
Účinnost a bezpečnost přípravku GIOTRIF jako druhé linie léčby pacientů s pokročilým NSCLC skvamózní histologie byla zkoumána v randomizované otevřené mezinárodní studii fáze III LUX-Lung 8. Pacienti, kterým byly v první linii podány nejméně 4 cykly terapie na bázi platiny, byli následně randomizováni 1:1 k podávání přípravku GIOTRIF 40 mg denně nebo erlotinibu 150 mg denně do progrese. Randomizace byla stratifikována dle rasy (východoasijská versus jiná než východoasijská). Primárním cílovým parametrem bylo PFS, OS bylo klíčovým sekundárním cílovým parametrem. K ostatním sekundárním cílovým parametrům patřily ORR, DCR, změna ve velikosti tumoru a HRQOL.
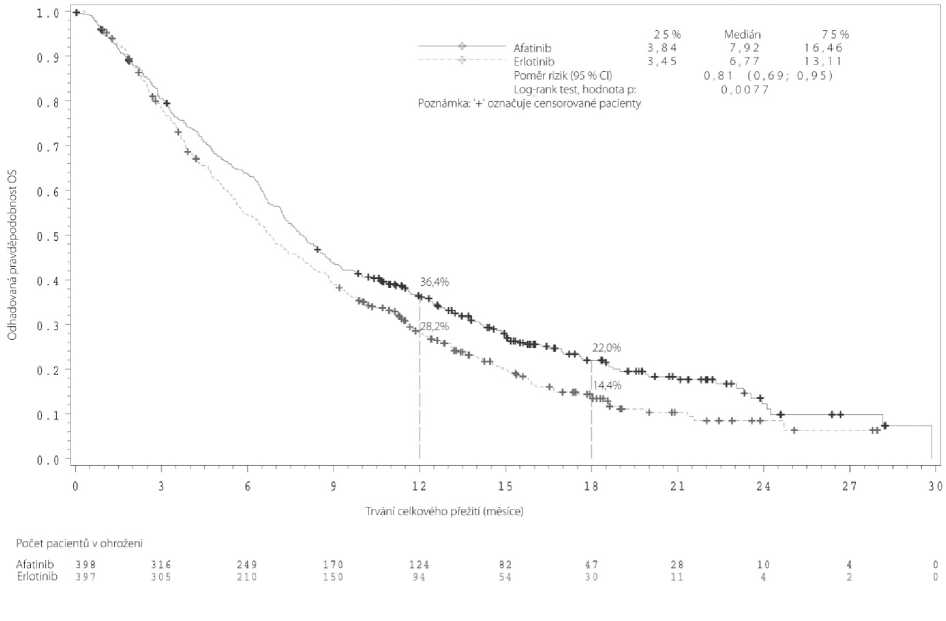
Mezi 795 randomizovanými pacienty byla většina mužů (84 %), bílých (73 %), současných nebo bývalých kuřáků (95 %) s výchozím výkonnostním stavem ECOG 1 (67 %) a ECOG 0 (33 %). Přípravek GIOTRIF ve druhé linii v porovnání s erlotinibem významně zlepšil PFS a OS pacientů se skvamózním NSCLC. Výsledky účinnosti v době primární analýzy OS zahrnující všechny randomizované pacienty jsou shrnuty v obrázku 2 a tabulce 8.
Tabulka 8: Výsledky účinnosti přípravku GIOTRIF v porovnání s erlotinibem ve studii LUX-Lung 8 na základě primární analýzy OS zahrnující všechny randomizované pacienty
|
GIOTRIF (N=398) |
Erlotinib (n=397) |
Poměr rizik (HR)/ poměr šancí (OR) (95 % CI) |
Hodnota p2 | |
|
PFS Měsíce (medián) |
2,63 |
1,94 |
HR 0,81 (0,69, 0,96) |
0,0103 |
|
OS Měsíce (medián) |
7,92 |
6,77 |
HR 0,81 (0,69, 0,95) |
0,0077 |
|
Naživu po 12 měsících Naživu po 18 měsících |
36,4 % 22,0 % |
28,2 % 14,4 % | ||
|
Objektivní odpověď (CR+PR)1 |
5,5 % |
2,8 % |
OR 2,06 (0,98, 4,32) |
0,0551 |
|
Délka odpovědi Měsíce (medián) |
7,29 |
3,71 |
CR=kompletní odpověď; PR=částečná odpověď
2hodnota p pro PFS/OS na základě stratifikovaného log-rank testu; hodnota p pro objektivní odpověď (Objective Response Rate) a míru kontroly onemocnění (Disease Control Rate) na základě logistické regrese
Poměr rizik pro celkové přežití byl 0,68 u pacientů ve věku < 65 let (95 % CI 0,55, 0,85) a 0,95 (95 % CI 0,76, 1,19) u pacientů ve věku 65 let a starších.
Obrázek 2: Kaplan-Meierova křivka pro OS dle léčebné skupiny ve studii LUX-Lung 8
Přínos s ohledem na PFS s sebou nesl zlepšení příznaků souvisejících s onemocněním a oddálení doby do zhoršení (viz Tabulka 9).
|
Bolest | |||
|
% zlepšených pacientů3’ c |
43 % vs. 35 %; p=0,0294 |
51 % vs. 44 %; p=0,0605 |
40% vs. 39%; p=0,7752 |
|
Oddálení doby do zhoršení (v měsících)b’ c |
4,5 vs. 3,7 HR 0,89; p=0,2562 |
2,6 vs. 1,9 HR 0,79; p=0,0078 |
2,5 vs. 2,4 HR 0,99; p=0,8690 |
a prezentovány jsou hodnoty pro přípravek GIOTRIF v porovnání s erlotinibem, hodnota p vychází z logistické regrese
b hodnota p pro dobu do zhoršení na základě stratifikovaného log-rank testu c hodnoty p nebyly upraveny s ohledem na multiplicitu
Účinnost u EGFR negativních nádorů nebyla stanovena.
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s tímto léčivým přípravkem u všech podskupin pediatrické populace v indikacích NSCLC (viz bod 4.2 pro informace o pediatrickém použití).
5.2 Farmakokinetické vlastnosti
Absorpce
Po perorálním podání přípravku GIOTRIF byly pozorovány Cmax afatinibu přibližně za 2 až 5 hodin po dávce. Hodnoty Cmax a AUC0-<X) se v dávkovém rozmezí 20 mg až 50 mg přípravku GIOTRIF zvýšily nepatrně více než proporcionálně. Systémová expozice vůči afatinibu se snižuje o 50 % (Cmax) a 39 % (AUCo-<X)), pokud je afatinib podáván spolu s jídlem s vysokým obsahem tuku ve srovnání s podáním nalačno. Na základě populačních farmakokinetických údajů odvozených z klinických studií u různých typů nádorů bylo pozorováno průměrné snížení AUCT ss o 26 %, pokud byla konzumována potrava v průběhu 3 hodin před užitím nebo 1 hodinu po užití přípravku GIOTRIF. Proto nesmí být potrava konzumována nejméně 3 hodiny před užitím a nejméně 1 hodinu po užití přípravku GIOTRIF (viz body 4.2 a 4.5).
Distribuce
In vitro je u člověka afatinib vázán na bílkoviny plazmy přibližně z 95 %. Afatinib se váže na bílkoviny jak nekovalentně (tradiční vazba na proteiny), tak i kovalentně.
Biotransformace
Metabolické reakce katalyzované enzymy hrají u afatinibu in vivo zanedbatelnou roli. Kovalentní sloučeniny adiční k proteinům představovaly hlavní cirkulující metabolity afatinibu.
Eliminace
U lidí probíhá vylučování afatinibu primárně stolicí. Po podání perorálního roztoku 15 mg afatinibu je 85,4 % dávky zachyceno ve stolici a 4,3 % v moči. Mateřská sloučenina afatinibu odpovídala 88 % zachycené dávky. Efektivní poločas vylučování afatinibu je přibližně 37 hodin. Rovnovážného stavu plazmatických koncentrací afatinibu bylo tedy dosaženo během 8 dnů při opakovaném podávání afatinibu, což vedlo k akumulaci na 2,77násobek (AUC0-<») a 2,11násobek (Cmax). U pacientů léčených afatinibem déle než 6 měsíců byl terminální poločas odhadnut na 344 hodin.
Porucha funkce ledvin
Méně než 5 % jednotlivé dávky afatinibu se vylučuje ledvinami. Bezpečnost, farmakokinetika a účinnost přípravku GIOTRIF nebyly specificky zkoumány u pacientů s poruchou funkce ledvin. Na základě populačních farmakokinetických údajů odvozených z klinických studií u různých typů nádorů se nejeví jako nutná žádná úprava dávky u pacientů s mírnou nebo středně závažnou poruchou funkce ledvin (viz „Populační farmakokinetická analýza u zvláštních populací“ dále a bod 4.2).
Porucha funkce jater
Afatinib se vylučuje zejména biliární/fekální exkrecí. Jedinci s mírnou (Child Pugh A) nebo se středně závažnou (Child Pugh B) poruchou funkce jater měli podobnou expozici ve srovnání se zdravými dobrovolníky po podání jednotlivé dávky přípravku GIOTRIF 50 mg. To je ve shodě s populačními farmakokinetickými údaji odvozenými z klinických studií u různých typů nádorů (viz „Populační farmakokinetická analýza u zvláštních populací“ níže). Žádná úprava úvodní dávky se nejeví jako nutná u pacientů s mírnou nebo středně závažnou poruchou funkce jater (viz bod 4.2). Farmakokinetika afatinibu nebyla zkoumána u jedinců se závažnou poruchou (Child Pugh C) funkce jater (viz bod 4.4).
Populační farmakokinetická analýza u zvláštních populací
Populační farmakokinetická analýza byla provedena u 927 nemocných s karcinomem (764 mělo NSCLC), kteří užívali GIOTRIF v monoterapii. Žádná úprava úvodní dávky nebyla nutná pro kteroukoliv z následujících testovaných kovariant.
Věk
Nebyl pozorován žádný významný vliv věku (v rozmezí 28-87 let) na farmakokinetiku afatinibu.
Tělesná hmotnost
Plazmatická expozice (AUCx,ss) byla zvýšena o 26 % u pacienta s tělesnou hmotností 42 kg (2,5-tý percentil) a snížena o 22 % u pacienta s hmotností 95 kg (97,5-tý percentil) v poměru s pacientem o tělesné hmotnosti 62 kg (medián tělesné hmotnosti pacientů v celkové populaci pacientů).
Pohlaví
Ženy měly o 15 % vyšší plazmatickou expozici (AUCT,ss, korigovaná tělesná hmotnost) než muži.
Rasa
Rasa neměla žádný vliv na farmakokinetiku afatinibu na základě populační farmakokinetické analýzy, včetně pacientů asijského, kavkazského a černošského původu. Údaje o černošských rasových skupinách byly omezené.
Porucha funkce ledvin
Expozice vůči afatinibu se středně zvýšila s poklesem clearance kreatininu (CrCl vypočítána podle Cockcrofta a Gaulta), tj. u pacienta s CrCl 60 ml/min, respektive 30 ml/min se expozice (AUCT,ss) vůči afatinibu zvýšila o 13 %, respektive 42 % a snížila o 6 %, respektive 20 % u pacienta s CrCl 90 ml/min respektive 120 ml/min a to ve srovnání s pacientem s CrCl 79 ml/min (medián CrCl pacientů v celkové analyzované populaci pacientů).
Porucha funkce jater
Pacienti s mírnou až středně závažnou poruchou funkce jater identifikovaní podle abnormálních jaterních testů nevykazovali korelaci s žádnou významnou změnou expozice vůči afatinibu. Pro středně závažnou a závažnou poruchu funkce jater byly dostupné omezené údaje.
Další charakteristiky nemocných/vnitřní faktory
Další charakteristiky nemocných/vnitřní faktory, u kterých byl zjištěn významný dopad na expozici vůči afatinibu, byly: skóre výkonnosti ECOG, hladiny laktátdehydrogenázy, hladiny alkalické fosfatázy a celková bílkovina. Individuální velikosti účinku těchto kovariant byly považovány za klinicky nevýznamné.
Anamnéza kouření, konzumace alkoholu (omezené údaje) nebo přítomnost metastáz v játrech, neměly žádný významný dopad na farmakokinetiku afatinibu.
Další informace o lékových interakcích
Interakce s transportními systémy pro vychytávání léků
In vitro údaje svědčily o tom, že lékové interakce s afatinibem dané inhibicí transportérů OATB1B1, OATP1B3, OATP2B1, OAT1, OAT3, OCT1, OCT2 a OCT3 jsou nepravděpodobné.
Interakce s enzymy cytochromu P450 (CYP)
U člověka bylo zjištěno, že při metabolismu afatinibu hrají enzymaticky katalyzované reakce zanedbatelnou roli. Přibližně 2 % z dávky afatinibu byla metabolizována FMO3 a N-demethylace závislá na CYP3A byla příliš nízká na to, aby ji bylo možno kvantitativně zjistit. Afatinib není inhibitorem ani induktorem CYP enzymů. Proto je nepravděpodobné, že by přípravek ovlivňoval metabolismus jiných léků, které tlumí nebo jsou metabolizovány enzymy CYP.
Účinek inhibice UDP-glukuronosyltransferázy 1A1 (UGT1A1) na afatinib
In vitro údaje svědčily o tom, že lékové interakce s afatinibem dané inhibicí UGT1A1 jsou
nepravděpodobné.
5.3 Předklinické údaje vztahující se k bezpečnosti
Perorální podání jednotlivé dávky myším a potkanům svědčilo o nízkém akutním toxickém potenciálu afatinibu. Ve studiích s opakovaným podáváním perorálních dávek v trvání až 26 týdnů u potkanů nebo až 52 týdnů u miniprasat byly hlavní účinky identifikovány v kůži (kožní změny, epiteliální atrofie a folikulitida u potkanů), v gastrointestinálním traktu (průjem, eroze žaludku, epiteliální atrofie u potkanů a miniprasat) a v ledvinách (papilární nekróza u potkanů). V závislosti na nálezech se tyto změny objevily při expozicích nižších, než nastávají při klinicky významných hladinách nebo při expozicích v jejich rozsahu nebo nad nimi. Vedle toho byla v různých orgánech pozorována farmakodynamicky zprostředkovaná atrofie epitelií u obou druhů zvířat.
Reprodukční toxicita
Na základě mechanizmu účinku všechny léčivé přípravky zacílené na EGFR včetně přípravku GIOTRIF mají potenciál způsobit poškození plodu. Embryo-fetální vývojové studie provedené u afatinibu neodhalily žádné známky teratogenity. Příslušná celková systémová expozice (AUC) byla buď mírně vyšší (2,2násobek u potkanů) nebo nižší (0,3násobek u králíků) ve srovnání s hladinami u pacientů.
Radioaktivně značený afatinib podaný perorálně potkanům 11. den laktace se vylučoval do mléka samic.
Studie fertility u samců a samic potkanů až do maxima tolerovaných dávek neodhalily žádný významný vliv na fertilitu. Celková systémová expozice (AUC0-24) u samců a samic potkanů se pohybovala v rozsahu expozice pozorované u pacientů nebo nižší (1,3násobek respektive 0,51násobek).
Studie u potkanů až do maxima tolerovaných dávek neodhalila žádný významný vliv na prenatální a postnatální vývoj. Nejvyšší celková systémová expozice (AUC0-24) u samic potkanů byla nižší než pozorovaná u pacientů (0,23násobek).
Fototoxicita
3T3 test in vitro prokázal, že afatinib může mít fototoxický potenciál.
Kancerogenita
Studie kancerogenity nebyly s přípravkem GIOTRIF provedeny.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Jádro tablety Monohydrát laktosy Mikrokrystalická celulosa (E460) Koloidní bezvodý oxid křemičitý (E551) Krospovidon typ A Magnesium-stearát (E470b)
Potahová vrstva tablety
GIOTRIF 20 mg potahované tablety Hypromelosa (E464)
Makrogol 400 Oxid titaničitý (E171)
Mastek (E553b)
Polysorbát 80 (E433)
GIOTRIF 30, 40 a 50 mg potahované tablety Hypromelosa (E464)
Makrogol 400 Oxid titaničitý (E171)
Mastek (E553b)
Polysorbát 80 (E433)
Hlinitý lak indigokarmínu (E132)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí a světlem.
6.5 Druh obalu a obsah balení
PVC/PVDC perforovaný jednodávkový blistr. Každý blistr je zabalen spolu se sáčkem vysoušedla v laminovaném hliníkovém obalu a obsahuje 7x1 potahovanou tabletu. Velikosti balení jsou 7x1, 14 x 1 nebo 28 x 1 potahovaná tableta.
Na trhu nemusí být k dispozici všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Německo
8. REGISTRAČNÍ ČÍSLO(A)
GIOTRIF 20 mg potahované tablety EU/1/13/879/001 EU/1/13/879/002 EU/1/13/879/003
GIOTRIF 30 mg potahované tablety EU/1/13/879/004 EU/1/13/879/005 EU/1/13/879/006
GIOTRIF 40 mg potahované tablety EU/1/13/879/007 EU/1/13/879/008 EU/1/13/879/009
GIOTRIF 50 mg potahované tablety EU/1/13/879/010 EU/1/13/879/011 EU/1/13/879/012
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 25. září 2013
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu.
A. VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného/výrobců odpovědných za propouštění šarží
Boehringer Ingelheim Pharma GmbH & Co. KG
Binder Strasse 173
55216 Ingelheim am Rhein
Německo
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na zvláštní lékařský předpis a lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky;
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GIOTRIF 20 mg potahované tablety afatinibum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna potahovaná tableta obsahuje afatinibum 20 mg (ve formě afatinibi dimaleas)
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje laktosu. Další informace naleznete v příbalové informaci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
7x1 potahovaná tableta 14 x 1 potahovaná tableta 28x1 potahovaná tableta
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Perorální podání
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí a světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Německo
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/879/001
EU/1/13/879/002
EU/1/13/879/003
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
GIOTRIF 20 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GIOTRIF 20 mg potahované tablety afatinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim (logo)
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
Před použitím neotvírejte.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GIOTRIF 20 mg potahované tablety afatinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim (logo)
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
Před použitím neotvírejte. *
* je vytištěno pouze na části blistru, kde nejsou tablety; tj. není vytištěno nad místy, které obsahují tablety. Toto opatření zajistí, že text je čitelný až do upotřebení poslední tablety z blistru.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GIOTRIF 30 mg potahované tablety afatinibum
|
2. |
OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK | |
|
Jedna potahovaná tableta obsahuje afatinibum 30 mg (ve formě afatinibi dimaleas) | ||
|
3. |
SEZNAM POMOCNÝCH LÁTEK | |
|
Obsahuje laktosu. Další informace naleznete v příbalové informaci. | ||
|
4. |
LÉKOVÁ FORMA A OBSAH BALENÍ | |
7x1 potahovaná tableta 14 x 1 potahovaná tableta 28x1 potahovaná tableta
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Perorální podání
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí a světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Německo
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/879/004
EU/1/13/879/005
EU/1/13/879/006
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
GIOTRIF 30 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GIOTRIF 30 mg potahované tablety afatinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim (logo)
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
Před použitím neotvírejte.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GIOTRIF 30 mg potahované tablety afatinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim (logo)
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
Před použitím neotvírejte. *
* je vytištěno pouze na části blistru, kde nejsou tablety; tj. není vytištěno nad místy, které obsahují tablety. Toto opatření zajistí, že text je čitelný až do upotřebení poslední tablety z blistru.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GIOTRIF 40 mg potahované tablety afatinibum
|
2. |
OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK | |
|
Jedna potahovaná tableta obsahuje afatinibum 40 mg (ve formě afatinibi dimaleas) | ||
|
3. |
SEZNAM POMOCNÝCH LÁTEK | |
|
Obsahuje laktosu. Další informace naleznete v příbalové informaci. | ||
|
4. |
LÉKOVÁ FORMA A OBSAH BALENÍ | |
7x1 potahovaná tableta 14 x 1 potahovaná tableta 28x1 potahovaná tableta
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Perorální podání
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁN
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí a světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Německo
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/879/007
EU/1/13/879/008
EU/1/13/879/009
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
GIOTRIF 40 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GIOTRIF 40 mg potahované tablety afatinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim (logo)
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
Před použitím neotvírejte.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GIOTRIF 40 mg potahované tablety afatinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim (logo)
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
Před použitím neotvírejte. *
* je vytištěno pouze na části blistru, kde nejsou tablety; tj. není vytištěno nad místy, které obsahují tablety. Toto opatření zajistí, že text je čitelný až do upotřebení poslední tablety z blistru.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GIOTRIF 50 mg potahované tablety afatinibum
|
2. |
OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK | |
|
Jedna potahovaná tableta obsahuje afatinibum 50 mg (ve formě afatinibi dimaleas) | ||
|
3. |
SEZNAM POMOCNÝCH LÁTEK | |
|
Obsahuje laktosu. Další informace naleznete v příbalové informaci. | ||
|
4. |
LÉKOVÁ FORMA A OBSAH BALENÍ | |
7x1 potahovaná tableta 14 x 1 potahovaná tableta 28x1 potahovaná tableta
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Perorální podání
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí a světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Německo
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/879/010
EU/1/13/879/011
EU/1/13/879/012
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
GIOTRIF 50 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GIOTRIF 50 mg potahované tablety afatinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim (logo)
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
Před použitím neotvírejte.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GIOTRIF 50 mg potahované tablety afatinibum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim (logo)
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
Před použitím neotvírejte. *
* je vytištěno pouze na části blistru, kde nejsou tablety; tj. není vytištěno nad místy, které obsahují tablety. Toto opatření zajistí, že text je čitelný až do upotřebení poslední tablety z blistru.
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
GIOTRIF 20 mg potahované tablety
afatinibum
'VTento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je GIOTRIF a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete GIOTRIF užívat
3. Jak se GIOTRIF užívá
4. Možné nežádoucí účinky
5. Jak GIOTRIF uchovávat
6. Obsah balení a další informace
1. Co je GIOTRIF a k čemu se používá
GIOTRIF je léčivý přípravek, který obsahuje léčivou látku afatinib. Afatinib blokuje činnost skupiny proteinů, která je známá pod názvem ErbB (včetně EGFR [receptoru pro epidermální růstový faktor nebo ErbB1], HER2 [ErbB2], ErbB3 a ErbB4). Tyto proteiny jsou zapojeny do růstu a šíření buněk zhoubných nádorů, a mohou být ovlivněny změnami (mutacemi) v genech, které je vytvářejí. Blokádou činnosti těchto proteinů může tento léčivý přípravek bránit růstu a šíření buněk zhoubných nádorů.
Tento léčivý přípravek se používá samostatně k léčbě dospělých pacientů s určitým typem zhoubného nádoru plic (nemalobuněčného karcinomu plic):
• který je určen změnou v genu pro receptor epidermálního růstového faktoru (mutací genu pro EGFR). GIOTRIF Vám může být předepsán jako první léčba, nebo pokud předchozí léčba chemoterapií nebyla dostatečně účinná
• dlaždicobuněčného (skvamózního) typu, pokud předchozí léčba chemoterapií nebyla dostatečně účinná.
2. Čemu musíte věnovat pozornost, než začnete GIOTRIF užívat Neužívejte GIOTRIF
- jestliže jste alergický(á) na afatinib nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před použitím tohoto přípravku se poraďte se svým lékařem nebo lékárníkem:
• pokud jste žena, Vaše tělesná hmotnost je nižší než 50 kg nebo trpíte problémy s ledvinami. Pokud se na Vás něco z toho vztahuje, lékař Vás může častěji kontrolovat, protože nežádoucí účinky mohou být prohloubeny. Léčba tímto léčivým přípravkem se nedoporučuje, pokud trpíte závažným onemocněním ledvin.
• pokud trpíte plicním zánětem s názvem intersticiální plicní nemoc nebo jste jej prodělal(a).
• pokud máte problémy s játry. Lékař Vám může provést vyšetření jaterních testů. Léčba tímto léčivým přípravkem se nedoporučuje, pokud trpíte závažným onemocněním jater.
• pokud se u Vás vyskytly oční problémy, jako je závažná suchost očí, zánět průhledné přední části oka (zánět rohovky) nebo vředy ve vnější části oka nebo pokud používáte kontaktní čočky
• pokud se u Vás vyskytly srdeční problémy. Lékař Vás může chtít častěji kontrolovat.
Během užívání tohoto přípravku informujte svého lékaře ihned:
• pokud se u Vás objeví průjem. Léčba při prvních známkách průjmu je důležitá.
• pokud se u Vás objeví kožní vyrážka. Včasná léčba kožní vyrážky je důležitá.
• pokud se u Vás objeví nové nebo náhlé zhoršení dechu, možná s kašlem nebo s horečkou. Může
jít o příznaky plicního zánětu (intersticiální plicní nemoci), které mohou ohrožovat život.
• pokud se u Vás objeví náhlé nebo zhoršující se zčervenání oka, bolest oka, zvýšené slzení očí, rozmazané vidění a/nebo přecitlivělost na světlo. Může nastat nutnost okamžitě zahájit léčbu.
Viz také možné nežádoucí účinky v bodě 4.
Děti a dospívající
GIOTRIF nebyl zkoumán u dětí nebo dospívajících. Nepodávejte tento léčivý přípravek dětem nebo dospívajícím mladším než 18 let.
Další léčivé přípravky a GIOTRIF
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat a to včetně léků rostlinného původu a léčivých přípravků dostupných bez lékařského předpisu.
Zejména následně uvedené léčivé přípravky mohou zvýšit krevní hladinu přípravku GIOTRIF, pokud se užívají před přípravkem GIOTRIF. Z tohoto důvodu mohou zvýšit také riziko vzniku nežádoucích účinků. Tyto léky by měly být proto užívány s takovým časovým odstupem od podání dávky přípravku GIOTRIF, jak je to možné. To znamená nejlépe 6 hodin (pro léky podávané dvakrát denně) nebo 12 hodin (pro léky podávané jednou denně) od podání přípravku GIOTRIF:
• Ritonavir, ketokonazol (kromě šampónu), itrakonazol, erythromycin, nelfinavir, sachinavir - užívané k léčbě různých druhů infekcí.
• Verapamil, chinidin, amiodaron - užívané k léčbě srdečních onemocnění.
• Cyklosporin A, takrolimus - užívané k ovlivnění imunitního systému.
Následující léky mohou snižovat účinnost přípravku GIOTRIF:
• Karbamazepin, fenytoin, fenobarbital - užívané k léčbě záchvatů křečí.
• Třezalka tečkovaná (Hypericum perforatum), rostlinný přípravek k léčbě depresí.
• Rifampicin, antibiotikum používané k léčbě tuberkulózy.
Zeptejte se svého lékaře, pokud si nejste jisti, kdy máte užít tyto léky.
GIOTRIF může zvýšit krevní hladiny jiných léků, včetně, ale ne pouze, u:
• Sulfasalazinu, který se užívá k léčbě zánětu/infekce.
• Rosuvastatinu, který se užívá ke snížení hladiny cholesterolu.
Informujte svého lékaře před užíváním těchto léků společně s přípravkem GIOTRIF.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat.
Během užívání tohoto přípravku se musíte vyvarovat otěhotnění. Pokud můžete otěhotnět, používejte odpovídající metodu antikoncepce během léčby a nejméně 1 měsíc po užití poslední dávky tohoto přípravku. Důvodem je riziko, že může dojít k poškození dosud nenarozeného dítěte.
Pokud během léčby tímto přípravkem otěhotníte, informujte ihned svého lékaře, který spolu s Vámi rozhodne, zda má léčba pokračovat nebo ne.
Pokud plánujete po užití poslední dávky léku otěhotnět, musíte se poradit s lékařem, protože lék nemusí být z těla ještě úplně odstraněn.
Kojení
Během užívání tohoto přípravku nekojte, protože nelze vyloučit riziko pro kojené dítě.
Řízení dopravních prostředků a obsluha strojů
Pokud se u Vás v souvislosti s léčbou objeví příznaky ovlivňující zrak (například zčervenání a/nebo podráždění očí, suchost očí, slzení, přecitlivělost na světlo) nebo příznaky ovlivňující Vaši schopnost soustředění a reagování, doporučuje se neřídit a obsluhovat stroje, a to až do vymizení těchto účinků (viz bod 4. Možné nežádoucí účinky).
Přípravek GIOTRIF obsahuje laktosu
Tento léčivý přípravek obsahuje cukr zvaný monohydrát laktosy. Pokud Vám Váš lékař řekl, že nesnášíte některé cukry, poraďte se se svým lékařem než začnete tento léčivý přípravek užívat.
3. Jak se GIOTRIF užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Dávkování
Doporučená dávka je 40 mg denně.
Dávku, kterou dostáváte, může lékař přizpůsobit (zvýšit nebo snížit), a to v závislosti na tom, jak dobře tento přípravek snášíte.
Kdy užívat GIOTRIF
• Je důležité užívat tento přípravek bez potravy
• Užívejte tento přípravek nejméně 1 hodinu před jídlem nebo
• Pokud jste již jedl(a), vyčkejte nejméně 3 hodiny, než tento přípravek užijete.
• Užívejte tento lék jednou denně, každý den zhruba ve stejnou denní dobu. To Vám usnadní si zapamatovat, že máte přípravek užít.
• Tabletu nelámejte, nežvýkejte ani nedrťte.
• Spolkněte tabletu vcelku a zapijte ji sklenicí vody.
GIOTRIF se užívá ústy. Pokud máte potíže se spolknutím tablety, rozpusťte ji ve sklenici neperlivé vody. Žádnou jinou tekutinu nelze použít. Vhoďte tabletu do vody, aniž byste jí rozdrtili. Ve vodě s tabletou příležitostně míchejte po dobu až 15 minut, dokud se nerozpadne na drobné částečky. Tekutinu poté ihned vypijte. Pak sklenici znovu naplňte vodou a tuto vodu opět vypijte, aby bylo zajištěno, že jste užil(a) všechen lék.
Pokud nejste schopni polykat a máte zavedenou žaludeční sondu, lékař Vám může navrhnout, že budete lék přijímat cestou žaludeční sondy.
Jestliže jste užil(a) více přípravku GIOTRIF, než jste měl(a)
Kontaktujte ihned svého lékaře nebo lékárníka. Může se u Vás objevit zvýšený výskyt nežádoucích účinků a lékař může přerušit Vaši léčbu a poskytnout Vám podpůrnou péči.
Jestliže jste zapomněl(a) užít GIOTRIF
• Pokud je příští plánovaná dávka za více než 8 hodin, užijte opomenutou dávku, jakmile si na to vzpomenete.
• Pokud je příští plánovaná dávka v době do 8 hodin, pak tuto opomenutou dávku zcela vynechte a užijte až svou následující dávku v obvyklém čase. Poté pokračujte v užívání tablet
v pravidelných intervalech, jako obvykle.
Nezdvojnásobujte následující dávku (dvě tablety místo jedné v tutéž dobu), abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) užívat GIOTRIF
Neukončujte užívání tohoto přípravku bez předchozí porady s lékařem. Každodenní užívání tohoto léku je důležité a to po celou dobu, po kterou Vám jej lékař předepisuje. Pokud neužíváte tento přípravek tak, jak Vám jej lékař předepsal, zhoubný nádor může začít opět růst.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i GIOTRIF nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Kontaktujte svého lékaře co nejdříve, pokud se u Vás objeví kterýkoliv z níže uvedených závažných nežádoucích účinků. V některých případech může Váš lékař rozhodnout o přerušení léčby, snížit Vaši dávku nebo ukončit léčbu:
• Průjem (velmi časté, může se objevit u více než 1 z 10 jedinců).
Průjmy trvající déle než 2 dny nebo průjmy závažnější intenzity mohou vést k ztrátě tekutin (časté, mohou se objevit až u 1 z 10 jedinců), nízké hladině draslíku v krvi (časté) a zhoršení funkce ledvin (časté). Průjem lze léčit. Při prvních známkách průjmu pijte dostatek tekutin. Kontaktujte ihned svého lékaře a co nejdříve zahajte vhodnou léčbu proti průjmu. Měli byste mít k dispozici lék proti průjmu ještě před zahájením užívání přípravku GIOTRIF.
• Kožní vyrážka (velmi časté).
Kožní vyrážku je důležité léčit včas. Informujte svého lékaře, pokud se vyrážka objeví. Pokud léčba vyrážky není účinná a vyrážka se zhoršuje (například dojde k tvorbě puchýřů nebo k olupování kůže) musíte na to ihned upozornit svého lékaře, protože Váš lékař může rozhodnout o ukončení Vaší léčby přípravkem GIOTRIF. Vyrážka se může objevit nebo se zhoršit v oblastech kůže, které jsou vystaveny slunečnímu záření. Doporučuje se nošení ochranného oděvu a užívání krémů chránicích proti slunečnímu záření.
• Plicní zánět (méně časté, může se objevit až u 1 ze 100 jedinců)
nazývaný „intersticiální plicní nemoc“. Informujte ihned svého lékaře, pokud se u Vás objeví nové nebo náhlé zhoršení dechu, možná s kašlem nebo horečkou.
• Podráždění očí nebo oční zánět
Podrážení očí nebo oční zánět se může často objevit ve formě zánětu spojivek (konjunktivitida) nebo zánětu spojivek a rohovky (keratokonjunktivitida) nebo méně často ve formě zánětu rohovky (keratitida). Informujte svého lékaře, pokud se u Vás objeví náhlé nebo zhoršující se oční příznaky, jako je bolest oka nebo jeho zčervenání či suchost.
Pokud se u Vás vyskytne kterýkoli z výše uvedených příznaků, kontaktujte ihned svého lékaře.
Byly hlášeny rovněž následující další nežádoucí účinky:
Velmi časté nežádoucí účinky (mohou se objevit u více než 1 z 10 jedinců):
• Bolavá místa v ústech a zánět v ústech
• Infekce nehtů
• Snížená chuť k jídlu
• Krvácení z nosu
• Pocit na zvracení
• Zvracení
Časté nežádoucí účinky (mohou se objevit až u 1 z 10 jedinců):
• Bolest, zčervenání, otok nebo olupování kůže na Vašich rukou a nohou
• Zvýšení hodnot jaterních enzymů (aspartát-aminotransferáza a alanin-aminotransferáza) v krevních testech
• Zánět výstelky močového měchýře s pocitem pálení při močení a s častou naléhavou potřebou močit (cystitida)
• Abnormální chuťové pocity (dysgeuzie)
• Bolest břicha, trávicí potíže, pálení žáhy
• Zánět rtů
• Pokles tělesné hmotnosti
• Rýma
• Svalové křeče
• Horečka
Méně časté nežádoucí účinky (mohou se objevit až u 1 ze 100 jedinců):
• Zánět slinivky břišní (pankreatitida)
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak GIOTRIF uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce, obalu a blistru za "Použitelné do:" a "EXP". Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí a světlem.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co GIOTRIF obsahuje
- Léčivou látkou je afatinibum. Jedna potahovaná tableta obsahuje afatinibum 20 mg (ve formě afatinibi dimaleas).
- Pomocnými látkami jsou monohydrát laktosy, mikrokrystalická celulosa (E460), koloidní bezvodý oxid křemičitý (E551), krospovidon typ A, magnesium-stearát (E470b), hypromelosa (E464), makrogol 400, oxid titaničitý (E171), mastek (E553b), polysorbát 80 (E433).
Jak GIOTRIF vypadá a co obsahuje toto balení
GIOTRIF 20 mg potahované tablety jsou bílé až nažloutlé, kulatého tvaru. Jsou opatřeny kódem „T20“ na jedné straně a logem společnosti Boehringer Ingelheim na straně druhé.
GIOTRIF potahované tablety jsou dostupné v baleních, která obsahují 1, 2 nebo 4 perforované jednodávkové blistry. Každý blistr obsahuje 7x1 potahovanou tabletu a je zabalen společně se sáčkem vysoušedla v hliníkovém obalu.
Na trhu nemusí být k dispozici všechny velikosti balení.
Držitel rozhodnutí o registraci
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Německo
Výrobce
Boehringer Ingelheim Pharma GmbH & Co. KG
Binger Strasse 173
D-55216 Ingelheim am Rhein
Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien SCS Boehringer Ingelheim Comm.V Tél/Tel: +32 2 773 33 11 |
Lietuva Boehringer Ingelheim RCV GmbH & Co KG Lietuvos filialas Tel: +370 37 473922 |
|
Btarapna Eboprarep HHrenxaňM P^B rMÓX h Ko. Kr - KnoH Ebnrapna Ten: +359 2 958 79 98 |
Luxembourg/Luxemburg SCS Boehringer Ingelheim Comm.V Tél/Tel: +32 2 773 33 11 |
|
Česká republika Boehringer Ingelheim spol. s r.o. Tel: +420 234 655 111 |
Magyarország Boehringer Ingelheim RCV GmbH & Co KG Magyarországi Fióktelepe Tel: +36 1 299 8900 |
|
Danmark Boehringer Ingelheim Danmark A/S Tlf: +45 39 15 88 88 |
Malta Boehringer Ingelheim Ltd. Tel: +44 1344 424 600 |
|
Deutschland Boehringer Ingelheim Pharma GmbH & Co. KG Tel: +49 (0) 800 77 90 900 |
Nederland Boehringer Ingelheim b.v. Tel: +31 (0) 800 22 55 889 |
|
Eesti Boehringer Ingelheim RCV GmbH & Co KG Eesti Filiaal Tel: +372 612 8000 |
Norge Boehringer Ingelheim Norway KS Tlf: +47 66 76 13 00 |
|
EXXáSa Boehringer Ingelheim Ellas A.E. T^: +30 2 10 89 06 300 |
Osterreich Boehringer Ingelheim RCV GmbH & Co KG Tel: +43 1 80 105-0 |
|
Espaňa Boehringer Ingelheim Espana, S.A. Tel: +34 93 404 51 00 |
Polska Boehringer Ingelheim Sp. z o.o. Tel: +48 22 699 0 699 |
|
France Boehringer Ingelheim France S.A.S. Tél: +33 3 26 50 45 33 |
Portugal Boehringer Ingelheim, Unipessoal, Lda. Tel: +351 21 313 53 00 |
|
Hrvatska Boehringer Ingelheim Zagreb d.o.o. Tel: +385 1 2444 600 |
Románia Boehringer Ingelheim RCV GmbH & Co KG Viena - Sucursala Bucuresti Tel: +40 21 302 2800 |
|
Ireland Boehringer Ingelheim Ireland Ltd. Tel: +353 1 295 9620 |
Slovenija Boehringer Ingelheim RCV GmbH & Co KG Podružnica Ljubljana Tel: +386 1 586 40 00 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Boehringer Ingelheim RCV GmbH & Co KG organizačná zložka Tel: +421 2 5810 1211 |
Sverige
Boehringer Ingelheim AB
Tel: +46 8 721 21 00
Puh/Tel: +358 10 3102 800
Kúnpoq
Boehringer Ingelheim Ellas A.E. T^: +30 2 10 89 06 300
Latvija United Kingdom
Boehringer Ingelheim RCV GmbH & Co KG Boehringer Ingelheim Ltd. Latvijas filiale Tel: +44 1344 424 600
Tel: +371 67 240 011
Tato příbalová informace byla naposledy revidována {MM/RRRR}
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Příbalová informace: informace pro uživatele
GIOTRIF 30 mg potahované tablety
afatinibum
'VTento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je GIOTRIF a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete GIOTRIF užívat
3. Jak se GIOTRIF užívá
4. Možné nežádoucí účinky
5. Jak GIOTRIF uchovávat
6. Obsah balení a další informace
1. Co je GIOTRIF a k čemu se používá
GIOTRIF je léčivý přípravek, který obsahuje léčivou látku afatinib. Afatinib blokuje činnost skupiny proteinů, která je známá pod názvem ErbB (včetně EGFR [receptoru pro epidermální růstový faktor nebo ErbB1], HER2 [ErbB2], ErbB3 a ErbB4). Tyto proteiny jsou zapojeny do růstu a šíření buněk zhoubných nádorů, a mohou být ovlivněny změnami (mutacemi) v genech, které je vytvářejí. Blokádou činnosti těchto proteinů může tento léčivý přípravek bránit růstu a šíření buněk zhoubných nádorů.
Tento léčivý přípravek se používá samostatně k léčbě dospělých pacientů s určitým typem zhoubného nádoru plic (nemalobuněčného karcinomu plic):
• který je určen změnou v genu pro receptor epidermálního růstového faktoru (mutací genu pro EGFR). GIOTRIF Vám může být předepsán jako první léčba, nebo pokud předchozí léčba chemoterapií nebyla dostatečně účinná.
• dlaždicobuněčného (skvamózního) typu, pokud předchozí léčba chemoterapií nebyla dostatečně účinná.
2. Čemu musíte věnovat pozornost, než začnete GIOTRIF užívat Neužívejte GIOTRIF
- jestliže jste alergický(á) na afatinib nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před použitím tohoto přípravku se poraďte se svým lékařem nebo lékárníkem:
• pokud jste žena, Vaše tělesná hmotnost je nižší než 50 kg nebo trpíte problémy s ledvinami. Pokud se na Vás něco z toho vztahuje, lékař Vás může častěji kontrolovat, protože nežádoucí účinky mohou být prohloubeny. Léčba tímto léčivým přípravkem se nedoporučuje, pokud trpíte závažným onemocněním ledvin.
• pokud trpíte plicním zánětem s názvem intersticiální plicní nemoc nebo jste jej prodělal(a).
• pokud máte problémy s játry. Lékař Vám může provést vyšetření jaterních testů. Léčba tímto léčivým přípravkem se nedoporučuje, pokud trpíte závažným onemocněním jater.
• pokud se u Vás vyskytly oční problémy, jako je závažná suchost očí, zánět průhledné přední části oka (zánět rohovky) nebo vředy ve vnější části oka nebo pokud používáte kontaktní čočky
• pokud se u Vás vyskytly srdeční problémy. Lékař Vás může chtít častěji kontrolovat.
Během užívání tohoto přípravku informujte svého lékaře ihned:
• pokud se u Vás objeví průjem. Léčba při prvních známkách průjmu je důležitá.
• pokud se u Vás objeví kožní vyrážka. Včasná léčba kožní vyrážky je důležitá.
• pokud se u Vás objeví nové nebo náhlé zhoršení dechu, možná s kašlem nebo s horečkou. Může
jít o příznaky plicního zánětu (intersticiální plicní nemoci), které mohou ohrožovat život.
• pokud se u Vás objeví náhlé nebo zhoršující se zčervenání oka, bolest oka, zvýšené slzení očí, rozmazané vidění a/nebo přecitlivělost na světlo. Může nastat nutnost okamžitě zahájit léčbu.
Viz také možné nežádoucí účinky v bodě 4.
Děti a dospívající
GIOTRIF nebyl zkoumán u dětí nebo dospívajících. Nepodávejte tento léčivý přípravek dětem nebo dospívajícím mladším než 18 let.
Další léčivé přípravky a GIOTRIF
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat a to včetně léků rostlinného původu a léčivých přípravků dostupných bez lékařského předpisu.
Zejména následně uvedené léčivé přípravky mohou zvýšit krevní hladinu přípravku GIOTRIF, pokud se užívají před přípravkem GIOTRIF. Z tohoto důvodu mohou zvýšit také riziko vzniku nežádoucích účinků. Tyto léky by měly být proto užívány s takovým časovým odstupem od podání dávky přípravku GIOTRIF, jak je to možné. To znamená nejlépe 6 hodin (pro léky podávané dvakrát denně) nebo 12 hodin (pro léky podávané jednou denně) od podání přípravku GIOTRIF:
• Ritonavir, ketokonazol (kromě šampónu), itrakonazol, erythromycin, nelfinavir, sachinavir - užívané k léčbě různých druhů infekcí.
• Verapamil, chinidin, amiodaron - užívané k léčbě srdečních onemocnění.
• Cyklosporin A, takrolimus - užívané k ovlivnění imunitního systému.
Následující léky mohou snižovat účinnost přípravku GIOTRIF:
• Karbamazepin, fenytoin, fenobarbital - užívané k léčbě záchvatů křečí.
• Třezalka tečkovaná (Hypericum perforatum), rostlinný přípravek k léčbě depresí.
• Rifampicin, antibiotikum používané k léčbě tuberkulózy.
Zeptejte se svého lékaře, pokud si nejste jisti, kdy máte užívat tyto léky.
GIOTRIF může zvýšit krevní hladiny jiných léků, včetně, ale ne pouze, u:
• Sulfasalazinu, který se užívá k léčbě zánětu/infekce.
• Rosuvastatinu, který se užívá ke snížení hladiny cholesterolu.
Informujte svého lékaře před užíváním těchto léků společně s přípravkem GIOTRIF.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat.
Během užívání tohoto přípravku se musíte vyvarovat otěhotnění. Pokud můžete otěhotnět, používejte odpovídající metodu antikoncepce během léčby a nejméně 1 měsíc po užití poslední dávky tohoto přípravku. Důvodem je riziko, že může dojít k poškození dosud nenarozeného dítěte.
Pokud během léčby tímto přípravkem otěhotníte, informujte ihned svého lékaře, který spolu s Vámi rozhodne, zda má léčba pokračovat nebo ne.
Pokud plánujete po užití poslední dávky léku otěhotnět, musíte se poradit s lékařem, protože lék nemusí být z těla ještě úplně odstraněn.
Kojení
Během užívání tohoto přípravku nekojte, protože nelze vyloučit riziko pro kojené dítě.
Řízení dopravních prostředků a obsluha strojů
Pokud se u Vás v souvislosti s léčbou objeví příznaky ovlivňující zrak (například zčervenání a/nebo podráždění očí, suchost očí, slzení, přecitlivělost na světlo) nebo příznaky ovlivňující Vaši schopnost soustředění a reagování, doporučuje se neřídit a obsluhovat stroje, a to až do vymizení těchto účinků (viz bod 4. Možné nežádoucí účinky).
Přípravek GIOTRIF obsahuje laktosu
Tento léčivý přípravek obsahuje cukr zvaný monohydrát laktosy. Pokud Vám Váš lékař řekl, že nesnášíte některé cukry, poraďte se se svým lékařem než začnete tento léčivý přípravek užívat.
3. Jak se GIOTRIF užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Dávkování
Doporučená dávka je 40 mg denně.
Dávku, kterou dostáváte, může lékař přizpůsobit (zvýšit nebo snížit), a to v závislosti na tom, jak dobře tento přípravek snášíte.
Kdy užívat GIOTRIF
• Je důležité užívat tento přípravek bez potravy
• Užívejte tento přípravek nejméně 1 hodinu před jídlem nebo
• Pokud jste již jedl(a), vyčkejte nejméně 3 hodiny, než tento přípravek užijete.
• Užívejte tento lék jednou denně, každý den zhruba ve stejnou denní dobu. To Vám usnadní si zapamatovat, že máte přípravek užít.
• Tabletu nelámejte, nežvýkejte ani nedrťte.
• Spolkněte tabletu vcelku a zapijte ji sklenicí vody.
GIOTRIF se užívá ústy. Pokud máte potíže se spolknutím tablety, rozpusťte ji ve sklenici neperlivé vody. Žádnou jinou tekutinu nelze použít. Vhoďte tabletu do vody, aniž byste jí rozdrtili. Ve vodě s tabletou příležitostně míchejte po dobu až 15 minut, dokud se nerozpadne na drobné částečky. Tekutinu poté ihned vypijte. Pak sklenici znovu naplňte vodou a tuto vodu opět vypijte, aby bylo zajištěno, že jste užil(a) všechen lék. Pokud nejste schopni polykat a máte zavedenou žaludeční sondu, lékař Vám může navrhnout, že budete lék přijímat cestou žaludeční sondy.
Jestliže jste užil(a) více přípravku GIOTRIF, než jste měl(a)
Kontaktujte ihned svého lékaře nebo lékárníka. Může se u Vás objevit zvýšený výskyt nežádoucích účinků a lékař může přerušit Vaši léčbu a poskytnout Vám podpůrnou péči.
Jestliže jste zapomněl(a) užít GIOTRIF
• Pokud je příští plánovaná dávka za více než 8 hodin, užijte opomenutou dávku, jakmile si na to vzpomenete.
• Pokud je příští plánovaná dávka v době do 8 hodin, pak tuto opomenutou dávku zcela vynechte a užijte až svou následující dávku v obvyklém čase. Poté pokračujte v užívání tablet
v pravidelných intervalech, jako obvykle.
Nezdvojnásobujte následující dávku (dvě tablety místo jedné v tutéž dobu), abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) užívat GIOTRIF
Neukončujte užívání tohoto přípravku bez předchozí porady s lékařem. Každodenní užívání tohoto léku je důležité a to po celou dobu, po kterou Vám jej lékař předepisuje. Pokud neužíváte tento přípravek tak, jak Vám jej lékař předepsal, zhoubný nádor může začít opět růst.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i GIOTRIF nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Kontaktujte svého lékaře co nejdříve, pokud se u Vás objeví kterýkoliv z níže uvedených závažných nežádoucích účinků. V některých případech může Váš lékař rozhodnout o přerušení léčby, snížit Vaši dávku nebo ukončit léčbu:
• Průjem (velmi časté, může se objevit u více než 1 z 10 jedinců).
Průjmy trvající déle než 2 dny nebo průjmy závažnější intenzity mohou vést k ztrátě tekutin (časté, mohou se objevit až u 1 z 10 jedinců), nízké hladině draslíku v krvi (časté) a zhoršení funkce ledvin (časté). Průjem lze léčit. Při prvních známkách průjmu pijte dostatek tekutin. Kontaktujte ihned svého lékaře a co nejdříve zahajte vhodnou léčbu proti průjmu. Měli byste mít k dispozici lék proti průjmu ještě před zahájením užívání přípravku GIOTRIF.
• Kožní vyrážka (velmi časté).
Kožní vyrážku je důležité léčit včas. Informujte svého lékaře, pokud se vyrážka objeví. Pokud léčba vyrážky není účinná a vyrážka se zhoršuje (například dojde k tvorbě puchýřů nebo k olupování kůže) musíte na to ihned upozornit svého lékaře, protože Váš lékař může rozhodnout o ukončení Vaší léčby přípravkem GIOTRIF. Vyrážka se může objevit nebo se zhoršit v oblastech kůže, které jsou vystaveny slunečnímu záření. Doporučuje se nošení ochranného oděvu a užívání krémů chránicích proti slunečnímu záření.
• Plicní zánět (méně časté, může se objevit až u 1 ze 100 jedinců)
nazývaný „intersticiální plicní nemoc“ Informujte ihned svého lékaře, pokud se u Vás objeví nové nebo náhlé zhoršení dechu, možná s kašlem nebo horečkou.
• Podráždění očí nebo oční zánět
Podrážení očí nebo oční zánět se může často objevit ve formě zánětu spojivek (konjunktivitida) nebo zánětu spojivek a rohovky (keratokonjunktivitida) nebo méně často ve formě zánětu rohovky (keratitida). Informujte svého lékaře, pokud se u Vás objeví náhlé nebo zhoršující se oční příznaky, jako je bolest oka nebo jeho zčervenání či suchost.
Pokud se u Vás vyskytne kterýkoli z výše uvedených příznaků, kontaktujte ihned svého lékaře.
Byly hlášeny rovněž následující další nežádoucí účinky:
Velmi časté nežádoucí účinky (mohou se objevit u více než 1 z 10 jedinců):
• Bolavá místa v ústech a zánět v ústech
• Infekce nehtů
• Snížená chuť k jídlu
• Krvácení z nosu
• Pocit na zvracení
• Zvracení
Časté nežádoucí účinky (mohou se objevit až u 1 z 10 jedinců):
• Bolest, zčervenání, otok nebo olupování kůže na Vašich rukou a nohou
• Zvýšení hodnot jaterních enzymů (aspartát-aminotransferáza a alanin-aminotransferáza) v krevních testech
• Zánět výstelky močového měchýře s pocitem pálení při močení a s častou naléhavou potřebou močit (cystitida)
• Abnormální chuťové pocity (dysgeuzie)
• Bolest břicha, trávicí potíže, pálení žáhy
• Zánět rtů
• Pokles tělesné hmotnosti
• Rýma
• Svalové křeče
• Horečka
Méně časté nežádoucí účinky (mohou se objevit až u 1 ze 100 jedinců):
• Zánět slinivky břišní (pankreatitida)
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak GIOTRIF uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce, obalu a blistru za "Použitelné do:" a "EXP". Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí a světlem.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co GIOTRIF obsahuje
- Léčivou látkou je afatinibum. Jedna potahovaná tableta obsahuje afatinibum 30 mg (ve formě afatinibi dimaleas).
- Pomocnými látkami jsou monohydrát laktosy, mikrokrystalická celulosa (E460), koloidní bezvodý oxid křemičitý (E551), krospovidon typ A, magnesium-stearát (E470b), hypromelosa (E464), makrogol 400, oxid titaničitý (E171), mastek (E553b), polysorbát 80 (E433), hlinitý lak indigokarmínu (E132).
Jak GIOTRIF vypadá a co obsahuje toto balení
GIOTRIF 30 mg potahované tablety jsou tmavě modré, kulatého tvaru. Jsou opatřeny kódem „T30“ na jedné straně a logem společnosti Boehringer Ingelheim na straně druhé.
GIOTRIF potahované tablety jsou dostupné v baleních, která obsahují 1, 2 nebo 4 perforované jednodávkové blistry. Každý blistr obsahuje 7x1 potahovanou tabletu a je zabalen společně se sáčkem vysoušedla v hliníkovém obalu.
Na trhu nemusí být k dispozici všechny velikosti balení.
Držitel rozhodnutí o registraci
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Německo
Výrobce
Boehringer Ingelheim Pharma GmbH & Co. KG
Binger Strasse 173
D-55216 Ingelheim am Rhein
Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien SCS Boehringer Ingelheim Comm.V Tél/Tel: +32 2 773 33 11 |
Lietuva Boehringer Ingelheim RCV GmbH & Co KG Lietuvos filialas Tel: +370 37 473922 |
|
Btarapna Eboprarep HHrenxaňM P^B rMÓX h Ko. Kr - KnoH Ebnrapna Ten: +359 2 958 79 98 |
Luxembourg/Luxemburg SCS Boehringer Ingelheim Comm.V Tél/Tel: +32 2 773 33 11 |
|
Česká republika Boehringer Ingelheim spol. s r.o. Tel: +420 234 655 111 |
Magyarország Boehringer Ingelheim RCV GmbH & Co KG Magyarországi Fióktelepe Tel: +36 1 299 8900 |
|
Danmark Boehringer Ingelheim Danmark A/S Tlf: +45 39 15 88 88 |
Malta Boehringer Ingelheim Ltd. Tel: +44 1344 424 600 |
|
Deutschland Boehringer Ingelheim Pharma GmbH & Co. KG Tel: +49 (0) 800 77 90 900 |
Nederland Boehringer Ingelheim b.v. Tel: +31 (0) 800 22 55 889 |
|
Eesti Boehringer Ingelheim RCV GmbH & Co KG Eesti Filiaal Tel: +372 612 8000 |
Norge Boehringer Ingelheim Norway KS Tlf: +47 66 76 13 00 |
|
EXXáSa Boehringer Ingelheim Ellas A.E. T^: +30 2 10 89 06 300 |
Osterreich Boehringer Ingelheim RCV GmbH & Co KG Tel: +43 1 80 105-0 |
|
Espaňa Boehringer Ingelheim Espana, S.A. Tel: +34 93 404 51 00 |
Polska Boehringer Ingelheim Sp. z o.o. Tel: +48 22 699 0 699 |
|
France Boehringer Ingelheim France S.A.S. Tél: +33 3 26 50 45 33 |
Portugal Boehringer Ingelheim, Unipessoal, Lda. Tel: +351 21 313 53 00 |
|
Hrvatska Boehringer Ingelheim Zagreb d.o.o. Tel: +385 1 2444 600 |
Románia Boehringer Ingelheim RCV GmbH & Co KG Viena - Sucursala Bucuresti Tel: +40 21 302 2800 |
|
Ireland Boehringer Ingelheim Ireland Ltd. Tel: +353 1 295 9620 |
Slovenija Boehringer Ingelheim RCV GmbH & Co KG Podružnica Ljubljana Tel: +386 1 586 40 00 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Boehringer Ingelheim RCV GmbH & Co KG organizačná zložka Tel: +421 2 5810 1211 |
Sverige
Boehringer Ingelheim AB
Tel: +46 8 721 21 00
Puh/Tel: +358 10 3102 800
Kúnpoq
Boehringer Ingelheim Ellas A.E. T^: +30 2 10 89 06 300
Latvija United Kingdom
Boehringer Ingelheim RCV GmbH & Co KG Boehringer Ingelheim Ltd. Latvijas filiale Tel: +44 1344 424 600
Tel: +371 67 240 011
Tato příbalová informace byla naposledy revidována {MM/RRRR}
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Příbalová informace: informace pro uživatele
GIOTRIF 40 mg potahované tablety
afatinibum
'VTento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je GIOTRIF a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete GIOTRIF užívat
3. Jak se GIOTRIF užívá
4. Možné nežádoucí účinky
5. Jak GIOTRIF uchovávat
6. Obsah balení a další informace
1. Co je GIOTRIF a k čemu se používá
GIOTRIF je léčivý přípravek, který obsahuje léčivou látku afatinib. Afatinib blokuje činnost skupiny proteinů, která je známá pod názvem ErbB (včetně EGFR [receptoru pro epidermální růstový faktor nebo ErbB1], HER2 [ErbB2], ErbB3 a ErbB4). Tyto proteiny jsou zapojeny do růstu a šíření buněk zhoubných nádorů a mohou být ovlivněny změnami (mutacemi) v genech, které je vytvářejí. Blokádou činnosti těchto proteinů může tento léčivý přípravek bránit růstu a šíření buněk zhoubných nádorů.
Tento léčivý přípravek se používá samostatně k léčbě dospělých pacientů s určitým typem zhoubného nádoru plic (nemalobuněčného karcinomu plic):
• který je určen změnou v genu pro receptor epidermálního růstového faktoru (mutací genu pro EGFR). GIOTRIF Vám může být předepsán jako první léčba nebo pokud předchozí léčba chemoterapií nebyla dostatečně účinná.
• dlaždicobuněčného (skvamózního) typu, pokud předchozí léčba chemoterapií nebyla dostatečně účinná.
2. Čemu musíte věnovat pozornost, než začnete GIOTRIF užívat Neužívejte GIOTRIF
- jestliže jste alergický(á) na afatinib nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před použitím tohoto přípravku se poraďte se svým lékařem nebo lékárníkem:
• pokud jste žena, Vaše tělesná hmotnost je nižší než 50 kg nebo trpíte problémy s ledvinami. Pokud se na Vás něco z toho vztahuje, lékař Vás může častěji kontrolovat, protože nežádoucí
účinky mohou být prohloubeny. Léčba tímto léčivým přípravkem se nedoporučuje, pokud trpíte závažným onemocněním ledvin.
• pokud trpíte plicním zánětem s názvem intersticiální plicní nemoc nebo jste jej prodělal(a).
• pokud máte problémy s játry. Lékař Vám může provést vyšetření jaterních testů. Léčba tímto léčivým přípravkem se nedoporučuje, pokud trpíte závažným onemocněním jater.
• pokud se u Vás vyskytly oční problémy, jako je závažná suchost očí, zánět průhledné přední části oka (zánět rohovky) nebo vředy ve vnější části oka nebo pokud používáte kontaktní čočky
• pokud se u Vás vyskytly srdeční problémy. Lékař Vás může chtít častěji kontrolovat.
Během užívání tohoto přípravku informujte svého lékaře ihned:
• pokud se u Vás objeví průjem. Léčba při prvních známkách průjmu je důležitá.
• pokud se u Vás objeví kožní vyrážka. Včasná léčba kožní vyrážky je důležitá.
• pokud se u Vás objeví nové nebo náhlé zhoršení dechu, možná s kašlem nebo s horečkou. Může
jít o příznaky plicního zánětu (intersticiální plicní nemoci), které mohou ohrožovat život.
• pokud se u Vás objeví náhlé nebo zhoršující se zčervenání oka, bolest oka, zvýšené slzení očí, rozmazané vidění a/nebo přecitlivělost na světlo. Může nastat nutnost okamžitě zahájit léčbu.
Viz také možné nežádoucí účinky v bodě 4.
Děti a dospívající
GIOTRIF nebyl zkoumán u dětí nebo dospívajících. Nepodávejte tento léčivý přípravek dětem nebo dospívajícím mladším než 18 let.
Další léčivé přípravky a GIOTRIF
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat a to včetně léků rostlinného původu a léčivých přípravků dostupných bez lékařského předpisu.
Zejména následně uvedené léčivé přípravky mohou zvýšit krevní hladinu přípravku GIOTRIF, pokud se užívají před přípravkem GIOTRIF. Z tohoto důvodu mohou zvýšit také riziko vzniku nežádoucích účinků. Tyto léky by měly být proto užívány s takovým časovým odstupem od podání dávky přípravku GIOTRIF jak je to možné. To znamená nejlépe 6 hodin (pro léky podávané dvakrát denně) nebo 12 hodin (pro léky podávané jednou denně) od podání přípravku GIOTRIF:
• Ritonavir, ketokonazol (kromě šampónu), itrakonazol, erythromycin, nelfinavir, sachinavir - užívané k léčbě různých druhů infekcí.
• Verapamil, chinidin, amiodaron - užívané k léčbě srdečních onemocnění.
• Cyklosporin A, takrolimus - užívané k ovlivnění imunitního systému.
Následující léky mohou snižovat účinnost přípravku GIOTRIF:
• Karbamazepin, fenytoin, fenobarbital - užívané k léčbě záchvatů křečí.
• Třezalka tečkovaná (Hypericumperforatum), rostlinný přípravek k léčbě depresí.
• Rifampicin, antibiotikum používané k léčbě tuberkulózy.
Zeptejte se svého lékaře, pokud si nejste jisti, kdy máte užít tyto léky.
GIOTRIF může zvýšit krevní hladiny jiných léků, včetně, ale ne pouze, u:
• Sulfasalazinu, který se užívá k léčbě zánětu/infekce.
• Rosuvastatinu, který se užívá ke snížení hladiny cholesterolu.
Informujte svého lékaře před užíváním těchto léků společně s přípravkem GIOTRIF.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat.
Během užívání tohoto přípravku se musíte vyvarovat otěhotnění. Pokud můžete otěhotnět, používejte odpovídající metodu antikoncepce během léčby a nejméně 1 měsíc po užití poslední dávky tohoto přípravku. Důvodem je riziko, že může dojít k poškození dosud nenarozeného dítěte.
Pokud během léčby tímto přípravkem otěhotníte, informujte ihned svého lékaře, který spolu s Vámi rozhodne, zda má léčba pokračovat nebo ne.
Pokud plánujete po užití poslední dávky léku otěhotnět, musíte se poradit s lékařem, protože lék nemusí být z těla ještě úplně odstraněn.
Kojení
Během užívání tohoto přípravku nekojte, protože nelze vyloučit riziko pro kojené dítě.
Řízení dopravních prostředků a obsluha strojů
Pokud se u Vás v souvislosti s léčbou objeví příznaky ovlivňující zrak (například zčervenání a/nebo podráždění očí, suchost očí, slzení, přecitlivělost na světlo) nebo příznaky ovlivňující Vaši schopnost soustředění a reagování, doporučuje se neřídit a obsluhovat stroje, a to až do vymizení těchto účinků (viz bod 4. Možné nežádoucí účinky).
Přípravek GIOTRIF obsahuje laktosu
Tento léčivý přípravek obsahuje cukr zvaný monohydrát laktosy. Pokud Vám Váš lékař řekl, že nesnášíte některé cukry, poraďte se se svým lékařem než začnete tento léčivý přípravek užívat.
3. Jak se GIOTRIF užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Dávkování
Doporučená dávka je 40 mg denně.
Dávku, kterou dostáváte, může lékař přizpůsobit (zvýšit nebo snížit), a to v závislosti na tom, jak dobře tento přípravek snášíte.
Kdy užívat GIOTRIF
• Je důležité užívat tento přípravek bez potravy
• Užívejte tento přípravek nejméně 1 hodinu před jídlem nebo
• Pokud jste již jedl(a), vyčkejte nejméně 3 hodiny, než tento přípravek užijete.
• Užívejte tento lék jednou denně, každý den zhruba ve stejnou denní dobu. To Vám usnadní si zapamatovat, že máte přípravek užít.
• Tabletu nelámejte, nežvýkejte ani nedrťte.
• Spolkněte tabletu vcelku a zapijte ji sklenicí vody.
GIOTRIF se užívá ústy. Pokud máte potíže se spolknutím tablety, rozpusťte ji ve sklenici neperlivé vody. Žádnou jinou tekutinu nelze použít. Vhoďte tabletu do vody, aniž byste jí rozdrtili. Ve vodě s tabletou příležitostně míchejte po dobu až 15 minut, dokud se nerozpadne na drobné částečky. Tekutinu poté ihned vypijte. Pak sklenici znovu naplňte vodou a tuto vodu opět vypijte, aby bylo zajištěno, že jste užil(a) všechen lék.
Pokud nejste schopni polykat a máte zavedenou žaludeční sondu, lékař Vám může navrhnout, že budete lék přijímat cestou žaludeční sondy.
Jestliže jste užil(a) více přípravku GIOTRIF, než jste měl(a)
Kontaktujte ihned svého lékaře nebo lékárníka. Může se u Vás objevit zvýšený výskyt nežádoucích účinků a lékař může přerušit Vaši léčbu a poskytnout Vám podpůrnou péči.
Jestliže jste zapomněl(a) užít GIOTRIF
• Pokud je příští plánovaná dávka za více než 8 hodin, užijte opomenutou dávku, jakmile si na to vzpomenete.
• Pokud je příští plánovaná dávka v době do 8 hodin, pak tuto opomenutou dávku zcela vynechte a užijte až svou následující dávku v obvyklém čase. Poté pokračujte v užívání tablet
v pravidelných intervalech, jako obvykle.
Nezdvojnásobujte následující dávku (dvě tablety místo jedné v tutéž dobu), abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) užívat GIOTRIF
Neukončujte užívání tohoto přípravku bez předchozí porady s lékařem. Každodenní užívání tohoto léku je důležité a to po celou dobu, po kterou Vám jej lékař předepisuje. Pokud neužíváte tento přípravek tak, jak Vám jej lékař předepsal, zhoubný nádor může začít opět růst.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i GIOTRIF nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Kontaktujte svého lékaře co nejdříve, pokud se u Vás objeví kterýkoliv z níže uvedených závažných nežádoucích účinků. V některých případech může Váš lékař rozhodnout o přerušení léčby, snížit Vaši dávku nebo ukončit léčbu:
• Průjem (velmi časté, může se objevit u více než 1 z 10 jedinců).
Průjmy trvající déle než 2 dny nebo průjmy závažnější intenzity mohou vést k ztrátě tekutin (časté, mohou se objevit až u 1 z 10 jedinců), nízké hladině draslíku v krvi (časté) a zhoršení funkce ledvin (časté). Průjem lze léčit. Při prvních známkách průjmu pijte dostatek tekutin. Kontaktujte ihned svého lékaře a co nejdříve zahajte vhodnou léčbu proti průjmu. Měli byste mít k dispozici lék proti průjmu ještě před zahájením užívání přípravku GIOTRIF.
• Kožní vyrážka (velmi časté).
Kožní vyrážku je důležité léčit včas. Informujte svého lékaře, pokud se vyrážka objeví. Pokud léčba vyrážky není účinná a vyrážka se zhoršuje (například dojde k tvorbě puchýřů nebo k olupování kůže) musíte na to ihned upozornit svého lékaře, protože Váš lékař může rozhodnout o ukončení Vaší léčby přípravkem GIOTRIF. Vyrážka se může objevit nebo se zhoršit v oblastech kůže, které jsou vystaveny slunečnímu záření. Doporučuje se nošení ochranného oděvu a užívání krémů chránicích proti slunečnímu záření.
• Plicní zánět (méně časté, může se objevit až u 1 ze 100 jedinců)
nazývaný „intersticiální plicní nemoc“ Informujte ihned svého lékaře, pokud se u Vás objeví nové nebo náhlé zhoršení dechu, možná s kašlem nebo horečkou.
• Podráždění očí nebo oční zánět
Podrážení očí nebo oční zánět se může často objevit ve formě zánětu spojivek (konjunktivitida) nebo zánětu spojivek a rohovky (keratokonjunktivitida) nebo méně často ve formě zánětu rohovky (keratitida). Informujte svého lékaře, pokud se u Vás objeví náhlé nebo zhoršující se oční příznaky, jako je bolest oka nebo jeho zčervenání či suchost.
Pokud se u Vás vyskytne kterýkoli z výše uvedených příznaků, kontaktujte ihned svého lékaře.
Byly hlášeny rovněž následující další nežádoucí účinky:
Velmi časté nežádoucí účinky (mohou se objevit u více než 1 z 10 jedinců):
• Bolavá místa v ústech a zánět v ústech
• Infekce nehtů
• Snížená chuť k jídlu
• Krvácení z nosu
• Pocit na zvracení
• Zvracení
Časté nežádoucí účinky (mohou se objevit až u 1 z 10 jedinců):
• Bolest, zčervenání, otok nebo olupování kůže na Vašich rukou a nohou
• Zvýšení hodnot jaterních enzymů (aspartát-aminotransferáza a alanin-aminotransferáza) v krevních testech
• Zánět výstelky močového měchýře s pocitem pálení při močení a s častou naléhavou potřebou močit (cystitida)
• Abnormální chuťové pocity (dysgeuzie)
• Bolest břicha, trávicí potíže, pálení žáhy
• Zánět rtů
• Pokles tělesné hmotnosti
• Rýma
• Svalové křeče
• Horečka
Méně časté nežádoucí účinky (mohou se objevit až u 1 ze 100 jedinců):
• Zánět slinivky břišní (pankreatitida)
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak GIOTRIF uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce, obalu a blistru za "Použitelné do:" a "EXP". Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí a světlem.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co GIOTRIF obsahuje
- Léčivou látkou je afatinibum. Jedna potahovaná tableta obsahuje afatinibum 40 mg (ve formě afatinibi dimaleas).
- Pomocnými látkami jsou monohydrát laktosy, mikrokrystalická celulosa (E460), koloidní bezvodý oxid křemičitý (E551), krospovidon typ A, magnesium-stearát (E470b), hypromelosa (E464), makrogol 400, oxid titaničitý (E171), mastek (E553b), polysorbát 80 (E433), hlinitý lak indigokarmínu (E132).
Jak GIOTRIF vypadá a co obsahuje toto balení
GIOTRIF 40 mg potahované tablety jsou světle modré, kulatého tvaru. Jsou opatřeny kódem „T40“ na jedné straně a logem společnosti Boehringer Ingelheim na straně druhé.
GIOTRIF potahované tablety jsou dostupné v baleních, která obsahují 1, 2 nebo 4 perforované jednodávkové blistry. Každý blistr obsahuje 7x1 potahovanou tabletu a je zabalen společně se sáčkem vysoušedla v hliníkovém obalu.
Na trhu nemusí být k dispozici všechny velikosti balení.
Držitel rozhodnutí o registraci
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Německo
Výrobce
Boehringer Ingelheim Pharma GmbH & Co. KG
Binger Strasse 173
D-55216 Ingelheim am Rhein
Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien SCS Boehringer Ingelheim Comm.V Tél/Tel: +32 2 773 33 11 |
Lietuva Boehringer Ingelheim RCV GmbH & Co KG Lietuvos filialas Tel: +370 37 473922 |
|
Btarapna Eboprarep HHrenxaňM P^B rMÓX h Ko. Kr - KnoH Ebnrapna Ten: +359 2 958 79 98 |
Luxembourg/Luxemburg SCS Boehringer Ingelheim Comm.V Tél/Tel: +32 2 773 33 11 |
|
Česká republika Boehringer Ingelheim spol. s r.o. Tel: +420 234 655 111 |
Magyarország Boehringer Ingelheim RCV GmbH & Co KG Magyarországi Fióktelepe Tel: +36 1 299 8900 |
|
Danmark Boehringer Ingelheim Danmark A/S Tlf: +45 39 15 88 88 |
Malta Boehringer Ingelheim Ltd. Tel: +44 1344 424 600 |
|
Deutschland Boehringer Ingelheim Pharma GmbH & Co. KG Tel: +49 (0) 800 77 90 900 |
Nederland Boehringer Ingelheim b.v. Tel: +31 (0) 800 22 55 889 |
|
Eesti Boehringer Ingelheim RCV GmbH & Co KG Eesti Filiaal Tel: +372 612 8000 |
Norge Boehringer Ingelheim Norway KS Tlf: +47 66 76 13 00 |
|
EXXáSa Boehringer Ingelheim Ellas A.E. T^: +30 2 10 89 06 300 |
Osterreich Boehringer Ingelheim RCV GmbH & Co KG Tel: +43 1 80 105-0 |
|
Espaňa Boehringer Ingelheim Espana, S.A. Tel: +34 93 404 51 00 |
Polska Boehringer Ingelheim Sp. z o.o. Tel: +48 22 699 0 699 |
|
France Boehringer Ingelheim France S.A.S. Tél: +33 3 26 50 45 33 |
Portugal Boehringer Ingelheim, Unipessoal, Lda. Tel: +351 21 313 53 00 |
|
Hrvatska Boehringer Ingelheim Zagreb d.o.o. Tel: +385 1 2444 600 |
Románia Boehringer Ingelheim RCV GmbH & Co KG Viena - Sucursala Bucuresti Tel: +40 21 302 2800 |
|
Ireland Boehringer Ingelheim Ireland Ltd. Tel: +353 1 295 9620 |
Slovenija Boehringer Ingelheim RCV GmbH & Co KG Podružnica Ljubljana Tel: +386 1 586 40 00 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Boehringer Ingelheim RCV GmbH & Co KG organizačná zložka Tel: +421 2 5810 1211 |
Sverige
Boehringer Ingelheim AB
Tel: +46 8 721 21 00
Puh/Tel: +358 10 3102 800
Kúnpoq
Boehringer Ingelheim Ellas A.E. T^: +30 2 10 89 06 300
Latvija United Kingdom
Boehringer Ingelheim RCV GmbH & Co KG Boehringer Ingelheim Ltd. Latvijas filiale Tel: +44 1344 424 600
Tel: +371 67 240 011
Tato příbalová informace byla naposledy revidována {MM/RRRR}
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Příbalová informace: informace pro uživatele
GIOTRIF 50 mg potahované tablety
afatinibum
'VTento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je GIOTRIF a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete GIOTRIF užívat
3. Jak se GIOTRIF užívá
4. Možné nežádoucí účinky
5. Jak GIOTRIF uchovávat
6. Obsah balení a další informace
1. Co je GIOTRIF a k čemu se používá
GIOTRIF je léčivý přípravek, který obsahuje léčivou látku afatinib. Afatinib blokuje činnost skupiny proteinů, která je známá pod názvem ErbB (včetně EGFR [receptoru pro epidermální růstový faktor nebo ErbB1], HER2 [ErbB2], ErbB3 a ErbB4). Tyto proteiny jsou zapojeny do růstu a šíření buněk zhoubných nádorů, a mohou být ovlivněny změnami (mutacemi) v genech, které je vytvářejí. Blokádou činnosti těchto proteinů může tento léčivý přípravek bránit růstu a šíření buněk zhoubných nádorů.
Tento léčivý přípravek se používá samostatně k léčbě dospělých pacientů s určitým typem zhoubného nádoru plic (nemalobuněčného karcinomu plic):
• který je určen změnou v genu pro receptor epidermálního růstového faktoru (mutací genu pro EGFR). GIOTRIF Vám může být předepsán jako první léčba nebo pokud předchozí léčba chemoterapií nebyla dostatečně účinná.
• dlaždicobuněčného (skvamózního) typu, pokud předchozí léčba chemoterapií nebyla dostatečně účinná
2. Čemu musíte věnovat pozornost, než začnete GIOTRIF užívat Neužívejte GIOTRIF
- jestliže jste alergický(á) na afatinib nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před použitím tohoto přípravku se poraďte se svým lékařem nebo lékárníkem:
• pokud jste žena, Vaše tělesná hmotnost je nižší než 50 kg nebo trpíte problémy s ledvinami. Pokud se na Vás něco z toho vztahuje, lékař Vás může častěji kontrolovat, protože nežádoucí účinky mohou být prohloubeny. Léčba tímto léčivým přípravkem se nedoporučuje, pokud trpíte závažným onemocněním ledvin.
• pokud trpíte plicním zánětem s názvem intersticiální plicní nemoc nebo jste jej prodělal(a).
• pokud máte problémy s játry. Lékař Vám může provést vyšetření jaterních testů. Léčba tímto léčivým přípravkem se nedoporučuje, pokud trpíte závažným onemocněním jater.
• pokud se u Vás vyskytly oční problémy, jako je závažná suchost očí, zánět průhledné přední části oka (zánět rohovky) nebo vředy ve vnější části oka nebo pokud používáte kontaktní čočky
• pokud se u Vás vyskytly srdeční problémy. Lékař Vás může chtít častěji kontrolovat.
Během užívání tohoto přípravku informujte svého lékaře ihned:
• pokud se u Vás objeví průjem. Léčba při prvních známkách průjmu je důležitá.
• pokud se u Vás objeví kožní vyrážka. Včasná léčba kožní vyrážky je důležitá.
• pokud se u Vás objeví nové nebo náhlé zhoršení dechu, možná s kašlem nebo s horečkou. Může
jít o příznaky plicního zánětu (intersticiální plicní nemoci), které mohou ohrožovat život.
• pokud se u Vás objeví náhlé nebo zhoršující se zčervenání oka, bolest oka, zvýšené slzení očí, rozmazané vidění a/nebo přecitlivělost na světlo. Může nastat nutnost okamžitě zahájit léčbu.
Viz také možné nežádoucí účinky v bodě 4.
Děti a dospívající
GIOTRIF nebyl zkoumán u dětí nebo dospívajících. Nepodávejte tento léčivý přípravek dětem nebo dospívajícím mladším než 18 let.
Další léčivé přípravky a GIOTRIF
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat a to včetně léků rostlinného původu a léčivých přípravků dostupných bez lékařského předpisu.
Zejména následně uvedené léčivé přípravky mohou zvýšit krevní hladinu přípravku GIOTRIF, pokud se užívají před přípravkem GIOTRIF. Z tohoto důvodu mohou zvýšit také riziko vzniku nežádoucích účinků. Tyto léky by měly být proto užívány s takovým časovým odstupem od podání dávky přípravku GIOTRIF, jak je to možné. To znamená nejlépe 6 hodin (pro léky podávané dvakrát denně) nebo 12 hodin (pro léky podávané jednou denně) od podání přípravku GIOTRIF:
• Ritonavir, ketokonazol (kromě šampónu), itrakonazol, erythromycin, nelfinavir, sachinavir - užívané k léčbě různých druhů infekcí.
• Verapamil, chinidin, amiodaron - užívané k léčbě srdečních onemocnění.
• Cyklosporin A, takrolimus - užívané k ovlivnění imunitního systému.
Následující léky mohou snižovat účinnost přípravku GIOTRIF:
• Karbamazepin, fenytoin, fenobarbital - užívané k léčbě záchvatů křečí.
• Třezalka tečkovaná (Hypericum perforatum), rostlinný přípravek k léčbě depresí.
• Rifampicin, antibiotikum používané k léčbě tuberkulózy.
Zeptejte se svého lékaře, pokud si nejste jisti, kdy máte užít tyto léky.
GIOTRIF může zvýšit krevní hladiny jiných léků, včetně, ale ne pouze, u:
• Sulfasalazinu, který se užívá k léčbě zánětu/infekce.
• Rosuvastatinu, který se užívá ke snížení hladiny cholesterolu.
Informujte svého lékaře před užíváním těchto léků společně s přípravkem GIOTRIF.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat.
Během užívání tohoto přípravku se musíte vyvarovat otěhotnění. Pokud můžete otěhotnět, používejte odpovídající metodu antikoncepce během léčby a nejméně 1 měsíc po užití poslední dávky tohoto přípravku. Důvodem je riziko, že může dojít k poškození dosud nenarozeného dítěte.
Pokud během léčby tímto přípravkem otěhotníte, informujte ihned svého lékaře, který spolu s Vámi rozhodne, zda má léčba pokračovat nebo ne.
Pokud plánujete po užití poslední dávky léku otěhotnět, musíte se poradit s lékařem, protože lék nemusí být z těla ještě úplně odstraněn.
Kojení
Během užívání tohoto přípravku nekojte, protože nelze vyloučit riziko pro kojené dítě.
Řízení dopravních prostředků a obsluha strojů
Pokud se u Vás v souvislosti s léčbou objeví příznaky ovlivňující zrak (například zčervenání a/nebo podráždění očí, suchost očí, slzení, přecitlivělost na světlo) nebo příznaky ovlivňující Vaši schopnost soustředění a reagování, doporučuje se neřídit a obsluhovat stroje, a to až do vymizení těchto účinků (viz bod 4. Možné nežádoucí účinky).
Přípravek GIOTRIF obsahuje laktosu
Tento léčivý přípravek obsahuje cukr zvaný monohydrát laktosy. Pokud Vám Váš lékař řekl, že nesnášíte některé cukry, poraďte se se svým lékařem než začnete tento léčivý přípravek užívat.
3. Jak se GIOTRIF užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Dávkování
Doporučená dávka je 40 mg denně.
Dávku, kterou dostáváte, může lékař přizpůsobit (zvýšit nebo snížit), a to v závislosti na tom, jak dobře tento přípravek snášíte.
Kdy užívat GIOTRIF
• Je důležité užívat tento přípravek bez potravy
• Užívejte tento přípravek nejméně 1 hodinu před jídlem nebo
• Pokud jste již jedl(a), vyčkejte nejméně 3 hodiny, než tento přípravek užijete.
• Užívejte tento lék jednou denně, každý den zhruba ve stejnou denní dobu. To Vám usnadní si zapamatovat, že máte přípravek užít.
• Tabletu nelámejte, nežvýkejte ani nedrťte.
• Spolkněte tabletu vcelku a zapijte ji sklenicí vody.
GIOTRIF se užívá ústy. Pokud máte potíže se spolknutím tablety, rozpusťte ji ve sklenici neperlivé vody. Žádnou jinou tekutinu nelze použít. Vhoďte tabletu do vody, aniž byste jí rozdrtili. Ve vodě s tabletou příležitostně míchejte po dobu až 15 minut, dokud se nerozpadne na drobné částečky. Tekutinu poté ihned vypijte. Pak sklenici znovu naplňte vodou a tuto vodu opět vypijte, aby bylo zajištěno, že jste užil(a) všechen lék.
Pokud nejste schopni polykat a máte zavedenou žaludeční sondu, lékař Vám může navrhnout, že budete lék přijímat cestou žaludeční sondy.
Jestliže jste užil(a) více přípravku GIOTRIF, než jste měl(a)
Kontaktujte ihned svého lékaře nebo lékárníka. Může se u Vás objevit zvýšený výskyt nežádoucích účinků a lékař může přerušit Vaši léčbu a poskytnout Vám podpůrnou péči.
Jestliže jste zapomněl(a) užít GIOTRIF
• Pokud je příští plánovaná dávka za více než 8 hodin, užijte opomenutou dávku, jakmile si na to vzpomenete.
• Pokud je příští plánovaná dávka v době do 8 hodin, pak tuto opomenutou dávku zcela vynechte a užijte až svou následující dávku v obvyklém čase. Poté pokračujte v užívání tablet
v pravidelných intervalech, jako obvykle.
Nezdvojnásobujte následující dávku (dvě tablety místo jedné v tutéž dobu), abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) užívat GIOTRIF
Neukončujte užívání tohoto přípravku bez předchozí porady s lékařem. Každodenní užívání tohoto léku je důležité a to po celou dobu, po kterou Vám jej lékař předepisuje. Pokud neužíváte tento přípravek tak, jak Vám jej lékař předepsal, zhoubný nádor může začít opět růst.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i GIOTRIF nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Kontaktujte svého lékaře co nejdříve, pokud se u Vás objeví kterýkoliv z níže uvedených závažných nežádoucích účinků. V některých případech může Váš lékař rozhodnout o přerušení léčby, snížit Vaši dávku nebo ukončit léčbu:
• Průjem (velmi časté, může se objevit u více než 1 z 10 jedinců).
Průjmy trvající déle než 2 dny nebo průjmy závažnější intenzity mohou vést k ztrátě tekutin (časté, mohou se objevit až u 1 z 10 jedinců), nízké hladině draslíku v krvi (časté) a zhoršení funkce ledvin (časté). Průjem lze léčit. Při prvních známkách průjmu pijte dostatek tekutin. Kontaktujte ihned svého lékaře a co nejdříve zahajte vhodnou léčbu proti průjmu. Měli byste mít k dispozici lék proti průjmu ještě před zahájením užívání přípravku GIOTRIF.
• Kožní vyrážka (velmi časté).
Kožní vyrážku je důležité léčit včas. Informujte svého lékaře, pokud se vyrážka objeví. Pokud léčba vyrážky není účinná a vyrážka se zhoršuje (například dojde k tvorbě puchýřů nebo k olupování kůže) musíte na to ihned upozornit svého lékaře, protože Váš lékař může rozhodnout o ukončení Vaší léčby přípravkem GIOTRIF. Vyrážka se může objevit nebo se zhoršit v oblastech kůže, které jsou vystaveny slunečnímu záření. Doporučuje se nošení ochranného oděvu a užívání krémů chránicích proti slunečnímu záření.
• Plicní zánět (méně časté, může se objevit až u 1 ze 100 jedinců)
nazývaný „intersticiální plicní nemoc“ Informujte ihned svého lékaře, pokud se u Vás objeví nové nebo náhlé zhoršení dechu, možná s kašlem nebo horečkou.
• Podráždění očí nebo oční zánět
Podrážení očí nebo oční zánět se může často objevit ve formě zánětu spojivek (konjunktivitida) nebo zánětu spojivek a rohovky (keratokonjunktivitida) nebo méně často ve formě zánětu rohovky (keratitida). Informujte svého lékaře, pokud se u Vás objeví náhlé nebo zhoršující se oční příznaky, jako je bolest oka nebo jeho zčervenání či suchost.
Pokud se u Vás vyskytne kterýkoli z výše uvedených příznaků, kontaktujte ihned svého lékaře.
Byly hlášeny rovněž následující další nežádoucí účinky:
Velmi časté nežádoucí účinky (mohou se objevit u více než 1 z 10 jedinců):
• Bolavá místa v ústech a zánět v ústech
• Infekce nehtů
• Snížená chuť k jídlu
• Krvácení z nosu
• Pocit na zvracení
• Zvracení
Časté nežádoucí účinky (mohou se objevit až u 1 z 10 jedinců):
• Bolest, zčervenání, otok nebo olupování kůže na Vašich rukou a nohou
• Zvýšení hodnot jaterních enzymů (aspartát-aminotransferáza a alanin-aminotransferáza) v krevních testech
• Zánět výstelky močového měchýře s pocitem pálení při močení a s častou naléhavou potřebou močit (cystitida)
• Abnormální chuťové pocity (dysgeuzie)
• Bolest břicha, trávicí potíže, pálení žáhy
• Zánět rtů
• Pokles tělesné hmotnosti
• Rýma
• Svalové křeče
• Horečka
Méně časté nežádoucí účinky (mohou se objevit až u 1 ze 100 jedinců):
• Zánět slinivky břišní (pankreatitida)
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak GIOTRIF uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce, obalu a blistru za "Použitelné do:" a "EXP". Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí a světlem.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co GIOTRIF obsahuje
- Léčivou látkou je afatinibum. Jedna potahovaná tableta obsahuje afatinibum 50 mg (ve formě afatinibi dimaleas).
- Pomocnými látkami jsou monohydrát laktosy, mikrokrystalická celulosa (E460), koloidní bezvodý oxid křemičitý (E551), krospovidon typ A, magnesium-stearát (E470b), hypromelosa (E464), makrogol 400, oxid titaničitý (E171), mastek (E553b), polysorbát 80 (E433), hlinitý lak indigokarmínu (E132).
Jak GIOTRIF vypadá a co obsahuje toto balení
GIOTRIF 50 mg potahované tablety jsou tmavě modré, oválného tvaru. Jsou opatřeny kódem „T50“ na jedné straně a logem společnosti Boehringer Ingelheim na straně druhé.
GIOTRIF potahované tablety jsou dostupné v baleních, která obsahují 1, 2 nebo 4 perforované jednodávkové blistry. Každý blistr obsahuje 7x1 potahovanou tabletu a je zabalen společně se sáčkem vysoušedla v hliníkovém obalu.
Na trhu nemusí být k dispozici všechny velikosti balení.
Držitel rozhodnutí o registraci
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Německo
Výrobce
Boehringer Ingelheim Pharma GmbH & Co. KG
Binger Strasse 173
D-55216 Ingelheim am Rhein
Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien SCS Boehringer Ingelheim Comm.V Tél/Tel: +32 2 773 33 11 |
Lietuva Boehringer Ingelheim RCV GmbH & Co KG Lietuvos filialas Tel: +370 37 473922 |
|
Btarapna Eboprarep HHrenxaňM P^B rMÓX h Ko. Kr - KnoH Ebnrapna Ten: +359 2 958 79 98 |
Luxembourg/Luxemburg SCS Boehringer Ingelheim Comm.V Tél/Tel: +32 2 773 33 11 |
|
Česká republika Boehringer Ingelheim spol. s r.o. Tel: +420 234 655 111 |
Magyarország Boehringer Ingelheim RCV GmbH & Co KG Magyarországi Fióktelepe Tel: +36 1 299 8900 |
|
Danmark Boehringer Ingelheim Danmark A/S Tlf: +45 39 15 88 88 |
Malta Boehringer Ingelheim Ltd. Tel: +44 1344 424 600 |
|
Deutschland Boehringer Ingelheim Pharma GmbH & Co. KG Tel: +49 (0) 800 77 90 900 |
Nederland Boehringer Ingelheim b.v. Tel: +31 (0) 800 22 55 889 |
|
Eesti Boehringer Ingelheim RCV GmbH & Co KG Eesti Filiaal Tel: +372 612 8000 |
Norge Boehringer Ingelheim Norway KS Tlf: +47 66 76 13 00 |
|
EXXáSa Boehringer Ingelheim Ellas A.E. T^: +30 2 10 89 06 300 |
Osterreich Boehringer Ingelheim RCV GmbH & Co KG Tel: +43 1 80 105-0 |
|
Espaňa Boehringer Ingelheim Espana, S.A. Tel: +34 93 404 51 00 |
Polska Boehringer Ingelheim Sp. z o.o. Tel: +48 22 699 0 699 |
|
France Boehringer Ingelheim France S.A.S. Tél: +33 3 26 50 45 33 |
Portugal Boehringer Ingelheim, Unipessoal, Lda. Tel: +351 21 313 53 00 |
|
Hrvatska Boehringer Ingelheim Zagreb d.o.o. Tel: +385 1 2444 600 |
Románia Boehringer Ingelheim RCV GmbH & Co KG Viena - Sucursala Bucuresti Tel: +40 21 302 2800 |
|
Ireland Boehringer Ingelheim Ireland Ltd. Tel: +353 1 295 9620 |
Slovenija Boehringer Ingelheim RCV GmbH & Co KG Podružnica Ljubljana Tel: +386 1 586 40 00 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Boehringer Ingelheim RCV GmbH & Co KG organizačná zložka Tel: +421 2 5810 1211 |
Sverige
Boehringer Ingelheim AB
Tel: +46 8 721 21 00
Puh/Tel: +358 10 3102 800
Kúnpoq
Boehringer Ingelheim Ellas A.E. T^: +30 2 10 89 06 300
Latvija United Kingdom
Boehringer Ingelheim RCV GmbH & Co KG Boehringer Ingelheim Ltd. Latvijas filiale Tel: +44 1344 424 600
Tel: +371 67 240 011
Tato příbalová informace byla naposledy revidována {MM/RRRR}
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
75