Ganfort 0,3 Mg/Ml + 5 Mg/Ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
GANFORT 0,3 mg/ml + 5 mg/ml oční kapky, roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml roztoku obsahuje bimatoprostum 0,3 mg a timololum 5 mg (jako timololi maleas 6,8 mg). Pomocné látky se známým účinkem:
Jeden ml roztoku obsahuje 0,05 mg/ml benzalkonium-chloridu.
Úplný seznam pomocných látek viz bod 6.1
3. LÉKOVÁ FORMA
Oční kapky, roztok.
Bezbarvý až světle žlutý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Snížení nitroočního tlaku u dospělých pacientů (IOP) s glaukomem s otevřeným úhlem nebo nitrooční hypertenzí, kteří nedostatečně reagují na léčbu lokálními betablokátory nebo analogy prostaglandinu.
4.2 Dávkování a způsob podání
Dávkování
Doporučená dávka pro dospělé (včetně starších osob)
Doporučená dávka je jedna kapka GANFORTu do postiženého oka (očí) jedenkrát denně buď ráno, nebo večer. Dávka se má podávat každý den ve stejnou dobu.
Z údajů o léku GANFORT v existující literatuře vyplývá, že večerní dávka dokáže účinněji snižovat IOP než ranní dávka. Při volbě ranního nebo večerního dávkování je však třeba zohlednit pravděpodobnost dodržování léčby (viz bod 5.1).
Vynechá-li se jedna dávka, léčba musí pokračovat další plánovanou dávkou. Dávkování jedenkrát denně do postiženého oka (očí) nemá být překročeno.
Porucha funkce ledvin a jater
GANFORT nebyl studován u pacientů s poruchou ledvin nebo jater. U těchto pacientů má proto být použit s opatrností.
Pediatrická populace
Bezpečnost a účinnost GANFORTu u dětí ve věku 0 až 18 let nebyla stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Pokud je používán více než jeden lokální oční přípravek, pak je mezi jejich podáním nutné zachovat časový odstup nejméně 5 minut.
Systémová absorpce se sníží při použití nasolakrimální okluze nebo zavření víčka na dobu 2 minut. To může vést ke sníženému výskytu systémových nežádoucích účinků a zvýšit aktivitu v místě působení.
4.3 Kontraindikace
■ Hypersensitivita na léčivou látku(y) nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
■ Reaktivní onemocnění cest dýchacích včetně průduškového astmatu nebo průduškového astmatu v anamnéze, těžká chronická obstrukční plicní choroba.
■ Sinusová bradykardie, sick sinus syndrom, sinoatriální blokáda, atrioventrikulární blok druhého nebo třetího stupně, který není kontrolovaný kardiostimulátorem. Klinicky zjevné srdeční selhání, kardiogenní šok.
4.4 Zvláštní upozornění a opatření pro použití
Tak jako u ostatních lokálně aplikovaných očních léčivých přípravků, mohou být i léčivé látky GANFORTu (timolol/ bimatoprost) vstřebávány systémově. Žádné zvýšení systémového vstřebávání individuálních léčivých látek nebylo pozorováno. Vzhledem k beta-adrenergním účinkům timololu se mohou vyskytnout tytéž typy kardiovaskulárních, plicních a jiných nežádoucích účinků, které byly pozorovány u systémových betablokátorů. Výskyt systémových nežádoucích účinků je při topickém očním podání nižší než při systémovém podání. Opatření ke snížení systémové absorpce viz bod 4.2.
Srdeční poruchy
U pacientů s kardiovaskulárním onemocněním (např. ischemická choroba srdeční, Prinzmetalova angina a srdeční selhání) a antihypertenzní terapií systémovými betablokátory má být zvážena terapie jinou léčivou látkou. Pacienty s kardiovaskulárními chorobami je třeba sledovat kvůli známkám zhoršení choroby a kvůli výskytu nežádoucích účinků.
Vzhledem ke svému negativnímu účinku na převodní čas mají být betablokátory pacientům se srdeční blokádou prvního stupně podávány s opatrností.
Cévní poruchy
Pacienti se závažnými poruchami/onemocněními periferní cirkulace (tj. závažné formy Raynaudovy choroby nebo Raynaudova syndromu) mají být léčeni s opatrností.
Poruchy dýchacího systému
Po podání některých očních betablokátorů byly hlášeny respirační účinky, včetně úmrtí způsobeného bronchospasmem u pacientů s astmatem.
U pacientů s mírnou/středně závažnou chronickou obstrukční plicní chorobou má být GANFORT použit s opatrností a pouze pokud potenciální přínos převáží potenciální rizika.
Endokrinní poruchy
Beta-adrenergní blokátory je nutno podávat s opatrností pacientům se spontánní hypoglykemií nebo labilní formou diabetu, neboť betablokátory mohou maskovat příznaky a symptomy akutní hypoglykemie.
Betablokátory mohou rovněž maskovat příznaky hypertyreózy.
Onemocnění rohovky
Oční betablokátory mohou způsobovat suchost očí. Pacienti s onemocněními rohovky mají být léčeni s opatrností.
Jiné betablokátory
Účinky na nitrooční tlak nebo známé účinky systémové betablokády mohou být zesíleny, je-li timolol podán pacientům, kteří již dostávají systémový betablokátor. Odpověď těchto pacientů na léčbu má být pečlivě sledována. Použití dvou topických beta-adrenergních blokátorů se nedoporučuje (viz bod 4.5).
Anafylaktické reakce
Pacienti s atopií nebo těžkou anafylaktickou reakcí na různé alergeny v anamnéze mohou při užívání betablokátorů výrazněji reagovat na opakované podráždění příslušnými alergeny a nemusí reagovat na obvyklou dávku adrenalinu používanou k léčení anafylaktických reakcí.
Odchlípení cévnatky
Po podání přípravků zamezujících tvorbě komorové vody (např. timolol, acetazolamid) po filtračních procedurách bylo hlášeno odchlípení cévnatky.
Chirurgická anestezie
Oční betablokátory mohou blokovat systémové beta-agonistické účinky, např. u adrenalinu. Anesteziolog má být informován o tom, že je pacientovi podáván timolol.
Jaterní nežádoucí účinky
U pacientů s lehčím jaterním onemocněním v anamnéze nebo s abnormálními výchozími hladinami ALT, AST a/nebo bilirubinu nemá podávání bimatoprostu po dobu 2 let mít žádné nežádoucí účinky na jaterní funkce. Nejsou známé žádné nežádoucí účinky očního timololu na funkci jater.
Oční nežádoucí účinky
Dříve, než je léčba zahájena, má být pacient informován o možném růstu řas, ztmavnutí kůže na víčkách nebo periokulárně a zvýšené hnědé pigmentaci duhovky, které byly pozorovány během léčby bimatoprostem a GANFORTem. Zvýšená pigmentace duhovky je pravděpodobně trvalá a může vést k rozdílnému vzhledu očí, pokud bylo léčeno pouze jedno oko. Po ukončení léčby GANFORTem může být pigmentace duhovky trvalá. Po 1 roku léčby GANFORTem byla incidence pigmentace duhovky 0,2 %. Po 1 roku léčby pouze bimatoprostovými očními kapkami byla incidence 1,5 % a po 3 letech léčby se nezvýšila. Změna pigmentace je způsobena zvýšením obsahu melaninu v melanocytech, spíše než zvýšením počtu melanocytů. Dlouhodobé účinky zvýšené pigmentace duhovky nejsou známy. Změna barvy duhovky související s očním podáním bimatoprostu nemusí být patrná několik měsíců až let. Mateřská znaménka ani pihy na duhovce nebývají léčbou ovlivněny. Pigmentace tkáně okolo očí byla u některých pacientů hlášena jako reverzibilní.
Při léčbě GANFORTem byl hlášen makulární edém, včetně cystoidního makulárního edému. Proto má být GANFORT používán s opatrností u afakických pacientů, pseudoafakických pacientů s trhlinou zadního pouzdra čočky nebo u pacientů se známými rizikovými faktory pro vznik makulárního edému (např. nitrooční chirurgický zákrok, okluze retinální žíly, zánětlivé onemocnění očí a diabetická retinopatie).
GANFORT má být používán s opatrností u pacientů s aktivním nitroočním zánětem (např. uveitida), protože se zánět může zhoršit.
Kůže
V oblastech, kde roztok GANFORTu přichází opakovaně do styku s kožním povrchem, může potenciálně dojít k růstu ochlupení. Proto je důležité GANFORT aplikovat podle pokynů a zabránit jeho stékání na tváře nebo jiné oblasti kůže.
Pomocné látky
Konzervační látka v GANFORTu, benzalkonium-chlorid, může způsobit podráždění oka. Před aplikací léku musí být kontaktní čočky vyjmuty a znovu nasazeny nejdříve 15 minut po podání. Je známo, že benzalkonium-chlorid mění barvu měkkých kontaktních čoček. Proto nesmí s měkkými kontaktními čočkami přijít do styku.
Bylo hlášeno, že benzalkonium-chlorid způsobuje tečkovitou keratopatii a/nebo toxickou ulcerózní keratopatii. Proto je nutné pacienty se syndromem suchého oka nebo s ohrožením rohovky při častějším nebo prodlouženém používání GANFORTu sledovat.
Další onemocnění
GANFORT nebyl studován u pacientů s očními zánětlivými stavy, neovaskularizací, záněty, glaukomem se zavřeným úhlem, kongenitálním glaukomem a glaukomem s úzkým úhlem.
Ve studiích bimatoprostu 0,3 mg/ml u pacientů s glaukomem nebo oční hypertenzí bylo prokázáno, že častější expozice oka více než 1 dávce bimatoprostu denně může zhoršit účinky na snižování IOP. Pacienti používající GANFORT s jinými analogy prostaglandinu mají být sledováni s ohledem na změny nitroočního tlaku.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné specifické studie interakcí s fixní kombinací bimatoprostu/timololu.
Existuje možnost aditivních účinků, které vedou k hypotenzi a/nebo výrazné bradykardii, je-li podán oční roztok s betablokátorem souběžně s perorálními blokátory kalciového kanálu, guanethidinem, beta-adrenergními blokátory, parasympatomimetiky, antiarytmiky (včetně amiodaronu) a digitalisovými glykosidy.
V průběhu kombinované léčby inhibitory CYP2D6 (např. chinidin, fluoxetin, paroxetin) a timololem byla hlášena zvýšená systémová betablokáda (např. zpomalený srdeční rytmus, deprese).
V ojedinělých případech vedlo souběžné použití očních betablokátorů a adrenalinu (epinefrinu) k mydriáze.
4.6 Fertilita, těhotenství a kojení
Adekvátní údaje o podávání fixní kombinace bimatoprostu/timololu těhotným ženám nejsou k dispozici. Pokud to není nezbytně nutné, GANFORT se nemá během těhotenství podávat. Informace o možnosti snížení systémové absorpce viz bod 4.2.
Bimatoprost
Adekvátní údaje o podávání bimatoprostu těhotným ženám nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu při vysokých dávkách toxických pro matku (viz bod 5.3).
Timolol
Epidemiologické studie neprokázaly malformační účinky, ale prokázaly riziko opoždění nitroděložního růstu v případě, že se betablokátory podávají perorálně. Kromě toho, pokud byly betablokátory podávány před porodem, byly u novorozence pozorovány známky a symptomy betablokády (např. bradykardie, hypotenze, dušnost a hypoglykemie). Podává-li se GANFORT až do porodu, musí být novorozenec v prvních dnech života pečlivě monitorován. Studie s timololem na zvířatech prokázaly reprodukční toxicitu při dávkách značně vyšších než dávky, které by se použily v klinické praxi (viz bod 5.3).
Kojení
Timolol
Betablokátory jsou vylučovány do mateřského mléka. Při terapeutických dávkách timololu v očních kapkách je však nepravděpodobné, že by se do mléka dostalo takové množství, které by u kojence vedlo ke klinickým příznakům betablokády. Informace o možnosti snížení systémové absorpce viz bod 4.2.
Bimatoprost
Není známo, zda je bimatoprost vylučován do mateřského mléka, ale je vylučován do mléka potkanů. GANFORT nemá být podáván kojícím ženám.
Fertilita
Nejsou k dispozici žádné údaje o účincích GANFORTu na lidskou fertilitu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
GANFORT má zanedbatelný vliv na schopnost řídit a obsluhovat stroje. Jestliže, stejně jako po jiné léčbě očí, nastane po podání přechodné rozostření vidění, má pacient před řízením nebo obsluhou strojů počkat, dokud se zrak nevyjasní.
4.8 Nežádoucí účinky
GANFORT
Shrnutí bezpečnostního profilu
Nežádoucí účinky hlášené v klinických studiích při použití přípravku GANFORT se omezily na dříve hlášené reakce u jednotlivě podávaného bimatoprostu a timololu. V klinických studiích nebyly pozorovány žádné nové nežádoucí účinky specifické pro GANFORT.
Většina nežádoucích účinků udávaných v klinických studiích s použitím GANFORTu se týkala očí, byly pouze mírné a žádné nebyly vážné. Na základě 12 měsíčních klinických údajů byla nejčastěji hlášeným nežádoucím účinkem hyperémie spojivky (většinou v náznacích nebo mírná a považovaná za nezánětlivou) přibližně u 26 % pacientů, která vedla k přerušení léčby u 1,5 % pacientů.
Seznam nežádoucích účinků v tabulce
Tabulka 1 představuje nežádoucí účinky, které byly hlášeny během klinických studií u GANFORTu (v každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti) nebo v období po uvedení na trh.
Četnost možných nežádoucích účinků uvedených níže je definována pomocí následující konvence:
|
Velmi časté |
>1/10 |
|
Časté |
>1/100 až <1/10 |
|
Méně časté |
>1/1 000 až <1/100 |
|
Vzácné |
>1/10 000 až < 1/1 000 |
|
Velmi vzácné |
<1/10 000 |
|
Není známo |
Frekvenci nelze z dostupných údajů určit |
Tabulka 1
|
Třídy orgánových systémů |
Četnost |
Nežádoucí účinek |
|
Poruchy imunitního systému |
Není známo |
Hypersenzitivní reakce včetně známek nebo příznaků alergické dermatitidy, angioedému, oční alergie |
|
Psychiatrické poruchy |
Není známo |
Insomnie, noční můry |
|
Poruchy nervového systému |
Časté |
Bolest hlavy, závratě |
|
Není známo |
Dysgeuzie | |
|
Poruchy oka |
Ve lmi časté |
Hyperemie spojivek |
|
Časté |
Superficiální tečkovitá keratitida, eroze rohovky, pálení očí, svědění očí, bodavý pocit v očích, pocit cizího tělesa, suchost očí, erytém víček, bolest oka, fotofobie, výtok z očí, |
|
zrakové poruchy, svědění víček, zhoršení zrakové ostrosti, blefaritida, edém víček, podráždění očí, epifora, růst řas | ||
|
Méně časté |
Iritida, spojivkový edém, bolest víček, astenopie, trichiáza, hyperpigmentace duhovky, prohloubení rýhy v očním víčku, retrakce víček | |
|
Není známo |
Cystoidní makulární edém, zduření oka, rozmazané vidění | |
|
Srdeční poruchy |
Není známo |
Bradykardie |
|
Respirační, hrudní a mediastinální poruchy |
Časté |
Rinitida |
|
Méně časté | ||
|
Není známo |
Bronchospasmus (převážně u pacientů s bronchospastickou chorobou), astma | |
|
Poruchy kůže a podkožní tkáně |
Časté |
Pigmentace víček, hirsutismus, nadměrná pigmentace kůže v okolí očí |
|
Není známo |
Alopecie | |
|
Obecné poruchy a reakce v místě podání |
Není známo |
Únava |
Další nežádoucí účinky, které byly pozorovány u jedné z léčivých látek přípravku (bimatoprost a timolol) a mohou se potenciálně vyskytnout i u GANFORTu, jsou uvedeny níže v Tabulce 2 (bimatoprost) a Tabulce 3 (timolol):
Bimatoprost
Tabulka 2
|
Třída orgánových systémů |
Nežádoucí účinek |
|
Poruchy oka |
Ztmavnutí řas, blefarospazmus, retinální hemoragie, uveitida, perirobitální erytém |
|
Cévní poruchy |
Hypertenze |
|
Celkové poruchy a reakce v místě aplikace |
Astenie |
|
Gastrointestinální poruchy | |
|
Vyšetření |
Abnormální testy jaterních funkcí |
Timolol
GANFORT (bimatoprost/timolol), stejně jako jiné topicky podávané oční léčivé přípravky, je absorbován do systémového oběhu. Absorpce timololu může způsobovat podobné nežádoucí účinky jako u systémových betablokátorů. Výskyt systémových nežádoucích účinků je při topickém očním podání nižší než při systémovém podání. Informace o možnosti snížení systémové absorpce viz bod 4.2.
Doplňující nežádoucí reakce, které byly zaznamenány u oftalmických betablokátorů a mohou se také vyskytnout u GANFORTu, jsou uvedeny níže v Tabulce 3:
Tabulka 3
|
Třída orgánových systémů |
Nežádoucí účinek |
|
Poruchy imunitního systému |
Systémové alergické reakce včetně anafylaxe |
|
Poruchy metabolismu a výživy |
Hypoglykemie |
|
Psychiatrické poruchy |
Deprese, ztráta paměti |
|
Poruchy nervového systému |
Synkopa, mozková cévní příhoda, zhoršené známky a symptomy myastenia gravis, parestezie, mozková ischemie |
|
Poruchy oka |
Snížená citlivost rohovky, diplopie, ptóza, odloučení choriodey po filtrační chirurgii (viz bod 4.4), keratitida |
|
Srdeční poruchy |
Atrioventrikulární blokáda, srdeční zástava, arytmie, srdeční selhání, městnavé srdeční selhání, bolest na hrudi, palpitace, edém |
|
Cévní poruchy |
Hypotenze, Raynaudův fenomén, studené ruce a nohy |
|
Respirační, hrudní a mediastinální poruchy | |
|
Gastrointestinální poruchy |
Nauzea, průjem, dyspepsie, sucho v ústech, bolesti břicha, zvracení |
|
Poruchy kůže a podkožní tkáně |
Psoriáziformní vyrážka nebo exacerbace psoriázy, kožní vyrážka |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Myalgie |
|
Poruchy reprodukčního systému a prsu |
Sexuální dysfunkce, snížené libido |
|
Celkové poruchy a reakce v místě aplikace |
Astenie |
Nežádoucí účinky hlášené u očních kapek obsahujících fosfáty
Velmi vzácně byly u některých pacientů s významně poškozenou rohovkou hlášeny případy korneální kalcifikace spojené s použitím očních kapek obsahujících fosfáty.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V*.
4.9 Předávkování
Není pravděpodobné, že by mohlo nastat topické předávkování přípravkem GANFORT, nebo že by bylo spojenou s toxicitou.
Bimatoprost
Jestliže je GANFORT náhodně požit, mohou být užitečné následující informace: během dvoutýdenní studie u potkanů a myší při dávkách bimatoprostu až do 100 mg/kg/den nevznikla žádná toxicita. Tato dávka vyjádřená v mg/m2 je nejméně 70krát vyšší než dávka jedné lahvičky GANFORTu náhodně požitá 10kg dítětem.
Timolol
Symptomy systémového předávkování timololem zahrnují: bradykardii, hypotenzi, bronchospasmus, bolest hlavy, závratě, dušnost a srdeční zástavu. Studie pacientů se selháním ledvin prokázala, že timolol je špatně dialyzovatelný.
Dojde-li k předávkování, léčba musí být symptomatická a podpůrná.
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Oftalmologika,- betablokátory - ATC kód: S01ED51 Mechanismus účinku
GANFORT obsahuje dvě léčivé látky: bimatoprost a timolol. Tyto dvě složky snižují zvýšený nitrooční tlak (IOP) doplňkovým mechanismem účinku a tento kombinovaný účinek vede k další redukci IOP ve srovnání s podáváním kterékoliv z těchto složek zvlášť. GANFORT začíná působit velmi rychle.
Bimatoprost je léčivá látka působící jako silné oční hypotenzivum. Je to syntetický prostamid, strukturálně blízký prostaglandinu F2a(PGF2a), který nepůsobí na známé prostaglandinové receptory. Bimatoprost selektivně napodobuje účinek nově objevených biosyntetizovaných substancí nazývaných prostamidy. Nicméně, prostamidové receptory nebyly ještě dosud strukturálně identifikovány. Mechanismem účinku, kterým bimatoprost snižuje nitrooční tlak u člověka, je zvýšení odtoku nitrooční tekutiny trámčinou komorového úhlu a zvýšení odtoku uveosklerální cestou.
Timolol je beta1 a beta2 neselektivní blokátor adrenergních receptorů, který nemá významný sympatomimetický účinek, přímý tlumivý účinek na myokard nebo lokálně anestetický účinek (stabilizující membrány). Timolol snižuje IOP tím, že snižuje tvorbu nitrooční tekutiny. Přesný mechanismus účinku není jasně stanoven, ale pravděpodobné je potlačení zvýšené syntézy cyklické AMP způsobené endogenní beta-adrenergní stimulací.
Klinické účinky
Účinek GANFORTu na snížení IOP není horší než účinek dosažený kombinovaným podáváním bimatoprostu (jednou denně) a timololu (dvakrát denně).
Z údajů o léku GANFORT v existující literatuře vyplývá, že večerní dávka dokáže účinněji snižovat IOP než ranní dávka. Při volbě ranního nebo večerního dávkování je však třeba zohlednit pravděpodobnost dodržování léčby.
Pediatrická populace
Bezpečnost a účinnost GANFORTu u dětí od 0 do 18 let nebyla stanovena.
5.2 Farmakokinetické vlastnosti
Léčivý přípravek GANFORT
Koncentrace plazmatického bimatoprostu a timololu byly stanoveny ve zkřížené studii porovnávající monoterapie s léčbou GANFORTem u zdravých subjektů. Systémové vstřebávání jednotlivých složek bylo minimální a nebylo ovlivněno současným podáváním v jediném přípravku.
Ve dvou 12 měsíčních studiích, kdy se měřilo systémové vstřebávání, nebyla pozorována kumulace žádné ze složek.
Bimatoprost:
Bimatoprost in vitro velmi dobře penetruje lidskou rohovkou a sklérou. Po očním podání je systémová expozice bimatoprostu velmi nízká a ani po čase nedochází ke kumulaci. Při podávání jedenkrát denně po jedné kapce 0,03 % bimatoprostu do obou očí po dobu dvou týdnů dosáhly koncentrace v krvi maximálních hodnot do 10 minut po podání a během 1,5 hodiny po aplikaci klesly pod nejnižší detekovatelnou hodnotu (0,025 ng/ml). Průměrné hodnoty Cmax a AUC 0-24hrs byly 7. a 14. den podobné. Průměrná hodnota Cmax byla přibližně 0,08 ng/ml a AUC 0-24hrs přibližně 0,09 ng^hod/ml, což ukazuje, že rovnovážného stavu bylo dosaženo během prvního týdne očního podávání.
Bimatoprost je se střední mírou distribuován do tělesných tkání a systémový distribuční objem byl v ustáleném stavu u člověka 0,67 l/kg. V lidské krvi je bimatoprost především v plazmě. Vazba bimatoprostu na plazmatické bílkoviny je přibližně 88 %.
Bimatoprost, který se po očním podání dostane do systémového oběhu, je z větší části nemetabolizovaný. Bimatoprost poté podléhá oxidaci, N-deetylaci a glukuronidaci a vytváří různé druhy metabolitů.
Bimatoprost je primárně eliminován ledvinami, až 67 % z intravenózní dávky podané zdravým dobrovolníkům bylo vyloučeno močí, 25 % z takto podané dávky bylo vyloučeno stolicí. Poločas eliminace určený po intravenózním podání byl přibližně 45 minut. Celková clearance krve byla 1,5 l/hod/kg.
Charakteristika u starších pacientů
U starších pacientů (65 let a starší) při dávkování dvakrát denně byla průměrná hodnota AUC 0-24hod 0,0634 ng^hod/ml bimatoprostu, což je signifikantně více než 0,0218 ng^hod/ml u mladých zdravých dospělých osob. Nicméně, toto zjištění není klinicky relevantní, protože systémová expozice starších i mladších osob byla při očním podávání velmi nízká. Kumulace bimatoprostu v krvi v čase není známá a bezpečnostní profil pro starší i mladé pacienty byl podobný.
Timolol
Po očním podávání 0,5 % roztoku očních kapek lidem podrobujícím se operaci katarakty byla maximální koncentrace timololu v moku oční komory 898 ng/ml jednu hodinu po podání. Část dávky se vstřebává systémově, kde se rozsáhle metabolizuje v játrech. Poločas timololu v plazmě je cca 4 až 6 hodin. Timolol se částečně metabolizuje v játrech a timolol a jeho metabolity se vylučují ledvinami. Timolol se neváže ve velkém rozsahu na plazmu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Léčivý přípravek GANFORT
Studie oční toxicity po opakovaném podávání GANFORTu neprokázaly žádné zvláštní riziko u člověka. Profil oční a systémové bezpečnosti jednotlivých složek je již pevně stanovený.
Bimatoprost
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity a hodnocení kancerogenního potenciálu neodhalily žádné zvláštní riziko pro člověka. Ve studiích na hlodavcích při systémových expozicích 33 až 97krát vyšších, než jakých je dosahováno u člověka po očním podání, se vyskytly druhově specifické aborty.
Oční podávání bimatoprostu opicím v koncentracích >0,03 % denně po dobu jednoho roku způsobilo zvýšení pigmentace duhovky a reverzibilní, na dávce závislé, periokulární účinky, charakterizované prominující horní a/nebo dolní rýhou a rozšířením palpebrální štěrbiny. Zdá se, že zvýšení pigmentace duhovky je způsobeno zvýšenou stimulací produkce melaninu v melanocytech, a ne zvýšením počtu melanocytů. Žádné funkční ani mikroskopické změny ve vztahu k periokulárním účinkům nebyly pozorovány a mechanizmus způsobující periokulární změny není znám.
Timolol
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu a reprodukční toxicity neodhalily žádné zvláštní riziko pro člověka.
6.1 Seznam pomocných látek
Benzalkonium-chlorid Chlorid sodný
Heptahydrát hydrogenfosforečnanu sodného Monohydrát kyseliny citronové
Kyselina chlorovodíková nebo hydroxid sodný (k úpravě pH)
Čištěná voda
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
Chemická a fyzikální stabilita po otevření před použitím byla prokázána na dobu 28 dní při 25 °C.
Z mikrobiologického hlediska doba a podmínky uchovávání po otevření před použitím jsou v odpovědnosti pacienta a normálně doba nemá být delší než 28 dní při 25 °C.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Bílá, neprůhledná LDPE lahvička s polystyrenovým uzávěrem se závitem. Jedna lahvička je naplněna
3 ml.
Dostupné jsou následující velikosti balení: krabička obsahující 1 nebo 3 lahvičky po 3 ml. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Allergan Pharmaceuticals Ireland
Castlebar Road
Westport
Co. Mayo
Irsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/06/340/001-002
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace:19. května 2006
Datum posledního prodloužení registrace: 23. června 2011
10. DATUM REVIZE TEXTU
<{MM/RRRR}>
<{DD/MM/RRRR}>
<{DD měsíc RRRR}>
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropská agentura pro léčivé přípravky http://www.ema.europa.eu
NÁZEV PŘÍPRAVKU
1.
GANFORT 0,3 mg/ml + 5 mg/ml oční kapky, roztok, v jednodávkovém obalu.
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml roztoku obsahuje bimatoprostum 0,3 mg a timololum 5 mg (jako timololi maleas 6,8 mg).
Úplný seznam pomocných látek viz bod 6.1
3. LÉKOVÁ FORMA
Oční kapky, roztok, v jednodávkovém obalu. Bezbarvý až světle žlutý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Snížení nitroočního tlaku (IOP) u dospělých pacientů s glaukomem s otevřeným úhlem nebo nitrooční hypertenzí, kteří nedostatečně reagují na léčbu lokálními betablokátory nebo analogy prostaglandinu.
4.2 Dávkování a způsob podání
Dávkování
Doporučená dávka pro dospělé (včetně starších osob)
Doporučená dávka je jedna kapka GANFORTu v jednodávkovém obalu do postiženého oka (očí) jedenkrát denně buď ráno, nebo večer. Dávka se má podávat každý den ve stejnou dobu.
Z údajů o léku GANFORT (vícedávkové balení) v existující literatuře vyplývá, že večerní dávka dokáže účinněji snižovat IOP než ranní dávka. Při volbě ranního nebo večerního dávkování je však třeba zohlednit pravděpodobnost dodržování léčby (viz bod 5.1).
Pouze k jednorázovému použití, obsah jedné nádobky je dostačující k ošetření obou očí. Veškerý nespotřebovaný roztok je zapotřebí bezprostředně po použití zlikvidovat.
Vynechá-li se jedna dávka, léčba musí pokračovat další plánovanou dávkou. Dávkování jedenkrát denně do postiženého oka (očí) nemá být překročeno.
Porucha ledvin a jater
GANFORT v jednodávkovém obalu nebyl studován u pacientů s poruchou ledvicn nebo jater. U těchto pacientů má proto být použit s opatrností.
Pediatrická populace
Bezpečnost a účinnost GANFORTu v jednodávkovém obalu u dětí ve věku do 18 let nebyla stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Pokud je používán více než jeden lokální oční přípravek, pak je mezi jejich podáním nutné zachovat časový odstup nejméně 5 minut.
Systémová absorpce se sníží při použití nasolakrimální okluze nebo zavření víčka na dobu 2 minut. To může vést ke sníženému výskytu systémových nežádoucích účinků a zvýšit aktivitu v místě působení.
4.3 Kontraindikace
■ Hypersensitivita na léčivou látku(y) nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
■ Reaktivní onemocnění cest dýchacích včetně průduškového astmatu nebo průduškového astmatu v anamnéze, těžká chronická obstrukční plicní choroba.
■ Sinusová bradykardie, sick sinus syndrom, sinoatriální blokáda, atrioventrikulámí blok druhého nebo třetího stupně, který není kontrolovaný kardiostimulátorem. Klinicky zjevné srdeční selhání, kardiogenní šok.
4.4 Zvláštní upozornění a opatření pro použití
Tak jako u ostatních lokálně aplikovaných očních léčivých přípravků, mohou být i léčivé látky GANFORTu v jednodávkovém obalu (timolol/ bimatoprost) vstřebávány systémově. Žádné zvýšení systémového vstřebávání individuálních léčivých látek nebylo u GANFORTu (vícedávkové balení) pozorováno. Vzhledem k beta-adrenergním účinkům timololu se mohou vyskytnout tytéž typy kardiovaskulárních, plicních a jiných nežádoucích účinků (ADR), které byly pozorovány u systémových betablokátorů. Výskyt systémových nežádoucích účinků je při topickém očním podání nižší než při systémovém podání. Opatření ke snížení systémové absorpce viz bod 4.2.
Srdeční poruchy
U pacientů s kardiovaskulárním onemocněním (např. ischemická choroba srdeční, Prinzmetalova angina a srdeční selhání) a pacientů podstupujících antihypertenzní terapií systémovými betablokátory má být zvážena terapie jinou léčivou látkou. Pacienty s kardiovaskulárními chorobami je třeba sledovat kvůli známkám zhoršení choroby a kvůli výskytu nežádoucích účinků.
Vzhledem k negativnímu účinku na převodní čas mají být betablokátory pacientům se srdeční blokádou prvního stupně podávány s opatrností.
Cévní poruchy
Pacienti se závažnými poruchami/onemocněními periferní cirkulace (tj. závažné formy Raynaudovy choroby nebo Raynaudova syndromu) mají být léčeni s opatrností.
Poruchy dýchacího systému
Po podání některých očních betablokátorů byly hlášeny respirační účinky, včetně úmrtí způsobeného bronchospasmem u pacientů s astmatem.
U pacientů s mírnou/středně závažnou chronickou obstrukční plicní chorobou má být GANFORT jednodávkovém obalu použit s opatrností a pouze pokud potenciální přínos převáží potenciální rizika.
Endokrinní poruchy
Beta-adrenergní blokátory je nutno podávat s opatrností pacientům se spontánní hypoglykemií nebo s labilní formou diabetu, neboť betablokátory mohou maskovat příznaky a symptomy akutní hypoglykemie.
Betablokátory mohou rovněž maskovat příznaky hypertyreózy.
Onemocnění rohovky
Oční betablokátory mohou způsobovat suchost očí. Pacienti s onemocněními rohovky mají být léčeni s opatrností.
Jiné betablokátory
Účinky na nitrooční tlak nebo známé účinky systémové betablokády mohou být zesíleny, je-li timolol podán pacientům, kteří již dostávají systémový betablokátor. Odpověď těchto pacientů na léčbu má
14
být pečlivě sledována. Použití dvou topických beta-adrenergních blokátorů se nedoporučuje (viz bod 4.5).
Anafylaktické reakce
Pacienti s atopií nebo těžkou anafylaktickou reakcí na různé alergeny v anamnéze mohou při užívání betablokátorů výrazněji reagovat na opakované podráždění příslušnými alergeny a nemusí reagovat na obvyklou dávku adrenalinu používanou k léčení anafylaktických reakcí.
Odchlípení cévnatky
Po podání přípravků zamezujících tvorbě komorové vody (např. timolol, acetazolamid) po filtračních procedurách bylo hlášeno odchlípení cévnatky.
Chirurgická anestezie
Oční betablokátory mohou blokovat systémové beta-agonistické účinky, např. u adrenalinu. Anesteziolog má být informován o tom, že je pacientovi podáván timolol.
Jaterní nežádoucí účinky
U pacientů s lehčím jaterním onemocněním v anamnéze nebo s abnormálními výchozími hladinami ALT, AST a/nebo bilirubinu nemá podávání bimatoprostu očních kapek po dobu 2 let mít žádné nežádoucí účinky na jaterní funkce. Nejsou známé žádné nežádoucí účinky očního timololu na funkci jater.
Oční nežádoucí účinky
Dříve, než je léčba zahájena, má být pacient informován o možném růstu řas a periorbitální kožní hyperpigmentaci, které byly pozorovány během léčby GANFORTem v jednodávkovém obalu. Zvýšená hnědá pigmentace duhovky byla rovněž pozorována během léčby GANFORTem (vícedávkové balení). Zvýšená pigmentace duhovky je pravděpodobně trvalá a může vést k rozdílnému vzhledu očí, pokud bylo léčeno pouze jedno oko. Po ukončení léčby GANFORTem může být pigmentace duhovky trvalá. Po 1 roku léčby GANFORTem (vícedávkové balení) byla incidence pigmentace duhovky 0,2 %. Po 1 roku léčby pouze bimatoprostovými očními kapkami byla incidence
1,5 % a po 3 letech léčby se nezvýšila. Změna pigmentace je způsobena zvýšením obsahu melaninu v melanocytech, spíše než zvýšením počtu melanocytů. Dlouhodobé účinky zvýšené pigmentace duhovky nejsou známy. Změna barvy duhovky související s očním podáním bimatoprostu nemusí být patrná několik měsíců až let. Mateřská znaménka ani pihy na duhovce nebývají léčbou ovlivněny. Pigmentace tkáně okolo očí byla u některých pacientů hlášena jako reversibilní.
Při léčbě GANFORTem byl hlášen makulární edém, včetně cystoidního makulárního edému. Proto má být GANFORT používán s opatrností u afakických pacientů, pseudoafakických pacientů s trhlinou zadního pouzdra čočky nebo u pacientů se známými rizikovými faktory pro vznik makulárního edému (např. nitrooční chirurgický zákrok, okluze retinální žíly, zánětlivé onemocnění očí a diabetická retinopatie).
GANFORT má být používán s opatrností u pacientů s aktivním nitroočním zánětem (např. uveitida), protože se zánět může zhoršit.
Kůže
V oblastech, kde roztok GANFORTu přichází opakovaně do styku s kožním povrchem, může potenciálně dojít k růstu ochlupení. Proto je důležité GANFORT aplikovat podle pokynů a zabránit jeho stékání na tváře nebo jiné oblasti kůže.
Další onemocnění
GANFORT v jednodávkovém obalu nebyl studován u pacientů s očními zánětlivými stavy, neovaskularizací, záněty, glaukomem se zavřeným úhlem, kongenitálním glaukomem a glaukomem s úzkým úhlem.
Ve studiích bimatoprostu 0,3 mg/ml u pacientů s glaukomem nebo oční hypertenzí bylo prokázáno, že častější expozice oka více než 1 dávce bimatoprostu denně může zhoršit účinky na snižování IOP.
Pacienti používající GANFORT s jinými analogy prostaglandinu mají být sledováni na změny nitroočního tlaku.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné specifické studie interakcí s fixní kombinací bimatoprostu/timololu.
Existuje možnost aditivních účinků, které vedou k hypotenzi a/nebo výrazné bradykardii, je-li podán oční roztok s betablokátorem souběžně s perorálními blokátory kalciového kanálu, guanethidinem, beta-adrenergními blokátory, parasympatomimetiky, antiarytmiky (včetně amiodaronu) a digitalisovými glykosidy.
V průběhu kombinované léčby inhibitory CYP2D6 (např. chinidin, fluoxetin, paroxetin) a timololem byla hlášena zvýšená systémová betablokáda (např. zpomalený srdeční rytmus, deprese).
V ojedinělých případech vedlo souběžné použití očních betablokátorů a adrenalinu (epinefrinu) k mydriáze.
4.6 Fertilita, těhotenství a kojení
Adekvátní údaje o podávání fixní kombinace bimatoprostu/timololu těhotným ženám nejsou k dispozici. Pokud to není nezbytně nutné, GANFORT v jednodávkovém obalu se nemá během těhotenství podávat. Informace o možnosti snížení systémové absorpce viz bod 4.2.
Bimatoprost
Adekvátní údaje o podávání bimatoprostu těhotným ženám nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu při vysokých dávkách toxických pro matku (viz bod 5.3).
Timolol
Epidemiologické studie neprokázaly malformační účinky, ale prokázaly riziko opoždění nitroděložního růstu v případě, že se betablokátory podávají perorálně. Kromě toho, pokud byly betablokátory podávány před porodem, byly u novorozence pozorovány známky a symptomy betablokády (např. bradykardie, hypotenze, dušnost a hypoglykemie). Podává-li se GANFORT v jednodávkovém obalu až do porodu, musí být novorozenec v prvních dnech života pečlivě monitorován. Studie s timololem na zvířatech prokázaly reprodukční toxicitu při dávkách značně vyšších než dávky, které by se použily v klinické praxi (viz bod 5.3).
Kojení
Timolol
Betablokátory jsou vylučovány do mateřského mléka. Při terapeutických dávkách timololu v očních kapkách je však nepravděpodobné, že by se do mléka dostalo takové množství, které by u kojence vedlo ke klinickým příznakům betablokády. Informace o možnosti snížení systémové absorpce viz bod 4.2.
Bimatoprost
Není známo, zda je bimatoprost vylučován do mateřského mléka, ale je vylučován do mléka potkanů. GANFORT v jednodávkovém obalu nemá být podáván kojícím ženám.
Fertilita
Nejsou k dispozici žádné údaje o účincích GANFORTu v jednodávkovém obalu na lidskou fertilitu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
GANFORT v jednodávkovém obalu má zanedbatelný vliv na schopnost řídit a obsluhovat stroje. Jestliže, stejně jako po jiné topické léčbě očí, nastane po podání přechodné rozostření vidění, má pacient před řízením nebo obsluhou strojů počkat, dokud se zrak nevyjasní.
4.8 Nežádoucí účinky
GANFORT v jednodávkovém obalu
Shrnutí bezpečnostního profilu
Nežádoucí účinky hlášené v klinické studii při použití přípravku GANFORT v jednodávkovém obalu se omezily na dříve hlášené reakce u GANFORTu (vícedávkové balení) nebo u jednotlivě podávaného bimatoprostu nebo timololu. V klinických studiích nebyly pozorovány žádné nové nežádoucí účinky specifické pro GANFORT v jednodávkovém obalu.
Většina nežádoucích účinků udávaných s použitím GANFORTu v jednodávkovém obalu se týkala očí, byly pouze mírné a žádné nebyly vážné. Na základě 12 týdenní klinické studie GANFORTu v jednodávkovém obalu podávaného jednou denně byla nejčastěji hlášeným nežádoucím účinkem hyperémie spojivky (většinou v náznacích nebo mírná a považovaná za nezánětlivou) přibližně u 21 % pacientů, která vedla k přerušení léčby u 1,4 % pacientů.
Seznam nežádoucích účinků v tabulce
Tab ulka 1 uvádí nežádoucí účinky hlášené během 12týdenní klinické studie u GANFORTu v jednodávkovém obalu (v každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti) nebo v období po uvedení na trh.
Četnost možných nežádoucích účinků uvedených níže je definována pomocí následující konvence:
|
Velmi časté |
>1/10 |
|
Časté |
>1/100 až <1/10 |
|
Méně časté |
>1/1,000 až <1/100 |
|
Vzácné |
>1/10,000 až <1/1,000 |
|
Velmi vzácné |
<1/10 000 |
|
Není známo |
Frekvenci nelze z dostupných údajů určit |
Tabulka 1
|
Orgánový systém |
F rekvence |
Nežádoucí účinek |
|
Poruchy imunitního systému |
Není známo |
Přecitlivělé reakce včetně projevů nebo příznaků alergické dermatitidy, angioedému, oční alergie |
|
Poruchy oka |
Velmi časté |
Hyperémie spojivek |
|
Časté |
Tečkovitá keratitida, podráždění oka, podráždění spojivek, svědění očí, bolest očí, pocit cizího tělesa v oku, suché oko, zvýšené slzení, erytém víček, fotofobie, růst řas | |
|
Méně časté |
Abnormální pocit v oku, svědění víček, edém víček, astenopie, zabarvení (ztmavnutí) řas | |
|
Není známo |
Zduření oka | |
|
Poruchy nervového systému |
Časté |
Bolesti hlavy |
|
Srdeční poruchy |
Není známo |
Bradykardie |
|
Respirační, hrudní a mediastinální poruchy |
Není známo | |
|
Celkové poruchy a reakce v místě aplikace |
Méně časté |
Únava |
|
Poruchy kůže a podkožní tkáně |
Časté |
Hyperpigmentace kůže (kolem očí) |
Tabulka 2 uvádí další nežádoucí účinky hlášené u GANFORTu (vícedávkové balení), které by mohly případně nastat GANFORTu v jednodávkovém obalu. Většina z nich byly oční a mírně závažné.
Tabulka 2
|
Třídy orgánových systémů |
Četnost |
Nežádoucí účinek |
|
Poruchy nervového systému |
Časté |
Závratě |
|
Není známo |
Dysgeuzie | |
|
Poruchy oka |
Časté |
Eroze rohovky, výtok z očí, zrakové poruchy, blefaritida |
|
Méně časté |
Iritida, spojivkový edém, bolest víček, zhoršení zrakové ostrosti, trichiáza, hyperpigmentace duhovky, prohloubení rýhy v očním víčku, retrakce víček | |
|
Není známo |
Cystoidní makulární edém, rozostřené vidění | |
|
Psychiatrické poruchy |
Není známo |
Nespavost, noční můry |
|
Respirační, hrudní a mediastinální poruchy |
Časté |
Rinitida |
|
Není známo |
Bronchospasmus (převážně u pacientů s bronchospastickou chorobou). | |
|
Poruchy kůže a podkožní tkáně |
Časté |
Hirsutismus |
|
Není známo |
Alopécie |
Další nežádoucí účinky, které byly pozorovány u jedné z léčivých látek přípravku (bimatoprost a timolol) a mohou se potenciálně vyskytnout i u GANFORTu v jednodávkovém obalu, jsou uvedeny v tabulce 3 (bimatoprost) a tabulce 4 (timolol):
Bimatoprost 0,3 mg/ml (vícedávkové balení a jednodávkový obal)
Tabulka 3
|
Třída orgánových systémů |
Nežádoucí účinek |
|
Poruchy oka |
Blefarospazmus, retinální hemoragie, uveitida |
|
Cévní poruchy |
Hypertenze |
|
Celkové poruchy a reakce v místě aplikace |
Astenie |
|
Gastrointestinální poruchy | |
|
Vyšetření |
Abnormální testy jaterních funkcí |
Timolol
GANFORT (bimatoprost/timolol), stejně jako jiné topicky podávané oční léčivé přípravky, je absorbován do systémového oběhu. Absorpce timololu může způsobovat podobné nežádoucí účinky jako u systémových betablokátorů. Výskyt systémových nežádoucích účinků je při topickém očním podání nižší než při systémovém podání. Informace o možnosti snížení systémové absorpce viz bod 4.2.
Doplňující nežádoucí reakce, které byly zaznamenány u oftalmických betablokátorů a mohou se také vyskytnout u GANFORTu v jednodávkovém obalu, jsou uvedeny níže v tabulce 4:
Tabulka 4
|
Třída orgánových systémů |
Nežádoucí účinek |
|
Poruchy imunitního systému |
Systémové alergické reakce včetně anafylaxe |
|
Poruchy metabolismu a výživy |
Hypoglykemie |
|
Psychiatrické poruchy |
Deprese, ztráta paměti |
|
Poruchy nervového systému |
Synkopa, mozková cévní příhoda, zhoršené známky a symptomy myastenia gravis, parestezie, mozková ischemie |
|
Poruchy oka |
Snížená citlivost rohovky, diplopie, ptóza, odloučení cévnatky po filtrační chirurgii (viz bod 4.4), keratitida |
|
Srdeční poruchy |
Atrioventrikulární blokáda, srdeční zástava, arytmie, srdeční selhání, městnavé srdeční selhání, bolest na hrudi, palpitace, edém |
|
Cévní poruchy |
Hypotenze, Raynaudův fenomén, studené ruce a nohy |
|
Respirační, hrudní a mediastinální poruchy | |
|
Gastrointestinální poruchy |
Nauzea, průjem, dyspepsie, sucho v ústech, bolesti břicha, zvracení |
|
Poruchy kůže a podkožní tkáně |
Psoriáziformní vyrážka nebo exacerbace psoriázy, kožní vyrážka |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Myalgie |
|
Poruchy reprodukčního systému a prsu |
Sexuální dysfunkce, snížené libido |
|
Celkové poruchy a reakce v místě aplikace |
Astenie |
Nežádoucí účinky hlášené u očních kapek obsahujících fosfáty
Velmi vzácně byly u některých pacientů s významně poškozenou rohovkou hlášeny případy korneální kalcifikace spojené s použitím očních kapek obsahujících fosfáty.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V*.
4.9 Předávkování
Není pravděpodobné, že by mohlo nastat topické předávkování přípravkem GANFORT v jednodávkovém obalu, nebo že by bylo spojenou s toxicitou.
Bimatoprost
Jestliže dojde k náhodnému požití GANFORTu v jednodávkovém obalu, mohou být užitečné následující informace: během dvoutýdenní studie u myší a potkanů při perorálních dávkách bimatoprostu až do 100 mg/kg/den nevznikla žádná toxicita,u lidí to odpovídá ekvivalentní dávce 8,1, respektive 16,2 mg/kg. Tyto dávky jsou nejméně 7,5krát vyšší než množství bimatoprostu při náhodném požití celého obsahu krabičky s jednotlivými dávkami GANFORTu (90 jednodávkových obalů x 0,4 ml; 36 ml) u dítěte o hmotnosti 10 kg [(36 ml*0,3 mg/ml bimatoprostu)/10 kg;
1,08 mg/kg].
Timolol
Symptomy systémového předávkování timololem zahrnují: bradykardii, hypotenzi, bronchospasmus, bolest hlavy, závratě, dušnost a srdeční zástavu. Studie pacientů se selháním ledvin prokázala, že timolol je špatně dialyzovatelný.
Dojde-li k předávkování, léčba musí být symptomatická a podpůrná.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Oftalmologika,- betablokátory - ATC kód: S01ED51 Mechanismus účinku
GANFORT v jednodávkovém obalu obsahuje dvě léčivé látky: bimatoprost a timolol. Tyto dvě složky snižují zvýšený nitrooční tlak (IOP) doplňkovým mechanismem účinku a tento kombinovaný účinek vede k další redukci IOP ve srovnání s podáváním kterékoliv z těchto složek zvlášť. GANFORT v jednodávkovém obalu začíná působit velmi rychle.
Bimatoprost je léčivá látka působící jako silné oční hypotenzivum. Je to syntetický prostamid, strukturálně blízký prostaglandinu F2a (PGF2a), který nepůsobí na známé prostaglandinové receptory. Bimatoprost selektivně napodobuje účinek nově objevených biosyntetizovaných substancí nazývaných prostamidy. Nicméně, prostamidové receptory nebyly ještě dosud strukturálně identifikovány. Mechanismem účinku, kterým bimatoprost snižuje nitrooční tlak u člověka, je zvýšení odtoku nitrooční tekutiny trámčinou komorového úhlu a zvýšení odtoku uveosklerální cestou.
Timolol je beta1 a beta2 neselektivní blokátor adrenergních receptorů, který nemá významný sympatomimetický účinek, přímý tlumivý účinek na myokard nebo lokálně anestetický účinek (stabilizující membrány). Timolol snižuje IOP tím, že snižuje tvorbu nitrooční tekutiny. Přesný mechanismus účinku není jasně stanoven, ale pravděpodobné je potlačení zvýšené syntézy cyklické AMP způsobené endogenní beta-adrenergní stimulací.
Klinické účinky
12 týdenní klinická studie (dvojitě zaslepená, randomizovaná, s paralelními skupinami) porovnávala účinnost a bezpečnost l GANFORTu v jednodávkovém obalu a GANFORTu (vícedávkové balení) u pacientů s glaukomem nebo oční hypertenzí. GANFORT v jednodávkovém obalu nedosáhl horších výsledků účinnosti při snižování IOP než GANFORT(vícedávkové balení): horní hranice 95 % CI rozdílu mezi ošetřeními spadala do předem definovaného rozsahu 1,5 mm Hg v každém časovém bodě hodnoceno (za 0, 2, a 8 hodin) ve 12. týdnu (u primární analýzy) a rovněž ve 2. a 6. týdnu, pro průměrnou změnu IOP horšího oka v základní hodnotě (IOP horšího oka znamená oko s vyšší denní hodnotou IOP na základní hodnotě). Horní hranice 95 % CI ve 12. týdnu ve skutečnosti nepřekročila 0,14 mm Hg.
Obě skupiny ošetřovaných vykazovaly statisticky a klinicky významný průměrný pokles v základní hodnotě u IOP horšího oka ve všech následných časových bodech během studie (p < 0,001). Průměrné změny v základní hodnotě IOP horšího oka se v průběhu 12 týdenní studie pohybovaly od -9,16 do -7,98 mm Hg u skupiny GANFORT (v jednodávkovém obalu) a od -9,03 do -7,72 mm Hg pro skupinu GANFORT (vícedávkové balení).
GANFORT v jednodávkovém obalu rovněž dosáhl ekvivalentní účinnosti při snížení IOP jako GANFORT (vícedávkové balení) u IOP průměrného a horšího oka v každém následném časovém bodě ve 2., 6. a 12. týdnu.
Na základě studií GANFORTu (vícedávkové balení) bylo zjištěno, že účinek GANFORTu na snížení IOP není horší než účinek dosažený kombinovaným podáváním bimatoprostu (jednou denně) a timololu (dvakrát denně).
Z údajů o léku GANFORT (vícedávkové balení) v existující literatuře vyplývá, že večerní dávka dokáže účinněji snižovat IOP než ranní dávka. Při volbě ranního nebo večerního dávkování je však třeba zohlednit pravděpodobnost dodržování léčby.
Pediatrická populace
Bezpečnost a účinnost GANFORTu v jednodávkovém obalu u dětí do 18 let nebyla stanovena.
5.2 Farmakokinetické vlastnosti Léčivý přípravek GANFORT
Koncentrace plazmatického bimatoprostu a timololu byly stanoveny ve zkřížené studii porovnávající monoterapie s léčbou GANFORTem (vícedávkové balení) u zdravých subjektů. Systémové vstřebávání jednotlivých složek bylo minimální a nebylo ovlivněno současným podáváním v jediném přípravku.
Ve dvou 12 měsíčních studiích GANFORTu (vícedávkové balení), kdy se měřilo systémové vstřebávání, nebyla pozorována kumulace žádné ze složek.
Bimatoprost
Bimatoprost in vitro velmi dobře penetruje lidskou rohovkou a sklérou. Po očním podání je systémová expozice bimatoprostu velmi nízká a ani po čase nedochází ke kumulaci. Při podávání jedenkrát denně po jedné kapce 0,03 % bimatoprostu do obou očí po dobu dvou týdnů dosáhly koncentrace v krvi maximálních hodnot do 10 minut po podání a během 1,5 hodiny po aplikaci klesly pod nejnižší detekovatelnou hodnotu (0,025 ng/ml). Průměrné hodnoty Cmax a AUC 0-24hrs byly 7. a 14. den podobné. Průměrná hodnota Cmax byla přibližně 0,08 ng/ml a AUC 0-24hrs přibližně 0,09 ng^hod/ml, což ukazuje, že rovnovážného stavu bylo dosaženo během prvního týdne očního podávání.
Bimatoprost je se střední mírou distribuován do tělesných tkání a systémový distribuční objem byl v ustáleném stavu u člověka 0,67 l/kg. V lidské krvi je bimatoprost především v plazmě. Vazba bimatoprostu na plazmatické bílkoviny je přibližně 88 %.
Bimatoprost, který se po očním podání dostane do systémového oběhu, je z větší části nemetabolizovaný. Bimatoprost poté podléhá oxidaci, N-deetylaci a glukuronidaci a vytváří různé druhy metabolitů.
Bimatoprost je primárně eliminován ledvinami, až 67 % z intravenózní dávky podané zdravým dobrovolníkům bylo vyloučeno močí, 25 % z takto podané dávky bylo vyloučeno stolicí. Poločas eliminace určený po intravenózním podání byl přibližně 45 minut. Celková clearance krve byla
1,5 l/hod/kg.
Charakteristika u starších pacientů
U starších pacientů (65 let a starší) při dávkování bimatoprostu 0,3 mg/ml dvakrát denně byla průměrná hodnota AUC 0-24hod 0,0634 ng^hod/ml bimatoprostu, což je signifikantně více než 0,0218 ng^hod/ml u mladých zdravých dospělých osob. Nicméně, toto zjištění není klinicky relevantní, protože systémová expozice starších i mladších osob byla při očním podávání velmi nízká. Kumulace bimatoprostu v krvi v čase není známá a bezpečnostní profil pro starší i mladé pacienty byl podobný.
Timolol
Po očním podávání 0,5 % roztoku očních kapek lidem podrobujícím se operaci katarakty byla maximální koncentrace timololu v moku oční komory 898 ng/ml jednu hodinu po podání. Část dávky se vstřebává systémově, kde se rozsáhle metabolizuje v játrech. Poločas timololu v plazmě je cca 4 až
21
6 hodin. Timolol se částečně metabolizuje v játrech a timolol a jeho metabolity se vylučují ledvinami. Timolol se neváže ve velkém rozsahu na plazmu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Léčivý přípravek GANFORT
Studie oční toxicity po opakovaném podávání GANFORTu (vícedávkové balení) neprokázaly žádné zvláštní riziko u člověka. Profil oční a systémové bezpečnosti jednotlivých složek je již pevně stanovený.
Bimatoprost:
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity a hodnocení kancerogenního potenciálu neodhalily žádné zvláštní riziko pro člověka. Ve studiích na hlodavcích při systémových expozicích 33 až 97krát vyšších, než jakých je dosahováno u člověka po očním podání, se vyskytly druhově specifické aborty.
Oční podávání bimatoprostu opicím v koncentracích >0,03 % denně po dobu jednoho roku způsobilo zvýšení pigmentace duhovky a reverzibilní, na dávce závislé, periokulární účinky, charakterizované prominující horní a/nebo dolní rýhou a rozšířením palpebrální štěrbiny. Zdá se, že zvýšení pigmentace duhovky je způsobeno zvýšenou stimulací produkce melaninu v melanocytech, a ne zvýšením počtu melanocytů. Žádné funkční ani mikroskopické změny ve vztahu k periokulárním účinkům nebyly pozorovány a mechanizmus způsobující periokulární změny není znám.
Timolol:
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu a reprodukční toxicity neodhalily žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Chlorid sodný
Heptahydrát hydrogenfosforečnanu sodného Monohydrát kyseliny citronové
Kyselina chlorovodíková nebo hydroxid sodný (k úpravě pH)
Čištěná voda
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
Po otevření pouzdra použijte obsah do 7 dnů. Otevřený jednodávkový obal ihned po prvním použití zlikvidujte.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání. Uchovávejte jednodávkové obaly v pouzdře, aby byl léčivý přípravek chráněn před světlem a vlhkostí.
6.5 Druh obalu a obsah balení
Průhledné, jednodávkové LDPE obaly s víčkem k ukroucení Jeden jednodávkový obal obsahuje 0,4 ml roztoku.
Dostupné jsou následující velikosti balení: krabička obsahující 5, 30 nebo 90 jednodávkových obalů; jeden strip obsahuje 5 jednodávkových obalů zabalených v hliníkovém pouzdře. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Allergan Pharmaceuticals Ireland
Castlebar Road
Westport
Co. Mayo
Irsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/06/340/003 5 jednodávkových obalů EU/1/06/340/004 30 jednodávkových obalů EU/1/06/340/005 90 jednodávkových obalů
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 19. května 2006
Datum posledního prodloužení registrace: 23. června 2011
10. DATUM REVIZE TEXTU
<{MM/RRRR}>
< { DD/MM/RRRR} >
<{DD měsíc RRRR}>
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropská agentura pro léčivé přípravky http://www.ema.europa.eu
A. VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
VÝROBCE ODPOVĚDNÝ /VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
A.
Název a adresa výrobce odpovědného/výrobců odpovědných za propouštění šarží
Allergan Pharmaceuticals Ireland
Castlebar Road
Westport
Co. Mayo
Irsko
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ
POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
Neuplatňuje se.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GANFORT 0,3 mg/ml + 5 mg/ml oční kapky, roztok Bimatoprostum/timololum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden ml roztoku obsahuje bimatoprostum 0,3 mg a timololum 5 mg (jako timololi maleas 6,8 mg).
3. SEZNAM POMOCNÝCH LÁTEK
Benzalkonium-chlorid, heptahydrát hydrogenfosforečnanu sodného, monohydrát kyseliny citrónové, chlorid sodný, kyselina chlorovodíková nebo hydroxid sodný (k úpravě pH) a čištěná voda.
Další informace viz příbalová informace.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Oční kapky, roztok, 3 ml
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Oční podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Před použitím vyjměte kontaktní čočky.
8. POUŽITELNOST
EXP
Zlikvidujte za čtyři týdny po prvním otevření. Otevřeno:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Allergan Pharmaceuticals Ireland
Castlebar Road
Westport
Co. Mayo
Irsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/06/340/001
13. ČÍSLO ŠARŽE
c.s.
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
GANFORT
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GANFORT 0,3 mg/ml + 5 mg/ml oční kapky, roztok Bimatoprostum/timololum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden ml roztoku obsahuje bimatoprostum 0,3 mg a timololum 5 mg (jako timololi maleas 6,8 mg).
3. SEZNAM POMOCNÝCH LÁTEK
Benzalkonium-chlorid, heptahydrát hydrogenfosforečnanu sodného, monohydrát kyseliny citrónové, chlorid sodný, kyselina chlorovodíková nebo hydroxid sodný (k úpravě pH) a čištěná voda.
Další informace viz příbalová informace.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Oční kapky, roztok, 3 x 3 ml
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Oční podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Před použitím vyjměte kontaktní čočky.
8. POUŽITELNOST
EXP
Zlikvidujte za čtyři týdny po prvním otevření. Otevřeno (1)
Otevřeno (2)
Otevřeno (3)
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Allergan Pharmaceuticals Ireland
Castlebar Road
Westport
Co. Mayo
Irsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/06/340/002
13. ČÍSLO ŠARŽE
c.s.
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
GANFORT
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
GANFORT 0,3 mg/ml + 5 mg/ml oční kapky, roztok
Bimatoprostum/timololum
Oční podání
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
č.S.
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
3 ml
6. JINÉ
POUZDRO OBSAHUJÍCÍ PROUŽEK 5 JEDNODÁVKOVÝCH OBALŮ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GANFORT 0,3 mg/ml + 5 mg/ml oční kapky, roztok. Bimatoprostum/timololum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden ml roztoku obsahuje bimatoprostum 0,3 mg a timololum 5 mg (jako timololi maleas 6,8 mg).
3. SEZNAM POMOCNÝCH LÁTEK
Heptahydrát hydrogenfosforečnanu sodného, monohydrát kyseliny citrónové, chlorid sodný, kyselina chlorovodíková nebo hydroxid sodný (k úpravě pH) a čištěná voda.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Oční kapky, roztok 5 x 0,4 ml
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Oční podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
Po otevření pouzdra spotřebujte jednodávkové obaly do 7 dnů.
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte jednodávkové obaly v pouzdře, aby byl léčivý přípravek chráněn před světlem a vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Otevřené jednodávkové obaly ihned po použití zlikvidujte.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Allergan Pharmaceuticals Ireland Castlebar Road,
Westport,
Co. Mayo,
Irsko.
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/06/340/003-005
13. ČÍSLO ŠARŽE
č.S.
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
Pouze pro jednorázové použití
16. INFORMACE V BRAILLOVĚ PÍSMU
KRABIČKA NA POUZDRO OBSAHUJÍCÍ PROUŽEK 5 JEDNODÁVKOVÝCH OBALŮ
NÁZEV LÉČIVÉHO PŘÍPRAVKU
GANFORT 0,3 mg/ml + 5 mg/ml oční kapky, roztok bimatoprostum/timololum
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
Jeden ml roztoku obsahuje bimatoprostum 0,3 mg a timololum 5 mg (jako timololi maleas 6,8 mg).
3. SEZNAM POMOCNÝCH LÁTEK
Chlorid sodný, heptahydrát hydrogenfosforečnanu sodného, monohydrát kyseliny citrónové, kyselina chlorovodíková nebo hydroxid sodný (k udržení pH) a čištěná voda.
4. LÉKOVÁ FORMA A OBSAH
Oční kapky, roztok 5 x 0,4 ml
5. ZPŮSOB A CESTA PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Oční podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Otevřené jednodávkové obaly ihned po použití zlikvidujte.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Allergan Pharmaceuticals Ireland, Castlebar Road,
Westport,
Co. Mayo,
Ireland
12. REGISTRAČNÍ ČÍSLO(A)
EU/1/06/340/003
13. ČÍSLO ŠARŽE
c.s.
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku je vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
Pouze pro jednorázové použití
16. INFORMACE V BRAILLOVĚ PÍSMU
GANFORT jednodávkový
KRABIČKAOBSAHUJÍCÍ 30 JEDNODÁVKOVÝCH OBALŮ (DODANÝCH V 6
V V ř r r o
POUZDRECH, Z NICHŽ KAŽDÉ OBSAHUJE 5 JEDNODÁVKOVÝCH OBALŮ)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GANFORT 0,3 mg/ml + 5 mg/ml oční kapky, roztok Bimatoprostum/timololum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden ml roztoku obsahuje bimatoprostum 0,3 mg a timololum 5 mg (jako timololi maleas 6,8 mg).
3. SEZNAM POMOCNÝCH LÁTEK
Heptahydrát hydrogenfosforečnanu sodného, monohydrát kyseliny citrónové, chlorid sodný, kyselina chlorovodíková nebo hydroxid sodný (k úpravě pH) a čištěná voda.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Oční kapky, roztok 30 x 0,4 ml
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Oční podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Otevřené jednodávkové obaly ihned po použití zlikvidujte.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Allergan Pharmaceuticals Ireland, Castlebar Road,
Westport,
Co. Mayo,
Irsko.
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/06/340/004
13. ČÍSLO ŠARŽE
c.s.
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
Pouze pro jednorázové použití
16. INFORMACE V BRAILLOVĚ PÍSMU
GANFORT jednodávkový
KRABIČKA OBSAHUJÍCÍ 90 JEDNODÁVKOVÝCH OBALŮ (DODANÝCH V 18 POUZDRECH, Z NICHŽ KAŽDÉ OBSAHUJE 5 JEDNODÁVKOVÝCH OBALŮ)
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
GANFORT 0,3 mg/ml + 5 mg/ml oční kapky, roztok bimatoprostum/timololum
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
Jeden ml roztoku obsahuje bimatoprostu 0,3 mg a timololu 5 mg (jako timololi maleas 6,8 mg).
3. SEZNAM POMOCNÝCH LÁTEK
Chlorid sodný, heptahydrát hydrogenfosforečnanu sodného, monohydrát kyseliny citrónové, kyselina chlorovodíková nebo hydroxid sodný (k udržení pH) a čištěná voda.
4. LÉKOVÁ FORMA A OBSAH
Oční kapky, roztok 90 x 0,4 ml
5. ZPŮSOB A C ESTA PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Oční podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Otevřené jednodávkové obaly ihned po použití zlikvidujte.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Allergan Pharmaceuticals Ireland, Castlebar Road,
Westport,
Co. Mayo,
Ireland.
12. REGISTRAČNÍ ČÍSLO(A)
EU/1/06/340/005
13. ČÍSLO ŠARŽE
c.s.
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku je vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
Pouze pro jednorázové použití
16. INFORMACE V BRAILLOVĚ PÍSMU
GANFORT jednodávkový
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU JEDNODÁVKOVÝ OBAL
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
GANFORT
bimatoprost/timolol
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
č.š.
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
0,4 ml
6. JINÉ
GANFORT 0,3 mg/ml + 5 mg/ml oční kapky, roztok
Bimatoprostum/timololum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je GANFORT a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete GANFORT používat
3. Jak se GANFORT používá
4. Možné nežádoucí účinky
5 Jak GANFORT uchovávat
6. Obsah balení a další informace
1. Co je přípravek GANFORT a k čemu se používá
GANFORT obsahuje dvě různé léčivé látky (bimatoprost a timolol), jež obě snižují nitrooční tlak. Bimatoprost patří do skupiny léků zvaných prostamidy - analoga prostaglandinu. Timolol patří do skupiny léků zvaných betablokátory.
Vaše oko obsahuje průzračnou vodnatou tekutinu, která vyživuje vnitřní části oka. Tato tekutina je stále odváděna z oka a je nahrazována novou. Jestliže tekutina nemůže dostatečně rychle odtékat, zvyšuje se nitrooční tlak, který by vám nakonec mohl poškodit zrak (onemocnění zvané zelený zákal). GANFORT působí tím, že snižuje tvorbu tekutiny a zvyšuje množství odváděné tekutiny. Tímto způsobem je nitrooční tlak snižován.
Oční kapky GANFORT se používají k léčbě vysokého nitroočního tlaku u dospělých včetně starších pacientů. Tento vysoký tlak může vést k rozvoji zeleného zákalu. Váš lékař vám předepíše GANFORT, pokud jiné oční kapky obsahující betablokátory nebo analoga prostaglandinu sama o sobě dostatečně neúčinkovala.
2. Čemu musíte věnovat pozornost, než začnete GANFORT používat Nepoužívejte GANFORT oční kapky, roztok
- jestliže jste alergický(á) (přecitlivělý(á) na bimatoprost, timolol, betablokátory nebo na kteroukoli další složku GANFORTu (uvedenou v bodě 6),
- jestliže máte, nebo jste v minulosti měl(a) onemocnění dýchacích cest, jako astma nebo těžkou chronickou obstrukční plicní chorobu (těžkou plicní chorobu, která může
způsobovat sípání, potíže s dýcháním a/nebo dlouhodobý kašel),
- jestliže máte potíže se srdcem, jako je pomalý srdeční rytmus, zástava srdce, srdeční selhávání.
Upozornění a opatření
Před zahájením léčby tímto přípravkem informujte svého lékaře, jestliže máte nyní nebo jste měl(a) v minulosti
- ischemickou chorobu srdeční (mezi příznaky patří bolest nebo svírání na hrudi, dušnost nebo dušení), srdeční selhání, nízký krevní tlak
- poruchy srdečního rytmu, jako je pomalý srdeční rytmus
- poruchy s dýcháním, astma nebo chronickou obstrukční plicní chorobu
- onemocnění krevního oběhu (jako je Raynaudova choroba nebo Raynaudův syndrom)
- zvýšenou činnost štítné žlázy, neboť timolol může zamaskovat známky a příznaky onemocnění štítné žlázy
- cukrovku, neboť timolol může zamaskovat příznaky nízké hladiny cukru v krvi
- těžké alergické reakce
- potíže s játry nebo ledvinami
- problémy s povrchem oka
- oddělení jedné z vrstev oční bulvy po operaci ke snížení nitroočního tlaku
- známé rizikové faktory pro vznik makulárního edému (otok sítnice vedoucí k zhoršení vidění), např. operace katarakty (šedého zákalu)
Před podáním anestezie při chirurgickém výkonu informujte svého lékaře o tom, že používáte GANFORT, neboť timolol může ovlivnit účinky některých léčivých přípravků používaných během anestezie.
GANFORT může způsobit ztmavnutí řas, jejich růst, a také ztmavnutí kůže v okolí víček. Vaše duhovka může také časem ztmavnout. Tyto změny mohou být trvalé. Změna může být výraznější, pokud je léčeno pouze jedno oko. GANFORT může při kontaktu s kožním povrchem způsobovat růst ochlupení.
Děti a dospívající
GANFORT není určen pro děti a dospívající mladší 18 let.
Další léčivé přípravky a GANFORT
GANFORT a ostatní léčivé přípravky, které používáte, včetně jiných očních kapek k léčbě glaukomu, se mohou navzájem ovlivňovat. Prosím, informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat. Informujte svého lékaře, pokud používáte nebo chcete začít užívat přípravky snižující krevní tlak, léky na onemocnění srdce, přípravky na léčbu cukrovky, chinidin (používaný k léčbě onemocnění srdce a některých typů malárie) nebo přípravky na léčbu deprese, známé pod názvem fluoxetin nebo paroxetin.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat. Nepoužívejte GANFORT pokud jste těhotná, pokud to výslovně nedoporučí lékař.
Nepoužívejte GANFORT, pokud kojíte. Timolol se může dostat do Vašeho mateřského mléka. Poraďte se se svým lékařem dříve, než začnete během kojení užívat jakýkoliv lék.
Řízení dopravních prostředků a obsluha strojů
GANFORT může u některých pacientů způsobit rozostřené vidění. Dokud tyto příznaky nevymizí, neřiďte motorová vozidla ani neobsluhujte stroje.
GANFORT obsahuje benzalkonium-chlorid
GANFORT obsahuje konzervační látku nazývanou benzalkonium-chlorid. Benzalkonium-chlorid může způsobovat podráždění oka a je také známo, že mění barvu měkkých kontaktních čoček. Nepoužívejte kapky, dokud máte v očích kontaktní čočky. Po použití kapek vyčkejte alespoň 15 minut, než si čočky opět nasadíte.
Jak se GANFORT používá
3.
Vždy používejte GANFORT přesně podle pokynů svého lékaře nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Obvyklá dávka je jedna kapka denně, buď ráno, nebo večer do každého léčeného oka. Lék používejte každý den ve stejnou dobu.
Návod k použití
Lahvičku nesmíte použít, pokud je před prvním otevřením porušena bezpečnostní pečeť.


5.

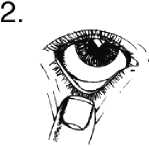
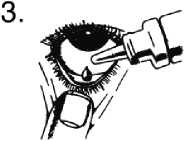
1. Umyjte si ruce. Zakloňte hlavu a podívejte se na strop.
2. Jemně stáhněte dolní víčko a vytvořte tak malou kapsu.
3. Otočte lahvičku dnem vzhůru a zmáčkněte, aby se uvolnila jedna kapka do každého léčeného oka.
4. Uvolněte dolní víčko a zavřete oko.
5. Oko nechte zavřené a prstem stiskněte koutek zavřeného oka (místo, kde je oko nejblíže nosu) a držte po dobu 2 minut. Tím se sníží pravděpodobnost, že GANFORT pronikne do celého Vašeho těla.
Jestliže kapka Vaše oko minula, opakujte postup znovu.
Abyste zabránil(a) přenosu infekce, neměl by se horní konec lahvičky při kapání dotknout oka nebo čehokoliv jiného. Ihned po použití zavřete lahvičku víčkem.
Pokud používáte GANFORT s dalšími očními přípravky, mezi vkápnutím GANFORTu a aplikací jiného přípravku dodržte odstup nejméně pěti minut. Pokud používáte jakoukoli oční mast nebo gel, použijte je až nakonec.
Jestliže jste použil(a) více GANFORTu, než jste měl(a)
Jestliže jste použil(a) více GANFORTu než jste měl(a), je nepravděpodobné, že si vážněji ublížíte. Další dávku si vkápněte v obvyklém čase. Jestliže máte obavy, poraďte se se svým lékařem nebo lékárníkem.
Jestliže jste zapomněl(a) použít GANFORT
Jestliže jste zapomněl(a) GANFORT použít, vkápněte si jednu kapku hned, jakmile si vzpomenete, a pak se vraťte ke svému pravidelnému dávkování. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) používat GANFORT
GANFORT se musí používat každý den, aby řádně působil.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
Možné nežádoucí účinky
4.
Podobně jako všechny léky může mít i GANFORT nežádoucí účinky, které se ale nemusí vyskytnout u každého. Pokud nejsou nežádoucí účinky závažné, lze obvykle v používání kapek pokračovat. Jestliže máte obavy, poraďte se s lékařem nebo lékárníkem. Bez porady se svým lékařem používání GANFORTu nepřerušujte.
U GANFORTu lze pozorovat následující nežádoucí účinky:
Velmi časté nežádoucí účinky
Mohou postihnout 1 z 10 pacientů
Postihující oko
zarudnutí.
Časté nežádoucí účinky
Mohou postihovat 1 až 9 pacientů ze 100 Postihující oko
pálení, svědění, bodání, citlivost na světlo, bolest oka, zalepené oči, suché oči, pocit cizího tělesa v oku, malé oděrky na povrchu oka se zánětem nebo bez něj, potíže se zrakovou ostrostí, zarudlá a svědící víčka, tmavší zbarvení víček, tmavší barva kůže v okolí očí, delší řasy, podráždění oka, slzení, otok víček, poruchy zraku.
Postihující jiné části těla
rýma, chloupky rostoucí kolem oka, závratě, bolesti hlavy.
Méně časté nežádoucí účinky
Mohou postihovat 1 až 9 pacientů z 1 000 Postihující oko
zánět duhovky, otok spojivky (průhledná vrstva oka), bolestivá víčka, unavené oči, zarůstající řasy, tmavší duhovka, pokleslý vzhled očí, odchlípnutí víčka od povrchu oka.
Postihující jiné části těla dušnost.
Nežádoucí účinky, kde četnost není známa
Postihující oko
cystoidní makulární edém (otok sítnice vedoucí k zhoršení vidění), otok oka, rozmazané vidění. Postihující jiné části těla
potíže s dýcháním (sípání), projevy alergické reakce (otok, zarudnutí oka a kožní vyrážka), změny ve vnímání chuti, zpomalení srdečního rytmu, potíže se spánkem, noční můry, astma, ztráta ochlupení, únava.
Další nežádoucí účinky byly pozorovány u pacientů užívajících oční kapky obsahující bimatoprost, a proto se mohou vyskytnout i u GANFORTu:
• Ztmavnutí řas, ztmavnutí duhovky, častější mrkání, krvácení do zadního segmentu oka (sítnicové krvácení), zánět oka
• Vysoký krevní tlak
• Slabost
• Zvýšení hodnot krevních testů, naznačuj ících j ak funguj í játra
Další nežádoucí účinky byly pozorovány u pacientů, kteří používali oční kapky obsahující timolol, a proto se mohou vyskytnout i u GANFORTu. Timolol je stejně jako ostatní místně podané oční léčivé přípravky absorbován do krve. To může způsobovat podobné nežádoucí účinky, jaké jsou pozorovány
u betablokátorů podaných „intravenózně“ (do žíly) a/nebo „perorálně“ (ústy). Pravděpodobnost výskytu nežádoucích účinků po podání očních kapek je nižší, než jsou-li léčivé přípravky podány například ústy nebo injekčně. Uvedené nežádoucí účinky zahrnují reakce, které byly popsány při použití skupiny betablokátorů k léčbě onemocnění oka:
• Závažné alergické reakce s otoky a dušností, které by mohly být život ohrožující
• Nízká hladina cukru v krvi
• Deprese, ztráta pamětiOmdlévání, mrtvice snížené prokrvení mozku, zhoršení myastenia gravis (zvýšená svalová ochablost), pocity brnění
• Snížená citlivost povrchu oka, zdvojené vidění, pokles očního víčka, oddělení jedné z vrstev oční bulvy po operaci ke snížení nitroočního tlaku, zánět povrchu oka
• Srdeční selhání, nepravidelný srdeční tep nebo zástava srdce, rychlý nebo pomalý srdeční tep, nadměrné hromadění tekutin v těle, především vody, bolest na hrudi Nízký krevní tlak, oteklé nebo studené ruce, nohy a končetiny způsobené zúžením krevních cév
• Kašel
• Průjem, bolest břicha, pocit na zvracení, zvracení, trávicí potíže, sucho v ústech
• Červená šupinatá místa na kůži, kožní vyrážka
• Bolesti svalů
• Snížený pohlavní pud, sexuální dysfunkce (porucha sexuálních funkcí)
Další nežádoucí účinky hlášené u očních kapek obsahujících fosfáty
Ve velmi vzácných případech došlo u některých pacientů se závažným poškozením průhledné vrstvy přední části oka (rohovky) ke vzniku zakalených vápenatých skvrn na rohovce, které vznikly v průběhu léčby.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V*. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak GANFORT uchovávat
Uchovávejte GANFORT mimo dohled a dosah dětí.
GANFORT nepoužívejte po uplynutí doby použitelnosti, uvedené na štítku lahvičky a na krabičce za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Po otevření se může roztok kontaminovat- znečistit, což může způsobit infekci oka. Proto po 4 týdnech od prvního otevření lahvičku zlikvidujte, i přesto, že v ní nějaký roztok ještě zůstal. Pro lepší zapamatování si zapište datum otevření na označené místo na krabičce.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí
6. Obsah balení a další informace Co GANFORT obsahuje
• Léčivými látkami jsou bimatoprostum 0,3 mg/ml a timololum 5 mg/ml, odpovídající timololi maleas 6,8 mg/ml.
• Dalšími složkami jsou benzalkonium-chlorid (konzervační látka), chlorid sodný, heptahydrát hydrogenfosforečnanu sodného, monohydrát kyseliny citronové a čištěná voda. Do roztoku mohou být přidaná malá množství kyseliny chlorovodíkové nebo hydroxidu sodného k úpravě hodnoty pH (kyselosti).
Jak GANFORT vypadá a co obsahuje toto balení
GANFORT je bezbarvý, čirý až nažloutlý roztok očních kapek v plastové lahvičce. Jedno balení obsahuje 1 nebo 3 plastové lahvičky se šroubovacím uzávěrem. Lahvičky jsou naplněny pouze z poloviny a obsahují každá 3 mililitry roztoku. To je dostačující množství pro používání na dobu 4 týdnů. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Allergan Pharmaceuticals Ireland
Castlebar Road
Westport
Co. Mayo
Irsko
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Island
Actavis ehf.
Sími: +354 550 3300
Italia
Allergan S.p.A Tel: +39 06 509 561
Latvija
Allergan Baltics UAB Tel: +371 27331152
Lietuva
Allergan Baltics UAB Tel: +370 62660247
Belgie/Belgique/Belgien/
Luxembourg/Luxemburg/Nederland
Allergan n.v.
Tél/Tel: +32 (0)2 351 24 24
Etarapna
AaepraH Etarapua EOOfl Tea.: +359 (0) 800 20 280
Česká republika
Allergan CZ s.r.o.
Tel: +420 800 188 818
Danmark/Norge/Suomi/Finland/Sverige
Allergan Norden AB Tlf/Puh/Tel: +46 (0)8 594 100 00
Polska
Allergan Sp.z o.o.
Tel.: +48 22 256 37 00
EXlába/Kónpoq
Allergan Hellas Pharmaceuticals S.A. TpT.: +30 210 74 73 300
France
Románia
Ireland/Malta/United Kingdom Slovenská republika
Allergan Ltd Allergan SK s.r.o.
Tel: +44 (0) 1628 494026 Tel: +421 800 221 223
Tato příbalová informace byla naposledy revidována <{MM/RRRR}> <{měsíc RRRR}
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropská agentura pro léčivé přípravky http://www.ema.europa.eu/.
Příbalová informace: informace pro pacienta
GANFORT 0,3 mg/ml + 5 mg/ml oční kapky, roztok, v jednodávkovém obalu
Bimatoprostum/timololum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí
ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je GANF ORT v j ednodávkovém obalu a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete GANFORT v jednodávkovém obalu používat
3. Jak se GANFORT v jednodávkovém obalu používá
4. Možné nežádoucí účinky
5 Jak GANFORT v jednodávkovém obalu uchovávat
6. Obsah balení a další informace
1. Co je přípravek GANFORT v jednodávkovém obalu a k čemu se používá
GANFORT v jednodávkovém obalu obsahuje dvě různé léčivé látky (bimatoprost a timolol), jež obě snižují nitrooční tlak. Bimatoprost patří do skupiny léků zvaných prostamidy - analoga prostaglandinu. Timolol patří do skupiny léků zvaných betablokátory.
Vaše oko obsahuje průzračnou vodnatou tekutinu, která vyživuje vnitřní části oka. Tato tekutina je stále odváděna z oka a je nahrazována novou. Jestliže tekutina nemůže dostatečně rychle odtékat, zvyšuje se nitrooční tlak, který by vám nakonec mohl poškodit zrak (onemocnění zvané zelený zákal). GANFORT v jednodávkovém obalu působí tím, že snižuje tvorbu tekutiny a zvyšuje množství odváděné tekutiny. Tímto způsobem je nitrooční tlak snižován.
Oční kapky GANFORT v jednodávkovém obalu se používají k léčbě vysokého nitroočního tlaku u dospělých včetně starších pacientů. Tento vysoký tlak může vést k rozvoji zeleného zákalu. Váš lékař vám předepíše GANFORT v jednodávkovém obalu, pokud jiné oční kapky obsahující betablokátory nebo analoga prostaglandinu sama o sobě dostatečně neúčinkovala.
Tento léčivý přípravek neobsahuje konzervační látky.
2. Čemu musíte věnovat pozornost, než začnete GANFORT v jednodávkovém obalu používat Nepoužívejte GANFORT oční kapky, roztok v jednodávkovém obalu
- jestliže jste alergický(á) (přecitlivělý(á)) na bimatoprost, timolol, betablokátory nebo na kteroukoli další složku GANFORTu v jednodávkovém obalu (uvedenou v bodě 6),
- jestliže máte, nebo jste v minulosti měl(a) onemocnění dýchacích cest, jako astma nebo těžkou chronickou obstrukční plicní chorobu (těžkou plicní chorobu, která může
způsobovat sípání, potíže s dýcháním a/nebo dlouhodobý kašel),
- jestliže máte potíže se srdcem, jako je pomalý srdeční rytmus, zástava srdce, srdeční selhávání.
Upozornění a opatření
Před zahájením léčby tímto přípravkem informujte svého lékaře, jestliže máte nyní nebo jste měl(a) v minulosti
- ischemickou chorobu srdeční (mezi příznaky patří bolest nebo svírání na hrudi, dušnost nebo dušení), srdeční selhání, nízký krevní tlak
- poruchy srdečního rytmu, jako je pomalý srdeční rytmus
- poruchy s dýcháním, astma nebo chronickou obstrukční plicní chorobu
- onemocnění krevního oběhu (jako je Raynaudova choroba nebo Raynaudův syndrom)
- zvýšenou činnost štítné žlázy, neboť timolol může zamaskovat známky a příznaky onemocnění štítné žlázy
- cukrovku, neboť timolol může zamaskovat příznaky nízké hladiny cukru v krvi
- těžké alergické reakce
- potíže s játry nebo ledvinami
- problémy s povrchem oka
- oddělení jedné z vrstev oční bulvy po operaci ke snížení nitroočního tlaku
- známé rizikové faktory pro vznik makulárního edému (otok sítnice vedoucí k zhoršení vidění), např. operace katarakty (šedého zákalu)
Před podáním anestezie při chirurgickém výkonu informujte svého lékaře o tom, že používáte GANFORT v jednodávkovém obalu, neboť timolol může ovlivnit účinky některých léčivých přípravků používaných během anestezie.
GANFORT v jednodávkovém obalu může způsobit ztmavnutí řas, jejich růst, a také ztmavnutí kůže v okolí víček. Vaše duhovka může také časem ztmavnout. Tyto změny mohou být trvalé. Změna může být výraznější, pokud je léčeno pouze jedno oko. GANFORT v jednodávkovém obalu může při kontaktu s povrchem pokožky způsobit růst ochlupení.
Děti a dospívající
GANFORT v jednodávkovém obalu není určen pro děti a dospívající mladší 18 let.
Další léčivé přípravky a GANFORT v jednodávkovém obalu
GANFORT v jednodávkovém obalu a ostatní léčivé přípravky, které používáte, včetně jiných očních kapek k léčbě glaukomu, se mohou navzájem ovlivňovat. Prosím, informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat. Informujte svého lékaře, pokud používáte nebo chcete začít užívat přípravky snižující krevní tlak, léky na onemocnění srdce, přípravky na léčbu cukrovky, chinidin (používaný k léčbě onemocnění srdce a některých typů malárie) nebo přípravky na léčbu deprese, známé pod názvem fluoxetin nebo paroxetin.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat. Nepoužívejte GANFORT v jednodávkovém obalu pokud jste těhotná, pokud to výslovně nedoporučí lékař.
Nepoužívejte GANFORT v jednodávkovém obalu, pokud kojíte. Timolol se může dostat do Vašeho mateřského mléka. Poraďte se se svým lékařem dříve, než začnete během kojení užívat jakýkoliv lék.
Řízení dopravních prostředků a obsluha strojů
GANFORT v jednodávkovém obalu může u některých pacientů způsobit rozostřené vidění. Dokud tyto příznaky nevymizí, neřiďte motorová vozidla ani neobsluhujte stroje.
Jak se GANFORT v jednodávkovém obalu používá
3.
Vždy používejte GANFORT v jednodávkovém obalu přesně podle pokynů svého lékaře nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Obvyklá dávka je jedna kapka denně, buď ráno, nebo večer do každého léčeného oka. Lék používejte každý den ve stejnou dobu.
Návod k použití
Před použitím si umyjte ruce. Před použitím se ujistěte, že je jednodávková nádobka neporušená. Roztok je zapotřebí použít bezprostředně po otevření. Aby nedošlo ke kontaminaci, zabraňte tomu, aby se otevřená část jednodávkové nádobky dotkla oka nebo čehokoli jiného.
2. Jednodávkový obal držte svisle (uzávěrem směrem nahoru) a uzávěr kroucením odstraňte.
3. Jemně stáhněte dolní víčko a vytvořte tak malou kapsu. Otočte jednodávkový obal dnem vzhůru a zmáčkněte, aby se uvolnila jedna kapka do postiženého oka (očí).
4. Se zavřenýma očima přitiskněte prst do koutku zavřeného oka (na místě, kde oko sousedí
s nosem) a 2 minuty podržte. Zabráníte tím tomu, aby se GANFORT v jednodávkovém obalu dostal do zbytku těla.
5. Po použití jednodávkový obal zlikvidujte, i přesto, že v něm zbyl nějaký roztok.
Jestliže kapka Vaše oko minula, opakujte postup znovu. Otřete veškerý přebytečný roztok, který steče po tváři.
Pokud nosíte kontaktní čočky, před aplikací tohoto léčivého přípravku je vyjměte. Po aplikaci kapek a před opětovným nasazením kontaktních čoček vyčkejte 15 minut.
Pokud používáte GANFORT v jednodávkovém obalu s dalšími očními přípravky, mezi vkápnutím GANFORTu v jednodávkovém obalu a aplikací jiného přípravku dodržte odstup nejméně pěti minut. Pokud používáte jakoukoli oční mast nebo gel, použijte je až nakonec.
Jestliže jste použil(a) více GANFORTu v jednodávkovém obalu, než jste měl(a)
Jestliže jste použil(a) více GANFORTu v jednodávkovém obalu, než jste měl(a), je nepravděpodobné, že si vážněji ublížíte. Další dávku si vkápněte v obvyklém čase. Jestliže máte obavy, poraďte se se svým lékařem nebo lékárníkem.
Jestliže jste zapomněl(a) použít GANFORT v jednodávkovém obalu
Jestliže jste zapomněl(a) GANFORT v jednodávkovém obalu použít, vkápněte si jednu kapku hned, jakmile si vzpomenete, a pak se vraťte ke svému pravidelnému dávkování. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) používat GANFORT v jednodávkovém obalu
GANFORT se musí používat každý den, aby řádně působil.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
Možné nežádoucí účinky
4.
Podobně jako všechny léky může mít i GANFORT v jednodávkovém obalu nežádoucí účinky, které se ale nemusí vyskytnout u každého. Pokud nejsou nežádoucí účinky závažné, lze obvykle v používání kapek pokračovat. Jestliže máte obavy, poraďte se s lékařem nebo lékárníkem. Bez porady se svým lékařem používání GANFORTu v jednodávkovém obalu nepřerušujte.
U GANFORTu v jednodávkovém obalu lze pozorovat následující nežádoucí účinky:
Velmi časté nežádoucí účinky
Mohou postihovat více než 1 z 10 pacientů Postihující oko Zarudnutí oka
Časté nežádoucí účinky
Mohou postihovat 1 až 9 pacientů ze 100 Postihující oko
malé prasklinky na povrchu oka se zánětem, podráždění oka, podráždění spojivek (průhledné vrstvy oka), svědění očí, bolest očí, pocit cizího tělesa v oku, suché oči, slzení očí, zčervenání očních víček, citlivost na světlo, delší řasy
Postihující jiné části těla
bolest hlavy, tmavší zbarvení kůže v okolí oka.
Méně časté nežádoucí účinky
Mohou postihovat 1 až 9 pacientů z 1 000 Postihující oko
abnormální pocit v oku, svědění očních víček, otoky očních víček, únava očí, ztmavnutí řas
Postihující jiné části těla únava.
Nežádoucí účinky, u nichž četnost není známa
Postihující oko otok oka
Postihující jiné části těla
zpomalení srdečního rytmu, projevy alergické reakce (otok, zarudnutí oka a kožní vyrážka), astma, dušnost.
U pacientů užívajících GANFORT (vícedávkové balení) byly pozorovány další nežádoucí účinky, které se tedy mohou objevit i u pacientů používajících GANFORT v jednodávkovém obalu:
Závratě, malé prasklinky na povrchu oka, zalepené oči, zhoršení zraku, zánět duhovky, otok spojivek (průhledná vrstva oka), zánět očních víček, bolest očních víček, snížená schopnost vidění, zarůstání řas, ztmavnutí duhovky, zapadlé oči, odchlípnutí víčka od povrchu oka, cystoidní makulární edém (otok sítnice v oku vedoucí ke zhoršení zraku), rozostřené vidění, rýma, dušnost, potíže s dýcháním / sípání, růst chloupků kolem oka, potíže se spánkem, noční můry, vypadávání vlasů, změny chuti.
Další nežádoucí účinky byly pozorovány u pacientů užívajících oční kapky obsahující bimatoprost, a proto se mohou vyskytnout i u GANFORTu v jednodávkovém obalu:
Škubání víčka, krvácení do zadního segmentu oka (sítnicové krvácení), zánět oka
Vysoký krevní tlak
Slabost
Pocit na zvracení
Zvýšení hodnot krevních testů, naznačujících jak fungují játra
53
Další nežádoucí účinky byly pozorovány u pacientů, kteří používali oční kapky obsahující timolol, a proto se mohou vyskytnout i u GANFORTu v jednodávkovém obalu. Timolol je stejně jako ostatní místně podané oční léčivé přípravky absorbován do krve. To může způsobovat podobné nežádoucí účinky, jaké jsou pozorovány u betablokátorů podaných „intravenózně“ (do žíly) a/nebo „perorálně“ (ústy). Pravděpodobnost výskytu nežádoucích účinků po podání očních kapek je nižší, než jsou-li léčivé přípravky podány například ústy nebo injekčně. Uvedené nežádoucí účinky zahrnují reakce, které byly popsány při použití skupiny betablokátorů k léčbě onemocnění oka:
• Závažné alergické reakce s otoky a dušností, které by mohly být život ohrožující
• Nízká hladina cukru v krvi
• Deprese; ztráta paměti
• Omdlévání; mrtvice; snížené prokrvení mozku; zhoršení myastenia gravis (zvýšená svalová ochablost), pocity brnění; závratě
• Snížená citlivost povrchu oka, zdvojené vidění, pokles očního víčka, oddělení jedné z vrstev oční bulvy po operaci ke snížení nitroočního tlaku, zánět povrchu oka"
• Srdeční selhání; nepravidelný srdeční tep nebo zástava srdce, rychlý nebo pomalý srdeční tep, nadměrné hromadění tekutin v těle, především vody, bolest na hrudi
• Nízký krevní tlak, oteklé nebo studené ruce, nohy a končetiny, způsobené zúžením cév
• Kašel
• Průjem, bolest břicha, pocit na zvracení, zvracení, trávicí potíže, sucho v ústech
• Červená šupinatá místa na kůži, kožní vyrážka
• Bolesti svalů
• Snížený pohlavní pud, sexuální dysfunkce
• Slabost
Další nežádoucí účinky hlášené u očních kapek obsahujících fosfáty
Ve velmi vzácných případech došlo u některých pacientů se závažným poškozením průhledné vrsty přední části oka (rohovky) ke vzniku zakalených vápenatých skvrn na rohovce, které vznikly v průběhu léčby.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V*. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak GANFORT v jednodávkovém obalu uchovávat
Uchovávejte GANFORT v jednodávkovém obalu mimo dohled a dosah dětí.
Nepoužívejte GANFORT v jednodávkovém obalu po uplynutí doby použitelnosti, uvedené na štítku jednodávkového obalu a na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Tento lék je určen pouze k jednorázovému použití a neobsahuje konzervační látky. Nepoužitý roztok neuchovávejte.
Tento léčivý přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání. Uchovávejte jednodávkové obaly v pouzdře, aby byl léčivý přípravek chráněn před světlem a vlhkostí. Po otevření pouzdra použijte obsah do 7 dnů.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí
6. Obsah balení a další informace Co GANFORT v jednodávkovém obalu obsahuje
• Léčivými látkami jsou bimatoprostum 0,3 mg/ml a timololum 5 mg/ml, odpovídající timololi maleas 6,8 mg/ml.
• Dalšími složkami jsou chlorid sodný, heptahydrát hydrogenfosforečnanu sodného, monohydrát kyseliny citronové a čištěná voda. Do roztoku mohou být přidaná malá množství kyseliny chlorovodíkové nebo hydroxidu sodného k úpravě hodnoty pH (kyselosti).
Jak GANFORT v jednodávkovém obalu vypadá a co obsahuje toto balení
GANFORT v jednodávkovém obalu je bezbarvý až lehce nažloutlý roztok dodávaný v plastových jednodávkových obalech, z nichž každý obsahuje 0,4 ml roztoku.
Balení obsahují 1, 6 nebo 18 fóliových pouzder, z nichž každé obsahuje 5 jednodávkových obalů, což je celkem 5, 30 nebo 90 jednodávkových obalů.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Allergan Pharmaceuticals Ireland,
Castlebar Road,
Westport,
Co. Mayo,
Irsko.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Island
Actavis ehf.
Sími: +354 550 3300
Italia
Allergan S.p.A Tel: +39 06 509 561
Latvija
Allergan Baltics UAB Tel: +371 27331152
Lietuva
Allergan Baltics UAB Tel: +370 62660247
Belgie/Belgique/Belgien/
Luxembourg/Luxemburg/Nederland
Allergan n.v.
Tél/Tel: +32 (0)2 351 24 24
Eunrapnu
AnepraH Etnrapna EOOfl Ten.: +359 (0) 800 20 280
Česká republika
Allergan CZ s.r.o.
Tel: +420 800 188 818
Danmark/Norge/Suomi/Finland/Sverige
Allergan Norden AB Tlf/Puh/Tel: +46 (0)8 594 100 00
|
Eesti Allergan Baltics UAB Tel: + 372 56955144 |
Osterreich Pharm-Allergan GmbH Tel: +43 1 99460 6355 |
|
EXláSa/Kúrcpoq Allergan Hellas Pharmaceuticals S.A. TpA.: +30 210 74 73 300 |
Polska Allergan Sp.z o.o. Tel.: +48 22 256 37 00 |
|
Espaňa Allergan S.A Tel: +34 91 807 6130 |
Portugal Profarin Lda. Tel: +351 21 425 3242 |
|
France Allergan France SAS Tél: +33 (0)1 49 07 83 00 |
Románia Allergan S.R.L. Tel: +40 21 301 53 02 |
|
Hrvatska Ewopharma d.o.o. Tel: +385 1 6646 563 |
Slovenija Ewopharma d.o.o. Tel: +386 (0) 590 848 40 |
|
Ireland/Malta/United Kingdom Allergan Ltd Tel: +44 (0) 1628 494026 |
Slovenská republika Allergan SK s.r.o. Tel: +421 800 221 223 |
Tato příbalová informace byla naposledy revidována <{MM/RRRR}> <{měsíc RRRR}
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropská agentura pro léčivé přípravky http://www.ema.europa.eu/.
PŘÍLOHA IV
VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZMĚNY V REGISTRACI
S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/ aktualizovaných zpráv o bezpečnosti (PSUR) bimatoprostu/timololu dospěl výbor CHMP k těmto vědeckým závěrům:
V současné pravidelně aktualizované zprávě o bezpečnosti velký počet případů zahrnuje místní podráždění oční tkáně v bezprostředním okolí, angioedém, urtikarii, ekzém a alergickou dermatitidu. Navíc některé případy zahrnovaly pozitivní rechallenge a dechallenge. Bere se na vědomí, že hypersenzitivita je uvedena jako nežádoucí reakce v informacích o přípravku u timololu. Proto farmakovigilanční výbor souhlasil s přidáním „hypersenzitivní reakce včetně známek a příznaků alergické dermatitidy, angioedému, oční alergie“ do bodu 4.8 jak pro přípravek Ganfort, tak Ganfort PF.
Současná pravidelně aktualizovaná zpráva o bezpečnosti hodnotila 14 případů nočních můr, které zahrnovaly jak případy pozitivní dechallenge, tak pozitivní rechallenge. Bylo hodnoceno 14 případů insomnie, které rovněž zahrnovaly pozitivní dechallenge. Noční můry a insomnie jsou uvedeny jako nežádoucí účinky v informacích o přípravku timolol. Z tohoto důvodu farmakovigilanční výbor souhlasil s tím, že do bodu 4.8 přípravku Ganfort mají být přidány „noční můry a insomnie“.
Dysgeuzie byla hodnocena v rámci kontroly 12 případů (jeden závažný případ a 11 nezávažných).
V hodnocených případech byl hlášen blízký časový vztah společně s možným způsobem účinku, což podporuje kauzální vztah mezi přípravkem Ganfort a dysgeuzií. Z tohoto důvodu farmakovigilanční výbor souhlasí s tím, že do bodu 4.8 přípravku Ganfort bude zařazena „dysgeuzie“.
Při kontrole 30 případů byl hodnocen otok oka. Byla hlášena úzká časová souvislost a také pozitivní dechallenge, což podporuje kauzální vztah mezi přípravkem Ganfort / Ganfort PF a otokem oka.
Z tohoto důvodu farmakovigilanční výbor souhlasí s tím, aby byl do bodu 4.8 pro Ganfort a Ganfort PF zařazen „otok oka“.
Kontrola 46 případů s rozmazaným viděním, z nichž u některých byla pozorována přímá časová souvislost a pozitivní dechallenge, podporuje kauzální vztah mezi přípravkem Ganfort a rozmazaným viděním. Současně je rozmazaené vidění uvedeno jako další nežádoucí účinek spojený s timololovou složkou v přípravku Ganfort v dokumentu Company Core Data Sheet. Z tohoto důvodu farmakovigilanční výbor souhlasí s tím, aby bylo do bodu 4.8 pro Ganfort přidáno „rozmazané vidění“.
Bradykardie byla hodnocena jako potenciální bezpečnostní signál a bylo zkontrolováno 15 případů. Ty ukázaly úzký časový vztah a pozitivní rechallenge a dechallenge, což podporuje kauzální vztah mezi přípravkem Ganfort / Ganfort PF a bradykardií. Bradykardie je také dobře známým farmakologickým účinkem léčby systemickými betablokátory. Z tohoto důvodu farmakovigilanční výbor souhlasí s tím, aby byla do bodu 4.8 pro Ganfort přidána „bradykardie“.
Alopecie byla hodnocena jako potenciální bezpečnostní signál s 23 případy, které zahrnovaly úzký časový vztah a pozitivní dechallenge a rechallenge, což podporuje kauzální vztah mezi přípravkem Ganfort a alopecií. Z tohoto důvodu farmakovigilanční výbor souhlasí s tím, aby byla do bodu 4.8 pro Ganfort přidána „Alopecie“.
V bezpečnostním hodnocení 26 případů únavy byl hlášen úzký časový vztah a pozitivní dechallenge a rechallenge, což podporuje kauzální vztah mezi přípravkem Ganfort a únavou. Proto farmakovigilanční výbor souhlasí s tím, aby byla do bodu 4.8 pro Ganfort přidána „únava“.
Astma je v současné době uvedeno jako nežádoucí účinek v informacích o přípravku timolol. Případy astmatu a případy související s astmatem byly hodnoceny na současném farmakovigilančním výboru. Hodnocení ukázalo úzký časový vztah a pozitivní rechallenge a dechallenge, což podporuje kauzální
vztah mezi přípravkem Ganfort PF a astmatem, jakož i dalšími s astmatem spojenými projevy, jako jsou dyspnoe a sípání. Z tohoto důvodu farmakovigilanční výbor souhlasí s tím, aby byly přidány do bodu 4.8 pro Ganfort a Ganfort PF ..astma" a do bodu 4.8 pro Ganfort PF ..dDvspnoc".
Proto, s ohledem na údaje předložené v kontrolované periodicky opakované zprávě o bezpečnosti, farmakovigilanční výbor rozhodl o nutnosti změnit informace o léčivých přípravcích obsahujících bimatoprost / timolol.
Výbor CHMP souhlasí s vědeckými závěry výboru PRAC.
Zdůvodnění změny v registraci
Na základě vědeckých závěrů týkajících se bimatoprostu/timololu výbor CHMP zastává stanovisko, že poměr přínosů a rizik léčivého přípravku obsahujícího/léčivých přípravků obsahujících bimatoprost/timolol zůstává nezměněný, a to pod podmínkou, že v informacích o přípravku budou provedeny navrhované změny.
Výbor CHMP doporučuje změnu v registraci.
59