Fycompa 8 Mg
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Fycompa 2 mg potahované tablety Fycompa 4 mg potahované tablety Fycompa 6 mg potahované tablety Fycompa 8 mg potahované tablety Fycompa 10 mg potahované tablety Fycompa 12 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Fycompa 2 mg potahované tablety
Jedna potahovaná tableta obsahuje perampanelum 2 mg.
Pomocná látka se známým účinkem: Jedna 2mg tableta obsahuje lactosum monohydricum 78,5 mg. Úplný seznam pomocných látek viz bod 6.1.
Fycompa 4 mg potahované tablety
Jedna potahovaná tableta obsahuje perampanelum 4 mg.
Pomocná látka se známým účinkem: Jedna 4mg tableta obsahuje lactosum monohydricum 157,0 mg. Úplný seznam pomocných látek viz bod 6.1.
Fycompa 6 mg potahované tablety
Jedna potahovaná tableta obsahuje perampanelum 6 mg.
Pomocná látka se známým účinkem: Jedna 6mg tableta obsahuje lactosum monohydricum 151,0 mg. Úplný seznam pomocných látek viz bod 6.1.
Fycompa 8 mg potahované tablety
Jedna potahovaná tableta obsahuje perampanelum 8 mg.
Pomocná látka se známým účinkem: Jedna 8mg tableta obsahuje lactosum monohydricum 149,0 mg. Úplný seznam pomocných látek viz bod 6.1.
Fycompa 10 mg potahované tablety
Jedna potahovaná tableta obsahuje perampanelum 10 mg.
Pomocná látka se známým účinkem: Jedna 10mg tableta obsahuje lactosum monohydricum 147,0 mg. Úplný seznam pomocných látek viz bod 6.1.
Fycompa 12 mg potahované tablety
Jedna potahovaná tableta obsahuje perampanelum 12 mg.
Pomocná látka se známým účinkem: Jedna 12mg tableta obsahuje lactosum monohydricum 145,0 mg. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta (tableta)
Fycompa 2 mg potahované tablety
Oranžová, kulatá, bikonvexní tableta s vyrytým označením E275 na jedné straně a číslem 2 na druhé straně
Fycompa 4 mg potahované tablety
Červená, kulatá, bikonvexní tableta s vyrytým označením E277 na jedné straně a číslem 4 na druhé straně
Fycompa 6 mg potahované tablety
Růžová, kulatá, bikonvexní tableta s vyrytým označením E294 na jedné straně a číslem 6 na druhé straně
Fycompa 8 mg potahované tablety
Nachová, kulatá, bikonvexní tableta s vyrytým označením E295 na jedné straně a číslem 8 na druhé straně
Fycompa 10 mg potahované tablety
Zelená, kulatá, bikonvexní tableta s vyrytým označením E296 na jedné straně a číslem 10 na druhé straně
Fycompa 12 mg potahované tablety
Modrá, kulatá, bikonvexní tableta s vyrytým označením E297 na jedné straně a číslem 12 na druhé straně
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Fycompa je indikován k přídatné léčbě parciálních záchvatů s nebo bez sekundární generalizace u dospělých a dospívajících pacientů ve věku od 12 let s epilepsií.
Přípravek Fycompa je indikován k přídatné léčbě primárně generalizovaných tonicko-klonických záchvatů u dospělých a dospívajících pacientů ve věku od 12 let s idiopatickou generalizovanou epilepsií (viz bod 5.1).
4.2 Dávkování a způsob podání
Dávkování
Dospělí a dospívající
Přípravek Fycompa musí být titrován podle individuální odpovědi pacienta, aby bylo možné optimalizovat poměr mezi účinností a snášenlivostí.
Perampanel se užívá perorálně jednou denně večer před spaním.
Parciální záchvaty
Při dávkách 4 mg/den až 12 mg/den se perampanel ukázal jako účinný při léčbě parciálních záchvatů. Léčba přípravkem Fycompa má být zahájena dávkou 2 mg/den. Dávku je možné zvýšit na základě klinické odpovědi a snášenlivosti, a to o 2 mg (buď jednou týdně nebo jednou za dva týdny dle uvážení poločasu uvedeného níže) na udržovací dávku 4 mg/den až 8 mg/den. V závislosti na individuální klinické odpovědi a snášenlivosti při dávce 8 mg/den může být dávka postupně zvyšována vždy o 2 mg/den až na 12 mg/den. U pacientů, kteří souběžně užívají léčivé přípravky, které nezkracují poločas perampanelu (viz bod 4.5), nemá být titrace prováděna častěji než v 2týdenních intervalech. U pacientů, kteří souběžně užívají léčivé přípravky, které zkracují poločas perampanelu (viz bod 4.5), nemá být titrace prováděna častěji než v týdenních intervalech.
Primárně generalizované tonicko-klonické záchvaty
Při dávkách až 8 mg/den se perampanel ukázal jako účinný při léčbě primárně generalizovaných tonicko-klonických záchvatů.
Léčba přípravkem Fycompa má být zahájena dávkou 2 mg/den. Dávku je možné zvýšit na základě klinické odpovědi a snášenlivosti, a to o 2 mg (buď jednou týdně nebo jednou za dva týdny dle uvážení poločasu uvedeného níže) na udržovací dávku až 8 mg/den. V závislosti na individuální klinické odpovědi a snášenlivosti při dávce 8 mg/den může být dávka zvyšována až na 12 mg/den, která může být u některých pacientů účinná (viz bod 4.4). U pacientů, kteří souběžně užívají léčivé přípravky, které nezkracují poločas perampanelu (viz bod 4.5), nemá být titrace prováděna častěji než v 2týdenních intervalech. U pacientů, kteří souběžně užívají léčivé přípravky, které zkracují poločas perampanelu (viz bod 4.5), nemá být titrace prováděna častěji než v týdenních intervalech.
Vysazení
Doporučuje se léčbu ukončovat postupně, aby se minimalizovalo potenciální riziko tzv. „rebound“ záchvatů. Avšak vzhledem k dlouhému poločasu a následnému pomalému poklesu plazmatických koncentrací je možné podávání perampanelu náhle ukončit, pokud je to nezbytně nutné.
Vynechané dávky
Jedna vynechaná dávka: Jelikož má perampanel dlouhý poločas, měl by pacient počkat a užít následující dávku podle dávkovacího intervalu.
Při vynechání více než 1 dávky v souvislém období kratším než 5 poločasů (3 týdny u pacientů neužívajících antiepileptika indukující metabolismus perampanelu, 1 týden u pacientů užívajících antiepileptika indukující metabolismus perampanelu (viz bod 4.5)), je nutné zvážit nové zahájení léčby od hladiny poslední podané dávky.
Pokud pacient přestal užívat perampanel na souvislou dobu delší než 5 poločasů, doporučuje se postupovat podle výše uvedených doporučení pro úvodní dávku.
Starší pacienti (od 65 let)
Klinické studie s přípravkem Fycompa u pacientů s epilepsií nezahrnovaly dostatečný počet pacientů ve věku od 65 let, aby bylo možné určit, zda se jejich odpověď liší od mladších pacientů. Analýza bezpečnostních informací u 905 starších pacientů léčených perampanelem (ve dvojitě zaslepených studiích provedených v neepileptických indikacích) nevykázala žádné rozdíly v bezpečnostním profilu v souvislosti s věkem. Tyto výsledky, v kombinaci s neprokázanými rozdíly při užívání perampanelu souvisejícími s věkem, naznačují, že úprava dávkování u starších pacientů není nutná. Perampanel je nutné u starších pacientů používat s opatrností s ohledem na možnost lékové interakce u pacientů s polymedikací (viz bod 4.4).
Porucha funkce ledvin
U pacientů s lehkou poruchou funkce ledvin není nutná žádná úprava dávky. Užívání perampanelu u pacientů se středně těžkou nebo těžkou poruchou funkce ledvin nebo u pacientů na hemodialýze se nedoporučuje.
Porucha funkce jater
Zvyšování dávek u pacientů s lehkou a středně těžkou poruchou funkce jater musí být založeno na klinické odpovědi a snášenlivosti. U pacientů s lehkou nebo středně těžkou poruchou funkce jater je možné zahájit podávání dávkou 2 mg. Zvyšování dávky u pacientů je možné provádět po 2 mg, ne častěji než jednou za 2 týdny, v závislosti na snášenlivosti a účinnosti.
Dávka perampanelu u pacientů s lehkou a středně těžkou poruchou by neměla překročit 8 mg.
Použití u pacientů s těžkou poruchou funkce jater se nedoporučuje.
Pediatrická populace
Bezpečnost a účinnost perampanelu u dětí ve věku do 12 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Přípravek Fycompa by se měl podávat v jedné perorální dávce před spaním. Může se užívat s jídlem i bez jídla (viz bod 5.2). Tabletu je nutné polknout celou a zapít sklenicí vody. Tableta se nesmí kousat, drtit ani dělit. Tablety nelze přesně rozdělit, neboť nemají půlicí rýhu.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Sebevražedné představy
Během léčby antiepileptiky v různých indikacích byly u některých pacientů hlášeny případy sebevražedných představ a chování. Metaanalýza randomizovaných placebem kontrolovaných studií antiepileptik rovněž prokázala mírně zvýšené riziko sebevražedných představ a chování.
Mechanismus tohoto rizika není znám a dostupné údaje nevylučují možnost zvýšeného rizika u perampanelu.
Proto by u pacientů měly být sledovány příznaky sebevražedných představ a chování a zvážena vhodná léčba. Pacienti (a osoby poskytující pacientům péči) by měli být upozorněni na to, že v případě výskytu sebevražedných představ či chování by měli vyhledat lékařskou pomoc.
Poruchy nervového systému
Perampanel může způsobovat závratě a spavost a může tedy mít vliv na schopnost řídit a obsluhovat stroje (viz bod 4.7).
Perorální antikoncepce
Při dávkách 12 mg/den může přípravek Fycompa snižovat účinnost antikoncepce s obsahem progestačního hormonu. V takovém případě se při používání přípravku Fycompa doporučuje používat jinou, nehormonální formu antikoncepce (viz bod 4.5).
Pády
Při používání přípravku bylo zaznamenáno zvýšené riziko pádů, především u starších pacientů; základní příčina není známa.
U pacientů léčených perampanelem bylo hlášeno agresivní a nepřátelské chování. U pacientů léčených perampanelem v klinických studiích byly agresivita, zlost a podrážděnost hlášeny častěji při vyšších dávkách. Většina hlášených příhod byla buď mírná, nebo středně závažná a pacienti se zotavili buď spontánně, nebo po úpravě dávky. U některých pacientů (< 1 % v klinických studiích s perampanelem) však byly zaznamenány myšlenky na ohrožení jiných, fyzické útoky nebo výhružné chování. Pacientům a pečovatelům je nutné sdělit, že mají okamžitě upozornit zdravotnického pracovníka, pokud si všimnou významných změn nálady nebo vzorců chování. Jestliže se takové příznaky objeví, je nutné dávku perampanelu snížit, a pokud jsou příznaky závažné, je nutné ho okamžitě vysadit.
Možnost zneužití
Opatrnosti je zapotřebí u pacientů se zneužíváním látek v anamnéze a u těchto pacientů je nutné sledovat potenciální příznaky zneužívání perampanelu.
Souběžné podávání s antiepileptiky indukujícími CYP3A
Míra odpovědí po přidání perampanelu ve stálých dávkách byla nižší v případech, kdy pacienti souběžně užívali antiepileptika indukující enzym CYP3A (karbamazepin, fenytoin, oxkarbazepin), v porovnání s mírou odpovědí u pacientů souběžně užívajících antiepileptika, která enzym neindukují. Pokud pacient přechází ze souběžně užívaných antiepileptik neindukujících enzym na léčivé přípravky indukující enzym nebo naopak, je nutné sledovat jeho klinickou odpověď. V závislosti na individuální klinické odpovědi a snášenlivosti je možné dávku zvyšovat nebo snižovat vždy po 2 mg (viz bod 4.2).
Jiné souběžně podávané léčivé přípravky (mimo antiepileptika) indukující nebo inhibující cytochrom P450
Při přidávání nebo odebírání induktorů nebo inhibitorů cytochrom P450 je nutné u pacientů pečlivě sledovat jejich snášenlivost a klinickou odpověď, neboť může dojít k poklesu nebo zvýšení plazmatických hladin perampanelu. Může být nutná adekvátní úprava dávky perampanelu.
Přípravek Fycompa obsahuje laktózu, a proto by pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným nedostatkem laktázy nebo malabsorpcí glukózy a galaktózy tento přípravek neměli užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Přípravek Fycompa není považován za silný induktor nebo inhibitor cytochromu P450 nebo UGT enzymů (viz bod 5.2).
Perorální antikoncepce
U zdravých žen, kterým byly podávány dávky 12 mg (ale nikoliv 4 nebo 8 mg/den) po dobu 21 dní souběžně s kombinovanými perorálními kontraceptivy, se ukázalo, že přípravek Fycompa snižuje expozici levonorgestrelu (střední hodnoty Cmax a AUC se snížily shodně o 40 %). Hodnota AUC ethinylestradiolu nebyla přípravkem Fycompa v dávce 12 mg ovlivněna, kdežto hodnota Cmax se snížila o 18 %. Proto je nutné u žen vyžadujících přípravek Fycompa v dávce 12 mg/den vzít v úvahu možnost snížené účinnosti perorální antikoncepce s obsahem progestačního hormonu a používat i jinou spolehlivou metodu antikoncepce (nitroděložní tělísko, kondom) (viz bod 4.4).
Interakce přípravku Fycompa s jinými antiepileptiky
Potenciální interakce přípravku Fycompa (v dávce do 12 mg jednou denně) a jiných antiepileptik byly
posuzovány v klinických studiích a hodnoceny v populační farmakokinetické analýze ve čtyřech sdružených studiích fáze 3 zahrnujících pacienty s parciálními záchvaty a primárně generalizovanými tonicko-klonickými záchvaty. Vliv těchto interakcí na průměrnou koncentraci v ustáleném stavu je shrnut v následující tabulce.
|
O 1 vv v Souběžně podávané antiepileptikum |
Vliv antiepileptika na koncentraci přípravku Fycompa |
Vliv přípravku Fycompa na koncentraci antiepileptika |
|
Karbamazepin |
2,75násobný pokles |
<10% pokles |
|
Klobazam |
Žádný vliv |
<10% pokles |
|
Klonazepam |
Žádný vliv |
Žádný vliv |
|
Lamotrigin |
Žádný vliv |
<10% pokles |
|
Levetiracetam |
Žádný vliv |
Žádný vliv |
|
Oxkarbazepin |
1,9násobný pokles |
35% nárůst |
|
Fenobarbital |
Žádný vliv |
Žádný vliv |
|
Fenytoin |
1,7násobný pokles |
Žádný vliv |
|
Topiramát |
19% pokles |
Žádný vliv |
|
Kyselina valproová |
Žádný vliv |
<10% pokles |
|
Zonisamid |
Žádný vliv |
Žádný vliv |
1) Aktivní metabolit monohydroxykarbazepin nebyl hodnocen.
U některých antiepileptik známých jako induktory enzymů (karbamazepin, fenytoin, oxkarbazepin) bylo prokázáno, že zvyšují clearance perampanelu a tím tedy snižují plazmatické koncentrace perampanelu.
Karbamazepin, známý silný induktor enzymů, snížil ve studii provedené u zdravých subjektů hladiny perampanelu o dvě třetiny.
Podobný výsledek byl pozorován v populační farmakokinetické analýze provedené u pacientů s parciálními záchvaty, kterým byl podáván perampanel v dávce do 12 mg/den, a u pacientů s primárně generalizovanými tonicko-klonickými záchvaty, kterým byl podáván perampanel v dávce do 8 mg/den v placebem kontrolovaných klinických studiích. Celková clearance přípravku Fycompa se zvýšila při souběžném podávání s karbamazepinem (2,75násobně), fenytoinem (1,7násobně) a oxkarbazepinem (1,9násobně), které jsou známými induktory metabolických enzymů (viz bod 5.2). Tento účinek je nutné brát v úvahu při přidávání nebo odebírání těchto antiepileptik z léčebného režimu pacienta.
V populační farmakokinetické analýze pacientů s parciálními záchvaty, kterým byl podáván přípravek Fycompa v dávce do 12 mg/den v placebem kontrolovaných klinických studiích, neměl přípravek Fycompa při nejvyšší hodnocené dávce perampanelu (12 mg/den) klinicky významný vliv na clearanci klonazepamu, levetiracetamu, fenobarbitalu, fenytoinu, topiramátu, zonisamidu, karbamazepinu, klobazamu, lamotriginu ani kyseliny valproové.
V populační farmakokinetické analýze u pacientů s epilepsií perampanel snižoval clearanci oxkarbazepinu o 26 %. Oxkarbazepin je rychle metabolizován cytosolovým enzymem reduktázou na aktivní metabolit, monohydroxykarbazepin. Účinek perampanelu na koncentraci monohydroxykarbazepinu není znám.
Perampanel se dávkuje za účelem dosažení klinického účinku bez ohledu na jiná antiepileptika.
Vliv perampanelu na substráty CYP3A
U zdravých subjektů přípravek Fycompa (v dávce 6 mg jednou denně po dobu 20 dní) snížil hodnotu AUC midazolamu o 13 %. Větší pokles u expozice midazolamu (nebo jiných citlivých substrátů CYP3A) nelze vyloučit při vyšších dávkách přípravku Fycompa.
Účinek induktorů cvtochromu P450 na farmakokinetiku perampanelu
Předpokládá se, že silné induktory cytochromu P450, jako je rifampicin a hypericum (třezalka), budou snižovat koncentrace perampanelu a nebyla vyloučena možnost vyšších plazmatických koncentrací reaktivních metabolitů v jejich přítomnosti. Bylo prokázáno, že felbamát snižuje koncentrace některých léčivých přípravků a mohl by snižovat i koncentrace perampanelu.
Účinek inhibitorů cytochromu P450 na farmakokinetiku perampanelu
U zdravých subjektů ketokonazol inhibující CYP3A4 (v dávce 400 mg jednou denně po dobu 10 dní) zvyšoval hodnotu AUC perampanelu o 20 % a prodlužoval poločas perampanelu o 15 % (67,8 h vs. 58,4 h). Větší účinky nelze vyloučit, pokud je perampanel kombinován s inhibitorem CYP3A s delším poločasem než u ketokonazolu nebo pokud je inhibitor podáván po delší dobu.
Levodopa
U zdravých subjektů neměl přípravek Fycompa (v dávce 4 mg jednou denně po dobu 19 dní) žádný vliv na hodnotu Cmax nebo AUC levodopy.
Alkohol
Farmakodynamická interakční studie u zdravých subjektů ukázala, že účinky perampanelu na činnosti vyžadující pozornost a ostražitost, jako je řízení dopravních prostředků, byly aditivní nebo supraaditivní k účinkům samotného alkoholu. Vícečetné podávání perampanelu v dávce 12 mg/den zvyšovalo úroveň zlosti, zmatenosti a deprese, což prokázalo hodnocení s použitím pětibodové stupnice POMS (Profile of Mood State - profil stavu nálady) (viz bod 5.1). Tyto účinky lze rovněž pozorovat při použití přípravku Fycompa v kombinaci s jinými léčivými přípravky tlumícími činnost centrální nervové soustavy (CNS).
Pediatrická populace
Studie interakcí byly provedeny pouze u dospělých.
V populační farmakokinetické analýze u dospívajících pacientů v klinických studiích fáze 3 nebyly zaznamenány žádné významné rozdíly mezi touto a celkovou populací.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku a antikoncepce u mužů a žen
Užívání přípravku Fycompa se nedoporučuje u žen ve fertilním věku nepoužívajících antikoncepci, pokud to není nezbytně nutné.
Údaje o podávání perampanelu těhotným ženám jsou omezené (méně než 300 ukončených těhotenství). Studie na zvířatech nenaznačovaly žádné teratogenní účinky u potkanů ani králíků, ale embryotoxicita byla pozorována u potkanů při dávkách toxických pro matku (viz bod 5.3). Podávání přípravku Fycompa se v těhotenství nedoporučuje.
Kojení
Studie na kojících potkanech prokázaly vylučování perampanelu a/nebo jeho metabolitů do mléka (viz bod 5.3). Není známo, zda se perampanel vylučuje do lidského mateřského mléka. Riziko pro kojené novorozence/děti nelze vyloučit. Na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku je nutno rozhodnout, zda přerušit kojení nebo ukončit/přerušit podávání přípravku Fycompa.
Ve studii fertility u potkanů byly u samic při vysokých dávkách (30 mg/kg) pozorovány prodloužené a nepravidelné estrální cykly. Tyto změny však neměly vliv na fertilitu ani časný vývoj embrya. Nebyly zaznamenány žádné účinky na fertilitu samců (viz bod 5.3). Vliv perampanelu na lidskou fertilitu nebyl stanoven.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Fycompa má mírný vliv na schopnost řídit nebo obsluhovat stroje.
Perampanel může způsobovat závratě a spavost a může tedy mít vliv na schopnost řídit nebo obsluhovat stroje. Pacientům se doporučuje, aby neřídili dopravní prostředky, neobsluhovali složité stroje ani se nezapojovali do jiných potenciálně rizikových činností, dokud nebude jasné, zda má perampanel vliv na jejich schopnost tyto činnosti provádět (viz body 4.4 a 4.5).
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Ve všech kontrolovaných i nekontrolovaných studiích u pacientů s parciálními záchvaty byl 1639 subjektům podáván perampanel. U 1147 z nich trvala léčba 6 měsíců a u 703 déle než 12 měsíců.
V kontrolované a nekontrolované studii u pacientů s primárně generalizovanými tonicko-klonickými záchvaty dostávalo perampanel 114 subjektů, z nichž 68 bylo léčeno po dobu 6 měsíců a 36 po dobu delší než 12 měsíců.
Nežádoucí účinky vedoucí k ukončení podávání:
V kontrolovaných klinických studiích fáze 3 u pacientů s parciálními záchvaty byl počet ukončených podávání v důsledku nežádoucích účinků 1,7 %, 4,2 %, respektive 13,7 % u pacientů randomizovaných do skupin, ve kterých byl perampanel podáván v doporučené dávce 4 mg, 8 mg, respektive 12 mg/den, a 1,4 % u pacientů randomizovaných do skupiny s placebem. Nežádoucími účinky, které nejčastěji (>1 % pacientů z celkové skupiny s perampanelem a vyšší výskyt než u placeba) vedly k ukončení podávání, byly závratě a spavost.
V kontrolované klinické studii fáze 3 u pacientů s primárně generalizovanými tonicko-klonickými záchvaty byl počet ukončených podávání v důsledku nežádoucích účinků 4,9 % u pacientů randomizovaných do skupiny, ve které byl perampanel podáván v dávce 8 mg a 1,2 % u pacientů randomizovaných do skupiny s placebem. Nežádoucím účinkem, který nejčastěji (>2 % ve skupině s perampanelem a vyšší výskyt než u placeba) vedl k ukončení léčby, byla závrať.
Tabulka se seznamem nežádoucích účinků
V následující tabulce jsou podle tříd orgánových systémů a frekvence výskytu uvedeny nežádoucí účinky, které byly identifikovány na základě posouzení údajů z kompletní bezpečnostní databáze
z klinických studií s přípravkem Fycompa. Ke klasifikaci nežádoucích účinků se použila následující konvence: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100).
V každé kategorii četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Třídy orgánových systémů |
Velmi časté |
Časté |
Méně časté |
|
Poruchy metabolismu a výživy |
Snížená chuť k jídlu Zvýšená chuť k jídlu |
|
Třídy orgánových systémů |
Velmi časté |
Časté |
Méně časté |
|
Psychiatrické poruchy |
Zlost Úzkost Stav zmatenosti |
Sebevražedné představy Pokus o sebevraždu | |
|
Poruchy nervového systému |
Závratě Spavost |
Ataxie Dysartrie Porucha rovnováhy Podrážděnost | |
|
Poruchy oka |
Diplopie Rozostřené vidění | ||
|
Poruchy ucha a labyrintu | |||
|
Gastrointestinální poruchy | |||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | |||
|
Celkové poruchy |
Poruchy chůze Únava | ||
|
Vyšetření |
Nárůst tělesné hmotnosti | ||
|
Poranění, otravy a procedurální komplikace |
Pád |
Pediatrická populace
Na základě databáze klinických hodnocení provedených u 196 dospívajících, kterým byl podáván perampanel v dvojitě zaslepených studiích parciálních záchvatů a primárně generalizovaných tonicko-klonických záchvatů, byl celkový bezpečnostní profil u dospívajících podobný profilu u dospělých, kromě agresivity, která byla pozorována častěji u dospívajících než u dospělých.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Klinické zkušenosti s předávkováním perampanelem u lidí jsou omezené. Ve zprávě o úmyslném předávkování, při kterém mohla dávka být až 264 mg, došlo u pacienta ke změně duševního stavu, agitovanosti a agresivnímu chování. Pacient se zotavil bez dalších následků. Proti účinkům perampanelu neexistuje žádné specifické antidotum. Indikována je všeobecná podpůrná péče o pacienta, včetně sledování vitálních funkcí a klinického stavu pacienta. S ohledem na dlouhý poločas perampanelu mohou být jeho účinky delšího trvání. Vzhledem k nízké clearance ledvinami se nepředpokládá, že by speciální zákroky, jako je forsírovaná diuréza, dialýza nebo hemoperfuze, měly význam.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiepileptika, jiná antiepileptika, ATC kód: N03AX22 Mechanismus účinku
Perampanel je prvním představitelem selektivního, nekompetitivního antagonisty ionotropního glutamátového AMPA receptoru (a-amino-3-hydroxy-5-methyl-4-izoxazolpropionová kyselina) na postsynaptických neuronech. Glutamát je primární excitační neurotransmiter v centrálním nervovém systému a je zapojen do několika neurologických poruch způsobených nadměrnou excitací neuronů. Předpokládá se, že je aktivace AMPA receptorů glutamátem zodpovědná za většinu rychlých excitačních synaptických přenosů v mozku. V in vitro studiích perampanel nekonkuroval AMPA ve vaznosti na AMPA receptor, ale vazba perampanelu byla nahrazena nekompetitivními antagonisty AMPA receptorů, což naznačuje, že perampanel je nekompetitivní antagonista AMPA receptorů. V podmínkách in vitro perampanel inhiboval zvýšení hladiny intracelulárního vápníku indukované AMPA (ale nikoliv zvýšení indukované NMDA). V podmínkách in vivo perampanel výrazně prodlužoval latenci záchvatu u modelu záchvatu indukovaného AMPA.
Přesný mechanismus, jakým perampanel vykonává své antiepileptické účinky u lidí, ještě není zcela objasněn.
Farmakodynamické účinky
Farmakokinetická/farmakodynamická analýza (účinnosti) byla provedena na základě souhrnných údajů ze 3 studií účinnosti u parciálních záchvatů. Kromě toho byla provedena farmakokinetická/farmakodynamická analýza (účinnosti) v rámci jedné studie účinnosti u primárně generalizovaných tonicko-klonických záchvatů. V obou analýzách koreluje expozice perampanelu s poklesem četnosti záchvatů.
Psychomotorický výkon
Jednotlivá dávka i vícečetné dávky 8 mg a 12 mg zhoršily psychomotorický výkon u zdravých dobrovolníků, a to v závislosti na výši dávky. Účinky perampanelu na složité činnosti, jako je schopnost řídit dopravní prostředky, byly aditivní nebo supraaditivní k účinkům alkoholu. Výsledky testování psychomotorického výkonu se vrátily do normálu do 2 týdnů od ukončení podávání perampanelu.
Kognitivní funkce
Ve studii hodnotící účinky perampanelu na ostražitost a paměť u zdravých dobrovolníků pomocí standardní série testů nebyly po podání jednotlivé dávky i vícečetných dávek perampanelu až 12 mg/den zjištěny žádné účinky perampanelu.
Ostražitost a nálada
Úroveň ostražitosti (pozornosti) se u zdravých subjektů, kterým byl podáván perampanel v dávkách 4 až 12 mg/den snižovala v závislosti na výši dávky. Ke zhoršení nálady došlo pouze po podání dávky 12 mg/den. Změny v náladě byly malé a odrážely celkový pokles ostražitosti. Vícečetné podávání perampanelu v dávce 12 mg/den také zvýraznilo účinky alkoholu na bdělost a ostražitost a zvýšilo úroveň zlosti, zmatenosti a deprese, což prokázalo hodnocení s použitím pětibodové stupnice POMS (Profile of Mood State - profil stavu nálady).
Srdeční elektrofyziologie
Perampanel neprodlužoval QTc interval při podávání v denních dávkách do 12 mg/den a nevykazoval žádný s dávkou související nebo klinicky důležitý vliv na dobu trvání QRS.
Parciální záchvaty
Účinnost perampanelu u parciálních záchvatů byla stanovena ve třech 19týdenních, randomizovaných, dvojitě zaslepených, placebem kontrolovaných, multicentrických studiích s přídatnou terapií u dospělých a dospívajících pacientů. Pacienti měli parciální záchvaty s nebo bez sekundární generalizace, které nebyly adekvátně kontrolovány jedním až třemi souběžně podávanými antiepileptiky. Během 6týdenního základního období museli mít pacienti více než pět záchvatů, přičemž žádné období bez záchvatu nesmělo přesahovat 25 dní. V těchto třech studiích měli pacienti průměrnou dobu trvání epilepsie přibližně 21,06 let. 85,3 % až 89,1 % pacientů souběžně užívalo dvě až tři antiepileptika s nebo bez současné stimulace nervus vagus.
Dvě studie (studie 304 a 305) srovnávaly perampanel v dávkách 8 a 12 mg/den s placebem a třetí studie (studie 306) srovnávala perampanel v dávkách 2, 4 a 8 mg/den s placebem. Ve všech třech studiích, po 6týdenní základní fázi pro stanovení základní frekvence záchvatů před randomizací, byli pacienti randomizováni a byla jim natitrována randomizovaná dávka. Během titrační fáze byla ve všech třech studiích léčba zahájena na dávce 2 mg/den a navyšována týdně o 2 mg/den až na cílovou dávku. Pacienti zaznamenávající netolerovatelné nežádoucí účinky mohli zůstat na stejné dávce nebo jim mohla být dávka snížena na předchozí tolerovanou dávku. Ve všech třech studiích byla titrační fáze následována udržovací fází, která trvala 13 týdnů a během níž byla pacientům podávána stabilní dávka perampanelu.
Souhrnné 50% podíly respondérů měly tyto hodnoty: placebo 19 %, 4 mg 29 %, 8 mg 35 % a 12 mg 35 %. U léčby perampanelem v dávkách 4 mg/den (studie 306), 8 mg/den (studie 304, 305 a 306) a 12 mg/den (studie 304 a 305) byl pozorován statisticky významný účinek na snížení frekvence záchvatů během 28 dní (v léčebné fázi oproti základní fázi) v porovnání se skupinou s placebem. 50% podíl respondérů ve skupinách s dávkou 4 mg, 8 mg a 12 mg činil 23,0 %, 31,5 %, respektive 30,0 % u kombinace s antiepileptiky indukujícími enzym a 33,3 %, 46,5 %, respektive 50,0 % při podávání perampanelu s antiepileptiky, která enzym neindukují. Tyto studie ukazují, že podávání perampanelu jednou denně v dávkách 4 mg až 12 mg bylo jako přídatná léčba u této populace výrazně účinnější než placebo.
Údaje z placebem kontrolovaných studií ukazují, že zlepšení kontroly záchvatů je pozorováno u podávání perampanelu jednou denně v dávce 4 mg a tento přínos se s rostoucí dávkou k 8 mg/den zvyšuje. U dávky 12 mg nebyl u celkové populace pozorován žádný přínos z hlediska účinnosti v porovnání s dávkou 8 mg. Přínos u dávky 12 mg byl pozorován u některých pacientů, kteří dávku 8 mg snáší a jejich odpověď na tuto dávku byla nedostatečná. Klinicky významného snížení frekvence záchvatů v poměru k placebu bylo dosaženo již ve druhém týdnu podávání, když pacienti začali dostávat denní dávku 4 mg.
1,7 až 5,8 % pacientů užívajících perampanel v klinických studiích bylo zcela bez záchvatů v průběhu udržovacího období 3 měsíců v porovnání s 0 % - 1,0 % pacientů s placebem. Nejsou k dispozici žádné údaje o účincích vysazení souběžně podávaných antiepileptik pro dosažení monoterapie s perampanelem.
Otevřené prodloužení studie
Devadesát sedm procent pacientů, kteří dokončili randomizované studie u pacientů s parciálními záchvaty, bylo zařazeno do otevřeného prodloužení studie (n=1186). Pacienti z randomizované studie byli převedeni na perampanel podávaný po dobu 16 týdnů a poté následovalo dlouhé udržovací období (>1 rok). Průměrná výše denní dávky činila 10,05 mg.
Primárně generalizované tonicko-klonické záchvaty
Perampanel jako adjuvantní léčba u pacientů ve věku 12 let a starších s idiopatickou generalizovanou epilepsií, kteří trpí primárně generalizovanými tonicko-klonickými záchvaty, byla stanovena v multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované studii (studie 332). Vhodní pacienti na stabilní dávce 1-3 antiepileptik, u kterých došlo k minimálně 3 primárně
generalizovaným tonicko-klonickým záchvatům v průběhu 8týdenního vstupního období, byli randomizováni buď do skupiny užívající perampanel, nebo placebo. Do studie bylo zařazeno celkem 164 pacientů (perampanel N = 82, placebo N = 82). Pacientům byly titrovány dávky po dobu čtyř týdnů až do cílové dávky 8 mg za den nebo do nejvyšší tolerované dávky, a poté jim byla po dobu dalších 13 týdnů podávána poslední dávka, které bylo dosaženo na konci titračního období. Celková doba léčby byla 17 týdnů. Hodnocený lék byl podáván jednou denně.
50% podíl respondérů s primárně generalizovanými tonicko-klonickými záchvaty během udržovacího období byl ve skupině s perampanelem (58,0 %) významně vyšší než ve skupině s placebem (35,8 %), P = 0,0059. 50% podíl respondérů činil 22,2 % u kombinace s antiepileptiky indukujícími enzym a 69,4 % při podávání perampanelu s antiepileptiky, která enzym neindukují. Počet subjektů užívajících perampanel v kombinaci s antiepileptiky, která indukují enzym, byl malý (n = 9). Medián procentuální změny ve frekvenci primárně generalizovaných tonicko-klonických záchvatů za 28 dní během titračního a udržovacího období (celkově) byl vzhledem k prerandomizaci vyšší ve skupině s perampanelem (-76,5 %) než u placeba (-38,4 %), P < 0,0001. Během udržovacího období 3 měsíců bylo 30,9 % (25/81) pacientů užívajících pera^npanel v klinických studiích zcela bez prr^nárně generalizovaných tonicko-klonických záchvatů v porovnání s 12,3 % (10/81) pacientů ve skupině s placebem.
Jiné podtypy idiopatických generalizovaných záchvatů
Účinnost a bezpečnost perampanelu u pacientů s myoklonickými záchvaty nebyla stanovena.
Dostupné údaje jsou pro vyvození jakýchkoli závěrů nedostačující.
Účinnost perampanelu v léčbě záchvatů absence nebyla prokázána.
Ve studii 332 bylo u pacientů s primárně generalizovanými tonicko-klonickými záchvaty, kteří trpěli také souběžnými myoklonickými záchvaty, dosaženo stavu bez záchvatů u 16,7 % (4/24) pacientů ve skupině s perampanelem au 13,0 % (3/23) pacientů ve skupině s placebem; upacientů se souběžnými záchvaty absence bylo dosaženo stavu bez záchvatů u 22,2 % (6/27) pacientů ve skupině s perampanelem au 12,1 % (4/33) pacientů ve skupině s placebem. Stavu bez záchvatů jakéhokoli typu bylo dosaženo u 23,5 % (19/81) pacientů ve skupině s perampanelem a u 4,9 % (4/81) pacientů ve skupině s placebem.
Otevřená prodloužená fáze
Ze 140 pacientů, kteří dokončili studii 332, vstoupilo 114 subjektů (81,4 %) do prodloužené fáze. Pacienti z randomizované studie byli převedeni na perampanel v průběhu 6 týdnů, následovaných dlouhodobou udržovací fází (> 1 rok). V prodloužené fázi mělo 73,7 % subjektů modální denní dávku perampanelu vyšší než 4-8 mg/den a 16,7 % mělo modální denní dávku vyšší než 8-12 mg/den.
Pokles frekvence primárně generalizovaných tonicko-klonických záchvatů nejméně o 50 % byl pozorován u 65,9 % subjektů po 1 roce léčby během prodloužené fáze (vzhledem k počáteční frekvenci záchvatů před léčbou perampanelem). Tyto údaje jsou v souladu s těmi, které vyjadřují procentuální změnu ve frekvenci záchvatů, a prokázaly, že 50% podíl respondérů s primárně generalizovanými tonicko-klonickými záchvaty byl celkově stabilní v čase od 26. týdne až do konce 2. roku. Podobné výsledky byly zaznamenány u všech záchvatů a absencí vs. myoklonických záchvatů, které byly hodnoceny v průběhu času.
Přechod na monoterapii
Nejsou k dispozici žádné údaje o účincích vysazení souběžně podávaných antiepileptik pro dosažení monoterapie perampanelem.
Pediatrická populace
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem Fycompa u jedné nebo více podskupin pediatrické populace u farmakorezistentních epilepsií (epileptické syndromy související s lokalitou a věkem) (informace o použití u dospívajících viz bod 4.2).
Tři pivotní, dvojitě zaslepené, placebem kontrolované studie fáze 3 zahrnovaly 143 dospívajících ve věku 12 až 18 let. Výsledky u těchto dospívajících byly podobné výsledkům pozorovaným u dospělé populace.
Studie 332 zahrnovala 22 dospívajících ve věku 12 až 18 let. Výsledky u těchto dospívajících byly podobné výsledkům pozorovaným u dospělé populace.
5.2 Farmakokinetické vlastnosti
Farmakokinetika perampanelu byla studována u zdravých dospělých subjektů (věkové rozmezí 18 až 79 let), dospělých a dospívajících s parciálními záchvaty a s primárně generalizovanými tonicko-klonickými záchvaty, dospělých s Parkinsonovou chorobou, dospělých s diabetickou neuropatií, dospělých s roztroušenou sklerózou a subjektů s poruchou funkce jater.
Absorpce
Perampanel je po perorálním podání snadno absorbován bez průkazu výrazného metabolismu prvního průchodu („first-pass“ metabolismus). Podávání tablet perampanelu současně s jídlem s vysokým obsahem tuku nemělo vliv na maximální plazmatickou expozici (Cmax) ani celkovou expozici (AUCo_inf) perampanelu. Hodnota tmax byla dosažena přibližně o 1 hodinu později v porovnání s dosažením hodnoty tmax nalačno.
Distribuce
Údaje z in vitro studií naznačují, že se perampanel přibližně z 95 % váže na plazmatické bílkoviny.
In vitro studie ukazují, že perampanel není substrátem ani významným inhibitorem transportních polypeptidů organických aniontů (OATP) 1B1 a 1B3, transportérů organických aniontů (OAT) 1, 2, 3 a 4, transportérů organických kationtů (OCT) 1, 2 a 3 a efluxních transportérů P-glykoproteinu a proteinu rezistence karcinomu prsu (BCRP - Breast Cancer Resistance Protein).
Biotransformace
Perampanel je výrazně metabolizován primární oxidací a následně glukuronidací. Podle výsledků klinické studie u zdravých subjektů, kterým byl podáván radioaktivně značený perampanel, a in vitro studií za použití lidských rekombinantních CYP a lidských jaterních mikrozomů je metabolismus perampanelu zprostředkován především CYP3A.
Po podání radioaktivně značeného perampanelu byla v plazmě pozorována pouze stopová množství perampanelu.
Eliminace
Po podání radioaktivně značené dávky perampanelu buď 8 zdravým dospělým nebo starším subjektům bylo přibližně 30 % radioaktivity zjištěno v moči a 70 % ve stolici. Zjištěnou radioaktivitu v moči a ve stolici primárně tvořila směs oxidovaných a konjugovaných metabolitů. V populační farmakokinetické analýze souhrnných údajů z 19 studií fáze 1 byla průměrná hodnota ti/2 perampanelu 105 hodin. Při podávání v kombinaci se silným induktorem CYP3A karbamazepinem činila průměrná hodnota t1/2 25 hodin.
Linearita/nelinearita
U zdravých subjektů se plazmatické koncentrace perampanelu zvýšily přímo úměrně k podávaným dávkám v rozmezí 2 až 12 mg. V populační farmakokinetické analýze u pacientů s parciálními záchvaty, kterým byl v placebem kontrolovaných klinických studiích podáván perampanel v dávce do 12 mg/den, a u pacientů s primárně generalizovanými tonicko-klonickými záchvaty, kterým byl podáván perampanel v dávce do 8 mg/den, byl zjištěn lineární vztah mezi dávkou a plazmatickými koncentracemi perampanelu.
Zvláštní populace
Porucha funkce jater
Farmakokinetika perampanelu po podání jediné dávky 1 mg byla hodnocena u 12 pacientů s lehkou a středně těžkou poruchou funkce jater (skóre Child-Pugh A, respektive B) v porovnání s 12 zdravými, demograficky odpovídajícími subjekty. Průměrná zdánlivá clearance nenavázaného perampanelu u subjektů s lehkou poruchou byla 188 ml/min oproti 338 ml/min u odpovídajících kontrolních subjektů, a u subjektů se středně těžkou poruchou byla 120 ml/min oproti 392 ml/min u odpovídajících kontrolních subjektů. Poločas ti/2 byl delší u subjektů s lehkou poruchou (306 h oproti 125 h) a subjektů se středně těžkou poruchou (295 h oproti 139 h) v porovnání s odpovídajícími zdravými subjekty.
Porucha funkce ledvin
Farmakokinetika perampanelu nebyla u pacientů s poruchou funkce ledvin formálně hodnocena. Eliminace perampanelu probíhá téměř výhradně prostřednictvím metabolismu následovaného rychlým vylučováním metabolitů; v plazmě jsou pozorována jen stopová množství metabolitů perampanelu.
V populační farmakokinetické analýze u pacientů s parciálními záchvaty, kteří měli hodnoty clearance kreatininu od 39 do 160 ml/min a kterým byl v placebem kontrolovaných klinických studiích podáván perampanel v dávce do 12 mg/den, nebyla clearance perampanelu ovlivněna clearancí kreatininu.
V populační farmakokinetické analýze u pacientů s primárně generalizovanými tonicko-klonickými záchvaty, kteří dostávali perampanel v dávce do 8 mg/den v klinické studii kontrolované placebem, nebyla clearance perampanelu ovlivněna vstupní hodnotou clearance kreatininu.
Pohlaví
V populační farmakokinetické analýze u pacientů s parciálními záchvaty, kterým byl v placebem kontrolovaných klinických studiích podáván perampanel v dávce do 12 mg/den, a u pacientů
s primárně generalizovanými tonicko-klonickými záchvaty, kteří dostávali perampanel v dávce do 8 mg/den, byla clearance perampanelu u žen (0,54 l/h) o 18 % nižší než u mužů (0,66 l/h).
Starší pacienti (od 65 let)
V populační farmakokinetické analýze u pacientů s parciálními záchvaty (ve věku 12 až 74 let) a
u pacientů s primárně generalizovanými tonicko-klonickými záchvaty (ve věku 12 až 58 let), kterým byl v placebem kontrolovaných klinických studiích podáván perampanel v dávce do 8 nebo 12 mg/den, nebyl zjištěn žádný výrazný vliv věku na clearanci perampanelu. U starších pacientů není nutná úprava dávky (viz bod 4.2).
Pediatrická populace
V populační farmakokinetické analýze u dospívajících pacientů v klinických studiích fáze 3 nebyly zaznamenány žádné významné rozdíly mezi touto a celkovou populací.
Studie lékových interakcí
In vitro hodnocení lékových interakcí Inhibice enzymů metabolizujících léky
U lidských jaterních mikrozomů měl perampanel (30 ^mol/l) z hlavních jaterních enzymů CYP a UGT slabý inhibiční účinek na CYP2C8 a UGT1A9.
Indukce enzymů metabolizujících léky
V porovnání s pozitivními kontrolami (včetně fenobarbitalu a rifampicinu) bylo zjištěno, že perampanel z hlavních jaterních enzymů CYP a UGT v kultuře lidských hepatocytů slabě indukuje CYP2B6 (30 ^mol/l) a CYP3A4/5 (>3 ^mol/l).
Nežádoucí účinky, které nebyly pozorovány v klinických studiích, avšak vyskytly se ve studiích na zvířatech při expozici podobné expozici při klinickém podávání, a které mohou být důležité pro klinické použití:
Ve studii fertility u potkanů byly u samic při maximálních tolerovaných dávkách (30 mg/kg) pozorovány prodloužené a nepravidelné estrální cykly. Tyto změny však neměly vliv na fertilitu ani časný vývoj embrya. Nebyly zaznamenány žádné účinky na fertilitu samců.
Vylučování do mateřského mléka bylo u potkanů měřeno 10 dní po vrhu. Maximální hodnoty byly dosaženy po 1 hodině a byly 3,65krát vyšší než hladiny v plazmě.
Ve studii toxicity v prenatálním a postnatálním vývoji u potkanů byly při dávkách toxických pro matku zaznamenány abnormality při vrhu a kojení a stoupl počet narození mrtvých mláďat. Behaviorální a reprodukční vývoj mláďat nebyl ovlivněn, ale některé parametry fyzického vývoje vykazovaly zpoždění, které bylo pravděpodobně sekundárním důsledkem farmakologických účinků perampanelu na CNS. Průchod placentární bariérou byl relativně nízký - v plodu bylo zjištěno 0,09 % nebo méně podané dávky.
Neklinické údaje neodhalily genotoxické účinky ani kancerogenní potenciál perampanelu. Podávání maximálních tolerovaných dávek potkanům a opicím mělo za následek farmakologické klinické příznaky u CNS a nižší konečnou tělesnou hmotnost. V klinické patologii nebo histopatologii nebyly zjištěny žádné změny, které by bylo možné přímo připisovat perampanelu.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Jádro tablety Monohydrát laktosy Částečně substituovaná hyprolosa Povidon K 29-32 Magnesium-stearát (E470b)
Fycompa 2 mg potahované tablety
Potahová vrstva Hypromelosa 2910 Mastek
Makrogol 8000 Oxid titaničitý (E171)
Žlutý oxid železitý (E172)
Červený oxid železitý (E172)
Fycompa 4 mg potahované tablety
Potahová vrstva Hypromelosa 2910 Mastek
Makrogol 8000 Oxid titaničitý (E171)
Červený oxid železitý (E172)
Fycompa 6 mg potahované tablety
Potahová vrstva Hypromelosa 2910 Mastek
Makrogol 8000 Oxid titaničitý (E171)
Červený oxid železitý (E172)
Fycompa 8 mg potahované tablety
Potahová vrstva Hypromelosa 2910 Mastek
Makrogol 8000 Oxid titaničitý (E171)
Červený oxid železitý (E172)
Černý oxid železitý (E172)
Fycompa 10 mg potahované tablety
Potahová vrstva Hypromelosa 2910 Mastek
Makrogol 8000 Oxid titaničitý (E171)
Žlutý oxid železitý (E172)
Hlinitý lak indigokarmínu (E132)
Fycompa 12 mg potahované tablety
Potahová vrstva Hypromelosa 2910 Mastek
Makrogol 8000 Oxid titaničitý (E171)
Hlinitý lak indigokarmínu (E132)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
5 let
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení PVC/Al blistry
Fycompa 2 mg potahované tablety
Balení po 7 jen pro první týden dávkování, 28 a 98
Fycompa 4 mg potahované tablety 4 mg - balení po 7, 28, 84 a 98
Fycompa 6 mg potahované tablety 6 mg - balení po 7, 28, 84 a 98
Fycompa 8 mg potahované tablety 8 mg - balení po 7, 28, 84 a 98
Fycompa 10 mg potahované tablety 10 mg - balení po 7, 28, 84 a 98
Fycompa 12 mg potahované tablety 12 mg - balení po 7, 28, 84 a 98
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Velká Británie
tel: +44 (0)208 600 1400
fax: +44 (0)208 600 1401
e-mail: EUmedinfo@eisai.net
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/12/776/001-0023
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 23. července 2012
10. DATUM REVIZE TEXTU {MM.RRRR}
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Fycompa 0,5 mg perorální suspenze
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml perorální suspenze obsahuje perampanelum 0,5 mg. Jedna lahev o objemu 340 ml obsahuje perampanelum 170 mg Pomocná látka se známým účinkem:
Jeden ml perorální suspenze obsahuje 175 mg sorbitolu (E420). Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Perorální suspenze Bílá až téměř bílá suspenze
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Fycompa je indikován k přídatné léčbě parciálních záchvatů s nebo bez sekundární generalizace u dospělých a dospívajících pacientů ve věku od 12 let s epilepsií.
Přípravek Fycompa je indikován k přídatné léčbě primárně generalizovaných tonicko-klonických záchvatů u dospělých a dospívajících pacientů ve věku od 12 let s idiopatickou generalizovanou epilepsií (viz bod 5.1).
4.2 Dávkování a způsob podání
Dávkování
Přípravek Fycompa musí být titrován podle individuální odpovědi pacienta, aby bylo možné optimalizovat poměr mezi účinností a snášenlivostí.
Suspenze perampanelu se užívá perorálně jednou denně večer před spaním.
Může se užívat s jídlem i bez jídla, ale přednostně vždy za stejných podmínek. Při přechodu z tablet na suspenzi je třeba postupovat s opatrnosti (viz bod 5.2).
Parciální záchvaty
Při dávkách 4 mg/den až 12 mg/den se perampanel ukázal jako účinný při léčbě parciálních záchvatů.
Léčba přípravkem Fycompa má být zahájena dávkou 2 mg/den (4 ml/den). Dávku je možné zvýšit na základě klinické odpovědi a snášenlivosti, a to o 2 mg (4 ml) (buď jednou týdně nebo jednou za dva týdny dle uvážení poločasu uvedeného níže) na udržovací dávku 4 mg/den (8 ml/den) až 8 mg/den (16 ml/den). V závislosti na individuální klinické odpovědi a snášenlivosti při dávce 8 mg/den (16 ml/den) může být dávka postupně zvyšována vždy o 2 mg/den (4 ml/den) až na 12 mg/den (24 ml/den) U pacientů, kteří souběžně užívají léčivé přípravky, které nezkracují poločas perampanelu (viz bod 4.5), nemá být titrace prováděna častěji než v 2týdenních intervalech. U pacientů, kteří souběžně užívají léčivé přípravky, které zkracují poločas perampanelu (viz bod 4.5), nemá být titrace prováděna častěji než v týdenních intervalech.
Primárně generalizované tonicko-klonické záchvaty
Při dávkách až 8 mg/den se perampanel ukázal jako účinný při léčbě primárně generalizovaných tonicko-klonických záchvatů.
Léčba přípravkem Fycompa má být zahájena dávkou 2 mg/den (4 ml/den). Dávku je možné zvýšit na základě klinické odpovědi a snášenlivosti, a to o 2 mg (4 ml) (buď jednou týdně nebo jednou za dva týdny dle uvážení poločasu uvedeného níže) na udržovací dávku až 8 mg/den (16 ml/den).
V závislosti na individuální klinické odpovědi a snášenlivosti při dávce 8 mg/den (16 ml/den) může být dávka zvyšována až na 12 mg/den (24 ml/den), která může být u některých pacientů účinná (viz bod 4.4). U pacientů, kteří souběžně užívají léčivé přípravky, které nezkracují poločas perampanelu (viz bod 4.5), nemá být titrace prováděna častěji než v 2týdenních intervalech. U pacientů, kteří souběžně užívají léčivé přípravky, které zkracují poločas perampanelu (viz bod 4.5), nemá být titrace prováděna častěji než v týdenních intervalech.
Vysazení
Doporučuje se léčbu ukončovat postupně, aby se minimalizovalo potenciální riziko tzv. „rebound“ záchvatů. Avšak vzhledem k dlouhému poločasu a následnému pomalému poklesu plazmatických koncentrací je možné podávání perampanelu náhle ukončit, pokud je to nezbytně nutné.
Vynechané dávky
Jedna vynechaná dávka: Jelikož má perampanel dlouhý poločas, měl by pacient počkat a užít následující dávku podle dávkovacího intervalu.
Při vynechání více než 1 dávky v souvislém období kratším než 5 poločasů (3 týdny u pacientů neužívajících antiepileptika indukující metabolismus perampanelu, 1 týden u pacientů užívajících antiepileptika indukující metabolismus perampanelu (viz bod 4.5)), je nutné zvážit nové zahájení léčby od hladiny poslední podané dávky.
Pokud pacient přestal užívat perampanel na souvislou dobu delší než 5 poločasů, doporučuje se postupovat podle výše uvedených doporučení pro úvodní dávku.
Starší pacienti (od 65 let)
Klinické studie s přípravkem Fycompa u pacientů s epilepsií nezahrnovaly dostatečný počet pacientů ve věku od 65 let, aby bylo možné určit, zda se jejich odpověď liší od mladších pacientů. Analýza bezpečnostních informací u 905 starších pacientů léčených perampanelem (ve dvojitě zaslepených studiích provedených v neepileptických indikacích) nevykázala žádné rozdíly v bezpečnostním profilu v souvislosti s věkem. Tyto výsledky, v kombinaci s neprokázanými rozdíly při užívání perampanelu souvisejícími s věkem, naznačují, že úprava dávkování u starších pacientů není nutná. Perampanel je nutné u starších pacientů používat s opatrností s ohledem na možnost lékové interakce u pacientů s polymedikací (viz bod 4.4).
Porucha funkce ledvin
U pacientů s lehkou poruchou funkce ledvin není nutná žádná úprava dávky. Užívání perampanelu u pacientů se středně těžkou nebo těžkou poruchou funkce ledvin nebo u pacientů na hemodialýze se nedoporučuje.
Porucha funkce jater
Zvyšování dávek u pacientů s lehkou a středně těžkou poruchou funkce jater musí být založeno na klinické odpovědi a snášenlivosti. U pacientů s lehkou nebo středně těžkou poruchou funkce jater je možné zahájit podávání dávkou 2 mg (4 ml). Zvyšování dávky u pacientů je možné provádět po 2 mg (4 ml), ne častěji než jednou za 2 týdny, v závislosti na snášenlivosti a účinnosti.
Dávka perampanelu u pacientů s lehkou a středně těžkou poruchou by neměla překročit 8 mg.
Použití u pacientů s těžkou poruchou funkce jater se nedoporučuje.
Pediatrická populace
Bezpečnost a účinnost perampanelu u dětí ve věku do 12 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Přípravek Fycompa je určen k perorálnímu podání.
Příprava: Zatlačovací adaptér lahve (press-in-bottle adapter, PIBA), který se dodává v krabičce s přípravkem, je nutné před použitím pevně zasunout do hrdla lahve, kde zůstane po celou dobu používání lahve. Stříkačku pro perorální podání je nutné zasunout do PIBA a dávku natáhnout z převrácené lahve. Víčko je nutné po každém použití opět uzavřít. Víčko správně pasuje, když je PIBA v lahvi.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Sebevražedné představy
Během léčby antiepileptiky v různých indikacích byly u některých pacientů hlášeny případy sebevražedných představ a chování. Metaanalýza randomizovaných placebem kontrolovaných studií antiepileptik rovněž prokázala mírně zvýšené riziko sebevražedných představ a chování.
Mechanismus tohoto rizika není znám a dostupné údaje nevylučují možnost zvýšeného rizika u perampanelu.
Proto by u pacientů měly být sledovány příznaky sebevražedných představ a chování a zvážena vhodná léčba. Pacienti (a osoby poskytující pacientům péči) by měli být upozorněni na to, že v případě výskytu sebevražedných představ či chování by měli vyhledat lékařskou pomoc.
Poruchy nervového systému
Perampanel může způsobovat závratě a spavost a může tedy mít vliv na schopnost řídit a obsluhovat stroje (viz bod 4.7).
Perorální antikoncepce
Při dávkách 12 mg/den může přípravek Fycompa snižovat účinnost antikoncepce s obsahem progestačního hormonu. V takovém případě se při používání přípravku Fycompa doporučuje používat jinou, nehormonální formu antikoncepce (viz bod 4.5).
Pády
Při používání přípravku bylo zaznamenáno zvýšené riziko pádů, především u starších pacientů; základní příčina není známa.
U pacientů léčených perampanelem bylo hlášeno agresivní a nepřátelské chování. U pacientů léčených perampanelem v klinických studiích byly agresivita, zlost a podrážděnost hlášeny častěji při vyšších dávkách. Většina hlášených příhod byla buď mírná, nebo středně závažná a pacienti se zotavili buď spontánně, nebo po úpravě dávky. U některých pacientů (< 1 % v klinických studiích s perampanelem) však byly zaznamenány myšlenky na ohrožení jiných, fyzické útoky nebo výhružné chování. Pacientům a pečovatelům je nutné sdělit, že mají okamžitě upozornit zdravotnického pracovníka, pokud si všimnou významných změn nálady nebo vzorců chování. Jestliže se takové příznaky objeví, je nutné dávku perampanelu snížit, a pokud jsou příznaky závažné, je nutné ho okamžitě vysadit.
Možnost zneužití
Opatrnosti je zapotřebí u pacientů se zneužíváním látek v anamnéze a u těchto pacientů je nutné sledovat potenciální příznaky zneužívání perampanelu.
Souběžné podávání s antiepileptiky indukujícími CYP3A
Míra odpovědí po přidání perampanelu ve stálých dávkách byla nižší v případech, kdy pacienti souběžně užívali antiepileptika indukující enzym CYP3A (karbamazepin, fenytoin, oxkarbazepin), v porovnání s mírou odpovědí u pacientů souběžně užívajících antiepileptika, která enzym neindukují. Pokud pacient přechází ze souběžně užívaných antiepileptik neindukujících enzym na léčivé přípravky indukující enzym nebo naopak, je nutné sledovat jeho klinickou odpověď. V závislosti na individuální klinické odpovědi a snášenlivosti je možné dávku zvyšovat nebo snižovat vždy po 2 mg (viz bod 4.2).
Jiné souběžně podávané léčivé přípravky (mimo antiepileptika) indukující nebo inhibující cytochrom P450
Při přidávání nebo odebírání induktorů nebo inhibitorů cytochrom P450 je nutné u pacientů pečlivě sledovat jejich snášenlivost a klinickou odpověď, neboť může dojít k poklesu nebo zvýšení plazmatických hladin perampanelu. Může být nutná adekvátní úprava dávky perampanelu.
Sorbitol
Přípravek Fycompa obsahuje sorbitol (E420), a proto by pacienti se vzácnými dědičnými problémy s intolerancí fruktózy tento přípravek neměli užívat.
Je třeba zvýšené opatrnosti, pokud kombinujete přípravek Fycompa perorální suspenze s dalšími antiepileptickými léčivými přípravky obsahujícími sorbitol, protože kombinovaný příjem více než 1 gramu sorbitolu může ovlivnit vstřebávání některých léků.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Přípravek Fycompa není považován za silný induktor nebo inhibitor cytochromu P450 nebo UGT enzymů (viz bod 5.2).
Perorální antikoncepce
U zdravých žen, kterým byly podávány dávky 12 mg (ale nikoliv 4 nebo 8 mg/den) po dobu 21 dní souběžně s kombinovanými perorálními kontraceptivy, se ukázalo, že přípravek Fycompa snižuje expozici levonorgestrelu (střední hodnoty Cmax a AUC se snížily shodně o 40 %). Hodnota AUC ethinylestradiolu nebyla přípravkem Fycompa v dávce 12 mg ovlivněna, kdežto hodnota Cmax se snížila o 18 %. Proto je nutné u žen vyžadujících přípravek Fycompa v dávce 12 mg/den vzít v úvahu možnost snížené účinnosti perorální antikoncepce s obsahem progestačního hormonu a používat i jinou spolehlivou metodu antikoncepce (nitroděložní tělísko, kondom) (viz bod 4.4).
Interakce přípravku Fycompa s jinými antiepileptiky
Potenciální interakce přípravku Fycompa (v dávce do 12 mg jednou denně) a jiných antiepileptik byly posuzovány v klinických studiích a hodnoceny v populační farmakokinetické analýze ve čtyřech sdružených studiích fáze 3 zahrnujících pacienty s parciálními záchvaty a primárně generalizovanými tonicko-klonickými záchvaty. Vliv těchto interakcí na průměrnou koncentraci v ustáleném stavu je shrnut v následující tabulce.
|
O 1 vv v Souběžně podávané antiepileptikum |
Vliv antiepileptika na koncentraci přípravku Fycompa |
Vliv přípravku Fycompa na koncentraci antiepileptika |
|
Karbamazepin |
2,75násobný pokles |
<10% pokles |
|
Klobazam |
Žádný vliv |
<10% pokles |
|
Klonazepam |
Žádný vliv |
Žádný vliv |
|
Lamotrigin |
Žádný vliv |
<10% pokles |
|
Levetiracetam |
Žádný vliv |
Žádný vliv |
|
Oxkarbazepin |
1,9násobný pokles |
35% nárůst |
|
Fenobarbital |
Žádný vliv |
Žádný vliv |
|
Fenytoin |
1,7násobný pokles |
Žádný vliv |
|
Topiramát |
19% pokles |
Žádný vliv |
|
Kyselina valproová |
Žádný vliv |
<10% pokles |
|
Zonisamid |
Žádný vliv |
Žádný vliv |
1) Aktivní metabolit monohydroxykarbazepin nebyl hodnocen.
U některých antiepileptik známých jako induktory enzymů (karbamazepin, fenytoin, oxkarbazepin) bylo prokázáno, že zvyšují clearance perampanelu a tím tedy snižují plazmatické koncentrace perampanelu.
Karbamazepin, známý silný induktor enzymů, snížil ve studii provedené u zdravých subjektů hladiny perampanelu o dvě třetiny.
Podobný výsledek byl pozorován v populační farmakokinetické analýze provedené u pacientů s parciálními záchvaty, kterým byl podáván perampanel v dávce do 12 mg/den, a u pacientů s primárně generalizovanými tonicko-klonickými záchvaty, kterým byl podáván perampanel v dávce do 8 mg/den v placebem kontrolovaných klinických studiích. Celková clearance přípravku Fycompa se zvýšila při souběžném podávání s karbamazepinem (2,75násobně), fenytoinem (1,7násobně) a oxkarbazepinem (1,9násobně), které jsou známými induktory metabolických enzymů (viz bod 5.2). Tento účinek je nutné brát v úvahu při přidávání nebo odebírání těchto antiepileptik z léčebného režimu pacienta.
V populační farmakokinetické analýze pacientů s parciálními záchvaty, kterým byl podáván přípravek Fycompa v dávce do 12 mg/den v placebem kontrolovaných klinických studiích, neměl přípravek Fycompa při nejvyšší hodnocené dávce perampanelu (12 mg/den) klinicky významný vliv na clearanci klonazepamu, levetiracetamu, fenobarbitalu, fenytoinu, topiramátu, zonisamidu, karbamazepinu, klobazamu, lamotriginu ani kyseliny valproové.
V populační farmakokinetické analýze u pacientů s epilepsií perampanel snižoval clearanci oxkarbazepinu o 26 %. Oxkarbazepin je rychle metabolizován cytosolovým enzymem reduktázou na aktivní metabolit, monohydroxykarbazepin. Účinek perampanelu na koncentraci monohydroxykarbazepinu není znám.
Perampanel se dávkuje za účelem dosažení klinického účinku bez ohledu na jiná antiepileptika.
Vliv perampanelu na substráty CYP3A
U zdravých subjektů přípravek Fycompa (v dávce 6 mg jednou denně po dobu 20 dní) snížil hodnotu AUC midazolamu o 13 %. Větší pokles u expozice midazolamu (nebo jiných citlivých substrátů CYP3A) nelze vyloučit při vyšších dávkách přípravku Fycompa.
Účinek induktorů cytochromu P450 na farmakokinetiku perampanelu
Předpokládá se, že silné induktory cytochromu P450, jako je rifampicin a hypericum (třezalka), budou snižovat koncentrace perampanelu a nebyla vyloučena možnost vyšších plazmatických koncentrací reaktivních metabolitů v jejich přítomnosti. Bylo prokázáno, že felbamát snižuje koncentrace některých léčivých přípravků a mohl by snižovat i koncentrace perampanelu.
Účinek inhibitorů cytochromu P450 na farmakokinetiku perampanelu
U zdravých subjektů ketokonazol inhibující CYP3A4 (v dávce 400 mg jednou denně po dobu 10 dní) zvyšoval hodnotu AUC perampanelu o 20 % a prodlužoval poločas perampanelu o 15 % (67,8 h vs. 58,4 h). Větší účinky nelze vyloučit, pokud je perampanel kombinován s inhibitorem CYP3A s delším poločasem než u ketokonazolu nebo pokud je inhibitor podáván po delší dobu.
Levodopa
U zdravých subjektů neměl přípravek Fycompa (v dávce 4 mg jednou denně po dobu 19 dní) žádný vliv na hodnotu Cmax nebo AUC levodopy.
Alkohol
Farmakodynamická interakční studie u zdravých subjektů ukázala, že účinky perampanelu na činnosti vyžadující pozornost a ostražitost, jako je řízení dopravních prostředků, byly aditivní nebo supraaditivní k účinkům samotného alkoholu. Vícečetné podávání perampanelu v dávce 12 mg/den zvyšovalo úroveň zlosti, zmatenosti a deprese, což prokázalo hodnocení s použitím pětibodové stupnice POMS (Profile of Mood State - profil stavu nálady) (viz bod 5.1). Tyto účinky lze rovněž pozorovat při použití přípravku Fycompa v kombinaci s jinými léčivými přípravky tlumícími činnost centrální nervové soustavy (CNS).
Pediatrická populace
Studie interakcí byly provedeny pouze u dospělých.
V populační farmakokinetické analýze u dospívajících pacientů v klinických studiích fáze 3 nebyly zaznamenány žádné významné rozdíly mezi touto a celkovou populací.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku a antikoncepce u mužů a žen
Užívání přípravku Fycompa se nedoporučuje u žen ve fertilním věku nepoužívajících antikoncepci, pokud to není nezbytně nutné.
Údaje o podávání perampanelu těhotným ženám jsou omezené (méně než 300 ukončených těhotenství). Studie na zvířatech nenaznačovaly žádné teratogenní účinky u potkanů ani králíků, ale embryotoxicita byla pozorována u potkanů při dávkách toxických pro matku (viz bod 5.3). Podávání přípravku Fycompa se v těhotenství nedoporučuje.
Kojení
Studie na kojících potkanech prokázaly vylučování perampanelu a/nebo jeho metabolitů do mléka (viz bod 5.3). Není známo, zda se perampanel vylučuje do lidského mateřského mléka. Riziko pro kojené novorozence/děti nelze vyloučit. Na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku je nutno rozhodnout, zda přerušit kojení nebo ukončit/přerušit podávání přípravku Fycompa.
Fertilita
Ve studii fertility u potkanů byly u samic při vysokých dávkách (30 mg/kg) pozorovány prodloužené a nepravidelné estrální cykly. Tyto změny však neměly vliv na fertilitu ani časný vývoj embrya. Nebyly zaznamenány žádné účinky na fertilitu samců (viz bod 5.3). Vliv perampanelu na lidskou fertilitu nebyl stanoven.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Fycompa má mírný vliv na schopnost řídit nebo obsluhovat stroje.
Perampanel může způsobovat závratě a spavost a může tedy mít vliv na schopnost řídit nebo obsluhovat stroje. Pacientům se doporučuje, aby neřídili dopravní prostředky, neobsluhovali složité stroje ani se nezapojovali do jiných potenciálně rizikových činností, dokud nebude jasné, zda má perampanel vliv na jejich schopnost tyto činnosti provádět (viz body 4.4 a 4.5).
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Ve všech kontrolovaných i nekontrolovaných studiích u pacientů s parciálními záchvaty byl 1639 subjektům podáván perampanel. U 1147 z nich trvala léčba 6 měsíců a u 703 déle než 12 měsíců.
V kontrolované a nekontrolované studii u pacientů s primárně generalizovanými tonicko-klonickými záchvaty dostávalo perampanel 114 subjektů, z nichž 68 bylo léčeno po dobu 6 měsíců a 36 po dobu delší než 12 měsíců.
Nežádoucí účinky vedoucí k ukončení podávání:
V kontrolovaných klinických studiích fáze 3 u pacientů s parciálními záchvaty byl počet ukončených podávání v důsledku nežádoucích účinků 1,7 %, 4,2 %, respektive 13,7 % u pacientů randomizovaných do skupin, ve kterých byl perampanel podáván v doporučené dávce 4 mg, 8 mg, respektive 12 mg/den, a 1,4 % u pacientů randomizovaných do skupiny s placebem. Nežádoucími účinky, které nejčastěji (>1 % pacientů z celkové skupiny s perampanelem a vyšší výskyt než u placeba) vedly k ukončení podávání, byly závratě a spavost.
V kontrolované klinické studii fáze 3 u pacientů s primárně generalizovanými tonicko-klonickými záchvaty byl počet ukončených podávání v důsledku nežádoucích účinků 4,9 % u pacientů randomizovaných do skupiny, ve které byl perampanel podáván v dávce 8 mg a 1,2 % u pacientů randomizovaných do skupiny s placebem. Nežádoucím účinkem, který nejčastěji (>2 % ve skupině s perampanelem a vyšší výskyt než u placeba) vedl k ukončení léčby, byla závrať.
Tabulka se seznamem nežádoucích účinků
V následující tabulce jsou podle tříd orgánových systémů a frekvence výskytu uvedeny nežádoucí účinky, které byly identifikovány na základě posouzení údajů z kompletní bezpečnostní databáze z klinických studií s přípravkem Fycompa. Ke klasifikaci nežádoucích účinků se použila následující konvence: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100).
V každé kategorii četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Třídy orgánových systémů |
Velmi časté |
Časté |
Méně časté |
|
Poruchy metabolismu a výživy |
Snížená chuť k jídlu Zvýšená chuť k jídlu | ||
|
Psychiatrické poruchy |
Zlost Úzkost Stav zmatenosti |
Sebevražedné představy Pokus o sebevraždu | |
|
Poruchy nervového systému |
Závratě Spavost |
Ataxie Dysartrie Porucha rovnováhy Podrážděnost | |
|
Poruchy oka |
Diplopie Rozostřené vidění | ||
|
Poruchy ucha a labyrintu | |||
|
Gastrointestinální poruchy | |||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | |||
|
Celkové poruchy |
Poruchy chůze Únava | ||
|
Vyšetření |
Nárůst tělesné hmotnosti | ||
|
Poranění, otravy a procedurální komplikace |
Pád |
Pediatrická populace
Na základě databáze klinických hodnocení provedených u 196 dospívajících, kterým byl podáván perampanel v dvojitě zaslepených studiích parciálních záchvatů a primárně generalizovaných tonicko-klonických záchvatů, byl celkový bezpečnostní profil u dospívajících podobný profilu u dospělých, kromě agresivity, která byla pozorována častěji u dospívajících než u dospělých.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Klinické zkušenosti s předávkováním perampanelem u lidí jsou omezené. Ve zprávě o úmyslném předávkování, při kterém mohla dávka být až 264 mg, došlo u pacienta ke změně duševního stavu, agitovanosti a agresivnímu chování. Pacient se zotavil bez dalších následků. Proti účinkům perampanelu neexistuje žádné specifické antidotum. Indikována je všeobecná podpůrná péče o pacienta, včetně sledování vitálních funkcí a klinického stavu pacienta. S ohledem na dlouhý poločas perampanelu mohou být jeho účinky delšího trvání. Vzhledem k nízké clearance ledvinami se nepředpokládá, že by speciální zákroky, jako je forsírovaná diuréza, dialýza nebo hemoperfuze, měly význam.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiepileptika, jiná antiepileptika, ATC kód: N03AX22 Mechanismus účinku
Perampanel je prvním představitelem selektivního, nekompetitivního antagonisty ionotropního glutamátového AMPA receptoru (a-amino-3-hydroxy-5-methyl-4-izoxazolpropionová kyselina) na postsynaptických neuronech. Glutamát je primární excitační neurotransmiter v centrálním nervovém systému a je zapojen do několika neurologických poruch způsobených nadměrnou excitací neuronů. Předpokládá se, že je aktivace AMPA receptorů glutamátem zodpovědná za většinu rychlých excitačních synaptických přenosů v mozku. V in vitro studiích perampanel nekonkuroval AMPA ve vaznosti na AMPA receptor, ale vazba perampanelu byla nahrazena nekompetitivními antagonisty AMPA receptorů, což naznačuje, že perampanel je nekompetitivní antagonista AMPA receptorů. V podmínkách in vitro perampanel inhiboval zvýšení hladiny intracelulárního vápníku indukované AMPA (ale nikoliv zvýšení indukované NMDA). V podmínkách in vivo perampanel výrazně prodlužoval latenci záchvatu u modelu záchvatu indukovaného AMPA.
Přesný mechanismus, jakým perampanel vykonává své antiepileptické účinky u lidí, ještě není zcela objasněn.
Farmakodynamické účinky
Farmakokinetická/farmakodynamická analýza (účinnosti) byla provedena na základě souhrnných údajů ze 3 studií účinnosti u parciálních záchvatů. Kromě toho byla provedena farmakokinetická/farmakodynamická analýza (účinnosti) v rámci jedné studie účinnosti u primárně generalizovaných tonicko-klonických záchvatů. V obou analýzách koreluje expozice perampanelu s poklesem četnosti záchvatů.
Psychomotorický výkon
Jednotlivá dávka i vícečetné dávky 8 mg a 12 mg zhoršily psychomotorický výkon u zdravých dobrovolníků, a to v závislosti na výši dávky. Účinky perampanelu na složité činnosti, jako je schopnost řídit dopravní prostředky, byly aditivní nebo supraaditivní k účinkům alkoholu. Výsledky testování psychomotorického výkonu se vrátily do normálu do 2 týdnů od ukončení podávání perampanelu.
Kognitivní funkce
Ve studii hodnotící účinky perampanelu na ostražitost a paměť u zdravých dobrovolníků pomocí standardní série testů nebyly po podání jednotlivé dávky i vícečetných dávek perampanelu až 12 mg/den zjištěny žádné účinky perampanelu.
Ostražitost a nálada
Úroveň ostražitosti (pozornosti) se u zdravých subjektů, kterým byl podáván perampanel v dávkách 4 až 12 mg/den snižovala v závislosti na výši dávky. Ke zhoršení nálady došlo pouze po podání dávky 12 mg/den. Změny v náladě byly malé a odrážely celkový pokles ostražitosti. Vícečetné podávání perampanelu v dávce 12 mg/den také zvýraznilo účinky alkoholu na bdělost a ostražitost a zvýšilo úroveň zlosti, zmatenosti a deprese, což prokázalo hodnocení s použitím pětibodové stupnice POMS (Profile of Mood State - profil stavu nálady).
Srdeční elektrofyziologie
Perampanel neprodlužoval QTc interval při podávání v denních dávkách do 12 mg/den a nevykazoval žádný s dávkou související nebo klinicky důležitý vliv na dobu trvání QRS.
Klinická účinnost a bezpečnost
Parciální záchvaty
Účinnost perampanelu u parciálních záchvatů byla stanovena ve třech 19týdenních, randomizovaných, dvojitě zaslepených, placebem kontrolovaných, multicentrických studiích s přídatnou terapií u dospělých a dospívajících pacientů. Pacienti měli parciální záchvaty s nebo bez sekundární generalizace, které nebyly adekvátně kontrolovány jedním až třemi souběžně podávanými antiepileptiky. Během 6týdenního základního období museli mít pacienti více než pět záchvatů, přičemž žádné období bez záchvatu nesmělo přesahovat 25 dní. V těchto třech studiích měli pacienti průměrnou dobu trvání epilepsie přibližně 21,06 let. 85,3 % až 89,1 % pacientů souběžně užívalo dvě až tři antiepileptika s nebo bez současné stimulace nervus vagus.
Dvě studie (studie 304 a 305) srovnávaly perampanel v dávkách 8 a 12 mg/den s placebem a třetí studie (studie 306) srovnávala perampanel v dávkách 2, 4 a 8 mg/den s placebem. Ve všech třech studiích, po 6týdenní základní fázi pro stanovení základní frekvence záchvatů před randomizací, byli pacienti randomizováni a byla jim natitrována randomizovaná dávka. Během titrační fáze byla ve všech třech studiích léčba zahájena na dávce 2 mg/den a navyšována týdně o 2 mg/den až na cílovou dávku. Pacienti zaznamenávající netolerovatelné nežádoucí účinky mohli zůstat na stejné dávce nebo jim mohla být dávka snížena na předchozí tolerovanou dávku. Ve všech třech studiích byla titrační fáze následována udržovací fází, která trvala 13 týdnů a během níž byla pacientům podávána stabilní dávka perampanelu.
Souhrnné 50% podíly respondérů měly tyto hodnoty: placebo 19 %, 4 mg 29 %, 8 mg 35 % a 12 mg 35 %. U léčby perampanelem v dávkách 4 mg/den (studie 306), 8 mg/den (studie 304, 305 a 306) a 12 mg/den (studie 304 a 305) byl pozorován statisticky významný účinek na snížení frekvence záchvatů během 28 dní (v léčebné fázi oproti základní fázi) v porovnání se skupinou s placebem. 50% podíl respondérů ve skupinách s dávkou 4 mg, 8 mg a 12 mg činil 23,0 %, 31,5 %, respektive 30,0 % u kombinace s antiepileptiky indukujícími enzym a 33,3 %, 46,5 %, respektive 50,0 % při podávání perampanelu s antiepileptiky, která enzym neindukují. Tyto studie ukazují, že podávání perampanelu jednou denně v dávkách 4 mg až 12 mg bylo jako přídatná léčba u této populace výrazně účinnější než placebo.
Údaje z placebem kontrolovaných studií ukazují, že zlepšení kontroly záchvatů je pozorováno u podávání perampanelu jednou denně v dávce 4 mg a tento přínos se s rostoucí dávkou k 8 mg/den zvyšuje. U dávky 12 mg nebyl u celkové populace pozorován žádný přínos z hlediska účinnosti v porovnání s dávkou 8 mg. Přínos u dávky 12 mg byl pozorován u některých pacientů, kteří dávku 8 mg snáší a jejich odpověď na tuto dávku byla nedostatečná. Klinicky významného snížení frekvence záchvatů v poměru k placebu bylo dosaženo již ve druhém týdnu podávání, když pacienti začali dostávat denní dávku 4 mg.
1,7 až 5,8 % pacientů užívajících perampanel v klinických studiích bylo zcela bez záchvatů v průběhu udržovacího období 3 měsíců v porovnání s 0 % - 1,0 % pacientů s placebem. Nejsou k dispozici žádné údaje o účincích vysazení souběžně podávaných antiepileptik pro dosažení monoterapie s perampanelem.
Otevřené prodloužení studie
Devadesát sedm procent pacientů, kteří dokončili randomizované studie u pacientů s parciálními záchvaty, bylo zařazeno do otevřeného prodloužení studie (n=1186). Pacienti z randomizované studie byli převedeni na perampanel podávaný po dobu 16 týdnů a poté následovalo dlouhé udržovací období (>1 rok). Průměrná výše denní dávky činila 10,05 mg.
Primárně generalizované tonicko-klonické záchvaty
Perampanel jako adjuvantní léčba u pacientů ve věku 12 let a starších s idiopatickou generalizovanou epilepsií, kteří trpí primárně generalizovanými tonicko-klonickými záchvaty, byla stanovena v multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované studii (studie 332). Vhodní pacienti na stabilní dávce 1-3 antiepileptik, u kterých došlo k minimálně 3 primárně generalizovaným tonicko-klonickým záchvatům v průběhu 8týdenního vstupního období, byli randomizováni buď do skupiny užívající perampanel, nebo placebo. Do studie bylo zařazeno celkem 164 pacientů (perampanel N = 82, placebo N = 82). Pacientům byly titrovány dávky po dobu čtyř týdnů až do cílové dávky 8 mg za den nebo do nejvyšší tolerované dávky, a poté jim byla po dobu dalších 13 týdnů podávána poslední dávka, které bylo dosaženo na konci titračního období. Celková doba léčby byla 17 týdnů. Hodnocený lék byl podáván jednou denně.
50% podíl respondérů s primárně generalizovanými tonicko-klonickými záchvaty během udržovacího období byl ve skupině s perampanelem (58,0 %) významně vyšší než ve skupině s placebem (35,8 %), P = 0,0059. 50% podíl respondérů činil 22,2 % u kombinace s antiepileptiky indukujícími enzym a 69,4 % při podávání perampanelu s antiepileptiky, která enzym neindukují. Počet subjektů užívajících perampanel v kombinaci s antiepileptiky, která indukují enzym, byl malý (n = 9). Medián procentuální změny ve frekvenci primárně generalizovaných tonicko-klonických záchvatů za 28 dní během titračního a udržovacího období (celkově) byl vzhledem k prerandomizaci vyšší ve skupině s perampanelem (-76,5 %) než u placeba (-38,4 %), P < 0,0001. Během udržovacího období 3 měsíců bylo 30,9 % (25/81) pacientů užívajících pera^npanel v klinických studiích zcela bez prr^nárně generalizovaných tonicko-klonických záchvatů v porovnání s 12,3 % (10/81) pacientů ve skupině s placebem.
Jiné podtypy idiopatických generalizovaných záchvatů
Účinnost a bezpečnost perampanelu u pacientů s myoklonickými záchvaty nebyla stanovena.
Dostupné údaje jsou pro vyvození jakýchkoli závěrů nedostačující.
Účinnost perampanelu v léčbě záchvatů absence nebyla prokázána.
Ve studii 332 bylo u pacientů s primárně generalizovanými tonicko-klonickými záchvaty, kteří trpěli také souběžnými myoklonickými záchvaty, dosaženo stavu bez záchvatů u 16,7 % (4/24) pacientů ve skupině s perampanelem au 13,0 % (3/23) pacientů ve skupině s placebem; upacientů se souběžnými záchvaty absence bylo dosaženo stavu bez záchvatů u 22,2 % (6/27) pacientů ve skupině s perampanelem au 12,1 % (4/33) pacientů ve skupině s placebem. Stavu bez záchvatů jakéhokoli typu bylo dosaženo u 23,5 % (19/81) pacientů ve skupině s perampanelem a u 4,9 % (4/81) pacientů ve skupině s placebem.
Otevřená prodloužená fáze
Ze 140 pacientů, kteří dokončili studii 332, vstoupilo 114 subjektů (81,4 %) do prodloužené fáze. Pacienti z randomizované studie byli převedeni na perampanel v průběhu 6 týdnů, následovaných dlouhodobou udržovací fází (> 1 rok). V prodloužené fázi mělo 73,7 % subjektů modální denní dávku perampanelu vyšší než 4-8 mg/den a 16,7 % mělo modální denní dávku vyšší než 8-12 mg/den.
Pokles frekvence primárně generalizovaných tonicko-klonických záchvatů nejméně o 50 % byl pozorován u 65,9 % subjektů po 1 roce léčby během prodloužené fáze (vzhledem k počáteční frekvenci záchvatů před léčbou perampanelem). Tyto údaje jsou v souladu s těmi, které vyjadřují procentuální změnu ve frekvenci záchvatů, a prokázaly, že 50% podíl respondérů s primárně generalizovanými tonicko-klonickými záchvaty byl celkově stabilní v čase od 26. týdne až do konce 2. roku. Podobné výsledky byly zaznamenány u všech záchvatů a absencí vs. myoklonických záchvatů, které byly hodnoceny v průběhu času.
Přechod na monoterapii
Nejsou k dispozici žádné údaje o účincích vysazení souběžně podávaných antiepileptik pro dosažení monoterapie perampanelem.
Pediatrická populace
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem Fycompa u jedné nebo více podskupin pediatrické populace u farmakorezistentních epilepsií (epileptické syndromy související s lokalitou a věkem) (informace o použití u dospívajících viz bod 4.2).
Tři pivotní, dvojitě zaslepené, placebem kontrolované studie fáze 3 zahrnovaly 143 dospívajících ve věku 12 až 18 let. Výsledky u těchto dospívajících byly podobné výsledkům pozorovaným u dospělé populace.
Studie 332 zahrnovala 22 dospívajících ve věku 12 až 18 let. Výsledky u těchto dospívajících byly podobné výsledkům pozorovaným u dospělé populace.
5.2 Farmakokinetické vlastnosti
Farmakokinetika perampanelu byla studována u zdravých dospělých subjektů (věkové rozmezí 18 až 79 let), dospělých a dospívajících s parciálními záchvaty a s primárně generalizovanými tonicko-klonickými záchvaty, dospělých s Parkinsonovou chorobou, dospělých s diabetickou neuropatií, dospělých s roztroušenou sklerózou a subjektů s poruchou funkce jater.
Absorpce
Perampanel je po perorálním podání snadno absorbován bez průkazu výrazného metabolismu prvního průchodu („first-pass“ metabolismus).
Perorální suspenze perampanelu je na lačno bioekvivalentní s tabletami perampanelu při přepočtu na stejné dávky v mg. Při podání jedné dávka 12 mg v obou lékových formách současně s jídlem s vysokým obsahem tuku, dosáhnul perampanel v perorální suspenzi ekvivalentní celkové expozice (AUCo_inf), a přibližne o 23 % nižší maximální plazmatické expozice (Cmax) a hodnota (tmax) byla dosažena přibližně o 2 hodiny pozdějí ve srovnání s tabletovou lékovou formou. Populační farmakokinetická analýza ukázala, že při simulovaných podmínkách ustáleného stavu expozice byly hodnoty Cmax a AUC perampanelu v perorální suspenzi bioekvivaletní s tabletovou formou na lačno i po podání jídla.
Hodnoty Cmax byly přibližně o 22 % a AUC přibližně o 13 % nižší při podání jedné dávky 12 mg perampanelu perorální suspenze současně s jídlem s vysokým obsahem tuku ve srovnání s podáním na lačno.
Distribuce
Údaje z in vitro studií naznačují, že se perampanel přibližně z 95 % váže na plazmatické bílkoviny.
In vitro studie ukazují, že perampanel není substrátem ani významným inhibitorem transportních polypeptidů organických aniontů (OATP) 1B1 a 1B3, transportérů organických aniontů (OAT) 1, 2, 3 a 4, transportérů organických kationtů (OCT) 1, 2 a 3 a efluxních transportérů P-glykoproteinu a proteinu rezistence karcinomu prsu (BCRP - Breast Cancer Resistance Protein).
Biotransformace
Perampanel je výrazně metabolizován primární oxidací a následně glukuronidací. Podle výsledků klinické studie u zdravých subjektů, kterým byl podáván radioaktivně značený perampanel, a in vitro studií za použití lidských rekombinantních CYP a lidských jaterních mikrozomů je metabolismus perampanelu zprostředkován především CYP3A.
Po podání radioaktivně značeného perampanelu byla v plazmě pozorována pouze stopová množství perampanelu.
Eliminace
Po podání radioaktivně značené dávky perampanelu buď 8 zdravým dospělým nebo starším subjektům bylo přibližně 30 % radioaktivity zjištěno v moči a 70 % ve stolici. Zjištěnou radioaktivitu v moči a ve stolici primárně tvořila směs oxidovaných a konjugovaných metabolitů. V populační
farmakokinetické analýze souhrnných údajů z 19 studií fáze 1 byla průměrná hodnota ti/2 perampanelu 105 hodin. Při podávání v kombinaci se silným induktorem CYP3A karbamazepinem činila průměrná hodnota t1/2 25 hodin.
Linearita/nelinearita
U zdravých subjektů se plazmatické koncentrace perampanelu zvýšily přímo úměrně k podávaným dávkám v rozmezí 2 až 12 mg. V populační farmakokinetické analýze u pacientů s parciálními záchvaty, kterým byl v placebem kontrolovaných klinických studiích podáván perampanel v dávce do 12 mg/den, a u pacientů s primárně generalizovanými tonicko-klonickými záchvaty, kterým byl podáván perampanel v dávce do 8 mg/den, byl zjištěn lineární vztah mezi dávkou a plazmatickými koncentracemi perampanelu.
Zvláštní populace
Porucha funkce jater
Farmakokinetika perampanelu po podání jediné dávky 1 mg byla hodnocena u 12 pacientů s lehkou a středně těžkou poruchou funkce jater (skóre Child-Pugh A, respektive B) v porovnání s 12 zdravými, demograficky odpovídajícími subjekty. Průměrná zdánlivá clearance nenavázaného perampanelu u subjektů s lehkou poruchou byla 188 ml/min oproti 338 ml/min u odpovídajících kontrolních subjektů, a u subjektů se středně těžkou poruchou byla 120 ml/min oproti 392 ml/min u odpovídajících kontrolních subjektů. Poločas t1/2 byl delší u subjektů s lehkou poruchou (306 h oproti 125 h) a subjektů se středně těžkou poruchou (295 h oproti 139 h) v porovnání s odpovídajícími zdravými subjekty.
Porucha funkce ledvin
Farmakokinetika perampanelu nebyla u pacientů s poruchou funkce ledvin formálně hodnocena. Eliminace perampanelu probíhá téměř výhradně prostřednictvím metabolismu následovaného rychlým vylučováním metabolitů; v plazmě jsou pozorována jen stopová množství metabolitů perampanelu.
V populační farmakokinetické analýze u pacientů s parciálními záchvaty, kteří měli hodnoty clearance kreatininu od 39 do 160 ml/min a kterým byl v placebem kontrolovaných klinických studiích podáván perampanel v dávce do 12 mg/den, nebyla clearance perampanelu ovlivněna clearancí kreatininu.
V populační farmakokinetické analýze u pacientů s primárně generalizovanými tonicko-klonickými záchvaty, kteří dostávali perampanel v dávce do 8 mg/den v klinické studii kontrolované placebem, nebyla clearance perampanelu ovlivněna vstupní hodnotou clearance kreatininu.
Pohlaví
V populační farmakokinetické analýze u pacientů s parciálními záchvaty, kterým byl v placebem kontrolovaných klinických studiích podáván perampanel v dávce do 12 mg/den, a u pacientů
s primárně generalizovanými tonicko-klonickými záchvaty, kteří dostávali perampanel v dávce do 8 mg/den, byla clearance perampanelu u žen (0,54 l/h) o 18 % nižší než u mužů (0,66 l/h).
Starší pacienti (od 65 let)
V populační farmakokinetické analýze u pacientů s parciálními záchvaty (ve věku 12 až 74 let) a
u pacientů s primárně generalizovanými tonicko-klonickými záchvaty (ve věku 12 až 58 let), kterým byl v placebem kontrolovaných klinických studiích podáván perampanel v dávce do 8 nebo 12 mg/den, nebyl zjištěn žádný výrazný vliv věku na clearanci perampanelu. U starších pacientů není nutná úprava dávky (viz bod 4.2).
Pediatrická populace
V populační farmakokinetické analýze u dospívajících pacientů v klinických studiích fáze 3 nebyly zaznamenány žádné významné rozdíly mezi touto a celkovou populací.
Studie lékových interakcí
In vitro hodnocení lékových interakcí Inhibice enzymů metabolizujících léky
U lidských jaterních mikrozomů měl perampanel (30 ^mol/l) z hlavních jaterních enzymů CYP a UGT slabý inhibiční účinek na CYP2C8 a UGT1A9.
Indukce enzymů metabolizujících léky
V porovnání s pozitivními kontrolami (včetně fenobarbitalu a rifampicinu) bylo zjištěno, že perampanel z hlavních jaterních enzymů CYP a UGT v kultuře lidských hepatocytů slabě indukuje CYP2B6 (30 ^mol/l) a CYP3A4/5 (>3 ^mol/l).
5.3 Předklinické údaje vztahující se k bezpečnosti
Nežádoucí účinky, které nebyly pozorovány v klinických studiích, avšak vyskytly se ve studiích na zvířatech při expozici podobné expozici při klinickém podávání, a které mohou být důležité pro klinické použití:
Ve studii fertility u potkanů byly u samic při maximálních tolerovaných dávkách (30 mg/kg) pozorovány prodloužené a nepravidelné estrální cykly. Tyto změny však neměly vliv na fertilitu ani časný vývoj embrya. Nebyly zaznamenány žádné účinky na fertilitu samců.
Vylučování do mateřského mléka bylo u potkanů měřeno 10 dní po vrhu. Maximální hodnoty byly dosaženy po 1 hodině a byly 3,65krát vyšší než hladiny v plazmě.
Ve studii toxicity v prenatálním a postnatálním vývoji u potkanů byly při dávkách toxických pro matku zaznamenány abnormality při vrhu a kojení a stoupl počet narození mrtvých mláďat. Behaviorální a reprodukční vývoj mláďat nebyl ovlivněn, ale některé parametry fyzického vývoje vykazovaly zpoždění, které bylo pravděpodobně sekundárním důsledkem farmakologických účinků perampanelu na CNS. Průchod placentární bariérou byl relativně nízký - v plodu bylo zjištěno 0,09 % nebo méně podané dávky.
Neklinické údaje neodhalily genotoxické účinky ani kancerogenní potenciál perampanelu. Podávání maximálních tolerovaných dávek potkanům a opicím mělo za následek farmakologické klinické příznaky u CNS a nižší konečnou tělesnou hmotnost. V klinické patologii nebo histopatologii nebyly zjištěny žádné změny, které by bylo možné přímo připisovat perampanelu.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Krystalizující sorbitol (E420)
Mikrokrystalická celulosa (E460)
Sodná sůl karmelosy (E466)
Poloxamer 188
Simetikonová emulze 30 % obsahující čištěnou vodu, silikonový olej, polysorbát 65, methylcelulosu, silikagel, makrogol-stearát, kyselinu sorbovou, kyselinu benzoovou a kyselinu sírovou Bezvodá kyselina citronová (E330)
Natrium-benzoát (E211)
Čištěná voda
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
Po prvním otevření: 90 dní.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Polyethylentereftalátová (PET) lahev s polypropylenovým (PP) dětským bezpečnostním uzávěrem; lahev obsahuje 340 ml suspenze ve vnější papírové krabičce.
Krabička obsahuje jednu lahev, dvě 20ml stříkačky pro perorální podání se stupnicí a LDPE zatlačovací adaptér lahve (PIBA). Stříkačky pro perorální podání jsou opatřeny stupnicí po 0,5 ml.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky na likvidaci.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Velká Británie
tel: +44 (0)208 600 1400
fax: +44 (0)208 600 1401
e-mail: EUmedinfo@eisai.net
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/12/776/024
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 23. července 2012
10. DATUM REVIZE TEXTU {MM.RRRR}
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Eisai Manufacturing Ltd.
European Knowledge Centre Mosquito Way Hatfield, Herts AL10 9SN Velká Británie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Fycompa 2 mg potahované tablety Perampanelum
2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK
Jedna tableta obsahuje perampanelum 2 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje laktózu: více informací naleznete v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
7 potahovaných tablet 28 potahovaných tablet 98 potahovaných tablet
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Perorální podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/12/776/001
EU/1/12/776/017
EU/1/12/776/018
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Fycompa 2 mg
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Fycompa 2 mg tablety Perampanelum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Eisai
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Fycompa 4 mg potahované tablety Perampanelum
2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK
Jedna tableta obsahuje perampanelum 4 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje laktózu: více informací naleznete v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
7 potahovaných tablet 28 potahovaných tablet 84 potahovaných tablet 98 potahovaných tablet
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Perorální podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/12/776/002
EU/1/12/776/003
EU/1/12/776/004
EU/1/12/776/019
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Fycompa 4 mg
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Fycompa 4 mg tablety Perampanelum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Eisai
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Fycompa 6 mg potahované tablety Perampanelum
2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK
Jedna tableta obsahuje perampanelum 6 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje laktózu: více informací naleznete v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
7 potahovaných tablet 28 potahovaných tablet 84 potahovaných tablet 98 potahovaných tablet
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Perorální podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/12/776/005
EU/1/12/776/006
EU/1/12/776/007
EU/1/12/776/020
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Fycompa 6 mg
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Fycompa 6 mg tablety Perampanelum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Eisai
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Fycompa 8 mg potahované tablety Perampanelum
2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK
Jedna tableta obsahuje perampanelum 8 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje laktózu: více informací naleznete v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
7 potahovaných tablet 28 potahovaných tablet 84 potahovaných tablet 98 potahovaných tablet
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Perorální podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/12/776/008
EU/1/12/776/009
EU/1/12/776/010
EU/1/12/776/021
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Fycompa 8 mg
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Fycompa 8 mg tablety Perampanelum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Eisai
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Fycompa 10 mg potahované tablety Perampanelum
2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK
Jedna tableta obsahuje perampanelum 10 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje laktózu: více informací naleznete v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
7 potahovaných tablet 28 potahovaných tablet 84 potahovaných tablet 98 potahovaných tablet
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Perorální podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/12/776/011
EU/1/12/776/012
EU/1/12/776/013
EU/1/12/776/022
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Fycompa 10 mg
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Fycompa 10 mg tablety Perampanelum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Eisai
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Fycompa 12 mg potahované tablety Perampanelum
2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK
Jedna tableta obsahuje perampanelum 12 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje laktózu: více informací naleznete v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
7 potahovaných tablet 28 potahovaných tablet 84 potahovaných tablet 98 potahovaných tablet
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Perorální podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/12/776/014
EU/1/12/776/015
EU/1/12/776/016
EU/1/12/776/023
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Fycompa 12 mg
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Fycompa 12 mg tablety Perampanelum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Eisai
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Fycompa 0,5 mg perorální suspenze perampanelum
2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK
Jeden ml perorální suspenze obsahuje perampanelum 0,5 mg. Jedna lahev (340 ml) obsahuje perampanelum 170 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje sorbitol: více informací naleznete v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Perorální suspenze 340 ml.
1 lahev
2 stříkačky pro perorální podání
1 zatlačovací adaptér lahve (PIBA)
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Před použitím protřepejte nejméně po dobu 5 sekund. Perorální podání Datum otevření:
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
Po prvním otevření: použijte během 90 dní.
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eisai Europe Limited
European Knowledge Centre
Mosquito Way
Hatfield
Hertfordshire
AL10 9SN
Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/12/776/024
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Fycompa 0,5 mg/ml
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
Fycompa 2 mg, 4 mg, 6 mg, 8 mg, 10 mg a 12 mg potahované tablety
Perampanelum
'VTento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je přípravek Fycompa a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Fycompa užívat
3. Jak se přípravek Fycompa užívá
4. Možné nežádoucí účinky
5. Jak přípravek Fycompa uchovávat
6. Obsah balení a další informace
1. Co je přípravek Fycompa a k čemu se používá
Přípravek Fycompa obsahuje lék zvaný perampanel. Patří do skupiny léků zvaných antiepileptika.
Tyto léky se používají k léčbě epilepsie - stavů, kdy pacient trpí opakovanými záchvaty (křečemi).
Lékař Vám jej předepsal ke snížení počtu záchvatů.
Přípravek Fycompa se používá v kombinaci s dalšími antiepileptiky k léčbě určitých forem epilepsie u
lidí ve věku od 12 let.
- Používá se k léčbě záchvatů, které postihují jednu část Vašeho mozku (zvaných „parciální záchvaty“).
- Tyto parciální záchvaty mohou (ale nemusí) být následovány záchvatem postihujícím celý Váš mozek (zvaným „sekundární generalizace“).
- Používá se také k léčbě určitých záchvatů, které od samého začátku postihují celý mozek (takzvané „generalizované záchvaty“) a způsobují křeče nebo zírání do prázdna.
2. Čemu musíte věnovat pozornost, než začnete přípravek Fycompa užívat Neužívejte přípravek Fycompa:
- jestliže jste alergický(á) na perampanel nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Jestliže máte jaterní problémy nebo středně těžké až těžké ledvinové problémy, poraďte se před užitím přípravku Fycompa se svým lékařem nebo lékárníkem.
Přípravek Fycompa byste neměl(a) užívat, jestliže máte těžké jaterní problémy nebo středně těžké až těžké ledvinové problémy.
Před užitím tohoto léku byste měl(a) svého lékaře informovat, pokud jste v minulosti byl(a) závislý(á) na alkoholu nebo lécích/drogách.
- Přípravek Fycompa u Vás může vyvolávat závratě nebo ospalost, především na začátku léčby.
- Přípravek Fycompa může zvýšit Vaši náchylnost k pádům, především pokud jste starší osoba; může to být důsledek Vašeho onemocnění.
- Přípravek Fycompa může vyvolat agresivitu, zlobu nebo násilí. Může u Vás také vyvolat neobvyklé nebo extrémní změny chování nebo nálady.
Pokud u Vás nastane jakákoli z těchto situací, informujte svého lékaře nebo lékárníka.
U malého počtu lidí léčených antiepileptiky se objevily myšlenky na sebepoškozování nebo sebevraždu. Pokud se u Vás tyto myšlenky kdykoli objeví, okamžitě informujte svého lékaře.
Jestliže po užití přípravku Fycompa zaznamenáte kterýkoli z výše uvedených účinků (nebo pokud si nejste jistý(á)), poraďte se se svým lékařem nebo lékárníkem.
Děti
Přípravek Fycompa se nedoporučuje u dětí do 12 let. Bezpečnost a účinnost v této věkové skupině nejsou dosud známy.
Další léčivé přípravky a přípravek Fycompa
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat. To platí i o lécích, které jsou dostupné bez lékařského předpisu, a rostlinných přípravcích. Užívání přípravku Fycompa s určitými jinými léky může způsobovat nežádoucí účinky nebo ovlivňovat jejich fungování. Užívání jiných léků nezahajujte ani neukončujte bez předchozí konzultace se svým lékařem nebo lékárníkem.
- Jiná antiepileptika, jako je karbamazepin, oxkarbazepin a fenytoin, která se používají k léčbě záchvatů, mohou ovlivnit působení přípravku Fycompa. Informujte svého lékaře, pokud tyto léky užíváte nebo jste v nedávné době užíval(a), jelikož může být nutná úprava Vaší dávky.
- Felbamát (lék používaný k léčbě epilepsie) může také ovlivnit působení přípravku Fycompa. Informujte svého lékaře, pokud tento lék užíváte nebo jste v nedávné době užíval(a), jelikož může být nutná úprava Vaší dávky.
- Midazolam (lék používaný k zastavení delších, akutních (náhlých) záchvatů, k sedaci (zklidnění) a při problémech se spánkem) může být ovlivněn působením přípravku Fycompa. Informujte svého lékaře, pokud midazolam užíváte, jelikož může být nutná úprava Vaší dávky.
- Některé další léky, jako je rifampicin (lék používaný k léčbě bakteriálních infekcí), hypericum (třezalka tečkovaná) (lék používaný k léčbě mírné úzkosti) a ketokonazol (lék používaný
k léčbě plísňových infekcí), mohou ovlivnit působení přípravku Fycompa. Informujte svého lékaře, pokud tyto léky užíváte nebo jste v nedávné době užíval(a), jelikož může být nutná úprava Vaší dávky.
- Perorální antikoncepce (také zvaná „hormonální antikoncepce“ užívaná ústy)
Informujte svého lékaře, pokud užíváte hormonální antikoncepci. Přípravek Fycompa může snižovat účinnost některých druhů hormonální antikoncepce, jako je například levonorgestrel. Během užívání přípravku Fycompa byste měla používat jiné formy spolehlivé a účinné antikoncepce (například kondom nebo nitroděložní tělísko). V dodržování tohoto opatření byste měla pokračovat po dobu jednoho měsíce po ukončení léčby. Poraďte se se svým lékařem o tom, jaký druh antikoncepce by pro Vás mohl být vhodný.
Přípravek Fycompa s alkoholem
Před požitím alkoholu se poraďte se svým lékařem. Ke konzumaci alkoholu během užívání antiepileptik, včetně přípravku Fycompa, je nutné přistupovat s opatrností.
- Konzumace alkoholu během užívání přípravku Fycompa může snížit Vaši pozornost a ovlivnit Vaši schopnost řídit nebo obsluhovat přístroje a stroje.
- Konzumace alkoholu během užívání přípravku Fycompa může také zhoršit Vaše pocity zlosti, zmatenosti nebo smutku.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat. Nepřerušujte léčbu bez předchozí konzultace se svým lékařem.
- Podávání přípravku Fycompa se v těhotenství nedoporučuje.
- Během léčby přípravkem Fycompa musíte používat spolehlivou metodu antikoncepce, abyste zamezila otěhotnění. V dodržování tohoto opatření byste měla pokračovat po dobu jednoho měsíce po ukončení léčby. Informujte svého lékaře, pokud užíváte hormonální antikoncepci. Přípravek Fycompa může snižovat účinnost některých druhů hormonální antikoncepce, jako je například levonorgestrel. Během užívání přípravku Fycompa byste měla používat jiné spolehlivé a účinné formy antikoncepce (například kondom nebo nitroděložní tělísko). Toto opatření byste měla dodržovat také po dobu jednoho měsíce po ukončení léčby. Poraďte se se svým lékařem o tom, jaký druh antikoncepce by pro Vás mohl být vhodný.
Není známo, zda mohou složky přípravku Fycompa přecházet do mateřského mléka.
Váš lékař zváží možné přínosy a rizika pro Vaše dítě v souvislosti s užíváním přípravku Fycompa během kojení.
Řízení dopravních prostředků a obsluha strojů
Neřiďte dopravní prostředek ani neobsluhujte žádné stroje, dokud nebudete vědět, jaký má na Vás přípravek Fycompa vliv.
O vlivu epilepsie na řízení dopravních prostředků a obsluhu strojů se musíte poradit se svým lékařem.
- Přípravek Fycompa u Vás může vyvolávat závratě nebo ospalost, především na začátku léčby. Pokud k tomu dojde, neřiďte dopravní prostředek ani neobsluhujte žádné přístroje nebo stroje.
- Konzumace alkoholu během užívání přípravku Fycompa může tyto účinky ještě zhoršit.
Přípravek Fycompa obsahuje laktózu
Přípravek Fycompa obsahuje laktózu (typ cukru). Pokud Vám Váš lékař řekl, že nesnášíte některé cukry, poraďte se se svým lékařem, než začnete tento léčivý přípravek užívat.
3. Jak se přípravek Fycompa užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Jaké množství léku užít
Doporučená počáteční dávka přípravku je 2 mg jednou denně před spaním.
- Váš lékař může tuto dávku zvýšit v krocích po 2 mg na udržovací dávku od 4 mg do 12 mg, v závislosti na Vaší odpovědi na léčbu.
- Jestliže máte lehké nebo středně těžké jaterní problémy, neměla by Vaše dávka přesahovat 8 mg/den a mezi jednotlivými zvýšeními dávky má být interval nejméně 2 týdny.
- Neužívejte více přípravku Fycompa, než Vám doporučil Váš lékař. Může trvat několik týdnů, než pro Vás bude nalezena správná výše dávky přípravku Fycompa.
Jak se lék užívá
Tabletu polkněte celou a zapijte sklenicí vody. Přípravek Fycompa můžete užívat s jídlem i bez jídla. Tabletu nekousejte, nedrťte ani nedělte. Tablety nelze přesně rozdělit, neboť nemají půlicí rýhu.
Jestliže jste užil(a) více přípravku Fycompa, než jste měl(a)
Jestliže jste užil(a) více přípravku Fycompa, než jste měl(a), okamžitě informujte svého lékaře. Můžete zaznamenat zmatenost, neklid a agresivní chování.
Jestliže jste zapomněl(a) užít přípravek Fycompa
- Jestliže jste zapomněl(a) užít tabletu, počkejte na příští dávku a poté pokračujte v obvyklém dávkování.
- Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
- Jestliže jste vynechal(a) méně než 7 dní léčby přípravkem Fycompa, pokračujte v užívání denní tablety podle původních pokynů svého lékaře.
- Jestliže jste vynechal(a) více než 7 dní léčby přípravkem Fycompa, ihned informujte svého lékaře.
Jestliže jste přestal(a) užívat přípravek Fycompa
Přípravek Fycompa užívejte tak dlouho, jak Vám to doporučil Váš lékař. Přípravek nepřestávejte užívat, pokud o tom nerozhodl Váš lékař. Lékař může snižovat Vaši dávku, aby zamezil návratu nebo zhoršení Vašich záchvatů.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
U malého počtu lidí léčených antiepileptiky se objevily myšlenky na sebepoškozování nebo sebevraždu. Pokud se u Vás tyto myšlenky kdykoli objeví, okamžitě informujte svého lékaře.
Velmi časté (mohou postihnout více než 1 uživatele z 10) nežádoucí účinky jsou:
- pocit závratí
- pocit ospalosti (dřímota nebo spavost).
Časté (mohou postihnout více než 1 uživatele ze 100) nežádoucí účinky jsou:
- zvýšená nebo snížená chuť k jídlu, nárůst tělesné hmotnosti
- agresivita, zlost, podráždění, úzkost nebo zmatenost
- problémy s chůzí nebo jiné problémy s rovnováhou (ataxie, porucha chůze, porucha rovnováhy)
- pomalá řeč (dysartrie)
- rozostřené vidění nebo dvojité vidění (diplopie)
- točení hlavy (závrať)
- nevolnost (pocit na zvracení)
- bolest zad
- pocit velké únavy
- pády.
Méně časté (mohou postihnout více než 1 uživatele z 1000) nežádoucí účinky jsou:
- myšlenky na sebezraňování nebo na ukončení vlastního života (sebevražedné myšlenky), pokus o ukončení vlastního života (pokus o sebevraždu)
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Fycompa uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a blistru. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Tento přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Fycompa obsahuje
Léčivou látkou je perampanelum. Jedna potahovaná tableta obsahuje perampanelum 2 mg, 4 mg,
6 mg, 8 mg, 10 mg nebo 12 mg.
Dalšími složkami jsou:
Jádro tablety (2mg a 4mg tablety):
Monohydrát laktózy, částečně substituovaná hyprolóza, povidon, magnesium-stearát (E470b)
Jádro tablety (6mg, 8mg, 10mg a 12mg tablety)
Monohydrát laktózy, částečně substituovaná hyprolóza, povidon, mikrokrystalická celulóza, magnesium-stearát (E470b)
Potah tablety (2mg, 4mg, 6mg, 8mg, 10mg a 12mg tablety)
Hypromelóza 2910, mastek, makrogol 8000, oxid titaničitý (E171), barviva*
*Barvivy jsou:
2mg tableta: žlutý oxid železitý (E172), červený oxid železitý (E172)
4mg tableta: červený oxid železitý (E172)
6mg tableta: červený oxid železitý (E172)
8mg tableta: červený oxid železitý (E172), černý oxid železitý (E172)
10mg tableta: žlutý oxid železitý (E172), hlinitý lak indigokarmínu (E132)
12mg tableta: hlinitý lak indigokarmínu (E132)
Jak přípravek Fycompa vypadá a co obsahuje toto balení
Všechny síly přípravku Fycompa obsahují kulaté, bikonvexní potahované tablety 2mg: oranžové, s označením E275 na jedné straně a číslem 2 na druhé straně 4mg: červené, s označením E277 na jedné straně a číslem 4 na druhé straně 6mg: růžové, s označením E294 na jedné straně a číslem 6 na druhé straně 8mg: nachové, s označením E295 na jedné straně a číslem 8 na druhé straně 10mg: zelené, s označením E296 na jedné straně a číslem 10 na druhé straně 12mg: modré, s označením E297 na jedné straně a číslem 12 na druhé straně
Přípravek Fycompa je k dispozici v následujících baleních:
2mg tableta - balení po 7, 28 a 98
4mg, 6mg, 8mg, 10mg, 12mg tablety - balení po 7, 28, 84 a 98 Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Eisai Europe Limited, European Knowledge Centre, Mosquito Way, Hatfield, Hertfordshire, AL10
9SN, Velká Británie
e-mail: EUmedinfo@eisai.net
Výrobce
Eisai Manufacturing Limited, European Knowledge Centre, Mosquito Way, Hatfield, Hertfordshire, AL10 9SN, Velká Británie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien Eisai SA/NV Tél/Tel: + 32 (0)2 502 58 04 |
Luxembourg/Luxemburg Eisai SA/NV Tél/Tel: + 32 (0)2 502 58 04 (Belgique/Belgien) |
|
BtnrapHH Eisai Ltd. Ten.: +44 (0) 20 8600 1400 (06egHHeHO Kpancrao) |
Magyarország Eisai Ltd. Tel.: +44 (0) 20 8600 1400 Egyesult Királyság |
|
Česká republika Eisai GesmbH organizačni složka Tel.: + 420 242 485 839 |
Malta Associated Drug Co. Ltd Tel:+356 2277 8000 |
|
Danmark Eisai AB Tlf: + 46 (0) 8 501 01 600 (Sverige) |
Nederland Eisai B.V. Tél/Tel: + 31 (0) 900 575 3340 |
|
Deutschland Eisai GmbH Tel: + 49 (0) 69 66 58 50 |
Norge Eisai AB Tlf: + 46 (0) 8 501 01 600 (Sverige) |
|
Eesti Eisai Ltd. Tel: +44 (0) 20 8600 1400 (Ůhendkuningriik) |
Osterreich Eisai GesmbH Tel: + 43 (0) 1 535 1980-0 |
|
EXXáSa Arriani Pharmaceuticals S.A. T^: +30 210 668 3000 |
Polska Eisai Ltd. Tel.: + 44 (0) 20 8600 1400 (Wielka Brytania) |
|
Espaňa Eisai Farmacéutica, S.A. Tel: + (34) 91 455 94 55 |
Portugal Eisai Farmacéutica, Unipessoal Lda Tel: + 351 214 875 540 |
|
France Eisai SAS Tél: + (33) 1 47 67 00 05 |
Románia Eisai Ltd. Tel: +44 (0) 20 8600 1400 (Marea Britanie) |
|
Hrvatska Eisai Ltd. Tel: + 44 (0)20 8600 1400 (Velika Britanija) |
Slovenija Eisai Ltd. Tel: +44 (0) 20 8600 1400 (Velika Britanija) |
Ireland
Eisai Ltd
Tel: + 44 (0)20 8600 1400 (United Kingdom)
Ísland
Eisai AB
Sími: + 46 (0)8 501 01 600 (Svífrjóó)
Italia
Eisai S.r.l.
Tel: + 39 02 5181401 Kúnpoq
Arriani Pharmaceuticals S.A. T^: +30 210 668 3000 (EAláSa)
Latvija
Eisai Ltd.
Tel: +44 (0) 20 8600 1400 (Liebritanija)
Lietuva
Eisai Ltd.
Tel. +44 (0) 20 8600 1400 (Jungtiné Karalysté)
Slovenská republika
Eisai GesmbH organizačni složka Tel.: + 420 242 485 839 (Česká republika)
Suomi/Finland
Eisai AB
Puh/Tel: + 46 (0) 8 501 01 600 (Ruotsi)
Sverige
Eisai AB
Tel: + 46 (0) 8 501 01 600 United Kingdom Eisai Ltd.
Tel: + 44 (0) 20 8600 1400
Tato příbalová informace byla naposledy revidována {MM.RRRR}.
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Příbalová informace: informace pro uživatele
Fycompa 0,5 mg/ml perorální suspenze
Perampanelum
'VTento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je přípravek Fycompa a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Fycompa užívat
3. Jak se přípravek Fycompa užívá
4. Možné nežádoucí účinky
5. Jak přípravek Fycompa uchovávat
6. Obsah balení a další informace
1. Co je přípravek Fycompa a k čemu se používá
Přípravek Fycompa obsahuje lék zvaný perampanel. Patří do skupiny léků zvaných antiepileptika.
Tyto léky se používají k léčbě epilepsie - stavů, kdy pacient trpí opakovanými záchvaty (křečemi).
Lékař Vám jej předepsal ke snížení počtu záchvatů.
Přípravek Fycompa se používá v kombinaci s dalšími antiepileptiky k léčbě určitých forem epilepsie u
lidí ve věku od 12 let.
- Používá se k léčbě záchvatů, které postihují jednu část Vašeho mozku (zvaných „parciální záchvaty“).
- Tyto parciální záchvaty mohou (ale nemusí) být následovány záchvatem postihujícím celý Váš mozek (zvaným „sekundární generalizace“).
- Používá se také k léčbě určitých záchvatů, které od samého začátku postihují celý mozek (takzvané „generalizované záchvaty“) a způsobují křeče nebo zírání do prázdna.
2. Čemu musíte věnovat pozornost, než začnete přípravek Fycompa užívat Neužívejte přípravek Fycompa:
- jestliže jste alergický(á) na perampanel nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Jestliže máte jaterní problémy nebo středně těžké až těžké ledvinové problémy, poraďte se před užitím přípravku Fycompa se svým lékařem nebo lékárníkem.
Přípravek Fycompa byste neměl(a) užívat, jestliže máte těžké jaterní problémy nebo středně těžké až těžké ledvinové problémy.
Před užitím tohoto léku byste měl(a) svého lékaře informovat, pokud jste v minulosti byl(a) závislý(á) na alkoholu nebo lécích/drogách.
- Přípravek Fycompa u Vás může vyvolávat závratě nebo ospalost, především na začátku léčby.
- Přípravek Fycompa může zvýšit Vaši náchylnost k pádům, především pokud jste starší osoba; může to být důsledek Vašeho onemocnění.
- Přípravek Fycompa může vyvolat agresivitu, zlobu nebo násilí. Může u Vás také vyvolat neobvyklé nebo extrémní změny chování nebo nálady.
Pokud u Vás nastane jakákoli z těchto situací, informujte svého lékaře nebo lékárníka.
U malého počtu lidí léčených antiepileptiky se objevily myšlenky na sebepoškozování nebo sebevraždu. Pokud se u Vás tyto myšlenky kdykoli objeví, okamžitě informujte svého lékaře.
Jestliže po užití přípravku Fycompa zaznamenáte kterýkoli z výše uvedených účinků (nebo pokud si nejste jistý(á)), poraďte se se svým lékařem nebo lékárníkem.
Děti
Přípravek Fycompa se nedoporučuje u dětí do 12 let. Bezpečnost a účinnost v této věkové skupině nejsou dosud známy.
Další léčivé přípravky a přípravek Fycompa
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat. To platí i o lécích, které jsou dostupné bez lékařského předpisu, a rostlinných přípravcích. Užívání přípravku Fycompa s určitými jinými léky může způsobovat nežádoucí účinky nebo ovlivňovat jejich fungování. Užívání jiných léků nezahajujte ani neukončujte bez předchozí konzultace se svým lékařem nebo lékárníkem.
- Jiná antiepileptika, jako je karbamazepin, oxkarbazepin a fenytoin, která se používají k léčbě záchvatů, mohou ovlivnit působení přípravku Fycompa. Informujte svého lékaře, pokud tyto léky užíváte nebo jste v nedávné době užíval(a), jelikož může být nutná úprava Vaší dávky.
- Felbamát (lék používaný k léčbě epilepsie) může také ovlivnit působení přípravku Fycompa. Informujte svého lékaře, pokud tento lék užíváte nebo jste v nedávné době užíval(a), jelikož může být nutná úprava Vaší dávky.
- Midazolam (lék používaný k zastavení delších, akutních (náhlých) záchvatů, k sedaci (zklidnění) a při problémech se spánkem) může být ovlivněn působením přípravku Fycompa. Informujte svého lékaře, pokud midazolam užíváte, jelikož může být nutná úprava Vaší dávky.
- Některé další léky, jako je rifampicin (lék používaný k léčbě bakteriálních infekcí), hypericum (třezalka tečkovaná) (lék používaný k léčbě mírné úzkosti) a ketokonazol (lék používaný
k léčbě plísňových infekcí), mohou ovlivnit působení přípravku Fycompa. Informujte svého lékaře, pokud tyto léky užíváte nebo jste v nedávné době užíval(a), jelikož může být nutná úprava Vaší dávky.
- Perorální antikoncepce (také zvaná „hormonální antikoncepce“ užívaná ústy)
Informujte svého lékaře, pokud užíváte hormonální antikoncepci. Přípravek Fycompa může snižovat účinnost některých druhů hormonální antikoncepce, jako je například levonorgestrel. Během užívání přípravku Fycompa byste měla používat jiné formy spolehlivé a účinné antikoncepce (například kondom nebo nitroděložní tělísko). V dodržování tohoto opatření byste měla pokračovat po dobu jednoho měsíce po ukončení léčby. Poraďte se se svým lékařem o tom, jaký druh antikoncepce by pro Vás mohl být vhodný.
Přípravek Fycompa s alkoholem
Před požitím alkoholu se poraďte se svým lékařem. Ke konzumaci alkoholu během užívání antiepileptik, včetně přípravku Fycompa, je nutné přistupovat s opatrností.
- Konzumace alkoholu během užívání přípravku Fycompa může snížit Vaši pozornost a ovlivnit Vaši schopnost řídit nebo obsluhovat přístroje a stroje.
- Konzumace alkoholu během užívání přípravku Fycompa může také zhoršit Vaše pocity zlosti, zmatenosti nebo smutku.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat. Nepřerušujte léčbu bez předchozí konzultace se svým lékařem.
- Podávání přípravku Fycompa se v těhotenství nedoporučuje.
- Během léčby přípravkem Fycompa musíte používat spolehlivou metodu antikoncepce, abyste zamezila otěhotnění. V dodržování tohoto opatření byste měla pokračovat po dobu jednoho měsíce po ukončení léčby. Informujte svého lékaře, pokud užíváte hormonální antikoncepci. Přípravek Fycompa může snižovat účinnost některých druhů hormonální antikoncepce, jako je například levonorgestrel. Během užívání přípravku Fycompa byste měla používat jiné spolehlivé a účinné formy antikoncepce (například kondom nebo nitroděložní tělísko). Toto opatření byste měla dodržovat také po dobu jednoho měsíce po ukončení léčby. Poraďte se se svým lékařem o tom, jaký druh antikoncepce by pro Vás mohl být vhodný.
Není známo, zda mohou složky přípravku Fycompa přecházet do mateřského mléka.
Váš lékař zváží možné přínosy a rizika pro Vaše dítě v souvislosti s užíváním přípravku Fycompa během kojení.
Řízení dopravních prostředků a obsluha strojů
Neřiďte dopravní prostředek ani neobsluhujte žádné stroje, dokud nebudete vědět, jaký má na Vás přípravek Fycompa vliv.
O vlivu epilepsie na řízení dopravních prostředků a obsluhu strojů se musíte poradit se svým lékařem.
- Přípravek Fycompa u Vás může vyvolávat závratě nebo ospalost, především na začátku léčby. Pokud k tomu dojde, neřiďte dopravní prostředek ani neobsluhujte žádné přístroje nebo stroje.
- Konzumace alkoholu během užívání přípravku Fycompa může tyto účinky ještě zhoršit.
Přípravek Fycompa obsahuje sorbitol
Pokud Vám Váš lékař řekl, že nesnášíte některé cukry, poraďte se se svým lékařem, než začnete přípravek Fycompa užívat.
Používání přípravku Fycompa s dalšími antiepileptickými léčivými přípravky, které obsahují sorbitol, může ovlivnit jejich účinnost. Informujte svého lékaře nebo lékárníka, zda užíváte nějaké další antiepileptické léčivé přípravky se sorbitolem.
3. Jak se přípravek Fycompa užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Jaké množství léku užít
Doporučená počáteční dávka přípravku je 2 mg (4 ml) jednou denně před spaním.
- Váš lékař může tuto dávku zvýšit v krocích po 2 mg (4 ml) na udržovací dávku od 4 mg (8 ml) do 12 mg (24 ml), v závislosti na Vaší odpovědi na léčbu.
- Jestliže máte lehké nebo středně těžké jaterní problémy, neměla by Vaše dávka přesahovat 8 mg/den a mezi jednotlivými zvýšeními dávky má být interval nejméně 2 týdny.
- Neužívejte více přípravku Fycompa, než Vám doporučil Váš lékař. Může trvat několik týdnů, než pro Vás bude nalezena správná výše dávky přípravku Fycompa.
Jak se lék užívá
Přípravek Fycompa je určen k perorálnímu podání (ústy). Přípravek Fycompa můžete užívat s jídlem i bez jídla, avšak měl(a) byste jej užívat vždy stejným způsobem. Například pokud se rozhodnete užít přípravek Fycompa s jídlem, užívejte ho vždy s jídlem.
Pro dávkování prosím použijte přiloženou stříkačku pro perorální podání a adaptér.
Pokyny k použití stříkačky pro perorální podání a adaptéru jsou uvedeny níže:
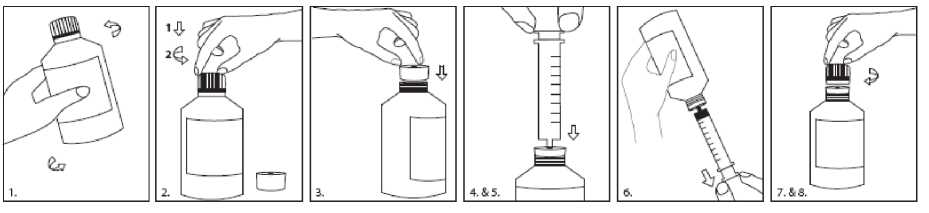
1. Před použitím protřepejte nejméně po dobu 5 sekund.
2. Zamáčkněte víčko a pootočte jím. Lahev se otevře.
3. Zamáčkněte adaptér do hrdla lahve, až pevně zapadne.
4. Zatlačte píst stříkačky pro perorální podání úplně dolů.
5. Zasuňte stříkačku pro perorální podání co nejdál do otvoru adaptéru.
6. Otočte lahev dnem vzhůru a natáhněte předepsané množství přípravku Fycompa.
7. Otočte lahev zpět a vyjměte stříkačku pro perorální podání.
8. Nechte adaptér na místě a uzavřete lahev víčkem. Umyjte stříkačku pro perorální podání čistou vodou a pořádně ji osušte.
Jestliže jste užil(a) více přípravku Fycompa, než jste měl(a)
Jestliže jste užil(a) více přípravku Fycompa, než jste měl(a), okamžitě informujte svého lékaře. Můžete zaznamenat zmatenost, neklid a agresivní chování.
Jestliže jste zapomněl(a) užít přípravek Fycompa
- Jestliže jste zapomněl(a) užít přípravek Fycompa, počkejte na příští dávku a poté pokračujte v obvyklém dávkování.
- Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
- Jestliže jste vynechal(a) méně než 7 dní léčby přípravkem Fycompa, pokračujte v užívání denní dávky podle původních pokynů svého lékaře.
- Jestliže jste vynechal(a) více než 7 dní léčby přípravkem Fycompa, ihned informujte svého lékaře.
Jestliže jste přestal(a) užívat přípravek Fycompa
Přípravek Fycompa užívejte tak dlouho, jak Vám to doporučil Váš lékař. Přípravek nepřestávejte užívat, pokud o tom nerozhodl Váš lékař. Lékař může snižovat Vaši dávku, aby zamezil návratu nebo zhoršení Vašich záchvatů.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
U malého počtu lidí léčených antiepileptiky se objevily myšlenky na sebepoškozování nebo sebevraždu. Pokud se u Vás tyto myšlenky kdykoli objeví, okamžitě informujte svého lékaře.
Velmi časté (mohou postihnout více než 1 uživatele z 10) nežádoucí účinky jsou:
- pocit závratí
- pocit ospalosti (dřímota nebo spavost).
Časté (mohou postihnout více než 1 uživatele ze 100) nežádoucí účinky jsou:
- zvýšená nebo snížená chuť k jídlu, nárůst tělesné hmotnosti
- agresivita, zlost, podráždění, úzkost nebo zmatenost
- problémy s chůzí nebo jiné problémy s rovnováhou (ataxie, porucha chůze, porucha rovnováhy)
- pomalá řeč (dysartrie)
- rozostřené vidění nebo dvojité vidění (diplopie)
- točení hlavy (závrať)
- nevolnost (pocit na zvracení)
- bolest zad
- pocit velké únavy
- pády.
Méně časté (mohou postihnout více než 1 uživatele z 1000) nežádoucí účinky jsou:
- myšlenky na sebezraňování nebo na ukončení vlastního života (sebevražedné myšlenky), pokus o ukončení vlastního života (pokus o sebevraždu)
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Fycompa uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku lahve a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Tento přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Pokud v lahvi zbyla nějaká suspenze déle než 90 dní od prvního oveření, nepoužívejte ji.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Fycompa obsahuje
- Léčivou látkou je perampanelum. Jeden mililitr obsahuje perampanelum 0,5 mg.
- Dalšími složkami jsou krystalizující sorbitol (E420), mikrokrystalická celulosa (E460), sodná sůl karmelosy (E466), poloxamer 188, simetikonová emulze 30% (obsahující čištěnou vodu, silikonový olej, polysorbát 65, methylcelulosu, silikagel, makrogol-stearát, kyselinu sorbovou, kyselinu benzoovou a kyselinu sírovou), bezvodá kyselina citronová (E330), natrium-benzoát (E211) a čištěná voda.
Jak přípravek Fycompa vypadá a co obsahuje toto balení
Přípravek Fycompa 0,5 mg/ml perorální suspenze je bílá až téměř bílá suspenze. Dodává se v lahvi o objemu 340 ml se dvěma stříkačkami pro perorální podání opatřenými stupnicí a LDPE zatlačovacím adaptérem lahve (PIBA).
Držitel rozhodnutí o registraci
Eisai Europe Limited, European Knowledge Centre, Mosquito Way, Hatfield, Hertfordshire, AL10
9SN, Velká Británie
e-mail: EUmedinfo@eisai.net
Výrobce
Eisai Manufacturing Limited, European Knowledge Centre, Mosquito Way, Hatfield, Hertfordshire, AL10 9SN, Velká Británie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Btnrapuu
Eisai Ltd.
Ten.: +44 (0) 20 8600 1400 (06egHHeHO Kpancrao)
Česká republika
Eisai GesmbH organizačni složka Tel.: + 420 242 485 839
Danmark
Eisai AB
Tlf: + 46 (0) 8 501 01 600 (Sverige)
Deutschland
Eisai GmbH
Tel: + 49 (0) 69 66 58 50
Eesti
Eisai Ltd.
Tel: +44 (0) 20 8600 1400 (Uhendkuningriik)
EXXúSa
Arriani Pharmaceuticals S.A. T^: +30 210 668 3000
Luxembourg/Luxemburg
Eisai SA/NV
Tél/Tel: + 32 (0)2 502 58 04 (Belgique/Belgien)
Magyarország Eisai Ltd.
Tel.: +44 (0) 20 8600 1400 Egyesult Királyság
Malta
Associated Drug Co. Ltd Tel:+356 2277 8000
Nederland
Eisai B.V.
Tél/Tel: + 31 (0) 900 575 3340
Norge
Eisai AB
Tlf: + 46 (0) 8 501 01 600 (Sverige)
Osterreich
Eisai GesmbH
Tel: + 43 (0) 1 535 1980-0
|
Espaňa Eisai Farmacéutica, S.A. Tel: + (34) 91 455 94 55 |
Portugal Eisai Farmacéutica, Unipessoal Lda Tel: + 351 214 875 540 |
|
France Eisai SAS Tél: + (33) 1 47 67 00 05 |
Románia Eisai Ltd. Tel: +44 (0) 20 8600 1400 (Marea Britanie) |
|
Hrvatska Eisai Ltd. Tel: + 44 (0)20 8600 1400 (Velika Britanija) |
Slovenija Eisai Ltd. Tel: +44 (0) 20 8600 1400 (Velika Britanija) |
|
Ireland Eisai Ltd Tel: + 44 (0)20 8600 1400 (United Kingdom) |
Slovenská republika Eisai GesmbH organizačni složka Tel.: + 420 242 485 839 (Česká republika) |
|
Ísland Eisai AB Sími: + 46 (0)8 501 01 600 (Svífrjóó) |
Suomi/Finland Eisai AB Puh/Tel: + 46 (0) 8 501 01 600 (Ruotsi) |
|
Italia Eisai S.r.l. Tel: + 39 02 5181401 Kúnpoq Arriani Pharmaceuticals S.A. T^: + 30 210 668 3000 (EAláSa) Latvija Eisai Ltd. Tel: +44 (0) 20 8600 1400 (Liebritanija) Lietuva Eisai Ltd. Tel. +44 (0) 20 8600 1400 (Jungtiné Karalysté) |
Sverige Eisai AB Tel: + 46 (0) 8 501 01 600 United Kingdom Eisai Ltd. Tel: + 44 (0) 20 8600 1400 |
Tato příbalová informace byla naposledy revidována {MM.RRRR}.
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
74