Foscan 4 Mg/Ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Foscan 1 mg/ml injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml obsahuje temoporfinum 1 mg.
Pomocné látky se známým účinkem
Jeden ml obsahuje 376 mg bezvodého ethanolu a 560 mg propylenglykolu. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok Tmavě nachový roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Foscan je indikován k paliativní léčbě pacientů s pokročilým skvamózním karcinomem v oblasti hlavy a krku, při kterém selhaly předchozí způsoby léčby, a který je nevhodný pro radioterapii, chirurgický zákrok či systémovou chemoterapii.
4.2 Dávkování a způsob podání
Fotodynamická terapie přípravkem Foscan musí být aplikována pouze na odborných onkologických pracovištích, ve kterých multidisciplinární tým odborníků vyhodnotí způsob léčby a pacient je pod dohledem lékařů, kteří mají zkušenost s fotodynamickou terapií.
Dávkování
Dávka je 0,15 mg/kg tělesné hmotnosti.
Pediatrická populace
Použití přípravku Foscan u pediatrické populace není relevantní.
Způsob podání
Foscan se podává intravenózně zavedenou kanylou do velké žíly horní končetiny, přednostně do antekubitální fosy, v jednotlivé pomalé intravenózní injekci trvající nejméně 6 minut. Před injekcí je nutné vyzkoušet průchodnost zavedené kanyly a zabránit mimožilnímu podání (viz bod 4.4).
Tmavě nachové zbarvení roztoku spolu s lahvičkami z jantarově hnědého skla znemožňuje vizuální ověření přítomnosti částic. Proto je třeba jako předběžné opatření užít in line filtr, který je obsažen v balení. Foscan se nesmí rozpouštět v roztoku chloridu sodného ani v žádném jiném vodném roztoku, ani se takovými roztoky nesmí proplachovat.
Požadovaná dávka přípravku Foscan se podává pomalou intravenózní injekcí trvající nejméně 6 minut. Po 96 hodinách od podání přípravku Foscan je třeba léčené místo osvítit světlem s vlnovou délkou 652 nm ze schváleného laserového zdroje. Pomocí schválené mikročočkové vláknové optiky je třeba osvítit celý povrch tumoru. Pokud je to možné, musí ozařovaná plocha přesahovat okraje tumoru alespoň o 0,5 cm.
Ozáření musí být provedeno ne dříve než za 90 hodin a ne později než za 110 hodin po injekci přípravku Foscan.
Dopadající světelná dávka je 20 J/cm2 dodávaná při světelném příkonu 100 mW/cm2 na povrch tumoru po době ozáření zhruba 200 s.
Každé pole se smí ozářit pouze jednou v průběhu jedné léčby. Lze ozařovat více polí, která se nepřekrývají. Je třeba zajistit, že žádná oblast či tkáň nebude vystavena vyšší než uvedené světelné dávce.
Tkáň mimo cílové oblasti musí být plně stíněna, aby se předešlo fotoaktivaci rozptýleným či odraženým světlem. Na základě zvážení ošetřujícího lékaře lze aplikovat druhý cyklus léčby u pacientů, u kterých se nepředpokládá nekróza tumoru a jeho odstranění. V tomto případě je doporučený minimální interval mezi prvním a druhým cyklem léčby 4 týdny.
4.3 Kontraindikace
• Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
• Porfyrie nebo jiná onemocnění zhoršující se účinkem světla
• Hypersenzitivita na porfyriny.
• Tumory, o kterých je známo, že erodují velké cévy a jsou v oblasti ozáření nebo k ní přiléhají.
• Plánovaný chirurgický výkon v průběhu dalších 30 dnů.
• Současně přítomné oční onemocnění, při kterém se předpokládá požadavek vyšetření štěrbinovou lampou v průběhu dalších 30 dnů.
• Současná terapie některým fotosenzibilizujícím přípravkem.
4.4 Zvláštní upozornění a opatření pro použití
Všichni pacienti, kteří jsou léčeni přípravkem Foscan, budou dočasně fotosenzitivní. Je třeba přijmout opatření k tomu, aby se předešlo expozici kůže a očí přímému slunečnímu záření nebo jasnému vnitřnímu osvětlení v místnosti v průběhu prvních 15 dnů po injekci. Fotosenzitivní kožní reakce jsou způsobovány viditelným světlem, takže krémy na opalování chránící před ultrafialovým zářením neposkytují žádnou ochranu. Je důležité, aby pacienti byli uváděni zpět k normálnímu osvětlení postupně (viz pokyny k ochraně před světlem pro pacienty na konci této části).
Po dobu šesti měsíců následujících po léčbě přípravkem Foscan se snažte vyvarovat delšímu vystavení paže, do které byl podán Foscan, přímému slunečnímu záření. Pokud plánujete delší pobyt venku, jako preventivní opatření noste barevnou košili s dlouhými rukávy chránící paži se vpichem.
Lékaři si musí být vědomi toho, že většina z toxických účinků souvisejících s fotodynamickou terapií jsou lokální účinky pozorované v důsledku fotoaktivace. Fotoaktivace vyvolává lokální poškození tkáně vedoucí k akutní zánětlivé reakci. Tato reakce je často spojena s otokem a bolestí s následnou nekrózou. Fotodynamický efekt může také vést k poškození okolní tkáně, které může vyvolat vznik píštěle, perforace nebo cévní ruptury, jakož i infekci a následnou sepsi. Je proto důležité, aby během fotoaktivace při ozařování laserem byla zdravá tkáň v okolí tumoru chráněna před fotoaktivací pomocí správných ozařovacích a stínících technik. Proaktivní kontrola lokálních účinků a snížení fotoaktivace v oblastech bez tumoru jsou důležité k řízení rizik.
Zvláštní péče musí být věnována tomu, aby se předešlo extravazaci v místě vpichu injekce. Pokud k ní doj de, chraňte postiženou oblast před světlem po dobu alespoň tří měsíců. Není znám žádný jiný přípravek, který by měl ochranný nebo léčebný účinek při případné extravazaci.
Po neschváleném použití při léčbě maligních striktur žlučových cest a mezoteliomu byly hlášeny nežádoucí účinky zahrnující cholangitidu, cholecystitidu, jaterní absces a perforaci jícnu. Po fotoaktivaci je zde nebezpečí poškození okolní oblasti.
Neplánované nebo náhlé chirurgické výkony tam, kde byl podán Foscan, lze bez předchozího období 30 dnů provádět pouze, pokud jsou absolutně nezbytné a potenciální prospěch převažuje nad rizikem pro pacienta. Je nutné přijmout veškerá opatření pro to, aby se předešlo přímému ozáření pacienta chirurgickými lampami v průběhu operace. Místo toho se doporučuje použití čelních lamp.
Některé pulzní oxymetry mohou vydávat světlo o vlnové délce blízké té, která se používá pro fotoaktivaci přípravku Foscan. Oxymetry je třeba přemístit alespoň každých 10 až 15 minut, aby se předešlo riziku místních popálenin kůže.
Jiná bolest než bolest v místě vpichu, uvedená v bodě 4.8, může krátkodobě po léčbě vyžadovat použití NSAID nebo opioidních analgetik. Bolest se objevuje druhý den po ozáření a obvykle trvá 2 až 4 týdny.
Ozáření dýchacích cest může vést k lokálnímu zánětu a otoku. Je třeba očekávat z toho vyplývající komplikace (tj. dušnost nebo dokonce obstrukci dýchacích cest vedoucí např. k intubaci nebo tracheotomii). Je třeba zvážit profylaktickou léčbu kortikosteroidy.
Odborní lékaři musí poučit pacienty o nutném dodržování následujících opatření, která jsou uvedena v příbalové informaci.
|
Doba po injekci přípravku F oscan |
Co musím udělat, abych předešel popáleninám |
|
Den 1 (0 až 24 hodin) |
Zůstaňte uvnitř tmavší místnosti. Udržujte záclony stažené a používejte žárovky o výkonu 60 W nebo nižším. Vyhněte se vystavení přímému slunečnímu záření. |
|
Den 2 až 7 |
Můžete se postupně vrátit k normálnímu vnitřnímu osvětlení. Pamatujte na to, abyste předešli přímému světlu procházejícímu oknem nebo přímému světlu z domácích spotřebičů, jako jsou lampy na čtení. Na televizi se můžete dívat. Můžete vyjít ven po soumraku. Pokud je absolutně nezbytné vyjít ven při denním světle, musíte pečlivě dbát toho, abyste zakryli celou svou kůži včetně tváře a rukou a abyste měli tmavé brýle. Typ oblečení, které musíte nosit: • Klobouk s širokou krempou pro ochranu hlavy, krku, nosu a uší. • Šátek na krk: pro ochranu hlavy a krku. • Sluneční brýle s postranními kryty: pro ochranu očí a kůže okolo očí. • Horní část oblečení s dlouhými rukávy: pro ochranu horní části těla/paží. • Dlouhé kalhoty: pro ochranu spodní části těla/dolních končetin. • Rukavice: pro ochranu rukou, zápěstí a prstů. • Ponožky: pro ochranu nohou a kotníků. • Uzavřenou obuv: pro ochranu nohou. • Nenoste příliš tenké oblečení, protože to vás neuchrání před silným světlem. Noste tmavé, hustě tkané oblečení. • Pokud se nedopatřením vystavíte světlu, můžete pociťovat bodavé a |
|
pálivé pocity na kůži. Musíte ihned opustit osvětlenou oblast. Vaše oči mohou být v průběhu tohoto týdne velice citlivé na jasné světlo. Můžete pociťovat bolest očí či hlavy, pokud se rozsvítí světlo. Pokud máte tyto problémy, noste tmavé brýle. | |
|
Dny 8 až 14 |
Nyní můžete začít vycházet ven během denního světla. Zůstávejte v zastíněných místech nebo vycházejte pouze, pokud je zamračeno. Noste dále oblečení, které je tmavé, z hustě tkané látky. Začínejte 8. den s pobytem venku po dobu 10 až 15 min. Pokud neuvidíte žádné zrudnutí kůže během dalších 24 hodin, můžete v průběhu týdne svůj pobyt venku postupně prodlužovat. Vyhněte se přímému slunečnímu záření nebo silnému osvětlení v místnosti. Zůstávejte ve stínu. |
|
Den 15 a další dny |
Vaše citlivost vůči světlu se postupně vrací k normálu. Musíte tuto skutečnost pečlivě vyzkoušet vystavením vrchní strany vaší ruky slunci po dobu 5 min. Čekejte po dobu 24 hodin, zda se neobjeví nějaké zrudnutí. Pokud se zrudnutí objeví, je třeba se vyhnout přímému slunečnímu záření po dobu dalších 24 hodin. Potom můžete tuto zkoušku opakovat. Pokud se žádné zrudnutí neobjeví, můžete postupně prodlužovat své vystavení se slunečnímu záření ze dne na den. Ze začátku nezůstávejte na slunci po dobu delší než 15 min. Většina lidí je schopná se vrátit k normálnímu režimu 22. den. První den po zkoušce kůže můžete zůstávat na přímém slunci po dobu 15 min. Můžete prodlužovat své vystavení o dalších 15 min každý den, tj. na 30 min druhý den, 45 min třetí den, 60 min čtvrtý den a tak dále. Jestliže kdykoliv pocítíte píchavé či pálivé pocity nebo uvidíte zarudnutí kůže po vystavení se slunci, čekejte až do vymizení těchto příznaků dříve, než svou kůži na tento časový interval opět vystavíte světlu. Po dobu 30 dnů po podání přípravku Foscan se vyhněte vyšetřením očí, která používají zářivá světla. Po dobu 3 měsíců po léčení přípravkem Foscan se vyhněte opalování UV světlem. Nesluňte se. Po dobu šesti měsíců následujících po léčbě přípravkem Foscan se snažte vyvarovat delšímu vystavení paže, do které byl podán Foscan, přímému slunečnímu záření. Pokud plánujete delší pobyt venku, jako preventivní opatření noste barevný oděv s dlouhými rukávy chránící paži se vpichem. |
Tento léčivý přípravek obsahuje 48 obj. % alkoholu, tj. do 4,2 g v jedné dávce, což odpovídá do 84 ml piva, 35 ml vína. Je škodlivý pro alkoholiky. Je nutno vzít v úvahu u těhotných a kojících žen, dětí a vysoce rizikových skupin, jako jsou pacienti s jaterním onemocněním nebo epilepsií. Množství alkoholu v těchto léčivých přípravcích může měnit účinky dalších léků. Množství alkoholu v těchto léčivých přípravcích může snížit pozornost při řízení motorových vozidel nebo obsluze strojů.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Jestliže se temoporfin používá s jinými léky obsahujícími fotosenzibilizující léčivou látku, je možný vznik fotosenzitivní kožní reakce. Taková reakce byla hlášena pro lokálně podávaný fluoruracil.
Nebyly pozorovány žádné další interakce. In-vitro studie s lidskou jaterní tkání neprokázaly interakce s jinými léky prostřednictvím inhibice enzymů cytochromu P-450 temoporfinem.
4.6 Fertilita, těhotenství a kojení
Údaje o podávání temoporfinu těhotným ženám nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Foscan lze v těhotenství použít pouze tehdy, když klinický stav ženy vyžaduje léčbu temoporfinem.
Ženy ve fertilním věku musí během léčby a ještě 3 měsíce po ukončení terapie používat účinnou antikoncepci.
Kojení
Není známo, zda se temoporfin/metabolity vylučují do lidského mateřského mléka. Riziko pro kojené novorozence/děti nelze vyloučit. Kojení má být přerušeno nejméně na dobu jednoho měsíce po injekci přípravku Foscan.
Fertilita
Účinky přípravku Foscan na fertilitu lidí nebyly studovány.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Množství alkoholu obsažené v tomto léčivém přípravku může ovlivnit schopnost řídit motorová vozidla a obsluhovat stroje.
Na základě farmakodynamického profilu se předpokládá, že temoporfin je bezpečný nebo že není pravděpodobné, že by ovlivňoval pozornost. Aby se předešlo problémům s fotosenzitivitou, doporučuje se neřídit vozidla v průběhu prvních 15 dnů po injekci a obsluhovat strojní zařízení pouze, pokud to je možné za daných světelných podmínek v rámci doporučených opatření ohledně osvětlení (viz bod 4.4). Řízení motorového vozidla a obsluha strojního zařízení za normálního osvětlení nebo podmínek denního světla se může obnovit, jakmile se ukáže, že fotosenzitivita ustoupila.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Všichni pacienti, kterým je aplikován přípravek Foscan, budou dočasně citliví na světlo a musí být instruováni o opatřeních k předejití expozici slunečnímu záření a jasnému osvětlení místnosti a jejich dodržování. Pokud se týká nežádoucích účinků uvedených v tabulce, gastrointestinální poruchy, nežádoucí kožní reakce a celkové poruchy a reakce v místě aplikace jsou nejčastěji pozorovanými nežádoucími účinky.
Většina toxických účinků spojených s fotodynamickou terapií jsou lokální účinky pozorované v místě ozáření, případně v okolních tkáních. Lokální nežádoucí účinky jsou charakteristické pro akutní zánětlivou odpověď tkáně vyvolanou fotoaktivací a často zahrnují otok a bolest s následnou nekrózou (viz bod 4.4).
Fotosenzitivní reakce může nastat, avšak dodržení pokynů k ochraně před světlem (viz bod 4.4 výše) a zabránění zbytečnému vnitřnímu osvětlení během ozařování snižuje toto riziko.
Kvůli nízkému počtu léčených pacientů nebylo možné identifikovat nežádoucí účinky, které lze kategorizovat jako méně časté a vzácné. Bolest v místě vpichu je přechodná a lze ji zmenšit snížením rychlosti aplikace injekce. Léčba jiných typů bolesti uvedených v tomto bodě viz bod 4.4.
Souhrn nežádoucích účinků v tabulce
Četnosti jsou definovány jako: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1000 až < 1/100); vzácné (> 1/10000 až < 1/1000); velmi vzácné < 1/10000, není známo (z dostupných údajů nelze určit). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Třída orgánových systémů |
Nežádoucí účinky |
|
Infekce a infestace |
Časté: Místní infekce v oblasti fotoaktivace, např. faryngitida, stomatitida Není známo: Sepse1 |
|
Poruchy krve a lymfatického systému |
Časté: |
|
Poruchy nervového systému |
Časté: Závrať, pocit pálení |
|
Cévní poruchy |
Velmi časté: Krvácení Není známo: Cévní ruptura; viz bod 4.3 |
|
Respirační, hrudní a mediastinální poruchy |
Není známo: Obstrukce dýchacích cest3 |
|
Gastrointestinální poruchy |
Velmi časté: Zácpa, nekrotizující stomatitida, dysfagie Časté: |
|
Poruchy kůže a podkožní tkáně |
Časté: Puchýř, erytém, kožní hyperpigmentace, fotosenzitivní reakce, nekróza kůže2 |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Časté: Trismus3 Není známo: Píštěl2 |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté: Bolest ve fotoaktivované oblasti, např. bolest obličeje, bolest hlavy, bolest v místě injekce, otok ve fotoaktivované oblasti, např. otok tváře, otok jazyka Časté: Pyrexie, reakce v místě injekce, otok |
|
Poranění, otravy a procedurální komplikace |
Velmi časté: Jizva2 Časté: Tepelná popálenina, spálenina od slunce2 |
1 V důsledku lokální infekce
2 Ve fotoaktivované oblasti
3 V důsledku lokálního otoku
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
V případě předávkování by léčba laserem vedla k hlubší nekróze tumoru, než se očekává při doporučené dávce. Ozařování tumoru je třeba provádět pouze, pokud potenciální prospěch opravňuje podstoupení potenciálního rizika nadměrné nekrózy. Pokud tumor není ozářen, je třeba ponechat období alespoň 4 týdnů mezi předávkováním a novým podávím přípravku Foscan.
Lze očekávat, že nežádoucí reakce související s předávkováním budou omezeny na fotosenzitivní kožní reakce. Expozice okolnímu světlu po předávkování přináší zvýšené riziko fotosenzitivních kožních reakcí. Publikovaný klinický výzkum ukázal, že trvání a intenzita fotosenzitivity při doporučené dávce 0,15 mg/kg se snižuje o jednu třetinu oproti dávce 0,3 mg/kg. Studie na zvířatech ukázaly některé hematologické a chemické změny v krvi (snížený počet krevních destiček, erytrocytů a hemoglobinu, zvýšený počet neutrofilů, zvýšené hodnoty fibrinogenu, bilirubinu, triglyceridů a cholesterolu).
Je třeba přísně dodržovat doporučený omezený světelný režim. Předtím, než se pacient vrátí k normálním světelným podmínkám, je třeba provést zkoušku fotosenzitivity kůže.
Není známo, že by s předávkováním souvisely jakékoliv specifické systémové symptomy. Léčba by měla být podpůrná.
Jsou k dispozici pouze omezené informace o účincích nadměrné expozice laserovému záření v průběhu léčby. Bylo zaznamenáno zvýšené poškození tkáně.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antineoplastické látky, jiné antineoplastické látky, ATC kód: L01XD05.
Temoporfin je fotosenzibilizující látka určená k fotodynamické léčbě tumorů.
Farmakologický účinek je zahájen fotoaktivací temoporfinu netepelným světlem při vlnové délce 652 nm, které následuje po intravenózním podání. Terapeutický účinek je zprostředkován tvorbou vysoce reaktivních kyslíkatých složek, což je proces závislý na intracelulární interakci temoporfinu se světlem a kyslíkem.
V klinickém zkoušení na 147 pacientech s pokročilým skvamózním karcinomem v oblasti hlavy a krku byla pozorována odpověď tumoru definovaná jako snížení alespoň o 50 % hmotnosti tumoru po dobu alespoň čtyř týdnů v 25 % případů po jednorázové léčbě. Kompletní lokální odpověď dle WHO byla pozorována u 14 % pacientů. Odpovědi tumoru se zvyšují u pacientů s plně ozářenými lézemi v hloubce 10 mm či méně.
Medián pozorovaného trvání odpovědi tumoru pro všechny pacienty byl 57 dní pro celkovou odpověď a 84 dní pro úplnou odpověď.
37 pacientům byly aplikovány alespoň 2 léčby přípravkem Foscan. Deset pacientů dosáhlo odpovědi tumoru následkem opakované léčby. Šest z nich vykazovalo plnou lokální odpověď podle kritérií WHO.
5.2 Farmakokinetické vlastnosti
Temoporfin je látka s nízkou clearance s terminálním plasmatickým poločasem 65 hodin. Maximální hladiny v krevní plazmě se objevují 2 až 4 hodin po injekci, a poté plazmatické hladiny klesají podle dvousložkové exponenciální křivky. Lze pozorovat rozsáhlý distribuční objem, který je mezi hodnotami celkové a extracelulární tělesné tekutiny. Temoporfin se nekoncentruje ve tkáních. Vazba na plazmatické proteiny činí 85 až 87 %. Temoporfin se v krvi váže na plazmatické lipoproteiny a proteiny o vysoké hustotě, jako je albumin. Po 15 dnech od infuze koncentrace temoporfinu v plazmě klesá na původní hodnoty, takže pacienti jsou obecně schopni se postupně vrátit k normálním podmínkám venkovního osvětlení.
Jsou k dispozici pouze omezené údaje o eliminaci temoporfinu u lidí. Údaje získané u zvířat ukazují, že se temoporfin výlučně eliminuje játry do žluče a vylučuje se stolicí. Do žluče se eliminují dva hlavní metabolity temoporfinu. Neexistuje žádná enterohepatická recirkulace těchto metabolitů. Oba tyto metabolity jsou konjugované. Žádné metabolity nejsou v systémovém oběhu detekovány.
5.3 Předklinické údaje vztahující se k bezpečnosti
Ve studiích toxicity s opakovanou dávkou u potkanů a psů byly hlavními nežádoucími účinky temoporfinu fototoxicita a nepříznivé reakce v místě injekce. Lokální dráždění po intravenózním podání přípravku Foscan injekční roztok se vyskytuje při všech dávkách. Velmi rychlá podávání způsobila úhyn u psů a králíků. Nebyly shledány žádné další známky toxicity, avšak u psů, kterým byla podána doporučená terapeutická dávka, překračovala systémová expozice expozici u lidí.
Genotoxicita temoporfinu byla zkoumána v omezeném rozsahu. Vzhledem k tvorbě reaktivních typů kyslíku vykazuje temoporfin minimální riziko mutagenity. Toto riziko lze kontrolovat v klinické praxi minimalizací přímé expozice světlu (viz bod 4.4).
Ve vývojových studiích toxicity u králíků temoporfin při systémových expozicích stejných, jako jsou expozice použité u lidí při doporučené terapeutické dávce, způsoboval vzrůst časné postimplantační ztráty. Nebyly pozorovány žádné další vývojové účinky, avšak aplikované dávky neposkytovaly dostatečný přebytek proti humánním terapeutickým dávkám tak, aby poskytly adekvátní rozmezí bezpečnosti.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Bezvodý ethanol (E1510)
Propylenglykol (E1520)
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
Foscan se nesmí ředit vodnými roztoky.
6.3 Doba použitelnosti
5 let
Po otevření je přípravek určen k okamžitému použití.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
Injekční lahvičky typu I z jantarově hnědého skla s uzávěrem z bromobutylového elastomeru a hliníkovou pertlí obsahující 1 ml, 3 ml nebo 6 ml injekčního roztoku.
Jedno balení obsahuje jednu injekční lahvičku a filtr s Luerovými spojkami pro injekční stříkačku a kanylu. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Při zacházení s tímto léčivým přípravkem je nutné dodržovat příslušná opatření. Studie prokázaly, že Foscan není dráždivý. Jedna lahvička obsahuje jednu dávku přípravku a veškerý nepoužitý roztok musí být zlikvidován.
Foscan je fotosenzitivní. Jakmile se přípravek vyjme z balení, musí se ihned podávat. Tam, kde nelze předejít zpoždění, je třeba roztok chránit před světlem.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
biolitec Pharma Ltd.
Otto-Schott-Str. 15 07745 Jena Německo
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/01/197/003 (1 ml)
EU/1/01/197/004 (3 ml)
EU/1/01/197/005 (6 ml)
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 24. října 2001
Datum posledního prodloužení registrace: 22. září 2011
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu/
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
biolitec Pharma Ltd.
Otto-Schott-Str. 15 07745 Jena Německo
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2)
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Foscan 1 mg/ml injekční roztok Temoporfinum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden ml obsahuje temoporfinum 1 mg.
3. SEZNAM POMOCNÝCH LÁTEK
bezvodý ethanol a propylenglykol (pro další údaje si přečtěte příbalovou informaci)
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok 1 mg/1 ml Injekční roztok 3 mg/3 ml Injekční roztok 6 mg/6 ml Sterilní filtr
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Intravenózní podání
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Jednotlivá dávka. Nepoužitý zbytek znehodnoťte.
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
10 ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
biolitec Pharma Ltd. Otto-Schott-Str. 15 07745 Jena Německo
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/01/197/003 (1 ml) EU/1/01/197/004 (3 ml) EU/1/01/197/005 (6 ml)
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
Nevyžaduje se - odůvodnění přijato.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Foscan 1 mg/ml injekční roztok Temoporfinum Intravenózní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE č.s.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 mg/1 ml 3 mg/3 ml 6 mg/6 ml
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
Foscan 1 mg/ml injekční roztok
Temoporfinum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo zdravotní sestry.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Foscan a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Foscan používat
3. Jak se Foscan používá
4. Možné nežádoucí účinky
5. Jak přípravek Foscan uchovávat
6. Obsah balení a další informace
1. Co je Foscan a k čemu se používá
Léčivou látkou v přípravku Foscan je temoporfin.
Foscan je fotosensibilizující porfyrinový lék, který zvyšuje citlivost ke světlu a je aktivován světlem z laseru při léčbě, která se nazývá fotodynamická terapie.
Foscan se používá k léčbě rakoviny v oblasti hlavy a krku u pacientů, kteří nemohou být léčeni jinou léčbou.
2. Čemu musíte věnovat pozornost, než začnete Foscan používat
Neužívejte Foscan
- jestliže jste alergický(á) na temoporfin nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6),
- jestliže jste přecitlivělý(á) [alergický(á)] na porfyriny
- pokud máte porfyrii či jakoukoliv další chorobu, která se zhoršuje působením světla
- pokud léčený tumor prochází velkou cévou
- pokud se v průběhu dalších 30 dnů připravujete na operaci
- pokud máte oční onemocnění, které v průběhu dalších 30 dnů vyžaduje vyšetření jasným světlem
- pokud jste již léčeni některým přípravkem pro zvýšení citlivosti vůči světlu.
Upozornění a opatření
• Foscan zvýší vaši citlivost vůči světlu na dobu 15 dnů po injekci. To znamená, že normální denní světlo nebo jasné vnitřní osvětlení vám může způsobit popálení kůže. Abyste tomu zabránili, musíte pečlivě dodržovat instrukce pro postupné vystavení se zvyšujícím hladinám světla uvnitř místnosti v průběhu prvního týdne a venkovnímu zastíněnému světlu v druhém týdnu po léčbě (viz tabulka na konci této příbalové informace).
• Prosím, pohovořte o tom se svým lékařem dříve, než půjdete domů po první injekci přípravku Foscan.
• Krémy s ochranným faktorem proti slunečnímu záření nezabrání této citlivosti.
• Postupně se budete stávat méně citlivými vůči světlu. Normálně jsou lidé schopni se vrátit k normálnímu venkovnímu osvětlení po 15 dnech.
• Nenechte se vyšetřovat očním lékařem ani optikem pomocí zářivých světel po dobu 30 dnů po injekci přípravku Foscan.
• Nesluňte se ani se nevystavujte ultrafialovému záření po dobu 3 měsíců po injekci přípravku Foscan.
• Po dobu šesti měsíců následujících po léčbě přípravkem Foscan se snažte vyvarovat delšímu vystavení paže, do které byl podán Foscan, přímému slunečnímu záření. Pokud plánujete delší pobyt venku, jako preventivní opatření noste barevný oděv s dlouhými rukávy chránící paži se vpichem.
Rozpis pokynů vás bude informovat, jak zabránit popálení kůže. Tyto pokyny musíte přesně dodržovat.
Zeptejte se, prosím, svého lékaře nebo zdravotní sestry v případě, že si nejste něčím jisti.
|
Doba po injekci přípravku F oscan |
Co musím udělat, abych předešel(předešla) popáleninám |
|
Den 1 (0 až 24 hodin) |
Zůstaňte uvnitř tmavší místnosti. Udržujte záclony stažené a používejte žárovky o výkonu 60 W nebo nižším. Vyhněte se vystavení přímému slunečnímu záření. |
|
Den 2 až 7 |
Můžete se postupně vrátit k normálnímu vnitřnímu osvětlení. Pamatujte na to, abyste předešli přímému světlu procházejícímu oknem nebo přímému světlu z domácích spotřebičů, jako jsou lampy na čtení. Na televizi se můžete dívat. Můžete vyjít ven po soumraku. Pokud je absolutně nezbytné vyjít ven při denním světle, musíte pečlivě dbát toho, abyste zakryli celou svou kůži včetně tváře a rukou a abyste měli tmavé brýle. Typ oblečení, které musíte nosit: • Klobouk s širokou krempou pro ochranu hlavy, krku, nosu a uší. • Šátek na krk: pro ochranu hlavy a krku. • Sluneční brýle s postranními kryty: pro ochranu očí a kůže okolo očí. • Horní část oblečení s dlouhými rukávy: pro ochranu horní části těla/paží. • Dlouhé kalhoty: pro ochranu spodní části těla/dolních končetin. • Rukavice: pro ochranu rukou, zápěstí a prstů. • Ponožky: pro ochranu nohou a kotníků. • Uzavřenou obuv: pro ochranu nohou. • Nenoste příliš tenké oblečení, protože to vás neuchrání před silným světlem. Noste tmavé, hustě tkané oblečení. • Pokud se nedopatřením vystavíte světlu, můžete pociťovat bodavé a pálivé pocity na kůži. Musíte ihned jít z osvětlené oblasti. Vaše oči mohou být v průběhu tohoto týdne velice citlivé na jasné světlo. Můžete pociťovat bolest očí či hlavy, pokud se rozsvítí světlo. Pokud máte tyto problémy, noste tmavé brýle. |
|
Dny 8 až 14 |
Nyní můžete začít vycházet ven během denního světla. Zůstávejte v zastíněných místech nebo vycházejte pouze, pokud je zamračeno. Noste dále oblečení, které je tmavé, z hustě tkané látky. Začínejte 8. den s pobytem venku po dobu 10 až 15 min. Pokud neuvidíte žádné zrudnutí kůže během dalších 24 hodin, můžete v průběhu týdne svůj pobyt venku postupně prodlužovat. Vyhněte se přímému slunečnímu záření nebo silnému osvětlení v místnosti. Zůstávejte ve stínu. |
|
Den 15 a další dny |
Vaše citlivost vůči světlu se postupně vrací k normálu. Musíte tuto skutečnost pečlivě vyzkoušet vystavením vrchní strany vaší ruky slunci po dobu 5 min. Čekejte po dobu 24 hodin, zda se neobjeví nějaké zrudnutí. Pokud se zrudnutí objeví, je třeba se vyhnout přímému slunečnímu záření po dobu dalších 24 hodin. Potom můžete tuto zkoušku opakovat. Pokud se žádné zrudnutí neobjeví, můžete postupně ze dne na den prodlužovat své vystavení se slunečnímu záření. Ze začátku nezůstávejte na slunci po dobu delší než 15 min. Většina lidí je schopná se vrátit k normálnímu režimu 22. den. První den po zkoušce kůže můžete zůstávat na přímém slunci po dobu 15 min. Každý den můžete prodlužovat své vystavení o dalších 15 min, tj. na 30 min druhý den, 45 min třetí den, 60 min čtvrtý den a tak dále. Jestliže kdykoliv cítíte píchavé či pálivé pocity nebo uvidíte zarudnutí kůže po vystavení se slunci, čekejte až do vymizení těchto příznaků dříve, než svou kůži na tento časový interval opět vystavíte světlu Po dobu 30 dnů po podání přípravku Foscan se vyhněte vyšetřením očí, která používají zářivá světla. Po dobu 3 měsíců po léčení přípravkem Foscan se vyhněte opalování UV světlem. Nesluňte se. Po dobu šesti měsíců následujících po léčbě přípravkem Foscan se snažte vyvarovat delšímu vystavení paže, do které byl podán Foscan, přímému slunečnímu záření. Pokud plánujete delší pobyt venku, jako preventivní opatření noste barevný oděv s dlouhými rukávy chránící paži se vpichem. |
Další léčivé přípravky a přípravek Foscan
Informujte svého lékaře o všech lécích, které používáte, které jste v nedávné době používal(a) nebo které možná budete používat.
Těhotenství a kojení
• Musíte předejít otěhotnění po dobu 3 měsíců po léčení přípravkem Foscan.
• Poraďte se se svým lékařem či lékárníkem dříve, než začnete užívat jakýkoliv lék.
Nekojte po dobu alespoň jednoho měsíce po injekci přípravku Foscan.
Řízení dopravních prostředků a obsluha strojů
• Množství alkoholu obsažené v tomto léčivém přípravku může na dobu několika hodin po injekci ovlivnit Vaši schopnost řídit motorová vozidla nebo obsluhovat stroje.
• V prvních 15 dnech po injekci přípravkem Foscan se nedoporučuje řídit ani obsluhovat stroje kvůli doporučeným omezením týkajícím se vystavování se světlu.
Přípravek Foscan obsahuje alkohol:
• Přípravek obsahuje 48 obj. % alkoholu, tj do 4,2 g v jedné dávce, což odpovídá do 84 ml piva, 35 ml vína. Tento přípravek je také škodlivý pro alkoholiky. Představuje riziko také pro těhotné nebo kojící ženy, děti a vysoce rizikové skupiny, jako jsou pacienti s jaterním onemocněním nebo epilepsií.
Množství alkoholu obsažené v tomto přípravku může ovlivnit účinek jiných léčivých přípravků.
3. Jak se Foscan používá
• Lékař nebo zdravotní sestra Vám podá pomalu do žíly injekci přípravku Foscan, podání bude trvat přibližně 6 minut.
• Za čtyři dny po podání bude lékař léčit nádor laserovým zářením. Lékař zakryje zdravou tkáň v okolí nádoru a poté bude laserem ozařovat přímo nádor po dobu přibližně 5 minut. Laserové záření není horké a nebude Vás pálit.
Jestliže jste dostal(a) více přípravku Foscan, než jste měl(a)
• Nesmíte být léčen(a) laserem.
• Můžete být citlivý(á) vůči světlu po delší dobu než 15 dnů.
Musíte pečlivě dodržovat pokyny týkající se prevence popálení kůže.
Máte-li jakékoli další otázky týkající se používání tohoto přípravku, zeptejte se svého lékaře
nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i přípravek Foscan nežádoucí účinky.
• Každý, kdo užívá Foscan, bude citlivý vůči světlu po dobu 15 dnů po injekci.
• Musíte dodržovat pokyny, které jste dostal(a), tak, abyste se vyhnul(a) slunečnímu záření a jasnému světlu v místnosti.
• Tyto pokyny jsou v této příbalové informaci. Lékař vám rovněž řekne, co máte dělat.
Pokud nebudete tyto pokyny dodržovat, můžete utrpět závažná popálení, která vedou k trvalým jizvám.
Většina nežádoucích účinků souvisejících s fotodynamickou terapií jsou místní účinky pozorované jako důsledek aktivace přípravku Foscan laserem. Po ošetření laserem můžete cítit bolest. Tuto bolest lze zmírnit léky proti bolesti. Prosím, informujte svého lékaře nebo zdravotní sestru, pokud máte bolesti, nebo v případě, že léky proti bolesti, které užíváte, bolest neodstranily. Dále pravděpodobně zaznamenáte otok a zarudnutí kolem ošetřované oblasti. Můžete dostat nějaké léky ke zmírnění otoku. Za 2 až 4 dny ošetřovaná oblast zčerná. Černá barva je způsobena odumřelými nádorovými buňkami (nekrózou). Foscan může také poškodit tkáň v okolí nádoru.
Velmi časté nežádoucí účinky (mohou postihnout více než 1 z 10 osob)
• Můžete pociťovat bolest v místě podání přípravku Foscan.
• Po ozáření laserem můžete pociťovat bolest v ošetřované oblasti, např. bolest v obličeji nebo bolest hlavy.
• Může se také vyskytnout krvácení, vředy, otoky v ošetřované oblasti, jako je otok obličeje nebo jazyka, a zjizvení.
• Můžete trpět zácpou.
Tyto účinky mohou způsobit obtíže při jídle a pití.
Časté nežádoucí účinky (mohou postihnout až 1 z 10 osob)
• Může dojít k přechodnému podráždění, pálivým pocitům nebo k poškození kůže v místě podání, což však záhy odezní.
• Může dojít ke vzniku vředů, puchýřů, zarudnutí nebo ztmavnutí kůže.
• Zvracení
• Horečka
• Nevolnost
• Chudokrevnost
• Citlivost na světlo
• Spálení sluncem
• Popáleniny
• Obtíže s polykáním
• Závratě
• Mohou se vyskytovat otoky nebo ztuhlost čelistí. Může dojít k rozvoji infekce v zasažené oblasti, např. zánět v krku nebo v ústech.
Nežádoucí účinky, jejichž četnost výskytu není známa (frekvenci z dostupných údajů nelze určit):
• Zablokování dýchacích cest v důsledku otoku ošetřované oblasti
• Píštěl v ošetřované oblasti
• Sepse
• Prasknutí cévy
Závažné nežádoucí účinky, jako je zánět žlučovodu nebo žlučníku, jaterní absces nebo perforace (proděravění) v ošetřované oblasti, byly hlášeny při použití u rakoviny v jiných oblastech, než je hlava a krk. Pro více informací kontaktujte svého lékaře.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Foscan uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Foscan by měl být uchováván v nemocniční lékárně.
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem. Po vyjmutí léku z obalu musí být přípravek použit okamžitě.
Jedna injekční lahvička obsahuje jednu dávku a veškerý nepoužitý přípravek musí být zlikvidován.
6. Obsah balení a další informace Co Foscan obsahuje
- Léčivou látkou je temoporfinum. Jeden ml injekčního roztoku obsahuje temoporfinum 1 mg.
- Pomocnými látkami jsou bezvodý ethanol (E1510) a propylenglykol (E1520).
Jak Foscan vypadá a co obsahuje toto balení
Injekční roztok Foscan je tmavě nachový roztok v injekční lahvičce z jantarově hnědého skla,
obsahující 1 ml, 3 ml nebo 6 ml roztoku
Jedno balení obsahuje 1 injekční lahvičku a filtr.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
biolitec Pharma Ltd.
Otto-Schott-Str. 15 07745 Jena Německo
Tel.:+49 3641 5195330 Fax: +49 3641 5195331
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
Foscan 1 mg/ml injekční roztok Temoporfinum
1. OBSAH BALENÍ
Účinnou složkou je temoporfin. Jeden ml roztoku obsahuje 1 mg temoporfinu. Pomocné látky jsou bezvodý ethanol a propylenglykol. Dodává se současně filtr s Luerovými spojkami pro injekční stříkačku a kanylu.
Jedno balení obsahuje jednu injekční lahvičku s obsahem 1 ml, 3 ml nebo 6 ml injekčního roztoku. Jedna lahvička obsahuje jednu dávku a všechen nepoužitý roztok se musí zlikvidovat dle předpisů.
2. VÝPOČET DÁVKY
Vypočítejte požadovanou dávku přípravku Foscan podle tělesné hmotnosti pacienta. Obvyklá dávka je 0,15 mg/kg tělesné hmotnosti.
3. PODÁVÁNÍ PŘÍPRAVKU FOSCAN (96 hodin před ozářením léčeného místa laserem)
Foscan je nutné podat intravenózně pomocí kanyly zavedené do velké žíly horní končetiny, přednostně do antekubitální fosy. Před injekcí je třeba vyzkoušet průchodnost zavedené kanyly.
Tmavě nachové zbarvení roztoku spolu s jantarově hnědou lahvičkou znemožňuje vizuální ověření přítomnosti částic. Proto musí být preventivně použit in-line filtr, který je dodáván jako součást balení.
Natáhněte celý obsah lahvičky obsahující Foscan do injekční stříkačky a vytlačte vzduch (obr. 1).
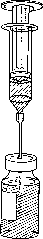
Obr. 1
Připojte filtr ke stříkačce (obr. 2).
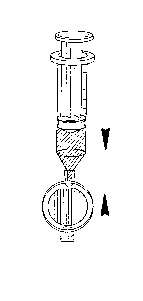
Obr. 2
Tlačte na píst pro naplnění prázdného prostoru uvnitř filtru. Pokračujte v tlaku na píst pro vytlačení přebytečného přípravku Foscan tak, aby byl ve stříkačce požadovaný objem s ponecháním dostatečného množství pro vyplnění prostoru v intravenózní kanyle (obr. 3).
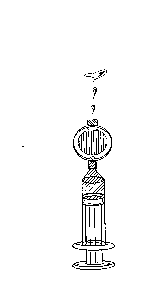
Obr. 3
Připojte stříkačku a filtr ke kanyle. Podávejte požadovanou dávku přípravku Foscan v pomalé intravenózní injekci po dobu alespoň 6 min (obr. 4).
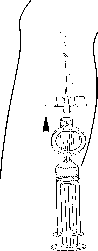
Obr. 4
Odstraňte intravenózní kanylu ihned po injekci. NEPROPLACHUJTE vodným roztokem, jako je injekční roztok chloridu sodného o koncentraci 9 mg/ml (0,9 %) či voda na injekce.
Zvláštní pozornost je třeba věnovat tomu, aby se předešlo k mimožilnímu podání. Pokud k tomu dojde, chraňte postiženou oblast před světlem po dobu alespoň tří měsíců. Není známý žádný jiný přípravek, který by měl ochranný nebo léčebný účinek v případě mimožilní aplikace.
Foscan je fotosensitivní. Po vyjmutí z balení musí být okamžitě podán. Jestliže je zdržení nevyhnutelné, musí být přípravek chráněn před světlem.
4. OZÁŘENÍ LÉČENÉHO MÍSTA LASEREM
Seznamte se, prosím, s příručkou pro uživatele laseru a informaci pro uživatele mikročočkové vláknové optiky.
96 hodin po podání přípravku Foscan je třeba ozářit léčené místo světlem o vlnové délce 652 nm ze schváleného laserového zdroje. Světlo je třeba aplikovat na celý povrch tumoru s použitím schválené mikročočkové vláknové optiky. Pokud je to možné, musí ozařovaná plocha přesahovat okraj tumoru o vzdálenost 0,5 cm.
Ozáření musí být provedeno ne dříve než za 90 hodin a ne později než za 110 hodin po injekci přípravku Foscan.
Dopadající světelná dávka je 20 J/cm2, dodávaná mikročočkovou vláknovou optikou na kruhové pole povrchu tumoru při příkonu 100 mW/cm2 a času ozáření 200 s.
Každé pole se má při každé léčbě ozářit jednou. Lze ozařovat více polí, která se nepřekrývají. Je třeba věnovat pozornost tomu, aby se zajistilo, že žádná oblast či tkáň neobdrží vyšší než udanou světelnou dávku. Tkáň mimo cílovou oblast se musí plně stínit, aby se předešlo fotoaktivaci rozptýleným či odraženým světlem.
5. BEZPEČNOSTNÍ ÚDAJE
Foscan není dráždivá látka.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
27