Forsteo 20 Mikrogramů/80 Mikrolitrů
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
FORSTEO 20 mikrogramů/80 mikrolitrů, injekční roztok v předplněném peru
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jednotlivá dávka 80 mikrolitrů; obsahuje teriparatidum* 20 mikrogramů.
V předplněném peru je ve 2,4 ml obsaženo 600 mikrogramů teriparatidu (odpovídá 250 mikrogramům v mililitru).
*Teriparatid, rhPTH (1-34), produkovaný E.coli za použití rekombinantní DNA technologie, je identický s 34-N terminální sekvencí aminokyselin endogenního humánního parathormonu.
Úplný seznam pomocných látek viz bod 6.1
3. LÉKOVÁ FORMA
Injekční roztok.
Bezbarvý, čirý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek FORSTEO je indikován pro dospělé.
Léčba osteoporózy u postmenopauzálních žen a mužů, u kterých existuje zvýšené riziko zlomenin (viz bod 5.1). U postmenopauzálních žen byl prokázán významný pokles výskytu zlomenin obratlů i nonvertebrálních zlomenin, ne však zlomenin proximálního femuru.
Léčba osteoporózy spojené s trvalou terapií systémovými glukokortikoidy u žen a mužů, u kterých existuje zvýšené riziko zlomenin (viz bod 5.1).
4.2 Dávkování a způsob podání
Dávkování
Doporučená dávka přípravku FORSTEO je 20 mikrogramů, podávaných jedenkrát denně.
Maximální celková délka léčby přípravkem FORSTEO má být 24 měsíců (viz bod 4.4). Tato 24 měsíční terapie nemá být v průběhu pacientova života opakována.
Suplementaci vápníkem a vitamínem D mají dostávat pacienti s nedostatečným příjmem těchto látek potravou.
Po vysazení přípravku FORSTEO lze pacientům podávat jinou léčbu osteoporózy.
Zvláštní populace
Pacienti s _poruchou funkce ledvin
Přípravek FORSTEO se nesmí podávat pacientům s těžkou poruchou funkce ledvin (viz bod 4.3.).
U pacientů se středně těžkou poruchou renálních funkcí má být přípravek FORSTEO podáván se zvýšenou opatrností. U pacientů s mírnou poruchou renálních funkcí není zvláštní opatrnost vyžadována.
Pacienti s _poruchou _ funkce _jater
Přípravek nebyl hodnocen u pacientů s poruchou funkce jater (viz bod 5.3). Z tohoto důvodu má být přípravek FORSTEO podáván s opatrností.
Pediatrická_populace a mladí dospělí s otevřenými epifýzárními štěrbinami:
Bezpečnost a účinnost přípravku FORSTEO u dětí a dospívajících mladších 18 let nebyla stanovena. Přípravek FORSTEO se nemá podávat pediatrickým pacientům (mladším 18 let) nebo mladým dospělým s otevřenými epifýzárními štěrbinami.
Starší pacienti
Přizpůsobení dávky věku není vyžadováno (viz bod 5.2).
Způsob podání
Přípravek FORSTEO má být podáván jedenkrát denně subkutánní injekcí do stehna nebo do břicha.
Pacienti musí být poučeni o správné injekční technice (viz bod 6.6). Instrukce ke správnému používání pera lze rovněž nalézt v Návodu k použití.
4.3 Kontraindikace
• Přecitlivělost na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
• Těhotenství a kojení (viz body 4.4 a 4.6)
• Preexistující hyperkalcémie
• Těžká porucha funkce ledvin
• Metabolická onemocnění skeletu (včetně hyperparathyreózy a Pagetovy choroby) jiná než primární osteoporóza nebo glukokortikoidy indukovaná osteoporóza
• Nejasné zvýšení alkalické fosfatázy
• Předchozí zevní radioterapie skeletu nebo radioterapie implantovaným zdrojem záření
• Pacienti s malignitami skeletu nebo kostními metastázami musí být z léčby teriparatidem vyloučeni
4.4 Zvláštní upozornění a opatření pro použití
Hladiny kalcia v séru a v moči
U pacientů s normální hladinou kalcia v krvi bylo po podání injekce teriparatidu pozorováno mírné a přechodné zvýšení sérové koncentrace vápníku. Koncentrace kalcia v séru dosahují maxima za 4 až 6 hodin po podání teriparatidu, k výchozím hodnotám se vracejí za 16 až 24 hodin. Pokud se provádí odběr krve ke stanovení hladiny kalcia v séru, neměl by být proveden dříve než za 16 hodin po poslední aplikaci přípravku FORSTEO. Rutinní sledování kalcémie během léčby není vyžadováno.
FORSTEO může vést k mírnému zvýšení vylučování vápníku močí, ale v klinických studiích se výskyt hyperkalciúrie nelišil od pacientů na placebu.
Urolitiáza
Přípravek FORSTEO nebyl hodnocen u pacientů s aktivní urolitiázou. U pacientů s aktivní nebo nedávno manifestovanou urolitiázou by přípravek FORSTEO mohl vést ke zhoršení stavu, a měl by tedy být podáváno se zvýšenou opatrností.
Ortostatická hypotenze
V krátkodobých studiích s přípravkem FORSTEO byly pozorovány izolované epizody přechodné ortostatické hypotenze. K této příhodě typicky došlo během 4 hodin po podání a příznaky spontánně odezněly během několika minut až několika hodin. Pokud se tato přechodná ortostatická hypotenze objevila, vyskytla se během prvních několika dávek. Obtíže ustoupily po uložení pacienta do vodorovné polohy, a nevedly k přerušení léčby.
Porucha funkce ledvin
Pacienti se středně těžkou poruchou funkce ledvin by měli být sledováni se zvýšenou opatrností.
Dospělí mladšího věku
Zkušenosti s podáváním u populace dospělých mladšího věku, včetně pre-menopauzálních žen, jsou omezené (viz bod 5.1). Léčba by měla být u této části populace zahájena pouze tehdy, kdy její přínos jasně převáží možná rizika.
Ženy ve fertilním věku musí používat během léčby přípravkem FORSTEO účinnou antikoncepci.
V případě těhotenství musí být léčba přípravkem FORSTEO ukončena.
Délka léčby
Studie na potkanech poukázaly na zvýšený výskyt osteosarkomu při dlouhodobém podávání teriparatidu (viz bod 5.3). Než budou dostupné další klinické výsledky, neměla by být překročena doporučená délka podávání teriparatidu 24 měsíců.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Ve studii s 15 zdravými dobrovolníky, kteří denně užívali digoxin až do dosažení rovnovážného stavu, neovlivnilo podání jednorázové dávky přípravku FORSTEO účinek digoxinu na srdce. Ze sporadických případů však vyplývá, že pacienti s hyperkalcémií mohou být ohroženi digitálisovou toxicitou. Protože přípravek FORSTEO přechodně zvyšuje koncentraci kalcia v séru, měl by být u pacientů užívajících digoxin podáván se zvýšenou opatrností.
Přípravek FORSTEO byl hodnocen ve farmakodynamických interakčních studiích s hydrochlorothiazidem. Žádné klinicky významné interakce nebyly zaznamenány.
Současné podávání raloxifenu nebo hormonální substituční léčby s přípravkem FORSTEO nemělo vliv na hladinu vápníku v séru a v moči nebo na výskyt klinických nežádoucích příhod.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku/antikoncepce u žen
Ženy ve fertilním věku musí používat během léčby přípravkem FORSTEO účinnou antikoncepci.
V případě těhotenství musí být léčba přípravkem FORSTEO ukončena.
Použití přípravku FORSTEO je v těhotenství kontraindikováno (viz bod 4.3).
Kojení
Použití přípravku FORSTEO během kojení je kontraindikováno. Není známo, zda je teriparatid vylučován do mateřského mléka.
Fertilita
Ve studiích u králíků byla prokázána reprodukční toxicita (viz bod 5.3). Účinek teriparatidu na fetální vývoj u člověka nebyl hodnocen. Potenciální riziko u člověka není známo.
4.7 Účinky na schopnost řídit a obsluhovat stroje
FORSTEO nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
U některých pacientů byla pozorována přechodná ortostatická hypotenze nebo závratě. Tito pacienti by se do ústupu příznaků měli zdržet řízení motorových vozidel nebo obsluhy strojů.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Mezi nejčastěji hlášené nežádoucí účinky u pacientů léčených přípravkem FORSTEO patřily nauzea, bolesti končetin, bolesti hlavy a závratě.
Tabulkový seznam nežádoucích účinků
Alespoň jedna nežádoucí příhoda byla hlášena ve studiích s teriparatidem u 82,8% pacientů používajících přípravek FORSTEO a u 84,5% pacientů používajících placebo.
Nežádoucí účinky spojené s používáním teriparatidu v klinických studiích a po uvedení na trh jsou shrnuty v níže uvedené tabulce. Bylo použito následující ohodnocení četnosti výskytu nežádoucích účinků: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000).
Poruchy krve a lymfatického systému
Časté: anémie_
Poruchy imunitního systému
Vzácné: Anyfylaxe_
Poruchy metabolismu a výživy
Časté: hypercholesterolémie
Méně časté: hyperkalcémie větší než 2,76 mmol/l, hyperurikémie
Vzácné: hyperkalcémie větší než 3,25 mmol/l_
Psychiatrické poruchy
Časté: deprese_
Poruchy nervového systému
Časté: závratě, bolest hlavy, ischias, synkopa_
Poruchy ucha a labyrintu
Časté: vertigo_
Srdeční poruchy
Časté: palpitace
Méně časté: tachykardie_
Cévní poruchy
Časté: hypotenze_
Respirační, hrudní a mediastinální poruchy
Časté: dyspnoe
Méně časté: emfyzém_
Gastrointestinální poruchy
Časté: nauzea, zvracení, hiátová hernie, gastroezofageální reflux
Méně časté: hemorhoidy_
Poruchy kůže a podkožní tkáně
Časté: zvýšené pocení_
Poruchy svalové a kosterní soustavy a pojivové tkáně
Velmi časté: bolest končetin Časté: svalové křeče
Méně časté: myalgie, artralgie křeče /bolest* v zádech_
Poruchy ledvin a močových cest
Méně časté: močová inkontinence, polyúrie, nucení na močení, nefrolitiáza
Vzácné: renální selhání/porucha funkce ledviní_
Celkové poruchy a reakce v místě aplikace
Časté: únava, bolest na hrudi, asténie, mírné a přechodné reakce v místě aplikace zahrnující bolest, otok, erytém, ohraničenou modřinu, svědění a slabé krvácení v místě vpichu.
Méně časté: erytém v místě injekce, reakce v místě injekce
Vzácné: možné alergické reakce brzy po aplikaci injekce: akutní dyspnoe, orofaciální edém,
generalizovaná kopřivka, bolest na hrudi, edém (zejména periferní)_
Vícenásobná vyšetření
Méně časté: zvýšení hmotnosti, srdeční šelest, zvýšení alkalické fosfatázy_
* Vážné případy křečí v zádech nebo bolesti byly hlášeny v průběhu minut po podání injekce.
Popis vybraných nežádoucích účinků
V klinických studiích byly hlášeny následující nežádoucí účinky s rozdílem > 1% ve frekvenci výskytu oproti placebu: vertigo, nauzea, bolest končetin, závratě, deprese, dyspnoe.
FORSTEO zvyšuje koncentraci kyseliny močové v séru. Zvýšení koncentrace kyseliny močové v séru nad horní hranici normy se v rámci klinických studií vyskytlo u 2,8% pacientů používajících FORSTEO oproti 0,7% pacientů používajících placebo. Hyperurikémie však neměla za následek zvýšený výskyt dny, bolestí kloubů nebo urolitiázy.
Protilátky vykazující zkříženou reaktivitu s teriparatidem byly ve velké klinické studii prokázány u 2,8% žen užívajících FORSTEO. Všeobecně byly protilátky poprvé prokazovány po 12 měsících léčby a po vysazení léčby docházelo k jejich poklesu. V této souvislosti nebyly prokázány žádné reakce přecitlivělosti, alergické reakce, změny koncentrace kalcia v séru nebo vliv na vývoj kostní denzity (BMD).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Příznaky
Přípravek FORSTEO byl podán jednorázově až do dávky 100 mikrogramů a při opakovaném podávání až do dávky 60 mikrogramů/den po dobu 6 týdnů.
Příznaky, které lze očekávat při předávkování, zahrnují opožděnou hyperkalcémii a riziko ortostatické hypotenze. Dále se mohou vyskytnout nauzea, zvracení, závratě a bolest hlavy.
Zkušenosti s předávkováním vycházející z postmarketingových spontánních hlášení.
V postmarketingových hlášeních se vyskytly případy chyb v medikaci, kdy došlo k podání celého množství teriparatidu obsaženém v peru (až 800 pg) v jediné dávce. Hlášené přechodné příhody zahrnovaly nauzeu, slabost/letargii a hypotenzi. V některých případech nebyly při předávkování hlášeny žádné nežádoucí účinky. Ve spojitosti s předávkováním nebylo hlášeno úmrtí.
Léčba předávkování
Žádné specifické antidotum pro přípravek FORSTEO neexistuje. Při podezření na předávkování má být přípravek FORSTEO dočasně vysazen, měla by být sledována koncentrace kalcia v séru a měla by být zahájena příslušná podpůrná léčba, např. hydratace.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Léčiva ovlivňující homeostázu vápníku hormony příštítných tělísek a analogy, ATC kód: H05AA02h
Mechanismus účinku
Endogenní parathormon (PTH) obsahující 84 aminokyselin je hlavním regulátorem metabolismu kalcia a fosforu v kostech a v ledvinách. FORSTEO (rhPTH(1-34) je aktivní fragment (1-34) endogenního lidského parathormonu. Fyziologické účinky PTH zahrnují stimulaci kostní novotvorby přímým působením na buňky tvořící kostní hmotu (osteoblasty), a tím nepřímé zvýšení střevní absorpce vápníku, zvýšení tubulární reabsorpce kalcia a vylučování fosfátů ledvinami.
Farmakodvnamické účinky
FORSTEO je přípravek stimulující kostní novotvorbu určený k léčbě osteoporózy. Účinky přípravku FORSTEO na skelet závisí na charakteru systémové expozice. Podávání přípravku FORSTEO jedenkrát denně zvyšuje apozici nové kosti na povrchu trámčité i kortikální kosti preferenční stimulací aktivity osteoblastů, která převládá nad aktivitou osteoklastů.
Klinická účinnost
Rizikové faktory
Pro identifikaci žen a mužů se zvýšeným rizikem osteoporotických fraktur, u kterých je přepokládán přínos léčby, by měly být zváženy nezávislé rizikové faktory, např. nízká BMD, věk, předchozí fraktura, rodinná anamnéza zlomeniny krčku stehenní kosti, vysoký kostní obrat a nízký body mass index.
Vysoké riziko osteoporózy indukované glukokortikoidy by mělo být u premenopauzálních žen zváženo, pokud u nich již dříve došlo k fraktuře, nebo pokud u nich existuje kombinace rizikových faktorů zvyšujících riziko fraktury (např. nízká kostní denzita [např. T skóre <-2], trvalá terapie vysokými dávkami glukokortikoidů např. >7,5 mg/den po dobu nejméně 6 měsíců], vysoká aktivita skrytého onemocnění, nízká hladina pohlavních hormonů).
Postmenopauzální osteoporóza
Do pivotní klinické studie bylo zařazeno 1 637 postmenopauzálních žen (průměrný věk 69,5 let). Při vstupu do studie mělo devadesát procent pacientek jednu nebo více zlomenin obratlů a vertebrální BMD činila průměrně 0,82 g/cm2 (ekvivalentní k T skóre = - 2.6 SD). Všechny pacientky denně dostávaly 1 000 mg vápníku a alespoň 400 IU vitamínu D. Výsledky ze sledování trvajícího až 24 měsíců (průměrná doba: 19 měsíců) prokázaly statisticky významné snížení zlomenin (tabulka 1). K zabránění jedné nebo více nových zlomenin obratlů je třeba léčit 11 žen po dobu průměrně 19 měsíců.
Tabulka 1
|
Výskyt zlomenin u postmenopauzálních žen | |||
|
Placebo (N = 544) (%) |
FORSTEO (N = 541) (%) |
Relativní riziko (95% CI) vs. Placebo | |
|
Nová zlomenina obratle (>1) a |
14.3 |
5.0 b |
0.35 (0.22, 055) |
|
Mnohočetné zlomeniny obratlů (>2) a |
4.9 |
1.1 b |
0.23 (0.09, 0.60) |
|
Nonvertebrální zlomeniny c |
5.5 |
2.6d |
0.47 (0.25, 0.87) |
|
Závažné nonvertebrální zlomeninyc (kyčel, předloktí, paže, žebra a pánev) |
3.9 |
1.5 d |
0.38 (0.17, 0.86) |
Zkratky: N=počet pacientek náhodně rozdělených do jednotlivých léčebných skupin, CI=interval spolehlivosti
a Výskyt zlomenin obratle byl hodnocen u 448 pacientek s placebem a 444 pacientek užívajících FORSTEO, u kterých byla provedeno počáteční a následné rtg vyšetření páteře. b p<0.001 ve srovnání s placebem
c Signifikantní snížení výskytu zlomeniny kyčle nebylo prokázáno d p<0.025 ve srovnání s placebem
Za 19 měsíců léčby (průměrná doba) se ve srovnání s placebem zvýšila kostní denzita (BMD) v bederní páteři o 9% a v celkové oblasti proximálního femuru (total hip) o 4% (p<0,001).
Sledování po ukončení léčby: Po ukončení léčby přípravkem FORSTEO bylo 1 262 postmenopauzálních žen z pivotní klinické studie zařazeno do follow-up studie. Primárním cílem této fáze studie bylo shromáždit více informací o bezpečnosti přípravku FORSTEO. Během této observační fáze byla povolena jiná léčba osteoporózy a bylo provedeno další zhodnocení výskytu zlomenin obratlů.
Během průměrného období 18 měsíců po vysazení přípravku FORSTEO byl počet pacientek s alespoň jednou novou zlomeninou obratle o 41% nižší ve srovnání s placebem (p=0,004).
V otevřené studii bylo přípravkem FORSTEO léčeno 503 postmenopauzálních žen se závažnou osteoporózou a zlomeninou v předchozích 3 letech (83% podstoupilo předchozí léčbu osteoporózy) po dobu až 24 měsíců. Po 24 měsících bylo od zahájení do ukončení léčby zvýšení kostní denzity bederní páteře, proximálního femuru (total hip) a krčku stehenní kosti 10,5%, 2,6% a 3,9% oproti počátečním hodnotám. Průměrné zvýšení BMD od 18 do 24 měsíce v bederní páteři, proximálním femuru (total hip) a krčku stehenní kosti bylo 1,4%, 1,2% a 1,6%.
Osteoporóza u mužů
Do klinické studie u mužů s idiopatickou osteoporózou nebo hypogonadální (definovanou jako nízká ranní hladina volného testosteronu nebo zvýšené hladiny FSH nebo LH) osteoporózou bylo zařazeno 437 pacientů (průměrný věk 58,7 let). Při vstupu do studie činila kostní denzita páteře a krčku stehenní kosti ve vyjádření T-skóre 2,2 resp 2,1. Při vstupu do studie mělo 35% pacientů zlomeninu obratle a 59% nonvertebrální zlomeninu.
Všichni pacienti denně dostávali 1 000 mg vápníku a alespoň 400 IU vitamínu D. Po 3 měsících došlo k významnému zvýšení BMD v bederní páteři. Za 12 měsíců se BMD bederní páteře zvýšila oproti placebu o 5%, celkového proximálního femuru o 1%. Nebyl však prokázán významný účinek na výskyt zlomenin.
Osteoporóza indukovaná glukokortikoidy
Účinnost přípravku FORSTEO u mužů a žen (N=428), kteří byli trvale léčeni systémovými glukokortikoidy (odpovídající dávce 5 mg a více prednisonu po dobu nejméně 3 měsíců) byl prokázán v 18 měsíční primární fázi randomizované, dvojitě zaslepené 36i měsíční studie kontrolované komparátorem (alendronát 10 mg/den). Při zahájení léčby mělo 28% pacientů radiograficky potvrzenu jednu nebo více zlomenin obratlů. Všem pacientům bylo denně podáváno 1000 mg vápníku a 800 IU vitamínu D.
Tato studie zahrnovala postmenopauzální ženy ( N=277), premenopauzální ženy (N=67) a muže (N=83). Skupina postmenopauzálních žen měla při zahájení léčby průměrný věk 61 let, střední BMD bederní páteře T skóre -2.7, medián dávky glukokortikoidu odpovídající 7,5 mg/den prednisonu a 34% pacientek mělo jednu nebo více radiograficky potvrzených zlomenin obratle; průměrný věk premenopauzálních žen byl 37 let, střední BMD bederní páteře T skóre -2.5, medián dávky glukokortikoidu odpovídající 10 mg/den prednisonu a 9 % mělo jednu nebo více radiograficky potvrzených zlomenin obratle; a průměrný věk u mužů byl 57 let, střední BMD bederní páteře T skóre -2.2, medián dávky glukokortikoidu odpovídající 10 mg/den prednisonu, a 24 % mělo jednu nebo více radiograficky potvrzených zlomenin obratle.
18ti měsíční primární fázi studie dokončilo 69% pacientů. Při dosažení cílového parametru v 18. měsíci přípravek FORSTEO významně zvýšil BMD bederní časti páteře (7,2 %) oproti alendronátu (3,4 %) (p<0.001). Přípravek FORSTEO zvýšil BMD proximálního femuru (total hip) (3,6 %) oproti alendronátu (2,2 %) (p<0.01), stejně tak krčku stehenní kosti (3,7%) ve srovnání s alendronátem (2,1 %) (p<0.05).
Mezi 18 a 24 měsícem došlo u pacientů léčených teriparatidem k dalšímu zvýšení BMD bederní páteře, proximálního femuru (total hip) a krčku stehenní kosti o 1,7 %, 0,9 % a 0,4 %.
Ve 36 měsíci analýza rentgenových snímků 169 pacientů léčených alendronátem a 173 pacientů používajících přípravek FORSTEO ukázala, že u 13 pacientů ve skupině léčené alendronátem (7,7%) došlo ke vzniku nové vertebrální zlomeniny ve srovnání se 3 pacienty (1,7%) (p=0,01) ve skupině lečených přípravkem FORSTEO. Mimo to ve skupině léčené alendronátem došlo u 15 pacientů z 214 (7,0%) k nonvertebrální zlomenině, ve srovnání s 16 pacienty z 214 (7,5%) (p=0,84) užívajícími přípravek FORSTEO.
U premenopauzálních žen bylo zvýšení BMD od zahájení do ukončení léčby v 18 měsíci významně vyšší ve skupině užívající přípravek FORSTEO ve srovnání se skupinou užívající alendronát u bederní páteře (4,2% oproti -1.9%; p<0,001) a proximálního femuru (total hip) (3,8% oproti 0,9%; p=0,005). Významný vliv na poměr fraktur nebyl prokázán.
5.2 Farmakokinetické vlastnosti
Distribuce v organizmu
Distribuční objem je přibližně 1,7 l/kg. Po subkutánním podání je poločas přípravku FORSTEO přibližně 1 hodina, což odráží čas nutný pro vstřebání z místa vpichu.
Biotransformace
S přípravkem FORSTEO nebyly provedeny žádné studie metabolismu nebo exkrece, zdá se však, že periferní metabolismus parathormonu probíhá převážně v játrech a ledvinách.
Eliminace z organizmu
Na vylučování přípravku FORSTEO se podílí hepatální i extra-hepatální clearance (přibližně 62 l/hod u žen a 94 l/hod u mužů).
Starší pacienti
Ve farmakokinetice přípravku FORSTEO nebyly zaznamenány žádné rozdíly s ohledem na věk (rozpětí od 31 do 85 let). Přizpůsobení dávky věku není vyžadováno.
5.3 Předklinické údaje vztahující se k bezpečnosti
Teriparatid nebyl genotoxický v žádném ze standardně prováděných testů. Při podávání potkanům, myším a králíkům nebyly prokázány žádné teratogenní účinky. Při podávání teriparatidu březím potkanům a myším v denních dávkách od 30 do 1000 pg/kg nebyly pozorovány žádné závažné účinky. U březích králíků došlo při podávání teriparatidu ke zmenšení početnosti vrhu a resorpci plodu při denních dávkách od 3 do 100 pg/kg. Embryotoxicita pozorovaná u králíků může být způsobena vyšší senzitivitou k účinku PTH na ionizovaný vápník v krvi oproti hlodavcům.
U potkanů, léčených téměř celoživotně denní injekcí teriparatidu, bylo prokázáno dávkově závislé zvýšení kostní novotvorby a zvýšený výskyt osteosarkomu, velmi pravděpodobně epigenetickým mechanismem. Podávání teriparatidu potkanům nezvýšilo incidenci žádného jiného typu nádorového onemocnění. Klinický význam těchto nálezů je díky odlišné fyziologii kosti u potkanů a u lidí pravděpodobně zanedbatelný. Žádné kostní tumory nebyly zaznamenány u ovarektomovaných opic léčených po dobu 18 měsíců ani v průběhu dalších 3 let po ukončení léčby. Navíc v klinických studiích nebo pokračovacích studiích po ukončení léčby nebyl žádný osteosarkom prokázán.
Studie na zvířatech prokázaly, že významně snížený průtok krve játry snižuje expozici PTH hlavnímu štěpnému systému (Kupfferovy buňky) a následně clearance PTH(1-84).
FARMACEUTICKÉ ÚDAJE
6.
6.1 Seznam pomocných látek
Kyselina octová 98%
Natrium-acetát
Mannitol
Metakresol
Kyselina chlorovodíková (k úpravě pH) Hydroxid sodný (k úpravě pH)
Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
2 roky
Chemická, fyzikální a mikrobiologická stabilita po otevření před použitím byla prokázána po dobu 28 dní při teplotě 2-8°C. Po otevření lze přípravek uchovávat maximálně 28 dní při teplotě 2-8°C.
Za nedodržení doporučených podmínek a doby uchovávání je zodpovědný uživatel.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte po celou dobu v chladničce ( 2-8°C). Pero vraťte do chladničky okamžitě po použití. Chraňte před mrazem.
Předplněné pero neuchovávejte s nasazenou jehlou.
6.5 Druh obalu a obsah balení
2,4 ml roztoku v náplni (silikonové sklo typu I) s pístem (pryž z halobutylu), diskovitým uzávěrem (pryžový laminát z polyisopren/bromobutylu) a hliníkovým pertlem v předplněném peru.
FORSTEO se dodává v balení obsahujícím 1 nebo 3 předplněná pera. Každé pero obsahuje 28 dávek po 20 mikrogramech (v 80 mikrolitrech).
Na trhu nemusí být k dispozici všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
FORSTEO je dodáván v předplněném peru. Pero by mělo být používáno pouze jedním pacientem. Pro každou aplikaci je nutno použít novou, sterilní jehlu. Každé balení přípravku FORSTEO obsahuje Návod k obsluze s podrobným popisem používání pera. Balení neobsahuje jehly. K peru lze používat jehly určené k inzulinovému peru. Po každé aplikaci musí být pero s přípravkem FORSTEO vráceno do chladničky.
Přípravek FORSTEO by neměl být použit, pokud je roztok zakalený, zbarvený nebo obsahuje částice. Instrukce k používání dávkovače lze rovněž nalézt v návodu k obsluze.
Veškerý nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko
8. REGISTRAČNÍ ČÍSLO
EU/1/03/247/001-002
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 10. června 2003
Datum posledního prodloužení registrace: 10. června 2013
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese: http://www.ema.europa.eu
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce biologické léčivé látky (látek)
Boehringer-Ingelheim RCV GmbH & Co KG, Dr.-Boehringer-Gasse 5-11, 1121 Vídeň, Rakousko
Název a adresa výrobce odpovědného za propouštění šarží
Lilly France S.A.S., rue du colonel Lilly, 67640 Fegersheim, Francie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci dále předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2,. registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
Aktualizovaný RMP se předkládá každé tři roky.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
FORSTEO 20 mikrogramů/80 mikrolitrů, injekční roztok v předplněném peru. Teriparatidum
2 OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden mililitr obsahuje teriparatidum 250 mikrogramů.
3. SEZNAM POMOCNÝCH LÁTEK
Kyselina octová 98%, natrium-acetát, mannitol, metakresol, voda na injekci. Roztok kyseliny chlorovodíkové a/nebo roztok hydroxidu sodného (k úpravě pH)
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok,
1 předplněné pero s 2,4 ml roztoku 3 předplněná pera s 2,4 ml roztoku v jednom peru
Jedno pero obsahuje 28 dávek po 20 mikrogramech (v 80 mikrolitrech)
5. ZPŮSOB A CESTA PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Subkutánní podání
6 ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Zde odtrhněte.
8 POUŽITELNOST
EXP
Předplněné pero znehodnoťte po 28 dnech od prvního použití. Datum prvního použití:
9 ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce. Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli Lilly Nederland B.V. Papendorpseweg 83, 3528 BJ Utrecht Nizozemsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/03/247/001
nebo
EU/1/03/247/002
13. ČÍSLO ŠARŽE
Lot:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15 NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
FORSTEO
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ETIKETA
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
FORSTEO 20 mikrogramů/80 mikrolitrů, injekce
Teriparatidum
Subkutánní podání
2 ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4 ČÍSLO ŠARŽE
Lot:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
2,4 ml
6. JINÉ
Uchovávejte v chladničce.
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele FORSTEO 20 mikrogramů/80 mikrolitrů, injekční roztok v předplněném peru
teriparatidum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li případně další otázky, zeptejte se svého lékaře nebo lékárníka.
• Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je FORSTEO a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete FORSTEO používat
3. Jak se FORSTEO používá
4. Možné nežádoucí účinky
5. Jak přípravek FORSTEO uchovávat
6. Obsah balení a další informace
1. Co je FORSTEO a k čemu se používá
Přípravek FORSTEO obsahuje léčivou látku teriparatid, která se používá k zesílení kostí a ke snížení rizika zlomenin stimulací tvorby kostí.
FORSTEO se používá k léčbě osteoporózy u dospělých. Osteoporóza je nemoc, která způsobuje řídnutí a křehkost kostí. Objevuje se především u žen po menopauze, ale může k ní dojít také u mužů. Osteoporóza je také častá u pacientů, kteří užívají kortikosteroidy.
2. Čemu musíte věnovat pozornost, než začnete FORSTEO používat
Nepoužívejte přípravek FORSTEO:
• jestliže j ste alergický(á) na teriparatid nebo na kteroukoli další složku tohoto přípravku , uvedenou v bodě 6).
• jestliže máte vysoké hladiny vápníku (preexistující hyperkalcémie).
• jestliže trpíte vážným onemocněním ledvin.
• jestliže u vás byl diagnostikován kostní nádor nebo jiný nádor, který se rozšířil do kostí.
• jestliže máte určitá kostní onemocnění. Pokud trpíte onemocněním kostí, oznamte to svému lékaři.
• jestliže máte v krvi nevysvětlitelné vysoké hladiny enzymu nazývaného alkalická fosfatáza, což může znamenat, že trpíte tzv. Pagetovou chorobou kostí (onemocnění s abnormálními kostními změnami). Pokud si tím nejste jistý(á), zeptejte se svého lékaře.
• jestliže jste podstoupil(a) léčbu ozařováním, zahrnující ozařování kostí.
• jestliže j ste těhotná nebo koj íte.
Upozornění a opatření
Přípravek FORSTEO může zvýšit hladinu vápníku v krvi nebo v moči.
Před použitím přípravku FORSTEO se poraďte se svým lékařem nebo lékarníkem:
• pokud se u vás vyskytne přetrvávající pocit na zvracení, zvracení, zácpa, vyčerpanost nebo svalová slabost. Mohou to být příznaky příliš vysoké hladiny vápníku v krvi.
• pokud trpíte nebo jste trpěl(a) ledvinovými kameny.
• pokud trpíte onemocněním ledvin (středně těžká porucha funkce ledvin).
U některých pacientů se po několika prvních dávkách mohou objevit závratě nebo zrychlený srdeční rytmus. Pro případ závratí si první dávky přípravku FORSTEO proto prosím aplikujte na místě, kde můžete sedět nebo ležet.
Doporučená doba léčby 24 měsíců nemá být překročena.
Přípravek FORSTEO nemá být používán u rostoucích dospělých.
Děti a dospívající
Přípravek FORSTEO nemá být používán u dětí a dospívajících (mladších 18 let).
Dalším léčivé přípravky a přípravek FORSTEO
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat, protože léky se občas mohou vzájemně ovlivňovat (např. digoxin/digitalis, lék užívaný k léčbě srdečních onemocnění).
Těhotenství a kojení
FORSTEO neužívejte, pokud jste těhotná nebo kojíte. Pokud jste žena v plodném věku, musíte používat během léčby přípravkem FORSTEO účinnou antikoncepci. Pokud otěhotníte, léčba přípravkem FORSTEO musí být ukončena. Poraďte se s lékařem nebo lékárníkem před užitím jakéhokoliv léku.
Řízení dopravních prostředků a obsluha strojů
Po podání přípravku FORSTEO mohou někteří pacienti pociťovat závratě. Neřiďte motorová vozidla a neobsluhujte stroje, dokud se nebudete cítit lépe.
Důležité informace o některých složkách přípravku FORSTEO:
Tento přípravek obsahuje méně než 1mmol sodíku (23 mg) v jedné dávce, tj. zanedbatelné množství sodíku“.
3. Jak se FORSTEO používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem nebo lékárníkem.
Doporučená dávka přípravku je 20 mikrogramů podaných jednou denně formou injekce pod kůži (subkutánně) do stehna nebo břicha. Pravidelné používání přípravku v určitou denní dobu vám pomůže na dávku nezapomenout.
FORSTEO užívejte každý den tak dlouho, jak stanoví váš lékař. Celková doba léčby přípravkem FORSTEO by neměla přesáhnout 24 měsíců. Tuto 24 měsíční léčebnou kúru byste v průběhu života měl(a) podstoupit pouze jednou.
FORSTEO si můžete aplikovat v době jídla.
Přečtěte si přiložený návod k obsluze, abyste věděl(a), jak používat pero FORSTEO. íaž 31 (průměr 0,25 až 0,33 mm) a délka 12,7, 8 nebo 5 mm.
Injekci přípravku FORSTEO si podejte krátce po vyndání pera z chladničky, jak je uvedeno v návodu k obsluze. Po použití ihned pero FORSTEO vraťte do chladničky. Ke každé injekci použijte novou jehlu a po použití ji zlikvidujte. Pero neuchovávejte s nasazenou jehlou. Pero FORSTEO nikdy nedávejte nikomu jinému.
Lékař vám může doporučit užívat FORSTEO s kalciem a vitamínem D. Určí jaké denní dávky užívat. Přípravek FORSTEO může být používán nezávisle na jídle.
Jestliže jste použil(a) vyšší dávku přípravku FORSTEO než jste měl/a:
Pokud jste omylem použil(a) více přípravku FORSTEO, než jste měl(a), kontaktujte svého lékaře nebo lékárníka.
Známky předávkování, které mohou být očekávány, zahrnují pocit na zvracení, zvracení, závratě a bolest hlavy.
Jestliže jste zapomněl(a) použít FORSTEO nebo jste si ho nemohl(a) podat v obvyklou dobu,
podejte si ho co nejdříve ihned ještě tentýž den. Nezdvojujte následující dávku, abyste nahradil(a) vynechanou dávku. Nikdy si nepodávejte více než jednu injekci v jednom dnu. Vynechanou dávku nepřidávejte k další pravidelné dávce.
Jestliže jste přestal(a) používat přípravek FORSTEO
Uvažujete-li o tom, že přestanete přípravek FORSTEO používat, poraďte se prosím se svým lékařem. Váš lékař Vám poradí a rozhodne, jak dlouho budete přípravkem FORSTEO léčen(a).
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Nejčastější nežádoucí účinky jsou bolest končetin,(výskyt velmi častý, může se vyskytnout u více než 1 osoby z 10) a nevolnost, bolest hlavy a závratě (výskyt je častý).
Pokud budete mít po podání injekce závratě (točení hlavy), sedněte si nebo si lehněte, dokud se nebudete cítit lépe. Nebudete-li se cítit lépe, oznamte to lékaři před dalším podáním přípravku.
V souvislosti s používáním teriparatidu byly hlášeny případy výskytu mdlob.
Pokud se u Vás projeví potíže, jako jsou zarudnutí v místě vpichu, bolest, otok, svědění, vznik modřin nebo slabé krvácení v okolí místa vpichu (výskyt je častý), mohou tyto odeznít během několika dnů nebo týdnů. V jiném případě to oznamte svému lékaři co nejdříve.
U některých pacientů se mohou brzy po aplikaci injekce projevit alergické reakce zahrnující dýchavičnost, otok obličeje, vyrážku a bolest na prsou (výskyt je vzácný). Ve vzácných případech může dojít k závažným a potenciálně život ohrožujícím alergickým reakcím včetně anafylaxe.
Další nežádoucí účinky zahrnují:
Časté: mohou se projevit až u 1 z 10 pacientů
• zvýšená hladina cholesterolu v krvi
• deprese
• bolesti nohou nervového původu (neuralgické bolesti)
• pocit na omdlení
• nepravidelný srdeční tep
• dýchavičnost
• zvýšené pocení
• svalové křeče
• ztráta energie
• únava
• bolest na hrudníku
• nízký krevní tlak
• pálení žáhy (bolest nebo pálení za hrudní kostí) • zvraceni
• brániční kýla
• nizká hladina hemoglobinu nebo nizký počet červených krvinek (anémie).
Méně časté: mohou se projevit až u 1 ze 100 pacientů
• zrychlený srdeční tep
• abnormální srdeční ozvy
• dušnost
• hemoroidy
• samovolný únik moči
• častější potřeba močení
• zvýšení tělesné hmotnosti
• ledvinové kameny
• svalová bolest a bolest kloubů. U některých pacientů se vyskytly silné křeče nebo bolest v zádech, které vedly k hospitalizaci.
• zvýšeni hladin vápniku v krvi
• zvýšení hladin kyseliny močové v krvi
• zvýšení hladiny enzymu nazývaného alkalická fosfatáza.
Vzácné: mohou se projevit až u 1 pacienta z 1000
• snížení funkce ledvin, včetně selhání ledvin
• otoky, zejména rukou a nohou.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek FORSTEO uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti, uvedené na krabičce a peru za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
FORSTEO uchovávejte po celou dobu v chladničce (2-8°C). FORSTEO se může po prvním podání používat 28 dní, pokud je pero uchováváno v chladničce (při teplotě 2-8°C).
FORSTEO chraňte před mrazem. Abyste zabránili zmrazení, neuchovávejte pero v blízkosti mrazáku. FORSTEO nepoužívejte, pokud je nebo bylo zmraženo.
Po 28 dnech pero řádně znehodnoťte i v případě, že není zcela prázdné.
FORSTEO obsahuje čirý bezbarvý roztok. FORSTEO nepoužívejte, je-li roztok zakalený či zbarvený nebo pokud jsou v něm pevné částice.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek FORSTEO obsahuje
• Léčivou látkou je teriparatidum. Jeden mililitr injekčního roztoku obsahuje teriparatidum 250 mikrogramů.
• Pomocnými látkami jsou kyselina octová 98%, natrium-acetát, mannitol, metakresol a voda na injekci. Kyselina chlorovodíková a/nebo roztok hydroxidu sodného mohou být přidány k úpravě pH.
Jak přípravek FORSTEO vypadá a co obsahuje toto balení
FORSTEO je bezbarvý čirý roztok. Roztok je v náplni v předplněném peru. Každé pero obsahuje 2,4 ml roztoku postačující na 28 dávek. Pero je v balení po jednom nebo třech kusech. Na trhu nemusí být k dispozici všechny velikosti balení.
Držitel rozhodnutí o registraci
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Nizozemsko Výrobce
Lilly France S.A.S., Rue de Colonel Lilly, F 67640 Fegersheim, Francie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
Belgie/Belgique/Belgien
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32 (0) 2 548 84 84 Btnrapnn
Tn "Enn Hnán HegepnaHg" E.B. - Ennrapna Ten: + 359 2 491 41 40 Česká republika Eli Lilly CR, s.r.o.
Tel: + 420 234 664 111 Danmark
Eli Lilly Danmark A/S Tlf: + 45 45 26 60 00
Deutschland
Lilly Deutschland GmbH Tel: + 49 (0) 6172 273 2222 Eesti
Eli Lilly Holdings Limited Eesti filiaal
Tel: + 372 6817 280
EkXába
OAPMAIEPB-AIAAY A.E.B.E.
Tr|A,: + 30 210 629 4600 Espaňa
Elanco Valquímica, S.A.
Tel: + 34-91 623 1732 France
Lilly France SAS
Tél: + 33 (0) 1 55 49 34 34
Hrvatska
Eli Lilly Hrvatska d.o.o.
Tel: +385 1 2350 999 Ireland
Eli Lilly and Company (Ireland) Limited
Tel: + 353 (0) 1 661 4377
Island
Icepharma hf.
Sími: + 354 540 8000
Lietuva
Eli Lilly Holdings Limited atstovybé Tel: + 370 (5) 2649600 Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32 (0) 2 548 84 84
Magyarország
Lilly Hungária Kft.
Tel: + 36 1 328 5100 Malta
Charles de Giorgio Ltd.
Tel: + 356 25600 500 Nederland
Eli Lilly Nederland B.V.
Tel: + 31(0) 30 6025800 Norge
Eli Lilly Norge A.S Tlf: + 47 22 88 18 00 Osterreich Eli Lilly Ges. m.b.H.
Tel: + 43 (0) 1 711 780 Polska
Eli Lilly Polska Sp. z o.o.
Tel: + 48 (0) 22 440 33 00
Portugal
Lilly Portugal Produtos Farmaceuticos, Lda
Tel: + 351 21 412 66 00
Románia
Eli Lilly Románia S.R.L.
Tel: + 40 21 4023000 Slovenija
Eli Lilly farmacevtska družba, d.o.o.
Tel: + 386 (0) 1 580 00 10 Slovenská republika
Eli Lilly Slovakia, s.r.o.
Tel: + 421 220 663 111
Italia
Suomi/Finland
Oy Eli Lilly Finland Ab Puh/Tel: + 358 (0) 9 8545 250 Sverige
Eli Lilly Sweden AB
Tel: + 46 (0) 8 7378800
United Kingdom
Eli Lilly and Company Limited
Tel: +44 (0) 1256 315000
Eli Lilly Italia S.p.A.
Tel: + 39 055 42571
Kúrcpog
Phadisco Ltd
TqA.: + 357 22 715000
Latvija
Eli Lilly Holdings Limited, párstávnieciba Latvija Tel: + 371 67364000
Tato příbalová informace byla naposledy revidována {MM/RRRR}
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese: http://www.ema.europa.eu
Na webových stránkách Evropské agentury pro léčivé přípravky je tato příbalová informace k dispozici ve všech úředních jazycích EU/EHP.
NÁVOD K OBSLUZE PERA
Forsteo
FORSTEO 20 mikrogramů (pg)/ 80 mikrolitrů, injekční roztok v předplněném peru Návod k použití
Než začnete používat Vaše nové pero, přečtěte si prosím pozorně celý Návod k použití. Při používání pera se pečlivě řiďte pokyny.
Přečtěte si rovněž přiloženou pnbalovou informaci.
Nesdílejte s nikým pero ani injekční jehly, jinak se vystavujete riziku přenosu infekčních onemocnění.
Vaše pero obsahuje léčivý přípravek na 28 dní léčby.
Části pera Forsteo*
Žlutý píst
Černé injekční tlačítko


Červený Modré tělo proužek pera
Náplň s přípravkem Bílý kryt pera
Vnější kryt jehly
Papírová Jehla fólie

* Jehly nejsou součástí balení. Mohou být použity jehly Becton, Dickinson and Company o rozměru 29 - 31 (průměr 0,25 - 0,33mm) a délky 12,7, 8 nebo 5 mm. Poraďte se se svým lékařem nebo lékárníkem, který rozměr a délka jehly jsou pro vás nejlepší.
Před každou injekcí si umyjte ruce. Místo vpichu očistěte podle pokynů vašeho lékaře nebo lékárníka.
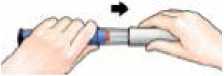
1
Sejměte bílý kryt pera

2
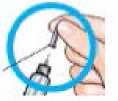
Nasaďte novou jehlu
Odstraňte
_papírovou fólii.


Vnější kryt jehly

Sejměte vnější kryt jehly a uschovejte jej.
Nasaďte jehlu rovně na náplň s přípravkem.
Našroubujte jehlu do dotažení.
Nasaďte na jehlu vnější kryt.
3-5 kompletními otáčkami vnějšího krytu odšroubujte jehlu.

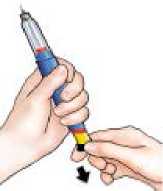
5
Ověřte si podání dávky

Po ukončení aplikace dávky:
Po vytažení jehly z kůže si zkontrolujte, že
černé injekční tlačítko je úplně zamáčknuto. Pokud není vidět žlutý píst, aplikovali jste dávku správně.

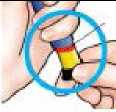
Červený
proužek
Vnitřní
kryt
jehly
Vytáhněte černé injekční tlačítko, dokud se nezastaví.
Pokud nemůžete vytáhnout černé injekční tlačítko, viz Řešení potíží, Otázka E._
Sejměte vnitřní kryt jehly a vyhoďte jej.
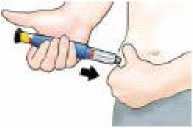
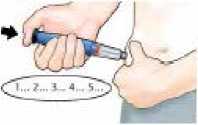
Stiskněte jemně kožní řasu na stehně nebo břiše a jehlu vbodněte rovně pod kůži.
Stlačte černé injekční tlačítko, dokud se nezastaví. Tlačítko držte pevně stlačené a počítejte p-o-m-a-l-u do 5. Potom jehlu vytáhněte z kůže.
Nesmí být viditelná žádná část žlutého pístu. Pokud je žlutá část vidět a podali jste si již dávku, neaplikujte si další dávku stejný den podruhé. Místo toho musíte znovu nastavit pero FORSTEO (Řešení potíží, Otázka A).
Odstraňte vnější kryt s jehlou a znehodnoťte je podle pokynů lékaře nebo lékárníka.
Nasaďte bílý kryt zpět na pero. Pero FORSTEO vraťte ihned po použití do ledničky.
Pokyny k zacházení s jehlami nemají nahrazovat místní zdravotnické a institucionální předpisy.

Otázka
A. Po stisknutí černého injekčního tlačítka je stále vidět žlutý píst. Jak mám znovu nastavit pero FORSTEO?

Řešení
Pro opětovné nastavení pera FORSTEO proveďte níže uvedené kroky.
1) Pokud jste si již podal/a dávku, NEAPLIKUJTE si další dávku stejný den podruhé.
2) Odstraňte jehlu.
3) Připojte novou jehlu, sejměte vnější kryt jehly a uschovejte jej.
4) Vytáhněte černé injekční tlačítko, dokud se nezastaví. Zkontrolujte, zda je viditelný červený proužek.
5) Sej měte vnitřní kryt j ehly a vyhoďte j ej.
6) Nasměrujte jehlu dolů do prázdné nádobky. Stlačte černé injekční tlačítko, dokud se nezastaví. Tlačítko držte pevně stlačené a počítejte p-o-m-a-l-u do 5. Můžete vidět vytékat malý proud nebo kapku tekutiny. Po provedení by mělo být černé injekční tlačítko úplně zamáčknuto.
7) Pokud stále vidíte žlutý píst, kontaktujte prosím svého lékaře nebo lékárníka.
8) Nasaďte vnější kryt jehly na jehlu. 3-5 kompletními otáčkami vnějšího krytu odšroubujte jehlu. Odstraňte vnější kryt
s jehlou a znehodnoťte je podle pokynů lékaře nebo lékárníka. Nasaďte bílý kryt zpět na pero. Pero FORSTEO vraťte do ledničky. Tomuto problému můžete předcházet, pokud budete pro každou injekci používat NOVOU jehlu, stisknete černé injekční tlačítko úplně a počítáte p-o-m-a-l-u do 5.
B. Jak se mohu ujistit, že mé pero FORSTEO funguje?

Pero FORSTEO je navrženo pro podání plné dávky při každé aplikaci, pokud je používáno přesně podle pokynů v části Návod kpoužití. Úplné zamáčknutí černého injekčního tlačítka vám ukáže, že perem FORSTEO byla podána celá dávka
Pro správnou funkci pera FORSTEO nezapomeňte použít pro každou aplikaci novou jehlu.
C. V peru FORSTEO jsou vidět vzduchové bubliny.

Malá vzduchová bublinka neovlivní dávku a neublíží vám. Můžete si dál aplikovat dávku jako obvykle.
D. Nemohu odšroubovat jehlu.

1) Nasaďte na j ehlu vněj ší kryt.
2) Použijte vnější kryt k odšroubování jehly.
3) 3-5 kompletními otáčkami vnějšího krytu
odšroubujte jehlu._
4) Pokud stále nemůžete jehlu odstranit, požádejte někoho o pomoc._
E. Co mám dělat, Vyměňte své pero FORSTEO za nové a aplikujte
pokud nemohu dávku podle pokynů svého lékaře nebo lékárníka.
vytáhnout černé
injekční tlačítko? Znamená to, že jste již užil/a všechen přípravek, který
mohl být přesně podán, přesto může být ještě v náplni trochu zbývajícího přípravku.
Čištění a uchovávání
Čištění pera FORSTEO
• Otřete vnější část pera FORSTEO čistým, vlhkým hadříkem.
• Neponořujte pero FORSTEO ani jej neumývejte nebo čistěte žádnou tekutinou
Uchovávání pera FORSTEO
• Pero FORSTEO vraťte hned po každém použití do ledničky. Čtěte a dodržujte pokyny týkající se uchovávání pera uvedené v Příbalové informaci pro pacienty.
• Neuchovávejte pero FORSTEO s nasazenou jehlou, může to způsobit tvorbu vzduchových bublin v náplni.
• Uchovávejte pero FORSTEO s nasazeným bílým krytem.
• Nikdy neuchovávejte pero FORSTEO v mrazničce.
• Pokud byl přípravek zmražen, pero znehodnoťte a použijte nové pero FORSTEO.
• Pokud bylo pero FORSTEO ponecháno mimo chladničku, nevyhazujte jej. Vraťte pero zpět do chladničky a kontaktujte svého lékaře nebo lékárníka.
Likvidace jehel a pera
Likvidace použitých jehel a pera FORSTEO
• Před likvidací pera FORSTEO nezapomeňte odstranit jehlu.
• Pero FORSTEO a použité jehly znehodnoťte podle pokynů svého lékaře nebo lékárníka.
• Pero znehodnoťte po 28 dnech po prvním použití.
Další důležité poznámky
• Pero FORSTEO obsahuje léčivý přípravek na 28 dní léčby.
• Nepřendávejte přípravek do stříkačky.
• Poznamenejte si datum první injekce do kalendáře.
• Pro správné používání přípravku si přečtěte a dodržujte pokyny uvedené v Příbalové informaci.
• Zkontrolujte si etiketu pera FORSTEO, abyste se ujistil/a, že používáte správný přípravek, a že není překročena doba použitelnosti.
• Kontaktujte svého lékaře nebo lékárníka, pokud zaznamenáte jakýkoli z následujících případů:
- Pero FORSTEO se zdá poškozené
- Roztok NENÍ čirý, bezbarvý a bez částic
• Pro každou injekci použijte novou jehlu.
• V průběhu aplikace můžete slyšet jedno nebo více cvaknutí - jedná se o běžnou činnost pera.
• Pero FORSTEO není určeno osobám nevidomým nebo osobám s poškozeným zrakem, pokud jim nemůže pomoci osoba, která je se správným používáním pera seznámena.
• Pero FORSTEO uchovávejte mimo dohled a dosah dětí._
Pro Eli Lilly and Company vyrábí Lilly France, F-67640 Fegersheim, Francie. Návod k obsluze pera byl naposledy revidován {MM/RRRR}_
29