Formano
sp.zn. sukls195301/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Formano
12 pg prášek k inhalaci v tvrdých tobolkách
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tobolka obsahuje 12 mikrogramů formoteroli fumaras (ve formě formoteroli fumaras dihydricus).
Pomocné látky: obsahuje monohydrát laktosy 23.99 mg.
Úplný seznam pomocných látek viz bod 6.1
3. LÉKOVÁ FORMA
Prášek k inhalaci v tvrdé tobolce.
Popis přípravku: průsvitná želatinová tobolka obsahující prášek k inhalaci.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Prevence bronchokonstrikce vyvolané tělesnou námahou, symptomatická léčba bronchiálního astmatu a jiných chronických obstrukčních plicních nemocí s reverzibilní složkou.
Symptomatická dlouhodobá léčba bronchiálního astmatu v kombinaci s dlouhodobou protizánětlivou terapií (např. kortikosteroidy).
Pozn.:
Dosud nebylo prokázáno, že by formoterol mohl nahradit léčbu kortikosteroidy. U bronchiálního astmatu musí být formoterol při inhalaci kombinován s kortikosteroidy.
4.2 Dávkování a způsob podání Tobolky jsou určeny pouze k inhalaci
Bronchodilatační účinek formoterolu je výrazný i za 12 hodin po inhalaci. U většiny pacientů je proto podávání dvakrát denně dostačující pro kontrolu bronchokonstrikce spojené s chronickými stavy během dne i v noci.
Dospělí:
Symptomatická léčba bronchiálního astmatu a jiných chronických obstrukčních plicních nemocí s reverzibilní složkou.
Obvyklá udržovací dávka je 1 inhalační tobolka (12 mikrogramů) dvakrát denně.
Pokud je nutné zmírnit přetrvávající symptomy, je možné přidat další 1-2 tobolky denně.
Maximální denní dávka je 4 inhalační tobolky (48 mikrogramů).
Pacient by měl být informován, že jestliže je nutné přidávat tobolky častěji než dvakrát v týdnu, je třeba poradit se s lékařem a léčbu přehodnotit, jelikož je možné, že došlo ke zhoršení stavu.
Profylaxe bronchospazmu vyvolaného námahou nebo před expozicí známému alergenu, které se nelze vyhnout:
Obsah 1 inhalační tobolky (12 mikrogramů) se inhaluje 15 minut před plánovanou činností či expozicí alergenem. U dospělých pacientů s těžkým astmatem může stav vyžadovat inhalaci obsahu 2 tobolek (24 mikrogramů).
Děti od 6 let:
Symptomatická léčba bronchiálního astmatu bez jiných chronických obstrukčních plicních nemocí s reverzibilní složkou:
Obvyklá udržovací dávka je 1 inhalační tobolka (12 mikrogramů) dvakrát denně.
Pokud je nutné zmírnit potenciální symptomy, je možné přidat další 1-2 tobolky denně.
Maximální denní dávka je 4 inhalační tobolky (48 mikrogramů).
Pacient by měl být informován, že jestliže je nutné přidávat tobolky častěji než dvakrát v týdnu, je třeba poradit se s lékařem a léčbu přehodnotit, jelikož je možné, že došlo ke zhoršení stavu.
Prevence bronchospazmu způsobeného vdechnutím alergenu či tělesnou námahou:
Obsah 1 inhalační tobolky (12 mikrogramů) se inhaluje 15 minut před plánovanou činností či expozicí alergenem.
Přípravek není určen pro děti mladší 6 let.
Poškození ledvin a jater:
Neexistuje teoretický důvod pro úpravu dávky u pacientů s poškozením ledvin či jater, avšak klinické údaje podporující použití přípravku u těchto pacientů nejsou k dispozici.
Je třeba zajistit, aby pacient byl lékařem či lékárníkem seznámen se způsobem použití inhalátoru.
Návod k použití: 1. Sejměte kryt.
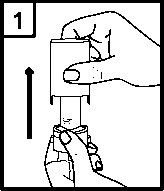
2. Pevně držte spodní část inhalátoru a otevřete jej otáčením náustku ve směru šipky.

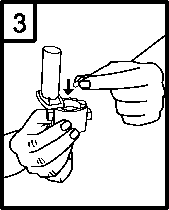
3. Suchou rukou umístěte jednu tobolku do zásobníku ve tvaru tobolky na spodní části inhalátoru.
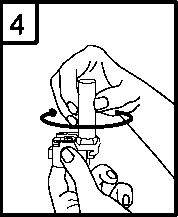
4. Našroubujte náustek tak, aby byl inhalátor uzavřen.
5. Držte inhalátor ve svislé pozici (náustkem vzhůru) a naráz jednou pevně zmáčkněte obě tlačítka. Tím se propíchne tobolka. Tlačítka uvolněte.
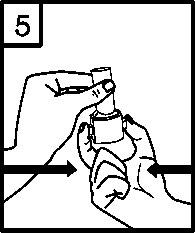
Pozn.: Je možné, že se želatinová tobolka rozpadne a během inhalace do úst a krku vniknou malé části želatiny. Ty jsou zcela neškodné a po polknutí se stráví. Riziko rozpadu tobolky omezíte, pokud tobolku vyjmete z blistru těsně před použitím a tlačítka zmáčknete pouze jednou.
6. Hluboce vydechněte.
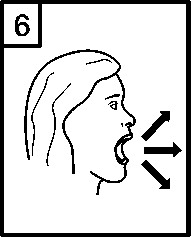
7. Umístěte náustek do úst a mírně zakloňte hlavu. Sevřete rty pevně kolem náustku a co nejrychleji a nejhlouběji nadechněte.
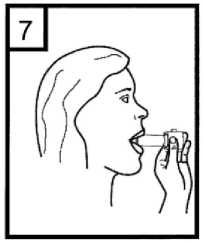
8. Zadržte dech tak dlouho, jak je to pro Vás příjemné a vyjměte inhalátor z úst. Poté normálně dýchejte. Otevřete inhalátor a zkontrolujte, zda uvnitř nezůstal zbytek prášku. Pokud uvnitř zůstal zbytek prášku, opakujte kroky 6 až 8.
9. Po použití odstraňte zbytek tobolky a zavřete náustek.
Čištění inhalátoru: K odstranění zbývajícího prášku vyčistěte zásobník na tobolku suchou utěrkou. Je možné použít i čistý měkký kartáček.
4.3 Kontraindikace
Hypersenzitivita na formoterol, obecně na beta-2 agonisty nebo na laktosu (která obsahuje malé množství mléčných proteinů) nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a zvláštní opatření pro použití
Formoterol nesmí být používán (a je nedostačující) jako lék první volby na astma.
Pacienti s astmatem, jejichž léčba vyžaduje užívání P2-agonistů s dlouhou dobou účinku, musí rovněž užívat optimální udržovací protizánětlivou léčbu, jejíž součástí jsou kortikosteroidy. Pacienty je nutno poučit, aby pokračovali v užívání protizánětlivé léčby i po zavedení formoterolu do léčby, a to i v případě, že příznaky poleví. Jestliže příznaky přetrvávají nebo je třeba zintenzivnit léčbu P2-agonisty, znamená to zhoršení základního onemocnění a nutnost přehodnocení udržovací léčby.
I když formoterol lze nasadit jako přídatnou léčbu k inhalačním kortikosteroidům, pokud při nich nejsou dostatečně kontrolovány příznaky astmatu, léčba formoterolem nesmí být zahájena v průběhu těžké akutní exacerbace astmatu nebo v případě významného zhoršení nebo akutního zhoršení astmatu. Během léčby formoterolem se mohou vyskytovat závažné nežádoucí účinky související s astmatem a exacerbace astmatu. Pacienty je nutno poučit, aby pokračovali v léčbě, ale zároveň vyhledali lékařskou pomoc v případě, že po zahájení léčby formoterolem nadále nebudou příznaky astmatu pod kontrolou nebo se zhorší. Po zvládnutí příznaků astmatu lze uvažovat o postupném snížení dávky formoterolu. Při snižování léčby je důležitá pravidelná kontrola pacientů. Je třeba použít nejnižší účinnou dávku formoterolu.
Maximální denní dávka nesmí být překročena. Nebyla stanovena dlouhodobá bezpečnost obvyklé léčby při dávkách vyšších než 36 mikrogramů denně u dospělých s astmatem, 18 mikrogramů denně u dětí s astmatem a 18 mikrogramů denně u pacientů s chronickou obstrukční plicní nemocí (CHOPN).
Častá potřeba užívání léků (tj. při profylaktické léčbě například kortikosteroidy a P2-agonisty s dlouhodobým účinkem) v prevenci námahou indukované bronchokonstrikce několikrát každý týden, a to přes adekvátní udržovací léčbu, může být známkou suboptimální kontroly astmatu a vyžaduje přehodnocení léčby astmatu a zhodnocení dodržování léčebného režimu pacientem.
Opatrnost je nutná při léčbě pacientů s tyreotoxikózou, feochromocytomem, hypertrofickou obstrukční kardiomyopatií, idiopatickou subvalvulární aortální stenózou, těžkou hypertenzí, aneurysmatem či jiným vážným kardiovaskulárním onemocněním, jako je ischemická choroba srdeční, tachyarytmie nebo těžké srdeční selhání.
Formoterol může indukovat prodloužení intervalu QTc. Opatrnost je nutná při léčbě pacientů s prodlouženým intervalem QTc a u pacientů léčených přípravky, které mají vliv na interval QTc (viz bod 4.5).
Vzhledem k hyperglykemickým účinkům P2-agonistů se u pacientů s diabetes mellitus zpočátku doporučuje rozšířené sledování hladiny glukózy v krvi.
Léčba P2-agonisty může vést k potenciálně závažné hypokalémii. Zvláštní opatrnost se doporučuje u těžkého akutního astmatu, protože rizika, která s jejich podáváním souvisejí, mohou být zesílena hypoxií. Hypokalemický účinek může být zesílen souběžným podáváním xantinových derivátů, steroidů a diuretik. Proto musí být sledovány hladiny draslíku v krevním séru.
Stejně jako u jiné inhalační léčby, je nutno zvážit možnost výskytu paradoxního bronchospasmu. Pokud k němu dojde, je nutno léčbu okamžitě přerušit a zahájit alternativní léčbu (viz bod 4.8).
Formoterol obsahuje monohydrát laktosy (méně než 500 mikrogramů na jednu podávanou dávku). Toto množství běžně nezpůsobuje problémy u osob s intolerancí laktosy. Pacienti se vzácnou dědičnou intolerancí galaktosy, vrozeným deficitem laktasy nebo glukoso-galaktosovou malabsorpcí nesmí tento přípravek užívat.
Děti ve věku do 6 let nesmí být formoterolem léčeny, protože pro tuto věkovou skupinu není k dispozici dostatek zkušeností.
Stejně jako ostatní beta2-mimetika, i formoterol může zeslabit porodní bolesti prostřednictvím relaxace děložních hladkých svalů.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
S formoterolem nebyly provedeny žádné specifické studie interakcí.
Souběžná léčba jinými sympatomimetiky, například P2-agonisty nebo efedrinem, může zesilovat nežádoucí účinky formoterolu a může vyžadovat titraci dávky.
Souběžná léčba deriváty xantinu, steroidy nebo diuretiky, jako jsou tiazidy a kličková diuretika, může zesilovat vzácné hypokalemické nežádoucí účinky P2-agonistů. U pacientů léčených digitalisovými glykosidy může hypokalémie zvyšovat náchylnost k arytmiím.
Existuje teoretické riziko, že souběžná léčba jinými léčivými přípravky, o nichž je známo, že prodlužují interval QTc, může vést k farmakodynamickým interakcím s formoterolem a zvyšovat možné riziko komorových arytmií. Mezi tyto léčivé přípravky patří například některá antihistaminika (např. terfenadin, astemizol, mizolastin), některá antiarytmika (např. chinidin, disopyramid, prokainamid), erytromycin, fenotiaziny a tricyklická antidepresiva.
Kombinace kortikosteroidů a formoterolu může vyvolat zvýšený hyperglykemický účinek.
U pacientů, kteří současně podstupují anestezii halogenovanými uhlovodíky, existuje zvýšené riziko arytmií.
Bronchodilatační účinky formoterolu lze zesílit anticholinergiky, kortikosteroidy a xantinovými deriváty.
Beta-adrenergní blokátory mohou zeslabovat nebo rušit účinek formoterolu. Formoterol proto nesmí být podáván spolu s beta-adrenergními blokátory (včetně očních kapek), nejsou-li k tomu závažné důvody.
Inhibitory monoaminooxidázy: Formoterol může interagovat s inhibitory monoaminooxidázy a neměl by být podáván pacientům, kteří je užívají, ani během 14 dnů po ukončení jejích užívání.
4.6 Těhotenství a kojení
Údaje o podávání formoterolu těhotným ženám jsou nedostatečné. Ve studiích na zvířatech formoterol způsoboval ztráty při implantaci, snížené přežíváni časně po porodu a sníženou porodní hmotnost. Tyto účinky se dostavily při výrazně vyšších systémových expozicích, než jakých je dosahováno při klinickém použití formoterolu. O léčbě formoterolem je možné uvažovat ve všech fázích těhotenství, pokud je nutná ke zvládnutí astmatu a pokud je předpokládaná prospěšnost pro matku větší než možné riziko pro plod. Možné riziko pro člověka není známo.
Není známo, zda se formoterol vylučuje do lidského mateřského mléka. U potkanů byla v mateřském mléku zjištěna malá množství formoterolu. O podávání formoterolu kojícím ženám lze uvažovat pouze v případě, že předpokládaná prospěšnost pro matku je větší než možné riziko pro dítě.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Formoterol nemá žádný vliv na schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Nejčastěji hlášené nežádoucí příhody terapie pomocí P2-agonistů jako třes a palpitace jsou obvykle mírné a ustupují po několika dnech léčení.
Nežádoucí reakce spojované s podáváním formoterolu jsou uvedeny dále, a to podle tříd orgánových systémů a frekvence. Frekvence je definována následujícím způsobem: velmi časté (>1/10), časté (>1/100 a <1/10), méně časté (>1/1 000 a < 1/100), vzácné (>1/10 000 a < 1/1000) a velmi vzácné (<1/10 000).
|
Srdeční poruchy |
časté |
Palpitace. |
|
méně časté | ||
|
vzácné |
Srdeční arytmie, např. fibrilace síní, supraventrikulární tachykardie, extrasystoly. | |
|
velmi vzácné |
Angina pectoris, prodloužení intervalu QTc | |
|
Gastrointestinální poruchy |
vzácné |
Nevolnost, oropharyngeální podráždění |
|
Poruchy imunitního systému |
vzácné |
Reakce z přecitlivělosti, např. bronchospazmus, exantém, kopřivka, svědění, závažná hypotenze, angioedém |
|
velmi vzácné |
Periferní edém | |
|
Poruchy metabolismu a výživy |
vzácné |
hypokalémie |
|
velmi vzácné |
Hyperglykémie, hyperkalémie | |
|
Poruchy pohybového systému, a pojivové tkáně poruchy |
méně časté |
Svalové křeče, myalgie |
|
Poruchy nervového systému |
časté |
Bolesti hlavy, třes |
|
méně časté | ||
|
vzácné |
poruchy chuti | |
|
Psychiatrické poruchy |
méně časté |
Agitovanost, neklid, poruchy spánku |
|
Cévní poruchy |
velmi vzácné |
Změny v krevním tlaku |
|
Respirační, hrudní a mediastinální poruchy |
méně časté |
Zvlášť závažný bronchospasmus |
Jako u každé inhalační terapie se ve velmi vzácných případech může vyskytnout paradoxní bronchospasmus (viz bod 4.4).
Léčba pomocí R2-agonistů může vést ke zvýšení hladin krevního inzulínu, volných kyselin mastných, glycerolu a ketonových tělísek.
Pomocná látka laktóza obsahuje malá množství mléčných proteinů. Ty mohou vyvolávat alergické reakce.
4.9 Předávkování
Klinické zkušenosti s léčbou předávkování jsou omezené. Předávkování by pravděpodobně vedlo k účinkům typickým pro P2-agonisty: třes, bolesti hlavy, bušení srdce, tachykardie, hyperglykémie, hypokalémie, prodloužený interval QTc, komorové arytmie, ospalost, metabolická acidóza, hypotenze, nevolnost a zvracení. Beta-2 agonisté mohou vyvolat projevy ischemické choroby srdeční náhlým snížením diastolického krevního tlaku nebo precipitací srdečních arytmií.
Léčba:
Podpůrná a symptomatická.
V závažných případech by měl být pacient přijat do nemocnice.
Lze zvážit použití kardioselektivních betablokátorů, avšak pouze se zachováním extrémní opatrnosti, protože použití P-adrenergních blokátorů může vyvolat bronchospasmus. Je nutno sledovat draslík v krevním séru.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiastmatikum, bronchodilatans, selektivní beta2- mimetikum ATC kód: R03AC13
Formoterol je silné selektivní beta2-adrenomimetikum. U pacientů s reverzibilní obstrukcí dýchacích cest působí bronchodilatačně. Účinek nastupuje velmi rychle (během 1-3 minut) a trvá ještě za 12 hodin po inhalaci. V terapeutických dávkách jsou účinky na ardiovaskulární systém minimální a vyskytují se jen příležitostně.
Formoterol inhibuje uvolnění histaminu a leukotrienů z pasivně senzibilizovaných lidských plic. U zvířat byly pozorovány některé z jeho protizánětlivých účinků, jako je potlačení edému a pokles kumulace zánětlivých buněk.
U člověka bylo prokázáno, že Formoterol je účinný v prevenci bronchospazmu, vyvolaného inhalačními alergeny, námahou, chladem, histaminem nebo metacholinem.
Formoterol aplikovaný inhalátorem Aerolizer dvakrát denně v dávkách 12 a 24 mikrogramů působí u pacientů se stabilní chronickou obstrukční plicní nemocí s reverzibilní složkou rychlý nástup bronchodilatace, která přetrvává ještě za 12 hodin. Kromě toho je léčba subjektivně doprovázena zlepšením kvality života, hodnocené pomocí dotazníku (Saint George's Respiratory Questionnaire).
5.2. Farmakokinetické vlastnosti
Absorpce:
Je pravděpodobné, že kolem 90 % podané dávky formoterolu je spolknuto a vstřebává se z gastrointestinálního traktu. To znamená, že farmakokinetické vlastnosti perorálních forem platí i u inhalačního prášku.
Perorální aplikace až do dávky 300 mikrogramů jsou rychle absorbovány z gastrointestinálního traktu. Vrcholové plazmatické koncentrace nezměněné látky jsou dosaženy za 0,5-1 hodinu po podání. Absorpce po podání perorální dávky 80 mikrogramů činí 65 % a více.
Farmakokinetika formoterolu byla v rozmezí zkoumaných perorálních dávek (20-300 mikrogramů) lineární. Při opakovaném perorálním podání 40-160 mikrogramů denně nedochází k signifikantní kumulaci léku v organismu.
Po inhalaci terapeutických dávek nebylo možné formoterol zjistit v plazmě běžnými analytickými metodami. Z rozboru vylučované moče bylo zjištěno, že inhalační formoterol se rychle vstřebává. Maximální rychlosti exkrece po podání 12-96 mikrogramů bylo dosaženo během 1-2 hodin po inhalaci. Při podání vyšší dávky (jednorázově 120 mikrogramů), než je dávka terapeutická, bylo vrcholu plazmatické koncentrace (266 pmol/l) dosaženo za 5 minut po inhalaci. U pacientů s chronickou obstrukční plicní nemocí s reverzibilní složkou, léčených po dobu 12 týdnů formoterol fumarátem dvakrát denně v dávkách 12 nebo 24 mikrogramů, byla koncentrace formoterolu v plazmě po inhalaci za 10 min. 11,5 až 25,7 pmol/l, za 2 hodiny 23,3 a 6 hodin 50,3 pmol/l.
Kumulativní exkrece formoterolu močí po podání prášku k inhalaci (12-24 mikrogramů) a dvou různých aerosolových forem (12-96 mikrogramů) ukazuje na dávce závislé zvýšení objemu formoterolu v oběhu.
Distribuce:
Vazba formoterolu na plazmatické bílkoviny je 61-64 % (váže se zejména na albumin z 34 %).
V rozmezí koncentrací dosažených terapeutickými dávkami nedochází k úplné saturaci vazebných míst.
Biotransformace:
Formoterol je eliminován primárně glukuronidací. Významný podíl na metabolizaci má O-demetylace následovaná glukuronidací.
Biotransformace je katalyzována několika isoenzymy systému CYP450 (2D6, 2C19, 2C9, a 2A6), proto je potenciál pro metabolické lékové interakce nízký. Kinetika formoterolu je podobná po jednorázovém i opakovaném podávání, což svědčí o nepřítomnosti auto-indukce či inhibice metabolismu.
Eliminace:
Vylučování formoterolu je pravděpodobně vícefázové. Stanovení biologického poločasu závisí na rozmezí sledovaného časového intervalu. Na základě plazmatických nebo sérových koncentrací formoterolu 6, 8 nebo 12 hodin po perorálním podání byl poločas vylučování stanoven na 2 až 3 hodiny. Na základě rychlosti vylučování do moče mezi 3 a 16 hodinami po inhalaci byl poločas vylučování určen na 5 hodin.
Formoterol a jeho metabolity jsou úplně vylučovány z organizmu, asi 2/3 (perorální) dávky se vyloučí močí a 1/3 stolicí. Po inhalaci se v průměru asi 6 až 9 % dávky vyloučí v nezměněné formě močí. Renální clearance formoterolu z krve je 150 ml/min.
5.3 Předklinické údaje vztahující se k bezpečnosti přípravku
Mutagenita:
Testy na mutagenitu byly provedeny se zaměřením na široké rozmezí hodnocených parametrů. V žádných in vitro a in vivo studiích nebyly zjištěny žádné genotoxické účinky.
Karcinogenita:
V 2leté studii na potkanech a myších nebyl prokázán karcinogenní potenciál.
U samců myší, kterým byly podávány vysoké dávky, bylo zaznamenáno mírné zvýšení výskytu benigních tumorů nadledvin ze subkapsulárních buněk. Předpokládá se, že se jedná o projev změn ve fyziologickém procesu stárnutí.
Dvě studie na potkanech, které zahrnovaly dvě různá dávková rozmezí, ukázaly vzestup výskytu mezovariálních leiomyomů. Tato benigní neoplazmata jsou u potkanů typická v souvislosti s dlouhodobou léčbou a s vysokými dávkami beta2-adrenergních látek.
Byl také zjištěn zvýšený výskyt ovariálních cyst a benigních granulomů/ tumorů thekálních buněk; je známo, že beta2-mimetika působí na ovária u samic potkanů a jsou pravděpodobně specifické pro hlodavce. Při používání vysokých dávek byl ještě zjištěn výskyt jiných druhů nádorů, které se však četností neliší od populace sledované v minulosti a výskyt těchto nádorů nebyl zjištěn při nízkých dávkách.
Výskyt žádného typu nádoru nebyl statisticky významně zvýšen při použití nejnižší dávky; ani u dávky, která vedla k expozici 10x vyšší, než je maximální doporučená dávka formoterolu.
Na základě těchto nálezů a nepřítomnosti mutagenního účinku, je možné uzavřít, že použití formoterolu v terapeutických dávkách nepředstavuje karcinogenní riziko.
Reprodukční toxicita:
Při pokusech na zvířatech nebyl zjištěn žádný teratogenní účinek. Po perorálním podání byl formoterol vylučován do mléka potkaních samic.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Monohydrát laktosy.
Tobolky obsahují želatinu.
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25oC. Uchovávejte v původním obalu.
6.5 Druh obalu a velikost balení
PVC/PVDC blistr.
Velikost balení:
1 inhalátor + 10, 20, 30, 50, 56, 60, 100, 120, 180 nebo 200 tobolek.
2 inhalátory + 100 tobolek.
4 inhalátory + 200 tobolek.
50 inhalátorů+ 500 tobolek.
50 nebo 60 tobolek bez inhalátoru.
Na trhu nemusí být všechny velikosti balení.
6.6 Návod k použití přípravku, zacházení s ním
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
EXELTIS CZECH s.r.o.
Želetavská 1449/9 140 00 Praha 4 - Michle Česká republika
8. REGISTRAČNÍ ČÍSLO
14/001/06-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
18.1.2006/5.2.2009
10. DATUM REVIZE TEXTU
11.11.2015