Fertavid 900 Iu/1,08Ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Fertavid 50 IU/0,5 ml injekční roztok Fertavid 75 IU/0,5 ml injekční roztok Fertavid 100 IU/0,5 ml injekční roztok Fertavid 150 IU/0,5 ml injekční roztok Fertavid 200 IU/0,5 ml injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Fertavid 50 IU/0,5 ml injekční roztok
Jedna injekční lahvička obsahuje 50 IU rekombinantního folikuly stimulačního hormonu (FSH) v 0,5 ml vodného roztoku. To odpovídá síle 100 IU/ml. Jedna injekční lahvička obsahuje 5 mikrogramů proteinu (specifická biologická aktivita in vivo odpovídá přibližně 10 000 IU FSH/mg proteinu). Injekční roztok obsahuje léčivou látku follitropinum beta, produkovanou pomocí genetického inženýrství buněčnou linií ovariálních buněk křečka čínského (CHO).
Fertavid 75 IU/0,5 ml injekční roztok
Jedna injekční lahvička obsahuje 75 IU rekombinantnífolikuly stimulačního hormonu (FSH) v 0,5 ml vodného roztoku. To odpovídá síle 150 IU/ml. Jedna injekční lahvička obsahuje 7,5 mikrogramů proteinu (specifická biologická aktivita in vivo odpovídá přibližně 10 000 IU FSH/mg proteinu). Injekční roztok obsahuje léčivou látku follitropinum beta, produkovanou pomocí genetického inženýrství buněčnou linií ovariálních buněk křečka čínského (CHO).
Fertavid 100 IU/0,5 ml injekční roztok
Jedna injekční lahvička obsahuje 100 IU rekombinantního folikuly stimulačního hormonu (FSH) v 0,5 ml vodného roztoku. To odpovídá síle 200 IU/ml. Jedna injekční lahvička obsahuje 10 mikrogramů proteinu (specifická biologická aktivita in vivo odpovídá přibližně 10 000 IU FSH/mg proteinu). Injekční roztok obsahuje léčivou látku follitropinum beta, produkovanou pomocí genetického inženýrství buněčnou linií ovariálních buněk křečka čínského (CHO).
Fertavid 150 IU/0,5 ml injekční roztok
Jedna injekční lahvička obsahuje 150 IU rekombinantního folikuly stimulačního hormonu (FSH) v 0,5 ml vodného roztoku. To odpovídá síle 300 IU/ml. Jedna injekční lahvička obsahuje 15 mikrogramů proteinu (specifická biologická aktivita in vivo odpovídá přibližně 10 000 IU FSH/mg proteinu). Injekční roztok obsahuje léčivou látku follitropinum beta, produkovanou pomocí genetického inženýrství buněčnou linií ovariálních buněk křečka čínského (CHO).
Fertavid 200 IU/0,5 ml injekční roztok
Jedna injekční lahvička obsahuje 200 IU rekombinantního folikuly stimulačního hormonu (FSH) v 0,5 ml vodného roztoku. To odpovídá síle 400 IU/ml. Jedna injekční lahvička obsahuje 20 mikrogramů proteinu (specifická biologická aktivita in vivo odpovídá přibližně 10 000 IU FSH/mg proteinu). Injekční roztok obsahuje léčivou látku follitropinum beta, produkovanou pomocí genetického inženýrství buněčnou linií ovariálních buněk křečka čínského (CHO).
Pomocná látka/Pomocné látky se známým účinkem:
Tento léčivý přípravek obsahuje méně než 1 mmol (23 mg) sodíku na injekci, tj. v podstatě je „bez sodíku“.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok (injekce). Čirý a bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
U dospělých žen:
Fertavid je určen pro léčbu ženské infertility při těchto klinických situacích:
• Anovulace (včetně syndromu polycystických ovárií, PCOS) u žen, které nereagovaly na léčbu klomifen-citrátem.
• Řízená hyperstimulace ovárií k indukci vývoje mnohočetných folikulů v programech asistované reprodukce [např. in vitro fertilizace/embryo transfer (IVF/ET), tubární přenos gamet (GIFT)
a intracytoplazmatická injekce spermie (ICSI)].
U dospělých mužů:
• Poruchy spermatogeneze u hypogonadotropního hypogonadismu.
4.2 Dávkování a způsob podání
Léčba přípravkem Fertavid má být zahájena pod dohledem lékaře, který má zkušenost s léčbou infertility.
První injekce přípravku Fertavid by měla být podána pod přímým lékařským dohledem.
Dávkování
Dávkování u žen
V odpovědi ovárií na exogenní gonadotropiny existují velké inter- a intraindividuální rozdíly. Proto je nemožné stanovit jednotné dávkovací schéma. Z toho důvodu má být dávkování individuálně upraveno v závislosti na odpovědi ovárií. K tomu je zapotřebí ultrazvukové vyšetření zrání folikulů. Rovněž může být užitečné současně stanovit sérové hladiny estradiolu.
Na základě výsledků srovnávacích klinických studiích je považováno za vhodné aplikovat nižší celkovou dávku přípravku Fertavid během kratšího období léčby, než je obecně používáno pro FSH získaný z moči, a to nejen v zájmu dosažení optimálního vývoje folikulů, ale také ke snížení rizika nechtěné ovariální hyperstimulace (viz bod 5.1).
Klinická zkušenost s přípravkem Fertavid je založena až na třech léčebných cyklech v obou indikacích. Celková zkušenost s IVF ukazuje, že během prvních čtyř pokusů zůstává úspěšnost léčby většinou stabilní a poté se postupně snižuje.
• Anovulace
Doporučuje se sekvenční léčebné schéma začínající podáváním 50 IU přípravku Fertavid denně. Počáteční dávka se nemění po dobu nejméně sedmi dnů. Nedojde-li k žádné odpovědi ovárií, je denní dávka postupně zvyšována až do zaznamenání adekvátní farmakodynamické odpovědi na základě zvýšeného růstu folikulů nebo plazmatické hladiny estradiolu. Za optimální je považováno denní zvýšení hladiny estradiolu o 40-100 %. Denní dávka se pak nemění až do dosažení preovulačního stavu. Preovulačního stavu je dosaženo tehdy, kdy podle ultrasonografického nálezu dosáhne dominantní folikul nejméně 18 mm v průměru a/nebo při dosažení plazmatických hladin estradiolu 300-900 pikogramů/ml (1 000-3 000 pmol/1). K dosažení tohoto stavu obvykle postačí léčba v trvání 7-14 dnů. Podávání přípravku Fertavid je poté přerušeno a ovulace může být indukována podáním humánního choriového gonadotropinu (hCG).
Je-li množství reagujících folikulů příliš vysoké nebo zvyšují-li se hladiny estradiolu příliš rychle, tzn. dochází-li ke dvojnásobnému zvýšení hladiny estradiolu častěji než jednou denně dva či tři po sobě následující dny, má být denní dávka snížena.
Vzhledem k tomu, že folikuly větší než 14 mm mohou vést k těhotenství, představují vícečetné preovulační folikuly větší než 14 mm riziko vícečetného těhotenství. V takovém případě nemá být hCG aplikován a těhotenství je třeba se vyhnout, aby se zabránilo vícečetnému těhotenství.
• Řízená ovariální hvperstimulace v programech asistované reprodukce
Používají se různé stimulační protokoly. Minimálně pro první čtyři dny je doporučena počáteční dávka 100-225 IU. Poté může být dávka individuálně upravena na základě odpovědi ovárií.
V klinických studiích bylo prokázáno, že postačující udržovací dávka se pohybuje v rozmezí 75-375 IU po dobu šesti až dvanácti dní, někdy však může být nutná delší léčba.
Fertavid může být podáván samotný nebo v kombinaci s agonistou nebo antagonistou GnRH pro prevenci předčasné luteinizace. Je-li podáván s agonistou GnRH, může být zapotřebí vyšší celková léčebná dávka přípravku Fertavid.
Odpověď ovárií je monitorována ultrazvukovým vyšetřením. Rovněž může být užitečné současně stanovit sérové hladiny estradiolu. Konečná fáze dozrávání folikulů je indukována podáním hCG poté, co je ultrazvukovým vyšetřením zjištěna přítomnost nejméně tří folikulů o velikosti 16-20 mm a je prokázána dobrá odpověď estradiolu (plazmatické hladiny asi 300-400 pikogramů/ml (1 000-1 300 pmol/1) pro každý folikul o průměru větším než 18 mm). Získání oocytů je provedeno o 34-35 hodin později.
Dávkování u mužů
Fertavid se podává v dávce 450 IU/týden, nejlépe rozdělen do 3 dávek po 150 IU společně s hCG.
V léčbě přípravkem Fertavid a hCG je třeba pokračovat nejméně 3-4 měsíce, než lze očekávat jakékoliv zlepšení spermatogeneze. K posouzení odpovědi se doporučuje analýza spermatu za 4 až 6 měsíců po zahájení léčby. Pokud pacient po tomto období nereagoval, je možno v kombinované terapii pokračovat, stávající klinická zkušenost ukazuje, že pro dosažení spermatogeneze může být zapotřebí léčba trvající 18 měsíců nebo déle.
Pediatrická populace
Ve schválené indikaci není u pediatrické populace pro přípravek Fertavid žádné relevantní použití. Způsob podávání
Fertavid má být podáván pomalu intramuskulárně nebo podkožně, aby se zabránilo bolesti při podání injekce a úniku z místa injekce. Místo podkožní injekce je třeba měnit, aby nedošlo k atrofii tukové tkáně. Veškerý nepoužitý roztok má být znehodnocen.
Podkožní injekce přípravku Fertavid může být aplikována pacientkou nebo partnerem za předpokladu předchozího náležitého poučení lékařem. Aplikace přípravku Fertavid samotnou pacientkou je možná pouze u pacientek, které jsou motivovány, náležitě zaškoleny a mají možnost porady s odborníkem.
4.3 Kontraindikace
Pro muže a ženy
• Hypersensitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku uvedenou v bodě 6.1.
• Nádory ovária, prsu, dělohy, varlat, hypofýzy nebo hypotalamu.
• Primární gonadální porucha
Navíc pro ženy
• Vaginální krvácení dosud nejasné etiologie.
• Ovariální cysty nebo zvětšená ovária bez souvislosti se syndromem polycystických ovárií (PCOS).
• Malformace reprodukčních orgánů neslučitelné s těhotenstvím.
• Myomy dělohy neslučitelné s těhotenstvím.
4.4 Zvláštní upozornění a opatření pro použití
Hypersenzitivní reakce na antibiotika
• Fertavid může obsahovat stopy streptomycinu a/nebo neomycinu. Tato antibiotika mohou u náchylných osob způsobovat reakce z přecitlivělosti.
Vyšetření na neplodnost před zahájením léčby
Před zahájením léčby je nutno neplodnost párů řádně vyšetřit. Pacienty je nutno vyšetřit zejména na hypothyroidismus, insuficienci nadledvin, hyperprolaktinémii a nádory hypofýzy nebo hypothalamu, a je nutno podat příslušnou léčbu.
U žen
Ovariální hyperstimulační syndrom (OHSS)
OHSS je zdravotní příhoda odlišná od nekomplikovaného zvětšení ovárií. Klinickými známkami a příznaky mírného až středně závažného ovariálního hyperstimulačního syndromu jsou bolesti břicha, nauzea, průjem, mírné až střední zvětšení ovárií a ovariální cysty. Závažný OHSS můž být život ohrožující. Klinickými známkami a příznaky závažného ovariálního hyperstimulačního syndromu jsou velké ovariální cysty, akutní bolesti břicha, ascites, pleurální výpotek, hydrothorax, dušnost, oligurie, hematologické abnormality a přibývání na váze. Ve vzácných případech se v souvislosti s OHSS může objevit žilní nebo arteriální tromboembolie. V souvislosti s OHSS byly rovněž hlášeny přechodné abnormality jaterních funkčních testů, které naznačují jaterní dysfunkci s morfologickými změnami při biopsii jater nebo bez nich.
OHSS může být vyvolán podáním lidského choriového gonadotropinu (hCG) a těhotenstvím (endogenním hCG). Časný OHSS se obvykle objeví během 10 dní po podání hCG a může souviset s nadměrnou odpovědí ovárií na stimulaci gonadotropinem. Pozdní OHSS se objevuje více než 10 dní po podání hCG, jako důsledek hormonálních změn v těhotenství. Kvůli riziku vzniku OHSS je nutno pacientky sledovat nejméně 2 týdny po podání hCG.
Ženy se známými rizikovými faktory pro silnou odpověď ovárií mohou být zvláště náchylné ke vzniku OHSS během léčby přípravkem Fertavid nebo po ní. U žen v prvním cyklu stimulace ovárií, u kterých jsou rizikové faktory známy pouze částečně, se doporučuje pečlivé sledování časných známek a příznaků OHSS.
Ke snížení rizika vzniku OHSS je nutno před léčbou provést ultrazvukové vyšetření vývoje folikulů a to pak provádět pravidelně v průběhu léčby. Rovněž může být užitečné současně stanovit hladiny sérového estradiolu. Při asistované reprodukci je riziko OHSS zvýšeno při 18 nebo více folikulech o průměru 11 mm nebo více. Pokud je folikulů celkem 30 nebo více, doporučuje se podávání hCG zastavit.
V závislosti na odpovědi ovárií lze ke snížení OHSS zvážit následující opatření:
- vysadit další stimulaci gonadotropinem na maximálně 3 dny (coasting);
- vysadit hCG a zrušit léčebný cyklus;
- podat dávku nižší než 10 000 IU močového hCG s cílem spustit konečné zrání oocytu, např. 5 000 IU močového hCG nebo 250 mikrogramů rec-hCG (což odpovídá přibližně 6 500 IU močového hCG);
- zrušit přenos čerstvého embrya a embrya dát ke kryoprezervaci;
- zamezit podávání hCG kvůli podpoře luteální fáze.
Pokud se OHSS vyvine, je nutno nasadit a dodržovat standartní a vhodnou léčbu OHSS.
Vícečetné těhotenství
U všech způsobů léčby gonadotropinem, včetně přípravku Fertavid, byla hlášena mnohočetná těhotenství a porody. Vícečetné těhotenství, především jeho pozdější stádia zvyšují riziko nežádoucích důsledků pro matku (komplikace v těhotenství a při porodu) a pro dítě (nízká porodní hmotnost). U anovulačních žen, které podstupují indukci ovulace může sledování vývoje folikulů za využití transvaginálního ultrazvuku napomoci stanovit, zda v cyklu pokračovat či nikoli, aby se snížilo riziko vícečetného těhotenství. Rovněž může být užitečné současně stanovovat hladiny sérového estradiolu. Pacientky je nutno před zahájením léčby na možnost vícečetného těhotenství upozornit.
U žen podstupujících asistovanou reprodukci (ART) riziko vícečetného těhotenství souvisí zejména s počtem přenesených embryí. Pokud se používá k cyklu indukujícímu ovulaci, měla by příslušná úprava dávky (příslušné úpravy dávek) FSH vývoji vícečetných folikulů zabránit.
Mimoděložní těhotenství
U infertilních žen, které se podrobují asistované reprodukci je zvýšena incidence mimoděložních těhotenství. Proto je důležité časné ultrazvukové potvrzení intrauterinní lokalizace těhotenství.
Spontánní _ potrat
Četnost nedokončených těhotenství je u žen podstupujících asistovanou reprodukci vyšší než u normální populace.
Cévní komplikace
Po léčbě gonadotropiny, včetně přípravku Fertavid, byly hlášeny tromboembolické příhody, jak v souvislosti s OHSS, tak s OHSS nesouvisející. Intravaskulární trombóza, která může vzniknout v žilách nebo arteriích, může vést ke snížení krevního průtoku životně důležitými orgány nebo končetinami. U žen s obecně uznávanými rizikovými faktory tromboembolických příhod, jako je osobní nebo rodinná anamnéza, silná obezita nebo trombofilie, může léčba gonadotropiny, včetně přípravku Fertavid, toto riziko dále zvýšit. U těchto žen je třeba přínosy podávání gonadotropinů, včetně přípravku Fertavid, zvážit proti rizikům. Je nutno však mít na paměti, že samotné těhotenství rovněž přináší zvýšené riziko trombózy.
Vrozené malformace
Incidence kongenitálních malformací při asistované reprodukci může být nepatrně vyšší než u spontánní koncepce. To může být způsobeno rozdíly v charakteristikách rodičů (např. věk matky, charakteristika spermií) a vícečetným těhotenstvím.
Torze ovária
Po léčbě gonadotropiny, včetně přípravku Fertavid, byly hlášeny torze ovárií. Torze ovária může souviset s dalšími rizikovými faktory, například OHSS, těhotenstvím, prodělanými břišními operacemi, anamnézou torze ovárií v minulosti, ovariálními cystami v přítomnosti či minulosti a s polycystickými ovárii. Poškození ovárií v důsledku sníženého přívodu krve lze omezit včasnou diagnózou a neprodlenou detorzí.
Nádory ovárií a _jiných částí reprodukčního systému
Byly hlášeny případy nádorů vaječníků a jiných orgánů reprodukčního systému a to benigních a maligních u žen, které podstoupily léčbu neplodnosti řadou různých způsobů léčby. Nejsou jednotné názory na to, zda léčebné užití gonadotropinů zvyšuje riziko těchto nádorů u neplodných žen.
Další zdravotní stavy
Před zahájením léčby přípravkem Fertavid je rovněž nutno vyhodnotit zdravotní stavy, které jsou kontraindikací těhotenství.
U mužů
Primární testikulární _porucha
Zvýšené hladiny endogenního FSH u mužů svědčí pro primární testikulární poruchu. Tito pacienti nereagují na léčbu kombinací Fertavid/hCG.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Současné použití přípravku Fertavid a klomifen-citrátu může zesílit folikulární odpověď. Po hypofyzární desenzibilaci vyvolané GnRH agonistou může být k dosažení adekvátní folikulární odpovědi zapotřebí podávat Fertavid ve vyšší dávce.
4.6 Fertilita, těhotenství a kojení
Fertilita
Fertavid se používá v léčbě žen podstupujících ovariální indukci nebo kontrolovanou ovariální hyperstimulaci v rámci programů asistované reprodukce. U mužů se Fertavid užívá v léčbě deficitní spermatogeneze podmíněné hypogonadotropním hypogonadismem. Dávkování a způsob podání viz bod 4.2.
Podávání přípravku Fertavid v těhotenství není indikováno. V případě neúmyslného podání během těhotenství nejsou dostatečné klinické údaje k vyloučení eratogenního působení rekombinantního FSH. Nicméně u těchto případů nebyl dosud hlášen žádný speciální malformační efekt. Ve studiích prováděných na zvířatech nebyl pozorován žádný teratogenní efekt.
Kojení
Nejsou k dispozici žádné informace z klinických hodnocení nebo ze studií na zvířatech o vylučování follitropinu beta do mléka. Vzhledem k vysoké molekulární hmotnosti follitropinu beta je nepravděpodobné, že by se tato látka vylučovala do lidského mateřského mléka. Pokud by byl follitropin beta vylučován do lidského mateřského mléka, byl by rozštěpen v gastrointestinálním traktu dítěte. Follitropin beta může ovlivňovat tvorbu mléka.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Fertavid nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Klinické užití přípravku Fertavid intramuskulární nebo podkožní aplikací může vyvolat lokální reakce v místě vpichu injekce (3 % všech léčených pacientů). Průběh těchto lokálních reakcí je mírný a přechodný. Generalizované reakce z přecitlivělosti byly pozorovány velmi zřídka (přibližně 0,2 % všech pacientů léčených follitropinem beta).
Léčba užen:
Z klinických studií bylo referováno o přibližně 4 % žen, které byly léčeny follitropinem beta a měly známky a příznaky syndromu ovariální hyperstimulace (OHSS) (viz bod 4.4). Nežádoucí účinky týkající se tohoto syndromu zahrnují bolest v oblasti pánve a/nebo tlak, bolest břicha a/nebo napětí, potíže s prsy a zvětšení ovárií.
V následující tabulce jsou uvedeny nežádoucí účinky follitropinu beta, hlášené v klinických studiích u žen, seřazené podle tříd orgánových systémů a četnosti; časté (> 1/100 až < 1/10), méně časté (> 1/1 000 až < 1/100).
|
Třída orgánového systému |
Četnost |
Nežádoucí účinky |
|
Poruchy nervového systému |
Časté | |
|
Gastrointestinální poruchy |
Časté |
Napětí břicha Bolest břicha |
|
Méně časté |
Břišní dyskomfort Zácpa | |
|
Poruchy reprodukčního systému a prsu |
Časté |
OHSS Bolest v oblasti pánve |
|
Méně časté |
Potíže s prsy1 Krvácení z dělohy mimo cyklus Ovariální cysta Zvětšení ovárií Ovariální torze Zvětšení dělohy Krvácení z pochvy |
|
Třída orgánového systému |
Četnost |
Nežádoucí účinky |
|
Celkové poruchy a reakce v místě aplikace |
Časté |
Reakce v místě aplikace injekce2 |
|
Méně časté |
Generalizovaná reakce přecitlivělosti3 |
1. Potíže s prsy zahrnují citlivost, bolest a/nebo napětí prsou a bolest bradavky
2. Lokální rekace v místě aplikace injekce zahrnují: modřiny, bolest, zarudnutí, otok a svědění
3. Ke generalizované reakci z přecitlivělosti patří zarudnutí, kopřivka, vyrážka a svědění
Navíc byla hlášena ektopická těhotenství, potraty a vícečetná těhotenství. Tyto jevy pravděpodobně souvisí s asistovanou reprodukcí nebo následným těhotenstvím.
Ve vzácných případech je léčba follitropinem beta/hCG spojena stejně jako ostatními gonadotropiny s rizikem tromboembolické příhody.
Léčba u mužů:
V následující tabulce jsou uvedeny nežádoucí účinky follitropinu beta, hlášené v klinických studiích u mužů (30 pacientů, kterým byl přípavek podán), seřazené podle tříd orgánových systémů a četnosti; časté (> 1/100 až < 1/10)._
|
Třída orgánového systému |
Četnost |
Nežádoucí účinky |
|
Poruchy nervového systému |
Časté | |
|
Poruchy kůže a podkožní tkáně |
Časté |
Akné |
|
Poruchy reprodukčního systému a prsu |
Časté |
Epididymální cysta Gynekomastie |
|
Celkové poruchy a reakce v místě aplikace |
Časté |
Reakce v místě aplikace injekce2 |
1. Nežádoucí účinky, které jsou hlášeny pouze jednou, jsou uvedeny jako časté, protože jediné hlášení
zvyšuje četnost nad 1 %.
2. Lokální reakce v místě aplikace injekce včetně indurace a bolesti.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Ohledně akutní toxicity přípravku Fertavid u člověka nejsou k dispozici žádné údaje, ale ve studiích u zvířat byla prokázána velmi nízká akutní toxicita přípravku Fertavid a z moči získaných preparátů gonadotropinů. Příliš vysoké dávkování FSH může mít za následek hyperstimulaci ovárií (viz bod 4.4).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: pohlavní hormony a modulátory pohlavního systému, gonadotropiny; ATC kód: GO3G A06.
Fertavid obsahuje rekombinantní FSH. Ten je vyráběn technikou rekombinace DNA za použití tkáňové kultury ovariálních buněk křečka čínského, do které byly přeneseny humánní geny pro podjednotku FSH. Primární sekvence aminokyselin je identická se sekvencí u přirozeného humánního FSH. Je známo, že existují malé rozdíly ve struktuře sacharidového řetězce.
Mechanismus účinku
FSH je nepostradatelný při normálním růstu a dozrávání folikulů a při gonadální produkci steroidů.
U ženy je hladina FSH kritická pro zahájení a trvání vývoje folikulů a následně pro načasování dozrání a pro počet folikulů, které dosáhly zralosti. Ve vybraných případech porušené gonadální funkce lze tedy Fertavid použít ke stimulaci vývoje folikulů a produkce steroidů. Fertavid lze dále použít pro podporu vícečetného vývoje folikulů v programech asistované reprodukce [např. in vitro fertilizace/embryo transfer (IVF/ET), tubární přenos gamet (GIFT) a intracytoplazmatická injekce spermie (ICSI)]. Obecně platí, že po léčbě přípravkem Fertavid následuje podání hCG k indukci konečné fáze dozrávání folikulů, zahájení meiózy a ruptury folikulu.
Klinická účinnost a bezpečnost
V klinických hodnoceních porovnávajících rekombinantní FSH (follitropin beta) a močový FSH při kontrolované ovariální stimulaci u žen zapojených do programu asistované reprodukce (ART) a při indukci ovulace (viz tabulky 1 a 2 níže) byl Fertavid účinnější než močový FSH, protože ke spuštění zrání folikulů bylo zapotřebí nižší celkové dávky a kratšího období léčby.
U kontrolované stimulace ovárií vedl Fertavid v porovnání s močovým FSH k vyššímu počtu oocytů získaných při nižší celkové dávce a kratším období léčby.
Tabulka 1: Výsledky klinického hodnocení 37 608 (randomizované klinické hodnocení s porovnáváním skupin, srovnávající bezpečnost a účinnost přípravku Fertavid s močovým FSH při kontrolované stimulaci ovárií)._
|
Fertavid (n = 546) |
u-FSH (n = 361) | |
|
Průměrný počet získaných oocytů |
10,84* |
8,95 |
|
Průměrná celková dávka (počet ampulek po 75 IU) |
28,5* |
31,8 |
|
Průměrné trvání stimulace pomocí FSH (dny) |
10,7* |
11,3 |
*Rozdíly mezi oběma skupinami byly statisticky významné (p < 0,05).
U ovariální indukce vedl Fertavid v porovnání s močovým FSH k nižšímu mediánu celkové dávky a ke kratšímu mediánu trvání léčby.
Tabulka 2: Výsledky klinického hodnocení 37 609 (randomizované klinické hodnocení s porovnáváním skupin, srovnávající bezpečnost a účinnost přípravku Fertavid s močovým FSH při ovariální indukci)._
|
Fertavid (n = 105) |
u-FSH (n = 66) | |
|
Průměrný počet folikulů > 12 mm |
3,6* |
2,6 |
|
> 15 mm |
2,0 |
1,7 |
|
> 18 mm |
1,1 |
0,9 |
|
Medián celkové dávky (IU)a |
750* |
1 035 |
|
Medián trvání léčby (dny)a |
10,0* |
13,0 |
* Rozdíly mezi oběma skupinami byly statisticky významné (p < 0,05). a Omezeno na ženy s indukovanou ovulací (Fertavid, n = 76; u-FSH, n = 42).
5.2 Farmakokinetické vlastnosti
Absorpce
Po intramuskulárním nebo podkožním podání přípravku Fertavid je dosaženo maximálních koncentrací FSH přibližně za 12 hodin. Po intramuskulárním podání přípravku Fertavid jsou maximální koncentrace FSH vyšší a jsou dosaženy dříve u mužů než u žen. V důsledku pozvolného uvolňování z místa injekce a poločasu eliminace přibližně 40 hodin (rozmezí 12 - 70 hodin) zůstává hladina FSH zvýšena po dobu 24 - 48 hodin. Vzhledem k poměrně dlouhému poločasu eliminace bude mít opakované podání stejné dávky za následek plazmatické koncentrace FSH, které jsou přibližně 1,5 - 2,5 krát vyšší než po podání jednotlivé dávky. Toto zvýšení umožňuje dosáhnout terapeutických koncentrací FSH.
Neexistují žádné významné farmakokinetické rozdíly mezi intramuskulárním a podkožním podáním přípravku Fertavid. Oba způsoby mají absolutní biologickou dostupnost přibližně 77 %.
Distribuce, biotransformace a eliminace
Rekombinantní FSH je biochemicky velmi podobný z moči získanému humánnímu FSH a je distribuován, metabolizován a vylučován stejným způsobem.
5.3 Předklinické údaje vztahující se k bezpečnosti
Podání jednotlivé dávky přípravku Fertavid laboratorním potkanům nevyvolalo žádné toxikologicky signifikantní účinky. Ve studiích opakovaného podávání u laboratorních potkanů (dva týdny) a u psů (13 týdnů) až do stonásobku maximální dávky používané u člověka nevyvolal Fertavid žádné toxikologicky signifikantní účinky. V Amesově testu ani in vitro testu chromozomových aberací u humánních lymfocytů nevykazoval Fertavid žádný mutagenní potenciál.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Fertavid injekční roztok obsahuje:
Sacharózu
Dihydrát citronanu sodného L-metionin Polysorbát 20 Vodu na injekci.
Pro úpravu pH mohly být použity hydroxid sodný a/nebo kyselina chlorovodíková.
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
3 roky.
Obsah injekční lahvičky má být použit bezprostředně po propíchnutí pryžového uzávěru.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem.
Uchovávejte injekční lahvičku(y) v krabičce.
Pro svou potřebu může pacient/ka uchovávat přípravek Fertavid při teplotě do 25°C jedno období nepřesahující 3 měsíce.
Podmínky uchovávání po prvním otevření léčivého přípravku jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
0,5 ml roztoku v injekční lahvičce na 3 ml (ze skla typu I) s uzávěrem (chlorbutylová pryž). Balení 1, 5 nebo 10 injekčních lahviček.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Roztok nepoužívejte, pokud obsahuje částice nebo pokud není čirý.
Obsah injekční lahvičky má být použit bezprostředně po propíchnutí pryžového uzávěru.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
Fertavid 50 IU/0,5 ml injekční roztok EU/1/09/510/001 EU/1/09/510/002 EU/1/09/510/003
Fertavid 75 IU/0,5 ml injekční roztok EU/1/09/510/004 EU/1/09/510/005 EU/1/09/510/006
Fertavid 100 IU/0,5 ml injekční roztok EU/1/09/510/007 EU/1/09/510/008 EU/1/09/510/009
Fertavid 150 IU/0,5 ml injekční roztok EU/1/09/510/010 EU/1/09/510/011 EU/1/09/510/012
Fertavid 200 IU/0,5 ml injekční roztok EU/1/09/510/013 EU/1/09/510/014 EU/1/09/510/015
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 19. března 2009
Datum posledního prodloužení registrace: 21. února 2014
10. DATUM REVIZE TEXTU
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
NÁZEV PŘÍPRAVKU
1.
Fertavid 150 IU/0,18 ml injekční roztok Fertavid 300 IU/0,36 ml injekční roztok Fertavid 600 IU/0,72 ml injekční roztok Fertavid 900 IU/1,08 ml injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Fertavid 150 IU/0,18 ml injekční roztok
Jeden kontejner obsahuje čistou (netto) celkovou dávku 150 IU rekombinantní folikuly stimulující hormon (FSH) v 0,18 ml vodného roztoku. Injekční roztok obsahuje léčivou látku follitropinum beta, produkovanou pomocí genetického inženýrství buněčnou linií ovariálních buněk křečka čínského (CHO) v koncentraci 833 IU/ml vodného roztoku. Tato síla odpovídá 83,3 mikrogramům proteinu/ml (specifická biologická aktivita in vivo odpovídající přibližně 10 000 IU FSH/mg proteinu).
Fertavid 300 IU/0,36 ml injekční roztok
Jeden kontejner obsahuje čistou (netto) celkovou dávku 300 IU rekombinantní folikuly stimulující hormon (FSH) v 0,36 ml vodného roztoku. Injekční roztok obsahuje léčivou látku follitropinum beta, produkovanou pomocí genetického inženýrství buněčnou linií ovariálních buněk křečka čínského (CHO) v koncentraci 833 IU/ml vodného roztoku. Tato síla odpovídá 83,3 mikrogramům proteinu/ml (specifická biologická aktivita in vivo odpovídající přibližně 10 000 IU FSH/mg proteinu).
Fertavid 600 IU/0,72 ml injekční roztok
Jeden kontejner obsahuje čistou (netto) celkovou dávku 600 IU rekombinantní folikuly stimulující hormon (FSH) v 0,72 ml vodného roztoku. Injekční roztok obsahuje léčivou látku follitropinum beta, produkovanou pomocí genetického inženýrství buněčnou linií ovariálních buněk křečka čínského (CHO) v koncentraci 833 IU/ml vodného roztoku. Tato síla odpovídá 83,3 mikrogramům proteinu/ml (specifická biologická aktivita in vivo odpovídající přibližně 10 000 IU FSH/mg proteinu).
Fertavid 900 IU/1,08 ml injekční roztok
Jeden kontejner obsahuje čistou (netto) celkovou dávku 900 IU rekombinantní folikuly stimulující hormon (FSH) v 1,08 ml vodného roztoku. Injekční roztok obsahuje léčivou látku follitropinum beta, produkovanou pomocí genetického inženýrství buněčnou linií ovariálních buněk křečka čínského (CHO) v koncentraci 833 IU/ml vodného roztoku. Tato síla odpovídá 83,3 mikrogramům proteinu/ml (specifická biologická aktivita in vivo odpovídající přibližně 10 000 IU FSH/mg proteinu).
Pomocná látka/Pomocné látky se známým účinkem:
Tento léčivý přípravek obsahuje méně než 1 mmol (23 mg) sodíku na injekci, tj. v podstatě je „bez sodíku“.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok (injekce).
Čirý a bezbarvý roztok.
Kontejnery s náplní jsou určeny k použití společně s injekčním perem.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
U dospělých žen:
Fertavid je určen pro léčbu ženské infertility při těchto klinických situacích:
• Anovulace (včetně syndromu polycystických ovárií, PCOS) u žen, které nereagovaly na léčbu klomifen-citrátem.
• Řízená hyperstimulace ovárií k indukci vývoje mnohočetných folikulů v programech asistované reprodukce [např. in vitro fertilizace/embryo transfer (IVF/ET), tubární přenos gamet (GIFT)
a intracytoplazmatická injekce spermie (ICSI)].
U dospělých mužů:
• Poruchy spermatogeneze u hypogonadotropního hypogonadismu.
4.2 Dávkování a způsob podání
Léčba přípravkem Fertavid má být zahájena pod dohledem lékaře, který má zkušenost s léčbou infertility.
První injekce přípravku Fertavid by měla být podána pod přímým lékařským dohledem.
Dávkování
Dávkování u žen
V odpovědi ovárií na exogenní gonadotropiny existují velké inter- a intraindividuální rozdíly. Proto je nemožné stanovit jednotné dávkovací schéma. Z toho důvodu má být dávkování individuálně upraveno v závislosti na odpovědi ovárií. K tomu je zapotřebí ultrazvukové vyšetření zrání folikulů. Rovněž může být užitečné současně stanovit sérové hladiny estradiolu.
Při používání injekčního pera je třeba si uvědomit, že pero je přesný nástroj, který podá přesně takovou dávku, na kterou je nastaveno. Bylo prokázáno, že při podání perem je aplikovaná průměrně o 18 % vyšší dávka FSH než při podání konvenční stříkačkou. To může být zvláště významné při přechodu z používání injekčního pera na užívání konvenční stříkačky během jednoho léčebného cyklu. Zvláště při přechodu z používání stříkačky na pero může být nutná drobná úprava dávkování, aby se zabránilo podávání příliš vysokých dávek.
Na základě výsledků srovnávacích klinických studiích je považováno za vhodné aplikovat nižší celkovou dávku přípravku Fertavid během kratšího období léčby, než je obecně používáno pro FSH získaný z moči, a to nejen v zájmu dosažení optimálního vývoje folikulů, ale také ke snížení rizika nechtěné ovariální hyperstimulace (viz bod 5.1).
Klinická zkušenost s přípravkem Fertavid je založena až na třech léčebných cyklech v obou indikacích. Celková zkušenost s IVF ukazuje, že během prvních čtyř pokusů zůstává úspěšnost léčby většinou stabilní a poté se postupně snižuje.
• Anovulace
Doporučuje se sekvenční léčebné schéma začínající podáváním 50 IU přípravku Fertavid denně. Počáteční dávka se nemění po dobu nejméně sedmi dnů. Nedojde-li k žádné odpovědi ovárií, je denní dávka postupně zvyšována až do zaznamenání adekvátní farmakodynamické odpovědi na základě zvýšeného růstu folikulů nebo plazmatické hladiny estradiolu. Za optimální je považováno denní zvýšení hladiny estradiolu o 40-100 %. Denní dávka se pak nemění až do dosažení preovulačního stavu. Preovulačního stavu je dosaženo tehdy, kdy podle ultrasonografického nálezu dosáhne dominantní folikul nejméně 18 mm v průměru a/nebo při dosažení plazmatických hladin estradiolu 300-900 pikogramů/ml (1 000-3 000 pmol/1).
K dosažení tohoto stavu obvykle postačí léčba v trvání 7-14 dnů. Podávání přípravku Fertavid je poté přerušeno a ovulace může být indukována podáním humánního choriového gonadotropinu (hCG).
Je-li množství reagujících folikulů příliš vysoké nebo zvyšují-li se hladiny estradiolu příliš rychle, tzn. dochází-li ke dvojnásobnému zvýšení hladiny estradiolu častěji než jednou denně dva či tři po sobě následující dny, má být denní dávka snížena.
Vzhledem k tomu, že folikuly větší než 14 mm mohou vést k těhotenství, představují vícečetné preovulační folikuly větší než 14 mm riziko vícečetného těhotenství. V takovém případě nemá být hCG aplikován a těhotenství je třeba se vyhnout, aby se zabránilo vícečetnému těhotenství.
• Řízená ovariální hyperstimulace v programech asistované reprodukce
Používají se různé stimulační protokoly. Minimálně pro první čtyři dny je doporučena počáteční dávka 100-225 IU. Poté může být dávka individuálně upravena na základě odpovědi ovárií.
V klinických studiích bylo prokázáno, že postačující udržovací dávka se pohybuje v rozmezí 75-375 IU po dobu šesti až dvanácti dní, někdy však může být nutná delší léčba.
Fertavid může být podáván samotný nebo v kombinaci s agonistou nebo antagonistou GnRH pro prevenci předčasné luteinizace. Je-li podáván s agonistou GnRH, může být zapotřebí vyšší celková léčebná dávka přípravku Fertavid.
Odpověď ovárií je monitorována ultrazvukovým vyšetřením. Rovněž může být užitečné současně stanovit sérové hladiny estradiolu. Konečná fáze dozrávání folikulů je indukována podáním hCG poté, co je ultrazvukovým vyšetřením zjištěna přítomnost nejméně tří folikulů o velikosti 16-20 mm a je prokázána dobrá odpověď estradiolu (plazmatické hladiny asi 300-400 pikogramů/ml (1 000-1 300 pmol/1) pro každý folikul o průměru větším než 18 mm). Získání oocytů je provedeno o 34-35 hodin později.
Dávkování u mužů
Fertavid se podává v dávce 450 IU/týden, nejlépe rozdělen do 3 dávek po 150 IU společně s hCG.
V léčbě přípravkem Fertavid a hCG je třeba pokračovat nejméně 3-4 měsíce, než lze očekávat jakékoliv zlepšení spermatogeneze. K posouzení odpovědi se doporučuje analýza spermatu za 4 až 6 měsíců po zahájení léčby. Pokud pacient po tomto období nereagoval, je možno v kombinované terapii pokračovat, stávající klinická zkušenost ukazuje, že pro dosažení spermatogeneze může být zapotřebí léčba trvající 18 měsíců nebo déle.
Pediatrická populace
Ve schválené indikaci není u pediatrické populace pro přípravek Fertavid žádné relevantní použití. Způsob podávání
Fertavid injekční roztok v kontejnerech s náplní byl vyvinut pro použití společně s injekčním perem Puregon Pen a je určen k podkožnímu podání. Místo podkožní injekce je třeba měnit, aby se předešlo atrofii tukové tkáně.
S použitím injekčního pera může aplikaci přípravku Fertavid provést pacient/ka, za předpokladu náležitého poučení lékařem.
4.3 Kontraindikace
Pro muže a ženy
• Hypersensitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku uvedenou v bodě 6.1.
• Nádory ovária, prsu, dělohy, varlat, hypofýzy nebo hypotalamu.
• Primární gonadální porucha
Navíc pro ženy
• Vaginální krvácení dosud nejasné etiologie.
• Ovariální cysty nebo zvětšená ovária bez souvislosti se syndromem polycystických ovárií (PCOS).
• Malformace reprodukčních orgánů neslučitelné s těhotenstvím.
• Myomy dělohy neslučitelné s těhotenstvím.
4.4 Zvláštní upozornění a opatření pro použití
Hypersenzitivní reakce na antibiotika
• Fertavid může obsahovat stopy streptomycinu a/nebo neomycinu. Tato antibiotika mohou u náchylných osob způsobovat reakce z přecitlivělosti.
Vyšetření na neplodnost před zahájením léčby
• Před zahájením léčby je nutno neplodnost párů řádně vyšetřit. Pacienty je nutno vyšetřit zejména na hypothyroidismus, insuficienci nadledvin, hyperprolaktinémii a nádory hypofýzy nebo hypothalamu, a je nutno podat příslušnou léčbu.
Ovariální hyperstimulační syndrom (OHSS)
OHSS je zdravotní příhoda odlišná od nekomplikovaného zvětšení ování. Klinickými známkami a příznaky mírného až středně závažného ovariálního hyperstimulačního syndromu jsou bolesti břicha, nauzea, průjem, mírné až střední zvětšení ovárií a ovariální cysty. Závažný OHSS můž být život ohrožující. Klinickými známkami a příznaky závažného ovariálního hyperstimulačního syndromu jsou velké ovariální cysty, akutní bolesti břicha, ascites, pleurální výpotek, hydrothorax, dušnost, oligurie, hematologické abnormality a přibývání na váze. Ve vzácných případech se v souvislosti s OHSS může objevit žilní nebo arteriální tromboembolie. V souvislosti s OHSS byly rovněž hlášeny přechodné abnormality jaterních funkčních testů, které naznačují jaterní dysfunkci s morfologickými změnami při biopsii jater nebo bez nich.
OHSS může být vyvolán podáním lidského choriového gonadotropinu (hCG) a těhotenstvím (endogenním hCG). Časný OHSS se obvykle objeví během 10 dní po podání hCG a může souviset s nadměrnou odpovědí ovárií na stimulaci gonadotropinem. Pozdní OHSS se objevuje více než 10 dní po podání hCG, jako důsledek hormonálních změn v těhotenství. Kvůli riziku vzniku OHSS je nutno pacientky sledovat nejméně 2 týdny po podání hCG.
Ženy se známými rizikovými faktory pro silnou odpověď ovárií mohou být zvláště náchylné ke vzniku OHSS během léčby přípravkem Fertavid nebo po ní. U žen v prvním cyklu stimulace ovárií, u kterých jsou rizikové faktory známy pouze částečně, se doporučuje pečlivé sledování časných známek a příznaků OHSS.
Ke snížení rizika vzniku OHSS je nutno před léčbou provést ultrazvukové vyšetření vývoje folikulů a to pak provádět pravidelně v průběhu léčby. Rovněž může být užitečné současně stanovit hladiny sérového estradiolu. Při asistované reprodukci je riziko OHSS zvýšeno při 18 nebo více folikulech o průměru 11 mm nebo více. Pokud je folikulů celkem 30 nebo více, doporučuje se podávání hCG zastavit.
V závislosti na odpovědi ovárií lze ke snížení OHSS zvážit následující opatření:
- vysadit další stimulaci gonadotropinem na maximálně 3 dny (coasting);
- vysadit hCG a zrušit léčebný cyklus;
- podat dávku nižší než 10 000 IU močového hCG s cílem spustit konečné zrání oocytu, např. 5 000 IU močového hCG nebo 250 mikrogramů rec-hCG (což odpovídá přibližně 6 500 IU močového hCG);
- zrušit přenos čerstvého embrya a embrya dát ke kryoprezervaci;
- zamezit podávání hCG kvůli podpoře luteální fáze.
Pokud se OHSS vyvine, je nutno nasadit a dodržovat standartní a vhodnou léčbu OHSS.
Vícečetné těhotenství
U všech způsobů léčby gonadotropinem, včetně přípravku Fertavid, byla hlášena mnohočetná těhotenství a porody. Vícečetné těhotenství, především jeho pozdější stádia zvyšují riziko nežádoucích důsledků pro matku (komplikace v těhotenství a při porodu) a pro dítě (nízká porodní hmotnost). U anovulačních žen, které podstupují indukci ovulace může sledování vývoje folikulů za využití transvaginálního ultrazvuku napomoci stanovit, zda v cyklu pokračovat či nikoli, aby se snížilo riziko vícečetného těhotenství. Rovněž může být užitečné současně stanovovat hladiny sérového estradiolu. Pacientky je nutno před zahájením léčby na možnost vícečetného těhotenství upozornit.
U žen podstupujících asistovanou reprodukci riziko vícečetného těhotenství souvisí zejména s počtem přenesených embryí. Pokud se používá k cyklu indukujícímu ovulaci, měla by příslušná úprava dávky (příslušné úpravy dávek) FSH vývoji vícečetných folikulů zabránit.
Mimoděložní těhotenství
U infertilních žen, které se podrobují asistované reprodukci je zvýšena incidence mimoděložních těhotenství. Proto je důležité časné ultrazvukové potvrzení intrauterinní lokalizace těhotenství.
Spontánní potrat
Četnost nedokončených těhotenství je u žen podstupujících asistovanou reprodukci vyšší než u normální populace.
Cévní komplikace
Po léčbě gonadotropiny, včetně přípravku Fertavid, byly hlášeny tromboembolické příhody, jak v souvislosti s OHSS, tak s OHSS nesouvisející. Intravaskulární trombóza, která může vzniknout v žilách nebo arteriích, může vést ke snížení krevního průtoku životně důležitými orgány nebo končetinami. U žen s obecně uznávanými rizikovými faktory tromboembolických příhod, jako je osobní nebo rodinná anamnéza, silná obezita nebo trombofilie, může léčba gonadotropiny, včetně přípravku Fertavid, toto riziko dále zvýšit. U těchto žen je třeba přínosy podávání gonadotropinů, včetně přípravku Fertavid, zvážit proti rizikům. Je nutno však mít na paměti, že samotné těhotenství rovněž přináší zvýšené riziko trombózy.
Vrozené malformace
Incidence kongenitálních malformací při asistované reprodukci může být nepatrně vyšší než u spontánní koncepce. To může být způsobeno rozdíly v charakteristikách rodičů (např. věk matky, charakteristika spermií) a vícečetným těhotenstvím.
Torze ovária
Po léčbě gonadotropiny, včetně přípravku Fertavid, byly hlášeny torze ovárií. Torze ovária může souviset s dalšími rizikovými faktory, například OHSS, těhotenstvím, prodělanými břišními operacemi, anamnézou torze ovárií v minulosti, ovariálními cystami v přítomnosti či minulosti a s polycystickými ovárii. Poškození ovárií v důsledku sníženého přívodu krve lze omezit včasnou diagnózou a neprodlenou detorzí.
Nádory ovárií a jiných částí reprodukčního systému
Byly hlášeny případy nádorů vaječníků a jiných orgánů reprodukčního systému a to benigních a maligních u žen, které podstoupily léčbu neplodnosti řadou různých způsobů léčby. Nejsou jednotné názory na to, zda léčebné užití gonadotropinů zvyšuje riziko těchto nádorů u neplodných žen.
Další zdravotní stavy
Před zahájením léčby přípravkem Fertavid je rovněž nutno vyhodnotit zdravotní stavy, které jsou kontraindikací těhotenství.
U mužů
Primární testikulární porucha
Zvýšené hladiny endogenního FSH u mužů svědčí pro primární testikulární poruchu. Tito pacienti nereagují na léčbu kombinací Fertavid/hCG.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Současné použití přípravku Fertavid a klomifen-citrátu může zesílit folikulární odpověď. Po hypofyzární desenzibilaci vyvolané GnRH agonistou může být k dosažení adekvátní folikulární odpovědi zapotřebí podávat Fertavid ve vyšší dávce.
4.6 Fertilita, těhotenství a kojení
Fertilita
Fertavid se používá v léčbě žen podstupujících ovariální indukci nebo kontrolovanou ovariální hyperstimulaci v rámci programů asistované reprodukce. U mužů se Fertavid užívá v léčbě deficitní spermatogeneze podmíněné hypogonadotropním hypogonadismem. Dávkování a způsob podání viz bod 4.2.
Podávání přípravku Fertavid v těhotenství není indikováno. V případě neúmyslného podání během těhotenství nejsou dostatečné klinické údaje k vyloučení teratogenního působení rekombinantního FSH. Nicméně u těchto případů nebyl dosud hlášen žádný speciální malformační efekt. Ve studiích prováděných na zvířatech nebyl pozorován žádný teratogenní efekt.
Kojení
Nejsou k dispozici žádné informace z klinických hodnocení nebo ze studií na zvířatech o vylučování follitropinu beta do mléka. Vzhledem k vysoké molekulární hmotnosti follitropinu beta je nepravděpodobné, že by se tato látka vylučovala do lidského mateřského mléka. Pokud by byl follitropin beta vylučován do lidského mateřského mléka, byl by rozštěpen v gastrointestinálním traktu dítěte. Follitropin beta může ovlivňovat tvorbu mléka.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Fertavid nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Klinické užití přípravku Fertavid intramuskulární nebo podkožní aplikací může vyvolat lokální reakce v místě vpichu injekce (3 % všech léčených pacientů). Průběh těchto lokálních reakcí je mírný a přechodný. Generalizované reakce z přecitlivělosti byly pozorovány velmi zřídka (přibližně 0,2 % všech pacientů léčených follitropinem beta).
Léčba užen:
Z klinických studií bylo referováno o přibližně 4 % žen, které byly léčeny follitropinem beta a měly známky a příznaky syndromu ovariální hyperstimulace (OHSS) (viz bod 4.4). Nežádoucí účinky týkající se tohoto syndromu zahrnují bolest v oblasti pánve a/nebo tlak, bolest břicha a/nebo napětí, potíže s prsy a zvětšení ovárií.
V následující tabulce jsou uvedeny nežádoucí účinky follitropinu beta, hlášené v klinických studiích u žen, seřazené podle tříd orgánových systémů a četnosti; časté (> 1/100 až < 1/10), méně časté (> 1/1 000 až < 1/100).
|
Třída orgánového systému |
Četnost |
Nežádoucí účinky |
|
Poruchy nervového systému |
Časté | |
|
Gastrointestinální poruchy |
Časté |
Napětí břicha Bolest břicha |
|
Méně časté |
Břišní dyskomfort Zácpa | |
|
Poruchy reprodukčního systému a prsu |
Časté |
OHSS Bolest v oblasti pánve |
|
Méně časté |
Potíže s prsy1 Krvácení z dělohy mimo cyklus Ovariální cysta Zvětšení ovárií Ovariální torze Zvětšení dělohy Krvácení z pochvy |
|
Třída orgánového systému |
Četnost |
Nežádoucí účinky |
|
Celkové poruchy a reakce v místě aplikace |
Časté |
Reakce v místě aplikace injekce2 |
|
Méně časté |
Generalizovaná reakce přecitlivělosti3 |
1. Potíže s prsy zahrnují citlivost, bolest a/nebo napětí prsou a bolest bradavky
2. Lokální rekace v místě aplikace injekce zahrnují: modřiny, bolest, zarudnutí, otok a svědění
3. Ke generalizované reakci z přecitlivělosti patří zarudnutí, kopřivka, vyrážka a svědění
Navíc byla hlášena ektopická těhotenství, potraty a vícečetná těhotenství. Tyto jevy pravděpodobně souvisí s asistovanou reprodukcí nebo následným těhotenstvím.
Ve vzácných případech je léčba follitropinem beta/hCG spojena stejně jako ostatními gonadotropiny s rizikem tromboembolické příhody.
Léčba u mužů:
V následující tabulce jsou uvedeny nežádoucí účinky follitropinu beta, hlášené v klinických studiích u mužů (30 pacientů, kterým byl přípavek podán), seřazené podle tříd orgánových systémů a četnosti; časté (> 1/100 až < 1/10)._
|
Třída orgánového systému |
Četnost |
Nežádoucí účinky |
|
Poruchy nervového systému |
Časté | |
|
Poruchy kůže a podkožní tkáně |
Časté |
Akné |
|
Poruchy reprodukčního systému a prsu |
Časté |
Epididymální cysta Gynekomastie |
|
Celkové poruchy a reakce v místě aplikace |
Časté |
Reakce v místě aplikace injekce2 |
1. Nežádoucí účinky, které jsou hlášeny pouze jednou, jsou uvedeny jako časté, protože jediné hlášení
zvyšuje četnost nad 1 %.
2. Lokální reakce v místě aplikace injekce včetně indurace a bolesti.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Ohledně akutní toxicity přípravku Fertavid u člověka nejsou k dispozici žádné údaje, ale ve studiích u zvířat byla prokázána velmi nízká akutní toxicita přípravku Fertavid a z moči získaných preparátů gonadotropinů. Příliš vysoké dávkování FSH může mít za následek hyperstimulaci ovárií (viz bod 4.4).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: pohlavní hormony a modulátory pohlavního systému, gonadotropiny; ATC kód: GO3G A06.
Fertavid obsahuje rekombinantní FSH. Ten je vyráběn technikou rekombinace DNA za použití tkáňové kultury ovariálních buněk křečka čínského, do které byly přeneseny humánní geny pro podjednotku FSH. Primární sekvence aminokyselin je identická se sekvencí u přirozeného humánního FSH. Je známo, že existují malé rozdíly ve struktuře sacharidového řetězce.
Mechanismus účinku
FSH je nepostradatelný při normálním růstu a dozrávání folikulů a při gonadální produkci steroidů.
U ženy je hladina FSH kritická pro zahájení a trvání vývoje folikulů a následně pro načasování dozrání a pro počet folikulů, které dosáhly zralosti. Ve vybraných případech porušené gonadální funkce lze tedy Fertavid použít ke stimulaci vývoje folikulů a produkce steroidů. Fertavid lze dále použít pro podporu vícečetného vývoje folikulů v programech asistované reprodukce [např. in vitro fertilizace/embryo transfer (IVF/ET), tubární přenos gamet (GIFT) a intracytoplazmatická injekce spermie (ICSI)]. Obecně platí, že po léčbě přípravkem Fertavid následuje podání hCG k indukci konečné fáze dozrávání folikulů, zahájení meiózy a ruptury folikulu.
Klinická účinnost a bezpečnost
V klinických hodnoceních porovnávajících rekombinantní FSH (follitropin beta) a močový FSH při kontrolované ovariální stimulaci u žen zapojených do programu asistované reprodukce (ART) a při indukci ovulace (viz tabulky 1 a 2 níže) byl Fertavid účinnější než močový FSH, protože ke spuštění zrání folikulů bylo zapotřebí nižší celkové dávky a kratšího období léčby.
U kontrolované stimulace ovárií vedl Fertavid v porovnání s močovým FSH k vyššímu počtu oocytů získaných při nižší celkové dávce a kratším období léčby.
Tabulka 1: Výsledky klinického hodnocení 37 608 (randomizované klinické hodnocení s porovnáváním skupin, srovnávající bezpečnost a účinnost přípravku Fertavid s močovým FSH při kontrolované stimulaci ovárií)._
|
Fertavid (n = 546) |
u-FSH (n = 361) | |
|
Průměrný počet získaných oocytů |
10,84* |
8,95 |
|
Průměrná celková dávka (počet ampulek po 75 IU) |
28,5* |
31,8 |
|
Průměrné trvání stimulace pomocí FSH (dny) |
10,7* |
11,3 |
*Rozdíly mezi oběma skupinami byly statisticky významné (p < 0,05).
U ovariální indukce vedl Fertavid v porovnání s močovým FSH k nižšímu mediánu celkové dávky a ke kratšímu mediánu trvání léčby.
Tabulka 2: Výsledky klinického hodnocení 37 609 (randomizované klinické hodnocení s porovnáváním skupin, srovnávající bezpečnost a účinnost přípravku Fertavid s močovým FSH při ovariální indukci)._
|
Fertavid (n = 105) |
u-FSH (n = 66) | |
|
Průměrný počet folikulů > 12 mm |
3,6* |
2,6 |
|
> 15 mm |
2,0 |
1,7 |
|
> 18 mm |
1,1 |
0,9 |
|
Medián celkové dávky (IU)a |
750* |
1 035 |
|
Medián trvání léčby (dny)a |
10,0* |
13,0 |
* Rozdíly mezi oběma skupinami byly statisticky významné (p < 0,05). a Omezeno na ženy s indukovanou ovulací (Fertavid, n = 76; u-FSH, n = 42).
5.2 Farmakokinetické vlastnosti
Absorpce
Po podkožním podání přípravku Fertavid je dosaženo maximální koncentrace FSH přibližně za 12 hodin. V důsledku pozvolného uvolňování z místa injekce a poločasu eliminace přibližně 40 hodin (rozmezí 12 - 70 hodin) zůstává hladina FSH zvýšena po dobu 24 - 48 hodin. Vzhledem k poměrně dlouhému poločasu eliminace bude mít opakované podání stejné dávky za následek plazmatické koncentrace FSH, které jsou přibližně 1,5 - 2,5 krát vyšší než po podání jednotlivé dávky. Toto zvýšení umožňuje dosáhnout terapeutických koncentrací FSH.
Absolutní biologická dostupnost subkutánně podaného přípravku Fertavid je přibližně 77 %. Distribuce, biotransformace a eliminace
Rekombinantní FSH je biochemicky velmi podobný z moči získanému humánnímu FSH aje distribuován, metabolizován a vylučován stejným způsobem.
5.3 Předklinické údaje vztahující se k bezpečnosti
Podání jednotlivé dávky přípravku Fertavid laboratorním potkanům nevyvolalo žádné toxikologicky signifikantní účinky. Ve studiích opakovaného podávání u laboratorních potkanů (dva týdny) a u psů (13 týdnů) až do stonásobku maximální dávky používané u člověka nevyvolal Fertavid žádné toxikologicky signifikantní účinky. V Amesově testu ani in vitro testu chromozomových aberací u humánních lymfocytů nevykazoval Fertavid žádný mutagenní potenciál.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Fertavid injekční roztok obsahuje:
Sacharózu
Dihydrát citronanu sodného
L-metionin
Polysorbát 20
Benzylalkohol
Vodu na injekci.
Pro úpravu pH mohly být použity hydroxid sodný a/nebo kyselina chlorovodíková.
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
3 roky.
Po propíchnutí pryžového uzávěru kontejneru s náplní jehlou může být přípravek uchováván nejdéle po dobu 28 dnů.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem.
Uchovávejte kontejner s náplní v krabičce.
Pro svou potřebu může pacient/ka uchovávat přípravek Fertavid při teplotě do 25°C jedno období nepřesahující 3 měsíce.
Podmínky uchovávání po prvním otevření léčivého přípravku jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení Fertavid 150 IU/0,18 ml injekční roztok
0,18 ml roztoku v kontejneru na 1,5 ml (typ skla I) s pístem z šedé pryže a hliníkovou zátkou s pryžovou výstelkou.
Balení obsahuje l kontejner s náplní a 3 jehly určené pro použití s injekčním perem Puregon Pen.
Jeden kontejner s náplní obsahuje minimálně 225 IU aktivity FSH v 0,270 ml vodného roztoku; toto množství postačuje pro čistou (netto) celkovou dávku 150 IU.
Fertavid 300 IU/0,36 ml injekční roztok
0,36 ml roztoku v kontejneru na 1,5 ml (typ skla I) s pístem z šedé pryže a hliníkovou zátkou s pryžovou výstelkou.
Balení obsahuje l kontejner s náplní a 6 jehel určených pro použití s injekčním perem Puregon Pen. Jeden kontejner s náplní obsahuje minimálně 400 IU aktivity FSH v 0,480 ml vodného roztoku; toto množství postačuje pro čistou (netto) celkovou dávku 300 IU.
Fertavid 600 IU/0,72 ml injekční roztok
0,72 ml roztoku v kontejneru na 1,5 ml (typ skla I) s pístem z šedé pryže a hliníkovou zátkou s pryžovou výstelkou.
Balení obsahuje l kontejner s náplní a 6 jehel určených pro použití s injekčním perem Puregon Pen. Jeden kontejner s náplní obsahuje minimálně 700 IU aktivity FSH v 0,840 ml vodného roztoku; toto množství postačuje pro čistou (netto) celkovou dávku 600 IU.
Fertavid 900 IU/1,08 ml injekční roztok
1,08 ml roztoku v kontejneru na 1,5 ml (typ skla I) s pístem z šedé pryže a hliníkovou zátkou s pryžovou výstelkou.
Balení obsahuje l kontejner s náplní a 9 jehel určených pro použití s injekčním perem Puregon Pen. Jeden kontejner s náplní obsahuje minimálně 1 025 IU aktivity FSH v 1,230 ml vodného roztoku; toto množství postačuje pro čistou (netto) celkovou dávku 900 IU.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Roztok nepoužívejte, pokud obsahuje částice nebo pokud není čirý.
Fertavid injekční roztok je určen pro použití společně s perem Puregon Pen. Pokyny pro použití pera je třeba pečlivě dodržovat. Před podáním injekce musí být z kontejneru odstraněny vzduchové bubliny (viz Návod k použití pera).
Prázdné kontejnery nesmí být znovu plněny.
Kontejnery přípravku Fertavid nejsou určeny k tomu, aby v nich bylo prováděno mísení s jakýmkoliv jiným lékem.
Použité jehly zlikvidujte ihned po aplikaci.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Velká Británie
8. REGISTRAČNÍ ČÍSLO
Fertavid 150 IU/0,18 ml injekční roztok
EU/1/09/510/016
Fertavid 300 IU/0,36 ml injekční roztok EU/1/09/510/017
Fertavid 600 IU/0,72 ml injekční roztok EU/1/09/510/018
Fertavid 900 IU/1,08 ml injekční roztok EU/1/09/510/019
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 19. března 2009
Datum posledního prodloužení registrace: 21. února 2014
10. DATUM REVIZE TEXTU
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE/VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY /BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE/VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY /BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce biologické léčivé látky
N.V. Organon
Kloosterstraat 6, 5349 AB Oss Veersemeer 4, 5347 JN Oss Nizozemsko
Název a adresa výrobců odpovědných za propouštění šarží
Fertavid injekční roztok v injekčních lahvičkách 50 IU/0,5 ml, 75 IU/0,5 ml, 100 IU/0,5 ml,
150 IU/0,5 ml, 200 IU/0,5 ml:
N.V. Organon Kloosterstraat 6 5349 AB Oss Nizozemsko
Fertavid injekční roztok v kontejnerech s náplní 150 IU/0,18 ml, 300 IU/0,36 ml, 600 IU/0,72 ml, 900 IU/1,08 ml:
N.V. Organon Kloosterstraat 6 5349 AB Oss Nizozemsko
Organon (Ireland) Ltd.
PO. Box 2857 Swords, Co. Dublin Irsko
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz Příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Neuplatňuje se.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
Fertavid 50 IU/0,5 ml injekční roztok follitropinum beta
1 injekční lahvička obsahuje 0,5 ml follitropinu beta, což odpovídá:
50 IU (100 IU/ml) aktivity rekombinantního folikuly stimulujícího hormonu (FSH).
Pomocné látky: sacharóza, dihydrát citronanu sodného, metionin a polysorbát 20 ve vodě na injekci; hydroxid sodný a/nebo kyselina chlorovodíková pro úpravu pH.
Injekční roztok
1 injekční lahvička obsahující 0,5 ml 5 injekčních lahviček, každá obsahuje 0,5 ml 10 injekčních lahviček, každá obsahuje 0,5 ml
Intramuskulární (i.m.) a subkutánní (s.c.) podání
Obsah injekční lahvičky musí být použit ihned po propíchnutí pryžového uzávěru. Pouze k jednorázovému použití.
Před použitím si přečtěte příbalovou informaci.
Uchovávejte mimo dohled a dosah dětí.
Uchovávání pro lékárníka
Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
Uchovávání pro pacienta
Máte dvě možnosti:
1. Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
2. Uchovávejte při teplotě do 25°C jedno období nepřesahující 3 měsíce. Uchovávejte injekční lahvičku v krabičce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Velká Británie
EU/1/09/510/001
EU/1/09/510/002
EU/1/09/510/003
Lot
Nevyžaduje se - odůvodnění přijato
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Fertavid 50 IU/0,5 ml injekce follitropinum beta
1. m./s.c.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
6. JINÉ_
MSD
Fertavid 75 IU/0,5 ml injekční roztok follitropinum beta
1 injekční lahvička obsahuje 0,5 ml follitropinu beta, což odpovídá:
75 IU (150 IU/ml) aktivity rekombinantního folikuly stimulujícího hormonu (FSH).
Pomocné látky: sacharóza, dihydrát citronanu sodného, metionin a polysorbát 20 ve vodě na injekci; hydroxid sodný a/nebo kyselina chlorovodíková pro úpravu pH.
Injekční roztok
1 injekční lahvička obsahující 0,5 ml 5 injekčních lahviček, každá obsahuje 0,5 ml 10 injekčních lahviček, každá obsahuje 0,5 ml
Intramuskulární (i.m.) a subkutánní (s.c.) podání
Obsah injekční lahvičky musí být použit ihned po propíchnutí pryžového uzávěru. Pouze k jednorázovému použití.
Před použitím si přečtěte příbalovou informaci.
Uchovávejte mimo dohled a dosah dětí.
Uchovávání pro lékárníka
Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
Uchovávání pro pacienta
Máte dvě možnosti:
1. Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
2. Uchovávejte při teplotě do 25°C jedno období nepřesahující 3 měsíce. Uchovávejte injekční lahvičku v krabičce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Velká Británie
EU/1/09/510/004
EU/1/09/510/005
EU/1/09/510/006
Lot
Nevyžaduje se - odůvodnění přijato
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Fertavid 75 IU/0,5 ml injekce follitropinum beta
1. m./s.c.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
6. JINÉ_
MSD
Fertavid 100 IU/0,5 ml injekční roztok follitropinum beta
1 injekční lahvička obsahuje 0,5 ml follitropinu beta, což odpovídá:
100 IU (200 IU/ml) aktivity rekombinantního folikuly stimulujícího hormonu (FSH).
Pomocné látky: sacharóza, dihydrát citronanu sodného, metionin a polysorbát 20 ve vodě na injekci; hydroxid sodný a/nebo kyselina chlorovodíková pro úpravu pH.
Injekční roztok
1 injekční lahvička obsahující 0,5 ml 5 injekčních lahviček, každá obsahuje 0,5 ml 10 injekčních lahviček, každá obsahuje 0,5 ml
Intramuskulární (i.m.) a subkutánní (s.c.) podání
Obsah injekční lahvičky musí být použit ihned po propíchnutí pryžového uzávěru. Pouze k jednorázovému použití.
Před použitím si přečtěte příbalovou informaci.
Uchovávejte mimo dohled a dosah dětí.
Uchovávání pro lékárníka
Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
Uchovávání pro pacienta
Máte dvě možnosti:
1. Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
2. Uchovávejte při teplotě do 25°C jedno období nepřesahující 3 měsíce. Uchovávejte injekční lahvičku v krabičce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Velká Británie
EU/1/09/510/007
EU/1/09/510/008
EU/1/09/510/009
Lot
Nevyžaduje se - odůvodnění přijato
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Fertavid 100 IU/0,5 ml injekce follitropinum beta
1. m./s.c.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
6. JINÉ_
MSD
Fertavid 150 IU/0,5 ml injekční roztok follitropinum beta
1 injekční lahvička obsahuje 0,5 ml follitropinu beta, což odpovídá:
150 IU (300 IU/ml) aktivity rekombinantního folikuly stimulujícího hormonu (FSH).
Pomocné látky: sacharóza, dihydrát citronanu sodného, metionin a polysorbát 20 ve vodě na injekci; hydroxid sodný a/nebo kyselina chlorovodíková pro úpravu pH.
Injekční roztok
1 injekční lahvička obsahující 0,5 ml 5 injekčních lahviček, každá obsahuje 0,5 ml 10 injekčních lahviček, každá obsahuje 0,5 ml
Intramuskulární (i.m.) a subkutánní (s.c.) podání
Obsah injekční lahvičky musí být použit ihned po propíchnutí pryžového uzávěru. Pouze k jednorázovému použití.
Před použitím si přečtěte příbalovou informaci.
Uchovávejte mimo dohled a dosah dětí.
Uchovávání pro lékárníka
Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
Uchovávání pro pacienta
Máte dvě možnosti:
1. Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
2. Uchovávejte při teplotě do 25°C jedno období nepřesahující 3 měsíce. Uchovávejte injekční lahvičku v krabičce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Velká Británie
EU/1/09/510/010
EU/1/09/510/011
EU/1/09/510/012
Lot
Nevyžaduje se - odůvodnění přijato
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Fertavid 150 IU/0,5 ml injekce follitropinum beta
1. m./s.c.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
6. JINÉ_
MSD
Fertavid 200 IU/0,5 ml injekční roztok follitropinum beta
1 injekční lahvička obsahuje 0,5 ml follitropinu beta, což odpovídá:
200 IU (400 IU/ml) aktivity rekombinantního folikuly stimulujícího hormonu (FSH).
Pomocné látky: sacharóza, dihydrát citronanu sodného, metionin a polysorbát 20 ve vodě na injekci; hydroxid sodný a/nebo kyselina chlorovodíková pro úpravu pH.
Injekční roztok
1 injekční lahvička obsahující 0,5 ml 5 injekčních lahviček, každá obsahuje 0,5 ml 10 injekčních lahviček, každá obsahuje 0,5 ml
Intramuskulární (i.m.) a subkutánní (s.c.) podání
Obsah injekční lahvičky musí být použit ihned po propíchnutí pryžového uzávěru. Pouze k jednorázovému použití.
Před použitím si přečtěte příbalovou informaci.
Uchovávejte mimo dohled a dosah dětí.
Uchovávání pro lékárníka
Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
Uchovávání pro pacienta
Máte dvě možnosti:
1. Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
2. Uchovávejte při teplotě do 25°C jedno období nepřesahující 3 měsíce. Uchovávejte injekční lahvičku v krabičce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Velká Británie
EU/1/09/510/013
EU/1/09/510/014
EU/1/09/510/015
Lot
Nevyžaduje se - odůvodnění přijato
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Fertavid 200 IU/0,5 ml injekce follitropinum beta
1. m./s.c.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
6. JINÉ_
MSD
Fertavid 150 IU/0,18 ml injekční roztok follitropinum beta
225 IU aktivity rekombinantního FSH/0,270 ml Obsah netto 150 IU
Pomocné látky: sacharóza, dihydrát citronanu sodného, metionin, polysorbát 20 a benzylakohol ve vodě na injekci; hydroxid sodný a/nebo kyselina chlorovodíková pro úpravu pH.
Injekční roztok 1 kontejner s náplní 1 balení se 3 jehlami k peru
Subkutánní (s.c.) podání
Pouze pro použití s injekčním perem Puregon Pen. Před použitím si přečtěte příbalovou informaci.
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávání pro lékárníka
Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
Uchovávání pro pacienta
Máte dvě možnosti:
1. Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
2. Uchovávejte při teplotě do 25°C jedno období nepřesahující 3 měsíce. Uchovávejte kontejner s náplní v krabičce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Velká Británie
EU/1/09/510/016
Lot
Nevyžaduje se - odůvodnění přijato
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Fertavid 150 IU/0,18 ml injekce follitropinum beta
s.c.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
0,270 ml
6. JINÉ
MSD
Fertavid 300 IU/0,36 ml injekční roztok follitropinum beta
400 IU aktivity rekombinantního FSH/0,480 ml Obsah netto 300 IU
Pomocné látky: sacharóza, dihydrát citronanu sodného, metionin, polysorbát 20 a benzylakohol ve vodě na injekci; hydroxid sodný a/nebo kyselina chlorovodíková pro úpravu pH.
Injekční roztok
1 kontejner s náplní
2 balení se 3 jehlami k peru
Subkutánní (s.c.) podání
Pouze pro použití s injekčním perem Puregon Pen. Před použitím si přečtěte příbalovou informaci.
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávání pro lékárníka
Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
Uchovávání pro pacienta
Máte dvě možnosti:
1. Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
2. Uchovávejte při teplotě do 25°C jedno období nepřesahující 3 měsíce. Uchovávejte kontejner s náplní v krabičce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Velká Británie
EU/1/09/510/017
Lot
Nevyžaduje se - odůvodnění přijato
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Fertavid 300 IU/0,36 ml injekce follitropinum beta
s.c.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
0,480 ml
6. JINÉ
MSD
Fertavid 600 IU/0,72 ml injekční roztok follitropinum beta
700 IU aktivity rekombinantního FSH/0,840 ml Obsah netto 600 IU
Pomocné látky: sacharóza, dihydrát citronanu sodného, metionin, polysorbát 20 a benzylakohol ve vodě na injekci; hydroxid sodný a/nebo kyselina chlorovodíková pro úpravu pH.
Injekční roztok
1 kontejner s náplní
2 balení se 3 jehlami k peru
Subkutánní (s.c.) podání
Pouze pro použití s injekčním perem Puregon Pen. Před použitím si přečtěte příbalovou informaci.
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávání pro lékárníka
Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
Uchovávání pro pacienta
Máte dvě možnosti:
1. Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
2. Uchovávejte při teplotě do 25°C jedno období nepřesahující 3 měsíce. Uchovávejte kontejner s náplní v krabičce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Velká Británie
EU/1/09/510/018
Lot
Nevyžaduje se - odůvodnění přijato
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Fertavid 600 IU/0,72 ml injekce follitropinum beta
s.c.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
0,840 ml
6. JINÉ
MSD
Fertavid 900 IU/1,08 ml injekční roztok follitropinum beta
1 025 IU aktivity rekombinantního FSH/1,230 ml Obsah netto 900 IU
Pomocné látky: sacharóza, dihydrát citronanu sodného, metionin, polysorbát 20 a benzylakohol ve vodě na injekci; hydroxid sodný a/nebo kyselina chlorovodíková pro úpravu pH.
Injekční roztok 1 kontejner s náplní 3 balení se 3 jehlami k peru
Subkutánní (s.c.) podání
Pouze pro použití s injekčním perem Puregon Pen. Před použitím si přečtěte příbalovou informaci.
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávání pro lékárníka
Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
Uchovávání pro pacienta
Máte dvě možnosti:
1. Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
2. Uchovávejte při teplotě do 25°C jedno období nepřesahující 3 měsíce. Uchovávejte kontejner s náplní v krabičce.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Velká Británie
EU/1/09/510/019
Lot
Nevyžaduje se - odůvodnění přijato
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Fertavid 900 IU/1,08 ml injekce follitropinum beta
s.c.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1,230 ml
6. JINÉ
MSD
Příbalová informace: informace pro uživatele
Fertavid 50 IU/0,5 ml injekční roztok Fertavid 75 IU/0,5 ml injekční roztok Fertavid 100 IU/0,5 ml injekční roztok Fertavid 150 IU/0,5 ml injekční roztok Fertavid 200 IU/0,5 ml injekční roztok follitropinum beta
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se, svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Fertavid a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Fertavid používat
3. Jak se přípravek Fertavid používá
4. Možné nežádoucí účinky
5. Jak přípravek Fertavid uchovávat
6. Obsah balení a další informace
1. Co je přípravek Fertavid a k čemu se používá
Fertavid injekční roztok obsahuje follitropin beta, hormon známý jako folikuly stimulující hormon (FSH).
FSH patří do skupiny gonadotropinů, které mají velký vliv na plodnost a reprodukci u člověka. U žen je FSH nutný pro růst a vývoj folikulů ve vaječnících. Folikuly jsou malé kulaté váčky obsahující vajíčka. U mužů je FSH nutný pro tvorbu spermií.
Fertavid je určen pro léčbu neplodnosti v některých následujících situacích:
Ženy
Fertavid lze použít k vyvolání ovulace u žen, které neovulují a nereagují na léčbu klomifen-citrátem. U žen, které se podrobují asistované reprodukci, včetně oplodnění in vitro (IVF) a ostatních metod, může Fertavid navodit růst mnohočetných folikulů.
Muži
U mužů, kteří jsou neplodní z důvodů snížených hladin hormonů, může být Fertavid použit pro stimulaci tvorby spermií.
2. Čemu musíte věnovat pozornost, než začnete přípravek Fertavid používat
Nepoužívejte Fertavid
Jestliže:
• jste alergický(á) na follitropin beta nebo na kteroukoli další složku přípravku Fertavid (uvedenou v bodě 6)
• máte nádor vaječníku, prsu, dělohy, varlete nebo mozku [hypofýzy (podvěsku mozkového) nebo hypotalamu (části mezimozku)]
• máte silné nebo nepravidelné vaginální krvácení, jehož příčina je neznámá
• máte nefunkční vaječníky v důsledku stavu zvaného primární ovariální porucha/selhání
• máte ovariální cysty nebo zvětšené vaječníky bez souvislosti se syndromem polycystických ovárií (PCOS)
• máte malformace pohlavních orgánů, které znemožňují normální těhotenství
• máte myomy dělohy (nezhoubné nádory ze svalové tkáně), které znemožňují normální těhotenství
• jste muž a jste neplodný v důsledku stavu zvaného primární porucha/selhání funkce varlat. Upozornění a opatření
Předtím, než začnete používat přípravek Fertavid, svého lékaře informujte, pokud:
• jste někdy měl(a) alergickou reakci na určitá antibiotika (neomycin a/nebo streptomycin)
• máte problémy s hypofýzou nebo hypothalamem, které nejsou pod kontrolou
• máte málo aktivní štítnou žlázu (hypothyroidismus)
• Vaše nadledvinky nefungují správně (adrenokortikální nedostatečnost)
• máte vysoké hladiny prolaktinu v krvi (hyperprolaktinémie)
• máte jakékoli jiné zdravotní problémy (například cukrovku, onemocnění srdce nebo jakékoli jiné dlouhodobé onemocnění).
U žen:
Syndrom nadměrné stimulace vaječníků (OHSS)
Váš lékař bude pravidelně kontrolovat účinnost léčby, aby mohl den ze dne volit správnou dávku přípravku Fertavid. Pravidelně mohou být prováděna vyšetření vaječníků ultrazvukem. Váš lékař může rovněž sledovat hladiny hormonů v krvi. To je velmi důležité, protože příliš vysoké dávky FSH mohou mít za následek vzácné, ale závážné komplikace, při kterých dochází k nadměrné stimulaci vaječníků a rostoucí folikuly jsou větší, než je obvyklé. Tento závažný zdravotní stav se nazývá syndrom nadměrné stimulace vaječníků (OHSS). Ve vzácných případech může Být OHSS život ohrožujcí. OHSS způsobuje náhlé hromadění tekutiny v břiše a oblasti hrudníku a může způsobit tvorbu krevních sraženin. Pokud zaznamenáte výrazné zvětšení břicha, bolest v oblasti žaludku (břicha), nevolnost (nauzeu), zvracení, náhlý přírůstek na váze v důsledku hromadění tekutin, průjem, snížený výdej moči nebo potíže s dechem, ihned vyhledejte na svého lékaře (viz také bod 4. Možné nežádoucí účinky).
Pravidelné sledování odpovědi na léčbu FSH pomáhá zabránit nadměrné stimulaci vaječníků. Neprodleně kontaktujte svého lékaře, jestliže máte bolesti břicha, i pokud se vyskytnou několik dní po podání poslední injekce.
Vícečetné těhotenství nebo vrozené vady
Po léčbě gonadotropinovými přípravky je vyšší pravděpodobnost vícečetného těhotenství, a to i když se do dělohy vloží jen jedno embryo. Vícečetná těhotenství přinášejí v čase kolem porodu zvýšená zdravotní rizika pro matku i její děti. Vícečetná těhotenství a charakteristiky pacientů podstupujících léčbu neplodnosti (např. věk ženy, charakteristiky spermatu, genetické dispozice obou rodičů) mohou být navíc spojeny se zvýšením rizika vrozených vad.
Komplikace v těhotenství
Existuje mírně zvýšené riziko vzniku mimoděložní těhotenství (ektopického těhotenství). Proto by Váš lékař měl provést časné ultrazvukové vyšetření, aby možnost mimoděložního těhotenství vyloučil.
U žen podstupujících léčbu neplodnosti může být mírně zvýšeno riziko potratu.
Krevní sraženina (trombóza)
Léčba přípravkem Fertavid, stejně tak jako těhotenství, může zvýšit riziko vzniku krevní sraženiny (trombózy). Trombóza je tvorba krevní sraženiny v krevní cévě.
Krevní sraženiny mohou vést k závažným zdravotním stavům, jako je:
• ucpání cévy v plicích (plicní embolie)
• mrtvice
• srdeční záchvat
• cévní problémy (tromboflebitida)
• zastavení krevního průtoku (hluboká žilní trombóza), což může vést ke ztrátě ruky nebo nohy.
Proberte, prosím, toto téma s Vaším lékařem před zahájením léčby, zvláště:
• jestliže již víte, že je u Vás zvýšená pravděpodobnost vzniku trombózy
• jestliže se trombóza někdy vyskytla u Vás nebo Vašeho blízkého pokrevního příbuzného
• jestliže máte výraznou nadváhu.
Torze ovárií
Po léčbě gonadotropiny, včetně přípravku Fertavid, se objevila torze ovárií. Torze ovárií znamená přetočení vaječníků. Přetočení vaječníků může vést k přerušení průtoku krve do vaječníku.
Předtím, než začnete tento lék užívat, svého lékaře informujte, pokud:
• se u Vás kdykoli v minulosti vyskytl syndrom nadměrné stimulace vaječníků (OHSS)
• jste těhotná nebo si myslíte, že byste mohla být těhotná
• jste kdykoli v minulosti podstoupil(a) operaci žaludku (břicha)
• Vás kdykoli v minulosti postihlo přetočení vaječníků
• máte nebo jste v minulosti měla cysty ve vaječníku nebo vaječnících.
Nádory vaječníků a dalších částí reprodukčního systému
Byly hlášeny nádory vaječníků a dalších částí reprodukčního systému u žen, které podstoupily léčbu neplodnosti. Není známo, zda léčba přípravky na zvýšení plodnosti zvyšuje riziko vzniku těchto nádorů u neplodných žen.
Další zdravotní stavy
Navíc před zahájením používání tohoto přípravku svého lékaře informujte, pokud:
Vám lékař řekl, že by pro Vás mohlo být těhotenství nebezpečné.
U mužů:
Muži s příliš vysokým množstvím FSH v krvi
Zvýšené hladiny FSH v krvi jsou známkou poruchy funkce varlat. V těchto případech není obvykle Fertavid účinný. V rámci kontroly účinnosti léčby Vás může lékař po čtyřech až šesti měsících od zahájení léčby požádat o vzorek semene k provedení analýzy.
Další léčivé přípravky a přípravek Fertavid
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Při použití přípravku Fertavid v kombinaci s klomifen-citrátem, může být účinnost přípravku Fertavid zvýšena. Pokud byl podáván agonista GnRH (lék používaný k zabránění předčasné ovulace), může být zapotřebí vyšších dávek přípravku Fertavid.
Těhotenství a kojení
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoliv lék. Fertavid nesmíte užívat, jestliže jste již těhotná, nebo se domníváte, že byste mohla být těhotná.
Fertavid může mít vliv na tvorbu mléka. Prostup přípravku Fertavid do mléka není pravděpodobný. Pokud kojíte, informujte o tom svého lékaře dříve, než začnete užívat Fertavid.
Řízení dopravních prostředků a obsluha strojů
Vliv přípravku Fertavid na schopnosti řídit motorová vozidla a obsluhovat stroje není pravděpodobný. Důležité informace o některých složkách přípravku Fertavid
Tento léčivý přípravek obsahuje méně než 1 mmol (23 mg) sodíku na injekci, tj. v podstatě je „bez sodíku“.
Děti
Přípravek Fertavid nemá u dětí žádné relevantní použití.
3. Jak se přípravek Fertavid používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem nebo lékárníkem.
Dávkování u žen
Váš lékař rozhodne o velikosti počáteční dávky. V průběhu Vaší léčby může být tato dávka upravena. Další podrobnosti léčebného schématu jsou uvedeny níže.
Mezi jednotlivými ženami existují velké rozdíly v odpovědi vaječníků na FSH, proto není možné stanovit dávkovací schéma, které by bylo vhodné pro všechny pacientky. Váš lékař bude ke zjištění správného dávkování kontrolovat růst Vašich folikulů pomocí ultrazvuku a zjišťovat množství estradiolu (ženského pohlavního hormonu) v krvi.
• Ženy, které neovulují
Velikost počáteční dávky určí Váš lékař. Tato dávka je podávána alespoň po dobu sedmi dnů. Nedojde-li k odpovědi vaječníků, bude denní dávka postupně zvyšována, dokud se nedostaví vyhovující odpověď, měřeno růstem folikulů nebo hladinou estradiolu. Velikost denní dávky pak zůstane stejná až do vytvoření folikulu vhodné velikosti. Obvykle postačuje léčba v délce 7-14 dnů. Léčba přípravkem Fertavid je poté ukončena a ovulace bude navozena podáním humánního choriového gonadotropinu (hCG).
• Programy asistované reprodukce, např. IVF
Velikost počáteční dávky určí Váš lékař. Tato dávka je podávána alespoň po dobu prvních čtyř dnů. Poté může být Vaše dávka upravena v závislosti na odpovědi Vašich vaječníků. Když je přítomen dostatečný počet folikulů vhodné velikosti, je navozena konečná fáze dozrávání folikulů podáním hCG. Odběr vajíčka/vajíček je proveden o 34-35 hodin později.
Dávkování u mužů
Fertavid se obvykle podává v dávce 450 IU za týden, většinou rozdělen do 3 dávek po 150 IU společně s dalším hormonem (hCG), po dobu alespoň 3-4 měsíců. Doba léčby odpovídá době vývoje spermií a době, kdy může být očekáváno zlepšení. Pokud se spermie po tomto období nezačaly tvořit, Vaše léčba může pokračovat po dobu 18 měsíců nebo déle.
Jak jsou injekce podávány
První injekce přípravku Fertavid má být aplikována pouze v přítomnosti lékaře nebo zdravotní sestry. Injekce mohou být aplikovány pomalu do svalu (například do hýždí, stehna nebo horní části paže) nebo pod kůži (například spodní části břicha).
Pokud je injekce podávána do svalu, musí být aplikována pouze lékařem nebo zdravotní sestrou. Pokud je injekce podávána pod kůži, může být v některých případech aplikována Vámi nebo Vaším partnerem. Váš lékař Vám sdělí, jak a kdy injekce aplikovat. Jestliže si přípravek Fertavid aplikujete sami, dodržujte návod k použití v dalším bodě, aby byl Fertavid aplikován správně s minimálními nepříjemnými pocity.
Návod k použití
Krok 1 - Příprava stříkačky
Pro aplikaci přípravku Fertavid musíte použít sterilní jehly a stříkačky na jedno použití. Objem stříkačky musí být dostatečně malý, aby mohla být předepsaná dávka podána s náležitou přesností. Fertavid roztok pro injekci je dodáván ve skleněné lahvičce. Nepoužívejte roztok, pokud obsahuje částice nebo pokud není čirý. Nejprve musíte odstranit oddělitelný kryt z injekční lahvičky. Na stříkačku připevněte jehlu a propíchněte s ní pryžový uzávěr injekční lahvičky (a). Roztok natáhněte do stříkačky (b) a jehlu vyměňte za jehlu určenou k injekci (c). Nakonec podržte stříkačku s jehlou směřující vzhůru a jemně poklepejte na stěnu stříkačky, aby se uvolnily případné bubliny a vypluly na povrch; poté stlačte píst tak, aby byl vytlačen veškerý vzduch a ve stříkačce zbyl pouze roztok přípravku Fertavid (d). Pokud je to nutné, může být píst stlačen dále, aby byl upraven objem určený k aplikaci.
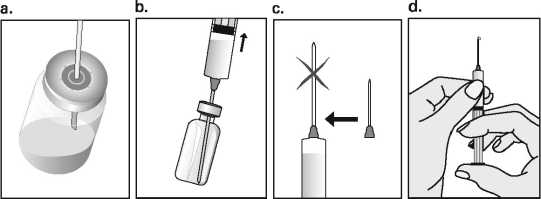
Krok 2 - Místo injekce
Nejlepším místem pro aplikaci injekce pod kůži je spodní část břicha v okolí pupku (e), kde je dostatek volné kůže a vrstvy tukové tkáně. Při každém podání injekce musíte místo aplikace mírně pozměnit.
Injekci lze aplikovat i do jiných oblastí. Váš lékař nebo Vaše zdravotní sestra Vám řekne, kam injekci aplikovat.
Krok 3 - Příprava oblasti vpichu
Několika poklepy na místo injekce dojde ke stimulaci drobných nervových zakončení, což pomůže zmírnit nepříjemné pocity v okamžiku vpichu jehly. Umyjte si ruce a potřete místo injekce dezinfekcí (např. chlorhexidinem 0,5%), aby byly odstraněny všechny povrchové bakterie. Očistěte asi 5 cm kolem místa vpichu a nechejte dezinfekci oschnout po dobu alespoň jedné minuty před provedením dalšího kroku.
Krok 4 - Zasunutí jehly
Mírně nařaste kůži. Druhou rukou zabodněte jehlu pod úhlem 90 stupňů do povrchu kůže tak, jak je znázorněno na obrázku (f).
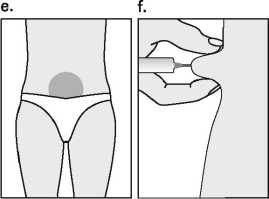
Krok 5 - Kontrola správné polohy jehly
Pokud je poloha jehly správná, bude poměrně obtížné povytáhnout píst zpět. Pokud je zpět do stříkačky nasáta jakákoliv krev, znamená to, že hrot jehly pronikl do žíly nebo tepny. Dojde-li k takové situaci, vytáhněte jehlu, místo vpichu zakryjte čtverečkem obsahujícím dezinfekci a přitlačte;
za 1-2 minuty přestane místo krvácet. Tento roztok dále nepoužívejte. Začněte znovu od kroku 1 s použitím nové injekční stříkačky, nových jehel a nové injekční lahvičky přípravku Fertavid.
Krok 6 - Injikování roztoku
Píst stlačujte pomalu stálým tlakem tak, aby byl roztok správně injikován a nebyly poškozeny tkáně kůže.
Krok 7 - Odstranění jehly
Rychlým pohybem vytáhněte jehlu a místo vpichu stlačte čtverečkem obsahujícím dezinfekci. Mírná masáž místa injekce - za stálého stlačování - pomáhá rozptýlit roztok přípravku Fertavid a zmírnit případné nepříjemné pocity.
Veškerý zbylý roztok musí být zlikvidován.
Fertavid nesměšujte s žádnými jinými léky.
Jestliže jste použil(a) více přípravku Fertavid, než jste měl(a)
Sdělte to ihned svému lékaři.
Příliš vysoká dávka přípravku Fertavid může vyvolat nadměrnou stimulaci vaječníků (OHSS). Můžete to pozorovat jako bolest břicha. Jestliže máte bolesti břicha, sdělte to neprodleně svému lékaři. Viz také bod 4 Možné nežádoucí účinky.
Jestliže jste zapomněl(a) použít Fertavid
Jestliže jste na dávku zapomněl(a), nezdvojujte následující dávku, abyste nahradil(a) vynechanou dávku.
Kontaktujte svého lékaře.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento léčivý přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Závazné nežádoucí účinky u zen
Komplikací léčby FSH je hyperstimulace vaječníků. Nadměrná stimulace vaječníků se může vyvinout do stavu nazývaného syndrom nadměrné stimulace vaječníků (OHSS), což může být závažný zdravotní problém. Toto riziko lze snížit pečlivým sledováním vývoje folikulů během léčby. Váš lékař bude provádě ultrazvuková vyšetření vaječníků s cílem pečlivě sledovat počty zrající folikulů. Váš lékař může také kontrolovat hladiny hormonů v krvi. Prvními příznaky jsou bolesti břicha, nevolnost nebo průjem. V závažnějších případech mohou příznaky zahrnovat zvětšení vaječníků, nahromadění tekutiny v břiše a/nebo v hrudníku (což může vést k náhlému přírůstku na váze v důsledku hromadění tekutin) a výskyt krevních sraženin v krevním oběhu. (Viz Upozornění a opatření v bodě 2.)
Neprodleně kontaktujte svého lékaře, jestliže máte bolesti břicha, nebo kterýkoli jiný příznak nadměrné stimulace vaječníků, i pokud se vyskytnou několik dní po podání poslední injekce.
Pokud jste žena
Časté nežádoucí účinky (mohou postihnout až 1 z 10 lidí):
- Bolest hlavy
- Reakce v místě aplikace injekce (například modřina, bolest, zarudnutí, otok a svědění)
- Ovariální hyperstimulační syndrom (OHSS)
- Bolest pánve
- Bolest a/nebo nadmutí břicha
Méně časté nežádoucí účinky (mohou postihnout až 1 ze 100 lidí):
- Potíže s prsy (včetně citlivosti)
- Průjem, zácpa nebo žaludeční dyskomfort
- Zvětšení dělohy
- Pocit nevolnosti
- Reakce přecitlivělosti (například vyrážka, zarudnutí, kopřivka a svědění)
- Ovariální cysty nebo zvětšení vaječníků
- Ovariální torze (přetočení vaječníků)
- Krvácení z pochvy
Vzácné nežádoucí účinky (mohou postihnout až 1 z 1 000 lidí):
- Krevní sraženiny (mohou se také objevit v přítomnosti nechtěné hyperstimulace ovárií, viz bod 2, Upozornění a opatření)
Rovněž bylo hlášeno mimoděložní těhotenství (ektopické těhotenství), potrat a vícečetné těotenství. Má se za to, že tyto nežádoucí účinky nesouvisejí s podáváním přípravku Fertavid, ale s postupy asistované reprodukce (ART) nebo s následným těhotenstvím.
Pokud jste muž:
Časté nežádoucí účinky (mohou postihnout až 1 z 10 lidí):
- Akné
- Reakce v místě aplikace injekce (například zatvrdnutí a bolest)
- Bolest hlavy
- Vyrážka
- Určité zvětšení prsní tkáně
- Cysta ve varleti
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Fertavid uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Uchovávání pro lékárníka
Uchovávejte při teplotě 2°C - 8°C (v chladničce).
Chraňte před mrazem.
Uchovávání pro pacienta
Máte dvě možnosti:
1. Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
2. Uchovávejte při teplotě do 25°C (pokojové teplotě) jedno období nepřesahující 3 měsíce. Zaznamenejte si, kdy jste začal/a přípravek uchovávat mimo chladničku.
Uchovávejte injekční lahvičku(y) v krabičce.
Obsah lahvičky musí být použit ihned po propíchnutí pryžového uzávěru.
Fertavid nepoužívejte po uplynutí doby použitelnosti, uvedené na krabičce a štítku za ‘EXP’. Datum se vztahuje k poslednímu dni uvedeného měsíce.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí
6. Obsah balení a další informace
Co Fertavid obsahuje
Léčivou látkou je follitropinum beta.
Fertavid 50 IU/0,5 ml injekční roztok: Jedna injekční lahvička obsahuje léčivou látku follitropin beta, hormon známý jako folikuly stimulující hormon (FSH) v síle 50 IU v 0,5 ml vodného roztoku v jedné injekční lahvičce.
Fertavid 75 IU/0,5 ml injekční roztok: Jedna injekční lahvička obsahuje léčivou látku follitropin beta, hormon známý jako folikuly stimulující hormon (FSH) v síle 75 IU v 0,5 ml vodného roztoku v jedné injekční lahvičce.
Fertavid 100 IU/0,5 ml injekční roztok: Jedna injekční lahvička obsahuje léčivou látku follitropin beta, hormon známý jako folikuly stimulující hormon (FSH) v síle 100 IU v 0,5 ml vodného roztoku v jedné injekční lahvičce.
Fertavid 150 IU/0,5 ml injekční roztok: Jedna injekční lahvička obsahuje léčivou látku follitropin beta, hormon známý jako folikuly stimulující hormon (FSH) v síle 150 IU v 0,5 ml vodného roztoku v jedné injekční lahvičce.
Fertavid 200 IU/0,5 ml injekční roztok: Jedna injekční lahvička obsahuje léčivou látku follitropin beta, hormon známý jako folikuly stimulující hormon (FSH) v síle200 IU v 0,5 ml vodného roztoku v jedné injekční lahvičce.
Pomocnými látkami jsou sacharóza, dihydrát citronanu sodného, metionin a polysorbát 20 ve vodě na injekci. Pro úpravu pH mohly být použity hydroxid sodný a/nebo kyselina chlorovodíková.
Jak Fertavid vypadá a co obsahuje toto balení
Fertavid injekční roztok (injekce) je čirá bezbarvá tekutina. Je dodáván ve skleněných injekčních lahvičkách. Balení obsahuje 1, 5 nebo 10 injekčních lahviček.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Merck Sharp & Dohme Limited
Hertford Road
Hoddesdon
Hertfordshire EN11 9BU Velká Británie
Výrobce
N.V. Organon Kloosterstraat 6 5349 AB Oss Nizozemsko
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien Lietuva
MSD Belgium BVBA/SPRL UAB Merck Sharp & Dohme
Tel/Tél: 0800 38 693 (+32(0)27766211) Tel: + 370 5 2780247
dpoc_belux@merck.com msd_lietuva@merck.com
|
BtnrapHH Mep k fflapn u floyM Etnrapna EOOfl Ten.: + 359 2 819 37 37 info-msdbg@merck.com |
Luxembourg/Luxemburg MSD Belgium BVBA/SPRL Tel/Tél: +32(0)27766211 dpoc_belux@merck.com |
|
Česká republika Merck Sharp & Dohme s.r.o. Tel.: +420 233 010 111 dpoc_czechslovak@merck.com |
Magyarország MSD Pharma Hungary Kft. Tel.: + 36 1 888 5300 hungary_msd@merck.com |
|
Danmark MSD Danmark ApS Tlf: + 45 4482 4000 dkmail@merck.com |
Malta Merck Sharp & Dohme Cyprus Limited Tel: 8007 4433 (+356 99917558) malta_info@merck.com |
|
Deutschland MSD SHARP & DOHME GMBH Tel: 0800 673 673 673 (+49 (0) 89 4561 2612) |
Nederland Merck Sharp & Dohme BV Tel: 0800 99 99 000 (+ 31 23 5153153) |
|
Eesti Merck Sharp & Dohme OU Tel: + 372 6144 200 msdeesti@merck.com |
Norge MSD (Norge) AS Tlf: + 47 32 20 73 00 msdnorge@msd.no |
|
ElláSa MSD A.O.B.EE. Tpk: +30 210 98 97 300 dpoc_greece@merck.com |
Osterreich Merck Sharp & Dohme Ges.m.b.H. Tel: +43 (0) 1 26 044 msd-medizin@merck.com |
|
Espaňa Merck Sharp & Dohme de Espana, S.A. Tel.: +34 91 321 06 00 msd info@merck.com |
Polska MSD Polska Sp. z o.o. Tel.: +48 22 549 51 00 msdpolska@merck.com |
|
France MSD France Tél + 33 (0)1 80 46 40 40 |
Portugal Merck Sharp & Dohme, Lda Tel: + 351 214 465700 clic@merck.com |
|
Hrvatska Merck Sharp & Dohme d.o.o. Tel: + 385 1 6611 333 croatia_info@merck.com |
Románia Merck Sharp & Dohme Romania S.R.L. Tel: + 40 21 529 29 00 msdromania@merck.com |
|
Ireland Merck Sharp & Dohme Ireland (Human Health) Limited Tel: +353 (0)1 2998700 medinfo_ireland@merck.com |
Slovenija Merck Sharp & Dohme, inovativna zdravila d.o.o Tel: + 386 1 5204201 msd_slovenia@merck.com |
|
Ísland Vistor hf. Sími: + 354 535 7000 |
Slovenská republika Merck Sharp & Dohme, s. r. o. Tel: + 421 2 58282010 dpoc_czechslovak@merck.com |
Italia
MSD Italia S.r.l.
Tel: +39 06 361911 medicalinformation.it@merck.com
Kúrcpog
Merck Sharp & Dohme Cyprus Limited Tqk 800 00 673 (+ 357 22866700) cyprus_info@merck.com
Latvija
SIA Merck Sharp & Dohme Latvija Tel: + 371 67364 224 msd_lv@merck.com
Suomi/Finland
MSD Finland Oy Puh/Tel: + 358 (0)9 804650 info@msd.fi
Sverige
Merck Sharp & Dohme (Sweden) AB Tel: + 46 77 570 04 88 medicinskinfo@merck.com
United Kingdom
Merck Sharp & Dohme Limited Tel: + 44 (0) 1992 467272 medicalinformationuk@merck.com
Tato příbalová informace byla naposledy revidována
Další zdroje informací
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu.
Příbalová informace: informace pro uživatele
Fertavid 150 IU/0,18 ml injekční roztok Fertavid 300 IU/0,36 ml injekční roztok Fertavid 600 IU/0,72 ml injekční roztok Fertavid 900 IU/1,08 ml injekční roztok follitropinum beta
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se, svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je přípravek Fertavid a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Fertavid používat
3. Jak se přípravek Fertavid používá
4. Možné nežádoucí účinky
5. Jak přípravek Fertavid uchovávat
6. Obsah balení a další informace 1. Co je přípravek Fertavid a k čemu se používá
Fertavid injekční roztok obsahuje follitropin beta, hormon známý jako folikuly stimulující hormon (FSH).
FSH patří do skupiny gonadotropinů, které mají velký vliv na plodnost a reprodukci u člověka. U žen je FSH nutný pro růst a vývoj folikulů ve vaječnících. Folikuly jsou malé kulaté váčky obsahující vajíčka. U mužů je FSH nutný pro tvorbu spermií.
Fertavid je určen pro léčbu neplodnosti v některých následujících situacích:
Ženy
Fertavid lze použít k vyvolání ovulace u žen, které neovulují a nereagují na léčbu klomifen-citrátem. U žen, které se podrobují asistované reprodukci, včetně oplodnění in vitro (IVF) a ostatních metod, může Fertavid navodit růst mnohočetných folikulů.
Muži
U mužů, kteří jsou neplodní z důvodů snížených hladin hormonů, může být Fertavid použit pro stimulaci tvorby spermií.
2. Čemu musíte věnovat pozornost, než začnete přípravek Fertavid používat
Nepoužívejte Fertavid
Jestliže:
• jste alergický(á) na follitropin beta nebo na kteroukoli další složku přípravku Fertavid (uvedenou v bodě 6)
• máte nádor vaječníku, prsu, dělohy, varlete nebo mozku [hypofýzy (podvěsku mozkového) nebo hypotalamu (části mezimozku)]
• máte silné nebo nepravidelné vaginální krvácení, jehož příčina je neznámá
• máte nefunkční vaječníky v důsledku stavu zvaného primární ovariální porucha/selhání
• máte ovariální cysty nebo zvětšené vaječníky bez souvislosti se syndromem polycystických ovárií (PCOS)
• máte malformace pohlavních orgánů, které znemožňují normální těhotenství
• máte myomy dělohy (nezhoubné nádory ze svalové tkáně), které znemožňují normální těhotenství
• jste muž a jste neplodný v důsledku stavu zvaného primární porucha/selhání funkce varlat. Upozornění a opatření
Předtím, než začnete používat přípravek Fertavid, svého lékaře informujte, pokud:
• jste někdy měl(a) alergickou reakci na určitá antibiotika (neomycin a/nebo streptomycin)
• máte problémy s hypofýzou nebo hypothalamem, které nejsou pod kontrolou
• máte málo aktivní štítnou žlázu (hypothyroidismus)
• Vaše nadledvinky nefungují správně (adrenokortikální nedostatečnost)
• máte vysoké hladiny prolaktinu v krvi (hyperprolaktinémie)
• máte jakékoli jiné zdravotní problémy (například cukrovku, onemocnění srdce nebo jakékoli jiné dlouhodobé onemocnění).
U žen:
Syndrom nadměrné stimulace vaječníků (OHSS)
Váš lékař bude pravidelně kontrolovat účinnost léčby, aby mohl den ze dne volit správnou dávku přípravku Fertavid. Pravidelně mohou být prováděna vyšetření vaječníků ultrazvukem. Váš lékař může rovněž sledovat hladiny hormonů v krvi. To je velmi důležité, protože příliš vysoké dávky FSH mohou mít za následek vzácné, ale závažné komplikace, při kterých dochází k nadměrné stimulaci vaječníků a rostoucí folikuly jsou větší, než je obvyklé. Tento závažný zdravotní stav se nazývá syndrom nadměrné stimulace vaječníků (OHSS). Ve vzácných případech může Být OHSS život ohrožujcí. OHSS způsobuje náhlé hromadění tekutiny v břiše a oblasti hrudníku a může způsobit tvorbu krevních sraženin. Pokud zaznamenáte výrazné zvětšení břicha, bolest v oblasti žaludku (břicha), nevolnost (nauzeu), zvracení, náhlý přírůstek na váze v důsledku hromadění tekutin, průjem, snížený výdej moči nebo potíže s dechem, ihned vyhledejte na svého lékaře (viz také bod 4. Možné nežádoucí účinky).
Pravidelné sledování odpovědi na léčbu FSH pomáhá zabránit nadměrné stimulaci vaječníků. Neprodleně kontaktujte svého lékaře, jestliže máte bolesti břicha, i pokud se vyskytnou několik dní po podání poslední injekce.
Vícečetné těhotenství nebo vrozené vady
Po léčbě gonadotropinovými přípravky je vyšší pravděpodobnost vícečetného těhotenství, a to i když se do dělohy vloží jen jedno embryo. Vícečetná těhotenství přinášejí v čase kolem porodu zvýšená zdravotní rizika pro matku i její děti. Vícečetná těhotenství a charakteristiky pacientů podstupujících léčbu neplodnosti (např. věk ženy, charakteristiky spermatu, genetické dispozice obou rodičů) mohou být navíc spojeny se zvýšením rizika vrozených vad.
Komplikace v těhotenství
Existuje mírně zvýšené riziko vzniku mimoděložní těhotenství (ektopického těhotenství). Proto by Váš lékař měl provést časné ultrazvukové vyšetření, aby možnost mimoděložního těhotenství vyloučil.
U žen podstupujících léčbu neplodnosti může být mírně zvýšeno riziko potratu.
Krevní sraženina (trombóza)
Léčba přípravkem Fertavid, stejně tak jako těhotenství, může zvýšit riziko vzniku krevní sraženiny (trombózy). Trombóza je tvorba krevní sraženiny v krevní cévě.
Krevní sraženiny mohou vést k závažným zdravotním stavům, jako je:
• ucpání cévy v plicích (plicní embolie)
• mrtvice
• srdeční záchvat
• cévní problémy (tromboflebitida)
• zastavení krevního průtoku (hluboká žilní trombóza), což může vést ke ztrátě ruky nebo nohy.
Proberte, prosím, toto téma s Vaším lékařem před zahájením léčby, zvláště:
• jestliže již víte, že je u Vás zvýšená pravděpodobnost vzniku trombózy
• jestliže se trombóza někdy vyskytla u Vás nebo Vašeho blízkého pokrevního příbuzného
• jestliže máte výraznou nadváhu.
Torze ování
Po léčbě gonadotropiny, včetně přípravku Fertavid, se objevila torze ovárií. Torze ovárií znamená přetočení vaječníků. Přetočení vaječníků může vést k přerušení průtoku krve do vaječníku.
Předtím, než začnete tento lék užívat, svého lékaře informujte, pokud:
• se u Vás kdykoli v minulosti vyskytl syndrom nadměrné stimulace vaječníků (OHSS)
• jste těhotná nebo si myslíte, že byste mohla být těhotná
• jste kdykoli v minulosti podstoupil(a) operaci žaludku (břicha)
• Vás kdykoli v minulosti postihlo přetočení vaječníků
• máte nebo jste v minulosti měla cysty ve vaječníku nebo vaječnících.
Nádory vaječníků a dalších částí reprodukčního systému
Byly hlášeny nádory vaječníků a dalších částí reprodukčního systému u žen, které podstoupily léčbu neplodnosti. Není známo, zda léčba přípravky na zvýšení plodnosti zvyšuje riziko vzniku těchto nádorů u neplodných žen.
Další zdravotní stavy
Navíc před zahájením používání tohoto přípravku svého lékaře informujte, pokud:
• Vám lékař řekl, že by pro Vás mohlo být těhotenství nebezpečné.
U mužů:
Muži s příliš vysokým množstvím FSH v krvi
Zvýšené hladiny FSH v krvi jsou známkou poruchy funkce varlat. V těchto případech není obvykle Fertavid účinný. V rámci kontroly účinnosti léčby Vás může lékař po čtyřech až šesti měsících od zahájení léčby požádat o vzorek semene k provedení analýzy.
Další léčivé přípravky a přípravek Fertavid
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Při použití přípravku Fertavid v kombinaci s klomifen-citrátem, může být účinnost přípravku Fertavid zvýšena. Pokud byl podáván agonista GnRH (lék používaný k zabránění předčasné ovulace), může být zapotřebí vyšších dávek přípravku Fertavid.
Těhotenství a kojení
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoliv lék. Fertavid nesmíte užívat, jestliže jste již těhotná, nebo se domníváte, že byste mohla být těhotná.
Fertavid může mít vliv na tvorbu mléka. Prostup přípravku Fertavid do mléka není pravděpodobný. Pokud kojíte, informujte o tom svého lékaře dříve, než začnete užívat Fertavid.
Řízení dopravních prostředků a obsluha strojů
Vliv přípravku Fertavid na schopnosti řídit motorová vozidla a obsluhovat stroje není pravděpodobný. Důležité informace o některých složkách přípravku Fertavid
Tento léčivý přípravek obsahuje méně než 1 mmol (23 mg) sodíku na injekci, tj. v podstatě je „bez sodíku“.
Děti
Přípravek Fertavid nemá u dětí žádné relevantní použití.
3. Jak se přípravek Fertavid používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý/á, poraďte se se svým lékařem nebo lékárníkem.
Dávkování u žen
Váš lékař rozhodne o velikosti počáteční dávky. V průběhu Vaší léčby může být tato dávka upravena. Další podrobnosti léčebného schématu jsou uvedeny níže.
Mezi jednotlivými ženami existují velké rozdíly v odpovědi vaječníků na FSH, proto není možné stanovit dávkovací schéma, které by bylo vhodné pro všechny pacientky. Váš lékař bude ke zjištění správného dávkování kontrolovat růst Vašich folikulů pomocí ultrazvuku a zjišťovat množství estradiolu (ženského pohlavního hormonu) v krvi.
• Ženy, které neovulují
Velikost počáteční dávky určí Váš lékař. Tato dávka je podávána alespoň po dobu sedmi dnů. Nedojde-li k odpovědi vaječníků, bude denní dávka postupně zvyšována, dokud se nedostaví vyhovující odpověď, měřeno růstem folikulů nebo hladinou estradiolu. Velikost denní dávky pak zůstane stejná až do vytvoření folikulu vhodné velikosti. Obvykle postačuje léčba v délce 714 dnů. Léčba přípravkem Fertavid je poté ukončena a ovulace bude navozena podáním humánního choriového gonadotropinu (hCG).
• Programy asistované reprodukce, např. IVF
Velikost počáteční dávky určí Váš lékař. Tato dávka je podávána alespoň po dobu prvních čtyř dnů. Poté může být Vaše dávka upravena v závislosti na odpovědi Vašich vaječníků. Když je přítomen dostatečný počet folikulů vhodné velikosti, je navozena konečná fáze dozrávání folikulů podáním hCG. Odběr vajíčka/vajíček je proveden o 34-35 hodin později.
Dávkování u mužů
Fertavid se obvykle podává v dávce 450 IU za týden, většinou rozdělen do 3 dávek po 150 IU společně s dalším hormonem (hCG), po dobu alespoň 3-4 měsíců. Doba léčby odpovídá době vývoje spermií a době, kdy může být očekáváno zlepšení. Pokud se spermie po tomto období nezačaly tvořit, Vaše léčba může pokračovat po dobu 18 měsíců nebo déle.
Jak jsou injekce podávány
Fertavid injekční roztok v kontejnerech s náplní byl vyvinut pro použití společně s injekčním perem Puregon Pen. Zvlášť uvedené pokyny pro použití pera musí být pečlivě dodržovány. Kontejner s náplní nepoužívejte, pokud v něm obsažený roztok obsahuje částice nebo pokud není čirý.
Pomocí pera mohou být Vámi nebo Vaším partnerem injekce aplikovány těsně pod kůži (např. do břišní stěny). Váš lékař Vám sdělí, jak a kdy injekce aplikovat. Jestliže si přípravek Fertavid aplikujete sami, dodržujte pečlivě pokyny, aby byl Fertavid aplikován správně a s minimálními nepříjemnými pocity.
První injekce přípravku Fertavid má být aplikována pouze v přítomnosti lékaře nebo zdravotní sestry.
Jestliže jste použil(a) více přípravku Fertavid, než jste měl(a)
Sdělte to ihned svému lékaři.
Příliš vysoká dávka přípravku Fertavid může vyvolat nadměrnou stimulaci vaječníků (OHSS). Můžete to pozorovat jako bolest břicha. Jestliže máte bolesti břicha, sdělte to neprodleně svému lékaři. Viz také bod 4 Možné nežádoucí účinky.
Jestliže jste zapomněl(a) použít Fertavid
Jestliže jste na dávku zapomněl(a), nezdvojujte následující dávku, abyste nahradil(a) vynechanou dávku.
Kontaktujte svého lékaře.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento léčivý přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Závazné nežádoucí účinky u zen
Komplikací léčby FSH je hyperstimulace vaječníků. Nadměrná stimulace vaječníků se může vyvinout do stavu nazývaného syndrom nadměrné stimulace vaječníků (OHSS), což může být závažný zdravotní problém. Toto riziko lze snížit pečlivým sledováním vývoje folikulů během léčby. Váš lékař bude provádě ultrazvuková vyšetření vaječníků s cílem pečlivě sledovat počty zrající folikulů. Váš lékař může také kontrolovat hladiny hormonů v krvi. Prvními příznaky jsou bolesti břicha, nevolnost nebo průjem. V závažnějších případech mohou příznaky zahrnovat zvětšení vaječníků, nahromadění tekutiny v břiše a/nebo v hrudníku (což může vést k náhlému přírůstku na váze v důsledku hromadění tekutin) a výskyt krevních sraženin v krevním oběhu. (Viz Upozornění a opatření v bodě 2.)
Neprodleně kontaktujte svého lékaře, jestliže máte bolesti břicha, nebo kterýkoli jiný příznak nadměrné stimulace vaječníků, i pokud se vyskytnou několik dní po podání poslední injekce.
Pokud jste žena
Časté nežádoucí účinky (mohou postihnout až 1 z 10 lidí):
- Bolest hlavy
- Reakce v místě aplikace injekce (například modřina, bolest, zarudnutí, otok a svědění)
- Ovariální hyperstimulační syndrom (OHSS)
- Bolest pánve
- Bolest a/nebo nadmutí břicha
Méně časté nežádoucí účinky (mohou postihnout až 1 ze 100 lidí):
- Potíže s prsy (včetně citlivosti)
- Průjem, zácpa nebo žaludeční dyskomfort
- Zvětšení dělohy
- Pocit nevolnosti
- Reakce přecitlivělosti (například vyrážka, zarudnutí, kopřivka a svědění)
- Ovariální cysty nebo zvětšení vaječníků
- Ovariální torze (přetočení vaječníků)
- Krvácení z pochvy
Vzácné nežádoucí účinky (mohou postihnout až 1 z 1 000 lidí):
- Krevní sraženiny (mohou se také objevit v přítomnosti nechtěné hyperstimulace ovárií, viz bod 2, Upozornění a opatření)
Rovněž bylo hlášeno mimoděložní těhotenství (ektopické těhotenství), potrat a vícečetné těhotenství. Má se za to, že tyto nežádoucí účinky nesouvisejí s podáváním přípravku Fertavid, ale s postupy asistované reprodukce (ART) nebo s následným těhotenstvím.
Pokud jste muž:
Časté nežádoucí účinky (mohou postihnout až 1 z 10 lidí):
- Akné
- Reakce v místě aplikace injekce (například zatvrdnutí a bolest)
- Bolest hlavy
- Vyrážka
- Určité zvětšení prsní tkáně
- Cysta ve varleti
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Fertavid uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Uchovávání pro lékárníka
Uchovávejte při teplotě 2°C - 8°C (v chladničce).
Chraňte před mrazem.
Uchovávání pro pacienta
Máte dvě možnosti:
1. Uchovávejte při teplotě 2°C - 8°C (v chladničce). Chraňte před mrazem.
2. Uchovávejte při teplotě do 25°C (pokojové teplotě) jedno období nepřesahující 3 měsíce. Zaznamenejte si, kdy jste začal(a) přípravek uchovávat mimo chladničku.
Uchovávejte kontejner s náplní v krabičce.
Po propíchnutí pryžového uzávěru kontejneru s náplní jehlou může být přípravek uchováván nejdéle po dobu 28 dnů.
Zaznamenejte, prosím, datum prvního použití kontejneru do tabulky záznamu dávkování, jak je uvedeno v návodu pro použití injekčního pera Puregon Pen.
Fertavid nepoužívejte po uplynutí doby použitelnosti, uvedené na krabičce a štítku za ‘EXP’. Datum se vztahuje k poslednímu dni uvedeného měsíce.
Použité jehly zlikvidujte ihned po aplikaci.
Nepřidávejte do kontejneru s náplní jakýkoli jiný lék.
Prázdné kontejnery nesmí být znovu plněny.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí
6. Obsah balení a další informace
Co Fertavid obsahuje
• Jeden kontejner s náplní obsahuje léčivou látku follitropin beta, hormon známý jako folikuly stimulující hormon (FSH) v síle 833 IU v ml vodného roztoku.
• Pomocnými látkami jsou sacharóza, dihydrát citronanu sodného, metionin, polysorbát 20 a benzylalkohol ve vodě na injekci. Pro úpravu pH mohly být použity hydroxid sodný a/nebo kyselina chlorovodíková.
Jak Fertavid vypadá a co obsahuje toto balení
Fertavid injekční roztok (injekce) je čirá bezbarvá tekutina. Je dodáván ve skleněných kontejnerech.
Každé balení obsahuje jeden kontejner s náplní.
Držitel rozhodnutí o registraci
Merck Sharp & Dohme Limited
Hertford Road, Hoddesdon
Hertfordshire EN11 9BU
Velká Británie
Výrobce
N.V. Organon Kloosterstraat 6 5349 AB Oss Nizozemsko
Organon (Ireland) Ltd. P.O. Box 2857 Drynam Road Swords, Co. Dublin Irsko
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien
MSD Belgium BVBA/SPRL
Tel/Tél: 0800 38 693 (+32(0)27766211)
Etarapnu
MepK fflapn h floyM Etarapua EOOfl Tea.: + 359 2 819 37 37 info-msdbg@merck.com
Česká republika
Merck Sharp & Dohme s.r.o.
Tel.: +420 233 010 111 dpoc_czechslovak@merck.com
Danmark
MSD Danmark ApS Tlf: + 45 4482 4000 dkmail@merck.com
Lietuva
UAB Merck Sharp & Dohme Tel: + 370 5 2780247 msd_lietuva@merck.com
Luxembourg/Luxemburg
MSD Belgium BVBA/SPRL Tel/Tél: +32(0)27766211 dpoc_belux@merck.com
Magyarország
MSD Pharma Hungary Kft.
Tel.: +36 1 888 5300 hungary_msd@merck.com
Malta
Merck Sharp & Dohme Cyprus Limited Tel: 8007 4433 (+356 99917558) malta_info@merck.com
|
Deutschland MSD SHARP & DOHME GMBH Tel: 0800 673 673 673 (+49 (0) 89 4561 2612) |
Nederland Merck Sharp & Dohme BV Tel: 0800 99 99 000 (+ 31 23 5153153) |
|
Eesti Merck Sharp & Dohme OU Tel: + 372 6144 200 msdeesti@merck.com |
Norge MSD (Norge) AS Tlf: + 47 32 20 73 00 msdnorge@msd.no |
|
EXláSa MSD A.O.B.EE. Tn^: +30 210 98 97 300 dpoc_greece@merck.com |
Osterreich Merck Sharp & Dohme Ges.m.b.H. Tel: +43 (0) 1 26 044 msd-medizin@merck.com |
|
Espaňa Merck Sharp & Dohme de Espana, S.A. Tel.: +34 91 321 06 00 msd info@merck.com |
Polska MSD Polska Sp. z o.o. Tel.: +48 22 549 51 00 msdpolska@merck.com |
|
France MSD France Tél + 33 (0)1 80 46 40 40 |
Portugal Merck Sharp & Dohme, Lda Tel: + 351 214 465700 clic@merck.com |
|
Hrvatska Merck Sharp & Dohme d.o.o. Tel: + 385 1 6611 333 croatia info@merck.com |
Románia Merck Sharp & Dohme Romania S.R.L. Tel: + 40 21 529 29 00 msdromania@merck.com |
|
Ireland Merck Sharp & Dohme Ireland (Human Health) Limited Tel: +353 (0)1 2998700 medinfo ireland@merck.com |
Slovenija Merck Sharp & Dohme, inovativna zdravila d.o.o Tel: + 386 1 5204201 msd_slovenia@merck.com |
|
Ísland Vistor hf. Sími: + 354 535 7000 |
Slovenská republika Merck Sharp & Dohme, s. r. o. Tel: + 421 2 58282010 dpoc_czechslovak@merck.com |
|
Italia MSD Italia S.r.l. Tel: +39 06 361911 medicalinformation.it@merck.com |
Suomi/Finland MSD Finland Oy Puh/Tel: + 358 (0)9 804650 info@msd.fi |
|
Kúnpoq Merck Sharp & Dohme Cyprus Limited Tn^: 800 00 673 (+ 357 22866700) cyprus info@merck.com |
Sverige Merck Sharp & Dohme (Sweden) AB Tel: + 46 77 570 04 88 medicinskinfo@merck.com |
|
Latvija SIA Merck Sharp & Dohme Latvija Tel: + 371 67364 224 msd lv@merck.com |
United Kingdom Merck Sharp & Dohme Limited Tel: + 44 (0) 1992 467272 medicalinformationuk@merck.com |
Tato příbalová informace byla naposledy revidována
Další zdroje informací
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu.
75