Eylea 40 Mg/Ml
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 mililitr injekčního roztoku obsahuje afliberceptum* 40 mg.
Jedna předplněná injekční stříkačka obsahuje 90 mikrolitrů, to odpovídá 3,6 mg afliberceptu. To poskytuje využitelné množství pro dodání jedné dávky 50 mikrolitrů obsahujících 2 mg afliberceptu.
*Fuzní protein skládající se z fragmentů extracelulárních domén humánního VEGF (vaskulární endoteliální růstový faktor) receptoru 1 a 2 fúzovaných na Fc fragment humánního IgG1 je vyráběn rekombinantní DNA technologií v buňkách K1 ovarií křečíka čínského.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok (injekce)
Roztok je čirý, bezbarvý až světle žlutý a isoosmotický.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Eylea je indikován u dospělých k léčbě
• neovaskulární (vlhké) formy věkem podmíněné makulární degenerace (VPMD) (viz bod 5.1),
• poruchy zraku způsobené makulárním edémem v důsledku okluze retinální žíly (RVO) (větve retinální žíly (BRVO) nebo centrální retinální žíly (CRVO)) (viz bod 5.1),
• poruchy zraku v důsledku diabetického makulárního edému (DME) (viz bod 5.1),
• porucha zraku v důsledku myopické chorioideální neovaskularizace (myopická CNV) (viz bod 5.1).
4.2 Dávkování a způsob podání
Přípravek Eylea je určen pouze pro injekci do sklivce.
Přípravek Eylea musí být podáván pouze kvalifikovaným lékařem, který má zkušenosti s aplikací injekcí do sklivce.
Dávkování Vlhká forma VPMD
Doporučená dávka přípravku Eylea je 2 mg afliberceptu, což odpovídá 50 mikrolitrům.
Na začátku léčby přípravkem Eylea se podává jedna injekce měsíčně ve třech po sobě jdoucích dávkách, následně se podává jedna injekce každé dva měsíce. Není žádný požadavek na kontroly mezi injekcemi.
Po prvních 12 měsících léčby přípravkem Eylea a na základě výsledků vyšetření zraku a/nebo anatomických poměrů může být léčebný interval prodloužen, např. režimem „treat and extend“, kdy dochází k postupnému prodlužování léčebných intervalů, aby byly udrženy stabilní výsledky vyšetření zraku a/nebo anatomických poměrů, avšak vzhledem k nedostatku údajů není možné určit délku těchto intervalů. Pokud dojde ke zhoršení výsledků vyšetření zraku a/nebo anatomických poměrů, léčebný interval má být podle toho zkrácen.
Plán kontrolmá proto určit ošetřující lékař, kontroly můžou být plánovány častěji v porovnání s plánem podání injekcí.
Makulární edém v důsledku RVO (BRVO nebo CRVO)
Doporučená dávka přípravku Eylea je 2 mg afliberceptu, což odpovídá 50 mikrolitrům.
Po první injekci je léčba aplikována jednou měsíčně. Interval mezi dvěma dávkami nemá být kratší než jeden měsíc.
Jestliže výsledky vyšetření zraku a anatomických poměrů naznačují, že pokračující léčba není pro pacienta přínosná, podávání přípravku Eylea má být ukončeno.
Léčba jednou měsíčně pokračuje, dokud nedojde k dosažení maximální zrakové ostrosti a/nebo vymizení příznaků aktivního onemocnění. Zapotřebí mohou být tři nebo více po sobě následující injekce aplikované jednou měsíčně.
Léčba může pokračovat v režimu „treat and extend“ s postupně prodlužujícími se léčebnými intervaly, aby byly udrženy stabilní výsledky vyšetření zraku a/nebo anatomických poměrů, avšak vzhledem k nedostatku údajů není možné určit délku těchto intervalů. Pokud dojde ke zhoršení výsledků vyšetření zraku a/nebo anatomických poměrů, léčebný interval má být podle toho zkrácen.
Plán kontrol a léčby má stanovit ošetřující lékař na základě individuální odpovědi pacienta.
Sledování aktivity nemoci může zahrnovat klinické vyšetření, funkční testy nebo zobrazovací techniky (např. optická koherentní tomografie nebo fluorescenční angiografie).
Diabetický makulární edém
Doporučená dávka přípravku Eylea je 2 mg afliberceptu, což odpovídá 50 mikrolitrům.
Léčba přípravkem Eylea se zahajuje jednou injekcí měsíčně s pěti po sobě jdoucími dávkami s následným podáváním jedné injekce každé dva měsíce. Kontroly mezi injekcemi nejsou požadovány.
Po 12 měsících léčby přípravkem Eylea a na základě výsledků vyšetření zraku a/nebo anatomických poměrů může být léčebný interval prodloužen, např. režimem „treat and extend“, kdy dochází k postupnému prodlužování léčebných intervalů, aby byly udrženy stabilní výsledky vyšetření zraku a/nebo anatomických poměrů, avšak vzhledem k nedostatku údajů není možné určit délku těchto intervalů. Pokud dojde ke zhoršení výsledků vyšetření zraku a/nebo anatomických poměrů, léčebný interval má být podle toho zkrácen.
Plán kontrol má proto určit ošetřující lékař, kontroly můžou být plánovány častěji v porovnání s plánem podání injekcí.
Pokud výsledky vyšetření zraku a anatomických poměrů naznačují, že pokračující léčba není pro pacienta přínosná, podávání přípravku Eylea má být ukončeno.
Myopická chorioideální neovaskularizace
Doporučená dávka přípravku Eylea je jedna intravitreální injekce 2 mg afliberceptu, což odpovídá 50 mikrolitrům.
Další dávky mohou být podány, pokud výsledky vyšetření zraku a/nebo anatomických poměrů ukazují, že onemocnění přetrvává. Recidivy by měly být léčeny jako nová manifestace onemocnění.
Plán kontrol má být stanoven ošetřujícím lékařem.
Interval mezi dvěma dávkami nemá být kratší než jeden měsíc.
Zvláštní populace
Porucha funkce jater a/nebo ledvin
U přípravku Eylea nebyly provedeny žádné specifické studie u pacientů s poškozením funkce jater a/nebo ledvin.
Dostupné údaje nenaznačují potřebu úpravy dávky přípravku Eylea u těchto pacientů (viz bod 5.2).
Starší populace
Nejsou nutná žádná zvláštní opatření. U pacientů s DME ve věku nad 75 let jsou zkušenosti omezené. Pediatrická populace
Bezpečnost a účinnost přípravku Eylea nebyly u dětí a dospívajících stanoveny. Neexistuje žádné relevantní použití přípravku Eylea u pediatrické populace v indikacích vlhké formy VPMD, CRVO, BRVO, DME a myopické CNV.
Způsob podání
Injekce do sklivce musí být prováděny podle lékařských standardů a příslušných pokynů kvalifikovaným lékařem, který má zkušenosti s aplikací injekcí do sklivce. Obecně musí být zajištěny odpovídající anestézie a asepse, zahrnující lokální širokospektrý mikrobicidní prostředek (např. jodovaný povidon aplikovaný na kůži kolem oka, oční víčko a povrch oka). Doporučuje se chirurgická dezinfekce rukou, sterilní rukavice, sterilní rouška a sterilní spekulum (nebo ekvivalentní náhrada).
Injekční jehla se zasune 3,5-4,0 mm posteriorně od limbu do prostoru sklivce tak, aby směřovala do centra očního bulbu a nikoli k horizontálnímu meridiánu. Poté se aplikuje objem injekce 0,05 ml; následující injekci je nutné aplikovat v jiném místě skléry.
Ihned po podání do sklivce by měli být pacienti sledováni s ohledem na zvýšení nitroočního tlaku. Vhodné monitorování může zahrnovat kontrolu prokrvení papily optického nervu nebo tonometrii. Jeli to nutné, mělo by být k dispozici sterilní vybavení pro paracentézu.
Po aplikaci do sklivce by měli být pacienti informováni, aby ihned hlásili všechny příznaky, které mohou svědčit pro endoftalmitidu (např. bolest oka, zarudnutí oka, fotofobie, rozmazané vidění).
Každá předplněná injekční stříkačka může být použita pouze pro léčbu jednoho oka.
Předplněná injekční stříkačka obsahuje množství převyšující doporučenou dávku 2 mg afliberceptu. Extrahovatelný objem stříkačky (90 mikrolitrů) není celý určen k použití. Přebytečný objem musí být před aplikací injekce vytlačen.
Aplikace celého objemu injekce může mít za následek předávkování. Pro odstranění všech bublin a vytlačení přebytečného léčivého přípravku pomalu stlačte píst tak, aby byla cylindrická báze kupolovité zátky zarovnána s černou dávkovací čárkou na stříkačce (odpovídající 50 mikrolitrům tzn.
2 mg afliberceptu).
Po aplikaci injekce musí být veškerý nespotřebovaný přípravek zlikvidován.
Pro manipulaci s léčivým přípravkem před podáním viz bod 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku aflibercept nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Aktivní oční nebo periokulární infekce nebo podezření na ni.
Aktivní závažný intraokulární zánět.
4.4 Zvláštní upozornění a opatření pro použití
Reakce spojené s aplikací intravitreální injekce
Intravitreální injekce, včetně injekcí přípravku Eylea, jsou spojovány s endoftalmitidou, nitroočním zánětem, rhegmatogenním odchlípením sítnice, trhlinou sítnice a iatrogenní traumatickou kataraktou (viz bod 4.8). Při aplikaci přípravku Eylea musí být vždy použity správné aseptické injekční postupy. Navíc mají být pacienti v týdnu, který následuje po aplikaci injekce, sledováni, aby se v případě infekce mohla zahájit včasná léčba. Pacienti mají být poučeni, aby neodkladně hlásili jakékoli příznaky, které mohou svědčit pro endoftalmitidu nebo jakoukoli výše uvedenou příhodu.
Během 60 minut po aplikaci injekce do sklivce bylo pozorováno zvýšení nitroočního tlaku, včetně po aplikaci přípravku Eylea (viz bod 4.8). Zvláštní opatření je nutné u pacientů s nedostatečně kontrolovaným glaukomem (neaplikujte injekci přípravku Eylea, pokud je nitrooční tlak > 30 mmHg). Ve všech případech proto musí být sledovány a vhodně léčeny jak nitrooční tlak, tak perfuze papily optického nervu.
Imunogenita
Vzhledem k tomu, že se jedná o terapeutický protein, existuje při použití přípravku Eylea riziko imunogenity (viz bod 4.8). Pacienti musí být instruováni, aby hlásili jakékoli známky intraokulárního zánětu, např. bolest, fotofobii nebo zarudnutí, které by mohly souviset s hypersenzitivitou.
Systémové účinky
Po injekčním intravitreálním podání inhibitorů VEGF byly zaznamenány systémové nežádoucí účinky, zahrnující krvácení mimo oko a arteriální tromboembolické příhody, a je zde teoretické riziko, že mohly souviset s inhibicí VEGF. K dispozici jsou omezené údaje o bezpečnosti léčby u pacientů s CRVO, BRVO, DME nebo myopickou CNV s anamnézou cévní mozkové příhody nebo tranzitorních ischemických atak nebo infarktu myokardu během posledních 6 měsíců. Léčbu takových pacientů je třeba provádět s opatrností.
Další
Jako u jiných typů intravitreální anti-VEGF léčby u VPMD, CRVO, BRVO, DME a myopické CNV platí také následující: 1
• Dávka nemá být podávána během 28 dní před plánovaným očním chirurgickým zákrokem a 28 dní po provedeném očním chirurgickém zákroku.
•
• Přípravek Eylea nemá být používán během těhotenství, pokud možný přínos nepřeváží možné riziko pro plod (viz bod 4.6).
• Ženy ve fertilním věku musí během léčby a minimálně 3 měsíce po poslední injekci afliberceptu do sklivce používat účinnou antikoncepci (viz bod 4.6).
• Zkušenosti s léčbou pacientů s ischemickou CRVO a BRVO jsou omezené. U pacientů, kteří jeví klinické známky ireverzibilní ischemické ztráty zrakové funkce, se léčba nedoporučuje.
Populace s omezenými daty
K dispozici jsou pouze omezené zkušenosti s léčbou pacientů s DME v důsledku diabetes mellitus 1. typu nebo u diabetických pacientů s HbA1c nad 12 % nebo s proliferativní diabetickou retinopatií. Přípravek Eylea nebyl hodnocen u pacientů s aktivními systémovými infekcemi nebo u pacientů se souběžnými chorobami oka, jako je odchlípení sítnice nebo makulární díra. Také nejsou žádné zkušenosti s léčbou přípravkem Eylea u diabetických pacientů s nekontrolovanou hypertenzí. Při léčbě takových pacientů má lékař zvážit tento nedostatek informací.
U myopické CNV nejsou k dispozici žádné zkušenosti s přípravkem Eylea v léčbě pacientů jiné než asijské rasy, pacientů, kteří dříve podstoupili léčbu myopické CNV, a pacientů s extrafoveolárními lézemi.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí.
Podpůrné použití fotodynamické léčby (PDT) verteporfinem a přípravku Eylea nebylo hodnoceno, proto bezpečnostní profil nebyl stanoven.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku.
Ženy ve fertilním věku musí během léčby a minimálně 3 měsíce po poslední injekci afliberceptu do sklivce používat účinnou antikoncepci (viz bod 4.4).
Údaje o podávání afliberceptu těhotným ženám nejsou k dispozici.
Studie na zvířatech prokázaly embryofetální toxicitu (viz bod 5.3).
Ačkoli systémová expozice po očním podání je velmi nízká, nemá být přípravek Eylea používán během těhotenství, pokud přínosy nepřeváží možná rizika pro plod.
Kojení
Není známo, zda se aflibercept vylučuje do lidského mateřského mléka. Riziko pro kojené děti nelze vyloučit.
Přípravek Eylea není doporučen během kojení. Na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku je nutno rozhodnout, zda přerušit kojení nebo přerušit podávání přípravku Eylea.
Fertilita
Výsledky ze studií na zvířatech s vysokou systémovou expozicí ukazují, že aflibercept může mít nepříznivý vliv na mužskou a ženskou fertilitu (viz bod 5.3). Takovéto účinky se neočekávají po oční aplikaci s velmi nízkou systémovou expozicí.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Vzhledem k možnosti výskytu přechodných poruch zraku souvisejících s podáním injekce nebo s očním vyšetřením má injekce přípravku Eylea malý vliv na schopnost řídit a obsluhovat stroje. Pacienti nemají řídit nebo obsluhovat stroje, dokud tyto poruchy zraku dostatečně neustoupí.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Celkem 3 102 pacientů představovalo bezpečnostní populaci v osmi studiích fáze III. Z těchto pacientů bylo 2 501 pacientů léčeno doporučenou dávkou 2 mg.
Závažné oční nežádoucí účinky na hodnoceném oku související s injekční procedurou se vyskytly u méně než 1 z 1 900 intravitreálních injekcí přípravku Eylea a zahrnovaly slepotu, endoftalmitidu, odchlípení sítnice, traumatickou kataraktu, kataraktu, krvácení do sklivce, odloučení sklivce a zvýšení nitroočního tlaku (viz bod 4.4).
Nejčastěji pozorované nežádoucí účinky (u minimálně 5 % pacientů léčených přípravkem Eylea) byly konjunktivální krvácení (25 %), snížení zrakové ostrosti (11 %), bolest oka (10 %), katarakta (8 %), zvýšení nitroočního tlaku (8 %), odloučení sklivce (7 %) a sklivcové vločky (7 %).
Seznam nežádoucích účinků uvedený v tabulce
Údaje o bezpečnosti, popsané níže, zahrnují všechny nežádoucí účinky z osmi studií fáze 3 u indikací vlhké formy VPMD, CRVO, BRVO, DME a myopické CNV s opodstatněným předpokladem příčinné souvislosti s aplikací injekce nebo léčivého přípravku.
Nežádoucí účinky jsou uvedeny podle tříd orgánových systémů a frekvence za použití následující konvence:
velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (^ 1/10 000 až <1/1 000).
V každé frekvenční skupině jsou nežádoucí účinky uvedeny v pořadí podle klesající závažnosti.
Tabulka 1: Všechny nežádoucí účinky vyskytující se během léčby hlášené u pacientů ve studiích fáze III (sdružené údaje ze studií fáze III u indikací vlhké formy VPMD, CRVO, BRVO, DME a myopické CNV) nebo v rámci postmarketingového sledování
|
Třída orgánového systému |
Velmi časté |
Časté |
Méně časté |
Vzácné |
|
Poruchy imunitního systému | ||||
|
Poruchy oka |
Snížení zrakové ostrosti, konjunktivální krvácení, bolest oka |
Trhlina v pigmentovém epitelu sítnice*, odchlípení pigmentového epitelu sítnice, degenerace sítnice, krvácení do sklivce, katarakta, kortikální katarakta, nukleární katarakta, subkapsulární katarakta, eroze rohovky, poškrábání rohovky, zvýšení nitroočního tlaku, rozmazané vidění, sklivcové vločky, odloučení sklivce, bolest v místě aplikace injekce, pocit cizího tělesa v očích, zvýšené slzení, otok víček, krvácení v místě aplikace injekce, keratitis punctata, konjunktivální hyperemie, okulární hyperemie |
Endoftalmitida2, odchlípení sítnice, trhlina sítnice, iritida, uveitida, iridocyklitida, lentikulární opacity, defekt korneálního epitelu, podráždění v místě injekce, abnormální citlivost oka, podráždění očního víčka, zarudnutí přední komory, korneální edém |
Slepota, traumatická katarakta vitritida, hypopyon |
* Onemocnění, o kterých je známo, že souvisí s vlhkou formou VPMD. Pozorované pouze ve studiích u vlhké formy VPMD.
Popis vybraných nežádoucích účinků
V rámci studií fáze III s vlhkou formou VPMD byla pozorována zvýšená incidence konjunktiválního krvácení u pacientů, kteří dostávali antitrombotika. Tato zvýšená incidence byla srovnatelná mezi pacienty, kteří dostávali ranibizumab či přípravek Eylea.
Arteriální tromboembolické příhody (ATEs) jsou nežádoucí účinky potenciálně související se systémovou inhibicí VEGF. Po intravitreálním použití inhibitorů VEGF existuje teoretické riziko arteriální tromboembolické příhody, včetně mozkové příhody a infarktu myokardu.
V klinických studiích s přípravkem Eylea byla u pacientů s VPMD, DME, RVO a myopická CNV pozorována nízká incidence arteriálních tromboembolických příhod. U všech indikací nebyl pozorován významný rozdíl mezi skupinami léčenými afliberceptem a příslušnými srovnávacími skupinami.
Jako u všech terapeutických proteinů existuje u přípravku Eylea možnost imunogenity.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
V klinických studiích byly použity dávky až 4 mg v měsíčních intervalech a objevily se izolované případy předávkování při dávce 8 mg.
Předávkování společně s větším objemem injekce může vést ke zvýšení nitroočního tlaku. Proto by v případě předávkování měl být monitorován nitrooční tlak a je-li to nezbytné podle ošetřujícího lékaře, měla by být zahájena odpovídající léčba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Oftalmologika/látky určené k léčbě neovaskularizace v oblasti oka ATC kód: S01LA05
Aflibercept je rekombinantní fúzní protein skládající se z částí extracelulárních domén humánního VEGF receptoru 1 a 2 fúzovaných na Fc fragment humánního IgG1.
Aflibercept se vyrábí rekombinantní DNA technologií v buňkách K1 ovarií křečíka čínského.
Aflibercept působí jako rozpustný falešný („decoy“) receptor, který váže VEGF-A a PlGF s vyšší afinitou než jejich přirozené receptory a tím může inhibovat vazbu a aktivaci těchto příbuzných receptorů VEGF.
Mechanismus účinku
Vaskulární endoteliální růstový faktor-A (VEGF-A) a placentární růstový faktor (PlGF) jsou zástupci VEGF skupiny angiogenních faktorů, které mohou působit jako silné mitogenní, chemotaktické a vaskulární permeabilitu ovlivňující faktory pro endoteliální buňky. VEGF působí přes dva tyrosinkinázové receptory; VEGFR-1 a VEGFR-2 nacházející se na povrchu endoteliální ch buněk. PlGF se váže pouze na VEGFR-1, který se také nachází na povrchu leukocytů. Nadměrná aktivace těchto receptorů působením VEGF-A může vést k patologické neovaskularizaci a nadměrné cévní permeabilitě. PlGF může v těchto procesech synergicky působit s VEGF-A a je také známo, že podporuje leukocytární infiltraci a cévní zánět.
Farmakodynamické účinky
Vlhká forma VPMD
Vlhká forma VPMD je charakterizována patologickou choroidální neovaskularizací (CNV). Únik krve a tekutiny z CNV může způsobit ztluštění nebo edém sítnice a/nebo subretinální/intraretinální hemoragii, které vedou ke ztrátě zrakové ostrosti.
U pacientů léčených přípravkem Eylea (jedna injekce měsíčně po dobu tří po sobě jdoucích měsíců s následnou jednou injekcí každé dva měsíce) se snížila centrální tloušťka sítnice [CRT] brzy po zahájení léčby, také se snížila průměrná velikost CNV léze, což odpovídalo výsledkům, které byly pozorovány u ranibizumabu 0,5 mg podávaného každý měsíc.
Ve studii VIEW1 došlo k průměrnému snížení CRT při vyšetření pomocí optické koherentní tomografie (OCT) (-130 mikronů v 52. týdnu léčby přípravkem Eylea 2 mg každé dva měsíce a -129 mikronů v 52. týdnu léčby ranibizumabem v dávce 0,5 mg každý měsíc). V 52. týdnu došlo také ve studii VIEW2 k průměrnému snížení CRT na OCT (-149 mikronů ve skupinách léčených přípravkem Eylea 2 mg podávaným každé dva měsíce a -139 mikronů ranibizumabem 0,5 mg podávaným každý měsíc).
Snížení velikosti CNV a snížení CRT byly obecně udržovány v druhém roce studií.
Makulární edém v důsledku CRVO a BRVO
U CRVO a BRVO dochází k retinální ischemii, která vede k uvolnění VEGF, který naopak destabilizuje těsná spojení a podporuje proliferaci endoteliálních buněk. Zvýšená tvorba VEGF souvisí s rozpadem bariéry mezi krví a sítnicí, zvýšením vaskulární permeability, edémem sítnice a komplikacemi spojenými s neovaskularizací.
U pacientů léčených 6 následnými injekcemi přípravku Eylea 2 mg jednou měsíčně byla pozorována konzistentní, rychlá a silná morfologická odpověď (při měření zlepšení průměrné CRT). V týdnu 24 byla redukce CRT statisticky nadřazena kontrole ve všech třech studiích (COPERNICUS u CRVO: -457 vs. -145 mikronů; GALILEO u CRVO: -449 vs. -169 mikronů; VIBRANT u BRVO: -280 vs. -128 mikronů).
Tento pokles od výchozího stavu CRT byl udržen do konce každé studie, týdne 100 u studie COPERNICUS, týdne 76 u studie GALILEO a týdne 52 u studie VIBRANT.
Diabetický makulární edém
Diabetický makulární edém je následek diabetické retinopatie a je charakterizovaný zvýšenou cévní permeabilitou a poškozením retinálních kapilár, což může vést ke ztrátě zrakové ostrosti.
U pacientů léčených přípravkem Eylea, z nichž většina byla klasifikována jako pacienti s diabetem typu II, byla brzy po zahájení léčby pozorována rychlá a masivní morfologická odpověď (CRT, stupeň DRSS).
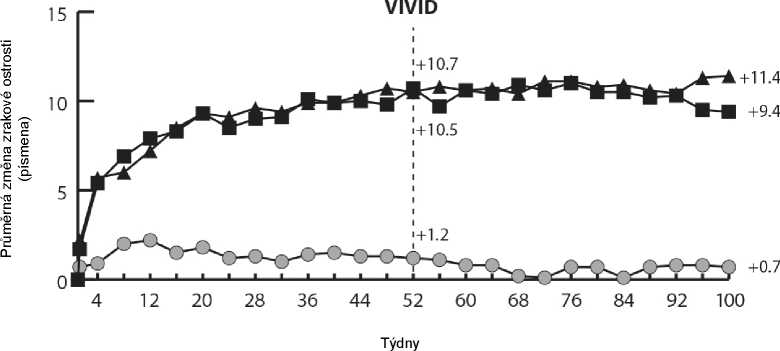
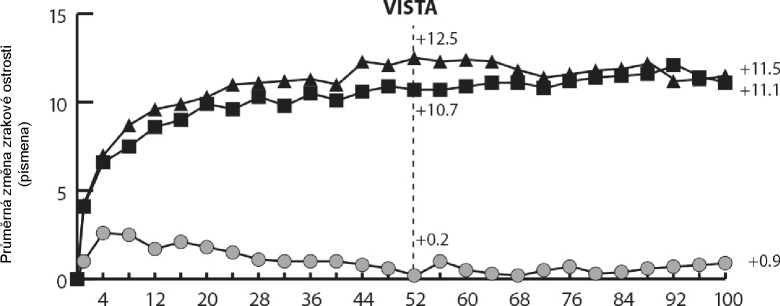
Ve studiích VIVIDDME a VISTADME bylo statisticky významné větší průměrné snížení CRT od výchozího stavu do týdne 52 pozorováno u pacientů léčených přípravkem Eylea než v kontrolní skupině léčené laserem, -192,4 a -183,1 mikrometrů pro skupiny léčené přípravkem Eylea 2Q8 a -66,2 a -73,3 mikrometrů pro kontrolní skupiny, v uvedeném pořadí. V týdnu 100 bylo udrženo snížení -195,8 a -191,1 mikrometrů pro skupiny Eylea 2Q8 a -85,7 a -83,9 mikrometrů pro kontrolní skupiny ve studiích VIVID-DME a VISTA-DME, v uvedeném pořadí.
Ve studiích VIVID-DME a VISTA-DME bylo předem definovaným způsobem hodnoceno zlepšení o > 2 kroky v DRSS. Skóre DRSS bylo hodnotitelné u 73,7 % pacientů ve studii VIVID-DME a u 98,3 % pacientů ve studii VISTA-DME. V 52. týdnu došlo ke zlepšení o > 2 kroky v DRSS u 27,7 % a 29,1 % pacientů ve skupinách léčených přípravkem Eylea 2Q8 a 7,5 % a 14,3 % v kontrolních skupinách. V
týdnu 100 byla příslušná procenta 32,6 % a 37,1 % ve skupinách léčených přípravkem Eylea 2Q8 a
8,2 % a 15,6 % v kontrolních skupinách.
Myopická chorioideální neovaskularizace
Myopická chorioideální neovaskularizace (myopická CNV) je častá přičina ztráty zraku u dospělých s patologickou myopií. Vyvíjí se v důsledku hojení rány, které následuje po rupturách Bruchovy membrány a představuje nejnebezpečnější zrak ohrožující příhodu u patologické myopie.
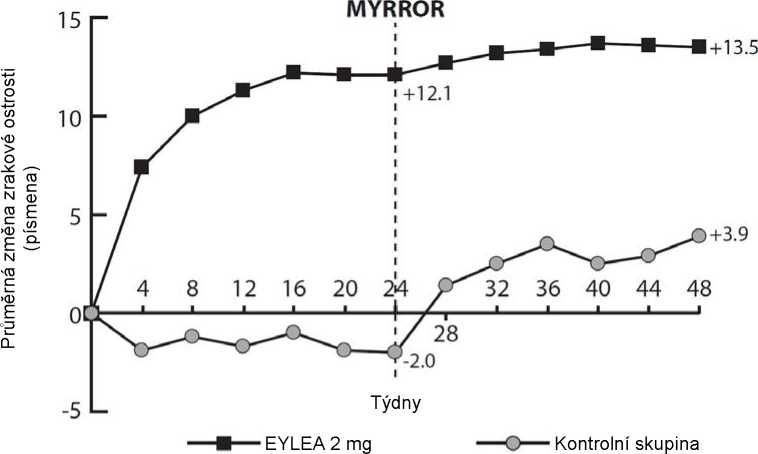
U pacientů léčených přípravkem Eylea ve studii MYRROR (jedna injekce podávaná na začátku léčby s dalšími injekcemi podávanými v případě přetrvávání nebo recidivy onemocnění) se CRT snížila brzy po zahájení léčby ve prospěch přípravku Eylea v týdnu 24 (-79 mikronů a -4 mikronů u skupiny léčené přípravkem Eylea 2 mg a kontrolní skupinou, v uvedeném pořadí), které bylo udrženo do týdne 48. Navíc poklesla průměrná velikost CNV léze.
Klinická účinnost a bezpečnost
Vlhká forma VPMD
Bezpečnost a účinnost přípravku Eylea byly hodnoceny ve dvou randomizovaných, multicentrických, dvojitě zaslepených studiích s aktivní kontrolou u pacientů s vlhkou formou VPMD (VIEW1 a VIEW2) s celkem 2412 pacienty léčenými a hodnotitelnými pro účinnost. Věk pacientů se pohyboval od 49 do 99 let s průměrným věkem 76 let. V těchto klinických hodnoceních bylo přibližně 89 % (1 616/1 817) pacientů randomizovaných k léčbě přípravkem Eylea ve věku 65 let nebo starších a přibližně 63 % (1 139/1 817) ve věku 75 let nebo starších. V každé studii byli pacienti náhodně přiřazeni v poměru 1:1:1:1 do 1 ze 4 dávkovacích režimů:
1) Přípravek Eylea 2 mg podávaný každých 8 týdnů po 3 úvodních měsíčních dávkách (Eylea 2Q8);
2) Přípravek Eylea 2 mg podávaný každé 4 týdny (Eylea 2Q4);
3) Přípravek Eylea 0,5 mg podávaný každé 4 týdny (Eylea 0,5Q4); a
4) ranibizumab 0,5 mg podávaný každé 4 týdny (ranibizumab 0,5Q4).
Ve druhém roce studií pokračovali pacienti v léčbě na dávce, do které byli původně randomizováni, ale s upraveným plánem dávkování na základě výsledků vyšetření zraku a anatomických poměrů při protokolem definovaném maximálním intervalu dávkování 12 týdnů.
V obou studiích byl primární cílový ukazatel účinnosti podíl pacientů v souboru podle protokolu, u kterých byl udržen zrak, to znamená ztráta méně než 15 písmen zrakové ostrosti v týdnu 52 oproti výchozímu stavu.
Ve studii VIEW1 byl zrak udržen v týdnu 52 u 95,1 % pacientů ve skupině přípravku Eylea 2Q8 ve srovnání s 94,4 % pacientů ve skupině ranibizumabu 0,5Q4.
Ve studii VIEW2 byl zrak udržen v týdnu 52 u 95,6 % pacientů ve skupině přípravku Eylea 2Q8 ve srovnání s 94,4 % pacientů ve skupině ranibizumabu 0,5Q4. V obou studiích přípravek Eylea prokázal, že není horší (non-inferior) a že je klinicky ekvivalentní skupině léčené ranibizumabem 0,5Q4.
Podrobné výsledky kombinované analýzy obou studií jsou uvedeny v tabulce 3 a na obrázku 1 níže.
|
Výsledek účinnosti |
Eylea 2Q8 E) (Eylea 2 mg každých 8 týdnů po 3 úvodních měsíčních dávkách) |
Ranibizumab 0,5Q4 (ranibizumab 0,5 mg každé 4 týdny) | ||
|
(N = |
607) |
(N = |
595) | |
|
týden 52 |
týden 96 |
týden 52 |
týden 96 | |
|
Průměrný počet injekcí od výchozího stavu. |
7,6 |
11,2 |
12,3 |
16,5 |
|
Průměrný počet injekcí od týdne 52 do 96. |
4,2 |
4,7 | ||
|
Podíl pacientů se ztrátou < 15 písmen oproti výchozímu stavu (PPS4). |
95,33 %5 |
92,42 % |
94,42 % 5 |
91,60 % |
|
Rozdíl6 |
0,9 % (-1,7; 3,5)F |
0,8 % (-2,3; 3,8)F | ||
|
Průměrná změna BCVA podle měření pomocí ETDRS4 skóre písmen od výchozího stavu. |
8,40 |
7,62 |
8,74 |
7,89 |
|
-0,32 (-1,87; 1,23) |
-0,25 (-1,98; 1,49) | |||
|
Podíl pacientů se ziskem > 15 písmen oproti výchozímu stavu. |
30,97 % |
33,44 % |
32,44 % |
31,60 % |
|
Rozdíl6 (95 % CI)7. |
-1,5 % (-6,8; 3,8) |
1,8 % (-3,5; 7,1) | ||
Obrázek 1. Průměrná změna zrakové ostrosti od výchozího stavu do týdne 96 pro kombinovaná data ze studií View1 a View2
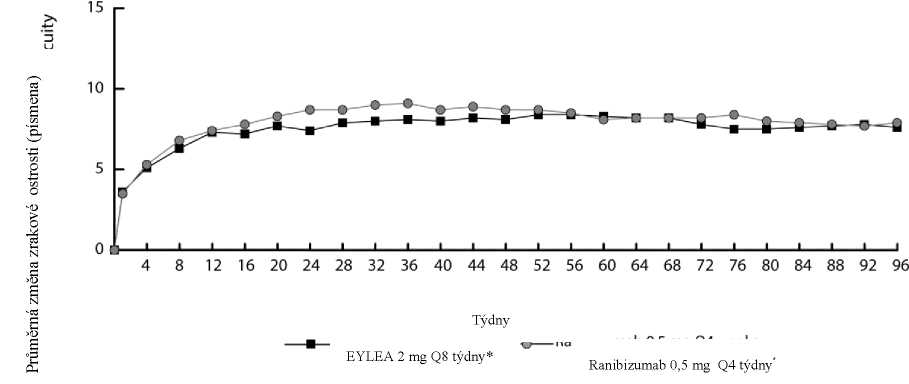
V kombinované analýze dat ze studií VIEW1 a VIEW2 prokázal přípravek Eylea klinicky významné změny oproti výchozímu stavu v předem specifikovaném sekundárním cílovém ukazateli účinnosti dotazníku Národního očního institutu pro oční funkci (National Eye Institute Visual Function Questionnaire, NEI VFQ-25) bez klinicky významných rozdílů oproti ranibizumabu. Velikost těchto změn byla podobná jako v publikovaných studiích, což odpovídalo zisku 15 písmen při nejlépe korigované ostrosti zraku (Best Corrected Visual Acuity, BCVA).
V druhém roce studií byla účinnost obecně udržena do posledního hodnocení v týdnu 96, u 2-4 % pacientů bylo třeba podávat všechny injekce po měsíci a třetině pacientů bylo třeba podat minimálně jednu injekci v jednoměsíčním léčebném intervalu.
Snížení průměrné plochy CNV bylo patrné ve všech skupinách v obou studiích.
Výsledky účinnosti u všech hodnocených podskupin (např. věk, pohlaví, rasa, výchozí zraková ostrost, typ léze, velikost léze) v každé studii a v kombinované analýze odpovídaly výsledkům u celkové populace.
Makulární edém v důsledku CRVO
Bezpečnost a účinnost přípravku Eylea byly hodnoceny ve dvou randomizovaných, multicentrických, dvojitě zaslepených studiích kontrolovaných předstíranou („sham“) procedurou u pacientů s makulárním edémem v důsledku CRVO (cOpERNICUS a GALILEO) s celkem 358 pacienty léčenými a hodnotitelnými pro účinnost (217 na přípravku Eylea). Věk pacientů se pohyboval od 22 do 89 let s průměrným věkem 64 let. V těchto CRVO studiích bylo přibližně 52 % (112/217) pacientů přiřazených k léčbě přípravkem Eylea ve věku 65 let nebo starších a přibližně 18 % (38/217) ve věku 75 let nebo starších. V obou studiích byli pacienti náhodně přiřazeni v poměru 3:2 buď do léčby přípravkem Eylea 2 mg podávaného každé 4 týdny (2Q4) nebo do kontrolní skupiny, která dostávala předstírané („sham“) injekce každé 4 týdny s celkovým počtem 6 injekcí.
Po 6 po sobě následujících měsíčních injekcích dostali pacienti léčbu pouze, pokud splnili předem specifikovaná léčebná kritéria, kromě pacientů v kontrolní skupině ve studii GALILEO, kteří dále dostávali předstírané injekce (kontrola kontroly) do týdne 52. Od tohoto časového bodu byli všichni pacienti léčeni, pokud byla splněna předem specifikovaná kritéria.
V obou studiích byl primární cílový ukazatel účinnosti podíl pacientů, kteří získali minimálně 15 písmen na BCVA v týdnu 24 ve srovnání s výchozím stavem. Sekundární cílový ukazatel účinnosti byl změna zrakové ostrosti v týdnu 24 ve srovnání s výchozím stavem.
Rozdíl mezi léčebnými skupinami byl statisticky významný ve prospěch přípravku Eylea v obou studiích. Maximálního zlepšení zrakové ostrosti bylo dosaženo v měsíci 3 s následnou stabilizací zrakové ostrosti a CRT až 6 měsíců. Statisticky významný rozdíl byl udržen až do týdne 52.
Podrobné výsledky z analýzy obou studií jsou uvedeny v tabulce 4 a na obrázku 2 níže.
|
Parametry účinnosti |
COPERNICUS |
GALILEO | ||||||||||
|
24 týdnů |
52 týdnů |
100 týdnů |
24 týdnů |
52 týdnů |
76 týdnů | |||||||
|
Eylea |
Kontrola |
Eylea |
Kontrola E) |
Eylea F) |
Kontrola E,F) |
Eylea |
Kontrola |
Eylea |
Kontrola |
Eylea G) |
Kontrola G) | |
|
2 mg Q4 (N = 114) |
(N = 73) |
2 mg (N = 114) |
(N = 73) |
2 mg (N = 114) |
(N = 73) |
2 mg Q4 (N = 103) |
(N = 68) |
2 mg (N = 103) |
(N = 68) |
2 mg (N = 103) |
(N = 68) | |
|
Podíl pacientů se ziskem > 15 písmen od výchozího stavu |
56 % |
12 % |
55 % |
30 % |
49,1 % |
23,3 % |
60 % |
22 % |
60 % |
32 % |
57,3 % |
29,4 % |
|
44,8 % (33,0, 56,6) |
25,9 % (11,8, 40,1) |
26,7 % (13,1,40,3) |
38,3 % (24,4, 52,1) |
27,9 % (13,0, 42,7) |
28,0 % (13,3, 42,6) | |||||||
|
p-hodnota |
p < 0,0001 |
p = 0,0006 |
p = 0,0003 |
p < 0,0001 |
p = 0,0004 |
p = 0,0004 | ||||||
|
Průměrná změna v BCVA12 měřená podle ETDRS12 skóre písmen od výchozího stavu (SD) |
17,3 (12,8) |
-4,0 (18,0) |
16,2 (17,4) |
3,8 (17,1) |
13,0 (17,7) |
1,5 (17,7) |
18,0 (12,2) |
3,3 (14,1) |
16,9 (14,8) |
3,8 (18,1) |
13,7 (17,8) |
6,2 (17,7) |
|
21,7 (17,4, 26,0) |
12,7 (7,7, 17,7) |
11,8 (6,7, 17,0) |
14,7 (10,8, 18,7) |
13,2 (8,2, 18,2) |
7,6 (2,1, 13,1) | |||||||
|
p-hodnota |
p < 0,0001 |
p < ,0001 |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
p = ,0070 | ||||||
G) Ve studii GALILEO dostávali jak pacienti v kontrolní skupině tak pacienti ve skupině přípravku Eylea 2 mg přípravek Eylea 2 mg podle potřeby každých 8 týdnů od týdne 52 do týdne 68; pacienti měli povinné návštěvy každých 8 týdnů.
Obrázek 2: Průměrná změna od výchozího stavu do týdne 76/100 u zrakové ostrosti podle léčebné skupiny ve studiích COPERNICUS a GALILEO (soubor pro plnou analýzu)
COPERNICUS
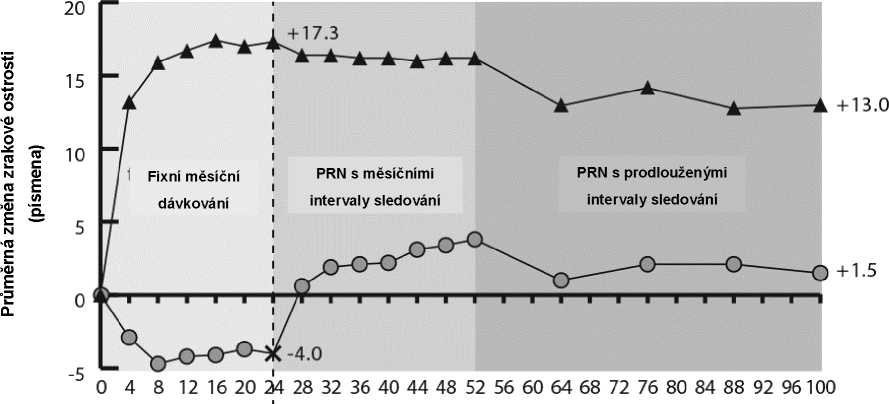
Týdny
GALILEO
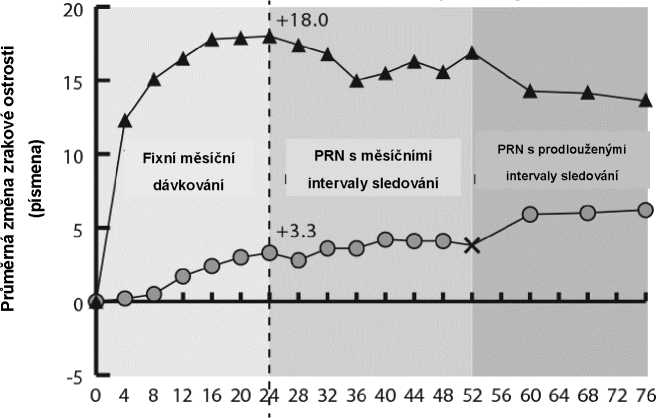
Týdny
-*- EYLEA 2 mg
O- Kontrolní skupina
^ Ukazuje převedení kontrolní skupiny na PRN léčbu přípravkem EYLEA 2 mg
Ve studii GALILEO mělo 86,4 % (n = 89) pacientů ve skupině přípravku Eylea a 79,4 % (n = 54) pacientů v rameni s předstíranou („sham“) léčbou při vstupu do studie CRVO s perfuzí. V týdnu 24 to bylo 91,8 % (n = 89) ve skupině přípravku Eylea a 85,5 % (n = 47) v rameni s předstíranou („sham“) léčbou. Tyto podíly byly udrženy v týdnu 76 s 84,3 % (n = 75) ve skupině s přípravkem Eylea a 84,0 % (n = 42) v rameni s předstíranou („sham“) léčbou.
Ve studii COPERNICUS mělo 67,5 % (n = 77) pacientů ve skupině přípravku Eylea a 68,5 % (n = 50) pacientů v rameni s předstíranou („sham“) léčbou při vstupu do studie CRVO s perfuzí. V týdnu 24 to bylo 87,4 % (n = 90) ve skupině přípravku Eylea a 58,6 % (n = 34) v rameni s předstíranou („sham“) léčbou. Tyto podíly byly udrženy v týdnu 100 s 76,8 % (n = 76) ve skupině s přípravkem Eylea a 78 % (n = 39) v rameni s předstíranou („sham“) léčbou. Pacienti v „sham“ rameni měli od týdne 24 nárok na léčbu přípravkem Eylea.
Příznivý účinek léčby přípravkem Eylea na zrakovou funkci byl u základních podskupin pacientů s perfuzí a bez perfuze obdobný. Léčebné účinky v ostatních hodnotitelných podskupinách (např. věk, pohlaví, rasa, výchozí zraková ostrost, doba trvání CRVO) v každé studii odpovídaly obecně výsledkům u celkové populace.
V kombinované analýze dat ze studií GALILEO a COPERNICUS prokázal přípravek Eylea klinicky významné změny oproti výchozímu stavu v předem specifikovaném sekundárním cílovém ukazateli účinnosti dotazníku Národního očního institutu pro oční funkci (National Eye Institute Visual Function Questionnaire, NEI VFQ-25). Velikost těchto změn byla podobná jako v publikovaných studiích, což odpovídalo zisku 15 písmen při nejlépe korigované ostrosti zraku (Best Corrected Visual Acuity, BCVA).
Makulární edém v důsledku BRVO
Bezpečnost a účinnost přípravku Eylea byla hodnocena v randomizované, multicentrické, dvojitě zaslepené, aktivně kontrolované studii u pacientů s makulárním edémem v důsledku BRVO (VIBRANT), který zahrnoval hemiretinální žilní okluzi (hemi-retinal vein occlusion). Celkem bylo léčeno a hodnoceno z hlediska účinnosti 181 pacientů (91 léčeno přípravkem Eylea). Věk pacientů se pohyboval od 42 do 94 let s průměrným věkem 65 let. Ve studii BRVO bylo přibližně 58 % (53/91) pacientů randomizovaných k léčbě přípravkem Eylea ve věku 65 let nebo starších a přibližně 23 % (21/91) ve věku 75 let nebo starších. V této studii byli pacienti náhodně přiřazeni v poměru 1:1 buď k léčbě přípravkem Eylea 2 mg aplikovaným každých 8 týdnů po 6 úvodních injekcích aplikovaných jednou měsíčně nebo k léčbě fotokoagulací laserem aplikované na počátku léčby (kontrolní skupina léčená laserem). Pacienti v kontrolní skupině léčené laserem mohli být na počátku týdne 12 dodatečně léčeni fotokoagulací laserem (tzv. „rescue laser treatment“) s minimálním intervalem 12 týdnů. Na základě předem specifikovaných kritérií mohli pacienti ve skupině léčené laserem od týdne 24 obdržet záchrannou léčbu přípravkem Eylea 2 mg, podávanou každé 4 týdny po 3 měsíce následovanou každých 8 týdnů.
Ve studii VIBRANT byl primárním cílovým parametrem poměr pacientů, kteří dosáhli hodnotu alespoň 15 písmen v BCVA v týdnu 24 ve srovnání se stavem na počátku léčby a skupina léčená přípravkem Eylea byla nadřazená kontrolní skupině léčené laserem.
Sekundární cílový parametr účinnosti ve studii VIBRANT byla změna zrakové ostrosti v týdnu 24 ve srovnání se stavem na počátku léčby, která byla statisticky významná ve prospěch přípravku Eylea. Průběh zlepšení zraku byl rychlý a maxima bylo dosaženo ve 3 měsících s udržením účinku až 12 měsíců.
67 pacientů ve skupině léčené laserem dostávalo záchrannou léčbu přípravkem Eylea na počátku týdne 24 (aktivní kontrola/ Eylea 2 mg), která vedla od týdne 24 do týdne 52 ke zlepšení zrakové ostrosti asi o 5 písmen.
Podrobné výsledky z analýzy studie VIBRANT jsou v tabulce 4 a na obrázku 3 níže.
Tabulka 4: Parametry účinnosti v týdnu 24 a v týdnu 52 (soubor pro plnou analýzu LOCF) ve studii VIBRANT
|
Parametry účinnosti |
VIBRANT | |||
|
24 týdnů |
52 týdnů | |||
|
Eylea 2mg Q4 (N = 91) |
Aktivní kontrola (laser) (N = 90) |
Eylea 2mg Q8 |
Aktivní kontrola (laser)/Eylea 2mg19 (N = 90) | |
|
Podíl pacientů se ziskem >15 písmen oproti výchozímu stavu (%) |
52,7 % |
26,7 % |
57,1 % |
41,1 % |
|
Vážený rozdíl A>B (%) (95% CI) p-hodnota |
26,6 % (13,0, 40,1) p=0,0003 |
16,2 % (2,0, 30,5) p=0,0296 | ||
|
Průměrná změna BCVA podle měření pomocí ETDRS skóre písmen od výchozího stavu (SD) |
17,0 (11,9) |
6,9 (12,9) |
17,1 (13,1) |
12,2 (11,9) |
|
Rozdíl v průměru LS A,C (95% CI) p-hodnota |
10,5 (7,1, 14,0) p<0,0001 |
5,2 (1,7, 8,7) p=0,003520 | ||
A) Rozdíl u přípravku Eylea 2 mg Q4 týdny minus kontrola laserem
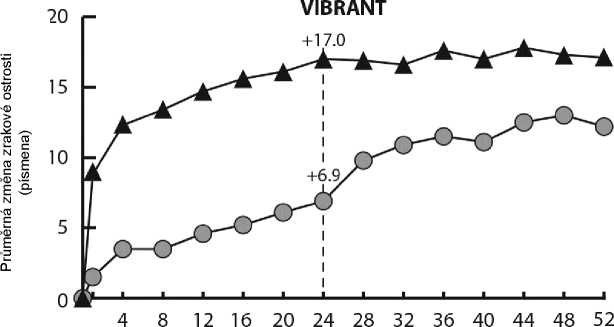
Týdny
-A:- Eylea 2 mg -Q- Kontrolní skupina (laser)
Na počátku léčby byl poměr pacientů s perfuzí ve skupině s přípravkem Eylea 60 % a ve skupině léčené laserem 68 %. V týdnu 24 byl tento poměr 80 % a 67 %. Ve skupině s přípravkem Eylea byl poměr pacientů s perfuzí udržován do týdne 52. Ve skupině léčené laserem, kde byli pacienti vhodní pro záchrannou léčbu přípravkem Eylea od týdne 24, se do týdne 52 zvýšil poměr pacientů s perfuzí na 78 %.
Diabetický makulární edém
Bezpečnost a účinnost přípravku Eylea byla hodnocena ve dvou randomizovaných, multicentrických, dvojitě zaslepených studiích s aktivní kontrolou u pacientů s DME (VIVIDDME a VISTADME). Celkem 862 pacientů bylo léčených a hodnotitelných pro účinnost, 576 přípravkem Eylea. Věk pacientů se pohyboval od 23 do 87 let s průměrným věkem 63 let. V DME studiích bylo přibližně 47 % (268/576) pacientů přiřazených k léčbě přípravkem Eylea ve věku 65 let nebo starších a přibližně 9 % (52/576) ve věku 75 let nebo starších. V obou studiích byli pacienti náhodně zařazeni v poměru 1:1:1 do 1 ze 3 režimů dávkování:
1) přípravek Eylea podávaný v dávce 2 mg každých 8 týdnů po 5 úvodních měsíčních injekcích (Eylea 2Q8),
2) přípravek Eylea podávaný v dávce 2 mg každé 4 týdny (Eylea 2Q4) a
3) makulární laserová fotokoagulace (aktivní kontrola).
Od 24. týdne byli pacienti, kteří splnili předem specifikovaný práh zrakové ztráty, zařaditelní do dodatečné léčby: pacienti ve skupinách léčených přípravkem Eylea mohli dostat laserovou léčbu a pacienti v kontrolní skupině mohli dostat přípravek Eylea.
V obou studiích byla primárním cílovým ukazatelem účinnosti průměrná změna od výchozího stavu v BCVA v týdnu 52, obě skupiny přípravku Eylea 2Q8 a Eylea 2Q4 prokázaly statistickou významnost a byly nadřazené kontrolní skupině. Tento přínos byl udržen do týdne 100.
Podrobné výsledky z analýzy studií VIVIDDME a VISTADME jsou uvedeny v tabulce 5 a na obrázku 4 níže.
Tabulka 5: Parametry účinnosti v týdnu 52 a v týdnu 100 (soubor pro plnou analýzu s LOCF^ ve studiích VIVIDDME a VISTADME
|
Parametry účinosti |
VIVIDDME |
VISTADME | ||||||||||
|
52 týdnů |
100 týdnů |
52 týdnů |
100 týdnů | |||||||||
|
Eylea |
Eylea |
Aktivní |
Eylea |
Eylea |
Aktivní |
Eylea |
Eylea |
Aktivní |
Eylea |
Eylea |
Aktivní | |
|
kontrola |
kontrola |
kontrola |
kontrola | |||||||||
|
2 mg Q8 A |
2 mg Q4 |
(laser) |
2 mg Q8 A |
2 mg Q4 |
(laser) |
2 mg Q8 A |
2 mg Q4 |
(laser) |
2 mg Q8 A |
2 mg Q4 |
(laser) | |
|
(N = 135) |
(N = 136) |
(N = 132) |
(N = 135) |
(N = 136) |
(N = 132) |
(N = 151) |
(N = 154) |
(N = 154) |
(N=151) |
(N=154) |
(N=154) | |
|
Průměrná změna v BCVA měřená podle ETDRS E skóre písmen od výchozího stavu |
10,7 |
10,5 |
1,2 |
9,4 |
11,4 |
0,7 |
10,7 |
12,5 |
0,2 |
11,1 |
11,5 |
0,9 |
|
Rozdíl v průměru |
9,1 |
9,3 |
8,2 |
10,7 |
10,45 |
12,19 |
10,1 |
10,6 | ||||
|
LSB"C.E |
(6,4; 11,8) |
(6,5; 12,0) |
(5,2; 11,3) |
(7,6; 13,8) |
(7,7; 13,2) |
(9,4; 15,0) |
(7,0; 13,3) |
(7,1; 14,2) | ||||
|
(97,5% CI) | ||||||||||||
|
Podíl pacientů se ziskem >15 písmen od výchozího stavu |
33 % |
32 % |
9 % |
31,1 % |
38,2 % |
12,1 % |
31 % |
42 % |
8 % |
33,1% |
38,3 % |
13,0 % |
|
Upravený rozdíl D’C’E (97,5% CI) |
24 % (13,5; 34,9) |
23 % (12,6; 33,9) |
19 % (8,0; 29.9) |
26,1 % (14,8; 37,5) |
23 % (13,5; 33,1) |
34 % (24,1; 44,4) |
20,1 % (9,6; 30,6) |
25,8 % (15,1; 36,6) | ||||
A Po zahájení léčby 5 injekcemi aplikovanými v měsíčním intervalu (1 injekce měsíčně)
B Průměr minimálních čtverců a CI na základě modelu ANCOVA s výchozím měřením BCVA jako kovariátou a faktorem pro léčebnou skupinu. Kromě toho byl region (Evropa/Austrálie vs. Japonsko) přidán jako faktor pro studii VIVIDdme a anamnéza infarktu myokardu a/nebo cévní mozkové příhody jako faktor pro studii VISTADME C Rozdíl u přípravku Eylea minus aktivní kontrola (laser)
D Rozdíl s intervalem spolehlivosti (Cl) a statistickým testem je vypočten pomocí Mantel-Haenszel váženého schéma upraveného podle regionu (Evropa/Austrálie vs. Japonsko) pro VIVIDdme a anamnézu IM nebo cévní mozkové příhody pro studii VISTAdme E BCVA: Nejlépe korigovaná zraková ostrost
ETDRS: Studie Early Treatment Diabetic Retinopathy LOCF: Poslední získané údaje
LS: Průměry minimálních čtverců odvozených z modelu ANCOVA Cl: Interval spolehlivosti
Týdny
EYLEA 2mg Q8 týdny
EYLEA 2mg Q4 týdny Aktivní kontrola (laser)
Léčebné účinky u hodnotitelných podskupin (např. věk, pohlaví, rasa, výchozí HbA1c, výchozí zraková ostrost, předchozí anti-VEGF léčba) v každé studii a v kombinované analýze obecně odpovídaly výsledkům u celkové populace.
Ve studiích VIVIDDME a VISTADME dostávalo 36 (9 %) a 197 (43 %) pacientů předchozí anti-VEGF léčbu, v uvedeném pořadí, s 3měsíční nebo delší dobou bez léčby. Léčebné účinky v podskupině pacientů, kteří měli předchozí léčbu VEGF inhibitorem, byly podobné jako u pacientů, kteří léčbu VEGF inhibitorem neměli.
Pacienti s bilaterálním onemocněním byli zařaditelní do léčby pomocí anti-VEGF na jejich druhém oku, pokud bylo posouzeno lékařem, že je to nutné. Ve studii VISTADME dostalo 217 (70,7 %) pacientů léčených přípravkem Eylea bilaterální injekce přípravku Eylea do týdne 100; ve studii VIVIDDME dostalo 97 (35,8 %) pacientů léčených přípravkem Eylea různou anti-VEGF léčbu jejich druhého oka.
Nezávislá srovnávací studie (DRCR.net Protocol T) použila dávkovací režim na základě striktních kritérií při měření OCT a zraku. Ve skupině léčené afliberceptem (n = 224) v týdnu 52 bylo v tomto dávkovacím režimu pacientům podáno průměrně 9,2 injekcí, což bylo podobné podané množství dávek jako ve skupině Eylea 2Q8 ve studiích VIVIDDME a VISTADME, zatímco celková účinnost ve skupině léčené afliberceptem ve studii Protocol T byla srovnatelná se skupinou Eylea 2Q8 ve studiích
VIVIDDME and VISTADME. Ve studii Protocol T byl pozorován průměrný zisk 13,3 písmen, přičemž 42 % pacientů získalo nejméně 15 písmen ve srovnání s výchozím stavem. Bezpečnostní profily, jak oční tak systémové (včetně ATEs), byly podobné těm ve studiích VIVIDDME and VISTADME.
Myopická chorioideální neovaskularizace
Bezpečnost a účinnost přípravku Eylea byla hodnocena v randomizované, multicentrické, dvojitě zaslepené studii kontrolované „sham“ ramenem u dosud neléčených asijských pacientů s myopickou CNV. Celkem 121 pacientů bylo léčených a hodnotitelných pro účinnost (90 přípravkem Eylea). Věk pacientů se pohyboval od 27 do 83 let s průměrným věkem 58 let. V myopické CNV studii bylo přibližně 36 % (33/91) pacientů přiřazených k léčbě přípravkem Eylea ve věku 65 let nebo starších a přibližně 10 % (9/91) ve věku 75 let nebo starších. Pacienti byli náhodně přiřazeni v poměru 3:1 do léčby buď 2 mg přípravku Eylea intravitreálně nebo do léčby předstíranými („sham“) injekcemi podávanými jednou na začátku studie s dalšími injekcemi podávanými měsíčně v případě přetrvávání nebo recidivy onemocnění do týdne 24, kdy byl hodnocen primární cílový ukazatel. V týdnu 24 byli pacienti, kteří byli v úvodu randomizováni do předstírané („sham“) léčby, zařaditelní pro podání první dávky přípravku Eylea. Poté byli pacienti v obou skupinách dále zařaditelní do podání dalších injekcí v případě přetrvávání nebo recidivy onemocnění.
Rozdíl mezi léčebnými skupinami byl statisticky významný ve prospěch přípravku Eylea pro primární cílový ukazatel (změna BCVA) a konfirmační sekundární cílový ukazatel účinnosti (podíl pacientů, kteří získali 15 písmen v BCVA) v týdnu 24 v porovnání s výchozím stavem. Rozdíly v obou cílových ukazatelech byly udrženy do týdne 48.
Podrobné výsledky z analýzy studie MYRROR jsou uvedeny v tabulce 6 a na obrázku 5 níže.
Tabulka 6: Výsledky účinnosti v týdnu 24 (primární analýza) a týdnu 48 ve studii MYRROR (soubor pro plnou analýzu s LOCFA))
|
Výsledky účinnosti |
MYRROR | |||
|
24 týdnů |
48 týdnů | |||
|
Eylea 2 mg (N = 90) |
Sham (N = 31) |
Eylea 2 mg (N = 90) |
Sham/ Eylea 2 mg (N = 31) | |
|
Průměrná změna v BCVA21 22 23 měřená podle ETDRS skóre písmen od výchozího stavu (SD) 21 |
12,1 (8,3) |
-2,0 (9,7) |
13,5 (8,8) |
3,9 (14,3) |
|
14,1 (10,8; 17,4) |
9,5 (5,4; 13,7) | |||
|
Podíl pacientů se ziskem >15 písmen od výchozího stavu |
38,9 % |
9,7 % |
50,0 % |
29,0 % |
|
Vážený rozdílD,F) (95 % CI) |
29,2 % (14,4; 44,0) |
21,0 % (1,9; 40,1) | ||
A) LOCF: Poslední získané údaje
Průměrný změna zrakové ostrosti od výchozího stavu do týdne 48 podle léčebné skupiny pro studii MYRROR (soubor pro plnou analýzu, LOCF)
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem Eylea u všech podskupin pediatrické populace u vlhké formy VPMD, CRVO, BRVO, DME a myopické CNV (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Přípravek Eylea se podává přímo do sklivce pro dosažení lokálního účinku v oku.
Absorpce/Distribuce
Aflibercept je po podání do sklivce pomalu absorbován z oka do krevního oběhu a je převážně pozorován v systémovém oběhu jako neaktivní stabilní komplex s VEGF; avšak pouze „volný aflibercept“ je schopen vázat endogenní VEGF.
Ve farmakokinetické podstudii u 6 pacientů s neovaskulární vlhkou formou VPMD s častým odběrem vzorků byly maximální plasmatické koncentrace volného afliberceptu (systémová Cmax) nízké, s průměrnou hodnotou přibližně 0,02 mikrogramů/ml (rozmezí 0 - 0,054) během 1 až 3 dnů po injekci dávky 2 mg do sklivce, a byly nedetekovatelné dva týdny po dávce téměř u všech pacientů. Při podání do sklivce každé 4 týdny se Aflibercept neakumuluje v plasmě.
Průměrná maximální plazmatická koncentrace volného afliberceptu je přibližně 50 až 500krát nižší než koncentrace afliberceptu nutná pro inhibici biologické aktivity systémového VEGF o 50 % u zvířecích modelů, u kterých byly pozorovány změny krevního tlaku, kdy hladiny cirkulujícího volného afliberceptu dosáhly přibližně 10 mikrogramů/ml a vrátily se k výchozím hodnotám, když hladina poklesla pod přibližně 1 mikrogram/ml. Odhaduje se, že po podání dávky 2 mg do sklivce je maximální plazmatická koncentrace volného afliberceptu u pacientů více než 100krát nižší než koncentrace afliberceptu nutná pro polovinu maximální vazby na systémový VEGF (2,91 mikrogramů/ml) ve studii u zdravých dobrovolníků. Systémové farmakodynamické účinky, jako jsou změny krevního tlaku, jsou proto nepravděpodobné.
Ve farmakokinetických podstudiích u pacientů s CRVO, BRVO, DME nebo myopickou CNV byly průměrné Cmax volného afliberceptu v plasmě podobné hodnotám v rozmezí 0,03 až 0,05 mikrogramů/ml a individuálním hodnotám nepřesahujícím 0,14 mikrogramů/ml. Poté plazmové koncentrace volného afliberceptu všeobecně klesly v jednom týdnu pod úroveň nebo blízko hodnotě dolního limitu kvantifikace; nedetekovatelné koncentrace byly dosaženy před dalším podáním po 4 týdnech u všech pacientů.
Eliminace
Protože Eylea je léčivý přípravek na bázi proteinu, nebyly provedeny žádné studie hodnotící metabolismus.
Volný aflibercept se váže na VEGF za tvorby stabilního a inertního komplexu. Jako u jiných velkých proteinů se očekává, že jak volný tak vázaný aflibercept budou eliminovány proteolytickým katabolismem.
Porucha funkce ledvin
S přípravkem Eylea nebyly provedeny žádné specifické studie u pacientů s poškozením funkce ledvin.
Farmakokinetická analýza pacientů ve studii VIEW2, z nichž 40 % mělo poruchu funkce ledvin (24 % mírná, 15 % středně závažná a 1 % závažná), neodhalila po podání do sklivce každých 4 nebo 8 týdnů žádné rozdíly s ohledem na plazmatické koncentrace aktivního léku.
Podobné výsledky byly pozorovány u pacientů s CRVO ve studii GALILEO, u pacientů s DME ve studii VIVIDDME a u pacientů s myopickou CNV ve studii MYRROR.
5.3 Předklinické údaje vztahující se k bezpečnosti
Účinky v neklinických studiích toxicity po opakovaném podávání byly pozorovány pouze při systémových expozicích významně přesahujících maximální expozici u člověka po podání zamýšlené klinické dávky do sklivce, což svědčí pro malý význam pro klinické použití.
Při systémové expozici přesahující maximální expozici u člověka byly pozorovány eroze a ulcerace respiračního epitelu nosních průduchů u opic léčených afliberceptem aplikovaným do sklivce. Systémová expozice založená na Cmax a AUC pro volný aflibercept byla asi 200krát, respektive 700krát vyšší při srovnání s odpovídajícími hodnotami pozorovanými u člověka po podání dávky 2 mg do sklivce. Při dávce 0,5 mg/oko u opic, při které ještě nebylo možné pozorovat nežádoucí účinek látky (No Observed Adverse Effect Level (NOAEL)), byla systémová expozice 42krát vyšší na základě Cmax a 56krát vyšší na základě AUC.
Nebyly provedeny žádné studie hodnotící mutagenní nebo karcinogenní potenciál afliberceptu.
Účinek afliberceptu na nitroděložní vývoj byl prokázán ve studiích embryo-fetálního vývoje u březích samic králíků při nitrožilním podání (3 až 60 mg/kg) a rovněž při subkutánním podání (0,1 až 1 mg/kg). NOAEL pro matku byla 3 mg/kg nebo 1 mg/kg, v uvedeném pořadí. Vývojová NOAEL nebyla identifikována. Při dávce 0,1 mg/kg byly systémové expozice založené na Cmax a kumulativní AUC pro volný aflibercept přibližně 17krát, respektive 10krát vyšší ve srovnání s odpovídajícími hodnotami pozorovanými u člověka po podání dávky 2 mg do sklivce.
Účinky na mužskou a ženskou fertilitu byly hodnoceny v rámci 6měsíční studie u opic při nitrožilním podání afliberceptu v dávkách od 3 do 30 mg/kg. Chybějící nebo nepravidelná menstruace spojená se změnami hladin ženských pohlavních hormonů a změny morfologie a motility spermií byly pozorovány při všech úrovních dávek. Na základě Cmax a AUC pro volný aflibercept pozorovanými při aplikaci nitrožilní dávky 3 mg/kg byly systémové expozice asi 4900krát, respektive 1500krát vyšší než expozice pozorované u člověka po dávce 2 mg aplikované do sklivce. Všechny změny byly reverzibilní.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Polysorbát 20
Monohydrát dihydrogenfosforečnanu sodného (na úpravu pH)
Heptahydrát hydrogenfosforečnanu sodného ( úpravu pH)
Chlorid sodný Sacharóza Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku v blistru a krabičce, aby byl přípravek chráněn před světlem.
Před použitím může být neotevřený blistr přípravku Eylea uchováván při pokojové teplotě (do 25 °C) po dobu až 24 hodin. Po otevření blistru pokračujte při aseptických podmínkách.
6.5 Druh obalu a obsah balení
90 mikrolitrů roztoku v předplněné injekční stříkačce (sklo typu I) označené černou dávkovací linkou, s pístovou zátkou (elastomerní pryž) a Luer lock adaptérem s víčkem jehly (elastomerní pryž). Velikost balení 1.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Předplněná injekční stříkačka je pouze na jedno použití.
Neotvírejte sterilní předplněný blistr mimo čistou místnost určenou k aplikaci.
Vzhledem k tomu, že předplněná injekční stříkačka obsahuje větší objem (90 mikrolitrů), než je doporučená dávka (50 mikrolitrů), je třeba část obsahu stříkačky před podáním zlikvidovat.
Před podáním je třeba roztok vizuálně zkontrolovat, zda nejsou přítomny jakékoli cizorodé částice a/nebo zabarvení, případně změněn fyzikální vzhled. Pozorujete-li takové změny, léčivý přípravek zlikvidujte.
Pro injekci do sklivce by měla být použita jehla 30 G x ‘A palce.
1. Až budete připraveni aplikovat přípravek Eylea, otevřete krabičku a vyjměte sterilní blistr. Opatrně otevřete blistr při zajištění sterility jeho obsahu. Nechte stříkačku ve sterilním zásobníku, dokud nejste připraveni k sestavení.
2. Pomocí aseptické techniky vyjměte stříkačku ze sterilního blistru.
3. K sejmutí víčka stříkačky držte stříkačku jednou rukou a druhou ruku použijte pro uchopení víčka stříkačky pomocí palce a ukazováku. Pamatujte si, prosím: Ulomte (neotáčejte nebo nevykrucujte) víčko stříkačky.
4. Pro zabránění ohrožení sterility přípravku nezatahujte zpět píst.
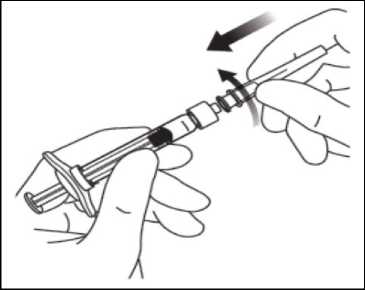
5. Pomocí aseptické techniky pevně nasaďte otočením injekční jehlu na Luer-lock hrot stříkačky.
6. Držte stříkačku s jehlou směřující nahoru a
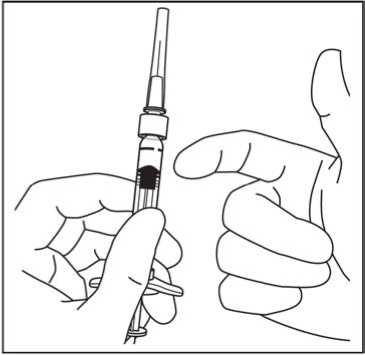
zkontrolujte, zda v ní nejsou bubliny. Pokud jsou tam bubliny, jemně poklepejte na stříkačku prstem, až se bubliny dostanou do horní části.
7. Pro odstranění všech bublin a vytlačení přebytečného léčivého přípravku pomalu stlačte píst tak, aby byla cylindrická báze kupolovité zátky zarovnána s černou dávkovací čárkou na stříkačce (ekvivalent 50 mikrolitrů).
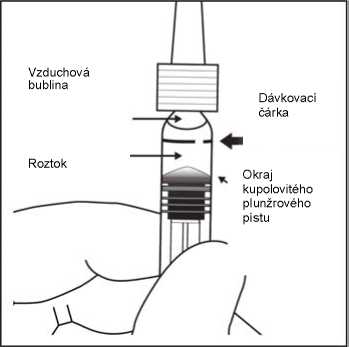
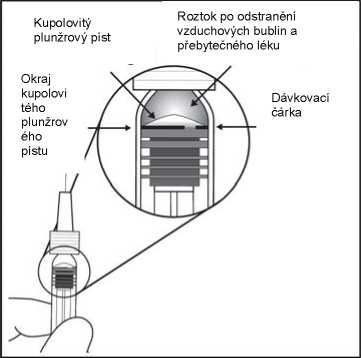
8. Předplněná stříkačka j e pouze na jedno použití.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Bayer Pharma AG D-13342 Berlin Německo
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/12/797/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 22. listopadu 2012
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Eylea 40 mg/ml injekční roztok v injekční lahvičce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 mililitr injekčního roztoku obsahuje afliberceptum* 40 mg.
Jedna injekční lahvička obsahuje 100 mikrolitrů, to odpovídá 4 mg afliberceptu. To poskytuje využitelné množství pro dodání jedné dávky 50 mikrolitrů obsahujících 2 mg afliberceptu.
*Fuzní protein skládající se z fragmentů extracelulárních domén humánního VEGF (vaskulární endoteliální růstový faktor) receptoru 1 a 2 fúzovaných na Fc fragment humánního IgG1 je vyráběn rekombinantní DNA technologií v buňkách K1 ovarií křečíka čínského.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok (injekce)
Roztok je čirý, bezbarvý až světle žlutý a isoosmotický.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Eylea je indikován u dospělých k léčbě neovaskulární
• neovaskulární (vlhké) formy věkem podmíněné makulární degenerace (VPMD) (viz bod 5.1),
• poruch zraku způsobené makulárním edémem v důsledku okluze retinální žíly (RVO) (větve retinální žíly (BRVO) nebo centrální retinální žíly (CRVO)) (viz bod 5.1),
• poruchy zraku v důsledku diabetického makulárního edému (DME) (viz bod 5.1),
• porucha zraku v důsledku myopické chorioideální neovaskularizace (myopická CNV) (viz bod 5.1).
4.2 Dávkování a způsob podání
Přípravek Eylea je určen pouze pro injekci do sklivce.
Přípravek Eylea musí být podáván pouze kvalifikovaným lékařem, který má zkušenosti s aplikací injekcí do sklivce.
Dávkování Vlhká forma VPMD
Doporučená dávka přípravku Eylea je 2 mg afliberceptu, což odpovídá 50 mikrolitrům.
Na začátku léčby přípravkem Eylea se podává jedna injekce měsíčně ve třech po sobě jdoucích dávkách, následně se podává jedna injekce každé dva měsíce. Není žádný požadavek na kontroly mezi injekcemi.
Po prvních 12 měsících léčby přípravkem Eylea a na základě výsledků vyšetření zraku a/nebo anatomických poměrů může být léčebný interval prodloužen, např. režimem „treat and extend“, kdy dochází k postupnému prodlužování léčebných intervalů, aby byly udrženy stabilní výsledky vyšetření zraku a/nebo anatomických poměrů, avšak vzhledem k nedostatku údajů není možné určit délku těchto intervalů. Pokud dojde ke zhoršení výsledků vyšetření zraku a/nebo anatomických poměrů, léčebný interval má být podle toho zkrácen.
Plán kontrol má proto určit ošetřující lékař, kontroly můžou být plánovány častěji v porovnání s plánem podání injekcí.
Makulární edém v důsledku RVO (BRVO nebo CRVO)
Doporučená dávka přípravku Eylea je 2 mg afliberceptu, což odpovídá 50 mikrolitrům.
Po první injekci je léčba aplikována jednou měsíčně. Interval mezi dvěma dávkami nemá být kratší než jeden měsíc.
Jestliže výsledky vyšetření zraku a anatomických poměrů naznačují, že pokračující léčba není pro pacienta přínosná, podávání přípravku Eylea má být ukončeno.
Léčba jednou měsíčně pokračuje, dokud nedojde k dosažení maximální zrakové ostrosti a/nebo vymizení příznaků aktivního onemocnění. Zapotřebí mohou být tři nebo více po sobě následující injekce aplikované jednou měsíčně.
Léčba může pokračovat v režimu „treat and extend“ s postupně prodlužujícími se léčebnými intervaly, aby byly udrženy stabilní výsledky vyšetření zraku a/nebo anatomických poměrů, avšak vzhledem k nedostatku údajů není možné určit délku těchto intervalů. Pokud dojde ke zhoršení výsledků vyšetření zraku a/nebo anatomických poměrů, léčebný interval má být podle toho zkrácen.
Plán kontrol a léčby má stanovit ošetřující lékař na základě individuální odpovědi pacienta.
Sledování aktivity nemoci může zahrnovat klinické vyšetření, funkční testy nebo zobrazovací techniky (např. optická koherentní tomografie nebo fluorescenční angiografie).
Diabetický makulární edém
Doporučená dávka přípravku Eylea je 2 mg afliberceptu, což odpovídá 50 mikrolitrům.
Léčba přípravkem Eylea se zahajuje jednou injekcí měsíčně s pěti po sobě jdoucími dávkami s následným podáváním jedné injekce každé dva měsíce. Kontroly mezi injekcemi nejsou požadovány.
Po 12 měsících léčby přípravkem Eylea a na základě výsledků vyšetření zraku a/nebo anatomických poměrů může být léčebný interval prodloužen, např. režimem „treat and extend“, kdy dochází k postupnému prodlužování léčebných intervalů, aby byly udrženy stabilní výsledky vyšetření zraku a/nebo anatomických poměrů, , avšak vzhledem k nedostatku údajů není možné určit délku těchto intervalů. Pokud dojde ke zhoršení výsledků vyšetření zraku a/nebo anatomických poměrů, léčebný interval má být podle toho zkrácen.
Plán kontrol má proto určit ošetřující lékař, kontroly můžou být plánovány častěji v porovnání s plánem podání injekcí.
Pokud výsledky vyšetření zraku a anatomických poměrů naznačují, že pokračující léčba není pro pacienta přínosná, podávání přípravku Eylea má být ukončeno.
Myopická chorioideální neovaskularizace
Doporučená dávka přípravku Eylea je jedna intravitreální injekce 2 mg afliberceptu, což odpovídá 50 mikrolitrům.
Další dávky mohou být podány, pokud výsledky vyšetření zraku a/nebo anatomických poměrů ukazují, že onemocnění přetrvává. Recidivy by měly být léčeny jako nová manifestace onemocnění.
Plán kontrol má být stanoven ošetřujícím lékařem.
Interval mezi dvěma dávkami nemá být kratší než jeden měsíc.
Zvláštní populace
Porucha funkce jater a/nebo ledvin
U přípravku Eylea nebyly provedeny žádné specifické studie u pacientů s poškozením funkce jater a/nebo ledvin.
Dostupné údaje nenaznačují potřebu úpravy dávky přípravku Eylea u těchto pacientů (viz bod 5.2).
Starší populace
Nejsou nutná žádná zvláštní opatření. U pacientů s DME ve věku nad 75 let jsou zkušenosti omezené. Pediatrická populace
Bezpečnost a účinnost přípravku Eylea nebyly u dětí a dospívajících stanoveny. Neexistuje žádné relevantní použití přípravku Eylea u pediatrické populace v indikacích vlhké formy VPMD, CRVO, BRVO, DME a myopické CNV.
Způsob podání
Injekce do sklivce musí být prováděny podle lékařských standardů a příslušných pokynů kvalifikovaným lékařem, který má zkušenosti s aplikací injekcí do sklivce. Obecně musí být zajištěny odpovídající anestézie a asepse, zahrnující lokální širokospektrý mikrobicidní prostředek (např. jodovaný povidon aplikovaný na kůži kolem oka, oční víčko a povrch oka). Doporučuje se chirurgická dezinfekce rukou, sterilní rukavice, sterilní rouška a sterilní spekulum (nebo ekvivalentní náhrada).
Injekční jehla se zasune 3,5-4,0 mm posteriorně od limbu do prostoru sklivce tak, aby směřovala do centra očního bulbu a nikoli k horizontálnímu meridiánu. Poté se aplikuje objem injekce 0,05 ml; následující injekci je nutné aplikovat v jiném místě skléry.
Ihned po podání do sklivce by měli být pacienti sledováni s ohledem na zvýšení nitroočního tlaku. Vhodné monitorování může zahrnovat kontrolu prokrvení papily optického nervu nebo tonometrii. Jeli to nutné, mělo by být k dispozici sterilní vybavení pro paracentézu.
Po aplikaci do sklivce by měli být pacienti informováni, aby ihned hlásili všechny příznaky, které mohou svědčit pro endoftalmitidu (např. bolest oka, zarudnutí oka, fotofobie, rozmazané vidění).
Každá injekční lahvička může být použita pouze pro léčbu jednoho oka.
Injekční lahvička obsahuje množství převyšující doporučenou dávku 2 mg afliberceptu.
Extrahovatelný objem injekční lahvičky (100 mikrolitrů) není celý určen k použití. Přebytečný objem musí být před aplikací injekce odstraněn. Aplikace celého objemu injekční lahvičky může mít za následek předávkování. Pro odstranění všech bublin a vytlačení přebytečného léčivého přípravku pomalu stlačte píst tak, aby byla cylindrická báze kupolovité zátky zarovnána s černou dávkovací čárkou na stříkačce (odpovídající 50 mikrolitrům tzn. 2 mg afliberceptu).
Po aplikaci injekce musí být veškerý nespotřebovaný přípravek zlikvidován.
Pro manipulaci s léčivým přípravkem před podáním, viz bod 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku aflibercept nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Aktivní oční nebo periokulární infekce nebo podezření na ni.
Aktivní závažný intraokulární zánět.
4.4 Zvláštní upozornění a opatření pro použití
Reakce spojené s aplikací intravitreální injekce
Intravitreální injekce, včetně injekcí přípravku Eylea, jsou spojovány s endoftalmitidou, nitroočním zánětem, rhegmatogenním odchlípením sítnice, trhlinou sítnice a iatrogenní traumatickou kataraktou (viz bod 4.8). Při aplikaci přípravku Eylea musí být vždy použity správné aseptické injekční postupy. Navíc mají být pacienti v týdnu, který následuje po aplikaci injekce, sledováni, aby se v případě infekce mohla zahájit včasná léčba. Pacienti mají být poučeni, aby neodkladně hlásili jakékoli příznaky, které mohou svědčit pro endoftalmitidu nebo jakoukoli výše uvedenou příhodu.
Během 60 minut po aplikaci injekce do sklivce bylo pozorováno zvýšení nitroočního tlaku, včetně po aplikaci přípravku Eylea (viz bod 4.8). Zvláštní opatření je nutné u pacientů s nedostatečně kontrolovaným glaukomem (neaplikujte injekci přípravku Eylea, pokud je nitrooční tlak > 30 mmHg). Ve všech případech proto musí být sledovány a vhodně léčeny jak nitrooční tlak, tak perfuze papily optického nervu.
Imunogenita
Vzhledem k tomu, že se jedná o terapeutický protein, existuje při použití přípravku Eylea riziko imunogenity (viz bod 4.8). Pacienti musí být instruováni, aby hlásili jakékoli známky intraokulárního zánětu např. bolest, fotofobii nebo zarudnutí, které by mohly souviset s hypersenzitivitou.
Systémové účinky
Po injekčním intravitreálním podání inhibitorů VEGF byly zaznamenány systémové nežádoucí účinky, zahrnující krvácení mimo oko a arteriální tromboembolické příhody, a je zde teoretické riziko, že mohly souviset s inhibicí VEGF. K dispozici jsou omezené údaje o bezpečnosti léčby u pacientů s CRVO, BRVO, DME nebo myopickou CNV s anamnézou cévní mozkové příhody nebo tranzitorních ischemických atak nebo infarktu myokardu během posledních 6 měsíců. Léčbu takových pacientů je třeba provádět s opatrností.
Další
Jako u jiných typů intravitreální anti-VEGF léčby u VPMD, CRVO, BRVO, DME a myopické CNV platí také následující:
• Bezpečnost a účinnost léčby přípravkem Eylea podávaným do obou očí současně nebyla studována z hlediska systémové expozice (viz bod 5.1). Současně prováděná bilaterální léčba může vést ke zvýšené systémové expozici, která může zvýšit riziko systémových nežádoucích účinků.
• Souběžné použití jiných anti-VEGF (vaskulární endoteliální růstové faktory)
K dispozici nejsou žádné údaje týkající se souběžného použití přípravku Eylea a jiných anti-VEGF léčivých přípravků (systémových nebo očních).
• Rizikové faktory spojené s vývojem trhliny pigmentového epitelu sítnice po podání anti-VEGF léčby u vlhké formy VPMD zahrnují rozsáhlé a/nebo značné odchlípení pigmentového epitelu sítnice. U pacientů s těmito rizikovými faktory pro vznik trhlin pigmentového epitelu sítnice je třeba zahajovat léčbu přípravkem Eylea s opatrností.
• Léčba by měla být vysazena u pacientů s rhegmatogenním odchlípením sítnice nebo u makulárních otvorů stupně 3 nebo 4.
• Při výskytu retinální trhliny je třeba dávku vynechat a léčba by neměla být obnovena, dokud se trhlina adekvátně nezhojí.
• V následujících případech se musí dávka vynechat a v plánované léčbě se nesmí pokračovat:
■ při poklesu nejlépe korigované ostrosti zraku (Best Corrected Visual Acuity, BCVA) o
>30 písmen oproti předchozímu stanovení ostrosti zraku;
■ při výskytu subretinálního krvácení, zahrnujícího střed foveynebo když je velikost
hemoragie > 50% celkové plochy léze;
• Dávka nemá být podávána během 28 dní před plánovaným očním chirurgickým zákrokem a 28 dní po provedeném očním chirurgickém zákroku.
• Přípravek Eylea nemá být používán během těhotenství, pokud možný přínos nepřeváží možné riziko pro plod (viz bod 4.6).
• Ženy ve fertilním věku musí během léčby a minimálně 3 měsíce po poslední injekci afliberceptu do sklivce používat účinnou antikoncepci (viz bod 4.6).
• Zkušenosti s léčbou pacientů s ischemickou CRVO a BRVO jsou omezené. U pacientů, kteří jeví klinické známky ireverzibilní ischemické ztráty zrakové funkce, se léčba nedoporučuje..
Populace s omezenými daty
K dispozici jsou pouze omezené zkušenosti s léčbou pacientů s DME v důsledku diabetes mellitus 1. typu nebo u diabetických pacientů s HbA1c nad 12 % nebo s proliferativní diabetickou retinopatií. Přípravek Eylea nebyl hodnocen u pacientů s aktivními systémovými infekcemi nebo u pacientů se souběžnými chorobami oka, jako je odchlípení sítnice nebo makulární díra. Také nejsou žádné zkušenosti s léčbou přípravkem Eylea u diabetických pacientů s nekontrolovanou hypertenzí. Při léčbě takových pacientů má lékař zvážit tento nedostatek informací.
U myopické CNV nejsou k dispozici žádné zkušenosti s přípravkem Eylea v léčbě pacientů jiné než asijské rasy, pacientů, kteří dříve podstoupili léčbu myopické CNV, a pacientů s extrafoveolárními lézemi.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí.
Podpůrné použití fotodynamické léčby (PDT) verteporfinem a přípravku Eylea nebylo hodnoceno, proto bezpečnostní profil nebyl stanoven.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku.
Ženy ve fertilním věku musí během léčby a minimálně 3 měsíce po poslední injekci afliberceptu do sklivce používat účinnou antikoncepci (viz bod 4.4).
Údaje o podávání afliberceptu těhotným ženám nejsou k dispozici.
Studie na zvířatech prokázaly embryofetální toxicitu po vysoké systémové expozici (viz bod 5.3).
Ačkoli systémová expozice po očním podání je velmi nízká, nemá být přípravek Eylea používán během těhotenství, pokud přínosy nepřeváží možná rizika pro plod.
Kojení
Není známo, zda se aflibercept vylučuje do lidského mateřského mléka. Riziko pro kojené děti nelze vyloučit.
Přípravek Eylea není doporučen během kojení. Na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku je nutno rozhodnout, zda přerušit kojení nebo přerušit podávání přípravku Eylea.
Fertilita
Výsledky ze studií na zvířatech s vysokou systémovou expozicí ukazují, že aflibercept může mít nepříznivý vliv na mužskou a ženskou fertilitu (viz bod 5.3). Takovéto účinky se neočekávají po oční aplikaci s velmi nízkou systémovou expozicí.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Vzhledem k možnosti výskytu přechodných poruch zraku, souvisejících s podáním injekce nebo s očním vyšetřením, má injekce přípravku Eylea malý vliv na schopnost řídit a obsluhovat stroje. Pacienti nemají řídit nebo obsluhovat stroje, dokud tyto poruchy zraku dostatečně neustoupí.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Celkem 3 102 pacientů představovalo bezpečnostní populaci v osmi studiích fáze III. Z těchto pacientů bylo 2 501 pacientů léčeno doporučenou dávkou 2 mg.
Závažné oční nežádoucí účinky na hodnoceném oku související s injekční procedurou se vyskytly u méně než 1 z 1 900 intravitreálních injekcí přípravku Eylea a zahrnovaly slepotu, endoftalmitidu, odchlípení sítnice, traumatickou kataraktu, kataraktu, krvácení do sklivce, odloučení sklivce a zvýšení nitroočního tlaku (viz bod 4.4).
Nejčastěji pozorované nežádoucí účinky (u minimálně 5 % pacientů léčených přípravkem Eylea) byly konjunktivální krvácení (25 %), snížení zrakové ostrosti (11 %), bolest oka (10 %), katarakta (8 %), zvýšení nitroočního tlaku (8 %), odloučení sklivce (7 %) a sklivcové vločky (7 %).
Seznam nežádoucích účinků uvedený v tabulce
Údaje o bezpečnosti, popsané níže, zahrnují všechny nežádoucí účinky z osmi studií fáze 3 u indikací vlhké formy VPMD, CRVO, BRVO, DME a myopické CNV s opodstatněným předpokladem příčinné souvislosti s aplikací injekce nebo léčivého.
Nežádoucí účinky jsou uvedeny podle tříd orgánových systémů a frekvence za použití následující konvence:
velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (>1/10 000 až <1/1 000).
V každé frekvenční skupině jsou nežádoucí účinky uvedeny v pořadí podle klesající závažnosti.
Tabulka 1: Všechny nežádoucí účinky vyskytující se během léčby hlášené u pacientů ve studiích fáze III (sdružené údaje ze studií fáze III u indikací vlhké formy VPMD, CRVO, BRVO, DME a myopické CNV) nebo v rámci postmarketingového sledování
|
Třída orgánového systému |
Velmi časté |
Časté |
Méně časté |
Vzácné |
|
Poruchy imunitního systému |
Hypersenzitivita* ** | |||
|
Poruchy oka |
Snížení zrakové ostrosti, konjunktivální krvácení, bolest oka |
Trhlina v pigmentovém epitelu sítnice*, odchlípení pigmentového epitelu sítnice, degenerace sítnice, krvácení do sklivce katarakta, nukleární katarakta, subkapsulární katarakta, kortikální katarakta, eroze rohovky, poškrábání rohovky, zvýšení nitroočního tlaku, rozmazané vidění, sklivcové vločky, odloučení sklivce, bolest v místě aplikace injekce, pocit cizího tělesa v očích, zvýšené slzení, otok víček, krvácení v místě aplikace injekce, keratitis punctata, konjunktivální hyperemie, okulární hyperemie |
Endoftalmitida**, odchlípení sítnice, trhlina sítnice, iritida, uveitida, iridocyklitida, lentikulární opacity, defekt korneálního epitelu, podráždění v místě injekce, abnormální citlivost oka, podráždění očního víčka, zarudnutí přední komory, korneální edém |
Slepota, traumatická katarakta, vitritida, hypopyon |
* Onemocnění, o kterých je známo, že souvisí s vlhkou formou VPMD. Pozorované pouze ve studiích u vlhké
formy VPMD.
** Endoftalmitida s pozitivním nebo negativním výsledkem kultivace.
*** Během postmarketingového období, případy hypersenzitivity včetně vyrážky, svědění, kopřivky a izolované případy anafylaktických/anafylaktoidních reakcí
Popis vybraných nežádoucích účinků
V rámci studií fáze III s vlhkou formou VPMD byla pozorována zvýšená incidence konjunktiválního krvácení u pacientů, kteří dostávali antitrombotika. Tato zvýšená incidence byla srovnatelná mezi pacienty, kteří dostávali ranibizumab či přípravek Eylea.
Arteriální tromboembolické příhody (ATEs) jsou nežádoucí účinky potenciálně související se systémovou inhibicí VEGF. Po intravitreálním použití inhibitorů VEGF existuje teoretické riziko arteriální tromboembolické příhody, včetně mozkové příhody a infarktu myokardu.
V klinických studiích s přípravkem Eylea byla u pacientů s VPMD, DME, RVO a myopická CNV pozorována nízká incidence arteriálních tromboembolických příhod. U všech indikací nebyl pozorován významný rozdíl mezi skupinami léčenými afliberceptem a příslušnými srovnávacími skupinami.
Jako u všech terapeutických proteinů existuje u přípravku Eylea možnost imunogenity.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
V klinických studiích byly použity dávky až 4 mg v měsíčních intervalech a objevily se izolované případy předávkování při dávce 8 mg.
Předávkování společně s větším objemem injekce může vést ke zvýšení nitroočního tlaku. Proto by v případě předávkování měl být monitorován nitrooční tlak a je-li to nezbytné podle ošetřujícího lékaře, měla by být zahájena odpovídající léčba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Oftalmologika/látky určené k léčbě neovaskularizace v oblasti oka ATC kód: S01LA05
Aflibercept je rekombinantní fúzní protein skládající se z částí extracelulárních domén humánního VEGF receptoru 1 a 2, fúzovaných na Fc fragment humánního IgG1.
Aflibercept se vyrábí rekombinantní DNA technologií v buňkách K1 ovarií křečíka čínského.
Aflibercept působí jako rozpustný falešný („decoy“) receptor, který váže VEGF-A a PlGF s vyšší afinitou než jejich přirozené receptory a tím může inhibovat vazbu a aktivaci těchto příbuzných receptorů VEGF.
Mechanismus účinku
Vaskulární endoteliální růstový faktor-A (VEGF-A) a placentární růstový faktor (PlGF) jsou zástupci VEGF skupiny angiogenních faktorů, které mohou působit jako silné mitogenní, chemotaktické a vaskulární permeabilitu ovlivňující faktory pro endoteliální buňky. VEGF působí přes dva tyrosinkinázové receptory; VEGFR-1 a VEGFR-2 nacházející se na povrchu endoteliální ch buněk. PlGF se váže pouze na VEGFR-1, který se také nachází na povrchu leukocytů. Nadměrná aktivace těchto receptorů působením VEGF-A může vést k patologické neovaskularizaci a nadměrné cévní permeabilitě. PlGF může v těchto procesech synergicky působit s VEGF-A, a je také známo, že podporuje leukocytární infiltraci a cévní zánět.
Farmakodynamické účinky
Vlhká forma VPMD
Vlhká forma VPMD je charakterizována patologickou choroidální neovaskularizací (CNV). Únik krve a tekutiny z CNV může způsobit ztluštění nebo edém sítnice a/nebo subretinální/intraretinální hemoragii, které vedou ke ztrátě zrakové ostrosti.
U pacientů léčených přípravkem Eylea (jedna injekce měsíčně po dobu tří po sobě jdoucích měsíců s následnou jednou injekcí každé dva měsíce) se snížila centrální tloušťka sítnice [CRT] brzy po zahájení léčby, také se snížila průměrná velikost CNV léze, což odpovídalo výsledkům, které byly pozorovány u ranibizumabu 0,5 mg podávaného každý měsíc.
Ve studii VIEW1 došlo k průměrnému snížení CRT při vyšetření pomocí optické koherentní tomografie (OCT) (-130 mikronů v 52. týdnu léčby přípravkem Eylea 2 mg každé dva měsíce a -129 mikronů v 52. týdnu léčby ranibizumabem v dávce 0,5 mg každý měsíc). V 52. týdnu došlo také ve studii VIEW2 k průměrnému snížení CRT na OCT (-149 mikronů ve skupinách léčených přípravkem Eylea 2 mg podávaným každé dva měsíce a -139 mikronů ranibizumabem 0,5 mg podávaným každý měsíc).
Snížení velikosti CNV a snížení CRT byly obecně udržovány v druhém roce studií.
Makulární edém v důsledku CRVO a BRVO
U CRVO a BRVO dochází k retinální ischemii, která vede k uvolnění VEGF, který naopak destabilizuje těsná spojení a podporuje proliferaci endoteliálních buněk. Zvýšená tvorba VEGF souvisí s rozpadem bariéry mezi krví a sítnicí, zvýšením vaskulární permeability, edémem sítnice a komplikacemi spojenými s neovaskularizací.
U pacientů léčených 6 následnými injekcemi přípravku Eylea 2 mg jednou měsíčně byla pozorována konzistentní, rychlá a silná morfologická odpověď (při měření zlepšení průměrné CRT). V týdnu 24 byla redukce CRT statisticky nadřazena kontrole ve všech třech studiích (COPERNICUS u CRVO: -457 vs. -145 mikronů; GALILEO u CRVO: -449 vs. -169 mikronů; VIBRANT u BRVO: -280 vs. -128 mikronů).
Tento pokles od výchozího stavu v CRT byl udržen do konce každé studie, týdne 100 u studie COPERNICUS, týdne 76 u studie GALILEO a týdne 52 u studie VIBRANT.
Diabetický makulární edém
Diabetický makulární edém je následek diabetické retinopatie a je charakterizovaný zvýšenou cévní permeabilitou a poškozením retinálních kapilár, což může vést ke ztrátě zrakové ostrosti.
U pacientů léčených přípravkem Eylea, z nichž většina byla klasifikována jako pacienti s diabetem typu II, byla brzy po zahájení léčby pozorována rychlá a masivní morfologická odpověď (CRT, stupeň DRSS).
Ve studiích VIVID-DME a VISTA-DME bylo statisticky významné větší průměrné snížení CRT od výchozího stavu do týdnu 52 pozorováno u pacientů léčených přípravkem Eylea než v kontrolní skupině léčené laserem, -192,4 a -183,1 mikrometrů pro skupiny léčené přípravkem Eylea 2Q8 a -66,2 a -73,3 mikrometrů pro kontrolní skupiny, v uvedeném pořadí. V týdnu 100 bylo udrženo snížení -
195,8 a -191,1 mikrometrů pro skupiny Eylea 2Q8 a -85,7 a -83,9 mikrometrů pro kontrolní skupiny ve studiích VIVID-DME a VISTA-DME, v uvedeném pořadí.
Ve studiích VIVID-DME a VISTA"DME bylo předem definovaným způsobem hodnoceno zlepšení o > 2 kroky v DRSS. Skóre DRSS bylo hodnotitelné u 73,7 % pacientů ve studii VIVID-DME a u 98,3 % pacientů ve studii VISTA"DME. V 52. týdnu došlo ke zlepšení o > 2 kroky v DRSS u 27,7 % a 29,1 % pacientů ve skupinách léčených přípravkem Eylea 2Q8 a 7,5 % a 14,3 % v kontrolních skupinách. V týdnu 100 byla příslušná procenta 32,6 % a 37,1 % ve skupinách léčených přípravkem Eylea 2Q8 a
8,2 % a 15,6 % v kontrolních skupinách.
Myopická chorioideální neovaskularizace
Myopická chorioideální neovaskularizace (myopická CNV) je častá přičina ztráty zraku u dospělých s patologickou myopií. Vyvíjí se v důsledku hojení rány, které následuje po rupturách Bruchovy membrány a představuje nejnebezpečnější zrak ohrožující příhodu u patologické myopie.
U pacientů léčených přípravkem Eylea ve studii MYRROR (jedna injekce podávaná na začátku léčby s dalšími injekcemi podávanými v případě přetrvávání nebo recidivy onemocnění), se CRT snížila brzy po zahájení léčby ve prospěch přípravku Eylea v týdnu 24 (-79 mikronů a -4 mikronů u skupiny léčené přípravkem Eylea 2 mg a kontrolní skupinou, v uvedeném pořadí), které bylo udrženo do týdne 48.
Navíc poklesla průměrná velikost CNV léze.
Klinická účinnost a bezpečnost
Vlhká forma VPMD
Bezpečnost a účinnost přípravku Eylea byly hodnoceny ve dvou randomizovaných, multicentrických, dvojitě zaslepených studiích s aktivní kontrolou u pacientů s vlhkou formou VPMD (VIEW1 a VIEW2) s celkem 2412 pacienty léčenými a hodnotitelnými pro účinnost. Věk pacientů se pohyboval od 49 do 99 let s průměrným věkem 76 let. V těchto klinických hodnoceních bylo přibližně 89 % (1 616/1 817) pacientů randomizovaných k léčbě přípravkem Eylea ve věku 65 let nebo starších a přibližně 63 % (1 139/1 817) ve věku 75 let nebo starších. V každé studii byli pacienti náhodně přiřazeni v poměru 1:1:1:1 do 1 ze 4 dávkovacích režimů:
1) Přípravek Eylea v dávce 2 mg podávaný každých 8 týdnů po 3 úvodních měsíčních dávkách (Eylea 2Q8);
2) Přípravek Eylea 2 mg podávaný každé 4 týdny (Eylea 2Q4);
3) Přípravek Eylea 0,5 mg podávaný každé 4 týdny (Eylea 0,5Q4);
4) ranibizumab 0,5 mg podávaný každé 4 týdny (ranibizumab 0,5Q4).
Ve druhém roce studií pokračovali pacienti v léčbě na dávce, do které byli původně randomizováni, ale s upraveným plánem dávkování na základě výsledků vyšetření zraku a anatomických poměrů při protokolem definovaném maximálním intervalu dávkování 12 týdnů.
V obou studiích byl primární cílový ukazatel účinnosti podíl pacientů v souboru podle protokolu, u kterých byl udržen zrak, to znamená ztráta méně než 15 písmen zrakové ostrosti v týdnu 52 oproti výchozímu stavu.
Ve studii VIEW1 byl zrak udržen v týdnu 52 u 95,1 % pacientů ve skupině přípravku Eylea 2Q8 ve srovnání s 94,4 % pacientů ve skupině ranibizumabu 0,5Q4.
Ve studii VIEW2 byl zrak udržen v týdnu 52 u 95,6 % pacientů ve skupině přípravku Eylea 2Q8 ve srovnání s 94,4 % pacientů ve skupině ranibizumabu 0,5Q4. V obou studiích přípravek Eylea prokázal, že není horší (non-inferior) a že je klinicky ekvivalentní skupině léčené ranibizumabem 0,5Q4.
Podrobné výsledky kombinované analýzy obou studií jsou uvedeny v tabulce 3 a na obrázku 1 níže.
Tabulka 2: Výsledky účinnosti v týdnu 52 (primární analýza) a týdnu 96; kombinovaná data ze studií VIEW1 a VIEW226 27
|
Výsledek účinnosti |
(Eylea 2 mg každých 8 týdnů po 3 úvodních měsíčních dávkách) |
Ranibizumab 0,5Q4 (ranibizumab 0,5 mg každé 4 týdny) | ||
|
(n = 607) |
(n |
= 595) | ||
|
týden 52 |
týden 96 |
týden 52 |
týden 96 | |
|
Průměrný počet injekcí od výchozího stavu. |
7,6 |
11,2 |
12,3 |
16,5 |
|
Průměrný počet injekcí od týdne 52 do 96. |
4,1 |
4,6 | ||
|
Podíl pacientů se ztrátou < 15 písmen oproti výchozímu stavu (PPSA)). |
95,33 %27 |
92,42 % |
94,42 % 27 |
91,60 % |
|
Rozdíl30 (95 % CI)31. |
0,9 % (-1,7; 3,5)F |
0,8 % (-2,3; 3,8)F | ||
|
Průměrná změna BCVA podle měření pomocí ETDRSA) skóre písmen od výchozího stavu. |
8,40 |
7,62 |
8,74 |
7,89 |
|
Rozdíl v v průměrné změně LS A) (ETDRS písmena)30 (95 % CI)31. |
-0,32 (-1,87; 1,23) |
-0,25 (-1,98; 1,49) | ||
|
Podíl pacientů se ziskem > 15 písmen oproti výchozímu stavu. |
30,97 % |
33,44 % |
32,44 % |
31,60 % |
|
Rozdíl30 (95 % CI)31. |
-1,5 % (-6,8; 3,8) |
1,8 % (-3,5; 7,1) | ||
Obrázek 1. Průměrná změna zrakové ostrosti od výchozího stavu do týdne 96 pro kombinované údaje ze studií VIEW1 a VIEW2.
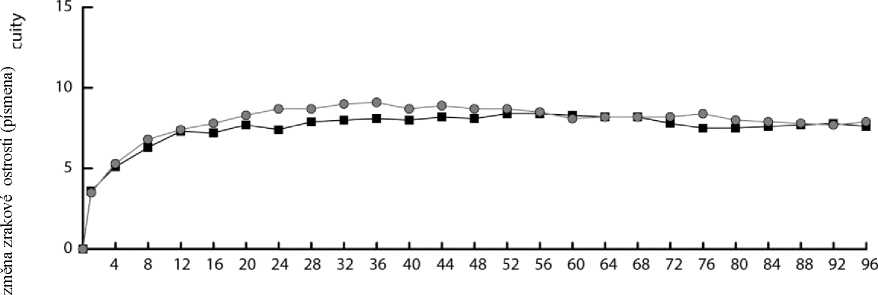
“•Ctí
Týdny
|
EYLEA 2 mg Q |
- |
h 0.5 mn 04 wppks |
|
EYLEA 2 mg Q8 týdny* |
Ranibizumab 0,5 mg Q4 týdny* |
V kombinované analýze dat ze studií VIEW1 a VIEW2 prokázal přípravek Eylea klinicky významné změny oproti výchozímu stavu v předem specifikovaném sekundárním cílovém ukazateli účinnosti dotazníku Národního očního institutu pro oční funkci (National Eye Institute Visual Function Questionnaire, NEI VFQ-25) bez klinicky významných rozdílů oproti ranibizumabu. Velikost těchto změn byla podobná jako v publikovaných studiích, což odpovídalo zisku 15 písmen při nejlépe korigované ostrosti zraku (Best Corrected Visual Acuity, BCVA).
V druhém roce studií byla účinnost obecně udržena do posledního hodnocení v týdnu 96, u 2-4 % pacientů bylo třeba podávat všechny injekce po měsíci a třetině pacientů bylo třeba podat minimálně jednu injekci v jednoměsíčním léčebném intervalu.
Snížení průměrné plochy CNV bylo patrné ve všech skupinách v obou studiích.
Výsledky účinnosti u všech hodnocených podskupin (např. věk, pohlaví, rasa, výchozí zraková ostrost, typ léze, velikost léze) v každé studii a v kombinované analýze odpovídaly výsledkům u celkové populace.
Makulární edém v důsledku CRVO
Bezpečnost a účinnost přípravku Eylea byly hodnoceny ve dvou randomizovaných, multicentrických, dvojitě zaslepených studiích kontrolovaných předstíranou („sham“) procedurou u pacientů s makulárním edémem v důsledku CRVO (cOpERNICUS a GALILEO) s celkem 358 pacienty léčenými a hodnotitelnými pro účinnost (217 na přípravku Eylea). Věk pacientů se pohyboval od 22 do 89 let s průměrným věkem 64 let. V těchto CRVO studiích bylo přibližně 52 % (112/217) pacientů přiřazených k léčbě přípravkem Eylea ve věku 65 let nebo starších a přibližně 18 % (38/217) ve věku 75 let nebo starších. V obou studiích byli pacienti náhodně přiřazeni v poměru 3:2 buď do léčby přípravkem Elea 2 mg podávaného každé 4 týdny (2Q4) nebo do kontrolní skupiny, která dostávala předstírané („sham“) injekce každé 4 týdny s celkovým počtem 6 injekcí.
Po 6 po sobě následujících měsíčních injekcích dostali pacienti léčbu pouze, pokud splnili předem specifikovaná léčebná kritéria, kromě pacientů v kontrolní skupině ve studii GALILEO, kteří dále dostávali předstírané injekce (kontrola kontroly) do týdne 52. Od tohoto časového bodu byli všichni pacienti léčeni, pokud byla splněna předem specifikovaná kritéria.
V obou studiích byl primární cílový ukazatel účinnosti podíl pacientů, kteří získali minimálně 15 písmen na BCVA v týdnu 24 ve srovnání s výchozím stavem. Sekundární cílový ukazatel účinnosti byl změna zrakové ostrosti v týdnu 24 ve srovnání s výchozím stavem.
Rozdíl mezi léčebnými skupinami byl statisticky významný ve prospěch přípravku Eylea v obou studiích. Maximálního zlepšení zrakové ostrosti bylo dosaženo v měsíci 3 s následnou stabilizací zrakové ostrosti a CRT až 6 měsíců. Statisticky významný rozdíl byl udržen až do týdne 52.
Podrobné výsledky z analýzy obou studií jsou uvedeny v tabulce 4 a na obrázku 2 níže.
Tabulka 3: Parametry účinnosti v týdnu 24, 52 a 76/100 (soubor pro plnou analýzu s LOCFC)) ve studiích COPERNICUS a GALILEO
|
Parametry účinnosti |
COPERNICUS |
GALILEO | ||||||||||
|
24 týdnů |
52 týdnů |
100 týdnů |
24 týdnů |
52 týdnů |
76 týdnů | |||||||
|
Eylea |
Kontrola |
Eylea |
Kontrola E) |
Eylea F) |
Kontrola E,F) |
Eylea |
Kontrola |
Eylea |
Kontrola |
Eylea G) |
Kontrola G) | |
|
2 mg Q4 (N = 114) |
(N = 73) |
2 mg (N = 114) |
(N = 73) |
2 mg (N = 114) |
(N = 73) |
2 mg Q4 (N = 103) |
(N = 68) |
2 mg (N = 103) |
(N = 68) |
2 mg (N = 103) |
(N = 68) | |
|
Podíl pacientů se ziskem > 15 písmen od výchozího stavu |
56 % |
12 % |
55 % |
30 % |
49,1 % |
23,3 % |
60 % |
22 % |
60 % |
32 % |
57,3 % |
29,4 % |
|
Vážený rozdílA,B) (95% CI) |
44,8 % (33,0, 56,6) |
25,9 % (11,8, 40,1) |
26,7 % (13,1,40,3) |
38,3 % (24,4, 52,1) |
27,9 % (13,0, 42,7) |
28,0 % (13,3, 42,6) | ||||||
|
p-hodnota |
p < 0,0001 |
p = 0,0006 |
p = 0,0003 |
p < 0,0001 |
p = 0,0004 |
p = 0,0004 | ||||||
|
Průměrná změna v BCVAC) měřená podle ETDRSC) skóre písmen od výchozího stavu (SD) |
17,3 (12,8) |
-4,0 (18,0) |
16,2 (17,4) |
3,8 (17,1) |
13,0 (17,7) |
1,5 (17,7) |
18,0 (12,2) |
3,3 (14,1) |
16,9 (14,8) |
3,8 (18,1) |
13,7 (17,8) |
6,2 (17,7) |
|
Rozdíl v průměru LS A,C,D) (95% CI) |
21,7 (17,4, 26,0) |
12,7 (7,7, 17,7) |
11,8 (6,7, 17,0) |
14,7 (10,8, 18,7) |
13,2 (8,2, 18,2) |
7,6 (2,1, 13,1) | ||||||
|
p-hodnota |
p < 0,0001 |
p < ,0001 |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
p = ,0070 | ||||||
A) Rozdíl u přípravku Eylea 2 mg Q4 týdny mínus kontrola
B) Rozdíl a interval spolehlivosti (CI) jsou vypočteny pomocí Cochran-Mantel-Haenszelova (CMH) testu upraveného na region (Amerika vs zbytek světa pro studii COPERNICUS a Evropa vs Asie/Pacifik pro studii GALILEO) a výchozí kategorii BCVA (>20/200 a <20/200)
C) BCVA: Nejlépe korigovaná zraková ostrost ETDRS: Studie Early Treatment Diabetic Retinopathy LOCF: Poslední získané údaje
SD: Standardní odchylka
LS: Průměry minimálních čtverců odvozených z modelu ANCOVA
D) LS průměrný rozdíl a interval spolehlivosti na základě modelu ANCOVA s faktory léčebné skupiny, regionu (Amerika vs zbytek světa pro studii COPERNICUS a Evropa vs Asie/Pacifik pro studii GALILEO) a výchozí kategorie BCVA (>20/200 a <20/200)
E) Ve studii COPERNICUS dostávala kontrolní skupina pacientů přípravek Eylea podle potřeby každé 4 týdny během týdne 24 až týdne 52; pacienti měli návštěvy každé 4 týdny
F) Ve studii COPERNICUS dostávali jak pacienti v kontrolní skupině tak pacienti ve skupině přípravku Eylea 2 mg přípravek Eylea 2 mg podle potřeby každé 4 týdny od týdne 52 do týdne 96; pacienti měli povinné čtvrtletní návštěvy, ale mohli mít návštěvy každé 4 týdny, podle potřeby
G V studii GALILEO dostávali jak pacienti v kontrolní skupině tak pacienti ve skupině přípravku Eylea 2 mg přípravek Eylea 2 mg podle potřeby každých 8 týdnů od týdne 52 do týdne 68; pacienti měli povinné návštěvy každých 8 týdnů.
Obrázek 2: Průměrná změna od výchozího stavu do týdne 76/100 u zrakové ostrosti podle léčebné skupiny ve studiích COPERNICUS a GALILEO (soubor pro plnou analýzu)
COPERNICUS
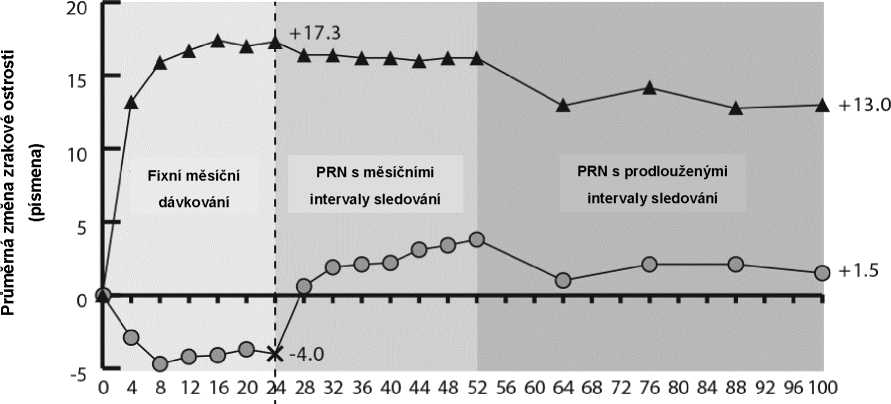
Týdny
GALILEO
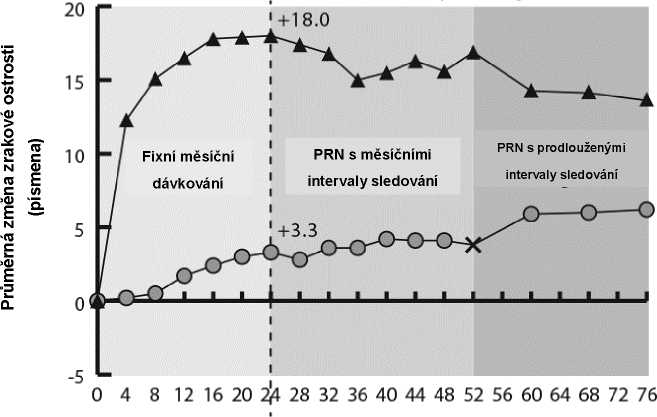
+ 13.7
Týdny
+6.2
-Q-Kontrolní skupina
EYLEA 2 mg
Ukazuje převedení kontrolní skupiny na PRN léčbu přípravkem EYLEA 2 mg
Ve studii GALILEO mělo 86,4 % (n = 89) pacientů ve skupině přípravku Eylea a 79,4 % (n = 54) pacientů v rameni s předstíranou („sham“) léčbou při vstupu do studie CRVO s perfuzí. V týdnu 24 to bylo 91,8 % (n = 89) ve skupině přípravku Eylea a 85,5 % (n = 47) v rameni s předstíranou („sham“) léčbou. Tyto podíly byly udrženy v týdnu 76 s 84,3 % (n = 75) ve skupině s přípravkem Eylea a 84,0 % (n = 42) v rameni s předstíranou („sham“) léčbou.
Ve studii COPERNICUS mělo 67,5 % (n = 77) pacientů ve skupině přípravku Eylea a 68,5 % (n = 50) pacientů v rameni s předstíranou („sham“) léčbou při vstupu do studie CRVO s perfuzí. V týdnu 24 to bylo 87,4 % (n = 90) ve skupině přípravku Eylea a 58,6 % (n = 34) v rameni s předstíranou („sham“) léčbou. Tyto podíly byly udrženy v týdnu 100 s 76,8 % (n = 76) ve skupině s přípravkem Eylea a 78 % (n = 39) v rameni s předstíranou („sham“) léčbou. Pacienti v „sham“ rameni měli od týdne 24 nárok na léčbu přípravkem Eylea.
Příznivý účinek léčby přípravkem Eylea na zrakovou funkci byl u základních podskupin pacientů s perfuzí a bez perfuze obdobný. Léčebné účinky v ostatních hodnotitelných podskupinách (např. věk, pohlaví, rasa, výchozí zraková ostrost, doba trvání CRVO) v každé studii odpovídaly obecně výsledkům u celkové populace.
V kombinované analýze dat ze studií GALILEO a COPERNICUS prokázal přípravek Eylea klinicky významné změny oproti výchozímu stavu v předem specifikovaném sekundárním cílovém ukazateli účinnosti dotazníku Národního očního institutu pro oční funkci (National Eye Institute Visual Function Questionnaire, NEI VFQ-25). Velikost těchto změn byla podobná jako v publikovaných studiích, což odpovídalo zisku 15 písmen při nejlépe korigované ostrosti zraku (Best Corrected Visual Acuity, BCVA).
Makulární edém v důsledku BRVO
Bezpečnost a účinnost přípravku Eylea byla hodnocena v randomizované, multicentrické, dvojitě zaslepené, aktivně kontrolované studii u pacientů s makulárním edémem v důsledku BRVO (VIBRANT), který zahrnoval hemiretinální žilní okluzi (hemi-retinal vein occlusion). Celkem bylo léčeno a hodnoceno z hlediska účinnosti 181 pacientů (91 léčeno přípravkem Eylea). Věk pacientů se pohyboval od 42 do 94 let s průměrným věkem 65 let. Ve studii BRVO bylo přibližně 58 % (53/91) pacientů randomizovaných k léčbě přípravkem Eylea ve věku 65 let nebo starších a přibližně 23 % (21/91) ve věku 75 let nebo starších. V této studii byli pacienti náhodně přiřazeni v poměru 1:1 buď k léčbě přípravkem Eylea 2 mg aplikovaným každých 8 týdnů po 6 úvodních injekcích aplikovaných jednou měsíčně nebo k léčbě fotokoagulací laserem aplikované na počátku léčby (kontrolní skupina léčená laserem). Pacienti v kontrolní skupině léčené laserem mohli být na počátku týdne 12 dodatečně léčeni fotokoagulací laserem (tzv. „rescue laser treatment“) s minimálním intervalem 12 týdnů. Na základě předem specifikovaných kritérií mohli pacienti ve skupině léčené laserem od týdne 24 obdržet záchrannou léčbu přípravkem Eylea 2 mg, podávanou každé 4 týdny po 3 měsíce následovanou každých 8 týdnů.
Ve studii VIBRANT byl primárním cílovým parametrem poměr pacientů, kteří dosáhli hodnotu alespoň 15 písmen v BCVA v týdnu 24 ve srovnání se stavem na počátku léčby a skupina léčená přípravkem Eylea byla nadřazená kontrolní skupině léčené laserem.
Sekundární cílový parametr účinnosti ve studii VIBRANT byla změna zrakové ostrosti v týdnu 24 ve srovnání se stavem na počátku léčby, která byla statisticky významná ve prospěch přípravku Eylea. Průběh zlepšení zraku byl rychlý a maxima bylo dosaženo ve 3 měsících s udržením účinku až 12 měsíců.
67 pacientů ve skupině léčené laserem dostávalo záchrannou léčbu přípravkem Eylea na počátku týdne 24 (aktivní kontrola/ Eylea 2 mg), která vedla od týdne 24 do týdne 52 ke zlepšení zrakové ostrosti asi o 5 písmen.
Podrobné výsledky z analýzy studie VIBRANT jsou v tabulce 4 a na obrázku 3 níže.
Tabulka 4: Parametry účinnosti v týdnu 24 a v týdnu 52 (soubor pro plnou analýzu LOCF) ve studii VIBRANT
|
Parametry účinnosti |
VIBRANT | |||
|
24 týdnů |
52 týdnů | |||
|
Eylea 2mg Q4 (N = 91) |
Aktivní kontrola (laser) (N = 90) |
Eylea 2mg Q8 (N = 91) D) |
Aktivní kontrola (laser)/Eylea 2mgE) (N = 90) | |
|
Podíl pacientů se ziskem >15 písmen oproti výchozímu stavu (%) |
52,7 % |
26,7 % |
57,1 % |
41,1 % |
|
Vážený rozdíl A>B (%) (95% CI) p-hodnota |
26,6 % (13,0, 40,1) p=0,0003 |
16,2 % (2,0, 30,5) p=0,0296 | ||
|
Průměrná změna BCVA podle měření pomocí ETDRS skóre písmen od výchozího stavu (SD) |
17,0 (11,9) |
6,9 (12,9) |
17,1 (13,1) |
12,2 (11,9) |
|
Rozdíl v průměru LS A,C (95% CI) p-hodnota |
10,5 (7,1, 14,0) p<0,0001 |
5,2 (1,7, 8,7) p=0,0035F) | ||
A) Rozdíl u přípravku Eylea 2 mg Q4 týdny minus kontrola laserem
B) Rozdíl a 95% interval spolehlivosti (CI) jsou vypočteny pomocí Mantel-Haenszelova váženého schématu upraveného na region (Severní Amerika vs Japonsko) a výchozí kategorii BCVA (>20/200 a <20/200)
C) LS průměrný rozdíl a 95% interval spolehlivosti na základě modelu ANCOVA s léčebnou skupinou, výchozí kategorií BCVA (>20/200 a <20/200) a regionem (Severní Amerika vs Japonsko) jako fixními účinky a výchozí BCVA jako kovariát
D) Od týdne 24 byl léčebný interval ve skupině s přípravkem Eylea prodloužen pro všechny subjekty ze 4 týdnů na 8 týdnů do týdne 48.
E) Na počátku týdne 24 mohly subjekty ve skupině léčené laserem obdržet záchrannou léčbu přípravkem Eylea, pokud splňovaly alespoň jedno předem specifikované kritérium zařaditelnosti. Celkem 67 subjektů v této skupině obdrželo přípravek Eylea jako záchrannou léčbu. Fixní režim pro přípravek Eylea jako záchrannou léčbu byl tři krát Eylea 2 mg každé 4 týdny následované injekcemi každých 8 týdnů.
F) Nominální p-hodnota
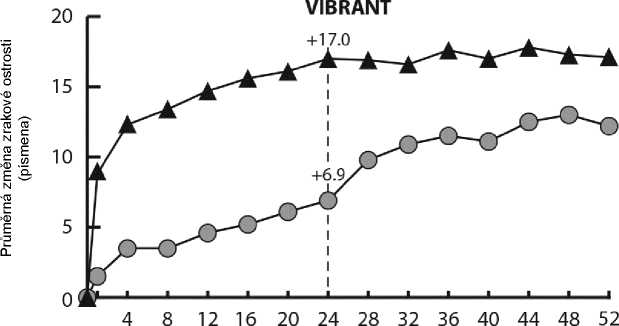
Týdny
Eylea 2 mg O Kontrolní skupina (laser)
Na počátku léčby byl poměr pacientů s perfuzí ve skupině s přípravkem Eylea 60 % a ve skupině léčené laserem 68 %. V týdnu 24 byl tento poměr 80 % a 67 %. Ve skupině s přípravkem Eylea byl poměr pacientů s perfuzí udržován do týdne 52. Ve skupině léčené laserem, kde byli pacienti vhodní pro záchrannou léčbu přípravkem Eylea od týdne 24, se do týdne 52 zvýšil poměr pacientů s perfuzí na 78 %.
Diabetický makulární edém
Bezpečnost a účinnost přípravku Eylea byla hodnocena ve dvou randomizovaných, multicentrických, dvojitě zaslepených studiích s aktivní kontrolou u pacientů s DME (VIVIDDME a VISTADME).. Celkem 862 pacientů bylo léčených a hodnotitelných pro účinnost, 576 přípravkem Eylea. Věk pacientů se pohyboval od 23 do 87 let s průměrným věkem 63 let. V DME studiích bylo přibližně 47 % (268/576) pacientů přiřazených k léčbě přípravkem Eylea ve věku 65 let nebo starších a přibližně 9 % (52/576) ve věku 75 let nebo starších. V obou studiích byli pacienti náhodně zařazeni v poměru 1:1:1 do 1 ze 3 režimů dávkování:
1) přípravek Eylea podávaný v dávce 2 mg každých 8 týdnů po 5 úvodních měsíčních injekcích (Eylea 2Q8),
2) přípravek Eylea podávaný v dávce 2 mg každé 4 týdny (Eylea 2Q4) a
3) makulární laserová fotokoagulace (aktivní kontrola).
Od 24. týdne byli pacienti, kteří splnili předem specifikovaný práh zrakové ztráty, zařaditelní do dodatečné léčby: pacienti ve skupinách léčených přípravkem Eylea mohli dostat laserovou léčbu a pacienti v kontrolní skupině mohli dostat přípravek Eylea.
V obou studiích byla primárním cílovým ukazatelem účinnosti průměrná změna od výchozího stavu v BCVA v týdnu 52, obě skupiny přípravku Eylea 2Q8 a Eylea 2Q4 prokázaly statistickou významnost a byly nadřazené kontrolní skupině. Tento přínos byl udržen do týdne 100.
Podrobné výsledky z analýzy studií VIVIDDME a VISTADME jsou uvedeny v tabulce 5 a na obrázku 4 níže
Tabulka 5: Parametry účinnosti v týdnu 52 a v týdnu 100 (soubor pro plnou analýzu s LOCF^ ve studiích VIVIDDME a VISTADME
|
Parametry účinosti |
VIVIDDME |
VISTADME | ||||||||||
|
52 týdnů |
100 týdnů |
52 týdnů |
100 týdnů | |||||||||
|
Eylea |
Eylea |
Aktivní |
Eylea |
Eylea |
Aktivní |
Eylea |
Eylea |
Aktivní |
Eylea |
Eylea |
Aktivní | |
|
kontrola |
kontrola |
kontrola |
kontrola | |||||||||
|
2 mg Q8 A |
2 mg Q4 |
(laser) |
2 mg Q8 A |
2 mg Q4 |
(laser) |
2 mg Q8 A |
2 mg Q4 |
(laser) |
2 mg Q8 A |
2 mg Q4 |
(laser) | |
|
(N = 135) |
(N = 136) |
(N = 132) |
(N = 135) |
(N = 136) |
(N = 132) |
(N = 151) |
(N = 154) |
(N = 154) |
(N=151) |
(N=154) |
(N=154) | |
|
Průměrná změna v BCVA měřená podle ETDRS E skóre písmen od výchozího stavu |
10,7 |
10,5 |
1,2 |
9,4 |
11,4 |
0,7 |
10,7 |
12,5 |
0,2 |
11,1 |
11,5 |
0,9 |
|
Rozdíl v průměru |
9,1 |
9,3 |
8,2 |
10,7 |
10,45 |
12,19 |
10,1 |
10,6 | ||||
|
LSB-C"E (97,5% CI) |
(6,4; 11,8) |
(6,5; 12,0) |
(5,2; 11,3) |
(7,6; 13,8) |
(7,7; 13,2) |
(9,4; 15,0) |
(7,0; 13,3) |
(7,1; 14,2) | ||||
|
Podíl pacientů se ziskem > 15 písmen od výchozího stavu |
33 % |
32 % |
9 % |
31,1 % |
38,2 % |
12,1 % |
31 % |
42 % |
8 % |
33,1% |
38,3 % |
13,0 % |
|
Upravený |
24 % |
23 % |
19 % |
26,1 % |
23 % |
34 % |
20,1 % |
25,8 % | ||||
|
rozdíl D’C’E (97,5% CI) |
(13,5; 34,9) |
(12,6; 33,9) |
(8,0; 29.9) |
(14,8; 37,5) |
(13,5; 33,1) |
(24,1; 44,4) |
(9,6; 30,6) |
(15,1; 36,6) | ||||
A Po zahájení léčby 5 injekcemi aplikovanými v měsíčním intervalu (1 injekce měsíčně)
B Průměr minimálních čtverců a CI na základě modelu ANCOVA s výchozím měřením BCVA jako kovariátou a faktorem pro léčebnou skupinu. Kromě toho byl region (Evropa/Austrálie vs. Japonsko) přidán jako faktor pro studii VIVIDdme a anamnéza infarktu myokardu a/nebo cévní mozkové příhody jako faktor pro studii VISTADME C Rozdíl u přípravku Eylea minus aktivní kontrola (laser)
D Rozdíl s intervalem spolehlivosti (Cl) a statistickým testem je vypočten pomocí Mantel-Haenszel váženého schéma upraveného podle regionu (Evropa/Austrálie vs. Japonsko) pro VIVIDdme a anamnézu IM nebo cévní mozkové příhody pro studii VISTAdme E BCVA: Nejlépe korigovaná zraková ostrost
ETDRS: Studie Early Treatment Diabetic Retinopathy LOCF: Poslední získané údaje
LS: Průměry minimálních čtverců odvozených z modelu ANCOVA Cl: Interval spolehlivosti
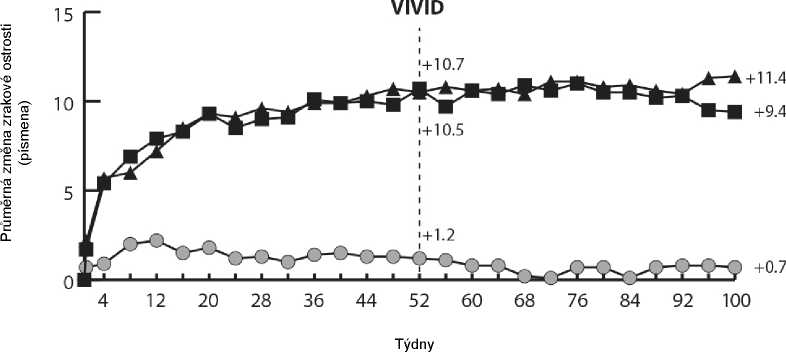
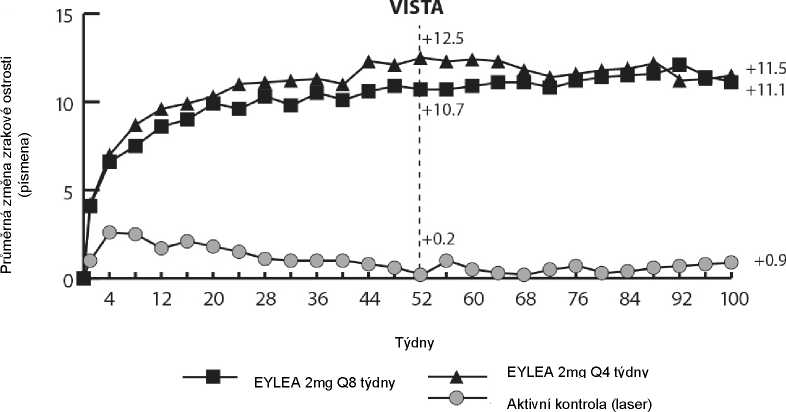
Léčebné účinky u hodnotitelných podskupin (např. věk, pohlaví, rasa, výchozí HbA1c, výchozí zraková ostrost, předchozí anti-VEGF léčba) v každé studii a v kombinované analýze obecně odpovídaly výsledkům u celkové populace.
Ve studiích VIVIDDME a VISTADME dostávalo 36 (9 %) a 197 (43 %) pacientů předchozí anti-VEGF léčbu, v uvedeném pořadí, s 3měsíční nebo delší dobou bez léčby. Léčebné účinky v podskupině pacientů, kteří měli předchozí léčbu VEGF inhibitorem, byly podobné jako u pacientů, kteří léčbu VEGF inhibitorem neměli.
Pacienti s bilaterálním onemocněním byli zařaditelní do léčby pomocí anti-VEGF na jejich druhém oku, pokud bylo posouzeno lékařem, že je to nutné. Ve studii VISTADME dostalo 217 (70,7 %) pacientů léčených přípravkem Eylea bilaterální injekce přípravku Eylea do týdne 100; ve studii VIVIDDME dostalo 97 (35,8 %) pacientů léčených přípravkem Eylea různou anti-VEGF léčbu jejich druhého oka.
Nezávislá srovnávací studie (DRCR.net Protocol T) použila dávkovací režim na základě striktních kritérií při měření OCT a zraku. Ve skupině léčené afliberceptem (n = 224) v týdnu 52 bylo v tomto dávkovacím režimu pacientům podáno průměrně 9,2 injekcí, což bylo podobné podané množství dávek jako ve skupině Eylea 2Q8 ve studiích VIVIDDME a VISTADME, zatímco celková účinnost ve skupině léčené afliberceptem ve studii Protocol T byla srovnatelná se skupinou Eylea 2Q8 ve studiích VIVIDDME and VISTADME Ve studii Protocol T byl pozorován průměrný zisk 13,3 písmen, přičemž
42 % pacientů získalo nejméně 15 písmen ve srovnání s výchozím stavem. Bezpečnostní profily, jak oční tak systémové (včetně ATEs), byly podobné těm ve studiích VIVIDDME and VISTADME.
Myopická chorioideální neovaskularizace
Bezpečnost a účinnost přípravku Eylea byla hodnocena v randomizované, multicentrické, dvojitě zaslepené studii kontrolované „sham“ ramenem u dosud neléčených asijských pacientů s myopickou CNV. Celkem 121 pacientů bylo léčených a hodnotitelných pro účinnost (90 přípravkem Eylea). Věk pacientů se pohyboval od 27 do 83 let s průměrným věkem 58 let. V myopické CNV studii bylo přibližně 36 % (33/91) pacientů přiřazených k léčbě přípravkem Eylea ve věku 65 let nebo starších a přibližně 10 % (9/91) ve věku 75 let nebo starších. Pacienti byli náhodně přiřazeni v poměru 3:1 do léčby buď 2 mg přípravku Eylea intravitreálně nebo do léčby předstíranými („sham“) injekcemi podávanými jednou na začátku studie s dalšími injekcemi podávanými měsíčně v případě přetrvávání nebo recidivy onemocnění do týdne 24, kdy byl hodnocen primární cílový ukazatel. V týdnu 24 byli pacienti, kteří byli v úvodu randomizováni do předstírané („sham“) léčby, zařaditelní pro podání první dávky přípravku Eylea. Poté byli pacienti v obou skupinách dále zařaditelní do podání dalších injekcí v případě přetrvávání nebo recidivy onemocnění.
Rozdíl mezi léčebnými skupinami byl statisticky významný ve prospěch přípravku Eylea pro primární cílový ukazatel (změna BCVA) a konfirmační sekundární cílový ukazatel účinnosti (podíl pacientů, kteří získali 15 písmen v BCVA) v týdnu 24 v porovnání s výchozím stavem. Rozdíly v obou cílových ukazatelech byly udrženy do týdne 48.
Podrobné výsledky z analýzy studie MYRROR jsou uvedeny v tabulce 6 a na obrázku 5 níže.
Tabulka 6: Výsledky účinnosti v týdnu 24 (primární analýza) a týdnu 48 ve studii MYRROR (soubor pro plnou analýzu s LOCFA))
|
Výsledky účinnosti |
MYRROR | |||
|
24 týdnů |
48 týdnů | |||
|
Eylea 2 mg (N = 90) |
Sham (N = 31) |
Eylea 2 mg (N = 90) |
Sham/ Eylea 2 mg (N = 31) | |
|
Průměrná změna v BCVAB) měřená podle ETDRS skóre písmen od výchozího stavu (SD) B) |
12,1 (8,3) |
-2,0 (9,7) |
13,5 (8,8) |
3,9 (14,3) |
|
Rozdíl v průměru LS C,D,E) (95 % CI) |
14,1 (10,8; 17,4) |
9,5 (5,4; 13,7) | ||
|
Podíl pacientů se ziskem >15 písmen od výchozího stavu |
38,9 % |
9,7 % |
50,0 % |
29,0 % |
|
Vážený rozdíl D,F) (95 % CI) |
29,2 % (14,4; 44,0) |
21,0 % (1,9; 40,1) | ||
A) LOCF: Poslední získané údaje
B) BCVA: Nejlépe korigovaná zraková ostrost
ETDRS: Studie Early Treatment Diabetic Retinopathy SD: standardní odchylka
C) LS: Průměry minimálních čtverců odvozených z modelu ANCOVA
D) CI: Interval spolehlivosti
E) Průměr minimálních čtverců a 95 % CI na základě modelu ANCOVA s léíčebnou skupinou a zemí (označení země) jako fixními účinky a výchozí BCVA jako kovariátou.
F) Rozdíl a 95 % CI jsou vypočteny pomocí Cochran-Mantel-Haenszel (CMH) schema upraveného podle země (označení země)
Průměrný změna zrakové ostrosti od výchozího stavu do týdne 48 podle léčebné skupiny pro studii MYRROR (soubor pro plnou analýzu, LOCF)
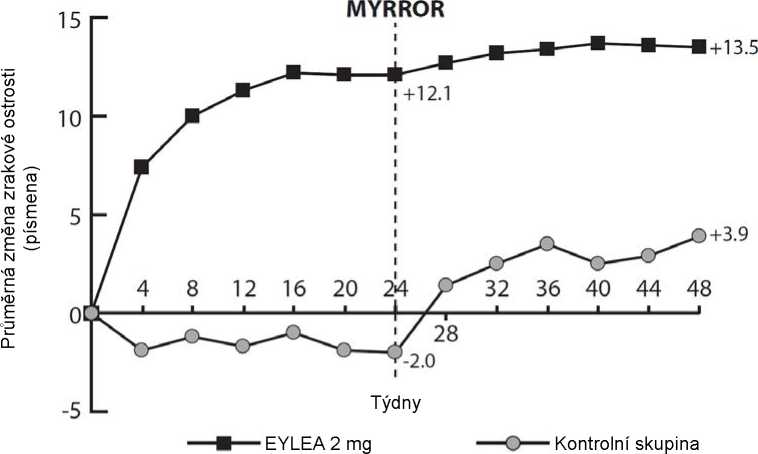
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem Eylea u všech podskupin pediatrické populace u vlhké formy VPMD, CRVO, BRVO, DME a myopické CNV (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Přípravek Eylea se podává přímo do sklivce pro dosažení lokálního účinku v oku.
Absorpce/Distribuce
Aflibercept je po podání do sklivce pomalu absorbován z oka do krevního oběhu a je převážně pozorován v systémovém oběhu jako neaktivní, stabilní komplex s VEGF; avšak pouze „volný aflibercept“ je schopen vázat endogenní VEGF.
Ve farmakokinetické podstudii u 6 pacientů s neovaskulární vlhkou formou VPMD s častým odběrem vzorků byly maximální plasmatické koncentrace volného afliberceptu (systémová Cmax) nízké, s průměrnou hodnotou přibližně 0,02 mikrogramů/ml (rozmezí 0 - 0,054) během 1 až 3 dnů po injekci dávky 2 mg do sklivce, a byly nedetekovatelné dva týdny po dávce téměř u všech pacientů. Při podání do sklivce každé 4 týdny se Aflibercept neakumuluje v plasmě.
Průměrná maximální plazmatická koncentrace volného afliberceptu je přibližně 50 až 500krát nižší než koncentrace afliberceptu nutná pro inhibici biologické aktivity systémového VEGF o 50 % u zvířecích modelů, u kterých byly pozorovány změny krevního tlaku, kdy hladiny cirkulujícího volného afliberceptu dosáhly přibližně 10 mikrogramů/ml a vrátily se k výchozím hodnotám, když hladina poklesla pod přibližně 1 mikrogram/ml. Odhaduje se, že po podání dávky 2 mg do sklivce je maximální plazmatická koncentrace volného afliberceptu u pacientů více než 100krát nižší než koncentrace afliberceptu nutná pro polovinu maximální vazby na systémový VEGF (2,91 mikrogramů/ml) ve studii u zdravých dobrovolníků. Systémové farmakodynamické účinky, jako jsou změny krevního tlaku, jsou proto nepravděpodobné.
Ve farmakokinetických podstudiích u pacientů s CRVO, BRVO, DME nebo myopickou CNV byly průměrné Cmax volného afliberceptu v plasmě podobné hodnotám v rozmezí 0,03 až 0,05
mikrogramů/ml a individuálním hodnotám nepřesahujícím 0,14 mikrogramů/ml. Poté plazmové koncentrace volného afliberceptu všeobecně klesly v jednom týdnu pod úroveň nebo blízko hodnotě dolního limitu kvantifikace; nedetekovatelné koncentrace byly dosaženy před dalším podáním po 4 týdnech u všech pacientů
Eliminace
Protože Eylea je léčivý přípravek na bázi proteinu, nebyly provedeny žádné studie hodnotící metabolismus.
Volný aflibercept se váže na VEGF za tvorby stabilního a inertního komplexu. Jako u jiných velkých proteinů se očekává, že jak volný tak vázaný aflibercept budou eliminovány proteolytickým katabolismem.
Porucha funkce ledvin
S přípravkem Eylea nebyly provedeny žádné specifické studie u pacientů s poškozením funkce ledvin.
Farmakokinetická analýza pacientů ve studii VIEW2, z nichž 40 % mělo poruchu funkce ledvin (24 % mírná, 15 % středně závažná a 1 % závažná), neodhalila po podání do sklivce každých 4 nebo 8 týdnů žádné rozdíly s ohledem na plazmatické koncentrace aktivního léku.
Podobné výsledky byly pozorovány u pacientů s CRVO ve studii GALILEO, u pacientů s DME ve studii VIVIDDME a u pacientů s myopickou CNV ve studii MYRROR.
5.3 Předklinické údaje vztahující se k bezpečnosti
Účinky v neklinických studiích toxicity po opakovaném podávání byly pozorovány pouze při systémových expozicích významně přesahujících maximální expozici u člověka po podání zamýšlené klinické dávky do sklivce, což svědčí pro malý význam pro klinické použití.
Při systémové expozici přesahující maximální expozici u člověka byly pozorovány eroze a ulcerace z respiračního epitelu nosních průduchů u opic léčených afliberceptem aplikovaným do sklivce. Systémová expozice založená na Cmax a AUC pro volný aflibercept byla asi 200krát, respektive 700krát vyšší při srovnání s odpovídajícími hodnotami pozorovanými u člověka po podání dávky 2 mg do sklivce. Při dávce 0,5 mg/oko u opic, při které ještě nebylo možné pozorovat nežádoucí účinek látky (No Observed Adverse Effect Level (NOAEL)), byla systémová expozice 42krát vyšší na základě Cmax a 56krát vyšší na základě AUC.
Nebyly provedeny žádné studie hodnotící mutagenní nebo karcinogenní potenciál afliberceptu.
Účinek alfiberceptu na nitroděložní vývoj byl prokázán ve studiích embryo-fetálního vývoje u březích samic králíků při nitrožilním podání (3 až 60 mg/kg) a rovněž při subkutánním podání (0,1 až 1 mg/kg). NOAEL pro matku byla 3 mg/kg nebo 1 mg/kg, v uvedeném pořadí. Vývojová NOAEL nebyla identifikována Při dávce 0,1 mg/kg byly systémové expozice založené na Cmax a kumulativní AUC pro volný aflibercept přibližně 17krát, respektive 10krát vyšší ve srovnání s odpovídajícími hodnotami pozorovanými u člověka po podání dávky 2 mg do sklivce.
Účinky na mužskou a ženskou fertilitu byly hodnoceny v rámci 6 měsíční studie u opic při nitrožilním podání afliberceptu v dávkách od 3 do 30 mg/kg. Chybějící nebo nepravidelná menstruace spojená se změnami hladin ženských pohlavních hormonů a změny morfologie a motility spermií byly pozorovány při všech úrovních dávek. Na základě Cmax a AUC pro volný aflibercept pozorovanými při aplikaci nitrožilní dávky 3 mg/kg byly systémové expozice asi 4900krát, respektive 1500krát vyšší než expozice pozorované u člověka po dávce 2 mg aplikované do sklivce. Všechny změny byly reverzibilní.
FARMACEUTICKÉ ÚDAJE
6.
6.1 Seznam pomocných látek
Polysorbát 20
Monohydrát dihydrogenfosforečnanu sodného (na úpravu pH)
Heptahydrát hydrogenfosforečnanu sodného (na úpravu pH)
Chlorid sodný Sacharóza Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte lahvičku v krabičce, aby byl přípravek chráněn před světlem.
Před použitím může být neotevřená lahvička přípravku Eylea uchovávána při pokojové teplotě (do 25 °C) po dobu až 24 hodin. Po otevření lahvičky pokračujte při aseptických podmínkách.
6.5 Druh obalu a obsah balení
100 mikrolitrů roztoku v injekční lahvičce (sklo typu I) se zátkou (elastomerní pryž) a 18 G jehlou s filtrem. Velikost balení 1.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Injekční lahvička je pouze na jedno použití.
Vzhledem k tomu, že lahvička obsahuje větší objem (100 mikrolitrů), než je doporučená dávka (50 mikrolitrů), je třeba část obsahu lahvičky před podáním zlikvidovat.
Před podáním je třeba roztok vizuálně zkontrolovat, zda nejsou přítomny jakékoli cizorodé částice a/nebo zabarvení, případně změněn fyzikální vzhled. Pozorujete-li takové změny, léčivý přípravek zlikvidujte.
Pro injekci do sklivce by měla být použita injekční jehla 30 G x ‘A palce.
1. Sejměte plastové víčko a dezinfikujte vněj ší část pryžové zátky lahvičky.


2. Nasaďte 18 G jehlu s filtrem o velikosti 5 mikronů dodávanou v balení na sterilní Luer-lock 1 ml stříkačku.
3. Zasuňte jehlu s filtrem do středu zátky lahvičky, aby byla jehla zasunuta do lahvičky celá a hrotem se dotýkala dna nebo okraje dna lahvičky.
4. Pomocí aseptické techniky natáhněte celý obsah lahvičky s přípravkem Eylea do stříkačky a držte přitom lahvičku ve svislé poloze mírně nakloněnou pro usnadnění úplného nasátí. Abyste zabránily natáhnutí vzduchu, zajistěte, aby byl zkosený hrot jehly s filtrem ponořen v tekutině. Během plnění stříkačky udržujte lahvičku nakloněnou tak, aby byl zkosený hrot jehly ponořený v tekutině.


5. Ujistěte se, že plunžrový píst je při vyprazdňování lahvičky vytažen dostatečně daleko tak, aby jehla s filtrem byla úplně vyprázdněna.
6. Sejměte jehlu s filtrem a správně ji zlikvidujte.
Pozn.: Jehla s filtrem není určena pro aplikaci do sklivce.
7. Při dodržení aseptické techniky pevně otáčením nasaďte 30 G x y% palcovou injekční jehlu na Luer-lock hrot stříkačky.


8. Držte stříkačku s jehlou směřující nahoru,
zkontrolujte, zda nejsou v injekční stříkačce bubliny. Pokud jsou v ní bubliny, jemně na injekční stříkačku poklepejte prstem, dokud se bubliny nedostanou nahoru.
9. Odstraňte všechny bubliny a vytlačte přebytečný léčivý přípravek pomalým stlačením plunžrového pístu tak, že hrot plunžrového pístu bude zarovnán s čárkou, která označuje 0,05 ml na stříkačce.


10. Inj ekční lahvička j e určena pouze pro j edno použití.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Bayer Pharma AG D-13342 Berlin Německo
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/12/797/002
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 22. listopadu 2012
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ
A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce biologické léčivé látky
Regeneron Pharmaceuticals, Inc.
81 Columbia Turnpike Rensselaer, New York 12144 USA
Název a adresa výrobců odpovědných za propouštění šarží
Bayer Pharma AG MullerstraBe 178 13353 Berlin Německo
GP Grenzach Produktions GmbH Emil-Barell-StraBe 7 79639 Grenzach-Wyhlen Německo
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
Systém farmakovigilance
Držitel rozhodnutí o registraci musí zajistit, aby byl zaveden funkční systém farmakovigilance uvedený v modulu 1.8.1 schválené registrace předtím, než bude léčivý přípravek uveden na trh, a dále po celou dobu, kdy bude léčivý přípravek na trhu.
• Další opatření k minimalizaci rizik
Před uvedením na trh musí držitel rozhodnutí o registraci (MAH) v každém členském státě předložit národnímu kompetentnímu úřadu ke schválení edukační materiály.
MAH musí v každém členském státě, kde je přípravek Eylea uváděn na trh a následně obchodován, před uvedením na trh nové indikace myopické chorioideální neovaskularizace (myopická CNV) a poté pravidelně zajistit, aby ve všech oftamologických klinikách, kde se předpokládá, že může být přípravek Eylea používán, byly k dispozici následující aktualizované materiály, které byly prodiskutovány a schváleny národním kompetentním úřadem:
• Informace pro lékaře
• Videozáznam metodiky podání do sklivce
• Piktogram procedury podání do sklivce
• Soubor informací pro pacienta
Informace pro lékaře mají obsahovat následující nejdůležitější složky:
• Souhrn údajů o přípravku
• Kdo může být léčen přípravkem Eylea
• Sterilní techniky, včetně periokulární a okulární dezinfekce, aby se minimalizovalo riziko infekce
• Použití antibiotik
• Použití jodovaného povidonu nebo rovnocenné náhrady
• Techniky podání do sklivce
• Potřeba vytlačit přebytečný objem z předplněné injekční stříkačky před aplikací přípravku Eylea, aby se zabránilo předávkování
• Sledování pacienta po podání do sklivce
• Hlavní známky a příznaky nežádoucích účinků souvisejících s podáním do sklivce, zahrnující endoftalmitidu, zvýšení nitroočního tlaku, trhlinu v pigmentovém epitelu sítnice a kataraktu
• Zvládnutí nežádoucích účinků, které souvisí s podáním do sklivce
• Ženy ve fertilním věku musí používat účinnou antikoncepci a těhotné ženy nemají používat přípravek Eylea
Soubor informací pro pacienta má být zajištěn ve formě informačních brožur pro pacienta a také jako audio-CD, a obsahuje následující nejdůležitější složky:
• Příbalová informace pro pacienta
• Kdo může být léčen přípravkem Eylea
• Jak se připravit na léčbu přípravkem Eylea
• Jaké jsou kroky, které následují po podání přípravku Eylea
• Hlavní známky a příznaky závažných nežádoucích účinků léčby, zahrnující endoftalmitidu, zvýšení nitroočního tlaku, trhlinu v pigmentovém epitelu sítnice a kataraktu
• Kdy vyhledat okamžitou pomoc u poskytovatele zdravotní péče
• Ženy ve fertilním věku musí používat účinnou antikoncepci a těhotné ženy nemají používat přípravek Eylea
• Povinnost uskutečnit poregistrační opatření
Držitel rozhodnutí o registraci uskuteční v daném termínu níže uvedená opatření:
|
Popis |
Termín splnění |
|
Poregistrační studie účinnosti (PAES) Provedení poregistrační randomizované studie u pacientů s neovaskulární (vlhkou) AMD s primárním cílem porovnání standardního režimu dávkování po 8 týdnech s upraveným režimem dávkování, podloženým výsledky vyšetření zraku a anatomických poměrů, na základě protokolu schváleného CHMP. |
Podání finální zprávy ze studie: 31. prosince 2018 |
|
Poregistrační studie účinnosti (PAES) Provedení intervenční poregistrační studie účinnosti u pacientů s diabetickým makulárním edémem s primárním cílem porovnání, různých léčebných režimů po úvodním prvním roce léčby přípravkem Eylea: standardního režimu dávkování každých 8 týdnů s alternativními léčebnými režimy dávkování, tj. prodloužené léčebné intervaly na základě výsledků vyšetření zraku a anatomických poměrů (PRN a treat-and-extend) |
Podání finální zprávy ze studie: listopad 2019 |
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA
Předplněná injekční stříkačka
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce Afliberceptum
2. OBSAH LÉČIVÉ LÁTKY
Afliberceptum
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky:
Polysorbát 20
Monohydrát dihydrogenfosforečnanu sodného (na úpravu pH) Heptahydrát hydrogenfosforečnanu sodného (na úpravu pH) Chlorid sodný Sacharóza Voda na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok v předplněné injekční stříkačce.
Jedna předplněná injekční stříkačka obsahuje 3,6 mg afliberceptu v 90 mikrolitrech (40 mg/ml) v isoosmotickém roztoku.
To poskytuje jednu dávku 2 mg/0,05 ml.
Přebytečný objem má být před aplikací ze stříkačky vytlačen.
1 předplněná injekční stříkačka (3,6 mg/90 mikrolitrů)
Jedna dávka: 2 mg/0,05 ml Přebytečný objem odstraňte.
5. ZPŮSOB A CESTA PODÁNÍ
Intravitreální podání.
Pouze pro jednorázové použití.
Před použitím si přečtěte příbalovou informaci.
Otevřete sterilní blistr v čisté místnosti určené pro aplikaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku v blistru v krabičce, aby byl přípravek chráněn před světlem.
Před použitím může být neotevřený blistr uchováván při pokojové teplotě (do 25 °C) po dobu až 24 hodin.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Bayer Pharma AG D-13342 Berlin Německo
12. REGISTRANČÍ ČÍSLO/ČÍSLA
EU/1/12/797/001
13. ČÍSLO ŠARŽE
č.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato
ÚDAJE UVÁDĚNÉ NA BLISTRU Předplněná injekční stříkačka
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Eylea 40 mg/ml injekční roztok Afliberceptum
2. OBSAH LÉČIVÉ LÁTKY
Afliberceptum
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Jedna předplněná injekční stříkačka obsahuje 3,6 mg / 90 mikrolitrů (40 mg/ml) v isoosmotickém roztoku.
To poskytuje jednu dávku 2 mg/0,05 ml.
Přebytečný objem má být před aplikací ze stříkačky vytlačen.
5. ZPŮSOB A CESTA PODÁNÍ
Intravitreální podání.
Pouze pro jednorázové použití.
Před použitím si přečtěte příbalovou informaci.
Otevřete sterilní blistr v čisté místnosti určené pro aplikaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku v blistru v krabičce, aby byl přípravek chráněn před světlem.
Před použitím může být neotevřený blistr uchováván při pokojové teplotě (do 25 °C) po dobu až 24 hodin.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Bayer Pharma AG D-13342 Berlin Německo
12. REGISTRANČÍ ČÍSLO/ČÍSLA
EU/1/12/797/001
13. ČÍSLO ŠARŽE
č.s.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK
Předplněná injekční stříkačka
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Eylea 40 mg/ml injekční roztok Afliberceptum Intravitreální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
Jednotlivá dávka = 2 mg/50 mikrolitrů 3,6 mg/90 mikrolitrů
6. JINÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
KRABIČKA
Injekční lahvička
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Eylea 40 mg/ml injekční roztok v injekční lahvičce Afliberceptum
2. OBSAH LÉČIVÉ LÁTKY
Afliberceptum
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky:
Polysorbát 20
Monohydrát dihydrogenfosforečnanu sodného (na úpravu pH) Heptahydrát hydrogenfosforečnanu sodného (na úpravu pH) Chlorid sodný Sacharóza Voda na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok v injekční lahvičce
Jedna injekční lahvička obsahuje 4 mg afliberceptu ve 100 mikrolitrech (40 mg/ml) v isoosmotickém roztoku.
To poskytuje jednu dávku 2 mg/0,05 ml. Přebytečný objem má být před aplikací vytlačen.
1 injekční lahvička (4 mg/0,1 ml)
18 G jehla s filtrem Jedna dávka: 2 mg/0,05 ml Přebytečný objem vytlačte.
5. ZPŮSOB A CESTA PODÁNÍ
Intravitreální podání.
Injekční lahvička pouze pro jednorázové použití. Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte injekční lahvičku v krabičce, aby byl přípravek chráněn před světlem.
Před použitím může být neotevřená injekční lahvička uchovávána při pokojové teplotě (do 25 °C) po dobu až 24 hodin.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Bayer Pharma AG D-13342 Berlin Německo
12. REGISTRANČÍ ČÍSLO/ČÍSLA
EU/1/12/797/002
13. ČÍSLO ŠARŽE
č.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU
ŠTÍTEK
Injekční lahvička
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Eylea 40 mg/ml injekční roztok Afliberceptum Intravitreální podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
Jednotlivá dávka = 2 mg/50 mikrolitrů Extrahovatelný obsah = 4 mg/100 mikrolitrů
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce
Afliberceptum
'VTento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek podán, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Eylea a k čemu se používá
2. Čemu musíte věnovat pozornost, než Vám bude přípravek Eylea podán
3. Jak Vám bude přípravek Eylea podáván
4. Možné nežádoucí účinky
5. Jak přípravek Eylea uchovávat
6. Obsah balení a další informace
1. Co je přípravek Eylea a k čemu se používá
Přípravek Eylea je roztok, který se podává v injekci do oka pro léčbu onemocnění oka u dospělých označených jako
- neovaskulární (vlhká) forma věkem podmíněné makulární degenerace (vlhká forma VPMD),
- porucha zraku způsobená makulárním edémem v důsledku uzávěru (okluze) sítnicové žíly (okluze větve sítnicové žíly (BRVO) nebo centrální sítnicové žíly (CRVO)),
- porucha zraku v důsledku diabetického makulárního edému (DME),
- porucha zraku v důsledku myopické chorioideální neovaskularizace (myopická CNV).
Aflibercept, léčivá látka přípravku Eylea, blokuje aktivitu skupiny faktorů, známých jako vaskulární endoteliální růstový faktor A (VEGF-A) a placentární růstový faktor (PlGF), které, pokud jsou u pacientů s vlhkou formou VPMD a myopickou CNV v nadbytku, se podílí na abnormální tvorbě nových krevních cév v oku. Tyto nové krevní cévy mohou způsobit únik složek krve do oka a následné poškození tkání v oku, které jsou důležité pro zrak.
U pacientů s CRVO dochází k blokádě hlavní cévy, která odvádí krev ze sítnice. Jako odpověď dochází ke zvýšení hladin VEGF, což způsobuje únik tekutiny do sítnice, a tím otok žluté skvrny (makuly, část sítnice zodpovědné za ostré vidění), což se označuje jako makulární otok (edém). Když je žlutá skvrna oteklá, centrální vidění se stává rozmazané.
U pacientů s BRVO je jedna nebo více větví hlavní krevní cévy, která odvádí krev ze sítnice, blokovaná. Hladiny VEGF jsou následkem toho zvýšené, což způsobuje prosakování tekutiny do sítnice, a tak makulární edém.
Diabetický makulární edém je otok sítnice, který se vyskytuje u pacientů s cukrovkou v důsledku prosakování tekutiny z cév v makule. Makula je část sítnice, která je zodpovědná za ostré vidění. Když se vytvoří otok v oblasti makuly, dojde k rozmazání centrálního vidění.
Bylo prokázáno, že přípravek Eylea zastavuje v oku růst nových abnormálních cév, které často krvácejí a uniká z nich tekutina. Přípravek Eylea pomáhá stabilizovat a v mnoha případech zlepšit ztrátu zraku u vlhké formy VPMD, CRVO, BRVO, DME a myopické CNV.
2. Čemu musíte věnovat pozornost, než Vám bude přípravek Eylea podán Přípravek Eylea Vám nebude podán:
- Jestliže jste alergický(á) na aflibercept nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
- Jestliže máte aktivní infekci v oku nebo kolem oka nebo existuje podezření na ni (okulární nebo periokulární infekce).
- Jestliže máte závažný zánět v oku (projevuje se jako bolest nebo zarudnutí).
Upozornění a opatření
Před podáním přípravku se poraďte se svým lékařem:
- Pokud máte glaukom (zelený zákal).
- Pokud se u Vás v minulosti objevily záblesky světla nebo pohybující se vločky v zorném poli a jestliže jste začali pozorovat zvýšení velikosti a počtu vloček.
- Pokud u Vás byl proveden nebo je plánován chirurgický výkon na oku během předchozích nebo následujících čtyř týdnů.
- Pokud máte závažnou formu CRVO nebo BRVO (ischemická CRVO nebo BRVO), léčba přípravkem Eylea se nedoporučuje.
Dále je důležité, abyste věděl(a), že
- bezpečnost a účinnost přípravku Eylea při podávání do obou očí zároveň nebyla hodnocena a tento způsob použití může vést ke zvýšenému riziku vzniku nežádoucích účinků,
- injekce přípravku Eylea může u některých pacientů způsobit zvýšení tlaku v oku (nitrooční tlak) během 60 minut od podání injekce. Toto bude Váš lékař po každé injekci sledovat,
- pokud u Vás dojde k rozvoji infekce nebo zánětu uvnitř oka (endoftalmitida) nebo jiné komplikace, objeví se bolest oka nebo zvýšený nepříjemný pocit v oku, zhoršující se zarudnutí oka, rozmazané nebo zhoršené vidění nebo zvýšená citlivost na světlo. Je důležité, aby byly tyto příznaky diagnostikovány a léčeny co možná nejdříve,
- Váš lékař zkontroluje, zda máte další rizikové faktory, které by mohly zvýšit riziko trhliny nebo odchlípení jedné z vrstev v zadní části oka (odchlípení sítnice nebo trhlina a odchlípení pigmentového epitelu sítnice nebo trhliny v něm), v takovém případě musí být přípravek Eylea podáván s opatrností,
- přípravek Eylea nemá být použit během těhotenství, pokud potenciální přínos nepřeváží možné riziko pro nenarozené dítě,
- ženy, které mohou otěhotnět, musí během léčby a minimálně tři měsíce po poslední injekci přípravku Eylea do sklivce používat účinnou antikoncepci.
Systémové použití inhibitorů VEGF, látek podobných těm, které jsou obsaženy v přípravku Eylea, může souviset s rizikem tvorby krevních sraženin, které blokují krevní cévy, což může vést k srdečnímu infarktu nebo mrtvici. Po injekci přípravku Eylea existuje teoretické riziko takových příhod. K dispozici jsou omezené údaje o bezpečnosti léčby pacientů s CRVO, BRVO, DME myopickou CNV, kteří prodělali cévní mozkovou příhodu, tranzitorní ischemickou ataku nebo srdeční záchvat během posledních 6 měsíců. Pokud se Vás jakýkoli z těchto stavů týká, bude přípravek Eylea podáván s opatrností.
K dispozici jsou pouze omezené zkoušenosti s léčbou
- pacientů s DME v důsledku diabetu (cukrovky) 1. typu,
- diabetiků s velmi vysokými průměrnými hladinami krevního cukru (HbA1c nad 12 %),
- diabetiků s onemocněním oka způsobeným cukrovkou, které se označuje jako proliferativní diabetická retinopatie.
K dispozici nejsou žádné zkušenosti s léčbou
- pacientů s akutními infekcemi,
- pacientů s dalšími onemocněními oka, jako je odchlípení sítnice nebo makulární díra,
- diabetiků s nekontrolovaným vysokým krevním tlakem,
- pacientů jiné než asijské rasy s myopickou CNV,
- pacientů dříve léčených pro myopickou CNV,
- pacientů s poškozením mimo centrální část makuly (extrafoveolární léze) v důsledku myopické CNV.
Pokud se Vás cokoli z výše uvedného týká, zváží Váš lékař tento nedostatek informací během Vaší léčby přípravkem Eylea.
Děti a dospívající
Použití přípravku Eylea u dětí a dospívajících mladších 18 let nebylo hodnoceno, protože vlhká forma VPMD, CRVO, BRVO, DME a myopická CNV se vyskytuje hlavně u dospělých. Proto není jeho použití u této věkové skupiny relevantní.
Další léčivé přípravky a Eylea
Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Těhotenství a kojení
- Ženy, které mohou otěhotnět, musí během léčby a minimálně tři měsíce po poslední injekci přípravku Eylea do sklivce používat účinnou antikoncepci.
- Nejsou žádné zkušenosti s použitím přípravku Eylea u těhotných žen. Přípravek Eylea nemá být používán během těhotenství, pokud potenciální přínos nepřeváží možné riziko pro nenarozené dítě. Pokud jste těhotná nebo plánujete těhotenství, poraďte se se svým lékařem před léčbou přípravkem Eylea.
- Používání přípravku Eylea se během kojení nedoporučuje, protože není známo, zda se do mateřského mléka vylučuje. Před zahájením léčby přípravkem Eylea se poraďte se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Po aplikaci injekce přípravku Eylea se u Vás mohou dočasně objevit poruchy zraku. Neřiďte vozidla a neobsluhujte stroje, dokud tyto poruchy přetrvávají.
Důležité informace o některých složkách přípravku Eylea
Tento přípravek obsahuje méně než 1 mmol (23 mg) sodíku v jedné dávce, tj. v podstatě je „bez sodíku“.
3. Jak Vám bude přípravek Eylea podáván
Lékař se zkušeností s aplikací injekcí do oka Vám bude podávat přípravek Eylea do oka za aseptických (čistých a sterilních) podmínek.
Doporučená dávka přípravku je 2 mg afliberceptu (50 mikrolitrů).
Přípravek Eylea se podává jako injekce do oka (injekce do sklivce).
Před aplikací injekce Váš lékař použije dezinfekční prostředek pro důkladné očištění oka, aby zabránil infekci. Váš lékař Vám také podá lokální anestetikum pro snížení nebo zabránění bolesti, kterou můžete pociťovat během podávání injekce.
Vlhká f forma VPMD
Pacientům s vlhkou formou VPMD bude podána jedna injekce měsíčně ve třech po sobě jdoucích dávkách, následně se podává jedna injekce každé dva měsíce.
Po prvních 12 měsících léčby přípravkem Eylea může být na základě lékařského vyšetření interval léčby prodloužen.
Jestliže nebudete mít potíže nebo Vám lékař nedá jiné pokyny, není třeba, abyste lékaře mezi podáním injekcí navštěvovali.
Makulární edém v důsledku okluze retinální žíly (BRVO nebo CRVO)
Lékař stanoví léčebný plán, který pro Vás bude nejvhodnější. Léčbu zahájíte sérií injekcí přípravku Eylea podávaných jednou měsíčně.
Interval mezi dvěma injekcemi by neměl být kratší než jeden měsíc.
Váš lékař může léčbu přípravkem Eylea, pokud pokračující léčba pro Vás nemá přínos.
Vaše léčba bude pokračovat injekcemi podávanými jednou měsíčně, dokud nebude Váš stav považován za stabilní. Mohou být zapotřebí tři nebo více injekce aplikované jednou měsíčně.
Váš lékař bude sledovat Vaši odpověď na léčbu a může pokračovat v léčbě postupným prodlužováním intervalu mezi injekcemi, dokud nebude dosažen stabilní stav. Pokud se Váš stav během léčby s prodlouženým léčebným intervalem začne zhoršovat, Váš lékař odpovídajícím způsobem intervaly zkrátí.
Na základě Vaší odpovědi na léčbu Váš lékař rozhodne o plánu následných vyšetření a léčbě. Jestliže se Váš stav po prvních třech měsících léčby nezlepší, lékař může léčbu přípravkem Eylea ukončit.
Pokud lékař bude považovat Váš stav za stabilní po dobu tří měsíců léčby, léčba může být ukončena.
V případě nutnosti mohou být intervaly mezi injekcemi prodlouženy na dobu delší než jeden měsíc. Pokud se Váš stav začne po přerušení léčby zhoršovat, může být léčba znovu zahájena.
Obvykle Vás lékař vyšetří během návštěvy, kdy je Vám aplikována injekce. Pokud jsou léčebné intervaly delší než jeden měsíc, lékař může rozhodnout, že Vás bude vyšetřovat častěji. Pak se budete muset objednat na další návštěvy, abyste mohl být lékařem vyšetřen mezi aplikacemi injekcí.
Diabetický makulární edém (DME)
Pacienti s DME budou léčeni jednou injekcí měsíčně po dobu prvních pěti po sobě jdoucích dávek a poté s následným podáváním jedné injekce každé dva měsíce.
Pokud se u Vás neobjeví žádné problémy nebo nedostanete jinou radu od svého lékaře, není nutné navštěvovat lékaře v době mezi injekcemi.
Po prvních 12 měsících léčby přípravkem Eylea může být léčebný interval prodloužen podle vyšetření provedeného Vaším lékařem. Váš lékař rozhodne o plánu následných vyšetření.
Váš lékař může rozhodnout léčbu přípravkem Eylea ukončit, pokud bude zjištěno, že pokračující léčba pro Vás nemá přínos.
Pacienti s myopickou CNV budou léčeni jednou injekcí. Další injekce dostanete pouze v případě, že vyšetření provedená Vaším lékařem zjistí, že se Vaše onemocnění nezlepšilo.
Interval mezi injekcemi nemá být kratší než jeden měsíc.
Pokud Vaše onemocnění vymizí a pak se vrátí, Váš lékař může znovu zahájit léčbu.
Váš lékař rozhodne o plánu kontrolních vyšetření.
Pokud dojde k vynechání dávky přípravku Eylea
Domluvte si novou schůzku pro vyšetření a podání injekce.
Ukončení léčby přípravkem Eylea
Před ukončením léčby se poraďte s lékařem.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Mohou se objevit alergické reakce (hypersenzitivita). Tyto reakce mohou být závažné a může být nutné, abyste navštívil(a) ihned lékaře.
Při podávání přípravku Eylea se mohou objevit některé nežádoucí účinky postihující oči, které jsou důsledkem injekčního podání. Některé z těchto nežádoucích účinků mohou být závažné a zahrnují slepotu, těžkou infekci nebo zánět uvnitř oka (endoftalmitida), odchlípení, trhlinu nebo krvácení vrstvy citlivé na světlo v zadní části oka (odchlípení sítnice nebo trhlina), zakalení čočky (katarakta), krvácení v oku (krvácení do sklivce), odloučení gelové hmoty uvnitř oka od sítnice (odloučení sklivce) a zvýšení tlaku uvnitř oka, viz bod 2. Tyto závažné nežádoucí účinky postihující oči se vyskytly u méně než 1 z každých 1 900 injekcí v klinických studiích.
Jestliže u Vás dojde k náhlému zhoršení zraku nebo zhoršení bolesti a zarudnutí oka, okamžitě kontaktujte svého lékaře.
Seznam hlášených nežádoucích účinků
Dále je uveden seznam nežádoucích účinků hlášených jako pravděpodobně související s injekčním podáním nebo s léčivým přípravkem. Nebuďte, prosím, znepokojeni, žádné z nich se u Vás nemusí objevit. Vždy se poraďte se svým lékařem, pokud budete mít podezření na jakékoli nežádoucí účinky.
Velmi časté nežádoucí účinky (mohou se vyskytnout u více než 1 z 10 osob):
- zhoršení zraku
- překrvení oka způsobené krvácením z drobných cév ve vnějších vrstvách oka (krvácení do spojivek)
- bolest oka
Časté nežádoucí účinky (mohou postihnout až 1 z 10 osob):
- odchlípení nebo trhlina jedné z vrstev v zadní části oka mající za následek záblesky světla s vločkami, což může někdy vést ke ztrátě zraku (trhlina v pigmentovém epitelu sítnice*/odchlípení, odchlípení sítnice/trhlina
- degenerace sítnice (mající za následek poruchu zraku)
- krvácení v oku (krvácení do sklivce)
- určitá forma zakalení čočky (katarakta)
- poškození povrchu oční koule (rohovky)
- zvýšení tlaku v oku
- pohybující se skvrny v zorném poli (vločky)
- odchlípení gelovité hmoty uvnitř oka od sítnice (odchlípení sklivce, mající za následek záblesky světla s vločkami)
- pocit cizího tělesa v oku
- zvýšená tvorba slz
- otok očního víčka
- krvácení v místě vpichu injekce
- zarudnutí oka
* Onemocnění, o kterých je známo, že souvisí s VPMD; pozorované pouze u pacientů s vlhkou formou VPMD.
Méně časté nežádoucí účinky (mohou postihnout až 1 ze 100 osob):
- alergické reakce (hypersenzitivita)**
- těžký zánět nebo infekce uvnitř oka (endoftalmitida)
- zánět duhovky nebo jiných částí oka (iritida, uveitida, iridocyklitida, zarudnutí přední komory)
- neobvyklé pocity v oku
- podráždění očního víčka
- otok rohovky (otok přední vrstvy oční koule)
** Byly hlášeny alergické reakce, j ako j sou vyrážka, svědění, kopřivka a několik případů závažných alergických (anafylaktických/anafylaktoidních) reakcí.
Vzácné nežádoucí účinky (mohou postihnout až 1 z 1 000 pacientů)
- slepota
- zakalení čočky následkem poranění (traumatická katarakta),
- zánět gelovité hmoty uvnitř oka
- hnis v oku
V klinických studiích byl u pacientů s vlhkou formou VPMD, kteří užívali přípravky na ředění krve, zaznamenán zvýšený výskyt krvácení z malých krevních cév ve vnější vrstvě oka (krvácení do spojivek). Frekvence výskytu těchto příhod byla mezi pacienty, kteří byli léčeni ranibizumabem, a pacienty, kteří byli léčeni přípravkem Eylea, srovnatelná.
Používání systémových inhibitorů VEGF, látek podobných jako látce v přípravku Eylea, může souviset s rizikem krevních sraženin, které blokují krevní cévy (arteriálních tromboembolických příhod), které mohou vést k srdečnímu infarktu nebo cévní mozkové příhodě. Existuje teoretické riziko takových příhod po podání injekce přípravku Eylea do oka.
Jako u jiných terapeutických proteinů existuje možnost imunitní reakce (tvorba protilátek) u přípravku Eylea.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Eylea uchovávat
• Uchovávejte tento přípravek mimo dohled a dosah dětí.
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a štítku za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
• Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
• Před použitím může být neotevřený blistr uchováván při pokojové teplotě (do 25 °C) po dobu až 24 hodin.
• Uchovávejte blistr v krabičce, aby byl chráněn před světlem.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Eylea obsahuje
- Léčivou látkou je: afliberceptum. Jedna předplněná injekční stříkačka obsahuje extrahovatelný objem 90 mikrolitrů, to odpovídá 3,6 mg afliberceptu. Jedna předplněná injekční stříkačka poskytuje dávku 2 mg afliberceptu v 50 mikrolitrech.
- Dalšími složkami jsou: polysorbát 20, monohydrát dihydrogenfosforečnanu sodného (na úpravu pH), heptahydrát hydrogenfosforečnanu sodného (na úpravu pH), chlorid sodný, sacharóza, voda na injekci.
Jak přípravek Eylea vypadá a co obsahuje toto balení
Přípravek Eylea je injekční roztok (injekce) v předplněné injekční stříkačce (3,6 mg/90 mikrolitrů).
Roztok je čirý až světle žlutý.
Velikost balení 1.
Držitel rozhodnutí o registraci
Bayer Pharma AG
D-13342 Berlin
Německo
Výrobce
GP Grenzach Produktions GmbH
Emil-Barell-StraBe 7
D-79639 Grenzach-Wyhlen
Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Lietuva
UAB Bayer Tel: +370-5-233 68 68 Luxembourg / Luxemburg Bayer SA-NV
Tél /Tel: +32-(0)2-535 63 11 Magyarország Bayer Hungária KFT Tel: +36-1-487 4100 Malta
Alfred Gera and Sons Ltd. Tel: +356-21 44 62 05 Nederland Bayer B.V.
Tel: +31-(0)297-28 06 66 Norge
Bayer AS
Tlf: +47-23 13 05 00 Osterreich
Bayer Austria Ges. m. b. H. Tel: +43-(0)1 -711 460 Polska
Bayer Sp. z o.o.
Tel: +48-22-572 35 00
Portugal
Bayer Portugal, Lda.
Tel: +351-21-416 42 00
Románia
SC Bayer SRL
Tel: +40-(0)21-528 59 00
Slovenija
Bayer d. o. o.
Tel: +386-(0)1 -58 14 400 Slovenská republika
Bayer, spol. s r.o.
Tel: +421-(0)2-59 21 31 11 Suomi/Finland
Bayer Oy
Puh/Tel: +358-(0)20-78521
Sverige
Bayer AB
Tel: +46-(0)8-580 223 00 United Kingdom
Bayer plc
Tel: +44-(0)1635-563000
Belgie / Belgique / Belgien
Bayer SA-NV
Tél/Tel: +32-(0)2-535 63 11
BtnrapHH
Eaňep EtnrapHn EOOfl Ten: +359-(0)2-81 401 01 Česká republika Bayer s.r.o.
Tel: +420-266 101 111
Danmark
Bayer A/S
Tlf: +45-45 235 000
Deutschland
Bayer Vital GmbH
Tel: +49-(0)214-30 513 48
Eesti
Bayer OU
Tel: +372-655 85 65 EXláSa
Bayer ET^ág ABEE Tn^: +30-210-618 75 00 Espaňa
Bayer Hispania S.L.
Tel: +34-93-495 65 00 France
Bayer HealthCare
Tél (N° vert): +33-(0)800 87 54 54
Hrvatska
Bayer d.o.o.
Tel: + 385-(0)1-6599 900
Ireland
Bayer Limited
Tel: +353-(0)1-2999 313
Ísland
Icepharma hf.
Sími: +354-540 80 00 Italia
Bayer S.p.A.
Tel: +39-02-3978 1 Kúrcpog
NOVAGEM Limited Tn^: +357-22-48 38 58 Latvija SIA Bayer
Tel: +371-67 84 55 63
Tato příbalová informace byla naposledy revidována {MM/RRRR}
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Každá předplněná injekční stříkačka má být použita pouze na léčbu jednoho oka.
Neotvírejte sterilní předplněný blistr mimo čistou místnost určenou k aplikaci.
Před podáním je třeba roztok vizuálně zkontrolovat, zda nejsou přítomny jakékoli cizorodé částice
a/nebo zabarvení, případně změněn fyzikální vzhled. Pozorujete-li takové změny, léčivý přípravek
zlikvidujte.
Před použitím může být neotevřený blistr přípravku Eylea uchováván při pokojové teplotě (do 25°C)
po dobu až 24 hodin. Po otevření blistru pokračujte při aseptických podmínkách.
Pro injekci do sklivce by měla být použita injekční jehla 30 G x A.
Návod k použitípředplněné injekční stříkačky:
1. Až budete připraveni aplikovat přípravek Eylea, otevřete krabičku a vyjměte sterilní blistr. Opatrně otevřete blistr při zajištění sterility jeho obsahu. Nechte stříkačku ve sterilním zásobníku, dokud nejste připraveni k sestavení.
2. Pomocí aseptické techniky vyjměte stříkačku ze sterilního blistru.

3. K sejmutí víčka stříkačky, držte stříkačku jednou rukou a druhou ruku použijte pro uchopení víčka stříkačky pomocí palce a ukazováku. Pamatujte si, prosím: ulomte (neotáčejte nebo nevykrucujte) víčko stříkačky.
4. Pro zabránění ohrožení sterility přípravku nezatahujte zpět píst.

5. Pomocí aseptické techniky pevně nasaďte otočením injekční jehlu na Luer-lock hrot stříkačky.
6. Držte stříkačku s jehlou směřující nahoru a

zkontrolujte, zda v ní nej sou bubliny. Pokud j sou tam bubliny, jemně poklepejte na stříkačku prstem, až se bubliny dostanou do horní části.
7. Pro odstranění všech bublin a vytlačení přebytečného léčivého přípravku pomalu stlačte píst tak , aby byla cylindrická základna kupolovité zátky zarovnána s černou dávkovací čárkou na stříkačce (ekvivalent 50 mikrolitrů).


8. Předplněná stříkačka j e pouze na jedno použití.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Eylea 40 mg/ml injekční roztok v injekční lahvičce
Afliberceptum
'VTento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek podán, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Eylea a k čemu se používá
2. Čemu musíte věnovat pozornost, než Vám bude přípravek Eylea podán
3. Jak Vám bude přípravek Eylea podáván
4. Možné nežádoucí účinky
5. Jak přípravek Eylea uchovávat
6. Obsah balení a další informace
1. Co je přípravek Eylea a k čemu se používá
Přípravek Eylea je roztok, který se podává v injekci do oka pro léčbu onemocnění oka u dospělých označených jako
- neovaskulární (vlhká) forma věkem podmíněné makulární degenerace u dospělých (vlhká forma VPMD),
- porucha zraku způsobená makulárním edémem v důsledku uzávěru (okluze) sítnicové žíly (okluze větve sítnicové žíly (BRVO) nebo centrální sítnicové žíly (CRVO)),
- porucha zraku v důsledku diabetického makulárního edému (DME),
- porucha zraku v důsledku myopické chorioideální neovaskularizace (myopická CNV).
Aflibercept, léčivá látka přípravku Eylea, blokuje aktivitu skupiny faktorů, známých jako vaskulární endoteliální růstový faktor A (VEGF-A) a placentární růstový faktor (PlGF), které, pokud jsou u pacientů s vlhkou formou VPMD a myopickou CNV v nadbytku, se podílí na abnormální tvorbě nových krevních cév v oku. Tyto nové krevní cévy mohou způsobit únik složek krve do oka a následné poškození tkání v oku, které jsou důležité pro zrak.
U pacientů s CRVO dochází k blokádě hlavní cévy, která odvádí krev ze sítnice. Jako odpověď dochází ke zvýšení hladin VEGF, což způsobuje únik tekutiny do sítnice a tím otok žluté skvrny (makuly, část sítnice zodpovědné za ostré vidění), což se označuje jako makulární otok (edém). Když je žlutá skvrna oteklá, centrální vidění se stává rozmazané.
U pacientů s BRVO je jedna nebo více větví hlavní krevní cévy, která odvádí krev ze sítnice, blokovaná. Hladiny VEGF jsou následkem toho zvýšené, což způsobuje prosakování tekutiny do sítnice a tak makulární edém.
Diabetický makulární edém je otok sítnice, který se vyskytuje u pacientů s cukrovkou v důsledku prosakování tekutiny z cév v makule. Makula je část sítnice, která je zodpovědná za ostré vidění. Když se vytvoří otok v oblasti makuly, dojde k rozmazání centrálního vidění.
Bylo prokázáno, že přípravek Eylea zastavuje v oku růst nových abnormálních cév, které často krvácejí a uniká z nich tekutina. Přípravek Eylea pomáhá stabilizovat a v mnoha případech zlepšit ztrátu zraku u vlhké formy VPMD, CRVO, BRVO, DME a myopické CNV.
2. Čemu musíte věnovat pozornost, než Vám bude přípravek Eylea podán Přípravek Eylea Vám nebude podán:
- Jestliže jste alergický(á) na aflibercept nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
- Jestliže máte aktivní infekci v oku nebo kolem oka nebo existuje podezření na ni (okulární nebo periokulární infekce).
- Jestliže máte závažný zánět v oku (projevuje se jako bolest nebo zarudnutí).
Upozornění a opatření
Před podáním přípravku se poraďte se svým lékařem:
- Pokud máte glaukom (zelený zákal).
- Pokud se u Vás v minulosti objevily záblesky světla nebo pohybující se vločky v zorném poli a jestliže jste začali pozorovat zvýšení velikosti a počtu vloček.
- Pokud u Vás byl proveden nebo je plánován chirurgický výkon na oku během předchozích nebo následujících čtyř týdnů.
- Pokud máte závažnou formu CRVO nebo BRVO (ischemická CRVO nebo BRVO), léčba přípravkem Eylea se nedoporučuje.
Dále je důležité, abyste věděl(a), že
- bezpečnost a účinnost přípravku Eylea při podávání do obou očí zároveň nebyla hodnocena a tento způsob použití může vést ke zvýšenému riziku vzniku nežádoucích účinků,
- injekce přípravku Eylea může u některých pacientů způsobit zvýšení tlaku v oku (nitrooční tlak) během 60 minut od podání injekce. Toto bude Váš lékař po každé injekci sledovat,
- pokud u Vás dojde k rozvoji infekce nebo zánětu uvnitř oka (endoftalmitida) nebo jiné komplikace, objeví se bolest oka nebo zvýšený nepříjemný pocit v oku, zhoršující se zarudnutí oka, rozmazané nebo zhoršené vidění nebo zvýšená citlivost na světlo. Je důležité, aby byly tyto příznaky diagnostikovány a léčeny co možná nejdříve,
- Váš lékař zkontroluje, zda máte další rizikové faktory, které by mohly zvýšit riziko trhliny nebo odchlípení jedné z vrstev v zadní části oka (odchlípení sítnice nebo trhlina a odchlípení pigmentového epitelu sítnice nebo trhliny v něm), v takovém případě musí být přípravek Eylea podáván s opatrností,
- přípravek Eylea nemá být použit během těhotenství, pokud potenciální přínos nepřeváží možné riziko pro nenarozené dítě,
- ženy, které mohou otěhotnět, musí během léčby a minimálně tři měsíce po poslední injekci přípravku Eylea do sklivce používat účinnou antikoncepci.
Systémové použití inhibitorů VEGF, látek podobných těm, které jsou obsaženy v přípravku Eylea, může souviset s rizikem tvorby krevních sraženin, které blokují krevní cévy, což může vést k srdečnímu infarktu nebo mrtvici. Po injekci přípravku Eylea existuje teoretické riziko takových příhod. K dispozici jsou omezené údaje o bezpečnosti léčby pacientů s CRVO, BRVO, DME a myopickou CNV, kteří prodělali cévní mozkovou příhodu, tranzitorní ischemickou ataku nebo srdeční záchvat během posledních 6 měsíců. Pokud se Vás jakýkoli z těchto stavů týká, bude přípravek Eylea podáván s opatrností.
K dispozici jsou pouze omezené zkoušenosti s léčbou
- pacientů s DME v důsledku diabetu (cukrovky) 1. typu,
- diabetiků s velmi vysokými průměrnými hladinami krevního cukru (HbA1c nad 12 %),
- diabetiků s onemocněním oka způsobeným cukrovkou, které se označuje jako proliferativní diabetická retinopatie.
K dispozici nejsou žádné zkušenosti s léčbou
- pacientů s akutními infekcemi,
- pacientů s dalšími onemocněními oka, jako je odchlípení sítnice nebo makulární díra,
- diabetiků s nekontrolovaným vysokým krevním tlakem,
- pacientů jiné než asijské rasy s myopickou CNV,
- pacientů dříve léčených pro myopickou CNV,
- pacientů s poškozením mimo centrální část makuly (extrafoveolární léze) v důsledku myopické CNV.
Pokud se Vás cokoli z výše uvedného týká, zváží Váš lékař tento nedostatek informací během Vaší léčby přípravkem Eylea.
Děti a dospívající
Použití přípravku Eylea u dětí a dospívajících mladších 18 let nebylo hodnoceno, protože vlhká forma VPMD, CRVO, BRVO, DME a myopická CNV se vyskytuje hlavně u dospělých. Proto není jeho použití u této věkové skupiny relevantní.
Další léčivé přípravky a Eylea
Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Těhotenství a kojení
- Ženy, které mohou otěhotnět, musí během léčby a minimálně tři měsíce po poslední injekci přípravku Eylea do sklivce používat účinnou antikoncepci.
- Nejsou žádné zkušenosti s použitím přípravku Eylea u těhotných žen. Přípravek Eylea nemá být používán během těhotenství, pokud potenciální přínos nepřeváží možné riziko pro nenarozené dítě. Pokud jste těhotná nebo plánujete těhotenství, poraďte se se svým lékařem před léčbou přípravkem Eylea.
- Používání přípravku Eylea se během kojení nedoporučuje, protože není známo, zda se do mateřského mléka vylučuje. Před zahájením léčby přípravkem Eylea se poraďte se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Po aplikaci injekce přípravku Eylea se u Vás mohou dočasně objevit poruchy zraku. Neřiďte vozidla a neobsluhujte stroje, dokud tyto poruchy přetrvávají.
Důležité informace o některých složkách přípravku Eylea
Tento přípravek obsahuje méně než 1 mmol (23 mg) sodíku v jedné dávce, tj. v podstatě je „bez sodíku“.
3. Jak Vám bude přípravek Eylea podáván
Lékař se zkušeností s aplikací injekcí do oka Vám bude podávat přípravek Eylea do oka za aseptických (čistých a sterilních) podmínek.
Doporučená dávka přípravku je 2 mg afliberceptu (50 mikrolitrů).
Přípravek Eylea se podává jako injekce do oka (injekce do sklivce).
Před aplikací injekce Váš lékař použije dezinfekční prostředek pro důkladné očištění oka, aby zabránil infekci. Váš lékař Vám také podá lokální anestetikum pro snížení nebo zabránění bolesti, kterou můžete pociťovat během podávání injekce.
Pacientům s vlhkou formou VPMD bude podána jedna injekce měsíčně, ve třech po sobě jdoucích dávkách, následně se podává jedna injekce každé dva měsíce.
Po prvních 12 měsících léčby přípravkem Eylea může být na základě lékařského vyšetření léčebný interval prodloužen.
Jestliže nebudete mít potíže nebo Vám lékař nedá jiné pokyny, není třeba, abyste lékaře mezi podáním injekcí navštěvovali.
Makulární edém v důsledku okluze retinální žíly (BRVO nebo CRVO)
Lékař stanoví léčebný plán, který pro Vás bude nejvhodnější. Léčbu zahájíte sérií injekcí přípravku Eylea podávaných jednou měsíčně.
Interval mezi dvěma injekcemi by neměl být kratší než jeden měsíc.
Váš lékař může léčbu přípravkem Eylea ukončit, pokud pokračující léčba pro Vás nemá přínos.
Vaše léčba bude pokračovat injekcemi podávanými jednou měsíčně, dokud nebude Váš stav považován za stabilní. Mohou být zapotřebí tři nebo více injekce aplikované jednou měsíčně.
Váš lékař bude sledovat Vaši odpověď na léčbu a může pokračovat v léčbě postupným prodlužováním intervalu mezi injekcemi, dokud nebude dosažen stabilní stav. Pokud se Váš stav během léčby s prodlouženým léčebným intervalem začne zhoršovat, Váš lékař odpovídajícím způsobem intervaly zkrátí.
Na základě Vaší odpovědi na léčbu Váš lékař rozhodne o plánu následných vyšetření a léčbě.
Jestliže se Váš stav po prvních třech měsících léčby nezlepší, lékař může léčbu přípravkem Eylea ukončit.
Pokud lékař bude považovat Váš stav za stabilní po dobu tří měsíců léčby, léčba může být ukončena.
V případě nutnosti mohou být intervaly mezi injekcemi prodlouženy na dobu delší než jeden měsíc. Pokud se Váš stav začne po přerušení léčby zhoršovat, může být léčba znovu zahájena.
Obvykle Vás lékař vyšetří během návštěvy, kdy je Vám aplikována injekce. Pokud jsou léčebné intervaly delší než jeden měsíc, lékař může rozhodnout, že Vás bude vyšetřovat častěji. Pak se budete muset objednat na další návštěvy, abyste mohl být lékařem vyšetřen mezi aplikacemi injekcí.
Diabetický makulární edém (DME)
Pacienti s DME budou léčeni jednou injekcí měsíčně po dobu prvních pěti po sobě jdoucích dávek a poté s následným podáváním jedné injekce každé dva měsíce.
Pokud se u Vás neobjeví žádné problémy nebo nedostanete jinou radu od svého lékaře, není nutné navštěvovat lékaře v době mezi injekcemi.
Po prvních 12 měsících léčby přípravkem Eylea může být léčebný interval prodloužen podle vyšetření provedeného Vaším lékařem. Váš lékař rozhodne o plánu následných vyšetření.
Váš lékař může rozhodnout léčbu přípravkem Eylea ukončit, pokud bude zjištěno, že pokračující léčba pro Vás nemá přínos.
Pacienti s myopickou CNV budou léčeni jednou injekcí. Další injekce dostanete pouze v případě, že vyšetření provedená Vaším lékařem zjistí, že se Vaše onemocnění nezlepšilo.
Interval mezi injekcemi nemá být kratší než jeden měsíc.
Pokud Vaše onemocnění vymizí a pak se vrátí, Váš lékař může znovu zahájit léčbu.
Váš lékař rozhodne o plánu kontrolních vyšetření.
Pokud dojde k vynechání dávky přípravku Eylea
Domluvte si novou schůzku pro vyšetření a podání injekce.
Ukončení léčby přípravkem Eylea
Před ukončením léčby se poraďte s lékařem.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Mohou se objevit alergické reakce (hypersenzitivita). Tyto reakce mohou být závažné a může být nutné, abyste navštívil(a) ihned lékaře.
Při podávání přípravku Eylea se mohou objevit některé nežádoucí účinky postihující oči, které jsou důsledkem injekčního podání. Některé z těchto nežádoucích účinků mohou být závažné a zahrnují slepotu, těžkou infekci nebo zánět uvnitř oka (endoftalmitida), odchlípení, trhlinu nebo krvácení vrstvy citlivé na světlo v zadní části oka (odchlípení sítnice nebo trhlina), zakalení čočky (katarakta), krvácení v oku (krvácení do sklivce), odloučení gelové hmoty uvnitř oka od sítnice (odloučení sklivce) a zvýšení tlaku uvnitř oka, viz bod 2. Tyto závažné nežádoucí účinky postihující oči se vyskytly u méně než 1 z každých 1 900 injekcí v klinických studiích.
Jestliže u Vás dojde k náhlému zhoršení zraku nebo zhoršení bolesti a zarudnutí oka, okamžitě kontaktujte svého lékaře.
Seznam hlášených nežádoucích účinků
Dále je uveden seznam nežádoucích účinků hlášených jako pravděpodobně související s injekčním podáním nebo s léčivým přípravkem. Nebuďte, prosím, znepokojeni, žádné z nich se u Vás nemusí objevit. Vždy se poraďte se svým lékařem, pokud budete mít podezření na jakékoli nežádoucí účinky.
Velmi časté nežádoucí účinky (mohou se vyskytnout u více než 1 z 10 osob):
• zhoršení zraku
• překrvení oka, způsobené krvácením z drobných cév ve vněj ších vrstvách oka (krvácení do spojivek)
• bolest oka
Časté nežádoucí účinky (mohou postihnout až 1 z 10 osob):
• odchlípení nebo trhlina jedné z vrstev v zadní části oka mající za následek záblesky světla s vločkami, což může někdy vést ke ztrátě zraku (trhlina v pigmentovém epitelu sítnice*/ odchlípení, odchlípení sítnice/trhlina)
• degenerace sítnice (mající za následek poruchu zraku)
• krvácení v oku (krvácení do sklivce)
• určitá forma zakalení čočky (katarakta)
• poškození povrchu oční koule (rohovky)
• zvýšení tlaku v oku
• pohybující se skvrny v zorném poli (vločky)
• odchlípení gelovité hmoty uvnitř oka od sítnice (odchlípení sklivce, mající za následek záblesky světla s vločkami)
• pocit cizího tělesa v oku
• zvýšená tvorba slz
• otok očního víčka
• krvácení v místě vpichu injekce
• zarudnutí oka
• Onemocnění, o kterých je známo, že souvisí s VPMD; pozorované pouze u pacientů s vlhkou formou VPMD.
Méně časté nežádoucí účinky (mohou postihnout až 1 ze 100 osob):
• alergické reakce (hypersenzitivita)**
• těžký zánět nebo infekce uvnitř oka (endoftalmitida)
• zánět duhovky nebo jiných částí oka (iritida, uveitida, iridocyklitida, zarudnutí přední komory)
• neobvyklé pocity v oku
• podráždění očního víčka
• otok rohovky (otok přední vrstvy oční koule)
** Byly hlášeny alergické reakce, jako jsou vyrážka, svědění, kopřivka a několik případů závažných alergických (anafylaktických/anafylaktoidních) reakcí.
Vzácné nežádoucí účinky (mohou postihnout až 1 z 1 000 pacientů)
• slepota
• zakalení čočky následkem poranění (traumatická katarakta)
• zánět gelovité hmoty uvnitř oka
• hnis v oku
V klinických studiích byl u pacientů s vlhkou formou VPMD, kteří užívali přípravky na ředění krve, zaznamenán zvýšený výskyt krvácení z malých krevních cév ve vnější vrstvě oka (krvácení do spojivek). Frekvence výskytu těchto příhod byla mezi pacienty, kteří byli léčeni ranibizumabem, a pacienty, kteří byli léčeni přípravkem Eylea, srovnatelná.
Používání systémových inhibitorů VEGF, látek podobných jako látce v přípravku Eylea, může souviset s rizikem krevních sraženin, které blokují krevní cévy (arteriálních tromboembolických příhod), které mohou vést k srdečnímu infarktu nebo cévní mozkové příhodě. Existuje teoretické riziko takových příhod po podání injekce přípravku Eylea do oka.
Jako u jiných terapeutických proteinů existuje možnost imunitní reakce (tvorba protilátek) u přípravku Eylea.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Eylea uchovávat
• Uchovávejte tento přípravek mimo dohled a dosah dětí.
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a štítku za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
• Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
• Před použitím může být neotevřená injekční lahvička uchovávána při pokojové teplotě (do 25 °C) po dobu až 24 hodin.
• Uchovávejte injekční lahvičku v krabičce, aby byla chráněna před světlem.
• Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu.
Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Eylea obsahuje
- Léčivou látkou je: afliberceptum. Jedna injekční lahvička obsahuje 100 mikrolitrů, to odpovídá 4 mg afliberceptu. Jedna injekční lahvička poskytuje dávku 2 mg afliberceptu v 50 mikrolitrech
- Dalšími složkami jsou: polysorbát 20, monohydrát dihydrogenfosforečnanu sodného (na úpravu pH), heptahydrát hydrogenfosforečnanu sodného (na úpravu pH), chlorid sodný, sacharóza, voda na injekci.
Jak přípravek Eylea vypadá a co obsahuje toto balení
Přípravek Eylea je injekční roztok (injekce) v injekční lahvičce (4 mg/100 mikrolitrů). Roztok je bezbarvý až světle žlutý.
Velikost balení 1.
Držitel rozhodnutí o registraci
Bayer Pharma AG D-13342 Berlin Německo
Výrobce
Bayer Pharma AG MullerstraBe 178 D-13353 Berlin Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Lietuva
UAB Bayer Tel: +370-5-233 68 68 Luxembourg / Luxemburg Bayer SA-NV
Tél /Tel: +32-(0)2-535 63 11 Magyarország Bayer Hungária KFT Tel: +36-1-487 4100 Malta
Alfred Gera and Sons Ltd. Tel: +356-21 44 62 05 Nederland Bayer B.V.
Tel: +31-(0)297-28 06 66 Norge
Bayer AS
Tlf: +47-23 13 05 00 Osterreich
Bayer Austria Ges. m. b. H. Tel: +43-(0)1 -711 460 Polska
Bayer Sp. z o.o.
Tel: +48-22-572 35 00
Portugal
Bayer Portugal, Lda.
Tel: +351-21-416 42 00
Románia
SC Bayer SRL
Tel: +40-(0)21-528 59 00
Slovenija
Bayer d. o. o.
Tel: +386-(0)1 -58 14 400 Slovenská republika
Bayer, spol. s r.o.
Tel: +421-(0)2-59 21 31 11 Suomi/Finland
Bayer Oy
Puh/Tel: +358-(0)20-78521
Sverige
Bayer AB
Tel: +46-(0)8-580 223 00 United Kingdom
Bayer plc
Tel: +44-(0)1635-563000
Belgie / Belgique / Belgien
Bayer SA-NV
Tél/Tel: +32-(0)2-535 63 11
Btarapna
Eaňep EtnrapHn EOOfl Ten: +359-(0)2-81 401 01 Česká republika Bayer s.r.o.
Tel: +420-266 101 111
Danmark
Bayer A/S
Tlf: +45-45 235 000
Deutschland
Bayer Vital GmbH
Tel: +49-(0)214-30 513 48
Eesti
Bayer OU
Tel: +372-655 85 65 EXláSa
Bayer ET^ág ABEE Tn^: +30-210-618 75 00 Espaňa
Bayer Hispania S.L.
Tel: +34-93-495 65 00 France
Bayer HealthCare
Tél (N° vert): +33-(0)800 87 54 54
Hrvatska
Bayer d.o.o.
Tel: + 385-(0)1-6599 900
Ireland
Bayer Limited
Tel: +353-(0)1-2999 313
Ísland
Icepharma hf.
Sími: +354-540 80 00 Italia
Bayer S.p.A.
Tel: +39-02-3978 1 Kúnpoq
NOVAGEM Limited Tn^: +357-22-48 38 58 Latvija SIA Bayer
Tel: +371-67 84 55 63
Tato příbalová informace byla naposledy revidována {MM/RRRR}
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Každá injekční lahvička má být použita pouze na léčbu jednoho oka.
Před podáním je třeba roztok vizuálně zkontrolovat, zda nejsou přítomny jakékoli cizorodé částice a/nebo zabarvení, případně změněn fyzikální vzhled. Pozorujete-li takové změny, léčivý přípravek zlikvidujte.
Před použitím může být neotevřená lahvička přípravku Eylea uchovávána při pokojové teplotě (do 25°C) po dobu až 24 hodin. Po otevření lahvičky pokračujte při aseptických podmínkách.
Pro injekci do sklivce by měla být použita injekční jehla 30 G x palce.
Návod k použití injekční lahvičky:


1. Sejměte plastové víčko a dezinfikujte vněj ší část pryžové zátky lahvičky.
2.
Nasaďte 18 G jehlu s filtrem o velikosti 5 mikronů dodávanou v balení na sterilní Luer-lock 1ml stříkačku.
3. Zasuňte jehlu s filtrem do středu zátky lahvičky, tak aby byla jehla zasunuta do lahvičky celá a hrotem se dotýkala dna nebo okraje dna lahvičky.
4. Pomocí aseptické techniky natáhněte celý obsah lahvičky s přípravkem Eylea do stříkačky a držte přitom lahvičku ve svislé poloze mírně nakloněnou pro usnadnění úplného nasátí. Abyste zabránily natáhnutí vzduchu, zajistěte, aby byl zkosený hrot jehly s filtrem ponořen v tekutině. Během plnění stříkačky udržujte lahvičku nakloněnou tak, aby byl zkosený hrot jehly ponořený v tekutině.




5. Ujistěte se, že plunžrový píst je při vyprazdňování lahvičky vytažen dostatečně daleko tak, aby jehla s filtrem byla úplně vyprázdněna.
6. Sejměte jehlu s filtrem a správně ji zlikvidujte.
Pozn.: Jehla s filtrem není určena pro aplikaci do sklivce.
7. Při dodržení aseptické techniky pevně otáčením nasaďte 30 G x palcovou injekční jehlu na hrot Luer-lock stříkačky.
8. Držte stříkačku s jehlou směřující nahoru, zkontrolujte, zda nejsou v stříkačce bubliny. Pokud jsou v ní bubliny, jemně na stříkačku poklepejte prstem, dokud se bubliny nedostanou nahoru.
9. Odstraňte všechny bubliny a vytlačte přebytečný léčivý přípravek pomalým stlačením plunžrového pístu tak, že hrot plunžrového pístu bude zarovnán s čárkou, která označuje 0,05 ml na stříkačce.


10. Inj ekční lahvička j e určena pouze pro j ednou použití.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
PŘÍLOHA IV
VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZMĚNY V REGISTRACI
Vědecké závěry
S ohledem na hodnotící zprávu výboru PRAC týkající se periodických zpráv o bezpečnosti (PSUR) afliberceptu (v indikaci pro vlhkou formu VPMD a CRVO) dospěl výbor CHMP k těmto vědeckým závěrům:
Během postmarketingového období byly hlášeny případy hypersenzitivních reakcí včetně vyrážky, svědění, kopřivky a izolovaných případů závažných anafylaktických/anafylaktoidních reakcí. Popsané případy zahrnovaly pozitivní rechallenge, přímou časovou souvislost s podáním afliberceptu a nedostatek alternativních vysvětlení. Na základě těchto údajů během postmarketingového období výbor PRAC potvrdil, že existuje příčinná souvislost mezi afliberceptem a výše zmíněnými hypersenzitivními reakcemi. Na základě dostupných údajů o afliberceptu v rámci hodnocení PSUR výbor PRAC považuje za důvodné změnit informace o přípravku léčivých přípravků obsahujících aflibercept.
Výbor CHMP souhlasí s vědeckými závěry výboru PRAC.
Zdůvodnění změny v registraci
Na základě vědeckých závěrů týkajících se afliberceptu (v indikaci pro vlhkou formu VPMD a CRVO) zastává CHMP stanovisko, že poměr přínosů a rizik léčivého přípravku/léčivých přípravků s obsahem afliberceptu (v indikaci pro vlhkou formu VPMD a CRVO) zůstává nezměněný, a to pod podmínkou, že v informacích o přípravku budou provedeny navrhované změny.
Výbor CHMP doporučuje změnu v registraci.
96
Bezpečnost a účinnost léčby přípravkem Eylea podávaným do obou očí současně nebyla studována z hlediska systémové expozice (viz bod 5.1). Současně prováděná bilaterální léčba může vést ke zvýšené systémové expozici, která může zvýšit riziko systémových nežádoucích účinků.
• Souběžné použití jiných anti-VEGF (vaskulární endoteliální růstové faktory)
K dispozici nejsou žádné údaje týkající se souběžného použití přípravku Eylea a jiných anti-VEGF léčivých přípravků (systémových nebo očních).
• Rizikové faktory spojené s vývojem trhliny pigmentového epitelu sítnice po podání anti-VEGF léčby u vlhké formy VPMD zahrnují rozsáhlé a/nebo značné odchlípení pigmentového epitelu sítnice. U pacientů s těmito rizikovými faktory pro vznik trhlin pigmentového epitelu sítnice je třeba zahajovat léčbu přípravkem Eylea s opatrností.
• Léčba by měla být vysazena u pacientů s rhegmatogenním odchlípením sítnice nebo u makulárních otvorů stupně 3 nebo 4.
• Při výskytu retinální trhliny je třeba dávku vynechat a léčba by neměla být obnovena, dokud se trhlina adekvátně nezhojí.
• V následujících případech se musí dávka vynechat a v plánované léčbě se nesmí pokračovat:
■ při poklesu nejlépe korigované ostrosti zraku (Best Corrected Visual Acuity, BCVA) o
>30 písmen oproti předchozímu stanovení ostrosti zraku;
■ při výskytu subretinálního krvácení, zahrnujícího střed fovey nebo když je velikost
hemoragie > 50% celkové plochy léze;
Endoftalmitida s pozitivním nebo negativním výsledkem kultivace.
Během postmarketingového období, případy hypersenzitivity včetně vyrážky, svědění, kopřivky a izolované případy anafylaktických/anafylaktoidních reakcí
BCVA: Nejlepší korigovaná zraková ostrost.
ETDRS: Studie Early Treatment Diabetic Retinopathy.
LS: Průměry nejmenších čtverců odvozené od ANCOVA.
PPS: Per Protocol Set
Soubor pro plnou analýzu (FAS), metoda extrapolace posledních získaných údajů (Last Observation Carried Forward, LOCF) pro všechny analýzy kromě podílu pacientů s udrženou zrakovou ostrostí v týdnu 52, což je PPS.
Rozdíl je hodnota ve skupině přípravku Eylea minus hodnota ve skupině ranibizumabu. Pozitivní hodnoty j sou ve prospěch přípravku Eylea.
Interval spolehlivosti (CI) vypočtený normálním odhadem.
Po zahájení léčby s dávkou po třech měsících.
Interval spolehlivosti ležící celý nad -10 % ukazuje non-inferioritu přípravku Eylea proti ranibizumabu.
Rozdíl u přípravku Eylea 2 mg Q4 mínus kontrola
Rozdíl a interval spolehlivosti (CI) j sou vypočteny pomocí Cochran-Mantel-Haenszelova (CMH) testu upraveného na region (Amerika vs zbytek světa pro studii COPERNICUS a Evropa vs Asie/Pacifik pro studii GALILEO) a výchozí kategorii BCVA (>20/200 a <20/200)
BCVA: Nejlépe korigovaná zraková ostrost ETDRS: Studie Early Treatment Diabetic Retinopathy LOCF: Poslední získané údaje
SD: Standardní odchylka
LS: Průměry minimálních čtverců odvozených z modelu ANCOVA
LS průměrný rozdíl a interval spolehlivosti na základě modelu ANCOVA s faktory léčebné skupiny, regionu (Amerika vs zbytek světa pro studii COPERNICUS a Evropa vs Asie/Pacifik pro studii GALILEO) a výchozí kategorie BCVA (>20/200 a <20/200)
Ve studii COPERNICUS dostávala kontrolní skupina pacientů přípravek Eylea podle potřeby každé 4 týdny během týdne 24 až týdne 52; pacienti měli návštěvy každé 4 týdny
Ve studii COPERNICUS dostávali jak pacienti v kontrolní skupině tak pacienti ve skupině přípravku Eylea 2 mg přípravek Eylea 2 mg podle potřeby každé 4 týdny od týdne 52 do týdne 96; pacienti měli povinné čtvrtletní návštěvy, ale mohli mít návštěvy každé 4 týdny, podle potřeby
Rozdíl a 95% interval spolehlivosti (CI) jsou vypočteny pomocí Mantel-Haenszelova váženého schématu upraveného na region (Severní Amerika vs Japonsko) a výchozí kategorii BCVA (>20/200 a <20/200)
LS průměrný rozdíl a 95% interval spolehlivosti na základě modelu ANCOVA s léčebnou skupinou, výchozí kategorií BCVA (>20/200 a <20/200) a regionem (Severní Amerika vs Japonsko) jako fixními účinky a výchozí BCVA jako kovariát
Od týdne 24 byl léčebný interval ve skupině s přípravkem Eylea prodloužen pro všechny subjekty ze 4 týdnů na 8 týdnů do týdne 48.
Na počátku týdne 24 mohly subjekty ve skupině léčené laserem obdržet záchrannou léčbu přípravkem Eylea, pokud splňovaly alespoň jedno předem specifikované kritérium zařaditelnosti. Celkem 67 subjektů v této skupině obdrželo přípravek Eylea jako záchrannou léčbu. Fixní režim pro přípravek Eylea jako záchrannou léčbu byl tři krát Eylea 2 mg každé 4 týdny následované injekcemi každých 8 týdnů.
Nominální p-hodnota
BCVA: Nejlépe korigovaná zraková ostrost ETDRS: Studie Early Treatment Diabetic Retinopathy SD: standardní odchylka
LS: Průměry minimálních čtverců odvozených z modelu ANCOVA
CI: Interval spolehlivosti
Průměr minimálních čtverců a 95 % CI na základě modelu ANCOVA s léčebnou skupinou a zemí (označení země) jako fixními účinky a výchozí BCVA jako kovariátou.
Rozdíl a 95 % CI jsou vypočteny pomocí Cochran-Mantel-Haenszel (CMH) schématu upraveného podle země (označení země)
BCVA: Nejlepší korigovaná zraková ostrost.
ETDRS: Studie Early Treatment Diabetic Retinopathy.
LS: Průměry nejmenších čtverců odvozené od ANCOVA.
PPS: Per Protocol Set
Soubor pro plnou analýzu (FAS), metoda extrapolace posledních získaných údajů (Last Observation Carried Forward, LOCF) pro všechny analýzy kromě podílu pacientů s udrženou zrakovou ostrostí v týdnu 52, což je PPS.
Po zahájení léčby s dávkou po třech měsících.
Interval spolehlivosti ležící celý nad -10 % ukazuje non-inferioritu přípravku Eylea proti ranibizumabu.
C )Rozdíl je hodnota ve skupině přípravku Eylea minus hodnota ve skupině ranibizumabu. Pozitivní hodnoty jsou ve prospěch přípravku Eylea.
Interval spolehlivosti (CI) vypočtený normálním odhadem.