Equilis Strepe
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Equilis StrepE lyofilizát a rozpouštědlo pro přípravu injekční suspenze pro koně
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
V jedné dávce 0,2 ml vakcíny:
Léčivá látka:
Živý deletovaný mutant Streptococcus equi kmen TW928 109,0 až 109,4 cfu1 1 kolonie tvořící jednotky Pomocné látky:
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Lyofilizát a rozpouštědlo pro přípravu injekční suspenze
Lyofilizát: špinavě bílá nebo krémově zbarvená peleta. Rozpouštědlo: čirý bezbarvý roztok
4. KLINICKÉ ÚDAJE
4.1 Cílové druhy zvířat
Koně
4.2 Indikace s upřesněním pro cílový druh zvířat
K imunizaci koní proti Streptococcus equi za účelem snížení klinických příznaků a výskytu abscesů mízních uzlin.
Nástup imunity: 2 týdny po základní vakcinaci.
Trvání imunity: do 3 měsíců.
Vakcína je určená pro koně, u kterých bylo jasně identifikováno riziko infekce zárodkem Streptococcus equi kvůli kontaktu s koňmi z prostor, u nichž je známa přítomnost tohoto patogenu, např. stáje s koňmi, kteří cestují na výstavy a/nebo závody v takových oblastech, nebo stáje, které obdrží nebo mají koně v ošetřování z takových oblastí.
4.3 Kontraindikace
Nejsou.
4.4 Zvláštní upozornění
Šíření vakcinačního kmene z místa injekce lze pozorovat po dobu čtyř dnů po vakcinaci.
Z literatury je známo, že u velmi nízkého počtu koní se může vyvinout purpura haemorrhagica, pokud jsou vakcinováni krátce po infekci. Purpura haemorrhagica nebyla pozorována v žádné studii bezpečnosti provedené během vývoje Equilis StrepE. Ačkoliv výskyt purpura haemorrhagica je velmi nízký, její výskyt nelze úplně vyloučit.
V čelenžních studiích provedených firmou Intervet byla zaznamenána nedostatečná chráněnost u přibližně jedné čtvrtiny koní vakcinovaných doporučenou dávkou.
Během jednoho týdne po vakcinaci nepodávejte antibiotika.
Vakcinační kmen je citlivý na peniciliny, tetracykliny, makrolidy a linkomycin.
Vakcinační kmen je rezistentní k aminoglykosidům, sulfonamidům, flumechinu a kombinacím trimetoprim-sulfo.
4.5 Zvláštní opatření pro použití
Zvláštní opatření pro použití u zvířat Vakcinovat lze pouze zdravé koně.
Zajistěte, aby lyofilizát byl před použitím úplně rozpuštěný.
Základní vakcinace provedená během vzplanutí onemocnění není účinná, protože imunita je až do úplného dokončení základní vakcinace nedostatečná.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům Pro uživatele:
Tento přípravek obsahuje živý bakteriální deletovaný mutant s omezeným potenciálem růstu na savčích tkáních. Náhodná injekce/náhodné sebepoškození injekčně aplikovaným přípravkem může způsobit zánětlivou reakci se silnou bolestivostí a otokem. Zvláštní pozornost musí být věnována při spojování aplikátoru a jehly, aby se zabránilo poranění píchnutím jehly. V případě náhodného sebepoškození injekčně aplikovaným přípravkem vyhledejte ihned lékařskou pomoc, i když bylo injikováno pouze malé množství přípravku a ukažte příbalovou informaci nebo etiketu praktickému lékaři.
Pro lékaře:
Tento přípravek obsahuje živý vakcinační kmen Streptococcus equi s oslabenou virulencí, auxotropní deletovaný mutant. Bakteriální složka tohoto přípravku může po náhodné injekci způsobit zánětlivou reakci se silným a bolestivým otokem.
Protizánětlivá léčba je indikována, i když bylo injekčně aplikované pouze malé množství přípravku.
Z bezpečnostních důvodů je třeba zvážit doplňující antibiotickou léčbu. Citlivost vakcinačního kmene k antibiotikům je zmíněna výše (viz bod 4.4).
4.6 Nežádoucí účinky (frekvence a závažnost)
Během 4 hodin po vakcinaci se v místě aplikace vyvine reakce ve formě difuzního zduření, které může být teplé a bolestivé. Tato reakce dosahuje maxima 2-3 dny po vakcinaci a maximální velikosti 3 cm krát 8 cm. Toto zduření úplně vymizí během 3 týdnů a obvykle nemá žádný vliv na chuť k příjmu krmiva vakcinovaných zvířat a nezpůsobuje žádné zřejmé nepohodlí. Vakcinační zárodek může lokálně v místě aplikace indukovat malý hnisavý zánět, který vede k narušení překrývající sliznice pysku a následnému výtoku tekutiny a zánětlivých buněk. 3-4 dny po vakcinaci často dochází k mírně zakalenému výtoku z místa submukosálního podání.
Několik dnů po vakcinaci se může vyskytnout mírné zvětšení retrofaryngeálních a mandibulámích mízních uzlin, které může být přechodně bolestivé. Ve velmi vzácných případech se může v místě aplikace nebo v regionálních mízních uzlinách vytvořit absces.
Dále se může v den vakcinace vyskytnout zvýšení rektální teploty až o 2°C. Ve vzácných případech lze pozorovat nechutenství, svalový třes, a horečku. Ve velmi vzácných případech se může vyvinout skleslost.
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
- velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
4.7 Použití v průběhu březosti, laktace nebo snášky
Nepoužívat u březích nebo laktujících klisen.
4.8 Interakce s dalšími léčivými přípravky a další formy interakce
Nejsou dostupné informace o bezpečnosti a účinnosti této vakcíny, pokud je podávána zároveň s jiným veterinárním léčivým přípravkem. Rozhodnutí o použití této vakcíny před nebo po jakémkoliv jiném veterinárním léčivém přípravku musí být provedeno na základě zvážení jednotlivých případů.
4.9 Podávané množství a způsob podání
Submukosální vakcinace s 0,2 ml rozpuštěného přípravku.
Vakcinační schéma:
Základní vakcinace: koně od 4 měsíců věku dostanou dvě vakcinace jednou dávkou v intervalu 4 týdnů.
Revakcinace
Revakcinace pro udržení imunity každé tři měsíce.
Primární odezva se udržuje po dobu až šesti měsíců po základní vakcinaci. Proto je pro obnovení imunity potřeba pouze jediná dávka vakcíny.
Doporučuje se vakcinovat všechny společně ustájené koně.
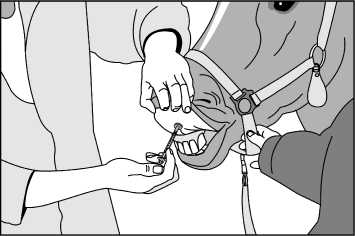
Nechejte sterilní rozpouštědlo dosáhnout pokojové teploty (15-25°C). Asepticky rozpusťte lyofilizát pomocí 0,3 ml dodaného sterilního rozpouštědla. Po přidání rozpouštědla počkejte 1 minutu a poté kroužením pečlivě promíchejte obsah. NETREPEJTE. Natáhněte 0,2 ml rozpuštěné vakcíny do dodané stříkačky (viz Obrázek 1) a nasaďte aplikátor na jehlu (viz Obrázek 2). Fixujte hlavu zvířete, zvedněte horní pysk a zasuňte jehlu do vnitřní strany horního pysku, až se aplikátor opře o pysk. Aplikujte celý obsah stříkačky do vnitřní strany horního pysku (viz Obrázek 3).
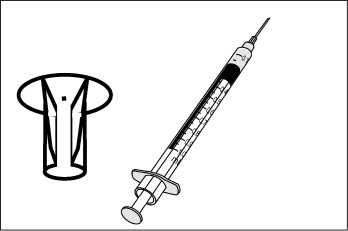
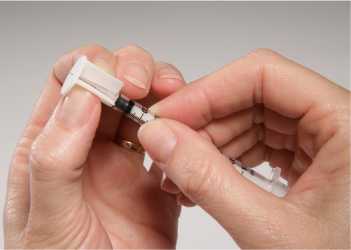
Obrázek 2
Obrázek 3
4.10 Předávkování (symptomy, první pomoc, antidota), pokud je to nutné
Mimo klinické příznaky zmíněné v bodě 4.6 vakcinace desetinásobkem doporučené dávky může indukovat absces v jedné ze submadibulárních mízních uzlin. Z abscesů vytéká hnisavá hmota po 2 týdnech po vakcinaci, ale poté vyzdraví bez intervence během jednoho měsíce. Dále se může v den vakcinace vyskytnout zvýšení rektální teploty až o 2,5°C. Příležitostně lze pozorovat jeden den po vakcinaci mírnou apatii.
4.11 Ochranné lhůty
Bez ochranných lhůt.
5. IMUNOLOGICKÉ VLASTNOSTI
Farmakoterapeutická skupina: imunologika pro koňovité, živá bakteriální vakcína ATC vet kód: QI05AE
Ke stimulaci imunity proti Streptococcus equi.
Vakcinační kmen je deletovaný mutant s omezeným potenciálem růstu ve tkáni savců. V doporučené dávce je schopen se během krátké doby pomnožit lokálně v místě submukosální aplikace a během několika dnů se šíří do oro-nasální dutiny, ovšem vakcinační kmen nepřežívá na oro-nasální sliznici a systémově se nerozšiřuje.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
NAO-1 stabilizátor Voda na injekci
6.2 Inkompatibility
Nemísit s jinými veterinárními léčivými přípravky s výjimkou rozpouštědla dodaného k použití s touto vakcínou.
6.3 Doba použitelnosti
Doba použitelnosti veterinárního léčivého přípravku v neporušeném obalu: 3 roky.
Doba použitelnosti po rekonstituci podle návodu: 4 hodiny.
6.4 Zvláštní opatření pro uchovávání
Lyofilizát:
Uchovávejte v chladničce (2°C - 8°C). Chraňte před světlem.
Rozpouštědlo:
Tento veterinární léčivý přípravek nevyžaduje žádné zvláštní podmínky pro uchovávání.
6.5 Druh a složení vnitřního obalu
Každé balení Equilis StrepE obsahuje: 10 lékovek s lyofilizátem a 10 lékovek s 0,5 ml rozpouštědla, obojí v 3 ml skleněných lékovkách typu I uzavřených halogenbutylovou gumovou zátkou uzavřenou kódovanou hliníkovou pertlí, 10 aplikátorů, 10 stříkaček s jehlou.
6.6 Zvláštní opatření pro zneškodňování nepoužitého veterinárního léčivého přípravku nebo odpadu, který pochází z tohoto přípravku
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z tohoto přípravku, musí být likvidován podle místních právních předpisů.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Intervet International B.V.
Wim de Korverstraat 35 NL - 5831 AN Boxmeer Nizozemsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/2/04/043/001
9. DATUM REGISTRACE/ PRODLOUŽENÍ REGISTRACE
Datum registrace: 07.05.2014
Datum posledního prodloužení: 10.04.2014
10. DATUM REVIZE TEXTU
Podrobné informace o veterinárním léčivém přípravku jsou k dispozici na webové stránce Evropské lékové agentury http://www.ema.europa.eu/.
ZÁKAZ PRODEJE, VÝDEJE A/NEBO POUŽITÍ
Neuplatňuje se.
A. VÝROBCE BIOLOGICKY ÚČINNÉ LÁTKY A DRŽITELPOVOLENÍ K VÝROBĚ ODPOVĚDNÝ ZA UVOLNĚNÍ ŠARŽE
B. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍCH SE VÝDEJE NEBO POUŽITÍ
C. DEKLARACE HODNOT MRL
A. VÝROBCE BIOLOGICKY ÚČINNÉ LÁTKY A DRŽITEL POVOLENÍ K VÝROBĚ ODPOVĚDNÝ ZA UVOLNĚNÍ ŠARŽE
Jméno a adresa výrobce biologicky účinné látky:
Intervet International B.V.
Wim de Korverstraat 35 NL - 5831 AN Boxmeer Nizozemsko
Jméno a adresa výrobce odpovědného za uvolnění šarže:
Intervet International B.V.
Wim de Korverstraat 35 NL - 5831 AN Boxmeer Nizozemsko
B. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍCH SE VÝDEJE NEBO POUŽITÍ
Veterinární léčivý přípravek je vydáván pouze na předpis.
C. DEKLARACE HODNOT MRL
Léčivé látky biologického původu určené k vytvoření aktivní imunity nespadají do působnosti nařízení (ES) č. 470/2009.
Pomocné látky (včetně adjuvancií) uvedené v SPC v bodě 6.1 jsou povolenými látkami, pro které tabulka 1 přílohy nařízení Komise (EU) č. 37/2010 uvádí, že nejsou požadovány MRL nebo nespadají do působnosti nařízení (ES) č.470/2009, pokud jsou použity pro tento veterinární léčivý přípravek.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
Equilis StrepE lyofilizát a rozpouštědlo pro přípravu injekční suspenze
V jedné dávce 0,2 ml vakcíny:
Živý deletovaný mutant Streptococcus equi kmen TW928 1 09 0 až 109,4 cfu
Lyofilizát pro přípravu injekční suspenze
10 x 1 dávka vakcíny 10 x 1 dávka rozpouštědla 10 aplikátorů 10 stříkaček s jehlou
Koně.
Submukosální podání do vnitřní strany horního pysku. Před použitím čtěte příbalovou informaci.
Bez ochranných lhůt.
EXP: {měsíc/rok}
Po rekonstituci spotřebujte do 4 hodin.
11. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce (2°C - 8°C). Chraňte před světlem.
12. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÉHO PŘÍPRAVKU NEBO ODPADU, POKUD JE JICH TŘEBA
Zneškodňování odpadu: čtěte příbalovou informaci.
13. OZNAČENÍ „POUZE PRO ZVÍŘATA“ A PODMÍNKY NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ, POKUD JE JICH TŘEBA_
Pouze pro zvířata. Veterinární léčivý přípravek je vydáván pouze na předpis.
14. OZNAČENÍ “UCHOVÁVAT MIMO DOSAH DĚTÍ”
Uchovávat mimo dosah dětí.
15. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Intervet International B.V. Wim de Korverstraat 35 NL - 5831 AN Boxmeer
16. REGISTRAČNÍ ČÍSLO
EU/2/04/043/001
17. ČÍSLO ŠARŽE OD VÝROBCE
Lot {číslo}
Equilis StrepE lyofilizát pro přípravu injekční suspenze pro koně
V jedné dávce 0,2 ml vakcíny:
Živý deletovaný mutant Streptococcus equi kmen TW928 1 09 0 až 109,4 cfu
Lyofilizát pro přípravu injekční suspenze
10 x 1 dávka
Koně
Bez ochranných lhůt.
EXP: {měsíc/rok}
Po rekonstituci spotřebujte do 4 hodin.
Uchovávejte v chladničce (2°C - 8°C). Chraňte před světlem.
12. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÉHO PŘÍPRAVKU NEBO ODPADU, POKUD JE JICH TŘEBA_
Zneškodňování odpadu: čtěte příbalovou informaci.
13. OZNAČENÍ „POUZE PRO ZVÍŘATA“ A PODMÍNKY NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ, POKUD JE JICH TŘEBA
Pouze pro zvířata. Veterinární léčivý přípravek je vydáván pouze na předpis.
14. OZNAČENÍ “UCHOVÁVAT MIMO DOSAH DĚTÍ”
Uchovávat mimo dosah dětí.
15. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Intervet International B.V. Wim de Korverstraat 35 NL - 5831 AN Boxmeer
16. REGISTRAČNÍ ČÍSLO(A)
EU/2/04/043/001
17. ČÍSLO ŠARŽE OD VÝROBCE
Lot {číslo}
|
1. |
NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU |
|
Equilis StrepE - rozpouštědlo | |
|
2. |
OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK |
|
3. |
LÉKOVÁ FORMA |
|
4. |
VELIKOST BALENÍ |
|
10 x |
1 dávka |
|
5. |
CÍLOVÝ DRUH ZVÍŘAT |
|
6. |
INDIKACE |
|
7. |
ZPŮSOB A CESTA PODÁNÍ |
|
8. |
OCHRANNÁ LHŮTA |
|
9. |
ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE (JSOU) NUTNÉ(Á) |
|
10. |
DATUM EXSPIRACE |
|
EXP |
{měsíc/rok} |
|
11. |
ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ |
12. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÉHO PŘÍPRAVKU NEBO ODPADU, POKUD JE JICH TŘEBA
13. OZNAČENÍ “POUZE PRO ZVÍŘATA”
14. OZNAČENÍ “UCHOVÁVAT MIMO DOSAH DĚTÍ”
15. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Intervet International B.V. Wim de Korverstraat 35 NL - 5831 AN Boxmeer
16. REGISTRAČNÍ ČÍSLO
17. ČÍSLO ŠARŽE OD VÝROBCE
Lot {číslo}
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU_
Equilis StrepE
2. MNOŽSTVÍ LÉČIVÉ(ÝCH) LÁTKY(EK)_
Živý Streptococcus equi
3. OBSAH VYJÁDŘENÝ HMOTNOSTÍ, OBJEMEM NEBO POČTEM DÁVEK
1 dávka
4. CESTA PODÁNÍ_
Submukosální podání.
5. OCHRANNÁ LHŮTA_
6. ČÍSLO ŠARŽE_
Lot: {číslo}
7. DATUM EXSPIRACE_
EXP: {měsíc/rok}
8. OZNAČENÍ “POUZE PRO ZVÍŘATA”_
Pouze pro zvířata.
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU_
Equilis StrepE - rozpouštědlo
2. OBSAH VYJÁDŘENÝ HMOTNOSTÍ, OBJEMEM NEBO POČTEM DÁVEK
1 dávka
3. CESTA PODÁNÍ_
Před použitím čtěte příbalovou informaci.
4. ČÍSLO ŠARŽE_
Lot: {číslo}
5. OCHRANNÁ LHŮTA_
6. DATUM EXSPIRACE_
EXP: {měsíc/rok}
7. OZNAČENÍ “POUZE PRO ZVÍŘATA”_
Pouze pro zvířata.
B. PŘÍBALOVÁ INFORMACE
PŘÍBALOVÁ INFORMACE
Equilis StrepE lyofilizát a rozpouštědlo pro přípravu injekční suspenze pro koně
1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
Držitel rozhodnutí o registraci a výrobce odpovědný za uvolnění šarže: Intervet International B.V.
Wim de Korverstraat 35 NL - 5831 AN Boxmeer Nizozemsko
2. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Equilis StrepE lyofilizát a rozpouštědlo pro přípravu injekční suspenze pro koně
3. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
V jedné dávce 0,2 ml vakcíny:
Živý deletovaný mutant Streptococcus equi kmen TW928 109,0 až 109,4 cfu1 1 kolonie tvořící jednotky
Lyofilizát: špinavě bílá nebo krémově zbarvená peleta.
Rozpouštědlo: čirý bezbarvý roztok
4. INDIKACE
K imunizaci koní proti Streptococcus equi za účelem snížení klinických příznaků a výskytu abscesů mízních uzlin.
Nástup imunity je zajištěn 2 týdny po základní vakcinaci. Trvání imunity je až 3 měsíce.
Vakcína je určená pro koně, u kterých bylo jasně identifikováno riziko infekce zárodkem Streptococcus equi kvůli kontaktu s koňmi z prostor, u nichž je známa přítomnost tohoto patogenu, např. stáje s koňmi, kteří cestují na výstavy a/nebo závody v takových oblastech, nebo stáje, které obdrží nebo mají koně v ošetřování z takových oblastí.
5. KONTRAINDIKACE
Nejsou.
6. NEŽÁDOUCÍ ÚČINKY
Během 4 hodin po vakcinaci se v místě aplikace vyvine reakce ve formě difuzního zduření, které může být teplé a bolestivé. Tato reakce dosahuje maxima 2-3 dny po vakcinaci a maximální velikosti 3 cm krát 8 cm. Toto zduření úplně vymizí během 3 týdnů a obvykle nemá žádný vliv na chuť k příjmu krmiva vakcinovaných zvířat a nezpůsobuje žádné zřejmé nepohodlí. Vakcinační zárodek může lokálně v místě aplikace indukovat malý hnisavý zánět, který vede k narušení překrývající sliznice pysku a následnému výtoku tekutiny a zánětlivých buněk. 3-4 dny po vakcinaci často dochází k mírně zakalenému výtoku z místa submukosálního podání.
Několik dnů po vakcinaci se může vyskytnout mírné zvětšení retrofaryngeálních a mandibulámích mízních uzlin, které může být přechodně bolestivé. Ve velmi vzácných případech se může v místě aplikace nebo v regionálních mízních uzlinách vytvořit absces.
Dále se může v den vakcinace vyskytnout zvýšení rektální teploty až o 2°C. Ve vzácných případech lze pozorovat nechutenství, svalový třes a horečku. Ve velmi vzácných případech se může vyvinout skleslost.
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
- velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
Jestliže zaznamenáte jakékoliv závažné nežádoucí účinky či jiné reakce, které nejsou uvedeny v této příbalové informaci, oznamte to prosím vašemu veterinárnímu lékaři.
7. CÍLOVÝ DRUH ZVÍŘAT
Koně.
8. DÁVKOVÁNÍ PRO KAŽDÝ DRUH, CESTA(Y) A ZPŮSOB PODÁNÍ
Submukosální vakcinace s 0,2 ml rozpuštěného přípravku.
Základní vakcinace: koně od 4 měsíců věku dostanou dvě vakcinace jednou dávkou v intervalu 4 týdnů.
Revakcinace: Revakcinujte každé tři měsíce pro udržení imunity.
Primární odezva se udržuje po dobu až šesti měsíců po základní vakcinaci. Proto je pro obnovení imunity potřeba pouze jediná dávka vakcíny.
Doporučuje se vakcinovat všechny společně ustájené koně.
9. POKYNY PRO SPRÁVNÉ PODÁNÍ
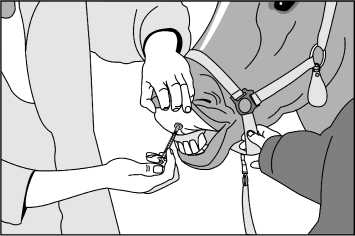
Nechejte sterilní rozpouštědlo dosáhnout pokojové teploty (15-25°C). Asepticky rozpusťte lyofilizát pomocí 0,3 ml dodaného sterilního rozpouštědla. Po přidání rozpouštědla počkejte 1 minutu a poté kroužením pečlivě promíchejte obsah. NETREPEJTE. Natáhněte 0,2 ml rozpuštěné vakcíny do dodané stříkačky (viz Obrázek 1) a nasaďte aplikátor na jehlu (viz Obrázek 2). Fixujte hlavu zvířete, zvedněte horní pysk a zasuňte jehlu do vnitřní strany horního pysku, až se aplikátor opře o pysk. Aplikujte celý obsah stříkačky do vnitřní strany horního pysku (viz Obrázek 3).
Obrázek 1
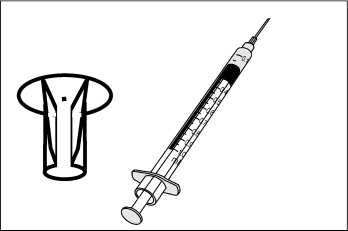
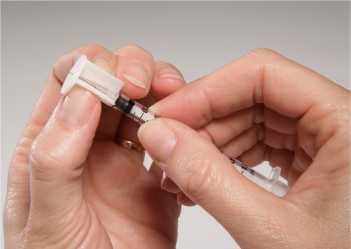
Obrázek 2
Obrázek 3
10. OCHRANNÁ LHŮTA
Bez ochranných lhůt.
11. ZVLÁŠTNÍ OPATŘENÍ PRO UCHOVÁVÁNÍ
Uchovávat mimo dosah dětí.
Lyofilizát: Uchovávejte v chladničce (2°C - 8°C). Chraňte před světlem.
Rozpouštědlo: Tento veterinární léčivý přípravek nevyžaduje žádné zvláštní podmínky pro uchovávání.
Doba použitelnosti po rekonstituci podle návodu: 4 hodiny.
12. ZVLÁŠTNÍ UPOZORNĚNÍ
Zvláštní upozornění:
Šíření vakcinačního kmene z místa injekce lze pozorovat po dobu čtyř dnů po vakcinaci.
Z literatury je známo, že u velmi nízkého počtu koní se může vyvinout purpura haemorrhagica, pokud jsou vakcinováni krátce po infekci. Purpura haemorrhagica nebyla pozorována v žádné studii
bezpečnosti provedené během vývoje Equilis StrepE. Ačkoliv výskyt purpura haemorrhagica je velmi nízký, její výskyt nelze úplně vyloučit.
V čelenžních studiích provedených firmou Intervet byla zaznamenána nedostatečná chráněnost u přibližně jedné čtvrtiny koní vakcinovaných doporučenou dávkou.
Během jednoho týdne po vakcinaci nepodávejte antibiotika.
Vakcinační kmen je citlivý na peniciliny, tetracykliny, makrolidy a linkomycin.
Vakcinační kmen je rezistentní k aminoglykosidům, sulfonamidům, flumechinu a kombinacím trimetoprim-sulfo.
Zvláštní opatření pro použití u zvířat Vakcinovat lze pouze zdravé koně.
Zajistěte, aby lyofilizát byl před použitím úplně rozpuštěný.
Základní vakcinace provedená během vzplanutí onemocnění není účinná, protože imunita je až do úplného dokončení základní vakcinace nedostatečná.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům Pro uživatele:
Tento přípravek obsahuje živý bakteriální deletovaný mutant s omezeným potenciálem růstu na savčích tkáních. Náhodná injekce/náhodné sebepoškození injekčně aplikovaným přípravkem může způsobit zánětlivou reakci se silnou bolestivostí a otokem.
Zvláštní pozornost musí být věnována při spojování aplikátoru a jehly, aby se zabránilo poranění píchnutím jehly. V případě náhodného sebepoškození injekčně aplikovaným přípravkem vyhledejte ihned lékařskou pomoc, i když bylo injikováno pouze malé množství přípravku a ukažte příbalovou informaci nebo etiketu praktickému lékaři.
Pro lékaře:
Tento přípravek obsahuje živý vakcinační kmen Streptococcus equi s oslabenou virulencí, auxotropní deletovaný mutant. Bakteriální složka tohoto přípravku může po náhodné injekci způsobit zánětlivou reakci se silným a bolestivým otokem.
Protizánětlivá léčba je indikována, i když bylo injekčně aplikované pouze malé množství přípravku.
Z bezpečnostních důvodů je třeba zvážit doplňující antibiotickou léčbu. Citlivost vakcinačního kmene k antibiotikům je zmíněna výše.
Březost, laktace nebo snáška:
Nepoužívat u březích nebo laktujících klisen.
Interakce s dalšími léčivými přípravky a další formy interakce:
Nejsou dostupné informace o bezpečnosti a účinnosti této vakcíny, pokud je podávána zároveň s jiným veterinárním léčivým přípravkem. Rozhodnutí o použití této vakcíny před nebo po jakémkoliv jiném veterinárním léčivém přípravku musí být provedeno na základě zvážení jednotlivých případů.
Předávkování (symptomy, první pomoc, antidota):
Mimo klinické příznaky zmíněné v bodě 6 vakcinace desetinásobkem doporučené dávky může indukovat absces v jedné ze submadibulárních mízních uzlin. Z abscesů vytéká hnisavá hmota po 2 týdnech po vakcinaci, ale poté vyzdraví bez intervence během jednoho měsíce. Dále se může v den vakcinace vyskytnout zvýšení rektální teploty až o 2,5°C. Příležitostně lze pozorovat jeden den po vakcinaci mírnou apatii.
^kompatibility:
Nemísit s jinými veterinárními léčivými přípravky s výjimkou rozpouštědla dodaného k použití s touto vakcínou.
13. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÉHO PŘÍPRAVKU NEBO ODPADU, POKUD JE JICH TŘEBA
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z tohoto přípravku, musí být likvidován podle místních právních předpisů.
14. DATUM POSLEDNÍ REVIZE PŘÍBALOVÉ INFORMACE
Podrobné informace o veterinárním léčivém přípravku jsou k dispozici na webové stránce Evropské lékové agentury http://www.ema.evropa.eu/
15. DALŠÍ INFORMACE
Pouze pro zvířata.
10 x 1 dávka vakcíny 10 x 1 dávka rozpouštědla 10 aplikátorů 10 stříkaček s jehlou
Vakcinační kmen je deletovaný mutant s omezeným potenciálem růstu ve tkáni savců. V doporučené dávce je schopen se během krátké doby pomnožit lokálně v místě submukosální aplikace a během několika dnů se šíří do oro-nasální dutiny, ovšem vakcinační kmen nepřežívá na oro-nasální sliznici a se systémově nerozšiřuje.
Pokud chcete získat informace o tomto veterinárním léčivém přípravku, kontaktujte prosím příslušného místního zástupce držitele rozhodnutí o registraci.
25