Eperzan 50 Mg
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Eperzan 30 mg prášek a rozpouštědlo pro injekční roztok Eperzan 50 mg prášek a rozpouštědlo pro injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Eperzan 30 mg prášek a rozpouštědlo pro injekční roztok
Jedno pero poskytne po rekonstituci albiglutidum 30 mg v dávce 0,5 ml.
Eperzan 50 mg prášek a rozpouštědlo pro injekční roztok
Jedno pero poskytne po rekonstituci albiglutidum 50 mg v dávce 0,5 ml.
Albiglutid je rekombinantní fuzní bílkovina skládající se ze dvou kopií sekvence 30 aminokyselin modifikovaného lidského peptidu 1 podobného glukagonu geneticky fúzovaných v sériích na lidský albumin.
Albiglutid se tvoří v buňkách Saccharomyces cerevisiae rekombinantní DNA technologií.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční roztok.
Prášek: lyofilizovaný bílý až žlutý prášek. Rozpouštědlo: čirý bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Eperzan je indikován k léčbě diabetes mellitus typu 2 u dospělých ke zlepšení kontroly glykemie jako: Monoterapie
Jestliže dieta a cvičení nejsou dostatečné pro kontrolu glykemie u pacientů, u nichž není podávání metforminu vhodné kvůli kontraindikacím nebo nesnášenlivosti.
Přídavná léčba
V kombinaci s dalšími léčivými přípravky snižujícími hladinu glukózy, včetně bazálního insulinu, jestliže jejich podávání spolu s dietou a cvičením není dostatečné pro kontrolu glykemie (dostupné údaje o různých kombinacích viz body 4.4 a 5.1).
4.2 Dávkování a způsob podání
Dávkování
Doporučená dávka přípravku Eperzan je 30 mg jednou týdně podaná subkutánně.
Dávku lze zvýšit na 50 mg jednou týdně na základě individuální glykemické odpovědi.
Je-li Eperzan přidán k existující léčbě metforminem, lze pokračovat v dosavadní dávce metforminu beze změny. Může být nutné snížit dávku současně podávaného insulinového sekretagoga (jako např. derivátů sulfonylmočoviny) nebo insulinu, aby se po zahájení léčby přípravkem Eperzan snížilo riziko hypoglykemie (viz body 4.4 a 4.8).
Používání přípravku Eperzan nevyžaduje specifické monitorování glukózy v krvi pacientem. Je-li však používán v kombinaci s derivátem sulfonylmočoviny nebo bazálním insulinem, může být monitorování glukózy v krvi pacientem nutné, aby se upravila dávka derivátu sulfonylmočoviny nebo bazálního insulinu.
Eperzan lze podávat v jakoukoli denní dobu bez ohledu na příjem potravy.
Eperzan se podává jednou týdně tentýž den v každém týdnu. Den každotýdenního podávání lze změnit, je-li to nutné, pokud poslední dávka byla podána před 4 nebo více dny.
Dojde-li ke zmeškání dávky, má být dávka podána, jakmile je to možné, během 3 dnů po zmeškané dávce. Poté může pacient pokračovat s podáváním v obvyklém dni. Je-li dávka zmeškána o více než 3 dny, pacient má počkat a podat si až následující pravidelně naplánovanou dávku.
Starší pacienti (> 65 let)
Na základě věku není nutná úprava dávky. Klinická zkušenost u pacientů ve věku > 75 let je velmi omezená (viz bod 5.2).
Pacienti s poruchou funkce ledvin
U pacientů s mírnou a středně závažnou poruchou funkce ledvin (eGFR 60 až 89, resp. 30 až 59 ml/min/1,73 m2) není nutná úprava dávky (viz body 4.4, 4.8, 5.1 a 5.2). Zkušenost u pacientů se závažnou poruchou funkce ledvin (< 30 ml/min/1,73 m2) nebo na dialýze je velmi omezená, proto se přípravek Eperzan u této skupiny pacientů nedoporučuje (viz body 4.4, 4.8, 5.1 a 5.2).
Pacienti s poruchou funkce jater
U pacientů s poruchou funkce jater se nedoporučuje úprava dávky. U pacientů s poruchou funkce jater neproběhly žádné studie (viz bod 5.2).
Pediatrická populace
Bezpečnost a účinnost přípravku Eperzan u dětí a dospívajících mladších 18 let nebyly stanoveny (viz bod 5.2). Nejsou dostupné žádné údaje.
Způsob podání
Eperzan je určen pro podávání pacientem jako subkutánní injekce do břicha, stehna nebo horní části paže. Eperzan se nesmí podávat intravenózně ani intramuskulárně.
Každé pero má používat pouze jedna osoba a je na jednorázové použití.
Lyofilizovaný prášek obsažený v peru musí být před podáním rekonstituován.
Návod k rekonstituci a podání přípravku Eperzan je uveden v bodě 6.6 a v Návodu k použití v příbalové informaci.
Je-li Eperzan používán spolu s insulinem, musí být každý léčivý přípravek podáván samostatnou injekcí. Tyto dva léčivé přípravky se nikdy nesmí mísit. Je přijatelné injikovat Eperzan a insulin do téže oblasti těla, ale místa injekce nesmí sousedit.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
U pacientů s diabetes mellitus typu 1 není s přípravkem Eperzan žádná zkušenost a u těchto pacientů se tedy nemá používat. Eperzan se nemá používat k léčbě diabetické ketoacidózy.
Akutní pankreatitida
Používání agonistů receptorů GLP-1 bylo spojeno s rizikem rozvoje akutní pankreatitidy. V klinických studiích byla akutní pankreatitida hlášena v souvislosti s přípravkem Eperzan (viz bod 4.8).
Pacienty je nutno informovat o charakteristických příznacích akutní pankreatitidy. Je-li podezření na pankreatitidu, je nutno podávání přípravku Eperzan přerušit; je-li pankreatitida potvrzena, nesmí se léčba přípravkem Eperzan znovu zahájit. U pacientů s pankreatitidou v anamnéze je nutná opatrnost.
Hypoglykemie
Riziko hypoglykemie je zvýšeno, je-li Eperzan použit v kombinaci s insulinovým sekretagogem (jako např. derivátem sulfonylmočoviny) nebo s insulinem. Z tohoto důvodu mohou pacienti potřebovat nižší dávku derivátu sulfonylmočoviny nebo insulinu, aby se u nich snížilo riziko hypoglykemie (viz body 4.2 a 4.8).
Závažné onemocnění gastrointestinálního traktu
Používání agonistů receptorů GLP-1 může být spojeno s gastrointestinálními nežádoucími účinky. Eperzan nebyl studován u pacientů se závažným onemocněním gastrointestinálního traktu, včetně závažné gastroparézy, a proto se používání přípravku Eperzan u těchto pacientů nedoporučuje.
Porucha funkce ledvin
U pacientů se závažnou poruchou funkce ledvin dostávajících přípravek Eperzan byl, ve srovnání s pacienty s mírnou nebo středně závažnou poruchou funkce ledvin, vyšší výskyt průjmu, nauzey a zvracení. Tyto typy gastrointestinálních příhod mohou vést k dehydrataci a zhoršení funkce ledvin.
Ukončení léčby
Po ukončení léčby může vliv přípravku Eperzan pokračovat, protože hladiny albiglutidu v plazmě klesají pomalu po dobu 3 až 4 týdnů. Tomu se má přizpůsobit výběr jiných léčivých přípravků a volba jejich dávky, protože nežádoucí účinky mohou pokračovat a účinnost může, alespoň částečně, přetrvávat, dokud hladiny albiglutidu neklesnou.
Nestudované populace
U pacientů se srdečním selháním třídy NYHA III - IV není zkušenost.
Eperzan nebyl studován v kombinaci s prandiálním insulinem, s inhibitory dipeptidylpeptidázy-4 (DPP-4) ani s inhibitory kotransportéru 2 sodíku/glukózy (SGLT2).
S použitím albiglutidu v kombinaci se samotnými thiazolidindiony, deriváty sulfonylmočoviny + thiazolidindiony a metforminem + deriváty sulfonylmočoviny + thiazolidindiony je omezená zkušenost.
Obsah sodíku
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) v 0,5ml dávce, tj. v podstatě je „bez sodíku“.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Albiglutid zpomaluje vyprazdňování žaludku a má potenciál ovlivňovat absorpci současně perorálně podávaných léčivých přípravků. Albiglutid ve srovnání s placebem zpomalil vyprázdnění žaludku jak tuhých složek, tak i tekutin při podání 100 mg jako jednorázové dávky zdravým dobrovolníkům (viz bod 5.1). Opatrnost je nutná u pacientů, kteří dostávají léčivé přípravky s úzkým terapeutickým indexem nebo léčivé přípravky, které vyžadují důkladné klinické monitorování.
Akarbóza
U pacientů s obstrukcí střev je akarbóza kontraindikována. Je-li podávána současně s albiglutidem, je nutná opatrnost (viz bod 4.8).
Simvastatin
V rovnovážném stavu albiglutidu (50 mg týdně) byla podána jedna dávka simvastatinu (80 mg). AUC simvastatinu se snížila o 40 % a Cmax simvastatinu byla zvýšena o 18 %. AUC kyseliny simvastatinu byla zvýšena o 36 % a Cmax byla zvýšena o přibližně 100 %. Bylo pozorováno zkrácení poločasu simvastatinu a kyseliny simvastatinu z přibližně 7 hodin na 3,5 hodiny. V klinických studiích se neukázal žádný účinek albiglutidu na bezpečnost simvastatinu.
Digoxin
Albiglutid nezměnil významně farmakokinetiku jedné dávky digoxinu (0,5 mg), která byla podána v rovnovážném stavu albiglutidu (50 mg týdně).
Warfarin
Při podání jedné dávky racemického warfarinu (25 mg) v rovnovážném stavu albiglutidu (50 mg týdně) nebyly pozorovány žádné klinicky významné účinky na farmakokinetiku R- ani S-enantiomeru warfarinu. Albiglutid také nezměnil významně farmakodynamické účinky warfarinu měřené jako mezinárodní normalizovaný poměr (INR).
Perorální antikoncepce
Albiglutid (50 mg týdně v rovnovážném stavu) neměl klinicky významný vliv na farmakokinetiku kombinované perorální antikoncepce v rovnovážném stavu obsahující 0,5 mg norethisteronu a 0,035 mg ethinylestradiolu. Při současném podávání albiglutidu a kombinované perorální antikoncepce nebyly pozorovány ani klinicky významné účinky na luteinizační hormon, folikuly stimulující hormon ani progesteron.
4.6 Fertilita, těhotenství a kojení
Údaje o podávání přípravku Eperzan těhotným ženám jsou omezené nebo nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Potenciální riziko pro člověka není známo. Podávání přípravku Eperzan se nedoporučuje v těhotenství a u žen v reprodukčním věku, které nepoužívají účinnou antikoncepci.
Podávání přípravku Eperzan má být ukončeno alespoň 1 měsíc před plánovaným otěhotněním vzhledem k dlouhému období odstraňování albiglutidu z organismu.
Kojení
Nejsou k dispozici údaje, které by podpořily používání přípravku Eperzan během kojení.
Není známo, zda se albiglutid vylučuje do lidského mateřského mléka. Vzhledem k tomu, že albiglutid je léčivá látka založená na bílkovině albuminu, je pravděpodobné, že bude přítomna v lidském mateřském mléce. Je nutno rozhodnout, zda ukončit kojení nebo ukončit léčbu a vzít při tom v úvahu přínos kojení pro dítě a přínos léčby pro matku. U myší, kterým byl podáván albiglutid během gestace a laktace, bylo pozorováno snížení tělesné hmotnosti potomků (viz bod 5.3).
Fertilita
Údaje o používání přípravku Eperzan na lidskou fertilitu nejsou k dispozici. Studie u myší ukázaly při dávkách toxických pro matku snížení estrogenního cyklu, ale neprokázaly škodlivé účinky na plodnost (viz bod 5.3). Potenciální riziko pro člověka není známo.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Eperzan nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje. Je-li Eperzan použit v kombinaci s insulinovým sekretagogem (jako např. deriváty sulfonylmočoviny) nebo insulinem, je nutno pacienty upozornit, aby během řízení a obsluhy strojů dodržovali opatření k zamezení hypoglykemie (viz bod 4.4).
4.8 Nežádoucí účinky
Souhrnný bezpečnostní profil
Eperzan dostalo v 8 placebem nebo aktivně kontrolovaných klinických studiích fáze III více než 2 300 pacientů.
Základní léčba v těchto studiích zahrnovala dietu a cvičení, metformin, deriváty sulfonylmočoviny, thiazolidindion, insulin glargin nebo kombinaci antidiabetik.
Trvání studií bylo od 32 týdnů až do 3 let. Kategorie četností níže popisují kombinované údaje pro 2 dávkování přípravku Eperzan, 30 mg nebo 50 mg týdně subkutánně.
Nejzávažnějším nežádoucím účinkem v klinických studiích byla akutní pankreatitida (viz bod 4.4).
Nejčastěji hlášenými nežádoucími účinky během klinických studií vyskytujícími se u > 5 % pacientů léčených přípravkem Eperzan byly průjem, nauzea a reakce v místě injekce včetně vyrážky, erytému nebo svědění v místě injekce.
Nežádoucí účinky v tabulce
Tabulka shrnuje nežádoucí účinky, které se vyskytly častěji u pacientů léčených přípravkem Eperzan než u pacientů léčených jakýmkoli komparátorem. Nežádoucí účinky hlášené podle souhrnné analýzy sedmi placebem a aktivně kontrolovaných studií fáze III během celé doby léčby jsou uvedeny v Tabulce 1.
Četnost je definována jako: velmi časté > 1/10; časté > 1/100 až < 1/10; méně časté > 1/1 000 až < 1/100; vzácné > 1/10 000 až < 1/1 000; velmi vzácné < 1/10 000 a není známo (z dostupných údajů nelze určit). V rámci každé skupiny četností jsou nežádoucí účinky uspořádány s klesající závažností.
Tabulka 1 Nežádoucí účinky ze studií fáze III během celé doby léčby
|
Třídy orgánových systémů |
Velmi časté |
Časté |
Méně časté |
Vzácné |
|
Infekce a infestace | ||||
|
Poruchy imunitního systému |
Hypersenzitivní reakce | |||
|
Poruchy metabolismu a výživy |
Hypoglykemie (je-li Eperzan užíván v kombinaci s insulinem nebo derivátem sulfonylmočoviny) |
Hypoglykemie (je-li Eperzan užíván v monoterapii nebo v kombinaci s metforminem nebo pioglitazonem) | ||
|
Srdeční poruchy |
Fibrilace síní/flutter síní | |||
|
Gastrointestinální poruchy |
gastroesofageální reflux |
Pankreatitida, obstrukce střev | ||
|
Celkové poruchy a reakce v místě aplikace |
Reakce v místě injekce |
Popis vybraných nežádoucích účinků:
Alergické reakce
Možné hypersenzitivní reakce (např. pruritus, erythema) včetně případu s generalizovaným pruritem a vyrážkou s dušností byly hlášeny v klinických studiích s albiglutidem.
Pankreatitida
Výskyt pankreatitidy (u níž se předpokládalo, že je spojena s léčbou) v klinických studiích byl 0,3 % u přípravku Eperzan ve srovnání s 0 % u placeba a 0,1 % u srovnávané léčby (tj. liraglutidu, pioglitazonu, glimepiridu, sitagliptinu a insulinu glargin) jak s přídatnou základní antidiabetickou léčbou (např. metforminem), tak bez ní.
Gastrointestinální příhody
Gastrointestinální příhody se vyskytly s vyšší frekvencí u přípravku Eperzan (38 % proti 32 %) v porovnání s jakýmkoli srovnávaným přípravkem. Nejčastěji byly hlášeny průjem (13 % proti 9 %), nauzea (12 % proti 11 %), zvracení (5 % proti 4 %) a zácpa (5 % proti 4 %); většina příhod se vyskytla během prvních 6 měsíců.
Gastrointestinální příhody se u přípravku Eperzan vyskytly častěji u pacientů se středně závažnou až závažnou poruchou funkce ledvin (eGFR 15 až 59 ml/min/1,73 m2) než u pacientů s mírnou poruchou funkce ledvin nebo normální funkcí ledvin.
Reakce v místě injekce
Reakce v místě injekce (typicky zahrnující vyrážku, erytém nebo svědění v místě injekce) se vyskytly u 15 % pacientů léčených přípravkem Eperzan ve srovnání se 7 % u jakéhokoli komparátoru a vedly k ukončení léčby u 2 % všech pacientů léčených přípravkem Eperzan. Obecně byly reakce v místě injekce mírné intenzity a nevyžadovaly léčbu.
Imunogenita
Podíl pacientů, u nichž se během léčby vyvinuly protilátky na albiglutid, byl 4 % (128/2 934). U žádné z těchto protilátek se in vitro stanovením neprokázalo, že by neutralizovala účinnost albiglutidu; tvorba protilátek byla většinou přechodná a nebyla spojena se sníženou účinností (HbAJc a FPG). I když většina pacientů s reakcí v místě injekce byla negativní na protilátky (~ 85 %), byly reakce v místě injekce hlášeny častěji u pacientů pozitivních na protilátky (41 %, N = 116) než u pacientů negativních na protilátky (14 %,
N = 1 927). Tyto účinky byly většinou mírné a nevedly k ukončení léčby. Jinak byl profil nežádoucích účinků u pacientů na protilátky pozitivních i negativních podobný.
Hypoglykemie
Závažná hypoglykemie vyžadující pomoc další osoby se při léčbě vyskytla méně často: u 0,3 % pacientů dostávajících Eperzan a u 0,4 % pacientů dostávajících srovnávaný přípravek. Většina pacientů s příhodou závažné hypoglykemie v klinických studiích dostávala současně derivát sulfonylmočoviny nebo insulin; žádná příhoda nevyžadovala hospitalizaci ani ukončení léčby.
Byl-li Eperzan použit v monoterapii, byl výskyt symptomatické hypoglykemie (< 3,9 mmol/l) podobný u přípravku Eperzan 30 mg (2 %), přípravku Eperzan 50 mg (1 %) a placeba (3 %).
Výskyt symptomatické hypoglykemie byl vyšší při použití přípravku Eperzan s derivátem sulfonylmočoviny (15 % až 22 %) nebo s insulinem (18 %) ve srovnání s kombinacemi nezahrnujícími derivát sulfonylmočoviny ani insulin (1 % až 4 %). Mezi pacienty randomizovanými na ostatní srovnávané přípravky byl výskyt symptomatické hypoglykemie 7 % až 33 % při použití s derivátem sulfonylmočoviny nebo insulinem a 2 % až 4 % v kombinaci bez těchto léčivých přípravků.
Pneumonie se vyskytla u 2 % pacientů dostávajících Eperzan ve srovnání s 0,8 % pacientů ve všech srovnávaných skupinách. U přípravku Eperzan se jednalo o jednotlivé epizody pneumonie u pacientů účastnících se studií s pozorováním 32 týdnů až 3 roky.
Fibrilace síní/flutter síní
Fibrilace síní/flutter síní se vyskytly u 1 % pacientů dostávajících Eperzan a u 0,5 % pacientů ve všech srovnávaných skupinách. Jak ve skupině s přípravkem Eperzan, tak i ve srovnávaných skupinách se jednalo převážně o muže, starší pacienty nebo pacienty s poruchou funkce ledvin.
Srdeční rytmus
Ve studiích fáze III u pacientů s diabetem typu 2 byla u albiglutidu pozorována malá zrychlení srdečního rytmu (1 až 2 tepy/min). Ve studii zaměřené na QT u zdravých dobrovolníků bylo po opakovaném podávání albiglutidu 50 mg pozorováno zrychlení srdečního rytmu (6 až 8 tepů/min) ve srovnání s výchozími hodnotami.
Ukončení léčby
V klinických studiích s trváním alespoň 2 roky ukončilo léčbu přípravkem Eperzan kvůli nežádoucím účinkům 8 % pacientů ve srovnání se 6 % ve všech srovnávaných skupinách. Nejčastější příhodou vedoucí k ukončení léčby přípravkem Eperzan byly reakce v místě injekce a gastrointestinální příhody, každé < 2 %.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Během klinických studií u pacientů s diabetem typu 2 byla nejvyšší podávaná dávka přípravku Eperzan 100 mg subkutánně každé čtyři týdny po 12 týdnů. Tato dávka byla spojena se zvýšeným výskytem nauzey, zvracení a bolesti hlavy.
Pro předávkování přípravkem Eperzan neexistuje specifické antidotum. V případě podezření na předávkování je nutno zahájit příslušnou klinickou léčbu podle klinického stavu dané osoby. Předpokládanými příznaky předávkování mohou být závažná nauzea, zvracení nebo bolest hlavy. U těchto příznaků může být, vzhledem k poločasu albiglutidu (5 dní), nutná delší doba pozorování a léčby.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: léčiva k terapii diabetu. Jiná antidiabetika, kromě insulinů. ATC kód: A10BX13
Mechanismus účinku
Albiglutid je agonista receptoru GLP-1 a zvyšuje sekreci insulinu závislou na glukóze. Albiglutid také zpomaluje vyprazdňování žaludku.
Farmakodynamické účinky
Kontrola glukózy
Eperzan snižuje hladinu glukózy nalačno a snižuje výchylky postprandiální glukózy. Většina pozorovaných snížení koncentrací glukózy v plazmě nalačno se vyskytla po j ednotlivé dávce, což je konzistentní s farmakokinetickým profilem albiglutidu.
U pacientů s diabetem typu 2, kteří dostali 2 dávky albiglutidu 32 mg (v 1. a 8. dni), bylo po podání standardní snídaně 9. den pozorováno statisticky významné snížení (24 %) AUC(0,5-4,5 hod) postprandiální glukózy v porovnání s placebem.
Jednotlivá dávka 50 mg albiglutidu nenarušila antiregulační hormonální odpověď glukagonu, adrenalinu, noradrenalinu, kortisolu ani růstového hormonu na hypoglykemii.
Gastrická motilita
Po podání 100 mg jako jednotlivé dávky zdravým dobrovolníkům zpomaloval albiglutid ve srovnání s placebem vyprazdňování žaludku. U tuhých látek se tJ/2 vyprázdnění žaludku zvýšil z 1,14 hodiny na 2,23 hodiny (p = 0,0112). U tekutin se tm vyprázdnění žaludku zvýšil z 0,28 hodiny na 0,69 hodiny
(p = 0,0018).
Klinická účinnost a bezpečnost
Přípravkem Eperzan bylo v 8 aktivně a placebem kontrolovaných klinických studiích fáze III celkem léčeno 2 365 pacientů s diabetem typu 2 a 2 530 jich dostávalo jinou studijní léčbu. Studie hodnotily používání přípravku Eperzan 30 mg a 50 mg jednou týdně; v 5 z 8 studií byla povolena titrace dávky přípravku Eperzan z 30 mg na 50 mg jednou týdně. Ve všech 8 klinických studiích se zahrnutím pacientů ze všech skupin léčby bylo 19 % pacientů (N = 937) ve věku 65 let a starších, 2 % (N = 112) byla ve věku 75 let a starších, 52 % bylo mužů, s průměrným body mass indexem (BMI) 33 kg/m2. 67 % pacientů bylo bělochů, 15 % Afroameričanů/afrického původu a 11 % bylo Asiatů; 26 % pacientů bylo Hispánců/Latinonameričanů.
V demografických podskupinách (věk, pohlaví, rasa/etnikum, trvání diabetu) nebyly pozorovány celkové rozdíly v účinku na glykemii nebo tělesnou hmotnost.
Monoterapie
Účinnost přípravku Eperzan se hodnotila ve 3leté randomizované dvojitě zaslepené placebem kontrolované multicentrické studii (n = 296) u pacientů neadekvátně kontrolovaných na dietě a cvičení. Pacienti byli randomizováni (1 : 1 : 1) do skupin Eperzan 30 mg jednou týdně, Eperzan 30 mg jednou týdně s titrací na 50 mg jednou týdně ve 12. týdnu nebo placebo. Primárním cílem byla změna od výchozí hodnoty HbAic v 52. týdnu. Ve srovnání s placebem vedla léčba přípravkem Eperzan 30 mg a 50 mg s.c. týdně ke statisticky významnému snížení HbAJc od výchozí hodnoty v 52. týdnu. Změna HbAJc od výchozí hodnoty po 6 měsících byla u dávek přípravku Eperzan 30 mg (0,9 %) a 50 mg (1,1 %) týdně také statisticky významná (viz Tabulka 2).
Tabulka 2. Výsledky v 52. týdnu v placebem kontrolované studii se dvěma režimy dávkování přípravku Eperzan (30 vs. 50 mg s.c. týdně) jako monoterapie
|
Eperzan 30 mg týdně |
Eperzan 50 mg týdně |
Placebo | |
|
ITTa (N) |
N = 100 |
N = 97 |
N = 99 |
|
HbAic (%) | |||
|
Výchozí stav (průměr) Změna v 52. týdnub Rozdíl proti placebub (95% CI) |
8,05 -0,70 -0,8 (-1,1; -0,6)c |
8,21 -0,9 -1,0 (-1,3; -0,8)c |
8,02 +0,2 |
|
Pacienti (%) dosáhnuvší HbA1c < 7 % |
49 |
40 |
21 |
|
Tělesná hmotnost (kg) | |||
|
Výchozí stav (průměr) Změna v 52. týdnub Rozdíl proti placebub (95% CI) |
96 -0,4 0,3 (-0,9; 1,5) |
97 -0,9 -0,2 (-1,4; 1,0) |
96 -0,7 |
a Populace podle původního léčebného záměru (intent to treat) - provedeno poslední pozorování b Upravený průměr
c p < 0,05 u rozdílu v léčbě
Kombinovaná léčba Přidání k metforminu
Účinnost přípravku Eperzan se hodnotila ve 3leté randomizované dvojitě zaslepené multicentrické studii (n = 999). K základní léčbě metforminem > 1 500 mg denně byl přidán Eperzan 30 mg s.c. týdně (s možností titrace na 50 mg týdně po alespoň 4 týdnech) a srovnáván se sitagliptinem 100 mg denně, glimepiridem 2 mg denně (s možností titrace na 4 mg denně) nebo placebem. Primárním cílem byla změna HbA1c od výchozí hodnoty po 2 letech ve srovnání s placebem. Výsledky ze 104. týdne jsou uvedeny v Tabulce 3. Eperzan vedl ke snížení glykemie a byla u něj prokázána statisticky významná superiorita ve snížení HbA1c oproti výchozí hodnotě ve srovnání s placebem, sitagliptinem nebo glimepiridem (viz Tabulka 3).
Tabulka 3. Výsledky ve 104. týdnu v placebem kontrolované studii srovnávající Eperzan 30 mg s.c. týdně (s možností titrace na 50 mg týdně) se sitagliptinem 100 mg denně a glimepiridem 2 až 4 mg denně jako přídavné léčby u pacientů nedostatečně kontrolovaných metforminem >1 500 mg denně
|
Eperzan 30 mg/50 mg týdně + metformin > 1 500 mg denně |
Placebo + metformin > 1 500 mg denně |
Sitagliptin 100 mg denně + metformin > 1 500 mg denně |
Glimepirid 2 až 4 mg denně + metformin > 1 500 mg denně | |
|
ITTa (N) |
297 |
100 |
300 |
302 |
|
HbAic (%) | ||||
|
Výchozí hodnota (průměr) Změna ve 104. týdnub Rozdíl proti placebu + metforminub, (95% CI) Rozdíl proti sitagliptinu + metforminub, (95% CI) Rozdíl proti glimepiridu + metforminub, (95% CI) |
8,1 -0,6 -0,9 (-1,2; -0,7)c -0,4 (-0,5; -0,2)c -0,3 (-0,5; -0,1)c |
8,1 +0,3 |
8,1 -0,3 |
8,1 -0,4 |
|
Podíl dosáhnuvších HbAJc < 7 % |
39 |
16 |
32 |
31 |
|
Tělesná hmotnost (kg) | ||||
|
Výchozí hodnota (průměr) Změna ve 104. týdnub Rozdíl proti placebu + metforminub, (95% CI) Rozdíl proti sitagliptinu + metforminub, (95% CI) Rozdíl proti glimepiridu + metforminub, (95% CI) |
90 -1,2 -0,2 (-1,1; 0,7) -0,4 (-1,0; 0,3) -2,4 (-3,0; -1,7)c |
92 -1,0 |
90 -0,9 |
92 +1,2 |
a Populace podle původního léčebného záměru (intent to treat) - provedeno poslední pozorování b Upravený průměr
c p < 0,05 u rozdílu v léčbě
Přidání k vioslitazonu
Účinnost přípravku Eperzan se hodnotila ve 3leté randomizované dvojitě zaslepené multicentrické studii (n = 299). Eperzan 30 mg s.c. týdně byl srovnáván s placebem u pacientů nedostatečně kontrolovaných pioglitazonem > 30 mg denně (s metforminem > 1 500 mg denně nebo bez něj).
Ve srovnání s placebem vedla léčba přípravkem Eperzan ke statisticky významnému snížení HbA1c od výchozí hodnoty v 52. týdnu (-0,8 % u přípravku Eperzan proti -0,1 % u placeba, p < 0,05) a FPG (-1,3 mmol/l u přípravku Eperzan proti +0,4 mmol/l u placeba, p < 0,05). Změna tělesné hmotnosti od výchozí hodnoty se statisticky významně mezi skupinami léčby nelišila (viz Tabulka 4).
Tabulka 4. Výsledky v 52. týdnu v placebem kontrolované studii srovnávající Eperzan 30 mg s.c. týdně jako přídavnou léčbu u pacientů nedostatečně kontrolovaných pioglitazonem > 30 mg denně ± metforminem > 1 500 mg denně
|
Eperzan 30 mg týdně + pioglitazon > 30 mg denně (+/- metformin > 1 500 mg denně) |
Placebo + pioglitazon > 30 mg denně (+/- metformin > 1 500 mg denně) | |
|
ITTa (N) |
N = 150 |
N = 149 |
|
HbA1c (%) | ||
|
Výchozí hodnota (průměr) |
8,1 |
8,1 |
|
Změna v 52. týdnub |
-0,8 |
p < 0,05 u rozdílu v léčbě
|
Rozdíl proti placebu + pioglitazonub (95% CI) |
-0,8 (-1,0; -0,6)c |
-0,05 |
|
Podíl dosáhnuvších HbA1c < 7 % |
44 |
15 |
|
Tělesná hmotnost (kg) | ||
|
Výchozí hodnota (průměr) |
98 |
100 |
|
Změna v 52. týdnub |
0,3 |
+0,5 |
|
Rozdíl proti placebu + pioglitazonub |
-0,2 (-1,2; 0,8) | |
|
(95% CI) |
a Populace podle původního léčebného záměru (intent to treat) - provedeno poslední pozorování b Upravený průměr
Přidání k metforminu a derivátu sulfonylmočoviny
Účinnost přípravku Eperzan se hodnotila ve 3leté randomizované dvojitě zaslepené multicentrické studii (n = 657). K základní léčbě metforminem > 1 500 mg denně a glimepiridem 4 mg denně byl přidán Eperzan 30 mg s.c. týdně (s možností titrace na 50 mg týdně po alespoň 4 týdnech) a srovnáván s placebem nebo pioglitazonem 30 mg denně (s možností titrace na 45 mg denně). Primárním cílem byla změna HbAic od výchozí hodnoty v 52. týdnu ve srovnání s placebem. V 52. týdnu vedla léčba přípravkem Eperzan ve srovnání s placebem ke statisticky významnému snížení HbA1c od výchozí hodnoty. Léčba přípravkem Eperzan nedosáhla předem specifikované hranice noninferiority (0,3 %) pro HbA1c proti pioglitazonu. Změna tělesné hmotnosti od výchozí hodnoty u přípravku Eperzan se nelišila statisticky významně od placeba, ale byla statisticky významně nižší ve srovnání s pioglitazonem (viz Tabulka 5).
Tabulka 5. Výsledky v 52. týdnu v placebem kontrolované studii srovnávající Eperzan 30 mg s.c. týdně (s možností titrace na 50 mg týdně) s pioglitazonem 30 mg denně (s možností titrace na 45 mg/den) jako přídavné léčby u pacientů nedostatečně kontrolovaných metforminem + derivátem sulfonylmočoviny (glimepiridem 4 mg denně)
|
Eperzan 30 mg/50 mg týdně + metformin > 1 500 mg denně + glimepirid 4 mg denně |
Placebo + metformin > 1 500 mg denně + glimepirid 4 mg denně |
Pioglitazon + metformin > 1 500 mg denně + glimepirid 4 mg denně | |
|
ITTa (N) |
269 |
115 |
273 |
|
HbAic (%) | |||
|
Výchozí hodnota (průměr) Změna v 52. týdnub Rozdíl proti placebu + met + glimb (95% CI) Rozdíl proti pioglitazonu + met + glimb (95% CI) |
8,2 -0,6 -0,9 (-1,1; -0,7)c 0,3 (0,1; 0,4) |
8,3 +0,33 |
8,3 -0,80 |
|
Podíl dosáhnuvších HbAic < 7 % |
30 |
9 |
35 |
|
Tělesná hmotnost (kg) | |||
|
Výchozí hodnota (průměr) Změna v 52. týdnub Rozdíl proti placebu + met + glimb (95% CI) Rozdíl proti pioglitazonu + met + glimb (95% CI) |
91 -0,4 -0,03 (-0,9; 0,8) -4,9 (-5,5; -4,2)c |
90 -0,4 |
91 +4,4 |
a Populace podle původního léčebného záměru (intent to treat) - provedeno poslední pozorování b Upravený průměr
c p < 0,05 u rozdílu v léčbě
Přidání k insulinu slarsin
Účinnost přípravku Eperzan se hodnotila v 52týdenní randomizované otevřené multicentrické noninferioritní studii (n = 563). K základní léčbě insulinem glargin (zahájené 10 jednotkami a titrované na > 20 jednotek denně) byl přidán Eperzan 30 mg s.c. týdně (s možností titrace na 50 mg, nedošlo-li po 8 týdnech k adekvátní kontrole) a srovnáván s prandiálním insulinem lispro (podávaným denně v době jídla započatým podle standardní péče a titrovaným do účinku). Primárním cílem byla změna HbA1c od výchozí hodnoty ve 26. týdnu. Ve 26. týdnu byla průměrná denní dávka insulinu glargin 53 IU při podání Eperzanu a 51 IU při podání lispro. Průměrná denní dávka insulinu lispro byla ve 26. týdnu 31 IU a v 52. týdnu, 69 % pacientů léčených přípravkem Eperzan dostávalo 50 mg týdně. Ve 26. týdnu byl rozdíl mezi léčbami přípravkem Eperzan a insulinem lispro u HbA1c 0,2 % a dosáhl předem specifikovanou hranici noninferiority (0,4 %). Léčba přípravkem Eperzan vedla ke statisticky významnému průměrnému úbytku tělesné hmotnosti u přípravku Eperzan (-0,7 kg) ve srovnání s průměrným přírůstkem tělesné hmotnosti u insulinu lispro (+0,8 kg) (viz Tabulka 6).
Tabulka 6. Výsledky ve 26. týdnu ve studii srovnávající Eperzan 30 mg s.c. týdně (s možností titrace na 50 mg týdně) s prandiálním insulinem lispro jako přídavné léčby u pacientů nedostatečně kontrolovaných na samotném insulinu glargin
|
Eperzan + insulin glargin (> 20 jednotek denně) |
Insulin lispro + insulin glargin (> 20 jednotek denně) | |
|
ITTa (N) |
N = 282 |
N = 281 |
|
HbAic (%) | ||
|
Výchozí hodnota (průměr) Změna ve 26. týdnub Rozdíl proti insulinu lisprob (95% CI) p hodnota (noninferiority) |
8,47 -0,8 -0,2 (-0,3; 0,0) < 0,0001 |
8,43 -0,6 |
|
Podíl dosáhnuvších HbA1c < 7 % |
30 % |
25 % |
|
Tělesná hmotnost (kg) | ||
|
Výchozí hodnota (průměr) Změna ve 26. týdnub Rozdíl proti insulinu lisprob (95% CI) |
93 -0,7 -1,5 (-2,1; -1,0)c |
92 +0,8 |
|
a Populace podle původního léčebnéh |
io záměru (intent to treat) - provedeno poslední | |
pozorování b Upravený průměr c p < 0,05 u rozdílu v léčbě
U pacientů, kteří dokončili studii (52 týdnů), byla upravená průměrná změna výchozího HbA1c -1,0 % u přípravku Eperzan (N = 121) a -0,9 % u insulinu lispro (N = 141). Upravená průměrná změna tělesné hmotnosti od výchozího stavu po 52 týdnech byla u přípravku Eperzan (N = 122) -1,0 kg a u insulinu lispro (N = 141) +1,7 kg. Tyto údaje vylučují užívání antidiabetické léčby dovolené po zhodnocení účinnosti, pokud byly překročeny glykemické meze.
Aktivně kontrolovaná studie _proti insulinu glargin _jako _přídavné léčby k metforminu s derivátem sulfonylmočoviny nebo bez něho
Účinnost přípravku Eperzan se hodnotila ve 3leté randomizované (2 : 1) otevřené insulinem glargin kontrolované noninferioritní studii (n = 735). K základní léčbě metforminem > 1 500 mg denně (s derivátem sulfonylmočoviny nebo bez něho) byl přidán Eperzan 30 mg s.c. týdně (s možností titrace na 50 mg týdně) a srovnáván s insulinem glargin (zahájeným na 10 jednotkách a titrovaným týdně podle souhrnu údajů o přípravku). Primárním cílem byla změna HbAJc od výchozí hodnoty v 52. týdnu. Počáteční celková denní dávka insulinu glargin byla v rozmezí mezi 2 a 40 jednotkami (medián denní dávky 10 jednotek) a v 52. týdnu byla v rozmezí mezi 3 a 230 jednotkami (medián denní dávky 30 jednotek). Medián denní dávky insulinu glargin užitého před hyperglykemickou záchranou byl 10 jednotek (rozmezí 2 až 40 jednotek) na počátku studie a 30 jednotek (rozmezí 3 až 230 jednotek) v 52. týdnu. Ve 156. týdnu, byla u 77 % pacientů léčených přípravkem Eperzan dávka titrována na 50 mg s.c. týdně. V 52. týdnu byl rozdíl u HbA1c od výchozích hodnot mezi léčbami přípravkem Eperzan a insulinem glargin 0,1 % (-0,04; 0,27) a dosáhl předem specifikovanou hranici noninferiority (0,3 %). U přípravku Eperzan byl pozorován statisticky významný úbytek tělesné hmotnosti ve srovnání s přírůstkem tělesné hmotnosti u insulinu glargin; rozdíl ve změně tělesné hmotnosti byl statisticky významný (viz Tabulka 7).
Tabulka 7. Výsledky v 52. týdnu aktivně kontrolované studie srovnávající Eperzan 30 mg s.c. týdně (s množností titrace na 50 mg týdně) s insulinem glargin (titrovaným týdně podle souhrnu údajů o přípravku) jako přídavné léčby u pacientů nedostatečně kontrolovaných metforminem ± derivátem sulfonylmočoviny
|
Eperzan 30 mg/50 mg týdně ± metformin (s derivátem sulfonylmočoviny nebo bez něho) |
Insulin glargin ± metformin (s derivátem sulfonylmočoviny nebo bez něho) | |
|
ITTa (N) |
496 |
239 |
|
HbAic (%) | ||
|
Výchozí hodnota (průměr) |
8,28 |
8,36 |
|
Změna v 52. týdnub |
-0,7 |
-0,8 |
|
Rozdíl proti insulinu glarginb (95% CI) |
0,1 (-0,04; 0,3) | |
|
p hodnota (noninferiority) |
< 0,0086 | |
|
Podíl dosáhnuvší HbAJc < 7 % |
32 |
33 |
|
Tělesná hmotnost (kg) | ||
|
Výchozí hodnota (průměr) |
95 |
92 |
|
Změna v 52. týdnub |
-1,1 |
1,6 |
|
Rozdíl proti insulinu glarginb (95% CI) |
-2,6 (-3,2; -2,0) c |
a Populace podle původního léčebného záměru (intent to treat) - provedeno poslední pozorování b Upravený průměr
c p < 0,05 u rozdílu v léčbě
U pacientů, kteří byli léčeni alespoň 104 týdny, byla upravená průměrná změna výchozího HbA1c -0,97 % u přípravku Eperzan (N = 182) a -1,04 % u insulinu glargin (N = 102). Upravená průměrná změna tělesné hmotnosti od výchozího stavu po 104 týdnech byla u přípravku Eperzan (N = 184) -2,6 kg a u insulinu glargin (N = 104) +1,4 kg. Tyto údaje vylučují užívání antidiabetické léčby dovolené po zhodnocení účinnosti, pokud byly překročeny glykemické meze.
Aktivně kontrolovaná studie proti liraglutidu v kombinaci s metforminem, thiazolidindionem nebo derivátem sulfonylmočoviny (jako monoterapie nebo duální léčba)
Účinnost přípravku Eperzan se hodnotila v 32týdenní randomizované otevřené liraglutidem kontrolované noninferioritní studii (n = 805). Eperzan 30 mg s.c. týdně (s možností titrace na 50 mg týdně v 6. týdnu) byl srovnáván s liraglutidem 1,8 mg denně (titrovaným od 0,6 mg v 1. týdnu a 1,2 mg v 1. až 2. týdnu) u pacientů nedostatečně kontrolovaných monoterapií nebo kombinovanou perorální antidiabetickou léčbou (metformin, thiazolidindion nebo derivát sulfonylmočoviny). Primárním cílem byla změna HbAJc od výchozí hodnoty v 32. týdnu.
Léčba přípravkem Eperzan nedosáhla předem specifikované hranice noninferiority (0,3 %) u HbAJc proti liraglutidu (viz Tabulka 8).
Tabulka 8. Výsledky aktivně kontrolované studie přípravku Eperzan 30 mg s.c. týdně (s titrací na 50 mg týdně) proti liraglutidu 1,8 mg denně v 32. týdnua
|
Eperzan 30 mg/50 mg týdně |
Liraglutid 1,8 mg denně | |
|
Populace podle původního léčebného záměru (N) |
402 |
403 |
|
HbAxc (%) | ||
|
Výchozí hodnota (průměr) |
8,2 |
8,2 |
|
Změna v 32. týdnub Rozdíl proti liraglutidub (95% CI) p hodnota (noninferiority) |
-0,8 0,2 (0,1; 0,3) p = 0,0846 |
-1,0 |
|
Podíl dosáhnuvších HbAJc < 7 % |
42 % |
52 % |
|
Tělesná hmotnost (kg) | ||
|
Výchozí hodnota (průměr) Změna v 32. týdnub Rozdíl proti liraglutidub (95% CI) |
92 -0,6 1,55 (1,05; 2,06)c |
93 -2,2 |
|
a Populace podle původního léčebného záměru (intent to treat) - provec |
eno poslední | |
pozorování b Upravený průměr c p < 0,05 u rozdílu v léčbě
Aktivně kontrolovaná studie proti sitagliptinu u pacientů s diabetem typu 2 a různými stupni poruchy funkce ledvin
Účinnost přípravku Eperzan se hodnotila v randomizované dvojitě zaslepené aktivně kontrolované 52týdenní studii u 486 pacientů s mírnou, středně závažnou a závažnou poruchou funkce ledvin nedostatečně kontrolovaných současným režimem diety a cvičení nebo jinou antidiabetickou léčbou. Eperzan 30 mg s.c. týdně (s možností titrace na 50 mg týdně dle potřeby) byl srovnáván se sitagliptinem. Sitagliptin byl podáván podle clearance kreatininu odhadnuté podle Cockcroft-Gaultovy rovnice (100 mg denně u mírné, 50 mg u středně závažné a 25 mg denně u závažné poruchy funkce ledvin). Primárním cílem byla změna HbA1c od výchozí hodnoty v 26. týdnu.
Léčba přípravkem Eperzan vedla ve 26. týdnu ke statisticky významnému snížení HbA1c oproti výchozím hodnotám ve srovnání se sitagliptinem. Modelově upravený průměrný pokles HbA1c od výchozího stavu u přípravku Eperzan byl -0,80 (n = 125) u pacientů s mírnou poruchou funkce ledvin (eGFR 60 až 89 ml/min/1,73 m2), -0,83 (n = 98) u pacientů se středně závažnou poruchou funkce ledvin (eGFR 30 až 59 ml/min/1,73 m2), resp. -1,08 (n = 19) u pacientů se závažnou poruchou funkce ledvin (eGFR < 30 ml/min/1,73 m2) (viz Tabulka 9).
Tabulka 9. Výsledky v 26. týdnu ve studii s přípravkem Eperzan 30 mg s.c. týdně (s možností titrace na 50 mg týdne dle potřeby) proti sitagliptinu (dávkovanému podle funkce ledvin) u pacientů s různými stupni poruchy funkce ledvin
|
Eperzan 30 mg/50 mg týdně |
Sitagliptin | |
|
Populace podle původního léčebného záměru (N) |
246 (125 mírná, 98 středně závažná, 19 závažná)a |
240 (122 mírná, 99 středně závažná, 15 závažná)a |
|
HbAic (%) | ||
|
Výchozí hodnota (průměr) Změna ve 26. týdnub Rozdíl proti sitagliptinub (95% CI) |
8,1 -0,8 -0,3 (-0,5; -0,2)c |
8,2 -0,5 |
|
Podíl dosáhnuvších HbAic < 7 % |
43 % |
31 % |
|
Tělesná hmotnost (kg) | ||
|
Výchozí hodnota (průměr) Změna ve 26. týdnub Rozdíl proti sitagliptinub (95% CI) |
84 -0,8 -0,6 (-1,1; -0,1)c |
83 -0,19 |
a Populace podle původního léčebného záměru (intent to treat) - provedeno poslední
pozorování (ITT-LOCF) b Upravený průměr c p < 0,05 u rozdílu v léčbě
Přetrvávání kontroly glykemie
Přetrvávání kontroly glykemie přípravkem Eperzan v čase ve srovnání s jinými třídami antidiabetik užívanými k léčbě diabetes mellitus typu 2 a placebem je ukázáno na Obrázku 1 jako přídavná léčba k metforminu.
Obrázek 1: Kaplan-Meierova křivka popisující přetrvávání kontroly glykemie (měřeno jako doba do záchranné léčby) u přípravku Eperzan ve srovnání se dvěma aktivními kontrolami (sitagliptinem a glimepiridem) a placebem
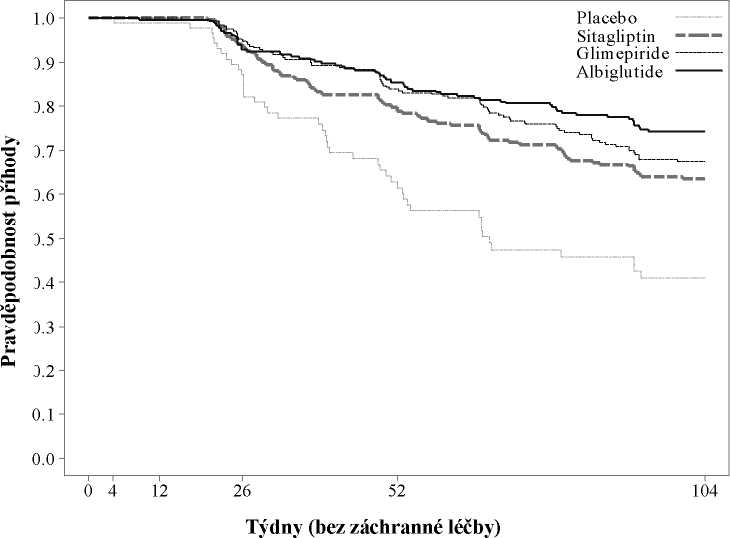
osa x: Týdny (bez záchranné léčby), osa y: Pravděpodobnost příhody Glukóza v plazmě nalačno
Léčba přípravkem Eperzan samotným nebo v kombinaci s jedním nebo dvěma perorálními antidiabetiky vedla ke snížení hladiny glukózy v plazmě nalačno od výchozí hodnoty ve srovnání s placebem o 1,3 až 2,4 mmol/l. Většina tohoto snížení byla pozorována během prvních dvou týdnů léčby.
Kardiovaskulární vyhodnocení:
Pro porovnání kardiovaskulární bezpečnosti přípravku Eperzan (N = 2 524) ve srovnání se všemi srovnávanými přípravky (N = 2 583) byla provedena metaanalýza z 9 klinických studií (8 velkých studií účinnosti a 1 dávku stanovující studie fáze II) s dobou trvání až 3 roky. Výstup nazvaný MACE+ (major adverse cardiac events plus) zahrnoval hospitalizace kvůli nestabilní angině pectoris navíc k výstupům MACE (akutní infarkt myokardu, mozková příhoda a kardiovaskulární úmrtí). Poměr rizika pro přípravek Eperzan proti srovnávané léčbě byl u MACE+ 1,0 (95% CI 0,68; 1,49). Podíl výskytu pozorovaný u MACE+ byl 1,2 příhody na 100 osoboroků u přípravku Eperzan, resp. 1,1 příhody na 100 osoboroků u všech komparátorů.
Pediatrická populace
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem Eperzan u jedné nebo více podskupin pediatrické populace při léčbě diabetes mellitus typu 2 (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Absorpce
Po subkutánním podání jedné 30mg dávky pacientům s diabetem typu 2 bylo maximální koncentrace dosaženo za 3 až 5 dní po podání s průměrným vrcholem koncentrace albiglutidu (Cmax) 1,74 pg/ml a průměrnou plochou pod křivkou v závislosti na čase (AUC) 465 pg.h/ml. Průměrné týdenní koncentrace v rovnovážném stavu po subkutánním podání 30 mg nebo 50 mg albiglutidu stanovené v analýzách farmakokinetiky v populacích ze studií fáze III byly přibližně 2,6 pg/ml, resp. 4,4 pg/ml. Expozice v rovnovážném stavu jsou dosaženy po 3 - 5 týdnech podávání jednou týdně. Expozice při dávkách 30 mg a 50 mg byly konzistentní s dávce úměrným navýšením. U zdravých dobrovolníků však po podávání 50 mg byla koncentrace v rovnovážném stavu v 36. dnu 7,39 pg/ml, tedy vyšší než se předpokládalo podle analýz farmakokinetiky v populacích ze studií fáze III. Po subkutánním podání albiglutidu do břicha, stehna nebo horní části paže je dosahováno podobné expozice.
Distribuce
Průměrný odhad zdánlivého distribučního objemu albiglutidu po subkutánním podání je 11 litrů. Vzhledem k tomu, že albiglutid je albuminová fúzní molekula, nebyla hodnocena vazba na bílkoviny krevní plazmy.
Biotransformace
Albiglutid je bílkovina, jejíž hlavní předpokládanou metabolickou cestou je degradace na menší peptidy a jednotlivé aminokyseliny všudypřítomnými proteolytickými enzymy.
Eliminace
Průměrná zdánlivá clearance albiglutidu je podle analýz farmakokinetiky v populacích ze studií fáze III a naměřených hodnot 67 ml/h s eliminačním poločasem přibližně 5 dní.
Zvláštní populace
Pacienti s poruchou funkce ledvin
V analýze farmakokinetiky v populaci zahrnující studii fáze III u pacientů s mírnou, středně závažnou a závažnou poruchou funkce ledvin byly expozice zvýšeny přibližně o 30 až 40 % u závažné poruchy funkce ledvin ve srovnání s expozicemi pozorovanými u pacientů s diabetem typu 2 s normální funkcí ledvin. Klinická farmakologická studie také ukázala podobný vzestup expozice u pacientů se středně závažnou nebo závažnou poruchou funkce ledvin nebo pacientů na dialýze ve srovnání s pacienty bez poruchy funkce ledvin. Tyto rozdíly nebyly považovány za klinicky významné (viz bod 4.2).
Pacienti s poruchou funkce jater
Klinické studie pro zjištění vlivu poruchy funkce jater na farmakokinetiku přípravku Eperzan nebyly provedeny. Terapeutické bílkoviny, jako je albiglutid, jsou katabolizovány široce distribuovanými proteolytickými enzymy, které se neomezují na jaterní tkáň; proto se nezdá, že by změny funkce jater měly vliv na eliminaci přípravku Eperzan (viz bod 4.2).
Pohlaví
Výsledky analýz farmakokinetiky v populaci neprokázaly žádný klinicky významný vliv pohlaví na clearance.
Rasa a etnikum
Podle výsledků analýz farmakokinetiky v populaci, která zahrnovala bělochy, Afroameričany/Afričany, Asiaty a hispánské/nehispánské pacienty, neměly rasa a etnikum klinicky významný vliv na farmakokinetiku clearance přípravku Eperzan.
U japonských pacientů byla expozice vyšší o přibližně 30 až 40 % než u bělochů, pravděpodobně kvůli nižší tělesné hmotnosti. Tento účinek nebyl považován za klinicky relevantní.
Starší osoby (> 65 let)
Na základě analýzy farmakokinetiky v populaci u jedinců ve věku 24 - 83 let neměl věk klinicky významný vliv na farmakokinetiku albiglutidu (viz bod 4.2).
Tělesná hmotnost
Tělesná hmotnost nemá klinicky významný vliv na AUC albiglutidu v rozmezí 44 až 158 kg. 20% vzestup tělesné hmotnosti vedl k přibližně 18,5% vzestupu clearance.
Pediatrická populace
Pro pediatrické pacienty nejsou dostupné žádné farmakokinetické údaje.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti nebo toxicity po opakovaném podávání neodhalily žádné zvláštní riziko pro člověka. Vzhledem k tomu, že albiglutid je rekombinantní bílkovina, nebyly provedeny studie genotoxicity.
V 52týdenní studii u opic se objevil malý vzestup hmotnosti tkáně slinivky při 50 mg/kg/týden (75násobek klinické expozice na základě AUC) spojený s acinární buněčnou hypertrofií. Byl pozorován také malý nárůst počtu buněk ostrůvků. Změny na slinivce nebyly spojeny s histomorfologickými abnormalitami ani průkazem zvýšené proliferace.
Vzhledem k imunogenitě u hlodavců nebyly s albiglutidem provedeny žádné studie kancerogenity. Ve studiích kancerogenity u hlodavců s jinými agonisty receptoru GLP-1 trvajících 2 roky byly pozorovány tumory štítné žlázy z C-buněk. Ve studiích u hlodavců s těmito jinými látkami bylo pozorováno zvýšení hladin kalcitoninu v séru spojené s hyperplázií C-buněk štítné žlázy a tumory z C-buněk. V 21denní studii u myší vedl albiglutid také k na dávce závislému zvýšení hladin kalcitoninu v séru, což ukazuje, že tumory štítné žlázy u hlodavců jsou také u albiglutidu teoreticky možné. U opic, kterým bylo podáváno až 50 mg/kg/týden po dobu 52 týdnů (75násobek klinické expozice na základě AUC), nebyly pozorovány žádné změny na štítné žláze spojené s albiglutidem. Klinický význam pozorovaných tumorů z C-buněk štítné žlázy u hlodavců není znám.
Ve studiích reprodukční toxicity s albiglutidem u myší nebyl při dávkách do 50 mg/kg/den (nízké násobky klinické expozice) pozorován žádný účinek na páření nebo fertilitu. Při dávce 50 mg/kg/den, dávce spojené s maternální toxicitou (úbytek tělesné hmotnosti a snížení příjmu potravy), byly pozorovány redukce estrogenních cyklů. Vliv na embryofetální vývoj (embryofetální úmrtnost a změny na skeletu) byl pozorován při 50 mg/kg/den (nízké násobky klinické expozice). Potomstvo myší s dávkou 50 mg/kg/den během organogeneze mělo, když bylo kojeno, sníženou tělesnou hmotnost (která se upravila po odstavení), dehydrataci, sníženou teplotu a opožděnou balanopreputiální separaci. Při dávce 5 mg/kg/den (expozice podobné klinické expozici) nebyly pozorovány žádné účinky.
V prenatálních a postnatálních vývojových studiích u myší, kterým byl podáván albiglutid během březosti nebo laktace, byla při dávce > 1 mg/kg/den (expozice nižší než klinická expozice) pozorována snížená tělesná hmotnost potomků F1 generace, když byli kojeni. Snížená tělesná hmotnost potomků F1 generace se upravila po odstavení s výjimkou samic F1 generace od matek, kterým byl albiglutid podáván perinatálně (konec gestace do 10 dnů post partum) v dávkách > 5 mg/kg/den, bez dalších účinků na vývoj. Stopová množství albiglutidu byla detekována v plazmě potomků. Není známo, zda snížení tělesné hmotnosti potomků bylo způsobeno přímým vlivem albiglutidu na potomky nebo sekundárním vlivem na matky.
V prenatálních a postnatálních vývojových studiích u laktujících samic bylo při všech dávkách
(> 1 mg/kg/den) pozorováno zvýšení mortality a morbidity. V předchozích toxikologických studiích u nelaktujících, nebřezích myší ani u březích myší nebyly úhyny pozorovány. Tyto nálezy jsou konzistentní se syndromem laktačního ileu, který byl dříve hlášen u myší. Vzhledem k tomu, že relativní stres z energetických požadavků při laktaci je u člověka mnohem nižší než u myší a že lidé mají větší energetické rezervy, úhyny pozorované u laktujících myší nejsou pro člověka relevantní.
6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek
Prášek pro injekční roztok:
Monohydrát dihydrogenfosforečnanu sodného Hydrogenfosforečnan sodný
Dihydrát trehalosy Mannitol (E421) Polysorbát 80
Rozpouštědlo: Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
3 roky
Po rekonstituci je pero nutno použít během 8 hodin. Pero se užije okamžitě po nasazení jehly, jinak může roztok v jehle zaschnout a ucpat ji.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce při teplotě 2 °C až 8 °C. Chraňte před mrazem.
Pacienti mohou pera uchovávat za pokojové teploty nepřesahující 30 °C maximálně 4 týdny před použitím. Po této době je nutno pero buď použít, nebo zlikvidovat.
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
Dvoukomorová zásobní vložka (DCC) složená z nádoby ze skla typu 1 uzavřené brombutylovými gumovými zátkami a brombutylovým gumovým uzavíracím diskem v polypropylenové manžetě uzávěru. Každá zásobní vložka je zabudovaná do jednorázového plastikového injekčního pera.
Perem se podává jednorázová dávka 30 mg nebo 50 mg přípravku Eperzan v objemu 0,5 ml.
Velikost balení:
Krabička se 4 jednodávkovými pery a 4 jehlami.
Vícečetné balení obsahující 12 jednodávkových per a 12 jehel (3 balení po 4 perech a 4 jehlách).
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Likvidace
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Pokyny pro použití
Eperzan, který byl zmražen, se nesmí použít.
Prohlédněte pero a ujistěte se, že v okénku je vidět číslice „1“. Neukazuje-li se číslice „1“, pero nepoužívejte. Rekonstituce a podání pacientovi
Úplné pokyny pro rekonstituci a podání pacientovi jsou uvedeny v bodu Návod k použití v příbalové informaci pro pacienta.
Poučte pacienta, aby si před zahájením léčby přečetl celý Návod k použití, včetně Otázek a odpovědí, a vrátil se k němu pokaždé před podáním injekce.
Alternativní způsob rekonstituce (pouze pro zdravotnické pracovníky):
Návod k použití v příbalové informaci ukládá pacientovi čekat po smíchání lyofilizovaného prášku a rozpouštědla 15 minut u 30mg pera a 30 minut u 50mg pera k zajištění rekonstituce. Zdravotničtí pracovníci mohou použít následující alternativní způsob rekonstituce, který umožňuje rychlejší disoluci. Vzhledem k tomu, že tento způsob je založen na správném míchání a vizuální kontrole roztoku, je určen pouze pro zdravotnické pracovníky.
Zkontrolujte, že v okénku pera je vidět číslice „1“ a zkontrolujte datum exspirace.
Postupujte podle návodu a otáčejte zásobní vložkou, dokud se v okénku neobjeví „2“ a neuslyšíte cvaknutí. To smíchá rozpouštědlo v zadní komoře zásobní vložky s lyofilizovaným práškem v přední komoře. Lehce kružte perem po dobu jedné minuty tak, aby průhledná zásobní vložka směřovala vzhůru. Vyvarujte se protřepávání, protože může vést k tvorbě pěny. Zkontrolujte a pokračujte v kroužení perem, dokud se nerozpustí všechen prášek. Ke kompletnímu rozpuštění dojde u 30mg pera obvykle během 2 minut, ale může trvat až 5 minut; to se ověří vizuální kontrolou nepřítomnosti částic v čirém roztoku. Ke kompletnímu rozpuštění dojde u 50mg pera obvykle během 7 minut, ale může trvat až 10 minut. Malé množství pěny nad roztokem po rekonstituci je normální.
Po rekonstituci pokračujte v krocích uvedených v návodu k použití pro nasazení jehly, přípravu injektoru pera a podání injekce.
Použijte Eperzan pouze, pokud se jedná o čirý roztok, který neobsahuje žádné částice.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Trading Services Limited, Currabinny,
Carrigaline,
County Cork, Irsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/13/908/001
EU/1/13/908/002
EU/1/13/908/003
EU/1/13/908/004
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 21. března 2014
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce biologické léčivé látky
GlaxoSmithKline LLC Building 40 893 River Road Conshohocken, PA 19428 USA
Název a adresa výrobce odpovědného za propouštění šarží
Glaxo Operations UK Limited (Trading as Glaxo Wellcome Operations)
Harmire Road Barnard Castle Durham, DL12 8DT Velká Británie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA - balení pro 4 pera
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Eperzan 30 mg prášek a rozpouštědlo pro injekční roztok Albiglutidum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna dávka obsahuje po rekonstituci 30 mg v 0,5 ml.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje také: monohydrát dihydrogenfosforečnanu sodného, hydrogenfosforečnan sodný, dihydrát trehalosy, mannitol (E421), polysorbát 80, vodu na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek a rozpouštědlo pro injekční roztok
4 pera 4 jehly
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Přečtěte si příbalovou informaci. Subkutánní podání.
Jednou týdně.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO
DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Pouze k jednorázovému použití.
Po použití pero zlikvidujte.
Přečtěte si příbalovou informaci.
Po smíchání počkejte před injekcí 15 minut.
8. POUŽITELNOST
EXP
Uchovávejte v chladničce při teplotě 2 °C až 8 °C.
Chraňte před mrazem.
Pera lze uchovávat za pokojové teploty nepřesahující 30 °C maximálně 4 týdny před použitím.
Použijte během 8 hodin po rekonstituci.
Použijte okamžitě po nasazení jehly.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ
NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Trading Services Limited
Currabinny
Carrigaline
County Cork
Irsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/908/001
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
eperzan 30
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
PC:
SN:
NN:
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA
Vícečetné balení obsahující 12 jednodávkových per a 12 jehel (3 balení po 4 perech a 4 jehlách) Bez blue boxu
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Eperzan 30 mg prášek a rozpouštědlo pro injekční roztok Albiglutidum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna dávka obsahuje po rekonstituci 30 mg v 0,5 ml.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje také: monohydrát dihydrogenfosforečnanu sodného, hydrogenfosforečnan sodný, dihydrát trehalosy, mannitol (E421), polysorbát 80, vodu na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek a rozpouštědlo pro injekční roztok
Komponenty vícečetného balení skládajícího se ze 3 balení, každé obsahující 4 pera a 4 jehly.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Přečtěte si příbalovou informaci. Subkutánní podání.
Jednou týdně.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO
DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Pouze k jednorázovému použití.
Po použití pero zlikvidujte.
Přečtěte si příbalovou informaci.
Po smíchání počkejte před injekcí 15 minut.
8. POUŽITELNOST
EXP
Uchovávejte v chladničce při teplotě 2 °C až 8 °C.
Chraňte před mrazem.
Jednu krabičku obsahující 4 pera a 4 jehly lze uchovávat za pokojové teploty nepřesahující 30 °C maximálně 4 týdny před použitím. Ostatní krabičky musí být uchovávány při teplotě 2 °C až 8 °C dokud nejsou zapotřebí.
Použijte během 8 hodin po rekonstituci.
Použijte okamžitě po nasazení jehly.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Trading Services Limited
Currabinny
Carrigaline
County Cork
Irsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/908/003
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
eperzan 30
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA
Vícečetné balení obsahující 12 jednodávkových per a 12 jehel (3 balení po 4 perech a 4 jehlách) S blue boxem
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Eperzan 30 mg prášek a rozpouštědlo pro injekční roztok Albiglutidum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna dávka obsahuje po rekonstituci 30 mg v 0,5 ml.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje také: monohydrát dihydrogenfosforečnanu sodného, hydrogenfosforečnan sodný, dihydrát trehalosy, mannitol (E421), polysorbát 80, vodu na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek a rozpouštědlo pro injekční roztok
Vícečetné balení: 12 per (3 balení po 4 perech/4 jehlách) Neprodávejte samostatně
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Přečtěte si příbalovou informaci. Subkutánní podání.
Jednou týdně.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO
DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Pouze k jednorázovému použití.
Po použití pero zlikvidujte.
Přečtěte si příbalovou informaci.
Po smíchání počkejte před injekcí 15 minut.
8. POUŽITELNOST
Uchovávejte v chladničce při teplotě 2 °C až 8 °C.
Chraňte před mrazem.
Jednu krabičku obsahující 4 pera a 4 jehly lze uchovávat za pokojové teploty nepřesahující 30 °C maximálně 4 týdny před použitím. Ostatní krabičky musí být uchovávány při teplotě 2 °C až 8 °C dokud nejsou zapotřebí.
Použijte během 8 hodin po rekonstituci.
Použijte okamžitě po nasazení jehly.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Trading Services Limited
Currabinny
Carrigaline
County Cork
Irsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/908/003
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
eperzan 30
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
|
JEDINEČNÝ IDENTIFIKÁTOR - |
- DATA ČITELNÁ OKEM |
|
PC: SN: NN: |
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA - balení pro 4 pera
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Eperzan 50 mg prášek a rozpouštědlo pro injekční roztok Albiglutidum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna dávka obsahuje po rekonstituci 50 mg v 0,5 ml.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje také: monohydrát dihydrogenfosforečnanu sodného, hydrogenfosforečnan sodný, dihydrát trehalosy, mannitol (E421), polysorbát 80, vodu na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek a rozpouštědlo pro injekční roztok
4 pera 4 jehly
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Přečtěte si příbalovou informaci. Subkutánní podání.
Jednou týdně.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO
DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Pouze k jednorázovému použití.
Po použití pero zlikvidujte.
Přečtěte si příbalovou informaci.
Doba rekonstituce
Po smíchání počkejte před injekcí 30 minut.
8. POUŽITELNOST
Uchovávejte v chladničce při teplotě 2 °C až 8 °C.
Chraňte před mrazem.
Pera lze uchovávat za pokojové teploty nepřesahující 30 °C maximálně 4 týdny před použitím.
Použijte během 8 hodin po rekonstituci.
Použijte okamžitě po nasazení jehly.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Trading Services Limited
Currabinny
Carrigaline
County Cork
Irsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/908/002
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
eperzan 50
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
PC:
SN:
NN:
KRABIČKA
Vícečetné balení obsahující 12 jednodávkových per a 12 jehel (3 balení po 4 perech a 4 jehlách) Bez blue boxu
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Eperzan 50 mg prášek a rozpouštědlo pro injekční roztok Albiglutidum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna dávka obsahuje po rekonstituci 50 mg v 0,5 ml.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje také: monohydrát dihydrogenfosforečnanu sodného, hydrogenfosforečnan sodný, dihydrát trehalosy, mannitol (E421), polysorbát 80, vodu na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek a rozpouštědlo pro injekční roztok
Komponenty vícečetného balení skládajícího se ze 3 balení, každé obsahující 4 pera a 4 jehly. Neprodávejte samostatně
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Přečtěte si příbalovou informaci. Subkutánní podání.
Jednou týdně.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO
DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Pouze k jednorázovému použití.
Po použití pero zlikvidujte.
Přečtěte si příbalovou informaci.
Doba rekonstituce
Po smíchání počkejte před injekcí 30 minut.
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce při teplotě 2 °C až 8 °C.
Chraňte před mrazem.
Jednu krabičku obsahující 4 pera a 4 jehly lze uchovávat za pokojové teploty nepřesahující 30 °C maximálně 4 týdny před použitím. Ostatní krabičky musí být uchovávány při teplotě 2 °C až 8 °C dokud nejsou zapotřebí.
Použijte během 8 hodin po rekonstituci.
Použijte okamžitě po nasazení jehly.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ
NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Trading Services Limited
Currabinny
Carrigaline
County Cork
Irsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/908/004
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
eperzan 50
JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
KRABIČKA
Vícečetné balení obsahující 12 jednodávkových per a 12 jehel (3 balení po 4 perech a 4 jehlách) S blue boxem
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Eperzan 50 mg prášek a rozpouštědlo pro injekční roztok Albiglutidum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna dávka obsahuje po rekonstituci 50 mg v 0,5 ml.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje také: monohydrát dihydrogenfosforečnanu sodného, hydrogenfosforečnan sodný, dihydrát trehalosy, mannitol (E421), polysorbát 80, vodu na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek a rozpouštědlo pro injekční roztok
Vícečetné balení: 12 per (3 balení po 4 perech/4 jehlách) Neprodávejte samostatně
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Přečtěte si příbalovou informaci. Subkutánní podání.
Jednou týdně.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO
DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Pouze k jednorázovému použití.
Po použití pero zlikvidujte.
Přečtěte si příbalovou informaci.
Doba rekonstituce
Po smíchání počkejte před injekcí 30 minut.
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce při teplotě 2 °C až 8 °C.
Chraňte před mrazem.
Jednu krabičku obsahující 4 pera a 4 jehly lze uchovávat za pokojové teploty nepřesahující 30 °C maximálně 4 týdny před použitím. Ostatní krabičky musí být uchovávány při teplotě 2 °C až 8 °C dokud nejsou zapotřebí.
Použijte během 8 hodin po rekonstituci.
Použijte okamžitě po nasazení jehly.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ
NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Trading Services Limited
Currabinny
Carrigaline
County Cork
Irsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/908/004
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
eperzan 50
2D čárový kód s jedinečným identifikátorem.
|
JEDINEČNÝ IDENTIFIKÁTOR - |
- DATA ČITELNÁ OKEM |
|
PC: SN: NN: |
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Eperzan 30 mg prášek a rozpouštědlo pro injekční roztok
Albiglutidum
Subkutánní podání
Jednou týdně
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
30 mg
6. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Eperzan 50 mg prášek a rozpouštědlo pro injekční roztok
Albiglutidum
Subkutánní podání
Jednou týdně
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
50 mg
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
Eperzan 30 mg prášek a rozpouštědlo pro injekční roztok
Albiglutidum
'VTento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Eperzan a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Eperzan používat
3. Jak se Eperzan používá
4. Možné nežádoucí účinky
5. Jak Eperzan uchovávat
6. Obsah balení a další informace
Návod k použití předplněného pera (na druhé straně)
Otázky a odpovědi k návodu k použití předplněného pera
Přečtěte si obě strany této příbalové informace.
1. Co je Eperzan a k čemu se používá
Eperzan obsahuje léčivou látku albiglutid, která patří do skupiny léčivých přípravků nazývaných agonisté receptoru GLP-1, jež se používají ke snížení cukru (glukózy) v krvi u dospělých s diabetem (cukrovkou) typu 2.
Cukrovku typu 2 máte:
• proto, že Vaše tělo nevytváří dostatek insulinu ke kontrole hladiny cukru v krvi nebo
• proto, že Vaše tělo není schopno použít insulin správně.
Eperzan pomáhá Vašemu tělu zvýšit tvorbu insulinu, když je hladina cukru v krvi vysoká.
Eperzan se používá ke kontrole cukru v krvi:
- samotný, není-li cukr v krvi dostatečně kontrolován samotnou dietou a cvičením a nemůžete-li užívat metformin (jiné antidiabetikum)
nebo
- v kombinaci s jinými antidiabetiky užívanými ústy (jako metformin nebo léčivé přípravky známé jako deriváty sulfonylmočoviny nebo thiazolidindiony) nebo s insulinem.
Je velmi důležité, abyste během používání přípravku Eperzan pokračoval(a) v dodržování diety a způsobu života, který Vám doporučil lékař.
2. Čemu musíte věnovat pozornost, než začnete Eperzan používat Nepoužívejte Eperzan:
- jestliže jste alergický(á) na albiglutid nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Myslíte-li si, že se Vás to týká, nepoužívejte Eperzan bez porady s lékařem, zdravotní sestrou nebo lékárníkem.
Upozornění a opatření
Před použitím přípravku Eperzan se poraďte se svým lékařem, zdravotní sestrou nebo lékárníkem:
• Máte-li cukrovku typu 1 (závislou na insulinu) nebo ketoacidózu (velmi závažnou komplikaci cukrovky, ke které dojde, pokud Vaše tělo není schopno rozkládat glukosu, protože nemá dostatek insulinu), tento léčivý přípravek není pro Vás správný. Poraďte se s lékařem, jak poznat příznaky ketoacidózy, a pokud se vyskytnou, vyhledejte okamžitě lékařskou pomoc.
• Pokud jste kdykoli v minulosti měl(a) pankreatitidu (zánět slinivky břišní). Váš lékař rozhodne, zda můžete Eperzan používat a vysvětlí Vám příznaky pankreatitidy (viz bod 4).
• Užíváte-li na cukrovku derivát sulfonylmočoviny nebo insulin, protože může dojít ke snížení hladiny cukru v krvi (hypoglykemii). Pro snížení tohoto rizika může Váš lékař upravit dávku těchto jiných přípravků (známky nízkého krevního cukru viz „Velmi časté nežádoucí účinky“ v bodu 4).
• Máte-li vážné problémy s vyprazdňováním žaludku (gastroparéza) nebo máte-li závažné onemocnění střev (závažné onemocnění trávicího traktu). Vyskytují-li se u Vás tyto stavy, používání přípravku Eperzan se nedoporučuje.
Před používáním přípravku Eperzan se poraďte s lékařem, zdravotní sestrou nebo lékárníkem, pokud se domníváte, že se Vás cokoli z výše uvedeného týká.
Děti a dospívající
Není známo, zda je Eperzan bezpečný a účinný u osob mladších než 18 let. Eperzan se u dětí a dospívajících nedoporučuje.
Další léčivé přípravky a Eperzan
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat (viz také výše uvedený bod 2 „Upozornění a opatření“).
Trpíte-li neprůchodností střev, neměl(a) byste užívat akarbosu.
Poraďte se s lékařem, pokud užíváte zároveň akarbosu a Eperzan.
Těhotenství, kojení a plodnost
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem, zdravotní sestrou nebo lékárníkem dříve, než začnete tento přípravek užívat. Existuje-li možnost, že můžete otěhotnět, musíte během používání tohoto přípravku užívat účinnou antikoncepci.
Okamžitě oznamte svému lékaři, zdravotní sestře nebo lékárníkovi, pokud během léčby přípravkem Eperzan otěhotníte.
O bezpečnosti přípravku Eperzan u těhotných žen nejsou žádné informace. Během těhotenství se Eperzan nesmí používat.
Pokud plánujete otěhotnět, může lékař rozhodnout ukončit léčbu přípravkem Eperzan alespoň jeden měsíc před plánovaným těhotenstvím. Je to proto, že vyplavení přípravku Eperzan z těla trvá delší dobu.
Kojení
Kojíte-li, musíte se před používáním přípravku Eperzan poradit s lékařem. Není známo, zda se Eperzan vylučuje do mateřského mléka. Spolu s lékařem rozhodnete, zda budete používat Eperzan, nebo kojit. Obojí společně není možné.
Plodnost
Není známo, zda Eperzan může ovlivnit plodnost u mužů nebo u žen.
Řízení dopravních prostředků a obsluha strojů
Eperzan nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje. Používáte-li však Eperzan s derivátem sulfonylmočoviny nebo insulinem, může se hladina cukru v krvi snížit (hypoglykemie). To může působit problémy se soustředěním, můžete pociťovat závratě nebo být ospalý(á). Dojde-li k tomu, neřiďte dopravní prostředky ani neobsluhujte stroje.
Obsah sodíku
Tento přípravek obsahuje méně než 1 mmol (23 mg) sodíku v jedné 0,5ml dávce, tj. v podstatě je „bez sodíku“.
3. Jak se Eperzan používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře, zdravotní sestry nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem, zdravotní sestrou nebo lékárníkem.
Doporučená dávka přípravku je 30 mg jednou týdně, která se vpichuje tentýž den každý týden. Lékař může zvýšit dávku na 50 mg jednou týdně, pokud 30mg dávkou není Váš cukr v krvi dostatečně kontrolován. Je-li to nutné, můžete změnit den v týdnu, kdy používáte Eperzan, za podmínky, že od poslední dávky uplynuly alespoň 4 dny.
Eperzan můžete použít v jakoukoli denní dobu buď s jídlem nebo nalačno.
Eperzan je dodáván v injektoru typu pera, kterým si jej můžete vstříknout sám(sama). Požádejte svého lékaře, zdravotní sestru nebo lékárníka aby Vám ukázal, jak se to správně dělá. Vpíchnete Eperzan pod kůži v oblasti břicha, stehna nebo zadní horní části paže. Každý týden můžete vpichovat do téže oblasti na těle, ale nevpichujte pokaždé do přesně téhož místa.
Eperzan se nesmí vstřikovat do žíly (intravenózně) ani do svalu (intramuskulárně).
Injektor typu pera obsahuje prášek a vodu, které musíte před použitím smíchat. Za bodem 6 této příbalové informace je Návod k použití, který Vám poskytne pokyny k přípravě léčivého přípravku a k jeho vpíchnutí krok za krokem. Máte-li otázky nebo nerozumíte-li tomu, jak se pero používá, poraďte se se svým lékařem, zdravotní sestrou nebo lékárníkem.
Nikdy nemíchejte dohromady insulin s přípravkem Eperzan. Potřebujete-li použít obojí ve stejnou dobu, použijte dvě různé injekce. Můžete vpíchnout obě injekce do téže oblasti těla (například do oblasti břicha), ale neměl(a) byste aplikovat injekce velmi blízko k sobě.
Jestliže jste použil(a) více přípravku Eperzan, než jste měl(a)
Použijete-li příliš mnoho přípravku Eperzan, poraďte se s lékařem nebo lékárníkem. Je-li to možné, ukažte jim obal nebo tuto příbalovou informaci. Můžete cítit silný pocit na zvracení (závažná nauzea), zvracet nebo mít bolesti hlavy.
Jestliže jste zapomněl(a) použít Eperzan
Pokud vynecháte dávku, vpíchněte si další dávku, co nejdříve si vzpomenete, do 3 dnů od vynechané dávky. Poté se můžete vrátit k obvyklému dni podávání injekce. Pokud od vynechané dávky uplynuly již více než 3 dny, počkejte s další injekcí na svůj obvyklý plánovaný den. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) používat Eperzan
Používejte Eperzan tak dlouho, dokud Vám to lékař doporučuje. Přestanete-li používat Eperzan, může to ovlivnit hladinu cukru v krvi. Nepřestávejte v používání, pokud Vám to lékař nedoporučí.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Riziko akutní pankreatitidy (zánětu slinivky břišní)
Pankreatitida byla hlášena jako méně častý nežádoucí účinek. Může postihnout až 1 ze 100 osob. Pankreatitida může být závažná a život ohrožující.
Vyskytne-li se u Vás:
• úporná bolest břicha, která nepolevuje, může se jednat o příznak pankreatitidy. Bolest může, ale nemusí, být provázena zvracením. Bolest může vyzařovat z přední části (břicha) do zad.
Přestaňte Eperzan používat a okamžitě se poraďte s lékařem.
Další nežádoucí účinky hlášené u přípravku Eperzan Velmi časté: mohou postihnout více než 1 z 10 osob:
• nízká hladina cukru v krvi (hypoglykemie) při používání přípravku Eperzan v kombinaci s insulinem nebo derivátem sulfonylmočoviny. Varovné příznaky nízké hladiny cukru v krvi mohou zahrnovat studený pot, studenou bledou kůži, bolest hlavy, pocit ospalosti, slabosti, závratě, zmatenosti nebo podráždění, pocit hladu, rychlý tlukot srdce a pocit neklidu. Lékař Vás seznámí s tím, co máte dělat, pokud máte nízkou hladinu cukru v krvi.
• průjem;
• pocit na zvracení (nauzea);
• vyrážka, zčervenání nebo svědění kůže v místě vpichu přípravku Eperzan.
Časté: mohou postihnout až 1 z 10 osob:
• infekce plic (pneumonie);
• nízká hladina cukru v krvi (hypoglykemie) při používání přípravku Eperzan samotného nebo v kombinaci s metforminem nebo pioglitazonem;
• nepravidelný tlukot srdce;
• zvracení;
• zácpa;
• nechutenství;
• pálení žáhy (gastroezofageální reflux).
Méně časté: mohou postihnout až 1 ze 100 osob:
• obstrukce (neprůchodnost) střeva.
Vzácné: mohou postihnout až 1 z 1 000 osob:
• alergická reakce (přecitlivělost).
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Eperzan uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na peru a na krabičce za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Pero a jehly uchovávejte do použití v původní krabičce.
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem. Tento léčivý přípravek nelze uchovávat při pokojové teplotě (nižší než 30 °C) déle než celkem 4 týdny před použitím. Po této době je nutno pero/pera buď použít, nebo zlikvidovat.
• Po smíchání prášku a tekutiny v peru je nutno pero použít během 8 hodin.
• Pero použijte okamžitě po nasazení a přípravě jehly, jinak může roztok zaschnout uvnitř jehly a ucpat ji.
Každé pero použijte pouze jednou.
Po použití pera jehlu neodstraňujte. Zbavte se pera tak, jak Vám poradil lékař, zdravotní sestra nebo lékárník.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co Eperzan obsahuje
- Léčivou látkou je albiglutidum.
- Jedno pero poskytne albiglutidum 30 mg v dávce 0,5 ml. Rozpouštědlem je voda na injekci.
- Dalšími složkami jsou: monohydrát dihydrogenfosforečnanu sodného a hydrogenfosforečnan sodný (viz bod 2 „Obsah sodíku“), dihydrát trehalosy, mannitol (E421), polysorbát 80.
Jak Eperzan vypadá a co obsahuje toto balení
Eperzan je dodáván jako pero k injekci pacientem. Každé pero obsahuje bílý až žlutý prášek a bezbarvé rozpouštědlo v oddělených komorách. S každým perem je dodána jehla.
Pera jsou dodávána v baleních obsahujících 4 pera a 4 jehly a ve vícečetných baleních skládajících se ze 3 balení, každé obsahující 4 pera a 4 jehly. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
GlaxoSmithKline Trading Services Limited, Currabinny, Carrigaline, County Cork, Irsko Jméno a adresa výrobce odpovědného za propouštění šarží:
|
Glaxo Operations UK Limited (Trading as Harmire Road Barnard Castle Durham DL12 8DT Velká Británie |
Glaxo Wellcome Operations) |
|
Další informace o tomto přípravku získáte |
u místního zástupce držitele rozhodnutí o registraci: |
|
Belgie/Belgique/Belgien GlaxoSmithKline Pharmaceuticals s.a./n.v Tél/Tel: + 32 (0)10 85 52 00 |
Luxembourg/Luxemburg . GlaxoSmithKline Pharmaceuticals s.a./n.v Belgique/Belgien Tél/Tel: + 32 (0)10 85 52 00 |
|
Btarapna raaKcoCMHTKaaňH EOOfl Tea.: + 359 2 953 10 34 |
Magyarország GlaxoSmithKline Kft. Tel.: + 36 1 225 5300 |
|
Česká republika GlaxoSmithKline s.r.o. Tel: + 420 222 001 111 cz.info@gsk.com |
Malta GlaxoSmithKline Malta Tel: + 356 21 238131 |
|
Danmark GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 info@glaxosmithkline.dk |
Nederland GlaxoSmithKline BV Tel: + 31 (0)30 6938100 nlinfo@gsk.com |
|
Deutschland GlaxoSmithKline GmbH & Co. KG Tel.: + 49 (0)89 36044 8701 produkt.info@gsk.com |
Norge GlaxoSmithKline AS Tlf: + 47 22 70 20 00 firmapost@gsk.no |
|
Eesti GlaxoSmithKline Eesti OU Tel: + 372 6676 900 estonia@gsk.com |
Osterreich GlaxoSmithKline Pharma GmbH Tel: + 43 (0)1 97075 0 at.info@gsk.com |
|
EXlába GlaxoSmithKline A.E.B.E. Tqk + 30 210 68 82 100 |
Polska GSK Services Sp. z.o.o. Tel.: + 48 (0)22 576 9000 |
|
Espaňa GlaxoSmithKline, S.A. Tel: + 34 902 202 700 es-ci@gsk.com France |
Portugal GlaxoSmithKline - Produtos Farmaceuticos, Lda. Tel: + 351 21 412 95 00 FI.PT@gsk.com |
|
Laboratoire GlaxoSmithKline Tél: + 33 (0)1 39 17 84 44 diam@gsk.com Hrvatska |
Románia GlaxoSmithKline (GSK) S.R.L. Tel: + 4021 3028 208 |
GlaxoSmithKline d.o.o. Tel:++385 1 6051 999
|
Ireland GlaxoSmithKline (Ireland) Limited Tel: + 353 (0)1 4955000 |
Slovenija GlaxoSmithKline d.o.o. Tel: + 386 (0)1 280 25 00 medical.x.si@gsk.com |
|
Ísland Vistor hf. Sími: + 354 535 7000 |
Slovenská republika GlaxoSmithKline Slovakia s. r. o. Tel: + 421 (0)2 48 26 11 11 recepcia.sk@gsk.com |
|
Italia GlaxoSmithKline S.p.A. Tel: + 39 (0)45 9218 111 |
Suomi/Finland GlaxoSmithKline Oy Puh/Tel: + 358 (0)10 30 30 30 Finland.tuoteinfo@gsk.com |
|
Kónpoq GlaxoSmithKline (Cyprus) Ltd Tqk + 357 22 39 70 00 gskcyprus@gsk.com |
Sverige GlaxoSmithKline AB Tel: + 46 (0)31 67 09 00 info .produkt@g sk. com |
|
Latvija GlaxoSmithKline Latvia SIA Tel: + 371 67312687 lv-epasts@gsk.com Lietuva GlaxoSmithKline Lietuva UAB Tel: + 370 5 264 90 00 info.lt@gsk.com |
United Kingdom GlaxoSmithKline UK Tel: + 44 (0)800 221441 customercontactuk@gsk.com |
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
ČS POZOR:
Pero nesmí zmrznout. Zmrzlo-li, vyhoďte ho.
Pero Eperzan 30 mg jednou týdně
Pozorně si přečtěte níže uvedené pokyny včetně Otázek a odpovědí a postupujte podle návodu, abyste přípravek smíchal(a) a připravil(a) pero k injekci.
Uschovejte si tento návod a použijte ho pokaždé když si budete připravovat svůj lék.
Nebudete-li sledovat kroky A až C ve správném pořadí, může dojít k poškození pera.
Charakterizace pera
> Pero obsahuje léčivý prášek v jedné komoře a vodu v jiné komoře. Bude nutné je smíchat otáčením pera.
i

Okénko
Injekční tlačítko*
* Injekční tlačítko je zasunuto, dokud pero není připraveno k injekci.
Číslo 3: Jsou odstraněny velké vzduchové bubliny, objevilo se injekční tlačítko a pero je připraveno k injekci.
Číslo 2: Prášek přípravku a voda jsou smíchány. Čekejte 15 minut, poté nasaďte jehlu.
Číslo 1: Pero je připraveno. Prášek přípravku a voda jsou v oddělených komorách průhledné zásobní vložky.
Při uchovávání v chladničce jej před započetím kroku A ponechte 15 minut při pokojové teplotě.
Jehly znovu nepoužívejte, nenasazujte na ně zpět kryt ani je z pera neodstraňujte. Ihned po injekci pero vyhoďte.
Než začnete: umyjte si ruce, shromážděte a zkontrolujte všechen materiál.
> Umyjte si ruce.
> Vyjměte pero a novou jehlu z krabičky a zkontrolujte štítek na peru, abyste se ujistil(a), že se jedná o Vám předepsanou dávku.
> Připravte si čistý prázdný pohárek, ve kterém bude pero stát během smíchávání přípravku, minutku/stopky pro měření doby do rozpuštění a nádobu pro vyhození pera (tyto předměty nejsou součástí přípravku).
Čistý prázdný pohárek

Minutka / stopky

KROK A: Kontrola pera a smíchání přípravku Zkontrolujte pero
> Ujistěte se, že máte připraveny všechny náležitosti uvedené výše (pero, jehlu, pohárek, minutku, nádobu na vyhození).
> Zkontrolujte dobu použitelnosti pera. Nepoužívejte je po jejím uplynutí.
ZKONTROLUJTE DOBU POUŽITELNOSTI
> Zkontrolujte, zda je v okénku pera číslice [1].
Pokud se neobjevuje [1], NEpoužívejte jej.
Otáčejte perem, abyste promíchal(a) Váš léčivý přípravek
> Držte tělo pera průhlednou zásobní vložkou směrem vzhůru tak, abyste v okénku viděl(a) číslici [1].
> Druhou rukou otáčejte průhlednou zásobní vložkou ve směru šipky (ve směru hodinových ručiček), dokud neucítíte/neuslyšíte „cvaknutí“ a neuvidíte v okénku číslici [2]. Tím se v průhledné zásobní vložce smíchá prášek přípravku s tekutinou.
"CVAK"
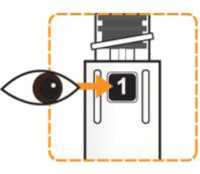
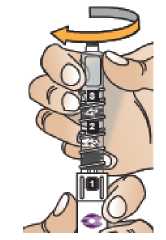
LJ
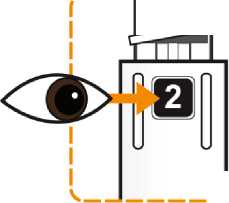
J_J
>
Pomalu a opatrně zakývejte 5krát perem ze strany na stranu, aby se přípravek smíchal (jako stěrače u auta). NEtřeste perem příliš intenzivně, aby se zabránilo tvorbě pěny, která může ovlivnit Vaši dávku.
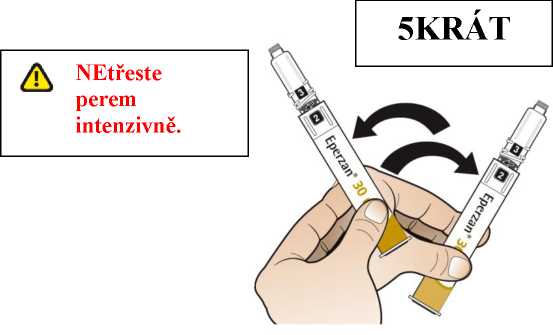
Čekejte, dokud se léčivý přípravek nerozpustí
> Umístěte pero do čistého prázdného pohárku průhlednou zásobní vložkou směrem vzhůru.

> Nastavte minutku/stopky na 15 minut.

Než přistoupíte ke kroku B, musíte počkat 15 minut, než se přípravek rozpustí.
Než se přistoupí ke kroku B, může být pero s naředěným léčivem uchováváno nejvýše po dobu 8 hodin. Po připojení jehly je nutno pero použít okamžitě.
KROK B: Nasazení jehly a příprava pera k injekci
Po 15 minutách čekání si umyjte ruce a proveďte všechny další kroky naráz.
Zkontrolujte rozpuštěný přípravek

> Opět pomalu a opatrně 5krát zakývejte perem ze strany na stranu, aby se přípravek promíchal (jako stěrače u auta). NEtřeste perem příliš intenzivně, aby se zabránilo tvorbě pěny, která může ovlivnit Vaši dávku.
OPAKOVANÉ KÝVANÍ /!\
“ NEtřeste
perem intenzivně
> Zkontrolujte pohledem do okénka, zda tekutina v zásobní vložce je čirá a bez pevných částic.
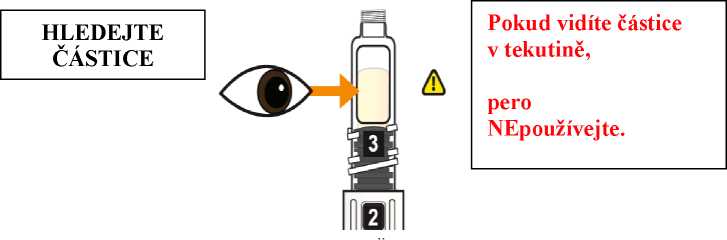
> Tekutina bude mít žlutou barvu a na jejím povrchu budou velké vzduchové bubliny. Nasaďte jehlu
> Z vnějšího krytu jehly odstraňte nálepku.
> Držte pero průhlednou zásobní vložkou směrem vzhůru.
> Stlačujte jehlu dolů na zásobní vložku, dokud neucítíte/neuslyšíte „cvaknutí“ - to znamená, že jehla je nasazena.
|
M | |
|
1 | |
Poklepejte kvůli vzduchovým bublinám
> Poklepejte lehce 2 - 3krát na průhlednou zásobní vložku s jehlou směřující vzhůru, aby velké vzduchové bubliny vypluly vzhůru.
Malé bubliny nevadí a není nutno je dostat vzhůru. Otáčejte perem, abyste připravil(a) jehlu
> PO nasazení jehly, kdy je v okénku číslice [2], pomalu otočte průhlednou zásobní vložkou
několikrát ve směru šipky (ve směru hodinových ručiček), dokud neucítíte/neuslyšíte „cvaknutí“ a neuvidíte v okénku číslici [3]. To odstraní ze zásobníku velké vzduchové bubliny. Ze spodní části pera také vyjede injekční tlačítko.
“CVAK”
Odstranění oboi kryty jehly
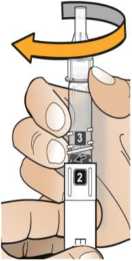
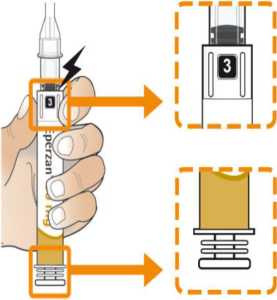
> Opatrně odstraňte vnější kryt jehly a poté vnitřní kryt jehly. Z jehly může odkápnout několik kapek
tekutiny. To je normální.
Krok 1: Odstraňte vnější kryt jehly
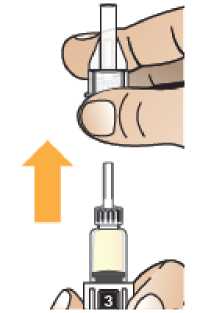
Krok 2: Odstraňte vnitřní
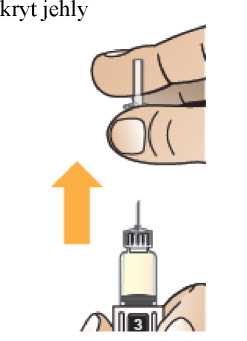
Vpíchněte léčivý přípravek
>
Píchněte jehlu do kůže na břiše, stehnu nebo horní části paže a vstříkněte tak, jak Vám to ukázal lékař nebo zdravotní sestra.

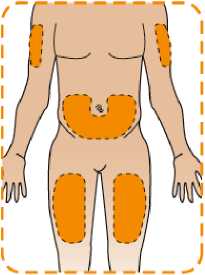
>
>
Abyste vstříkl(a) Váš léčivý přípravek, stlačujte palcem pomalu a rovnoměrně injekční tlačítko. Čím pomaleji stlačujete, tím lépe budete injekci snášet.
Držte injekční tlačítko stlačené, dokud neuslyšíte „cvaknutí“ Stále držte palec na tlačítku a pomalu počítejte do 5, aby byla aplikována celá dávka přípravku.
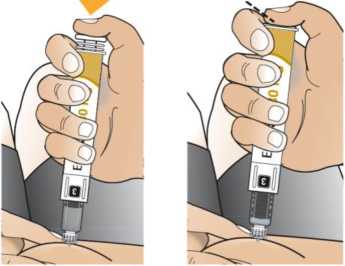
Vstřikujte pomalu a rovnoměrně. Po cvaknutí" počítejte do 5, aby byla aplikována celá dávka.
> Až napočítáte do 5, vytáhněte jehlu z kůže.
Vyhoďte pero
> Nenasazujte zpět kryt na jehlu, ani neodstraňujte jehlu z pera.
> Nevyhazujte použité pero do domácího odpadu. Vyhoďte pero podle pokynů svého lékaře nebo lékárníka.
Otázky a odpovědi Okénko s číslicí
Jsou číslice 1, 2 a 3 způsob, jak si volím dávku léčivého přípravku?
> Nikoli, dávku přípravku si nevolíte. Číslice Vám pomáhají připravit a podat léčivý přípravek. Číslice 1 - Pero je připraveno k použití. Prášek přípravku a voda jsou v oddělených komorách průhledné zásobní vložky.
Číslice 2 - Prášek přípravku a voda jsou smíchány a poté lehce promíseny. Čekejte 15 minut, potom nasaďte jehlu.
Číslice 3 - Velké vzduchové bubliny jsou odstraněny, objevilo se injekční tlačítko, pero je připraveno k injekci.
Co se stane, pokud neslyším „CVAK“, když se v okénku objeví číslice 2 nebo 3?
> Pokud neuslyšíte „cvak“ když se v okénku objeví číslice 2 nebo 3, možná není číslice v okénku přesně uprostřed. Pomalu otočte průhlednou zásobní vložkou nepatrně ve směru hodinových ručiček, abyste dokončil(a) „cvaknutí“ a číslici umístil(a) doprostřed okénka.
Krok A - Kontrola pera a smíchání přípravku
Co se stane, pokud jsem nečekal(a) 15 minut po změně na číslici 2 na peru?
> Pokud jste nečekal(a) plných 15 minut, je možné, že léčivo není plně smícháno s vodou. To může vést ke vznášení se částic v průhledné zásobní vložce, neúčinné dávce a/nebo ucpání jehly. Čekání celých 15 minut zajišťuje, že se prášek přípravku a voda správně promísí, i když se Vám vizuálně může zdát, že jsou promíchány dříve.
Co se stane, pokud nechám pero po změně na číslici 2 v kroku A stát více než 15 minut?
> Dokud nebyla nasazena jehla, lze pero použít až do 8 hodin po zahájení kroku A. Uběhlo-li od smíchání přípravku v kroku A více než 8 hodin, pero vyhoďte a použijte jiné.
Krok B - Nasazení jehly a příprava pera k injekci
Co se stane, pokud nechám pero s jehlou nasazenou v kroku B a chci krok C dokončit později?
> To může způsobit ucpání jehly, po kroku B musí krok C následovat ihned.
Co se stane, pokud v kroku B nenasadím jehlu jak je popsáno v návodu?
> Nenasazujte jehlu v kroku A. Je-li jehla nasazena v kroku A, může dojít ke ztrátě části přípravku během míchání. Pokud jste nasadil(a) jehlu v kroku A, pero vyhoďte a použijte jiné.
> Nasaďte jehlu v okamžiku, kdy je v okénku číslice 2, a to dříve, než otočíte zásobní jednotku do další pozice (číslice 3). To umožní vzduchu uvnitř zásobní vložky uniknout ven skrze jehlu.
o Pokud jehlu nasadíte až poté, co se v okénku objeví číslice 3, pero nemusí uvolnit plnou dávku nebo se může zaseknout. Pero vyhoďte a použijte jiné.
> Spíše než s ní otáčet, se má jehla zatlačit a to tak, dokud neucítíte/neuslyšíte „cvaknutí“. Pokud jste
s jehlou omylem otočil(a) spíše než ji zatlačil(a) a číslice 2 je stále v okénku, pero můžete dále použít.
> Pokud se Vám nedaří dosáhnout číslice 3, pero vyhoďte a použijte jiné.
Krok C - Odstranění obou krytů jehly a vstříknutí přípravku
V peru jsou stále malé vzduchové bublinky. Mohu pero přesto použít?
> Ano, přítomnost malých vzduchových bublinek je normální a dostanete správnou dávku léčivého přípravku. Malé vzduchové bublinky Vám neuškodí.
Po podání přípravku je v průhledné zásobní vložce stále vidět nějaká tekutina.
> To je normální. Pokud jste slyšel(a)/cítil(a) injekční tlačítko „cvaknout“ a před vytažením jehly z kůže pomalu počítal(a) do 5, dostal(a) jste správnou dávku léčivého přípravku.
30 mg
Ověřte si, prosím, že používáte správnou dávku.
Tyto pokyny jsou určeny pro:
Příbalová informace: informace pro pacienta
Eperzan 50 mg prášek a rozpouštědlo pro injekční roztok
Albiglutidum
'VTento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Eperzan a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Eperzan používat
3. Jak se Eperzan používá
4. Možné nežádoucí účinky
5. Jak Eperzan uchovávat
6. Obsah balení a další informace
Návod k použití předplněného pera (na druhé straně)
Otázky a odpovědi k návodu k použití předplněného pera
Přečtěte si obě strany této příbalové informace.
1. Co je Eperzan a k čemu se používá
Eperzan obsahuje léčivou látku albiglutid, která patří do skupiny léčivých přípravků nazývaných agonisté receptoru GLP-1, jež se používají ke snížení cukru (glukózy) v krvi u dospělých s diabetem (cukrovkou) typu 2.
Cukrovku typu 2 máte:
• proto, že Vaše tělo nevytváří dostatek insulinu ke kontrole hladiny cukru v krvi nebo
• proto, že Vaše tělo není schopno použít insulin správně.
Eperzan pomáhá Vašemu tělu zvýšit tvorbu insulinu, když je hladina cukru v krvi vysoká.
Eperzan se používá ke kontrole cukru v krvi:
- buď samotný, není-li cukr v krvi dostatečně kontrolován samotnou dietou a cvičením a nemůžete-li užívat metformin (jiné antidiabetikum)
nebo
- v kombinaci s jinými antidiabetiky užívanými ústy (jako metformin nebo léčivé přípravky známé jako deriváty sulfonylmočoviny nebo thiazolidindiony) nebo s insulinem.
Je velmi důležité, abyste během používání přípravku Eperzan pokračoval(a) v dodržování diety a způsobu života, který Vám doporučil lékař.
2. Čemu musíte věnovat pozornost, než začnete Eperzan používat Nepoužívejte Eperzan:
- jestliže jste alergický(á) na albiglutid nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Myslíte-li si, že se Vás to týká, nepoužívejte Eperzan bez porady s lékařem, zdravotní sestrou nebo lékárníkem.
Upozornění a opatření
Před použitím přípravku Eperzan se poraďte se svým lékařem, zdravotní sestrou nebo lékárníkem:
• Máte-li cukrovku typu 1 (závislou na insulinu) nebo ketoacidózu (velmi závažnou komplikaci cukrovky, ke které dojde, pokud Vaše tělo není schopno rozkládat glukosu, protože nemá dostatek insulinu), tento léčivý přípravek není pro Vás správný. Poraďte se s lékařem, jak poznat příznaky ketoacidózy, a pokud se vyskytnou, vyhledejte okamžitě lékařskou pomoc.
• Pokud jste kdykoli v minulosti měl(a) pankreatitidu (zánět slinivky břišní). Váš lékař rozhodne, zda můžete Eperzan používat a vysvětlí Vám příznaky pankreatitidy (viz bod 4).
• Užíváte-li na cukrovku derivát sulfonylmočoviny nebo insulin, protože může dojít ke snížení hladiny cukru v krvi (hypoglykemii). Pro snížení tohoto rizika může Váš lékař upravit dávku těchto jiných přípravků (známky nízkého krevního cukru viz „Velmi časté nežádoucí účinky“ v bodu 4).
• Máte-li vážné problémy s vyprazdňováním žaludku (gastroparéza) nebo máte-li závažné onemocnění střev (závažné onemocnění trávicího traktu). Vyskytují-li se u Vás tyto stavy, používání přípravku Eperzan se nedoporučuje.
Před používáním přípravku Eperzan se poraďte s lékařem, zdravotní sestrou nebo lékárníkem, pokud se domníváte, že se Vás cokoli z výše uvedeného týká.
Děti a dospívající
Není známo, zda je Eperzan bezpečný a účinný u osob mladších než 18 let. Eperzan se u dětí a dospívajících nedoporučuje.
Další léčivé přípravky a Eperzan
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat (viz také výše uvedený bod 2 „Upozornění a opatření“).
Trpíte-li neprůchodností střev, neměl(a) byste užívat akarbosu.
Poraďte se s lékařem, pokud užíváte zároveň akarbosu a Eperzan.
Těhotenství, kojení a plodnost
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem, zdravotní sestrou nebo lékárníkem dříve, než začnete tento přípravek užívat. Existuje-li možnost, že můžete otěhotnět, musíte během používání tohoto přípravku užívat účinnou antikoncepci.
Okamžitě oznamte svému lékaři, zdravotní sestře nebo lékárníkovi, pokud během léčby přípravkem Eperzan otěhotníte.
O bezpečnosti přípravku Eperzan u těhotných žen nejsou žádné informace. Během těhotenství se Eperzan nesmí používat.
Pokud plánujete otěhotnět, může lékař rozhodnout ukončit léčbu přípravkem Eperzan alespoň jeden měsíc před plánovaným těhotenstvím. Je to proto, že vyplavení přípravku Eperzan z těla trvá delší dobu.
Kojení
Kojíte-li, musíte se před používáním přípravku Eperzan poradit s lékařem. Není známo, zda se Eperzan vylučuje do mateřského mléka. Spolu s lékařem rozhodnete, zda budete používat Eperzan, nebo kojit. Obojí společně není možné.
Plodnost
Není známo, zda Eperzan může ovlivnit plodnost u mužů nebo u žen.
Řízení dopravních prostředků a obsluha strojů
Eperzan nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje. Používáte-li však Eperzan s derivátem sulfonylmočoviny nebo insulinem, může se hladina cukru v krvi snížit (hypoglykemie). To může působit problémy se soustředěním, můžete pociťovat závratě nebo být ospalý(á). Dojde-li k tomu, neřiďte dopravní prostředky ani neobsluhujte stroje.
Obsah sodíku
Tento přípravek obsahuje méně než 1 mmol (23 mg) sodíku v jedné 0,5ml dávce, tj. v podstatě je „bez sodíku“.
3. Jak se Eperzan používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře, zdravotní sestry nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem, zdravotní sestrou nebo lékárníkem.
Doporučená dávka přípravku je 30 mg jednou týdně, která se vpichuje tentýž den každý týden. Lékař může zvýšit dávku na 50 mg jednou týdně, pokud 30mg dávkou není Váš cukr v krvi dostatečně kontrolován. Je-li to nutné, můžete změnit den v týdnu, kdy používáte Eperzan, za podmínky, že od poslední dávky uplynuly alespoň 4 dny.
Eperzan můžete použít v jakoukoli denní dobu buď s jídlem nebo nalačno.
Eperzan je dodáván v injektoru typu pera, kterým si jej můžete vstříknout sám(sama). Požádejte svého lékaře, zdravotní sestru nebo lékárníka aby Vám ukázal, jak se to správně dělá. Vpíchnete Eperzan pod kůži v oblasti břicha, stehna nebo zadní horní části paže. Každý týden můžete vpichovat do téže oblasti na těle, ale nevpichujte pokaždé do přesně téhož místa.
Eperzan se nesmí vstřikovat do žíly (intravenózně) ani do svalu (intramuskulárně).
Injektor typu pera obsahuje prášek a vodu, které musíte před použitím smíchat. Za bodem 6 této příbalové informace je Návod k použití, který Vám poskytne pokyny k přípravě léčivého přípravku a k jeho vpíchnutí krok za krokem. Máte-li otázky nebo nerozumíte-li tomu, jak se pero používá, poraďte se se svým lékařem, zdravotní sestrou nebo lékárníkem.
Nikdy nemíchejte dohromady insulin s přípravkem Eperzan. Potřebujete-li použít obojí ve stejnou dobu, použijte dvě různé injekce. Můžete vpíchnout obě injekce do téže oblasti těla (například do oblasti břicha), ale neměl(a) byste aplikovat injekce velmi blízko k sobě.
Jestliže jste použil(a) více přípravku Eperzan, než jste měl(a)
Použijete-li příliš mnoho přípravku Eperzan, poraďte se s lékařem nebo lékárníkem. Je-li to možné, ukažte jim obal nebo tuto příbalovou informaci. Můžete cítit silný pocit na zvracení (závažná nauzea), zvracet nebo mít bolesti hlavy.
Jestliže jste zapomněl(a) použít Eperzan
Pokud vynecháte dávku, vpíchněte si další dávku, co nejdříve si vzpomenete, do 3 dnů od vynechané dávky. Poté se můžete vrátit k obvyklému dni podávání injekce. Pokud od vynechané dávky uplynuly již více než 3 dny, počkejte s další injekcí na svůj obvyklý plánovaný den. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) používat Eperzan
Používejte Eperzan tak dlouho, dokud Vám to lékař doporučuje. Přestanete-li používat Eperzan, může to ovlivnit hladinu cukru v krvi. Nepřestávejte v používání, pokud Vám to lékař nedoporučí.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Riziko akutní pankreatitidy (zánětu slinivky břišní)
Pankreatitida byla hlášena jako méně častý nežádoucí účinek. Může postihnout až 1 ze 100 osob. Pankreatitida může být závažná a život ohrožující.
Vyskytne-li se u Vás:
• úporná bolest břicha, která nepolevuje, může se jednat o příznak pankreatitidy. Bolest může, ale nemusí, být provázena zvracením. Bolest může vyzařovat z přední části (břicha) do zad.
Přestaňte Eperzan používat a okamžitě se poraďte s lékařem.
Další nežádoucí účinky hlášené u přípravku Eperzan Velmi časté: mohou postihnout více než 1 z 10 osob:
• nízká hladina cukru v krvi (hypoglykemie) při používání přípravku Eperzan v kombinaci s insulinem nebo derivátem sulfonylmočoviny. Varovné příznaky nízké hladiny cukru v krvi mohou zahrnovat studený pot, studenou bledou kůži, bolest hlavy, pocit ospalosti, slabosti, závratě, zmatenosti nebo podráždění, pocit hladu, rychlý tlukot srdce a pocit neklidu. Lékař Vás seznámí s tím, co máte dělat, pokud máte nízkou hladinu cukru v krvi.
• průjem;
• pocit na zvracení (nauzea);
• vyrážka, zčervenání nebo svědění kůže v místě vpichu přípravku Eperzan.
Časté: mohou postihnout až 1 z 10 osob:
• infekce plic (pneumonie);
• nízká hladina cukru v krvi (hypoglykemie) při používání přípravku Eperzan samotného nebo v kombinaci s metforminem nebo pioglitazonem;
• nepravidelný tlukot srdce;
• zvracení;
• zácpa;
• nechutenství;
• pálení žáhy (gastroezofageální reflux).
Méně časté: mohou postihnout až 1 ze 100 osob:
• obstrukce (neprůchodnost) střeva.
Vzácné: mohou postihnout až 1 z 1 000 osob:
• alergické reakce (přecitlivělost)
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Eperzan uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na peru a na krabičce za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Pero a jehly uchovávejte do použití v původní krabičce.
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem. Tento léčivý přípravek nelze uchovávat při pokojové teplotě (nižší než 30 °C) déle než celkem 4 týdny před použitím. Po této době je nutno pero/pera buď použít, nebo zlikvidovat.
• Po smíchání prášku a tekutiny v peru je nutno pero použít během 8 hodin.
• Pero použijte okamžitě po nasazení a přípravě jehly, jinak může roztok zaschnout uvnitř jehly a ucpat
ji.
Každé pero použijte pouze jednou.
Po použití pera jehlu neodstraňujte. Zbavte se pera tak, jak Vám poradil lékař, zdravotní sestra nebo lékárník.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co Eperzan obsahuje
- Léčivou látkou je albiglutidum.
Jedno pero poskytne albiglutidum 50 mg v dávce 0,5 ml.
- Rozpouštědlem je voda na injekci.
- Dalšími složkami jsou: monohydrát dihydrogenfosforečnanu sodného a hydrogenfosforečnan sodný (viz bod 2 „Obsah sodíku“), dihydrát trehalosy, mannitol (E421), polysorbát 80.
Jak Eperzan vypadá a co obsahuje toto balení
Eperzan je dodáván jako pero k injekci pacientem. Každé pero obsahuje bílý až žlutý prášek a bezbarvé rozpouštědlo v oddělených komorách. S každým perem je dodána jehla.
Pera jsou dodávána v baleních obsahujících 4 pera a 4 jehly a ve vícečetných baleních skládajících se ze 3 balení, každé obsahující 4 pera a 4 jehly. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
GlaxoSmithKline Trading Services Limited, Currabinny, Carrigaline, County Cork, Irsko Jméno a adresa výrobce odpovědného za propouštění šarží:
|
Glaxo Operations UK Limited (Trading as Harmire Road Barnard Castle Durham DL12 8DT Velká Británie |
Glaxo Wellcome Operations) |
|
Další informace o tomto přípravku získáte |
u místního zástupce držitele rozhodnutí o registraci: |
|
Belgie/Belgique/Belgien GlaxoSmithKline Pharmaceuticals s.a./n.v Tél/Tel: + 32 (0)10 85 52 00 |
Luxembourg/Luxemburg . GlaxoSmithKline Pharmaceuticals s.a./n.v Belgique/Belgien Tél/Tel: + 32 (0)10 85 52 00 |
|
Btarapna raaKcoCMHTKaaňH EOOfl Tea.: + 359 2 953 10 34 |
Magyarország GlaxoSmithKline Kft. Tel.: + 36 1 225 5300 |
|
Česká republika GlaxoSmithKline s.r.o. Tel: + 420 222 001 111 cz.info@gsk.com |
Malta GlaxoSmithKline Malta Tel: + 356 21 238131 |
|
Danmark GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 info@glaxosmithkline.dk |
Nederland GlaxoSmithKline BV Tel: + 31 (0)30 6938100 nlinfo@gsk.com |
|
Deutschland GlaxoSmithKline GmbH & Co. KG Tel.: + 49 (0)89 36044 8701 produkt.info@gsk.com |
Norge GlaxoSmithKline AS Tlf: + 47 22 70 20 00 firmapost@gsk.no |
|
Eesti GlaxoSmithKline Eesti OU Tel: + 372 6676 900 estonia@gsk.com |
Osterreich GlaxoSmithKline Pharma GmbH Tel: + 43 (0)1 97075 0 at.info@gsk.com |
|
EXlába GlaxoSmithKline A.E.B.E. Tqk + 30 210 68 82 100 |
Polska GSK Services Sp. z.o.o. Tel.: + 48 (0)22 576 9000 |
|
Espaňa GlaxoSmithKline, S.A. Tel: + 34 902 202 700 es-ci@gsk.com |
Portugal GlaxoSmithKline - Produtos Farmaceuticos, Lda. Tel: + 351 21 412 95 00 FI.PT@gsk.com |
|
France Laboratoire GlaxoSmithKline Tél: + 33 (0)1 39 17 84 44 diam@gsk.com Hrvatska GlaxoSmithKline d.o.o. |
Románia GlaxoSmithKline (GSK) S.R.L. Tel: + 4021 3028 208 |
|
65 |
Tel:++385 1 6051 999
|
Ireland GlaxoSmithKline (Ireland) Limited Tel: + 353 (0)1 4955000 |
Slovenija GlaxoSmithKline d.o.o. Tel: + 386 (0)1 280 25 00 medical.x.si@gsk.com |
|
Ísland Vistor hf. Sími: + 354 535 7000 |
Slovenská republika GlaxoSmithKline Slovakia s. r. o Tel: + 421 (0)2 48 26 11 11 recepcia.sk@gsk.com |
|
Italia GlaxoSmithKline S.p.A. Tel: + 39 (0)45 9218 111 |
Suomi/Finland GlaxoSmithKline Oy Puh/Tel: + 358 (0)10 30 30 30 Finland.tuoteinfo@gsk.com |
|
Kónpoq GlaxoSmithKline (Cyprus) Ltd Tn^: + 357 22 39 70 00 gskcyprus@gsk.com |
Sverige GlaxoSmithKline AB Tel: + 46 (0)31 67 09 00 info .produkt@g sk. com |
|
Latvija GlaxoSmithKline Latvia SIA Tel: + 371 67312687 lv-epasts@gsk.com |
United Kingdom GlaxoSmithKline UK Tel: + 44 (0)800 221441 customercontactuk@gsk.com |
|
Lietuva GlaxoSmithKline Lietuva UAB Tel: + 370 5 264 90 00 info.lt@gsk.com |
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
NÁVOD K POUŽITÍ
Okénko
Číslo 3: Jsou odstraněny velké vzduchové bubliny, objevilo se injekční tlačítko a pero je připraveno k injekci.
Číslo 2: Prášek přípravku a voda jsou smíchány. Čekejte 30 minut, poté nasaďte jehlu.
Číslo 1: Pero je připraveno. Prášek přípravku a voda jsou v oddělených komorách průhledné zásobní vložky.
Injekční tlačítko*
* Injekční tlačítko je zasunuto, dokud pero není připraveno k injekci.
Průhledná
zásobní
vložka
Tělo pera
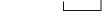
Pero Eperzan 50 mg jednou týdně
Pozorně si přečtěte níže uvedené pokyny včetně Otázek a odpovědí a postupujte podle návodu, abyste přípravek smíchal(a) a připravil(a) pero k injekci.
Uschovejte si tento návod a použijte ho, pokaždé když si budete připravovat svůj lék.
Nebudete-li sledovat kroky A až C ve správném pořadí, může dojít k poškození pera.
Charakterizace pera
> Pero obsahuje léčivý prášek v jedné komoře a vodu v jiné komoře. Bude nutné je smíchat otáčením pera.
ČS POZOR:
Pero nesmí zmrznout. Zmrzlo-li, vyhoďte ho.
Při uchovávání v chladničce jej před započetím kroku A ponechte 15 minut při pokojové teplotě.
Jehly znovu nepoužívejte, nenasazujte na ně zpět kryt ani je z pera neodstraňujte. Ihned po injekci pero vyhoďte.
Než začnete: umyjte si ruce, shromážděte a zkontrolujte všechen materiál.
> Umyjte si ruce.
> Vyjměte pero a novou jehlu z krabičky a zkontrolujte štítek na peru, abyste se ujistil(a), že se jedná o Vám předepsanou dávku.
> Připravte si čistý prázdný pohárek, ve kterém bude pero stát během smíchávání přípravku, minutku/stopky pro měření doby do rozpuštění a nádobu pro vyhození pera (tyto předměty nejsou součástí přípravku).
Eperzan 50 mg pero

Jehla
Toto 50mg pero přípravku EPERZAN vyžaduje pro smíchání prášku přípravku a vody v kroku A 30 minut. Jedná se o odlišnost od 30mg pera přípravku EPERZAN, které jste možná používal(a) dříve.
NEnasazujte
aS jehlu dříve, než jak je uvedeno v kroku B
Minutka / stopky
Čistý prázdný pohárek


KROK A: Kontrola pera a smíchání přípravku Zkontrolujte pero
> Ujistěte se, že máte připraveny všechny náležitosti uvedené výše (pero, jehlu, pohárek, minutku, nádobu na vyhození).
> Zkontrolujte dobu použitelnosti pera. Nepoužívejte je po jejím uplynutí.
ZKONTROLUJTE DOBU POUŽITELNOSTI
> Zkontrolujte, zda je v okénku pera číslice [1].
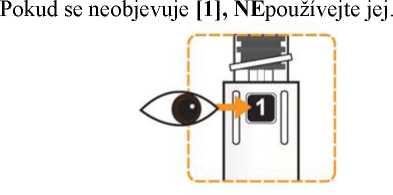
Otáčejte perem, abyste promíchal(a) Váš léčivý přípravek
> Držte tělo pera průhlednou zásobní vložkou směrem vzhůru tak, abyste v okénku viděl(a) číslici [1].
> Druhou rukou otáčejte průhlednou zásobní vložkou ve směru šipky (ve směru hodinových ručiček), dokud neucítíte/neuslyšíte „cvaknutí“ a neuvidíte v okénku číslici [2]. Tím se v průhledné zásobní vložce smíchá prášek přípravku s tekutinou.
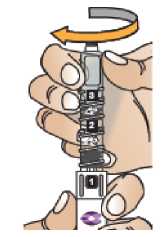
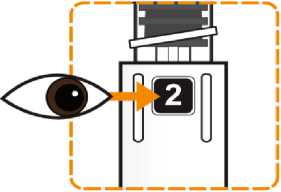
>
Pomalu a opatrně zakývejte 5krát perem ze strany na stranu, aby se přípravek smíchal (jako stěrače u auta). NEtřeste perem příliš intenzivně, aby se zabránilo tvorbě pěny, která může ovlivnit Vaši dávku.
Čekejte, dokud se léčivý přípravek nerozpustí
> Umístěte pero do čistého prázdného pohárku průhlednou zásobní vložkou směrem vzhůru.

> Nastavte minutku/stopky na 30 minut.

Než přistoupíte ke kroku B, musíte počkat 30 minut, než se přípravek rozpustí.
Než se přistoupí ke kroku B, může být pero s naředěným léčivem uchováváno nejvýše po dobu 8 hodin.
Po připojení jehly je nutno pero použít okamžitě.
KROK B: Nasazení jehly a příprava pera k injekci
Po 30 minutách čekání si umyjte ruce a proveďte všechny další kroky naráz.
Zkontrolujte rozpuštěný přípravek
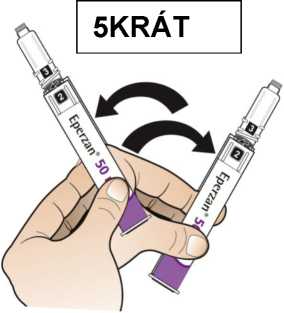

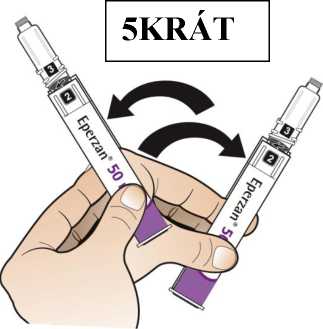
> Opět pomalu a opatrně 5krát zakývejte perem ze strany na stranu, aby se přípravek promíchal (jako stěrače u auta). NEtřeste perem příliš intenzivně, aby se zabránilo tvorbě pěny, která může ovlivnit Vaši dávku.

> Zkontrolujte pohledem do okénka, zda tekutina v zásobní vložce je čirá a bez pevných částic.
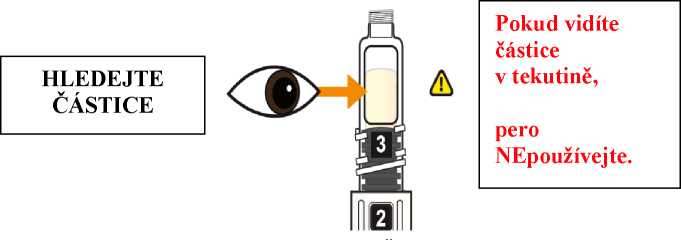
> Tekutina bude mít žlutou barvu a na jejím povrchu budou velké vzduchové bubliny. Nasaďte jehlu
> Z vnějšího krytu jehly odstraňte nálepku.
>
>
Držte pero průhlednou zásobní vložkou směrem vzhůru.
Stlačujte jehlu dolů na zásobní vložku, dokud neucítíte/neuslyšíte „cvaknutí“ - to znamená, že jehla je nasazena.
A u NEotáčejte
ani ji nenasazujte křivě.
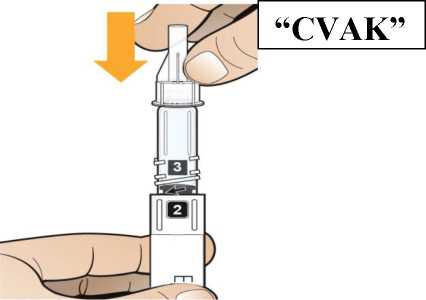
Poklepejte kvůli vzduchovým bublinám
> Poklepejte lehce 2 - 3krát na průhlednou zásobní vložku s jehlou směřující vzhůru, aby velké vzduchové bubliny vypluly vzhůru.

Malé bubliny nevadí a není nutno je dostat vzhůru.
Otáčejte perem, abyste připravil(a) jehlu
> PO nasazení jehly, kdy v okénku je číslice [2], pomalu otočte průhlednou zásobní vložkou
několikrát ve směru šipky (ve směru hodinových ručiček), dokud neucítíte/neuslyšíte „cvaknutí“
KROK C: Odstranění obou krytu jeniy a vpicnnuti leciveno přípravku
a neuvidíte v okénku číslici [3]. To odstraní ze zásobníku velké vzduchové bubliny. Ze spodní části pera také vyjede injekční tlačítko.
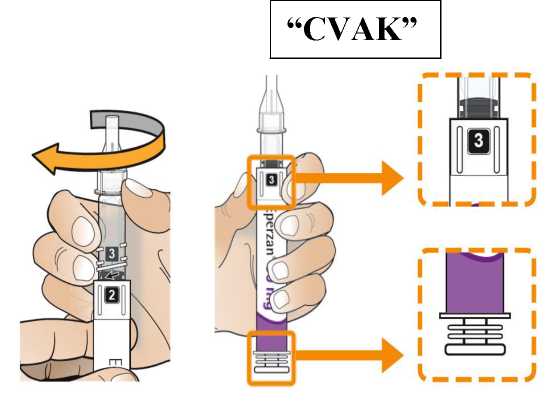
Odstraňte kryty jehly
> Opatrně odstraňte vnější kryt jehly a poté vnitřní kryt jehly. Z jehly může odkápnout několik kapek
tekutiny. To je normální.
Krok 1: Odstraňte vnější kryt jehly
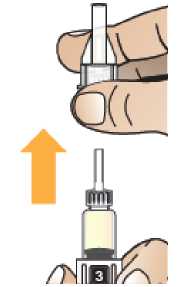
Krok 2: Odstraňte vnitřní kryt jehly
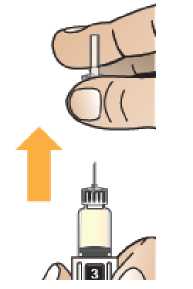
Vpíchněte léčivý přípravek
>
Píchněte jehlu do kůže na břiše, stehnu nebo horní části paže a vstříkněte tak, jak Vám to ukázal lékař nebo zdravotní sestra ukázal.
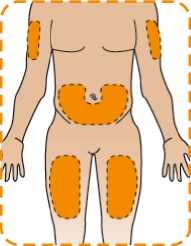
>
>
Abyste vstříkl(a) Váš léčivý přípravek, stlačujte palcem pomalu a rovnoměrně injekční tlačítko. Čím pomaleji stlačujete, tím lépe budete injekci snášet.
Držte injekční tlačítko stlačené, dokud neuslyšíte „cvaknutí“ Stále držte palec na tlačítku a pomalu počítejte do 5, aby byla aplikována celá dávka přípravku.
”CVAK
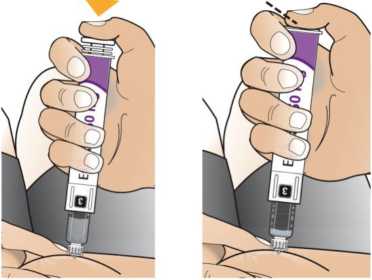
> Až napočítáte do 5, vytáhněte jehlu z kůže.
Vyhoďte pero
> Nenasazujte zpět kryt na jehlu, ani neodstraňujte jehlu z pera.
> Nevyhazujte použité pero do domácího odpadu. Vyhoďte pero podle pokynů svého lékaře nebo lékárníka.
Otázky a odpovědi Okénko s číslicí
Jsou číslice 1, 2 a 3 způsob, jak si volím dávku léčivého přípravku?
> Nikoli, dávku přípravku si nevolíte. Číslice Vám pomáhají připravit a podat léčivý přípravek.
Číslice 1 - Pero je připraveno k použití. Prášek přípravku a voda jsou v oddělených komorách průhledné zásobní vložky.
Číslice 2 - Prášek přípravku a voda jsou smíchány a poté lehce promíseny. Čekejte 30 minut, potom nasaďte jehlu.
Číslice 3 - Velké vzduchové bubliny jsou odstraněny, objevilo se injekční tlačítko, pero je připraveno k injekci.
Co se stane, pokud neslyším „CVAK“, když se v okénku objeví číslice 2 nebo 3?
> Pokud neuslyšíte „cvak“ když se v okénku objeví číslice 2 nebo 3, možná není číslice v okénku přesně uprostřed. Pomalu otočte průhlednou zásobní vložkou nepatrně ve směru hodinových ručiček, abyste dokončil(a) „cvaknutí“ a číslici umístil(a) doprostřed okénka.
Krok A - Kontrola pera a smíchání přípravku
Co se stane, pokud jsem nečekal(a) 30 minut po změně na číslici 2 na peru?
> Pokud jste nečekal(a) plných 30 minut, je možné, že léčivo není plně smícháno s vodou. To může vést ke vznášení se částic v průhledné zásobní vložce, neúčinné dávce a/nebo ucpání jehly. Čekání celých 30 minut zajišťuje, že se prášek přípravku a voda správně promísí, i když se Vám vizuálně může zdát, že jsou promíchány dříve.
Co se stane, pokud nechám pero po změně na číslici 2 v kroku A stát více než 30 minut?
> Dokud nebyla nasazena jehla, lze pero použít až do 8 hodin po zahájení kroku A. Uběhlo-li od smíchání přípravku v kroku A více než 8 hodin, pero vyhoďte a použijte jiné.
Krok B - Nasazení jehly a příprava pera k injekci
Co se stane, pokud nechám pero s jehlou nasazenou v kroku B a chci krok C dokončit později?
> To může způsobit ucpání jehly, po kroku B musí krok C následovat ihned.
Co se stane, pokud nenasadím jehlu v kroku B, jak je popsáno v návodu?
> Nenasazujte jehlu v kroku A. Je-li jehla nasazena v kroku A, může dojít ke ztrátě části přípravku během míchání. Pokud jste nasadil(a) jehlu v kroku A, pero vyhoďte a použijte jiné.
> Nasaďte jehlu v okamžiku, kdy je v okénku číslice 2, a to dříve, než otočíte zásobní jednotku do další pozice (číslice 3). To umožní vzduchu uvnitř zásobní vložky uniknout ven skrze jehlu.
o Pokud jehlu nasadíte až poté, co se v okénku objeví číslice 3, pero nemusí uvolnit plnou dávku nebo se může zaseknout. Pero vyhoďte a použijte jiné.
> Spíše než s ní otáčet se má jehla zatlačit tak, dokud neucítíte/neuslyšíte „cvak“. Pokud jste s jehlou omylem otočil(a) spíše než ji zatlačil(a) a číslice 2 je stále v okénku, pero můžete dále použít.
Pokud se Vám nedaří dosáhnout číslice 3, pero vyhoďte a použijte jiné.
Krok C - Odstranění obou krytů jehly a vstříknutí léčivého přípravku
V peru jsou stále malé vzduchové bublinky. Mohu pero přesto použít?
> Ano, přítomnost malých vzduchových bublinek je normální a dostanete správnou dávku léčivého přípravku. Malé vzduchové bublinky Vám neuškodí.
Po podání přípravku je v průhledné zásobní vložce stále vidět nějaká tekutina.
> To je normální. Pokud jste slyšel(a)/cítil(a) injekční tlačítko „cvaknout“ a před vytažením jehly z kůže pomalu počítal(a) do 5, dostal(a) jste správnou dávku léčivého přípravku.
50 mg
Ověřte si, prosím, že používáte správnou dávku.
Tyto pokyny jsou určeny pro:
73