Entresto 49 Mg/51 Mg
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Entresto 24 mg/26 mg potahované tablety Entresto 49 mg/51 mg potahované tablety Entresto 97 mg/103 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Entresto 24 mg/26 mg potahované tablety
Jedna potahovaná tableta obsahuje sacubitrilum 24,3 mg a valsartanum 25,7 mg (jako komplexu sodné soli sakubitril-valsartan).
Entresto 49 mg/51 mg potahované tablety
Jedna potahovaná tableta obsahuje sacubitrilum 48,6 mg a valsartanum 51,4 mg (jako komplexu sodné soli sakubitril-valsartan).
Entresto 97 mg/103 mg potahované tablety
Jedna potahovaná tableta obsahuje sacubitrilum 97,2 mg a valsartanum 102,8 mg (jako komplexu sodné soli sakubitril-valsartan).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta (tablety)
Entresto 24 mg/26 mg potahované tablety
Nafialovělá oválná bikonvexní potahovaná tableta se zkosenými hranami, bez půlicí rýhy, s vyraženým „NVR“ na jedné straně a „LZ“ na druhé straně. Přibližné rozměry tablety 13,1 mm x
5.2 mm.
Entresto 49 mg/51 mg potahované tablety
Světle žlutá oválná bikonvexní potahovaná tableta se zkosenými hranami, bez půlicí rýhy, s vyraženým „NVR“ na jedné straně a „L1“ na druhé straně. Přibližné rozměry tablety 13,1 mm x
5.2 mm.
Entresto 97 mg/103 mg potahované tablety
Světle růžová oválná bikonvexní potahovaná tableta se zkosenými hranami, bez půlicí rýhy, s vyraženým „NVR“ na jedné straně a „L11“ na druhé straně. Přibližné rozměry tablety 15,1 mm x 6,0 mm.
KLINICKÉ ÚDAJE
4.
4.1 Terapeutické indikace
Přípravek Entresto je indikován k léčbě symptomatického chronického srdečního selhání s redukovanou ejekční frakcí u dospělých pacientů (viz bod 5.1).
4.2 Dávkování a způsob podání
Dávkování
Doporučená zahajovací dávka přípravku Entresto je jedna tableta 49 mg/51 mg dvakrát denně, kromě stavů popsaných níže. Dávka by měla být zdvojnásobena za 2-4 týdny do dosažení cílové dávky jedna tableta 97 mg/103 mg dvakrát denně, podle tolerance pacienta (viz bod 5.1).
Pokud se u pacienta objeví problémy s tolerancí (systolický krevní tlak [STK] <95 mmHg, symptomatická hypotenze, hyperkalemie, renální dysfunkce), doporučuje se úprava dávek souběžných léčivých přípravků, přechodná titrace dávek přípravku Entresto směrem dolů nebo jeho vysazení (viz bod 4.4).
Ve studii PARADIGM-HF byl přípravek Entresto podáván společně s ostatními terapiemi na srdeční selhání, místo ACE inhibitoru nebo jiných blokátorů receptoru pro angiotenzin II (ARB) (viz bod 5.1). K dispozici je omezená zkušenost u pacientů, kteří v současné době neužívají ACE inhibitor nebo ARB nebo kteří užívají malé dávky těchto léčivých přípravků, proto se u těchto pacientů doporučuje zahajovací dávka 24 mg/26 mg dvakrát denně a pomalá titrace dávek (zdvojnásobení každé 3-4 týdny) (viz „TITRATION“ v bodě 5.1).
Léčba se nemá zahajovat u pacientů se sérovou hladinou draslíku >5,4 mmol/l nebo s STK <100 mmHg (viz bod 4.4). U pacientů s STK >100 až 110 mmHg se má zvážit zahajovací dávka 24 mg/26 mg dvakrát denně.
Přípravek Entresto nemá být podáván společně s ACE inhibitorem nebo ARB. Kvůli potenciálnímu riziku angioedému při současném užívání s ACE inhibitorem nesmí být léčba tímto přípravkem zahájena nejméně 36 hodin po ukončení léčby ACE inhibitorem (viz body 4.3, 4.4 a 4.5).
Valsartan obsažený v přípravku Entresto je více biologicky dostupný než valsartan v jiných formách tablet na trhu (viz bod 5.2).
Pokud je vynechána dávka, pacient by měl užít další dávku v pravidelný čas.
Speciální populace Starší populace
Dávka u starších pacientů má být nastavena dle jejich renálních funkcí.
Porucha funkce ledvin
Úprava dávky se nevyžaduje u pacientů s lehkou poruchou funkce ledvin (odhadovaná rychlost glomerulární filtrace [eGFR] 60-90 ml/min/1,73 m2). U pacientů se středně těžkou poruchou funkce ledvin (eGFR 30-60 ml/min/1,73 m2) má být zvážena zahajovací dávka 24 mg/26 mg dvakrát denně.
U pacientů s těžkou poruchou funkce ledvin (eGFR <30 ml/min/1,73 m2) je k dispozici velmi omezená klinická zkušenost (viz bod 5.1), proto má být přípravek Entresto podáván s opatrností a doporučená zahajovací dávka je 24 mg/26 mg dvakrát denně. K dispozici nejsou žádné zkušenosti u pacientů v terminálním stádiu renálního onemocnění a přípravek Entresto se v těchto případech nedoporučuje.
Porucha funkce jater
Úprava dávky se nevyžaduje při podávání přípravku Entresto pacientům s lehkou poruchou funkce jater (Child-Pugh klasifikace A). K dispozici je omezená klinická zkušenost u pacientů se středně těžkou poruchou funkce jater (Child-Pugh klasifikace B) nebo s hodnotami AST/ALT více než dvojnásobek horní hranice normálního rozmezí. Přípravek Entresto je třeba u těchto pacientů podávat s opatrností a doporučená zahajovací dávka je 24 mg/26 mg dvakrát denně (viz body 4.4 a 5.2). Přípravek Entresto je kontraindikován u pacientů s těžkou poruchou funkce jater, biliární cirhózou nebo cholestázou (Child-Pugh klasifikace C) (viz bod 4.3).
Pediatrická populace
Bezpečnost a účinnost přípravku Entresto u dětí a dospívajících ve věku do 18 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Perorální podání.
Přípravek Entresto se může podávat s jídlem nebo bez jídla (viz bod 5.2). Tablety se musí spolknout a zapít sklenicí vody.
4.3 Kontraindikace
• Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
• Současné užívání s ACE inhibitory (viz body 4.4 a 4.5). Přípravek Entresto nesmí být podán do 36 hodin po ukončení léčby ACE inhibitorem.
• Angioedém související s předchozí léčbou ACE inhibitory nebo s léčbou ARB v anamnéze (viz bod 4.4).
• Dědičný nebo idiopatický angioedém (viz bod 4.4).
• Současné užívání s léčivými přípravky obsahujícími aliskiren u pacientů s diabetes mellitus nebo u pacientů s poruchou funkce ledvin (eGFR <60 ml/min/1,73 m2) (viz body 4.4 a 4.5).
• Závažná porucha funkce jater, biliární cirhóza a cholestáza (viz bod 4.2).
• Druhý a třetí trimestr těhotenství (viz bod 4.6).
4.4 Zvláštní upozornění a opatření pro použití
Duální blokáda renin-angiotenzin-aldosteronového systému (RAAS)
• Kombinace přípravku Entresto s ACE inhibitorem je kontraindikována kvůli zvýšenému riziku vzniku angioedému (viz bod 4.3). Léčba přípravkem Entresto nesmí být zahájena do 36 hodin po užití poslední dávky ACE inhibitoru. Pokud je léčba přípravkem Entresto ukončena, léčba ACE inhibitorem nesmí být zahájena do 36 hodin po podání poslední dávky přípravku Entresto (viz body 4.2, 4.3 a 4.5).
• Kombinace přípravku Entresto s přímými inhibitory reninu jako je aliskiren se nedoporučuje (viz bod 4.5). Kombinace přípravku Entresto s přípravky obsahujícími aliskiren je kontraindikovaná u pacientů s diabetes mellitus nebo u pacientů s poruchou funkce ledvin (eGFR <60 ml/min/1,73 m2) (viz body 4.3 a 4.5).
• Přípravek Entresto obsahuje valsartan, a proto nemá být podáván současně s jiným ARB obsahujícím přípravkem (viz body 4.2 a 4.5).
Léčba nemá být zahájena, dokud STK není >100 mmHg. Pacienti s STK <100 mmHg nebyli studováni (viz bod 5.1). U pacientů léčených přípravkem Entresto během klinických studií byly hlášeny případy symptomatické hypotenze (viz bod 4.8), zejména u pacientů ve věku >65 let, pacientů s renálním onemocněním a pacientů s nízkým STK (<112 mmHg). Při zahajování léčby přípravkem Entresto nebo během titrace jeho dávek je třeba rutinně monitorovat krevní tlak. Pokud se objeví hypotenze, doporučuje se přechodná titrace směrem dolů nebo vysazení přípravku Entresto (viz bod 4.2). Má být zvážena úprava dávky diuretik, současně podávaných antihypertenziv a léčba jiných příčin hypotenze (např. hypovolemie).. Symptomatická hypotenze se objeví pravděpodobněji, pokud byl pacient v objemové depleci, např. při léčbě diuretiky, dietním omezení soli, průjmu nebo zvracení. Deplece sodíku a/nebo objemová deplece mají být korigovány před zahájením léčby přípravkem Entresto, ale tato korektivní akce musí být pečlivě vyvážena oproti riziku objemového přetížení.
Porucha funkce ledvin
Vyšetření pacientů se srdečním selháním má vždy zahrnovat zhodnocení renálních funkcí. Pacienti s lehkou a středně těžkou poruchou funkce ledvin podléhají většímu riziku rozvoje hypotenze (viz bod 4.2). U pacientů s těžkou poruchou renálních funkcí (odhadovaná GFR <30 ml/min/1,73m2) je velmi omezená klinická zkušenost a tito pacienti mohou být v největším riziku rozvoje hypotenze (viz bod 4.2). K dispozici nejsou žádné zkušenosti u pacientů v terminálním stádiu renálního onemocnění a přípravek Entresto se v těchto případech nedoporučuje.
Zhoršení renálních funkcí
Užívání přípravku Entresto může být spojeno se sníženou funkcí ledvin. Riziko může být dále zvýšeno dehydratací nebo současným užíváním nesteroidních protizánětlivých léků (NSAID) (viz bod 4.5).
U pacientů, u kterých dojde ke klinicky významnému snížení funkce ledvin by měla být zvážena titrace směrem dolů.
Hyperkalemie
Léčba nemá být zahájena, pokud je sérová hladina draslíku >5,4 mmol/l. Užívání přípravku Entresto může být spojeno se zvýšeným rizikem hyperkalemie, i když hypokalemie se může také vyskytnout (viz bod 4.8). Doporučuje se sledovat hladiny draslíku v séru, zvláště u pacientů, kteří mají rizikové faktory jako je porucha funkce ledvin, diabetes mellitus nebo hypoaldosteronismus, nebo kteří jsou na dietě s vysokým obsahem draslíku nebo užívají antagonisty mineralokortikoidního receptoru (viz bod 4.2). Pokud se u pacientů objeví klinicky významná hyperkalemie, doporučuje se úprava dávek souběžně podávaných léčivých přípravků nebo přechodná titrace směrem dolů nebo vysazení. Pokud je sérová hladina draslíku >5,4 mmol/l, je třeba zvážit vysazení.
Angioedém
U pacientů léčených přípravkem Entresto byl hlášen angioedém. Pokud se objeví angioedém, má být podávání přípravku Entresto ihned ukončeno a má být poskytnuta vhodná léčba a sledování až do doby kompletního a trvalého ústupu známek a příznaků. Přípravek nesmí být znovu podán.
V případech potvrzeného angioedému, při kterém byl otok omezen na obličej a rty se stav obvykle upravil bez léčby, ačkoli antihistaminika byla vhodná ke zmírnění příznaků.
Angioedém spojený s otokem laryngu může být fatální. Pokud je pravděpodobné, že je obstrukce dýchacích cest způsobena otokem jazyka, glottis nebo hrtanu, je třeba nasadit rychle vhodnou terapii, např. roztok adrenalinu 1 mg/1 ml (0,3-0,5 ml) a/nebo přijmout opatření nutná k zajištění průchodných dýchacích cest.
Pacienti s výskytem angioedému v anamnéze nebyli studováni. Protože mohou mít vyšší riziko vzniku angioedému, doporučuje se dbát opatrnosti, pokud je přípravek Entresto užíván těmito pacienty. Přípravek Entresto je kontraindikován u pacientů se známým výskytem angioedému spojeného s předchozí léčbou ACE inhibitorem nebo ARB v anamnéze nebo s dědičným nebo idiopatickým angioedémem (viz bod 4.3).
Pacienti černošské rasy mají zvýšenou vnímavost k rozvoji angioedému (viz bod 4.8).
Pacienti se stenózou renální arterie
Přípravek Entresto může zvyšovat hladinu urey v krvi a kreatininu v séru u pacientů s bilaterální nebo unilaterální stenózou renální arterie. U pacientů se stenózou renální arterie je třeba dbát opatrnosti a doporučuje se sledovat renální funkce.
Pacienti s funkční klasifikací NYHA IV
Při zahajování léčby přípravkem Entresto u pacientů s funkční klasifikací NYHA IV je třeba dbát opatrnosti z důvodu omezené klinické zkušenosti u této populace.
Natriuretický peptid typu B (BNP)
BNP není vhodný biomarker srdečního selhání u pacientů léčených přípravkem Entresto, protože je substrátem neprilysinu (viz bod 5.1).
Pacienti s poruchou funkce jater
U pacientů se středně těžkou poruchou funkce jater (Child-Pugh klasifikace B) nebo s hodnotami AST/ALT více než dvojnásobek horní hranice normálního rozmezí je k dispozici omezená klinická zkušenost. U těchto pacientů může být expozice zvýšena a bezpečnost není stanovena. Pokud se přípravek používá u těchto pacientů, doporučuje se dbát opatrnosti (viz body 4.2 a 5.2). Přípravek Entresto je kontraindikován u pacientů s těžkou poruchou funkce jater, biliární cirhózou nebo cholestázou (Child-Pugh klasifikace C) (viz bod 4.3).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Interakce mající za následek kontraindikaci
ACE inhibitory
Současné užívání přípravku Entresto s ACE inhibitory je kontraindikováno, protože současná inhibice neprilysinu (NEP) a ACE může zvyšovat riziko angioedému. Léčba přípravkem Entresto nesmí být zahájena do 36 hodin po užití poslední dávky ACE inhibitoru. Léčba ACE inhibitorem nesmí být zahájena do 36 hodin po podání poslední dávky přípravku Entresto (viz body 4.2 a 4.3).
Aliskiren
Současné užívání přípravku Entresto s přípravky obsahujícími aliskiren je kontraindikováno u pacientů s diabetes mellitus nebo u pacientů s poruchou funkce ledvin (eGFR <60 ml/min/1,73 m2) (viz bod 4.3). Kombinace přípravku Entresto s přímými inhibitory reninu jako je aliskiren se nedoporučuje (viz bod 4.4). Kombinace přípravku Entresto s aliskirenem je potenciálně spojena s vyšším výskytem nežádoucích účinků, jako je hypotenze, hyperkalemie a snížení renálních funkcí (včetně akutního renálního selhání) (viz body 4.3 a 4.4).
Interakce mající za následek nedoporučení současného užívání
Přípravek Entresto obsahuje valsartan, a proto se nemá podávat současně s jiným přípravkem obsahujícím ARB (viz bod 4.4).
Interakce vyžadující opatrnost
OATP1B1 a OATP1B3 substráty, např. statiny
Údaje in vitro ukazují, že sakubitril inhibuje transportéry OATP1B1 a OATP1B3. Přípravek Entresto může proto zvyšovat systémovou expozici substrátů OATP1B1 a OATP1B3 jako jsou statiny. Současné podávání přípravku Entresto zvyšovalo Cmax atorvastatinu a jeho metabolitů na dvojnásobek a AUC na 1,3-násobek. Při současném podávání přípravku Entresto se statiny je třeba dbát opatrnosti. Při současném podávání přípravku Entresto a simvastatinu nebyly relevantní lékové interakce pozorovány.
Inhibitory PDE5 včetně sildenafilu
Přidání jedné dávky sildenafilu k přípravku Entresto v rovnovážném stavu u pacientů s hypertenzí bylo spojeno s významně vyšším snížením krevního tlaku v porovnání s podáním samotného přípravku Entresto. Proto je třeba dbát opatrnosti, pokud je zahajována léčba sildenafilem nebo jiným PDE5 inhibitorem u pacientů léčených přípravkem Entresto.
Draslík
Současné užívání draslík šetřících diuretik (triamteren, amilorid), mineralokortikoidních antagonistů (např. spironolakton, eplerenon), přípravků k suplementaci draslíku, náhrad solí obsahujících draslík nebo jiných přípravků (jako je heparin) může vést ke zvýšení draslíku v séru a ke zvýšení kreatininu v séru. Pokud je přípravek Entresto podáván současně s těmito přípravky, doporučuje se sledovat hladiny draslíku v séru (viz bod 4.4).
Nesteroidní protizánětlivé léky (NSAIDs), včetně selektivních inhibitorů cyklooxygenázy-2 (COX-2 inhibitorů)
U starších pacientů, pacientů v objemové depleci (včetně pacientů na diuretické léčbě) nebo pacientů s oslabenou funkcí ledvin může současné užívání přípravku Entresto a NSAIDs vést ke zvýšení rizika zhoršení funkce ledvin. Pokud je zahajována nebo měněna léčba u pacientů užívajících přípravek Entresto, kteří současně užívají NSAIDs, doporučuje se sledovat funkce ledvin (viz bod 4.4).
Lithium
Při současném podávání lithia s ACE inhibitory nebo blokátory receptorů pro angiotenzin II bylo popsáno reverzibilní zvýšení koncentrací lithia v séru a jeho toxicity. Interakce mezi přípravkem Entresto a lithiem nebyly zkoumány. Proto se tato kombinace nedoporučuje. Pokud se tato kombinace ukáže jako nezbytná, doporučuje se pečlivě monitorovat hladiny lithia v séru. Riziko toxicity lithia se může dále zvětšovat, jestliže je současně užíváno diuretikum.
Furosemid
Současné podávání přípravku Entresto a furosemidu nemělo žádný vliv na farmakokinetiku přípravku Entresto, ale snižovalo Cmax furosemidu o 50 % a AUC furosemidu o 28 %. Zatímco nebyla žádná relevantní změna v objemu moči, vylučování sodíku močí bylo sníženo za 4 hodiny a 24 hodin po současném podání. U pacientů léčených přípravkem Entresto byla průměrná denní dávka furosemidu nezměněna od výchozí hodnoty až do konce studie PARADIGM-HF.
Nitráty, např. nitroglycerin
Nevyskytla se žádná léková interakce (“drug-drug interaction”) mezi přípravkem Entresto a intravenózně podaným nitroglycerinem, s ohledem na snížení krevního tlaku. Současné podání nitroglycerinu a přípravku Entresto bylo spojeno s léčebným rozdílem 5 tepů za minutu v srdeční frekvenci v porovnání s podáním samotného nitroglycerinu. Podobný účinek na srdeční frekvenci se může objevit, pokud se přípravek Entresto podává společně se sublingválními, perorálními nebo transdermálními nitráty. Úprava dávky se obvykle nevyžaduje.
OATP a MRP2 transportéry
Aktivní metabolit sakubitrilu (LBQ657) a valsartanu jsou substráty OATP1B1, OATP1B3, OAT1 a OAT3; valsartan je také substrátem MRP2. Proto současné podávání přípravku Entresto s inhibitory OATP1B1, OATP1B3, OAT3 (např. rifampicinem, cyklosporinem), OAT1 (např. tenofovirem, cidofovirem) nebo MRP2 (např. ritonavirem) může navzájem zvyšovat systémovou expozici LBQ657 nebo valsartanu. Pokud zahajujete nebo ukončujete současnou léčbu s těmito léčivými přípravky, měla by tomu být věnována patřičná péče.
Metformin
Současné podávání přípravku Entresto s metforminem snižovalo Cmax a AUC metforminu o 23 %. Klinický význam těchto nálezů není znám. Proto když se zahajuje léčba přípravkem Entresto u pacientů užívajících metformin, měl by být zhodnocen klinický stav pacienta.
Nevýznamné interakce
Při současném podávání přípravku Entresto s digoxinem, warfarinem, hydrochlorothiazidem, amlodipinem, omeprazolem, karvedilolem nebo kombinací levonorgestrelu/ethinylestradiolu nebyla pozorována žádná klinicky významná léková interakce.
Interakce CYP450
Studie látkové výměny in vitro ukazují, že potenciál lékových interakcí zprostředkovaných CYP450 je malý, protože metabolizmus přípravku Entresto pomocí enzymů CYP450 je omezený. Přípravek Entresto neindukuje ani neinhibuje enzymy CYP450.
4.6 Fertilita, těhotenství a kojení
Užívání přípravku Entresto se nedoporučuje během prvního trimestru těhotenství a je kontraindikováno během druhého a třetího trimestru těhotenství (viz bod 4.3).
Valsartan
Epidemiologická fakta s ohledem na riziko teratogenity následně po expozici ACE inhibitorům během prvního trimestru těhotenství nebyla průkazná; nicméně malé zvýšení rizika nelze vyloučit. Zatímco nejsou k dispozici kontrolovaná epidemiologická data ohledně rizika s ARB, může existovat podobné riziko pro tuto třídu léčivých přípravků. Pokud je pokračující léčba ARB považována za nezbytnou, je třeba u pacientek plánujících těhotenství změnit léčbu na alternativní antihypertenzní léčbu, která má stanovený bezpečnostní profil pro užívání v těhotenství. Pokud je diagnostikováno těhotenství, léčba ARB má být ihned ukončena a případně zahájena alternativní léčba. Je známo, že expozice léčbě ARB během druhého a třetího trimestru indukuje u lidí fetotoxicitu (zhoršení renálních funkcí, oligohydramnion, retardace osifikace lebky) a neonatální toxicitu (renální selhání, hypotenze, hyperkalemie).
Pokud dojde k expozici ARB od druhého trimestru těhotenství, doporučuje se kontrola renálních funkcí a lebky ultrazvukem. Kojenci, jejichž matky užívaly ARB, by měli být podrobně sledováni pro hypotenzi (viz bod 4.3).
Sakubitril
Údaje o podávání sakubitrilu těhotným ženám nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3).
Entresto
Údaje o užívání přípravku Entresto u těhotných žen nejsou k dispozici. Studie na zvířatech s přípravkem Entresto prokázaly reprodukční toxicitu (viz bod 5.3).
Kojení
Není známo, zda se přípravek Entresto vylučuje do lidského mateřského mléka. Složky přípravku Entresto, sakubitril a valsartan, byly vylučovány do mléka kojících potkanů (viz bod 5.3). Kvůli možnému riziku nežádoucích reakcí u kojených novorozenců/dětí se přípravek nedoporučuje během kojení. Je třeba se rozhodnout, zda přerušit kojení nebo v době kojení ukončit podávání přípravku Entresto, přičemž je třeba vzít v úvahu důležitost podávání přípravku Entresto pro matku.
Fertilita
Nejsou k dispozici žádné údaje o účinku přípravku Entresto na lidskou fertilitu. Ve studiích s tímto přípravkem se neprokázalo žádné zhoršení fertility u potkaních samců a samic (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Entresto má malý vliv na schopnost řídit nebo obsluhovat stroje. Pokud řídíte vozidla nebo obsluhujete stroje, je třeba vzít v úvahu, že se občas může objevit závrať nebo únava.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nejčastější hlášené nežádoucí účinky během léčby přípravkem Entresto byly hypotenze, hyperkalemie a porucha funkce ledvin (viz bod 4.4). U pacientů léčených přípravkem Entresto byl hlášen angioedém (viz popis vybraných nežádoucích účinků).
Bezpečnost přípravku Entresto u pacientů s chronickým srdečním selháním byla hodnocena v pivotní fázi 3 studie PARADIGM-HF, která porovnávala pacienty léčené přípravkem Entresto 97 mg/103 mg (n = 4203) nebo enalaprilem 10 mg (n = 4229) dvakrát denně. Pacienti randomizovaní do skupiny s přípravkem Entresto byli léčeni s mediánem délky expozice 24 měsíců, 3271 pacientů bylo léčeno déle než jeden rok.
Ve studii PARADIGM-HF byly subjekty nejprve léčeny ACE inhibitory a/nebo ARB a také musely úspěšně dokončit následné “run-in” periody s enalaprilem a přípravkem Entresto (medián expozice léku 15 a 29 dní, v uvedeném pořadí) před randomizovanou dvojitě-zaslepenou periodou. Během ”run-in” periody s enalaprilem 1102 pacientů (10,5 %) trvale ukončilo studii, 5,6 % kvůli nežádoucímu účinku, nejčastěji renální dysfunkce (1,7 %), hyperkalemie (1,7 %) a hypotenze (1,4 %). Během “run-in” periody s přípravkem Entresto 10,4 % pacientů trvale ukončilo studii, 5,9 % kvůli nežádoucímu účinku, nejčastěji renální dysfunkce (1,8 %), hypotenze (1,7 %) a hyperkalemie (1,3 %). Kvůli ukončením během “run-in” periody mohou být četnosti nežádoucích účinků, jak jsou prezentovány v tabulce níže, nižší než četnosti nežádoucích účinků očekávané v klinické praxi.
Ukončení léčby kvůli nežádoucímu účinku v dvojitě-zaslepeném období studie PARADIGM-HF se vyskytlo u 450 pacientů léčených přípravkem Entresto (10,7 %) a u 516 pacientů léčených enalaprilem (12,2 %).
Tabulkový seznam nežádoucích účinků
Nežádoucí účinky jsou seřazeny podle systému orgánových tříd a dále podle četnosti, nejčastější je uveden na prvním místě, s použitím následující konvence: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (> 1/1000 až <1/100), vzácné (>1/10000 až <1/1000), velmi vzácné (<1/10000). V rámci každé skupiny četností jsou nežádoucí účinky řazeny v pořadí se snižující se závažností.
Tabulka 1 Seznam nežádoucích účinků
|
Systém orgánových tříd |
Preferovaný termín |
Kategorie četností |
|
Poruchy krve a lymfatického systému |
Anemie |
Časté |
|
Poruchy imunitního systému |
Hypersenzitivita |
Méně časté |
|
Poruchy metabolismu a výživy |
Hyperkalemie* |
Velmi časté |
|
Hypokalemie |
Časté | |
|
Hypoglykemie |
Časté | |
|
Poruchy nervového systému |
Závrať |
Časté |
|
Časté | ||
|
Synkopa |
Časté | |
|
Posturální závrať |
Méně časté | |
|
Poruchy ucha a labyrintu |
Závrať |
Časté |
|
Cévní poruchy |
Hypotenze* |
Velmi časté |
|
Ortostatická hypotenze |
Časté | |
|
Respirační, hrudní a mediastinální poruchy |
Časté | |
|
Gastrointestinální poruchy |
Časté | |
|
Časté | ||
|
Gastritida |
Časté | |
|
Poruchy kůže a podkožní tkáně |
Méně časté | |
|
Méně časté | ||
|
Angioedém* |
Méně časté | |
|
Poruchy ledvin a močových cest |
Porucha funkce ledvin* |
Velmi časté |
|
Selhání ledvin (selhání ledvin, akutní selhání ledvin) |
Časté | |
|
Celkové poruchy a reakce v místě aplikace |
Únava |
Časté |
|
Astenie |
Časté |
*Viz popis vybraných nežádoucích účinků.
Popis vybraných nežádoucích účinků
Angioedém
U pacientů léčených přípravkem Entresto byl hlášen angioedém. Ve studii PARADIGM-HF byl angioedém hlášen u 0,5 % pacientů léčených přípravkem Entresto, v porovnání s 0,2 % pacientů léčených enalaprilem. Vyšší incidence angioedému byla pozorována u pacientů černé rasy léčených přípravkem Entresto (2,4 %) a enalaprilem (0,5 %) (viz bod 4.4).
Hyperkalemie a sérový draslík
Ve studii PARADIGM-HF byly hlášeny hyperkalemie a koncentrace sérového draslíku >5,4 mmol/l v 11,6 % a 19,7 % u pacientů léčených přípravkem Entresto, a ve 14,0 % a 21,1 % u pacientů léčených enalaprilem, v uvedeném pořadí.
Krevní tlak
Ve studii PARADIGM-HF byly hypotenze a klinicky významný nízký systolický krevní tlak (<90 mmHg a snížení z výchozí hodnoty o >20 mmHg) hlášeny v 17,6 % a 4,76 % u pacientů léčených přípravkem Entresto v porovnání s 11,9 % a 2,67 % u pacientů léčených enalaprilem, v uvedeném pořadí.
Porucha funkce ledvin
Ve studii PARADIGM-HF byla porucha funkce ledvin hlášena v 10,1 % u pacientů léčených přípravkem Entresto a u 11,5 % pacientů léčených enalaprilem.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
S ohledem na předávkování u lidí jsou k dispozici omezená data. Jednotlivá dávka přípravku Entresto 583 mg sakubitrilu/617 mg valsartanu a mnohočetné dávky 437 mg sakubitrilu/463 mg valsartanu (po 14 dní) byly studovány u zdravých dobrovolníků a byly dobře tolerovány.
Nejpravděpodobnější příznak předávkování je hypotenze z důvodu účinků přípravku Entresto, které snižují krevní tlak. Je třeba poskytnout symptomatickou léčbu.
Z důvodu vysoké vazby na proteiny je nepravděpodobné, že by byl tento léčivý přípravek odstraněn hemodialýzou.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Léčiva ovlivňující renin-angiotenzinový systém, antagonisté angiotenzinu II, ostatní kombinace, ATC kód: C09DX04
Mechanismus účinku
Přípravek Entresto představuje mechanismus účinku angiotenzin receptor neprilysinu inhibitoru prostřednictvím simultánní inhibice neprilysinu (neutrální endopeptidázy, NEP) přes LBQ657, aktivní metabolit proléčiva sakubitrilu a blokádou receptorů typu 1 (AT1) pro angiotenzin II přes valsartan. Komplementární kardiovaskulární benefity přípravku Entresto u pacientů se srdečním selháním jsou přisuzovány vzestupu peptidů, které jsou degradovány neprilysinem, jako jsou natriuretické peptidy (NP), prostřednictvím LBQ657 a simultánní inhibicí účinků angiotenzinu II valsartanem. Natriuretické peptidy uplatňují své účinky aktivací membránově vázaných guanylyl cyklázových spojených receptorů, což vede ke zvýšeným koncentracím druhého posla cyklického guanosinmonofosfátu (cGMP), které mohou vést k vazodilataci, natriuréze a diuréze, zvyšuje se rychlost glomerulární filtrace a průtok krve ledvinami, k inhibici uvolnění reninu a aldosteronu, snížení aktivace sympatiku a anti-hypertrofickým a anti-fibrotickým účinkům.
Valsartan inhibuje škodlivé kardiovaskulární a renální účinky angiotenzinu II selektivní blokádou AT1 receptoru a také inhibuje uvolnění aldosteronu závislé na angiotenzinu II. To předchází trvalé aktivaci renin-angiotenzin-aldosteronového systému, která by mohla vést k vazokonstrikci, renální retenci sodíku a tekutin, aktivaci buněčného růstu a proliferace a následně k maladaptivní kardiovaskulární přestavbě.
Farmakodvnamické účinky
Farmakodynamické účinky přípravku Entresto byly hodnoceny po podání jednotlivé a mnohočetných dávek zdravým subjektům a pacientům se srdečním selháním a jsou konzistentní se simultánní inhibicí neprilysinu a blokádou RAAS. V 7-denní studii kontrolované valsartanem u pacientů se sníženou ejekční frakcí (HFrEF) vedlo podávání přípravku Entresto k počátečnímu zvýšení natriurézy, ke zvýšenému cGMP v moči a ke sníženým plazmatickým hladinám mid-regionálního pro-atriálního natriuretického peptidu (MR-proANP) a N-terminálního pro-hormonu mozkového natriuretického peptidu (NT-proBNP) v porovnání s valsartanem. V 21-denní studii u pacientů s HFrEF přípravek Entresto významně zvyšoval ANP a cGMP v moči a cGMP v plazmě a snižoval plazmatický NT-proBNP, aldosteron a endotelin-1 v porovnání s výchozím stavem. Receptor AT1 byl také blokován, což bylo prokázáno zvýšenou plazmatickou aktivitou reninu a plazmatickými koncentracemi reninu. Ve studii PARADIGM-HF snižoval přípravek Entresto plazmatický NT-proBNP a zvyšoval plazmatický BNP a cGMP v moči v porovnání s enalaprilem. BNP není vhodný biomarker srdečního selhání u pacientů léčených přípravkem Entresto, protože BNP je substrátem neprilysinu (viz bod 4.4). NT-proBNP není substrátem neprilysinu, a proto je vhodnějším biomarkerem.
V podrobné QTc klinické studii u zdravých subjektů mužského pohlaví neměly jednotlivé dávky přípravku Entresto 194 mg sakubitrilu/206 mg valsartanu a 583 mg sakubitrilu/617 mg valsartanu žádný účinek na srdeční repolarizaci.
Neprilysin je jeden z mnoha enzymů zapojený do odstranění amyloidu-P (AP) z mozku a cerebrospinálního moku (CSF). Podání přípravku Entresto 194 mg sakubitrilu/206 mg valsartanu jednou denně po dobu dvou týdnů zdravým subjektům bylo spojeno se zvýšením AP1-38 v cerebrospinálním moku v porovnání s placebem, nevyskytly se žádné změny v koncentracích AP1-40 a 1-42 v cerebrospinálním moku. Klinický význam tohoto nálezu není jasný (viz bod 5.3).
Klinická účinnost a bezpečnost
Síly 24 mg/26 mg, 49 mg/51 mg a 97 mg/103 mg jsou uváděny v některých publikacích jako 50, 100 nebo 200 mg.
PARADIGM-HF
PARADIGM-HF byla mezinárodní, randomizovaná, dvojitě-zaslepená studie s 8442 pacienty, která srovnávala přípravek Entresto s enalaprilem, oba přípravky byly podávány dospělým pacientům s chronickým srdečním selháním třídy NYHA II-IV a sníženou ejekční frakcí (ejekční frakce levé komory [LVEF] <40 %, upravená později na <35 %) k další léčbě srdečního selhání. Primární cíl byl složený z kardiovaskulárního (CV) úmrtí nebo hospitalizace pro srdeční selhání (HF). Pacienti s STK <100 mmHg, závažnou poruchou funkce ledvin (eGFR <30 ml/min/1,73 m2) a závažnou poruchou funkce jater byli vyloučeni při screeningu, a proto nebyli prospektivně studováni.
Před účastí ve studii byli pacienti dobře léčeni standardní léčbou, která zahrnovala ACE inhibitory/ARBs (>99 %), beta-blokátory (94 %), antagonisty mineralokortikoidních receptorů (58 %) a diuretika (82 %). Medián délky následného sledování byl 27 měsíců a pacienti byli léčeni až 4,3 roku.
U pacientů bylo požadováno ukončení jejich současné léčby ACE inhibitorem nebo ARB a vstup do následné jednoduše-zaslepené run-in periody, během které dostávali léčbu enalaprilem 10 mg dvakrát denně, následovaný jednoduše-zaslepenou léčbou přípravkem Entresto 100 mg dvakrát denně, která se zvyšovala na 200 mg dvakrát denně (viz bod 4.8 pro ukončení podávání během této periody). Poté byli randomizováni do dvojitě-zaslepené periody studie, během které dostávali buď přípravek Entresto 200 mg nebo enalapril 10 mg dvakrát denně [Entresto (n = 4209), enalapril (n = 4233)].
Průměrný věk studované populace byl 64 let a 19 % bylo ve věku 75 let nebo více. Při randomizaci bylo 70 % pacientů třídy NYHA II, 24 % bylo třídy III a 0,7 % bylo třídy IV. Průměrná LVEF byla 29 % a bylo zde 963 (11,4 %) pacientů s výchozí LVEF >35 % a <40 %.
Ve skupině s podáváním přípravku Entresto zůstalo 76 % pacientů na cílové dávce 200 mg dvakrát
denně na konci studie (průměrná denní dávka 375 mg). Ve skupině s enalaprilem zůstalo
75 % pacientů na cílové dávce 10 mg dvakrát denně na konci studie (střední denní dávka 18,9 mg).
Přípravek Entresto byl superiorní nad enalaprilem, přičemž redukoval riziko kardiovaskulárních úmrtí nebo hospitalizací pro srdeční selhání na 21,8 % v porovnání s 26,5 % pro pacienty léčené enalaprilem. Snížení absolutního rizika bylo 4,7 % pro kombinovaný cíl kardiovaskulárního úmrtí nebo hospitalizace pro srdeční selhání, 3,1 % pro kardiovaskulární úmrtí samotné a 2,8 % pro první samotnou hospitalizaci pro srdeční selhání. Snížení relativního rizika bylo 20 % proti enalaprilu (viz Tabulka 2). Tento účinek byl pozorován časně a přetrvával během trvání studie (viz Obrázek 1). Obě komponenty přispěly k redukci rizika. Náhlá úmrtí zahrnovala přes 45 % kardiovaskulárních úmrtí a byla redukována o 20 % u pacientů léčených přípravkem Entresto v porovnání s pacienty léčenými enalaprilem (HR 0,80; p = 0,0082). Selhání srdce jako pumpy zahrnovalo přes 26 % kardiovaskulárních úmrtí a bylo redukováno o 21 % u pacientů léčených přípravkem Entresto v porovnání s pacienty léčenými enalaprilem (HR 0,79; p = 0,0338).
Toto snížení rizika bylo konzistentně pozorováno napříč podskupinami včetně: pohlaví, věku, rasy, geografické polohy, třídy NYHA (II/III), ejekční frakce, funkce ledvin, diabetu nebo hypertenze v anamnéze, předchozí léčby srdečního selhání a fibrilace síní.
Přípravek Entresto zlepšil přežití s významným snížením celkové mortality o 2,8 % (Entresto 17 %, enalapril 19,8 %). Relativní snížení rizika bylo 16 % v porovnání s enalaprilem (viz Tabulka 2).
Tabulka 2 Účinky léčby na primární cílový složený endpoint, jeho složky a celkovou mortalitu přes medián sledování (follow-up) 27 měsíců
|
Entresto N = 41871 n (%) |
Enalapril N = 42121 n (%) |
Hazard ratio (95 % CI) |
Redukce relativního rizika |
p-hodnota •k jfe jfe | |
|
Primární složený cílový endpoint úmrtí z kardiovaskulárních příčin a hospitalizace pro srdeční selhání1 |
914 (21,83) |
1117 (26,52) |
0,80 (0,73; 0,87) |
20 % |
0,0000002 |
|
Jednotlivé složky primárního složené |
io cílového end |
pointu | |||
|
Úmrtí |
558 (13,33) |
693 (16,45) |
0,80 (0,71; 0,89) |
20 % |
0,00004 |
|
První hospitalizace pro srdeční selhání |
537 (12,83) |
658 (15,62) |
0,79 (0,71; 0,89) |
21 % |
0,00004 |
|
Sekundární cílový em |
point | ||||
|
Celková mortalita |
711 (16,98) |
835 (19,82) |
0,84 (0,76; 0,93) |
16 % |
0,0005 |
Kaplan-Meierova křivka pro primární složený cílový endpoint a složku úmrtí z kardiovaskulárních příčin
Obrázek 1
Doba do prvního výskytu úmrtí z kardiovaskulárních příčin nebo hospitalizací pro srdeční selhání ve studii PARADIGM-HF
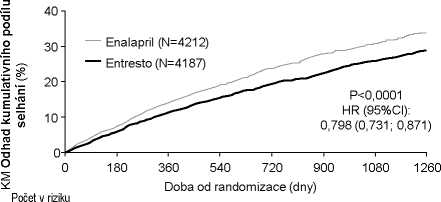
Entresto 4187 3922 3663 3018 2257 1544 896 249
Enalapril 4212 3883 3579 2922 2123 1488 853 236
Doba do výskytu úmrtí z kardiovaskulárních příčin v PARADIGM-HF
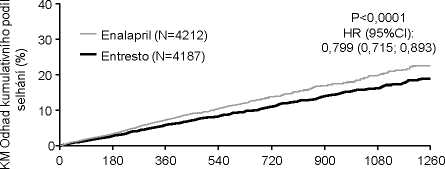
Doba od randomizace (dny)
Počet v riziku
Entresto 4187 4056 3891 3282 2478 1716 1005 280
Enalapril 4212 4051 3860 3231 2410 1726 994 279
TITRATION
TITRATION byla 12-týdenní studie bezpečnosti a snášenlivosti u 538 pacientů s chronickým srdečním selháním (třída NYHA II-IV) a systolickou dysfunkcí (ejekční frakce levé komory <35 %), kteří před vstupem do studie neužívali ACE inhibitory nebo léčbu ARB, nebo užívali různé dávky ACE inhibitorů nebo ARB. Pacienti dostali zahajovací dávku přípravku Entresto 50 mg dvakrát denně a byli titrováni na 100 mg dvakrát denně, poté na cílovou dávku 200 mg dvakrát denně, buď ve 3-týdenním nebo 6-týdenním režimu.
Větší počet pacientů, kteří dříve nedostávali ACE inhibitor nebo léčbu ARB nebo byli léčeni nízkými dávkami (ekvivalentní k <10 mg enalaprilu/den) byl schopen dosáhnout a udržet si dávku přípravku Entresto 200 mg, když byla titrována směrem nahoru po dobu 6 týdnů (84,8 %) nebo 3 týdnů (73,6 %). Celkově dosáhlo a udrželo si cílovou dávku přípravku Entresto 200 mg dvakrát denně 76 % pacientů bez jakéhokoli přerušení dávkování nebo titrace směrem dolů po dobu 12 týdnů.
Pediatrická populace
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií u jedné nebo více podskupin pediatrické populace v léčbě srdečního selhání (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Valsartan obsažený v přípravku Entresto je více biologicky dostupný než valsartan v jiných lékových formách tablet na trhu; 26 mg, 51 mg a 103 mg valsartanu v přípravku Entresto je ekvivalentní k 40 mg, 80 mg a 160 mg valsartanu v jiných lékových formách tablet na trhu, v tomto pořadí.
Absorpce
Po perorálním podání se přípravek Entresto disociuje na valsartan a proléčivo sakubitril. Sakubitril je dále metabolizován na aktivní metabolit LBQ657. Tyto dosahují vrcholových plazmatických koncentrací za 2 hodiny, 1 hodinu a 2 hodiny, v tomto pořadí. Perorální absolutní biologická dostupnost sakubitrilu a valsartanu se odhaduje na více než 60 % (sakubitril) a 23 % (valsartan).
Po dvoudenním podávání přípravku Entresto je dosaženo ustáleného stavu hladin sakubitrilu, LBQ657 a valsartanu do tří dnů. V ustáleném stavu se sakubitril a valsartan významně nekumulují, zatímco LBQ657 se kumuluje 1,6-násobně. Podání s jídlem nemělo klinicky významný vliv na systémové expozice sakubitrilu, LBQ657 a valsartanu. Přípravek Entresto může být podáván s jídlem nebo bez jídla.
Distribuce
Sakubitril, LBQ657 a valsartan jsou vysoce vázány na plazmatické proteiny (94-97 %). Na základě srovnání expozic v plazmě a cerebrospinálním moku prochází LBQ657 hematoencefalickou bariérou v omezeném množství (0,28 %). Průměrný zdánlivý objem distribuce valsartanu a sakubitrilu byl 75 litrů až 103 litrů, v uvedeném pořadí.
Biotransformace
Sakubitril je rychle konvertován karboxylesterázami 1b a 1c na LBQ657, LBQ657 není dále ve významném rozsahu metabolizován. Valsartan je metabolizován minimálně, protože pouze asi 20 % dávky je přeměňováno na metabolity. V plazmě byl identifikován metabolit hydroxylu valsartanu v nízkých koncentracích (<10 %).
Protože metabolizmus sakubitrilu a valsartanu, zprostředkovaný enzymem cytochromu CYP450 je minimální, neočekává se, že by současné podávání s léčivými přípravky, které ovlivňují enzymy cytochromu CYP450 ovlivňovalo farmakokinetiku.
Eliminace
Po perorálním podání je 52-68 % sakubitrilu (primárně jako LBQ657) a přibližně 13 % valsartanu a jeho metabolitů vylučováno v moči, 37-48 % sakubitrilu (primárně jako LBQ657) a 86 % valsartanu a jeho metabolitů je vylučováno ve stolici.
Sakubitril, LBQ657 a valsartan jsou vylučovány z plazmy s průměrným poločasem eliminace (T./2) přibližně 1,43 hodin (sakubitril), 11,48 hodin (LBQ657) a 9,90 hodin (valsartan).
Linearita/nelinearita
Farmakokinetiky sakubitrilu, LBQ657 a valsartanu byly přibližně lineární při testovaném rozmezí dávek přípravku Entresto 24 mg sakubitrilu/26 mg valsartanu až 97 mg sakubitrilu/103 mg valsartanu.
Zvláštní populace
Starší pacienti
Expozice LBQ657 a valsartanu jsou zvýšeny u subjektů starších 65 let věku o 42 % (LBQ657) and 30 % (valsartan) v porovnání s mladšími subjekty.
Porucha funkce ledvin
Byl pozorován vzájemný vztah mezi funkcí ledvin a systémovou expozicí k LBQ657 u pacientů s mírnou až těžkou poruchou funkce ledvin. Expozice LBQ657 u pacientů se středně těžkou (30 ml/min/1,73 m2 < eGFR <60 ml/min/1,73 m2) a těžkou poruchou funkce ledvin (15 ml/min/1,73 m2 < eGFR <30 ml/min/1,73 m2) byla 1,4-krát a 2,2-krát vyšší v porovnání s pacienty s lehkou poruchou funkce ledvin (60 ml/min/1,73 m2 < eGFR <90 ml/min/1,73 m2), největší skupinou pacientů zařazených v PARADIGM-HF). Expozice valsartanu byla podobná u pacientů se středně těžkou a těžkou poruchou funkce ledvin v porovnání s pacienty s lehkou poruchou funkce ledvin. Nebyly provedeny žádné studie u pacientů podstupujících dialýzu. LBQ657 a valsartan jsou ale vysoce vázané na plazmatické proteiny, a proto je nepravděpodobné, že by byly účinně odstraněny dialýzou.
Porucha funkce jater
U pacientů s mírnou až středně těžkou poruchou funkce jater se expozice sakubitrilu zvýšila 1,5- a 3,4- násobně, expozice LBQ657 se zvýšila 1,5- a 1,9-násobně a expozice valsartanu se zvýšila 1,2-násobně a 2,1-násobně, v uvedeném pořadí v porovnání s odpovídajícími zdravými subjekty. Avšak u pacientů s mírnou až středně těžkou poruchou funkce jater se expozice volných koncentrací LBQ657 zvýšily o 1,47- a 3,08-násobek, v uvedeném pořadí, a expozice volných koncentrací valsartanu se zvýšily o 1,09-násobek a 2,20-násobek, v uvedeném pořadí, v porovnání se zdravými subjekty. Přípravek Entresto nebyl studován u pacientů s těžkou poruchou funkce jater, biliární cirhózou nebo cholestázou (viz body 4.3 a 4.4).
Vliv pohlaví
Farmakokinetiky přípravku Entresto (sakubitril, LBQ657 a valsartan) jsou podobné mezi subjekty mužského a ženského pohlaví.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje (včetně studií s komponentami sakubitril a valsartan a/nebo přípravkem Entresto) získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu a fertility neodhalily žádné zvláštní riziko pro člověka.
Fertilita, reprodukce a vývoj
Léčba přípravkem Entresto během organogeneze měla za následek zvýšenou embryofetální letalitu u potkanů v dávkách >49 mg sakubitrilu/51 mg valsartanu/kg/den (<0,72-násobek maximální doporučené dávky pro člověka [MRHD] na základě AUC) a u králíků v dávkách >4,9 mg sakubitrilu/5,1 mg valsartanu/kg/den (2-násobek MRHD na základě AUC valsartanu a 0,03-násobek MRHD na základě AUC LBQ657). Přípravek je teratogenní na základě nízkého výskytu fetálního hydrocefalu (spojeného s dávkami toxickými pro matku), který byl pozorován u králíků při dávce přípravku Entresto >4,9 mg sakubitrilu/5,1 mg valsartanu/kg/den. Kardiovaskulární abnormality (hlavně kardiomegalie) byly pozorovány u plodů králíků při dávce netoxické pro matku (1,46 mg sakubitrilu/1,54 mg valsartanu/kg/den). Mírné zvýšení u dvou fetálních skeletálních změn (deformace části kosti hrudní před srůstem, oboustranná osifikace části kosti hrudní před srůstem) bylo pozorováno u králíků při dávce přípravku Entresto 4,9 mg sakubitrilu/5,1 mg valsartanu/kg/den. Nežádoucí embryofetální účinky přípravku Entresto jsou připisovány antagonistické aktivitě na receptory pro angiotenzin (viz bod 4.6).
Léčba sakubitrilem během organogeneze vedla k embryo-fetální letalitě a embryo-fetální toxicitě (snížená fetální tělesná hmotnost a malformace skeletu) u králíků v dávkách spojených s mateřskou toxicitou (500 mg/kg/den; 5,7-násobek MRHD na základě AUC LBQ657). Při dávkách >50 mg/kg/den bylo pozorováno mírné celkové zpoždění v osifikaci. Tento nález se nepovažuje za nepříznivý. Nebyl pozorován žádný důkaz embryo-fetální toxicity ani teratogenity u potkanů léčených sakubitrilem. Embryo-fetální nepozorovaná úroveň nežádoucích účinků (NOAEL) pro sakubitril byla alespoň 750 mg/kg/den u potkanů a 200 mg/kg/den u králíků (2,2-násobek MRHD na základě AUC LBQ657).
Prenatální a postnatální vývojové studie u potkanů prováděné se sakubitrilem ve vysokých dávkách až do 750 mg/kg/den (2,2-násobek MRHD na základě AUC) a s valsartanem v dávkách až do 600 mg/kg/den (0,86-násobek MRHD na základě AUC) ukazují, že léčba přípravkem Entresto během organogeneze, gestace a laktace může ovlivnit vývoj a přežití plodu.
Ostatní preklinické nálezy
Entresto
Účinky přípravku Entresto na koncentrace amyloidu-P v mozkomíšním moku a mozkové tkáni byly hodnoceny u mladých makaků (2-4 roky), léčených přípravkem Entresto (24 mg sakubitrilu/26 mg valsartanu/kg/den) po dobu dvou týdnů. V této studii byla clearance amyloidu-P v mozkomíšním moku u makaků redukována, byly zvýšené hladiny Api-40, 1-42 a 1-38 v mozkomíšním moku, nevyskytlo se odpovídající zvýšení hladin amyloidu-P v mozku. Zvýšení Api-40 a 1-42 v mozkomíšním moku nebyla pozorována ve dvoutýdenní studii u lidí - zdravých dobrovolníků (viz bod 5.1). Dodatečně v toxikologické studii u makaků léčených přípravkem Entresto v dávkách 146 mg sakubitrilu/154 mg valsartanu/kg/den po dobu 39 týdnů nebyl důkaz přítomnosti amyloidových plaků v mozku. V této studii však nebyl obsah amyloidu měřen kvantitativně.
Sakubitril
U nedospělých potkanů léčených sakubitrilem (postnatální dny 7 až 70) se objevilo snížení vývoje kostní masy a prodloužení kostí odpovídající věku. Studie u dospělých potkanů ukázala pouze minimální přechodný inhibiční vliv na kostní minerální densitu, ale ne na žádné jiné parametry týkající se kostního růstu, naznačující žádný relevantní vliv sakubitrilu na kosti u dospělé pacientské populace za normálních podmínek. Ačkoli mírný přechodný zásah sakubitrilu do časné fáze hojení fraktury u dospělých nemůže být vyloučen.
Valsartan
U nedospělých potkanů léčených valsartanem (postnatální dny 7 až 70) vedly dávky tak nízké jako 1 mg/kg/den k trvalým nevratným změnám ledvin sestávajícím z tubulární nefropatie (občas doprovázené tubulární epiteliální nekrózou) a dilatace pánvičky. Tyto změny ledvin reprezentují očekávaný nadsazený farmakologický účinek inhibitorů angiotenzin konvertujícího enzymu a blokátorů typu 1pro angiotenzin II; tyto účinky jsou pozorovány, pokud jsou potkani léčeni během prvních 13 dní života. Tato perioda se shoduje s 36 týdny gestace u člověka, což by mohlo být příležitostně prodlouženo na 44 týdnů po početí u člověka. 4
Entresto 49 mg/51 mg potahované tablety Hypromelosa 2910/3 Oxid titaničitý (E171)
Makrogol 4000 Mastek
Červený oxid železitý (E172)
Žlutý oxid železitý (E172)
Entresto 97 mg/103 mg potahované tablety Hypromelosa 2910/3 Oxid titaničitý (E171)
Makrogol 4000 Mastek
Červený oxid železitý (E172)
Černý oxid železitý (E172)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
30 měsíců
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
6.5 Druh obalu a obsah balení
PVC/PVDC/Al blistry. Jeden blistr obsahuje buď 10 nebo14 potahovaných tablet.
Entresto 24 mg/26 mg potahované tablety
Velikosti balení: 14, 20, 28 nebo 56 potahovaných tablet.
Entresto 49 mg/51 mg potahované tablety
Velikosti balení: 14, 20, 28 nebo 56 potahovaných tablet a multipacky obsahující 168(3x56) nebo 196 (7x28) potahovaných tablet.
Entresto 97 mg/103 mg potahované tablety
Velikosti balení: 14, 20, 28 nebo 56 potahovaných tablet a multipacky obsahující 168 (3x56) nebo 196 (7x28) potahovaných tablet.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
Entresto 24 mg/26 mg potahované tablety
EU/1/15/1058/001
EU/1/15/1058/008-010
Entresto 49 mg/51 mg potahované tablety
EU/1/15/1058/002-004
EU/1/15/1058/011-013
Entresto 97 mg/103 mg potahované tablety
EU/1/15/1058/005-007
EU/1/15/1058/014-016
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
19. listopadu 2015
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Novartis Pharma GmbH Roonstrasse 25 90429 Norimberk Německo
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
Držitel rozhodnutí o registraci předloží první pravidelně aktualizovanou zprávu o bezpečnosti pro tento léčivý přípravek do 6 měsíců od jeho registrace.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
Entresto 24 mg/26 mg potahované tablety sacubitrilum/valsartanum
Jedna 24 mg/26 mg tableta obsahuje sacubitrilum 24,3 mg a valsartanum 25,7 mg (jako komplexu sodné soli sakubitril-valsartan).
Potahovaná tableta
14 potahovaných tablet 20 potahovaných tablet 28 potahovaných tablet 56 potahovaných tablet
Před použitím si přečtěte příbalovou informaci. Perorální podání
Uchovávejte mimo dohled a dosah dětí.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
EU/1/15/1058/001
EU/1/15/1058/008
EU/1/15/1058/009
EU/1/15/1058/010
28 potahovaných tablet 14 potahovaných tablet 20 potahovaných tablet 56 potahovaných tablet
Lot
Entresto 24 mg/26 mg
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH NEBO STRIPECH BLISTRY
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Entresto 24 mg/26 mg tablety sacubitrilum/valsartanum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
Entresto 49 mg/51 mg potahované tablety sacubitrilum/valsartanum
Jedna 49 mg/51 mg tableta obsahuje sacubitrilum 48,6 mg a valsartanum 51,4 mg (jako komplexu sodné soli sakubitril-valsartan).
Potahovaná tableta
14 potahovaných tablet 20 potahovaných tablet 28 potahovaných tablet 56 potahovaných tablet
Před použitím si přečtěte příbalovou informaci. Perorální podání
Uchovávejte mimo dohled a dosah dětí.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
EU/1/15/1058/002 EU/1/15/1058/003 EU/1/15/1058/011 EU/1/15/1058/012
28 potahovaných tablet 56 potahovaných tablet 14 potahovaných tablet 20 potahovaných tablet
Lot
Entresto 49 mg/51 mg
Entresto 49 mg/51 mg potahované tablety sacubitrilum/valsartanum
Jedna 49 mg/51 mg tableta obsahuje sacubitrilum 48,6 mg a valsartanum 51,4 mg (jako komplexu sodné soli sakubitril-valsartan).
Potahovaná tableta
Multipack: 168 (3 balení po 56) potahovaných tablet Multipack: 196 (7 balení po 28) potahovaných tablet
Před použitím si přečtěte příbalovou informaci. Perorální podání
Uchovávejte mimo dohled a dosah dětí.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/15/105 8/004 168 potahovaných tablet
EU/1/15/1058/013 196 potahovaných tablet
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Entresto 49 mg/51 mg
Entresto 49 mg/51 mg potahované tablety sacubitrilum/valsartanum
Jedna 49 mg/51 mg tableta obsahuje sacubitrilum 48,6 mg a valsartanum 51,4 mg (jako komplexu sodné soli sakubitril-valsartan).
Potahovaná tableta
28 potahovaných tablet. Součást multipacku. Neprodává se samostatně. 56 potahovaných tablet. Součást multipacku. Neprodává se samostatně.
Před použitím si přečtěte příbalovou informaci. Perorální podání
Uchovávejte mimo dohled a dosah dětí.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/15/105 8/004 168 potahovaných tablet
EU/1/15/1058/013 196 potahovaných tablet
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Entresto 49 mg/51 mg
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH NEBO STRIPECH BLISTRY
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Entresto 49 mg/51 mg tablety sacubitrilum/valsartanum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
Entresto 97 mg/103 mg potahované tablety sacubitrilum/valsartanum
Jedna 97 mg/103 mg tableta obsahuje sacubitrilum 97,2 mg a valsartanum 102,8 mg (jako komplexu sodné soli sakubitril-valsartan).
Potahovaná tableta
14 potahovaných tablet 20 potahovaných tablet 28 potahovaných tablet 56 potahovaných tablet
Před použitím si přečtěte příbalovou informaci. Perorální podání
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
EU/1/15/1058/005
EU/1/15/1058/006
EU/1/15/1058/014
EU/1/15/1058/015
28 potahovaných tablet 56 potahovaných tablet 14 potahovaných tablet 20 potahovaných tablet
Lot
Entresto 97 mg/103 mg
Entresto 97 mg/103 mg potahované tablety sacubitrilum/valsartanum
Jedna 97 mg/103 mg tableta obsahuje sacubitrilum 97,2 mg a valsartanum 102,8 mg (jako komplexu sodné soli sakubitril-valsartan).
Potahovaná tableta
Multipack: 168 (3 balení po 56) potahovaných tablet Multipack: 196 (7 balení po 28) potahovaných tablet
Před použitím si přečtěte příbalovou informaci. Perorální podání
Uchovávejte mimo dohled a dosah dětí.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/15/1058/007 168 potahovaných tablet
EU/1/15/1058/016 196 potahovaných tablet
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Entresto 97 mg/103 mg
Entresto 97 mg/103 mg potahované tablety sacubitrilum/valsartanum
Jedna 97 mg/103 mg tableta obsahuje sacubitrilum 97,2 mg a valsartanum 102,8 mg (jako komplexu sodné soli sakubitril-valsartan).
Potahovaná tableta
28 potahovaných tablet. Součást multipacku. Neprodává se samostatně. 56 potahovaných tablet. Součást multipacku. Neprodává se samostatně.
Před použitím si přečtěte příbalovou informaci. Perorální podání
Uchovávejte mimo dohled a dosah dětí.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/15/1058/007 168 potahovaných tablet
EU/1/15/1058/016 196 potahovaných tablet
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Entresto 97 mg/103 mg
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH NEBO STRIPECH BLISTRY
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Entresto 97 mg/103 mg tablety sacubitrilum/valsartanum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Novartis Europharm Limited
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
Entresto 24 mg/26 mg potahované tablety Entresto 49 mg/51 mg potahované tablety Entresto 97 mg/103 mg potahované tablety
sacubitrilum/valsartanum
'VTento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí
ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Entresto a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Entresto užívat
3. Jak se Entresto užívá
4. Možné nežádoucí účinky
5. Jak Entresto uchovávat
6. Obsah balení a další informace 5
2. Čemu musíte věnovat pozornost, než začnete Entresto užívat Neužívejte Entresto:
• jestliže jste alergický(á) na sakubitril, valsartan nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6). Pokud si myslíte, že můžete být alergický(á) na kteroukoli složku tohoto přípravku, sdělte to svému lékaři předtím, než začnete přípravek Entresto užívat.
• pokud užíváte jiný typ léku zvaný inhibitor angiotenzin konvertujícího enzymu (ACE inhibitor) (například enalapril, lisinopril nebo ramipril). ACE inhibitory se užívají k léčbě vysokého krevního tlaku nebo srdečního selhání. Pokud jste užil(a) ACE inhibitor, počkejte 36 hodin
po užití poslední dávky, než začnete užívat přípravek Entresto (viz „Další léčivé přípravky a Entresto5“).
• pokud se u Vás nebo u člena Vaší rodiny v minulosti objevila reakce zvaná angioedém (otok obličeje, rtů, jazyka a/nebo hrtanu, potíže s dýcháním), když jste užil(a) ACE inhibitor nebo blokátor receptoru angiotenzinu (ARB) (jako je valsartan, telmisartan nebo irbesartan).
• pokud máte cukrovku nebo trpíte poruchou funkce ledvin a jste v současné době léčeni lékem, který snižuje krevní tlak obsahujícím aliskiren (viz „Další léčivé přípravky a Entresto“).
• pokud trpíte závažným onemocněním j ater.
• pokud jste těhotná více než 3 měsíce (rovněž je lepší se vyhnout tomuto léku v časném těhotenství, viz „Těhotenství a kojení “).
Pokud se Vás jakákoliv z výše uvedených informací týká, neužívejte přípravek Entresto a poraďte se se svým lékařem.
Upozornění a opatření
Před užitím přípravku Entresto se poraďte se svým lékařem, lékárníkem nebo zdravotní sestrou
• pokud jste v současné době léčen(a) blokátorem receptoru angiotenzinu (ARB) nebo aliskirenem (viz „Neužívejte Entresto5“).
• pokud se u Vás někdy v minulosti objevil angioedém (viz „Neužívejte Entresto“ a bod 4 „Možné nežádoucí účinky“).
• pokud máte nízký krevní tlak nebo užíváte jiné léčivé přípravky, které snižují krevní tlak (například močopudný lék) nebo trpíte zvracením nebo průjmem, zvláště pokud je Vám 65 let a více nebo pokud máte onemocnění ledvin a nízký krevní tlak.
• pokud máte těžké onemocnění ledvin.
• pokud trpíte dehydratací.
• pokud máte zúženou ledvinnou tepnu.
• pokud máte onemocnění jater.
Váš lékař může během léčby přípravkem Entresto v pravidelných intervalech kontrolovat množství draslíku ve Vaší krvi.
Pokud se Vás jakákoliv z výše uvedených informací týká, poraďte se se svým lékařem, lékárníkem nebo zdravotní sestrou předtím, než začnete užívat přípravek Entresto.
Děti a dospívající
Tento léčivý přípravek není určen pro užití u dětí (ve věku do 18 let). Je to z toho důvodu, že nebyl studován u této věkové skupiny.
Další léčivé přípravky a Entresto
Informujte svého lékaře, lékárníka nebo zdravotní sestru o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat. Může být nutné změnit dávku, přijmout jiná opatření nebo dokonce přestat užívat některý z těchto léků. Je to zvláště důležité u následujících léků:
• ACE inhibitory. Neužívejte přípravek Entresto s ACE inhibitory. Pokud jste užil(a)
ACE inhibitor, počkejte 36 hodin po užití poslední dávkyACE inhibitoru předtím, než začnete užívat přípravek Entresto (viz „Neužívejte Entresto1“). Pokud přestanete užívat přípravek Entresto, počkejte 36 hodin po užití poslední dávky přípravku Entresto předtím, než začnete užívat ACE inhibitor.
• jiné léky užívané k léčbě srdečního selhání nebo ke snížení krevního tlaku, jako jsou blokátory receptoru angiotenzinu nebo aliskiren (viz „Neužívejte Entresto “).
• některé léky známé jako statiny, které se užívají ke snížení vysokých hladin cholesterolu (například atorvastatin).
• sildenafil, lék užívaný k léčbě poruch erekce nebo plicní hypertenze.
• léky, které zvyšují množství draslíku v krvi. Tyto zahrnují doplňky draslíku, náhrady solí obsahující draslík, draslík šetřící léky a heparin.
• léky proti bolesti zvané nesteroidní protizánětlivé léky (NSAID) nebo selektivní inhibitory cyklooxygenázy-2 (Cox-2 inhibitory). Když zahajujete nebo upravujete léčbu a užíváte některý z těchto léků, Váš lékař může chtít překontrolovat funkci Vašich ledvin (viz „Upozornění a opatření“).
• lithium, lék užívaný k léčbě některých typů psychiatrických onemocnění.
• furosemid, lék patřící k typům léčiv známých jako diuretika (léky na odvodnění), které se užívají k produkci zvýšeného množství moči.
• nitroglycerin, lék užívaný k léčbě anginy pectoris.
• některé typy antibiotik (ze skupiny rifamycinu), cyklosporin (používaný v prevenci odmítnutí transplantovaných orgánů) nebo antivirotika jako je ritonavir (užívaný k léčbě HIV/AIDS).
• metformin, lék užívaný k léčbě diabetu.
Pokud se Vás jakákoliv z výše uvedených informací týká, poraďte se se svým lékařem nebo lékárníkem předtím, než začnete užívat přípravek Entresto.
Těhotenství a kojení
Svému lékaři musíte sdělit, pokud si myslíte, že jste (nebo byste mohla být) těhotná. Váš lékař Vám obyčejně poradí, abyste přestala užívat tento lék předtím, než otěhotníte nebo jakmile se dozvíte, že jste těhotná, a doporučí Vám užívat jiný lék namísto přípravku Entresto. Tento lék se nedoporučuje užívat v časném těhotenství a nesmí být užíván, pokud jste těhotná více než 3 měsíce, protože může způsobit závažné poškození Vašeho dítěte, pokud se užívá po třetím měsíci těhotenství.
Kojení
Entresto se nedoporučuje u matek v době kojení. Sdělte svému lékaři, pokud kojíte nebo plánujete kojit.
Řízení dopravních prostředků a obsluha strojů
Předtím, než budete řídit automobil, používat nástroje nebo obsluhovat stroje, nebo provádět aktivity, které vyžadují pozornost, ujistěte se, že víte, jak Vás přípravek Entresto ovlivňuje. Pokud při užívání tohoto léku trpíte závratí nebo velkou únavou, neřiďte motorové vozidlo, nejezděte na kole ani nepracujte se žádnými nástroji nebo neobsluhujte stroje.
Jak se Entresto užívá
3.
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Obvykle začnete užívat 24 mg/26 mg nebo 49 mg/51 mg dvakrát denně (jednu tabletu ráno a jednu tabletu večer). Váš lékař rozhodne o přesné zahajovací dávce na základě léků, které jste užíval(a) předtím. Váš lékař poté dávku upraví na pro Vás nejoptimálnější dávku v závislosti na tom, jak odpovídáte na léčbu.
Obvyklá doporučená cílová dávka je 97 mg/103 mg dvakrát denně (jedna tableta ráno a jedna tableta večer).
U pacientů užívajících přípravek Entresto se může objevit nízký krevní tlak (závrať, omámení), vysoká hladina draslíku v krvi (která by byla detekována, pokud by Váš lékař provedl krevní test) nebo zhoršená funkce ledvin. Pokud k tomu dojde, Váš lékař může snížit dávku jakéhokoliv jiného léku, který užíváte, dočasně snížit dávku přípravku Entresto nebo úplně vysadit léčbu přípravkem Entresto.
Tabletu zapijte sklenicí vody. Přípravek Entresto můžete užívat s jídlem nebo bez jídla.
Jestliže jste užil(a) více přípravku Entresto, než jste měl(a)
Pokud jste náhodně užil(a) příliš mnoho tablet přípravku Entresto nebo pokud někdo jiný užil Vaše tablety, ihned kontaktujte svého lékaře. Pokud pocítíte silnou závrať a/nebo mdlobu, informujte svého lékaře tak rychle, jak je to možné a lehněte si.
Jestliže jste zapomněl(a) užít přípravek Entresto
Tento lék je vhodné užívat každý den ve stejnou dobu. Pokud jste ale zapomněl(a) užít dávku, měl(a) byste jednoduše užít další dávku v obvyklou dobu. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou tabletu.
Jestliže jste přestal(a) užívat přípravek Entresto
Ukončení léčby přípravkem Entresto může způsobit zhoršení Vašeho zdravotního stavu. Nepřestávejte užívat tento lék, dokud Vám to nesdělí Váš lékař.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí
vyskytnout u každého.
Některé nežádoucí účinky mohou být závažné.
• Ukončete užívání přípravku Entresto a vyhledejte okamžitě lékařskou pomoc, pokud
zaznamenáte jakýkoliv otok obličeje, rtů, jazyka a/nebo hrtanu, který může způsobit potíže s dýcháním nebo polykáním. Toto mohou být příznaky angioedému (méně častého nežádoucího účinku, který může postihnout až 1 ze 100 lidí).
Ostatní možné nežádoucí účinky:
Pokud se stupeň závažnosti kteréhokoliv z níže uvedených nežádoucích účinků změní na závažný,
oznamte to lékaři nebo lékárníkovi.
Velmi časté (mohou postihnout více než 1 z 10 lidí):
• nízký krevní tlak (závrať, omámení)
• vysoká hladina draslíku v krvi (patrná z krevního testu)
• snížená funkce ledvin (porucha funkce ledvin)
Časté (mohou postihnout až 1 z 10 lidí):
• kašel
• závrať
• průjem
• nízká hladina červených krvinek (patrná z krevního testu)
• únava
• (akutní) selhání ledvin (závažná porucha funkce ledvin)
• nízká hladina draslíku v krvi (patrná z krevního testu)
• bolest hlavy
• mdloba
• slabost
• pocit nemoci (nevolnost)
• nízký krevní tlak (závrať, omámení) při změně polohy těla ze sedu nebo lehu do stoje
• zánět žaludku (bolest žaludku, nevolnost)
• pocit motání se
• nízká hladina cukru v krvi (patrná z krevního testu)
Méně časté (mohou postihnout až 1 ze 100 lidí):
• alergická reakce s vyrážkou a svěděním
• závrať při změně polohy ze sedu do stoje
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Entresto uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a blistru za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Tento přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
Nepoužívejte žádné balení přípravku Entresto, které je poškozené nebo ukazuje známky manipulace. Nevyhazujte žádné léčivé přípravky do odpadních vod. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Entresto obsahuje
• Léčivými látkami jsou sacubitrilum a valsartanum.
o Jedna 24 mg/26 mg potahovaná tableta obsahuje sacubitrilum 24,3 mg a valsartanum 25,7 mg (jako komplexu sodné soli sakubitril-valsartan). o Jedna 49 mg/51 mg potahovaná tableta obsahuje sacubitrilum 48,6 mg a valsartanum 51,4 mg (jako komplexu sodné soli sakubitril-valsartan). o Jedna 97 mg/103 mg potahovaná tableta obsahuje sacubitrilum 97,2 mg a valsartanum 102,8 mg (jako komplexu sodné soli sakubitril-valsartan).
• Dalšími složkami j ádra tablety j sou mikrokrystalická celulosa, částečně substituovaná hyprolosa, krospovidon, magnesium-stearát, mastek a koloidní bezvodý oxid křemičitý.
• Potahy 24 mg/26 mg a 97 mg/103 mg tablety obsahují hypromelosu, oxid titaničitý (E171), makrogol 4000, mastek, červený oxid železitý (E172) a černý oxid železitý (E172).
• Potah 49 mg/51 mg tablety obsahuje hypromelosu, oxid titaničitý (E171), makrogol 4000, mastek, červený oxid železitý (E172) a žlutý oxid železitý (E172).
Jak přípravek Entresto vypadá a co obsahuje toto balení
Entresto 24 mg/26 mg potahované tablety jsou nafialovělé oválné tablety s vyraženým „NVR“ na jedné straně a „LZ“ na druhé straně. Přibližné rozměry tablety 13,1 mm x 5,2 mm.
Entresto 49 mg/51 mg potahované tablety j sou světle žluté oválné tablety s vyraženým „NVR“ na jedné straně a „L1“ na druhé straně. Přibližné rozměry tablety 13,1 mm x 5,2 mm.
Entresto 97 mg/103 mg potahované tablety jsou světle růžové oválné tablety s vyraženým „NVR“ na jedné straně a „L11“ na druhé straně. Přibližné rozměry tablety 15,1 mm x 6,0 mm.
Tablety jsou dodávány v PVC/PVDC/Al blistrových baleních po 14, 20, 28 nebo 56 tabletách.
49 mg/51 mg a 97 mg/103 mg jsou též dodávány v multipacích po 168 tabletách (3 balení po 56 tabletách) nebo po 196 tabletách (7 balení po 28 tabletách).
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Velká Británie
Výrobce
Novartis Pharma GmbH RoonstraBe 25 D-90429 Norimberk Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
Lietuva Novartis Pharma Services Inc. Tel: +370 5 269 16 50 |
|
Btarapna Novartis Pharma Services Inc. Tea: +359 2 489 98 28 |
Luxembourg/Luxemburg Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
|
Česká republika Novartis s.r.o. Tel: +420 225 775 111 |
Magyarország Novartis Hungária Kft. Pharma Tel.: +36 1 457 65 00 |
|
Danmark Novartis Healthcare A/S Tlf: +45 39 16 84 00 |
Malta Novartis Pharma Services Inc. Tel: +356 2122 2872 |
|
Deutschland Novartis Pharma GmbH Tel: +49 911 273 0 |
Nederland Novartis Pharma B.V. Tel: +31 26 37 82 111 |
|
Eesti Novartis Pharma Services Inc. Tel: +372 66 30 810 |
Norge Novartis Norge AS Tlf: +47 23 05 20 00 |
|
EXXáSa Novartis (Hellas) A.E.B.E. Tqk: +30 210 281 17 12 |
Osterreich Novartis Pharma GmbH Tel: +43 1 86 6570 |
|
Espaňa Novartis Farmacéutica, S.A. Tel: +34 93 306 42 00 |
Polska Novartis Poland Sp. z o.o. Tel.: +48 22 375 4888 |
|
France Novartis Pharma S.A.S. Tél: +33 1 55 47 66 00 |
Portugal Novartis Farma - Produtos Farmaceuticos, S.A Tel: +351 21 000 8600 |
|
Hrvatska Novartis Hrvatska d.o.o. Tel. +385 1 6274 220 |
Románia Novartis Pharma Services Romania SRL Tel: +40 21 31299 01 |
|
Ireland Novartis Ireland Limited Tel: +353 1 260 12 55 |
Slovenija Novartis Pharma Services Inc. Tel: +386 1 300 75 50 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Novartis Slovakia s.r.o. Tel: +421 2 5542 5439 |
Italia
Novartis Farma S.p.A.
Tel: +39 02 96 54 1
Kúrcpog
Novartis Pharma Services Inc. Tni: +357 22 690 690
Latvija
Novartis Pharma Services Inc. Tel: +371 67 887 070
Suomi/Finland
Novartis Finland Oy Puh/Tel: +358 (0)10 6133 200
Sverige
Novartis Sverige AB Tel: +46 8 732 32 00
United Kingdom
Novartis Pharmaceuticals UK Ltd. Tel: +44 1276 698370
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
49
Primární cílový endpoint byl definován jako doba do první příhody úmrtí z kardiovaskulárních příčin nebo hospitalizace pro srdeční selhání.
Úmrtí z kardiovaskulárních příčin zahrnuje všechny pacienty, kteří zemřeli k určitému datu bez ohledu na předchozí hospitalizaci.
Jednostranná p-hodnota * Úplný analytický soubor
FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek
Jádro tablety
Mikrokrystalická celulosa Částečně substituovaná hyprolosa Krospovidon typ A Magnesium-stearát Mastek
Koloidní bezvodý oxid křemičitý Potah tablety
Entresto 24 mg/26 mg potahované tablety Hypromelosa 2910/3 Oxid titaničitý (E171)
Makrogol 4000 Mastek
Červený oxid železitý (E172)
Černý oxid železitý (E172)
Co je Entresto a k čemu se používá
Entresto je lék známý jako inhibitor angiotenzinového receptoru a neprilysinu. Rozkládá se na dvě léčivé látky, sakubitril a valsartan.
Entresto se používá k léčbě dlouhodobého typu srdečního selhání u dospělých.
Tento typ srdečního selhání se objevuje, když je srdce oslabené a nemůže pumpovat dostatek krve do plic a do zbytku těla. Nejčastější příznaky srdečního selhání jsou dušnost, vyčerpanost, únava a otoky kotníků.