Entacapone Orion 200 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Entacapone Orion 200 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna potahovaná tableta obsahuje entacaponum 200 mg. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta
Hnědooranžová oválná bikonvexní potahovaná tableta, na jedné straně vyraženo „COMT“.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Entakapon je určen pro dospělé pacienty jako doplňková léčba ke standardní léčbě přípravky obsahujícími buď levodopu/benserazid nebo levodopu/karbidopu a používá se u Parkinsonovy choroby s motorickým neklidem, objevujícím se při odeznívání poslední dávky, který nelze těmito kombinacemi stabilizovat.
4.2 Dávkování a způsob podání
Entakapon by se měl používat pouze v kombinaci s levodopou/benserazidem nebo levodopou/karbidopou. Dle souboru informací, určených pro preskripci přípravků na bázi levodopy, je současné užití těchto přípravků s entakaponem možné.
Dávkování
Užívá se jedna tableta 200 mg s každou dávkou levodopy v kombinaci s inhibitorem dopadekarboxylázy. Maximální doporučená dávka je 200 mg desetkrát denně, tj. 2000 mg entakaponu.
Entakapon zvyšuje účinek levodopy. Ke snížení dopaminergních nežádoucích reakcí levodopy, např. dyskineze, nauzey, zvracení a halucinací, je proto často nezbytné upravit dávku levodopy v prvních dnech až týdnech po zahájení léčby entakaponem. Denní dávka levodopy by se měla snížit asi o 10-30%, a to prodloužením intervalů mezi jednotlivými dávkami a/nebo snížením množství levodopy v jedné dávce dle klinického stavu pacienta.
Při ukončení léčby entakaponem je nutno upravit dávkování u další antiparkinsonické léčby, zvláště pak dávku levodopy, a to tak, aby se dosáhlo dostatečného stupně kontroly symptomů parkinsonismu.
Entakapon zvyšuje biologickou dostupnost levodopy, kombinované ve standardních přípravcích s benserazidem, o něco více (o 5-10%) ve srovnání se standardními přípravky, kombinujícími levodopu s karbidopou. Může se proto stát, že pacientům, užívajícím standardní přípravky s levodopou/benserazidem, je třeba po nasazení entakaponu ve větší míře snížit dávku levodopy.
Pacienti s poruchou funkce ledvin
Renální insuficience nemá na farmakokinetiku entakaponu vliv a dávku není tedy nutno upravovat.
U pacientů, léčených dialýzou, lze ovšem zvážit možnost prodloužení intervalu mezi dávkami (viz bod 5.2).
Pacienti s poruchou funkce jater Viz bod 4.3.
Starší osoby
Starším osobám není třeba dávky entakaponu upravovat.
Pediatrická populace
Bezpečnost a účinnost Entacapone Orionu u dětí ve věku do 18 let nebyla stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Entakapon se podává perorálně, a to zároveň s každou dávkou levodopy/karbidopy nebo levodopy/benserazidu.
Entakapon lze užívat při jídle i mezi jídly (viz bod 5.2).
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Porucha funkce jater.
Feochromocytom.
Souběžné užívání entakaponu a neselektivních inhibitorů monoaminooxidázy (MAO-A a MAO-B, např. fenelzin nebo tranylcypromin).
Souběžné užívání selektivního inhibitoru MAO-A s kombinací entakaponu a selektivního inhibitoru MAO-B (viz bod 4.5).
Neuroleptický maligní syndrom (NMS) a/nebo netraumatická rhabdomyolýza v anamnéze.
4.4 Zvláštní upozornění a opatření pro použití
Sekundární rhabdomyolýza v důsledku závažných dyskinezí nebo neuroleptického maligního syndromu (NMS) byla u pacientů s Parkinsonovou chorobou pozorována jen vzácně.
NMS, včetně rhabdomyolýzy a hypertermie, je charakterizován motorickými symptomy (rigidita, myoklonus, třes), změnami mentálního stavu (např. neklid, zmatenost, kóma), hypertermií, autonomními dysfunkcemi (tachykardie, nestabilní krevní tlak) a zvýšenou sérovou hladinou kreatin-fosfokinázy. V jednotlivých případech mohou být přítomny jen některé z těchto příznaků nebo nálezů NMS.
V případech, kdy byl entakapon během kontrolovaných studií náhle vysazen, nebyly zaznamenány v souvislosti s léčbou entakaponem ani NMS, ani rhabdomyolýza. Po uvedení na trh byly hlášeny ojedinělé případy NMS zejména po náhlém snížení dávky nebo vysazení entakaponu a jiné souběžné léčby dopaminergními přípravky. Pokud je ukončení léčby entakaponem nebo jinou dopaminergní medikací nutné, mělo by probíhat pomalu; pokud se i při jeho pomalém vysazování objeví známky a/nebo symptomy NMS, je třeba zvýšit dávky levodopy.
Léčba entakaponem by měla být podávána opatrně u pacientů s ischemickou chorobou srdeční.
Vzhledem k mechanismu účinku může entakapon zasahovat do metabolismu léčivých přípravků obsahujících katecholovou skupinu a zesilovat jejich účinek. Proto je třeba entakapon podávat s opatrností u pacientů, léčených přípravky, které jsou metabolizovány katechol-O-methyltransferázou
(COMT), např.: rimiterol, isoprenalin, adrenalin, noradrenalin, dopamin, dobutamin, alfa-methyldopa a apomorfin (viz také bod 4.5).
Entakapon se vždy podává jako adjuvans při léčbě levodopou. Upozornění, platná pro léčbu levodopou je tedy třeba brát v úvahu i při léčbě entakaponem. Entakapon zvyšuje biologickou dostupnost levodopy ve standardních přípravcích s levodopou/benserazidem o 5-10% ve srovnání se standardními přípravky obsahujícími levodopu/karbidopu. Proto se dopaminergní nežádoucí reakce mohou častěji vyskytovat v případech, kdy se entakapon přidává k léčbě levodopou/benserazidem (viz také bod 4.8). Aby se snížily dopaminergní nežádoucí reakce levodopy, je často nezbytné v závislosti na klinickém stavu pacienta upravit dávku levodopy v prvních dnech až týdnech po zahájení léčby entakaponem (viz bod 4.2 a 4.8).
Entakapon může zhoršit ortostatickou hypotenzi, vyvolanou levodopou. Entakapon by měl být s opatrností podáván u pacientů, kteří užívají další léčivé přípravky, které mohou způsobit ortostatickou hypotenzi.
V klinických studiích se nežádoucí dopaminergní reakce, např. dyskineze, vyskytovaly častěji u pacientů užívajících entakapon a agonisty dopaminu (jako například bromokriptin), selegilin nebo amantadin, než u pacientů užívajících s touto kombinací placebo. Je možné, že po zahájení léčby entakaponem bude nutné upravit dávkování i u jiných antiparkinsonických léčivých přípravků.
Podávání entakaponu společně s levodopou je u pacientů trpících Parkinsonovou chorobou doprovázeno ospalostí a epizodami náhlého nástupu spánku; proto je nutno věnovat zvýšenou opatrnost řízení motorových vozidel nebo obsluze strojů (viz též bod 4.7).
Pokud pacienti trpí průjmem, doporučuje se sledovat jejich hmotnost, aby se zabránilo případnému nadměrnému snížení tělesné hmotnosti. Protrahovaný nebo přetrvávající průjem, objevující se během užívání entakaponu, může být příznakem kolitidy. V případě protrahovaného nebo přetrvávajícího průjmu je třeba léčivý přípravek vysadit a zvážit příslušnou léčbu a vyšetření.
Pacienti by měli být pravidelně monitorováni z důvodu možnosti rozvoje impulzivních poruch. Pacienti a jejich ošetřovatelé by měli být upozorněni, že u pacientů léčených agonisty dopaminu a/nebo jinou dopaminergní léčbou, jako je Entacapone Orion ve spojení s levodopou, se mohou rozvinout symptomy impulzivních poruch včetně patologického hráčství, zvýšeného libida, hypersexuality, nutkavého utrácení nebo nakupování, záchvatovitého a nutkavého přejídání. Pokud se tyto příznaky objeví, doporučuje se léčbu přehodnotit.
U pacientů, kteří měli progresivní anorexii, astenii a snížení tělesné hmotnosti během relativně krátké doby, je třeba zvážit provedení celkového lékařského vyšetření včetně funkce jater.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Při doporučeném dávkovacím režimu nebyly pozorovány žádné interakce entakaponu s karbidopou. Studie farmakokinetické interakce s benserazidem nejsou k dispozici.
Ve studiích s jednorázovou dávkou podanou zdravým dobrovolníkům nebyly pozorovány žádné interakce mezi entakaponem a imipraminem, nebo mezi entakaponem a moklobemidem. Podobně nebyly pozorovány žádné interakce mezi entakaponem a selegilinem ve studiích s opakovanou dávkou u pacientů s parkinsonizmem. Nicméně zkušenosti s klinickým použitím entakaponu a některých léčivých přípravků včetně inhibitorů MAO-A, tricyklických antidepresiv, inhibitorů zpětného vychytávání noradrenalinu, jako jsou desipramin, maprotilin a venlafaxin, a léčivých přípravků, které jsou metabolizovány COMT, (např. látek s katecholovou strukturou: rimiterol, isoprenalin, adrenalin, noradrenalin, dopamin, dobutamin, alfa-methyldopa, apomorphin a paroxetin) jsou dosud omezené. Proto je při souběžném užívání entakaponu a uvedených léčivých přípravků nutná opatrnost (viz také bod 4.3 a 4.4).
Entakapon lze podávat spolu se selegilinem (selektivním inhibitorem MAO-B); denní dávka selegilinu by ovšem neměla překročit 10 mg.
Entakapon může v gastrointestinálním traktu tvořit cheláty se sloučeninami železa. Entakapon a přípravky obsahující železo je proto třeba užívat s nejméně 2-3 hodinovým odstupem (viz bod 4.8).
Entakapon se váže na vazebné místo II lidského albuminu, kam se vážou i některé další léčivé přípravky včetně diazepamu a ibuprofenu. Studie klinických interakcí s diazepamem a nesteroidními protizánětlivými léčivými přípravky se neprováděly. Na základě výsledků in vitro studií se při terapeutických koncentracích těchto přípravků neočekává jejich významné vytěsňování.
Vzhledem k afinitě entakaponu k cytochromu P450 2C9 in vitro (viz bod 5.2) může entakapon případně interferovat s léčivými přípravky, jejichž metabolismus je na zmíněném enzymu závislý, např. S-warfarin. Při studiu interakcí u zdravých dobrovolníků entakapon neměnil plazmatické hladiny S-warfarinu, zatímco hodnota AUC u R-warfarinu se zvětšila v průměru o 18 % [CI90 1126 %]. Hodnoty INR stouply v průměru o 13 % [CI90 6-19 %]. Proto se u pacientů užívajících warfarin doporučuje po zahájení léčby enakaponem monitorovat hodnoty INR.
4.6 Fertilita, těhotenství a kojení
Ve studiích na zvířatech, ve kterých byly subjekty vystavovány významně vyšším hladinám entakaponu, než jsou hladiny terapeutické, nebyly pozorovány zjevné teratogenní nebo primární fetotoxické účinky. Protože nejsou zatím zkušenosti s používáním entakaponu u těhotných žen, entakapon by neměl být během těhotenství podáván.
Kojení
Ve studiích provedených na zvířatech se entakapon vylučoval do mléka. Bezpečnost entakaponu u kojenců není známa. Ženy by proto během léčby entakaponem neměly kojit.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Entacapone Orion spolu s levodopou má výrazný vliv na schopnost řídit nebo obsluhovat stroje. Entakapon spolu s levodopou mohou vyvolávat závratě a symptomatický ortostatismus. Proto je třeba opatrnosti při řízení nebo obsluze strojů.
Pacienty, kteří jsou léčeni entakaponem spolu s levodopou a u nichž se objeví ospalost a/nebo epizody náhlého nástupu spánku, je nutno upozornit, že nesmí řídit motorová vozidla nebo vykonávat činnosti, při kterých může snížení pozornosti vyvolat riziko závažného poranění sebe sama nebo jiných osob, popřípadě i úmrtí (např. obsluha stroje). Do odeznění těchto rekurentních epizod nesmí pacienti tyto činnosti vykonávat (viz také bod 4.4).
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nejčastější nežádoucí účinky vyvolané entakaponem souvisí se zvýšenou dopaminergní aktivitou a vyskytují se nejčastěji na počátku léčby. Snížení dávky levodopy snižuje závažnost a frekvenci zmíněných účinků. Další velkou skupinu nežádoucích účinků představují gastrointestinální symptomy včetně nauzey, zvracení, bolestí břicha, zácpy a průjmu. Entakapon může způsobit červenohnědé zbarvení moči, nicméně se jedná o neškodný jev.
Obvykle jsou nežádoucí účinky způsobené entakaponem mírné až středně závažné. K nežádoucím účinkům, které vedly nejčastěji k ukončení léčby entakaponem během klinických studií, patřily gastrointestinální symptomy (např. průjem, 2,5 %) a zvýšení dopaminergních nežádoucích účinků
5
levodopy (např. dyskineze, 1,7 %).
Dyskineze (27 %), nauzea (11 %), průjem (8 %), bolesti břicha (7 %) a pocit sucha v ústech (4,2 %) byly zaznamenány mnohem častěji u entakaponu než u placeba, jak ukazují souhrnné výsledky klinických studií, kdy 406 pacientů užívalo aktivní medikaci a 296 pacientům bylo podáváno placebo.
Některé z nežádoucích účinků, např. dyskineze, nauzea a bolesti břicha, mohou být častější při vyšších dávkách entakaponu (1400 až 2000 mg denně) v porovnání s nižšími dávkami.
Seznam nežádoucích účinků v tabulce
V Tabulce č. 1 jsou shrnuty nežádoucí účinky, které se vyskytly jak během klinických studií entakaponu, tak po jeho uvedení na trh.
Tabulka 1* Nežádoucí účinky léčiva
|
Psychiatrické poruchy Časté: Velmi vzácné: |
Nespavost, halucinace, zmatenost, paronirie Agitovanost |
|
Poruchy nervového systému | |
|
Velmi časté: |
Dyskineze |
|
Časté: |
Zhoršený parkinsonismus, závratě, dystonie, hyperkineze |
|
Srdeční poruchy** | |
|
Časté: |
Jiné případy ischemické choroby srdeční než infarkt myokardu (např. angina pectoris) |
|
Méně časté: |
Infarkt myokardu |
|
Gastrointestinální poruchy | |
|
Velmi časté: | |
|
Časté: | |
|
Velmi vzácné: | |
|
Není známo: |
Kolitida |
|
Poruchy jater a žlučových cest | |
|
Vzácné: |
Abnormální hodnoty jaterních funkčních testů |
|
Není známo: |
Hepatitida převážně s cholestatickými příznaky (viz bod 4.4) |
|
Poruchy kůže a podkožní tkáně | |
|
Vzácné: |
Erytematózní nebo makulopapulární vyrážka |
|
Velmi vzácné: |
Kopřivka |
|
Není známo: |
Změna barvy kůže, vlasů, vousů a nehtů |
|
Poruchy ledvin a močových cest | |
|
Velmi časté: |
Změna barvy moče |
|
Celkové poruchy a reakce v místě aplikace | |
|
Časté: |
Únava, zvýšená potivost, pád |
|
Velmi vzácné: |
Úbytek tělesné hmotnosti |
* Nežádoucí účinky jsou roztříděny podle frekvence výskytu, počínaje nejčastějším výskytem, při použití dohodnutých výrazů: Velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000); velmi vzácné (<1/10000), není známo (z dostupných údajů nelze určit, protože z klinických nebo epidemiologických studií nelze odvodit kvalifikovaný odhad).
** Četnosti incidence infarktu myokardu a jiných případů ischemické choroby srdeční (0,43 % a 1,54 %, v tomto pořadí) jsou odvozeny z analýzy 13 dvojitě zaslepených studií zahrnujících 2 082 pacientů s motorickým neklidem, objevujícím se při odeznívání poslední dávky, kteří užívali entakapon.
Popis vybraných nežádoucích účinků
Výskyt izolovaných případů nadměrné ospalosti během dne a epizod náhlého nástupu spánku souvisí se souběžným užíváním entakaponu a levodopy.
Impulzivní poruchy: U pacientů léčených agonisty dopaminu a/nebo dopaminergními přípravky, jako je Comtess ve spojení s levodopou, se mohou rozvinout symptomy jako patologické hráčství, zvýšené libido, hypersexualita, nutkavé utrácení nebo nakupování a záchvatovité a nutkavé přejídání (viz bod 4.4).
Byly hlášeny ojedinělé případy NMS v souvislosti s náhlou úpravou nebo vysazením entakaponu nebo jiné dopaminergní léčby.
Byly hlášeny ojedinělé případy rhabdomyolýzy.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Z postmarketingových údajů, které zahrnují izolované případy předávkování, byla nejvyšší denní dávka entakaponu 16000 mg. Akutní symptomy a příznaky předávkování zahrnovaly zmatenost, sníženou pohyblivost, ospalost, hypotonii, změnu barvy kůže a kopřivku. Léčba akutního předávkování je symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: jiná dopaminergní léčiva, ATC kód: N04BX02.
Entakapon patří do nové terapeutické skupiny inhibitorů katechol-O-methyl transferázy (COMT). Jedná se o reverzibilně, specificky a převážně periferně působící inhibitor COMT, vyvinutý k souběžnému podávání s přípravky obsahujícími levodopu. Entakapon snižuje metabolickou přeměnu levodopy na 3-O-methyldopu (3-OMD) inhibicí enzymu COMT. To vede ke zvýšení hodnoty AUC levodopy. Množství levodopy, kterou má mozek k dispozici, se tak zvyšuje a entakapon tak prodlužuje klinickou odpověď na levodopu.
Entakapon inhibuje enzym COMT hlavně v periferních tkáních. Míra inhibice COMT v červených krvinkách úzce koresponduje s plazmatickou koncentrací entakaponu, což jasně ukazuje na reverzibilní povahu inhibice COMT.
Klinické studie
Ve dvou dvojitě zaslepených studiích fáze III uskutečněných celkem na 376 pacientech s Parkinsonovou chorobou a motorickým neklidem objevujícím se na konci dávky, byl podáván entakapon nebo placebo s každou dávkou levodopy/inhibitoru dopa-dekarboxylázy. Výsledky jsou uvedeny v Tabulce 2. Ve Studii I byl hodnocen denní „ON“ čas (v hodinách) podle domácích záznamů. Ve Studii II byl měřen podíl denního „ON“ času.
Tabulka 2: Denní „ON“ čas (Střední ± SD)
|
Studie I: Denní „On“ čas (h) | |||
|
Entakapon (n=85) |
Placebo (n=86) |
Rozdíl | |
|
Počátek |
9,3±2,2 |
9,2±2,5 | |
|
8.-24. týden |
10,7±2,2 |
9,4±2,6 |
1 h 20 min (8,3 %) CI95 % 45 min, 1 h 56 |
|
Studie II: Podíl denního „On“ času (%' | |||
|
Entakapon (n=103) |
Placebo (n=102) |
Rozdíl | |
|
Počátek |
60,0±15,2 |
60,8±14,0 | |
|
8.-24. týden |
66,8±14,5 |
62,8±16,80 |
4,5 % (0 h 35 min) CI95 % 0,93 %, 7,97% |
Byl pozorován odpovídající pokles „OFF“ času.
Procento změny „OFF“ času oproti počátečním hodnotám bylo -24 % ve skupině entakaponu a 0 % v placebo skupině ve Studii I. Odpovídající údaje ve Studii II byly -18 % a -5 %.
5.2 Farmakokinetické vlastnosti
Všeobecná charakteristika léčivé látky Absorpce
V absorpci entakaponu existují velké intra- a interindividuální rozdíly.
Maximální koncentrace (Cmax) v plazmě se obvykle dosahuje asi jednu hodinu po užití tablety 200 mg entakaponu. Léčivá látka podléhá rozsáhlému metabolismu při prvním průchodu játry. Biologická dostupnost entakaponu je asi 35 % po perorálním podání. Jídlo absorpci entakaponu významně neovlivňuje.
Distribuce
Po absorpci z gastrointestinálního traktu je entakapon rychle distribuován do periferních tkání a jeho distribuční objem činí 20 litrů při rovnovážném stavu (VdSS). Přibližně 92 % dávky je eliminováno během p-fáze v krátkém eliminačním poločase 30 minut. Celková clearance entakaponu je asi 800 ml/min.
Entakapon se váže ve značném rozsahu na proteiny v plazmě, hlavně na albumin. V lidské plazmě tvoří nevázaná část asi 2,0 % v rozsahu terapeutických koncentrací. V terapeutických koncentracích entakapon nevytěsňuje jiné vysoce vázané léčivé látky (např. warfarin, kyselinu salicylovou, fenylbutazon či diazepam), ani není žádnou z těchto látek ve významném rozsahu v terapeutických či vyšších koncentracích vytěsňován.
Biotransformace
Malé množství entakaponu, (E)-izomer, se konvertuje na (Z)-izomer. (E)-izomer tvoří 95 % AUC entakaponu. (Z)-izomer a stopová množství jiných metabolitů tvoří zbývajících 5 %.
Údaje z in vitro studií, při nichž byly použity lidské jaterní mikrosomy, naznačují, že entakapon inhibuje cytochrom P450 2C9 (IC50 ~4 pm). Entakapon jen nepatrně nebo vůbec neinhiboval ostatní typy isoenzymů P450 (CYP1A2, CYP2A6, CYP2D6, CYP2E1, CYP3A a CYP2C19) (viz bod 4.5).
Eliminace
Vylučování entakaponu probíhá převážně extrarenálními metabolickými cestami. Odhaduje se, že 80-90 % podané dávky se vyloučí stolicí, i když u člověka to nebylo potvrzeno. Přibližně 10-20 % se vyloučí močí. Pouze stopové množství entakaponu se nachází v moči v nezměněné formě. Velká část (95 %) látky, vyloučené močí, je konjugována s kyselinou glukuronovou. Z metabolitů, nalezených v moči, bylo pouze asi 1 % vytvořeno oxidací.
Charakteristika u pacientů
Farmakokinetické vlastnosti entakaponu jsou podobné jak u mladších osob, tak i starších osob. Metabolismus léčivého přípravku je zpomalen u pacientů s mírnou až středně závažnou jaterní insuficiencí (Child-Pughova třída A a B), což vede ke zvýšení plazmatických koncentrací entakaponu v absorpční i v eliminační fázi (viz bod 4.3). Renální poškození neovlivňuje farmakokinetiku entakaponu. V případě pacientů na dialyzační terapii lze ovšem uvažovat o delších intervalech mezi jednotlivými dávkami.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity a hodnocení kancerogenního potenciálu neodhalily žádné zvláštní riziko pro člověka. Ve studiích toxicity po opakovaném podání byla pozorována anemie, nejpravděpodobněji způsobená vlastností entakaponu tvořit cheláty se železem. Pokud jde o reprodukční toxicity, u králíků bylo pozorováno snížení váhy plodu a poněkud opožděný vývoj kostí při systémovém podávání dávek v terapeutickém rozmezí.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Jádro tablety
Mikrokrystalická celulosa Sodná sůl kroskarmelosy Povidon
Magnesium-stearát
Potah
Polyvinylalkohol, částečně hydrolyzovaný
Mastek
Makrogol
Sójový lecithin
Žlutý oxid železitý (E172)
Červený oxid železitý (E172)
Oxid titaničitý (E171)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Bílá HDPE lahvička s bílým teplovzdorným polypropylenovým (PP) uzávěrem z HD-polyethylenu obsahující 30, 60, 100 nebo 175 tablet.
Na trhu nemusí být k dispozici všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky pro likvidaci.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Orion Corporation Orionintie 1 FI-02200 Espoo Finsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/11/708/001-004
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace:18 srpen 2011
Datum posledního prodloužení registrace: 8 duben 2016
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Orion Corporation Orionintie 1 FI-02200 Espoo Finsko
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Neuplatňuje se.
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM A VNITŘNÍM OBALU KRABIČKA A ŠTÍTEK NA LAHVIČCE
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Entacapone Orion 200 mg potahované tablety entacaponum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna tableta obsahuje entacaponum 200 mg.
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
30 potahovaných tablet 60 potahovaných tablet 100 potahovaných tablet 175 potahovaných tablet
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Perorální podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Orion Corporation Orionintie 1 FI-02200 Espoo Finsko
|
12. REGISTRAČNÍ ČÍSLO/ČÍSLA | |
|
EU/1/11/708/001 |
30 potahovaných tablet |
|
EU/1/11/708/002 |
60 potahovaných tablet |
|
EU/1/11/708/003 |
100 potahovaných tablet |
|
EU/1/11/708/004 |
175 potahovaných tablet |
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
entacapone orion 200 mg [pouze na krabičce]
Entacapone Orion 200 mg potahované tablety
Entacaponum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je Entacapone Orion a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Entacapone Orion užívat
3. Jak se Entacapone Orion užívá
4. Možné nežádoucí účinky
5. Jak Entacapone Orion uchovávat
6. Obsah balení a další informace
1. Co je Entacapone Orion a k čemu se používá
Entacapone Orion tablety obsahují entakapon a používají se spolu s levodopou k léčbě Parkinsonovy choroby. Entacapone Orion podporuje levodopu a tím zmírňuje příznaky Parkinsonovy choroby. Entacapone Orion nemá žádný vliv na zmírňování příznaků Parkinsonovy choroby, pokud není užíván s levodopou.
2. Čemu musíte věnovat pozornost, než začnete Entacapone Orion užívat
Neužívejte Entacapone Orion
• jestliže jste alergický/á na entakapon nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6);
• jestliže trpíte feochromocytomem (nádorem nadledvin; protože hrozí riziko závažného zvýšení krevního tlaku);
• jestliže užíváte některá antidepresiva (zeptejte se svého lékaře nebo lékárníka, zda lze Váš antidepresivní přípravek užívat spolu s Entacapone Orionem);
• jestliže trpíte onemocněním jater;
• jestliže jste někdy prodělal(a) vzácnou reakci na antipsychotická léčiva, zvanou neuroleptický maligní syndrom (NMS). Pro charakteristiku NMS viz bod 4 Možné nežádoucí účinky;
• jestliže jste někdy trpěl(a) vzácnou formou onemocnění svalů zvanou rhabdomyolýza, která nebyla způsobena zraněním.
Upozornění a opatření
Před užitím přípravku Entacapone Orion se poraďte se svým lékařem nebo lékárníkem:
• jestliže jste někdy v minulosti měl(a) srdeční infarkt nebo jakákoliv jiná onemocnění srdce;
• jestliže užíváte lék, který může způsobit závrať nebo pocit omámení (snížení krevního tlaku), když vstanete ze židle nebo z postele;
• jestliže máte dlouhotrvající průjem, sdělte to svému lékaři, protože to může být příznak zánětu tlustého střeva;
• jestliže máte průjem, doporučuje se kontrolovat Vaši tělesnou hmotnost, aby se zabránilo možné nepřiměřené ztrátě hmotnosti;
• jestliže trpíte zvyšující se ztrátou chuti k jídlu, slabostí, vyčerpáním a v relativně krátké době úbytkem tělesné hmotnosti, je třeba zvážit provedení celkového lékařského vyšetření včetně funkce jater.
Informujte svého lékaře, pokud Vy nebo Vaši rodinní příslušníci, či ošetřovatelé zaznamenáte, že se u Vás objevuje nutkání nebo touha chovat se neobvyklým způsobem, či nemůžete odolat nutkání, popudu či pokušení provádět některé činnosti, kterými byste mohl(a) poškodit sebe či své okolí. Tyto projevy jsou nazývány impulzivními poruchami a může mezi ně patřit návykové hráčství, nadměrná konzumace jídla nebo nadměrné utrácení, abnormálně vysoký zájem o sex nebo nárůst sexuálních myšlenek a pocitů. Pokud se tyto projevy objeví, Váš lékař možná bude muset přehodnotit Vaši léčbu.
Protože Entacapone Orion tablety budou užívány společně s dalšími léky obsahujícími levodopu, přečtěte si, prosím, pozorně také příbalové informace těchto léků.
Jestliže začínáte užívat Entacapone Orion, může být potřeba upravit dávku jiných léků, určených pro léčbu Parkinsonovy choroby. Dodržujte pokyny svého lékaře.
Neuroleptický maligní syndrom (NMS) je závažná, ale vzácná reakce na určité léky, a může se objevit zvláště, když jsou Entacapone Orion a další léky pro léčbu Parkinsonovy choroby náhle vysazeny nebo je dávka náhle snížena. Pokud jde o charakteristiku, NMS viz bod 4 Možné nežádoucí účinky. Váš lékař Vám může doporučit, aby ukončení léčby Entacapone Orionem a dalšími léky pro léčbu Parkinsonovy choroby probíhalo pomalu.
Entacapone Orion užívaný spolu s levodopou může vyvolat ospalost a může způsobit, že náhle upadnete do spánku. Pokud se to stane, nesmíte řídit nebo obsluhovat stroje ani dopravní prostředky (viz „Řízení dopravních prostředků a obsluha strojů“).
Další léčivé přípravky a přípravek Entacapone Orion
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které budete užívat. Obzvláště sdělte svému lékaři, pokud užíváte některý z následujících přípravků:
• rimiterol, isoprenalin, adrenalin, noradrenalin, dopamin, dobutamin, alfa-methyldopu, apomorfin;
• antidepresiva včetně desipraminu, maprotilinu, venlafaxinu, paroxetinu;
• warfarin užívaný ke snížení srážlivosti krve;
• doplňky stravy obsahující železo. Entacapone Orion může snižovat vstřebávání železa
ze zažívacího ústrojí. Proto neužívejte současně Entacapone Orion a doplňky stravy obsahující železo. Po užití jednoho přípravku vyčkejte alespoň 2-3 hodiny, než užijete druhý.
Těhotenství, kojení a plodnost
Neužívejte Entacapone Orion během těhotenství, nebo pokud kojíte.
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat.
Řízení dopravních prostředků a obsluha strojů
Entacapone Orion užívaný spolu s levodopou může snižovat krevní tlak, což může vyvolat závratě. Zvláště opatrně si počínejte při řízení dopravních prostředků, při používání nářadí nebo obsluze strojů.
Kromě toho může Entacapone Orion užívaný spolu s levodopou vyvolávat značnou ospalost nebo způsobit, že náhle upadnete do spánku.
Neřiďte dopravní prostředek ani neobsluhujte stroje, pokud se u Vás objeví tyto nežádoucí účinky.
3. Jak se Entacapone Orion užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Entacapone Orion se užívá spolu s léky obsahujícími levodopu (a to v kombinaci buď s karbidopou nebo benserazidem). Současně můžete užívat také jiné léky určené pro léčbu Parkinsonovy choroby.
Doporučená dávka Entacapone Orionu je tableta 200 mg užívaná s každou dávkou levodopy. Maximální doporučená dávka je 10 tablet denně, tj. 2000 mg Entacapone Orionu.
V případě, že trpíte sníženou funkcí ledvin a jste léčeni dialýzou, může Vám lékař říct, abyste prodloužil(a) čas mezi jednotlivými dávkami.
Obrázek 1
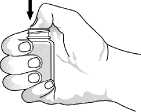
První otevření lahvičky: Otevřete uzávěr a palcem zatlačte na utěsnění, dokud se neprotrhne. Viz obrázek 1.
Použití u dětí a dospívajících
Zkušenosti s podáváním Entacapone Orionu pacientům mladším 18 let jsou omezené. Proto se užívání Entacapone Orionu u dětí nedoporučuje.
Jestliže jste užil(a) více přípravku Entacapone Orion, než jste měl(a)
V případě předávkování kontaktujte ihned svého lékaře, lékárníka nebo nejbližší nemocnici.
Jestliže jste zapomněl(a) užít přípravek Entacapone Orion
Jestliže jste zapomněl(a) vzít tabletu Entacapone Orionu s dávkou levodopy, měl(a) byste pokračovat užitím další tablety Entacapone Orionu s další dávkou levodopy.
Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou tabletu.
Jestliže jste přestal(a) užívat přípravek Entacapone Orion
Bez pokynu svého lékaře léčbu Entacapone Orionem nepřerušujte.
Když přerušíte léčbu, bude Váš lékař pravděpodobně muset upravit dávkování Vašich dalších léků na Parkinsonovu chorobu. Náhlé vysazení Entacapone Orionu a dalších léků na Parkinsonovu chorobu může mít za následek nechtěné nežádoucí účinky. Viz bod 2 Upozornění a opatření.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. Nežádoucí účinky, vyvolané Entacapone Orionem, jsou obvykle mírné až středně závažné.
Zmíněné nežádoucí účinky často souvisejí se zvýšením účinku léčby levodopou a dochází k nim
především na počátku léčby. Pokud po zahájení léčby Entacapone Orionem zaznamenáte uvedené nežádoucí účinky, měl(a) byste kontaktovat svého lékaře, který rozhodne o případné úpravě dávky levodopy.
Velmi časté (mohou postihnout více než 1 z 10 lidí):
• Mimovolní pohyby s potížemi při provádění volních pohybů (dyskineze);
• pocit nevolnosti (nucení na zvracení);
• neškodné zabarvení moči do hnědočervena.
Časté (mohou postihnout až 1 z 10 lidí):
• Přehnané pohyby (hyperkineze), zhoršení příznaků Parkinsonovy choroby, dlouhodobé svalové stahy (dystonie);
• nevolnost (zvracení), průjem, bolesti břicha, zácpa, sucho v ústech;
• závrať, unavenost, zvýšená potivost, pád;
• zrakové/sluchové/hmatové/čichové halucinace (vnímání něčeho, co ve skutečnosti není přítomno), ospalost, živé sny a zmatenost;
• projevy onemocnění srdce nebo tepen (např. bolest na hrudi).
Méně časté (mohou postihnout až 1 z 100 lidí):
• Srdeční infarkt.
Vzácné (mohou postihnout až 1 z 1000 lidí):
• Vyrážky;
• abnormální výsledky jaterních testů.
Velmi vzácné (mohou postihnout až 1 z 10000 lidí):
• Duševní neklid;
• snížená chuť k jídlu, pokles tělesné hmotnosti;
• kopřivka.
Není známo (četnost nelze z dostupných údajů určit):
• Zánět tlustého střeva (kolitida), zánět jater (hepatitida) se zežloutnutím kůže a očního bělma;
• zbarvení kůže, vlasů, vousů a nehtů.
Pokud je Entacapone Orion podáván ve vyšších dávkách:
V dávkách 1400 až 2000 mg denně jsou následující nežádoucí účinky častější:
• Mimovolní pohyby;
• nevolnost;
• bolesti břicha.
Ostatní důležité nežádoucí účinky, které se mohou objevit:
• Entacapone Orion podávaný spolu s levodopou může vzácně způsobit, že se budete cítit velmi ospalý(á) během dne, a může být příčinou náhlého upadnutí do spánku;
• Neuroleptický maligní syndrom (NMS) je vzácná těžká reakce na léky, které se užívají k léčbě
poruch centrálního nervového systému. Je charakterizována ztuhlostí, svalovými záškuby, třesem, duševním neklidem, zmateností, bezvědomím, zvýšenou tělesnou teplotou, zvýšeným srdečním tepem a nestabilním krevním tlakem;
• vzácná těžká svalová porucha (rhabdomyolýza), která způsobuje svalovou bolest, bolestivost
(citlivost při tlaku) a slabost a může vést k problémům s ledvinami.
Můžete zaznamenat následující nežádoucí účinky:
• Neschopnost odolat nutkání provádět činnost, která by Vás mohla poškodit. Mezi tyto činnosti mohou patřit:
• silné nutkání k nadměrnému hazardu i přes riziko vážných rodinných nebo osobních následků;
• změněný nebo zvýšený zájem o sex a chování, které ve Vás nebo ve Vašem okolí budí zvýšené obavy, např. zvýšený sexuální apetit;
• nekontrolovatelné nadměrné nakupování nebo utrácení;
• záchvatovité přejídání (příjem velkého množství potravy za krátkou dobu) nebo nutkavé přejídání (příjem většího množství jídla, než je obvyklé a než je nutné pro zahnání hladu).
Informujte svého lékaře, pokud zaznamenáte některých z těchto nežádoucích účinků. Váš lékař s Vámi probere možnosti, jak tyto nežádoucí účinky zvládat či je omezit.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Entacapone Orion uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a na štítku lahvičky. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Nevyhazujte žádné léčivé přípravky do odpadních vod. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Entacapone Orion obsahuje
- Léčivou látkou je entacaponum. Jedna tableta obsahuje entacaponum 200 mg.
- Dalšími složkami jsou mikrokrystalická celulóza, sodná sůl kroskarmelózy, povidon a magnesium-stearát.
- Potah tablety obsahuje částečně hydrolyzovaný polyvinylalkohol, mastek, makrogol, sójový lecithin, žlutý oxid železitý (E172), červený oxid železitý (E172) a oxid titaničitý (E171).
Jak přípravek Entacapone Orion vypadá a co obsahuje toto balení
Entacapone Orion 200 mg potahované tablety jsou hnědooranžové oválné tablety, na jedné straně je vyraženo „COMT“. Tablety jsou baleny v lahvičkách.
K dispozici jsou čtyři různé velikosti balení (lahvičky s obsahem 30, 60, 100 nebo 175 tablet). Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Orion Corporation Orionintie FI-02200 Espoo
Finsko
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci
|
Belgique/Belgie/Belgien Orion Corporation Tél./Tel: +358 10 4261 |
Lietuva UAB Orion Pharma Tel: +370 5 276 9499 |
|
Btarapna Orion Corporation Ten.: +358 10 4261 |
Luxembourg/Luxemburg Orion Corporation Tél./Tel: +358 10 4261 |
|
Česká republika Orion Corporation Tel: +358 10 4261 |
Magyarország Orion Corporation Tel.: +358 10 4261 |
|
Danmark Orion Pharma A/S Tlf: +45 8614 0000 |
Malta Orion Corporation Tel: +358 10 4261 |
|
Deutschland Orion Pharma GmbH Tel: +49 40 899 689-0 |
Nederland Orion Corporation Tel: +358 10 4261 |
|
Eesti Orion Pharma Eesti OU Tel: +372 6 616 863 |
Norge Orion Pharma AS Tlf.: +47 40 00 42 10 |
|
EXXáSa ORION PHARMA HELLAS M.E.n.E TpA.: +30 210 9803355 |
Osterreich Orion Corporation Tel: +358 10 4261 |
|
Espaňa Orion Corporation Tel.: +358 10 4261 |
Polska Orion Pharma Poland Sp. z o.o. Tel.: +48 22 8333177, 8321036 |
|
France Orion Corporation Tél.: +358 10 4261 |
Portugal Orionfin Unipessoal Lda Tel: +351 21 924 9910/17 |
|
Hrvatska Orion Corporation Tel.: +358 10 4261 |
Románia Orion Corporation Tel: +358 10 4261 |
|
Ireland Orion Pharma (Ireland) Ltd. c/o Allphar Services Ltd. Tel: +353 1 428 7777 |
Slovenija Orion Corporation Tel: +358 10 4261 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Orion Corporation Tel: +358 10 4261 |
Puh./Tel: +358 10 4261
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
24