Emadine 0,5 Mg/Ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
EMADINE 0,5 mg/ml, oční kapky, roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 ml roztoku obsahuje emedastinum 0,5 mg (ve formě emedastini difumaras) Pomocné látky se známým účinkem: benzalkonium-chlorid 0,1 mg/ml Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Oční kapky, (roztok).
Čirý, bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Symptomatická léčba sezónní alergické konjunktivitidy.
4.2 Dávkování a způsob podání
EMADINE nebyl studován v klinických zkouškách přesahujících šest týdnů. Dávkování
Dávka je jedna kapka přípravku EMADINE do postiženého oka (očí) dvakrát denně.
Používá-li se více než jeden oční léčivý přípravek, je třeba léčivé přípravky podávat s odstupem minimálně 10 minut. Oční masti mají být aplikovány jako poslední.
Starší populace
EMADINE nebyl studován u pacientů starších než 65 let, a proto se jeho používání v této věkové kategorii nedoporučuje.
Dětská populace
EMADINE lze používat u dětských pacientů (3 roky a starší) ve stejném dávkování jako u dospělých. Použití při poškození funkce ledvin nebo jater
Přípravek EMADINE nebyl u těchto pacientů studován, a proto se jeho použití u těchto pacientů nedoporučuje.
Způsob podání
Pro oční podání.
Aby se zabránilo kontaminaci hrotu kapátka a roztoku, je třeba dbát na to, aby se hrot kapátka lahvičky nedotkl očních víček, okolních tkání nebo jiných povrchů.
Pokud je po sejmutí víčka bezpečnostní kroužek uvolněný, je třeba jej před použitím přípravku odstranit.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Infiltráty na rohovce oka
V souvislosti s používáním přípravku EMADINE byl zaznamenán výskyt infiltrátů na oční rohovce.
V případě infiltrátů rohovky se má podávání přípravku přerušit a má se zavést odpovídající léčba.
Pomocné látky
Benzalkonium-chlorid, který se běžně používá jako konzervační činidlo u očních léčivých přípravků, je uváděn jako původce keratitis punctata a/nebo keratitis ulcerans toxica. Vzhledem k tomu, že přípravek EMADINE obsahuje benzalkonium-chlorid, je nutné během častého nebo dlouhodobého používání pacienta monitorovat.
Dále může benzalkonium-chlorid způsobit podráždění oka a je o něm známo, že zbarvuje měkké kontaktní čočky. Styku s měkkými kontaktními čočkami by se mělo zabránit. Pacienti by měli být poučeni, aby čočky před aplikací přípravku EMADINE vyjmuli z oka a vyčkali nejméně 15 minut po nakapání, než si opět nasadí kontaktní čočky zpět.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí.
4.6 Fertilita, těhotenství a kojení
Údaje o podávání emedastinu těhotným ženám nejsou dostatečné. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Potenciální riziko pro člověka není známo. Avšak vzhledem k absenci účinků na adrenergní, dopaminergní a serotoninové receptory, může být přípravek EMADINE používán během těhotenství, pokud je respektováno dávkování doporučené v bodě 4.2.
Kojení
Emedastin byl po perorálním podání nalezen v mléce potkanů. Není známo, zda lokální aplikace může mít u lidí za následek dostatečnou systémovou absorpci, která by vedla k detekovatelným množstvím v mateřském mléce. Přípravek EMADINE by měl být používán během kojení s opatrností.
Fertilita
Studie na zvířatech neprokázaly poškození fertility (viz bod 5.3). Údaje o vlivu na fertilitu u lidí nejsou k dispozici.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek EMADINE nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje, pokud se však stejně jako u jiných očních přípravků vyskytne při aplikaci přechodné rozmazané vidění nebo jiná porucha vidění, má pacient před řízením nebo obsluhou strojů vyčkat, dokud se vidění nevyjasní.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Ve 13 klinických studiích, které zahrnovaly 696 pacientů, byl přípravek EMADINE aplikován jednou až čtyřikrát denně do obou očí po dobu 42 dnů. V souvislosti s podáváním přípravku EMADINE se v
klinických studiích vyskytly nežádoucí účinky v průměru u 7% pacientů; avšak méně než 1% těchto pacientů léčbu z důvodu nežádoucího účinku přerušilo. Žádné závažné nežádoucí účinky na oči nebo systémové nežádoucí účinky nebyly v klinických studiích hlášeny. Nejčastěji hlášeným nežádoucím účinkem byla bolest a svědění oka, které se vyskytly u 1% až 2% pacientů.
Tabulkový souhrn nežádoucích účinků
Nežádoucí účinky uvedené níže, byly pozorovány v klinických studiích nebo byly zjištěné na základě zkušeností po uvedení na trh. Jsou roztříděny do skupin dle tříd orgánových systémů a podle následujících pravidel: velmi časté (>1/ 10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (>1/10 000 až <1/1000) velmi vzácné (<1/10 000) nebo není známo (z dostupných údajů nelze určit). V každé skupině četnosti jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinek |
|
Psychiatrické poruchy |
Méně časté |
neobvyklé sny |
|
Poruchy nervového systému |
Méně časté |
bolest hlavy, bolest hlavy provázející zánět vedlejších nosních dutin, dysgeuzie |
|
Poruchy oka |
Časté |
bolest oka, svědění oka, hyperemie spojivek |
|
Méně časté |
infiltráty na rohovce, skvrny na rohovce, rozmazané vidění, podráždění oka, suché oko, pocit cizího tělíska v oku, zvýšené slzení, astenopie, hyperemie oka | |
|
Srdeční poruchy |
Není známo | |
|
Poruchy kůže a podkožní tkáně |
Méně časté |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Při očním podáním přípravku nejsou očekávány žádné specifické účinky po předávkování.
Žádné údaje ohledně předávkování u lidí v důsledku náhodného nebo úmyslného požití nejsou k dispozici. V případě náhodného požití obsahu lahvičky EMADINE se mohou projevit jeho sedativní účinky a je třeba vzít v úvahu potenciál emedastinu prodloužit QT interval, proto se má zavést odpovídající monitorování a léčba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: dekongesční léčiva a antialergika; jiná antialergika.
ATC kód: S01GX06
Emedastin je silný selektivní a lokálně účinný Hj histaminový antagonista (Ki = 1,3 nM). Zkoušení in vitro afinity emedastinu k histaminovým receptorům (H1, H2 a H3) prokázalo 10 000 násobnou selektivitu k receptoru H1, přičemž příslušné hodnoty Ki se rovnaly 1,3 nM, resp. 49 064 nM, resp.
12 430 nM. Lokální oční aplikace emedastinu in vivo vyvolává koncentračně závislou inhibici histaminem stimulované spojivkové vaskulámí permeability. Studie s emedastinem neprokázaly účinek na adrenergní, dopaminergní a serotoninové receptory.
5.2 Farmakokinetické vlastnosti
Absorpce
Emedastin je systémově absorbován podobně jako jiné lokálně podávané lékové substance. Ve studii na deseti zdravých dobrovolnících, kterým byl po dobu 15 dnů bilaterálně dvakrát denně podáván 0,05% oční roztok EMADINE, byly koncentrace mateřské látky v plazmě obvykle pod dolní hranicí detekčního limitu metody stanovení (0,3 ng/ml). Vzorky, ve kterých byl emedastin kvantifikovatelný, měly koncentraci od 0,30 do 0,49 ng/ml.
Biologická dostupnost emedastinu při perorálním podání u člověka je přibližně 50% a maximální koncentrace v plazmě bylo dosaženo během jedné až dvou hodin po podání.
Metabolismus
Emedastin je převážně metabolizován játry. Eliminační poločas lokálně podávaného emedastinu je deset hodin. Přibližně 44% perorální dávky je vyloučeno močí během 24 hodin, pouze 3,6% dávky je však vyloučeno v nezměněné podobě . Močí se vylučují především dva primární metabolity, 5- a 6-hydroxyemedastin, oba jak ve volné, tak v konjugované formě. Méně častými metabolity jsou také 5'-oxo analoga 5-a 6-hydroxyemedastinu a N-oxidu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Emedastin-difumarát prokázal nízkou akutní toxicitu u celé řady živočišných druhů a při různých cestách podání. V dlouhodobých studiích místní aplikace do očí u králíků nebyly pozorovány žádné významné místní ani systémové účinky.
Infiltráty rohovkových limbálních mononukleárních buněk byly zaznamenány u 1/4 opičích samců, kterým bylo podáváno 0,5 mg/ml a u 4/4 samců a 1/4 samic, kterým byl podáván 1,0 mg/ml. Infiltráty mononukleárních buněk skléry byly přítomny u 1/4 samců a 1/4 samic, kterým bylo podáváno 0,5 mg/ml a u 2/4 samců a 1/4 samic, kterým byl podáván 1,0 mg/ml. Průměrné vrcholové hodnoty v plazmě byly přibližně 1 ng/ml a 2 ng/ml při podávání 0,5 mg/ml resp. 1,0 mg/ml.
Zjistilo se, že emedastin prodlužuje u psů QT interval; hladina nevyvolávající ještě žádný účinek (NOEL) odpovídá hladinám 23krát vyšším než byly hladiny nalezené u pacientů (7 ng/ml ve srovnání s 0,3 ng/ml, tj. limitem detekce emedastinu).
Emedastin-difumarát nebyl ve studiích na myších a potkanech shledán karcinogenním. Emedastin-difumarát nebyl ve standardní sérii zkoušek genotoxicity in vivo a in vitro shledán ani genotoxickým.
V teratologické studii na potkanech se objevily při nejvyšší hodnocené dávce (140 mg/kg/den) toxické účinky na plod, ne však účinky teratogenní; při nižších dávkách (40 mg/kg/den), odpovídajících s výraznou rezervou dávkám, podávaným jako doporučené terapeutické dávky, nebyly odhaleny žádné účinky. Ve studii na králících nebyla odhalena reprodukční toxicita.
Nebylo zjištěno poškození fertility nebo snížení reprodukční kapacity u potkanů po perorálním podání emedastin-difumarátu v dávce až 30 mg/kg/den.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Benzalkonium-chlorid 0,1 mg/ml Trometamol
Chlorid sodný Hypromelosa
Kyselina chlorovodíková/hydroxid sodný (k úpravě pH)
Čištěná voda
6.2 Inkompability
Neuplatňuje se.
6.3 Doba použitelnosti
30 měsíců.
Přípravek EMADINE se nemá používat déle než 4 týdny po prvním otevření.
6.4 Zvláštní opatření pro uchovávání Uchovávejte při teplotě do 25 °C.
6.5 Druh obalu a obsah balení
EMADINE je dodáván v 5 ml a 10 ml neprůhledných plastových aplikačních lahvičkách DROP-TAINER. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Alcon Laboratories (UK) Ltd.
Frimley Business Park Frimley Camberley Surrey, GU16 7SR Velká Británie
8. REGISTRAČNÍ ČÍSLA
EU/1/98/095/001 -2
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 27. ledna 1999.
Datum posledního prodloužení registrace: 29. ledna 2004
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu.
EMADINE 0,5 mg/ml, oční kapky, roztok, jednodávkový obal
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 ml roztoku obsahuje emedastinum 0,5 mg (ve formě emedastini difumaras) Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Oční kapky, roztok.
Čirý, bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Symptomatická léčba sezónní alergické konjunktivitidy.
4.2 Dávkování a způsob podání
EMADINE nebyl studován v klinických zkouškách přesahujících šest týdnů. Dávkování
Dávka je jedna kapka přípravku EMADINE do postiženého oka (očí) dvakrát denně.
Používá-li se více než jeden oční léčivý přípravek, je třeba léčivé přípravky podávat s odstupem minimálně 10 minut. Oční masti mají být aplikovány jako poslední.
Pro jednorázové použití; jedna ampulka je dostatečná pro léčbu obou očí. Všechen nespotřebovaný roztok by měl být ihned po použití zlikvidován.
Starší populace
EMADINE nebyl studován u pacientů starších než 65 let, a proto se jeho používání v této věkové kategorii nedoporučuje.
Dětská populace
EMADINE lze používat u dětských pacientů (3 roky a starší) ve stejném dávkování jako u dospělých. Použití při poškození funkce ledvin nebo jater
EMADINE nebyl u těchto pacientů studován, a proto se jeho použití u těchto pacientů nedoporučuje. Způsob podání Pro oční podání.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a zvláštní opatření pro použití
Infíltrátv na rohovce oka
V souvislosti s používáním přípravku EMADINE byl zaznamenán výskyt infiltrátů na oční rohovce.
V případě infiltrátů rohovky se má podávání přípravku přerušit a má se zavést odpovídající léčba.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí.
4.6 Fertilita, těhotenství a kojení
Údaje o podávání emedastinu těhotným ženám nejsou dostatečné. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Potenciální riziko pro člověka není známo. Avšak vzhledem k absenci účinků na adrenergní, dopaminergní a serotoninové receptory, může být přípravek EMADINE používán během těhotenství, pokud je respektováno dávkování doporučené v bodě 4.2.
Kojení
Emedastin byl po perorálním podání nalezen v mléce potkanů. Není známo, zda lokální aplikace může mít u lidí za následek dostatečnou systémovou absorpci, která by vedla k detekovatelným množstvím v mateřském mléce. Přípravek EMADINE by měl být používán během kojení s opatrností.
Fertilita
Studie na zvířatech neprokázaly poškození fertility (viz bod 5.3). Údaje o vlivu na fertilitu u lidí nejsou k dispozici.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek EMADINE nemá žádný nebo má zanedbatelná vliv na schopnost řídit nebo obsluhovat stroje, pokud se stejně jako u jiných očních přípravků vyskytne při aplikaci přechodné rozmazané vidění nebo jiná poruch vidění, má pacient před řízením nebo obsluhou strojů vyčkat, dokud se vidění neupraví.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Ve 13 klinických studiích, které zahrnovaly 696 pacientů, byl přípravek EMADINE aplikován jednou až čtyřikrát denně do obou očí po dobu 42 dnů. V souvislosti s podáváním přípravku EMADINE se v klinických studiích vyskytly nežádoucí účinky v průměru u 7% pacientů; avšak méně než 1% těchto pacientů léčbu z důvodu nežádoucího účinku přerušilo. Žádné závažné nežádoucí účinky na oči nebo systémové nežádoucí účinky nebyly v klinických studiích hlášeny. Nejčastěji hlášeným nežádoucím účinkem byla bolest a svědění oka, které se vyskytly u 1% až 2% pacientů.
Tabulkový souhrn nežádoucích účinků
Nežádoucí účinky uvedené níže, byly pozorovány v klinických studiích nebo byly zjištěné na základě zkušeností po uvedení na trh. Jsou roztříděny do skupin dle tříd orgánových systémů a podle následujících pravidel: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (>1/10 000 až <1/1000) velmi vzácné (<1/10 000) nebo není známo (z dostupných údajů nelze určit). V každé skupině četnosti jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinek |
|
Psychiatrické poruchy |
Méně časté |
neobvyklé sny |
|
Poruchy nervového systému |
Méně časté |
bolest hlavy, bolest dutin, dysgeuzie |
|
Poruchy oka |
Časté |
bolest oka, svědění oka, hyperemie spojivek |
|
Méně časté |
infiltráty na rohovce, skvrny na rohovce, rozmazané vidění, podráždění oka, suché oko, pocit cizího tělíska v oku, zvýšené slzení, astenopie, hyperemie oka | |
|
Srdeční poruchy |
Není známo | |
|
Poruchy kůže a podkožní tkáně |
Méně časté |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Při očním podáním přípravku nejsou očekávány žádné specifické účinky po předávkování.
Žádné údaje ohledně předávkování u lidí v důsledku náhodného nebo úmyslného požití nejsou k dispozici. V případě náhodného požití obsahu lahvičky EMADINE se mohou projevit jeho sedativní účinky a je třeba vzít v úvahu potenciál emedastinu prodloužit QT interval, proto se má zavést odpovídající monitorování a léčba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: látky pro dekongesci a antialergika; jiná antialergika.
ATC kód: S01G X 06
Emedastin je silný selektivní a lokálně účinný H1 histaminový antagonista (Ki = 1,3 nM). Zkoušení in vitro afinity emedastinu k histaminovým receptorům (H1, H2 a H3) prokázalo 10 000 násobnou selektivitu k receptoru H1, přičemž příslušné hodnoty Ki se rovnaly 1,3 nM, resp. 49 064 nM, resp.
12 430 nM. Lokální oční aplikace emedastinu in vivo vyvolává koncentračně závislou inhibici histaminem stimulované spojivkové vaskulární permeability. Studie s emedastinem neprokázaly účinek na adrenergní, dopaminergní a serotoninové receptory.
5.2 Farmakokinetické vlastnosti
Absorpce
Emedastin je systémově absorbován podobně jako jiné lokálně podávané lékové substance. Ve studii na deseti zdravých dobrovolnících, kterým byl po dobu 15 dnů bilaterálně dvakrát denně podáván 0,05% oční roztok EMADINE, byly koncentrace účinné látky v plazmě obvykle pod dolní hranicí detekčního limitu metody stanovení (0,3 ng/ml). Vzorky, ve kterých byl emedastin kvantifikovatelný, měly koncentraci od 0,30 do 0,49 ng/ml.
Biologická dostupnost emedastinu při perorálním podání člověku je přibližně 50% a maximální koncentrace v plazmě bylo dosaženo během jedné až dvou hodin po podání.
Metabolismus
Emedastin je převážně metabolizován játry. Eliminační poločas lokálně podávaného emedastinu je deset hodin. Přibližně 44% perorální dávky je vyloučeno močí během 24 hodin, pouze 3,6% dávky je však vyloučeno v nezměněné podobě. Močí se vylučují především dva primární metabolity, 5- a 6-hydroxyemedastin, oba jak ve volné, tak v konjugované formě. Méně častými metabolity jsou také 5'-oxo analoga 5-a 6-hydroxyemedastinu a N-oxidu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Emedastin-difumarát prokázal nízkou akutní toxicitu u celé řady živočišných druhů a při různých cestách podání. V dlouhodobých studiích místní aplikace do očí u králíků nebyly pozorovány žádné významné místní ani systémové účinky.
Infiltráty rohovkových limbálních mononukleárních buněk byly zaznamenány u 1/4 opičích samců, kterým bylo podáváno 0,5 mg/ml a u 4/4 samců a 1/4 samic, kterým byl podáván 1,0 mg/ml. Infiltráty mononukleárních buněk skléry byly přítomny u 1/4 samců a 1/4 samic, kterým bylo podáváno 0,5 mg/ml a u 2/4 samců a 1/4 samic, kterým byl podáván 1,0 mg/ml. Průměrné vrcholové hodnoty v plazmě byly přibližně 1 ng/ml a 2 ng/ml při podávání 0,5 mg/ml resp. 1,0 mg/ml.
Zjistilo se, že emedastin prodlužuje u psů QT interval; hladina nevyvolávající ještě žádný účinek (NOEL) odpovídá hladinám 23krát vyšším než byly hladiny nalezené u pacientů (7 ng/ml ve srovnání s 0,3 ng/ml, tj. limitem detekce emedastinu).
Emedastin-difumarát nebyl ve studiích na myších a potkanech shledán karcinogenním. Emedastin-difumarát nebyl ve standardní sérii zkoušek genotoxicity in vivo a in vitro shledán ani genotoxickým.
V teratologické studii na potkanech se objevily při nejvyšší hodnocené dávce (140 mg/kg/den) toxické účinky na plod, ne však účinky teratogenní; při nižších dávkách (40 mg/kg/den), odpovídajících s výraznou rezervou dávkám podávaným jako doporučené terapeutické dávky, nebyly odhaleny žádné účinky. Ve studii na králících nebyla odhalena reprodukční toxicita.
Nebylo zjištěno poškození fertility nebo snížení reprodukční kapacity u potkanů po perorálním podání emedastin-difumarátu v dávce až 30 mg/kg/den.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Trometamol Chlorid sodný Hypromelosa
Kyselina chlorovodíková/hydroxid sodný (k úpravě pH) Čištěná voda
6.2 Inkompability
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky.
Po prvním otevření ochranného fóliového přebalu: 7 dní.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 30oC.
6.5 Druh obalu a obsah balení
EMADINE je dodáván v polyethylenových jednodávkových ampulkách o obsahu 0,35 ml. Pět jednodávkových ampulek je zataveno v ochranném fóliovém přebalu.
K dispozici jsou následující velikosti balení: 30 x 0,35 ml jednodávkových ampulek a 60 x 0,35 ml jednodávkových ampulek. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Pouze pro jednorázové použití; jedna ampulka je dostatečná pro léčbu obou očí. Všechen nespotřebovaný roztok by měl být ihned po použití zlikvidován.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Alcon Laboratories (UK) Ltd.
Frimley Business Park Frimley Camberley Surrey, GU16 7SR Velká Británie
8. REGISTRAČNÍ ČÍSLA
EU/1/98/095/003-4
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 27. ledna 1999.
Datum posledního prodloužení registrace: 29. ledna 2004
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu.
A. VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Názvy a adresy výrobců odpovědných za propouštění šarží
EMADINE 0.5 mg/ml, oční kapky, roztok S.A. Alcon-Couvreur N.V.,
Rijksweg 14,
B-2870 Puurs,
Belgie.
Alcon Cusí, S.A.,
Camil Fabra 58,
08320 El Masnou,
Barcelona,
Španělsko.
EMADINE 0.5 mg/ml, oční kapky, roztok, jednodávkový obal
S.A. Alcon-Couvreur N.V.,
Rijksweg 14,
B-2870 Puurs,
Belgie.
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
Neuplatňuje se.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
EMADINE 0,5 mg/ml, oční kapky, roztok Emedastinum
2. OBSAH LÉČIVÉ LÁTKY
Emedastinum 0,5 mg/ml ve formě emedastini difumaras.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje: benzalkonium-chlorid 0,1 mg/ml, trometamol, chlorid sodný, hypromelosa, kyselina chlorovodíková/hydroxid sodný (k úpravě pH), čištěná voda.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Oční kapky, roztok; 1 x 5 ml 1 x 10 ml
5. ZPŮSOB A CESTA PODÁNÍ
Oční podání. Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP:
Zlikvidujte čtyři týdny po prvním otevření. Otevřeno:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 25 °C.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Alcon Laboratories (UK) Ltd
Frimley Business Park
Frimley
Camberley
Surrey, GU16 7SR
Velká Británie
12. REGISTRAČNÍ ČÍSLA
EU/1/98/095/001 1 x 5 ml EU/1/98/095/002 1 x 10 ml
13. ČÍSLO ŠARŽE
Lot:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16 INFORMACE V BRAILLOVĚ PÍSMU
Emadine
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
EMADINE 0,5 mg/ml oční kapky
Emedastinum
Oční podání.
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
EXP:
Zlikvidujte čtyři týdny po prvním otevření. Otevřeno:
4. ČÍSLO ŠARŽE
Lot:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
5 ml 10 ml
6. JINÉ
Krabička pro 30 x 0.35 ml jednodávkový obal a krabička pro 60 x 0.35 ml jednodávkový obal
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
EMADINE 0,5 mg/ml, oční kapky, roztok, jednodávkový obal Emedastinum
2 OBSAH LÉČIVÉ LÁTKY
Emedastinum 0,5 mg/ml ve formě emedastini difumaras.
3 SEZNAM POMOCNÝCH LÁTEK
Obsahuje: trometamol, chlorid sodný, hypromelosa, kyselina chlorovodíková, hydroxid sodný a čištěná voda.
4 LÉKOVÁ FORMA A OBSAH BALENÍ
Oční kapky, roztok. 0,35 ml x 30.
0.35 ml x 60
5 ZPŮSOB A CESTA PODÁNÍ
Oční podání. Před použitím si přečtěte příbalovou informaci.
6 ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7 DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Pouze pro jednorázové použití; jeden jednodávkový obal je dostatečný pro léčbu obou očí. Bez konzervační látky.
8 POUŽITELNOST
EXP:
Zlikvidujte veškerý nespotřebovaný roztok v jednodávkovém obalu ihned po použití.
Zlikvidujte veškeré nespotřebované jednodávkové obaly jeden týden po prvním otevření ochranného fóliového přebalu.
Uchovávejte při teplotě do 30°C.
10 ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11 NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Alcon Laboratories (UK) Ltd.
Frimley Business Park
Frimley
Camberley
Surrey, GU16 7SR
Velká Británie
12 REGISTRAČNÍ ČÍSLOA
EU/1/98/095/003 0.35 ml x 30 EU/1/98/095/004 0.35 ml x 60
13 ČÍSLO ŠARŽE
Lot:
14 KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15 NÁVOD K POUŽITÍ
16 INFORMACE V BRAILLOVĚ PÍSMU
Emadine
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE
Ochranný fóliový přebal
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
EMADINE 0,5 mg/ml, oční kapky, roztok, jednodávkový obal Emedastinum
2 OBSAH LÉČIVÉ LÁTKY
Emedastin 0,5 mg/ml ve formě emedastini difumaras.
3 SEZNAM POMOCNÝCH LÁTEK
Obsahuje: trometamol, chlorid sodný, hypromelosa, kyselina chlorovodíková, hydroxid sodný a čištěná voda.
4 LÉKOVÁ FORMA A OBSAH BALENÍ
Oční kapky, roztok; 0,35 ml x 5.
5 ZPŮSOB A CESTA PODÁNÍ
Oční podání. Před použitím si přečtěte příbalovou informaci.
6 ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7 DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Pouze pro jednorázové použití; jeden jednodávkový obal je dostatečný pro léčbu obou očí. Bez konzervační látky.
8 POUŽITELNOST
EXP:
Zlikvidujte veškerý nespotřebovaný roztok v jednodávkovém obalu ihned po použití.
Zlikvidujte veškeré nespotřebované jednodávkové obaly jeden týden po prvním otevření ochranného fóliového přebalu.
Uchovávejte při teplotě do 30°C.
10 ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11 NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Alcon Laboratories (UK) Ltd.
Frimley Business Park
Frimley
Camberley
Surrey, GU16 7SR
Velká Británie
12 REGISTRAČNÍ ČÍSLA
EU/1/98/095/003 0.35 ml x 30 EU/1/98/095/004 0.35 ml x 60
13 ČÍSLO ŠARŽE
Lot:
14 KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15 NÁVOD K POUŽITÍ
Roztrhněte přebal v místě nastřižení.
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Jednodávkový obal
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
EMADINE Oční podání
2. ZPŮSOB PODÁNÍ_
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST_
EXP:
4. ČÍSLO ŠARŽE
Lot:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienty
EMADINE 0,5 mg/ml, oční kapky, roztok
Emedastinum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek EMADINE a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek EMADINE používat
3. Jak se přípravek EMADINE používá
4. Možné nežádoucí účinky
5. Jak přípravek EMADINE uchovávat
6. Obsah balení a další informace
1. Co je přípravek EMADINE a k čemu se používá
EMADINE je léčivý přípravek, který se používá k léčbě sezónního alergického zánětu spojivek očí (alergický stav oka). Snižuje intenzitu alergické reakce.
Alergický zánět spojivek. Některé látky (alergeny) jako jsou pyly, domácí prach nebo zvířecí srst mohou způsobovat alergickou reakci, která se projevuje svěděním, zarudnutím oka nebo také otoky v okolí Vašich očí.
Pokud se nebudete cítit lépe nebo pokud se Vám přitíží, musíte se poradit s lékařem.
2. Čemu musíte věnovat pozornost, než začnete přípravek EMADINE používat Nepoužívejte přípravek EMADINE
• jestliže jste alergický(á) na emedastin nebo na kteroukoliv další složku tohoto přípravku (uvedenou v bodě 6).
Poraďte se se svým lékařem.
Upozornění a opatření
• Nepoužívejte přípravek EMADINE pro léčbu dětí mladších než 3 roky.
• Jestliže nosíte kontaktní čočky, prosím přečtěte si bod „Přípravek EMADINE obsahuje benzalkonium-chlorid“ níže.
• EMADINE není doporučován pro léčbu pacientů ve věku vyšším než 65 let, protože u této věkové skupiny nebyly provedeny žádné klinické studie.
• Používání přípravku EMADINE není doporučováno u pacientů s onemocněním ledvin a jater.
Před použitím přípravku EMADINE se poraďte se svým lékařem nebo lékárníkem.
Další léčivé přípravky a přípravek EMADINE
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Jestliže současně s přípravkem EMADINE používáte ještě další oční léčivé přípravky, postupujte podle informací v bodě 3 „Jak se přípravek EMADINE používá“.
Těhotenství, kojení a plodnost
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek používat.
Řízení dopravních prostředků a obsluha strojů
Můžete zjistit, že je Vaše vidění po určitou dobu po použití přípravku EMADINE rozmazané. Neřiďte nebo neobsluhujte stroje, dokud nebudete opět vidět jasně.
Přípravek EMADINE obsahuje benzalkonium-chlorid
Konzervační látka v přípravku EMADINE (benzalkonium-chlorid) může způsobit podráždění oka a je o něm známo, že zbarvuje měkké kontaktní čočky. Z tohoto důvodu nepoužívejte kapky EMADINE, pokud máte kontaktní čočky nasazeny v oku. Vyčkejte nejméně 15 minut po nakapání přípravku EMADINE, než si kontaktní čočky opět nasadíte.
3. Jak se přípravek EMADINE používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Doporučená dávka přípravku u dospělých a dětí ve věku 3 roky a více: Jedna kapka do oka, dvakrát denně.
Vždy používejte tento přípravek přesně v souladu s příbalovou informací nebo podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Kapky používejte pouze do očí.
Otočte stránku pro více informací
Nyní otočte>
3. Jak se přípravek EMADINE používá (pokračování)
2
Doporučená dávka <viz strana 1
• Připravte si lahvičku s přípravkem EMADINE a zrcátko.
• Umyjte si ruce.
• Vezměte lahvičku a odšroubujte uzávěr.
• Pokud je po sejmutí víčka bezpečnostní kroužek uvolněný, před použitím přípravku jej odstraňte.
• Lahvičku držte hrotem dolů mezi palcem a prostředníčkem.
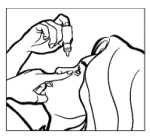
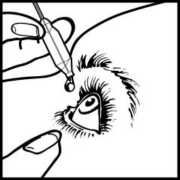
• Zakloňte hlavu dozadu. Čistým prstem si stáhněte víčko dolů tak, aby se mezi očním víčkem a okem vytvořila jakási „kapsa“. Tam se umístí kapka (viz obr. 1).
• Hrot lahvičky dejte těsně k oku. Můžete si pomoci zrcátkem.
• Hrotem lahvičky se nedotýkejte oka nebo očního víčka, okolních tkání nebo jiných povrchů. Oční kapky by se tím mohly znečistit.
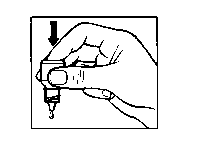
• Lehce zatlačte na dno lahvičky tak, aby se uvolnila jedna kapka EMADINE.
• Lahvičku nestlačujte; je vyrobena tak, aby k uvolnění kapky stačil lehký tlak na dno (obrázek 2).
• Pokud máte kapat do obou očí, pokračujte stejným způsobem i u druhého oka.
• Ihned po použití nasaďte zpět pevně uzávěr.
Jestliže nedopatřením přípravek EMADINE požijete nebo použijete k injekční aplikaci, okamžitě kontaktujte lékaře. Mohlo by dojít k poruše Vašeho srdečního rytmu.
Jestliže se Vám nepodaří vkápnout kapku do oka, celý úkon opakujte.
Jestliže si do oka nakapete příliš velké množství, oko vypláchněte sterilním fyziologickým roztokem, pokud není k dispozici, použijte vlažnou vodu. Další kapky již do oka nekapejte a vyčkejte do doby další aplikace dle pravidelného dávkovacího režimu.
Jestliže jste zapomněl(a) použít EMADINE v pravidelnou dobu, vkápněte si jednu kapku do oka ihned, jakmile si vzpomenete, a pak se vraťte ke svému pravidelnému dávkovacímu schématu. Nezdvojujte následující dávku, abyste doplnil(a) vynechanou dávku.
Používáte-li ještě jiné oční kapky, zachovejte mezi aplikací přípravku EMADINE a jiných přípravků interval alespoň 10 minut. Oční masti se aplikují jako poslední.
Máte-li jakékoli další otázky týkající se používání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i přípravek EMADINE nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Obvykle můžete v používání kapek pokračovat, pokud nejsou účinky závažné. Máte-li obavy, sdělte to svému lékaři nebo lékárníkovi.
Časté nežádoucí účinky
(mohou se objevit až u 1 osoby z 10)
Účinky na oko: bolest oka, svědění oka, zarudnutí oka.
Méně časté nežádoucí účinky
(mohou se objevit až u 1 osoby ze 100)
Účinky na oko: poškození rohovky, neobvyklý pocit v očích, zvýšené slzení, unavené oči, podráždění oka, rozmazané vidění, skvrny na rohovce, suché oko.
Celkové nežádoucí účinky: bolest hlavy, problémy se spánkem, bolest hlavy provázející zánět vedlejších nosních dutin, pachuť v ústech, vyrážka.
Není známo
(četnost výskytu z dostupných údajů nelze určit)
Celkové nežádoucí účinky: zvýšená srdeční frekvence Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek EMADINE uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na lahvičce a papírové krabičce za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte při teplotě do 25 °C.
Čtyři týdny po prvním otevření lahvičku zlikvidujte, aby se zabránilo kontaminaci přípravku. Zapište datum otevření každé lahvičky na štítek lahvičky a na krabičku na vyznačené místo.
Otevřeno:
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek EMADINE obsahuje
Léčivou látkou je emedastinum 0.5 mg/ml ve formě emedastini difumaras.
Pomocnými látkami jsou benzalkonium-chlorid, trometamol, chlorid sodný, hypromelosa, čištěná voda. Malé množství kyseliny chlorovodíkové nebo hydroxidu sodného se přidává proto, aby se udržely normální hodnoty kyselosti (úrovně pH).
Jak přípravek EMADINE vypadá a co obsahuje toto balení
EMADINE je tekutina (roztok) dodávaná v balení obsahujícím 5 ml nebo 10 ml plastovou (DROP-TAINER) lahvičku se šroubovacím uzávěrem. Na trhu nemusí být Všechny velikosti balení .
Výrobce Výrobce
Alcon Cusí, S.A., Camil Fabra 58, B-2870 Puurs, 08320 El Masnou,
S.A. Alcon-Couvreur N.V., Rijksweg 14,
Camberley Surrey, GU16 7SR Velká Británie
Španělsko
Belgie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
|
Belgie/Belgique/Belgien Luxembourg/Luxemburg Alcon NV @ + 32 (0)2 754 32 10 (Belgie/Belgique/Belgien) |
Latvija Alcon Pharmaceuticals Ltd ® + 371 67 321 121 |
|
EfcnrapHH Ahkoh Etarapna EOOfl ® + 359 2 950 15 65 |
Lietuva Alcon Pharmaceuticals Ltd atstovybé ® + 370 5 2 314 756 |
|
Česká republika Alcon Pharmaceuticals (Czech Republic) s.r.o. ® + 420 225 775 111 |
Magyarország Alcon Hungária Gyógyszerkereskedelmi Kft ® + 36-1-463-9080 |
|
Danmark Alcon Nordic A/S ® + 45 3636 4300 |
Nederland Alcon Nederland BV ® + 31 (0) 183 654321 |
|
Deutschland Alcon Pharma GmbH ® + 49 (0)761 1304-0 |
Norge Alcon Nordic A/S ® + 45 3636 4300 |
|
EkXába/Knnpoq A^kov Aapnopáxopic EXKác, AEBE ® + 30 210 68 78 300 (EMá5a) |
Osterreich Alcon Ophthalmika GmbH ® + 43 (0)1 596 69 70 |
|
Eesti Alcon Pharmaceuticals Ltd. Eesti filiaal ® + 372 6 313 214 |
Polska Alcon Polska Sp. z o.o. ® + 48 22 820 3450 |
|
Espaňa Alcon Cusí, S.A. ® + 34 93 497 7000 |
Portugal Alcon Portugal -Produtos e Equipamentos Oftalmológicos, Lda. ® + 351 214 400 300 |
|
France Laboratoires Alcon ® + 33 (0)1 47 10 47 10 |
Románia S.C. Alcon Romania S.R.L. ® + 40 21 203 93 24 |
|
Hrvatska Alcon Farmaceutika d.o.o. ® + 385 1 4611 988 |
Slovenija Alcon d.o.o. ® + 386 1 422 5280 |
|
Ireland Malta United Kingdom Alcon Laboratories (UK) Ltd |
Slovenská republika Novartis Slovakia s.r.o. Alcon Division ® + 421 2 5441 0378 |
® + 44 (0) 871 376 1402 (United Kingdom)
Suomi/Finland
Alcon Nordic A/S ® + 45 3636 4300
Sverige
Alcon Nordic A/S ® + 45 3636 4300
Island
Alcon Nordic A/S ® + 45 3636 4300
Italia
Alcon Italia S.p.A. ® + 39 02 81 80 31
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu.
Příbalová informace: informace pro pacienty
EMADINE 0,5 mg/ml oční kapky, roztok, jednodávkový obal
Emedastinum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek EMADINE a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek EMADINE používat
3. Jak se přípravek EMADINE používá
4. Možné nežádoucí účinky
5. Jak přípravek EMADINE uchovávat
6. Obsah balení a další informace
1. Co je přípravek EMADINE a k čemu se používá
EMADINE je léčivý přípravek, který se používá k léčbě sezónního alergického zánětu spojivek očí (alergický stav oka). Snižuje intenzitu alergické reakce.
Alergický zánět spojivek. Některé látky (alergeny) jako jsou pyly, domácí prach nebo zvířecí srst mohou způsobovat alergickou reakci, která se projevuje svěděním, zarudnutím oka nebo také otoky v okolí Vašich očí.
Pokud se nebudete cítit lépe nebo pokud se Vám přitíží, musíte se poradit s lékařem.
2. Čemu musíte věnovat pozornost, než začnete přípravek EMADINE používat Nepoužívejte přípravek EMADINE
• jestliže jste alergický(á) na emedastin nebo na kteroukoliv další složku tohoto přípravku (uvedenou v bodě 6).
Poraďte se se svým lékařem.
Upozornění a opatření
• Nepoužívejte přípravek EMADINE pro léčbu dětí mladších než 3 roky.
• EMADINE není doporučován pro léčbu pacientů ve věku vyšším než 65 let, protože u této věkové skupiny nebyly provedeny žádné klinické studie.
• Používání přípravku EMADINE není doporučováno u pacientů s onemocněním ledvin a jater.
Před použitím přípravku EMADINE se poraďte se svým lékařem nebo lékárníkem.
Další léčivé přípravky a přípravek EMADINE
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat
Jestliže současně s přípravkem EMADINE používáte ještě další oční léčivé přípravky, postupujte podle informací v bodě 3 „Jak se přípravek EMADINE používá“.
Těhotenství, kojení a plodnost
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat.
Řízení dopravních prostředků a obsluha strojů
Můžete zjistit, že je Vaše vidění po určitou dobu po použití přípravku EMADINE rozmazané. Neřiďte nebo neobsluhujte stroje, dokud nebudete opět vidět jasně.
3. Jak se přípravek EMADINE používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Doporučená dávka přípravku u dospělých a dětí ve věku 3 roky a více: Jedna kapka do oka, dvakrát denně.
Vždy používejte tento přípravek přesně v souladu s příbalovou informací nebo podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Kapky používejte pouze do očí.
Otočte stránku pro více informací
Nyní otočte>
3. Jak se přípravek EMADINE používá (pokračování)
3
1 2
Doporučená dávka <viz strana 1
Nepoužívejte jednodávkový obal - ampulku, která již byla otevřena. Nepoužívejte žádnou uzavřenou ampulku z ochranného fóliového přebalu, který byl otevřen déle než týden.
• Roztrhněte ochranný fóliový přebal a vyjměte pás pěti ampulek.
• Nepoužívejte, pokud je roztok zakalený nebo obsahuje částice.
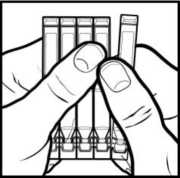
• Držte pás dlouhou plochou stranou nahoru a oddělte ampulku tahem směrem k sobě, zatímco ostatní pevně držíte. Pokud ampulky pevně drží, bude potřeba je od sebe odlomit (obrázek 1).
• Odeberte jednu ampulku. Ostatní vraťte do ochranného fóliového přebalu.
• Ujistěte se, zda máte po ruce zrcátko a umyjte si ruce.
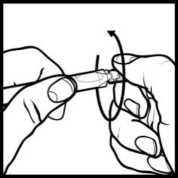
• Držte ampulku za plochý konec mezi palcem a ukazováčkem a otevřete ji zakroucením druhého konce (obrázek 2).
• Zakloňte hlavu. Stáhněte čistým prstem víčko směrem dolů tak, aby se mezi víčkem a okem vytvořila jakási “kapsa”. Tam se umístí kapka.
• Držte ampulku mezi palcem a ostatními prsty otevřeným koncem směrem dolů.
• Hrot ampulky dejte těsně k oku. Můžete si pomoci zrcátkem.
• Hrotem ampulky se nedotýkejte oka nebo očního víčka, okolních tkání nebo jiných povrchů. Oční kapky by se tím mohly znečistit.
• Lehce zatlačte na ampulku tak, aby se uvolnila jedna kapka do kapsy mezi očním víčkem a okem (obrázek 3).
• Pokud Vám lékař doporučil, že máte přípravek používat do obou očí, pokračujte stejným způsobem u druhého oka - použijte stejnou ampulku.
• Vyhoďte ampulku včetně zbývajícího roztoku.
• Vyhoďte všechny nepoužité ampulky z ochranného přebalu, který byl otevřen déle než týden, i když jsou ampulky stále uzavřené.
Jestliže nedopatřením přípravek EMADINE požijete nebo použijete k injekční aplikaci, okamžitě kontaktujte lékaře. Mohlo by dojít k poruše Vašeho srdečního rytmu.
Jestliže se Vám nepodaří kápnout kapku do oka, celý úkon opakujte.
Jestliže si do oka nakapete příliš velké množství, oko vypláchněte sterilním fyziologickým roztokem, nemáte-li jej k dispozici, použijte vlažnou vodu. Další kapky již do oka nekapejte a vyčkejte do doby další aplikace dle pravidelného dávkovacího režimu.
Jestliže jste zapomněl(a) použít EMADINE v pravidelnou dobu, vkápněte si jednu kapku do oka ihned, jakmile si vzpomenete, a pak se vraťte ke svému pravidelnému dávkovacímu schématu. Nezdvojujte následující dávku, abyste doplnil(a) vynechanou dávku.
Používáte-li současně ještě jiné oční kapky, zachovejte mezi aplikací přípravku EMADINE a jiných přípravků interval alespoň 10 minut. Oční masti se aplikují jako poslední.
Máte-li jakékoli další otázky týkající se používání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i přípravek EMADINE nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Obvykle můžete v používání kapek pokračovat, pokud nejsou účinky závažné. Máte-li obavy, sdělte to svému lékaři nebo lékárníkovi.
Časté nežádoucí účinky
(mohou se objevit až u 1 osoby z 10)
Účinky na oko: bolest oka, svědění oka, zarudnutí oka.
Méně časté nežádoucí účinky
(mohou se objevit až u 1 osoby ze 100)
Účinky na oko: poškození rohovky, neobvyklý pocit v očích, zvýšené slzení, unavené oči, podráždění oka, rozmazané vidění, skvrny na rohovce, suché oko.
Celkové nežádoucí účinky: bolest hlavy, problémy se spánkem, bolest hlavy provázející zánět vedlejších nosních dutin, pachuť v ústech, vyrážka
Není známo
(četnost výskytu z dostupných údajů nelze určit)
Celkové nežádoucí účinky: zvýšená srdeční frekvence Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek EMADINE uchovávat
Uchovávejte mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na ampulce a papírové krabičce za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte při teplotě do 30°C.
Ampulku musíte po použití ihned vyhodit. Jeden týden po prvním otevření ochranného fóliového přebalu musí být všechny nespotřebované ampulky vyhozeny.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek EMADINE obsahuje
- Léčivou látkou je emedastinum 0.5 mg/ml ve formě emedastini difumaras.
- Pomocnými látkami j sou trometamol, chlorid sodný, hypromelosa, čištěná voda. Malé množství kyseliny chlorovodíkové nebo hydroxidu sodného se přidává proto, aby se udržely normální hodnoty kyselosti (úrovně pH).
Jak přípravek EMADINE vypadá a co obsahuje toto balení
EMADINE je tekutina (roztok), dodávaná v jednodávkových obalech (ampulkách), o obsahu 0.35 ml. Pět ampulek je baleno pohromadě ve fóliovém přebalu. Balení přípravku EMADINE obsahuje 30 nebo 60 ampulek. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o Výrobce
registraci
S.A. Alcon-Couvreur N.V. Rijksweg 14,
B-2870 Puurs,
Belgie
Alcon Laboratories (UK) Ltd.,
Frimley Business Park Frimley Camberley Surrey, GU16 7SR Velká Británie
|
Belgie/Belgique/Belgien Luxembourg/Luxemburg Alcon NV @ + 32 (0)2 754 32 10 (Belgie/Belgique/Belgien) |
Latvija Alcon Pharmaceuticals Ltd ® + 371 67 321 121 |
|
Bt^rapnn Ahkoh Etnrapua EOOfl ® + 359 2 950 15 65 |
Lietuva Alcon Pharmaceuticals Ltd atstovybé ® + 370 5 2 314 756 |
|
Česká republika Alcon Pharmaceuticals (Czech Republic) s.r.o. ® + 420 225 775 111 |
Magyarország Alcon Hungária Gyógyszerkereskedelmi Kft ® + 36-1-463-9080 |
|
Danmark Alcon Nordic A/S ® + 45 3636 4300 |
Nederland Alcon Nederland BV ® + 31 (0) 183 654321 |
|
Deutschland Alcon Pharma GmbH ® + 49 (0)761 1304-0 |
Norge Alcon Nordic A/S ® + 45 3636 4300 |
|
EXXába/Knnpog A^kov Aagnopáxopig EXkáq AEBE ® + 30 210 68 78 300 (EMá5a) |
Osterreich Alcon Ophthalmika GmbH ® + 43 (0)1 596 69 70 |
|
Eesti Alcon Pharmaceuticals Ltd. Eesti filiaal ® + 372 6 313 214 |
Polska Alcon Polska Sp. z o.o. ® + 48 22 820 3450 |
|
Espaňa Alcon Cusí, S.A. ® + 34 93 497 7000 |
Portugal Alcon Portugal -Produtos e Equipamentos Oftalmológicos, Lda. ® + 351 214 400 300 |
|
France Laboratoires Alcon ® + 33 (0)1 47 10 47 10 |
Románia S.C. Alcon Romania S.R.L. ® + 40 21 203 93 24 |
|
Hrvatska Alcon Farmaceutika d.o.o. ® + 385 1 4611 988 |
Slovenija Alcon d.o.o. ® + 386 1 422 5280 |
|
Ireland Malta United Kingdom Alcon Laboratories (UK) Ltd ® + 44 (0) 871 376 1402 (United Kingdom) |
Slovenská republika Novartis Slovakia s.r.o. Alcon Division ® + 421 2 5441 0378 |
Italia
Sverige
Alcon Nordic A/S ® + 45 3636 4300
Alcon Italia S.p.A. ® + 39 02 81 80 31
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu.
37