Elonva 100 Mikrogramů
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Elonva 100 mikrogramů injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna předplněná injekční stříkačka obsahuje 100 mikrogramů corifollitropinum alfa* v 0,5 ml injekčního roztoku.
*korifolitropin alfa je glykoprotein produkovaný ovariálními buňkami čínských křečků technologií rekombinantní DNA.
Pomocná látka/Pomocné látky se známým účinkem:
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) na injekci, tzn. je v podstatě „bezsodíkový“.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok (injekce). Čirý bezbarvý vodný roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Elonva je indikován pro kontrolovanou stimulaci ovarií (Controlled Ovarian Stimulation, COS) v kombinaci s antagonistou hormonu uvolňujícího gonadotropiny (GnRH), s cílem navodit vývoj mnohočetných folikulů u žen zapojených do programu asistované reprodukce (Assisted Reproductive Technology, ART).
4.2 Dávkování a způsob podání
Léčba přípravkem Elonva se musí zahájit pod dohledem lékaře se zkušenostmi v léčbě problémů s plodností.
Dávkování
Při léčbě žen ve fertilním věku je dávka přípravku Elonva založena na hmotnosti a věku.
- Pro ženy, které váží 60 kg nebo méně a kterým je 36 let nebo méně, se doporučuje jedna 100mikrogramová dávka.
- Jedna 150mikrogramová dávka se doporučuje pro ženy:
- vážící více než 60 kilogramů bez ohledu na věk.
- vážící 50 kilogramů nebo více ve věku nad 36 let.
Ženy, kterým je více než 36 let a které váží méně než 50 kg, nebyly hodnoceny.
|
Tělesná hmotnost | ||||
|
Méně než 50 kg |
50 - 60 kg |
Více než 60 kg | ||
|
Věk |
36 let nebo méně |
100 mikrogramů |
100 mikrogramů |
150 mikrogramů |
|
Více než 36 let |
Nebylo hodnoceno. |
150 mikrogramů |
150 mikrogramů | |
Doporučené dávky přípravku Elonva byly stanoveny pouze v léčebném cyklu s antagonistou GnRH, který se podával od 5. nebo 6. dne stimulace (viz také body 4.1, 4.4 a 5.1).
1. den stimulace:
Přípravek Elonva se podává jako jednorázová subkutánní injekce, nejlépe do břišní stěny, v průběhu časné folikulární fáze menstruačního cyklu.
5. nebo 6. den stimulace:
Léčbu antagonistou GnRH je nutno zahájit 5. nebo 6. den stimulace v závislosti na ovariální odpovědi, tj. podle počtu a velikosti zrajících folikulů. Může být také užitečné současně stanovit sérové hladiny estradiolu. Antagonista GnRH je používán pro prevenci předčasného vzestupu luteinizačního hormonu (LH).
8. den stimulace:
Za sedm dní po injekci přípravku Elonva, v první den stimulace, lze pokračovat v COS léčbě denně podávanými injekcemi (rekombinantního) folikuly stimulujícího hormonu [(rec)FSH] až do dosažení kritéria pro spuštění finální maturace oocytu (3 folikuly >17 mm). Denní dávka (rec)FSH může záviset na ovariální odpovědi. U těch žen, které odpovídají normálně, se doporučuje denní dávka 150 IU (rec)FSH. Podání (rec)FSH v den aplikace lidského choriogonadotropinu (human Chorionic Gonadotropin, hCG) lze v závislosti na ovariální odpovědi vynechat. Zpravidla se adekvátního vývoje folikulů dosahuje průměrně do devátého dne léčby (rozpětí 6 až 18 dní).
Jakmile jsou pozorovány tři folikuly o velikosti >17 mm, podává se ve stejný nebo následující den k navození finální maturace oocytů jednorázová injekce 5 000 až 10 000 IU hCG. V případě nadměrné ovariální odpovědi postupujte podle doporučení v bodě 4.4, aby se snížilo riziko rozvoje ovariálního hyperstimulačního syndromu (OHSS).
Zvláštní populace
Porucha funkce ledvin
U pacientek s renální insuficiencí nebyla provedena žádná klinická hodnocení. Protože u pacientek s renální insuficiencí může být rychlost eliminace korifolitropinu alfa snížena, užívání přípravku Elonva se u těchto žen nedoporučuje (viz body 4.4 a 5.2).
Porucha funkce jater
Ačkoliv údaje od pacientek s poškozenými játry nejsou k dispozici, není pravděpodobné, že by poškození jater ovlivňovalo vylučování korifolitropinu alfa (viz bod 5.2).
Pediatrická populace
V rámci schválené indikace není použití přípravku Elonva u pediatrické populace relevantní.
Způsob podání
Podkožní injekci přípravku Elonva může aplikovat žena sama nebo její partner za předpokladu, že od lékaře obdrží náležité pokyny. Přípravek Elonva mohou aplikovat samostatně pouze ženy, které jsou dobře motivovány, dostatečně vyškoleny a které mají možnost konzultace s odborníkem.
4.3 Kontraindikace
• Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku uvedenou v bodě 6.1.
• Nádory ovaria, prsu, dělohy, hypofýzy nebo hypotalamu.
• Abnormální (nemenstruační) vaginální krvácení bez známé/diagnostikované příčiny.
• Primární selhání ovarií.
• Ovariální cysty nebo zvětšená ovaria.
• Ovariální hyperstimulační syndrom (OHSS) v anamnéze.
• Předchozí cyklus COS (kontrolované ovariální stimulace), který vedl podle ultrazvukového vyšetření k více než 30 folikulům o velikosti > 11 mm.
• Vstupní počet antrálních folikulů >20.
• Děložní myom neslučitelný s těhotenstvím.
• Malformace reprodukčních orgánů neslučitelné s těhotenstvím.
• Syndrom polycystických ovarií (PCOS).
4.4 Zvláštní upozornění a opatření pro použití
Vyšetření neplodnosti před zahájením léčby
Před zahájením léčby je nutno neplodnost páru náležitě vyšetřit. Ženy musí být vyšetřeny zejména s ohledem na hypotyreózu, adrenokortikální nedostatečnost, hyperprolaktinemii a nádory hypofýzy nebo hypotalamu a musí být podána příslušná specifická léčba. Před zahájením léčby je třeba také zhodnotit stavy, které jsou kontraindikací pro těhotenství.
Dávkování během stimulačního cyklu
Přípravek Elonva je určen pouze pro jednorázovou subkutánní injekci. Další injekce přípravku Elonva se ve stejném léčebném cyklu nesmějí podávat. (Viz také bod 4.2.)
Po podání přípravku Elonva se nesmí aplikovat žádný další přípravek obsahující FSH před 8. stimulačním dnem (viz také bod 4.2).
Renální insuficience
U pacientek s renální insuficiencí mírného, středně závažného nebo závažného stupně může být rychlost eliminace korifolitropinu alfa snížena (viz body 4.2 a 5.2). Užívání přípravku Elonva se proto u těchto žen nedoporučuje.
Nedoporučeno užívání s protokolem s použitím agonistů GnHR
Údaje o užívání přípravku Elonva v kombinaci s agonistou GnRH jsou omezené. Výsledky malého nekontrolovaného klinického hodnocení svědčí pro vyšší ovariální odpověď, než jaká bývá při kombinaci s antagonistou GnRH. Užívání přípravku Elonva se proto v kombinaci s agonistou GnRH nedoporučuje (viz také bod 4.2).
Ovariální hyperstimulační syndrom (OHSS)
OHSS je stav odlišný od nekomplikovaného zvětšení ovarií. Klinické známky a příznaky OHSS mírného a středního stupně jsou bolest břicha, nevolnost, průjem, mírné až střední zvětšení ovarií a ovariálních cyst. OHSS těžkého stupně může ohrožovat život. Klinické známky a příznaky těžkého OHSS jsou velké ovariální cysty, akutní bolest břicha, ascites, pleurální výpotek, hydrothorax, dušnost, oligurie, hematologické abnormality a nárůst tělesné hmotnosti. Ve vzácných případech se může ve spojitosti s OHSS objevit žilní nebo arteriální tromboembolismus. Ve spojitosti s OHSS byly také hlášeny přechodné abnormality testů jatemích funkcí naznačující dysfunkci jater s morfologickými změnami v jatemí biopsii nebo bez nich.
OHSS může být způsoben podáním hCG a těhotenstvím (endogenní hCG). Časný OHSS se obvykle objevuje během 10 dní po podání hCG a může souviset s nadměrnou ovariální odpovědí na stimulaci gonadotropinem. Pozdní OHSS vzniká po více než 10 dnech od aplikace hCG, jako důsledek hormonálních změn v těhotenství. Z důvodu rizika rozvoje OHSS musí být pacientky monitorovány po alespoň 2 týdny po podání hCG.
Ženy se známými rizikovými faktory pro vysokou ovariální odpověď mohou být zvlášť náchylné ke vzniku OHSS po léčbě přípravkem Elonva. Pro ženy, které podstupují svůj první cyklus ovariální stimulace a jejichž rizikové faktory jsou známy pouze částečně, je doporučený pečlivý dohled kvůli zachycení časných známek a příznaků OHSS.
Ke snížení rizika OHSS je nutno vývoj folikulů hodnotit ultrazvukem před léčbou a v pravidelných intervalech v průběhu léčby. Může být také užitečné současně stanovit sérové hladiny estradiolu. Při ART je riziko OHSS zvýšeno, pokud se vyvine 18 nebo více folikulů o průměru 11 mm nebo více. Když se vyvine celkem 30 folikulů nebo více, doporučuje se nepodávat hCG.
V závislosti na ovariální odpovědi lze pro snížení rizika OHSS zvážit následující opatření:
- pozdržet další stimulaci gonadotropinem na maximálně 3 dny (dobíhání);
- pozdržet podání hCG a ukončit léčebný cyklus
- při spouštění finální maturace oocytů podat dávku hCG nižší než 10 000 IU, např.
5 000 IU hCG nebo 250 mikrogramů rec-hCG (což je ekvivalent přibližně 6 500 IU);
- zrušit transfer čerstvého embrya a embrya kryoprezervovat;
- vyhnout se podání hCG pro podporu luteální fáze.
Je důležité dodržovat doporučenou dávku přípravku Elonva a léčebný cyklus a pečlivě monitorovat ovariální odpověď, aby se snížilo riziko OHSS. Pokud se vyvine OHSS, je třeba přijmout a následně dodržovat standardní a vhodná opatření pro zaléčení OHSS.
Torze ovaria
Po léčbě s gonadotropiny, včetně přípravku Elonva, byla hlášena torze ovaria. Torze ovaria může souviset s dalšími stavy, jako je OHSS, těhotenství, operace v abdominální oblasti v anamnéze, torze ovaria v anamnéze, ovariální cysty současné anebo v anamnéze. Poškození ovarií v důsledku sníženého přívodu krve lze předejít včasnou diagnózou a okamžitou detorzí.
Mnohočetná těhotenství
U všech terapií gonadotropiny, včetně přípravku Elonva, byla hlášena mnohočetná těhotenství a porody. Ženu i jejího partnera je nutno informovat o potenciálních rizicích pro matku (komplikace těhotenství a porodu) a novorozence (nízká porodní hmotnost), ještě než bude léčba zahájena. U žen podstupujících procedury v rámci ART je riziko mnohočetných těhotenství spojeno hlavně s počtem přenášených embryí.
Ektopické těhotenství
U neplodných žen podstupujících ART je zvýšená incidence ektopických těhotenství. Je důležité provést časné ultrazvukové potvrzení toho, že se jedná o nitroděložní těhotenství, a nikoliv o mimoděložní těhotenství.
Vrozené malformace
Incidence vrozených malformací po ART může být lehce vyšší než po spontánních otěhotněních. Za příčinu tohoto jevu se považují rozdíly v rodičovských charakteristikách (např. věk matky, charakteristika spermií) a vyšší incidence mnohočetných těhotenství.
Nádory ovarií a jiných částí reprodukčního systému
U žen, které při léčbě neplodnosti podstoupily léčebný režim vícekrát, byly hlášeny nádory ovarií a jiných částí reprodukčního systému, a to jak nezhoubné, tak zhoubné. Není však stanoveno, zda léčba gonadotropiny zvyšuje riziko těchto nádorů u neplodných žen.
Cévní komplikace
Po léčbě gonadotropiny, včetně přípravku Elonva, byly hlášeny tromboembolické příhody související nebo nesouvisející s OHSS. Intravaskulární trombóza, která může vzniknout v žilách nebo tepnách, může vést ke sníženému průtoku krve do životně důležitých orgánů nebo končetin. U žen s obecně uznávanými rizikovými faktory tromboembolických příhod, například s osobní nebo rodinnou anamnézou, těžkou obezitou nebo trombofilií, může léčba gonadotropiny dále zvyšovat toto riziko. U těchto žen je třeba zvážit prospěch z podávání gonadotropinu proti jeho rizikům. Je však třeba poznamenat, že těhotenství samo o sobě také přináší zvýšení rizika trombózy.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Žádné studie interakcí nebyly s přípravkem Elonva a jinými léčivými přípravky provedeny. Protože
korifolitropin alfa není substrátem enzymů cytochromu P450, nepředpokládají se žádné metabolické
interakce s jinými léčivými přípravky.
4.6 Fertilita, těhotenství a kojení
V případě náhodné expozice přípravku Elonva v průběhu těhotenství není dostatek klinických údajů, aby bylo možné vyloučit nežádoucí ovlivnění těhotenství. Ve studiích na zvířatech byla pozorována reprodukční toxicita (viz předklinické údaje o bezpečnosti v bodě 5.3). Užívání přípravku Elonva v průběhu těhotenství není indikováno.
Kojení
Užívání přípravku Elonva v průběhu kojení není indikováno.
Fertilita
Přípravek Elonva je indikován pro použití při neplodnosti (viz bod 4.1).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje nebyly provedeny.
Elonva může způsobovat závratě. Ženy by měly být informovány o tom, že pokud pociťují závratě, neměly by řídit nebo obsluhovat stroje.
Souhrn bezpečnostního profilu
Nejčastěji hlášenými nežádoucími účinky léčby přípravkem Elonva v průběhu klinických hodnocení (N=2397) jsou pánevní dyskomfort (6,0 %), OHSS (4,3 %, viz také bod 4.4), bolest hlavy (4,0 %), pánevní bolest (2,9 %), nevolnost (2,3 %), únava (1,5 %) a citlivost prsů (1,3 %).
Tabulkový seznam nežádoucích účinků
Níže uvedená tabulka ukazuje hlavní nežádoucí účinky u žen léčených přípravkem Elonva v klinických hodnoceních, uspořádané podle tříd orgánového systému a četnosti výskytu; velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1 000 až < 1/100), vzácné (> 1/10 000 až < 1/1 000 a velmi vzácné (< 1/10 000). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Třída orgánového systému |
Četnost |
Nežádoucí účinek |
|
Psychiatrické poruchy |
Méně časté |
Kolísání nálady |
|
Poruchy nervového systému |
Časté Méně časté |
Bolest hlavy Závrať |
|
Cévní poruchy |
Méně časté | |
|
Gastrointestinální poruchy |
Časté Méně časté | |
|
Poruchy svalové a kosterní |
Méně časté |
Bolest v zádech |
|
soustavy a pojivové tkáně | ||
|
Stavy spojené s těhotenstvím, |
Méně časté |
Spontánní potrat |
|
šestinedělím a perinatálním obdobím | ||
|
Poruchy reprodukčního systému a prsu |
Časté Méně časté |
OHSS (ovariální hyperstimulační syndrom), bolest v pánevní oblasti, dyskomfort v pánevní oblasti, citlivost prsů Torze ovaria, bolest v děložních |
adnexech, předčasná ovulace, bolest prsů_
|
Celkové poruchy a reakce |
Časté |
Únava |
|
v místě aplikace |
Méně časté |
Hematom v místě injekce, bolest v místě injekce, zvýšená dráždivost |
|
Vyšetření |
Méně časté |
Zvýšení alanin-aminotransferázy, zvýšení aspartát-aminotransferázy |
|
Poranění, otravy a procedurální komplikace |
Méně časté |
Bolest při zákroku |
Popis vybraných nežádoucích účinků
Navíc bylo hlášeno ektopické těhotenství a mnohočetná těhotenství. Tyto jevy pravděpodobně souvisejí s ART nebo následným těhotenstvím.
Ve vzácných případech byla léčba přípravkem Elonva, stejně jako léčba dalšími gonadotropiny, spojena s rozvojem tromboembolismu.
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Více než jedna injekce přípravku Elonva v rámci jednoho léčebného cyklu nebo příliš vysoká dávka přípravku Elonva a/nebo (rec)FSH mohou zvýšit riziko OHSS. Opatření ke snížení rizika OHSS viz bod 4.4.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: pohlavní hormony a modulátory pohlavního systému, gonadotropiny ATC kód: G03GA09
Mechanismus účinku
Korifolitropin alfa je navržen jako látka stimulující folikuly s prodlouženými účinky se stejným farmakodynamickým profilem jako (rec)FSH, ale s výrazně prodlouženým trváním aktivity FSH. Vzhledem k jeho schopnosti spustit a udržet růst mnohočetných folikulů po celý týden, může jednorázová subkutánní injekce doporučené dávky přípravku Elonva v léčebném cyklu COS nahradit prvních sedm injekcí jakéhokoli denně podávaného přípravku (rec)FSH. Dlouhého trvání aktivity FSH bylo dosaženo přidáním peptidu s terminální karboxyskupinou z P-podjednotky lidského choriogonadotropinu (hCG) k P-řetězci lidského FSH. Korifolitropin alfa nevykazuje žádnou vnitřní LH/hCG aktivitu.
Klinická účinnost a bezpečnost
Ve třech randomizovaných, dvojitě zaslepených klinických studiích byla porovnávána léčba jednorázově podávanou subkutánní injekcí přípravku Elonva, 100 mikrogramů (studie ENSURE) nebo 150 mikrogramů (studie ENGAGE a PURSUE), během prvních sedmi dnů COS s léčbou denní dávkou 150, 200, respektive 300 IU recFSH. V každém ze tří klinických hodnocení byla tlumena hypofýza antagonistou GnRH (injekce ganirelix-acetátu v denní dávce 0,25 mg).
Ve studii ENSURE bylo v rámci programu ART 396 zdravých, normálně ovulujících žen ve věku 18 až 36 let s tělesnou hmotností 60 kg nebo nižší léčeno v jednom cyklu 100 mikrogramy přípravku Elonva a supresí hypofýzy antagonistou GnRH. Primárním kritériem hodnocení účinnosti byl počet získaných oocytů. Medián celkového trvání stimulace byl v obou skupinách 9 dní, což ukazuje, že k dokončení stimulace ovárií byly od 8. dne stimulace potřebné dva dny podávání recFSH (recFSH se v této studii podával i v den podání hCG).
Ve studii ENGAGE bylo v rámci programu ART 1506 zdravých, normálně ovulujících žen ve věku 18 až 36 let s tělesnou hmotností vyšší než 60 kg a nižší než nebo rovnou 90 kg léčeno v jednom cyklu 150 mikrogramy přípravku Elonva a supresí hypofýzy antagonistou GnRH. Souběžnými primárními kritérii hodnocení účinnosti byla míra trvajících těhotenství a počet získaných oocytů. Medián celkového trvání stimulace byl v obou skupinách 9 dní, což ukazuje, že k dokončení stimulace ovárií byly od 8. dne stimulace potřebné dva dny podávání recFSH (recFSH se v této studii podával i v den podání hCG).
Ve studii PURSUE bylo v rámci programu ART 1390 zdravých, normálně ovulujících žen ve věku 35 až 42 let s tělesnou hmotností 50 kg nebo vyšší léčeno v jednom cyklu 150 mikrogramy přípravku Elonva a supresí hypofýzy antagonistou GnRH. Primárním kritériem hodnocení účinnosti byla míra vitálních těhotenství. Počet získaných oocytů byl klíčovým sekundárním kritériem hodnocení účinnosti. Medián celkového trvání stimulace byl v obou skupinách 9 dní, což ukazuje, že k dokončení stimulace ovárií byl od 8. dne stimulace potřebný jeden den podávání recFSH (recFSH se v této studii v den podání hCG nepodával).
Počet získaných oocytů
Ve všech třech studiích vedla léčba jednou injekcí přípravku Elonva 100 nebo 150 mikrogramů po prvních sedm dnů COS k vyššímu počtu získaných oocytů v porovnání s každodenní dávkou recFSH. Rozdíly byly nicméně v mezích předem definované ekvivalence (ENGAGE a ENSURE) nebo non-inferiority (PURSUE). Viz Tabulka 1 dále.
Tabulka 1: Průměrná hodnota počtu oocytů získaných v populaci všech zařazených subjektů (ITT) studií ENSURE, ENGAGE a PURSUE
|
Parametr |
ENSURE (18 - 36 let věku) (tělesná hmotnost 60 kg nebo nižší) |
ENGAGE (18-36 let věku) (tělesná hmotnost vyšší než 60 kg a nižší než nebo rovna 90 kg) |
PURSUE (35 - 42 let věku) (tělesná hmotnost 50 kg nebo vyšší) | |||
|
Elonva 100 pg |
recFSH 150 IU |
Elonva 150 Pg |
recFSH 200 IU |
Elonva 150 Pg |
recFSH 300 IU | |
|
N = 268 |
N = 128 |
N = 756 |
N = 750 |
N = 694 |
N = 696 | |
|
Průměrná hodnota počtu oocytů |
13,3 |
10,6 |
13,8 |
12,6 |
10,7 |
10,3 |
|
Rozdíl [95% interval spolehlivosti] |
2,5 [1,2, 3,9] |
1,2 [0,5, 1,9] |
0,5 [-0,2, 1,2] | |||
Těhotenství z fresh cyklů ve studiích ENGAGE a PURSUE
Ve studii ENGAGE byla non-inferiorita prokázána četností trvajících těhotenství při porovnání přípravku Elonva a recFSH, přičemž četnost trvajících těhotenství byla definována jako přítomnost nejméně jednoho plodu se srdeční aktivitou zjišťovanou nejméně 10 týdnů po přenosu embrya.
Ve studii PURSUE byla non-inferiorita prokázána četností vitálních těhotenství při porovnání přípravku Elonva a recFSH, přičemž četnost vitálních těhotenství byla definována jako procento subjektů s nejméně jedním plodem se srdeční aktivitou zjišťovanou 5 až 6 týdnů po přenosu embrya.
Výsledky studií ENGAGE a PURSUE týkající se těhotenství z fresh cyklů jsou shrnuty v Tabulce 2 níže.
Primárním kritériem hodnocení účinnosti ve studii ENGAGE byla trvající těhotenství (zjišťováno nejméně 10 týdnů po přenosu embrya).
|
Parametr |
Fresh cykly ve studii ENGAGE^ (18 až 36 let věku) (tělesná hmotnost vyšší než 60 kg a nižší než nebo rovna 90 kg) |
Fresh cykly ve studii PURSUE* (35 až 42 let věku) (tělesná hmotnost 50 kg nebo vyšší) | ||||
|
Elonva 150 pg |
recFSH 200 IU |
Rozdíl [95% interval spolehlivosti] |
Elonva 150 pg |
recFSH 300 IU |
Rozdíl [95% interval spolehlivosti] | |
|
N = 756 |
N = 750 |
N = 694 |
N = 696 | |||
|
Míra vitálních těhotenství |
39,9 % |
39,1 % |
1,1 [-3,8, 5,9] |
23,9 % |
26,9 % |
-3,0 [-7,3, 1,4] |
|
Míra trvajících těhotenství |
39,0 % |
38,1 % |
1,1 [-3,8, 5,9] |
22,2 % |
24,0 % |
-1,9 [-6,1, 2,3] |
|
Míra živých porodů* |
35,6 % |
34,4 % |
1,3 [-3,5, 6,1] |
21,3 % |
23,4 % |
-2,3 [-6,5, 1,9] |
íprimárním kritériem hodnocení účinnosti ve studii PURSUE byla četnost vitálních těhotenství definovaná jako procento subjektů s nejméně jedním plodem se srdeční aktivitou zjišťovanou 5 až 6 týdnů po přenosu embrya. *Četnost živých porodů byla ve studiích ENGAGE a PURSUE sekundárním kritériem hodnocení účinnosti.
V těchto klinických studiích byl bezpečnostní profil jednorázové injekce přípravku Elonva srovnatelný s denně podávanými injekcemi recFSH.
Těhotenství z cyklů kryoembryotransferu (FTET frozen-thawed embryo transfer]) ve studiích ENGAGE and PURSUE
Studie následného sledování FTET v ENGAGE zahrnovala ženy, které měly alespoň jedno embryo rozmražené pro použití minimálně 1 rok od kryokonzervace. Průměrný počet embryí transferovaných v průběhu cyklů FTET ve studii ENGAGE byl 1,7 v obou léčených skupinách.
Studie následného sledování FTET v PURSUE zahrnovala ženy, které měly alespoň jedno embryo rozmražené pro použití během 2 let od data poslední kryokonzervace pro tuto studii. Průměrný počet embryí transferovaných v průběhu cyklů FTET ve studii ENGAGE byl 2,4 v obou léčených skupinách. Tato studie také poskytla bezpečnostní údaje týkající se novorozenců narozených z kryokonzervovaných embryí.
Maximální počet FTET cyklů byl 5 ve studii následného sledování FTET v ENGAGE a 4 ve studii následného sledování FTET v PURSUE. Výsledky studií ENGAGE a PURSUE týkající se těhotenství z prvních dvou FTET cyklů jsou shrnuty v Tabulce 3 níže.
|
FTET cykly ve studii ENGAGE (18-36 let) (tělesná váha vyšší než 60 kg a nižší nebo rovna 90 kg) |
FTET cykly ve (35-4 (tělesná váha vyšš 50 |
studii PURSUE 2 let) í než nebo rovna kg) | ||||||||||
|
Elonva _150 ůg_ |
recFS 200 II |
H J |
Elonva _150 ůg_ |
recFSH 300 IU | ||||||||
|
n |
N |
% |
n |
N |
% |
n |
N |
% |
n |
N |
% | |
|
FTET cyklus 1a | ||||||||||||
|
Trvající |
55 |
148 |
37,2 |
45 |
147 |
30,6 |
43 |
152 |
28,3 |
42 |
145 |
29,0 |
|
Živý porod |
- |
- |
- |
- |
- |
- |
43 |
152 |
28,3 |
41 |
145 |
28,3 |
|
FTET cyklus 2a | ||||||||||||
|
Trvající |
9 |
38 |
23,7 |
9 |
31 |
29,0 |
8 |
23 |
34,8 |
6 |
14 |
42,9 |
|
Živý porod |
- |
- |
- |
- |
- |
- |
8 |
23 |
34,8 |
6 |
14 |
42,9 |
n = počet subjektů dané události; N = celkový počet subjektů a na embryotransfer.
Kongenitální malformace hlášené u novorozenců narozených po cyklu kryoembryotransferu (FTET [frozen-thawed embryo transfer])
Po používání přípravku Elonva bylo narozeno po cyklu FTET 61 novorozenců a po fresh ART cyklech bylo narozeno 630 novorozenců. Míry výskytu kongenitálních malformací (kombinace závažných a minoritních) hlášených u novorozenců narozených po cyklu FTET (16,4 %) byly podobné těm, hlášeným u novorozenců narozených po fresh ART cyklech (19,5 %).
Imunogenita
Z 2511 žen léčených přípravkem Elonva, které byly po léčbě vyšetřovány na tvorbu protilátek, byla u čtyř (0,16 %) prokázána tvorba protilátek, včetně tří, které byly působení přípravku Elonva vystaveny jednou, a jedna žena byla jeho působení vystavena dvakrát. Ve všech případech tyto protilátky nebyly neutralizující a neinterferovaly s odpovědí na stimulaci nebo s normálními fyziologickými odpověďmi osy hypothalamus-hypofýza-ovária. Dvě z těchto čtyř žen otěhotněly během téhož léčebného cyklu, ve kterém došlo k detekci protilátek, což naznačuje, že přítomnost neneutralizujících protilátek po stimulaci přípravkem Elonva není klinicky relevantní.
Pediatrická populace
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem Elonva u jedné nebo více podskupin pediatrické populace s hypogonadotropním hypogonadismem (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Farmakokinetické parametry korifolitropinu alfa byly hodnoceny po subkutánním podání u žen podstupujících léčebný cyklus kontrolované stimulace ovárií. 1
Tělesná hmotnost je určujícím faktorem expozice korifolitropinu alfa. Expozice korifolitropinu alfa po jedné subkutánní injekci je 665 hodin*ng/ml (AUC, 426 - 1037 hodin*ng/mť) a je po podání 100 mikrogramů korifolitropinu alfa ženám s tělesnou hmotností 60 kilogramů nebo nižší podobná jako po podání 150 mikrogramů korifolitropinu alfa ženám s tělesnou hmotností vyšší než 60 kilogramů.
Absorpce
Po jednorázové subkutánní injekci přípravku Elonvaje maximální sérová koncentrace korifolitropinu alfa 4,24 ng/ml (2,49 - 7,21 ng/ml2) a dosahuje se po 44 hodinách (35 - 57 hodin2) po podání dávky. Absolutní biologická dostupnost je 58 % (48 - 70 %2).
Distribuce
Distribuce, metabolismus a eliminace korifolitropinu alfa jsou velmi podobné jako u jiných gonadotropinů, jako jsou FSH, hCG a LH. Po absorpci do krve je korifolitropin alfa distribuován hlavně do ovarií a do ledvin. Distribuční objem v ustáleném stavu je 9,2 l (6,5 - 13,1 l2). Expozice korifolitropinu alfa se v rozmezí 60 mikrogramů až 240 mikrogramů zvyšuje proporcionálně s dávkou.
Eliminace
Korifolitropin alfa má eliminační poločas 70 hodin (59 - 82 hodin2) a clearence 0,13 l/hod (0,10 -0,18 l/hod2). Korifolitropin alfa se vylučuje převážně ledvinami a jeho rychlost eliminace může být snížena u pacientek s renální insuficiencí (viz body 4.2 a 4.4). Jaterní metabolismus přispívá k vylučování korifolitropinu alfa jen v menší míře.
Další zvláštní populace
Porucha funkce jater
Ačkoliv nejsou k dispozici údaje od pacientek se sníženou funkcí jater, není pravděpodobné, že by poškození jater narušovalo farmakokinetický profil korifolitropinu alfa.
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinické údaje z konvenčních studií toxicity a bezpečnostní farmakologie po jednorázové dávce a opakovaných dávkách neodhalily žádná zvláštní rizika pro lidi.
Studie reprodukční toxicity u potkanů a králíků indikují, že korifolitropin alfa nepříznivě neovlivňuje fertilitu. Podání korifolitropinu alfa potkanům a králíkům před pářením a hned po páření a v průběhu časné březosti vedlo k embryotoxicitě. U králíků byla pozorována teratogenita, pokud byl přípravek podán před pářením. Embryotoxicita i teratogenita jsou připisovány superovulačnímu stavu zvířete, které není schopno unést více embryí, než je fyziologické. Relevance těchto nálezů pro klinické užívání přípravku Elonva je omezená.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Natrium-citrát Sacharóza Polysorbát 20 Metionin
Hydroxid sodný (pro úpravu pH)
Kyselina chlorovodíková (pro úpravu pH)
Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Pro usnadnění je možné, aby pacientka přípravek skladovala při teplotě 25 °C nebo nižší po dobu nepřesahující 1 měsíc.
Uchovávejte injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a velikost balení
Elonva se dodává v předplněných 1ml injekčních stříkačkách typu luer-lock (hydrolytické sklo typu I), uzavřených pístem z brombutylového elastomeru a koncovou krytkou. Injekční stříkačka je vybavena automatickým bezpečnostním systémem, který předchází poranění při píchnutí jehlou po použití, a je zabalena společně se sterilní injekční jehlou. Jedna předplněná injekční stříkačka obsahuje 0,5 ml injekčního roztoku.
Přípravek Elonva je dostupný v balení po 1 předplněné injekční stříkačce.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Přípravek Elonva nepoužívejte, pokud není roztok čirý.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/09/609/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 25. ledna 2010
Datum posledního prodloužení registrace: 22. srpna 2014
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
NÁZEV PŘÍPRAVKU
1.
Elonva 150 mikrogramů injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna předplněná injekční stříkačka obsahuje 150 mikrogramů corifollitropinum alfa* v 0,5 ml injekčního roztoku.
*korifolitropin alfa je glykoprotein produkovaný ovariálními buňkami čínských křečků technologií rekombinantní DNA.
Pomocná látka/Pomocné látky se známým účinkem:
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) na injekci, tzn. je v podstatě „bezsodíkový“.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok (injekce). Čirý bezbarvý vodný roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Elonva je indikován pro kontrolovanou stimulaci ovarií (Controlled Ovarian Stimulation, COS) v kombinaci s antagonistou hormonu uvolňujícího gonadotropiny (GnRH), s cílem navodit vývoj mnohočetných folikulů u žen zapojených do programu asistované reprodukce (Assisted Reproductive Technology, ART).
4.2 Dávkování a způsob podání
Léčba přípravkem Elonva se musí zahájit pod dohledem lékaře se zkušenostmi v léčbě problémů s plodností.
Dávkování
Při léčbě žen ve fertilním věku je dávka přípravku Elonva založena na hmotnosti a věku.
- Pro ženy, které váží 60 kg nebo méně a kterým je 36 let nebo méně, se doporučuje jedna 100mikrogramová dávka.
- Jedna 150mikrogramová dávka se doporučuje pro ženy:
- vážící více než 60 kilogramů bez ohledu na věk.
- vážící 50 kilogramů nebo více ve věku nad 36 let.
Ženy, kterým je více než 36 let a které váží méně než 50 kg, nebyly hodnoceny.
|
Tělesná hmotnost | ||||
|
Méně než 50 kg |
50 - 60 kg |
Více než 60 kg | ||
|
Věk |
36 let nebo méně |
100 mikrogramů |
100 mikrogramů |
150 mikrogramů |
|
Více než 36 let |
Nebylo hodnoceno. |
150 mikrogramů |
150 mikrogramů | |
Doporučené dávky přípravku Elonva byly stanoveny pouze v léčebném cyklu s antagonistou GnRH, který se podával od 5. nebo 6. dne stimulace (viz také body 4.1, 4.4 a 5.1).
1. den stimulace:
Přípravek Elonva se podává jako jednorázová subkutánní injekce, nejlépe do břišní stěny, v průběhu časné folikulární fáze menstruačního cyklu.
5. nebo 6. den stimulace:
Léčbu antagonistou GnRH je nutno zahájit 5. nebo 6. den stimulace v závislosti na ovariální odpovědi, tj. podle počtu a velikosti zrajících folikulů. Může být také užitečné současně stanovit sérové hladiny estradiolu. Antagonista GnRH je používán pro prevenci předčasného vzestupu luteinizačního hormonu (LH).
8. den stimulace:
Za sedm dní po injekci přípravku Elonva, v první den stimulace, lze pokračovat v COS léčbě denně podávanými injekcemi (rekombinantního) folikuly stimulujícího hormonu [(rec)FSH] až do dosažení kritéria pro spuštění finální maturace oocytu (3 folikuly >17 mm). Denní dávka (rec)FSH může záviset na ovariální odpovědi. U těch žen, které odpovídají normálně, se doporučuje denní dávka 150 IU (rec)FSH. Podání (rec)FSH v den aplikace lidského choriogonadotropinu (human Chorionic Gonadotropin, hCG) lze v závislosti na ovariální odpovědi vynechat. Zpravidla se adekvátního vývoje folikulů dosahuje průměrně do devátého dne léčby (rozpětí 6 až 18 dní).
Jakmile jsou pozorovány tři folikuly o velikosti >17 mm, podává se ve stejný nebo následující den k navození finální maturace oocytů jednorázová injekce 5 000 až 10 000 IU hCG. V případě nadměrné ovariální odpovědi postupujte podle doporučení v bodě 4.4, aby se snížilo riziko rozvoje ovariálního hyperstimulačního syndromu (OHSS).
Zvláštní populace
Porucha funkce ledvin
U pacientek s renální insuficiencí nebyla provedena žádná klinická hodnocení. Protože u pacientek s renální insuficiencí může být rychlost eliminace korifolitropinu alfa snížena, užívání přípravku Elonva se u těchto žen nedoporučuje (viz body 4.4 a 5.2).
Porucha funkce jater
Ačkoliv údaje od pacientek s poškozenými játry nejsou k dispozici, není pravděpodobné, že by poškození jater ovlivňovalo vylučování korifolitropinu alfa (viz bod 5.2).
Pediatrická populace
V rámci schválené indikace není použití přípravku Elonva u pediatrické populace relevantní.
Způsob podání
Podkožní injekci přípravku Elonva může aplikovat žena sama nebo její partner za předpokladu, že od lékaře obdrží náležité pokyny. Přípravek Elonva mohou aplikovat samostatně pouze ženy, které jsou dobře motivovány, dostatečně vyškoleny a které mají možnost konzultace s odborníkem.
4.3 Kontraindikace
• Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku uvedenou v bodě 6.1.
• Nádory ovaria, prsu, dělohy, hypofýzy nebo hypotalamu.
• Abnormální (nemenstruační) vaginální krvácení bez známé/diagnostikované příčiny.
• Primární selhání ovarií.
• Ovariální cysty nebo zvětšená ovaria.
• Ovariální hyperstimulační syndrom (OHSS) v anamnéze.
• Předchozí cyklus COS (kontrolované ovariální stimulace), který vedl podle ultrazvukového vyšetření k více než 30 folikulům o velikosti > 11 mm.
• Vstupní počet antrálních folikulů > 20.
• Děložní myom neslučitelný s těhotenstvím.
• Malformace reprodukčních orgánů neslučitelné s těhotenstvím.
• Syndrom polycystických ovarií (PCOS).
4.4 Zvláštní upozornění a opatření pro použití
Vyšetření neplodnosti před zahájením léčby
Před zahájením léčby je nutno neplodnost páru náležitě vyšetřit. Ženy musí být vyšetřeny zejména s ohledem na hypotyreózu, adrenokortikální nedostatečnost, hyperprolaktinemii a nádory hypofýzy nebo hypotalamu a musí být podána příslušná specifická léčba. Před zahájením léčby je třeba také zhodnotit stavy, které jsou kontraindikací pro těhotenství.
Dávkování během stimulačního cyklu
Přípravek Elonva je určen pouze pro jednorázovou subkutánní injekci. Další injekce přípravku Elonva se ve stejném léčebném cyklu nesmějí podávat. (Viz také bod 4.2.)
Po podání přípravku Elonva se nesmí aplikovat žádný další přípravek obsahující FSH před 8. stimulačním dnem (viz také bod 4.2).
Renální insuficience
U pacientek s renální insuficiencí mírného, středně závažného nebo závažného stupně může být rychlost eliminace korifolitropinu alfa snížena (viz body 4.2 a 5.2). Užívání přípravku Elonva se proto u těchto žen nedoporučuje.
Nedoporučeno užívání s protokolem s použitím agonistů GnHR
Údaje o užívání přípravku Elonva v kombinaci s agonistou GnRH jsou omezené. Výsledky malého nekontrolovaného klinického hodnocení svědčí pro vyšší ovariální odpověď, než jaká bývá při kombinaci s antagonistou GnRH. Užívání přípravku Elonva se proto v kombinaci s agonistou GnRH nedoporučuje (viz také bod 4.2).
Ovariální hyperstimulační syndrom (OHSS)
OHSS je stav odlišný od nekomplikovaného zvětšení ovarií. Klinické známky a příznaky OHSS mírného a středního stupně jsou bolest břicha, nevolnost, průjem, mírné až střední zvětšení ovarií a ovariálních cyst. OHSS těžkého stupně může ohrožovat život. Klinické známky a příznaky těžkého OHSS jsou velké ovariální cysty, akutní bolest břicha, ascites, pleurální výpotek, hydrothorax, dušnost, oligurie, hematologické abnormality a nárůst tělesné hmotnosti. Ve vzácných případech se může ve spojitosti s OHSS objevit žilní nebo arteriální tromboembolismus. Ve spojitosti s OHSS byly také hlášeny přechodné abnormality testů jatemích funkcí naznačující dysfunkci jater s morfologickými změnami v jatemí biopsii nebo bez nich.
OHSS může být způsoben podáním hCG a těhotenstvím (endogenní hCG). Časný OHSS se obvykle objevuje během 10 dní po podání hCG a může souviset s nadměrnou ovariální odpovědí na stimulaci gonadotropinem. Pozdní OHSS vzniká po více než 10 dnech od aplikace hCG, jako důsledek hormonálních změn v těhotenství. Z důvodu rizika rozvoje OHSS musí být pacientky monitorovány po alespoň 2 týdny po podání hCG.
Ženy se známými rizikovými faktory pro vysokou ovariální odpověď mohou být zvlášť náchylné ke vzniku OHSS po léčbě přípravkem Elonva. Pro ženy, které podstupují svůj první cyklus ovariální stimulace a jejichž rizikové faktory jsou známy pouze částečně, je doporučený pečlivý dohled kvůli zachycení časných známek a příznaků OHSS.
Ke snížení rizika OHSS je nutno vývoj folikulů hodnotit ultrazvukem před léčbou a v pravidelných intervalech v průběhu léčby. Může být také užitečné současně stanovit sérové hladiny estradiolu. Při ART je riziko OHSS zvýšeno, pokud se vyvine 18 nebo více folikulů o průměru 11 mm nebo více. Když se vyvine celkem 30 folikulů nebo více, doporučuje se nepodávat hCG.
V závislosti na ovariální odpovědi lze pro snížení rizika OHSS zvážit následující opatření:
- pozdržet další stimulaci gonadotropinem na maximálně 3 dny (dobíhání);
- pozdržet podání hCG a ukončit léčebný cyklus
- při spouštění finální maturace oocytů podat dávku hCG nižší než 10 000 IU, např.
5 000 IU hCG nebo 250 mikrogramů rec-hCG (což je ekvivalent přibližně 6 500 IU);
- zrušit transfer čerstvého embrya a embrya kryoprezervovat;
- vyhnout se podání hCG pro podporu luteální fáze.
Je důležité dodržovat doporučenou dávku přípravku Elonva a léčebný cyklus a pečlivě monitorovat ovariální odpověď, aby se snížilo riziko OHSS. Pokud se vyvine OHSS, je třeba přijmout a následně dodržovat standardní a vhodná opatření pro zaléčení OHSS.
Torze ovaria
Po léčbě s gonadotropiny, včetně přípravku Elonva, byla hlášena torze ovaria. Torze ovaria může souviset s dalšími stavy, jako je OHSS, těhotenství, operace v abdominální oblasti v anamnéze, torze ovaria v anamnéze, ovariální cysty současné anebo v anamnéze. Poškození ovarií v důsledku sníženého přívodu krve lze předejít včasnou diagnózou a okamžitou detorzí.
Mnohočetná těhotenství
U všech terapií gonadotropiny, včetně přípravku Elonva, byla hlášena mnohočetná těhotenství a porody. Ženu i jejího partnera je nutno informovat o potenciálních rizicích pro matku (komplikace těhotenství a porodu) a novorozence (nízká porodní hmotnost), ještě než bude léčba zahájena. U žen podstupujících procedury v rámci ART je riziko mnohočetných těhotenství spojeno hlavně s počtem přenášených embryí.
Ektopické těhotenství
U neplodných žen podstupujících ART je zvýšená incidence ektopických těhotenství. Je důležité provést časné ultrazvukové potvrzení toho, že se jedná o nitroděložní těhotenství, a nikoliv o mimoděložní těhotenství.
Vrozené malformace
Incidence vrozených malformací po ART může být lehce vyšší než po spontánních otěhotněních. Za příčinu tohoto jevu se považují rozdíly v rodičovských charakteristikách (např. věk matky, charakteristika spermií) a vyšší incidence mnohočetných těhotenství.
Nádory ovarií a jiných částí reprodukčního systému
U žen, které při léčbě neplodnosti podstoupily léčebný režim vícekrát, byly hlášeny nádory ovarií a jiných částí reprodukčního systému, a to jak nezhoubné, tak zhoubné. Není však stanoveno, zda léčba gonadotropiny zvyšuje riziko těchto nádorů u neplodných žen.
Cévní komplikace
Po léčbě gonadotropiny, včetně přípravku Elonva, byly hlášeny tromboembolické příhody související nebo nesouvisející s OHSS. Intravaskulární trombóza, která může vzniknout v žilách nebo tepnách, může vést ke sníženému průtoku krve do životně důležitých orgánů nebo končetin. U žen s obecně uznávanými rizikovými faktory tromboembolických příhod, například s osobní nebo rodinnou anamnézou, těžkou obezitou nebo trombofilií, může léčba gonadotropiny dále zvyšovat toto riziko. U těchto žen je třeba zvážit prospěch z podávání gonadotropinu proti jeho rizikům. Je však třeba poznamenat, že těhotenství samo o sobě také přináší zvýšení rizika trombózy.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Žádné studie interakcí nebyly s přípravkem Elonva a jinými léčivými přípravky provedeny. Protože
korifolitropin alfa není substrátem enzymů cytochromu P450, nepředpokládají se žádné metabolické
interakce s jinými léčivými přípravky.
4.6 Fertilita, těhotenství a kojení
V případě náhodné expozice přípravku Elonva v průběhu těhotenství není dostatek klinických údajů, aby bylo možné vyloučit nežádoucí ovlivnění těhotenství. Ve studiích na zvířatech byla pozorována reprodukční toxicita (viz předklinické údaje o bezpečnosti v bodě 5.3). Užívání přípravku Elonva v průběhu těhotenství není indikováno.
Kojení
Užívání přípravku Elonva v průběhu kojení není indikováno.
Fertilita
Přípravek Elonva je indikován pro použití při neplodnosti (viz bod 4.1).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje nebyly provedeny.
Elonva může způsobovat závratě. Ženy by měly být informovány o tom, že pokud pociťují závratě, neměly by řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nejčastěji hlášenými nežádoucími účinky léčby přípravkem Elonva v průběhu klinických hodnocení (N=2397) jsou pánevní dyskomfort (6,0 %), OHSS (4,3 %, viz také bod 4.4), bolest hlavy (4,0 %), pánevní bolest (2,9 %), nevolnost (2,3 %), únava (1,5 %) a citlivost prsů (1,3 %).
Tabulkový seznam nežádoucích účinků
Níže uvedená tabulka ukazuje hlavní nežádoucí účinky u žen léčených přípravkem Elonva v klinických hodnoceních, uspořádané podle tříd orgánového systému a četnosti výskytu; velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1 000 až < 1/100), vzácné (> 1/10 000 až < 1/1 000 a velmi vzácné (< 1/10 000). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Třída orgánového systému |
Četnost |
Nežádoucí účinek |
|
Psychiatrické poruchy |
Méně časté |
Kolísání nálady |
|
Poruchy nervového systému |
Časté Méně časté |
Bolest hlavy Závrať |
|
Cévní poruchy |
Méně časté | |
|
Gastrointestinální poruchy |
Časté Méně časté | |
|
Poruchy svalové a kosterní |
Méně časté |
Bolest v zádech |
|
soustavy a pojivové tkáně | ||
|
Stavy spojené s těhotenstvím, |
Méně časté |
Spontánní potrat |
|
šestinedělím a perinatálním obdobím | ||
|
Poruchy reprodukčního systému a prsu |
Časté Méně časté |
OHSS (ovariální hyperstimulační syndrom), bolest v pánevní oblasti, dyskomfort v pánevní oblasti, citlivost prsů Torze ovaria, bolest v děložních |
adnexech, předčasná ovulace, bolest prsů_
|
Celkové poruchy a reakce v místě aplikace |
Časté |
Únava |
|
Méně časté |
Hematom v místě injekce, bolest v místě injekce, zvýšená dráždivost | |
|
Vyšetření |
Méně časté |
Zvýšení |
alaninaminotransferázy,
zvýšení
aspartátaminotransferázy
|
Poranění, otravy a |
Méně časté |
Bolest při zákroku |
|
procedurální komplikace |
Popis vybraných nežádoucích účinků
Navíc bylo hlášeno ektopické těhotenství a mnohočetná těhotenství. Tyto jevy pravděpodobně souvisejí s ART nebo následným těhotenstvím.
Ve vzácných případech byla léčba přípravkem Elonva, stejně jako léčba dalšími gonadotropiny, spojena s rozvojem tromboembolismu.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Více než jedna injekce přípravku Elonva v rámci jednoho léčebného cyklu nebo příliš vysoká dávka přípravku Elonva a/nebo (rec)FSH mohou zvýšit riziko OHSS. Opatření ke snížení rizika OHSS viz bod 4.4.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: pohlavní hormony a modulátory pohlavního systému, gonadotropiny ATC kód: G03GA09
Mechanismus účinku
Korifolitropin alfa je navržen jako látka stimulující folikuly s prodlouženými účinky se stejným farmakodynamickým profilem jako (rec)FSH, ale s výrazně prodlouženým trváním aktivity FSH. Vzhledem k jeho schopnosti spustit a udržet růst mnohočetných folikulů po celý týden, může jednorázová subkutánní injekce doporučené dávky přípravku Elonva v léčebném cyklu COS nahradit prvních sedm injekcí jakéhokoli denně podávaného přípravku (rec)FSH. Dlouhého trvání aktivity FSH bylo dosaženo přidáním peptidu s terminální karboxyskupinou z P-podjednotky lidského choriogonadotropinu (hCG) k P-řetězci lidského FSH. Korifolitropin alfa nevykazuje žádnou vnitřní LH/hCG aktivitu.
Klinická účinnost a bezpečnost
Ve třech randomizovaných, dvojitě zaslepených klinických studiích byla porovnávána léčba jednorázově podávanou subkutánní injekcí přípravku Elonva, 100 mikrogramů (studie ENSURE) nebo 150 mikrogramů (studie ENGAGE a PURSUE), během prvních sedmi dnů COS s léčbou denní dávkou 150, 200, respektive 300 IU recFSH. V každém ze tří klinických hodnocení byla tlumena hypofýza antagonistou GnRH (injekce ganirelix-acetátu v denní dávce 0,25 mg).
Ve studii ENSURE bylo v rámci programu ART 396 zdravých, normálně ovulujících žen ve věku 18 až 36 let s tělesnou hmotností 60 kg nebo nižší léčeno v jednom cyklu 100 mikrogramy přípravku Elonva a supresí hypofýzy antagonistou GnRH. Primárním kritériem hodnocení účinnosti byl počet získaných oocytů. Medián celkového trvání stimulace byl v obou skupinách 9 dní, což ukazuje, že k dokončení stimulace ovárií byly od 8. dne stimulace potřebné dva dny podávání recFSH (recFSH se v této studii podával i v den podání hCG).
Ve studii ENGAGE bylo v rámci programu ART 1506 zdravých, normálně ovulujících žen ve věku 18 až 36 let s tělesnou hmotností vyšší než 60 kg a nižší než nebo rovnou 90 kg léčeno v jednom cyklu 150 mikrogramy přípravku Elonva a supresí hypofýzy antagonistou GnRH. Souběžnými primárními kritérii hodnocení účinnosti byla míra trvajících těhotenství a počet získaných oocytů. Medián celkového trvání stimulace byl v obou skupinách 9 dní, což ukazuje, že k dokončení stimulace ovárií
byly od 8. dne stimulace potřebné dva dny podávání recFSH (recFSH se v této studii podával i v den podání hCG).
Ve studii PURSUE bylo v rámci programu ART 1390 zdravých, normálně ovulujících žen ve věku 35 až 42 let s tělesnou hmotností 50 kg nebo vyšší léčeno v jednom cyklu 150 mikrogramy přípravku Elonva a supresí hypofýzy antagonistou GnRH. Primárním kritériem hodnocení účinnosti byla míra vitálních těhotenství. Počet získaných oocytů byl klíčovým sekundárním kritériem hodnocení účinnosti. Medián celkového trvání stimulace byl v obou skupinách 9 dní, což ukazuje, že k dokončení stimulace ovárií byl od 8. dne stimulace potřebný jeden den podávání recFSH (recFSH se v této studii v den podání hCG nepodával).
Počet získaných oocytů
Ve všech třech studiích vedla léčba jednou injekcí přípravku Elonva, 100 nebo 150 mikrogramů, po prvních sedm dnů COS k vyššímu počtu získaných oocytů v porovnání s každodenní dávkou recFSH. Rozdíly byly nicméně v mezích předem definované ekvivalence (ENGAGE a ENSURE) nebo non-inferiority (PURSUE). Viz Tabulka 1 dále.
Tabulka 1: Průměrná hodnota počtu oocytů získaných v populaci všech zařazených subjektů (ITT) studií ENSURE, ENGAGE a PURSUE
|
Parametr |
ENSURE (18 - 36 let věku) (tělesná hmotnost 60 kg nebo nižší) |
ENGAGE (18-36 let věku) (tělesná hmotnost vyšší než 60 kg a nižší než nebo rovna 90 kg) |
PURSUE (35 - 42 let věku) (tělesná hmotnost 50 kg nebo vyšší) | |||
|
Elonva 100 pg |
recFSH 150 IU |
Elonva 150 Pg |
recFSH 200 IU |
Elonva 150 Pg |
recFSH 300 IU | |
|
N = 268 |
N = 128 |
N = 756 |
N = 750 |
N = 694 |
N = 696 | |
|
Průměrná hodnota počtu oocytů |
13,3 |
10,6 |
13,8 |
12,6 |
10,7 |
10,3 |
|
Rozdíl [95% interval spolehlivosti] |
2,5 [1,2, 3,9] |
1,2 [0,5, 1,9] |
0,5 [-0,2, 1,2] | |||
Těhotenství z fresh cyklů ve studiích ENGAGE a PURSUE
Ve studii ENGAGE byla non-inferiorita prokázána četností trvajících těhotenství při porovnání přípravku Elonva a recFSH, přičemž četnost trvajících těhotenství byla definována jako přítomnost nejméně jednoho plodu se srdeční aktivitou zjišťovanou nejméně 10 týdnů po přenosu embrya.
Ve studii PURSUE byla non-inferiorita prokázána četností vitálních těhotenství při porovnání přípravku Elonva a recFSH, přičemž četnost vitálních těhotenství byla definována jako procento subjektů s nejméně jedním plodem se srdeční aktivitou zjišťovanou 5 až 6 týdnů po přenosu embrya.
Výsledky studií ENGAGE a PURSUE týkající se těhotenství z fresh cyklů jsou shrnuty v Tabulce 2 níže.
Primárním kritériem hodnocení účinnosti ve studii ENGAGE byla trvající těhotenství (zjišťováno nejméně 10 týdnů po přenosu embrya).
|
Parametr |
Fresh cykly ve studii ENGAGE^ (18 až 36 let věku) (tělesná hmotnost vyšší než 60 kg a nižší než nebo rovna 90 kg) |
Fresh cykly ve studii PURSUE* (35 až 42 let věku) (tělesná hmotnost 50 kg nebo vyšší) | ||||
|
Elonva 150 pg |
recFSH 200 IU |
Rozdíl [95% interval spolehlivosti] |
Elonva 150 pg |
recFSH 300 IU |
Rozdíl [95% interval spolehlivosti] | |
|
N = 756 |
N = 750 |
N = 694 |
N = 696 | |||
|
Míra vitálních těhotenství |
39,9 % |
39,1 % |
1,1 [-3,8, 5,9] |
23,9 % |
26,9 % |
-3,0 [-7,3, 1,4] |
|
Míra trvajících těhotenství |
39,0 % |
38,1 % |
1,1 [-3,8, 5,9] |
22,2 % |
24,0 % |
-1,9 [-6,1, 2,3] |
|
Míra živých porodů* |
35,6 % |
34,4 % |
1,3 [-3,5, 6,1] |
21,3 % |
23,4 % |
-2,3 [-6,5, 1,9] |
íprimárním kritériem hodnocení účinnosti ve studii PURSUE byla četnost vitálních těhotenství definovaná jako procento subjektů s nejméně jedním plodem se srdeční aktivitou zjišťovanou 5 až 6 týdnů po přenosu embrya. *Míra živých porodů byla ve studiích ENGAGE a PURSUE sekundárním kritériem hodnocení účinnosti.
V těchto klinických studiích byl bezpečnostní profil jednorázové injekce přípravku Elonva srovnatelný s denně podávanými injekcemi recFSH.
Těhotenství z cyklů kryoembryotransferu (FTET frozen-thawed embryo transfer]) ve studiích ENGAGE and PURSUE
Studie následného sledování FTET v ENGAGE zahrnovala ženy, které měly alespoň jedno embryo rozmražené pro použití minimálně 1 rok od kryokonzervace. Průměrný počet embryí transferovaných v průběhu cyklů FTET ve studii ENGAGE byl 1,7 v obou léčených skupinách.
Studie následného sledování FTET v PURSUE zahrnovala ženy, které měly alespoň jedno embryo rozmražené pro použití během 2 let od data poslední kryokonzervace pro tuto studii. Průměrný počet embryí transferovaných v průběhu cyklů FTET ve studii ENGAGE byl 2,4 v obou léčených skupinách. Tato studie také poskytla bezpečnostní údaje týkající se novorozenců narozených z kryokonzervovaných embryí.
Maximální počet FTET cyklů byl 5 ve studii následného sledování FTET v ENGAGE a 4 ve studii následného sledování FTET v PURSUE. Výsledky studií ENGAGE a PURSUE týkající se těhotenství z prvních dvou FTET cyklů jsou shrnuty v Tabulce 3 níže.
|
FTET cykly ve studii ENGAGE (18-36 let) (tělesná váha vyšší než 60 kg a nižší nebo rovna 90 kg) |
FTET cykly ve (35-4 (tělesná váha vyšš 50 |
studii PURSUE 2 let) í než nebo rovna kg) | ||||||||||
|
Elonva _150 ůg_ |
recFS 200 II |
H J |
Elonva _150 ůg_ |
recFSH 300 IU | ||||||||
|
n |
N |
% |
n |
N |
% |
n |
N |
% |
n |
N |
% | |
|
FTET cyklus 1a | ||||||||||||
|
Trvající |
55 |
148 |
37,2 |
45 |
147 |
30,6 |
43 |
152 |
28,3 |
42 |
145 |
29,0 |
|
Živý porod |
- |
- |
- |
- |
- |
- |
43 |
152 |
28,3 |
41 |
145 |
28,3 |
|
FTET cyklus 2a | ||||||||||||
|
Trvající |
9 |
38 |
23,7 |
9 |
31 |
29,0 |
8 |
23 |
34,8 |
6 |
14 |
42,9 |
|
Živý porod |
- |
- |
- |
- |
- |
- |
8 |
23 |
34,8 |
6 |
14 |
42,9 |
n = počet subjektů dané události; N = celkový počet subjektů a na embryotransfer.
Kongenitální malformace hlášené u novorozenců narozených po cyklu kryoembryotransferu (FTET [frozen-thawed embryo transfer])
Po používání přípravku Elonva bylo narozeno po cyklu FTET 61 novorozenců a po fresh ART cyklech bylo narozeno 630 novorozenců. Míry výskytu kongenitálních malformací (kombinace závažných a minoritních) hlášených u novorozenců narozených po cyklu FTET (16,4 %) byly podobné těm, hlášeným u novorozenců narozených po fresh ART cyklech (19,5 %).
Imunogenita
Z 2511 žen léčených přípravkem Elonva, které byly po léčbě vyšetřovány na tvorbu protilátek, byla u čtyř (0,16 %) prokázána tvorba protilátek, včetně tří, které byly působení přípravku Elonva vystaveny jednou a jedna žena byla jeho působení vystavena dvakrát. Ve všech případech tyto protilátky nebyly neutralizující a neinterferovaly s odpovědí na stimulaci nebo s normálními fyziologickými odpověďmi osy hypothalamus-hypofýza-ovária. Dvě z těchto čtyř žen otěhotněly během téhož léčebného cyklu, ve kterém došlo k detekci protilátek, což naznačuje, že přítomnost neneutralizujících protilátek po stimulaci přípravkem Elonva není klinicky relevantní.
Pediatrická populace
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem Elonva u jedné nebo více podskupin pediatrické populace s hypogonadotropním hypogonadismem (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Farmakokinetické parametry korifolitropinu alfa byly hodnoceny po subkutánním podání u žen podstupujících léčebný cyklus kontrolované stimulace ovárií. 3
Tělesná hmotnost je určujícím faktorem expozice korifolitropinu alfa. Expozice korifolitropinu alfa po jedné subkutánní injekci je 665 hodin*ng/ml (AUC, 426 - 1037 hodin*ng/mť) a je po podání 100 mikrogramů korifolitropinu alfa ženám s tělesnou hmotností 60 kilogramů nebo nižší podobná jako po podání 150 mikrogramů korifolitropinu alfa ženám s tělesnou hmotností vyšší než 60 kilogramů.
Absorpce
Po jednorázové subkutánní injekci přípravku Elonva je maximální sérová koncentrace korifolitropinu alfa 4,24 ng/ml (2,49 - 7,21 ng/ml4) a dosahuje se po 44 hodinách (35 - 57 hodin4) po podání dávky. Absolutní biologická dostupnost je 58 % (48 - 70 %4).
Distribuce
Distribuce, metabolismus a eliminace korifolitropinu alfa jsou velmi podobné jako u jiných gonadotropinů, jako jsou FSH, hCG a LH. Po absorpci do krve je korifolitropin alfa distribuován hlavně do ovarií a do ledvin. Distribuční objem v ustáleném stavu je 9,2 l (6,5 - 13,1 l4). Expozice korifolitropinu alfa se v rozmezí 60 mikrogramů až 240 mikrogramů zvyšuje proporcionálně s dávkou.
Eliminace
Korifolitropin alfa má eliminační poločas 70 hodin (59 - 82 hodin4) a clearence 0,13 l/hod (0,10 -0,18 l/hod4). Korifolitropin alfa se vylučuje převážně ledvinami a jeho rychlost eliminace může být snížena u pacientek s renální insuficiencí (viz bod 4.2 a 4.4). Jaterní metabolismus přispívá k vylučování korifolitropinu alfa jen v menší míře.
Další zvláštní populace
Porucha funkce jater
Ačkoliv nejsou k dispozici údaje od pacientek se sníženou funkcí jater, není pravděpodobné, že by poškození jater narušovalo farmakokinetický profil korifolitropinu alfa.
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinické údaje z konvenčních studií toxicity a bezpečnostní farmakologie po jednorázové dávce a opakovaných dávkách neodhalily žádná zvláštní rizika pro lidi.
Studie reprodukční toxicity u potkanů a králíků indikují, že korifolitropin alfa nepříznivě neovlivňuje fertilitu. Podání korifolitropinu alfa potkanům a králíkům před pářením a hned po páření a v průběhu časné březosti vedlo k embryotoxicitě. U králíků byla pozorována teratogenita, pokud byl přípravek podán před pářením. Embryotoxicita i teratogenita jsou připisovány superovulačnímu stavu zvířete, které není schopno unést více embryí, než je fyziologické. Relevance těchto nálezů pro klinické užívání přípravku Elonva je omezená.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Natrium-citrát Sacharóza Polysorbát 20 Metionin
Hydroxid sodný (pro úpravu pH)
Kyselina chlorovodíková (pro úpravu pH)
Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Pro usnadnění je možné, aby pacientka přípravek skladovala při teplotě 25 °C nebo nižší po dobu nepřesahující 1 měsíc.
Uchovávejte injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a velikost balení
Elonva se dodává v předplněných 1ml injekčních stříkačkách typu luer-lock (hydrolytické sklo typu I), uzavřených pístem z brombutylového elastomeru a koncovou krytkou. Injekční stříkačka je vybavena automatickým bezpečnostním systémem, který předchází poranění při píchnutí jehlou po použití, a je zabalena společně se sterilní injekční jehlou. Jedna předplněná injekční stříkačka obsahuje 0,5 ml injekčního roztoku.
Přípravek Elonva je dostupný v balení po 1 předplněné injekční stříkačce.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Přípravek Elonva nepoužívejte, pokud není roztok čirý.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/09/609/002
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 25. ledna 2010
Datum posledního prodloužení registrace: 22. srpna 2014
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE/VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY /BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE/VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY BIOLOGICKÝCH
LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce biologické léčivé látky
N.V. Organon Kloosterstraat 6 5349 AB Oss Nizozemsko
N.V. Organon Veersemeer 4,
5347 JN Oss Nizozemsko
Název a adresa výrobců odpovědných za propouštění šarží N.V. Organon
Kloosterstraat 6 5349 AB Oss P O. Box 20 5340 BH Oss Nizozemsko
Organon (Ireland) Ltd.
Drynam Road, Swords, Co. Dublin Irsko
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz Příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
• Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• Na žádost Evropské agentury pro léčivé přípravky;
• Při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které
mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Elonva 100 mikrogramů injekční roztok corifollitropinum alfa
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna předplněná injekční stříkačka obsahuje corifollitropinum alfa 100 mikrogramů v 0,5 ml injekčního roztoku.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: natrium-citrát, sacharóza, polysorbát 20, metionin, hydroxid sodný (pro úpravu pH), kyselina chlorovodíková (pro úpravu pH), voda na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok
1 předplněná injekční stříkačka s automatickým bezpečnostním systémem (prevence poranění jehlou) a sterilní injekční jehlou. 0,5 ml.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Pouze k jednorázovému použití.
Před použitím si přečtěte příbalovou informaci. Subkutánní podání (s.c.)
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
Uchovávání pro lékárníka
Uchovávejte v chladničce. Chraňte před mrazem.
Uchovávání pro pacienta Máte dvě možnosti:
1. Uchovávejte v chladničce. Chraňte před mrazem.
2. Uchovávejte při teplotě 25 °C nebo nižší po období nepřesahující 1 měsíc. Uchovávejte injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/609/001
13. ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
<Nevyžaduje se - odůvodnění přijato>
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Elonva 100 mikrogramů injekce corifonitropinum alfa
s.c.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
0,5 ml
6. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Elonva 150 mikrogramů injekční roztok corifollitropinum alfa
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna předplněná injekční stříkačka obsahuje corifollitropinum alfa 150 mikrogramů v 0,5 ml injekčního roztoku.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: natrium-citrát, sacharóza, polysorbát 20, metionin, hydroxid sodný (pro úpravu pH), kyselina chlorovodíková (pro úpravu pH), voda na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok
1 předplněná injekční stříkačka s automatickým bezpečnostním systémem (prevence poranění jehlou) a sterilní injekční jehlou. 0,5 ml.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Pouze k jednorázovému použití.
Před použitím si přečtěte příbalovou informaci. Subkutánní podání (s.c.)
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
Uchovávání pro lékárníka
Uchovávejte v chladničce. Chraňte před mrazem.
Uchovávání pro pacienta Máte dvě možnosti:
1. Uchovávejte v chladničce. Chraňte před mrazem.
2. Uchovávejte při teplotě 25 °C nebo nižší po období nepřesahující 1 měsíc. Uchovávejte injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/609/002
13. ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
<Nevyžaduje se - odůvodnění přijato>
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Elonva 150 mikrogramů injekce corifonitropinum alfa
s.c.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
0,5 ml
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: Informace pro uživatele
Elonva 100 mikrogramů injekční roztok
corifollitropinum alfa
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je přípravek Elonva a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Elonva používat
3. Jak se přípravek Elonva používá
4. Možné nežádoucí účinky
5 Jak přípravek Elonva uchovávat
6. Obsah balení a další informace
1. Co je přípravek Elonva a k čemu se používá
Přípravek Elonva obsahuje léčivou látku korifolitropin alfa a patří do skupiny léků nazývaných gonadotropní hormony. Gonadotropní hormony hrají významnou roli v lidské plodnosti a reprodukci. Jedním z těchto gonadotropních hormonů je folikuly stimulující hormon (FSH), který ženy potřebují pro růst a vývoj folikulů (malé kulaté váčky ve vaječnících, které obsahují vajíčka).
Přípravek Elonva se užívá na podporu otěhotnění u žen podstupujících léčbu neplodnosti, například oplodnění in vitro (IVF). IVF zahrnuje odběr vajíček z vaječníku, jejich oplodnění v laboratoři a přenesení embryí do dělohy o několik dní později. Přípravek Elonva navozuje růst a vývoj několika folikulů ve stejnou dobu pomocí kontrolované stimulace vaječníků.
2. Čemu musíte věnovat pozornost, než začnete přípravek Elonva používat
Nepoužívejte přípravek Elonva, jestliže:
- jste alergická (přecitlivělá) na korifolitropin alfa nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6)
- máte rakovinu vaječníku, prsu, dělohy nebo mozku (hypofýzy nebo hypotalamu)
- jste nedávno prodělala neočekávané krvácení z pochvy, jiné než menstruační, bez zjištěné příčiny
- máte vaječníky, které jsou nefunkční v důsledku onemocnění zvaného primární selhání vaječníků
- máte cysty na vaječníku nebo zvětšené vaječníky
- máte syndrom polycystických vaječníků (PCOS)
- jste prodělala syndrom nadměrné stimulace vaječníků (OHSS). OHSS je závažný zdravotní problém, ke kterému může dojít, pokud jsou vaječníky stimulovány nadměrně. Viz níže další vysvětlení.
- jste dříve podstoupila léčebný cyklus kontrolované stimulace vaječníků, který vedl k růstu více než 30 folikulů o velikosti 11 mm nebo větších
- máte bazální počet antrálních folikulů (počet malých folikulů přítomných ve vaječnících na začátku menstruačního cyklu) vyšší než 20
- máte malformace pohlavních orgánů, které znemožňují normální těhotenství
- máte myomy v děloze, které znemožňují normální těhotenství
Upozornění a opatření
Před použitím přípravku Elonva se poraďte se svým lékařem.
Syndrom nadměrné stimulace vaječníků (OHSS)
Léčba gonadotropními hormony, ke kterým patří i přípravek Elonva, může způsobovat syndrom nadměrné stimulace vaječníků (OHSS). Jedná se o závažné onemocnění, při němž jsou vaječníky nadměrně stimulovány a rostoucí folikuly se stanou většími, než je obvyklé. Ve vzácných případech může být OHSS život ohrožující. Proto je důležitý pečlivý lékařský dohled. Váš lékař bude provádět ultrazvukové vyšetření Vašich vaječníků, aby kontroloval účinky léčby. Váš lékař také může kontrolovat hladinu hormonů v krvi. (Viz také bod 4).
OHSS způsobuje náhlé hromadění tekutiny v žaludku a oblasti hrudníku a může způsobit vznik krevní sraženiny. Informujte ihned svého lékaře, pokud se u Vás objeví:
- závažný otok břicha a bolest v oblasti žaludku (břicha)
- nevolnost
- zvracení
- náhlý přírůstek hmotnosti v důsledku hromadění tekutiny
- průjem
- snížený výdej moči
- potíže s dýcháním
Přípravek Elonva můžete použít pouze jednou v průběhu jednoho léčebného cyklu, jinak se může zvýšit možnost vzniku OHSS.
Před zahájením používání tohoto léku informujte svého lékaře, jestliže jste někdy prodělala syndrom nadměrné stimulace vaječníků (OHSS).
Torze ovaria
Torze ovaria je přetočení vaječníku. Přetočení vaječníku může zastavit přívod krve do vaječníku.
Před zahájením používání tohoto léku informujte svého lékaře, jestliže:
- jste někdy prodělala syndrom nadměrné stimulace vaječníků (OHSS).
- jste těhotná nebo si myslíte, že můžete být těhotná.
- jste někdy prodělala operaci v oblasti žaludku (břicha).
- jste někdy prodělala přetočení vaječníku.
- máte nebo jste měla cysty na jednom nebo obou vaječnících.
Krevní sraženina. (Trombóza)
Léčba gonadotropními hormony, ke kterým patří i přípravek Elonva, může (stejně jako těhotenství) zvyšovat riziko vzniku krevní sraženiny (trombózy). Trombóza je vytvoření krevní sraženiny v cévě.
Krevní sraženiny mohou způsobit závažné zdravotní stavy, jako např.:
- ucpání cévy v plicích (plicní embolie)
- mrtvici
- srdeční záchvat
- problémy s cévami (tromboflebitida)
- špatný průtok krve (hluboká žilní trombóza), který může vyústit ve ztrátu paže nebo nohy.
Před zahájením léčby tuto záležitost, prosím, proberte se svým lékařem, zejména jestliže:
- víte, že již máte zvýšenou možnost vzniku trombózy
- jste Vy nebo kdokoli jiný z Vaší nejbližší rodiny prodělali trombózu
- máte výraznou nadváhu.
Mnohočetné porody nebo vrozené defekty
I pokud se do dělohy přenáší pouze jedno embryo, existuje vyšší pravděpodobnost dvojčat nebo i vícerčat. Mnohočetná těhotenství přinášejí zvýšené zdravotní riziko pro matku i její děti. Mnohočetná těhotenství a specifické charakteristiky párů, které mají problémy s plodností (např. věk ženy, určité problémy se spermatem, genetické dispozice obou rodičů), mohou být také spojeny se zvýšeným rizikem vrozených defektů.
Komplikace těhotenství
Pokud léčba přípravkem Elonva vede k těhotenství, je zde zvýšená možnost mimoděložního (ektopického) těhotenství. Z tohoto důvodu musí Váš lékař provést časné ultrazvukové vyšetření k vyloučení možnosti mimoděložního těhotenství.
Rakovina vaječníků a jiných částí rozmnožovacího systému
U žen, které podstoupily léčbu neplodnosti, byla hlášena rakovina vaječníků nebo jiných částí rozmnožovacího systému. Není známo, zda léčba přípravky na podporu plodnosti zvyšuje riziko těchto nádorů u neplodných žen.
Další zdravotní stavy
Před zahájením používání tohoto léku navíc informujte svého lékaře, jestliže:
- máte onemocnění ledvin.
- máte problémy s hypofýzou nebo hypotalamem, které nejsou zaléčeny
- máte sníženou funkci štítné žlázy (hypotyreóza)
- Vaše nadledviny nepracují správně (nedostatečnost nadledvin)
- máte vysokou hladinu prolaktinu v krvi (hyperprolaktinémie)
- máte nějaký jiný zdravotní problém (např. diabetes, srdeční onemocnění nebo jiné dlouhodobé onemocnění)
- Vám lékař sdělil, že pro Vás těhotenství může být nebezpečné Další léčivé přípravky a přípravek Elonva
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste užívala v nedávné době nebo které možná budete užívat, a to i o lécích, které jsou dostupné bez lékařského předpisu.
Těhotenství a kojení
Přípravek Elonva nesmíte používat, pokud jste již těhotná nebo pokud si myslíte, že byste mohla být těhotná, nebo pokud kojíte.
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat tento lék.
Řízení dopravních prostředků a obsluha strojů
Přípravek Elonva může způsobovat závratě. Pokud pociťujete závratě, nesmíte řídit dopravní prostředky nebo obsluhovat stroje.
Přípravek Elonva obsahuje sodík
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) na injekci, je tedy v podstatě „bezsodíkový“.
3. Jak se přípravek Elonva používá
Vždy používejte přípravek Elonva přesně podle pokynů svého lékaře. Pokud si nejste jistá, poraďte se se svým lékařem nebo lékárníkem.
Přípravek Elonva se používá u žen podstupujících léčbu neplodnosti, například in vitro fertilizaci (IVF ). V průběhu léčby se přípravek Elonva používá v kombinaci s lékem (takzvaný antagonista GnRH), který brání, aby vaječník uvolnil vajíčko příliš brzy. Léčba antagonistou GnRH obvykle začíná za 5 až 6 dní po injekci přípravku Elonva.
Používání přípravku Elonva v kombinaci s agonistou GnRH (další lék, který brání, aby vaječník uvolnil vajíčko příliš brzy) se nedoporučuje.
Dávka
Při léčbě žen v plodném věku je dávka přípravku Elonva založena na hmotnosti a věku.
- Pro ženy, které váží 60 kg nebo méně a kterým je 36 let nebo méně, se doporučuje jedna 100mikrogramová dávka.
- Jedna 150mikrogramová dávka se doporučuje pro ženy:
- vážící více než 60 kilogramů bez ohledu na věk.
- vážící 50 kilogramů nebo více ve věku nad 36 let.
Ženy, kterým je více než 36 let a které váží méně než 50 kg, nebyly hodnoceny.
|
Tělesná hmotnost | ||||
|
Méně než 50 kg |
50 - 60 kg |
Více než 60 kg | ||
|
Věk |
36 let nebo méně |
100 mikrogramů |
100 mikrogramů |
150 mikrogramů |
|
Více než 36 let |
Nebylo hodnoceno. |
150 mikrogramů |
150 mikrogramů | |
V průběhu prvních sedmi dní po injekci přípravku Elonva nesmíte užívat (rekombinantní) folikuly stimulující hormon ((rec)FSH). Sedm dní po injekci přípravku Elonva může Váš lékař rozhodnout o pokračování ve stimulačním cyklu jiným gonadotropním hormonem, jako je (rec)FSH. Tato léčba může pokračovat po několik dní, dokud nebude přítomen dostatek folikulů přiměřené velikosti. To lze ověřit ultrazvukovým vyšetřením. Léčba pomocí (rec)FSH se potom zastaví a vajíčka se nechají dozrát podáním hCG (lidský choriogonadotropin). Vajíčka se z vaječníku odebírají za 34-36 hodin.
Jak se přípravek Elonva podává
Léčba přípravkem Elonva musí probíhat pod dohledem lékaře se zkušenostmi v léčbě problémů s plodností. Přípravek Elonva musí být podáván pod kůži (subkutánně) do kožní řasy (sevře se mezi palcem a ukazováčkem) nejlépe přímo pod pupkem. Injekci může podat zdravotnický pracovník (například zdravotní sestra), Váš partner nebo Vy sama, pokud jste pečlivě poučeni Vaším lékařem. Vždy používejte přípravek Elonva přesně podle pokynů svého lékaře. Pokud si nejste jistá, měla byste se poradit se svým lékařem nebo lékárníkem. Na konci této příbalové informace je po jednotlivých krocích uveden „Návod k použití“.
Přípravek Elonva nepodávejte do svalu.
Přípravek Elonva je dodáván v předplněné injekční stříkačce s automatickým bezpečnostním systémem, který předchází poranění při píchnutí jehlou po použití.
Jestliže jste použila více přípravku Elonva nebo (rec)FSH, než jste měla
Pokud si myslíte, že jste použila více přípravku Elonva nebo (rec)FSH, než jste měla, neprodleně kontaktujte svého lékaře.
Jestliže jste zapomněla použít přípravek Elonva
Jestliže jste zapomněla na injekci přípravku Elonva v den, kdy měla být podána, neprodleně kontaktujte svého lékaře. Neaplikujte si přípravek Elonva bez konzultace se svým lékařem.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
T-W r V r Vil i i V* 1
Závažné nežádoucí účinky
Možnou komplikací léčby gonadotropními hormony, ke kterým patří i přípravek Elonva, je nechtěná nadměrná stimulace vaječníků. Možnost vzniku této komplikace lze snížit pečlivým monitorováním počtu zrajících folikulů. Váš lékař bude provádět ultrazvukové vyšetření Vašich vaječníků, aby pečlivě monitoroval počet zrajících folikulů. Váš lékař možná bude také kontrolovat hladiny hormonů v krvi. První příznaky nadměrné stimulace vaječníků mohou být pozorovány jako bolest žaludku (břicha), nevolnost nebo průjem. Nadměrná stimulace vaječníků může přejít v onemocnění zvané syndrom nadměrné stimulace vaječníků (OHSS), které může představovat závažný zdravotní problém. V těžších případech může vést ke zvětšení vaječníků, nahromadění tekutiny v břiše a/nebo v hrudníku (což může způsobit nárůst tělesné hmotnosti v důsledku tvorby tekutiny) nebo sraženinám v cévách. Neodkladně kontaktujte svého lékaře, pokud se u Vás objeví bolest žaludku (břicha) nebo jakýkoli jiný příznak nadměrné stimulace vaječníků, i kdyby to bylo několik dní po podání injekce.
Riziko vzniku nežádoucího účinku je popsáno následujícími kategoriemi:
Časté (mohou postihnout až 1 z 10 žen)
- Syndrom nadměrné stimulace vaječníků (OHSS)
- Bolest v pánvi
- Pocit nevolnosti
- Bolest hlavy
- Nepříjemný pocit v pánvi
- Citlivost prsů
- Únava
Méně časté (mohou postihnout až 1 ze 100 žen)
- Přetočení vaječníku (torze vaječníku)
- Zvýšení jaterních enzymů
- Potrat
- Bolest po odběru vajíček
- Bolest během ošetření
- Předčasné uvolnění vajíčka (předčasná ovulace)
- Nadmutí břicha
- Zvracení
- Průjem
- Zácpa
- Bolest v zádech
- Bolest v prsech
- Tvorba modřin nebo bolest v místě injekce
- Předrážděnost
- Změny nálady
- Závrať
- Návaly horka
Také byla hlášena mimoděložní těhotenství (ektopické těhotenství) a mnohočetná těhotenství. Tyto nežádoucí účinky nejsou považovány za související s používáním přípravku Elonva, ale s metodou asistované reprodukce (ART) nebo s následným těhotenstvím.
Ve vzácných případech byla léčba přípravkem Elonva, stejně jako léčba dalšími gonadotropiny, spojena s tvorbou krevních sraženin (trombů), které se po vzniku v cévě uvolnily, putovaly krevním řečištěm a ucpaly jinou cévu (tromboembolismus).
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Elonva uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku a krabičce za „EXP“ (doba použitelnosti). Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávání pro lékárníka
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
Uchovávání pro pacienta
Máte dvě možnosti:
1. Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
2. Uchovávejte při teplotě 25 °C nebo nižší po dobu nepřesahující jeden měsíc. Poznamenejte si začátek doby uchovávání přípravku mimo chladničku a přípravek použijte do jednoho měsíce od tohoto data.
Uchovávejte injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
Nepoužívejte přípravek Elonva
- pokud byl uchováván mimo chladničku po déle než jeden měsíc.
- pokud byl uchováván mimo chladničku při teplotě vyšší než 25 °C.
- pokud zaznamenáte, že roztok není čirý.
- pokud zaznamenáte poškození injekční stříkačky nebo jehly.
Nevyhazujte prázdné nebo nepoužité injekční stříkačky do domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Elonva obsahuje
• Léčivou látkou je korifolitropin alfa. Jedna předplněná injekční stříkačka obsahuje 100 mikrogramů v 0,5 mililitru (ml) injekčního roztoku.
• Pomocnými látkami jsou: natrium-citrát, sacharóza, polysorbát 20, methionin a voda na injekci. Pro úpravu pH mohl být použit hydroxid sodný a/nebo kyselina chlorovodíková.
Jak přípravek Elonva vypadá a co obsahuje toto balení
Elonva je čirý a bezbarvý vodný injekční roztok (injekce) v předplněné injekční stříkačce s automatickým bezpečnostním systémem, který předchází poranění při píchnutí jehlou po použití. Injekční stříkačka je zabalena spolu se sterilní injekční jehlou. Jedna injekční stříkačka obsahuje 0,5 ml roztoku.
V jednom balení je jedna předplněná injekční stříkačka.
Přípravek Elonva je dostupný ve dvou silách: 100 mikrogramů a 150 mikrogramů injekční roztok.
Držitel rozhodnutí o registraci
Merck Sharp & Dohme Limited, Hertford Road, Hoddesdon, Hertfordshire EN11 9BU,
Velká Británie.
Výrobci
N.V. Organon, Kloosterstraat 6, 5349 AB Oss, Nizozemsko Organon (Ireland) Ltd., Drynam Road, Swords, Co. Dublin, Irsko
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci
Belgie/Belgique/Belgien
MSD Belgium BVBA/SPRL
Tel/Tél: 0800 38 693 (+32(0)27766211)
BtnrapHH
MepK fflapn h floyM Etarapna EOOfl Tea.: + 359 2 819 37 37 info-msdbg@merck.com
Česká republika
Merck Sharp & Dohme s.r.o.
Tel.: +420 233 010 111 dpoc_czechslovak@merck.com
Danmark
MSD Danmark ApS Tlf: + 45 4482 4000 dkmail@merck.com
Deutschland
MSD SHARP & DOHME GMBH
Tel: 0800 673 673 673 (+49 (0) 89 4561 2612)
Eesti
Merck Sharp & Dohme OU Tel: + 372 6144 200 msdeesti@merck.com
EXXáSa
MSD A.O.B.E.E
TpA,: + 30 210 98 97 300
Espaňa
Merck Sharp & Dohme de Espana, S.A.
Tel: +34 91 321 06 00 msd_info@merck.com
Lietuva
UAB Merck Sharp & Dohme Tel: + 370 5 2780247 msd_lietuva@merck.com
Luxembourg/Luxemburg
MSD Belgium BVBA/SPRL Tel/Tél: +32(0)27766211 dpoc_belux@merck.com
Magyarország
MSD Pharma Hungary Kft.
Tel.: + 36 1 888-5300 hungary_msd@merck.com
Malta
Merck Sharp & Dohme Cyprus Limited Tel: 8007 4433 (+356 99917558) malta_info@merck.com
Nederland
Merck Sharp & Dohme BV
Tel: 0800 99 99 000 (+ 31 23 5153153)
Norge
MSD (Norge) AS Tlf: + 47 32 20 73 00 msdnorge@msd.no
Osterreich
Merck Sharp & Dohme Ges.m.b.H.
Tel: +43 (0) 1 26 044 msd-medizin@merck.com
Polska
MSD Polska Sp.z o.o.
Tel.: +48 22 549 51 00 msdpolska@merck.com
Hrvatska
Merck Sharp & Dohme d.o.o.
Tel: + 385 1 6611 333 croatia_info@merck.com
Ireland
Merck Sharp & Dohme Ireland (Human Health) Limited
Tel: +353 (0)1 2998700 medinfo_ireland@merck.com
Ísland
Vistor hf.
Sími: + 354 535 7000
Italia
MSD Italia S.r.l.
Tel: +39 06 361911 medicalinformation.it@merck.com
Kúrcpog
Merck Sharp & Dohme Cyprus Limited TpA.: 800 00 673 +357 22866700 cyprus_info@merck.com
Latvija
SIA Merck Sharp &Dohme Latvija Tel: + 371 67 364224 msd_lv@merck.com
Portugal
Merck Sharp & Dohme, Lda Tel: + 351 214465700 clic@merck.com
Románia
Merck Sharp & Dohme Romania S.R.L.
Tel: + 40 21 529 29 00 msdromania@merck.com
Slovenija
Merck Sharp & Dohme, inovativna zdravila d.o.o.
Tel: + 386 1 5204201 msd_slovenia@merck.com
Slovenská republika
Merck Sharp & Dohme, s. r. o.
Tel: + 421 (2) 58282010 dpoc_czechslovak@merck.com
Suomi/Finland
MSD Finland Oy Puh/Tel: + 358 (0)9 804650 info@msd.fi
Sverige
Merck Sharp & Dohme (Sweden) AB Tel: + 46 (0)77 5700488 medicinskinfo@merck.com
United Kingdom
Merck Sharp & Dohme Limited Tel: +44 (0) 1992 467272 medicalinformationuk@merck.com
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Návod k použití
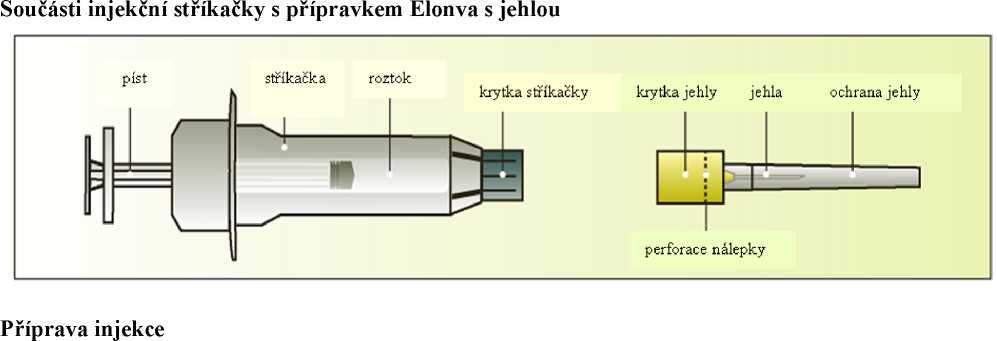
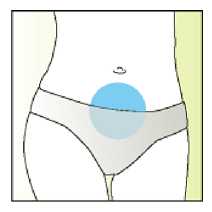
1.
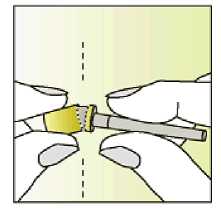
2.
3.
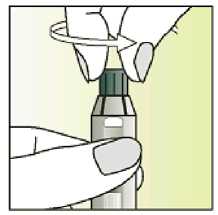
4.
Umyjte si ruce mýdlem a vodou a osušte je před použitím přípravku Elonva.
Tampónem naneste na místo vpichu (místo těsně pod pupkem) dezinfekci (např. alkohol), aby se odstranily všechny povrchové bakterie.
Očistěte asi 5 cm okolo místa, kam se bude zavádět jehla, a nechte dezinfekci schnout alespoň jednu minutu před dalším postupem.
Zatímco dezinfekce schne, porušte perforaci na nálepce a sundejte krytku jehly
Ochranu jehly ponechejte na místě
Ochranu jehly (obsahující jehlu) položte během přípravy injekční stříkačky na čistý suchý povrch.
Injekční stříkačku držte šedou krytkou vzhůru
Prstem jemně poklepejte na injekční stříkačku, abyste pomohla
bublinkám vzduchu vystoupat k hornímu okraji.
Injekční stříkačku dále držte namířenou vzhůru
Odšroubujte krytku injekční stříkačky proti směru hodinových
ručiček.
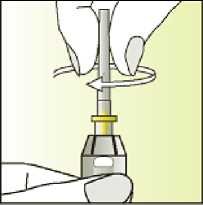
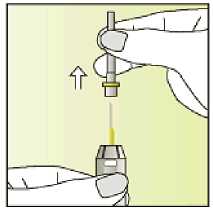
6.
Injekční stříkačku dále držte namířenou vzhůru
Zašroubujte ochranu jehly (obsahující jehlu) po směru hodinových
ručiček na injekční stříkačku.
Injekční stříkačku dále držte namířenou vzhůru Ochranu jehly odstraňte přímým tahem a vyhoďte ji
S jehlou ZACHÁZEJTE OPATRNĚ
Podání injekce
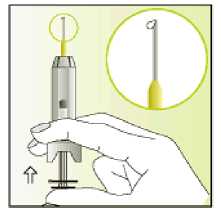
7.
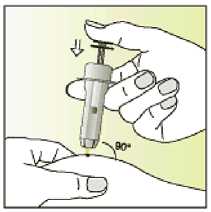
8.

9.
Nyní uchopte injekční stříkačku mezi ukazovák a prostředník v poloze směrem vzhůru Palec přiložte k pístu
Opatrně zatlačte na píst směrem vzhůru, až se na špičce jehly objeví malá kapička.
Palcem a ukazovákem vytvořte kožní řasu Do kožní řasy zaveďte celou jehlu v úhlu 90 stupňů OPATRNĚ stlačujte píst, dokud je to možné, a držte píst dole POČÍTEJTE DO PĚTI, aby byla zaručena aplikace celého roztoku.
Sundejte palec z pístu
Jehla se automaticky zasune do injekční stříkačky, ve které bude trvale uzavřena.
Příbalová informace: Informace pro uživatele
Elonva 150 mikrogramů injekční roztok
corifollitropinum alfa
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je přípravek Elonva a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Elonva používat
3. Jak se přípravek Elonva používá
4. Možné nežádoucí účinky
5 Jak přípravek Elonva uchovávat
6. Obsah balení a další informace
1. Co je přípravek Elonva a k čemu se používá
Přípravek Elonva obsahuje léčivou látku korifolitropin alfa a patří do skupiny léků nazývaných gonadotropní hormony. Gonadotropní hormony hrají významnou roli v lidské plodnosti a reprodukci. Jedním z těchto gonadotropních hormonů je folikuly stimulující hormon (FSH), který ženy potřebují pro růst a vývoj folikulů (malé kulaté váčky ve vaječnících, které obsahují vajíčka).
Přípravek Elonva se užívá na podporu otěhotnění u žen podstupujících léčbu neplodnosti, například oplodnění in vitro (IVF). IVF zahrnuje odběr vajíček z vaječníku, jejich oplodnění v laboratoři a přenesení embryí do dělohy o několik dní později. Přípravek Elonva navozuje růst a vývoj několika folikulů ve stejnou dobu pomocí kontrolované stimulace vaječníků.
2. Čemu musíte věnovat pozornost, než začnete přípravek Elonva používat
Nepoužívejte přípravek Elonva, jestliže:
- jste alergická (přecitlivělá) na korifolitropin alfa nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6)
- máte rakovinu vaječníku, prsu, dělohy nebo mozku (hypofýzy nebo hypotalamu)
- jste nedávno prodělala neočekávané krvácení z pochvy, jiné než menstruační, bez zjištěné příčiny
- máte vaječníky, které jsou nefunkční v důsledku onemocnění zvaného primární selhání vaječníků
- máte cysty na vaječníku nebo zvětšené vaječníky
- máte syndrom polycystických vaječníků (PCOS)
- jste prodělala syndrom nadměrné stimulace vaječníků (OHSS). OHSS je závažný zdravotní problém, ke kterému může dojít, pokud jsou vaječníky stimulovány nadměrně. Viz níže další vysvětlení
- jste dříve podstoupila léčebný cyklus kontrolované stimulace vaječníků, který vedl k růstu více než 30 folikulů o velikosti 11 mm nebo větších
- máte bazální počet antrálních folikulů (počet malých folikulů přítomných ve vaječnících na začátku menstruačního cyklu) vyšší než 20
- máte malformace pohlavních orgánů, které znemožňují normální těhotenství
- máte myomy v děloze, které znemožňují normální těhotenství
Upozornění a opatření
Před použitím přípravku Elonva se poraďte se svým lékařem.
Syndrom nadměrné stimulace vaječníků (OHSS)
Léčba gonadotropními hormony, ke kterým patří i přípravek Elonva, může způsobovat syndrom nadměrné stimulace vaječníků (OHSS). Jedná se o závažné onemocnění, při němž jsou vaječníky nadměrně stimulovány a rostoucí folikuly se stanou většími, než je obvyklé. Ve vzácných případech může být OHSS život ohrožující. Proto je důležitý pečlivý lékařský dohled. Váš lékař bude provádět ultrazvukové vyšetření Vašich vaječníků, aby kontroloval účinky léčby. Váš lékař také může kontrolovat hladinu hormonů v krvi. (Viz také bod 4).
OHSS způsobuje náhlé hromadění tekutiny v žaludku a oblasti hrudníku a může způsobit vznik krevní sraženiny. Informujte ihned svého lékaře, pokud se u Vás objeví:
- závažný otok břicha a bolest v oblasti žaludku (břicha)
- nevolnost
- zvracení
- náhlý přírůstek hmotnosti v důsledku hromadění tekutiny
- průjem
- snížený výdej moči
- potíže s dýcháním
Přípravek Elonva můžete použít pouze jednou v průběhu jednoho léčebného cyklu, jinak se může zvýšit možnost vzniku OHSS.
Před zahájením používání tohoto léku informujte svého lékaře, jestliže jste někdy prodělala syndrom nadměrné stimulace vaječníků (OHSS)
Torze ovaria
Torze ovaria je přetočení vaječníku. Přetočení vaječníku může zastavit přívod krve do vaječníku.
Před zahájením používání tohoto léku informujte svého lékaře, jestliže:
- jste někdy prodělala syndrom nadměrné stimulace vaječníků (OHSS).
- jste těhotná nebo si myslíte, že můžete být těhotná.
- jste někdy prodělala operaci v oblasti žaludku (břicha).
- jste někdy prodělala přetočení vaječníku.
- máte nebo jste měla cysty na jednom nebo obou vaječnících.
Krevní sraženina. (Trombóza)
Léčba gonadotropními hormony, ke kterým patří i přípravek Elonva, může (stejně jako těhotenství) zvyšovat riziko vzniku krevní sraženiny (trombózy). Trombóza je vytvoření krevní sraženiny v cévě.
Krevní sraženiny mohou způsobit závažné zdravotní stavy, jako např.:
- ucpání cévy v plicích (plicní embolie)
- mrtvici
- srdeční záchvat
- problémy s cévami (tromboflebitida)
- špatný průtok krve (hluboká žilní trombóza), který může vyústit ve ztrátu paže nebo nohy.
Před zahájením léčby tuto záležitost, prosím, proberte se svým lékařem, zejména jestliže:
- víte, že již máte zvýšenou možnost vzniku trombózy
- jste Vy nebo kdokoli jiný z Vaší nejbližší rodiny prodělali trombózu
- máte výraznou nadváhu.
Mnohočetné porody nebo vrozené defekty
I pokud se do dělohy přenáší pouze jedno embryo, existuje vyšší pravděpodobnost dvojčat nebo i vícerčat. Mnohočetná těhotenství přinášejí zvýšené zdravotní riziko pro matku i její děti. Mnohočetná těhotenství a specifické charakteristiky párů, které mají problémy s plodností (např. věk ženy, určité problémy se spermatem, genetické dispozice obou rodičů), mohou být také spojeny se zvýšeným rizikem vrozených defektů.
Komplikace těhotenství
Pokud léčba přípravkem Elonva vede k těhotenství, je zde zvýšená možnost mimoděložního (ektopického) těhotenství. Z tohoto důvodu musí Váš lékař provést časné ultrazvukové vyšetření k vyloučení možnosti mimoděložního těhotenství.
Rakovina vaječníků a jiných částí rozmnožovacího systému
U žen, které podstoupily léčbu neplodnosti, byla hlášena rakovina vaječníků nebo jiných částí rozmnožovacího systému. Není známo, zda léčba přípravky na podporu plodnosti zvyšuje riziko těchto nádorů u neplodných žen.
Další zdravotní stavy
Před zahájením používání tohoto léku navíc informujte svého lékaře, jestliže:
- máte onemocnění ledvin.
- máte problémy s hypofýzou nebo hypotalamem, které nejsou zaléčeny
- máte sníženou funkci štítné žlázy (hypotyreóza)
- Vaše nadledviny nepracují správně (nedostatečnost nadledvin)
- máte vysokou hladinu prolaktinu v krvi (hyperprolaktinémie)
- máte nějaký jiný zdravotní problém (např. diabetes, srdeční onemocnění nebo jiné dlouhodobé onemocnění)
- Vám lékař sdělil, že pro Vás těhotenství může být nebezpečné Další léčivé přípravky a přípravek Elonva
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste užívala v nedávné době nebo které možná budete užívat, a to i o lécích, které jsou dostupné bez lékařského předpisu.
Těhotenství a kojení
Přípravek Elonva nesmíte užívat, pokud jste již těhotná nebo pokud si myslíte, že byste mohla být těhotná, nebo pokud kojíte.
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat tento lék.
Řízení dopravních prostředků a obsluha strojů
Přípravek Elonva může způsobovat závratě. Pokud pociťujete závratě, nesmíte řídit dopravní prostředky nebo obsluhovat stroje.
Přípravek Elonva obsahuje sodík
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) na injekci, je tedy v podstatě „bezsodíkový“.
3. Jak se přípravek Elonva používá
Vždy používejte přípravek Elonva přesně podle pokynů svého lékaře. Pokud si nejste jistá, poraďte se se svým lékařem nebo lékárníkem.
Přípravek Elonva se používá u žen podstupujících léčbu neplodnosti, například in vitro fertilizaci (IVF). V průběhu léčby se přípravek Elonva používá v kombinaci s lékem (takzvaný antagonista
GnRH), který brání, aby vaječník uvolnil vajíčko příliš brzy. Léčba antagonistou GnRH obvykle začíná za 5 až 6 dní po injekci přípravku Elonva.
Používání přípravku Elonva v kombinaci s agonistou GnRH (další lék, který brání, aby vaječník uvolnil vajíčko příliš brzy) se nedoporučuje.
Dávka
Při léčbě žen v plodném věku je dávka přípravku Elonva založena na hmotnosti a věku.
- Pro ženy, které váží 60 kg nebo méně a kterým je 36 let nebo méně se doporučuje jedna 100mikrogramová dávka.
- Jedna 150mikrogramová dávka se doporučuje pro ženy:
- vážící více než 60 kilogramů bez ohledu na věk.
- vážící 50 kilogramů nebo více ve věku nad 36 let.
Ženy, kterým je více než 36 let a které váží méně než 50 kg, nebyly hodnoceny.
|
Tělesná hmotnost | ||||
|
Méně než 50 kg |
50 - 60 kg |
Více než 60 kg | ||
|
Věk |
36 let nebo méně |
100 mikrogramů |
100 mikrogramů |
150 mikrogramů |
|
Více než 36 let |
Nebylo hodnoceno. |
150 mikrogramů |
150 mikrogramů | |
V průběhu prvních sedmi dní po injekci přípravku Elonva nesmíte užívat (rekombinantní) folikuly stimulující hormon ((rec)FSH). Sedm dní po injekci přípravku Elonva může Váš lékař rozhodnout o pokračování ve stimulačním cyklu jiným gonadotropním hormonem, jako je (rec)FSH. Tato léčba může pokračovat po několik dní, dokud nebude přítomen dostatek folikulů přiměřené velikosti. To lze ověřit ultrazvukovým vyšetřením. Léčba pomocí (rec)FSH se potom zastaví a vajíčka se nechají dozrát podáním hCG (lidský choriogonadotropin). Vajíčka se z vaječníku odebírají za 34-36 hodin.
Jak se přípravek Elonva podává
Léčba přípravkem Elonva musí probíhat pod dohledem lékaře se zkušenostmi v léčbě problémů s plodností. Přípravek Elonva musí být podáván pod kůži (subkutánně) do kožní řasy (sevře se mezi palcem a ukazováčkem) nejlépe přímo pod pupkem. Injekci může podat zdravotnický pracovník (například zdravotní sestra), Váš partner nebo Vy sama, pokud jste pečlivě poučeni Vaším lékařem. Vždy používejte přípravek Elonva přesně podle pokynů svého lékaře. Pokud si nejste jistá, měla byste se poradit se svým lékařem nebo lékárníkem. Na konci této příbalové informace je po jednotlivých krocích uveden „Návod k použití“.
Přípravek Elonva nepodávejte do svalu.
Přípravek Elonva je dodáván v předplněné injekční stříkačce s automatickým bezpečnostním systémem, který předchází poranění při píchnutí jehlou po použití.
Jestliže jste použila více přípravku Elonva nebo (rec)FSH, než jste měla
Pokud si myslíte, že jste použila více přípravku Elonva nebo (rec)FSH, než jste měla, neprodleně kontaktujte svého lékaře.
Jestliže jste zapomněla použít přípravek Elonva
Jestliže jste zapomněla na injekci přípravku Elonva v den, kdy měla být podána, neprodleně kontaktujte svého lékaře. Neaplikujte si přípravek Elonva bez konzultace se svým lékařem.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře.
Možné nežádoucí účinky
4.
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
T-W r V r Vil i i V* 1
Závažné nežádoucí účinky
Možnou komplikací léčby gonadotropními hormony, ke kterým patří i přípravek Elonva, je nechtěná nadměrná stimulace vaječníků. Možnost vzniku této komplikace lze snížit pečlivým monitorováním počtu zrajících folikulů. Váš lékař bude provádět ultrazvukové vyšetření Vašich vaječníků, aby pečlivě monitoroval počet zrajících folikulů. Váš lékař možná bude také kontrolovat hladiny hormonů v krvi. První příznaky nadměrné stimulace vaječníků mohou být pozorovány jako bolest žaludku (břicha), nevolnost nebo průjem. Nadměrná stimulace vaječníků může přejít v onemocnění zvané syndrom nadměrné stimulace vaječníků (OHSS), které může představovat závažný zdravotní problém. V těžších případech může vést ke zvětšení vaječníků, nahromadění tekutiny v břiše a/nebo v hrudníku (což může způsobit nárůst tělesné hmotnosti v důsledku tvorby tekutiny) nebo sraženinám v cévách. Neodkladně kontaktujte svého lékaře, pokud se u Vás objeví bolest žaludku (břicha) nebo jakýkoli jiný příznak nadměrné stimulace vaječníků, i kdyby to bylo několik dní po podání injekce.
Riziko vzniku nežádoucího účinku je popsáno následujícími kategoriemi:
Časté (mohou postihnout až 1 z 10 žen)
- Syndrom nadměrné stimulace vaječníků (OHSS)
- Bolest v pánvi
- Pocit nevolnosti
- Bolest hlavy
- Nepříjemný pocit v pánvi
- Citlivost prsů
- Únava
Méně časté (mohou postihnout až 1 ze 100 žen)
- Přetočení vaječníku (torze vaječníku)
- Zvýšení jaterních enzymů
- Potrat
- Bolest po odběru vajíček
- Bolest během ošetření
- Předčasné uvolnění vajíčka (předčasná ovulace)
- Nadmutí břicha
- Zvracení
- Průjem
- Zácpa
- Bolest v zádech
- Bolest v prsech
- Tvorba modřin nebo bolest v místě injekce
- Předrážděnost
- Změny nálady
- Závrať
- Návaly horka
Také byla hlášena mimoděložní těhotenství (ektopické těhotenství) a mnohočetná těhotenství. Tyto nežádoucí účinky nejsou považovány za související s používáním přípravku Elonva, ale s metodou asistované reprodukce (ART) nebo s následným těhotenstvím.
Ve vzácných případech byla léčba přípravkem Elonva, stejně jako léčba dalšími gonadotropiny, spojena s tvorbou krevních sraženin (trombů), které se po vzniku v cévě uvolnily, putovaly krevním řečištěm a ucpaly jinou cévu (tromboembolismus).
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Elonva uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku a krabičce za „EXP“ (doba použitelnosti). Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávání pro lékárníka
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
Uchovávání pro pacienta
Máte dvě možnosti:
1. Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
2. Uchovávejte při teplotě 25 °C nebo nižší po dobu nepřesahující jeden měsíc. Poznamenejte si začátek doby uchovávání přípravku mimo chladničku a přípravek použijte do jednoho měsíce od tohoto data.
Uchovávejte injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
Nepoužívejte přípravek Elonva
- pokud byl uchováván mimo chladničku po déle než jeden měsíc.
- pokud byl uchováván mimo chladničku při teplotě vyšší než 25 °C.
- pokud zaznamenáte, že roztok není čirý.
- pokud zaznamenáte poškození injekční stříkačky nebo jehly.
Nevyhazujte prázdné nebo nepoužité injekční stříkačky do domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Elonva obsahuje
• Léčivou látkou je korifolitropin alfa. Jedna předplněná injekční stříkačka obsahuje 150 mikrogramů v 0,5 mililitru (ml) injekčního roztoku.
• Pomocnými látkami jsou: natrium-citrát, sacharóza, polysorbát 20, methionin a voda na injekci. Pro úpravu pH mohl být použit hydroxid sodný a/nebo kyselina chlorovodíková.
Jak přípravek Elonva vypadá a co obsahuje toto balení
Elonva je čirý a bezbarvý vodný injekční roztok (injekce) v předplněné injekční stříkačce s automatickým bezpečnostním systémem, který předchází poranění při píchnutí jehlou po použití. Injekční stříkačka je zabalena spolu se sterilní injekční jehlou. Jedna injekční stříkačka obsahuje 0,5 ml roztoku.
V jednom balení je jedna předplněná injekční stříkačka.
Přípravek Elonva je dostupný ve dvou silách: 100 mikrogramů a 150 mikrogramů injekční roztok.
Držitel rozhodnutí o registraci
Merck Sharp & Dohme Limited, Hertford Road, Hoddesdon, Hertfordshire EN11 9BU, Velká Británie.
Výrobci
N.V. Organon, Kloosterstraat 6, 5349 AB Oss, Nizozemsko Organon (Ireland) Ltd., Drynam Road, Swords, Co. Dublin, Irsko
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci
|
Belgie/Belgique/Belgien MSD Belgium BVBA/SPRL Tel/Tél: 0800 38 693 (+32(0)27766211) |
Lietuva UAB Merck Sharp & Dohme Tel: + 370 5 2780247 msd_lietuva@merck.com |
|
Btarapna MepK fflapn h floyM Etarapna EOOfl Ten.: + 359 2 819 37 37 info-msdbg@merck.com |
Luxembourg/Luxemburg MSD Belgium BVBA/SPRL Tel/Tél: +32(0)27766211 dpoc_belux@merck.com |
|
Česká republika Merck Sharp & Dohme s.r.o. Tel.: +420 233 010 111 dpoc_czechslovak@merck.com |
Magyarország MSD Pharma Hungary Kft. Tel.: + 36 1 888-5300 hungary_msd@merck.com |
|
Danmark MSD Danmark ApS Tlf: + 45 4482 4000 dkmail@merck.com |
Malta Merck Sharp & Dohme Cyprus Limited Tel: 8007 4433 (+356 99917558) malta_info@merck.com |
|
Deutschland MSD SHARP & DOHME GMBH Tel: 0800 673 673 673 (+49 (0) 89 4561 2612) |
Nederland Merck Sharp & Dohme BV Tel: 0800 99 99 000 (+ 31 23 5153153) |
|
Eesti Merck Sharp & Dohme OU Tel: + 372 6144 200 msdeesti@merck.com |
Norge MSD (Norge) AS Tlf: + 47 32 20 73 00 msdnorge@msd.no |
|
EXXáSa MSD A.O.B.E.E TpA,: + 30 210 98 97 300 |
Osterreich Merck Sharp & Dohme Ges.m.b.H. Tel: +43 (0) 1 26 044 msd-medizin@merck.com |
|
Espaňa Merck Sharp & Dohme de Espana, S.A. Tel: +34 91 321 06 00 msd info@merck.com |
Polska MSD Polska Sp.z o.o. Tel.: +48 22 549 51 00 msdpolska@merck.com |
|
France MSD France Tél. + 33 (0) 1 80 46 40 40 |
Portugal Merck Sharp & Dohme, Lda Tel: + 351 214465700 clic@merck.com |
Hrvatska
Merck Sharp & Dohme d.o.o.
Tel: + 385 1 6611 333 croatia_info@merck.com
Ireland
Merck Sharp & Dohme Ireland (Human Health) Limited
Tel: +353 (0)1 2998700 medinfo_ireland@merck.com
Ísland
Vistor hf.
Sími: + 354 535 7000
Italia
MSD Italia S.r.l.
Tel: +39 06 361911 medicalinformation.it@merck.com
Kúrcpog
Merck Sharp & Dohme Cyprus Limited TpA.: 800 00 673 +357 22866700 cyprus_info@merck.com
Latvija
SIA Merck Sharp &Dohme Latvija Tel: + 371 67 364224 msd_lv@merck.com
Románia
Merck Sharp & Dohme Romania S.R.L.
Tel: + 40 21 529 29 00 msdromania@merck.com
Slovenija
Merck Sharp & Dohme, inovativna zdravila d.o.o.
Tel: + 386 1 5204201 msd_slovenia@merck.com
Slovenská republika
Merck Sharp & Dohme, s. r. o.
Tel: + 421 (2) 58282010 dpoc_czechslovak@merck.com
Suomi/Finland
MSD Finland Oy Puh/Tel: + 358 (0)9 804650 info@msd.fi
Sverige
Merck Sharp & Dohme (Sweden) AB Tel: + 46 (0)77 5700488 medicinskinfo@merck.com
United Kingdom
Merck Sharp & Dohme Limited Tel: +44 (0) 1992 467272 medicalinformationuk@merck.com
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Návod k použití
Součásti injekční stříkačky s přípravkem Elonva s jehlou
stříkačka
roztok
krytka stříkačky krytka jehly jehla
ochrana jehly
perforace nálepky
Příprava injekce

2.
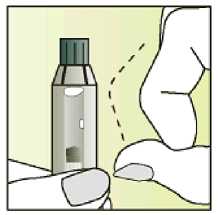
3.
4.
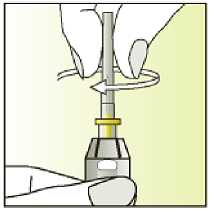
5.
Umyjte si ruce mýdlem a vodou a osušte je před použitím přípravku Elonva.
Tampónem naneste na místo vpichu (místo těsně pod pupkem) dezinfekci (např. alkohol), aby se odstranily všechny povrchové bakterie.
Očistěte asi 5 cm okolo místa, kam se bude zavádět jehla, a nechte dezinfekci schnout alespoň jednu minutu před dalším postupem.
Zatímco dezinfekce schne, porušte perforaci na nálepce a sundejte krytku jehly
Ochranu jehly ponechejte na místě
Ochranu jehly (obsahující jehlu) položte během přípravy injekční stříkačky na čistý suchý povrch.
Injekční stříkačku držte šedou krytkou vzhůru
Prstem jemně poklepejte na injekční stříkačku, abyste pomohla
bublinkám vzduchu vystoupat k hornímu okraji.
Injekční stříkačku dále držte namířenou vzhůru
Odšroubujte krytku injekční stříkačky proti směru hodinových
ručiček.
Injekční stříkačku dále držte namířenou vzhůru
Zašroubujte ochranu jehly (obsahující jehlu) po směru hodinových
ručiček na injekční stříkačku.
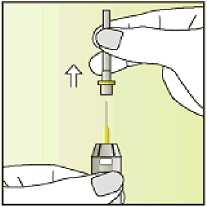
Podání injekce
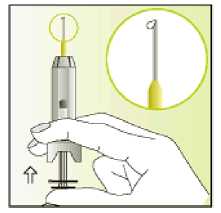
7.
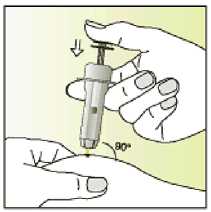
8.
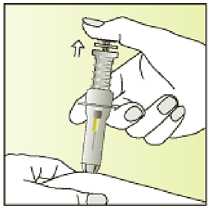
9.
Injekční stříkačku dále držte namířenou vzhůru Ochranu jehly odstraňte přímým tahem a vyhoďte ji S jehlou ZACHÁZEJTE OPATRNĚ.
Nyní uchopte injekční stříkačku mezi ukazovák a prostředník v poloze směrem vzhůru Palec přiložte k pístu
Opatrně zatlačte na píst směrem vzhůru, až se na špičce jehly objeví malá kapička.
Palcem a ukazovákem vytvořte kožní řasu Do kožní řasy zaveďte celou jehlu v úhlu 90 stupňů OPATRNĚ stlačujte píst, dokud je to možné, a držte píst dole POČÍTEJTE DO PĚTI, aby byla zaručena aplikace celého roztoku.
Sundejte palec z pístu
Jehla se automaticky zasune do injekční stříkačky, ve které bude trvale uzavřena.
59
důsledku dlouhého eliminačního poločasu jsou po podání doporučené dávky sérové koncentrace korifolitropinu alfa dostatečné pro udržení růstu mnohočetných folikulů po celý týden. To odůvodňuje nahrazení prvních sedmi injekcí denně podávaného (rec)FSH jednorázovou subkutánní injekcí přípravku Elonva v COS pro vývoj mnohočetných folikulů a navození těhotenství v rámci programu ART (viz bod 4.2).
Předpokládané rozmezí pro 90 % subjektů.
důsledku dlouhého eliminačního poločasu jsou po podání doporučené dávky sérové koncentrace korifolitropinu alfa dostatečné pro udržení růstu mnohočetných folikulů po celý týden. To odůvodňuje nahrazení prvních sedmi injekcí denně podávaného (rec)FSH jednorázovou subkutánní injekcí přípravku Elonva v COS pro vývoj mnohočetných folikulů a navození těhotenství v rámci programu ART (viz bod 4.2).
Předpokládané rozmezí pro 90 % subjektů.