Elocta 3000 Iu
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
ELOCTA 250 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 500 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 750 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 1000 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 1500 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 2000 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 3000 IU prášek a rozpouštědlo pro injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Elocta 250 IU prášek a rozpouštědlo pro injekční roztok
Jedna injekční lahvička obsahuje nominálně efmoroctocogum alfa 250 IU. Po rekonstituci obsahuje jeden ml injekčního roztoku přibližně efmoroctocogum alfa 83 IU.
ELOCTA 500 IU prášek a rozpouštědlo pro injekční roztok
Jedna injekční lahvička obsahuje nominálně efmoroctocogum alfa 500 IU. Po rekonstituci obsahuje jeden ml injekčního roztoku přibližně efmoroctocogum alfa 167 IU.
ELOCTA 750 IU prášek a rozpouštědlo pro injekční roztok
Jedna injekční lahvička obsahuje nominálně efmoroctocogum alfa 750 IU. Po rekonstituci obsahuje jeden ml injekčního roztoku přibližně efmoroctocogum alfa 250 IU.
ELOCTA 1000 IU prášek a rozpouštědlo pro injekční roztok
Jedna injekční lahvička obsahuje nominálně efmoroctocogum alfa 1 000 IU. Po rekonstituci obsahuje jeden ml injekčního roztoku přibližně efmoroctocogum alfa 333 IU.
ELOCTA 1500 IU prášek a rozpouštědlo pro injekční roztok
Jedna injekční lahvička obsahuje nominálně efmoroctocogum alfa 1 500 IU. Po rekonstituci obsahuje jeden ml injekčního roztoku přibližně efmoroctocogum alfa 500 IU.
ELOCTA 2000 IU prášek a rozpouštědlo pro injekční roztok
Jedna injekční lahvička obsahuje nominálně efmoroctocogum alfa 2 000 IU. Po rekonstituci obsahuje jeden ml injekčního roztoku přibližně efmoroctocogum alfa 667 IU.
ELOCTA 3000 IU prášek a rozpouštědlo pro injekční roztok
Jedna injekční lahvička obsahuje nominálně efmoroctocogum alfa 3 000 IU. Po rekonstituci obsahuje jeden ml injekčního roztoku přibližně efmoroctocogum alfa 1 000 IU.
Účinnost (IU) se stanovuje podle Evropského lékopisu chromogenní analýzou proti vlastnímu standardu, který je uveden ve standardu pro faktor VIII WHO. Specifická aktivita přípravku ELOCTA je 4 00010 200 IU/mg proteinu.
Efmoroktokog alfa (rekombinantní humánní koagulační faktor VIII, Fc fuzní protein (rFVIIFc)) obsahuje 1 890 aminokyselin. Vyrábí se rekombinantní DNA technologií v buněčné linii na humánních embryonálních ledvinách (HEK) bez přídavku jakékoliv bílkoviny lidského či zvířecího původu během kultivace buněk, čištění či konečné úpravy přípravku.
Pomocná látka se známým účinkem 0,6 mmol (nebo 14 mg) sodíku v injekční lahvičce. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční roztok.
Prášek: lyofilizovaný, bílý až téměř bílý prášek nebo koláč lyofilizátu. Rozpouštědlo: voda na injekci, čirý, bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Léčba a prevence krvácení u pacientů s hemofilií A (vrozený deficit faktoru VIII).
Přípravek ELOCTA lze používat ve všech věkových skupinách.
4.2 Dávkování a způsob podání
Léčba se má zahajovat pod dohledem lékaře, který má zkušenosti s léčbou hemofilie.
Dosud neléčení _ pacienti
Bezpečnost a účinnost přípravku ELOCTA u dosud neléčených pacientů nebyly dosud stanoveny. Nejsou dostupné žádné údaje.
Dávkování
Dávkování a trvání substituční terapie závisí na závažnosti nedostatku faktoru VIII, na místě a rozsahu krvácení a na klinickém stavu pacienta.
Počet podávaných jednotek rekombinantního faktoru VIII Fc se vyjadřuje v mezinárodních jednotkách (International Units, IU), které jsou stanovené oproti současnému standardu WHO pro léčivé přípravky obsahující faktor VIII. Aktivita FVIII v plazmě se vyjadřuje buď v procentech (vzhledem k normální lidské plazmě) nebo v IU (vzhledem k mezinárodnímu standardu pro FVIII v plazmě).
1 IU aktivity rekombinantního faktoru VIII Fc odpovídá množství faktoru VIII v 1 ml normální lidské plazmy.
Léčba on demand
Výpočet požadované dávky rekombinantního faktoru VIII Fc vychází z empirického předpokladu, že podání 1 IU faktoru VIII na kg tělesné hmotnosti zvýší plazmatickou aktivitu FVIII v plazmě o 2 IU/dl. Požadovaná dávka se stanoví podle následujícího vzorce:
Požadovaný počet jednotek = tělesná hmotnost (kg) x požadovaný vzestup FVIII (%) (IU/dl) x 0,5 (IU/kg na IU/dl)
Množství, které se má podat, a frekvence podávání mají vždy směřovat ke klinické účinnosti v individuálním případě (viz bod 5.2). Neočekává se zpoždění doby do dosažení maximální aktivity.
V případě následujících hemoragických příhod nemá aktivita faktoru VIII během daného období klesnout pod stanovenou hladinu plazmatické aktivity (v % normálu nebo IU/dl). Tabulka 1 může posloužit jako návod pro stanovení dávky v případech krvácení a při chirurgických výkonech:
Tabulka 1: Návod pro dávkování přípravku ELOCTA pro léčbu krvácivých příhod a chirurgických výkonů
|
Stupeň krvácení/typ chirurgického výkonu |
Požadovaná hladina FVIII (%) (IU/dl) |
Frekvence dávkování (hodiny) / délka trvání léčby (dny) |
|
Krvácení Časný hemartros, krvácení do svalstva nebo do ústní dutiny |
20-40 |
Infuzi opakovat každých 12-24 hodin po dobu minimálně 1 dne, dokud se krvácení nezastaví, což se projeví ústupem bolesti nebo zahojením. 1 |
|
Rozsáhlejší hemartros, krvácení do svalstva nebo hematom |
30-60 |
Infuzi opakovat každých 12-24 hodin po dobu 3-4 dní nebo déle, dokud bolest a akutní potíže neustoupí. 1 |
|
Život ohrožující krvácení |
60-100 |
Infuzi opakovat každých 8-24 hodin, dokud nepomine ohrožení. |
|
Chirurgický výkon Menší chirurgický výkon včetně extrakce zubu |
30-60 |
Infuzi opakovat každých 24 hodin po dobu minimálně 1 dne, až do zahojení. |
|
Velký chirurgický výkon |
80-100 (před a po operaci) |
Infuzi opakovat každých 8-24 hodin podle potřeby, dokud nedojde k uspokojivému zahojení rány, potom pokračovat v léčbě nejméně dalších 7 dní a udržovat aktivitu FVIII mezi 30-60 % (IU/dl). |
1 U některých pacientů a za některých okolností může být interval dávkování prodloužen až na 36 hodin. Viz bod 5.2 pro farmakokinetické údaje.
Profylaxe
V případě dlouhodobé profylaxe se doporučuje dávka 50 IU/kg každých 3 až 5 dnů. Dávka může být upravena podle odpovědi pacienta v rozmezí od 25 do 65 IU/kg (viz bod 5.1 a 5.2). V některých případech, zejména u mladších pacientů, může být nutný kratší interval mezi dávkami nebo vyšší dávky.
Monitorování léčby
V průběhu léčby je doporučeno provádět příslušné stanovení hladiny faktoru VIII (pomocí jednorázového vyšetření srážlivosti nebo chromogenního testu) za účelem získání vodítka pro velikost podávané dávky
i četnost opakovaných aplikací. U jednotlivých pacientů se může jejich odpověď na faktor VIII lišit dosahováním různých poločasů a hodnot obnovy faktoru VIII. Dávka podle tělesné hmotnosti může vyžadovat úpravu u pacientů s nízkou tělesnou hmotností a nadváhou. Zvláště u velkých chirurgických výkonů je přesné monitorování substituční léčby pomocí koagulačního vyšetření (aktivita faktoru VIII v plazmě) nepostradatelné.
Při použití jednorázového vyšetření koagulace na základě in vitro tromboplastinového času (aPTT) pro stanovení aktivity faktoru VIII u vzorků krve pacientů mohou být výsledky aktivity faktoru VIII významně ovlivněny jak typem aPTT reagencia, tak referenčním standardem použitým v testu. To je zvláště důležité při změně laboratoře a/nebo reagencia používaného v testu.
Starší _ populace
Zkušenosti u pacientů ve věku >65 let jsou omezené.
Pediatrická _ populace
U dětí ve věku do 12 let mohou být nutné častější nebo vyšší dávky (viz bod 5.1). U dospívajících ve věku 12 let a starších platí stejná doporučení jako u dospělých.
Způsob podání Intravenózní podání.
Přípravek ELOCTA by měl být podáván intravenózně injekcí během několika minut. Rychlost podávání by měla být stanovena podle úrovně pohodlí pacienta a neměla by přesáhnout 10 ml/min.
Návod k rekonstituci tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku (rekombinantní humánní koagulační faktor VIII a/nebo Fc doména) nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Hypersenzitivita
U přípravku ELOCTA jsou možné reakce z přecitlivělosti alergického typu. Pokud se objeví příznaky hypersenzitivity, pacienti by měli být poučeni, aby okamžitě ukončili používání léčivého přípravku a kontaktovali svého lékaře.
Pacienti mají být informováni o známkách reakcí z přecitlivělosti, jako je kopřivka, generalizovaná kopřivka, tlak na hrudi, sípání, hypotenze a anafylaxe.
V případě anafylaktického šoku je nutné dodržovat všeobecné lékařské postupy pro léčbu šoku.
Inhibitory
Známou komplikací léčby u individuálních případů hemofilie A je vznik neutralizačních protilátek (inhibitorů) proti faktoru VIII. Tyto inhibitory jsou obvykle IgG imunoglobuliny působící proti koagulační aktivitě faktoru VIII. Jsou kvantitativně udávané v Bethesda jednotkách (BU) na jeden ml plazmy a zjišťované pomocí modifikovaného testu. Riziko vzniku inhibitorů souvisí s expozicí faktoru VIII, přičemž toto riziko je nejvyšší během prvních 20 dnů expozice. Vzácně může dojít k tvorbě inhibitorů teprve po prvních 100 dnech expozice.
U dříve léčených pacientů s více než 100 dny expozice, kteří měli v anamnéze vývoj inhibitoru, byly pozorovány případy recidivujícího inhibitoru (nízký titr) po převodu z jednoho přípravku s obsahem faktoru VIII na jiný. Proto se doporučuje pečlivě monitorovat všechny pacienty pro výskyt inhibitoru po převodu na jakýkoli přípravek.
Obecně by všichni pacienti léčení přípravky obsahujícími koagulační faktor VIII měli být pečlivě sledováni z hlediska vzniku inhibitorů prostřednictvím vhodných klinických vyšetření a laboratorních testů. Pokud není dosaženo očekávané hladiny aktivity faktoru VIII nebo kontroly krvácení příslušnou dávkou, musí být provedeny testy na přítomnost inhibitoru faktoru VIII. U pacientů s vysokou hladinou inhibitorů může být léčba faktorem VIII neúčinná, a je třeba zvážit jiné léčebné možnosti. Léčba takovýchto pacientů by měla být prováděna lékařem se zkušeností v oblasti péče o pacienty s hemofilií a s inhibitory proti faktoru VIII.
Kardiovaskulární příhody
U pacientů se stávajícími kardiovaskulárními rizikovými faktory může substituční léčba pomocí FVIII zvýšit kardiovaskulární riziko.
Komplikace související s použitím katétru
Pokud je nutné použití centrálního žilního katétru (CŽK), je nutno zvážit riziko komplikací spojené s jeho použitím, včetně lokálních infekcí, bakteriémie a trombózy v místě zavedení katétru.
Záznam čísla šarže
Důrazně se doporučuje, aby vždy, když je přípravek ELOCTA podáván pacientovi, byl zaznamenán název a číslo šarže přípravku, aby byla jasná souvislost mezi pacientem a šarží léčivého přípravku.
Pediatrická populace
Uvedená varování a preventivní opatření platí pro dospělé i děti.
Zřetel na obsažené pomocné látky
Tento léčivý přípravek obsahuje 0,6 mmol (nebo 14 mg) sodíku v injekční lahvičce. Nutno vzít v úvahu u pacientů na dietě s nízkým obsahem sodíku.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
U lidského koagulačního faktoru VIII (rDNA) nebyly hlášeny žádné interakce s jinými léčivými přípravky. U přípravku ELOCTA nebyly provedeny žádné studie interakcí.
4.6 Fertilita, těhotenství a kojení
Těhotenství a kojení
S přípravkem ELOCTA se neprováděly reprodukční studie u zvířat. Byla provedena studie placentárního přenosu u myší (viz bod 5.3). Vzhledem k vzácnému výskytu hemofilie A u žen nejsou k dispozici zkušenosti týkající se použití faktoru VIII během těhotenství a kojení. Proto by měl být faktor VIII používán během těhotenství a laktace pouze tehdy, pokud je to jednoznačně indikováno.
Fertilita
Nejsou k dispozici žádné údaje o fertilitě. U zvířat nebyly provedeny žádné studie fertility s přípravkem ELOCTA.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek ELOCTA nemá žádný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky Souhrn bezpečnostního profilu
Vzácně byly pozorovány hypersenzitivita nebo alergické reakce (které mohou zahrnovat otok obličeje, vyrážku, kopřivku, tlak na hrudi a problémy s dýcháním, pálení a píchání v místě podání infuze, třesavku, zrudnutí, generalizovanou kopřivku, bolest hlavy, hypotenzi, letargii, nauzeu, neklid, tachykardii), které mohou v některých případech vyústit v těžkou anafylaxi (včetně šoku).
U pacientů s hemofilií A se mohou vytvořit neutralizační protilátky (inhibitory) proti faktoru VIII. Pokud se takové inhibitory objeví, projeví se jako nedostatečná klinická odpověď. V takových případech se doporučuje vyhledat specializované pracoviště k léčbě hemofilie.
Tabulkový seznam nežádoucích účinků
Frekvence v tabulce 2 uvedené níže byly pozorovány u celkem 233 pacientů se závažnou hemofilií A v klinických studiích fáze III a v prodloužené studii. Celkový počet dnů expozice byl 34 746 s mediánem 129 (rozmezí 1 - 326) dnů expozice na pacienta.
Tabulka 2 uvedená níže vychází z klasifikace orgánových systémů MedDRA (SOC a preferovaná úroveň termínu).
Hodnoty frekvence byly hodnoceny podle následující konvence: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
V rámci každé skupiny frekvence jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Třídy orgánových systémů dle MedDRA |
Nežádoucí účinky |
Kategorie dle frekvence |
|
Poruchy nervového systému |
Závrať Dysgeuzie |
Méně časté Méně časté Méně časté |
|
Srdeční poruchy |
Bradykardie |
Méně časté |
|
Cévní poruchy |
Hypertenze Nával horka Angiopatie1 |
Méně časté Méně časté Méně časté |
|
Respirační, hrudní a mediastinální poruchy |
Méně časté | |
|
Gastrointestinální poruchy |
Bolest dolní poloviny břicha |
Méně časté |
|
Poruchy kůže a podkožní tkáně |
Méně časté | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Artralgie Myalgie Bolest zad Otok kloubu |
Méně časté Méně časté Méně časté Méně časté |
|
Celkové poruchy a reakce v místě aplikace |
Malátnost Bolest na hrudi Pocit chladu Pocit horka |
Méně časté Méně časté Méně časté Méně časté |
|
Vyšetření |
Pozitivní protilátky proti faktoru VIII2 |
Méně časté |
|
Poranění, otravy a procedurální komplikace |
Hypotenze v souvislosti s výkonem |
Méně časté |
1 Pojem zkoušejícího: cévní bolest po injekční aplikaci přípravku ELOCTA
2 Jeden dospělý pacient měl pozitivní výsledek na protilátky proti faktoru VIII současně s jednorázovým měřením titru neutralizačních protilátek 0,73 Bethesda jednotek/ml v týdnu 14. Neutralizační protilátky nebyly potvrzeny při opakovaném testování 18 dnů později a při následných návštěvách byly negativní. Došlo ke zvýšení clearance (CL) v týdnu 14, které vymizelo při pokračující léčbě rFVnIFc.
Poregistrační zkušenosti
V poregistračním období byl pozorován vznik inhibitoru FVIII.
Pediatrická populace
Mezi dětmi a dospělými nebyly pozorovány žádné pro věk specifické rozdíly ve výskytu nežádoucích účinků.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Nebyly hlášeny žádné případy předávkování.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Hemostatika, koagulační faktor VIII, ATC kód: B02BD02 Mechanismus účinku
Komplex faktoru VIII/von Willebrandova faktoru se skládá ze dvou molekul (faktoru VIII a von Willebrandova faktoru) s různými fyziologickými funkcemi. Po aktivaci koagulační kaskády se faktor VIII konvertuje na aktivovaný faktor VIII a uvolní se z von Willebrandova faktoru. Aktivovaný faktor VIII působí jako kofaktor aktivovaného faktoru IX, urychlující konverzi faktoru X na aktivovaný faktor X na fosfolipidových površích. Aktivovaný faktor X transformuje protrombin na trombin. Trombin následně transformuje fibrinogen na fibrin a může dojít k vytvoření sraženiny.
Hemofilie A je pohlavně vázaná dědičná porucha srážlivosti krve způsobená sníženou hladinou funkčního faktoru VIII, v důsledku které dochází ke krvácení do kloubů, svalů nebo vnitřních orgánů, buď spontánnímu, nebo jako následek úrazu při nehodě či chirurgickém zákroku. Substituční léčbou se hladina faktoru VIII v plazmě zvýší, díky čemuž je možná přechodná korekce deficitu faktoru a korekce sklonu ke krvácení.
Přípravek ELOCTA (efmoroktokog alfa) je plně rekombinantní fuzní protein s prodlouženým poločasem rozpadu. Skládá se z rekombinantního humánního koagulačního faktoru VIII bez B-domény, kovalentně vázaného na Fc doménu humánního imunoglobulinu G1. Fc region humánního imunoglobulinu G1 se váže na neonatální Fc receptor. Tento receptor je exprimován v průběhu života a je součástí přirozeně se vyskytujícího mechanismu, který chrání imunoglobuliny před lysozomální degradací navrácením těchto proteinů zpět do oběhu, což vede k jejich dlouhému plazmatickému biologickému poločasu. Efmoroktokog alfa se váže na neonatální Fc receptor a tím využívá stejný, přirozeně se vyskytující mechanismus pro zpoždění lysozomální degradace a umožňuje dosažení delšího plazmatického biologického poločasu než endogenní faktor VIII.
Klinická účinnost a bezpečnost
Bezpečnost, účinnost a farmakokinetika přípravku ELOCTA byly hodnoceny ve 2 mezinárodních, otevřených, pivotních studiích - studii fáze 3 označené jako studie I a pediatrické studii fáze 3 označené jako studie II (viz Pediatrická populace).
Studie I srovnávala účinnost každého ze 2 profylaktických režimů léčby (individualizovaný a týdenní) pro léčbu on demand. Do studie bylo zařazeno celkem 165 dříve léčených mužských pacientů (12 až 65 let) se závažnou hemofilií A. Pacienti na profylaktickém režimu před zařazením do studie byli zařazeni do individualizovaného profylaktického ramena. Pacienti na on demand léčbě před vstupem byli zařazeni buď do ramena individualizované profylaxe nebo byli randomizováni do ramena týdenní profylaxe či do on demand ramen. V ramenu individualizované profylaxe zahájili pacienti režim léčby léčbou dvakrát týdně zahrnující 25 IU/kg první den s následným podáním 50 IU/kg čtvrtý den. Úprava dávky a intervalu individualizované profylaxe byla prováděna v rozmezí od 25 do 65 IU/kg každých 3 až 5 dnů. Týdenní profylaktická dávka byla 65 IU/kg. Kromě toho byla ve studii I hodnocena hemostatická účinnost při léčbě epizod krvácení a stanovena hemostatická účinnost během perioperativní léčby u pacientů podstupujících velké chirurgické výkony.
Individualizovaná_profylaxe: U 117 hodnotitelných pacientů zařazených do ramena individualizované profylaxe ve studii I byl střední interval dávky 3,51 (interkvartilní rozmezí 3,17-4,43) dnů a střední celková týdenní dávka byla 77,90 (interkvartilní rozmezí 72,35-91,20) IU/kg.
Medián roční četnosti krvácení u pacientů hodnotitelných z hlediska účinnosti byl 1,60 (interkvartilní rozmezí 0,0-4,69) u pacientů v ramenu individualizované profylaxe, 3,59 (1,86-8,36) u pacientů v ramenu týdenní profylaxe a 33,57 (21,14-48,69) u pacientů v ramenu léčby on demand. Žádné epizody krvácení se nevyskytly u 45,3 % pacientů léčených v režimu individualizované profylaxe a u 17,4 % pacientů léčených v režimu týdenní profylaxe.
Léčba krvácení: Ze 757 příhod krvácení pozorovaných během studie I bylo 87,3 % kontrolováno pomocí 1 injekce a celkem 97,8 % pomocí 2 nebo méně injekcí. Střední dávka na injekci pro léčbu epizody krvácení byla 27,35 (interkvartilní rozmezí 22,73-32,71) IU/kg. Střední celková dávka pro léčbu epizody krvácení byla 31,32 IU/kg (23,53; 52,53) v ramenu individualizované profylaxe a v ramenu týdenní profylaxe a 27,35 IU/kg (22,59; 32,71) v ramenu léčby on demand.
Perioperační léčba (chirurgická profylaxe): Ve studii I a v prodloužené studii bylo provedeno a vyhodnoceno celkem 23 velkých chirurgických výkonů u 22 pacientů. Většině pacientů (95,7 %) byla podána jedna předoperační dávka pro udržení hemostázy během operace. Střední dávka na injekci pro udržení hemostázy během operace byla 58,3 (rozmezí 45-102) IU/kg. V den operace byla většině pacientů podána druhá injekce. Celková dávka v den operace se pohybovala od 50,8 do 126,6 IU/kg.
Pediatrická populace <12 let věku
Do studie II bylo zařazeno celkem 71 dříve léčených mužských pediatrických pacientů se závažnou hemofilií A. Ze 71 zařazených pacientů byla 69 podána minimálně 1 dávka přípravku ELOCTA; tyto pacienty bylo možno hodnotit z hlediska účinnosti. Pacienti byli ve věku do 12 let (35 bylo ve věku <6 let a 34 bylo ve věku 6 až <12 let). Úvodní profylaktický režim zahrnoval 25 IU/kg první den s následným podáním 50 IU/kg čtvrtý den. U omezeného počtu pacientů ve studii byly povoleny a podávány dávky do 80 IU/kg a interval dávkování až 2 dny.
Individualizovaná profylaxe: U pediatrických pacientů v režimu individualizované profylaxe byl střední interval dávky 3,49 (interkvartilní rozmezí 3,46-3,51) dnů a střední celková týdenní dávka 91,63 (interkvartilní rozmezí 84,72-104,56) IU/kg u pacientů ve věku <6 let a 86,88 (interkvartilní rozmezí 79,12-103,08) IU/kg u pacientů ve věku od 6 do <12 let. Většina pacientů (78,3 %) pokračovala v režimu dávkování se střídajícími se dávkami (medián 31,73 IU/kg nižší dávka a 55,87 IU/kg vyšší dávka). Medián celkové roční četnosti krvácení byl 1,96 (interkvartilní rozmezí 0,00-3,96). U 46,4 pediatrických pacientů se nevyskytly žádné epizody krvácení.
Léčba krvácení: Z 86 příhod krvácení pozorovaných během studie II bylo 81,4 % kontrolováno pomocí 1 injekce a celkem 93,0 % epizod krvácení bylo kontrolováno pomocí 2 nebo méně injekcí. Střední dávka na injekci pro léčbu epizody krvácení byla 49,69 (interkvartilní rozmezí 29,41-56,82) IU/kg. Střední celková dávka pro léčbu epizody krvácení byla 54,90 IU/kg (29,41; 71,09).
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem ELOCTA u jedné nebo více podskupin pediatrické populace v léčbě vrozeného deficitu faktoru VIII (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Všechny farmakokinetické studie s přípravkem ELOCTA byly provedeny u dříve léčených pacientů se závažnou hemofilií A. Údaje prezentované v tomto bodě byly získány při chromogenních testech a jednorázových testech srážlivosti. Farmakokinetické parametry získané chromogenní metodou byly podobné jako parametry odvozené z jednorázového testu.
Farmakokinetické vlastnosti byly hodnoceny u 28 pacientů (>15 let) léčených přípravkem ELOCTA (rFVIIIFc). Po období bez léčby v trvání minimálně 96 hodin (4 dny) dostali pacienti jednotlivou dávku 50 IU/kg přípravku ELOCTA. Farmakokinetické vzorky byly shromážděny před dávkou a pak následně v 7 časových bodech až do 120 hodin (5 dnů) po podání dávky. Farmakokinetické parametry po podání dávky 50 IU/kg přípravku ELOCTA jsou uvedeny v tabulkách 3 a 4.
Tabulka 3: Farmakokinetické parametry přípravku ELOCTA získané pomocí jednorázového testu srážlivosti
|
Farmakokinetické parametry1 |
ELOCTA 95% IS |
|
N=28 | |
|
Přírůstková recovery (IU/dl na IU/kg) |
2,24 (2,11-2,38) |
|
AUC/Dávka |
51,2 |
|
(IU*h/dl na IU/kg) |
(45,0-58,4) |
|
Cmax (IU/dl) |
108 (101-115) |
|
CL (ml/h/kg) |
1,95 (1,71-2,22) |
|
t/ (h) |
19,0 (17,0-21,1) |
|
MRT (h) |
25,2 (22,7-27,9) |
|
Vss (ml/kg) |
49,1 (46,6-51,7) |
|
1 Farmakokinetické parametry jsou uvedeny ja |
co geometrický průměr (95% IS) |
Zkratky: IS = interval spolehlivosti; Cmax= maximální aktivita; AUC = plocha pod křivkou aktivita FVIII -čas; t/= terminální biologický poločas; CL = clearance; Vss = distribuční objem v ustáleném stavu; MRT = průměrný rezidenční čas.
Zkratky: IS = interval spolehlivosti; Cmax= maximální aktivita; AUC = plocha pod křivkou aktivita FVIII -čas; t/= terminální biologický poločas; CL = clearance; Vss = distribuční objem v ustáleném stavu; MRT = průměrný rezidenční čas.
|
Farmakokinetické parametry1 |
ELOCTA 95% IS |
|
N=27 | |
|
Přírůstková recovery (IU/dl na IU/kg) |
2,49 (2,28-2,73) |
|
AUC/Dávka |
47,5 |
|
(IU*h/dl na IU/kg) |
(41,6-54,2) |
|
Cmax (IU/dl) |
131 (104-165) |
|
CL (ml/h/kg) |
2,11 (1,85-2,41) |
|
t/ (h) |
20,9 (18,2-23,9) |
|
MRT (h) |
25,0 (22,4-27,8) |
|
Vss (ml/kg) |
52,6 (47,4-58,3) |
|
1 Farmakokinetické parametry jsou uvedeny ja |
co geometrický průměr (95% IS) |
Farmakokinetické údaje prokazují, že přípravek ELOCTA má prodloužený cirkulující poločas.
Pediatrická populace
Farmakokinetické parametry přípravku ELOCTA byly stanoveny pro dospívající ve studii I (odběr vzorků na farmakokinetické vyšetření byl proveden před podáním dávky s následným hodnocením při více časových bodech až do 120 hodin (5 dnů) po podání dávky) a u dětí ve studii II (odběr vzorků na farmakokinetické vyšetření byl proveden před podáním dávky s následným hodnocením při více časových bodech až do 72 hodin (3 dny) po podání dávky). Tabulky 5 a 6 uvádí farmakokinetické parametry vypočtené z pediatrických údajů u pacientů ve věku do 18 let.
Tabulka 5: Farmakokinetické parametry přípravku ELOCTA pro použití u pediatrických pacientů získané pomocí jednorázového testu srážlivosti_^_
|
Studie II |
Studie I* | |||
|
Farmakokinetické parametry1 |
< 6 let |
6 až <12 let |
12 až <18 let | |
|
N=23 |
N=31 |
N=11 | ||
|
Přírůstková recovery (IU/dl na IU/kg) |
1,90 (1,79-2,02) |
2,30 (2,04-2,59) |
1,81 (1,56-2,09) | |
|
AUC/Dose (IU*h/dl na IU/kg) |
28,9 (25,6-32,7) |
38,4 (33,2-44,4) |
38,2 (34,0-42,9) | |
|
t/ (h) |
12,3 (11,0-13,7) |
13,5 (11,4-15,8) |
16,0 (13,9-18,5) | |
|
MRT (h) |
16,8 (15,1-18,6) |
19,0 (16,2-22,3) |
22,7 (19,7-26,1) | |
|
CL (ml/h/kg) |
3,46 (3,06-3,91) |
2,61 (2,26-3,01) |
2,62 (2,33-2,95) | |
|
Vss (ml/kg) |
57,9 (54,1-62,0) |
49,5 (44,1-55,6) |
59,4 (52,7-67,0) | |
1 Farmakokinetické parametry jsou uvedeny jako geometrický průměr (95% IS)
Zkratky: IS = interval spolehlivosti; AUC = plocha pod křivkou aktivita FVIII - čas; t/ = terminální biologický poločas;
CL = clearance; MRT = střední rezidenční čas; Vss = distribuční objem v ustáleném stavu *Farmakokinetické parametry u pacientů ve věku od 12 do <18 let ze všech ramen ve studii I s různými schématy odběru vzorků
Tabulka 6: Farmakokinetické parametry přípravku ELOCTA pro použití u pediatrických pacientů získané pomocí chromogenního testu_^_
|
Studie II |
Studie I* | |||
|
Farmakokinetické parametry1 |
< 6 let |
6 až <12 let |
12 až <18 let | |
|
N=24 |
N=27 |
N=11 | ||
|
Přírůstková recovery (IU/dl na IU/kg) |
1,88 (1,73-2,05) |
2,08 (1,91-2,25) |
1,91 (1,61-2,27) | |
|
AUC/Dávka (IU*h/dl na IU/kg) |
25,9 (23,4-28,7) |
32,8 (28,2-38,2) |
40,8 (29,3-56,7) | |
|
t/ (h) |
14,3 (12,6-16,2) |
15,9 (13,8-18,2) |
17,5 (12,7-24,0) | |
|
MRT (h) |
17,2 (15,4-19,3) |
20,7 (18,0-23,8) |
23,5 (17,0-32,4) | |
|
CL (ml/h/kg) |
3,86 (3,48-4,28) |
3,05 (2,62-3,55) |
2,45 (1,76-3,41) | |
|
Vss (ml/kg) |
66,5 (59,8-73,9) |
63,1 (56,3-70,9) |
57,6 (50,2-65,9) | |
1 Farmakokinetické parametry jsou uvedeny jako geometrický průměr (95% IS)
Zkratky: IS = interval spolehlivosti; AUC = plocha pod křivkou aktivita FVIII - čas; t/ = terminální biologický poločas;
CL = clearance; MRT = střední rezidenční čas; Vss = distribuční objem v ustáleném stavu *Farmakokinetické parametry u pacientů ve věku od 12 do <18 let ze všech ramen ve studii I s různými schématy odběru vzorků
V porovnání s dospívajícími a dospělými mohou mít děti do 12 let věku vyšší clearance a kratší biologický poločas, což odpovídá pozorováním dalších koagulačních faktorů. Tyto rozdíly by se měly vzít v úvahu při stanovení dávkování.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě studií akutní toxicity a toxicity po opakovaném podávání (které zahrnovaly hodnocení lokální toxicity a bezpečnostní farmakologie) neodhalily žádné zvláštní riziko pro člověka. Studie hodnotící genotoxicitu, kancerogenní potenciál, reprodukční toxicitu nebo embryofetální vývoj nebyly provedeny. Ve studii placentárního přenosu bylo prokázáno, že přípravek ELOCTA prochází u myší placentou v malých množstvích.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek Sacharosa Chlorid sodný L-histidin
Dihydrát chloridu vápenatého
Polysorbát 20
Hydroxid sodný (pro úpravu pH)
Kyselina chlorovodíková (pro úpravu pH)
Rozpouštědlo Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
Je třeba používat pouze dodávanou injekční soupravu, protože v důsledku adsorpce lidského koagulačního faktoru VIII na vnitřní povrch některých injekčních zařízení může dojít k selhání léčby.
6.3 Doba použitelnosti
Neotevřená injekční lahvička 3 roky
Během doby použitelnosti může být přípravek uchováván při pokojové teplotě (do 30°C) po jedno nepřetržité období nepřesahující 6 měsíců. Jakmile byl přípravek jednou vyjmut z chladničky, je nutné na obalu vyznačit datum, kdy k tomu došlo. Po uchovávání při pokojové teplotě nesmí být přípravek vrácen do chladničky. Nepoužívejte po uplynutí doby použitelnosti uvedené na injekční lahvičce nebo šest měsíců po vyjmutí vnějšího obalu z chladničky, cokoli nastane jako první.
Po rekonstituci
Po rekonstituci byla chemická a fyzikální stabilita prokázána po dobu 6 hodin, když je přípravek uchováván při pokojové teplotě (až do 30°C). Chraňte před přímým slunečním světlem. Po rekonstituci musí být přípravek zlikvidován, pokud není použit během 6 hodin. Z mikrobiologického hlediska by měl být přípravek použit okamžitě po rekonstituci. Není-li použit okamžitě, přechází zodpovědnost za dobu a podmínky uchovávání přípravku po otevření a před použitím na uživatele.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2°C - 8°C). Chraňte před mrazem. Uchovávejte injekční lahvičku v krabičce, aby byl přípravek chráněn před světlem.
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení a zvláštní vybavení pro použití, podání nebo implantaci
Jedno balení obsahuje:
- prášek v injekční lahvičce (sklo typu 1) s bezlatexovou chlorbutylovou pryžovou zátkou,
- 3 ml rozpouštědla v předplněné injekční stříkačce (sklo typu 1) s bezlatexovou brombutylovou pryžovou pístovou zátkou,
- nástavec pístu,
- sterilní adaptér injekční lahvičky pro rekonstituci,
- sterilní infuzní souprava,
- dva tampóny napuštěné alkoholem,
- dvě náplasti, - jeden gázový polštářek.
Balení po 1.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Lyofilizovaný prášek na injekci v injekční lahvičce musí být rekonstituován dodávaným rozpouštědlem (voda na injekci) z předplněné injekční stříkačky pomocí sterilního adaptéru injekční lahvičky na rekonstituci.
S injekční lahvičkou by se mělo jemně kroužit, dokud se všechen prášek nerozpustí.
Pro další informace o rekonstituci a podání si přečtěte příbalovou informaci.
Rekonstituovaný roztok by měl být čirý až mírně opalizující a bezbarvý. Roztoky, které jsou zakalené nebo obsahují částice, se nesmí používat. Rekonstituovaný léčivý přípravek je třeba před podáním zkontrolovat zrakem, zda neobsahuje částečky hmoty a nedošlo ke změně barvy.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Swedish Orphan Biovitrum AB (publ)
SE-112 76 Stockholm Švédsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/15/1046/001
EU/1/15/1046/002
EU/1/15/1046/003
EU/1/15/1046/004
EU/1/15/1046/005
EU/1/15/1046/006
EU/1/15/1046/007
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 19. listopadu 2015
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE/VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY /BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE/VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY /BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce biologické léčivé látky
Biogen Inc 250 Binney Street Cambridge, MA 02142
Spojené státy americké
Název a adresa výrobce odpovědného za propouštění šarží
Swedish Orphan Biovitrum AB (publ)
Strandbergsgatan 49 SE-112 76 Stockholm Švédsko
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky. Držitel rozhodnutí o registraci předloží první pravidelně aktualizovanou zprávu o bezpečnosti pro tento léčivý přípravek do 6 měsíců od jeho registrace.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU_
ELOCTA 250 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 500 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 750 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 1000 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 1500 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 2000 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 3000 IU prášek a rozpouštědlo pro injekční roztok efmoroctocogum alfa
rekombinantní koagulační faktor VIII, Fc fuzní protein
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK_
Prášek: Efmoroctocogum alfa 250 IU (přibližně 83 IU/ml po rekonstituci)
Prášek: Efmoroctocogum alfa 500 IU (přibližně 167 IU/ml po rekonstituci)
Prášek: Efmoroctocogum alfa 750 IU (přibližně 250 IU/ml po rekonstituci)
Prášek: Efmoroctocogum alfa 1000 IU (přibližně 333 IU/ml po rekonstituci)
Prášek: Efmoroctocogum alfa 1500 IU (přibližně 500 IU/ml po rekonstituci)
Prášek: Efmoroctocogum alfa 2000 IU (přibližně 667 IU/ml po rekonstituci)
Prášek: Efmoroctocogum alfa 3000 IU (přibližně 1 000 IU/ml po rekonstituci)
3. SEZNAM POMOCNÝCH LÁTEK_
Prášek: sacharosa, chlorid sodný, L-histidin, dihydrát chloridu vápenatého, polysorbát 20, hydroxid sodný, kyselina chlorovodíková.
Rozpouštědlo: voda na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek a rozpouštědlo pro injekční roztok
Obsah: 1 injekční lahvička s práškem, 3 ml rozpouštědla v předplněné injekční stříkačce, 1 nástavec pístu, 1 adaptér injekční lahvičky, 1 infuzní souprava, 2 alkoholové tampóny, 2 náplasti, 1 gáza.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Intravenózní podání, po rekonstituci.
Před použitím si přečtěte příbalovou informaci.
Instrukční video, jak připravit a podat přípravek ELOCTA, je k dispozici po oskenování QR kódu chytrým telefonem nebo na webových stránkách.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
Spotřebujte během 6 hodin po rekonstituci.
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte injekční lahvičku ve vnějším obalu, aby byl přípravek chráněn před světlem.
Uchovávejte v chladničce.
Chraňte před mrazem.
Může být uchováváno při pokojové teplotě (do 30°C) po jedno nepřetržité období nepřesahující 6 měsíců. Po uchovávání při pokojové teplotě nesmí být přípravek vrácen do chladničky. Datum vyjmutí z chladničky:
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Swedish Orphan Biovitrum AB (publ)
SE-112 76 Stockholm
Švédsko
12. REGISTRAČNÍ ČÍSLO(A)
EU/1/15/1046/001
EU/1/15/1046/002
EU/1/15/1046/003
EU/1/15/1046/004
EU/1/15/1046/005
EU/1/15/1046/006
EU/1/15/1046/007
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
ELOCTA 250 ELOCTA 500 ELOCTA 750 ELOCTA 1000 ELOCTA 1500 ELOCTA 2000 ELOCTA 3000
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
ELOCTA 250 IU prášek a rozpouštědlo pro injekční roztok
ELOCTA 500 IU prášek a rozpouštědlo pro injekční roztok
ELOCTA 750 IU prášek a rozpouštědlo pro injekční roztok
ELOCTA 1000 IU prášek a rozpouštědlo pro injekční roztok
ELOCTA 1500 IU prášek a rozpouštědlo pro injekční roztok
ELOCTA 2000 IU prášek a rozpouštědlo pro injekční roztok
ELOCTA 3000 IU prášek a rozpouštědlo pro injekční roztok
efmoroctocogum alfa rekombinantní koagulační faktor VIII i.v.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
250 IU 500 IU 750 IU 1000IU
1500IU 2000 IU 3000IU
6. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Rozpouštědlo pro přípravek ELOCTA voda na injekci
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
3 ml
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
ELOCTA 250 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 500 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 750 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 1000 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 1500 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 2000 IU prášek a rozpouštědlo pro injekční roztok ELOCTA 3000 IU prášek a rozpouštědlo pro injekční roztok
efmoroctocogum alfa (rekombinantní koagulační faktor VIII)
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky, je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
• Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek ELOCTA a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek ELOCTA používat
3. Jak se přípravek ELOCTA používá
4. Možné nežádoucí účinky
5. Jak přípravek ELOCTA uchovávat
6. Obsah balení a další informace
7. Instrukce pro přípravu a podávání
1. Co je přípravek ELOCTA a k čemu se používá
Přípravek ELOCTA obsahuje léčivou látku efmoroktokog alfa, rekombinantní koagulační faktor VIII, Fc fuzní protein. Faktor VIII je bílkovina, která se přirozeně vytváří v těle a která je nutná pro srážení krve a zastavení krvácení.
Přípravek ELOCTA je lék používaný pro léčbu a prevenci krvácení u všech věkových skupin pacientů s hemofilií A (dědičná porucha krvácení způsobená nedostatkem faktoru VIII).
Přípravek ELOCTA se připravuje rekombinantní technologií bez přidání jakýchkoli lidských nebo zvířecích složek ve výrobním procesu.
Jak přípravek ELOCTA účinkuje
Pacientům s hemofilií A chybí faktor VIII nebo neúčinkuje správně. Přípravek ELOCTA se používá pro náhradu chybějícího nebo defektního faktoru VIII. Přípravek ELOCTA zvyšuje hladinu faktoru VIII v krvi a dočasně upravuje sklon ke krvácení.
2. Čemu musíte věnovat pozornost, než začnete přípravek ELOCTA používat Nepoužívejte přípravek ELOCTA:
• jestliže jste alergický(á) na efmoroktokog alfa nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před použitím přípravku ELOCTA se poraďte se svým lékařem, lékárníkem nebo zdravotní sestrou.
• Existuje malá možnost, že se u Vás může objevit anafylaktická reakce (závažná, náhlá alergická reakce) na přípravek ELOCTA. Známky alergických reakcí mohou zahrnovat svědění kůže celého těla, kopřivku, tlak na hrudi, problémy s dýcháním a nízký krevní tlak. Pokud se některé z těchto příznaků objeví, ukončete ihned podávání injekce a kontaktujte svého lékaře.
• Informujte svého lékaře, pokud si myslíte, že Vaše krvácení není pod kontrolou pomocí dávky, kterou dostáváte, protože pro to může být několik důvodů. Například tvorba protilátek (také známých jako inhibitory) proti faktoru VIII je známá komplikace, která může během léčby hemofilie A nastat. Protilátky zabraňují správnému účinku přípravku ELOCTA. To by měl zkontrolovat Váš lékař. Nezvyšujte celkovou dávku přípravku ELOCTA určenou pro kontrolu Vašeho krvácení bez konzultace se svým lékařem.
Komplikace související s použitím katétru
Pokud je nutné, abyste používal(a) centrální žilní katétr (CŽK), mělo by se zvážit riziko komplikací spojené s jeho použitím včetně lokálních infekcí, bakteriémie a trombózy v místě zavedení katétru.
Dokumentace
Důrazně se doporučuje, abyste při každém podání přípravku ELOCTA zaznamenal(a) název a číslo šarže přípravku.
Další léčivé přípravky a přípravek ELOCTA
Informujte svého lékaře nebo lékárníka o všech lécích, které používáte, které jste v nedávné době používal(a) nebo které možná budete používat.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat.
Řízení dopravních prostředků a obsluha strojů
Nebyly pozorovány žádné účinky na schopnost řídit nebo obsluhovat stroje.
Přípravek ELOCTA obsahuje sodík
Tento léčivý přípravek obsahuje 14 mg sodíku v injekční lahvičce po přípravě. Informujte svého lékaře, pokud jste na dietě s nízkým obsahem sodíku.
Jak se přípravek ELOCTA používá
3.
Léčba přípravkem ELOCTA by měla být zahájena lékařem, který má zkušenosti s léčbou
pacientů s hemofilií. Vždy používejte tento přípravek přesně podle pokynů svého lékaře (viz bod 7). Pokud
si nejste jistý(á), poraďte se se svým lékařem, lékárníkem nebo zdravotní sestrou.
Přípravek ELOCTA se podává injekcí do žíly. Váš lékař vypočte, jaká bude dávka přípravku ELOCTA (v mezinárodních jednotkách neboli IU), kterou budete dostávat podle Vašich individuálních potřeb substituční léčby faktorem VIII a na tom, zda se používá pro prevenci nebo léčbu krvácení. Informujte svého lékaře, pokud se domníváte, že Vaše krvácení není pod kontrolou pomocí dávky, kterou dostáváte.
To, jak často budete potřebovat injekci, bude záviset na tom, jak dobře u Vás přípravek ELOCTA účinkuje. Váš lékař provede příslušné laboratorní testy, aby se ujistil, že máte odpovídající hladinu faktoru VIII v krvi.
Léčba krvácení
Dávka přípravku ELOCTA se vypočte podle Vaší tělesné hmotnosti a hladiny faktoru VIII, které má být dosaženo. Cílová hladina faktoru VIII bude záviset na závažnosti a lokalizaci krvácení.
Prevence krvácení
• Obvyklá dávka přípravku ELOCTA je 50 IU na kg tělesné hmotnosti podávaná každé 3 až 5 dnů. Dávka může být upravena Vaším lékařem v rozmezí od 25 do 65 IU na kg tělesné hmotnosti.
V některých případech, zejména u mladších pacientů, mohou být nutné kratší intervaly mezi dávkami nebo vyšší dávky.
Použití u dětí a dospívajících
Přípravek ELOCTA se může používat u dětí a dospívajících každého věku. U dětí ve věku do 12 let mohou být nutné vyšší dávky nebo častější injekce.
Jestliže jste použil(a) více přípravku ELOCTA, než jste měl(a)
Informujte co možná nejdříve svého lékaře. Vždy používejte přípravek ELOCTA přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem, lékárníkem nebo zdravotní sestrou.
Jestliže jste zapomněl(a) použít přípravek ELOCTA
Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku. Užijte svou dávku co nejdříve si vzpomenete a pak pokračujte v normálním plánu dávkování. Pokud si nejste jistý(á), co mát dělat, zeptejte se svého lékaře nebo lékárníka.
Jestliže jste přestal(a) používat přípravek ELOCTA
Neukončujte používání přípravku ELOCTA bez porady se svým lékařem. Pokud ukončíte používání přípravku ELOCTA, nemusíte být dále chráněn(a) proti krvácení nebo může dojít k tomu, že se stávající krvácení nezastaví.
Máte-li jakékoli další otázky týkající se používání tohoto léčivého přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pokud se objeví závažné, náhlé alergické reakce (anafylaktická reakce), musí být podávání injekce okamžitě ukončeno. Musíte okamžitě kontaktovat svého lékaře, pokud se u Vás objeví některé z následujících příznaků alergických reakcí: otok obličeje, vyrážka, svědění kůže celého těla, kopřivka, tlak na hrudi, problémy s dýcháním, pálení a píchání v místě vpichu injekce, třesavka, zrudnutí, bolest hlavy, nízký krevní tlak, celkový pocit nevolnosti, nevolnost, neklid a zrychlený srdeční tep, pocit závratí nebo ztráty vědomí.
U tohoto léčivého přípravku se mohou objevit následující nežádoucí účinky.
Méně časté nežádoucí účinky (mohou postihnout až 1 ze 100 lidí): bolest hlavy, závratě, změna chuti, pomalý srdeční tep, vysoký krevní tlak, návaly horka, bolest cév po injekci, kašel, bolest břicha, vyrážka, otok kloubu, bolest svalů, bolest zad, bolest kloubu, celkové nepohodlí, bolest na hrudi, pocit chladu, pocit horka a nízký krevní tlak.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek ELOCTA uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Uchovávejte v chladničce (2°C - 8°C). Chraňte před mrazem. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Přípravek ELOCTA může být také uchováván při pokojové teplotě (do 30°C) po jedno nepřetržité období nepřesahující 6 měsíců. Zaznamenejte si prosím na vnější obal datum vyjmutí přípravku ELOCTA z chladničky a uložení při pokojové teplotě. Po uchovávání při pokojové teplotě nesmí být přípravek vrácen do chladničky.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na vnějším obalu a štítku injekční lahvičky za "EXP". Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Nepoužívejte tento léčivý přípravek, pokud byl uchováván při pokojové teplotě déle než 6 měsíců.
Po přípravě by měl být přípravek ELOCTA použit okamžitě. Pokud nemůžete použít připravený roztok přípravku ELOCTA okamžitě, měl(a) byste jej použít během 6 hodin. Připravený roztok neuchovávejte v chladničce. Chraňte připravený roztok před přímým slunečním světlem.
Připravený roztok bude čirý až mírně opaleskující a bezbarvý. Nepoužívejte tento přípravek, pokud si všimnete, že je zakalený nebo že obsahuje viditelné částice.
Nepoužitý roztok zlikvidujte vhodným způsobem. Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek ELOCTA obsahuje
Prášek:
• Léčivou látkou je efmoroctocogum alfa (rekombinantní koagulační faktor VIII, Fc fuzní protein). Jedna injekční lahvička přípravku ELOCTA obsahuje jmenovité množství efmoroctocogum alfa 250, 500, 750, 1 000, 1 500, 2 000 nebo 3 000 IU.
• Dalšími složkami jsou sacharóza, chlorid sodný, L-histidin, dihydrát chloridu vápenatého, polysorbát 20, hydroxid sodný, kyselina chlorovodíková. Pokud jste na dietě s omezeným obsahem sodíku, přečtěte si bod 2.
Rozpouštědlo:
3 ml voda na injekci
Jak přípravek ELOCTA vypadá a co obsahuje toto balení
Přípravek ELOCTA je dodáván jako prášek a rozpouštědlo pro injekční roztok. Prášek je bílý až téměř bílý prášek nebo koláč (hrudka). Rozpouštědlo poskytované pro přípravu injekčního roztoku je čirý, bezbarvý roztok. Po přípravě je injekční roztok čirý až mírně opaleskující a bezbarvý.
Jedno balení přípravku ELOCTA obsahuje 1 injekční lahvičku s práškem, 3 ml rozpouštědla v předplněné injekční stříkačce, 1 nástavec pístu, 1 adaptér injekční lahvičky, 1 infuzní soupravu, 2 alkoholové tampóny, 2 náplasti, 1 gázu.
Držitel rozhodnutí o registraci a výrobce
Swedish Orphan Biovitrum AB (publ) SE-112 76 Stockholm,
Švédsko
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci
Belgie/Belgique/Belgien
Swedish Orphan Biovitrum BVBA
Tél/Tel: + 32 2880 6119 e-mail: benelux@sobi.com
Etarapnu
Cyugum Op^aH EHOBrnpyM KaoH Etarapua OOfl Tea.: +420 257 222 034 e-mail: mail.bg@sobi.com
Lietuva
Oy Swedish Orphan Biovitrum Ab c/o UAB CentralPharma Communications Tel: +370 5 2430444 e-mail: centralpharma@centralpharma.lt
Luxembourg/Luxemburg
Swedish Orphan Biovitrum BVBA
Tél/Tel: + 32 2880 6119 e-mail: benelux@sobi.com
|
Česká republika Swedish Orphan Biovitrum s.r.o. |
Magyarország Swedish Orphan Biovitrum s.r.o. Magyarországi Fióktelepe |
|
Tel: +420 257 222 034 e-mail: mail.cz@sobi.com |
Tel: +420 257 222 034 e-mail: mail.hu@sobi.com |
|
Danmark Swedish Orphan Biovitrum A/S Tlf: + 45 32 96 68 69 e-mail: mail.dk@sobi.com |
Malta Swedish Orphan Biovitrum S.r.l. Tel: +39 0521 19 111 e-mail: mail.it@sobi.com |
|
Deutschland Swedish Orphan Biovitrum GmbH Tel: +49 89 55066760 e-mail: mail.de@sobi.com |
Nederland Swedish Orphan Biovitrum BVBA Tel: + 32 288 06119 e-mail: benelux@sobi.com |
|
Eesti Oy Swedish Orphan Biovitrum Ab c/o CentralPharma Communications OU Tel. +372 6 015 540 e-mail: centralpharma@centralpharma.ee |
Norge Swedish Orphan Biovitrum AS Tlf: +47 66 82 34 00 e-mail: mail.no@sobi.com |
|
EXláda Swedish Orphan Biovitrum S.r.l. Tr(k: +39 0521 19 111 e-mail: mail.it@sobi.com |
Osterreich Swedish Orphan Biovitrum GmbH Tel: +49 89 55066760 e-mail: mail.de@sobi.com |
|
Espaňa Swedish Orphan Biovitrum S.L |
Polska Swedish Orphan Biovitrum Sp. z o.o. Oddzial w Polsce |
|
Tel: + 34 913 91 35 80 e-mail: mail.es@sobi.com |
Tel: +420 257 222 034 e-mail: mail.pl@sobi.com |
|
France Swedish Orphan Biovitrum SARL Tél: +33 1 85 78 03 40 e-mail: mail.fr@sobi.com |
Portugal Swedish Orphan Biovitrum S.L Tel: + 34 913 91 35 80 e-mail: mail.es@sobi.com |
|
Hrvatska SWEDISH ORPHAN BIOVITRUM, Glavna Podružnica Zagreb Tel: +420 257 222 034 e-mail: mail.hr@sobi.com |
Románia Swedish Orphan Biovitrum s.r.o. Praga - Sucursala Bucuresti Tel: +420 257 222 034 e-mail: mail.ro@sobi.com |
|
Ireland Swedish Orphan Biovitrum Ltd |
Slovenija Swedish Orphan Biovitrum s.r.o. - Podružnica v Sloveniji |
|
Tel: + 44 1223 891854 e-mail: mail.uk@sobi.com |
Tel: +420 257 222 034 e-mail : mail.si@sobi.com |
Island
Swedish Orphan Biovitrum A/S Tlf: + 45 32 96 68 69 e-mail: mail.dk@sobi.com
Italia
Swedish Orphan Biovitrum S.r.l.
Tel: +39 0521 19 111 e-mail: mail.it@sobi.com
Kórcpog
Swedish Orphan Biovitrum S.r.l.
TpA,: +39 0521 19 111 e-mail: mail.it@sobi.com
Latvija
Oy Swedish Orphan Biovitrum Ab c/o CentralPharma Communications SIA Tel. +371 67 450 497 e-mail: centralpharma@centralpharma.lv
Slovenská republika
Swedish Orphan Biovitrum o.z.
Tel: +420 257 222 034 e-mail: mail.sk@sobi.com
Suomi/Finland
Oy Swedish Orphan Biovitrum Ab Puh/Tel: +358 201 558 840 e-mail: mail.fi@sobi.com
Sverige
Swedish Orphan Biovitrum AB (publ) Tel: +46 8 697 20 00 e-mail: mail.se@sobi.com
United Kingdom
Swedish Orphan Biovitrum Ltd
Tel: +44 1223 891854 e-mail: mail.uk@sobi.com
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Obraťte prosím na stránku příbalové informace s bodem 7. Instrukce pro přípravu a podávání
7. Instrukce pro přípravu a podávání
Přípravek ELOCTA se podává v intravenózní (i.v.) (nitrožilní) injekci po rozpuštění prášku na injekci v rozpouštědle dodávaném v předplněné injekční stříkačce. Balení přípravku ELOCTA obsahuje:
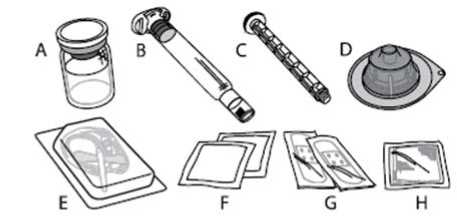
A) 1 injekční lahvička s práškem
B) 3 ml rozpouštědla v předplněné injekční stříkačce
C) 1 nástavec pístu
D) 1 adaptér injekční lahvičky
E) 1 infuzní souprava
F) 2 alkoholové tampóny
G) 2 náplasti
H) 1 gázový polštářek
Přípravek ELOCTA by se neměl míchat s jinými injekčními nebo infuzními roztoky. Před otevřením balení si umyjte ruce.
1. Zkontrolujte název a sílu balení, abyste se ujistil(a), že obsahuje správný přípravek. Zkontrolujte dobu použitelnosti na vnějším obalu přípravku ELOCTA. Nepoužívejte přípravek po uplynutí doby použitelnosti.
2. Pokud byl přípravek ELOCTA uchováván v chladničce, ponechte přípravek ELOCTA (A)
a injekční stříkačku s rozpouštědlem (B) zahřát na pokojovou teplotu. Nepoužívejte vnější zdroj tepla.
3.
Položte injekční lahvičku na čistý a rovný povrch. Sejměte pojistné plastové víčko z injekční lahvičky s přípravkem
ELOCTA.
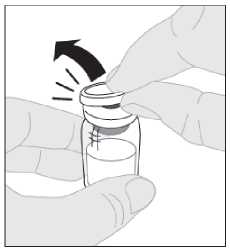
4.
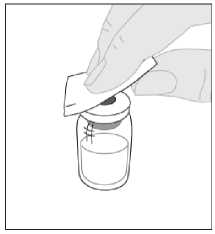
Otřete horní část injekční lahvičky jedním z tampónů napuštěných alkoholem (F), které jsou součástí balení, a nechte ji oschnout. Nedotýkejte se horní části injekční lahvičky a po očištění zabraňte jejímu kontaktu s jakýmkoli předmětem.
5. Sloupněte ochranný papírový kryt z průhledného plastového adaptéru injekční lahvičky (D). Nevyndávejte adaptér z jeho ochranného víčka. Nedotýkejte se vnitřní části balení adaptéru injekční lahvičky.
6. Držte adaptér injekční lahvičky v ochranném víčku a nasaďte jej přímo přes horní část injekční lahvičky. Stlačte pevně adaptér, dokud se nezacvakne na horní část injekční lahvičky a jeho hrot nepronikne přes zátku injekční lahvičky.
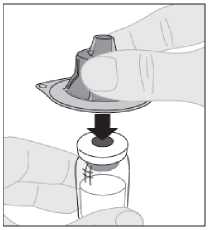
|
7. Připojte nástavec pístu (C) na injekční stříkačku s rozpouštědlem zasunutím hrotu pístu do otvoru v pístu injekční stříkačky. Otočte nástavcem pístu pevně ve směru hodinových ručiček, dokud není bezpečně usazen v pístu injekční stříkačky. |
J?*-, | |
|
8. Odlomte bílé bezpečnostní plastové víčko z injekční stříkačky s rozpouštědlem ohnutím v perforaci víčka, dokud se neulomí. Položte víčko stranou horní částí směřující dolů na rovný povrch. Nedotýkejte se vnitřní části víčka ani hrotu injekční stříkačky. |
íWj}\ YVy sf A 1 | |
|
9. Sejměte ochranné víčko z adaptéru a zlikvidujte jej. | ||
|
10. Připojte injekční stříkačku s rozpouštědlem na adaptér injekční lahvičky zasunutím hrotu injekční stříkačky do otvoru adaptéru. Pevně zatlačte a otočte injekční stříkačkou ve směru hodinových ručiček, dokud není bezpečně připojena. | ||
|
a§P | ||
Pomalu stlačte nástavec pístu a vstříkněte veškeré rozpouštědlo do injekční lahvičky s přípravkem ELOCTA.
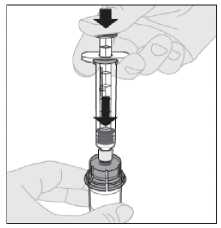
12. S injekční stříkačkou stále připojenou k adaptéru a stlačeným nástavcem pístu rozpusťte prášek jemnými krouživými pohyby injekční lahvičky.
Netřepejte.
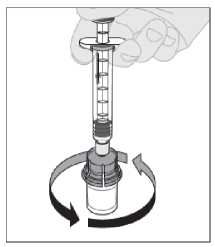
13. Před podáním musíte výsledný roztok zkontrolovat zrakem. Roztok by měl být čirý až mírně opaleskující a bezbarvý. Nepoužívejte roztok, pokud je zakalený nebo obsahuje viditelné částice.
14.
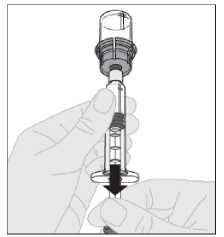
S nástavcem pístu injekční lahvičky stále plně stlačeným otočte injekční lahvičku. Pomalu zatáhněte za nástavec pístu, abyste natáhli roztok přes adaptér injekční lahvičky do injekční stříkačky.
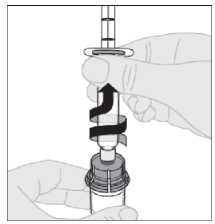
15. Odpojte injekční stříkačku od adaptéru injekční lahvičky jemným tahem a otáčením injekční lahvičky proti směru pohybu hodinových ručiček.
Poznámka: Použijete-li na injekci více než jednu injekční lahvičku s přípravkem ELOCTA, měla by být každá injekční lahvička připravena samostatně podle předchozích instrukcí (kroky 1 až 13) a injekční stříkačka s rozpouštědlem by měla být odstraněna a adaptér injekční lahvičky ponechán na místě. Pro natažení připraveného obsahu každé jednotlivé injekční lahvičky lze použít jednu velkou injekční stříkačku s luerovou koncovkou.
16. Injekční lahvičku a adaptér zlikvidujte.
Poznámka: Pokud nebude roztok použit okamžitě, je třeba pečlivě nasadit zpět víčko injekční stříkačky na hrot injekční stříkačky. Nedotýkejte se hrotu injekční stříkačky ani vnitřní části víčka.
Po přípravě může být přípravek ELOCTA před podáním uchováván při pokojové teplotě po dobu až 6 hodin. Po uplynutí této doby má být přípravek ELOCTA zlikvidován. Chraňte před přímým slunečním světlem.
Podávání (intravenózní injekce):
Přípravek ELOCTA by měl být podáván pomocí infuzní soupravy (E), která je součástí balení.
1.
Otevřete balení infuzní soupravy a sejměte víčko na konci hadičky. Připevněte injekční stříkačku s připraveným roztokem přípravku ELOCTA na konec hadičky infuzní soupravy otočením ve směru hodinových ručiček.
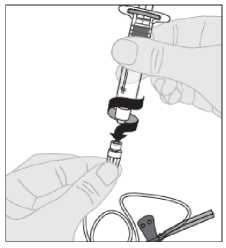
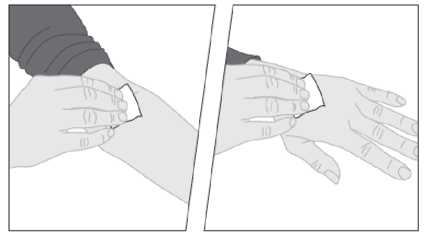
2. Je-li třeba, použijte turniket a připravte místo podání injekce tak, že kůži důkladně otřete pomocí dalšího tampónu napuštěného alkoholem, který je součástí balení.
3. Odstraňte veškerý vzduch z hadiček infuzní soupravy pomalým stlačením nástavce pístu,
dokud se tekutina nedostane do jehly infuzní soupravy. Neprotlačujte roztok jehlou. Sejměte průhledný plastový ochranný kryt z jehly.
4. Zaveďte jehlu infuzní soupravy do žíly podle instrukcí svého lékaře nebo zdravotní sestry a odstraňte turniket. Pokud dáváte přednost následující možnosti, můžete použít jednu z náplastí (G), které jsou součástí balení, pro přidržení plastových křidélek jehly v místě podání injekce. Přípravek ELOCTA by měl být podáván intravenózně injekcí během několika minut. Váš lékař může změnit doporučenou rychlost injekce, aby to pro Vás bylo pohodlnější.
5. Po dokončení podávání injekce a vyjmutí jehly byste měl(a) překlopit chránič jehly a nasunout jej na jehlu.
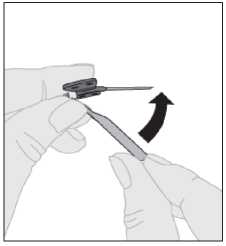
6. Použitou jehlu, veškerý nepoužitý roztok, injekční stříkačku a prázdnou injekční lahvičku bezpečně zlikvidujte do vhodné odpadní nádobky na zdravotnický materiál, protože tyto předměty mohou zranit ostatní, pokud nejsou správně zlikvidovány. Zařízení nepoužívejte opakovaně.
40