Eklira Genuair 322 Mikrogramů
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Eklira Genuair 322 mikrogramů, prášek k inhalaci
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna podaná dávka (dávka uvolněná z náustku) obsahuje 375 pg aclidinii bromidům, což je ekvivalent 322 pg přípravku aclidinium. To odpovídá odměřené dávce 400 pg aclidinii bromidům, což je ekvivalent 343 pg přípravku aclidinium.
Pomocné látky se známým účinkem:
Jedna odměřená dávka obsahuje 12,6 mg monohydrátu laktózy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek k inhalaci.
Bílý nebo téměř bílý prášek v bílém inhalátoru s integrálním indikátorem dávek a se zeleným dávkovacím tlačítkem.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Eklira Genuair je indikován jako udržovací bronchodilatační léčba k úlevě od příznaků u dospělých pacientů s chronickou obstrukční plicní nemocí (CHOPN).
4.2 Dávkování a způsob podání
Dávkování
Doporučená dávka je jedno vdechnutí 322 pg aklidinia dvakrát denně.
Při vynechání dávky je nutno další dávku podat co nejdříve. Pokud se však blíží doba následující dávky, má se vynechaná dávka přeskočit.
Starší populace
Pro starší pacienty není zapotřebí žádná úprava dávky (viz bod 5.2).
Zhoršená funkce ledvin
Pro pacienty se zhoršenou funkcí ledvin není zapotřebí žádná úprava dávky (viz bod 5.2).
Zhoršená funkce jater
Pro pacienty se zhoršenou funkcí jater není zapotřebí žádná úprava dávky (viz bod 5.2).
Pediatrická populace
U dětí a dospívajících (do věku 18 let) neexistuje relevantní použití přípravku Eklira Genuair v indikaci CHOPN.
Způsob podání K inhalačnímu podání.
Pacienti musí být poučeni, jak správně přípravek používat.
Návod k použití:
Seznámení s přípravkem Eklira Genuair:
Zelené tlačítko
Indikátor
dávek
Ochranný
kryt


Barevné kontrolní okénko
Náustek
Vyjměte inhalátor Genuair ze sáčku a seznamte se s jeho součástmi. Jak se Eklira Genuair používá
Souhrn
Pro použití inhalátoru Genuair musíte provést po odstranění krytu 2 kroky:
Krok 1 - Stiskněte a UVOLNĚTE zelené tlačítko a úplně vydechněte mimo inhalátor. Krok 2 - Rty pevně obemkněte náustek a SILNĚ a ZHLUBOKA vdechněte přes inhalátor.
Po inhalaci nezapomeňte znovu nasadit ochranný kryt.
Příprava
• Před prvním použitím roztrhněte zatavený sáček podél zářezu a vyjměte inhalátor Genuair.
• Když si chcete vzít svou dávku léčivého přípravku, sejměte ochranný kryt tak, že zlehka stisknete šipky vyznačené na obou stranách a vytáhnete kryt ven (viz obrázek 1).
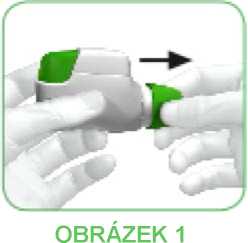
• Prohlédněte si náustek, zda není ucpaný.
Podržte inhalátor Genuair vodorovně náustkem směrem k sobě tak, aby zelené tlačítko směřovalo rovně nahoru (viz obrázek 2).
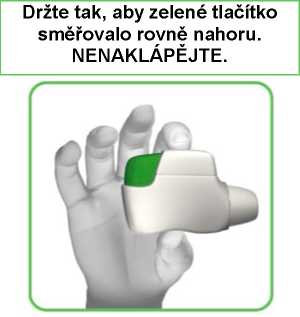
OBRÁZEK 2
KROK 1: STISKNĚTE zelené tlačítko zcela dolů a pak jej UVOLNĚTE (viz obrázky 3 a 4).
ZELENÉ TLAČÍTKO NEDRŽTE STISKNUTÉ.
STISKNĚTE zelené UVOLNĚTE zelené
tlačítko zcela dolů tlačítko
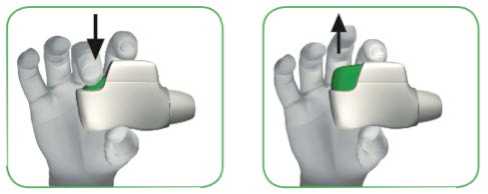
OBRÁZEK 3 OBRÁZEK 4
Zastavte a zkontrolujte: Ujistěte se, že je dávka připravena k inhalaci
• Ujistěte se, že barevné kontrolní okénko se zbarvilo zeleně (viz obrázek 5).
• Zelené kontrolní okénko potvrzuje, že léčivý přípravek je připraven k inhalaci.

• Než si vložíte inhalátor do úst, úplně vydechněte. Nevydechujte do inhalátoru.
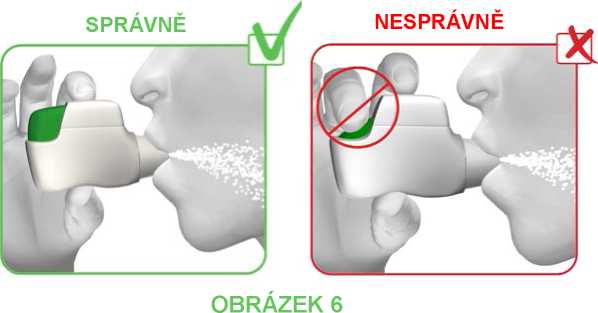
KROK 2: Rty pevně obemkněte náustek inhalátoru Genuair a SILNĚ a ZHLUBOKA vdechněte přes náustek (viz obrázek 6).
Tímto silným a hlubokým vdechnutím se léčivý přípravek dostane do plic.
POZOR: NEDRŽTE ZELENÉ TLAČÍTKO STISKNUTÉ V PRŮBĚHU INHALACE.
• V průběhu vdechování uslyšíte „KLIKNUTÍ “, které signalizuje, že používáte inhalátor Genuair správně.
• Pokračujte ve vdechování i poté, co uslyšíte „KLIKNUTÍ“ inhalátoru, abyste zajistili podání celé dávky.
• Vyjměte inhalátor Genuair z úst a zadržte dech tak dlouho, jak to bez potíží snesete, a potom pomalu vydechněte nosem.
Poznámka: Někteří pacienti mohou mít při inhalaci léčivého přípravku mírné sladké nebo nahořklé
chuťové vjemy nebo mohou pociťovat hrubý povrch v ústech v závislosti na pacientovi. Pokud po
inhalaci necítíte žádnou chuť ani nemáte žádné zvláštní pocity, neopakujte dávku.
Zastavte a zkontrolujte: Ujistěte se, že jste inhalovali správně
• Ujistěte se, že se kontrolní okénko zbarvilo červeně (viz obrázek 7). To potvrzuje, že jste správně inhalovali celou dávku.

OBRÁZEK 7
• Pokud okénko nezmění barvu na červenou, možná jste neuvolnili zelené tlačítko před inhalací nebo jste inhalaci neprovedli správně. Pokud k tomu dojde, zkuste to znovu.
Ujistěte se, že jste UVOLNILI zelené tlačítko a provedli SILNÝ a hluboký nádech přes náustek.
Poznámka: Nejste-li schopni provést inhalaci správně po několika pokusech, poraďte se s lékařem.
• Jakmile se okénko zbarví červeně, nasaďte zpět ochranný kryt tak, že jej zatlačíte na náustek (viz obrázek 8).

OBRÁZEK 8
Kdy byste měli dostat nový inhalátor Genuair?
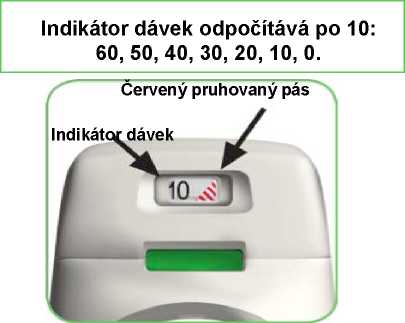
• Inhalátor Genuair je vybaven indikátorem dávek, který ukazuje přibližný počet dávek zbývajících v inhalátoru. Indikátor dávek se pomalu pohybuje dolů a odpočítává dávky po desítkách (60, 50, 40, 30, 20, 10, 0), (viz obrázek A). Každý inhalátor Genuair obsahuje nejméně 60 dávek.
• Když se na indikátoru dávek objeví červený pruhovaný pás, (viz obrázek A), znamená to, že se blíží poslední dávka a měli byste dostat nový inhalátor Genuair.
OBRÁZEK A
Poznámka: Pokud se Vám zdá, že je inhalátor Genuair poškozený, nebo pokud ztratíte kryt, musíte inhalátor vyměnit. Inhalátor Genuair SE NEMUSÍ čistit. Pokud si jej však přejete vyčistit, otřete vnější povrch náustku suchou buničinou nebo papírovým kapesníkem. K čištění inhalátoru Genuair NIKDY nepoužívejte vodu, protože by mohla lék poškodit.
• Když se uprostřed indikátoru dávek objeví 0 (nula), měli byste pokračovat v užívání dávek zbývajících v inhalátoru Genuair.
• Když je k inhalaci připravena poslední dávka, zelené tlačítko se nevrátí do úplné horní pozice, ale zůstane zablokované ve střední pozici (viz obrázek B). I když je zelené tlačítko zablokované, je možno provést inhalaci poslední dávky. Poté již inhalátor Genuair nelze znovu použít a musíte začít používat nový inhalátor Genuair.
r
Zablokováno

V_J
OBRÁZEK B
4.3 Kontraindikace
Hypersenzitivita na aklidinium-bromid, atropin nebo jeho deriváty včetně ipratropia, oxitropia nebo tiotropia nebo na pomocné látky uvedené v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Astma:
Eklira Genuair se nesmí užívat při astmatu; nebylo provedeno klinické hodnocení použití aklidinium-bromidu při astmatu.
Paradoxní bronchospasmus:
Stejně jako jiné druhy inhalační léčby může podávání přípravku Eklira Genuair vyvolat paradoxní bronchospasmus. Dojde-li k tomu, je nutno léčbu přípravkem Eklira Genuair zastavit a zvážit nasazení jiné léčby.
Zhoršení onemocnění:
Aklidinium-bromid je udržovací bronchodilatans a nesmí se používat k úlevě při akutních záchvatech bronchospasmů, tj. jako záchranný lék. Změní-li se intenzita CHOPN v průběhu léčby aklidinium-bromidem do takové míry, že pacient považuje za nutné nasazení doplňkové záchranné léčby, je nutno pacienta znovu vyšetřit a upravit jeho léčebný režim.
Vliv na kardiovaskulární systém:
Profil kardiovaskulární bezpečnosti je charakterizován anticholinergními účinky.
Při použití přípravku Eklira Genuair je nutno postupovat s opatrností u pacientů, u nichž se během posledních 6 měsíců vyskytl infarkt myokardu, nestabilní angina nebo během posledních 3 měsíců u nich byla nově diagnostikována arytmie, a případně u pacientů, kteří byli během posledních 12 měsíců hospitalizováni kvůli srdečnímu selhání s funkční třídou III a IV podle NYHA („New York Heart Association“). Tito pacienti byli vyloučeni z účasti v klinických hodnoceních, anticholinergní mechanismus může mít vliv na uvedené zdravotní stavy.
AnŤicholinergní účinnost:
Sucho v ústech, které bylo pozorováno ve spojitosti s anticholinergní léčbou, může být v dlouhodobém měřítku spojeno s výskytem zubního kazu.
Vzhledem ke svým anticholinergním účinkům se aklidinium bromid musí používat s opatrností u pacientů se symptomatickou hyperplazií prostaty nebo s obstrukcí krčku močového měchýře nebo s glaukomem s uzavřeným úhlem (i když přímý kontakt přípravku s očima je velmi nepravděpodobný).
Pomocné látky:
Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozenou deficiencí laktázy nebo malabsorpcí glukózy a galaktózy by tento přípravek neměli užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Současné podávání aklidinium-bromidu s jinými léčivými přípravky obsahujícími anticholinergika nebylo hodnoceno a nedoporučuje se.
Ačkoli nebyly provedeny žádné formální studie lékových interakcí in vivo, inhalačně podávaný aklidinium-bromid byl používán současně s jinými léčivými přípravky na CHOPN včetně sympatomimetických bronchodilatancií, methylxanthinů a perorálně i inhalačně podávaných steroidů bez klinických známek lékových interakcí.
Studie in vitro ukázaly, že aklidinium-bromid nebo metabolity aklidinium-bromidu v terapeutických dávkách podle očekávání nezpůsobují interakce se substráty P-glykoproteinu (P-gp) ani s léky metabolizovanými enzymy cytochromu P450 (CYP450) a esterázami (viz bod 5.2).
4.6 Fertilita, těhotenství a kojení
O použití aklidinium-bromidu u těhotných žen nejsou dostupné žádné údaje.
Studie na zvířatech prokázaly fetotoxicitu pouze u dávek na mnohem vyšších úrovních, než je maximální expozice lidského pacienta aklidinium-bromidu (viz bod 5.3). Aklidinium-bromid se smí používat během těhotenství pouze za předpokladu, že očekávaný přínos je vyšší než potenciální rizika.
Kojení
Není známo, zda se aklidinium-bromid a/nebo jeho metabolity vylučují do lidského mateřského mléka. Vzhledem k tomu, že studie na zvířatech prokázaly vylučování malých množství aklidinium-bromidu a/nebo jeho metabolitů do mléka, je nutno zvážit, zda přerušit kojení nebo přerušit podávání aklidinium- bromidu, a to na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti dlouhodobé léčby aklidinium-bromidem pro matku.
Fertilita
Studie na potkanech ukázaly mírné snížení fertility pouze u dávek mnohem vyšších, než je maximální expozice lidského pacienta aklidinium-bromidu (viz bod 5.3). Považuje se za nepravděpodobné, že by aklidinium-bromid podávaný v doporučených dávkách ovlivnil fertilitu u lidí.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Aklidinium-bromid má malý vliv na schopnost řídit nebo obsluhovat stroje. Výskyt bolesti hlavy, závratě nebo rozmazaného vidění po užití aklidinium-bromidu (viz bod 4.8) může ovlivnit schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nejčastěji hlášené nežádoucí účinky přípravku Eklira Genuair byly bolest hlavy (6,6 %) a zánět nosohltanu (5,5 %).
Tabulka s přehledem nežádoucích účinků
Četnosti přiřazené níže uvedeným nežádoucím účinkům jsou založeny na hrubých počtech výskytů nežádoucích účinků (tj. příhod přisuzovaných přípravku Eklira Genuair) pozorovaných při podávání přípravku Eklira Genuair 322 pg (636 pacientů) ve sdružené analýze jedné 6měsíční a dvou 3měsíčních randomizovaných, placebem kontrolovaných klinických studií.
Četnost nežádoucích účinků je definována za použití následujících konvencí: velmi časté (> 1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
|
Třída orgánových systémů |
Preferovaný termín |
Četnost |
|
Infekce a infestace |
Sinusitida |
Časté |
|
Zánět nosohltanu |
Časté | |
|
Poruchy imunitního systému |
Přecitlivělost |
Vzácné |
|
Angioedém |
Není známo | |
|
Poruchy nervového systému |
Časté | |
|
Závrať |
Méně časté | |
|
Poruchy oka |
Rozmazané vidění |
Méně časté |
|
Srdeční poruchy |
Méně časté | |
|
Palpitace |
Méně časté | |
|
Respirační, hrudní a mediastinální poruchy |
Časté | |
|
Dysfonie |
Méně časté | |
|
Gastrointestinální poruchy |
Časté | |
|
Pocit na zvracení* |
Časté | |
|
Sucho v ústech |
Méně časté | |
|
Zánět sliznice ústní dutiny |
Méně časté | |
|
Poruchy kůže a podkožní tkáně |
Méně časté | |
|
Méně časté | ||
|
Poruchy ledvin a močových cest |
Retence moči |
Méně časté |
* Pocit na zvracení se v klinických hodnoceních vyskytoval u aklidinia méně často než u placeba (43,9 oproti 48,3 případů za 1 000 pacientoroků sledování)
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Vysoké dávky aklidinium-bromidu mohou vést k výskytu anticholinergních obtíží a příznaků. Nicméně zdravým subjektům byly inhalačně podány jednorázové dávky až 6 000 pg aklidinium-bromidu bez celkových anticholinergních nežádoucích účinků. Dále nebyly pozorovány žádné klinicky relevantní nežádoucí účinky po 7denním podávání až 800 pg aklidinium-bromidu dvakrát denně zdravým subjektům.
Akutní intoxikace neúmyslným požitím aklidinium-bromidu je nepravděpodobná kvůli nízké biologické dostupnosti při ústním podání a vzhledem k tomu, že mechanismus inhalátoru Genuair je aktivován dýcháním.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Anticholinergika; ATC kód: R03BB05.
Aklidinium-bromid je kompetitivní, selektivní antagonista muskarinových receptorů (neboli anticholinergních), s delší dobou rezidence v receptorech M3 než v receptorech M2. Receptory M3 zprostředkují kontrakce hladkých svalů v dýchacích cestách. Inhalovaný aklidinium-bromid působí lokálně v plicích jako antagonista receptorů M3 hladkého svalstva dýchacích cest a navozuje bronchodilataci. Neklinické studie in vitro a in vivo ukázaly, že aklidinium způsobuje rychlou, na dávce závislou a dlouhodobou inhibici bronchokonstrikce navozené acetylcholinem. Aklidinium-bromid se rychle odbourává v plazmě, takže úroveň celkového anticholinergního účinku je nízká.
Farmakodynamické účinky
Klinická hodnocení účinnosti ukázala, že přípravek Eklira Genuair vyvolal klinicky významné zlepšení funkce plic (měřeno podle nuceného vydechovaného objemu za 1 sekundu [FEV1]) po dobu 12 hodin po ranním a večerním podání; toto zlepšení bylo zjevné do 30 minut po první dávce (zvýšení oproti výchozímu stavu o 124-133 ml). Maximální bronchodilatace bylo dosaženo do 1-3 hodin po podání dávky, přičemž průměr maximálního zlepšení FEV1 vzhledem k výchozímu stavu byl 227-268 ml (v klidovém stavu).
Elektrofyziologie srdce
Při podávání aklidinium-bromidu (200 pg nebo 800 pg) jednou denně po dobu 3 dnů zdravým subjektům v podrobné studii QT nebyl pozorován žádný vliv na interval QT (použita korekce metodou Fridericia nebo Bazett, nebo individuální).
Kromě toho nebyl pozorován žádný klinicky významný vliv přípravku Eklira Genuair na srdeční rytmus při 24hodinovém Holterovském monitorování po 3 měsících léčby 336 pacientů (z nichž 164 užívali přípravek Eklira Genuair 322 pg dvakrát denně).
Klinická, účinnost
Program klinického hodnocení přípravku Eklira Genuair fáze III zahrnoval 269 pacientů léčených přípravkem Eklira Genuair 322 pg dvakrát denně v jedné 6měsíční randomizované, placebem kontrolované studii a 190 pacientů léčených přípravkem Eklira Genuair 322 pg dvakrát denně v jedné 3měsíční randomizované, placebem kontrolované studii. Účinnost byla hodnocena měřením funkce plic a symptomatických výsledků, jako je dušnost, zdravotní stav specifický pro dané onemocnění, použití záchranných léků a výskyt exacerbací. V dlouhodobých studiích bezpečnosti byl přípravek Eklira Genuair spojen s bronchodilatačním účinkem při podávání v průběhu jednoleté léčebné fáze.
Bronchodilatace
V 6měsíční studii došlo u pacientů, jimž byl podáván přípravek Eklira Genuair 322 pg dvakrát denně, ke klinicky významnému zlepšení funkce plic (podle měření by FEV1). Maximální bronchodilatační účinky byly pozorovány ode dne 1 a byly zachovány v celém průběhu 6měsíční léčby. Po 6 měsících léčby bylo průměrné zlepšení ráno před podáním dávky (nejnižší hodnota) FEV1 v porovnání s placebem 128 ml (95% CI=85-170; p<0,0001).
Podobné výsledky byly pozorovány při použití přípravku Eklira Genuair v 3měsíční studii.
Zdravotní stav specifický pro dané onemocnění a zlepšení příznaků
Přípravek Eklira Genuair vyvolal klinicky významné zlepšení dušnosti (hodnoceno pomocí Transition Dyspnoea Index [TDI]) a zdravotního stavu specifického pro dané onemocnění (hodnoceno podle St. George’s Respiratory Questionnaire [SGRQ]). Níže uvedená tabulka obsahuje údaje o zlepšení příznaků po 6 měsících léčby přípravkem Eklira Genuair.
|
Proměnná |
Léčba |
Zlepšení oproti placebu |
p- hodnota | |
|
Eklira Genuair |
Placebo | |||
|
TDI | ||||
|
Procento pacientů, kteří dosáhli MCIDa |
56,9 |
45,5 |
1,68násobnéc zvýšení pravděpodobnosti |
0,004 |
|
Průměrná změna oproti výchozímu stavu |
1,9 |
0,9 |
1,0 jednotky |
<0,001 |
|
SGRQ | ||||
|
Procento pacientů, kteří dosáhli MCIDb |
57,3 |
41,0 |
1,87násobnéc zvýšení pravděpodobnosti |
<0,001 |
|
Průměrná změna oproti výchozímu stavu |
-7,4 |
-2,8 |
- 4,6 jednotky |
<0,0001 |
a Minimální klinicky významný rozdíl (minimum clinically important difference, MCID) změny TDI
nejméně o 1 jednotku.
b MCID nejméně - 4 jednotky změny SRGO.
c Odds ratio, zvýšení pravděpodobnosti dosažení MCID v porovnání s placebem.
U pacientů léčených přípravkem Eklira Genuair byla nižší potřeba záchranných léků v porovnání s pacienty léčenými placebem (snížení o 0,95 inhalační dávky za den po dobu 6 měsíců [p=0,005]). Eklira Genuair také zmírňoval denní příznaky CHOPN (dyspnoe, kašel, produkce hlenu) a také noční i časně ranní příznaky.
Sdružená analýza účinnosti na základě výsledků 6měsíční a 3měsíční placebem kontrolované studie ukázala statisticky významné snížení četnosti středně závažných a závažných exacerbací (vyžadujících léčbu antibiotiky nebo kortikosteroidy nebo končících hospitalizací) při léčbě aklidiniem 322 pg dvakrát denně v porovnání s placebem (poměr na pacienta na rok: 0,31 ku 0,44; p=0,0149).
Tolerance zátěže
Ve třítýdenní překřížené, randomizované, placebem kontrolované klinické studii byl Eklira Genuair spojován se statisticky významným zlepšením doby výdrže při zátěži v porovnání s placebem o 58 sekund (95% CI=9-108; p=0,021; předléčebná hodnota: 486 sekund). Přípravek Eklira Genuair statisticky významně snížil klidovou plicní hyperinflaci (funkční reziduální kapacita [FRC]=0,197 l [95% CI=0,321, 0,072; p=0,002]; reziduální objem [RV]=0,238 l [95% CI=0,396, 0,079; p=0,004]), také zlepšil inspirační kapacitu (o 0,078 l; 95% CI=0,01, 0,145; p=0,025) a omezil dyspnoi během zátěže (Borgova škála), (o 0,63 Borgových jednotek; 95% CI= 1,11, 0,14; p=0,012).
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem Eklira Genuair u všech podskupin pediatrické populace u CHOPN (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Absorpce
Aklidinium-bromid se rychle vstřebává v plicích, přičemž maximální koncentrace v plazmě se dosahuje do 5 minut od inhalace u zdravých subjektů a normálně během prvních 15 minut u pacientů s CHOPN. Podíl inhalované dávky, který se dostane do systémového oběhu jako nepozměněné aklidinium, je velmi nízký - méně než 5%.
Maximální koncentrace v plazmě dosažená po inhalaci suchého prášku u pacientů s CHOPN po jedné dávce 400 pg aklidinium-bromidu byla přibližně 80 pg/ml. Stabilní koncentrace v plazmě bylo dosaženo sedm dní po podávání dvakrát denně; s ohledem na krátký poločas může být stabilního stavu dosaženo již po první dávce. Ve stabilním stavu nebylo pozorováno žádné hromadění při opakovaném dávkování.
Distribuce v organismu
Celková depozice aklidinium-bromidu v plicích, inhalovaného z inhalátoru Genuair, byla průměrně 30 % odměřené dávky.
Navázání aklidinium-bromidu na plazmatické bílkoviny, zjištěné in vitro nejpravděpodobněji odpovídalo navázání metabolitů na bílkoviny vzhledem k rychlé hydrolýze aklidinium-bromidu v plazmě; na plazmatické proteiny bylo navázáno 87 % pro karboxylové metabolity a 15 % pro alkoholové metabolity. Hlavní plazmatickou bílkovinou, která váže aklidinium-bromid, je albumin.
Biotransformace
Aklidinium-bromid je rychle a do velké míry hydrolyzován na farmakologicky neaktivní deriváty alkoholu a kyseliny karboxylové. K hydrolýze dochází chemickými (neenzymatickými) i enzymatickými pochody působením esteráz, přičemž butyrylcholinesteráza je hlavní humánní esteráza účastnící se hydrolýzy. Plazmové koncentrace kyselinových metabolitů jsou přibližně 100krát vyšší než koncentrace alkoholových metabolitů a nezměněné účinné látky po inhalaci.
Nízká absolutní biologická dostupnost inhalovaného aklidinium-bromidu (< 5 %) je způsobena faktem, že aklidinium-bromid zachycený v plicích nebo spolknutý podléhá rozsáhlé systémové a presystémové hydrolýze.
Biotransformace enzymy CYP450 má menší význam pro celkovou metabolickou clearanci aklidinium-bromidu.
Studie in vitro ukázaly, že aklidinium-bromid v terapeutických dávkách ani jeho metabolity nemají inhibiční ani indukční účinek na žádný z enzymů cytochromu P450 (CYP450) ani nejsou inhibitory esteráz (karboxylesterázy, acetylcholinesterázy a butyrylcholinesterázy). Studie in vitro ukázaly, že aklidinium-bromid ani jeho metabolity nejsou substráty ani inhibitory P-glykoproteinu.
Eliminace z organismu
Konečný eliminační poločas aklidinium-bromidu je přibližně 2-3 hodiny.
Po intravenózním podání 400 pg radiologicky značeného aklidinium-bromidu zdravým subjektům bylo přibližně 1% dávky vyloučeno močí jako nezměněný aklidinium-bromid. Až 65 % dávky bylo eliminováno jako metabolity močí a až 33 % metabolitů bylo vyloučeno stolicí.
Po inhalaci 200 pg a 400 pg aklidinium-bromidu zdravými subjekty nebo pacienty s CHOPN byla exkrece nezměněného aklidinium-bromidu močí velmi nízká a pohybovala se kolem 0,1% podané dávky, což naznačuje, že renální clearance má při celkové clearanci aklidinia z plazmy jen malý význam.
Linearita/nelinearita
Aklidinium-bromid v terapeutickém rozsahu vykazoval kinetickou linearitu a časově nezávislé farmakokinetické chování.
F armakoki n eti cký/farmakodynamický vztah
Vzhledem k tomu, že aklidinium-bromid působí lokálně v plicích a je rychle dekomponován do plazmy, neexistuje přímý vztah mezi farmakokinetikou a farmakodynamikou.
Zvláštní skupiny pacientů
Starší pacienti
Farmakokinetické vlastnosti aklidinium-bromidu u pacientů s mírnou až závažnou CHOPN se jeví podobné u pacientů ve věku 40-59 let a u pacientů ve věku > 70 let. Proto není třeba žádné úpravy dávky pro starší pacienty s CHOPN.
Pacienti se zhoršenou funkcí jater
Nebyly provedeny žádné studie s pacienty se zhoršenou funkcí jater. Vzhledem k tomu, že aklidinium-bromid je metabolizován hlavně chemickým a enzymatickým štěpením v plazmě, je málo pravděpodobné, že dysfunkce jater ovlivní systémovou expozici. U pacientů se zhoršenou funkcí jater proto není třeba nijak upravovat dávku.
Pacienti se zhoršenou funkcí ledvin
Nebyl pozorován žádný signifikantní rozdíl farmakokinetických parametrů mezi subjekty s normální a se zhoršenou funkcí ledvin. Proto není třeba žádné úpravy dávky ani další monitorování pacientů s CHOPN, kteří mají zhoršenou funkci ledvin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu a reprodukční a vývojové toxicity neodhalily žádné zvláštní riziko pro člověka.
Účinky v neklinických studiích, týkající se kardiovaskulárních parametrů (zvýšení srdeční frekvence u psů), reprodukční toxicity (fetotoxické účinky) a fertility (mírný pokles četnosti početí, počtu žlutých tělísek a předimplantační a poimplantační ztráty) byly pozorovány pouze po expozicích dostatečně převyšujících maximální expozici u člověka, což svědčí o malém významu při klinickém použití.
Nízká toxicita pozorovaná v neklinických studiích toxicity je zčásti způsobena rychlou metabolickou přeměnou aklidinium-bromidu v plazmě a nedostatkem významné farmakologické aktivity hlavních metabolitů. Bezpečnostní limity systémové expozice u osob s dávkou 400 pg dvakrát denně v porovnání s hladinou bez pozorovaných nežádoucích účinků představoval 17násobek až 187násobek.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek Monohydrát laktózy.
6.2 Inkompatibility Neuplatňuje se.
6.3 Doba použitelnosti 3 roky.
Použít do 90 dnů po otevření sáčku.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Inhalátor Genuair uchovávejte v sáčku až do doby, kdy začnete podávat lék.
6.5 Druh obalu a obsah balení
Inhalátor je vícedílný prostředek vyrobený z polykarbonátu, akrylonitril-butadien-styrenu, polyoxymethylenu, polyester-butylen-tereftalátu, polypropylenu, polystyrenu a nerez oceli. Má bílou barvu a je opatřen integrálním indikátorem dávek a zeleným dávkovacím tlačítkem. Náustek je krytý snímatelným zeleným ochranným krytem. Inhalátor se dodává v obalu z vrstveného plastu, uložený v kartonové krabičce.
Krabička obsahující 1 inhalátor s 30 jednotkovými dávkami.
Krabička obsahující 1 inhalátor s 60 jednotkovými dávkami.
Krabička obsahující 3 inhalátory s 60 jednotkovými dávkami.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Návod k použití viz bod 4.2.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
AstraZeneca AB SE-151 85 Sodertalje Švédsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/12/778/001
EU/1/12/778/002
EU/1/12/778/003
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 20. července 2012
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu.
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Industrias Farmacéuticas Almirall, S.A.
Ctra. Nacional II, Km. 593 08740 Sant Andreu de la Barca Barcelona Španělsko
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
Systém farmakovigilance
Držitel rozhodnutí o registraci musí zajistit, aby byl zaveden funkční systém farmakovigilance uvedený v modulu 1.8.1 schválené registrace předtím, než bude léčivý přípravek uveden na trh, a dále po celou dobu, kdy bude léčivý přípravek na trhu.
Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční činnosti v oblasti farmakovigilance podrobně uvedené v plánu farmakovigilance tak, jak byly schváleny v RMP uvedeném v modulu 1.8.2 schválené registrace, a dle případných následných aktualizací RMP schválených Výborem pro humánní léčivé přípravky (CHMP).
V souladu s pokynem Výboru pro humánní léčivé přípravky k systémům řízení rizik pro humánní léčivé přípravky má být aktualizovaný RMP předložen současně s příští periodicky aktualizovanou zprávou o bezpečnosti (PSUR).
Dále má být aktualizovaný RMP předložen:
• jestliže byly obdrženy nové informace, které mohou mít dopad na současné specifikace bezpečnosti, farmakovigilanční plán nebo na činnosti k minimalizaci rizik,
• do 60 dní po dosažení důležitého milníku (týkajícího se farmakovigilance nebo minimalizace rizik),
• na žádost Evropské agentury pro léčivé přípravky.
• PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ
TOHOTO LÉČIVÉHO PŘÍPRAVKU
Neuplatňuje se.
• POVINNOST PROVÉST POREGISTRAČNÍ OPATŘENÍ
Držitel rozhodnutí o registraci uskuteční v daném termínu následující opatření:
|
Popis |
Termín splnění |
|
Poregistrační bezpečnostní (PAS) kohortní studie inhalačně podávaného aklidinium-bromidu a rizika vybraných kardiovaskulárních cílových ukazatelů. Kompletní studijní protokoly musí být předloženy před začátkem studie CHMP k přezkoumání, a to před zahájením užívání produktu. |
Protokoly studie musí být předloženy do září 2012. PASS bude zahájena po dosažení počtu 2000 lékařských předpisů v určené databázi. |
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabička
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Eklira Genuair 322 mikrogramů, prášek k inhalaci Aclidinium (aclidinii bromidům)
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna podaná dávka obsahuje 375 mikrogramů aclidinii bromidům, což odpovídá 322 mikrogramům přípravku aclidinium.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje také: monohydrát laktózy
4. LÉKOVÁ FORMA A OBSAH BALENÍ
1 inhalátor obsahující 30 jednotkových dávek 1 inhalátor obsahující 60 jednotkových dávek 3 inhalátory obsahující 60 jednotkových dávek
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
K inhalačnímu podání
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Inhalátor Genuair uchovávejte v sáčku až do doby, kdy začnete podávat lék.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
AstraZeneca AB SE-151 85 Sodertalje Švédsko
AstraZeneca (logo AstraZeneca)
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/12/778/001 30 jednotkových dávek EU/1/12/778/002 60 jednotkových dávek EU/1/12/778/003 3 inhalátory
13. ČÍSLO ŠARŽE
č. s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
eklira genuair
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Označení na inhalátoru
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Eklira Genuair 322 pg, prášek k inhalaci Aclidinium (aclidinii bromidům)
2. ZPŮSOB PODÁNÍ
K inhalačnímu podání
3. POUŽITELNOST
Použít do 90 dnů po otevření sáčku. EXP
4. ČÍSLO ŠARŽE
č. s.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
30 jednotkových dávek 60 jednotkových dávek
6. JINÉ
AstraZeneca (logo AstraZeneca)
B. PŘÍBALOVÁ INFORMACE
Eklira Genuair 322 mikrogramů, prášek k inhalaci
Aclidinium (aclidinii bromidům)
'V Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je přípravek Eklira Genuair a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Eklira Genuair užívat
3. Jak se Eklira Genuair používá
4. Možné nežádoucí účinky
5. Jak Eklira Genuair uchovávat
6. Obsah balení a další informace
7. Inhalátor Genuair: Návod k použití
1. Co je přípravek Eklira Genuair a k čemu se používá Co je přípravek Eklira Genuair
Léčivou látkou přípravku Eklira Genuair je aklidinium-bromid, který patří do skupiny léků zvaných bronchodilatancia. Bronchodilatancia uvolňují dýchací cesty a pomáhají udržovat otevřené průdušinky. Eklira Genuair je suchý prášek, který pomocí vdechnutí dostane lék přímo do plic. Tím se usnadňuje dýchání pacientů s chronickou obstrukční plicní nemocí (CHOPN).
K čemu se přípravek Eklira Genuair používá
Eklira Genuair je indikován k udržování dýchacích cest otevřených a k úlevě od příznaků CHOPN, což je závažné chronické onemocnění plic charakterizované dýchacími obtížemi. Pravidelné užívání přípravku Eklira Genuair Vám může pomoci, pokud trvale trpíte dušností související s Vaším onemocněním, a pomůže minimalizovat dopady onemocnění na Váš každodenní život.
2. Čemu musíte věnovat pozornost, než začnete přípravek Eklira Genuair užívat Nepoužívejte přípravek Eklira Genuair
- jestliže j ste alergický(á) na aklidinium-bromid nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
- jestliže j ste alergický(á) na atropin nebo příbuzné bronchodilatační léky, například na ipratropium, tiotropium nebo oxitropium.
Upozornění a opatření
Před použitím přípravku Eklira Genuair se poraďte se svým lékařem, lékárníkem nebo zdravotní sestrou:
- pokud máte astma;
- pokud jste měl(a) nedávno potíže se srdcem;
- pokud vidíte kruhy kolem světel nebo barevných obrazů (zelený zákal, glaukom);
- pokud máte zvětšenou prostatu, problémy s močením nebo zablokovaný močový měchýř.
Eklira Genuair je indikován k udržovací léčbě Vaší chronické obstrukční plicní nemoci; nesmí se používat k léčbě náhlých záchvatů dušnosti nebo sípání. Pokud se Vaše příznaky CHOPN (dušnost, sípání, kašel) nezlepší nebo pokud se zhorší, musíte co nejdříve vyhledat svého lékaře.
Sucho v ústech, které bylo pozorováno ve spojitosti s léky podobnými přípravku Eklira Genuair, může být po dlouhodobém užívání Vašeho léku spojeno s výskytem zubního kazu. Proto prosím nezapomínejte věnovat pozornost ústní hygieně.
Přípravek Eklira Genuair ihned přestaňte používat a vyhledejte lékařskou pomoc:
- pokud se u Vás bezprostředně po užití tohoto léku objeví tíseň na hrudi, kašel, sípání nebo dušnost. Může se jednat o známky stavu zvaného bronchospasmus.
Děti a dospívající
Přípravek Eklira Genuair nesmí užívat děti a dospívající mladší 18 let.
Další léčivé přípravky a Eklira Genuair
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Informujte svého lékaře, pokud jste užíval(a) nebo užíváte podobné léky na dýchací problémy, například léky obsahující tiotropium nebo ipratropium. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem. Použití přípravku Eklira Genuair s těmito léky se nedoporučuje.
Přípravek Eklira Genuair s jídlem a pitím
Přípravek Eklira Genuair můžete užívat kdykoli před jídlem nebo pitím či po něm.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat. Jste-li těhotná nebo kojíte, nesmíte přípravek Eklira Genuair užívat, pokud Vám to nedoporučí Váš lékař.
Řízení dopravních prostředků a obsluha strojů
Eklira Genuair má malý vliv na schopnost řídit nebo obsluhovat stroje. Tento lék může způsobit bolesti hlavy, závrať nebo rozmazané vidění. Pokud se u Vás objeví některý z těchto nežádoucích účinků, neřiďte dopravní prostředky ani neobsluhujte stroje, dokud bolest hlavy neodezní, nevymizí pocit závratě a Vaše vidění se nevrátí k normálnímu stavu.
Eklira Genuair obsahuje mohohydrát laktózy
Tento léčivý přípravek obsahuje laktózu. Pokud Vám Váš lékař řekl, že nesnášíte některé cukry, poraďte se se svým lékařem, než začnete tento léčivý přípravek užívat.
3. Jak se Eklira Genuair používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
- Doporučená dávka přípravku j e jedna inhalace (vdechnutí) dvakrát denně ráno a večer.
- Účinek přípravku Eklira Genuair trvá 12 hodin, takže byste se měli snažit užívat inhalátor Eklira Genuair každé ráno a každý večer ve stejnou dobu. Tím bude zajištěna vždy dostatečná hladina léku ve Vašem těle, která Vám usnadní dýchání v průběhu celého dne a noci. To Vám také pomůže si lépe zapamatovat, že si máte lék vzít.
- Návod k použití: Pokyny k použití inhalátoru Genuair najdete v části 7 na konci příbalové informace. Pokud si nejste jistý(á), jak přípravek Eklira Genuair používat, poraďte se se svým lékařem nebo lékárníkem.
CHOPN je chronické onemocnění; proto se přípravek Eklira Genuair doporučuje užívat každý den dvakrát denně, a nikoli pouze pokud se vyskytnou dýchací problémy nebo jiné příznaky CHOPN.
Doporučená dávka může být prospěšná i pro starší pacienty a pro pacienty, kteří mají problémy s ledvinami nebo s játry. Není nutná žádná úprava dávky.
Jestliže jste použil(a) více přípravku Eklira Genuair, než jste měl(a)
Domníváte-li se, že jste použil(a) více přípravku Eklira Genuair, než jste měl(a), poraďte se se svým lékařem nebo lékárníkem.
Jestliže jste zapomněl(a) použít přípravek Eklira Genuair
Jestliže jste zapomněl(a) užít dávku přípravku Eklira Genuair, vdechněte dávku, jakmile si na to vzpomenete. Pokud se však již blíží doba Vaší další dávky, přeskočte vynechanou dávku. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) používat Eklira Genuair
Tento lék je určen k dlouhodobému užívání. Chcete-li léčbu ukončit, nejprve se poraďte se svým lékařem, protože Vaše příznaky by se mohly zhoršit.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Vzácně se mohou vyskytnout alergické reakce. Pokud Vám začne otékat tvář, hrdlo, rty nebo jazyk (což může, ale nemusí být doprovázeno potížemi s dýcháním nebo polykáním) nebo pokud se Vám na kůži objeví velmi svědivé pupínky (kopřivka), přestaňte užívat tento lék a okamžitě vyhledejte svého lékaře; může se jednat o příznaky alergické reakce.
Při užívání přípravku Eklira Genuair se mohou vyskytnout následující nežádoucí účinky:
Časté: mohou se vyskytnout až u 1 osoby z 10
- Bolest hlavy
- Zánět dutin (sinusitida)
- Rýma (zánět nosohltanu)
- Kašel
- Průjem
- Pocit na zvracení
Méně časté: mohou se vyskytnout až u 1 osoby ze 100
- Závrať
- Sucho v ústech
- Zánět sliznice ústní dutiny (stomatitida)
- Chrapot (dysfonie)
- Zrychlený srdeční tep (tachykardie)
- Bušení srdce (palpitace)
- Potíže s močením (retence moči)
- Rozmazané vidění
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V*. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Eklira Genuair uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na označení inhalátoru a na krabičce za „EXP“ Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Použít do 90 dnů po otevření sáčku.
Inhalátor Genuair uchovávejte v sáčku až do doby, kdy začnete podávat lék.
Přípravek Eklira Genuair nepoužívejte, pokud si všimnete, že je obal poškozený nebo vykazuje známky pokusů o otevření.
Po užití poslední dávky musíte inhalátor vyhodit. Při odložení prázdného nebo nepoužitého inhalátoru do odpadu musíte respektovat místní předpisy upravující nakládání s komunálním odpadem. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co Eklira Genuair obsahuje
- Léčivou látkou je aclidinii bromidum. Jedna podaná dávka obsahuje 375 mikrogramů aclidinii bromidum, což odpovídá 322 mikrogramům aklidinia.
- Pomocnou látkou je monohydrát laktózy.
Jak Eklira Genuair vypadá a co obsahuje toto balení
Eklira Genuair je bílý nebo téměř bílý prášek.
Inhalátor Genuair má bílou barvu a je opatřen integrálním indikátorem dávek a zeleným dávkovacím tlačítkem. Náustek je krytý snímatelným zeleným ochranným krytem. Dodává se v plastovém sáčku.
Dodávané velikosti balení:
Krabička obsahující 1 inhalátor s 30 jednotkovými dávkami.
Krabička obsahující 1 inhalátor s 60 jednotkovými dávkami.
Krabička obsahující 3 inhalátory s 60 jednotkovými dávkami.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce Držitel rozhodnutí o registraci:
AstraZeneca AB SE-151 85 Sodertálje
Švédsko
Výrobce:
Industrias Farmacéuticas Almirall, S.A.
Ctra. Nacional II, Km. 593
08740 Sant Andreu de la Barca, Barcelona
Španělsko
|
Další informace o tomto přípravku získáte |
u místního zástupce držitele rozhodnutí o registraci: |
|
Belgie/Belgique/Belgien AstraZeneca S.A./N.V. Tel: +32 2 370 48 11 |
Lietuva UAB AstraZeneca Lietuva Tel: +370 5 2660550 |
|
Btarapna AcTpa3eHeKa Etarapna EOOfl Tea.: +359 (2) 44 55 000 |
Luxembourg/Luxemburg AstraZeneca S.A./N.V. Tél/Tel: +32 2 370 48 11 |
|
Česká republika AstraZeneca Czech Republic s.r.o. Tel: +420 222 807 111 |
Magyarország AstraZeneca Kft. Tel.: +36 1 883 6500 |
|
Danmark AstraZeneca A/S Tlf: +45 43 66 64 62 |
Malta Associated Drug Co. Ltd Tel: +356 2277 8000 |
|
Deutschland AstraZeneca GmbH Tel: +49 41 03 7080 |
Nederland AstraZeneca BV Tel: +31 79 363 2222 |
|
Eesti AstraZeneca Tel: +372 6549 600 |
Norge AstraZeneca AS Tlf: +47 21 00 64 00 |
|
EkXáda AstraZeneca A.E. Tr^: +30 2 106871500 |
Osterreich AstraZeneca Osterreich GmbH Tel: +43 1 711 31 0 |
|
Espaňa AstraZeneca Farmacéutica Spain, S.A. Tel: +34 91 301 91 00 |
Polska AstraZeneca Pharma Poland Sp. z o.o. Tel.: +48 22 874 35 00 |
|
France AstraZeneca Tél: +33 1 41 29 40 00 |
Portugal AstraZeneca Produtos Farmaceuticos, Lda. Tel: +351 21 434 61 00 |
|
Laboratórios Vitória, SA Tel: +351 21 475 83 00 | |
|
Hrvatska AstraZeneca d.o.o. Tel: +385 1 4628 000 |
Románia AstraZeneca Pharma SRL Tel: +40 21 317 60 41 |
|
Ireland A. Menarini Pharmaceuticals Ireland Ltd Tel: +353 1 284 6744 |
Slovenija AstraZeneca UK Limited Tel: +386 1 51 35 600 |
|
Island Vistor hf. Sími: +354 535 70 00 |
Slovenská republika AstraZeneca AB, o.z. Tel: +421 2 5737 7777 |
|
Italia AstraZeneca S.p.A. Tel: +39 02 9801 1 |
Suomi/Finland AstraZeneca Oy Puh/Tel: +358 10 23 010 |
|
Kónpoq A^skt^p OappaKeuuKq ArS Tr|A.: +357 22490305 |
Sverige AstraZeneca AB Tel: +46 8 553 26 000 |
|
Latvija SIA AstraZeneca Latvija Tel: +371 67377100 |
United Kingdom AstraZeneca UK Ltd Tel: +44 1582 836 836 |
Tato příbalová informace byla naposledy revidována {měsíc RRRR}.
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu/.
Na webových stránkách Evropské agentury pro léčivé přípravky je tato příbalová informace k dispozici ve všech úředních jazycích EU/EHP.
Tato část obsahuje informace o použití inhalátoru Genuair. Máte-li jakékoli otázky týkající se užívání inhalátoru, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
Před použitím inhalátoru Genuair si prosím přečtěte celý návod.
Seznámení s přípravkem Eklira Genuair: Vyjměte inhalátor Genuair ze sáčku a seznamte se s jeho součástmi.
Zelené tlačítko
Indikátor
dávek
Ochranný
kryt


Barevné kontrolní okénko
Náustek
Jak se Eklira Genuair používá
Souhrn
Pro použití inhalátoru Genuair musíte provést po odstranění krytu 2 kroky:
Krok 1: Stiskněte a UVOLNĚTE zelené tlačítko a úplně vydechněte mimo inhalátor. Krok 2: Rty pevně obemkněte náustek a SILNĚ a ZHLUBOKA vdechněte přes inhalátor.
Po inhalaci nezapomeňte znovu nasadit ochranný kryt.
Příprava
• Před prvním použitím roztrhněte zatavený sáček podél zářezu a vyjměte inhalátor Genuair.
• Když si chcete vzít svou dávku léku, sejměte ochranný kryt tak, že zlehka stisknete šipky vyznačené na obou stranách a vytáhnete kryt ven (viz obrázek 1).
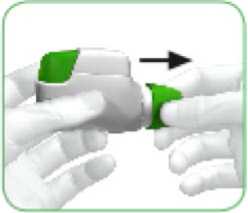
OBRÁZEK 1
• Prohlédněte si náustek, zda není ucpaný.
• Podržte inhalátor Genuair vodorovně náustkem směrem k sobě tak, aby zelené tlačítko směřovalo rovně nahoru (viz obrázek 2).

OBRÁZEK 2
KROK 1: STISKNĚTE zelené tlačítko zcela dolů a pak jej UVOLNĚTE (viz obrázky 3 a 4).
ZELENÉ TLAČÍTKO NEDRŽTE STISKNUTÉ.
ST,SKNETE ze|ené t|ačítko UVOLNĚTE zelené tlačítko zcela dolů
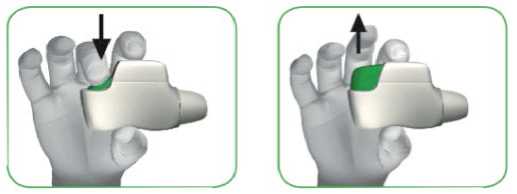
OBRÁZEK 3 OBRÁZEK 4
Zastavte a zkontrolujte: Ujistěte se, že je dávka připravena k inhalaci
• Ujistěte se, že barevné kontrolní okénko se zbarvilo zeleně (viz obrázek 5).
• Zelené kontrolní okénko potvrzuje, že lék je připraven k inhalaci.

• Než si vložíte inhalátor do úst, úplně vydechněte. Nevydechujte do inhalátoru.
KROK 2: Rty pevně obemkněte náustek inhalátoru Genuair a SILNĚ a ZHLUBOKA vdechněte přes náustek (viz obrázek 6).
- Tímto silným a hlubokým vdechnutím se lék dostane do plic.
SPRÁVNĚ
NESPRÁVNĚ
OBRÁZEK 6
• V průběhu vdechování uslyšíte „KLIKNUTÍ “, které signalizuje, že používáte inhalátor Genuair správně.
• Pokračujte ve vdechování i poté, co uslyšíte „KLIKNUTÍ“ inhalátoru, abyste zajistili podání celé dávky.
• Vyjměte inhalátor Genuair z úst a zadržte dech tak dlouho, jak to bez potíží snesete, a potom pomalu vydechněte nosem.
Poznámka: Někteří pacienti mohou mít při inhalaci léku mírné sladké nebo nahořklé chuťové vjemy nebo mohou pociťovat hrubý povrch v ústech v závislosti na pacientovi. Pokud po inhalaci necítíte žádnou chuť ani nemáte žádné zvláštní pocity, neopakujte dávku.
Zastavte a zkontrolujte: Ujistěte se, že jste inhalovali správně
• Ujistěte se, že se kontrolní okénko zbarvilo červeně (viz obrázek 7). To potvrzuje, že jste správně inhalovali celou dávku.

/
• Pokud okénko nezmění barvu na červenou, možná jste neuvolnili zelené tlačítko před inhalací nebo jste inhalaci neprovedli správně. Pokud k tomu dojde, zkuste to znovu.
Ujistěte se, že jste UVOLNILI zelené tlačítko a provedli SILNÝ a hluboký nádech přes náustek.
Poznámka: Nejste-li schopni provést inhalaci správně po několika pokusech, poraďte se s lékařem.
Jakmile se okénko zbarví červeně, nasaďte zpět ochranný kryt tak, že jej zatlačíte na náustek (viz obrázek 8).
r a

OBRÁZEK 8
Kdy byste měli dostat nový inhalátor Genuair?
• Inhalátor Genuair je vybaven indikátorem dávek, který ukazuje přibližný počet dávek zbývajících v inhalátoru. Indikátor dávek se pomalu pohybuje dolů a odpočítává dávky po desítkách (60, 50, 40, 30, 20, 10, 0), (viz obrázek A). Každý inhalátor Genuair obsahuje nejméně 60 dávek.
Když se na indikátoru dávek objeví červený pruhovaný pás, (viz obrázek A), znamená to, že se blíží poslední dávka a měli byste dostat nový inhalátor Genuair.
Červený pruhovaný pás
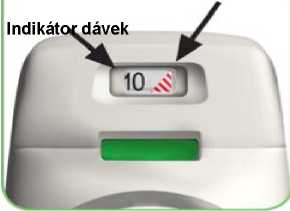
OBRÁZEK A
Indikátor dávek odpočítává po 10: 60, 50, 40, 30, 20, 10, 0.
Poznámka: Pokud se Vám zdá, že je inhalátor Genuair poškozený, nebo pokud ztratíte kryt, musíte inhalátor vyměnit. Inhalátor Genuair SE NEMUSÍ čistit. Pokud si jej však přejete vyčistit, otřete vnější povrch náustku suchou buničinou nebo papírovým kapesníkem.
K čištění inhalátoru Genuair NIKDY nepoužívejte vodu, protože by mohla lék poškodit.
• Když se uprostřed indikátoru dávek objeví 0 (nula), měli byste pokračovat v užívání dávek zbývajících v inhalátoru Genuair.
• Když je k inhalaci připravena poslední dávka, zelené tlačítko se nevrátí do úplné horní pozice, ale zůstane zablokované ve střední pozici (viz obrázek B). I když je zelené tlačítko zablokované, je možno provést inhalaci poslední dávky. Poté již inhalátor Genuair nelze znovu použít a musíte začít používat nový inhalátor Genuair.
Zablokováno

_J
OBRÁZEK B
PŘÍLOHA IV
VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZMĚNY PODMÍNEK ROZHODNUTÍ O
REGISTRACI
Vědecké závěry
S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) aklidinium-bromidu, mikronizovaného, dospěl výbor CHMP k těmto vědeckým závěrům:
Během sledovaného období bylo pozorováno několik případů pocitů na zvracení, stomatitidy a závratě. Ve všech případech byl zaznamenán dostatečný počet odeznění příznaků po ukončení léčby (pozitivní dechallenge), a proto je možné považovat příčinnou souvislost mezi léčivým přípravkem a nežádoucí příhodou přinejmenším za důvodnou možnost. V průběhu sledovaného období bylo hlášeno také několik případů a stížností týkajících se vnímání přípravku.
S ohledem na dostupné údaje o aclidinium-bromidu a riziku pocitu na zvracení, závratě a stomatitidy a s přihlédnutím k počtu případů „abnormální chuti přípravku“ dospěl výbor PRAC k závěru, že aktualizace informací o přípravku je opodstatněná.
Výbor CHMP souhlasí s vědeckými závěry předloženými výborem PRAC.
Zdůvodnění doporučující změnu podmínek rozhodnutí o registraci
Na základě vědeckých závěrů týkajících se aklidinium-bromidu, mikronizovaného, zastává výbor CHMP stanovisko, že poměr přínosů a rizik léčivých přípravků obsahujících léčivou látku aklidinium-bromid, mikronizovaný, je příznivý pod podmínkou, že v údajích o přípravku budou provedeny navržené změny.
Výbor CHMP doporučuje změnit podmínky rozhodnutí o registraci.
36