Duotrav 40 Mikrogramů/Ml + 5 Mg/Ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
DuoTrav 40 mikrogramů/ml + 5 mg/ml oční kapky, roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml roztoku obsahuje travoprostum 40 mikrogramů a timololum 5 mg (jako timololi maleas). Pomocné látky se známým účinkem:
Jeden ml roztoku obsahuje polykvadium-chlorid (POLYQUAD) 10 mikrogramů, propylenglykol 5 mg, hydrogenricinomakrogol 40 1 mg (viz bod 4.4).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Oční kapky, roztok (oční kapky). Čirý bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
DuoTrav je indikován k léčbě poklesu nitroočního tlaku (NOT) u dospělých pacientů s glaukomem s otevřeným úhlem nebo oční hypertenzí, kteří nedostatečně reagují na lokální betablokátory nebo analogy prostaglandinu (viz bod 5.1).
4.2 Dávkování a způsob podání
Dávkování
Použití u dospělých, včetně starší populace
Dávku tvoří jedna kapka přípravku DuoTrav do spojivkového vaku postiženého oka (postižených očí) jednou denně ráno nebo večer. Dávku je třeba aplikovat každý den ve stejnou dobu.
Při vynechání dávky by léčba měla pokračovat další dávkou podle plánu. Dávka by neměla přesáhnout jednu kapku do postiženého oka (očí) denně.
Zvláštní skupiny populace Poškození jater a ledvin
S přípravky DuoTrav a timolol 5 mg/ml oční kapky nebyly provedeny žádné studie na pacientech se zhoršenou funkcí jater nebo ledvin.
Travoprost byl zkoušen na pacientech s mírným až závažným zhoršením funkce jater a na pacientech s mírným až závažným zhoršením funkce ledvin (clearancí kreatininu až pouhých 14 ml/min). U těchto pacientů nebylo nutné upravovat dávku. U pacientů se zhoršenou funkcí jater nebo ledvin je nepravděpodobné, že bude nutné upravovat dávku přípravku DuoTrav (viz bod 5.2).
Pediatrická populace
Bezpečnost a účinnost přípravku DuoTrav u dětí a dospívajících ve věku nižším než 18 let nebyla stanovena. Žádné údaje nejsou k dispozici.
Způsob podání Pro oční podání.
Pacient by měl sejmout ochranný přebal až těsně před prvním použitím. Aby se zabránilo kontaminaci hrotu kapátka a roztoku, je třeba dbát na to, aby se hrot kapátka lahvičky nedotkl víčka, okolních tkání nebo jiných povrchů.
Při použití nasolakrimální okluze nebo při zavření víček na dobu 2 minut se snižuje systémová absorpce. To může vést ke snížení systémových nežádoucích účinků a ke zvýšení lokální aktivity (viz bod 4.4).
Používá-li se více než jeden lokální oční přípravek, je třeba léčivé přípravky aplikovat s odstupem nejméně 5 minut (viz bod 4.5).
Nahrazuje-li se jiný oční přípravek proti glaukomu přípravkem DuoTrav, měla by se léčba jiným přípravkem přerušit a léčba přípravkem DuoTrav zahájit následující den.
Pacienti musí být poučeni, aby si před aplikací přípravku DuoTrav vyjmuli měkké kontaktní čočky a vyčkali po nakapání přípravku 15 minut, než si čočky opět nasadí (viz bod 4.4).
4.3 Kontraindikace
Hypersensitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Hypersensitivita na jiné betablokátory.
Reaktivní onemocnění dýchacích cest včetně bronchiálního astmatu v současnosti či v anamnéze a těžká chronická obstrukční plicní nemoc.
Sinová bradykardie, syndrom chorého sinu včetně sinoatriální blokády, atrioventrikulární blokáda druhého nebo třetího stupně nekontrolovaná kardiostimulátorem. Zjevné srdeční selhání, kardiogenní šok.
Těžká alergická rýma, dystrofie rohovky.
4.4 Zvláštní upozornění a zvláštní opatření pro použití
Systémové účinky
Stejně jako jiné lokálně podávané oční přípravky se i travoprost a timolol absorbují systémově. Vzhledem k beta-adrenergní složce, timololu, se mohou objevit stejné typy kardiovaskulárních, plicních a dalších nežádoucích účinků pozorovaných u léčivých přípravků se systémovými beta-adrenergními blokátory. Incidence nežádoucích účinků po topickém očním podání je nižší než u systémového podání. Snížení systémové absorpce viz bod 4.2.
Srdeční poruchy
U pacientů s kardiovaskulárním onemocněním (např. s ischemickou chorobou srdeční,
Prinzmetalovou anginou a srdečním selháním) a hypotenzí by měla být léčba betablokátory kriticky posouzena a zvážena léčba jinými léčivými látkami. U pacientů s kardiovaskulárními onemocněními je třeba sledovat možné známky zhoršení těchto onemocnění a nežádoucích účinků.
Vzhledem k negativně dromotropnímu účinku by měly být betablokátory podávány pacientům s atrioventrikulární blokádou prvního stupně pouze s opatrností.
Cévní poruchy
Pacienty se závažnou poruchou periferního oběhu (např. s těžkou formou Raynaudovy nemoci nebo s Raynaudovým syndromem) je nutno léčit s opatrností.
Respirační poruchy
Po podání některých očních betablokátorů byly hlášeny respirační reakce včetně úmrtí v důsledku bronchospasmu u pacientů s astmatem.
Přípravek DuoTrav je třeba používat s opatrností u pacientů s mírnou či středně závažnou chronickou obstrukční plicní nemocí (CHOPN) a pouze v případech, kdy potenciální přínos léčby převyšuje nad potenciálním rizikem.
Hypoglykemie/diabetes mellitus
Betablokátory mají být podávány s opatrností u pacientů s výskytem spontánních hypoglykemií nebo u pacientů s labilním diabetem, protože betablokátory mohou maskovat známky a příznaky akutní hypoglykemie.
Svalová slabost
Bylo hlášeno, že léčivé přípravky s beta-adrenergními blokátory mohou potencovat projevy svalové slabosti, odpovídající některým myastenickým příznakům (např. diplopii, ptózu a celkovou slabost).
Poruchy rohovky
Oční betablokátory mohou způsobit suchost očí. Pacienty s onemocněním rohovky je nutno léčit s opatrností.
Odchlípení choroidey
Při podávání léků potlačujících tvorbu komorového moku (např. timololu, acetazolamidu) po filtračních výkonech bylo hlášeno odchlípení choroidey.
Další betablokátory
Účinek na nitrooční tlak či známé účinky systémové betablokády mohou být potencovány, pokud je timolol podáván pacientům již léčeným systémovým betablokátorem. Odpověď těchto pacientů je nutno pečlivě sledovat. Použití dvou topických betablokátorů se nedoporučuje (viz bod 4.5).
Chirurgická anestézie
Oční přípravky blokující betareceptory mohou blokovat systémový účinek beta-agonistů, např. adrenalinu. Je-li pacient léčen timololem, musí o tom být informován anesteziolog.
Hyperthyreóza
Betablokátory mohou také maskovat známky hyperthyreózy.
Kontakt s kůží
Prostaglandiny a analogy prostaglandinů jsou biologicky aktivní látky, které mohou být absorbovány kůží. Těhotné ženy nebo ženy, které se pokouší otěhotnět, by měly být náležitě opatrné, aby se vyhnuly přímému působení obsahu lahvičky na kůži. Pokud dojde ke kontaktu s větším množstvím obsahu lahvičky, důkladně omyjte okamžitě zasažené místo.
Anafylaktické reakce
Při léčbě betablokátory mohou být pacienti s atopií nebo těžkou anafylaktickou reakcí v anamnéze na různé alergeny reaktivnější na opakovanou expozici takovým alergenům a nemusí reagovat na obvyklé dávky adrenalinu, používané k léčbě anafylaktických reakcí.
Souběžná léčba
Může docházet k interakcím timololu s jinými léčivými přípravky (viz bod 4.5).
Užívání dvou lokálně podávaných prostaglandinů se nedoporučuje.
Účinky na oči
Travoprost může postupně měnit barvu oka zvyšováním počtu melanosomů (pigmentových granulí) v melanocytech. Před zahájením léčby musí být pacient informován o možnosti trvalé změny barvy oka. Jednostranná léčba může mít za následek trvalou heterochromii. Dlouhodobé účinky na melanocyty a jej ich veškeré účinky nejsou momentálně známy. Ke změně barvy duhovky dochází pomalu a po celé měsíce nebo roky nemusí být patrná. Změna barvy oka byla převážně pozorována u pacientů s duhovkou zbarvenou vícebarevně, např. modrohnědě, šedohnědě, žlutohnědě a zelenohnědě, objevila se však i u pacientů s hnědýma očima. V typickém případě se hnědá pigmentace kolem zornice rozšiřuje u postiženého oka směrem k periferii, celá duhovka nebo její části však mohou získat nahnědlejší nádech. Po ukončení léčby nebyl pozorován již žádný vzestup hnědého pigmentu duhovky.
V kontrolovaných klinických studiích bylo v souvislosti s užíváním travoprostu pozorováno periorbitální ztmavnutí a/nebo ztmavnutí kůže víček.
U analogů prostaglandinu byly pozorovány periorbitální změny a změny víčka zahrnující prohlubování rýhy očního víčka.
Travoprost může postupně měnit oční řasy léčeného oka (očí). Tyto změny byly zaznamenány u zhruba poloviny pacientů účastnících se klinického zkoušení a zahrnují: prodloužení, zesílení, zvýšení pigmentace a/nebo počtu řas. Mechanismus změn očních řas a jejich dlouhodobé důsledky nejsou momentálně známy.
Ve studiích na opicích bylo prokázáno, že travoprost vyvolává mírné zvětšení oční štěrbiny. Tento účinek však nebyl v klinických studiích pozorován a považuje se za druhově specifický.
S použitím přípravku DuoTrav při zánětlivých očních stavech nejsou žádné zkušenosti, stejně jako ani u neovaskulárního glaukomu, glaukomu s uzavřeným či zúženým úhlem nebo vrozeného glaukomu. Pouze omezené jsou zkušenosti při onemocnění oka vyvolaného štítnou žlázou, u glaukomu s otevřeným úhlem u pseudofakických pacientů a u pigmentového nebo pseudoexfoliativního glaukomu.
Během léčby analogy prostaglandinu F2a byl hlášen makulární edém. Při používání přípravku DuoTrav u afakických pacientů, pseudofakických pacientů s trhlinou v zadním pouzdru čočky nebo čočkách přední komory, nebo u pacientů se známými rizikovými faktory pro cystoidní makulární edém je třeba postupovat s opatrností.
U pacientů, u nichž je známo, že disponují rizikovými faktory pro iritidu či uveitidu a u pacientů s aktivním nitroočním zánětem, se může DuoTrav používat pouze s opatrností.
Pomocné látky
DuoTrav obsahuje propylenglykol, který může vyvolávat podráždění kůže.
DuoTrav obsahuje hydrogenricinomakrogol 40, který může vyvolávat kožní reakce.
Pacienti musí být poučeni, že mají před aplikací přípravku DuoTrav čočky vyjmout a vyčkat 15 minut, než si čočky opět nasadí (viz bod 4.2).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Žádné studie interakcí se specifickými léky nebyly u travoprostu ani timololu provedeny.
Je-li oční roztok obsahující betablokátory podáván souběžně s orálně podávanými blokátory kalciových kanálů, beta-adrenergními blokátory, antiarytmiky (včetně amiodaronu), srdečními glykosidy, parasympatomimetiky, guanethidinem, může teoreticky dojít k aditivním účinkům vyvolávajícím hypotenzi a/nebo výraznou bradykardii.
Při užívání betablokátorů se může zesílit hypertenzní reakce na náhlé přerušení léčby klonidinem.
Při kombinované léčbě inhibitory CYP2D6 (např. chinidinem, fluoxetinem, paroxetinem) a timololem byla hlášena zvýšená systémová beta-blokáda (např. snížení srdeční frekvence, deprese).
Příležitostně byla hlášena mydriáza v důsledku souběžného podávání očních betablokátorů a adrenalinu (epinefrinu).
Léčivé přípravky s betablokátory mohou zvyšovat hypoglykemický účinek antidiabetik. Betablokátory mohou maskovat známky a příznaky hypoglykemie (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku/antikoncepce
DuoTrav nesmějí používat ženy, které mohou otěhotnět, pokud nejsou přijata odpovídající antikoncepční opatření (viz bod 5.3).
Travoprost má škodlivé účinky na těhotné ženy a/nebo na plod či novorozené dítě.
Údaje o podávání přípravku DuoTrav nebo jednotlivých komponentů těhotným ženám jsou omezené nebo nejsou k dispozici. Timolol by během těhotenství neměl být podáván, pokud to není absolutně nezbytné.
V epidemiologických studiích nebyly zjištěny malformační účinky, ale při perorálním podávání betablokátorů bylo prokázáno riziko retardace intrauterinního růstu. Dále byly u novorozenců v případě, že byly betablokátory podávány až do porodu, pozorovány známky a příznaky betablokády (např. bradykardie, hypotenze, respirační distres a hypoglykemie). Pokud je přípravek DuoTrav podáván až do porodu, musí být novorozenec během prvních dnů života pečlivě sledován.
Přípravek DuoTrav by se neměl v těhotenství používat, není-li to jednoznačně nezbytné. Snížení systémové absorpce viz bod 4.2.
Kojení
Není známo, zda se travoprost z očních kapek vylučuje do mateřského mléka. Studie na zvířatech prokázaly vylučování travoprostu a jeho metabolitů do mateřského mléka. Timolol se vylučuje do mateřského mléka s potenciálem vyvolání závažných nežádoucích reakcí u kojence. Není však pravděpodobné, že by po terapeutických dávkách timololu v očních kapkách bylo v mateřském mléce přítomno dostatečné množství, které by mohlo způsobit klinické příznaky betablokády u kojence. Snížení systémové absorpce viz bod 4.2.
Užívání přípravku DuoTrav kojícími ženami se nedoporučuje.
Fertilita
Nejsou k dispozici žádná data o vlivu přípravku DuoTrav na lidskou fertilitu. Studie na zvířatech neukázaly žádný vliv travoprostu nebo timololu na plodnost při dávkách 250krát vyšších než maximální doporučená lidská oční dávka.
4.7 Účinky na schopnost řídit a obsluhovat stroje
DuoTrav nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
Stejně jako u jiných očních kapek se může vyskytnout dočasně zastřené vidění nebo jiné poruchy vidění. Pokud se po nakapání přípravku objeví zastřené vidění, musí pacient vyčkat, dokud se vidění neprojasní, a teprve potom může řídit nebo pracovat se stroji.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
V klinických studiích, jichž se zúčastnilo celkem 2170 pacientů léčených přípravkem DuoTrav, byl nejčastěji hlášeným nežádoucím účinkem, spojeným s léčbou, oční hyperemie (12,0 %).
Seznam nežádoucích účinků v tabulkovém formátu
Následující nežádoucí účinky uvedené v tabulce níže byly pozorovány při klinických studiích nebo ze zkušeností po uvedení přípravku na trh. Jsou uspořádány podle třídy orgánových systémů a jsou rozděleny podle následující klasifikace: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (>1/10 000 až <1/1000) velmi vzácné (<1/10 000, nebo není známo (podle dostupných údajů nelze odhadnout). V rámci každé této skupiny četnosti jsou nežádoucí reakce uvedeny s klesající závažností.
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí reakce |
|
Poruchy imunitního systému |
Méně časté |
hypersenzitivita. |
|
Psychiatrické poruchy |
Vzácné | |
|
Není známo | ||
|
Poruchy nervového systému |
Méně časté |
závratě, bolest hlavy. |
|
Není známo |
cerebrovaskulární příhoda, synkopa, parestézie. | |
|
Poruchy oka |
Velmi časté |
oční hyperemie. |
|
Časté |
tečkovitá keratitida, bolest oka, porucha zrakové ostrosti, rozmazané vidění, suché oko, svědění oka, oční diskomfort, podráždění oka | |
|
Méně časté |
keratitida, iritida, konjunktivitida, zánět v přední komoře, blefaritida, fotofobie, snížení vizuální ostrosti, astenopie, otok oka, zvýšené slzení, erytém očního víčka, růst očních řas, alergie oka, otok spojivek, otok očního víčka. | |
|
Vzácné |
eroze rohovky, meibomianitida, konjunktivální krvácení k, tvorba krust na okraji víček, trichiáza, distichiáza. | |
|
Není známo |
makulární edém, ptóza očního víčka, poškození rohovky. | |
|
Srdeční poruchy |
Méně časté |
bradykardie. |
|
Vzácné |
arytmie, nepravidelná srdeční akce. | |
|
Není známo |
srdeční selhání, tachykardie, bolest na hrudi, palpitace. | |
|
Cévní poruchy |
Méně časté |
hypertenze, hypotenze. |
|
Není známo |
periferní edém. | |
|
Respirační, hrudní a mediastinální |
Méně časté |
dyspnoe, zatékání hlenu z nosní dutiny do hltanu. |
|
poruchy |
Vzácné |
dysfonie, bronchospasmus, kašel, podráždění hrdla, bolest v orofaryngeální oblasti, nazální diskomfort. |
|
Není známo | ||
|
Gastrointestinální poruchy |
Není známo |
disgeuzie. |
|
Poruchy jater a žlučových cest |
Vzácné |
zvýšení alanin-aminotransferázy, zvýšení aspartát-aminotransferázy. |
|
Poruchy kůže a podkožní tkáně |
Méně časté |
kontaktní dermatitida, hypertrichóza, |
|
Vzácné |
kopřivka, změna barvy kůže, alopecie, hyperpigmentace kůže (periokulární). | |
|
Není známo | ||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně: |
Vzácné |
bolest končetin. |
|
Poruchy ledvin a močových cest |
Vzácné |
chromaturie. |
|
Celkové poruchy a reakce v místě aplikace |
Vzácné |
žízeň, únava. |
Další nežádoucí reakce se vyskytly u jedné z léčivých látek přípravku a mohou se vyskytnout také u přípravku DuoTrav :
|
Třídy orgánových systémů |
Preferované termíny dle MedDRA |
|
Poruchy oka |
uveitida, onemocnění spojivky, spojivkové folikuly, hyperpigmentace duhovky. |
|
Poruchy kůže a podkožní tkáně |
olupování kůže. |
Timolol
Stejně jako ostatní topicky aplikované oční léky se i timolol vstřebává do systémového oběhu. To může způsobit podobné nežádoucí účinky jako u systémových betablokátorů. Uváděné nežádoucí účinky zahrnují reakce pozorované u třídy očních betablokátorů. Incidence systémových nežádoucích účinků po topickém očním podání je nižší než u systémového podání. Snížení systémové absorpce viz bod 4.2
|
Třídy orgánových systémů |
Preferované termíny dle MedDRA |
|
Poruchy imunitního systému |
systémové alergické reakce včetně angioedému, kopřivky, lokalizované a generalizované vyrážky, svědění, anafylaxe. |
|
Poruchy metabolismu a výživy |
hypoglykemie. |
|
Psychiatrické poruchy |
insomnie, noční můry, ztráta paměti. |
|
Poruchy nervového systému |
mozková ischemie, zhoršení známek a příznaků myasthenie gravis. |
|
Poruchy oka |
známky a příznaky podráždění očí (např. pálení, štípání, svědění, slzení, zarudnutí), odchlípení choroidey po filtračním výkonu (viz bod 4.4 Zvláštní upozornění a opatření pro použití), snížená citlivost rohovky, diplopie. |
|
Srdeční poruchy |
bolest na hrudi, palpitace, edémy, kongestivní srdeční selhání, atrioventrikulární blokáda, srdeční zástava. |
|
Cévní poruchy |
Raynaudův fenomén, studené ruce a nohy. |
|
Respirační, hrudní a mediastinální poruchy |
bronchospasmus (převážně u pacientů s preexistujícím bronchospastickým onemocněním). |
|
Gastrointestinální poruchy |
dysgeuzie, nauzea, dyspepsie, průjem, sucho v ústech, bolest břicha, zvracení. |
|
Poruchy kůže a podkožní tkáně |
psoriaziformní vyrážka nebo exacerbace psoriázy. |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
myalgie. |
|
Poruchy reprodukčního systému a prsu |
sexuální dysfunkce, snížené libido. |
|
Celkové poruchy a reakce v místě aplikace |
astenie. |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Není pravděpodobné lokální předávkování přípravkem DuoTrav nebo spojení s toxicitou.
V případě náhodného požití mohou příznaky předávkování systémovými betablokátory zahrnovat bradykardii, hypotenzi, bronchospazmus a srdeční selhání.
Dojde-li k předávkování přípravkem DuoTrav, měla by být léčba symptomatická a podpůrná. Timolol se nedá snadno dialyzovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Oftalmologika; antiglaukomatika a miotika, ATC kód: S01ED51. Mechanismus účinku
Přípravek DuoTrav obsahuje dvě léčivé látky: travoprost a timolol-maleinát. Tyto dvě složky snižují nitrooční tlak vzájemně se doplňujícím mechanismem účinku a kombinovaný výsledek vede k většímu snížení nitroočního tlaku ve srovnání se samotnými látkami.
Travoprost, analog prostaglandinu F2a, je úplným agonistou, jenž je vysoce selektivní a má vysokou afinitu k receptoru prostaglandinu FP, a jenž snižuje nitrooční tlak zvýšením odtoku komorové vody přes trabekulární síť a uveosklerální cesty. Snížení nitroočního tlaku u člověka nastupuje zhruba 2 hodiny po podání a maximálního účinku je dosaženo po 12 hodinách. Výrazné snížení nitroočního tlaku lze udržet po období, přesahujícím u jedné dávky 24 hodin.
Timolol je neselektivní adrenergní blokátor, jenž nevykazuje žádný vnitřní sympatomimetický účinek, přímý depresivní účinek na myokard ani účinek stabilizující membránu. Studie tonografie a fluorometrie u člověka udávají, že jeho převládající účinek je spojen se snížením tvorby komorové vody a mírným zvýšením schopnosti odtoku.
Sekundární farmakologie
Travoprost významně zvyšuje krevní zásobení optického nervu u králíků po sedmidenní lokální aplikaci do oka (1,4 mikrogramu, jednou denně)
Farmakodynamické účinky
Klinické účinky
Ve dvanáctiměsíční kontrolované klinické studii na pacientech s glaukomem s otevřeným úhlem nebo oční hypertenzí a průměrným nitroočním tlakem na počátku studie 25 až 27 mm Hg činil průměrný účinek snížení nitroočního tlaku přípravku DuoTrav, podávaného jednou denně ráno, 8 až 10 mm Hg. Ve všech časových bodech při všech návštěvách bylo prokázáno, že přípravek DuoTrav nevykazoval při průměrném snížení nitroočního tlaku horší výsledky než latanoprost 50 mikrogramů/ml + timolol 5 mg/ml.
V tříměsíční kontrolované klinické studii na pacientech s glaukomem s otevřeným úhlem nebo oční hypertenzí a průměrným nitroočním tlakem na počátku studie 27 až 30 mm Hg byl průměrný účinek na snížení nitroočního tlaku přípravku DuoTrav, dávkovaného jednou denně ráno, 9 až 12 mm Hg a
byl až o 2 mm Hg vyšší než účinek travoprostu 40 mikrogramů/ml, dávkovaného jednou denně večer a o 2 až 3 mm Hg vyšší než účinek timololu 5 mg/ml, dávkovaného dvakrát denně. Statisticky lepší snížení ranního průměrného nitroočního tlaku (8 hodin ráno-24 hodin po poslední dávce přípravku DuoTrav) bylo pozorováno i ve srovnání s travoprostem při všech návštěvách po celou dobu studie.
Ve dvou tříměsíčních kontrolovaných klinických studiích na pacientech s glaukomem s otevřeným úhlem nebo s oční hypertenzí a průměrným nitroočním tlakem na počátku studie 23 až 26 mm Hg byl průměrný účinek na snížení nitroočního tlaku přípravku DuoTrav, dávkovaného jednou denně ráno,
7 až 9 mm Hg. Průměrné hodnoty snížení nitroočního tlaku nebyly horší, ačkoliv byly numericky nižší, než hodnoty, dosažené souběžnou terapií travoprostem 40 mikrogramů/ml, dávkovaného jednou denně večer a timololu 5 mg/ml, dávkovaného jednou denně ráno.
Při šestitýdenní kontrolované klinické studii došlo u pacientů s glaukomem s otevřeným úhlem nebo oční hypertenzí a průměrným nitroočním tlakem 24 až 26 mm Hg při podávání jednou denně (ráno) přípravku DuoTrav s konzervační látkou polykvadium-chlorid ke snížení tlaku o 8 mm Hg, což byla hodnota ekvivalentní účinku přípravku DuoTrav (s konzervační látkou benzalkonium-chlorid).
Kritéria pro zařazení byla ve všech studiích společná s výjimkou kritérií pro zařazení spojených s NOT a reakce na předchozí léčbu NOT. Klinický vývoj přípravku DuoTrav zahrnoval pacienty neléčené i léčené. Nedostatečná reakce na monoterapii nebyla kritériem pro zařazení. Stávající data signalizují, že večerní podávání může mít pro zmíněné snížení nitroočního tlaku jisté výhody. Při doporučování ranního nebo večerního podávání je třeba přihlédnout k tomu, jak je to pro pacienta výhodnější a při jakém podávání je pravděpodobnější lepší dodržování léčebného režimu.
5.2 Farmakokinetické vlastnosti
Absorpce
Travoprost a timolol se vstřebávají přes rohovku. Travoprost je prodrug, u něhož dochází v rohovce k rychlé hydrolýze a uvolnění účinné volné kyseliny. Po podání přípravku DuoTrav PQ jednou denně nebyla u zdravých subjektů studie (N = 22) po dobu 5 dnů volná kyselina travoprostu kvantifikovatelná ve vzorcích plazmy u většiny subjektů (94,4 %) a obecně nebyla detekovatelná jednu hodinu po podání. Když byly koncentrace měřitelné (> 0,01 ng/ml, což byl kvantifikační limit zkoušky), kolísaly od 0,01 do 0,03 ng/ml. Průměrná Cmax timololu v ustáleném stavu byla1,34 ng/ml a Tmax dosahoval po podávání přípravku DuoTrav jednou denně 0,69 hodiny.
Distribuce:
Volnou kyselinu travoprostu lze měřit v komorové vodě u zvířat v průběhu několika prvních hodin a u člověka v plazmě pouze během první hodiny po podání přípravku DuoTrav do oka. Timolol lze měřit v lidské komorové vodě po podání timololu do oka a v plazmě až po době 12 hodin po podání přípravku DuoTrav do oka.
Biotransformace
Metabolismus je hlavní cestou eliminace jak travoprostu tak účinné volné kyseliny. Systémové metabolické cesty jsou souběžné s cestami endogenního prostaglandinu F2a jež jsou charakterizovány redukcí dvojité vazby 13-14, oxidací 15-hydroxylu a P-oxidativním štěpením řetězce v horní části.
Timolol je metabolizován dvěma cestami. Jedna cesta zahrnuje etanolaminový postranní řetězec na thiadiazolovém řetězci a druhá etanolový postranní řetězec na morfolinovém dusíku a druhý podobný postranní řetězec s karbonylovou skupinou, přiléhající k dusíku. Poločas timololu t1/2 v plazmě je 4 hodiny po podání přípravku DuoTrav do oka.
Eliminace
Volná kyselina travoprostu a její metabolity se vylučují převážně ledvinami. V moči bylo nalezeno méně než 2 % dávky travoprostu do oka ve formě volné kyseliny. Timolol a jeho metabolity se vylučují především ledvinami. Zhruba 20 % dávky timololu se vylučuje do moči v nezměněné formě a zbytek se vylučuje do moči jako metabolity.
5.3 Předklinické údaje vztahující se k bezpečnosti
U opic bylo prokázáno, že podávání přípravku DuoTrav dvakrát denně rozšiřuje oční štěrbinu a zvyšuje pigmentaci duhovky, podobně jako to bylo zaznamenáno u očního podání prostanoidů.
DuoTrav s konzervační látkou polykvadium-chlorid vyvolával minimální toxicitu očního okolí, ve srovnání s očními kapkami obsahujícími konzervační látku benzalkoniuim-chlorid, na kultivovaných lidských rohovkových buňkách a po lokálním očním podání u králíků.
Travoprost
Lokální oční podání travoprostu opicím v koncentracích až 0,012 % do pravého oka dvakrát denně po dobu jednoho roku nevykázalo žádnou systémovou toxicitu.
Na potkanech, myších a králících byly s travoprostem provedeny studie reprodukční toxicity systémovou cestou podání. Výsledky jsou spojeny s agonistickým účinkem na receptor FP v děloze s časnou letalitou pro embryo, postimplantační ztrátou, toxicitou pro plod. U březích potkaních samic mělo systémové podání travoprostu v dávkách převyšujících více než 200krát klinickou dávku v průběhu organogeneze za následek zvýšený výskyt malformací. V amniotické tekutině a tkáních plodu březích potkaních samic, jimž byl podán travoprost značený 3H, byly naměřeny nízké hladiny radioaktivity. Studie reprodukce a vývoje prokázaly silný vliv na ztrátu plodu s vysokým podílem u potkanů a myší (180 pg/ml resp. 30 pg/ml plazmy) při expozicích 1,2 až 6krát převyšujících klinickou expozici (až 25 pg/ml).
Timolol
Data z jiných než klinických studií neodhalila žádné zvláštní riziko pro člověka u timololu na základě konvenčních studií farmakologie bezpečnosti, toxicity po opakovaném podání, genotoxicity a kancerogenního potenciálu. Studie reprodukční toxicity timololu prokázaly opožděnou osifikaci plodu potkanů bez nežádoucích účinků na postnatální vývoj (při 7000násobku klinické dávky).
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Polykvadium-chlorid Mannitol (E421).
Propylenglykol (E1520).
Hydrogenricinomakrogol 40 (HCO-40)
Kyselina boritá.
Chlorid sodný.
Hydroxid sodný a/nebo kyselina chlorovodíková (pro úpravu pH). Čištěná voda.
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky.
Zlikvidovat 4 týdny po prvním otevření.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 30°C.
6.5 Druh obalu a velikost balení
Oválná lahvička z polypropylenu (PP) nebo polyethylenu o nízké hustotě (LDPE) o objemu 2,5 ml s dávkovacím kapátkem z PP nebo LDPE a šroubovacím uzávěrem z PP, dodáváno v přebalu.
Velikost balení 1, 3 nebo 6 lahviček.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Alcon Laboratories (UK) Ltd.
Frimley Business Park Frimley,
Camberley,
Surrey GU16 7SR Velká Británie
8. REGISTRAČNÍ ČÍSLO (ČÍSLA)
EU/1/06/338/001 -6
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 24/04/06 Datum posledního prodloužení: 07/10/10
10. DATUM REVIZE TEXTU
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/
A. VÝROBCE ODPOVĚDNÝ /VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ /VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název adresa výrobce odpovědného za propouštění šarží
S.A. Alcon Couvreur N.V.,
Rijksweg 14, B-2870,
Puurs,
Belgie
nebo
Alcon Cusí, S.A.,
Camil Fabra 58,
08320 El Masnou,
Barcelona
Španělsko
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
• Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
KRABIČKA PRO JEDNOTLIVOU LAHVIČKU 2,5 ml + KRABIČKA PRO LAHVIČKY 3 x 2,5 ml + KRABIČKA PRO LAHVIČKY 6 x 2,5 ml
DuoTrav 40 mikrogramů/ml + 5 mg/ml oční kapky, roztok. travoprostum/timololum.
Jeden ml roztoku obsahuje travoprostum 40 mikrogramů a timololum 5 mg (jako timololi maleas).
Obsahuje: polykvadium-chlorid, mannitol (E421), propylenglykol (E1520), hydrogenricinomakrogol 40 (HCO-40), kyselina boritá, chlorid sodný, hydroxid sodný a/nebo kyselina chlorovodíková (k úpravě pH), čištěná voda.
Pro další informace viz příbalová informace
Oční kapky, roztok 1 x 2,5 ml 3 x 2,5 ml 6 x 2,5 ml
Oční podání.
Před použitím si přečtěte příbalovou informaci.
Uchovávejte mimo dohled a dosah dětí.
EXP.
Zlikvidujte 4 týdny po prvním otevření. Otevřeno.
Uchovávejte při teplotě do 30°C.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
Alcon Laboratories (UK) Ltd.,
Frimley Business Park
Frimley
Camberley
Surrey GU16 7SR
Velká Británie
PP lahvička PP lahvička PP lahvička LDPE lahvička LDPE lahvička LDPE lahvička
EU/1/06/338/001 1 x 2,5 ml. EU/1/06/338/002 3 x 2,5 ml. EU/1/06/338/003 6 x 2,5 ml. EU/1/06/338/004 1 x 2,5 ml. EU/1/06/338/005 3 x 2,5 ml. EU/1/06/338/006 6 x 2,5 ml.
Lot.
Výdej léčivého přípravku vázán na lékařský předpis.
duotrav
DuoTrav 40 mikrogramů/ml + 5 mg/ml oční kapky.
travoprostum/timololum.
Oční podání.
Před použitím čtěte příbalovou informaci. <Zde otevřete>
EXP.
Zlikvidujte 4 týdny po prvním otevření. Otevřeno.
Lot.
2,5 ml.
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU PŘEBAL
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
DuoTrav 40 mikrogramů/ml + 5 mg/ml oční kapky. travoprostum/timololum.
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
EXP
Zlikvidujte 4 týdny po prvním otevření.
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
2,5 ml.
6 JINÉ
DuoTrav 40 mikrogramů/ml + 5 mg/ml oční kapky, roztok
travoprost/timolol
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je DuoTrav a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek DuoTrav používat
3. Jak se přípravek DuoTrav používá
4. Možné nežádoucí účinky
5. Jak přípravek DuoTrav uchovávat
6. Obsah balení a další informace
1. Co je DuoTrav a k čemu se používá
Přípravek DuoTrav oční kapky roztok je kombinací dvou léčivých látek (travoprost a timolol). Travoprost je analog prostaglandinu, působící tak, že zvyšuje odtok kapaliny, čímž se tlak v oku snižuje. Timolol je betablokátor, vyvolávající snížení tvorby kapaliny uvnitř oka. Obě složky se vzájemně doplňují a snižují tlak v oku.
Přípravek DuoTrav oční kapky se používá k léčbě vysokého očního tlaku u dospělých, včetně starších osob. Tento tlak může vést k onemocnění, jemuž se říká glaukom.
2. Čemu musíte věnovat pozornost, než začnete přípravek DuoTrav používat
Nepoužívejte DuoTrav oční kapky roztok
• Jste-li alergický(á) na travoprost, prostaglandiny, timolol, betablokátory nebo na kteroukoli další složku.
• Máte-li nebo jste měl/a v minulosti problémy s dýcháním, jako je např. astma, těžká chronická obstrukční bronchitida (závažné plicní onemocnění, které může způsobovat sípání, dýchací obtíže a/nebo dlouhotrvající kašel), nebo jiné problémy s dýcháním.
• Trpíte-li vážnou sennou rýmou.
• Máte-li pomalý tlukot srdce, trpíte-li selháním srdce nebo poruchami srdečního rytmu (nepravidelný tlukot srdce).
• Je-li zakalen čirý povrch Vašeho oka.
Váš lékař Vám poradí, zda se některá z výše uvedených podmínek na Vás nevztahuje.
Upozornění a opatření
Než začnete používat tento léčivý přípravek, řekněte svému lékaři, pokud máte nebo jste v minulosti
měl/a
• ischemickou chorobu srdeční (mezi příznaky patří bolest nebo svírání na hrudi, dušnost či dušení), srdeční selhání, nízký krevní tlak,
• poruchy srdeční frekvence, např. pomalý tlukot srdce,
• dýchací problémy, astma nebo chronickou obstrukční plicní nemoc,
• špatný krevní oběh (např. Raynaudovu nemoc nebo Raynaudův syndrom),
• diabetes, protože timolol může maskovat známky a příznaky nízké hladiny cukru v krvi,
• zvýšenou činnost štítné žlázy, protože timolol může maskovat známky a příznaky onemocnění štítné žlázy.
• Informujte svého lékaře předtím, než podstoupíte operaci, že používáte přípravek DuoTrav, protože timolol může měnit účinek některých léků používaných při anestézii.
• Pokud máte myastenii gravis (chronickou nervosvalovou slabost).
• Když se dostaví závažná alergická reakce (kožní vyrážka, červenání a svědění oka) v průběhu léčby přípravkem DuoTrav, ať již byla její příčina jakákoliv, nemusí být podání adrenalinu jednoznačně účinné. Proto při jakékoliv léčbě sdělte prosím lékaři, že užíváte přípravek DuoTrav.
• Máte-li anginu pectoris, problémy krevního oběhu nebo nízký krevní tlak. DuoTrav může tyto zdravotní problémy zhoršovat. Máte-li obavy ze změn těchto příznaků, sdělte to co nejdříve svému lékaři.
• Trpíte-li cukrovkou. DuoTrav může maskovat příznaky nízké hladiny cukru v krvi (hypoglykemie), jako například roztřesenost a závratě. Při používání přípravku DuoTrav je doporučeno pečlivé monitorování hladiny cukru v krvi. Máte-li při dávkování přípravku DuoTrav jakékoli pochybnosti týkající se hladiny cukru v krvi, navštivte lékaře.
• DuoTrav může skrýt příznaky problémů se štítnou žlázou (hypertyreóza). Pokud máte problém se štítnou žlázou, poraďte se se svým lékařem dříve, než budete přípravek DuoTrav používat.
• Pokud jste měli operaci šedého zákalu, poraďte se se svým lékařem dříve, než budete přípravek DuoTrav používat.
• Jestliže máte v současné nebo nedávné době zánět oka, poraďte se se svým lékařem dříve, než budete přípravek DuoTrav používat.
• DuoTrav může měnit barvu duhovky (barevné části oka). Tato změna může být trvalá.
• DuoTrav může prodlužovat, ztlušťovat, zintenzivnit barvu a zvýšit počet Vašich očních řas a může způsobit neobvyklý růst ochlupení na očních víčkách.
• Travoprost může být absorbován kůží a z tohoto důvodu by neměl být používán u těhotných žen nebo žen, které se pokouší otěhotnět. Pokud dojde ke kontaktu léčivého přípravku s kůží, musí být místo důkladně opláchnuto.
Děti
DuoTrav není určen pro použití u dětí a dospívajících ve věku nižším než 18 let.
Další léčivé přípravky a DuoTrav
DuoTrav může ovlivňovat nebo naopak být ovlivňován jinými léčivými přípravky, které užíváte, včetně jiných očních kapek pro léčbu glaukomu. Informujte svého lékaře, pokud užíváte nebo máte v úmyslu užívat léky na snížení krevního tlaku, léky na srdce včetně chinidinu (používaného k léčbě srdečních onemocnění a některých typů malárie), léky na léčbu cukrovky či antidepresiva známá jako fluoxetin a paroxetin.
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat, a to i o lécích, které jsou dostupné bez lékařského předpisu.
Těhotenství, kojení a plodnost
Nepoužívejte přípravek DuoTrav, pokud jste těhotná, jestliže se Váš lékař nedomnívá, že je to nezbytné. Pokud byste mohla otěhotnět, musíte používat v době léčby dostatečně spolehlivou antikoncepci.
Nepoužívejte DuoTrav pokud kojíte. DuoTrav se může dostat do Vašeho mateřského mléka.
Poraďte se se svým lékařem dříve, než začnete během kojení užívat jakýkoliv lék.
Řízení dopravních prostředků a obsluha strojů
Po použití přípravku DuoTrav můžete zjistit, že je Vaše vidění na určitou dobu zastřené. Neřiďte dopravní prostředek ani neobsluhujte žádné stroje, dokud tento pocit neodezní.
DuoTrav obsahuje hydrogenricinomakrogol a propylenglykol, které mohou vyvolávat kožní reakce a podráždění.
3. Jak se přípravek DuoTrav používá
Vždy používejte tento léčivý přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Doporučená dávka přípravku je
Jedna kapka do postiženého oka (očí) jednou denně-ráno nebo večer. Používejte každý den ve stejnou dobu.
Pro obě oči používejte přípravek DuoTrav pouze na pokyn lékaře. Přípravek používejte tak dlouho, jak uvedl Váš lékař.
Přípravek DuoTrav používejte pouze ke kapání do očí.
1
2
3

• Bezprostředně před prvním použitím přípravku roztrhněte přebalový sáček a vyjměte lahvičku (obrázek 1). Poznamenejte na štítek do určeného místa datum otevření.
• Připravte si lahvičku s přípravkem DuoTrav a zrcadlo.
• Umyjte si ruce.
• Odšroubujte uzávěr.
• Držte lahvičku otočenou směrem dolů mezi palcem a ukazovákem.
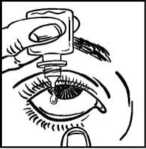
• Zakloňte hlavu. Stáhněte si čistým prstem oční víčko tak, aby se mezi víčkem a okem vytvořila jakási kapsa. Do tohoto místa se přípravek nakápne (obrázek 2).
• Hrot lahvičky držte těsně u oka. Pomůže-li Vám to, použijte zrcadlo.
• Nedotýkejte se kapátkem oka nebo víčka, okolních tkání nebo jiných povrchů. Mohlo by tak dojít ke znečištění kapek.
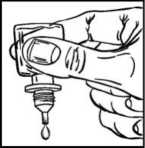
• Lehce stiskněte lahvičku tak, aby se uvolnila vždy jen jedna kapka přípravku DuoTrav (obrázek 3).
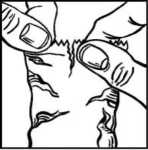
• Po použití přípravku DuoTrav stiskněte na dobu 2 minut prstem koutek oka u nosu (obrázek 4). To pomůže zajistit, aby se DuoTrav nedostal do jiných částí těla.
• Pokud používáte kapky do obou očí, opakujte postup i pro druhé oko.
• Ihned po použití uzavřete opět pevně uzávěr lahvičky.
• Používejte vždy pouze jednu lahvičku. Sáček neotvírejte dříve, než budete potřebovat lahvičku použít.
Další informace jsou uvedeny na další straně.
Kolik se užívá
<viz stranu 1
Pokud se kapka nedostane do oka, zkuste to znovu.
Jestliže jste užil(a) více přípravku DuoTrav, než jste měl(a), vypláchněte jej teplou vodou. Další dávku nepoužívejte, dokud není čas na pravidelné dávkování.
Jestliže jste zapomněl(a) užít přípravek DuoTrav, pokračujte až další plánovanou dávkou. Nezdvojujte následující dávku, abyste vynechanou dávku doplnil(a). Dávka by neměla překročit jednu kapku denně do postiženého oka.
Jestliže jste přestal(a) užívat přípravek DuoTrav, aniž byste se poradil(a) se svým lékařem, oční tlak ve Vašem oku nebude kontrolován, což by mohlo vést i ke ztrátě Vašeho zraku.
Používáte-li jiné oční kapky, vyčkejte mezi aplikacemi přípravku DuoTrav a dalšího přípravku minimálně 5 minut.
Pokud nosíte měkké kontaktní čočky, nepoužívejte kapky, pokud máte čočky nasazeny. Po nakapání přípravku vyčkejte 15 minut, než si čočky opět nasadíte.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Obvykle můžete kapky užívat i nadále, pokud nejsou účinky příliš závažné. Máte-li obavy, poraďte se se svým lékařem nebo lékárníkem. Nepřestávejte užívat přípravek DuoTrav bez porady se svým lékařem.
Velmi časté nežádoucí účinky
(mohou postihnout více než 1 osobu z 10)
Účinky na oko zarudnutí oka.
Časté nežádoucí účinky
(mohou postihnout až 1 osobu z 10)
Účinky na oko
zánět povrchu oka s poškozením povrchu, bolest oka, rozmazané vidění, neobvyklé vidění, suché oko, svědění oka, nepříjemný pocit v oku, známky a příznaky podráždění oka (např. pálení, píchání).
Méně časté nežádoucí účinky
(mohou postihnout až 1 osobu ze 100)
Účinky na oko
zánět povrchu oka, zánět očních víček, otok spojivky, zvýšený růst řas, zánět duhovky, zánět oka, citlivost na světlo, snížené vidění, únava očí, alergie oka, otok oka, zvýšená tvorba slz, zarudnutí víčka, změna barvy víčka.
Celkové nežádoucí účinky
alergie na léky, závratě, bolest hlavy, zvýšení nebo snížení krevního tlaku, dušnost, zvýšený růst vlasů, zatékání hlenu z nosní dutiny do hrdla, zánět kůže a svědění, snížená srdeční frekvence.
Vzácné nežádoucí účinky
(mohou postihnout až 1 osobu z 1000)
Účinky na. oko
ztenčení povrchu oka, zánět žláz na očních víčkách, praskání krevních cév v oku, krusty na okrajích víček, abnormální poloha řas, abnormální růst řas.
Celkové nežádoucí účinky
nervozita, nepravidelná srdeční frekvence, ztráta vlasů, poruchy hlasu, dušnost, kašel, podráždění hrdla, kopřivka, abnormální jaterní krevní testy, změna barvy kůže, ztmavnutí kůže, žízeň, únava, nepříjemný pocit v nose, zbarvení moči, bolest v rukou a nohou.
Není známo
(četnost z dostupných údajů nelze určit)
Účinky na oko
povislé oční víčko (což způsobuje, že oko zůstává polozavřené).
Celkové nežádoucí účinky
vyrážka, selhání srdce, bolest na hrudi, mozková příhoda, mdloby, deprese, astma, zvýšení srdeční frekvence, pocit znecitlivění nebo brnění, bušení srdce, otok dolních končetin, špatná chuť.
Dále:
Přípravek DuoTrav je kombinací 2 léčivých látek. Stejně jako ostatní léky podávané do očí i travoprost a timolol (betablokátor) se vstřebávají do krve. To může způsobovat podobné nežádoucí účinky, jaké jsou pozorovány u betablokátorů podaných do žíly nebo ústy. Výskyt nežádoucích účinků po místním podání do oka je nižší, než když jsou léky podány například ústy nebo injekčně. Níže jsou uvedeny nežádoucí účinky, které zahrnují reakce pozorované u třídy betablokátorů při léčbě onemocnění oka:
Účinky na oko: zánět očních víček, zánět rohovky, odchlípení vrstvy pod sítnicí obsahující krevní cévy po filtračních výkonech, které může způsobit poruchy vidění, snížená citlivost rohovky, eroze rohovky (poškození přední vrstvy očního bulbu), dvojité vidění, změny zabarvení duhovky.
Celkové nežádoucí účinky:
Srdce a oběh: pomalá srdeční činnost, bušení srdce, otoky (hromadění tekutin), změny srdečního rytmu nebo srdeční frekvence, městnavé srdeční selhání (srdeční onemocnění s dušností a otoky nohou v důsledku hromadění tekutin), určitý typ poruchy srdečního rytmu, srdeční záchvat (infarkt), nízký krevní tlak, Raynaudův fenomén, studené ruce a nohy, snížený přísun krve do mozku.
Dýchání: zúžení dýchacích cest v plicích (zejména u pacientů s již existujícím onemocněním), dýchací obtíže, ucpaný nos.
Nervový systém a celkové poruchy: potíže se spaním (nespavost), noční můry, ztráta paměti, ztráta síly a energie.
Žaludek: poruchy chuti, nucení ke zvracení, špatné trávení, průjem, sucho v ústech, bolest břicha, zvracení.
Alergie: generalizované alergické reakce včetně podkožních otoků, ke kterým může dojít např. v obličeji a na končetinách a které mohou ucpat dýchací cesty, což může vést k polykacím a dýchacím potížím, lokalizovaná nebo generalizovaná vyrážka, svědění, náhlá závažná život ohrožující alergická reakce.
Kůže: vyrážka s bělostříbřitým vzhledem (psoriasiformní vyrážka) nebo zhoršení psoriázy, odlupující se kůže.
Svaly: zhoršení známek a příznaků myasthenie gravis (svalová porucha), neobvyklé pocity jako mravenčení, svalová slabost/únava, bolest svalů nezpůsobená námahou.
Reprodukce: sexuální dysfunkce, snížené libido.
Metabolismus: nízké hladiny cukru v krvi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek DuoTrav uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Přípravek DuoTrav oční kapky roztok nepoužívejte po uplynutí doby použitelnosti uvedené na lahvičce a krabičce za „EXP“ (zkratka používaná pro dobu použitelnosti). Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte při teplotě do 30°C.
Nejpozději 4 týdny po prvním otevření je třeba lahvičku zlikvidovat, aby se zamezilo infekci, a používat novou lahvičku. Zapište si datum, kdy jste lahvičku otevřel(a), do příslušného místa na štítku lahvičky a na krabičce.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co DuoTrav obsahuje
Léčivými látkami jsou travoprostum a timololum. Jeden ml roztoku obsahuje travoprostum 40 mikrogramů a timololum 5 mg (jako timololi maleas)
Pomocnými látkami jsou polykvadium-chlorid, mannitol (E421), propylenglykol (E1520), hydrogenricinomakrogol 40, kyselina boritá, chlorid sodný, hydroxid sodný nebo kyselina chlorovodíková (pro úpravu pH), čištěná voda.
Malé množství hydroxidu sodného nebo kyseliny chlorovodíkové se přidává proto, aby se udržely normální hodnoty kyselosti (úrovně pH).
Jak přípravek DuoTrav vypadá a co obsahuje toto balení
DuoTrav je kapalina (čirý bezbarvý roztok), dodávaná v balení, obsahujícím plastovou lahvičku se šroubovacím uzávěrem o objemu 2,5 ml. Každá lahvička je vložena do přebalu.
Balení jsou po 1, 3 nebo 6 lahvičkách.
Na trhu nemusí být všechny velikosti balení.
Alcon Laboratories (UK) Ltd.
Frimley Business Park
Frimley
Camberley
Surrey GU16 7SR
Velká Británie
S.A. Alcon-Couvreur N.V Rijksweg 14 B-2870 Puurs Belgie
Alcon Cusí, S.A. Camil Fabra 58 08320 El Masnou Španělsko
|
Belgie/Belgique/Belgien Luxembourg/Luxemburg Alcon NV @ + 32 (0)2 754 32 10 (Belgie/Belgique/Belgien) |
Latvija Alcon Pharmaceuticals Ltd ® + 371 67 321 121 |
|
Etarapna Ahkoh Etarapna EOOfl ® + 359 2 950 15 65 |
Lietuva Alcon Pharmaceuticals Ltd atstovybé ® + 370 5 2 314 756 |
|
Česká republika Alcon Pharmaceuticals (Czech Republic) s.r.o. ® + 420 225 775 111 |
Magyarország Alcon Hungária Gyógyszerkereskedelmi Kft ® + 36-1-463-9080 |
|
Danmark Alcon Nordic A/S ® + 45 3636 4300 |
Nederland Alcon Nederland BV ® + 31 (0) 183 654321 |
|
Deutschland Alcon Pharma GmbH ® + 49 (0)761 1304-0 |
Norge Alcon Nordic A/S ® + 45 3636 4300 |
|
ETAáSa/Kúnpog A^kov Aagnopáxoprg ElXáq AEBE ® + 30 210 68 78 300 (EMá5a) |
Osterreich Alcon Ophthalmika GmbH ® + 43 (0)1 596 69 70 |
|
Eesti Alcon Pharmaceuticals Ltd. Eesti filiaal ® + 372 6 313 214 |
Polska Alcon Polska Sp. z o.o. ® + 48 22 820 3450 |
|
Espana Alcon Cusí, S.A. ® + 34 93 497 7000 |
Portugal Alcon Portugal -Produtos e Equipamentos Oftalmológicos, Lda. ® + 351 214 400 300 |
|
France Laboratoires Alcon ® + 33 (0)1 47 10 47 10 |
Romania S.C. Alcon Romania S.R.L. ® + 40 21 203 93 24 |
|
Hrvatska Alcon Farmaceutika d.o.o. ® + 385 1 4611 988 |
Slovenija Alcon d.o.o. ® + 386 1 422 5280 |
|
Ireland Malta United Kingdom Alcon Laboratories (UK) Ltd ® + 44 (0) 345 266 9363 (United Kingdom) |
Slovenská republika Novartis Slovakia s.r.o. Alcon Division ® + 421 2 5441 0378 |
Island
Suomi/Finland Alcon Nordic A/S ® + 45 3636 4300
Sverige
Alcon Nordic A/S ® + 45 3636 4300
Alcon Nordic A/S ® + 45 3636 4300
Italia
Alcon Italia S.p.A. ® + 39 02 81 80 31
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: http://www.ema.europa.eu.
30