Duoresp Spiromax 160 Mikrogramů/4,5 Mikrogramu
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
DuoResp Spiromax 160 mikrogramů/4,5 mikrogramu prášek k inhalaci
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna podaná dávka (dávka, která je uvolněna přes náustek Spiromax) obsahuje budesonidum 160 mikrogramů a formoteroli fumaras dihydricus 4,5 mikrogramu.
To odpovídá odměřené dávce budesonidum 200 mikrogramů a formoteroli fumaras dihydricus 6 mikrogramů.
Pomocná látka/Pomocné látky se známým účinkem:
Jedna dávka obsahuje přibližně 5 miligramů laktosy (ve formě monohydrátu).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek k inhalaci.
Bílý prášek.
Bílý inhalátor s poloprůhledným vínově červeným krytem náustku.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
DuoResp Spiromax je indikován pouze k léčbě dospělých ve věku od 18 let. Astma
DuoResp Spiromax je indikován k pravidelné léčbě pacientů s astmatem, u kterých je vhodné použití kombinované léčby (inhalační kortikoid a dlouhodobě působící P2-adrenergní agonista), tj.:
- pacientům, kteří nejsou adekvátně kontrolováni inhalačními kortikoidy a „podle potřeby“ podávanými krátkodobě působícími P2-adrenergními agonisty.
nebo
- pacientům již dobře kontrolovaným kombinací inhalačního kortikoidu a dlouhodobě působícího P2-adrenergního agonisty.
Chronická obstrukční plicní nemoc (CHOPN)
Symptomatická léčba pacientů s těžkou chronickou obstrukční plicní nemocí (FEV1 < 50 % normální předpovědní hodnoty) a s anamnézou opakovaných exacerbací, u kterých přetrvávají významné klinické příznaky nemoci při pravidelné léčbě dlouhodobě působícími bronchodilatátory.
4.2 Dávkování a způsob podání
Přípravek DuoResp Spiromax je indikován pouze k léčbě dospělých ve věku od 18 let. DuoResp Spiromax není určen pro děti do 12 let a dospívající ve věku od 13 do 17 let.
Dávkování
DuoResp Spiromax není určen k zahájení léčby astmatu.
Přípravek DuoResp Spiromax není vhodný k léčbě dospělých pacientů, kteří mají pouze mírné astma a kteří nejsou dostatečně kontrolováni pomocí inhalačního kortikosteroidu a podle potřeby podávaných inhalačních krátkodobě působících P2-adrenergních agonistů.
Dávkování přípravku DuoResp Spiromax je třeba individualizovat podle závažnosti onemocnění. Toto je nutné mít na paměti v době, kdy se léčba kombinovaným přípravkem zahajuje, ale i v době, kdy dochází k nastavení udržovací dávky. Pokud léčba pacienta vyžaduje kombinaci dávkování, které je jiné než dostupné dávkování kombinovaného inhalátoru, je nutné předepsat vhodné dávky P2-adrenergních agonistů a nebo kortikoidu v jednotlivých inhalátorech.
Jakmile je dosaženo kontroly příznaků astmatu, je na místě uvažovat o postupném snižování dávky přípravku DuoResp Spiromax. Lékař by měl pacienta pravidelně sledovat tak, aby dávkování přípravku DuoResp Spiromax bylo stále optimální. Dávka přípravku by měla být titrována na nejnižší dávku, při které je zachována účinná kontrola symptomů onemocnění.
Je-li vhodné titrovat na nižší dávku, než kterou může poskytnout přípravek DuoResp Spiromax, je nutná změna na alternativní kombinaci s fixní dávkou budesonidu a formoterol-fumarátu a s nižšími dávkami inhalačních kortikosteroidů. Pokud je astma kontrolováno i nejnižší doporučenou dávkou přípravku, lze v dalším kroku uvažovat o podávání samotného inhalačního steroidu.
V klinické praxi, pokud je dosaženo kontroly symptomů astmatu při dávkování dvakrát denně s nižší sílou přípravku, je při titraci dávky na nejnižší účinnou dávku možno uvažovat i o podávání přípravku DuoResp Spiromax jednou denně, pokud je předepisující lékař přesvědčen, že dlouhodobě působící bronchodilatátor je žádoucí k udržení kontroly astmatu spíše než léčba samotným inhalačním kortikosteroidem.
DuoResp Spiromax se užívá podle dvou léčebných přístupů:
Udržovací léčba přípravkem DuoResp Spiromax: DuoResp Spiromax je podáván pravidelně jako udržovací léčba se samostatným bronchodilatátorem s rychlým nástupem účinku k inhalaci při úlevové léčbě.
Udržovací a úlevová léčba přípravkem DuoResp Spiromax: DuoResp Spiromax je podáván pravidelně jako udržovací léčba a dle potřeby v závislosti na vývoji symptomů.
Udržovací léčba přípravkem DuoResp Spiromax
Pacienti by měli být poučeni, že musí mít úlevovou medikaci, tj. bronchodilatátor s rychlým nástupem účinku vždy k dispozici.
Doporučené dávkování:
Dospělí (18 let a starší): 1 až 2 inhalace dvakrát denně. U některých pacientů může být potřebné dávkování až maximálně 4 inhalace dvakrát denně.
Zvýšená spotřeba krátkodobě působícího bronchodilatátoru ukazuje na zhoršení kontroly astmatu a měla by být doprovázena přehodnocením léčby.
Pacienti užívají denně udržovací dávku přípravku DuoResp Spiromax a dále DuoResp Spiromax dle potřeby v závislosti na vývoji symptomů. Pacienti by měli být poučeni, že musí mít pro úlevové užití DuoResp Spiromax vždy k dispozici.
Udržovací a úlevová léčba přípravkem DuoResp Spiromax by měla být zvažována především u pacientů:
• s neadekvátní kontrolou astmatu, kteří často používají úlevovou léčbu.
• jejichž exacerbace astmatu vyžadovala v minulosti lékařský zásah.
Pacienti, kteří často užívají vyšší počet dávek přípravku DuoResp Spiromax dle potřeby, by měli být pečlivě sledováni pro možnost rozvoje nežádoucích účinků závislých na dávce.
Doporučené dávkování:
Dospělí (18 let a starší): Doporučená udržovací dávka je 2 inhalace denně, tj. jedna inhalace ráno a jedna večer, nebo 2 inhalace ráno či večer. Pro některé pacienty může být vhodná udržovací dávka 2 inhalace dvakrát denně. Při zhoršení by měl pacient inhalovat další 1 dávku dle potřeby. Pokud symptomy přetrvávají i po několika minutách po podání, je třeba inhalovat další dávku. Nedoporučuje se inhalovat více než 6 dávek najednou.
Obvykle není potřeba inhalovat více než 8 dávek za den, ale po omezenou dobu lze připustit i 12 inhalací za den. Pacienti, kteří užívají více než 8 inhalací za den, by měli být poučeni, že v tomto případě je nutné, aby vyhledali ošetřujícího lékaře. Lékař by měl zhodnotit stávající léčbu astmatu a znovu nastavit udržovací léčbu.
Chronická obstrukční plicní nemoc (CHOPN)
Doporučené dávkování:
Dospělí (18 let a starší): Dvě inhalace dvakrát denně
Zvláštní skupiny pacientů:
Starší pacienti (> 65 let)
U starších pacientů není nutné upravovat doporučené dávkování.
Pacienti s poruchou funkce ledvin nebo jater
U pacientů s poruchou funkce jater nebo ledvin nejsou dostupné klinické údaje o použití fixní kombinace budesonidu a dihydrátu formoterol-fumarátu. Vzhledem k tomu, že jsou obě léčivé látky primárně metabolizovány v játrech, lze očekávat zvýšenou orgánovou expozici u pacientů s těžkou cirhózou jater.
Pediatrická populace
Bezpečnost a účinnost přípravku DuoResp Spiromax nebyla dosud stanovena u dětí ve věku 12 let a mladších a u dospívajících ve věku 13 až 17 let. Nejsou dostupné žádné údaje.
Tento léčivý přípravek není doporučený pro použití u dětí a dospívajících do 18 let věku.
Způsob podání
Inhalační podání.
Inhalátor Spiromax je aktivován nádechem, tj. léčivé látky se dostávají do dýchacích cest spolu se vdechovaným vzduchem, jakmile se pacient nadechne přes náustek inhalátoru. Bylo prokázáno, že pacienti se středně závažným a závažným astmatem jsou schopni vytvořit dostatečný inspirační průtok pro Spiromax k dodání terapeutické dávky (viz bod 5.1).
Přípravek DuoResp Spiromax by měl být používán správně pro dosažení účinné léčby. Pacienti by proto měli být informováni, aby si pečlivě přečetli příbalovou informaci a dodržovali instrukce pro použití.
Použití přípravku DuoResp Spiromax by mělo probíhat podle tří jednoduchých kroků: otevřít, nadechnout a zavřít, které jsou uvedeny níže.
Otevřít: Držte Spiromax s krytem náustku dole a sklopením víčka náustku dolů jej otevírejte, dokud není plně otevřen, což je signalizováno jedním cvaknutím.
Nadechnout: Vložte náustek do úst mezi zuby, pevně ho sevřete rty, nekousejte náustek inhalátoru. Zhluboka a rychle se nadechněte ústy přes náustek. Vyjměte Spiromax z úst a zadržte dech na 10 sekund nebo tak dlouho, jak je to pohodlné.
Zavřít: Lehce vydechněte a zavřete kryt náustku
Je také důležité, abyste poradili pacientům, aby s inhalátorem před použitím netřepali, nevydechovali přes inhalátor Spiromax a neucpávali vývody vzduchu při přípravě kroku „Nadechnout“
Pacienti by také měli být informováni, aby si po inhalaci vypláchli ústa vodou (viz bod 4.4).
Pacient si může všimnout příchuti při použití přípravku DuoResp Spiromax, protože přípravek obsahuje laktosu.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo pomocné látky uvedené v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Všeobecně
Při přerušování léčby se doporučuje vysazovat přípravek postupně a nikoliv náhle.
Pokud pacient pokládá léčbu za neúčinnou, nebo potřebuje podávat vyšší než nejvyšší doporučené dávky přípravku DuoResp Spiromax, je nutné, aby vyhledal ošetřujícího lékaře (viz bod 4.2). Náhlé nebo progredující zhoršování astmatu nebo chronické obstrukční plicní nemoci potenciálně ohrožuje život pacienta a je nutný neodkladný lékařský zásah. V této situaci je nutné uvažovat o zintenzívnění léčby kortikosteroidy, např. nasazením perorálních kortikosteroidů nebo antibiotické, léčby, pokud je přítomna infekce.
Pacienti by měli mít úlevový inhalátor vždy k dispozici, buď Duo Resp Spiromax (pro pacienty s astmatem používající DuoResp Spiromax jako udržovací nebo úlevovou léčbu), nebo samostatný rychle působící bronchodilatační lék (pro pacienty s astmatem používající DuoResp Spriomax pouze jako udržovací léčbu).
Pacienti by měli být poučeni, aby užívali předepsanou udržovací dávku přípravku DuoResp Spiromax i v období, kdy nemají příznaky. Preventivní použití přípravku DuoResp Spiromax, např. před cvičením, nebylo hodnoceno. Úlevové inhalace přípravku DuoResp Spiromax by měly být užity při rozvoji symptomů onemocnění, ale nejsou určeny pro pravidelné preventivní použití, např. před cvičením. V těchto případech by mělo být zváženo podání rychle působícího bronchodilatátoru.
Příznaky astmatu
Lékař by měl pacienta pravidelně sledovat tak, aby dávkování přípravku DuoResp Spiromax bylo stále optimální. Dávka přípravku by měla být titrována na nejnižší dávku, při které je zachována účinná kontrola symptomů onemocnění. Jakmile je dosaženo kontroly symptomů astmatu, je na místě uvažovat o postupném snižování dávky přípravku DuoResp Spiromax. Je-li vhodné titrovat na nižší dávku, než kterou může poskytnout přípravek DuoResp Spiromax, je nutná změna na alternativní kombinaci s fixní dávkou budesonidu a formoterol-fumarátu a s nižšími dávkami inhalačních kortikosteroidů.
Při postupném snižování dávky je přitom důležité pravidelně sledovat pacienty.
U pacientů během exacerbace nebo pokud mají významné zhoršení nebo akutní zhoršení astmatu by neměla být zahájena léčba přípravkem DuoResp Spiromax.
V průběhu léčby přípravkem DuoResp Spiromax se mohou objevit závažné nežádoucí účinky související s léčbou astmatu a exacerbace. Pacienti by měli být poučeni, že je nutné pokračovat v léčbě a současně vyhledat lékařskou pomoc v případě, že se příznaky astmatu nedaří po zahájení léčby přípravkem DuoResp Spiromax kontrolovat či se dokonce zhoršují.
Inhalační léčba obecně může někdy paradoxně vyvolat bronchospasmus se sípáním a dušností těsně po inhalaci. Pokud paradoxně dojde k projevům bronchospasmu, je třeba léčbu přípravkem DuoResp Spiromax ihned ukončit, pacienta vyšetřit a pokud je to nezbytné, zahájit alternativní léčbu. Paradoxní bronchospasmus odpovídá na bronchodilatátor s rychlým nástupem účinku a má být léčen okamžitě (viz bod 4.8).
Systémové účinky
Inhalační kortikoidy mohou mít systémové účinky, zvláště pokud jsou podávány ve vysokých dávkách po dlouhou dobu. Tyto účinky jsou daleko méně pravděpodobné při inhalačním podávání ve srovnání s perorálním podáním kortikoidů.
Systémové účinky se mohou projevit Cushingovým syndromem, Cushingoidními znaky, adrenální supresí, zpomalením růstu u dětí a dospívajících, snížením minerální hustoty kostí, kataraktou a glaukomem. Méně často se může objevit celá řada účinků na psychiku nebo chování zahrnujících psychomotorickou hyperaktivitu, poruchy spánku, úzkost, depresi nebo agresi (zvláště u dětí) (viz bod 4.8).
Doporučuje se, aby lékař pravidelně sledoval růst u dětí a dospívajících, kteří užívají dlouhodobě inhalační kortikoidy. Pokud dojde ke zpomalení růstu, léčba by měla být zhodnocena s cílem možného snížení dávky inhalačního kortikosteroidu na nejnižší dávku, na které je dosaženo efektivní kontroly astmatu, pokud je to možné. Vždy je třeba vážit mezi přínosem kortikoidní léčby ke kontrole astmatu a možným zpomalením růstu. V této situaci je vhodné konzultovat s pediatrem se specializací v oboru respiračních onemocnění.
Omezená data z dlouhodobých klinických hodnocení ukazují, že děti a dospívající léčení inhalačním budesonidem dorůstají v dospělosti do své normální výšky. Na počátku léčby je však patrné přechodné zpomalení růstu (asi o 1 cm). K tomu obvykle dochází v průběhu prvního roku léčby.
Účinky na hustotu kostí
Potenciální vliv na hustotu kostí by měl být brán v úvahu zvláště u pacientů s rizikovými faktory pro osteoporózu a současně léčených vysokými dávkami přípravku po delší období.
Dlouhodobé studie s inhalačním budesonidem u dětí na průměrné denní dávce 400 mikrogramů (odměřená dávka) a u dospělých na průměrné denní dávce 800 mikrogramů (odměřená dávka) neprokázaly významný vliv na kostní denzitu. Nejsou dostupné informace pro fixní kombinaci budesonidu/dihydrátu formoterol-fumarátu ve vyšších dávkách.
Adrenální funkce
Pokud existuje podezření, že funkce nadledvin je po předchozí léčbě systémovými kortikoidy snížena, je třeba věnovat zvýšenou pozornost převodu pacientů na fixní léčbu pomocí kombinace budesonid/formoterol-fumarát.
Přínosem inhalačního budesonidu by měla být minimální potřeba perorálních kortikoidů. Ovšem pacienti převádění z perorálních kortikoidů mohou mít sníženou adrenální rezervu, někdy přetrvávající značně dlouho. Obnovení stavu může trvat značně dlouho po ukončení léčby perorálními kortikoidy, a proto mohou mít pacienti závislí na perorálních steroidech riziko snížené adrenální rezervy po značně dlouhou dobu. V takovém případě je třeba pravidelně kontrolovat funkci osy hypotalamus-hypofýza-nadledviny.
Vysoká dávka kortikosteroidů
Dlouhodobá léčba vysokými dávkami inhalačních kortikoidů, zvláště dávkami vyššími než doporučenými, může vést ke klinicky významné adrenální supresi. V období zvýšeného stresu, jako je např. těžká infekce nebo elektivní chirurgický zákrok, je třeba uvažovat o přídavné dávce systémových kortikoidů. Náhlé snížení dávky steroidů může vyvolat akutní nedostatečnost nadledvin. Příznaky a projevy, které lze pozorovat v průběhu této krize, jsou poněkud neurčité, ale mohou zahrnovat anorexii, bolest břicha, ztrátu tělesné hmotnosti, únavu, bolest hlavy, nevolnost, zvracení, sníženou úroveň vědomí, křeče, hypotenzi a hypoglykémii.
Léčbu přídatnými systémovými steroidy nebo inhalovaným budesonidem je třeba ukončovat postupně, a nikoliv náhle.
Převod z perorální léčby
V průběhu převodu z perorální léčby na kombinaci budesonid/formoterol-fumarát je aktivita systémových steroidů nižší, což se může projevit alergickými či artritickými příznaky, např. rinitidou, ekzémem a bolestí svalů a kloubů. V těchto případech je třeba zahájit specifickou léčbu. Obecně lze uvažovat o nedostatečném účinku kortikoidů v těch vzácných případech, kdy se objeví příznaky jako je únava, bolest hlavy, nevolnost a zvracení. V těchto případech je někdy nezbytné dočasně zvýšit dávku perorálních kortikoidů.
Infekce úst
Aby se minimalizovalo riziko kvasinkové infekce (candida) nosohltanu, je třeba poučit pacienty,aby si vypláchli ústa vodou po každé inhalaci udržovací dávky přípravku. Pokud dojde ke kvasinkové infekci nosohltanu, měli by si pacienti vypláchnout ústa vodou také po každé inhalaci podle potřeby.
Pneumonie u pacientů s CHOPN
U pacientů s CHOPN, kterým byly podávány inhalační glukokortikoidy, byl pozorován vyšší výskyt pneumonie, včetně pneumonie vyžadující hospitalizaci. Existují určité důkazy o tom, že zvýšené riziko pneumonie souvisí se zvyšováním dávky steroidu, avšak tuto závislost se nepodařilo definitivně prokázat ve všech studiích.
Neexistují jednoznačné klinické důkazy o rozdílech mezi léčivými přípravky ze skupiny inhalačních glukokortikoidů ohledně výše rizika pneumonie.
Lékaři mají sledovat možný vývoj pneumonie u pacientů s CHOPN, neboť klinické známky těchto infekcí se mohou překrývat se symptomy, které doprovázejí exacerbaci CHOPN.
Rizikovými faktory pro pneumonii u pacientů s CHOPN jsou současné kouření, vyšší věk, nízký index tělesné hmotnosti (BMI) a těžká CHOPN.
Interakce s jinými léčivými přípravky
Je nutné vyloučit současnou léčbu itrakonazolem, ritonavirem a jinými účinnými inhibitory CYP3A4 (viz bod 4.5). Pokud to není možné, je nutné maximálně prodloužit časový interval mezi podáním vzájemně působících léčiv. U pacientů užívajících silné inhibitory CYP3A4 se fixní kombinovaná léčba zahrnující budesonid/formoterol-fumarát nedoporučuje.
Upozornění na nutnost opatrnosti při zvláštních onemocněních
Fixní kombinace budesonidu a dihydrátu formoterol-fumarátu je nutné podávat opatrně pacientům s thyreotoxikózou, feochromocytomem, diabetes mellitus, neléčenou hypokalémií, hypertrofickou obstrukční kardiomyopatií, idiopatickou subvalvulární stenózou aorty, těžkou hypertenzí, aneurysmatem a jinými závažnými kardiovaskulárními poruchami, např. ischemickou chorobou srdeční, tachyarytmiemi nebo těžkým srdečním selháním.
K léčbě pacientů s prodlouženým intervalem QTc je třeba přistupovat opatrně. Podávání formoterolu může vyvolat prodloužení intervalu QTc.
Potřebu podávat inhalační kortikoidy, resp. velikost podávané dávky, je nutné pečlivě uvážit u pacientů s aktivní či němou formou plicní tuberkulózy, plísňovými a virovými infekcemi respiračního traktu.
U diabetiků je třeba myslet na dodatečnou kontrolu glykémie.
B?-adrenergních agonisté
Při podávání vysokých dávek B?-adrenergních agonistů se může vyvinout potenciálně závažná hypokalémie. Současná léčba B?-adrenergním agonistem s léky, které mohou vyvolat hypokalémii nebo umocnit hypokalemický efekt, např. s xantinovými deriváty, steroidy a diuretiky, může zvětšit možný hypokalemický účinek B2-adrenergních agonistů.
Léčba B2-adrenergním agonistem může vést ke zvýšení plazmatických koncentrací insulinu, volných mastných kyselin, glycerolu a ketonů.
Zvláštní pozornost je třeba věnovat pacientům s nestabilním astmatem s variabilní potřebou úlevové medikace a pacientům s akutním těžkým astmatickým záchvatem, neboť současná hypoxie může riziko hypokalémie zvýšit. V těchto situacích se doporučuje monitorovat kalémii.
Pomocné látky
Tento léčivý přípravek obsahuje laktosu. Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným nedostatkem laktasy nebo malabsorpcí glukosy a galaktosy by tento přípravek neměli užívat. Laktosa obsahuje malá množství mléčných proteinů, které mohou způsobit alergické reakce.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Farmakokinetické interakce
Silné inhibitory CYP3A4 (např. ketokonazol, itrakonazol, vorikonazol, posakonazol, klarithromycin, telithromycin, nefazodon a HIV proteázové inhibitory) pravděpodobně značně zvyšují plazmatické koncentrace budesonidu a souběžné podávání by mělo být vyloučeno. Pokud to není možné, měl by být časový interval mezi podáním inhibitoru a budesonidem co možná nejdelší (viz bod 4.4). U pacientů užívajících silné inhibitory CYP3A4 není udržovací a úlevová léčba fixní kombinace budesonidu a dihydrátu formoterol-fumarátu doporučena.
Silný inhibitor CYP3A4 ketokonazol, 200 mg jednou denně, zvýšil plazmatické koncentrace souběžně podaného budesonidu (jednotlivá dávka 3 mg) v průměru šestinásobně. Když byl ketokonazol podán 12 hodin po podání budesonidu, byla koncentrace zvýšena v průměru trojnásobně, což ukazuje, že oddálení času podání může snížit zvýšené plazmatické koncentrace. Omezená data týkající se této interakce s vysokými dávkami inhalačního budesonidu ukazují, že může dojít ke značnému zvýšení plazmatických koncentrací (v průměru čtyřnásobnému), pokud je itrakonazol, 200 mg jednou denně, podán souběžně s inhalačním budesonidem (jednotlivá dávka 1 000 ^g).
Farmakodynamické interakce
Betablokátory mohou částečně nebo úplně inhibovat účinek formoterolu. Fixní kombinace budesonidu a dihydrátu formoterol-fumarátu by tedy neměla být podávána současně s betablokátory (včetně očních kapek), pokud k tomu nejsou vážné důvody.
Současná léčba chinidinem, disopyramidem, prokainamidem, fenothiaziny, antihistaminiky (terfenadin), inhibitory monoaminooxidázy a tricyklickými antidepresivy může prodlužovat interval QTc, a tak zvyšovat riziko komorových arytmií.
Levodopa, L-thyroxin, oxytocin a alkohol mohou mít negativní vliv na toleranci srdce k P2-adrenergním agonistům.
Současná léčba inhibitory monoaminooxidázy včetně léčivých přípravků s podobnými vlastnostmi, jako je furazolidon a prokarbazin, může vyvolat hypertenzní reakce.
Existuje zvýšené riziko arytmií u pacientů, kterým je současně podávána anestézie halogenovanými uhlovodíky.
Současná léčba jinými P2-adrenergními agonisty nebo anticholinergiky může mít potenciálně aditivní bronchodilatační účinek.
Hypokalémie může zvyšovat dispozici k arytmiím u pacientů, kteří jsou léčeni digitalisovými glykosidy.
U budesonidu a formoterolu nebyly pozorovány interakce s jinými léčivy používanými k léčbě astmatu.
Pediatrická populace
Studie interakcí byly provedeny pouze u dospělých.
4.6 Fertilita, těhotenství a kojení
Klinické údaje o použití fixní kombinace budesonidu a dihydrátu formoterol-fumarátu nebo současném použití formoterolu a budesonidu v průběhu těhotenství nejsou k dispozici. Údaje získané ze studie zaměřené na embryofetální vývoj u potkanů ukazují, že u fixní kombinace není žádný nový dodatečný účinek.
Neexistují odpovídající klinické údaje hodnotící podávání formoterolu v průběhu těhotenství. Ve studiích na zvířatech měl formoterol při velmi vysokých systémových koncentracích nežádoucí vliv na reprodukci (viz bod 5.3).
Podávání inhalačního budesonidu u asi 2 000 žen v průběhu těhotenství nevedlo ke zvýšení rizika teratogenity. Ve studiích na zvířatech vedlo podávání kortikoidů k indukci malformací (viz bod 5.3). Při doporučeném dávkování je riziko u lidí nepravděpodobné.
Studie na zvířatech též prokázaly zvýšené riziko zpomalení intrauterinního růstu, kardiovaskulárních onemocnění v dospělosti, trvalých změn hustoty receptorů pro kortikoidy, životního cyklu neurotransmiterů a chování, pokud došlo k nadměrné expozici kortikoidům v průběhu prenatálního vývoje a to v dávkovém rozmezí nižším než dávky, které mají teratogenní účinky.
Fixní kombinace budesonidu a dihydrátu formoterol-fumarátu lze podat v průběhu těhotenství pouze tehdy, pokud očekávaný přínos převáží potenciální rizika. Měla by být podávána nejnižší účinná dávka budesonidu potřebná k udržování adekvátní kontroly astmatu.
Kojení
Budesonid je vylučován do mateřského mléka. V rozmezí terapeutických dávek se nepředpokládá, že by došlo k ovlivnění kojence. Není známo, zda formoterol přechází do mateřského mléka u lidí. V mateřském mléce laboratorních potkanů bylo zjištěno malé množství formoterolu. O podávání fixní kombinace budesonidu a dihydrátu formoterol-fumarátu kojícím ženám lze uvažovat pouze tehdy, když očekávaný přínos pro matku převáží nad jakýmkoliv možným rizikem pro kojence.
Fertilita
Nejsou k dispozici žádné údaje týkající se fertility.
4.7 Účinky na schopnost řídit a obsluhovat stroje
DuoResp Spiromax nemá žádný nebo má zanedbatelný vliv na schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky Souhrn bezpečnostního profilu
Protože DuoResp Spiromax obsahuje budesonid a formoterol, lze očekávat stejný typ a intenzitu nežádoucích účinků jako u odpovídajících monokomponentních přípravků. Výskyt nežádoucích účinků se nezvyšuje při podávání obou léčivých látek ve fixní kombinaci. Nejčastější nežádoucí účinky mající vztah k obsaženým léčivým látkám jsou předvídatelné farmakologické účinky P2-adrenergních agonistů, jako je třes a palpitace. Tyto nežádoucí účinky jsou mírné ve své intenzitě a odeznívají v průběhu několika dnů léčby. V průběhu klinické studie s budesonidem u pacientů s CHOPN trvající 3 roky se objevily kožní podlitiny a pneumonie s četností 10 % resp. 6 %, v placebové skupině s četností 4 % resp. 3 % (p < 0,001 resp. P < 0,01). Přípravek DuoResp Spiromax není indikován u pro použití u dětí a dospívajících do 18 let (viz bod 4.2).
Tabulkový přehled nežádoucích účinků
Nežádoucí účinky, které se mohou objevit při podávání budesonidu nebo formoterolu, jsou uvedeny dále, seřazeny podle tříd orgánových systémů a četností. Četnosti jsou definovány následovně: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>10 000 až <1/1 000) , velmi vzácné (<1/10 000) a neznámé (z dostupných údajů nelze určit).
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinek |
|
Infekce a infestace |
Časté |
Kandidové infekce nosohltanu, pneumonie (u pacientů s CHOPN) |
|
Poruchy imunitního systému |
Vzácné |
Časné a pozdní reakce přecitlivělosti, např. exantém, kopřivka, svědění, dermatitida, angioedém a anafýlaktická reakce. |
|
Endokrinní poruchy |
Velmi vzácné |
Cushingův syndrom, adrenální suprese, zpomalení růstu, snížení minerální hustoty kostí. |
|
Poruchy metabolismu a výživy |
Vzácné |
Hypokalémie |
|
Velmi vzácné |
Hyperglykémie | |
|
Psychiatrické poruchy |
Méně časté |
Agrese, psychomotorická hyperaktivita, úzkost, poruchy spánku. |
|
Velmi vzácné |
Deprese, změny chování (převáženě u dětí) | |
|
Poruchy nervového systému |
Časté | |
|
Méně časté |
Závratě | |
|
Velmi vzácné |
Poruchy chuti | |
|
Poruchy oka |
Velmi vzácné |
Katarakta a glaukom |
|
Srdeční poruchy |
Časté |
Palpitace |
|
Méně časté | ||
|
Vzácné |
Srdeční arytmie, např. síňové fibrilace, supraventrikulární tachykardie, extrasystoly | |
|
Velmi vzácné |
Angina pectoris. Prodloužení intervalu QTc | |
|
Cévní poruchy |
Velmi vzácné |
Kolísání krevního tlaku |
|
Respirační, hrudní a mediastinální poruchy |
Časté | |
|
Vzácné |
Bronchospasmus | |
|
Velmi vzácné |
Paradoxní bronchospasmus | |
|
Gastrointestinální poruchy |
Méně časté | |
|
Poruchy kůže a podkožní tkáně |
Méně časté |
Modřiny |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Méně časté |
Svalové křeče |
Popis vybraných nežádoucích účinků
Kvasinkové infekce v nosohltanu jsou důsledkem depozice léčiva. Pokud si bude pacient vyplachovat ústa po každé inhalaci, dojde k minimalizaci rizika. Kvasinkové infekce nosohltanu obvykle dobře reagují na lokální protiplísňovou léčbu bez nutnosti přerušit léčbu inhalačními kortikoidy.
Podobně jako při jiné inhalační léčbě se může velmi vzácně objevit paradoxní bronchospasmus, který postihuje méně než 1 z 10 000 pacientů. Projevuje se okamžitým zesílením sípání a dušností bezprostředně po inhalaci. Paradoxní bronchospasmus reaguje na podání rychle působících inhalačních bronchodilatátorů a má být léčen okamžitě. Léčba přípravkem DuoResp Spiromax musí být okamžitě přerušena, pacient by měl být vyšetřen a měla by být zahájena alternativní léčba (viz bod 4.4).
Může se objevit systémový účinek kortikoidů, zvláště při podávání vysokých dávek po dlouhou dobu. Tyto nežádoucí účinky jsou daleko méně pravděpodobné než u perorálních kortikoidů. Možné systémové účinky zahrnují Cushingův syndrom, Cushingoidní projevy, adrenální supresi, zpomalení růstu u dětí a dospívajících, snížení minerální hustoty kostí, kataraktu a glaukom. Může se objevit zvýšená citlivost k infekcím a snížená schopnost adaptace na stres. Tyto účinky jsou pravděpodobně závislé na dávce, době expozice, souběžné a dřívější expozici steroidům a individuální citlivosti.
Léčba P2-adrenergními agonisty může vést ke zvýšení hladin inzulínu, mastných kyselin, glycerolu a ketolátek v krvi.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Předávkování formoterolem vede pravděpodobně k projevům typickým pro P2-adrenergní agonisty: třes, bolest hlavy a palpitace. Může se též objevit tachykardie, hypokalémie, hyperglykémie, prodloužení intervalu QTc, arytmie, nauzea a zvracení. Indikována je podpůrná a symptomatická léčba. Dávka 90 mikrogramů formoterolu podaná v průběhu 3 hodin pacientům s akutní bronchokonstrikcí nevyvolala žádné nežádoucí účinky.
Akutní předávkování budesonidem, včetně vysokých dávek, nepředstavuje klinický problém. Při chronickém předávkování se mohou projevit systémové účinky kortikoidů, tj. hyperkorticismus a adrenální suprese.
Pokud je léčba přípravkem DuoResp Spiromax vysazována kvůli předávkování formoterolem, je třeba učinit vhodná opatření k suplementaci kortikoidní složky přípravku.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Léčiva k terapii onemocnění spojených s obstrukcí dýchacích cest, adrenergika a jiná léčiva k léčbě obstrukčního onemocnění dýchacích cest.
ATC kód: R03AK07
Mechanismus účinku a farmakodynamické účinky
DuoResp Spiromax obsahuje formoterol a budesonid, které mají různý mechanismus účinku a vykazují aditivní účinky, pokud jde o snížení četnosti exacerbací astmatu. Specifické vlastnosti budesonidu a formoterolu umožňují použití buď jako udržovací i úlevovou léčbu, nebo samotnou udržovací léčbu astmatu. Mechanismus účinku těchto dvou složek je popsán níže.
Budesonid
Budesonid je glukokortikoid, a pokud je podáván inhalační cestou, má v dýchacích cestách protizánětlivý účinek závisející na dávce, který se projevuje snížením frekvence symptomů a exacerbací astmatu. Inhalovaný budesonid má méně závažných nežádoucích účinků ve srovnání se systémovým podáním kortikoidů. Přesný mechanismus protizánětlivého účinku glukokortikoidů není znám.
Formoterol
Formoterol je selektivní P2-adrenergní agonista. Po inhalaci vyvolává rychlou a dlouhodobou relaxaci hladkého svalstva bronchů u pacientů s reverzibilní obstrukcí dýchacích cest. Bronchodilatační účinek je závislý na podané dávce, nastupuje 1 až 3 minuty po inhalaci. Přetrvává alespoň 12 hodin po podání jednotlivé dávky.
Klinická účinnost a bezpečnost
Klinická účinnost budesonid/formoterol v udržovací léčbě astmatu
V klinických studiích u dospělých bylo prokázáno, že přidání formoterolu k budesonidu zlepšuje kontrolu příznaků astmatu i hodnoty plicních funkcí a snižuje počet exacerbací.
Ve dvou 12týdenních studiích byl účinek budesonidu/formoterolu stejný jako účinek prosté kombinace budesonidu a formoterolu a lepší než účinek samotného budesonidu. Ve všech ramenech
studií byla používána krátkodobě působící P2-adrenergní agonisté dle potřeby. V průběhu sledování nedošlo ke snižování antiastmatického účinku.
Byly provedeny dvě 12týdenní klinické studie u dětí, ve kterých bylo celkem 265 dětí ve věku 6-11 let léčeno udržovací dávkou budesonid/formoterol (2 inhalace 80 mikrogramů/4,5 mikrogramů v jedné inhalaci dvakrát denně) a krátkodobě působící P2-adrenergní agonista podle potřeby. V obou studiích došlo ve srovnání s odpovídající dávkou samotného budesonidu ke zlepšení plicních funkcí a léčba byla dobře snášena.
Budesonid/formoterol v udržovací a úlevové léčbě astmatu
Do 5 dvojitě zaslepených klinických studií v trvání 6 nebo 12 měsíců zaměřených na sledování účinnosti a bezpečnosti bylo zařazeno celkem 12 076 pacientů s astmatem (z toho bylo 4 447 pacientů randomizovaných k léčbě budesonidem/formoterolem v udržovací a úlevové léčbě). Zařazeni byli pacienti s přítomnými symptomy onemocnění i přes léčbu inhalačními kortikoidy.
Podávání budesonidu/formoterolu v udržovací a úlevové léčbě vedlo ve všech 5 studiích ke statisticky i klinicky významnému poklesu počtu těžkých exacerbací. Toto srovnání zahrnovalo budesonid/formoterol ve vyšší udržovací dávce s terbutalinem jako úlevovou medikací (studie 735) a budesonid/formoterol ve stejné udržovací dávce, buď s formoterolem, nebo terbutalinem jako úlevovou medikací (studie 734) (viz tabulka níže). Ve studii 735 byly ve všech sledovaných skupinách podobné plicní funkce, kontrola symptomů a použití úlevové medikace. Ve studii 734 byly symptomy a použití úlevové medikace méně časté a plicní funkce zlepšené ve srovnání s oběma komparátory. Hodnocení všech 5 studií prokázalo, že pacienti léčení kombinací budesonid/formoterol v udržovací a úlevové léčbě nepotřebovali žádnou úlevovou medikaci v průměru u 57 % z celkového počtu dnů léčby. V průběhu sledování se neprokázal vývoj tolerance k prováděné léčbě.
Přehled těžkých exacerbací v klinických studiích
|
Studie č. Trvání |
Léčebná skupina |
n |
Těžké exacerbacea Příh Příhody/paci ody ento-rok | |
|
Studie 735 |
budesonid/dihydrát formoterolfumarátu 160/4,5 mikrogramu 2x denně + dle potřeby |
1 103 |
125 |
O Uí cr |
|
6 měsíců |
budesonid/dihydrát formoterolfumarátu 320/9 pg 2x denně + terbutalin 0,4 mg dle potřeby |
1 099 |
173 |
0,32 |
|
salmeterol/flutikason 2x25/125 pg 2x denně + terbutalin 0,4 mg dle potřeby |
1 119 |
208 |
0,38 | |
|
Studie 734 |
budesonid/dihydrát formoterolfumarátu 160/4,5 pg 2x denně + dle potřeby |
1 107 |
194 |
0,19b |
|
12 měsíc ů |
budesonid/dihydrát formoterolfumarátu 160/4,5 pg 2x denně + formoterol 4,5 pg dle potřeby |
1 137 |
296 |
0,29 |
|
budesonid/dihydrát formoterolfumarátu 160/4,5 pg 2x denně + terbutalin 0,4 mg dle potřeby |
1 138 |
377 |
0,37 | |
Definováno jako hospitalizace/léčba na jednotce intenzivní péče či léčba perorálními steroidy Snížení frekvence exacerbací je statisticky významné (p-hodnota < 0,01) pro obě srovnání
a
b
V jiných 2 klinických studiích s pacienty, kteří vyhledali lékařskou péči v důsledku akutní exacerbace astmatu, mělo podání budesonidu/formoterolu za následek rychlou a účinnou bronchodilataci podobně jako podání salbutamolu či formoterolu.
Chronická obstrukční plicní nemoc (CHOPN)
Ve dvou 12měsíčních klinických studiích byl hodnocen vliv na plicní funkce a frekvenci exacerbací (exacerbace byla definována jako potřeba podávat perorálně steroid nebo antibiotikum nebo hospitalizace v důsledku exacerbace) u pacientů s těžkou chronickou obstrukční plicní nemocí. V době vstupu do studie byla střední hodnota FEV1 na úrovni 36 % normální předpovědní hodnoty. Průměrný počet exacerbací za rok (jak je definováno výše) při podávání budesonidu/formoterolu byl ve srovnání
se samotným formoterolem nebo placebem významně nižší (průměrná frekvence exacerbací 1,4 vs.
1,8 až 1,9 ve skupině placebo/formoterol). Průměrný počet dnů na perorální léčbě steroidy v průběhu 12 měsíců byl mírně nižší ve skupině budesonid/formoterol (7 až 8 dnů/pacienta/rok vs. 11 až 12 dnů, resp. 9 až 12 dnů ve skupině placebo, resp. formoterol). Pokud jde o změny plicních funkcí, např. FEV1, nebyla léčba kombinací budesonid/formoterol lepší než léčba samotným formoterolem.
Maximální inspirační průtok u Spiromaxu inhalátor
U dětí a dospívajících s astmatem (ve věku 6-17 let), dospělých s astmatem (ve věku 18-45 let), dospělých s chronickou obstrukční plicní nemocí (CHOPN - ve věku >50 let) a u zdravých dobrovolníků (ve věku 18-45 let) byla provedena randomizovaná, otevřená, placebem kontrolovaná studie hodnotící maximální inspirační průtok (PIFR) a další související inhalační parametry po podání Spiromaxu inhalátor (obsahující placebo) a vícedávkového inhalátoru suchého prášku (obsahující placebo), který je k dispozici na trhu. U této skupiny subjektů byl také hodnocen dopad intenzívního školení na techniku inhalace suchého prášku na rychlost a objem inhalace. Údaje ze studie ukázaly, že bez ohledu na věk a závažnost základního onemocnění byli děti, dospívající a dospělí s astmatem a rovněž pacienti s CHOPN schopni dosáhnout inspiračního průtoku přes Spiromax, který byl podobný jako u vícedávkového inhalátoru suchého prášku, který je k dispozici na trhu. Průměrný PIFR dosažený pacienty s astmatem nebo CHOPN byl v průměru nad 60 l/min, kdy u obou příslušných inhalátorů je známo, že dodají srovnatelná množství léku do plic. Velmi malé množství pacientů mělo PIFR nižší než 40 l/min. Zdá se, že když PIFR bylo nižší než 40 l/min, nemělo to souvislost s věkem nebo závažností onemocnění.
5.2 Farmakokinetické vlastnosti
Absorpce
Fixní kombinace budesonidu a formoterolu a odpovídající monokomponentní přípravky jsou bioekvivalentní, pokud jde o systémovou dostupnost budesonidu a formoterolu. Nehledě na tuto skutečnost byla po podání fixní kombinace pozorována poněkud vyšší suprese kortisolu ve srovnání s monokomponentními přípravky. Rozdíl není považován za klinicky významný z hlediska bezpečnosti přípravku.
Není důkaz o tom, že by docházelo k farmakokinetické interakci mezi budesonidem a formoterolem.
Farmakokinetické parametry léčivých látek byly srovnatelné po podání budesonidu a formoterolu jako monoproduktů a po podání fixní kombinace. U budesonidu byla zjištěna mírně vyšší hodnota AUC, rychlost absorpce a maximální plazmatická koncentrace po podání ve fixní kombinaci. U formoterolu byla hodnota maximální plazmatické koncentrace podobná po podání ve fixní kombinaci. Inhalovaný budesonid se rychle absorbuje a maximální plazmatické koncentrace je dosaženo v průběhu 30 minut po inhalaci. Průměrná plicní depozice budesonidu po inhalaci z práškového inhalátoru byla ve studiích 32 % až 44 % podané dávky. Biologická dostupnost je asi 49 % z podané dávky. U dětí ve věku 6 až 16 let je plicní depozice při podání stejné dávky ve stejném rozmezí jako u dospělých. Výsledné plazmatické koncentrace nebyly stanoveny.
Inhalovaný formoterol se rychle absorbuje a maximální plazmatické koncentrace je dosaženo během 10 minut po inhalaci. Průměrná plicní depozice formoterolu z práškového inhalátoru zjištěná v průběhu klinického hodnocení je 28 % až 49 % podané dávky. Biologická dostupnost formoterolu je asi 61 % z podané dávky.
Distribuce
Vazba na plazmatické bílkoviny je asi 50 % pro formoterol a 90 % pro budesonid. Distribuční objem je asi 4 l/kg pro formoterol a 3 l/kg pro budesonid. Formoterol je inaktivován konjugací (aktivní O-demetylovaný a deformylovaný metabolit vytvářejí farmakologicky neúčinné konjugáty). Budesonid podléhá extenzivní biotransformaci (asi 90 %) prvním průchodem játry na metabolity s nízkou kortikoidní aktivitou. Kortikoidní aktivita hlavních metabolitů, 6-beta-hydroxybudesonidu a 16-alfa-hydroxyprednisolonu, je menší než 1 % aktivity budesonidu. Nic nenasvědčuje tomu, že by mezi budesonidem a formoterolem docházelo k metabolické nebo jiné interakci.
Eliminace
Převážná část podané dávky formoterolu je přeměňována v játrech a poté se eliminuje ledvinami.
Močí se v nezměněné formě vylučuje 8 % až 13 % inhalované dávky formoterolu. Formoterol má vysokou hodnotu celkové clearance (asi 1,4 l/min) a terminální eliminační poločas průměrně 17 hodin.
Budesonid je vylučován ve formě metabolitů tvořených převážně enzymovým systémem CYP3A4. Metabolity budesonidu jsou vylučovány ledvinami jako takové nebo konjugované. V moči byla nalezena pouze nepatrná množství nezměněného budesonidu. Budesonid má vysokou hodnotu celkové clearance (asi 1,2 l/min) a biologický eliminační poločas po i.v. podání je v průměru 4 hodiny.
Farmakokinetický(é)/farmakodynamický(é) vztah(y)
Není známa farmakokinetika formoterolu a budesonidu u dětí a pacientů s renální insuficiencí. U pacientů s hepatální insuficiencí může být zvýšena systémová expozice budesonidu i formoterolu.
Farmakokinetický profil přípravku DuoResp Spiromax
Ve farmakokinetických studiích s blokádou aktivním uhlím a bez ní byl přípravek DuoResp Spiromax hodnocen srovnáním s alternativním schváleným přípravkem obsahujícím fixní kombinaci se stejnými léčivými látkami, budesonidem a formoterolem a byla prokázána jejich ekvivalence v systémové expozici (bezpečnost) a plicní depozici (účinnost).
5.3 Předkliické údaje vztahující se k bezpečnosti
Výsledky experimentálních toxikologických studií u zvířat ukazují, že toxicita budesonidu, formoterolu nebo obou látek v kombinaci je výsledkem jejich zesíleného farmakologického účinku.
Ve studiích na reprodukční toxicitu u zvířat byly v experimentu po podání kortikoidů jako je budesonid zjištěny malformace (rozštěp patra a malformace skeletu). Výsledky těchto prací však nejsou pravděpodobně relevantní pro situaci u lidí v rozmezí doporučovaných dávek. Studie na reprodukční toxicitu u formoterolu odhalily poněkud sníženou plodnost u samců laboratorních potkanů při vysoké systémové expozici formoterolu, zvýšenou ztrátu březosti, sníženou schopnost přežívání v časném postnatálním stádiu a nižší porodní hmotnost při značně vyšší systémové expozici ve srovnání s klinickou praxí. Tyto experimentální výsledky však pravděpodobně nejsou relevantní k situaci u lidí.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek Monohydrát laktosy.
6.2 Inkompatibility Neuplatňuje se.
6.3 Doba použitelnosti 3 roky.
Po prvním otevření fóliového obalu: 6 měsíců
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25°C.
Po vyjmutí z fólie uchovávejte kryt náustku uzavřený.
6.5 Druh obalu a obsah balení
Inhalátor je bílý s poloprůhledným, vínově červeným víčkem náustku. Inhalátor je vyrobený z akrylonitril-butadien-styrenu (ABS), polyethylentereftalátu (PT) a polypropylenu (PP). Každý inhalátor obsahuje 120 dávek a je zabalený ve fólii.
Velikosti balení 1, 2 nebo 3 inhalátory.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Teva Pharma B.V.
Swensweg 5, 2031GA Haarlem Nizozemsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/14/920/001
EU/1/14/920/002
EU/1/14/920/003
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 28.duben 2014 Datum posledního prodloužení registrace:
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
NÁZEV PŘÍPRAVKU
1.
DuoResp Spiromax 320 mikrogramů/9 mikrogramů prášek k inhalaci
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna podaná dávka (dávka, která je uvolněna přes náustek Spiromax) obsahuje: budesonidum 320 mikrogramů a formoteroli fumaras dihydricus 9 mikrogramů.
To odpovídá odměřené dávce 400 mikrogramů budesonidum a 12 mikrogramů formoteroli fumaras dihydricus.
Pomocná látka/pomocné látky se známým účinkem:
Jedna dávka obsahuje přibližně 10 miligramů laktosy (ve formě monohydrátu)
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek k inhalaci.
Bílý prášek.
Bílý inhalátor s polotransparentním, vínově červeným krytem náustku.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
DuoResp Spiromax je indikován pouze k léčbě dospělých ve věku od 18 let.
DuoResp Spiromax je indikován k pravidelné léčbě pacientů s astmatem, u kterých je vhodné použití kombinované léčby (inhalační kortikoid a dlouhodobě působící P2-adrenergní agonista), tj.:
- pacienti, kteří nejsou adekvátně kontrolováni inhalačními kortikoidy a podle potřeby podávanými krátkodobě působícími P2-adrenergními agonisty.
nebo
- pacienti již dobře kontrolovaní kombinací inhalačního kortikoidu a dlouhodobě působícího P2-adrenergního agonisty.
Chronická obstrukční plicní nemoc (CHOPN)
Symptomatická léčba pacientů s těžkou chronickou obstrukční plicní nemocí (FEV1 < 50 % normální předpovědní hodnoty) a s anamnézou opakovaných exacerbací, u kterých přetrvávají významné klinické příznaky nemoci při pravidelné léčbě dlouhodobě působícími bronchodilatátory.
4.2 Dávkování a způsob podání
Přípravek DuoResp Spiromax je indikován pouze k léčbě dospělých ve věku od 18 let. Není určen pro děti do 12 let a dospívající ve věku od 13 do 17 let.
Dávkování
DuoResp Spiromax není určen k zahájení léčby astmatu.
Přípravek DuoResp Spiromax není vhodný k léčbě dospělých pacientů, kteří mají pouze mírné astma a kteří nejsou dostatečně kontrolováni pomocí inhalačního kortikosteroidu a podle potřeby podávaných inhalačních krátkodobě působících P2-adrenergních agonistů .
Dávkování přípravku DuoResp Spiromax je třeba individualizovat podle závažnosti onemocnění. Toto je nutné mít na paměti v době, kdy se léčba kombinovaným přípravkem zahajuje, ale i v době, kdy dochází k nastavení udržovací dávky. Pokud léčba pacienta vyžaduje kombinaci dávkování, které je jiné než dostupné dávkování kombinovaného inhalátoru, je nutné předepsat vhodné dávky P2-adrenergních agonistů a/nebo kortikoidu v jednotlivých inhalátorech.
Jakmile je dosaženo kontroly příznaků astmatu, je na místě uvažovat o postupném snižování dávky přípravku DuoResp Spiromax. Lékař by měl pacienta pravidelně sledovat tak, aby dávkování přípravku DuoResp Spiromax bylo stále optimální. Dávka přípravku by měla být titrována na nejnižší dávku, při které je zachována účinná kontrola symptomů onemocnění.
Je-li vhodné titrovat na nižší dávku, než kterou může poskytnout přípravek DuoResp Spiromax, je nutná změna na alternativní kombinaci s fixní dávkou budesonidu a formoterol-fumarátu a s nižšími dávkami inhalačních kortikosteroidů. Pokud je astma kontrolováno i nejnižší doporučenou dávkou přípravku, lze v dalším kroku uvažovat o podávání samotného inhalačního steroidu.
V klinické praxi, pokud je dosaženo kontroly symptomů astmatu při dávkování dvakrát denně s nižší sílou přípravku, je při titraci dávky na nejnižší účinnou dávku možno uvažovat i o podávání přípravku DuoResp Spiromax jednou denně, pokud je předepisující lékař přesvědčen, že dlouhodobě působící bronchodilatátor je žádoucí k udržení kontroly astmatu spíše než léčba samotným inhalačním kortikosteroidem.
Pacientům by mělo být doporučeno, aby měli svůj samostatný rychle působící bronchodilatátor pro úlevovou léčbu stále k dispozici pro „záchranné“ použití.
Doporučené dávkování:
Dospělí (18 let a starší): Jedna inhalace dvakrát denně. U některých pacientů může být vhodnější dávkování až maximálně 2 inhalace dvakrát denně.
Zvýšená spotřeba krátkodobě působícího bronchodilatátoru ukazuje na zhoršení kontroly astmatu a měla by být doprovázena přehodnocením léčby.
Přípravek DuoResp Spiromax 320 mikrogramů/9 mikrogramů by měl být používán pouze v režimu udržovací léčby. Pro režim udržovací a úlevové léčby jsou k dispozici nižší síly přípravku DuoResp Spiromax.
Chronická obstrukční _plicní nemoc (CHOPN)
Doporučené dávkování:
Dospělí (18 let a starší):
Jedna inhalace dvakrát denně Zvláštní skupiny pacientů:
Starší pacienti (> 65 let)
U starších pacientů není nutné upravovat doporučené dávkování.
Pacienti s poruchou funkce ledvin nebo jater
Nejsou dostupné klinické údaje o použití fixní kombinace budesonidu a dihydrátu formoterol-fumarátu u pacientů s poruchou funkce jater nebo ledvin. Vzhledem k tomu, že jsou obě léčivé látky primárně metabolizovány v játrech, lze očekávat zvýšenou orgánovou expozici u pacientů s těžkou cirhózou jater.
Pediatrická populace
Bezpečnost a účinnost přípravku DuoResp Spiromax u dětí ve věku 12 let a mladších a u dospívajících ve věku 13 až 17 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
Tento léčivý přípravek není doporučený pro použití u dětí a dospívajících do 18 let věku.
Způsob podání
Inhalační podání
Inhalátor Spiromax je aktivován nádechem, tj. léčivé látky se dostávají do dýchacích cest spolu se vdechovaným vzduchem, jakmile se pacient nadechne přes náustek inhalátoru. Bylo prokázáno, že pacienti se středně závažným a závažným astmatem jsou schopni vytvořit dostatečný inspirační průtok pro Spiromax k dodání terapeutické dávky (viz bod 5.1).
Přípravek DuoResp Spiromax by měl být používán správně pro dosažení účinné léčby. Pacienti by proto měli být informováni, aby si pečlivě přečetli příbalovou informaci a dodržovali instrukce pro použití.
Použití přípravku DuoResp Spiromax by mělo probíhat podle tří jednoduchých kroků: otevřít, nadechnout a zavřít, které jsou uvedeny níže.
Otevřít: Držte Spiromax s krytem náustku dole a sklopením víčka náustku dolů jej otevírejte, dokud není plně otevřen, což je signalizováno jedním cvaknutím.
Nadechnout: Vložte náustek do úst mezi zuby, pevně ho sevřete rty, nekousejte náustek inhalátoru. Zhluboka a rychle se nadechněte ústy přes náustek. Vyjměte Spiromax z úst a zadržte dech na 10 sekund nebo tak dlouho, jak je to pohodlné.
Zavřít: Lehce vydechněte a zavřete kryt náustku
Je také důležité, abyste poradili pacientům, aby s inhalátorem netřepali před jeho použitím, nevydechovali přes inhalátor Spiromax a neucpávali vývody vzduchu při přípravě kroku „Nadechnout“.
Pacienti by také měli být informováni, aby si vypláchli ústa vodou po inhalaci (viz bod 4.4).
Pacient si může všimnout příchuti při použití přípravku DuoResp Spiromax, protože přípravek obsahuje laktosu.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo pomocné látky uvedené v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Všeobecně
Při přerušování léčby se doporučuje vysazovat přípravek postupně a nikoliv náhle.
Pokud pacient pokládá léčbu za neúčinnou, nebo potřebuje podávat vyšší než nejvyšší doporučené dávky přípravku DuoResp Spiromax, je nutné, aby vyhledal ošetřujícího lékaře (viz bod 4.2). Náhlé nebo progredující zhoršování astmatu nebo chronické obstrukční plicní nemoci potenciálně ohrožuje život pacienta a je nutný neodkladný lékařský zásah. V této situaci je nutné uvažovat o zintenzívnění léčbě kortikosteroidy, např. nasazením perorálních kortikosteroidů nebo antibiotické léčby, pokud je přítomna infekce.
Pacienti by měli mít úlevový inhalátor vždy k dispozici, buď DuoResp Spiromax (pro pacienty s astmatem používající DuoResp Spiromax jako udržovací nebo úlevovou léčbu), nebo samostatný rychle působící bronchodilatační lék (pro pacienty s astmatem používající DuoResp Spriomax pouze jako udržovací léčbu).
Pacienti by měli být poučeni, aby užívali předepsanou udržovací dávku přípravku DuoResp Spiromax i v období, kdy nemají příznaky. Preventivní použití přípravku DuoResp Spiromax, např. před cvičením, nebylo hodnoceno. Úlevové inhalace přípravku DuoResp Spiromax by měly být užity při rozvoji symptomů onemocnění, ale nejsou určeny pro pravidelné preventivní použití, např. před cvičením. V těchto případech by mělo být zváženo podání rychle působícího bronchodilatátoru.
Příznaky astmatu
Lékař by měl pacienta pravidelně sledovat tak, aby dávkování přípravku DuoResp Spiromax bylo stále optimální. Dávka přípravku by měla být titrována na nejnižší dávku, při které je zachována účinná kontrola symptomů onemocnění. Jakmile je dosaženo kontroly příznaků astmatu, je na místě uvažovat o postupném snižování dávky přípravku DuoResp Spiromax. Je-li vhodné titrovat na nižší dávku, než kterou může poskytnout přípravek DuoResp Spiromax, je nutná změna na alternativní kombinaci s fixní dávkou budesonidu a formoterol-fumarátu a s nižšími dávkami inhalačních kortikosteroidů.
Pravidelná kontrola pacientů při snižování dávkování léčby je důležitá.
U pacientů během exacerbace nebo pokud mají významné zhoršení nebo akutní zhoršení astmatu by neměla být zahájena léčba přípravkem DuoResp Spiromax.
V průběhu léčby přípravkem DuoResp Spiromax se mohou objevit závažné nežádoucí účinky související s léčbou astmatu a exacerbace. Pacienti by měli být poučeni, že je nutné pokračovat v léčbě a současně vyhledat lékařskou pomoc v případě, že se příznaky astmatu nedaří po zahájení léčby přípravkem DuoResp Spiromax kontrolovat či se dokonce zhoršují.
Inhalační léčba obecně může někdy paradoxně vyvolat bronchospasmus s pískoty a dušností těsně po inhalaci. Pokud paradoxně dojde k projevům bronchospasmu, je třeba léčbu přípravkem DuoResp Spiromax ihned ukončit, pacienta vyšetřit a pokud je to nezbytné, zahájit alternativní léčbu. Paradoxní bronchospasmus odpovídá na bronchodilatátor s rychlým nástupem účinku a má být léčen okamžitě (viz bod 4.8).
Systémové účinky
Inhalační kortikoidy mohou mít systémové účinky, zvláště pokud jsou podávány ve vysokých dávkách po dlouhou dobu. Tyto účinky jsou daleko méně pravděpodobné při inhalačním podávání ve srovnání s perorálním podáním kortikoidů.
Systémové účinky se mohou projevit Cushingovým syndromem, Cushingoidními znaky, adrenální supresí, zpomalením růstu u dětí a dospívajících, snížením minerální hustoty kostí, kataraktou a glaukomem. Méně často se může objevit celá řada účinků na psychiku nebo chování zahrnujících psychomotorickou hyperaktivitu, poruchy spánku, úzkost, depresi nebo agresi (zvláště u dětí) (viz bod 4.8).
Doporučuje se, aby lékař pravidelně sledoval růst u dětí a dospívajících, kteří užívají dlouhodobě inhalační kortikoidy. Pokud dojde ke zpomalení růstu, léčba by měla být zhodnocena s cílem možného snížení dávky inhalačního kortikosteroidu na nejnižší dávku, na které je dosaženo efektivní kontroly astmatu, pokud je to možné. Vždy je třeba vážit mezi přínosem kortikoidní léčby ke kontrole astmatu a možným zpomalením růstu. V této situaci je vhodné konzultovat s pediatrem se specializací v oboru respiračních onemocnění.
Omezená data z dlouhodobých klinických hodnocení ukazují, že děti a dospívající léčení inhalačním budesonidem dorůstají v dospělosti do své normální výšky. Na počátku léčby je však patrné přechodné zpomalení růstu (asi o 1 cm). K tomu obvykle dochází v průběhu prvního roku léčby.
Účinky na hustotu kostí
Potenciální vliv na hustotu kostí by měl být brán v úvahu zvláště u pacientů s rizikovými faktory pro osteoporózu a současně léčených vysokými dávkami přípravku po delší období.
Dlouhodobé studie s inhalačním budesonidem u dětí na průměrné denní dávce 400 mikrogramů (odměřená dávka) a u dospělých na průměrné denní dávce 800 mikrogramů (odměřená dávka) neprokázaly významný vliv na kostní denzitu. Nejsou dostupné informace pro fixní kombinaci budesonidu/dihydrátu formoterol-fumarátu ve vyšších dávkách.
Adrenální funkce
Pokud existuje podezření, že funkce nadledvin je po předchozí léčbě systémovými kortikoidy snížena, je třeba věnovat zvýšenou pozornost převodu pacientů na fixní léčbu pomocí kombinace budesonid/formoterol-fumarát.
Přínosem inhalačního budesonidu by měla být minimální potřeba perorálních kortikoidů. Ovšem pacienti převádění z perorálních kortikoidů mohou mít sníženou adrenální rezervu, někdy přetrvávající značně dlouho. Obnovení stavu může trvat značně dlouho po ukončení léčby perorálními kortikoidy, a proto mohou mít pacienti závislí na perorálních steroidech riziko snížené adrenální rezervy po značně dlouhou dobu. V takovém případě je třeba pravidelně kontrolovat funkci osy hypotalamus-hypofýza-nadledviny.
Vysoká dávka kortikosteroidů
Dlouhodobá léčba vysokými dávkami inhalačních kortikoidů, zvláště dávkami vyššími než doporučenými, může vést ke klinicky významné adrenální supresi. V období zvýšeného stresu, jako je např. těžká infekce nebo elektivní chirurgický zákrok, je třeba uvažovat o přídavné dávce systémových kortikoidů. Náhlé snížení dávky steroidů může vyvolat akutní nedostatečnost nadledvin. Příznaky a projevy, které lze pozorovat v průběhu této krize, jsou poněkud neurčité, ale mohou zahrnovat anorexii, bolest břicha, ztrátu tělesné hmotnosti, únavu, bolest hlavy, nevolnost, zvracení, sníženou úroveň vědomí, křeče, hypotenzi a hypoglykémii.
Léčbu přídatnými systémovými steroidy nebo inhalovaným budesonidem je třeba ukončovat postupně, a nikoliv náhle.
Převod z perorální léčby
V průběhu převodu z perorální léčby na kombinaci budesonid/formoterol-fumarát je aktivita systémových steroidů nižší, což se může projevit alergickými či artritickými příznaky, např. rinitidou, ekzémem a bolestí svalů a kloubů. V těchto případech je třeba zahájit specifickou léčbu. Obecně lze uvažovat o nedostatečném účinku kortikoidů v těch vzácných případech, kdy se objeví příznaky jako je únava, bolest hlavy, nevolnost a zvracení. V těchto případech je někdy nezbytné dočasně zvýšit dávku perorálních kortikoidů.
Infekce úst
Aby se minimalizovalo riziko kvasinkové infekce (candida) nosohltanu, je třeba poučit pacienty, aby si vypláchli ústa vodou po každé inhalaci udržovací dávky přípravku. Pokud dojde ke kvasinkové infekci nosohltanu, měli by si pacienti vypláchnout ústa vodou také po každé inhalaci podle potřeby.
Pneumonie u pacientů s CHOPN
U pacientů s CHOPN, kterým byly podávány inhalační glukokortikoidy, byl pozorován vyšší výskyt pneumonie, včetně pneumonie vyžadující hospitalizaci. Existují určité důkazy o tom, že zvýšené riziko pneumonie souvisí se zvyšováním dávky steroidu, avšak tuto závislost se nepodařilo definitivně prokázat ve všech studiích.
Neexistují jednoznačné klinické důkazy o rozdílech mezi léčivými přípravky ze skupiny inhalačních glukokortikoidů ohledně výše rizika pneumonie.
Lékaři mají sledovat možný vývoj pneumonie u pacientů s CHOPN, neboť klinické známky těchto infekcí se mohou překrývat se symptomy, které doprovázejí exacerbaci CHOPN.
Rizikovými faktory pro pneumonii u pacientů s CHOPN jsou současné kouření, vyšší věk, nízký index tělesné hmotnosti (BMI) a těžká CHOPN.
Interakce s jinými léčivými přípravky
Je nutné vyloučit současnou léčbu itrakonazolem, ritonavirem a jinými účinnými inhibitory CYP3A4 (viz bod 4.5). Pokud to není možné, je nutné maximálně prodloužit časový interval mezi podáním vzájemně působících léčiv. U pacientů užívajících silné inhibitory CYP3A4 se fixní kombinovaná léčba zahrnující budesonid/formoterol-fumarát nedoporučuje.
Upozornění na nutnost opatrnosti při zvláštních onemocněních
Fixní kombinace budesonidu a dihydrátu formoterol-fumarátu je nutné podávat opatrně pacientům s thyreotoxikózou, feochromocytomem, diabetes mellitus, neléčenou hypokalémií, hypertrofickou obstrukční kardiomyopatií, idiopatickou subvalvulární stenózou aorty, těžkou hypertenzí, aneurysmatem a jinými závažnými kardiovaskulárními poruchami, např. ischemickou chorobou srdeční, tachyarytmiemi nebo těžkým srdečním selháním.
K léčbě pacientů s prodlouženým intervalem QTc je třeba přistupovat opatrně. Podávání formoterolu může vyvolat prodloužení intervalu QTc.
Potřebu podávat inhalační kortikoidy, resp. velikost podávané dávky, je nutné pečlivě uvážit u pacientů s aktivní či němou formou plicní tuberkulózy, plísňovými a virovými infekcemi respiračního traktu.
U diabetiků je potřeba myslet na dodatečnou kontrolu glykémie.
B?-adrenergní agonisté
Při podávání vysokých dávek P2-adrenergních agonistů se může vyvinout potenciálně závažná hypokalémie. Současná léčba P2-adrenergním agonistem s léky, které mohou vyvolat hypokalémii nebo umocnit hypokalemický efekt, např. s xantinovými deriváty, steroidy a diuretiky, může zvětšit možný hypokalemický účinek P2-adrenergních agonistů.
Léčba P2-adrenergním agonistem může vést ke zvýšení plazmatických koncentrací insulinu, volných mastných kyselin, glycerolu a ketonů.
Zvláštní pozornost je třeba věnovat pacientům s nestabilním astmatem s variabilní spotřebou úlevové medikace a pacientům s akutním těžkým astmatickým záchvatem, neboť současná hypoxie může riziko hypokalémie zvýšit. V těchto situacích se doporučuje monitorovat kalémii.
Pomocné látky
Tento léčivý přípravek obsahuje laktosu. Pacienti se vzácnými dědičnými problémy s intolerancí galaktosy, vrozeným nedostatkem laktasy nebo malabsorpcí glukosy a galaktosy by tento přípravek neměli užívat. Laktosa obsahuje malá množství mléčných proteinů, které mohou způsobit alergické reakce.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Farmakokinetické interakce
Silné inhibitory CYP3A4 (např. ketokonazol, itrakonazol, vorikonazol, posakonazol, klarithromycin, telithromycin, nefazodon a HIV proteázové inhibitory) pravděpodobně značně zvyšují plazmatické koncentrace budesonidu a souběžné podávání by mělo být vyloučeno. Pokud to není možné, měl by být časový interval mezi podáním inhibitoru a budesonidem co možná nejdelší (viz bod 4.4).
Silný inhibitor CYP3A4 ketokonazol, 200 mg jednou denně, zvýšil plazmatické koncentrace souběžně podaného budesonidu (jednotlivá dávka 3 mg) v průměru šestinásobně. Když byl ketokonazol podán 12 hodin po podání budesonidu, byla koncentrace zvýšena v průměru trojnásobně, což ukazuje, že oddálení času podání může snížit zvýšené plazmatické koncentrace. Omezená data týkající se této interakce s vysokými dávkami inhalačního budesonidu ukazují, že může dojít ke značnému zvýšení plazmatických koncentrací (v průměru čtyřnásobnému), pokud je itrakonazol, 200 mg jednou denně, podán souběžně s inhalačním budesonidem (jednotlivá dávka 1 000 pg).
Farmakodynamické interakce
Betablokátory mohou částečně nebo úplně antagonizovat účinek formoterolu. Fixní kombinace budesonidu a dihydrátu formoterol-fumarátu by tedy neměla být podávána současně s betablokátory (včetně očních kapek), pokud k tomu nejsou vážné důvody.
Současná léčba chinidinem, disopyramidem, prokainamidem, fenothiaziny, antihistaminiky (terfenadin), inhibitory monoaminooxidázy a tricyklickými antidepresivy může prodlužovat interval QTc, a tak zvyšovat riziko komorových arytmií.
Levodopa, L-thyroxin, oxytocin a alkohol mohou mít negativní vliv na toleranci srdce k P2-adrenergních agonistům.
Současná léčba inhibitory monoaminooxidázy včetně léčivých přípravků s podobnými vlastnostmi, jako je furazolidon a prokarbazin, může vyvolat hypertenzní reakce.
Existuje zvýšené riziko arytmií u pacientů, kterým je současně podávána anestézie halogenovanými uhlovodíky.
Současná léčba jinými P2-adrenergními agonisty nebo anticholinergiky může mít potenciálně aditivní bronchodilatační účinek.
Hypokalémie může zvyšovat dispozici k arytmiím u pacientů, kteří jsou léčeni digitalisovými glykosidy.
U budesonidu a formoterolu nebyly pozorovány interakce s jinými léčivy používanými k léčbě astmatu.
Pediatrická populace
Studie interakcí byly provedeny pouze u dospělých.
4.6 Fertilita, těhotenství a kojení
Klinické údaje o použití fixní kombinace budesonidu a dihydrátu formoterol-fumarátu nebo současném použití formoterolu a budesonidu v průběhu těhotenství nejsou k dispozici. Údaje získané ze studie zaměřené na embryofetální vývoj u potkanů ukazují, že u fixní kombinace není žádný nový dodatečný účinek.
Neexistují odpovídající klinické údaje hodnotící podávání formoterolu v průběhu těhotenství. Ve studiích na zvířatech měl formoterol při velmi vysokých systémových koncentracích nežádoucí vliv na reprodukci (viz bod 5.3).
Podávání inhalačního budesonidu u asi 2 000 žen v průběhu těhotenství nevedlo ke zvýšení rizika teratogenity. Ve studiích na zvířatech vedlo podávání kortikoidů k vývoji malformací (viz bod 5.3).
Při doporučeném dávkování je riziko u lidí nepravděpodobné.
Studie na zvířatech též prokázaly zvýšené riziko zpomalení intrauterinního růstu, kardiovaskulárních onemocnění v dospělosti, trvalých změn hustoty receptorů pro kortikoidy, životního cyklu neurotransmiterů a chování, pokud došlo k nadměrné expozici kortikoidům v průběhu prenatálního vývoje a to v dávkovém rozmezí nižším než dávky, které mají teratogenní účinky.
Fixní kombinace budesonidu a dihydrátu formoterol-fumarátu lze podat v průběhu těhotenství pouze tehdy, pokud očekávaný přínos převáží potenciální rizika. Podávána by měla být nejnižší účinná dávka budesonidu potřebná k udržování adekvátní kontroly astmatu.
Kojení
Budesonid je vylučován do mateřského mléka. V rozmezí terapeutických dávek se nepředpokládá, že by došlo k ovlivnění kojence. Není známo, zda formoterol přechází do mateřského mléka u lidí. V mateřském mléce laboratorních potkanů bylo zjištěno malé množství formoterolu. O podávání fixní kombinace budesonidu a dihydrátu formoterol-fumarátu kojícím ženám lze uvažovat pouze tehdy, když očekávaný přínos pro matku převáží nad jakýmkoliv možným rizikem pro kojence.
Fertilita
Nejsou k dispozici žádné údaje týkající se fertility.
4.7 Účinky na schopnost řídit a obsluhovat stroje
DuoResp Spiromax nemá žádný nebo má zanedbatelný vliv na schopnost řídit a obsluhovat stroje.
Souhrn bezpečnostního profilu
Protože DuoResp Spiromax obsahuje budesonid a formoterol, lze očekávat stejný typ a intenzitu nežádoucích účinků jako u odpovídajících monokomponentních přípravků. Výskyt nežádoucích účinků se nezvyšuje při podávání obou léčivých látek ve fixní kombinaci. Nejčastější nežádoucí účinky mající vztah k obsaženým léčivým látkám jsou předvídatelné farmakologické účinky P2-adrenergních agonistů, jako je třes a palpitace. Tyto nežádoucí účinky jsou mírné ve své intenzitě a odeznívají v průběhu několika dnů léčby. V průběhu klinické studie s budesonidem u pacientů s CHOPN trvající 3 roky se objevily kožní podlitiny a pneumonie s četností 10 % resp. 6 %, v placebové skupině s četností 4 % resp. 3 % (p < 0,001 resp. P < 0,01). Přípravek DuoResp Spiromax není indikován u pro použití u dětí a dospívajících do 18 let (viz bod 4.2).
Tabulkový přehled nežádoucích účinků
Nežádoucí účinky, které se mohou objevit při podávání budesonidu nebo formoterolu, jsou uvedeny dále, seřazeny podle tříd orgánových systémů a frekvence. Frekvence jsou definovány následovně: velmi časté (>1/10), časté (>1/100 až < 1/10), méně časté (>1/1 000 až < 1/100), vzácné (>10 000 až < 1/1 000) , velmi vzácné (< 1/10 000) a není známo (z dostupných údajů nelze určit).
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinek |
|
Infekce a infestace |
Časté |
Kandidové infekce nosohltanu, pneumonie (u pacientů s CHOPN) |
|
Poruchy imunitního systému |
Vzácné |
Časné a pozdní reakce přecitlivělosti, např. exantém, kopřivka, svědění, dermatitida, angioedém a anafylaktická reakce. |
|
Endokrinní poruchy |
Velmi vzácné |
Cushingův syndrom, adrenální suprese, zpomalení růstu, snížení minerální hustoty kostí. |
|
Poruchy metabolismu a výživy |
Vzácné |
Hypokalémie |
|
Velmi vzácné |
Hyperglykémie | |
|
Psychiatrické poruchy |
Méně časté |
Agrese, psychomotorická hyperaktivita, úzkost, poruchy spánku. |
|
Velmi vzácné |
Deprese, změny chování (převážně u dětí) | |
|
Poruchy nervového systému |
Časté | |
|
Méně časté |
Závratě | |
|
Velmi vzácné |
Poruchy chuti | |
|
Poruchy oka |
Velmi vzácné |
Katarakta a glaukom |
|
Srdeční poruchy |
Časté |
Palpitace |
|
Méně časté | ||
|
Vzácné |
Srdeční arytmie, např. síňové fibrilace, supraventrikulární tachykardie, extrasystoly | |
|
Velmi vzácné |
Angina pectoris. Prodloužení intervalu QTc | |
|
Cévní poruchy |
Velmi vzácné |
Kolísání krevního tlaku |
|
Respirační, hrudní a mediastinální poruchy |
Časté | |
|
Vzácné |
Bronchospasmus | |
|
Velmi vzácné |
Paradoxní bronchospasmus | |
|
Gastrointestinální poruchy |
Méně časté | |
|
Poruchy kůže a podkožní tkáně |
Méně časté |
Modřiny |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Méně časté |
Svalové křeče |
Kandidové infekce v nosohltanu jsou důsledkem depozice léčiva. Pokud si bude pacient vyplachovat ústa po každé inhalaci, dojde k minimalizaci rizika. Kandidové infekce nosohltanu obvykle dobře reagují na lokální protiplísňovou léčbu bez nutnosti přerušit léčbu inhalačními kortikoidy.
Podobně jako při jiné inhalační léčbě se může velmi vzácně objevit paradoxní bronchospasmus, který postihuje méně než 1 z 10 000 pacientů. Projevuje se okamžitým zesílením pískotů a dušností bezprostředně po inhalaci. Paradoxní bronchospasmus reaguje na podání rychle působících inhalačních bronchodilatátorů a má být léčen okamžitě. Léčba přípravkem DuoResp Spiromax musí být okamžitě přerušena, pacient by měl být vyšetřen a měla by být zahájena alternativní léčba (viz bod 4.4).
Může se objevit systémový účinek kortikoidů, zvláště při podávání vysokých dávek po dlouhou dobu. Tyto nežádoucí účinky jsou daleko méně pravděpodobné než u perorálních kortikoidů. Možné systémové účinky zahrnují Cushingův syndrom, Cushingoidní projevy, adrenální supresi, zpomalení růstu u dětí a dospívajících, snížení minerální hustoty kostí, kataraktu a glaukom. Může se objevit zvýšená citlivost k infekcím a snížená schopnost adaptace na stres. Tyto účinky jsou pravděpodobně závislé na dávce, době expozice, souběžné a dřívější expozici steroidům a individuální citlivosti.
Léčba P2-adrenergními agonisty může vést ke zvýšení hladin inzulínu, mastných kyselin, glycerolu a ketolátek v krvi.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Předávkování formoterolem vede pravděpodobně k projevům typickým pro P2-adrenergní agonisty: třes, bolest hlavy a palpitace. Může se též objevit tachykardie, hypokalémie, hyperglykémie, prodloužení intervalu QTc, arytmie, nauzea a zvracení. Indikována je podpůrná a symptomatická léčba. Dávka 90 mikrogramů formoterolu podaná v průběhu 3 hodin pacientům s akutní bronchokonstrikcí nevyvolala žádné nežádoucí účinky.
Akutní předávkování budesonidem, včetně vysokých dávek, nepředstavuje klinický problém. Při chronickém předávkování se mohou projevit systémové účinky kortikoidů, tj. hyperkorticismus a adrenální suprese.
Pokud je léčba přípravkem DuoResp Spiromax vysazována kvůli předávkování formoterolem, je třeba učinit vhodná opatření k suplementaci kortikoidní složky přípravku.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Léčiva k terapii onemocnění spojených s obstrukcí dýchacích cest, adrenergika a jiná léčiva k léčbě obstrukčního onemocnění dýchacích cest.
ATC kód: R03AK07
Mechanismus účinku a farmakodynamické účinky
DuoResp Spiromax obsahuje formoterol a budesonid, které mají různý mechanismus účinku a vykazují aditivní účinky, pokud jde o snížení četnosti exacerbací astmatu. Mechanismus účinku jednotlivých látek je diskutován níže.
Budesonid
Budesonid je glukokortikoid, a pokud je podáván inhalační cestou, má v dýchacích cestách protizánětlivý účinek závisející na dávce, který se projevuje snížením frekvence symptomů a exacerbací astmatu. Inhalovaný budesonid má méně závažných nežádoucích účinků ve srovnání se systémovým podáním kortikoidů. Přesný mechanismus protizánětlivého účinku glukokortikoidů není znám.
Formoterol
Formoterol je selektivní P2-adrenergní agonista. Po inhalaci vyvolává rychlou a dlouhodobou relaxaci hladkého svalstva bronchů u pacientů s reverzibilní obstrukcí dýchacích cest. Bronchodilatační účinek je závislý na podané dávce, nastupuje 1 až 3 minuty po inhalaci. Přetrvává alespoň 12 hodin po podání jednotlivé dávky.
Klinická účinnost a bezpečnost
Klinická účinnost budesonid/formoterol v udržovací léčbě astmatu
V klinických studiích u dospělých bylo prokázáno, že přidání formoterolu k budesonidu zlepšuje kontrolu příznaků astmatu i hodnoty plicních funkcí a snižuje počet exacerbací.
Ve dvou 12týdenních studiích byl účinek budesonidu/formoterolu stejný jako účinek prosté kombinace budesonidu a formoterolu a lepší než účinek samotného budesonidu. Ve všech ramenech studií byl používán krátkodobě působící P2-adrenergní agonista dle potřeby. V průběhu sledování nedošlo ke snižování antiastmatického účinku.
Byly provedeny dvě 12týdenní klinické studie u dětí, ve kterých bylo celkem 265 dětí ve věku 6-11 let léčeno udržovací dávkou budesonid/formoterol (2 inhalace 80 mikrogramů/4,5 mikrogramů v jedné inhalaci dvakrát denně) a krátkodobě působící P2-adrenergní agonista podle potřeby. V obou studiích došlo ve srovnání s odpovídající dávkou samotného budesonidu ke zlepšení plicních funkcí a léčba byla dobře tolerována.
Chronická obstrukční plicní nemoc (CHOPN)
Ve dvou 12měsíčních klinických studiích byl hodnocen vliv na plicní funkce a frekvenci exacerbací (exacerbace byla definována jako potřeba podávat perorálně steroid nebo antibiotikum a/nebo hospitalizace v důsledku exacerbace) u pacientů s těžkou chronickou obstrukční plicní nemocí. V době vstupu do studie byla střední hodnota FEV1 na úrovni 36 % normální předpovědní hodnoty. Průměrný počet exacerbací za rok (jak je definováno výše) při podávání budesonid/formoterol byl ve srovnání se samotným formoterolem nebo placebem významně nižší (průměrná frekvence exacerbací 1,4 vs. 1,8 až 1,9 ve skupině placebo/formoterol). Průměrný počet dnů na perorální léčbě steroidy v průběhu 12 měsíců byl mírně nižší ve skupině budesonid/formoterol (7 až 8 dnů/paciento/rok vs. 11 až 12 dnů, resp. 9 až 12 dnů ve skupině placebo, resp. formoterol). Pokud jde o změny plicních funkcí, např. FEV1, nebyla léčba kombinací budesonid/formoterol lepší než léčba samotným formoterolem.
Maximální inspirační průtok u Spiromaxu inhalátor
U dětí a dospívajících s astmatem (ve věku 6-17 let), dospělých s astmatem (ve věku 18-45 let), dospělých s chronickou obstrukční plicní nemocí (CHOPN - ve věku >50 let) a u zdravých dobrovolníků (ve věku 18-45 let) byla provedena randomizovaná, otevřená, placebem kontrolovaná studie hodnotící maximální inspirační průtok (PIFR) a další související inhalační parametry po podání Spiromaxu inhalátor (obsahující placebo) a vícedávkového inhalátoru suchého prášku (obsahující placebo), který je k dispozici na trhu. U této skupiny subjektů byl také hodnocen dopad intenzivního školení na techniku inhalace suchého prášku na rychlost a objem inhalace. Údaje ze studie ukázaly, že bez ohledu na věk a závažnost základního onemocnění byli děti, dospívající a dospělí s astmatem a rovněž pacienti s CHOPN schopni dosáhnout inspiračního průtoku přes Spiromax, který byl podobný jako u vícedávkového inhalátoru suchého prášku, který je k dispozici na trhu. Průměrný PIFR dosažený pacienty s astmatem nebo CHOPN byl v průměru nad 60 l/min, kdy u obou příslušných inhalátorů je známo, že dodají srovnatelná množství léku do plic. Velmi malé množství pacientů mělo PIFR nižší než 40 l/min. Zdá se, že když PIFR bylo nižší než 40 l/min, nemělo to souvislost s věkem nebo závažností onemocnění.
5.2 Farmakokinetické vlastnosti
Absorpce
Fixní kombinace budesonidu a formoterolu a odpovídající monokomponentní přípravky jsou bioekvivalentní, pokud jde o systémovou dostupnost budesonidu a formoterolu. Nehledě na tuto skutečnost byla po podání fixní kombinace pozorována poněkud vyšší suprese kortisolu ve srovnání s monokomponentními přípravky. Rozdíl není považován za klinicky významný z hlediska bezpečnosti přípravku.
Není důkaz o tom, že by docházelo k farmakokinetické interakci mezi budesonidem a formoterolem.
Farmakokinetické parametry léčivých látek byly srovnatelné po podání budesonidu a formoterolu jako monoproduktů a po podání fixní kombinace. U budesonidu byla zjištěna mírně vyšší hodnota AUC, rychlost absorpce a maximální plazmatická koncentrace po podání ve fixní kombinaci. U formoterolu byla hodnota maximální plazmatické koncentrace podobná po podání ve fixní kombinaci. Inhalovaný budesonid se rychle absorbuje a maximální plazmatické koncentrace je dosaženo v průběhu 30 minut po inhalaci. Průměrná plicní depozice budesonidu po inhalaci z práškového inhalátoru byla ve studiích 32 % až 44 % podané dávky. Biologická dostupnost je asi 49 % z podané dávky. U dětí ve věku 6 až 16 let je plicní depozice při podání stejné dávky ve stejném rozmezí jako u dospělých. Výsledné plazmatické koncentrace nebyly stanoveny.
Inhalovaný formoterol se rychle absorbuje a maximální plazmatické koncentrace je dosaženo během 10 minut po inhalaci. Průměrná plicní depozice formoterolu z práškového inhalátoru zjištěná v průběhu klinického hodnocení je 28 % až 49 % podané dávky. Biologická dostupnost formoterolu je asi 61 % z podané dávky.
Distribuce
Vazba na plazmatické bílkoviny je asi 50 % pro formoterol a 90 % pro budesonid. Distribuční objem je asi 4 l/kg pro formoterol a 3 l/kg pro budesonid. Formoterol je inaktivován konjugací (aktivní O-demetylovaný a deformylovaný metabolit vytvářejí farmakologicky neúčinné konjugáty). Budesonid podléhá extenzivní biotransformaci (asi 90 %) prvním průchodem játry na metabolity s nízkou kortikoidní aktivitou. Kortikoidní aktivita hlavních metabolitů, 6-beta-hydroxybudesonidu a 16-alfa-hydroxyprednisolonu, je menší než 1 % aktivity budesonidu. Nic nenasvědčuje tomu, že by mezi budesonidem a formoterolem docházelo k metabolické nebo jiné interakci.
Eliminace
Převážná část podané dávky formoterolu je přeměňována v játrech a poté se eliminuje ledvinami.
Močí se v nezměněné formě vylučuje 8 % až 13 % inhalované dávky formoterolu. Formoterol má vysokou hodnotu celkové clearance (asi 1,4 l/min) a terminální eliminační poločas průměrně 17 hodin.
Budesonid je vylučován ve formě metabolitů tvořených převážně enzymovým systémem CYP3A4. Metabolity budesonidu jsou vylučovány ledvinami jako takové nebo konjugované. V moči byla nalezena pouze nepatrná množství nezměněného budesonidu. Budesonid má vysokou hodnotu celkové clearance (asi 1,2 l/min) a biologický eliminační poločas po i.v. podání je v průměru 4 hodiny.
Není známa farmakokinetika formoterolu a budesonidu u dětí a pacientů s renální insuficiencí. U pacientů s hepatální insuficiencí může být zvýšena systémová expozice budesonidu i formoterolu.
Farmakokinetický profil přípravku DuoResp Spiromax
Ve farmakokinetických studiích s blokádou aktivním uhlím a bez ní byl přípravek DuoResp Spiromax hodnocen srovnáním s alternativním schváleným přípravkem obsahujícím fixní kombinaci se stejnými léčivými látkami, budesonidem a formoterolem a byla prokázána jejich ekvivalence v systémové expozici (bezpečnost) a plicní depozici (účinnost).
5.3 Předklinické údaje vztahující se k bezpečnosti
Výsledky experimentálních toxikologických studií u zvířat ukazují, že toxicita budesonidu, formoterolu nebo obou látek v kombinaci je výsledkem jejich zesíleného farmakologického účinku.
Ve studiích na reprodukční toxicitu u zvířat byly v experimentu po podání kortikoidů jako je budesonid zjištěny malformace (rozštěp patra a malformace skeletu). Výsledky těchto prací však nejsou pravděpodobně relevantní pro situaci u lidí v rozmezí doporučovaných dávek. Studie na reprodukční toxicitu u formoterolu odhalily poněkud sníženou plodnost u samců laboratorních potkanů při vysoké systémové expozici formoterolu, zvýšenou ztrátu březosti, sníženou schopnost přežívání v časném postnatálním stádiu a nižší porodní hmotnost při značně vyšší systémové expozici ve srovnání s klinickou praxí. Tyto experimentální výsledky však pravděpodobně nejsou relevantní k situaci u lidí.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek Monohydrát laktosy.
6.2 Inkompatibility Neuplatňuje se.
6.3 Doba použitelnosti 3 roky.
Po prvním otevření fóliového obalu: 6 měsíců
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25°C.
Po vyjmutí z fólie uchovávejte kryt náustku uzavřený.
6.5 Druh obalu a obsah balení
Inhalátor je bílý s poloprůhledným, vínově červeným krytem náustku. Inhalátor je vyrobený z akrylonitril-butadien-styrenu (ABS), polyethylentereftalátu (PT) a polypropylenu (PP). Každý inhalátor obsahuje 60 dávek a je zabalený ve fólii.
Velikosti balení 1, 2 nebo 3 inhalátory.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Teva Pharma B.V.
Swensweg 5, 2031GA Haarlem Nizozemsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/14/920/004
EU/1/14/920/005
EU/1/14/920/006
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 28.duben 2014 Datum posledního prodloužení registrace:
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
A. VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Norton (Waterford) Limited T/A Teva Pharmaceuticals Ireland
Unit 27/35 IDA Industrial Park
Cork Road
Waterford
Irská republika
Teva Pharmaceuticals Europe B.V.
Swensweg 5 NL-2031 GA Haarlem Nizozemsko
(pouze pro Polsko)
Teva Operations Poland Sp. z o.o.
Mogilska 80 Str. 31-546 Kraków Polsko
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
DuoResp Spiromax 160 mikrogramů/4,5 mikrogramu prášek k inhalaci budesonidum/formoteroli fumaras dihydricus
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Boční strana: Jedna podaná dávka obsahuje 160 mikrogramů budesonidu a 4,5 mikrogramu dihydrátu formoterol-fumarátu.
To odpovídá odměřené dávce 200 mikrogramů budesonidu a 6 mikrogramů dihydrátu formoterol-fumarátu.
Přední strana: Podaná dávka odpovídá odměřené dávce 200 mikrogramů budesonidum a 6 mikrogramů formoteroli fumaras dihydricus.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje laktosu. Pro více informací čtěte příbalovou informaci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek k inhalaci
1 inhalátor obsahuje 120 dávek.
2 inhalátory - každý obsahuje 120 dávek.
3 inhalátory - každý obsahuje 120 dávek.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Inhalační podání.
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Přední strana: Není určeno pro děti a dospívající.
Boční strana: Pouze pro dospělé ve věku 18 let a starší. Není určeno pro děti nebo dospívající do 18 let.
8. POUŽITELNOST
EXP
Použijte přípravek během 6 měsíců po vyjmutí z fólie.
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 25°C. Po vyjmutí z fólie uchovávejte kryt náustku uzavřený.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Teva Pharma B.V., Swensweg 5, 2031GA Haarlem, Nizozemsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/14/920/001
EU/1/14/920/002
EU/1/14/920/003
13. ČÍSLO ŠARŽE
Č.š.
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
DuoResp Spiromax 160 ^g/4,5 ^g
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
DuoResp Spiromax 160 mikrogramů/4,5 mikrogramu prášek k inhalaci budesonidum/formoteroli fumaras dihydricus Inhalační podání.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
Obsahuje 1 inhalátor
6. JINÉ
Uchovávejte kryt náustku uzavřený a používejte během 6 měsíců po vyjmutí z fólie. Teva Pharma B.V.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
DuoResp Spiromax 160 ^g/4,5 ^g prášek k inhalaci. budesonidum/formoteroli fumaras dihydricus
Inhalační podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
120 dávek
6. JINÉ
Začátek
Teva Pharma B.V.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
DuoResp Spiromax 320 mikrogramů/9 mikrogramů prášek k inhalaci budesonidum/formoteroli fumaras dihydricus.
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Boční strana: Jedna podaná dávka obsahuje 320 mikrogramů budesonidu a 9 mikrogramů dihydrátu formoterol-fumarátu.
To odpovídá odměřené dávce 400 mikrogramů budesonidum a 12 mikrogramů formoteroli fumaras dihydricus.
Přední strana: Podaná dávka odpovídá odměřené dávce 400 mikrogramů budesonidum a 12 mikrogramů formoteroli fumaras dihydricus.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje laktosu. Pro více informací čtěte příbalovou informaci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek k inhalaci
1 inhalátor obsahuje 60 dávek.
2 inhalátory - každý obsahuje 60 dávek.
3 inhalátory - každý obsahuje 60 dávek.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Inhalační podání.
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Přední strana: Není určeno pro děti a dospívající
Boční strana: Pouze pro dospělé ve věku 18 let a starší.
Není určeno pro děti nebo dospívající do 18 let.
8. POUŽITELNOST
EXP
Použijte přípravek během 6 měsíců po vyjmutí z fólie.
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 25°C. Po vyjmutí z fólie uchovávejte kryt náustku uzavřený.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Teva Pharma B.V., Swensweg 5, 2031GA Haarlem, Nizozemsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/14/920/004
EU/1/14/920/005
EU/1/14/920/006
13. ČÍSLO ŠARŽE
Č.š.
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
DuoResp Spiromax 320 ^g/9 ^g
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
DuoResp Spiromax 320 mikrogramů/9 mikrogramů prášek k inhalaci budesonidum/formoteroli fumaras dihydricus.
Inhalační podání.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
Obsahuje 1 inhalátor
6. JINÉ
Udržujte kryt náustku uzavřený a používejte během 6 měsíců po vyjmutí z fólie. Teva Pharma B.V.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
DuoResp Spiromax 320 mikrogramů/9 mikrogramů prášek k inhalaci. budesonidum/formoteroli fumaras dihydricus.
Inhalační podání.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
60 dávek
6. JINÉ
Začátek
Teva Pharma B.V.
B. PŘÍBALOVÁ INFORMACE
DuoResp Spiromax 160 mikrogramů/4,5 mikrogramu, prášek k inhalaci
(budesonidum/formoteroli fumaras dihydricus)
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je DuoResp Spiromax a k čemu se používá (strana 3)
2. Čemu musíte věnovat pozornost, než začnete DuoResp Spiromax užívat (strana 5)
3. Jak se DuoResp Spiromax používá (strana 9)
4. Možné nežádoucí účinky (strana 18)
5. Jak DuoResp Spiromax uchovávat (strana 21)
6. Obsah balení a další informace (strana 22)
1. Co je DuoResp Spiromax a k čemu se používá
DuoResp Spiromax obsahuje dvě různé léčivé látky: budesonid a dihydrát formoterol-fumarátu.
• Budesonid patří do skupiny léčiv označovaných jako „kortikosteroidy“ také označované jako „steroidy“. Budesonid léčí zánět a předchází vzniku otoku a zánětu ve Vašich plicích a pomáhá Vám snadněji dýchat.
• Dihydrát formoterol-fumarátu patří do skupiny léčiv označovaných jako „dlouhodobě účinná P2-adrenergní agonisté“ nebo „bronchodilatátory“ Působí tak, že uvolňuje svaly dýchacích cest, a tím pomáhá otevírat dýchací cesty a usnadňuje dýchání.
DuoResp Spiromax je indikován pro použití pouze u dospělých ve věku 18 let a starších.
Přípravek DuoResp Spiromax není indikován pro použití u dětí ve věku 12 let a mladších nebo
dospívajících ve věku od 13 do 17 let.
Lékař Vám předepsal tento lék k léčbě astmatu nebo chronické obstrukční plicní nemoci (CHOPN).
Přípravek DuoResp Spiromax lze předepsat k léčbě astmatu dvěma způsoby.
a) Někteří pacienti mají předepsány dva inhalátory k léčbě astmatu: DuoResp Spiromax společně se samostatným „úlevovým inhalátorem“, jako je salbutamol.
• Užívejte přípravek DuoResp Spiromax každý den. Tím se předchází vzniku astmatických příznaků, jako je dušnost a sípání.
• Používejte „úlevový inhalátor“, když se objeví příznaky astmatu, aby se Vám opět dobře dýchalo.
b) Někteří pacienti mají předepsán DuoResp Spiromax jako jediný inhalátor k léčbě astmatu.
• Používejte DuoResp Spiromax každý den. Tím se předchází vzniku astmatických příznaků, jako je dušnost a sípání.
• Používejte přípravek DuoResp Spiromax, když potřebujete užít dodatečné inhalace pro úlevu od příznaků astmatu, aby se Vám opět dobře dýchalo. Nepotřebujete používat další inhalátor.
Chronická obstrukční plicní nemoc (CHOPN)
CHOPN je dlouhodobé onemocnění dýchacích cest v plících, které je často způsobeno cigaretovým kouřem. Příznaky zahrnují dušnost, kašel, nepohodlí na hrudníku a vykašlávání hlenu. Přípravek DuoResp Spiromax může být také použit k léčbě příznaků závažné CHOPN u dospělých.
2. Čemu musíte věnovat pozornost, než začnete přípravek DuoResp Spiromax užívat Nepoužívejte přípravek DuoResp Spiromax, pokud:
Jste alergický(á) na budesonid, dihydrát formoterol-fumarátu nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před užitím přípravku DuoResp Spiromax se poraďte se svým lékařem, lékárníkem nebo zdravotní sestrou, pokud
• máte cukrovku,
• máte plicní infekci,
• máte vysoký krevní tlak, nebo jste někdy měli problémy se srdcem (např. nepravidelný tep, velmi rychlý tep, zúžení cév nebo Vám selhává srdce),
• máte problémy se štítnou žlázou nebo nadledvinami,
• máte nízkou hladinu draslíku v krvi,
• máte závažné problémy s játry.
Pokud užíváte tablety kortikosteroidu k léčbě astmatu nebo CHOPN, může váš lékař snížit počet tablet, které užíváte po zahájení léčby přípravkem DuoResp Spiromax. Pokud užíváte ústy tablety se steroidy dlouhou dobu, váš lékař může provést pravidelná vyšetření krve. Při snižování dávky perorálních tablet kortikosteroidu můžete pociťovat celkovou nevolnost, i když se Vaše příznaky na hrudníku mohou zlepšovat. Mohou se u Vás objevit příznaky, jako je ucpaný nos nebo rýma, slabost nebo bolest kloubů či svalů a vyrážka (ekzém). Pokud Vás tyto příznaky obtěžují, nebo pokud se objeví příznaky, jako je bolest hlavy, únava, nevolnost nebo zvracení, kontaktujte prosím ihned svého lékaře. Možná bude třeba, abyste užívali další léky, pokud se u Vás objeví příznaky alergie nebo zánětu kloubů. Měli byste informovat svého lékaře, pokud máte obavy ohledně toho, zda pokračovat v užívání přípravku DuoResp Spiromax.
Váš lékař může zvážit přidání tablet s obsahem kortikosteroidu k Vaší obvyklé léčbě během období zátěže (například, když máte infekci v oblasti hrudníku nebo před operací).
Děti a dospívající
Tento přípravek by neměli užívat děti nebo dospívající do 18 let.
Další léčivé přípravky a DuoResp Spiromax
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Informujte svého lékaře nebo lékárníka zvláště o následujících lécích:
• Beta blokátory (např. atenolol, propranolol k léčbě vysokého krevního tlaku nebo onemocnění srdce), včetně očních kapek (např. timolol k léčbě glaukomu).
• Léky k léčbě rychlého nebo nepravidelného tepu (např. chinidin, disopyramid a prokainamid).
• Léky jako digoxin, často používané k léčbě srdečního selhání.
• Diuretika, určená k „odvodnění organismu“ (např. furosemid). Používají se k léčbě vysokého krevního tlaku.
• Léky s obsahem steroidů užívané ústy (např. prednisolon).
• Xantiny (např. theofylin nebo aminofylin). Tyto léky se často používají k léčbě astmatu.
• Jiné léky k rozšíření průdušek (např. salbutamol).
• Tricyklická antidepresiva (např. amitryptylin) a antidepresivum nefazodon.
• Léky označené jako inhibitory monoaminooxidázy (např. fenelzin, furazolidon a prokardazin).
• Fenothiaziny (např. chlorpromazin nebo prochlorperazin).
• Léky označované jako „HIV proteázové inhibitory“ (např. ritonavir), určené k léčbě HIV infekce.
• Léky určené k léčbě infekcí (např. ketokonazol, itrakonazol, vorikonazol, posakonazol, klarithromycin a telithromycin).
• Léky k léčbě Parkinsonovy nemoci (např. levodopa).
• Léky k léčbě poruch štítné žlázy (např. levothyroxin).
• Léky k léčbě alergií nebo antihistaminika (např. terfenadin).
Pokud užíváte některý z výše uvedených léků, nebo pokud si nejste jisti, zeptejte se lékaře, lékárníka nebo zdravotní sestry předtím, než začnete užívat DuoResp Spiromax.
Informujte lékaře, lékárníka nebo zdravotní sestru také v případě, že jdete na plánovanou operaci nebo zubní výkon a bude používáno celkové anestetikum.
Těhotenství, kojení a plodnost
• Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem, lékárníkem nebo zdravotní sestrou dříve, než začnete přípravek DuoResp Spiromax užívat - NEUŽÍVEJTE tento přípravek bez porady se svým lékařem.
• Pokud otěhotníte až v průběhu léčby přípravkem DuoResp Spiromax, NEPŘESTÁVEJTE užívat DuoResp Spiromax, ale informujte o těhotenství ihned svého lékaře.
Řízení dopravních prostředků a obsluha strojů
DuoResp Spiromax nemá vliv nebo má zanedbatelný vliv na schopnost řídit motorová vozidla a na schopnost obsluhovat stroje.
DuoResp Spiromax obsahuje laktosu
Laktosa je typ cukru obsažený v mléce. Laktosa obsahuje malá množství mléčné bílkoviny, která může způsobit alergické reakce. Pokud vám váš lékař řekl, že nesnášíte některé cukry, poraďte se se svým lékařem, než začnete tento léčivý přípravek užívat.
3. Jak se DuoResp Spiromax užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Pokud si nejste
jistý(á), poraďte se se svým lékařem, lékárníkem nebo zdravotní sestrou.
• Je důležité používat DuoResp Spiromax každý den, i když právě nemáte žádné příznaky astmatu nebo CHOPN.
• Pokud užíváte DuoResp Spiromax k léčbě astmatu, váš lékař bude pravidelně kontrolovat vaše příznaky.
Přípravek DuoResp Spiromax lze předepsat k léčbě astmatu dvěma způsoby. Počet inhalací a
frekvence dávkování závisí na způsobu tohoto předpisu.
• Pokud vám byl předepsán DuoResp Spiromax a samostatný úlevový lék, čtěte oddíl „(A)
Použití přípravku DuoResp Spiromax a zvláštního úlevového léku“.
• Pokud vám byl předepsán DuoResp Spiromax jako jediný inhalátor, čtěte oddíl „(B) Použití přípravku DuoResp Spiromax jako jediného léku k léčbě astmatu“.
(A) DuoResp Spiromax a samostatný úlevový inhalátor.
Používejte DuoResp Spiromax každý den. Tím se předchází vzniku astmatických příznaků.
Doporučená dávka:
Dospělí (18 let a starší)
1 až 2 inhalace (použití) dvakrát denně.
Váš lékař může toto dávkování zvýšit na 4 inhalace dvakrát denně.
Pokud jsou vaše příznaky dobře kontrolovány, může vás lékař požádat, abyste užívali lék jednou denně.
Váš lékař vám pomůže s léčbou astmatu a upraví dávku tohoto léku na nejnižší dávku, která zajistí kontrolu vašeho astmatu. Pokud bude mít lékař pocit, že potřebujete nižší dávku než je dostupná ve Vašem přípravku DuoResp Spiromax, lékař Vám může předepsat alternativní inhalátor obsahující stejné léčivé látky jako Váš DuoResp Spiromax, ale s nižší dávkou kortikosteroidu. Počet inhalací, které Vám předepsal lékař, však sami neupravujte bez předchozí porady se svým lékařem.
K léčbě příznaků astmatu použijte samostatný „úlevový inhalátor“.
Vždy mějte u sebe „úlevový inhalátor“ a použijte jej k úlevě od náhlých záchvatů dušnosti a sípání. Neužíveje DuoResp Spiromax k léčbě příznaků astmatu - používejte samostatný úlevový inhalátor.
(B) Použití přípravku DuoResp Spiromax jako jediného léku k léčbě astmatu
Používejte DuoResp Spiromax tímto způsobem pouze tehdy, jestliže si to lékař přeje.
Používejte DuoResp Spiromax každý den. Tím se předchází vzniku astmatických příznaků.
Doporučená dávka
Dospělí (18 let a starší)
1 inhalace ráno a 1 inhalace večer nebo
2 inhalace ráno nebo
2 inhalace večer.
Váš lékař může toto dávkování zvýšit na 2 inhalace dvakrát denně.
Užívejte DuoResp Spiromax též jako „úlevový inhalátor“, pokud se objeví astmatické obtíže.
• Když se objeví příznaky astmatu, jako jsou náhlé záchvaty dušnosti nebo sípání, užijte 1 inhalaci a vyčkejte několik minut.
• Pokud se necítíte lépe, inhalujte další dávku.
• Při jedné příležitosti NEINHALUJTE více než 6 dávek.
Vždy mějte inhalátor DuoResp Spiromax u sebe a použijte jej k úlevě od náhlých záchvatů dušnosti a sípání.
Obvykle není třeba, abyste inhalovali více než 8 dávek za den. Lékař vám však může říci, že můžete po určitou omezenou dobu inhalovat až 12 dávek za den.
Pokud potřebujete pravidelně inhalovat 8 a více dávek za den, domluvte si návštěvu u lékaře. Je možné, že je třeba změnit Vaši léčbu.
NEUŽÍVEJTE více než 12 dávek v průběhu 24 hodin.
Pokud sportujete a objeví se astmatické obtíže, použijte DuoResp Spiromax jako úlevový lék. Neužívejte však DuoResp Spiromax před fyzickou zátěží k tomu, abyste předcházeli vzniku astmatických obtíží.
Chronická obstrukční plicní nemoc (CHOPN)
Doporučená dávka:
Dospělí (18 let a starší):
2 inhalace dvakrát denně.
Váš lékař Vám může předepsat další bronchodilatační léky k léčbě CHOPN např. anticholinergika (jako je tiotropium nebo ipratropium bromid).
Příprava nového inhalátoru DuoResp Spiromax
Před prvním použitím nového přípravku DuoResp Spiromax je třeba inhalátor připravit následujícím postupem:
• Zkontrolujte indikátor dávky, abyste zjistili, zda je v inhalátoru 120 inhalací.
• Zapište datum otevření fóliového sáčku na štítek na inhalátoru.
• Před použitím s inhalátorem netřepejte.
Jak inhalovat
Vždy, když je třeba provést inhalaci, postupujte podle instrukcí uvedených níže.
1. Držte inhalátor s poloprůhledným, vínově červeným krytem náustku dole.

2. Otvírejte kryt náustku jeho sklopením dolů, dokud neuslyšíte hlasité cvaknutí. Váš lék je aktivně odměřen. Inhalátor je nyní připraven k použití.
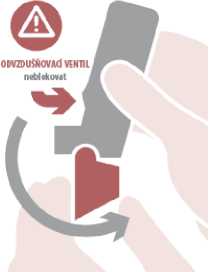
OTEVŘÍT
3. Lehce vydechněte (co nejpohodlněji). Nevydechujte přes inhalátor.
4. Vložte náustek do úst mezi zuby. Náustek nekousejte. Rty náustek stiskněte. Dbejte na to, abyste neblokovali vývody vzduchu.
Přes náustek se nadýchněte co nejhlouběji můžete.
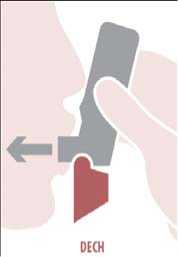
5. Zadržte dech na 10 sekund nebo tak dlouho, jak je to pohodlné.
6. Vyjměte inhalátor z úst. Můžete si všimnout příchuti během inhalace.
7. Pak jemně vydechněte (nevydechujte přes inhalátor). Uzavřete kryt náustku.

ZAVŘU
Pokud máte užít druhou dávku, opakujte kroky 1 až 7.
Po každé dávce si vypláchněte ústa vodou a vodu vyplivněte.
Nepokoušejte se rozebrat svůj inhalátor, oddělit nebo odšroubovat kryt náustku, který je k němu pevně připevněn a nesmí být od něj oddělován. Nepoužívejte svůj inhalátor Spiromax, pokud je poškozen nebo pokud se z něj odlomil náustek. Neotevírejte a nezavírejte kryt náustku, pokud neužíváte svůj inhalátor.
Čištění inhalátoru Spiromax
Udržujte svůj Spiromax suchý a čistý.
Je-li třeba, můžete otřít náustek svého inhalátoru Spiromax suchým hadříkem.
Kdy je třeba vyměnit inhalátor Spiromax za nový
• Indikátor počtu dávek ukazuje , kolik dávek (inhalací) v inhalátoru ještě zbývá. Začíná na 120 inhalacích, když je plný.

• Indikátor dávky na zadní straně inhalátoru ukazuje počet zbývajících ihalací v celých číslech.
• Pro zbývající inhalace od 20 do „8“, „6“, „4“, „2“ jsou čísla zobrazena červeně na bílém pozadí. Když jsou v okénku zobrazena čísla červeně, měli byste informovat svého lékaře a získat nový inhalátor.
Poznámka:
• Náustek „cvakne“, i když je inhalátor Spiromax prázdný.
• Pokud otevřete a zavřete náustek bez podání inhalace, bude to indikátor dávkování stále registrovat jako dávku. Tato dávka bude bezpečně zachována v inhalátoru na dobu, kdy bude podána další inhalace. Není možné náhodně podat lék navíc nebo inhalovat dvojnásobnou dávku při jedné inhalaci.
• Vždy, pokud neužíváte svůj inhalátor, mějte náustek zavřený.
Důležité informace o příznacích astmatu nebo CHOPN
Pokud cítíte dušnost nebo sípání během užívání přípravku DuoResp Spiromax, měli byste pokračovat v užívání přípravku DuoResp Spiromax, ale měli byste navštívit svého lékaře co možná nejdříve, protože je možné, že budete potřebovat další léčbu.
Kontaktujte ihned svého lékaře, pokud:
• se Vaše dýchání zhoršuje nebo se často probouzíte v noci s dušností a sípáním.
• máte ráno pocit sevření na hrudníku nebo tento pocit trvá déle než obvykle.
Tyto známky by mohly znamenat, že vaše astma nebo CHOPN není správně pod kontrolou a můžete ihned potřebovat jinou nebo dodatečnou léčbu.
Jakmile je vaše astma dobře kontrolováno, může váš lékař posoudit jako vhodné postupné snižování dávky přípravku DuoResp Spiromax.
Jestliže jste užili(a) více přípravku DuoResp Spiromax, než jste měli(a)
Je důležité, abyste užili dávky předepsané lékařem. Bez porady s lékařem byste neměli překračovat předepsaný počet dávek.
Jestliže jste užili(a) více přípravku DuoResp Spiromax, než jste měli(a), kontaktujte svého lékaře, lékárníka nebo zdravotní sestru.
Nejčastější příznaky, které se mohou objevit po užití většího množství přípravku DuoResp Spiromax, než jste měli, jsou třes, bolest hlavy a rychlý srdeční tep.
Jestliže jste zapomněl(a) užít přípravek DuoResp Spiromax
Jestliže jste zapomněl(a) užít dávku, užijte ji, jakmile si vzpomenete. Nicméně, nezdvojnásobujte následující dávku, abyste nahradili zapomenutou dávku. Pokud je téměř čas na další dávku, pouze užijte další dávku v obvyklou dobu.
Pokud začnete sípat nebo být dušní nebo se u Vás objeví jakékoli další příznaky astmatického záchvatu, použijte svůj úlevový inhalátor a pak vyhledejte lékaře.
Jestliže jste přestal(a) užívat přípravek DuoResp Spiromax
Nepřestávejte používat svůj inhalátor bez porady se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
Podobně jako všechny léky, může mít i tento lék nežádoucí účinky, které se ale nemusí vyskytnout u
každého.
Pokud se u vás objeví kterýkoliv z následujících nežádoucích účinků, přestaňte DuoResp
Spiromax užívat a ihned informujte svého lékaře:
Vzácné nežádoucí účinky: mohou postihnout až 1 z 1 000 lidí
• Otok obličeje, zvláště v okolí úst (otok jazyka a/nebo hrdla a/nebo polykací obtíže) nebo kopřivka doprovázená dýchacími obtížemi (angioedém) a/nebo náhlý pocit mdloby. Toto mohou být projevy alergické reakce na přípravek, mezi které může patřit vyrážka a svědění.
• Bronchospasmus (napnutí svalů v dýchacích cestách, které způsobuje sípání a dušnost). Pokud se náhle po užití tohoto léku objeví sípání, ukončete jeho užívání a informujte ihned svého lékaře.
Velmi vzácné nežádoucí účinky: mohou postihnout až 1 z 10 000 lidí
• Náhle vzniklé sípání a/nebo dušnost těsně po inhalaci z inhalátoru (také se označuje jako „paradoxní bronchospasmus“). Pokud se kterýkoliv z těchto příznaků objeví, přestaňte ihned používat inhalátor DuoResp Spiromax a použijte svůj „úlevový“ inhalátor. Kontaktujte ihned svého lékaře, protože může být nutné změnit léčbu.
Další možné nežádoucí účinky:
Časté: mohou postihnout až 1 z 10 lidí
• Palpitace (pocit bušení srdce), záchvěvy nebo třes. Pokud se tyto nežádoucí účinky objeví, jsou obvykle mírné a obvykle odeznívají při pokračování v léčbě přípravkem DuoResp Spiromax.
• Moučnivka (plísňová infekce) v ústech. Při vyplachování úst po inhalaci vodou (vodu nepolykejte) je výskyt málo pravděpodobný.
• Mírná bolest v krku, kašel a chraplavý hlas.
• Bolest hlavy.
• Pneumonie (infekční onemocnění plic) u pacientů s CHOPN (častý nežádoucí účinek)
Informujte svého lékaře, pokud máte jakýkoli z následující projevů při podávání přípravku DuoResp
Spiromax, neboť může jít o projevy infekčního onemocnění plic:
• horečka nebo zimnice
• zvýšená tvorba hlenu, změna barvy hlenu
• zhoršení kašle nebo zhoršení dýchacích obtíží
Méně časté: mohou postihnout až 1 ze 100 lidí
• Pocit neklidu, nervozita, agitovanost, úzkost nebo vztek.
• Porucha spánku.
• Pocit závratí.
• Nauzea (nevolnost).
• Zrychlený tep.
• Tvorba kožních podlitin.
• Svalové křeče.
Vzácné:
• Nízké hladiny draslíku v krvi.
• Nepravidelný tep.
Velmi vzácné:
• Deprese.
• Změny chování, zvláště u dětí.
• Bolest nebo tíže na hrudníku (angina pectoris).
• Poruchy převodního elektrického srdečního systému (prodloužení QTc intervalu)
• Zvýšení množství cukru (glukosy) v krvi.
• Změny chuti, např. nepříjemná chuť v ústech.
• Změny krevního tlaku.
• Inhalační kortikosteroidy mohou ovlivňovat normální tvorbu steroidních hormonů ve vašem těle, zvláště pokud užíváte vysoké dávky a po dlouhou dobu. Tyto účinky mohou zahrnovat:
- změny minerální hustoty kostí (snížení hustoty kostí),
- kataraktu (šedý oční zákal, zamlžení očky v oku),
- glaukom (zvýšený tlak v oku),
- zpomalení růstu u dětí a dospívajících,
- vliv na nadledviny (malá žláza sousedící s ledvinami).
Tyto účinky jsou daleko méně pravděpodobné u inhalovaných kortikosteroidů ve srovnání s tabletami s obsahem kortikosteroidů.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře.
Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek DuoResp Spiromax uchovávat
• Uchovávejte tento přípravek mimo dohled a dosah dětí.
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti vyznačené na krabičce nebo štítku vašeho inhalátoru za zkratkou EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
• Uchovávejte při teplotě do 25oC. Po vyjmutí z fólie uchovávejte kryt náustku uzavřený.
• Použijte přípravek během 6 měsíců po vyjmutí z fólie. Použijte štítek na inhalátoru, abyste zapsali datum otevření fólie.
• Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek DuoResp Spiromax obsahuje
- Léčivými látkami jsou budesonid a dihydrát formoterol-fumarátu. Jedna podaná dávka obsahuje 160 mikrogramů budesonidu a 4,5 mikrogramu dihydrátu formoterol-fumarátu. To odpovídá odměřené dávce 200 mikrogramů budesonidum a 6 mikrogramů formoteroli fumaras dihydricus
- Další složkou je monohydrát laktosy (viz bod 2 „DuoResp Spiromax obsahuje laktosu“)
Jak přípravek DuoResp Spiromax vypadá a co obsahuje toto balení
DuoResp Spiromax je prášek k inhalaci.
Každý inhalátor DuoResp Spiromax obsahuje 120 inhalací a má bílé tělo s poloprůhledným vínově
červeným krytem inhalátoru.
Balení po 1, 2 a 3 inhalátorech. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Teva Pharma B.V.,
Swensweg 5, 2031GA Haarlem, Nizozemsko.
Výrobce
Norton (Waterford) Limited T/A Teva Pharmaceuticals Irsko Unit 27/35, IDA Industrial Park, Cork Road, Waterford, Irsko
Teva Pharmaceuticals Europe B.V., Swensweg 5, 2031 GA Haarlem, Nizozemsko
(pouze pro Polsko) Teva Operations Poland Sp. z o.o., Mogilska 80 Str., 31-546 Kraków, Polsko
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien Lietuva
Teva Pharma Belgium N.V./S.A./AG UAB “Sicor Biotech”
Tel/Tél: +32 3 820 73 73 Tel: +370 5 266 02 03
|
Bt-nrapna |
Luxembourg/Luxemburg | |
|
TeBa ^apMacroTHKtnc Bt-nrapna EOO^, |
Teva Pharma Belgium N.V./S.A./AG | |
|
Te.n: +359 2 489 95 82 |
Tel/Tél: +32 3 820 73 73 | |
|
Česká republika |
Magyarország | |
|
Teva Pharmaceuticals CR, s.r.o. |
Teva Gyógyszergyár Zrt | |
|
Tel: +420 251 007 111 |
Tel.: +36 1 288 64 00 | |
|
Danmark | ||
|
Teva Denmark A/S |
Malta | |
|
Tlf: +45 44 98 55 11 |
Teva Pharmaceuticals Ireland | |
|
L-Irlanda | ||
|
Tel: +353 51 321 740 | ||
|
Deutschland |
Nederland | |
|
Teva GmbH |
Teva Nederland B.V. | |
|
Tel: +49 731 402 08 |
Tel: +31 800 0228 400 | |
|
Eesti |
Norge | |
|
Teva Eesti esindus UAB Sicor Biotech Eesti |
Teva Norway AS | |
|
filiaal |
Tlf: +47 6677 55 90 | |
|
Tel: +372 661 0801 | ||
|
EXXáSa |
Osterreich | |
|
Teva EXXáq A.E. |
ratiopharm Arzneimittel Vertriebs GmbH | |
|
Tn^: +30 210 72 79 099 |
Tel: +43 1 97007 0 | |
|
Espaňa |
Polska |
|
Teva Pharma S.L.U. |
Teva Pharmaceuticals Polska Sp. z o.o. |
Tél: +34 91 387 32 80 Tel.: +48 22 345 93 00
|
France |
Portugal | |
|
Teva Santé |
Teva Pharma - Produtos Farmaceuticos Lda | |
|
Tél: +33 1 55 91 7800 |
Tel: +351 21 476 75 50 | |
|
Hrvatska |
Románia | |
|
Pliva Hrvatska d.o.o |
Teva Pharmaceuticals S.R.L | |
|
Tel: + 385 1 37 20 000 |
Tel: +4021 230 6524 | |
|
Ireland Slovenija | ||
|
Teva Pharmaceuticals Ireland Tel: +353 51 321 740 |
Pliva Ljubljana d.o.o. Tel: +386 1 58 90 390 | |
|
Ísland Vistor |
Slovenská republika | |
|
Teva Pharmaceuticals Slovakia s.r.o. | ||
|
Simi: +354 535 7000 |
Tel: +421 2 5726 7911 | |
|
Italia Suomi/Finland Teva Italia S.r.l. ratiopharm Oy Tel: +39 028 917 981 Puh/Tel: +358 20 180 5900 | ||
|
Kúnpoq Teva EXXáq A.E. T^: +30 210 72 79 099 |
Sverige Teva Sweden AB Tel: +46 42 12 11 00 | |
|
Latvija United Kingdom | ||
|
Sicor Biotech filiale Latvija Tel: +371 67 323 666 |
Teva UK Limited Tel: +44 1977 628 500 | |
Tato příbalová informace byla naposledy revidována měsíci RRRR.
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
DuoResp Spiromax 320 mikrogramů/9 mikrogramů, prášek k inhalaci
(budesonidum/formoteroli fumaras dihydricus)
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je DuoResp Spiromax a k čemu se používá (strana 3)
2. Čemu musíte věnovat pozornost, než začnete DuoResp Spiromax užívat (strana 5)
3. Jak se DuoResp Spiromax používá (strana 8)
4. Možné nežádoucí účinky (strana 16)
5. Jak DuoResp Spiromax uchovávat (strana 19)
6. Obsah balení a další informace (strana 19)
1. Co je DuoResp Spiromax a k čemu se používá
DuoResp Spiromax obsahuje dvě různé léčivé látky: budesonid a dihydrát formoterol-fumarátu.
• Budesonid patří do skupiny léčiv označovaných jako „kortikosteroidy“ také označované jako „steroidy“. Budesonid léčí zánět a předchází vzniku otoku a zánětu ve Vašich plicích a pomáhá Vám snadněji dýchat.
• Dihydrát formoterol-fumarátu patří do skupiny léčiv označovaných jako „dlouhodobě účinná P2-adrenergní agonisté“ nebo „bronchodilatátory“ Působí tak, že uvolňuje svaly dýchacích cest, a tím pomáhá otevírat dýchací cesty a usnadňuje dýchání.
DuoResp Spiromax je indikován pro použití pouze u dospělých ve věku 18 let a starších.
Přípravek DuoResp Spiromax není indikován pro použití u dětí ve věku 12 let a mladších nebo
dospívajících ve věku od 13 do 17 let.
Lékař Vám předepsal tento lék k léčbě astmatu nebo chronické obstrukční plicní nemoci (CHOPN).
Lékař Vám předepíše k léčbě astmatu přípravek DuoResp Spiromax společně se samostatným
„úlevovým inhalátorem“, jako je salbutamol.
• DuoResp Spiromax užívejte každý den. Tím se předchází vzniku astmatických příznaků, jako je dušnost nebo sípání.
• „Úlevový inhalátor“ používejte pouze tehdy, když se objeví příznaky astmatu pro usnadnění dýchání.
Neužívejte DuoResp Spiromax 320/9 mikrogramů jako úlevový inhalátor.
Chronická obstrukční plicní nemoc (CHOPN)
CHOPN je dlouhodobé onemocnění dýchacích cest v plících, které je často způsobeno cigaretovým kouřem. Příznaky zahrnují dušnost, kašel, nepohodlí na hrudníku a vykašlávání hlenu. Přípravek DuoResp Spiromax může být také použit k léčbě příznaků závažné CHOPN u dospělých.
2. Čemu musíte věnovat pozornost, než začnete přípravek DuoResp Spiromax užívat Nepoužívejte přípravek DuoResp Spiromax, pokud:
Jste alergický(á) na budesonid, dihydrát formoterol-fumarátu nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před užitím přípravku DuoResp Spiromax se poraďte se svým lékařem, lékárníkem nebo zdravotní sestrou, pokud
• máte cukrovku,
• máte plicní infekci,
• máte vysoký krevní tlak, nebo jste někdy měli problémy se srdcem (např. nepravidelný tep, velmi rychlý tep, zúžení cév nebo Vám selhává srdce),
• máte problémy se štítnou žlázou nebo nadledvinami,
• máte nízkou hladinu draslíku v krvi,
• máte závažné problémy s játry.
Pokud užíváte tablety kortikosteroidu k léčbě astmatu nebo CHOPN, může váš lékař snížit počet tablet, které užíváte po zahájení léčby přípravkem DuoResp Spiromax. Pokud užíváte tablety se steroidy dlouhou dobu, váš lékař může provést pravidelná vyšetření krve. Při snižování dávky tablet kortikosteroidu můžete pociťovat celkovou nevolnost, i když se Vaše příznaky na hrudníku mohou zlepšovat. Mohou se u Vás objevit příznaky, jako je ucpaný nos nebo rýma, slabost nebo bolest kloubů či svalů a vyrážka (ekzém). Pokud Vás tyto příznaky obtěžují, nebo pokud se objeví příznaky, jako je bolest hlavy, únava, nauzea (nevolnost) nebo zvracení, kontaktujte prosím ihned svého lékaře. Možná bude třeba, abyste užívali další léky, pokud se u Vás objeví příznaky alergie nebo zánětu kloubů. Měli byste informovat svého lékaře, pokud máte obavy ohledně toho, zda pokračovat v užívání přípravku DuoResp Spiromax.
Váš lékař může zvážit přidání tablet s obsahem kortikosteroidu k Vaší obvyklé léčbě během období zátěže (například, když máte infekci v oblasti hrudníku nebo před operací).
Děti a dospívající
Tento přípravek by neměli užívat děti nebo dospívající do 18 let.
Další léčivé přípravky a DuoResp Spiromax
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Informujte svého lékaře nebo lékárníka zvláště o následujících lécích:
• Beta blokátory (např. atenolol, propranolol k léčbě vysokého krevního tlaku nebo onemocnění srdce), včetně očních kapek (např. timolol k léčbě glaukomu).
• Léky k léčbě rychlého nebo nepravidelného tepu (např. chinidin, disopyramid a prokainamid).
• Léky jako digoxin, často používané k léčbě srdečního selhání.
• Diuretika, určená k „odvodnění organismu“ (např. furosemid). Používají se k léčbě vysokého krevního tlaku.
• Léky s obsahem steroidů užívané ústy (např. prednisolon).
• Xantiny (např. theofylin nebo aminofylin). Tyto léky se často používají k léčbě astmatu.
• Jiné léky k rozšíření průdušek (např. salbutamol).
• Tricyklická antidepresiva (např. amitryptylin) a antidepresivum nefazodon.
• Léky označené jako inhibitory monoaminooxidázy (např. fenelzin, furazolidon a prokardazin).
• Fenothiaziny (např. chlorpromazin nebo prochlorperazin).
• Léky označované jako „HIV proteázové inhibitory“ (např. ritonavir), určené k léčbě HIV infekce.
• Léky určené k léčbě infekcí (např. ketokonazol, itrakonazol, vorikonazol, posakonazol, klarithromycin a telithromycin).
• Léky k léčbě Parkinsonovy nemoci (např. levodopa).
• Léky k léčbě poruch štítné žlázy (např. levothyroxin).
• Léky k léčbě alergií nebo antihistaminika (např.terfenadin).
Pokud užíváte některý z výše uvedených léků, nebo pokud si nejste jist/a, zeptejte se lékaře, lékárníka nebo zdravotní sestry předtím, než začnete užívat DuoResp Spiromax.
Informujte lékaře, lékárníka nebo zdravotní sestru také v případě, že jdete na plánovanou operaci nebo zubní výkon a bude používáno celkové anestetikum.
Těhotenství, kojení a plodnost
• Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem, lékárníkem nebo zdravotní sestrou dříve, než začnete přípravek DuoResp Spiromax užívat - NEUŽÍVEJTE tento přípravek bez porady se svým lékařem.
• Pokud otěhotníte až v průběhu léčby přípravkem DuoResp Spiromax, NEPŘESTÁVEJTE užívat DuoResp Spiromax, ale informujte o těhotenství ihned svého lékaře.
Řízení dopravních prostředků a obsluha strojů
DuoResp Spiromax nemá vliv nebo má zanedbatelný vliv na schopnost řídit motorová vozidla a na schopnost obsluhovat stroje.
DuoResp Spiromax obsahuje laktosu
Laktosa je typ cukru obsažený v mléce. Laktosa obsahuje malá množství mléčné bílkoviny, která může způsobit alergické reakce. Pokud Vám Váš lékař řekl, že nesnášíte některé cukry, poraďte se se svým lékařem, než začnete tento léčivý přípravek užívat.
4. Jak se DuoResp Spiromax užívá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem, lékárníkem nebo zdravotní sestrou.
• Je důležité používat DuoResp Spiromax každý den, i když právě nemáte žádné příznaky astmatu nebo CHOPN.
• Pokud užíváte DuoResp Spiromax k léčbě astmatu, váš lékař bude pravidelně kontrolovat vaše příznaky.
Astma
Užívejte DuoResp Spiromax každý den. Tím se předchází vzniku astmatických příznaků.
Doporučená dávka:
Dospělí (18 let a starší)
1 inhalace (použití) dvakrát denně.
Váš lékař může toto dávkování zvýšit na 2 inhalace dvakrát denně.
Pokud jsou Vaše příznaky dobře kontrolovány, může Vás lékař požádat, abyste užívali lék jednou denně.
Váš lékař Vám pomůže v léčbě astmatu a upraví dávku tohoto léku na nejnižší dávku, která zajistí kontrolu Vašeho astmatu. Pokud bude mít lékař pocit, že potřebujete nižší dávku než je dostupná ve Vašem přípravku DuoResp Spiromax, lékař Vám může předepsat alternativní inhalátor obsahující stejné léčivé látky jako Váš DuoResp Spiromax, ale s nižší dávkou kortikosteroidu. Počet inhalací, které Vám předepsal lékař, však sami neupravujte bez předchozí porady se svým lékařem.
Použijte samostatný „úlevový inhalátor“ k léčbě příznaků astmatu.
Vždy mějte u sebe „úlevový inhalátor“ a použijte jej k úlevě od náhlých záchvatů dušnosti a sípání. Neužívejte DuoResp Spiromax k léčbě příznaků astmatu.
Chronická obstrukční plicní nemoc (CHOPN)
Doporučená dávka:
Dospělí (18 let a starší)
• 1 inhalace dvakrát denně.
Váš lékař Vám může předepsat další bronchodilatační léky k léčbě CHOPN např. anticholinergika (jako je tiotropium nebo ipratropium bromid).
Příprava nového inhalátoru DuoResp Spiromax
Před prvním použitím nového přípravku DuoResp Spiromax je třeba inhalátor připravit podle následujícího postupu:
• Zkontrolujte indikátor dávky, abyste zjistili, že je v inhalátoru 60 inhalací.
• Zapište datum otevření fóliového sáčku na štítek na inhalátoru.
• Před použitím s inhalátorem netřepejte.
Jak inhalovat
Vždy, když je třeba provést inhalaci, postupujte podle instrukcí uvedených níže.
1. Držte inhalátor s polotransparentním, vínově červeným krytem náustku dole

2. Otevřete kryt náustku jeho sklopením dolů, dokud neuslyšíte hlasité cvaknutí. Váš lék je aktivně odměřen. Inhalátor je nyní připraven k použití.

OTEVRU
3. Lehce vydechněte (co nejpohodlněji). Nevydechujte přes inhalátor.
4. Vložte náustek do úst mezi zuby. Náustek nekousejte. Rty náustek stiskněte. Dbejte na to, abyste neblokovali vývody vzduchu.
Přes náustek se nadýchněte co nej hlouběji můžete.
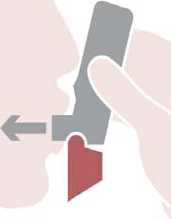
DECH
5. Zadržte dech na 10 sekund nebo co nejdéle je Vám pohodlné.
6. Vyjměte inhalátor z úst. Můžete si všimnout příchuti během inhalace.
7. Pak jemně vydechněte (nevydechujte přes inhalátor). Uzavřete kryt náustku.
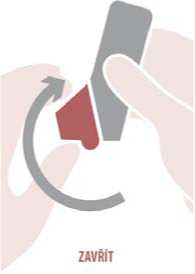
Pokud máte užít druhou dávku, opakujte kroky 1 až 7.
Vypláchněte si ústa vodou po každé dávce a vodu vyplivněte.
Nepokoušejte se rozebrat svůj inhalátor, oddělit nebo odšroubovat kryt náustku, který je k němu pevně připevněn a nesmí být od něj oddělován. Nepoužívejte svůj inhalátor Spiromax, pokud je poškozen nebo pokud se z něj odlomil náustek. Neotevírejte a nezavírejte kryt náustku, pokud neužíváte svůj inhalátor.
Čištění inhalátoru Spiromax
Udržujte svůj Spiromax suchý a čistý.
Je-li třeba, můžete otřít náustek svého inhalátoru Spiromax suchým hadříkem.
Kdy je třeba vyměnit inhalátor Spiromax za nový
• Indikátor počtu dávek ukazuje, kolik dávek (inhalací) v inhalátoru ještě zbývá. Začíná na 60 inhalacích, když je plný.

• Indikátor dávky na zadní straně inhalátoru ukazuje počet inhalací, které zbývají v celých číslech.
• Pro zbývající inhalace od 20 do „8“, „6“, „4“, „2“ jsou čísla zobrazena červeně na bílém pozadí. Když jsou zobrazena čísla červeně v okénku, měli byste informovat svého lékaře a získat nový inhalátor.
Poznámka:
• Náustek „cvakne“, i když je inhalátor Spiromax prázdný.
• Pokud otevřete a zavřete náustek bez podání inhalace, bude to indikátor dávkování stále registrovat jako dávku. Tato dávka bude bezpečně zachována v inhalátoru na dobu, kdy bude podána další inhalace. Není možné náhodně podat lék navíc nebo inhalovat dvojnásobnou dávku při jedné inhalaci.
• Vždy, pokud neužíváte svůj inhalátor, mějte náustek zavřený.
Důležité informace o příznacích astmatu nebo CHOPN
Pokud cítíte dušnost nebo sípání během užívání přípravku DuoResp Spiromax, měli byste pokračovat v užívání přípravku DuoResp Spiromax, ale měli byste navštívit svého lékaře co možná nejdříve, protože je možné, že budete potřebovat další léčbu.
Kontaktujte ihned svého lékaře, pokud:
• se Vaše dýchání zhoršuje nebo se často probouzíte v noci s dušností a sípáním.
• máte ráno pocit sevření na hrudníku nebo tento pocit trvá déle než obvykle.
Tyto známky by mohly znamenat, že vaše astma nebo CHOPN není správně pod kontrolou a můžete ihned potřebovat jinou nebo dodatečnou léčbu.
Jakmile je Vaše astma dobře kontrolováno, může Váš lékař posoudit jako vhodné postupné snižování dávky přípravku DuoResp Spiromax.
Jestliže jste užil(a) více přípravku DuoResp Spiromax, než jste měl(a).
Je důležité, abyste užil(a) dávku předepsanou lékařem. Bez porady s lékařem byste neměli překračovat předepsaný počet dávek.
Jestliže jste užili(a) více přípravku DuoResp Spiromax, než jste měl(a), kontaktujte svého lékaře, lékárníka nebo zdravotní sestru.
Nejčastější příznaky, které se mohou objevit po užití většího množství přípravku DuoResp Spiromax, než jste měl(a), jsou třes, bolest hlavy a rychlý srdeční tep.
Jestliže jste zapomněl(a) užít přípravek DuoResp Spiromax
Jestliže jste zapomněl(a) užít dávku, užijte ji, jakmilesi vzpomenete. Nicméně, nezdvojnásobujte následující dávku, abyste nahradil(a) zapomenutou dávku. Pokud je téměř čas na další dávku, pouze užijte další dávku v obvyklou dobu.
Pokud začnete sípat nebo být dušní nebo se u Vás objeví jakékoli další příznaky astmatického záchvatu, použijte svůj úlevový inhalátor a pak vyhledejte lékaře.
Jestliže jste přestal(a) užívat přípravek DuoResp Spiromax
Nepřestávejte používat svůj inhalátor bez porady se svým lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento lék nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pokud se kterýkoliv z následujících nežádoucích účinků objeví u Vás, přestaňte DuoResp Spiromax užívat a ihned zavolejte lékaři:
Vzácné nežádoucí účinky: mohou postihnout až 1 z 1 000 lidí
• Otok obličeje, zvláště v okolí úst (otok jazyka a/nebo hrdla a/nebo polykací obtíže) nebo kopřivka doprovázená dýchacími obtížemi (angioedém) a/nebo náhlý pocit mdloby. Toto mohou být projevy alergické reakce na přípravek, mezi které může patřit vyrážka a svědění.
• Bronchospasmus (napnutí svalů v dýchacích cestách, které způsobuje sípání a dušnost). Pokud se náhle po užití tohoto léku objeví sípání, ukončete jeho užívání a informujte ihned svého lékaře.
Velmi vzácné nežádoucí účinky: mohou postihnout až 1 z 10 000 lidí
• Náhle vzniklé sípání a/nebo dušnost těsně po inhalaci z inhalátoru (také se označuje jako „paradoxní bronchospasmus“). Pokud se kterýkoliv z těchto příznaků objeví, přestaňte ihned používat inhalátor DuoResp Spiromax a použijte svůj „úlevový“ inhalátor. Kontaktujte ihned svého lékaře, protože může být nutné změnit léčbu.
Další možné nežádoucí účinky:
Časté: mohou postihnout až 1 z 10 lidí
• Palpitace (pocit bušení srdce), záchvěvy nebo třes. Pokud se tyto nežádoucí účinky objeví, jsou obvykle mírné a obvykle odeznívají při pokračování v léčbě přípravkem DuoResp Spiromax.
• Moučnivka (plísňová infekce) v ústech. Při vyplachování úst po inhalaci vodou (vodu nepolykejte) je výskyt málo pravděpodobný.
• Mírná bolest v krku, kašel a chraplavý hlas.
• Bolest hlavy.
• Pneumonie (infekční onemocnění plic) u pacientů s CHOPN (častý nežádoucí účinek)
Informujte svého lékaře, pokud máte jakýkoli z následující projevů při podávání přípravku DuoResp Spiromax, neboť může jít o projevy infekčního onemocnění plic:
• horečka nebo zimnice
• zvýšená tvorba hlenu, změna barvy hlenu
• zhoršení kašle nebo zhoršení dýchacích obtíží
Méně časté: mohou postihnout až 1 ze 100 lidí
• Pocit neklidu, nervozita, agitovanost, úzkost nebo vztek.
• Porucha spánku.
• Pocit závratí.
• Nauzea (nevolnost).
• Zrychlený tep.
• Tvorba kožních podlitin.
• Svalové křeče.
Vzácné:
• Nízké hladiny draslíku v krvi.
• Nepravidelný tep.
Velmi vzácné:
• Deprese.
• Změny chování, zvláště u dětí.
• Bolest nebo tíže na hrudníku (angina pectoris).
• Poruchy převodního elektrického srdečního systému (prodloužení QTc intervalu)
• Zvýšení množství cukru (glukosy) v krvi.
• Změny chuti, např. nepříjemná chuť v ústech.
• Změny krevního tlaku.
• Inhalační kortikosteroidy mohou ovlivňovat normální tvorbu steroidních hormonů ve vašem těle, zvláště pokud užíváte vysoké dávky a po dlouhou dobu. Tyto účinky mohou zahrnovat:
- změny minerální hustoty kostí (snížení hustoty kostí),
- kataraktu (šedý oční zákal, zamlžení čočky v oku).
- glaukom (zvýšený tlak v oku).
- zpomalení růstu u dětí a dospívajících.
- vliv na nadledviny (malá žláza sousedící s ledvinami).
Tyto účinky jsou daleko méně pravděpodobné u inhalovaných kortikosteroidů ve srovnání s tabletami s obsahem kortikosteroidů.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře.
Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek DuoResp Spiromax uchovávat
• Uchovávejte tento přípravek mimo dohled a dosah dětí.
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti vyznačené na krabičce nebo štítku vašeho inhalátoru za zkratkou EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
• Uchovávejte při teplotě do 25oC. Po vyjmutí z fólie uchovávejte kryt náustku uzavřený.
• Používejte během 6 měsíců po vyjmutí z fólie. Použijte štítek na inhalátoru, abyste zapsali datum otevření fólie.
• Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek DuoResp Spiromax obsahuje
- Léčivými látkami jsou budesonid a dihydrát formoterol-fumarátu. Jedna podaná (inhalovaná) dávka obsahuje 320 mikrogramů budesonidu a 9 mikrogramů dihydrátu formoterol-fumarátu. To odpovídá odměřené dávce 400 mikrogramů budesonidum a 12 mikrogramů formoteroli fumaras dihydricus.
- Další složkou je monohydrát laktosy (viz bod 2 „DuoResp Spiromax obsahuje laktosu“)
Jak přípravek DuoResp Spiromax vypadá a co obsahuje toto balení
DuoResp Spiromax je prášek k inhalaci.
Každý inhalátor DuoResp Spiromax obsahuje 60 inhalací a má bílé tělo s polotransparentním, vínově červeným krytem inhalátoru.
Balení po 1, 2 a 3 inhalátorech. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci Teva Pharma B.V.,
Swensweg 5, 2031GA Haarlem, Nizozemsko.
Výrobce:
Norton (Waterford) Limited T/A Teva Pharmaceuticals Irsko Unit 27/35, IDA Industrial Park, Cork Road, Waterford, Irsko
Teva Pharmaceuticals Europe B.V., Swensweg 5, 2031 GA Haarlem, Nizozemsko (pouze pro Polsko) Teva Operations Poland Sp. z o.o., Mogilska 80 Str., 31-546 Kraków, Polsko
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien
Teva Pharma Belgium N.V./S.A./AG
Tel/Tél: +32 3 820 73 73
EturapuH
TeBa ^apMacroTHKt^c BuurapuH EOO^, Teu: +359 2 489 95 82
Lietuva
UAB “Sicor Biotech”
Tel: +370 5 266 02 03
Luxembourg/Luxemburg
Teva Pharma Belgium N.V./S.A./AG
Tel/Tél: +32 3 820 73 73
Česká republika
Teva Pharmaceuticals CR, s.r.o.
Tel: +420 251 007 111
Danmark
Teva Denmark A/S
Tlf: +45 44 98 55 11
Deutschland Teva GmbH Tel: +49 731 402 08
Eesti
Teva Eesti esindus UAB Sicor Biotech Eesti filiaal
Tel: +372 661 0801 EXXáSa
Teva EXXág A.E.
T^: +30 210 72 79 099
Espaňa
Teva Pharma S.L.U.
Tél: +34 91 387 32 80
France
Teva Santé
Tél: +33 1 55 91 7800
Hrvatska
Pliva Hrvatska d.o.o Tel: + 385 1 37 20 000
Ireland
Teva Pharmaceuticals Ireland Tel: +353 51 321 740
Ísland
Vistor
Simi: +354 535 7000
Magyarország
Teva Gyógyszergyár Zrt
Tel.: +36 1 288 64 00
Malta
Teva Pharmaceuticals Ireland L-Irlanda
Tel: +353 51 321 740
Nederland
Teva Nederland B.V.
Tel: +31 800 0228 400
Norge
Teva Norway AS Tlf: +47 6677 55 90
Osterreich
ratiopharm Arzneimittel Vertriebs GmbH Tel: +43 1 97007 0
Polska
Teva Pharmaceuticals Polska Sp. z o.o.
Tel.: +48 22 345 93 00
Portugal
Teva Pharma - Produtos Farmaceuticos Lda Tel: +351 21 476 75 50
Románia
Teva Pharmaceuticals S.R.L Tel: +4021 230 6524
Slovenija
Pliva Ljubljana d.o.o. Tel: +386 1 58 90 390
|
Slovenská republika | ||
|
Teva Pharmaceuticals Slovakia s.r.o. | ||
|
Tel: +421 2 5726 7911 | ||
Italia
Teva Italia S.r.l.
Tel: +39 028 917 981
Suomi/Finland ratiopharm Oy Puh/Tel: +358 20 180 5900
Kúrcpog
Teva EXXág A.E.
Tn^: +30 210 72 79 099
Latvija
Sicor Biotech filiale Latvija Tel: +371 67 323 666
Sverige
Teva Sweden AB Tel: +46 42 12 11 00
United Kingdom Teva UK Limited Tel: +44 1977 628 500
Tato příbalová informace byla naposledy revidována měsíci RRRR.
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
65