Dukoral
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Dukoral suspenze a šumivé granule pro perorální suspenzi Vakcína proti choleře (inaktivovaná, perorální)
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna dávka (3 ml) suspenze vakcíny obsahuje:
- Celkem 1,25x10n vibrií následujících kmenů:
Vibrio cholerae O1 Inaba classicus (calore inactivatus)
Vibrio cholerae O1 Inaba El Tor (formaldehydo inactivatus) Vibrio cholerae O1 Ogawa classicus (calore inactivatus)
Vibrio cholerae O1 Ogawa classicus (formaldehydo inactivatus)
31,25x109 vibrií* 31,25x109 vibrií* 31,25x109 vibrií* 31,25x109 vibrií*
- Cholera toxini B subunitas recombinans (r CTB) 1 mg
(produkováno V. cholerae O1 Inaba, klasický biotyp, kmen 213.)
* Počet vibrií před inaktivací.
Pomocné látky se známým účinkem:
Dihydrát dihydrogenfosforečnanu sodného 2,0 mg, dihydrát hydrogenfosforečnanu sodného 9,4 mg, chlorid sodný 26 mg, hydrogenuhličitan sodný 3600 mg, bezvodý uhličitan sodný 400 mg, sodná sůl sacharinu 30 mg, citronan sodný 6 mg.
Jedna dávka obsahuje přibližně 1,1 g sodíku.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Suspenze a šumivé granule pro perorální suspenzi.
Suspenze dodávaná v lahvičce je bělavá. Šumivé granule dodávané v sáčku jsou bílé.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Dukoral je indikován k aktivní imunizaci dospělých a dětí od dvou let věku proti chorobě, jejímž původcem je Vibrio cholerae seroskupiny O1, kteří budou cestovat do endemických oblastí či do oblastí s probíhající epidemií.
Užívání přípravku Dukoral se řídí oficiálními doporučeními s ohledem na epidemiologickou variabilitu a riziko nákazy nemocí v různých zeměpisných oblastech a za různých cestovních podmínek.
Přípravek Dukoral není náhradou za standardní ochranná opatření. V případě výskytu průjmu je třeba zavést rehydratační režim.
4.2 Dávkování a způsob podání
Dávkování
Základní vakcinační schéma
Standardní základní vakcinaci proti choleře přípravkem Dukoral tvoří dvě dávky vakcíny pro dospělé a děti od šesti let věku. Dětem od dvou do šesti let se podávají dávky tři. Interval mezi dávkami je minimálně 1 týden. Pokud mezi podáním jednotlivých dávek uplyne více než 6 týdnů, je třeba základní imunizaci zahájit znovu.
Imunizaci je třeba ukončit minimálně 1 týden před potenciální expozicí V. cholerae O1.
Posilovací dávka (booster dávka)
Pro trvalou ochranu proti choleře se doporučuje jedna posilovací dávka do dvou let u dospělých a dětí od šesti let věku a do šesti měsíců u dětí od dvou do šesti let. Pro opakované podávání posilovacích dávek nejsou k dispozici žádné klinické údaje o účinnosti. Imunologické údaje a údaje o trvání ochrany ovšem ukazují, že pokud od poslední vakcinace uplynuly maximálně dva roky pro dospělé a do 6 měsíců pro děti ve věku 2 - 6 let, měla by být podána jedna posilující dávka. Pokud od poslední vakcinace uplynula doba delší než dva roky (více než 6 měsíců pro děti ve věku 2 - 6 let), je třeba zopakovat základní vakcinační schéma.
Děti do dvou let
Dukoral byl podáván dětem ve věku od jednoho do dvou let ve studiích bezpečnosti a imunogenicity, ale účinnost ochrany nebyla u této věkové skupiny zkoumána. Přípravek Dukoral se proto nedoporučuje podávat dětem do dvou let věku.
Starší osoby
Údaje o účinnosti ochrany této vakcíny u subjektů ve věku 65 a více let jsou velmi omezené.
Způsob podání:
Vakcína je určena k perorálnímu podání. Před požitím je třeba suspenzi vakcíny smísit s roztokem pufru (hydrogenuhličitanu sodného). Hydrogenuhličitan sodný se dodává jako šumivé granule, který je třeba rozpustit ve sklenici studené vody (přibližně 150 ml). Je možné použít chlorovanou vodu. Suspenze vakcíny se poté smísí s roztokem pufru a vypije se do dvou hodin. Jednu hodinu před vakcinací a jednu hodinu po vakcinaci je třeba nejíst a nepít. Perorální podání jiných léčivých přípravků jednu hodinu před podáním a jednu hodinu po podání přípravku Dukoral není povoleno.
Děti od dvou do šesti let věku: polovina roztoku pufru se odlije a zbývající část (přibližně 75 ml) se smísí s celým obsahem vakcíny v lahvičce.
4.3 Kontraindikace
Hypersensitivita na léčivou látku(y) nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 nebo na formaldehyd.
Podávání přípravku Dukoral je třeba odložit u subjektů trpících akutní chorobou gastrointestinálního traktu nebo akutním horečnatým onemocněním.
4.4 Zvláštní upozornění a opatření pro použití
Klinické údaje o účinnosti ochrany přípravkem Dukoral proti choleře po podání posilovacích dávek nejsou k dispozici.
Přípravek Dukoral poskytuje ochranu konkrétně před Vibrio cholerae seroskupiny O1. Imunizace nechrání před V. cholerae seroskupiny O139 ani jinými druhy vibrií.
U subjektů nakažených virem HIV jsou k dispozici omezené údaje o imunogenicitě a bezpečnosti vakcíny. Účinnost ochrany poskytované vakcínou nebyla zkoumána. Imunizace subjektů nakažených virem HIV by mohla vést k přechodnému zvýšení virové zátěže. Přípravek Dukoral nemusí u subjektů v pokročilém stádiu onemocnění virem HIV vyvolat vytvoření ochranné hladiny protilátek. Studie účinnosti u populace s vysokou prevalencí HIV však prokázala podobnou ochranu jako u jiných populací.
Odpověď protilátek u očkovaných s endogenní či iatrogenní imunosupresí může být nedostatečná.
Ve výrobním procesu se používá formaldehyd a může být ve stopovém množství obsažen i v konečném přípravku. U subjektů, u nichž je známa hypersensitivita na formaldehyd, je třeba dbát zvýšené opatrnosti.
Přípravek Dukoral obsahuje přibližně 1,1 g sodíku v jedné dávce. Nutno vzít v úvahu u pacientů na dietě s nízkým obsahem sodíku.
Vakcína neposkytuje kompletní ochranu a navíc je důležité dodržovat standardní bezpečnostní opatření, aby nedošlo k nákaze cholerou.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Vakcína je labilní v kyselém prostředí. Jídlo a/nebo pití zvyšuje tvorbu žaludečních kyselin a účinek vakcíny může být snížen. Proto je třeba nejíst a nepít jednu hodinu před vakcinací a jednu hodinu po vakcinaci.
Perorální podání jiných vakcín a léčivých přípravků jednu hodinu před vakcinací a jednu hodinu po podání přípravku Dukoral není povoleno.
Předběžné výsledky klinické studie zahrnující omezený počet dobrovolníků neprokázaly žádné interakce v odpovědi protilátek na přípravek Dukoral, pokud byla společně s přípravkem Dukoral podávána živá perorální vakcína proti tyfu (enterosolventní tobolky). Imunitní odpověď na živou vakcínu proti tyfu nebyla v této studii zkoumána. Obdobně byla současně s přípravkem Dukoral podávána vakcína proti žluté zimnici a nebyla pozorována žádná interakce s imunitní odpovědí na vakcínu proti žluté zimnici. Imunitní odpověď na přípravek Dukoral nebyla zkoumána. V klinických studiích nebyly souběžně s přípravkem Dukoral podávány žádné jiné vakcíny/léčivé přípravky, včetně perorální vakcíny proti dětské obrně a antimalarik.
4.6 Fertilita, těhotenství a kojení
Nejsou k dispozici žádné údaje o reprodukční toxicitě u zvířat. Po pečlivém posouzení přínosů a rizik lze vakcínu podat během těhotenství a kojení, ačkoliv nebyly provedeny žádné studie, které by se zabývaly touto tématikou.
Během hromadné vakcinační kampaně provedené v Zanzibaru dostalo 196 těhotných žen minimálně jednu dávku přípravku Dukoral. Nevyskytly se statisticky významné důkazy o škodlivém účinku expozice přípravku Dukoral během těhotenství.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyl prokázán žádný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Bezpečnost přípravku Dukoral byla posuzována v klinických hodnoceních, jichž se účastnili dospělí i děti od dvou let věku; studie probíhaly v endemických zemích i mimo ně a zabývaly se cholerou a enterotoxigenní Escherichia coli (ETEC) produkující termolabilní enterotoxin (LT). V průběhu klinických hodnocení bylo podáno přes 94 000 dávek přípravku Dukoral. Vyhodnocení bezpečnosti se v jednotlivých hodnoceních lišilo s ohledem na způsob sledování, definici symptomů a následné kontrolní období. Ve většině studií byly nežádoucí příhody sledovány pasivně. Nejčastěji hlášené nežádoucí účinky, jako byly gastrointestinální symptomy, včetně bolestí břicha, průjmů, neschopnosti udržet stolici, nausey a zvracení, se vyskytovaly ve skupině užívají přípravek s podobnou četností jako ve skupině, která dostávala placebo.
Klasifikace dle frekvence: Velmi časté (>1/10); časté (>1/10 až 0, <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000); velmi vzácné (<1/10000), není známo (z dostupných údajů nelze určit).
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Poruchy metabolismu a výživy
Vzácné Ztráta chuti k jídlu/nechutenství
Velmi vzácné Dehydratace
Poruchy nervového systému Méně časté Bolest hlavy
Vzácné Závratě
Velmi vzácné Ospalost, insomnie, mdloby, snížená citlivost chuťových buněk
Respirační, hrudní a mediastinální poruchy
Vzácné Dechové příznaky (včetně rinitidy a kašle)
Gastrointestinální poruchy
Méně časté Průjem, křeče v břiše, bolest břicha, plynatost (nadýmání), diskomfort v krajině
břišní
Vzácné Zvracení, nauzea
Velmi vzácné Bolest v krku, dyspepsie
Poruchy kůže a podkožní tkáně Velmi vzácné Pocení, vyrážka
Poruchy svalové a kosterní soustavy a pojivové tkáně Velmi vzácné Bolest v kloubech
Celkové poruchy a reakce v místě aplikace Vzácné Horečka, nevolnost
Velmi vzácné Únava, třes
Nežádoucí účinky hlášené po uvedení přípravku na trh
Další nežádoucí účinky hlášené v období, kdy byl přípravek sledován po uvedení na trh, jsou uvedeny níže.
Infekce a infestace: gastroenteritida
Poruchy krve a lymfatického systému: lymfadenitida
Poruchy nervového systému: parestézie
Cévní poruchy: hypertenze
Respirační, hrudní a mediastinální poruchy: dušnost, zvýšené množství sputa Gastrointestinální poruchy: plynatost
Poruchy kůže a podkožní tkáně: kopřivka, angioedém, pruritus
Celkové poruchy a reakce v místě aplikace: bolesti, syndrom podobný chřipce, asténie, zimnice
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Údaje o předávkování jsou omezené. Hlášené nežádoucí účinky odpovídají těm, které byly pozorovány po doporučeném dávkování.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Bakteriální vakcíny, ATC kód: J07AE01 Mechanismus účinku
Vakcína obsahuje celé usmrcené baktérie V. cholerae O1 a rekombinantní netoxickou B subjednotku choleratoxinu (CTB). Ve vakcíně jsou obsaženy bakteriální kmeny serotypu Inaba a Ogawa a biotypu El Tor a klasické biotypy. Přípravek Dukoral se podává perorálně s pufrem hydrogenuhličitanu, který chrání antigeny před žaludečními kyselinami. Vakcína působí tak, že indukuje tvorbu protilátek proti bakteriálním složkám i proti CTB. Antibakteriální intestinální protilátky blokují vazbu bakterií na střevní stěnu, čímž zabraňují kolonizaci V. cholerae O1. Antitoxinové intestinální protilátky zabraňují tomu, aby se toxin cholery navázal na povrch střevní sliznice, čímž se předchází průjmovým příznakům vyvolaným působením toxinu.
Termolabilní toxin (LT) enterotoxigenní E. coli (ETEC ) je strukturálně, funkčně i imunologicky podobný CTB. Oba toxiny vykazují z imunologického hlediska zkříženou reaktivitu.
Účinnost proti choleře
Účinnost proti choleře byla posuzována ve třech randomizovaných dvojitě slepých klinických hodnoceních kontrolovaných placebem. Studie probíhaly v Bangladéši (endemická oblast) a v Peru (neendemická oblast). Počet pacientů zařazených do studie, režimy dávkování a následná kontrolní období jsou uvedeny v následující tabulce.
|
Místo studie |
Rok |
Režim dávkování |
Počet (věková skupina) |
Následná kontrola |
|
Cholera | ||||
|
Bangladéš |
1985-88 |
3 dávky v 6týdenních intervalech |
89 152 (2 - 65 let) |
6 měsíců - 5 let |
|
Peru, vojenská část |
1994 |
2 dávky v intervalu 7 - 11 dní |
1 563 (18 - 65 let) |
5 měsíců |
|
Peru, Pampy |
1993-95 |
2 dávky v dvoutýdenním intervalu a jedna posilovací dávka podaná po roce |
21 924 (2 - 65 let) |
2 roky |
V terénní studii v Bangladéši byla ochrana poskytovaná přípravkem Dukoral v celé populaci 85 % (95 % interval spolehlivosti - CI: 56, 95, analýza založená na množině subjektů bez závažných odchylek od studijního protokolu - per-protocol analysis) po dobu prvních šesti měsíců následného kontrolního období. Doba, po niž vakcína poskytovala ochranu, se lišila v závislosti na věku a trvala 6 měsíců u dětí a 2 roky u dospělých (viz následující tabulka). Explorační analýza naznačuje, že 2 dávky vakcíny jsou u dospělých stejně účinné jako dávky 3.
Tabulka: Ochrana před cholerou ve studii konané v Bangladéši (per-protocol analysis)
|
Ochrana, % (95 % CI) | ||
|
Dospělí a děti > 6 let |
Děti ve věku 2 - 6 let | |
|
6 měsíců |
76 (30, 92) |
100 |
|
1. rok |
76 (60, 85) |
44 (10, 65) |
|
2. rok |
60 (36, 76) |
33 (-23, 64) |
Ve druhém hodnocení, které se konalo v Peru a do nějž byli zařazeni vojenští rekruti, byla krátkodobá ochrana proti choleře po dvou dávkách vakcíny 85 % (95 % CI: 36, 97, per-protocol analysis). Ve třetí studii, která se konala ve volném terénu v Peru, se v průběhu prvního roku neprokázala žádná ochrana proti choleře. Po posilovací dávce, která byla podána 10 - 12 měsíců po základní imunizaci, byla ochrana v průběhu druhého roku 60,5 % (95 % CI: 28, 79).
Ochranná účinnost proti choleře byla hodnocena během dvou masových vakcinačních kampaní provedených v Mosambiku (prosinec 2003 - leden 2004) a v Zanzibaru (únor 2009 - květen 2010).
Ve studii případů a kontrol provedené během hromadné vakcinační kampaně v Mosambiku byla ochranná účinnost 2 dávek přípravku Dukoral 84 % (95% interval spolehlivosti: 43, 95, per-protocol analysis, p = 0,005) pro iniciálních 5 měsíců sledování.
V longitudinální kohortové analýze provedené během hromadné vakcinační kampaně provedené v Zanzibaru byla ochranná účinnost po 2 dávkách přípravku Dukoral 79 % (95% interval spolehlivosti, 47, 92) pro období sledování 15 měsíců. Kromě přímé ochrany bylo prokázáno, že přípravek Dukoral poskytuje významnou nepřímou (skupinovou) ochranu v hodnocené sestavě.
Ochrana poskytovaná přípravkem Dukoral proti choleře nebyla zkoumána po opakovaném podání posilovacích dávek.
Imunogenicita
Nebyly stanoveny žádné imunologické koreláty ochrany proti choleře po perorální vakcinaci. Existuje slabá korelace mezi odpovědí protilátek v séru, včetně odpovědí protilátek s vibriocidní aktivitou, a ochranou. Ochrannou imunitu pravděpodobně zprostředkují lokálně vylučované intestinální IgA protilátky.
Vakcína vyvolala odpověď intestinálního antitoxinu IgA u 70 - 100 % očkovaných subjektů. Sérové vibriocidní protilátky proti bakteriálním složkám byly patrné u 35 - 55 % očkovaných subjektů a antitoxinové protilátky u 78 - 87 % očkovaných subjektů. Posilovací dávka vyvolala anamnestickou odpověď, která poukazovala na imunitní paměť. Trvání imunitní paměti se u dospělých odhaduje nejméně na dva roky.
5.2 Farmakokinetické vlastnosti
Není relevantní.
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinické zkoušky bezpečnosti nebyly u této vakcíny provedeny.
6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek
Suspenze:
Dihydrát dihydrogenfosforečnanu sodného Dihydrát hydrogenfosforečnanu sodného Chlorid sodný
Voda na injekci
Šumivé granule:
Hydrogenuhličitan sodný Kyselina citrónová Uhličitan sodný Sodná sůl sacharinu Citronan sodný Malinová příchuť
6.2 Inkompatibility
Přípravek Dukoral se smí mísit pouze s dodávaným šumivým zrněným práškem rozpuštěným ve vodě. Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
3 roky.
Po rozpuštění šumivého zrněného prášku ve vodě a přidání suspenze vakcíny se směs musí vypít do dvou hodin.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem.
Přípravek v neotevřené lahvičce a sáčku uchovávaný v zevní krabičce je stabilní při teplotě do 25oC po dobu 14 dnů. Na konci tohoto období by měl být tento přípravek buď použit, anebo zlikvidován.
6.5 Druh obalu a obsah balení
3 ml suspenze vakcíny se plní do lahviček (ze skla typu I). Lahvička je opatřena pryžovou zátkou (bromobutylová pryž) a šroubovacím víčkem.
5.6 g šumivých granulí se plní do sáčků opatřených vnitřní polyesterovou/LD-polyetylénovou vrstvou a vnější aluminiovou/LD-polyetylénovou vrstvou.
Jedna dávka vakcíny se dodává společně s jedním sáčkem šumivých granulí.
Velikosti balení: 1x 1 dávka, 2x 1 dávka, 20x 1 dávka Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Šumivé granule je třeba rozpustit v přibližně 150 ml studené vody. Lahvičku s vakcínou je třeba jemně protřepat a suspenze vakcíny se potom přidá k roztoku pufru a dobře se smísí, aby vznikl bezbarvý, mírně zakalený roztok.
Děti ve věku 2 - 6 let: polovina roztoku pufru se vylije a zbývající část (přibližně 75 ml) se smísí s celým obsahem lahvičky vakcínou.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Valneva Sweden AB S-105 21 Stockholm Švédsko
+46 (0)8 735 1000 infodukoral@,valneva.com
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/03/263/001-003
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 28. dubna 2004
Datum posledního prodloužení registrace: 25. březen 2009
10. DATUM REVIZE TEXTU MM/RRRR
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/.
A. VÝROBCI BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ ZA
PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobců biologických léčivých látek
Valneva Sweden AB SE-105 21 Stockholm Švédsko
Cobra BioPharma Matfors AB Storjorden 2 SE-864 31 Matfors Švédsko
Název a adresa výrobce odpovědného za propouštění šarží
Valneva Sweden AB SE-105 21 Stockholm Švédsko
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
• Úřední propouštění sarzí
Podle článku 114 směrnice 2001/83/ES v pozdějším znění, bude úřední propouštění šarží provádět některá státní laboratoř nebo laboratoř k tomuto účelu určená.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
Držitel rozhodnutí o registraci je povinen informovat Evropskou komisi o plánu uvádění léčivého přípravku registrovaného tímto rozhodnutím na trh.
• Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Neuplatňuje se.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
DUKORAL - balení obsahující 1 dávku, balení obsahující 2x 1 dávku, balení obsahující 20x 1 dávku (vnější obal)
Obsahuje blue-box_
DUKORAL suspenze a šumivé granule pro perorální suspenzi. Vakcína proti choleře (inaktivovaná, perorální)
Léčivé látky: 1 dávka obsahuje
- 31,25x109 vibrií*každého z následujících kmenů V. cholerae O1: Inaba classicus (calore inactivatus), Inaba El Tor (formaldehydo inactivatus), Ogawa classicus (calore inactivatus), Ogawa classicus (formaldehydo inactivatus).
- Cholerae toxini B subunitas recombinans (r CTB) 1 mg.
* Počet vibrií před inaktivací.
Obsahuje sodík. Další informace najdete v příbalové informaci.
3 ml suspenze v lahvičce a 5,6 g šumivého zrněného prášku v sáčku. 1 dávka 2x 1 dávka 20x 1 dávka
Perorální podání.
Před použitím promíchejte vakcínu s pufrem. Před použitím si přečtěte příbalovou informaci.
Uchovávejte mimo dohled a dosah dětí.
Použitelné do: MM/RRRR
9 ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce. Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Valneva Sweden AB 105 21 Stockholm, Švédsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/03/263/001 1 dávka EU/1/03/263/002 2x 1 dávka EU/1/03/263/003 20x 1 dávka
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
DUKORAL
DUKORAL - balení obsahující 20x 1 dávku (vnitřní krabička obsahující 20 lahviček s vakcínou)
Neobsahuje blue-box
DUKORAL suspenze
Vakcína proti choleře (inaktivovaná, perorální)
Léčivé látky: 1 dávka obsahuje
- 31,25x109 vibrií*každého z následujících kmenů V. cholerae O1: Inaba classicus (calore inactivatus), Inaba El Tor (formaldehydo inactivatus), Ogawa classicus (calore inactivatus), Ogawa classicus (formaldehydo inactivatus).
- Cholerae toxini B subunitas recombinans (r CTB) 1 mg.
* Počet vibrií před inaktivací.
Obsahuje sodík. Další informace najdete v příbalové informaci.
3 ml suspenze v jedné lahvičce. 20x 1 dávka
Perorální podání.
Před použitím promíchejte vakcínu s pufrem. Před použitím si přečtěte příbalovou informaci.
Uchovávejte mimo dohled a dosah dětí.
Použitelné do: MM/RRRR
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce. Chraňte před mrazem.
10 ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Valneva Sweden AB 105 21 Stockholm, Švédsko
12 REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/03/263/003
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
Nevyžaduje se - odůvodnění přijato
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
DUKORAL - balení obsahující 20x 1 dávku (vnitřní krabička obsahující 20 sáčků s hydrogenuhličitanem sodným)
Neobsahuje modrou krabičku_
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
Hydrogenuhličitan sodný Šumivé granule
"2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje sodík. Další informace najdete v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
20x 5,6 g
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Určeno pro použití s přípravkem DUKORAL. Perorální podání.
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do: MM/RRRR
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
TI název a adresa držitele rozhodnutí o registraci
Valneva Sweden AB 105 21 Stockholm, Švédsko
T2. REGISTRAČNÍ CÍSLO/CÍSLA
EU/1/03/263/003
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
Nevyžaduje se - odůvodnění přijato
L NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
DUKORAL suspenze Perorální podání.
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
Použitelné do: MM/RRRR
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 dávka (3 ml)
6. JINÉ
L NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Hydrogenuhličitan sodný, šumivé granule Perorální podání.
"2. ZPŮSOB PODÁNÍ
Určeno pro použití s přípravkem DUKORAL. Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
Použitelné do: MM/RRRR 4 ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
5,6 g
6. JINÉ
Valneva Sweden AB, Švédsko
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele DUKORAL, suspenze a šumivé granule pro perorální suspenzi
Vakcína proti choleře (inaktivovaná, perorální)
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tuto vakcínu užívat, protože obsahuje pro Vás důležité informace
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
- Nezapomeňte vakcínu promíchat s roztokem pufru dle popisu v této příbalové informaci. Viz bod 3.
Co naleznete v této příbalové informaci
1. Co je přípravek Dukoral a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Dukoral používat
3. Jak se přípravek Dukoral používá
4. Možné nežádoucí účinky
5. Jak přípravek Dukoral uchovávat
6. Obsah balení a další informace
1. Co je přípravek Dukoral a k čemu se používá
Dukoral je perorální vakcína proti choleře, která stimuluje imunitní obranu ve střevech. Vakcína poskytuje ochranu proti choleře dospělým a dětem od dvou let věku.
Dukoral způsobuje tvorbu vlastní ochrany proti choleře ve Vašem těle. Po podání vakcíny bude Vaše tělo vytvářet látky označované jako protilátky, které bojují s bakteriemi cholery a toxinem, který způsobuje průjem.
2. Čemu musíte věnovat pozornost, než začnete přípravek Dukoral používat Nepoužívejte přípravek Dukoral
• jestliže jste alergický/á na kteroukoliv složku vakcíny (uvedenou v bodě 6) nebo na formaldehyd.
• jestliže trpíte akutní žaludeční poruchou nebo infekcí provázenou horečkou (vakcinaci je třeba odložit).
Upozornění a opatření
Před použitím přípravku Dukoral se poraďte se svým lékařem
• pokud užíváte léčivé přípravky, které ovlivňují imunitní systém,
• pokud trpíte onemocněním imunitního systému (včetně AIDS).
Vakcína Vám může poskytnout nižší úroveň ochrany než u osob se zdravým imunitním systémem.
Vakcína neposkytuje kompletní ochranu, je proto důležité dodržovat dietní a hygienické pokyny, aby nedošlo k výskytu průjmových onemocnění.
Děti
Nedávejte tuto vakcínu dětem mladším 2 let, protože ochrana u této věkové skupiny nebyla hodnocena.
Další léčivé přípravky a přípravek Dukoral
Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat. Neužívejte jiné léky 1 hodinu před a 1 hodinu po podání vakcíny.
Přípravek Dukoral s jídlem a pitím
Nejezte ani nepijte jednu hodinu před podáním vakcíny a jednu hodinu po podání vakcíny. Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tuto vakcínu užívat.
Řízení dopravních prostředků a obsluha strojů
Neexistují žádné důvody domnívat se, že přípravek Dukoral ovlivní Vaši schopnost řídit dopravní prostředky nebo obsluhovat stroje.
Dukoral obsahuje sodík
Přípravek Dukoral obsahuje přibližně 1,1 g sodíku v jedné dávce. Nutno vzít v úvahu u pacientů na dietě s nízkým obsahem sodíku.
3. Jak se přípravek Dukoral užívá
Vždy užívejte tuto vakcínu přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem.
Dospělí a děti od 6 let věku: základní vakcinaci tvoří 2 dávky užité perorálně (ústy) v intervalu minimálně 1 týdne (do 6 týdnů).
• Užijte první dávku ne později než dva týdny před Vaší cestou.
• Užijte druhou dávku minimálně jeden týden po první dávce a minimálně jeden týden před Vaší cestou.
Trvá asi 1 týden po poslední dávce, než nastoupí ochrana.
Pro trvalou ochranu se doporučuje revakcinace během 2 let. Pokud jste měl(a) svou poslední dávku vakcíny méně než před dvěma lety, jedna dávka Vaši ochranu obnoví. Pokud od poslední dávky vakcíny uplynula doba delší než 2 roky, je třeba zopakovat základní vakcinaci (2 dávky).
Děti ve věku od 2 do 6 let: základní vakcinaci tvoří 3 dávky užité perorálně (ústy) v intervalu minimálně 1 týden (do 6 týdnů). S vakcínou je třeba smísit pouze poloviční množství roztoku pufru.
• Podejte první dávku dítěti ne později než tři týdny před Vaší cestou.
• Podejte druhou dávku dítěti minimálně jeden týden po první dávce.
• Podejte třetí dávku dítěti minimálně jeden týden po druhé dávce a minimálně jeden týden před vaší cestou.
Trvá asi 1 týden po poslední dávce, než nastoupí ochrana.
Pro trvalou ochranu se doporučuje revakcinace během 6 měsíců. Pokud od poslední vakcinace uplynula doba kratší než 6 měsíců, jedna dávka ochranu obnoví. Pokud od poslední vakcinace uplynula doba delší než 6 měsíců, je třeba zopakovat základní vakcinaci (3 dávky).
Vakcína je bělavá suspenze dodávaná ve skleněných lahvičkách obsahujících jednu dávku. Každá dávka vakcíny se dodává s jedním sáčkem obsahujícím bílé šumivé granule hydrogenuhličitanu sodného. Šumivé granule se rozpustí ve sklenici studené vody a výsledný roztok pufru by se měl smísit s vakcínou. Je důležité používat roztok pufru, protože ochraňuje vakcínu před žaludečními kyselinami.
Vakcínu vypijte do 2 hodin po smísení s roztokem pufru.
1. Pro přípravu roztoku pufru rozpusťte šumivé granule ve sklenici studené vody (přibližně 150 ml).
Návod:
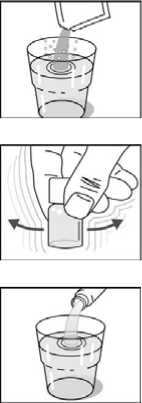
Nepoužívejte žádnou jinou tekutinu.
Děti ve věku od 2 do 6 let: vylijte polovinu roztoku pufru.
2. Protřepte lahvičku s vakcínou (1 lahvička = 1 dávka).
3. Přidejte vakcínu k roztoku pufru. Dobře promíchejte a směs vypijte.
Vakcínu vypijte během 2 hodin po smíchání s roztokem pufru. Jednu hodinu před a jednu hodinu po vakcinaci nic nejezte a nepijte.
Jestliže jste užil(
Jestliže užijete dávky s intervalem kratším než jeden týden, kontaktujte svého lékaře, lékárníka nebo zdravotní sestru.
Vzhledem k tomu, že jedna lahvička přípravku Dukoral obsahuje pouze jednu dávku, není předávkování pravděpodobné.
Pokud jste užil(a) více než jednu dávku najednou, obraťte se na svého lékaře, lékárníka nebo zdravotní sestru.
Jestliže jste zapomněl(a) užít přípravek Dukoral
Můžete užít druhou dávku přípravku Dukoral do 6 týdnů po první dávce (děti ve věku 2 až 6 let musí užít tři dávky). Pokud uplynulo více než 6 týdnů, obraťte se na svého lékaře, lékárníka nebo zdravotní sestru.
Máte-li jakékoliv další otázky týkající se užívání této vakcíny, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Dukoral nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Vyhledejte neprodleně lékaře, pokud se u Vás vyskytnou následující závažné nežádoucí účinky:
• Závažný průjem se ztrátou vody z těla.
• Závažné alergické reakce způsobující otok tváře nebo hrdla a dušnost.
Další nežádoucí účinky:
Méně časté nežádoucí účinky (mohou postihovat až 1 osobu ze 100)
• průjem, bolest žaludku, křeče v žaludku, plynatost, nadýmání a obecné žaludeční obtíže
• bolest hlavy
Vzácné nežádoucí účinky (mohou postihovat až 1 osobu z 1000)
• horečka
• celkový pocit nepohody, pocit závratě
• nauzea (nevolnost), zvracení, ztráta chuti k jídlu/nechutenství
• otok a dráždění v nose a kašel
Velmi vzácné nežádoucí účinky (mohou postihovat až 1 osobu z 10 000)
• vyrážka
• bolest v krku, snížená citlivost chuťových buněk
• únava, pocit únavy
• pocení, třes
• bolesti kloubů
• potíže se spánkem
Další nežádoucí účinky (četnost výskytu není možné z dostupných údajů odhadnout)
• chřipkové příznaky, obtíže s dýcháním, zimnice, celková bolest, slabost
• kopřivka, svědění
• zvětšení lymfatických uzlin
• necitlivost nebo brnění či mravenčení
• vysoký krevní tlak
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V1. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Dukoral uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte přípravek Dukoral po uplynutí doby použitelnosti uvedené na krabičce.
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
Přípravek v neotevřené lahvičce a sáčku uchovávaný v zevní krabičce je stabilní při teplotě do 25 oC po dobu 14 dnů. Na konci tohoto období by měl být tento přípravek buď použit, anebo zlikvidován.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Dukoral obsahuje
• Léčivými látkami jsou
31,25 x 109 vibrií1 každého z následujících kmenů V. cholerae O1: Inaba classicus (calore inactivatus), Inaba El Tor (formaldehydo inactivatus), Ogawa classicus (calore inactivatus), Ogawa classicus (formaldehydo inactivatus).
Cholerae toxini B subunitas recombinans (r CTB) 1 mg.
* Počet vibrií před inaktivací.
• Dalšími složkami jsou dihydrogenfosforečnan sodný, hydrogenfosforečnan sodný, chlorid sodný a voda na injekci.
Jak přípravek Dukoral vypadá a co obsahuje toto balení
Dukoral se dodává jako suspenze a šumivé granule pro přípravu perorální suspenze. Vakcína je bělavá suspenze dodávaná v lahvičce. Šumivé granule jsou bílé s malinovou příchutí a dodávají se v sáčku.
Dukoral je dodáván v balení po 1, 2 a 20 dávkách. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Valneva Sweden AB, 105 21 Stockholm, Švédsko infodukoral@valneva.com
Tato příbalová informace byla naposledy revidována MM/RRRR Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema. europa.eu.
Na webových stránkách Evropské agentury pro léčivé přípravky je tato příbalová informace k dispozici ve všech úředních jazycích EU/EHP.
27
Šumivé granule obsahují hydrogenuhličitan sodný, kyselinu citrónovou, uhličitan sodný, sodnou sůl sacharinu, citronan sodný a malinovou příchuť.