Cosopt Free Bez Konzervačních Přísad 20Mg/Ml+5Mg/Ml Oční Kapky, Roztok
zastaralé informace, vyhledat novějšíSp. zn. sukls164312/2014
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Cosopt FREE bez konzervačních přísad 20 mg/ml + 5 mg/ml oční kapky, roztok, jednodávkový obal
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml obsahuje dorzolamidi hydrochloridum 22,26 mg odpovídající dorzolamidum 20 mg a timololi maleas 6,83 mg odpovídající timololum 5 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Oční kapky, roztok, jednodávkový obal.
Čirý, bezbarvý až téměř bezbarvý, mírně viskózní roztok s hodnotou pH v rozmezí 5,5 až 5,8 a osmolaritou 242 až 323 mOsM.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Indikován k léčbě zvýšeného nitroočního tlaku u pacientů s glaukomem s otevřeným úhlem nebo s pseudoexfoliačním glaukomem, pokud je monoterapie lokálním betablokátorem nedostatečná.
4.2 Dávkování a způsob podání
Dávkování
Dávka je jedna kapka přípravku Cosopt FREE bez konzervačních přísad do (spojivkového vaku) postiženého oka (postižených očí) dvakrát denně.
Pokud se používá další lokální oftalmický přípravek, je nutno aplikovat přípravek Cosopt FREE bez konzervačních přísad a druhý lék v odstupu minimálně 10 minut.
Tento léčivý přípravek je sterilní roztok, který neobsahuje konzervační přísady. Roztok z jednoho jednodávkového obalu je nutno použít okamžitě po otevření obalu k aplikaci do postiženého oka (postižených očí). Protože není možno po otevření jednodávkového obalu zachovat sterilitu, je nutno okamžitě po aplikaci veškerý zbylý obsah zlikvidovat.
Pacienti musí být poučeni, aby si před použitím umyli ruce a aby se obal nedostal do kontaktu s okem nebo okolními tkáněmi, protože to může způsobit poranění oka (viz Pokyny kpoužití).
Pacienti musí být rovněž poučeni o tom, že oční roztoky mohou být při nesprávném zacházení kontaminovány běžnými bakteriemi, o kterých je známo, že způsobují oční infekce. Důsledkem použití znečištěných roztoků může být závažné poškození očí s následnou ztrátou zraku.
Systémovou absorpci lze snížit použitím nasolakrimální okluze nebo zavřením víček po aplikaci na dobu 2 minut. To opatření vede ke snížení systémových nežádoucích účinků a ke zvýšení místního účinku léčiva.
Protože jsou k dispozici různé formy jednodávkových obalů, pacient musí být informován o správném způsobu použití daného jednodávkového obalu. Viz prosím bod 6.6, kde naleznete příslušné obrázky a pokyny k použití.
Pediatrická populace
Účinnost u pediatrických pacientů nebyla stanovena.
Bezpečnost u pediatrických pacientů mladších 2 let nebyla stanovena. (Informace o bezpečnosti u pediatrických pacientů ve věku > 2 a < 6 let viz bod 5.1)
4.3 Kontraindikace
Přípravek Cosopt FREE bez konzervačních přísad je kontraindikován u pacientů s:
• reaktivním onemocněním dýchacích cest včetně astma bronchiale nebo astma bronchiale v anamnéze, nebo s těžkou formou chronické obstrukční plicní nemoci (CHOPN)
• sinusovou bradykardií, sick sinus syndromem, sinoatriální blokádou, atrioventrikulárním blokem druhého nebo třetího stupně nekontrolovanou pacemakrem, klinicky zjevným srdečním selháním, kardiogenním šokem
• těžkým poškozením ledvin (CrCl < 30 ml/min) nebo s hyperchloremickou acidózou
• hypersensitivitou na jednu nebo obě léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Výše uvedené kontraindikace vycházejí z jednotlivých složek a nejsou specifické pro tuto kombinaci.
4.4 Zvláštní upozornění a opatření pro použití
Reakce kardiovaskulárního systému/dýchacích cest
Stejně jako ostatní lokálně aplikované látky používané v oftamologii, i timolol je absorbován systémově. Vzhledem k betaadrenergnímu účinku timololu se mohou vyskytnout stejné typy kardiovaskulárních, plicních a ostatních nežádoucích účinků jako u systémových betablokátorů. Incidence systémových účinků v souvislosti s lokálním očním podáním je nižší, než u systémového podání. Opatření ke snížení systémové absorpce viz bod 4.2.
Srdeční poruchy:
U pacientů s kardiovaskulárním onemocněním (např. koronární onemocnění srdce, Prinzmetalova angina a srdeční selhání) a s antihypertenzní terapií systémovými betablokátory má být kriticky posouzena nutnost léčby očními betablokátory a má být zvážena terapie jinou léčivou látkou.
U pacientů s kardiovaskulárním onemocněním by měly být sledovány projevy zhoršení onemocnění a výskyt nežádoucích účinků.
Kvůli nežádoucímu vlivu betablokátorů na převodní čas se pacientům s AV blokem 1. stupně mají podávat betablokátory vždy s opatrností.
Cévní poruchy:
Pacienti s těžkou periferní cirkulační poruchou/nemocí (např. s těžkými formami Raynaudovy choroby nebo Raynaudova syndromu) mají být léčeni s opatrností.
Respirační poruchy:
U pacientů s astmatem byly v souvislosti s používáním některých očních betablokátorů hlášeny respirační nežádoucí účinky včetně úmrtí při bronchospasmu.
U pacientů s mírnou nebo středně těžkou formou chronické obstrukční plicní nemoci (CHOPN) má být přípravek Cosopt FREE bez konzervačních přísad používán s opatrností a pouze v případě, že potenciální prospěšnost léčby převyšuje její možná rizika.
Tento léčivý přípravek nebyl u pacientů s jatemím poškozením hodnocen, a proto musí být u takových pacientů používán s opatrností.
Imunologie a hypersenzitivita
Podobně jako u jiných lokálně aplikovaných oftalmických přípravků může u tohoto léčivého přípravku docházet k systémovému vstřebávání. Dorzolamid obsahuje sulfonamidovou skupinu, která se také objevuje v sulfonamidech. Proto se mohou při lokálním použití vyskytnout stejné typy nežádoucích reakcí jako při systémovém podání sulfonamidů, včetně závažných reakcí, jako je Stevens-Johnsonův syndrom a toxická epidermální nekrolýza. Pokud by se objevily příznaky závažných reakcí nebo hypersenzitivity, je nutno užívání přípravku přerušit.
Při aplikaci tohoto léčivého přípravku se vyskytly lokální nežádoucí účinky postihující oči, které se podobaly účinkům uváděným po použití očních kapek obsahujících dorzolamid-hydrochlorid. Jestliže se takové reakce objeví, je nutno zvážit vysazení přípravku Cosopt FREE bez konzervačních přísad.
Pacienti s atopií v anamnéze nebo těžkou formou anafylaktické reakce na různé alergeny v anamnéze, kterým jsou podávány betablokátory, mohou být zvýšeně reaktivní při opakovaném vystavení působení těchto alergenů a nemusí odpovídat na obvyklou léčbu anafylaktické reakce adrenalinem.
Souběžná léčba
Vliv na nitrooční tlak nebo známé účinky na systémovou betablokádu mohou být zesíleny v případě, že se timolol podá pacientům, kteří již užívají systémové betablokátory. Klinická odpověď u těchto pacientů má být podrobně sledována. Používání 2 topických betablokátorů současně se nedoporučuje (viz bod 4.5).
Podávání dorzolamidu a perorálních inhibitorů karboanhydrázy se nedoporučuje.
Vysazení léčby
Podobně jako u systémových betablokátorů je nutno v případě oftalmického timololu u pacientů s ischemickou chorobou srdeční ukončovat léčbu postupně.
Další účinky betablokátorů
Hypoglykemie/diabetes:
Pacientům se spontánní hypoglykemií nebo pacientům s labilním diabetem mají být podávány oční betablokátory s opatrností, protože mohou maskovat příznaky a známky akutní hypoglykemie.
Betablokátory mohou rovněž maskovat známky hyperthyroidismu. Náhlé vysazení léčby betablokátory může vést ke zhoršení příznaků.
Korneální poruchy
Oční betablokátory mohou vyvolat suchost očí. Pacienti s korneálním onemocněním mají být léčeni s opatrností.
Chirurgická anestezie
Oční betablokátory mohou blokovat systémové účinky betaagonistů, např. adrenalinu. Anesteziolog má být informován, jestli pacient používá timolol.
Léčba betablokátory může zhoršit příznaky myasthenie gravis.
Léčba perorálními inhibitory karboanhydrázy byla dávána do souvislosti s urolitiázou v důsledku poruchy acidobazické rovnováhy, zvláště u pacientů s ledvinovými kameny v anamnéze. Přestože při užívání přípravku Cosopt (s konzervačními přísadami) nebyly pozorovány žádné poruchy acidobazické rovnováhy, občas se objevily zprávy o urolitiáze. Protože přípravek Cosopt FREE bez konzervačních přísad obsahuje lokální inhibitor karboanhydrázy, který se vstřebává systémově, může u pacientů s ledvinovými kameny v anamnéze při užívání tohoto léčivého přípravku existovat nebezpečí rozvoje urolitiázy.
Jiné
Péče o pacienty s akutním glaukomem s uzavřeným úhlem vyžaduje kromě použití očních hypotenziv i léčebné zásahy. Tento léčivý přípravek nebyl u pacientů s akutním glaukomem s uzavřeným úhlem hodnocen.
U pacientů se stávajícími chronickými vadami rohovky a/nebo s nitrooční operací v anamnéze byl během užívání dorzolamidu popsán edém rohovky a ireverzibilní dekompenzace rohovky. U pacientů s nízkými počty endoteliálních buněk je ke vzniku edému rohovky zvýšený potenciál.
Při předepisování přípravku Cosopt FREE bez konzervačních přísad těmto skupinám pacientů je nutno přijmout bezpečnostní opatření.
Bylo hlášeno odchlípení chorioidey po filtračním zákroku při současném podání přípravků potlačujících tvorbu komorové tekutiny (např.timolol a acetazolamid).
Podobně jako při použití jiných antiglaukomatózních léků byla u některých pacientů po delší léčbě uváděna snížená reakce na oftalmický timolol-maleinát. V klinických studiích sledujících 164 pacientů po dobu minimálně tří let však nebyly po počáteční stabilizaci zjištěny žádné statisticky významné rozdíly v průměrném nitroočním tlaku.
Používání kontaktních čoček
Tento léčivý přípravek nebyl u pacientů používajících kontaktní čočky hodnocen.
Pediatrická populace Viz bod 5.1.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Žádné specifické klinické studie zaměřené na interakce s léčivou látkou nebyly provedeny.
V klinických studiích se tento léčivý přípravek bez prokázání nežádoucích interakcí používal současně s následujícími systémově působícími léky: ACE inhibitory, blokátory kalciových kanálů, diuretika, nesteroidní antirevmatika včetně kyseliny acetylsalicylové a hormony (např. estrogen, insulin, tyroxin).
Existuje možnost vzniku aditivního účinku vedoucího k hypotenzi a/nebo k výrazné bradykardii v případě současného podávání očních betablokátorů a perorálních blokátorů kalciových kanálů, betablokátorů, antiarytmik (včetně amiodaronu), digitalisových glykosidů, parasympatomimetik, guanethidinu, narkotik a inhibitorů monoaminooxidázy (IMAO).
Byla hlášena zesílená betablokáda (tj. snížená tepová frekvence, deprese) při současné léčbě CYP2D6 inhibitory (tj. quinidinem, fluoxetinem, paroxetinem) a timololem.
Přestože má samotný přípravek Cosopt FREE bez konzervačních přísad minimální nebo nulový účinek na velikost zornice, byly příležitostně hlášeny případy mydriázy, když byly oční betablokátory používány spolu s adrenalinem.
Betablokátory mohou zesílit hypoglykemický účinek antidiabetik.
Perorální betaadrenergní blokátory mohou zesílit „rebound“ hypertenzi, která se může objevit po vysazení klonidinu.
4.6 Fertilita, těhotenství a kojení
Přípravek Cosopt FREE bez konzervačních přísad se nesmí během těhotenství používat.
Dorzolamid
Klinické údaje o podávání během těhotenství nejsou k dispozici. U králíků vyvolal dorzolamid v dávkách toxických pro matku teratogenní účinek (viz bod 5.3).
Timolol
Nejsou k dispozici dostatečné údaje o podávání timololu těhotným ženám. Timolol nemá být podáván v těhotenství, pokud to není nezbytně nutné. Opatření ke snížení systémové absorpce, viz bod 4.2.
Epidemiologické studie s perorálně podávanými betablokátory neprokázaly malformativní účinky, ale bylo pozorováno riziko zpomalení intrauterinního růstu v případě perorálního podání betablokátorů. Navíc byly symptomy systémové blokády (tj. bradykardie, hypotenze, respirační tíseň, hypoglykemie) pozorovány u novorozenců, když byly betablokátory podávány matce až do doby porodu. Pokud je timolol podávána matce až do doby porodu, novorozenci mají být první den po narození pečlivě monitorováni..
Kojení
Není známo, zda se dorzolamid vylučuje do mateřského mléka. U kojících potkaních samic, jimž byl podáván dorzolamid, byl pozorován menší přírůstek tělesné hmotnosti potomků.
Betablokátory se vylučují do mateřského mléka. Avšak, při terapeutických dávkách timololu v očních kapkách je nepravděpodobné, že by bylo v mateřském mléce přítomno takové množství účinné látky, aby vyvolalo klinické projevy systémové betablokády u kojence. Opatření ke snížení systémové absorpce, viz bod 4.2. Pokud je doporučena léčba přípravkem Cosopt FREE bez konzervačních přísad, kojení se nedoporučuje.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje nebyly provedeny. Možné nežádoucí účinky, jako rozmazané vidění, mohou ovlivnit schopnost řídit vozidla a/nebo obsluhovat stroje.
4.8 Nežádoucí účinky
V klinických studiích byly pozorované nežádoucí příhody specifické pro přípravek Cosopt FREE bez konzervačních přísad konzistentní s nežádoucími účinky, které byly předtím hlášeny u dorzolamid-hydrochloridu a/nebo timolol-maleinátu.
Během klinických studií bylo přípravkem Cosopt (s konzervačními přísadami) léčeno celkem 1 035 pacientů. Přibližně 2,4 % všech pacientů léčbu očním roztokem přípravkuCosopt (s konzervačními přísadami) ukončilo kvůli lokálním očním nežádoucím reakcím; přibližně 1,2 % všech pacientů léčbu ukončilo kvůli lokálním nežádoucím reakcím připomínající alergii nebo hypersenzitivitu (jako je zánět víčka a konjuktivitida).
Ve srovnávací dvojitě zaslepené studii s opakovanou dávkou se ukázalo, že přípravek Cosopt FREE bez konzervačních přísad má podobný profil bezpečnosti jako přípravek Cosopt (s konzervačními přísadami).
Stejně jako ostatní lokálně aplikované látky používané v oftalmologii, i timolol je absorbován do systémového oběhu. Proto může působit podobné nežádoucí účinky, jako byly zaznamenány u systémových betablokátorů. Incidence systémových nežádoucích účinků v souvislosti s lokálním očním podáním je nižší než u systémového podání.
Po aplikaci přípravku Cosopt FREE bez konzervačních přísad nebo jedné z jeho složek byly buď v klinických studiích nebo po uvedení přípravku na trh popsány následující nežádoucí reakce:
[Velmi časté: (> 1/10), časté: (> 1/100, < 1/10), méně časté: (> 1/1 000, < 1/100), vzácné:
(> 1/10 000, < 1/1 000) a není známo (z dostupných údajů nelze určit)]
|
Třída orgánových systémů (MedDRA) |
Formulace |
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známo** |
|
Poruchy imunitního systému |
Cosopt FREE bez konzervační ch přísad |
známky a příznaky systémových alergických reakcí, včetně angioedému, kopřivky, pruritu, vyrážky, anafylaktické reakce | ||||
|
Timolol-maleinát oční kapky, roztok |
známky a příznaky systémových alergických reakcí, včetně angioedému, kopřivky, lokalizovaného a generalizovanéh o exantému, anafylaktické reakce | |||||
|
Poruchy metabolismu a výživy |
Timolol-maleinát oční kapky. roztok |
hypoglykemie | ||||
|
Psychiatrické poruchy |
Timolol-maleinát oční kapky. roztok |
deprese* |
insomnie*, noční můry*, ztráta paměti | |||
|
Poruchy nervového systému |
Dorzolamid hydrochlori d oční kapky, roztok |
bolest hlavy* |
závratě*, parestezie* |
|
Třída orgánových systémů (MedDRA) |
Formulace |
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známo** |
|
Timolol-maleinát oční kapky, roztok |
bolest hlavy* |
závratě*. synkopa* |
parestezie*. zvýšení výskytu známek a příznaků myasthenie gravis. snížené libido*. cerebrovaskulár ní příhoda*. mozková ischemie | |||
|
Poruchy oka |
Cosopt FREE bez konzervační ch přísad |
pálení a píchání |
infekce spojivek. rozostřené vidění. eroze rohovky. svědění oka. | |||
|
Dorzolamid hvdrochlori d oční kapky. roztok |
zánět víček*. podráždění víček* |
iridocyklitida * |
podráždění, včetně zarudnutí*. bolest*. šupinatění víček*. přechodná myopie (která po ukončení léčby vymizela). otok rohovky*. oční hypotonie*. odchlípení cévnatky (po filtračním zákroku)* | |||
|
Timolol-maleinát oční kapky, roztok |
známky a příznaky podráždění oka včetně blefaritidy*, keratitidy*, snížení citlivosti rohovky a pocit suchých očí* |
poruchy vidění, včetně změn lomu světla (v některých případech v důsledku vysazení miotické léčby)* |
ptóza. diplopie. odchlípnutí cévnatky po filtračním zákroku* (viz Zvláštní upozornění a opatření pro použití 4.4) |
zarudnutí. rozostřené vidění. eroze rohovky | ||
|
Poruchy ucha a lybrintu |
Timolol-maleinát oční kapky, roztok |
tinnitus* | ||||
|
Srdeční poruchy |
Timolol-maleinát oční kapky, roztok |
bradykardie* |
bolest na hrudi*. palpitace*. edém*. arytmie*. městnavé srdeční selhání*. srdeční zástava*. srdeční blok |
atrioventrikulá rní blok. srdeční selhání |
|
Třída orgánových systémů (MedDRA) |
Formulace |
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známo** |
|
Cévní poruchy |
Timolol-maleinát oční kankv, roztok |
hvnotenze*. klaudikace. Ravnaudův fenomén*. svndrom studených rukou a nohou* | ||||
|
Respirační, hrudní a mediastinální poruchy |
Cosont FREE bez konzervační ch nřísad |
sinusitida |
resnirační selhání. rhinitida. vzácně bronchosnasmus | |||
|
Dorzolamid hvdrochlori d oční kankv. roztok |
enistaxe* | |||||
|
Timolol-maleinát oční kankv, roztok |
dušnost* |
bronchosnasmus (převážně u pacientů s preexistující bronchosnastic-kou chorobou)*. respirační selhání. kašel* | ||||
|
Gastrointestiná lní poruchy |
Cosont FREE bez konzervační ch přísad |
dvsgeuz ie | ||||
|
Dorzolamid hvdrochlori d oční kankv. roztok |
nauzea* |
podráždění hrdla. sucho v ústech* | ||||
|
Timolol-maleinát oční kapky, roztok |
nauzea*. dvsnensie* |
průjem, sucho v ústech* |
dvsgeuzie bolest břicha. zvracení | |||
|
Poruchy kůže a podkožní tkáně |
Cosont FREE bez konzervační ch přísad |
kontaktní Stevens-Johnso nův svndrom. toxická enidermální nekrolýza | ||||
|
Dorzolamid hvdrochlori d oční kankv. roztok |
vyrážka* | |||||
|
Timolol-maleinát oční kapky, roztok |
alonecie*. nsoriaziformní exantém nebo exacerbace nsoriázv* |
kožní vyrážka |
|
Třída orgánových systémů (MedDRA) |
Formulace |
Velmi časté |
Časté |
Méně časté |
Vzácné |
Není známo** |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Timolol-maleinát oční kankv, roztok |
systémový lupus erythematosus |
myalgie | |||
|
Poruchy ledvin a močových cest |
Cosopt FREE bez konzervační ch přísad |
urolithiáza | ||||
|
Poruchy reprodukčního systému a prsu |
Timolol-maleinát oční kapky, roztok |
Peyronieova choroba*, snížené libido |
sexuální dysfunkce | |||
|
Celkové poruchy a reakce v místě aplikace |
Dorzolamid hydrochlori d oční kapkv. roztok |
astenie/únava * | ||||
|
Timolol-maleinát oční kapkv, roztok |
astenie/únava * |
* Tyto nežádoucí účinky byly pozorovány i po uvedení přípravku Cosopt (s konzervačními přísadami) na trh.
** Další nežádoucí účinky byly pozorovány u očních betablokátorů a mohou se vyskytnout po podání přípravku Cosopt FREE bez konzervačních přísad.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Žádné údaje ohledně předávkování náhodným nebo úmyslným požitím přípravku Cosopt (s konzervačními přísadami) nebo přípravku Cosopt FREE bez konzervačních přísad u lidí nejsou k dispozici.
Příznaky
Objevily se zprávy o neúmyslném předávkování oftalmickým roztokem timolol-maleinátu s výslednými systémovými účinky podobnými účinkům, pozorovaným po systémovém podání betaadrenergních blokátorů, jako jsou závratě, bolesti hlavy, dušnost, bradykardie, bronchospazmus a srdeční zástava. Nejčastějšími známkami a příznaky, které lze očekávat po předávkování dorzolamidem, jsou porucha elektrolytické rovnováhy, vznik acidotického stavu, případně účinky na centrální nervovou soustavu.
K dispozici je pouze omezené množství informací ohledně předávkování náhodným nebo úmyslným požitím dorzolamid-hydrochloridu u člověka. Při perorálním požití byla uváděna ospalost. Při lokální aplikaci byly popsány následující účinky: nevolnost, závratě, bolesti hlavy, únava, abnormální sny a dysfagie.
Léčba
Předávkování je nutno řešit symptomaticky a podpůrnou léčbou. Je třeba sledovat koncentrace elektrolytů (zvláště draslíku) v séru a hodnoty pH krve. Studie prokázaly, že timolol se nedialyzuje snadno.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiglaukotika a miotika - beta-blokátory - timolol, kombinace ATC kód: S01ED51
Mechanismus účinku
Přípravek Cosopt FREE bez konzervačních přísad sestává ze dvou složek: dorzolamid hydrochloridu a timolol-maleinátu. Každá z těchto dvou složek snižuje zvýšený nitrooční tlak omezením tvorby komorové vody; ale dochází k tomu různým mechanismem účinku.
Dorzolamid-hydrochlorid je účinný inhibitor lidské karboanhydrázy-II. Inhibice karboanhydrázy v ciliárních procesech oka snižuje sekreci komorové tekutiny, pravděpodobně zpomalením tvorby hydrogenuhličitanových iontů s následným snížením transportu sodíku a tekutin. Timolol-maleinát je neselektivním blokátor betaadrenergních receptorů. Přesný mechanismus účinku timolol-maleinátu při snižování nitroočního tlaku nebyl dosud stanoven, i když studie s použitím fluoresceinu a tomografické techniky naznačují, že hlavním účinkem by mohla být omezená tvorba komorové vody. V některých studiích však bylo však pozorováno i mírné zvýšení odtoku komorových tekutin. Kombinovaný účinek těchto dvou látek vede k většímu snížení nitroočního tlaku než při samostatné aplikaci každé složky.
Po lokální aplikaci snižuje přípravek Cosopt FREE bez konzervačních přísad zvýšený nitrooční tlak bez ohledu na to, zda souvisí nebo nesouvisí s glaukomem. Zvýšený nitrooční tlak je hlavním rizikovým faktorem v patogenezi postižení očních nervů a glaukomatózní ztráty zorného pole. Tento léčivý přípravek snižuje nitrooční tlak bez běžných nežádoucích účinků miotik, jako jsou noční slepota, akomodační spasmus a pupilární konstrikce.
Farmakodynamické účinky
Klinické účinky
Byly provedeny klinické studie v délce až 15 měsíců s cílem srovnat účinek přípravku Cosopt (s konzervačními přísadami) v dávkování dvakrát denně (ráno a před spaním) na snížení nitroočního tlaku s odděleně a v kombinaci podávaným 0,5% timololem a 2,0% dorzolamidem pacientům s glaukomem nebo oční hypertenzí, u kterých byla v těchto klinických hodnoceních souběžná léčba považována za vhodnou. To zahrnovalo jak neléčené pacienty, tak pacienty nedostatečně léčené timololem v monoterapii. Před zařazením do studie byla většina pacientů léčena lokálními betablokátory v monoterapii. V analýze kombinovaných studií byl účinek přípravku Cosopt (s konzervačními přísadami) 2 x denně na snižování nitroočního tlaku větší než při monoterapii buď 2% dorzolamidem 3 x denně nebo 0,5% timololem 2 x denně. Účinek přípravku Cosopt (s konzervačními přísadami 2 x denně na snižování nitroočního tlaku se rovnal účinku současné aplikace dorzolamidu 2 x denně a timololu 2 x denně. Účinek přípravku Cosopt (s konzervačními přísadami) 2 x denně na snižování nitroočního tlaku byl prokázán při měření v různých časových bodech přes den, přičemž tento účinek se zachoval v průběhu dlouhodobého podávání.
V dvojitě zaslepené studii s paralelní kontrolní skupinou s aktivní léčbou měl u 261 pacientů
se zvýšeným nitroočním tlakem > 22 mmHg v jednom oku nebo v obou očích přípravek Cosopt FREE bez konzervačních přísad účinek na snížení nitroočního tlaku rovnocenný účinku přípravku Cosopt (s konzervačními přísadami). Profil bezpečnosti přípravku Cosopt FREE bez konzervačních přísad byl podobný profilu bezpečnosti přípravku Cosopt (s konzervačními přísadami).
Pediatrická populace
Bylo provedeno tři měsíce trvající kontrolované klinické hodnocení, jehož primárním cílem bylo zdokumentování bezpečnosti 2% očního roztoku dorzolamid-hydrochloridu u dětí mladších 6 let.
V této studii byl v otevřeném uspořádání přípravek Cosopt (s konzervačními přísadami) podáván 30 pacientům ve věku méně než 6 let až 2 roky nebo více, jejichž nitrooční tlak nebyl pomocí monoterapie dorzolamidem nebo timololem odpovídajícím způsobem zvládán. Účinnost nebyla u těchto pacientů hodnocena. U této malé skupiny pacientů bylo podávání přípravku Cosopt
(s konzervačními přísadami) dvakrát denně obecně dobře snášeno, přičemž 19 pacientů dokončilo celou léčebnou kůru a 11 pacientů léčbu vysadilo kvůli chirurgickému zákroku, změně medikace nebo z jiných důvodů.
5.2 Farmakokinetické vlastnosti
Dorzolamid -hydrochlorid
Na rozdíl od perorálních inhibitorů karboanhydrázy umožňuje lokální aplikace dorzolamid-hydrochloridu, aby léčivá látka vyvíjela svůj účinek přímo v oku při podstatně nižších dávkách, a proto s menší systémovou expozicí. V klinických studiích to vedlo ke snížení nitroočního tlaku bez poruch acidobazické rovnováhy nebo změn v koncentracích elektrolytů, které jsou charakteristické pro perorální inhibitory karboanhydrázy.
Při lokální aplikaci se dorzolamid dostává do systémového oběhu. K vyhodnocení potenciálu k systémové inhibici karboanhydrázy po místní aplikaci byly měřeny koncentrace léčivé látky a metabolitů v červených krvinkách a v plazmě a inhibice karboanhydrázy v červených krvinkách. Při dlouhodobé aplikaci se dorzolamid hromadí v červených krvinkách v důsledku selektivní vazby na KA-II při současném zachování extrémně nízkých koncentrací léčivé látky. Mateřská léčivá látka vytváří jediný metabolit, N-desethyl, který inhibuje KA-II méně účinně než mateřská léčivá látka, ale inhibuje i méně aktivní izoenzym (KA-I). Metabolit se také hromadí v červených krvinkách, kde se primárně váže na KA-I. Dorzolamid se váže se střední intenzitou na proteiny v plazmě (přibližně z 33 %). Dorzolamid se primárně vylučuje v nezměněné podobě močí; metabolit se vylučuje močí rovněž. Po ukončení dávkování se dorzolamid vymývá z červených krvinek nelineárním způsobem; výsledkem je rychlý počáteční pokles koncentrace léčivé látky s následnou pomalejší fází vylučování s poločasem přibližně čtyř měsíců.
Pokud byl dorzolamid podáván perorálně ve snaze napodobit maximální systémovou expozici po dlouhodobé místní aplikaci do oka, bylo ustáleného stavu dosaženo do 13 týdnů. V ustáleném stavu nebyla v plazmě prakticky žádná volná léčivá látka ani metabolit; inhibice KA v červených krvinkách byla nižší, než se předpokládalo, že je nutná k farmakologickému účinku na funkci ledvin nebo dýchání. Podobné farmakokinetické účinky byly pozorovány po chronické místní aplikaci dorzolamid-hydrochloridu. Někteří starší pacienti s poškozením ledvin (odhadnutá hodnota CrCl 30-60 ml/min) vykazovali vyšší koncentrace metabolitů v červených krvinkách, tomuto nálezu však nebylo možno přiřadit žádné významné rozdíly v inhibici karboanhydrázy a z klinického hlediska významné systémové nežádoucí účinky.
Timolol-maleinát
Ve studii plazmatických koncentrací léčivé látky u šesti jedinců byla systémová expozice timololu stanovena po lokální aplikaci oftalmického roztoku timolol-maleinátu 0,5% dvakrát denně. Střední hodnota maximální plazmatické koncentrace po ranní aplikaci byla 0,46 ng/ml a po odpolední aplikaci činila 0,35 ng/ml.
5.3 Předklinické údaje vztahující se k bezpečnosti
Oční a systémový profil bezpečnosti jednotlivých složek je dobře doložen.
Dorzolamid
U králíků, kteří dostávali maternotoxické dávky dorzolamidu spojené s metabolickou acidózou, byly pozorovány malformace těl obratlů.
Timolol
Studie na zvířatech neprokázaly teratogenní účinek.
Navíc nebyly u zvířat léčených lokálně dorzolamid-hydrochloridem a timolol-maleinátem v oftalmickém roztoku ani se současně aplikovaným dorzolamid-hydrochloridem a timolol-maleinátem pozorovány žádné nežádoucí účinky na oči. Studie in vitro a in vivo s každou ze složek mutagenní potenciál neprokázaly. Při terapeutických dávkách přípravku Cosopt FREE bez konzervačních přísad se proto nepředpokládá významné riziko pro bezpečnost člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Hyetelosa Mannitol (E421)
Dihydrát citronanu sodného (E331)
Hydroxid sodný (E524) pro úpravu pH Voda na injekci
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky.
Přípravek Cosopt FREE nesmí být používán déle než 15 dní od prvního otevření sáčku. Po uplynutí této doby všechny nepoužité jednodávkové obaly zlikvidujte.
Otevřený jednodávkový obal po prvním použití okamžitě zlikvidujte.
6.4 Zvláštní opatření pro uchovávání
Neuchovávejte při teplotě nad 30 °C.
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
Přípravek Cosopt FREE bez konzervačních přísad se dodává v 0,2ml jednodávkových obalech z polyethylenu o nízké hustotě v hliníkových sáčcích obsahujících 15 jednodávkových obalů.
Velikosti balení:
30 x 0,2 ml (2 sáčky s 15 jednodávkovými obaly) 60 x 0,2 ml (4 sáčky s 15 jednodávkovými obaly)
120 x 0,2 ml (8 sáčků s 15 jednodávkovými obaly)
Pozn. K dispozici jsou různé formy jednodávkových obalů. Viz prosím bod 6.6 s příslušnými obrázky a pokyny k použití podle typu obalu.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky.
Pokyny k použití
Varianta 1
1. Otevřete hliníkový sáček, který obsahuje 15 jednodávkových obalů. V každém sáčku jsou tři stripy po 5 jednodávkových obalech. Na sáček napište datum prvního otevření.
2. Nejprve si umyjte ruce a pak odlomte jeden jednodávkový obal ze stripu a otočením otevřete horní část.


3. Zakloňte hlavu a stáhněte si mírně dolní víčko tak, aby mezi víčkem a okem vznikla mezera, jak je ukázáno na obrázku. Dbejte na to, aby se žádná část obalu nedotkla Vašeho oka, ani kdekoliv v okolí Vašeho oka.
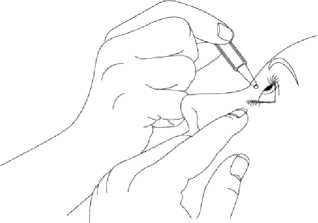
Pokud si nejste jistý(á), jak správně podat Váš lék, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Kápněte 1 kapku do postiženého oka (postižených očí) podle doporučení Vašeho lékaře. Nemrkejte při kapání kapek do oka.
Každý jednodávkový obal obsahuje dostatek roztoku pro obě oči.
5. Systémovou absorpci lze snížit použitím nasolakrimální okluze nebo zavřením víček po aplikaci na dobu 2 minut. Toto opatření vede ke snížení systémových nežádoucích účinků a ke zvýšení místního účinku léčiva.

6. Po nakapání použitý jednodávkový obal zlikvidujte, i když je v něm ještě zbytek roztoku, aby se zabránilo kontaminaci roztoku bez konzervančních látek.
7. Zbývající jednodávkové obaly uchovávejte v hliníkovém sáčku; tyto zbývající jednodávkové obaly je nutno použít do 15 dnů po otevření sáčku. Pokud Vám po 15 dnech zbývají v sáčku ještě nějaké jednodávkové obaly, tak musí být bezpečně zlikvidovány a musí být otevřen nový sáček. Je důležité, abyste pokračoval(a) v používání těchto očních kapek tak, jak Vám předepsal Váš lékař.
Varianta 2
1. Otevřete hliníkový sáček, který obsahuje 15 jednodávkových obalů. V každém sáčku jsou tři stripy po 5 jednodávkových obalech. Na sáček napište datum prvního otevření.
2. Nejprve si umyjte ruce a pak odlomte jeden jednodávkový obal ze stripu a otočením otevřete horní část.
Povšimněte si prosím, že otevřený jednodávkový obal má po obou stranách špičky „lamely“, jak ukazuje obrázek níže:
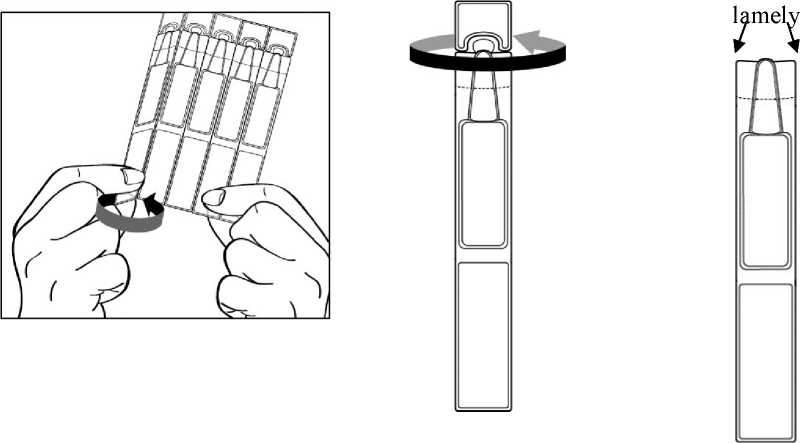
3. Držte jednodávkový obal tak, aby lamely po stranách obalu byly vodorovně s koutky Vašeho oka, jak je ukázáno níže na obrázku. Zakloňte hlavu a stáhněte si mírně dolní víčko tak, aby mezi víčkem a okem vznikla mezera, jak je ukázáno na obrázku. Dbejte na to, aby se žádná část obalu nedotkla Vašeho oka, ani kdekoliv v okolí Vašeho oka.
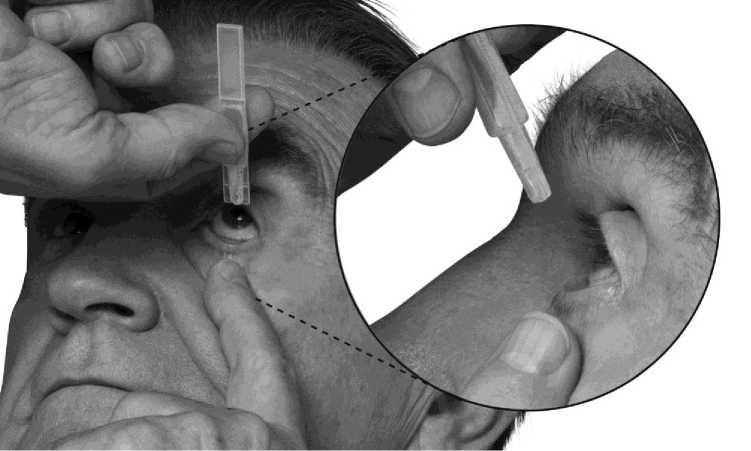
Pokud si nejste jistý(á), jak správně podat Váš lék, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Kápněte 1 kapku do postiženého oka (postižených očí) podle doporučení Vašeho lékaře. Nemrkejte při kapání kapek do oka.
Každý jednodávkový obal obsahuje dostatek roztoku pro obě oči.
5. Systémovou absorpci lze snížit použitím nasolakrimální okluze nebo zavřením víček po aplikaci na dobu 2 minut. Toto opatření vede ke snížení systémových nežádoucích účinků a ke zvýšení místního účinku léčiva.
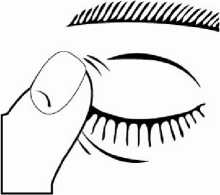
6. Po nakapání použitý jednodávkový obal zlikvidujte, i když je v něm ještě zbytek roztoku, aby se zabránilo kontaminaci roztoku bez konzervančních látek.
7. Zbývající jednodávkové obaly uchovávejte v hliníkovém sáčku; tyto zbývající jednodávkové obaly je nutno použít do 15 dnů po otevření sáčku. Pokud Vám po 15 dnech zbývají v sáčku ještě nějaké jednodávkové obaly, tak musí být bezpečně zlikvidovány a musí být otevřen nový sáček. Je důležité, abyste pokračoval(a) v používání těchto očních kapek tak, jak Vám předepsal Váš lékař.
Varianta 3
1. Otevřete hliníkový sáček, který obsahuje 15 jednodávkových obalů. V každém sáčku jsou tři stripy po 5 jednodávkových obalech. Na sáček napište datum prvního otevření.
2. Nejprve si umyjte ruce a pak odlomte jeden jednodávkový obal ze stripu a otočením otevřete horní část.
Povšimněte si prosím, že otevřený jednodávkový obal má po obou stranách špičky „lamely“, jak ukazuje obrázek níže:
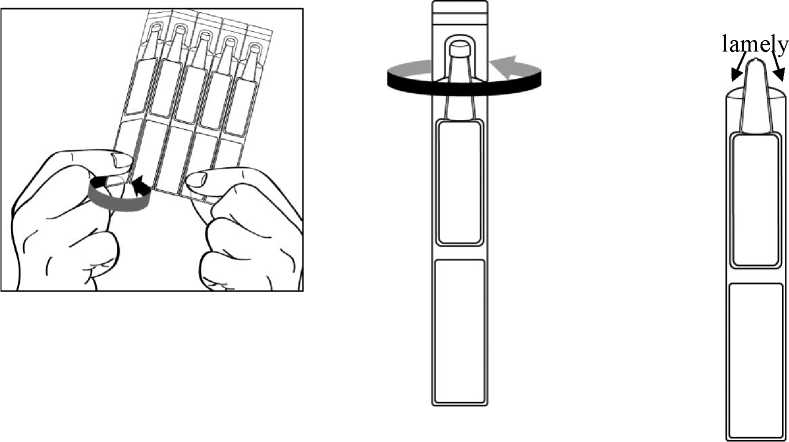
3. Držte jednodávkový obal tak, aby lamely po stranách obalu byly vodorovně s koutky Vašeho oka, jak je ukázáno níže na obrázku. Zakloňte hlavu a stáhněte si mírně dolní víčko tak, aby mezi víčkem a okem vznikla mezera, jak je ukázáno na obrázku. Dbejte na to, aby se žádná část obalu nedotkla Vašeho oka, ani kdekoliv v okolí Vašeho oka.

Pokud si nejste jistý(á), jak správně podat Váš lék, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Kápněte 1 kapku do postiženého oka (postižených očí) podle doporučení Vašeho lékaře. Nemrkejte při kapání kapek do oka.
Každý jednodávkový obal obsahuje dostatek roztoku pro obě oči.
5. Systémovou absorpci lze snížit použitím nasolakrimální okluze nebo zavřením víček po aplikaci na dobu 2 minut. Toto opatření vede ke snížení systémových nežádoucích účinků a ke zvýšení místního účinku léčiva.

6. Po nakapání použitý jednodávkový obal zlikvidujte, i když je v něm ještě zbytek roztoku, aby se zabránilo kontaminaci roztoku bez konzervančních látek.
7. Zbývající jednodávkové obaly uchovávejte v hliníkovém sáčku; tyto zbývající jednodávkové obaly je nutno použít do 15 dnů po otevření sáčku. Pokud Vám po 15 dnech zbývají v sáčku ještě nějaké jednodávkové obaly, tak musí být bezpečně zlikvidovány a musí být otevřen nový sáček. Je důležité, abyste pokračoval(a) v používání těchto očních kapek tak, jak Vám předepsal Váš lékař.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Merck Sharp & Dohme B.V.
Waarderweg 39 2031 BN Haarlem Nizozemsko
8. REGISTRAČNÍ ČÍSLO(A)
64/265/06-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 19.7.2006
Datum posledního prodloužení registrace: 10.12.2008
10. DATUM REVIZE TEXTU 30.11.2014