Convenia 80 Mg/Ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Convenia 80 mg/ml prášek a rozpouštědlo pro injekční roztok pro psy a kočky
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
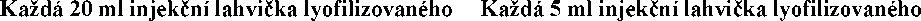
prášku obsahuje:
prášku obsahuje:
Léčivá látka:
340 mg Cefovecinum (ut natricum)
Léčivá látka:
852 mg Cefovecinum (ut natricum)
Excipiens:
19,17 mg methylparaben (E218) 2,13 mg propylparaben (E216)
Excipiens:
7,67 mg methylparaben (E218) 0,85 mg propylparaben (E216)
Každá 15 ml injekční lahvička rozpouštědla obsahuje:
Každá 10 ml injekční lahvička rozpouštědla obsahuje:
Excipiens:
13 mg/ml benzylalkohol
10,8 ml voda na injekci
Excipiens:
13 mg/ml benzylalkohol 4,45 ml voda na injekci
Po naředění podle pokynů na obalu injekční roztok obsahuje:
80,0 mg/ml Cefovecinum (ut natricum)
1,8 mg/ml methylparaben (E218)
0,2 mg/ml propylparaben (E216)
12,3 mg/ml benzylalkohol
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční roztok.
Prášek je šedobílý až žlutý a rozpouštědlo (solvens) je čirá, bezbarvá kapalina.
4. KLINICKÉ ÚDAJE
4.1 Cílové druhy zvířat
Psi a kočky.
4.2 Indikace s upřesněním pro cílový druh zvířat
K použití pouze pro následující infekce vyžadující prodlouženou léčbu. Antimikrobiální aktivita Convenia po jednorázové injekci trvá až 14 dnů.
Psi:
Na léčbu infekcí kůže a měkkých tkání včetně pyodermie, ran a abscesů vyvolaných Staphylococcus pseudintermedius, P-hemolytickými streptokoky, Escherichia coli a/nebo Pasteurella multocida.
Na léčbu infekcí močových cest vyvolaných Escherichia coli a/nebo Proteus spp.
Jako podpůrná léčba při mechanickém nebo chirurgickém parodontálním zákroku, při léčbě závažných infekcí dásní a parodontální tkáně vyvolaných Porphyromonas spp. a Prevotella spp. (Viz také bod 4.5 „Zvláštní opatření pro použití“.)
Kočky:
Na léčbu ran a abscesů v kůži a v měkkých tkáních spojených s Pasteurella multocida, Fusobacterium spp., Bacteroides spp., Prevotella oralis, P-hemolytickými streptokoky a/nebo Staphylococcus pseudintermedius.
Na léčbu infekcí močových cest vyvolaných Escherichia coli.
4.3 Kontraindikace
Nepoužívat v případě přecitlivělosti na cefalosporinová nebo penicilinová antibiotika.
Nepoužívat u malých býložravců (včetně morčat a králíků).
Nepoužívat u psů a koček mladších 8 týdnů.
4.4 Zvláštní upozornění pro každý cílový druh
Nejsou.
4.5 Zvláštní opatření pro použití
Zvláštní opatření pro použití u zvířat
Je rozumné ponechat třetí generaci cefalosporinů na léčbu klinických stavů, které měly slabou odezvu, nebo se očekává slabá odezva na ostatní skupiny antibiotik nebo na cefalosporiny první generace. Použití přípravku by mělo být na základě testu citlivosti a se zřetelem na místní antibiotickou politiku.
Základním požadavkem léčby onemocnění parodontu je mechanický a/nebo chirurgický zásah veterinárního lékaře.
Bezpečnost Convenia nebyla hodnocená u zvířat trpících závažnou dysfunkcí ledvin.
Pyoderma je často druhotná k výchozímu onemocnění. Proto je vhodné stanovit výchozí příčinu a podle toho zvíře léčit.
Obezřetnost by měla být věnována pacientům, kteří dříve prokázali reakce přecitlivělosti na cefovecin, jiné cefalosporiny, peniciliny nebo jiné léky. V případě alergické reakce, nepodávat další cefovecin a měla by být zavedena vhodná terapie pro přecitlivělost na beta-laktamy. Vážné akutní reakce přecitlivělosti mohou vyžadovat léčbu adrenalinem a další záchranná opatření, včetně kyslíku, intravenózních tekutin, intravenózního antihistaminu, kortikosteroidů a řízeného dýchání, pokud je klinicky indikováno. Veterináři by si měli být vědomi, že se alergické příznaky mohou znovu objevit po přerušení symptomatické léčby.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům
Peniciliny a cefalosporiny mohou způsobit přecitlivělost (alergii) následně po injekci, inhalaci, požití nebo kontaktu s pokožkou. Přecitlivělost k penicilinům může vést ke zkřížené reakci s cefalosporiny a opačně. Alergické reakce na tyto látky mohou být někdy vážné.
Nemanipulujte s tímto přípravkem, víte-li, že jste citliví nebo jste byli upozorněni, abyste nepracovali s těmito druhy přípravků.
Zacházejte s přípravkem opatrně, aby se zabránilo kontaktu s přípravkem, dodržujte všechna doporučená opatření.
Jestliže se následně po expozici přípravkem vyvinou příznaky jako je svědění pokožky, vyhledejte lékařskou pomoc a ukažte toto varování praktickému lékaři. Otoky obličeje, rtů nebo očí nebo obtíže při dýchání jsou vážnější příznaky a vyžadují okamžité lékařské ošetření.
Pokud víte, že jste citlivý na peniciliny nebo cefalosporiny, vyhněte se kontaktu s kontaminovaným odpadem. V případě kontaktu, umýt pokožku mýdlem a vodou.
4.6 Nežádoucí účinky (frekvence a závažnost)
Ve velmi ojedinělých případech byly pozorovány gastrointestinální příznaky včetně zvracení a/nebo průjmu.
Ve velmi ojedinělých případech byly zaznamenány neurologické příznaky a reakce v místě aplikace po podání přípravku.
4.7 Použití v průběhu březosti, laktace nebo snášky
Nebyla stanovena bezpečnost Convenia pro použití u fen a koček během březosti a laktace.
Léčena zvířata by se neměla používat pro reprodukci během 12 týdnů po posledním podání.
4.8 Interakce s dalšími léčivými přípravky a další formy interakce
Při současném používání jiných látek, které mají vysoký stupeň vazby na bílkoviny (např. furosemid, ketokonazol nebo nesteroidní protizánětlivé léky (NSAIDs)), může dojít k vazebné konkurenci s cefovecinem a tím k nežádoucím reakcím.
4.9 Podávané množství a způsob podání
Infekce kůže a měkkých tkání u psů:
Jednorázová subkutánní injekce 8 mg/kg živé hmotnosti (1 ml na 10 kg živé hmotnosti). Pokud je třeba, lze léčbu opakovat ve 14-ti denních intervalech celkově 3-krát. V souladu se správnou veterinární praxí by měla léčba pyodermie pokračovat i po úplném vymizení klinických příznaků.
Závažné infekce dásní a parodontální tkáně u psů:
Jednorázová subkutánní injekce 8 mg/kg živé hmotnosti (1 ml na 10 kg živé hmotnosti).
Rány a abscesy v kůži a měkkých tkáních u koček:
Jednorázová subkutánní injekce 8 mg/kg živé hmotnosti (1 ml na 10 kg živé hmotnosti). Pokud je třeba, další dávka může být podána 14 dnů po první injekci.
Infekce močových cest u psů a koček:
Jednorázová subkutánní injekce 8 mg/kg živé hmotnosti (1 ml na 10 kg živé hmotnosti).
Pro rozředění vezměte požadovaný objem dodaného rozpouštědla z injekční lahvičky (pro 20 ml injekční lahvičku obsahující 852 mg lyofilizovaného prášku použijte 10 ml rozpouštědla, pro 5 ml injekční lahvičku obsahující 340 mg lyofilizovaného prášku použijte 4 ml rozpouštědla) a přidejte do injekční lahvičky obsahující lyofilizovaný prášek. Injekční lahvičku protřepávejte dokud se prášek úplně nerozpustí.
|
Hmotnost zvířete (psi a kočky) |
Podávaný objem |
|
2,5 kg |
0,25 ml |
|
5 kg |
0,5 ml |
|
10 kg |
1,0 ml |
|
20 kg |
2,0 ml |
|
40 kg |
4,0 ml |
|
60 kg |
6,0 ml |
Pro zajištění správné dávky by měla být hmotnost zvířete stanovena co nejpřesněji, aby se předešlo poddávkování.
4.10 Předávkování (symptomy, první pomoc, antidota), pokud je to nutné
Opakované dávkování (8 podání) 5-násobku doporučené dávky ve 14-ti denních intervalech mladým psům bylo dobře tolerováno. Slabé a přechodné otoky v místě injekce byly pozorované po prvním a druhém podání. Jednorázová dávka 22,5násobku doporučené dávky způsobila přechodný edém a dráždění v místě vpichu.
Opakované dávkování (8 podání) 5-násobku doporučené dávky ve 14-ti denních intervalech mladým kočkám bylo dobře tolerováno. Jednorázová dávka 22,5násobku doporučené dávky způsobila přechodný edém a dráždění v místě vpichu.
4.11 Ochranné lhůty
Není určeno pro potravinová zvířata.
5. FARMAKOLOGICKÉ VLASTNOSTI
Farmakoterapeutická skupina: Antibiotika pro celkové použití (cefalosporiny).
ATCvet kód: QJ01DD91
5.1 Farmakodynamické vlastnosti
Cefovecin je cefalosporin třetí generace s širokým spektrem účinnosti proti gram-pozitivním a gram-negativním baktériím. Od jiných cefalosporinů se liší silnou vazbou na proteiny a dlouhodobým účinkem. Tak jako ostatní cefalosporiny, cefovecin inhibuje syntézu buněčné stěny - cefovecin má baktericidní účinek.
Cefovecin projevuje in-vitro účinnost proti Staphylococcuspseudintermedius a Pasteurella multocida, které jsou spojeny s infekcemi kůže u psů a koček. U anaerobních bakterií jako jsou Bacteroides spp. a Fusobacterium spp. izolované z abscesů u psů byla prokázána citlivost. U Porphyromonas gingivalis a Prevotella intermedia izolované z parodontálních onemocnění psů byla rovněž prokázána citlivost.
Navíc, cefovecin projevuje in-vitro účinnost proti Escherichia coli způsobující infekce močových cest u psů a koček.
In-vitro účinnost proti těmto patogenům, jakož i proti dalším patogenům kůže a močových cest izolovaných během evropského (Dánsko, Francie, Německo, Itálie a Velká Británie) průzkumu MIC (1999 - 2000) a během evropských (Francie, Německo, Španělsko a Velká Británie) terénních studií klinické účinnosti a bezpečnosti (2001 - 2003) je uvedena níže. Parodontální izoláty byly shromážděny během evropské (Francie a Belgie) terénní studie klinické účinnosti a bezpečnosti (2008).
1
|
Bakteriální patogen |
Původ |
Počet izolátů |
Cefovecin MIC (^g/ml) | |||
|
Min |
Max |
MIC501 |
MIC902 | |||
|
Staphylococcus pseudintermedius |
Pes Kočka |
226 44 |
<0,06 <0,06 |
8 8 |
0,12 0,12 |
0,25 0,25 |
|
P hemolytický Streptococcus spp. |
Pes Kočka |
52 34 |
<0,06 <0,06 |
16 1 |
<0,06 <0,06 |
0,12 0,12 |
|
Koaguláza negativní Staphylococcus spp.4 |
Kočka |
16 |
0,12 |
32 |
0,25 |
8 |
|
Staphylococcus aureus3 4 |
Pes4 Kočka 4 |
16 20 |
0,5 0,5 |
1 >32 |
1 1 |
1 16 |
|
Koaguláza positivní Staphylococcus 3, 4 spp. |
Pes4 Kočka 4 |
24 |
0,12 |
>32 |
0,25 |
0,5 |
|
Escherichia coli |
Pes Kočka |
167 93 |
0,12 0,25 |
>32 8 |
0,5 0,5 |
1 1 |
|
Pasteurella multocida |
Pes Kočka |
47 146 |
<0,06 <0,06 |
0.12 2 |
<0,06 <0,06 |
0,12 0,12 |
|
Proteus spp. |
Pes Kočka 4 |
52 19 |
0,12 0,12 |
8 0.25 |
0,25 0,12 |
0,5 0,25 |
|
Enterobacter spp.4 |
Pes4 Kočka 4 |
29 10 |
0,12 0,25 |
>32 8 |
1 2 |
>32 4 |
|
Klebsiella spp. 4 |
Pes4 Kočka 4 |
11 |
0,25 |
1 |
0,5 |
1 |
|
Prevotella spp. (2003 průzkum) |
Pes4 Kočka |
25 50 |
<0,06 <0,06 |
8 4 |
0,25 0,25 |
2 0,5 |
|
Fusobacterium spp. |
Kočka |
23 |
<0,06 |
2 |
0,12 |
1 |
|
Bacteroides spp. |
Kočka |
24 |
<0,06 |
8 |
0,25 |
4 |
|
Prevotella spp. (parodontální 2008) |
Pes |
29 |
<0,008 |
4 |
0,125 |
1 |
|
Porphyromonas spp. |
Pes |
272 |
<0,008 |
1 |
0,031 |
0,062 |
Nejnižší koncentrace, která úplně inhibuje viditelný růst nejméně 50 % izolátů
Nejnižší koncentrace, která úplně inhibuje viditelný růst nejméně 90 % izolátů
Některé z těchto patogenů (např. S. aureus) prokázaly přirozenou in vitro rezistenci na cefovecin
Klinická významnost těchto in vitro údajů nebyla prokázána.
2
3
4
Rezistence k cefalosporinům vyplývá z enzymatické inaktivace (produkce P-laktamázy), ze snížené propustnosti způsobené mutací porinu, nebo změny efluxu, nebo, vyselektováním málo afinitních penicilin vážících proteinů. Rezistence může být chromozomální nebo plazmid-kódující a může být přenesená pokud je spojená s transposony nebo plazmidy. Může být pozorována zkřížená rezistence s dalšími cefalosporiny a P-laktamovými antibakteriálními látkami.
Při aplikaci navrhovaného mikrobiologického break-pointu S < 2 ^g/ml nebyla zjištěna žádna rezistence k cefovecinu u terénních izolátů Pasteurella multocida, Fusobacterium spp. nebo Porphyromonas spp. Při aplikaci navrhovaného mikrobiologického break-pointu I < 4 ^g/ml, cefovecinová rezistence u
S.pseudintermedius a beta-hemolytických izolátů streptokoků byla nižší než 0,02 % a 3,4 % u izolátů
Prevotella intermedia. Procento cefovecin rezistentních izolátů E. coli, Prevotella oralis, Bacteroides spp. a Proteus spp. bylo 2,3 %, 2,7 %, 3,1 % a 1,4 %. Procento cefovecin rezistentních izolátů u koaguláza negativních stafylokoků (např. S. xylosus, S. schleiferi, S. epidermidis) je 9,5 %. Izoláty Pseudomonas spp., Enterococcus spp. a Bordetella bronchiseptica jsou přirozeně rezistentní na cefovecin.
5.2 Farmakokinetické údaje
Cefovecin má jedinečné farmakokinetické vlastnosti s mimořádně dlouhými biologickými poločasy u psů a koček.
U psů, když byl cefovecin podán jako jednorázová subkutánní dávka 8 mg/kg živé hmotnosti, bylo vstřebání rychlé a rozsáhlé; maximální koncentrace v plazmě byl po 6 hodinách 120 gg/ml a biologická dostupnost přibližně 99 %. Maximální koncentrace v tekutině tkáňových dutin 31,9 gg/ml byla naměřena 2 dny po podání. 14 dnů po podání byla průměrná koncentrace cefovecinu v plazmě 5,6 gg/ml. Vazba na plazmatické proteiny je vysoká (96,0 % až 98,7 %) a distribuční objem je nízký (0,1 l/kg). Biologický poločas je dlouhý - přibližně 5,5 dnů. Cefovecin je primárně vylučován ledvinami v nezměněné formě.
14 dní po podání byla koncentrace v moči 2,9 gg/ml.
U koček, když byl cefovecin podán jako jednorázová subkutánní dávka 8 mg/kg živé hmotnosti, bylo vstřebání rychlé a rozsáhlé; maximální koncentrace v plazmě byla po 2 hodinách 141 gg/ml a biologická dostupnost přibližně 99 %. 14 dnů po podání byla průměrná koncentrace cefovecinu v plazmě 18 gg/ml. Vazba na plazmatické proteiny je vysoká (více než 99 %) a distribuční objem je nízký (0,09 l/kg). Biologický poločas je dlouhý - přibližně 6,9 dnů. Cefovecin je primárně vylučován ledvinami v nezměněné formě. 10 a 14 dní po podání byla koncentrace v moči 1,3 gg/ml a 0,7 gg/ml. Po opakovaných podáních doporučené dávky byly pozorované zvýšené hladiny cefovecinu v plazmě.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Methylparaben (E218)
Propylparaben (E216)
Benzylalkohol Citronan sodný Kyselina citronová Hydroxid sodný (pro úpravu pH)
Kyselina chlorovodíková (pro úpravu pH)
Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto tento veterinární léčivý přípravek nesmí být mísen s žádnými dalšími veterinárními léčivými přípravky.
6.3 Doba použitelnosti
Doba použitelnosti veterinárního léčivého přípravku v neporušeném obalu: 3 roky Doba použitelnosti po rekonstituci podle návodu: 28 dnů.
Podobně jako u jiných cefalosporinů, barva naředěného roztoku může ztmavnout během této doby. Nicméně, pokud je uchováván jak je doporučeno, účinnost není ovlivněna.
6.4 Zvláštní opatření pro uchovávání
Před rekonstituci:
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
Uchovávejte v původním obalu aby byla chráněna před světlem.
Po rekonstituci:
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
Uchovávejte v původním obalu aby byla chráněna před světlem.
6.5 Druh a složení vnitřního obalu
Prášek:
Skleněná injekční lahvička typ I o objemu 5 ml nebo 20 ml s butylovou zátkou a hliníkovým uzávěrem. Rozpouštědlo:
Skleněná injekční lahvička typ I o objemu 10 ml nebo 15 ml s chlorbutylovou zátkou a hliníkovým uzávěrem.
Velikost balení: 1 injekční lahvička s práškem a 1 injekční lahvička s rozpouštědlem.
6.6 Zvláštní opatření pro zneškodňování nepoužitého veterinárního léčivého přípravku nebo odpadu, který pochází z tohoto přípravku
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z tohoto přípravku, musí být likvidován podle místních právních předpisů.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Zoetis Belgium SA Rue Laid Burniat 1 1348 Louvain-la-Neuve Belgie
8. REGISTRAČNÍ ČÍSLO(A)
EU/2/06/059/001 (20 ml injekční lahvička)
EU/2/06/059/002 (5 ml injekční lahvička)
9. DATUM REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum registrace: 19/06/2006
Datum posledního prodloužení: 15/06/2011
10. DATUM REVIZE TEXTU
Podrobné informace o veterinárním léčivém přípravku j sou k dispozici na webové stránce Evropské lékové agentury http://www.ema.europa.eu/.
ZÁKAZ PRODEJE, VÝDEJE A/NEBO POUŽITÍ
Neuplatňuje se.
A. DRŽITEL POVOLENÍ K VÝROBĚ ODPOVĚDNÝ ZA UVOLNĚNÍ ŠARŽE
B. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE NEBO POUŽITÍ
C. DEKLARACE HODNOT MRL
A. DRŽITEL POVOLENÍ K VÝROBĚ ODPOVĚDNÝ ZA UVOLNĚNÍ ŠARŽE
Jméno a adresa výrobce odpovědného za uvolnění šarže
Haupt Pharma Latina S.r.l.
S.S. 156 Km 47,600 04100 Borgo San Michele Latina Itálie
B. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE NEBO POUŽITÍ
Veterinární léčivý přípravek je vydáván pouze na předpis.
Držitel tohoto rozhodnutí o registraci musí informovat Evropskou komisi o marketingových plánech veterinárního přípravku povoleného tímto rozhodnutím.
C. DEKLARACE HODNOT MRL
Neuplatňuje se.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
|
PODROBNÉ ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ PAPÍROVÁ KRABICE (OBSAHUJÍCÍ INJEKČNÍ LAHVIČKU S LYOFILIZOVANÝM PRÁŠKEM A INJEKČNÍ LAHVIČKU S ROZPOUŠTĚDLEM) 20 ml injekční lahvička - 5 ml injekční lahvička | |
|
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU | |
Convenia 80 mg/ml prášek a rozpouštědlo pro injekční roztok pro psy a kočky Cefovecinum
Po naředění podle pokynů na obalu injekční roztok obsahuje: 80,0 mg/ml Cefovecinum (ut natricum)
1,8 mg/ml methylparaben (E218)
0,2 mg/ml propylparaben (E216)
12,3 mg/ml benzylalkohol
Prášek a rozpouštědlo pro injekční roztok.
10 ml (po rekonstituci) 4 ml (po rekonstituci)
Psi a kočky.
Pro některé infekce kůže, měkkých tkání, močového ústrojí a závažné parodontální infekce
Před použitím čtěte příbalovou informaci.
Před použitím čtěte příbalovou informaci.
EXP:
Po rekonstituci spotřebujte do 28 dnů. Datum spotřeby:
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte v původním obalu aby byla chráněna před světlem (před a po rekonstituci).
Zneškodňování odpadu: čtěte příbalovou informaci.
13. OZNAČENÍ „POUZE PRO ZVÍŘATA“ A PODMÍNKY NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ, POKUD JE JICH TŘEBA
Pouze pro zvířata. Veterinární léčivý přípravek je vydáván pouze na předpis.
Uchovávat mimo dosah dětí.
Zoetis Belgium SA Rue Laid Burniat 1 1348 Louvain-la-Neuve Belgie
EU/2/06/059/001
EU/2/06/059/002
Č.š.: {číslo}
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Convenia 80 mg/ml prášek pro injekční roztok pro psy a kočky
2. MNOŽSTVÍ LÉČIVÉ(ÝCH) LÁTKY(EK)
Každá injekční lahvička obsahuje 852 mg Cefovecinum.
3. OBSAH VYJÁDŘENÝ HMOTNOSTÍ, OBJEMEM NEBO POČTEM DÁVEK
10 ml (po rekonstituci)
4. CESTA PODÁNÍ
Pro subkutánní podání.
Před použitím čtěte příbalovou informaci.
5. OCHRANNÁ LHŮTA
6. ČÍSLO ŠARŽE
Č.š.:
7. DATUM EXSPIRACE
EXP: {mm/yyyy}
Po rekonstituci spotřebujte do 28 dnů. Datum spotřeby:
8. OZNAČENÍ „POUZE PRO ZVÍŘATA“
Pouze pro zvířata.
ETIKETA (15 ml INJEKČNÍ LAHVIČKA S ROZPOUŠTĚDLEM)_
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Rozpouštědlo pro Convenia
2. MNOŽSTVÍ OSTATNÍCH LÁTEK
13 mg/ml benzylalkoholu ve vodě na injekci
3. OBSAH VYJÁDŘENÝ HMOTNOSTÍ, OBJEMEM NEBO POČTEM DÁVEK
10 ml
4. CESTA PODÁNÍ
Před použitím čtěte příbalovou informaci.
5. OCHRANNÁ LHŮTA
6. ČÍSLO ŠARŽE
Č.š.: {číslo}
7. DATUM EXSPIRACE
EXP: {mm/yyyy}
8. OZNAČENÍ „POUZE PRO ZVÍŘATA“
Pouze pro zvířata.
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU_
Convenia 80 mg/ml prášek pro injekční roztok pro psy a kočky
2. MNOŽSTVÍ LÉČIVÉ(ÝCH) LÁTKY(EK)
340 mg Cefovecinum
3. OBSAH VYJÁDŘENÝ HMOTNOSTÍ, OBJEMEM NEBO POČTEM DÁVEK
4 ml (po rekonstituci)
4. CESTA PODÁNÍ
Pro subkutánní podání.
Před použitím čtěte příbalovou informaci.
5. OCHRANNÁ LHŮTA
6. ČÍSLO ŠARŽE
Č.š.: {číslo}
7. DATUM EXSPIRACE
EXP: {mm/yyyy}
Po rekonstituci spotřebujte do 28 dnů.
8. OZNAČENÍ „POUZE PRO ZVÍŘATA“
Pouze pro zvířata.
ETIKETA (10 ml INJEKČNÍ LAHVIČKA S ROZPOUŠTĚDLEM)_
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Rozpouštědlo pro Convenia
2. MNOŽSTVÍ OSTATNÍCH LÁTEK
13 mg/ml benzylalkoholu
3. OBSAH VYJÁDŘENÝ HMOTNOSTÍ, OBJEMEM NEBO POČTEM DÁVEK
4 ml
4. CESTA PODÁNÍ
Před použitím čtěte příbalovou informaci.
5. OCHRANNÁ LHŮTA
6. ČÍSLO ŠARŽE
Č.š.: {číslo}
7. DATUM EXSPIRACE
EXP: {mm/yyyy}
8. OZNAČENÍ „POUZE PRO ZVÍŘATA“
Pouze pro zvířata.
B. PŘÍBALOVÁ INFORMACE
PŘÍBALOVÁ INFORMACE PRO:
Convenia 80 mg/ml prášek a rozpouštědlo pro injekční roztok pro psy a kočky
1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
Držitel rozhodnutí o registraci:
Zoetis Belgium SA Rue Laid Burniat 1 1348 Louvain-la-Neuve Belgie
Výrobce odpovědný za uvolnění šarže:
Haupt Pharma Latina S.r.l.
S.S. 156 Km 47,600 04100 Borgo San Michele Latina Itálie
2. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Convenia 80 mg/ml prášek a rozpouštědlo pro injekční roztok pro psy a kočky Cefovecinum
3. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
Každá 20 ml injekční lahvička lyofilizovaného prášku obsahuje:
Léčivá látka:
852 mg Cefovecinum (ut natricum)
Excipiens:
19,17 mg methylparaben (E218)
2,13 mg propylparaben (E216)
Každá 15 ml injekční lahvička rozpouštědla obsahuje:
Excipiens:
13 mg/ml benzylalkohol
10.8 ml voda na injekci
Po naředění podle pokynů na obalu injekční ro: 80,0 mg/ml Cefovecinum (ut natricum)
1.8 mg/ml methylparaben (E218)
0,2 mg/ml propylparaben (E216)
12,3 mg/ml benzylalkohol
Každá 5 ml injekční lahvička lyofilizovaného prášku obsahuje:
Léčivá látka:
340 mg Cefovecinum (ut natricum)
Excipiens:
7,67 mg methylparaben (E218)
0,85 mg propylparaben (E216)
Každá 10 ml injekční lahvička rozpouštědla obsahuje:
Excipiens:
13 mg/ml benzylalkohol 4,45 ml voda na injekci
obsahuje:
4. INDIKACE
K použití pouze pro následující infekce vyžadující prodlouženou léčbu. Antimikrobiální aktivita Convenia po jednorázové injekci trvá až 14 dnů.
Psi:
Na léčbu infekcí kůže a měkkých tkání včetně pyodermie, ran a abscesů vyvolaných Staphylococcus pseudintermedius, P-hemolytickými streptokoky, Escherichia coli a/nebo Pasteurella multocida.
Na léčbu infekcí močových cest vyvolaných Escherichia coli a/nebo Proteus spp.
Jako podpůrná léčba při mechanickém nebo chirurgickém parodontálním zákroku při léčbě závažných infekcí dásní a parodontální tkáně vyvolaných Porphyromonas spp. a Prevotella spp. (Viz také bod 12 „Zvláštní upozornění - pro zvířata“.)
Kočky:
Na léčbu ran a abscesů v kůži a v měkkých tkáních spojených s Pasteurella multocida, Fusobacterium spp., Bacteroides spp., Prevotella oralis, P-hemolytickými streptokoky a/nebo Staphylococcus pseudintermedius.
Na léčbu infekcí močových cest vyvolaných Escherichia coli.
5. KONTRAINDIKACE
Nepoužívat v případě přecitlivělosti na cefalosporinová nebo penicilinová antibiotika. Nepoužívat u malých býložravců (včetně morčat a králíků).
Nepoužívat u psů a koček mladších 8 týdnů.
6. NEŽÁDOUCÍ ÚČINKY
Ve velmi ojedinělých případech byly pozorovány gastrointestinální příznaky včetně zvracení a/nebo průjmu.
Ve velmi ojedinělých případech byly zaznamenány neurologické příznaky a reakce v místě aplikace po podání přípravku.
Jestliže zaznamenáte jakékoliv závažné nežádoucí účinky či jiné reakce, které nejsou uvedeny v této příbalové informaci, oznamte to prosím vašemu veterinárnímu lékaři.
7. CÍLOVÝ DRUH ZVÍŘAT
Psi a kočky.
8. DÁVKOVÁNÍ PRO KAŽDÝ DRUH, CESTA(Y) A ZPŮSOB PODÁNÍ
Psi a kočky: 8 mg cefovecin/kg živé hmotnosti (1 ml/10 kg živé hmotnosti).
Dávkovači tabulka
|
Hmotnost zvířete (psi a kočky) |
Podávaný objem |
|
2,5 kg |
0,25 ml |
|
5 kg |
0,5 ml |
|
10 kg |
1,0 ml |
|
20 kg |
2,0 ml |
|
40 kg |
4,0 ml |
|
60 kg |
6,0 ml |
Pro rozředění vezměte požadovaný objem dodaného rozpouštědla z injekční lahvičky (pro 20 ml injekční lahvičku obsahující 852 mg lyofilizovaného prášku použijte 10 ml rozpouštědla, pro 5 ml injekční lahvičku obsahující 340 mg lyofilizovaného prášku použijte 4 ml rozpouštědla) a přidejte do injekční lahvičky obsahující lyofilizovaný prášek. Injekční lahvičku protřepávejte dokud se prášek úplně nerozpustí.
Infekce kůže a měkkých tkání u psů:
Jednorázová subkutánní injekce. Pokud je třeba, lze léčbu opakovat ve 14-ti denních intervalech celkově 3-krát. V souladu se správnou veterinární praxí by měla léčba pyodermie pokračovat i po úplném vymizení klinických příznaků.
Závažné infekce dásní a parodontální tkáně u psů:
Jednorázová subkutánní injekce 8 mg/kg živé hmotnosti (1 ml na 10 kg živé hmotnosti).
Rány a abscesy v kůži a měkkých tkáních u koček:
Jednorázová subkutánní injekce. Pokud je třeba, další dávka může být podána 14 dnů po první injekci.
Infekce močových cest u psů a koček:
Jednorázová subkutánní injekce.
9. POKYNY PRO SPRÁVNÉ PODÁNÍ
Pro zajištění správné dávky by měla být hmotnost zvířete stanovena co nejpřesněji, aby se předešlo poddávkování.
Studie kompatibility nejsou k dispozici, a proto tento veterinární léčivý přípravek nesmí být používán zároveň s jinými veterinárními léčivými přípravky.
Pyoderma je často druhotná k výchozímu onemocnění. Proto je vhodné stanovit výchozí příčinu a podle toho zvíře léčit.
10. OCHRANNÁ LHŮTA
Není určeno pro potravinová zvířata.
11. ZVLÁŠTNÍ OPATŘENÍ PRO UCHOVÁVÁNÍ
Uchovávat mimo dosah dětí.
Nepoužívejte tento veterinární léčivý přípravek po uplynutí doby použitelnost uvedené na krabičce .
Doba použitelnosti po rekonstituci podle návodu: 28 dnů.
Podobně jako u jiných cefalosporinů, barva naředěného roztoku může ztmavnout během této doby. Nicméně, pokud je uchováván jak je doporučeno, účinnost není ovlivněna.
Před rekonstituci:
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
Uchovávejte v původním obalu aby byla chráněna před světlem.
Po rekonstituci:
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
Uchovávejte v původním obalu aby byla chráněna před světlem.
12. ZVLÁŠTNÍ UPOZORNĚNÍ
Zvláštní opatření pro použití u zvířat:
Je rozumné ponechat třetí generaci cefalosporinů na léčbu klinických stavů, které měly slabou odezvu, nebo se očekává slabá odezva na ostatní skupiny antibiotik nebo na cefalosporiny první generace. Použití přípravku by mělo být na základě testu citlivosti a se zřetelem na místní antibiotickou politiku.
Základním požadavkem léčby onemocnění parodontu je mechanický a/nebo chirurgický zásah veterinárního lékaře.
Nebyla stanovena bezpečnost Convenia pro použití u fen a koček během březosti a laktace. Léčena zvířata by se neměla používat pro reprodukci během 12 týdnů po posledním podání.
Bezpečnost Convenia nebyla hodnocená u zvířat trpících závažnou dysfunkcí ledvin.
Obezřetnost by měla být věnována pacientům, kteří dříve prokázali reakce přecitlivělosti na cefovecin, jiné cefalosporiny, peniciliny nebo jiné léky. V případě alergické reakce, nepodávat další cefovecin a měla by být zavedena vhodná terapie pro přecitlivělost na beta-laktamy. Vážné akutní reakce přecitlivělosti mohou vyžadovat léčbu adrenalinem a další záchranná opatření, včetně kyslíku, intravenózních tekutin, intravenózního antihistaminu, kortikosteroidů a řízeného dýchání, pokud je klinicky indikováno. Veterináři by si měli být vědomi, že se alergické příznaky mohou znovu objevit po přerušení symptomatické léčby.
Při současném používání jiných látek, které mají vysoký stupeň vazby na bílkoviny (např. furosemid, ketokonazol nebo nesteroidní protizánětlivé léky (NSAIDs)), může dojít k vazebné konkurenci s cefovecinem a tím k nežádoucím reakcím.
Opakované dávkování (8 podání) 5-násobku doporučené dávky ve 14-ti denních intervalech mladým psům bylo dobře tolerováno. Slabé a přechodné otoky v místě injekce byly pozorované po prvním a druhém podání. Jednorázová dávka 22,5násobku doporučené dávky způsobila přechodný edém a dráždění v místě vpichu.
Opakované dávkování (8 podání) 5-násobku doporučené dávky ve 14-ti denních intervalech mladým kočkám bylo dobře tolerováno. Jednorázová dávka 22,5násobku doporučené dávky způsobila přechodný edém a dráždění v místě vpichu.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům:
Peniciliny a cefalosporiny mohou způsobit přecitlivělost (alergii) následně po injekci, inhalaci, požití nebo kontaktu s pokožkou. Přecitlivělost k penicilinům může vést ke zkřížené reakci s cefalosporiny a opačně. Alergické reakce na tyto látky mohou být někdy vážné.
Nemanipulujte s tímto přípravkem, víte-li, že jste citliví nebo jste byli upozorněni, abyste nepracovali s těmito druhy přípravků.
Zacházejte s přípravkem opatrně, aby se zabránilo kontaktu s přípravkem, dodržujte všechna doporučená opatření.
Jestliže se následně po expozici přípravkem vyvinou příznaky jako je svědění pokožky, vyhledejte lékařskou pomoc a ukažte toto varování praktickému lékaři. Otoky obličeje, rtů nebo očí nebo obtíže při dýchání jsou vážnější příznaky a vyžadují okamžité lékařské ošetření.
Pokud víte, že jste citlivý na peniciliny nebo cefalosporiny, vyhněte se kontaktu s kontaminovaným odpadem. V případě kontaktu, umýt pokožku mýdlem a vodou.
13. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z tohoto přípravku, musí být likvidován podle místních právních předpisů.
14. DATUM POSLEDNÍ REVIZE PŘÍBALOVÉ INFORMACE
Podrobné informace o veterinárním léčivém přípravku j sou k dispozici na webové stránce Evropské lékové agentury http://www.ema.europa.eu/.
15. DALŠÍ INFORMACE
Cefovecin je cefalosporin třetí generace s širokým spektrem účinnosti proti gram-pozitivním a gram-negativním baktériím. Od jiných cefalosporinů se liší silnou vazbou na proteiny a dlouhodobým účinkem. Tak jako ostatní cefalosporiny, cefovecin inhibuje syntézu buněčné stěny - cefovecin má baktericidní účinek.
Cefovecin projevuje in-vitro účinnost proti Staphylococcuspseudintermedius a Pasteurella multocida, které jsou spojeny s infekcemi kůže u psů a koček. U anaerobních bakterií jako jsou Bacteroides spp. a Fusobacterium spp. izolované z abscesů u psů byla prokázána citlivost. U Porphyromonas gingivalis a Prevotella intermedia izolované z parodontálních onemocnění psů byla rovněž prokázána citlivost.
Navíc, cefovecin projevuje in-vitro účinnost proti Escherichia coli způsobující infekce močových cest u psů a koček.
Rezistence k cefalosporinům vyplývá nejčastěji z enzymatické inaktivace (produkce P-laktamázy) nebo dalších mechanizmů. Rezistence může být chromozomální nebo plazmid-kódující a může být přenosná pokud je spojená s transposony nebo plazmidy. Může být pozorována zkřížená rezistence s dalšími cefalosporiny a P-laktamovými antibakteriálními látkami. Při aplikaci navrhovaného mikrobiologického break-pointu S < 2 pg/ml nebyla zjištěna žádna rezistence k cefovecinu u terénních izolátů Pasteurella multocida, Fusobacterium spp. a Porphyromonas spp. Při aplikaci navrhovaného mikrobiologického break-pointu I < 4 pg/ml, cefovecinová rezistence u S. pseudintermedius a beta-hemolytických izolátů streptokoků byla nižší než 0,02 % a 3,4 % u izolátů Prevotella intermedia. Procento cefovecin rezistentních izolátů E. coli, Prevotella oralis, Bacteroides spp. a Proteus spp. bylo 2,3 %, 2,7 %, 3,1 % a 1,4 %. Procento cefovecin rezistentních izolátů u koaguláza negativních stafylokoků (např. S. xylosus,
S. schleiferi, S. epidermidis) je 9,5 %. Izoláty Pseudomonas spp., Enterococcus spp. a Bordetella bronchiseptica jsou přirozeně rezistentní na cefovecin.
Cefovecin má jedinečné farmakokinetické vlastnosti s mimořádně dlouhými biologickými poločasy u psů a koček.
Přípravek je k dostání ve velikosti balení buď 5 ml nebo 20 ml složené z injekční lahvičky obsahující lyofilizovaný prášek a z druhé injekční lahvičky obsahující rozpouštědlo. Po naředění vznikne buď 4 ml nebo 10 ml injekčního roztoku. Na trhu nemusí být všechny velikosti balení.
Pokud chcete získat informace o tomto veterinárním léčivém přípravku, kontaktujte prosím příslušného místního zástupce držitele rozhodnutí o registraci.
Belgie/Belgique/Belgien Lietuva
Zoetis Belgium SA Zoetis Lietuva UAB
Tél/Tel.: +32 (0)2 746 81 78 Tel: +370 525 12029
Peny6nHKa Btnrapnn
Zoetis Luxembourg Holding Sarl Tem +359 2 970 41 72
Česká republika
Zoetis Česká republika, s.r.o.
Tel: +420 283 004 111
Danmark
Orion Pharma Animal Health Tlf: +45 49 12 67 65
Deutschland
Zoetis Deutschland GmbH Tel: +49 30 330063 0
Eesti
Zoetis Lietuva UAB Tel: +370 525 12029
EkkáSa
Zoetis Hellas S.A.
TqT..: +30 210 6785800
Espaňa
Zoetis Spain, S.L.
Tel: +34 91 4909900
France
Zoetis France
Tél: +33 (0)1 58 07 46 00
Hrvatska
Zoetis Netherlands Holdings BV Tel: +385 1 644 1460
Luxembourg
Zoetis Belgium SA Tél/Tel.: +32 (0)2 746 81 78
Magyarország
Zoetis Hungary Kft.
Tel: +361 488 3695
Malta
Agrimed Limited Tel: +356 21 465 797
Nederland
Zoetis B.V.
Tel: +31 (0)10 4064 600 Norge
Orion Pharma Animal Health Tlf: +47 40 00 41 90
Osterreich
Zoetis Osterreich GmbH Tel: +43 1 2701100 110
Polska
Zoetis Polska Sp. z o.o.
Tel: +48 22 335 61 40
Portugal
Zoetis Portugal, Lda.
Tel: +351 21 423 55 00
Románia
Zoetis Románia SRL Tel: +40 21 207 17 70
Slovenija
Ireland
Zoetis Ireland Limited Tel: +353 (0) 1 467 6650
Zoetis Luxembourg Holding Sarl Tel: +386 (0) 1 52 11 670
|
Island Icepharma hf. Sími: +354 540 80 00 |
Slovenská republika Zoetis Luxembourg Holding Sarl, o.z Tel: +421 2 5939 6190 |
|
Italia Zoetis Italia S.r.l. Tel: +39 06 3366 8133 |
Suomi/Finland Zoetis Finland Oy Puh/Tel: +358 (0)9 4300 40 |
|
Kúnpoq Zoetis Hellas S.A. TqA.: +30 210 6785800 |
Sverige Orion Pharma Animal Health Tel: +46 (0)8 623 64 40 |
|
Latvija Zoetis Lietuva UAB Tel: +370 525 12029 |
United Kingdom Zoetis UK Limited Tel: +44 (0) 845 300 8034 |
26