Colobreathe 1 662 500 Iu
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Colobreathe 1 662 500 IU, prášek k inhalaci v tvrdé tobolce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tobolka obsahuje colistimethatum natricum 1 662 500 IU, což se přibližně rovná 125 mg.
3. LÉKOVÁ FORMA
Prášek k inhalaci v tvrdé tobolce (prášek k inhalaci)
Tvrdé průhledné želatinové tobolky obsahující jemný bílý prášek.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Colobreathe je indikován k léčbě chronických plicních infekcí způsobených bakterií Pseudomonas aeruginosa u pacientů s cystickou fibrózou (CF) ve věku 6 let a starších (viz bod 5.1). Je třeba vzít v úvahu oficiální doporučení pro správné používání antibakteriálních látek.
4.2 Dávkování a způsob podání
Dávkování
Dospělí a děti ve věku 6 let a starší Jedna tobolka k inhalaci dvakrát denně.
Interval dávky má být co nejblíže 12 hodinám.
Účinnost přípravku Colobreathe byla prokázána ve studii trvající 24 týdnů. Léčba může pokračovat tak dlouho, dokud lékař neusoudí, že pacient dosáhl klinického přínosu
Porucha funkce ledvin
Úprava dávky není považována za nutnou (viz bod 5.2).
Porucha funkce jater
Úprava dávky není považována za nutnou (viz bod 5.2).
Pediatrická populace
Bezpečnost a účinnost přípravku Colobreathe u dětí mladších 6 let nebyla stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Pouze k inhalačnímu podání.
Tobolky přípravku Colobreathe se používají pouze pomocí práškového inhalátoru Turbospin.
Tobolky se nesmí polykat.
Pro zajištění správného podávání léčivého přípravku je nutné, aby lékař nebo jiný zdravotnický pracovník pacientovi ukázal, jak používat inhalátor. První dávku je nutné podat pod dohledem lékaře. Pokud jsou využívány další způsoby léčby, mají být používány v následujícím pořadí:
Inhalační bronchodilatancia Respirační fyzioterapie
Jiné inhalační léčivé přípravky Přípravek Colobreathe
4.3 Kontraindikace
Hypersenzitivita na léčivou látku, kolistin-sulfát nebo polymyxin B.
4.4 Zvláštní upozornění a opatření pro použití
Bronchospasmus a kašel
Při inhalaci může dojít k bronchospasmu nebo kašli. Tyto reakce obvykle vymizí nebo se výrazně zmírní s pokračujícím používáním a mohou se zlepšit vhodnou léčbou pomocí beta2-agonistů před nebo následně po inhalaci suchého prášku sodné soli kolistimethátu. Pokud bronchospasmus nebo kašel zůstávají nadále problematické, je třeba zvážit vysazení léčby.
Hemoptýza
Hemoptýza je komplikace u cystické fibrózy a je častější u dospělých. Použití sodné soli kolistimethátu u pacientů s klinicky významnou hemoptýzou se musí provádět, nebo v něm pokračovat, pouze v případě, že přínos léčby převýší riziko vyvolání dalšího krvácení.
Akutní respirační exacerbace
Dojde-li k akutní respirační exacerbaci, je třeba zvážit doplňující intravenózní nebo perorální léčbu antibiotiky.
Orální mykotická superinfekce
Po každé inhalaci přípravku Colobreathe je třeba ústa vypláchnout vodou. Výplach se nesmí polykat. Vypláchnutí může snížit riziko rozvoje orální mykotické superinfekce během léčby a může rovněž snížit nepříjemnou pachuť spojenou se sodnou solí kolistimethátu.
Nefrotoxicita/neurotoxicita
Po inhalaci přípravku Colobreathe dochází k velmi nízké transpulmonální absorpci kolistimethátu (viz bod 5.2). U pacientů, u nichž je známo, že mají sklon k nefrotoxickým nebo neurotoxickým účinkům, je nutné při podávání přípravku Colobreathe i nadále dbát opatrnosti.
Při souběžném použití přípravku Colobreathe a sodné soli kolistimethátu podávané parenterálně či v nebulizované formě je nutné dbát opatrnosti.
Při souběžném použití sodné soli kolistimethátu a potenciálně nefrotoxických či neurotoxických léčivých přípravků, včetně nedepolarizujících myorelaxancií (viz bod 4.5) je třeba dbát opatrnosti.
Jiné
Přípravek Colobreathe je třeba používat extrémně opatrně u pacientů s onemocněním myasthenia gravis, protože může způsobit lékem vyvolanou neuromuskulární blokádu.
U pacientů s porfyrií je třeba používat sodnou sůl kolistimethátu s extrémní opatrností.
Bezpečnost a účinnost byla hodnocena v kontrolovaných studiích po dobu až 24 týdnů (viz bod 5.1).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nejsou žádné zkušenosti s užíváním přípravku Colobreathe souběžně s jinými inhalačními antibakteriálními látkami.
Při souběžném použití s dalšími léčivými přípravky na bázi kolistimethátu sodného je nutné dbát opatrnosti, neboť je málo zkušeností a existuje možnost sumativní toxicity.
Nebyly provedeny žádné studie interakcí in vivo.
Sodná sůl kolistimethátu a kolistin byly zkoumány in vitro ke stanovení vlivu na expresi enzymů cytochromu P450 (CYP) na primárních kulturách čerstvých lidských hepatocytů. Léčba sodnou solí kolistimethátu ani kolistinem neindukuje aktivitu žádného testovaného enzymu (CYP1A2, 2B6, 2C8, 2C9, 2C19 a 3A4/5).
Při souběžném používání sodné soli kolistimethátu v inhalační formě s dalšími léčivými přípravky, které j sou potenciálně neurotoxické nebo nefrotoxické, j ako j sou například aminoglykosidy nebo neuromuskulární blokátory (např. kurariformní látky), je třeba dbát opatrnosti..
Souběžná léčba sodnou solí kolistimethátu a makrolidy, jako je azithromycin a klarithomycin, nebo fluorochinolony, jako je norfloxacin a ciprofloxacin, se má u pacientů s onemocněním myasthenia gravis provádět opatrně (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Údaje o podávání sodné soli kolistimethátu v inhalační formě těhotným ženám jsou omezené nebo nejsou k dispozici. Studie se zvířaty při parenterálním podávání prokázaly reprodukční toxicitu (viz bod 5.3). Studie intravenózního podávání jedné dávky během těhotenství u člověka prokázaly, že sodná sůl kolistimethátu prochází přes placentu, a existuje tedy potenciál pro fetální toxicitu při podávání léku během těhotenství.
Podávání sodné soli kolistimethátu se v těhotenství a u žen ve fertilním věku, které nepoužívají antikoncepci, nedoporučuje.
Kojení
Fyzikálně- chemické údaje naznačují vylučování sodné soli kolistimethátu sodného do lidského mateřského mléka. Riziko pro kojené novorozence /děti nelze vyloučit. Je třeba provést rozhodnutí, zda ukončit kojení nebo ukončit/vynechat léčbu sodnou solí kolistimethátu a zohlednit přínos kojení pro dítě oproti přínosu léčby kolistimethátem pro matku.
Fertilita
Sodná sůl kolistimethátu nemá patrné účinky na fertilitu samců ani samic potkanů nebo myší.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Na základě bezpečnostního profilu sodné soli kolistimethátu se však může vyskytnout neurotoxicita s možností závratí, zmatenosti nebo poruch vidění. Pacienti mají být upozorněni, aby neřídili ani neobsluhovali stroje, pokud se u nich tyto příznaky objeví.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Bezpečnost přípravku Colobreathe byla posuzována u celkem 237 subjektů (225 pacientů s cystickou fibrózou a 12 zdravých dobrovolníků). Z tohoto počtu bylo 187 pacientů ve věku 6 let nebo starších vystaveno působení jedné tobolky přípravku Colobreathe dvakrát denně v 24týdenní srovnávací studii fáze 3. Třicet dva pacientů bylo ve věku 6-12 let, 41 pacientů ve věku 13-17 let a 114 pacientů bylo 18letých nebo starších. Nejčastěji hlášené nežádoucí účinky vyjádřené jako procento pacientů léčených přípravkem Colobreathe byly: nepříjemná chuť (62 %), kašel (59,4 %), podráždění krku (43,9 %), dyspnoe (16,6 %) a dysfonie (10,7 %). Inhalace může vyvolat kašel nebo bronchospasmus, které mohou být kontrolovány premedikací inhalačními beta2 agonisty.
Podráždění krku nebo úst bylo zdokumentováno s nebulizovanou sodnou solí kolistimethátu a může k němu dojít u přípravku Colobreathe. Může to souviset s infekcí kvasinkou Candida albicans nebo hypersenzitivitou. Kožní vyrážka může také poukazovat na hypersenzitivitu, a pokud k ní dojde, je třeba léčbu ukončit.
Souhrn nežádoucích účinků v tabulce
Ve 24týdenní klinické studii byly pozorovány následující nežádoucí účinky u všech věkových kategorií. Frekvence je vyjadřována jako: velmi časté (> 1/10), časté (> 1/100 až <1/10), méně časté (> 1/1 000 až < 1/100), vzácné (> 1/10 000 až < 1/1 000), velmi vzácné < 1/10 000), není známo (z dostupných údajů nelze určit). U každé skupiny frekvence jsou nežádoucí účinky uvedeny v pořadí podle klesající závažnosti.
|
Třídy orgánových systémů |
Velmi časté |
Časté |
Méně časté |
|
Poruchy imunitního systému |
Hypersenzitivita na lék | ||
|
Poruchy metabolismu a výživy |
Kolísání tělesné hmotnosti, snížená chuť k jídlu | ||
|
Psychiatrické poruchy |
Úzkost | ||
|
Poruchy nervového systému |
Porucha rovnováhy, bolest hlavy |
Křeče (konvulze), somnolence | |
|
Poruchy ucha a labyrintu |
Tinitus |
Překrvení ucha | |
|
Respirační, hrudní a mediastinální poruchy |
Dyspnoe kašel, dysfonie, podráždění krku |
Hemoptýza, bronchospasmus, sípání, diskomfort v oblasti hrudníku, infekce dolních cest dýchacích, produktivní kašel, plicní chrůpky |
exacerbace dušnosti, faryngolaryngeální bolest, epistaxe, purulentní sputum, abnormální poslech hrudníku, zvýšená sekrece horních cest dýchacích |
|
Gastrointestinální poruchy |
Dysgeuzie |
Průjem, bolest zubů, hypersalivace flatulence | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Artralgie | ||
|
Poruchy ledvin a močových cest |
Proteinurie | ||
|
Celkové poruchy a reakce v místě aplikace |
Žízeň | ||
|
Vyšetření |
Pokles usilovného výdechového objemu | ||
|
Poranění, otravy a procedurální |
Chyba v medikaci |
|
komplikace |
Pediatrická populace
Ve 24týdenní klinické studii, kde byl přípravek Colobreathe podáván dvakrát denně dospělým a dětem ve věku 6-17 let, byly nežádoucí účinky zaznamenané u pediatrické populace podobné jako u celkové populace. Nejčastěji hlášené nežádoucí účinky vyjádřené jako procento pacientů léčených přípravkem Colobreathe byly: kašel (55 %), nepříjemná chuť (51 %), podráždění krku (34 %), dyspnoe (10 %) a dysfonie (10 %).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Symptomy
V současné době nejsou žádné zkušenosti s předávkováním při použití přípravku Colobreathe. Předávkování však může pravděpodobně vést k vyšší systémové expozici.
Předávkování je při aplikaci inhalační cestou nepravděpodobné, bylo však popsáno při systémovém použití. Častější známky a příznaky intravenózního předávkování zahrnují poruchy rovnováhy, parestezie a závratě. Může to také mít za následek neuromuskulární blokádu, která může vést ke svalové slabosti, apnoi a možné dechové zástavě. Předávkování může také způsobit akutní renální selhání charakterizované sníženým výdejem moči a zvýšenými sérovými koncentracemi BUN a kreatininu.
Léčba
Neexistuje žádné specifické antidotum, proto má být léčba vedena jako podpůrná. Lze provést opatření ke zvýšení rychlosti eliminace sodné soli kolistimethátu, např. podpora diurézy pomocí mannitolu, prodloužená hemodialýza nebo peritoneální dialýza, ale jejich účinnost není známá.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antibakteriální léčiva pro systémovou aplikaci, jiná antibakteriální léčiva.
ATC kód: J01XB01 Mechanismus účinku
Sodná sůl kolistimethátu (CMS) je cyklická polypeptidická antibakteriální látka, která je odvozena od bakterie Bacilluspolymyxa var. colistinus a patří do skupiny polymyxinů. Polymyxiny účinkují prostřednictvím poškození buněčné membrány a výsledné fyziologické účinky jsou pro bakterie fatální. Polymyxiny jsou selektivní ke gramnegativním bakteriím, které mají hydrofobní zevní membránu.
Rezistence
Rezistentní bakterie jsou charakterizovány modifikací fosfátových skupin lipopolysacharidů, které jsou nahrazeny olaminem nebo amino-arabinosou. Přirozeně rezistentní gramnegativní bakterie, jako jsou Próteus mirabilis a Burkholderia cepacia, vykazují kompletní substituci svých lipidových fosfátů olaminem nebo amino-arabinosou.
Zkřížená rezistence
Dá se očekávat zkřížená rezistence mezi sodnou solí kolistimethátu a polymyxinem B. Protože mechanismus účinku polymyxinu se liší od dalších antibakteriálních látek, neočekává se, že by rezistence na kolistin a polymyxin samotným výše uvedeným mechanismem vedla k rezistenci k dalším lékovým skupinám.
Epidemiologická prahová hodnota sodné soli kolistimethátu pro Pseudomonas aeruginosa, rozlišující divokou (wild) populaci od izolátů se získanými rysy rezistence, je 4 mg/l.
Klinická, účinnost
Fáze 3 klinické studie byla randomizovaná, otevřená, aktivní srovnávací studie porovnávající účinnost inhalace 1 662 500 IU suchého prášku sodné soli kolistimethátu s nebulizovaným roztokem tobramycinu k inhalaci, 300 mg/5 ml, u 380 pacientů s prokázanou cystickou fibrózou komplikovanou chronickou plicní infekcí bakterií Pseudomonas aeruginosa. Subjekty byly ve věku 6 let a více a měly FEV1 % predikované v rozmezí 25 - 75 %. U všech pacientů bylo také vyžadováno, aby před randomizací úspěšně absolvovali vstupní období léčby minimálně dvěma cykly nebulizovaného roztoku tobramycinu. Subjekty byly randomizovány pro používání buď jedné tobolky 1 662 500 IU sodné soli kolistimethátu dvakrát denně, nebo 300 mg tobramycinu dvakrát denně. Je třeba poznamenat, že léčba nebyla přerušena, když pacienti užívali současně parenterální antibakteriální účinné látky.
Účinnost byla měřena pomocí změny FEV1 % predikované ve srovnání s výchozí hodnotou po 24týdenní léčbě.
Výsledky pro ITT populaci (Intent-To-Treat) pro primární parametr účinnosti jsou uvedeny níže:
|
Změna FEV1 (% |
predikované) od začátku do 24. týdne (ITT populace) | |||
|
Skupina pacientů |
Colobreathe (Průměr) |
Tobramycin (Průměr) |
Upravený léčebný rozdíl |
95% interval spolehlivosti |
|
Všichni pacienti používající LOCF |
-0,90 (n = 183) |
0,35 (n = 190) |
-0,97 |
-2,74; 0,86 |
|
Dokončení pacienti |
0,39 (n = 153) |
0,78 (n = 171) |
-0,29 |
-2,21; 1,71 |
Data z primárního výsledného parametru, změny FEV1 (% predikované), nemají normální distribuci. Upravený léčebný rozdíl a 95% interval spolehlivosti byly získány zpětnou transformací log transformovaných dat. IIT populace vyloučila pacienty, kteří byli léčení, ale bez důkazu chronické infekce.
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem Colobreathe u jedné nebo více podskupin pediatrické populace u plicní infekce / kolonizace bakterií Pseudomonas aeruginosa u pacientů s cystickou fibrózou (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Absorpce
Kolistimethát není po inhalaci přípravku Colobreathe významně absorbován z plic. Po podání přípravku v dávce 1 662 500 IU dvakrát denně po dobu 7 dnů u dospělých, dospívajících a pediatrických pacientů s cystickou fibrózou byly zjištěny průměrné hodnoty C max celkového kolistimethátu až do výše 455 ng/ml (průměrná hodnota u dospělých). Tmax celkového kolistimethátu se projevilo v intervalu 0,5 až 1 hodina po podání dávky. Ačkoli farmakokinetická analýza populace ukázala, že věk je statisticky významnou kovariátou, AUC 0-6 a AUC0-6 upravená podle dávky (AUC 0-6 /D) pro celkový CMS a celkový volný kolistin byly podobné u dětí a dospívajících, zatímco u dospělých byla zjištěna vyšší AUC 0-6. Když byla hodnota AUC 0-6 upravena podle dávky a tělesné hmotnosti, byla u dětí pozorována mírně vyšší hodnota AUC 0-6-/D/W pro celkový CMS a celkový volný kolistin. U všech tří skupin byla zjištěna vysoká variabilita farmakokinetiky. Proto není úprava dávkování u nižších věkových skupin považována za nezbytnou.
Vysoké koncentrace celkového volného kolistinu (průměrná hodnota 23,5 mg/l) a celkového kolistimethátu (průměrná hodnota 178 mg/l) byly zjištěny ve sputum 1 hodinu po podání dávky 8. den po dávkování dvakrát denně po dobu 7 dní u všech věkových skupin.
Absorpce kolistimethátu z gastrointestinálního traktu se u normálního jedince nevyskytuje ve znatelné míře.
Distribuce v organismu
Vazba na proteiny je nízká. Polymyxiny přetrvávají v játrech, ledvinách, mozku, srdci a svalech. Jedna studie pacientů s cystickou fibrózou udává objem distribuce v ustáleném stavu 0,09 l/kg.
Biotransformace
Sodná sůl kolistimethátu se přeměňuje na bázi in vivo. Protože 80 % parenterální dávky lze v nezměněné formě získat z moči, a protože nedochází k vylučování žlučí, lze předpokládat, že zbývající lék je inaktivován v tkáních. Mechanismus je neznámý.
Eliminace z organismu
Studie systémové absorpce ukázala minimální vylučování močí, přičemž méně než 3 % dávky přípravku Colobreathe bylo vyloučeno močí jako sodná sůl kolistimethátu a kolistin. Úprava dávkování u pacientů s poruchou funkce ledvin proto není považována za nezbytnou. Odhadovaný průměrný konečný poločas celkového množství sodné soli kolistimethátu a celkového volného kolistinu činil 3,0 resp. 6,4 hodin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních studií genotoxicity neodhalily žádné zvláštní riziko pro člověka.
Studie farmakologické bezpečnosti, toxicity po opakovaném podávání nebo reprodukční toxicity na zvířatech využívající cesty zajišťující systémovou expozici neprokázaly žádné zvláštní nebezpečí. Nebyly zjištěny žádné patrné účinky na reprodukční schopnosti samců ani samic potkanů nebo myší. Ve studiích embryofetálního vývoje u myší byla pozorována resorpce a snížená osifikace, u potkanů došlo ke snížení hmotnosti plodu, snížení osifikace a při vysoké dávce 10 mg báze kolistinu denně ke snížení postnatálního přežití. Embryofetální studie u králíků nezaznamenaly žádné účinky při dávkách až 80 mg/kg sodné soli kolistimethátu (32 mg báze kolistinu/kg).
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Žádné.
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti 3 let.
6.4 Zvláštní opatření pro uchovávání
Neuchovávejte při teplotě nad 25 °C.
Uchovávejte v původním obalu až do doby bezprostředně před použitím, aby byl přípravek chráněn před vlhkostí.
6.5 Druh obalu a obsah balení
Tobolky jsou uloženy v oPA/Al/PVC blistrech s PE/Al odlupovací krycí fólií s buď 8 nebo 14 tvrdými tobolkami v jednom blistru.
Přípravek Colobreathe je k dispozici v baleních obsahujících buď 8 nebo 56 tvrdých tobolek.
Jedno balení o 56 tobolkách obsahuje jeden práškový inhalátor Turbospin a buď 7 blistrů s 8 tobolkami nebo 4 blistry se 14 tobolkami (56 tvrdých tobolek), což dostačuje na 4 týdny používání.
Jedno balení o 8 tobolkách obsahuje jeden práškový inhalátor Turbospin a 1 blistr s 8 tvrdými tobolkami, což dostačuje na 4 dny užívání.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Tobolky: neexistují žádné zvláštní požadavky pro likvidaci. Prostředek Turbospin je třeba zlikvidovat po spotřebování léčebného balení.
Tobolky přípravku Colobreathe se podávají pouze pomocí inhalátoru Turbospin.
Používání přípravku Colobreathe pomocí inhalátoru Turbospin Následující pokyny musí pacient při používání přípravku Colobreathe dodržovat:
Příprava inhalátoru Turbospin
1. Odstraňte víčko tak, že za něj zlehka zatáhnete.
2. Odšroubujte náustek, obnažíte tak komůrku inhalátoru Turbospin.
3. Vyjměte z blistru jednu tobolku. Po vynětí z obalu je nutné tobolku okamžitě použít.
4. Zlehka vložte tobolku do komůrky nejširším koncem napřed. Není nutné používat sílu.
5. Nyní zašroubujte zpět náustek.
Proražení tobolky a inhalace léčivého přípravku
6. Pro proražení tobolky:
• Držte inhalátor ve svislé poloze náustkem vzhůru a zlehka zatlačte na píst nahoru, dokud nedosáhnete viditelné čáry - v tomto místě budete pociťovat odpor a tím se zajistí tobolka v poloze připravené k propíchnutí. Uchovávejte tuto polohu, než budete pokračovat
s proražením.
• Nyní s tobolkou zajištěnou v poloze pokračujte v tlaku na píst co nejdále, a pak uvolněte.
• Nyní došlo k proražení tobolky a obsah je možné vdechnout.
• Neprorážejte tobolku více než jednou. Po proražení tobolky můžete vidět, že z komůrky vyjde malý obláček prášku. To je normální.
7. Pomalu vydechněte. Vložte náustek mezi rty a zuby. Pevně přitiskněte rty k náustku. Dávejte pozor a při inhalaci nezakrývejte prsty ani ústy vzduchové štěrbiny.
8. Poté pomalu zhluboka nadechněte ústy dostatečnou rychlostí, při níž slyšíte nebo cítíte, že se tobolka otáčí.
9. Vyjměte inhalátor Turbospin z úst a zadržte dech na dobu asi 10 sekund nebo tak dlouho, jak je pohodlné. Poté pomalu vydechněte.
10. Pokud neslyšíte, že by se tobolka otáčela, může být zaseklá v inhalátoru. Jestliže k tomu dojde, můžete uvolnit tobolku lehkým poklepáním na komůrku inhalátoru. Nesnažte se tobolku uvolnit opakovaným stiskem pístu. Pokud tobolku nelze uvolnit a prášek není možné inhalovat, zlikvidujte rozbitou tobolku a veškerý prášek, který v ní zbývá, a použijte jinou.
11. Inhalujte přípravek znovu. Zopakujte kroky 7 a 8, zajistíte tak, že bude tobolka zcela vyprázdněna.
12. Můžete překontrolovat, zda je tobolka prázdná tak, že odšroubujete náustek a tobolku zkontrolujete. Pokud není prázdná, zopakujte kroky 7, 8 a 9, dokud nevyinhalujete celý obsah.
13. Jakmile vyinhalujete celý obsah, vypláchněte si ústa důkladně vodou a vodu vyplivněte.
Vynětí prázdné tobolky z inhalátoru Turbospin
14. Když je tobolka prázdná, odšroubujte náustek a poté vyjměte a zlikvidujte prázdnou tobolku.
Další informace
Když se pomalu nadechujete, nasáváte vzduch přes tělo inhalátoru Turbospin do komůrky s tobolkou.
Proud vzduchu unáší drobné částečky léku z tobolky dýchacími cestami dolů do plic.
Občas Vám mohou vniknout velmi malé kousky pouzdra tobolky do úst nebo dýchacích cest.
• Pokud se tak stane, můžete cítit tyto kousky na jazyku nebo v dýchacích cestách.
• Pouzdro tobolky je vyrobeno z želatiny, která je lidem při spolknutí nebo vdechnutí neškodná.
• Možnost, že se tobolka rozbije na kousky se zvyšuje, pokud je při kroku 6 tobolka proražena více než jednou.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Forest Laboratories UK Ltd.,
Whiddon Valley Barnstaple North Devon EX32 8NS Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/11/747/001 56 tvrdých tobolek (4 blistry se 14 tobolkami) EU/1/11/747/002 8 tvrdých tobolek (1 blistr s 8 tobolkami)
EU/1/11/747/003 56 tvrdých tobolek (7 blistrů s 8 tobolkami)
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 13. února 2012 Datum posledního prodloužení registrace:
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu/.
A. VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného/výrobců odpovědných za propouštění šarží
Penn Pharmaceutical Services Ltd.
23-24 Tafarnaubach Industrial Estate Tredegar, Gwent NP2 3AA Velká Británie
Forest Tosara Ltd
Unit 146 Baldoyle Ind. Estate, Baldoyle,
Dublin 13,
Irsko
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
• Další opatření k minimalizaci rizik
Držitel rozhodnutí o registraci musí dohodnout formát a obsah vzdělávacího souboru pro lékařské pracovníky a pacienty s příslušnou národní autoritou před uvedením na trh v členském státu.
Držitel rozhodnutí o registraci musí zajistit, že všichni lékaři, kteří budou předepisovat nebo používat Colobreathe, obdrží vzdělávací soubor pro lékařské pracovníky a pacienty obsahující následující:
Souhrn údajů o přípravku Příbalová informace pro pacienta
• „DVD pro lékaře“
• „DVD pro pacienta“
• Informace obsažené na „DVD pro lékaře“ ve formě letáku pro lékaře, kteří nemají přístup k přehrávači DVD
• Informace obsažené na „DVD pro pacienta“ ve formě letáku pro pacienty, kteří nemají přístup k přehrávači DVD
Letáky/DVD pro lékaře a pacienty musí obsahovat následující klíčové body a informace:
• Představení přípravku: poskytnutí informací o obsahu krabičky, tj. pro léčbu v délce 28 dní je 56 tobolek a 1 zařízení. Vysvětlení, že zařízení musí být po 28 dnech zlikvidováno. Popis zařízení Turbospin a jeho funkce.
• Informace o nutnosti dodržovat léčbu, aby byly maximalizovány možné přínosy. Vysvětlení, že používání inhalačních antibiotik může omezit potřebu nitrožilně podávaných antibiotik.
• Podrobné pokyny o používání léku: počínaje rozbalením přípravku a konče likvidací použité tobolky a zařízení. Určité podrobné informace o čištění zařízení Turbospin.
• Popis častých nežádoucích účinků a to zejména neobvyklého kašle a nepříjemné chuti v ústech: Vysvětlení následujících bodů:
- u většiny pacientů se jedná jen o nepříj emnost.
- zdůraznění, že pacienti mají v léčbě vytrvat.
- kašel bude při opakovaném používání přípravku ustupovat a má se přibližně po prvním měsíci stabilizovat.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Colobreathe 1 662 500 IU, prášek k inhalaci v tvrdé tobolce Colistimethatum natricum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna tobolka obsahuje colistimethatum natricum 1 662 500 IU (což se přibližně rovná 125 mg).
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek k inhalaci v tvrdé tobolce
8 tobolek s 1 inhalátorem Turbospin (1 plato se 8 tobolkami)
56 tobolek s 1 inhalátorem Turbospin (4 blistry se 14 tobolkami) 56 tobolek s 1 inhalátorem Turbospin (7 blistry se 8 tobolkami)
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Pouze inhalační podání.
Používejte podle pokynů lékaře.
Tobolky nepolykejte.
Pouze pro použití s inhalátorem Turbospin.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Neuchovávejte při teplotě nad 25 °C.
Uchovávejte v původním obalu až do doby bezprostředně před použitím, aby byl přípravek chráněn před vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Forest Laboratories UK Ltd.,
Whiddon Valley
Barnstaple
North Devon
EX32 8NS
Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/11/747/001 56 tvrdých tobolek (4 blistry se 14 tobolkami) EU/1/11/747/002 8 tvrdých tobolek (1 blistr se 8 tobolkami) EU/1/11/747/003 56 tvrdých tobolek (7 blistrů se 8 tobolkami)
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Colobreathe
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH NEBO STRIPECH BLISTR
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Colobreathe 1 662 500 IU, prášek k inhalaci colistimethatum natricum Inhalační podání
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Forest Laboratories UK Ltd
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
Colobreathe 1 662 500 IU, prášek k inhalaci v tvrdé tobolce Colistimethatum natricum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je přípravek Colobreathe a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Colobreathe používat.
3. Jak se přípravek Colobreathe používá
4. Možné nežádoucí účinky
5. Jak přípravek Colobreathe uchovávat
6. Obsah balení a další informace
1. Co je přípravek Colobreathe a k čemu se používá
Přípravek Colobreathe obsahuje sodnou sůl kolistimethátu, typ antibiotika zvaného polymyxin.
Přípravek Colobreathe se používá k léčbě přetrvávajících plicních infekcí způsobených bakterií Pseudomonas aeruginosa u dospělých pacientů a dětí starších 6 let s cystickou fibrózou. Pseudomonas aeruginosa je velmi běžná bakterie, která infikuje téměř všechny pacienty s cystickou fibrózou v určitém okamžiku během života. Někteří lidé dostanou tuto infekci v raném věku, u jiných k tomu může dojít mnohem později. Není-li tato infekce zvládnutá, může způsobit poškození plic.
Jak působí
Přípravek Colobreathe působí tak, že ničí bakteriální buněčnou membránu, což na ně má smrtelný účinek.
2. Čemu musíte věnovat pozornost, než začnete přípravek Colobreathe používat Nepoužívejte přípravek Colobreathe:
• jestliže jste alergický(á) je Vaše dítě alergické) na sodnou sůl kolistimethátu, kolistin-sulfát nebo polymyxiny.
Upozornění a opatření
Informujte svého lékaře, pokud u Vás/Vašeho dítěte někdy došlo k následujícím stavům:
• předchozí špatná reakce na léky ve formě suchého prášku k inhalaci, pokud jste to již dříve neprobral(a) se svým lékařem;
• svalovému onemocnění známému jako myasthenia gravis nebo dědičnému onemocnění porfyrii;
• krev ve sputu (hlen, který vykašláváte)
Po každé inhalaci přípravku Colobreathe je třeba vypláchnout ústa vodou. Výplach se nesmí polykat. Vyplachování může snižovat riziko vzniku ústní plísňové superinfekce během léčby a může také snížit nepříjemnou chuť spojenou se sodnou solí kolistimethátu.
Když začnete/Vaše dítě začne používat přípravek Colobreathe, může se objevit kašel, dušnost, tlak na hrudi nebo sípání. Množství těchto nežádoucích účinků se může s dalším používáním inhalátoru snižovat, nebo Vám/Vašemu dítěti lékař může předepsat bronchodilatátor, který se používá před nebo po použití přípravku Colobreathe. Pokud se jakýkoli z těchto nežádoucích účinků stane problematickým, kontaktujte svého lékaře, který Vám/Vašemu dítěti může změnit léčbu.
Jestliže Vy/Vaše dítě máte jakékoli problémy s ledvinami či nervy, je nutné při podání přípravku Colobreathe dbát opatrnosti, avšak Váš lékař má být o této skutečnosti informován.
Pokud Vy/Vaše dítě potřebujete používat jiné formy kolistimethátu, a to injekčně či nebulizací (rozprašovačem), je nutné dbát opatrnosti, avšak Váš lékař má být o této skutečnosti informován.
Děti
Přípravek Colobreathe nepodávejte dětem mladším 6 let, protože pro ně není vhodný.
Další léčivé přípravky a přípravek Colobreathe
Informujte svého lékaře o všech lécích, které užíváte/Vaše dítě užívá, které jste v nedávné době užíval(a)/Vaše dítě v nedávné době užívalo nebo které možná budete/Vaše dítě bude užívat, a to zvláště:
• Pokud užíváte/Vaše dítě užívá aminoglykosidová antibiotika používaná k léčbě infekcí, je nutné dbát opatrnosti;
• Pokud trpíte/Vaše dítě trpí onemocněním myasthenia gravis a užíváte/užívá makrolidová antibiotika, jako jsou azithromycin a klarithromycin, nebo fluorochinolony, jako je norfloxacin a ciprofloxacin. Jejich používání ve stejné době jako přípravek Colobreathe může způsobit svalovou slabost;
• Pokud je Vám/Vašemu dítěti podávána sodná sůl kolistimethátu injekčně nebo nebulizací, je nutné dbát opatrnosti;
• Pokud musí být Vám nebo Vašemu dítěti podána celková anestezie, je nutné dbát opatrnosti. Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek používat.
K dispozici nejsou žádné informace týkající se bezpečnosti přípravku Colobreathe u těhotných žen. Váš lékař Vám má před použitím přípravku Colobreathe poradit, zda přínosy léku převyšují jeho rizika.
Sodná sůl kolistimethátu může být vylučována do mateřského mléka. Poraďte se o použití přípravku Colobreathe se svým lékařem.
Řízení dopravních prostředků a obsluha strojů
Během užívání přípravku Colobreathe se u Vás mohou vyskytnout závratě, zmatenost, nebo problémy s viděním. Neřiďte dopravní prostředky ani neobsluhujte žádné přístroje nebo stroje, dokud příznaky neodezní.
3. Jak se přípravek Colobreathe používá
Vždy užívejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á)/Vaše dítě není jisté, poraďte se se svým lékařem.
První dávka se má podávat pod lékařským dohledem.
Dávkování
Dospělí a děti ve věku 6 let a starší
• Obsah jedné tobolky přípravku Colobreathe se má inhalovat dvakrát denně pomocí inhalátoru Turbospin.
• Mezi dávkami má být interval 12 hodin.
Pořadí, ve kterém je třeba užívat nebo provádět jinou léčbu
Pokud užíváte/Vaše dítě užívá jiné způsoby léčby cystické fibrózy, je třeba dodržovat následující pořadí:
• Inhalační bronchodilatancia
• Dechová fyzioterapie
• Jiné inhalační léky
• Následně přípravek Colobreathe
Pořadí používání léčby ověřte u svého lékaře.

Způsob podání
Přípravek Colobreathe je vdechován do plic ve formě prášku z tobolky pomocí ručního inhalátoru nazývaného Turbospin. Přípravek Colobreathe smí být podáván pouze pomocí tohoto zařízení
Tobolky přípravku Colobreathe nepolykejte.
Při inhalaci přípravku Colobreathe z tobolky inhalátorem Turbospin dodržujte postup popsaný níže. Lékař, lékárník nebo zdravotní sestra Vám/Vašemu dítěti mají na počátku léčby ukázat, jak provádět inhalaci léku:
Používání přípravku Colobreathe pomocí inhalátoru Turbospin Příprava inhalátoru Turbospin
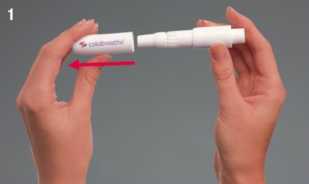
1. Odstraňte víčko tak, že za něj zlehka zatáhnete.

2. Odšroubujte náustek, obnažíte tak komůrku inhalátoru Turbospin.



3. Vyjměte z blistru jednu tobolku. Po vyjmutí z obalu je nutné tobolku okamžitě použít.
4. Zlehka vložte tobolku do komůrky nejširším koncem napřed. Není nutné používat sílu.
5. Nyní zašroubujte zpět náustek.
Proražení tobolky a inhalace léčivého přípravku
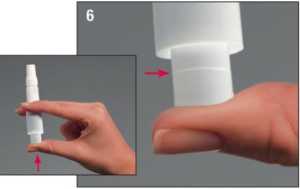
6. Pro proražení tobolky:
• Držte inhalátor ve svislé poloze náustkem vzhůru a zlehka zatlačte na píst nahoru, dokud
nedosáhnete viditelné rysky - v tomto místě budete pociťovat odpor, a tím se zajistí tobolka v poloze připravené k propíchnutí. Udržujte tuto polohu, než budete pokračovat s proražením.
• Nyní s tobolkou zajištěnou v poloze pokračujte v tlaku na píst co nejdále, a pak uvolněte.
• Nyní došlo k proražení tobolky a obsah je možné vdechnout.
Neprorážejte tobolku více než jednou. Po proražení tobolky můžete vidět, že z komůrky vyjde malý obláček prášku. To je normální.
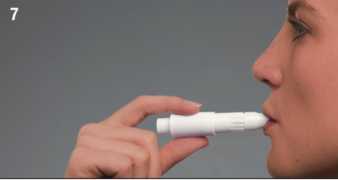
7. Pomalu vydechněte. Vložte náustek mezi rty a zuby. Pevně přitiskněte rty k náustku. Dávejte pozor a při inhalaci nezakrývejte prsty ani ústy vzduchové štěrbiny.
8. Poté se pomalu zhluboka nadechněte ústy dostatečnou rychlostí, při níž slyšíte nebo cítíte, že se tobolka otáčí.
9. Vyjměte inhalátor Turbospin z úst a zadržte dech na dobu asi 10 sekund nebo tak dlouho, jak je pohodlné. Poté pomalu vydechněte.
10. Pokud neslyšíte, že by se tobolka otáčela, může být zaseklá v inhalátoru. Jestliže k tomu dojde, můžete uvolnit tobolku lehkým poklepáním na komůrku inhalátoru. Nesnažte se tobolku uvolnit opakovaným tlakem na píst. Pokud tobolku nelze uvolnit a prášek není možné inhalovat, zlikvidujte rozbitou tobolku a veškerý prášek, který v ní zbývá, a použijte jinou.
11. Inhalujte přípravek znovu. Zopakujte kroky 7 a 8, zajistíte tak, že bude tobolka zcela vyprázdněna.
12. Můžete překontrolovat, zda je tobolka prázdná tak, že odšroubujete náustek a tobolku zkontrolujete. Pokud není prázdná, zopakujte kroky 7, 8 a 9, dokud nevyinhalujete celý obsah.
13. Jakmile vyinhalujete celý obsah, vypláchněte si ústa důkladně vodou a vodu vyplivněte.
Vyjmutí prázdné tobolky z inhalátoru Turbospin
14. Když je tobolka prázdná, odšroubujte náustek a poté vyjměte a zlikvidujte prázdnou tobolku.
Další informace
Když se pomalu nadechujete, nasáváte vzduch přes tělo inhalátoru Turbospin do komůrky s tobolkou.
Proud vzduchu unáší drobné částečky léčivého přípravku z tobolky dýchacími cestami dolů do plic.
Občas Vám mohou vniknout velmi malé kousky pouzdra tobolky do úst nebo dýchacích cest.
• Pokud se tak stane, můžete cítit tyto kousky na jazyku nebo v dýchacích cestách.
• Pouzdro tobolky je vyrobeno z želatiny, která je lidem při spolknutí nebo vdechnutí neškodná.
• Možnost, že se tobolka rozbije na kousky se zvyšuje, pokud je při kroku 6 tobolka proražena více než jednou.
Čištění inhalátoru Turbospin
Po každé dávce vyčistěte inhalátor Turbospin pomocí následujícího postupu:
1. Píst několikrát silně zatlačte, přičemž držte komůrku směrem dolů.
2. Vyčistěte komůrku hadříkem nebo vatovým tamponem. Nepoužívejte vodu.
3. Našroubujte náustek pevně zpět, nasaďte zpět víčko a inhalátor je připraven k použití pro další dávku.
Jestliže jste použil(a)/Vaše dítě použilo více přípravku Colobreathe, než jste měl(a)/Vaše dítě mělo, nebo jestliže jste náhodně spolkl(a)/Vaše dítě náhodně spolklo tobolku, okamžitě kontaktujte svého lékaře.
Jestliže jste zapomněl(a)/Vaše dítě zapomnělo použít přípravek Colobreathe
Jestliže jste zapomněl(a)/Vaše dítě zapomnělo použít dávku přípravku Colobreathe, je třeba ji použít ihned, jakmile si na to vzpomenete/vzpomene. Nesmí se užít 2 dávky během 12 hodin. Pokračujte následně podle pokynů.
Jestliže jste přestal(a)/Vaše dítě přestalo používat přípravek Colobreathe
Neukončujte předčasně léčbu, pokud Vám lékař neřekne, že můžete. Váš lékař rozhodne, jak dlouho by Vaše léčba/ léčba Vašeho dítěte měla trvat.
Máte-li/má-li Vaše dítě jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Alergické reakce
Alergická reakce na přípravek Colobreathe je možná (většinou závažné alergické reakce mohou způsobit vyrážky, otok obličeje, jazyka a krku, neschopnost dýchat kvůli zúžení dýchacích cest a ztrátu vědomí). Pokud se u Vás/Vašeho dítěte objeví známky alergické reakce, vyhledejte okamžitou lékařskou pomoc.
Další možné nežádoucí účinky
Po inhalaci přípravku Colobreathe můžete/Vaše může dítě cítit nepříjemnou pachuť v ústech.
Velmi časté: mohou postihnout více než 1 člověka z 10
• Dýchací potíže
• Kašel, podráždění v krku
• Chraplavý nebo slabý hlas, případně až ztráta hlasu
• Nepříjemná chuť
Časté: mohou postihnout až 1 člověka z 10
• Bolest hlavy
• Ušní šelest, problémy s rovnováhou
• Vykašlávání krve, sípání, nepříjemný pocit na hrudi, astma, produktivní kašel (kašel
s vykašláváním hlenu), infekce plic, plicní chrůpky (lékař je slyší při poslechu plic stetoskopem)
• Zvracení, pocit na zvracení
• Změny funkce plic (zjištěno při testování)
• Bolesti kloubů
• Nedostatek energie, únava
• Zvýšená teplota
Méně časté: mohou ovlivnit až 1 člověka ze 100
• Alergické reakce (reakce přecitlivělosti), příznaky mohou zahrnovat vyrážku a svědění
• Kolísání tělesné hmotnosti, snížená chuť k jídlu,
• Úzkost
• Záchvaty křečí
• Ospalost
• Zalehnutí uší
• Bolest na hrudi
• Dušnost
• Krvácení z nosu, rýma (hlen v nose, který může vyvolávat pocit ucpaného nosu), vykašlávání hustého zeleného hlenu, bolest v krku a vedlej ších nosních dutinách
• Neobvyklé zvuky na hrudi (lékař je slyší při poslechu vašich plic stetoskopem)
• Průjem, zvýšený odchod střevních plynů
• Nadměrná tvorba slin
• Bolest zubů
• Bílkoviny v moči (zjištěno při testování)
• Žízeň
Výše uvedené nežádoucí účinky byly pozorovány u lidí všech věkových skupin s podobnou četností. Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Colobreathe uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a blistru za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Neuchovávejte přípravek Colobreathe při teplotě nad 25 oC.
Uchovávejte v původním obalu až do doby bezprostředně před použitím, aby byl přípravek chráněn před vlhkostí.
Pokud náhodou dojde ke sloupnutí fólie a odkrytí některých tobolek, tyto tobolky vyhoďte.
Vyhoďte inhalátor Turbospin po spotřebování léčebného balení.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Colobreathe obsahuje
Léčivou látkou je colistimethatum natricum.. Jedna tobolka obsahuje colistimethatum natricum 1 662 500 IU (přibližně se rovná 125 mg).
Jak přípravek Colobreathe vypadá a co obsahuje toto balení
Tvrdé tobolky s práškem k inhalaci Colobreathe (prášek k inhalaci) jsou malé, tvrdé průhledné želatinové tobolky obsahující jemný bílý prášek.
Turbospin je inhalátor suchého prášku poháněný proudem vzduchu při nádechu vyrobený z polypropylenu a nerezové oceli.
Tobolky jsou baleny v blistrech dodávaných v krabičkách obsahujících:
• 56 tvrdých tobolek a 1 práškový inhalátor Turbospin, což dostačuje na 4 týdny používání.
• 8 tvrdých tobolek a 1 inhalátor Turbospin, což dostačuje na 4 dny používání.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Forest Laboratories UK Ltd.,
Whiddon Valley Barnstaple North Devon EX32 8NS Velká Británie
Výrobce
Penn Pharmaceutical Services Limited
Tafarnaubach Industrial Estate
Tredegar
Gwent
NP22 3AA
Velká Británie
Forest Tosara Ltd
Unit 146 Baldoyle Ind. Estate, Baldoyle, Dublin 13,
Irsko
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu. Na těchto stránkách naleznete též odkazy na další webové stránky, týkající se vzácných onemocnění a jejich léčby.
28