Cinryze 500 Jednotek
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Cinryze 500 jednotek, prášek pro injekční roztok a rozpouštědlo.
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna jednorázová injekční lahvička s práškem obsahuje 500 jednotek antiesterasum-C1 (humanum) vyrobeného z plazmy lidských dárců.
Po rekonstituci obsahuje jedna injekční lahvička 500 jednotek (U) antiesterasum-C1 (humanum) v 5 ml, což odpovídá koncentraci 100 jednotek/ml. Jedna jednotka je ekvivalentní průměrnému množství antiesterasum-C1 přítomnému v 1 ml normální lidské plazmy.
Celkový obsah bílkovin v rekonstituovaném roztoku je 15 ± 5 mg/ml.
Pomocná látka se známým účinkem:
Jedna injekční lahvička přípravku Cinryze obsahuje přibližně 11,5 mg sodíku.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek pro injekční roztok a rozpouštědlo. Bílý prášek.
Rozpouštědlo je čirý, bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Léčba a prevence atak angioedému před zákrokem u dospělých a dospívajících ve věku 12 až 17 let s hereditárním angioedémem (HAE).
Rutinní prevence atak angioedému u dospělých a dospívajících ve věku 12 až 17 let se závažnými a rekurentními atakami hereditárního angioedému (HAE), kteří netolerují perorální preventivní léčbu nebo je tato léčba dostatečně nechrání, anebo u pacientů, jejichž ataky jsou neadekvátně zvládány opakovanou akutní léčbou.
4.2 Dávkování a způsob podání
Terapii přípravkem Cinryze je nutno zahájit pod dohledem lékaře se zkušenostmi s péčí o pacienty s hereditárním angioedémem (HAE).
Dávkování
Dospělí
Léčba atak angioedému
• 1000 jednotek přípravku Cinryze při první známce nástupu ataky angioedému.
• Druhou dávku 1000 jednotek lze podat, jestliže odpověď pacienta po 60 minutách nebyla dostatečná.
• U pacientů, kteří trpí laryngálními atakami, nebo pokud se započetí léčby opozdí, je možné podat druhou dávku dříve než za 60 minut.
Rutinní prevence atak angioedému
• Pro rutinní prevenci atak angioedému se doporučuje počáteční dávka 1000 jednotek přípravku Cinryze každé 3 až 4 dny. Interval dávkování může být nutné upravit podle individuální odpovědi. Další potřebu pravidelné profylaxe přípravkem Cinryze je nutno posuzovat pravidelně.
Prevence atak angioedému před zákrokem
• 1000 jednotek přípravku Cinryze během 24 hodin před lékařským, stomatologickým nebo chirurgickým zákrokem.
Pediatrická populace
Pro léčbu, rutinní prevenci a prevenci před zákrokem u dospívajících ve věku 12 až 17 let je dávka stejná jako u dospělých.
Bezpečnost a účinnost přípravku Cinryze u dětí ve věku do 12 let nebyla dosud stanovena.
V současnosti dostupné údaje jsou uvedeny v bodě 4.8, 5.1 a 5.2, ale na jejich základě nelze učinit žádná doporučení ohledně dávkování.
Starší pacienti
Žádné zvláštní výzkumy nebyly provedeny. Pro léčbu, rutinní prevenci a prevenci před zákrokem u starších pacientů ve věku 65 let nebo starších je dávka stejná jako u dospělých.
Pacienti s poruchou ledvin nebo jater
Žádné zvláštní výzkumy nebyly provedeny. Pro léčbu, rutinní prevenci a prevenci před zákrokem u pacientů s poruchou ledvin nebo jater je dávka stejná jako u dospělých.
Způsob podání K intravenóznímu podání.
Návod k rekonstituci tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6. Rekonstituovaný přípravek se podává intravenózní injekcí rychlostí 1 ml za minutu.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Trombotické příhody
Trombotické příhody byly hlášeny u novorozenců a kojenců, kteří podstoupili srdeční bypass a při tom dostávali neschválené (off-label) vysoké dávky jiného přípravku C1 antiesterasy (až 500 jednotek/kg) k prevenci syndromu zvýšené propustnosti kapilár (capillary leak syndrome). Podle studie na zvířatech existuje při dávkách vyšších než 200 jednotek/kg potenciální trombogenní práh. Pacienty se známými rizikovými faktory pro trombotické příhody (včetně zavedeného katetru) je třeba pozorně sledovat.
Přenosná agens
Standardní opatření k prevenci infekcí, které jsou následkem použití léčivých přípravků vyrobených z lidské krve nebo plazmy, zahrnují výběr dárců, vyšetření jednotlivých odebraných dávek a poolů plazmy na specifické markery infekce a zařazení účinných výrobních kroků, kterými dojde k inaktivaci/odstranění virů. Přesto nelze při podávání léčivých přípravků vyrobených z lidské krve nebo plazmy zcela vyloučit možnost přenosu infekčních agens. Totéž platí pro neznámé nebo vznikající viry a jiné patogeny.
Přijatá opatření se považují za účinná na obalené viry, např. HIV, HBV a HCV, a neobalené viry HAV a parvovirus B19.
U pacientů, kteří pravidelně/opakovaně dostávají přípravek C1 antiesterasy odvozený z lidské plazmy, je třeba zvážit vhodnou vakcinaci (hepatitida A a B).
Důrazně se doporučuje zaznamenat název a číslo šarže přípravku při každém podání přípravku Cinryze, aby se zachovalo spojení mezi pacientem a šarží výrobku.
Hypersenzitivita
Podobně jako u všech biologických přípravků se mohou objevit hypersenzitivní reakce. Hypersenzitivní reakce mohou mít příznaky podobné atakám angioedému. Pacienty je nutné informovat, že časné známky hypersenzitivních reakcí zahrnují vyrážku, generalizovanou kopřivku, pocit tísně na hrudi, sípání, hypotenzi a anafylaxi. Jestliže se tyto příznaky objeví po podání, musí upozornit svého lékaře. V případě anafylaktických reakcí nebo šoku je třeba zajistit okamžitou lékařskou péči.
Domácí léčba a samopodání
Existují omezené údaje o použití tohoto léčivého přípravku v domácí péči nebo při samopodání. Možná rizika spojená s domácí léčbou se vztahují k podání jako takovému, stejně jako ke zvládnutí nežádoucích účinků, zejména hypersenzitivity. Rozhodnutí o využití domácí léčby by měl u každého pacienta individuálně učinit ošetřující lékař, který musí zajistit vhodnou instruktáž a v určitých intervalech překontrolovat techniku podávání.
Pediatrická populace
Trombotické příhody byly hlášeny u novorozenců a kojenců, kteří podstoupili srdeční bypass a při tom dostávali neschválené (off-label) vysoké dávky jiného přípravku C1 antiesterasy (až 500 jednotek/kg) k prevenci syndromu zvýšené propustnosti kapilár (capillary leak syndrome).
Sodík
Jedna injekční lahvička přípravku Cinryze obsahuje přibližně 11,5 mg sodíku. Nutno vzít v úvahu u pacientů na dietě s nízkým obsahem sodíku.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí.
4.6 Fertilita, těhotenství a kojení
Údaje z omezeného množství exponovaných těhotenství neindikují žádné nežádoucí účinky C1 antiesterasy na těhotenství ani na zdraví plodu/novorozeného dítěte. Doposud nejsou k dispozici žádné relevantní epidemiologické údaje. V reprodukčních studiích na potkanech nebyly pozorovány žádné účinky léčby na matku ani embryo/plod při hladinách dávek až 28krát převyšujících doporučenou dávku pro člověka (1000 jednotek) založenou na průměrné tělesné hmotnosti dospělého 70 kg. Možné riziko pro člověka není známo.
Proto je možné podávat přípravek Cinryze těhotným ženám pouze při zcela zřejmé indikaci.
Kojení
Není známo, zda se C1 antiesterasa vylučuje do lidského mateřského mléka. Riziko pro kojené novorozence/děti nelze vyloučit. Na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku je nutno rozhodnout, zda přerušit kojení nebo ukončit/přerušit podávání přípravku Cinryze.
Fertilita
Žádné specifické studie fertility, časného embryonálního a postnanálního vývoje ani studie karcinogenity nebyly provedeny (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Podle v současnosti dostupných klinických údajů má přípravek Cinryze malý vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Jediným častým nežádoucím účinkem pozorovaným v klinických studiích po infuzi přípravku Cinryze byla vyrážka; popisy charakteristických znaků vyrážky byly nespecifické, ale typicky se jednalo o zasažení horních končetin, hrudníku, břicha nebo místa vpichu. Žádná z vyrážek nebyla závažná a žádná nevedla k vysazení léčivého přípravku. Může docházek k hypersenzitivním reakcím (viz bod 4.4).
Tabulkový seznam nežádoucích účinků
Frekvence výskytu nežádoucích účinků byla určena primárně podle shrnutí nežádoucích účinků jednoznačně souvisejících s přípravkem Cinryze, které byly hlášeny v 8 ukončených klinických studiích provedených u pacientů s HAE. To zahrnuje údaje ze dvou placebem kontrolovaných studií, tří otevřených studií, od tří subjektů v rámci tzv. compassionate use a zpráv po uvedení na trh.
V těchto studiích bylo provedeno 385 expozic subjektů, což představuje více než 14500 infuzí přípravku Cinryze.
Nežádoucí účinky při léčbě přípravkem Cinryze jsou klasifikovány podle tříd orgánových systémů podle databáze MedDRA a absolutní frekvence v tabulce 1. V každé skupině frekvence výskytu jsou nežádoucí účinky seřazeny podle klesající závažnosti. Frekvence se definují jako velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (>1/10000 až < 1/1000) a velmi vzácné (<1/10000), a není známo (z dostupných údajů nelze určit).
Tabulka 1. Nežádoucí účinky hlášené v klinických studiích a ve zprávách po uvedení na trh
|
Třída orgánových systémů |
Frekvence: |
Nežádoucí účinek |
|
Poruchy imunitního systému |
Není známo: |
Hypersenzitivita |
|
Poruchy metabolismu a výživy |
Méně časté: |
Hyperglykémie |
|
Poruchy nervového systému |
Méně časté: |
Závrať, bolest hlavy |
|
Cévní poruchy |
Méně časté: |
Žilní trombóza, flebitida, pálení v žíle, návaly horka |
|
Respirační, hrudní a mediastinální poruchy |
Méně časté: | |
|
Gastrointestinální poruchy |
Méně časté: | |
|
Poruchy kůže a podkožní tkáně |
Časté: Méně časté: |
Kontaktní dermatitida, erytém, pruritus |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Méně časté: |
Otoky kloubů, artralgie, myalgie |
|
Celkové poruchy a reakce v místě aplikace |
Méně časté: |
Vyrážka/erytém v místě vpichu, bolest v místě infuze, dyskomfort na hrudi, pyrexie |
Popis vybraných nežádoucích účinků
Mezi hlášeními případů žilní trombózy byla nejčastějším zásadním rizikovým faktorem přítomnost zavedeného katetru.
Lokální reakce v místě aplikace byly méně časté. V klinických studiích se lokální reakce (popsané jako bolestivost, modřiny nebo vyrážka v místě vpichu injekce/katetru, pálení v žíle nebo flebitida) objevily v souvislosti s přibližně 0,2 % infuzí.
Pediatrická populace
V 8 ukončených klinických studiích bylo zahrnuto a vystaveno účinkům přípravku Cinryze 46 specifických pediatrických subjektů (2-5 let, n=3; 6-11 let, n=17; 12-17 let, n=26). U těchto dětí byly v souvislosti s přípravkem Cinryze zaznamenány pouze tyto nežádoucí účinky: bolest hlavy, nauzea, pyrexie a erytém v místě infuze. Žádný z těchto nežádoucích účinků nebyl závažný a žádný nevedl k vysazení léčivého přípravku.
Celkově je bezpečnost a snášenlivost přípravku Cinryze u dětí a dospělých podobná.
Bezpečnost s ohledem na přenosná agens viz bod 4.4.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Nebyl hlášen žádný případ předávkování.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Léky používané při hereditárním angioedému, C1 inhibitor získaný z plazmy, ATC kód: B06AC01.
Mechanismus účinku
C1 antiesterasa je protein z nadrodiny inhibitorů serinových proteáz, též serpinů. Hlavní funkcí serpinů je regulace aktivity serinových proteáz. C1 antiesterasaje glykoprotein s jedním řetězcem, který se nachází v plazmě. V maturovaném stavu je tvořen 478 aminokyselinami o zdánlivé molekulové hmotnosti 105 kD.
C1 antiesterasa inhibuje komplementový systém vazbou C1r a C1s, dvou aktivních podjednotek enzymu první komponenty klasické dráhy komplementového systému (C1), stejně jako serinové proteázy asociované s lektinem vázajícím manózu v lektinové dráze. Primárním substrátem aktivovaného enzymu C1 je C4; není-li C1 inhibován, dojde ke snížení hladin C4. C1 je nejdůležitějším inhibitorem kontaktní aktivace a reguluje kontaktní systém a vlastní koagulační kaskádu vazbou na kalikrein a faktor XIIa a jejich inaktivací. Jelikož jsou tyto cesty součástí kaskád amplifikace enzymu, bez C1 antiesterasy může vést spontánní nebo spouštěčem indukovaná aktivace těchto cest k nezadržitelné aktivaci a otokům.
Farmakodynamické účinky
V klinických studiích vedlo intravenózní podání přípravku Cinryze k významnému zvýšení systémových hladin antigenní a funkční C1 antiesterasy do 1 hodiny po podání. Podání C1 antiesterasy zvyšuje sérové hladiny C1 antiesterasy a dočasně obnovuje přirozenou regulaci kontaktního, komplementového a fibrinolytického systému, čímž kontroluje otékání a náchylnost k otékání.
Nízké hladiny sérového C4 často korelují s atakami HAE. Léčba přípravkem Cinryze vedla ke zvýšení hladin C4 za 12 hodin. Existuje statisticky významný (p = 0,0017) rozdíl ve změnách průměrných
hodnot oproti výchozím hodnotám mezi léčenými skupinami za 12 hodin, což dokazuje spojení léčby přípravkem Cinryze se zvýšením aktivity C4 (Cinryze + 2,9 mg/dl oproti placebu + 0,1 mg/dl).
Klinická účinnost a bezpečnost
Dvě randomizované, dvojitě zaslepené, placebem kontrolované studie (LEVP 2005-1/A a LEVP 2005-1/B) a údaje ze dvou otevřených studií (LEVP 2006-1 a LEVP 2006-4) prokázaly účinnost přípravku Cinryze při léčbě a prevenci atak angioedému u pacientů s deficiencí C1 antiesterasy.
Přípravek Cinryze při léčbě atak HAE
Ve studii LEVP 2005-1/A bylo použito randomizované, dvojitě zaslepené, placebem kontrolované schéma paralelních skupin; bylo randomizováno 71 pacientů s akutními atakami HAE (36 přípravek Cinryze, 35 placebo). Studie prokázala, že léčba přípravkem Cinryze do 4 hodin od vzniku ataky HAE vedla k více než dvojnásobnému zkrácení doby do začátku jednoznačné úlevy charakterizujícího příznaku ataky HAE ve srovnání s placebem (medián 2 hodiny u přípravku Cinryze oproti > 4 hodinám u placeba, p = 0,048). Léčba přípravkem Cinryze také vedla k více než dvojnásobnému zkrácení doby do úplné rezoluce ataky HAE ve srovnání s placebem (medián 12,3 hodiny oproti 31,6 hodinám, p = 0,001). Podíl pacientů se začátkem jednoznačné úlevy charakterizujícího příznaku do 4 hodin po podání dávky byl 60 % u přípravku Cinryze a 42 % u placeba (p = 0,062). Žádný z 15 pacientů léčených otevřeně přípravkem Cinryze pro laryngální ataky HAE nevyžadoval intubaci.
V otevřené studii LEVP 2006-1 bylo u 101 pacientů léčeno celkem 609 akutních atak HAE (medián 3 ataky na pacienta; rozmezí 1-57). Do 4 hodin po podání dávky přípravku Cinryze bylo dosaženo jednoznačné úlevy charakterizujícího příznaku u 87 % atak. U 95 %atak byla pozorována klinická úleva a/nebo pacienti byli propuštěni domů do 4 hodin. U pacientů s >1 atakou byl podíl atak odpovídajících do 4 hodin od podání dávky přípravku Cinryze a doba do odpovědi srovnatelné bez ohledu na počet léčených atak. Žádný ze 84 samostatných laryngálních atak HAE nevyžadoval po léčbě přípravkem Cinryze intubaci.
Přípravek Cinryze při rutinní prevenci atak HAE
Ve studii LEVP 2005-1/B bylo použito randomizované, dvojitě zaslepené, placebem kontrolované schéma se zkříženým uspořádáním; 22 pacientů bylo hodnotitelných z hlediska účinnosti (randomizováno a léčeno v obou zkřížených obdobích). Studie prokázala, že profylaxe přípravkem Cinryze vedla k více než dvojnásobnému snížení počtu atak HAE ve srovnání s placebem (průměr 6,3 atak u přípravku Cinryze oproti 12,8 atak u placeba, p < 0,0001). Ataky angioedému byly také méně závažné v průběhu profylaktické léčby přípravkem Cinryze ve srovnání s placebem (průměrné skóre závažnosti 1,3 oproti 1,9 nebo 32% redukce, p = 0,0008) a trvaly kratší dobu (průměr 2,1 dne oproti 3,4 dnům nebo 38% redukce, p = 0,0004). Celkový počet dnů s otokem v průběhu profylaktické léčby přípravkem Cinryze byl nižší ve srovnání s placebem (průměr 10,1 dne oproti 29,6 dnům nebo 66% snížení, p < 0,0001). Kromě toho bylo na léčbu atak HAE zapotřebí méně infuzí otevřeného přípravku Cinryze v průběhu léčby přípravkem Cinryze ve srovnání s placebem (průměr 4,7 infuze oproti 15,4 infuzím nebo 70% snížení, p < 0,0001).
V otevřené studii LEVP 2006-4 dostávalo 146 pacientů přípravek Cinryze jako profylaxi HAE
v obdobích o délce od 8 dnů do přibližně 32 měsíců (medián 8 měsíců). Před zařazením hlásili pacienti střední měsíční míru výskytu atak 3,0 (rozmezí 0,08-28,0). V průběhu profylaktické léčby přípravkem Cinryze byla tato míra výskytu 0,21 (rozmezí 0-4,56) a 86 % pacientů zaznamenalo v průměru < 1 ataku za měsíc. U pacientů, kteří profylakticky dostávali přípravek Cinryze alespoň 1 rok, zůstala měsíční míra výskytu na pacienta stále nízká (0,34 ataky za měsíc) ve vztahu k míře výskytu před studií.
Přípravek Cinryze při prevenci atak HAE před zákrokem
Otevřený přípravek Cinryze byl podán v průběhu 24 hodin celkem před 91 lékařskými, zubařskými nebo chirurgickými zákroky v klinickém programu (40 zákroků u dětí a 51 zákroků u dospělých). U 98 % zákroků nebyly hlášeny žádné ataky HAE v průběhu 72 hodin po dávce přípravku Cinryze.
Pediatrická populace
Léčba (LEVP 2006-1): Podíl atak HAE, u nichž se dosáhlo jednoznačné úlevy charakterizujícího příznaku do 4 hodin od léčby přípravkem Cinryze byl srovnatelný u 22 dětí zařazených do studie (věkové rozmezí 2-17) a dospělých s 89 %, resp. 86 % atak, při nichž se dosáhlo úlevy.
Prevence (LEVP 2006-4): Před zařazením do studie hlásilo 23 dětí (věkové rozmezí 3-17 let) střední měsíční míru výskytu atak HAE 3,0 (rozmezí 0,5-28,0). V průběhu studie, kdy byly děti profylakticky léčeny přípravkem Cinryze, byla zaznamenána u dětí v různých věkových podskupinách střední měsíční míra výskytu atak HAE 0,4 (rozmezí 0-3,4) a 87 % dětí byla hlášena v průměru < 1 ataka za měsíc. Tyto výsledky byly srovnatelné s výsledky získanými u dospělých.
V obou studiích, LEVP 2006-1 a LEVP 2006-4, vedlo podávání přípravku Cinryze ke zvýšení hladin antigenní a funkční C1 antiesterasy po infuzi ve srovnání s hodnotami před infuzí s obdobnými trendy pozorovanými u dětí a dospělých.
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky dvou ze čtyř studií s přípravkem Cinryze u pediatrické populace při deficienci C1 antiesterasy. Informace o použití u dětí viz bod 4.2.
5.2 Farmakokinetické vlastnosti
U pacientů s nesymptomatickým HAE byla provedena randomizovaná, otevřená farmakokinetická studie paralelních skupin s přípravkem Cinryze. Pacienti dostali buď jednorázovou intravenózní dávku 1000 jednotek nebo 1000jednotkovou dávku, po níž následovala za 60 minut další dávka 1000 jednotek. Průměrné farmakokinetické parametry funkční C1 antiesterasy, které byly získány z údajů o koncentraci korigovaných vzhledem k výchozí hodnotě, jsou uvedeny v tabulce 2.
Tabulka 2. Průměrné farmakokinetické parametry funkční C1 antiesterasy po podání přípravku _Cinryze___
|
Parametry |
Jednotlivá dávka (1000 jednotek*) |
Dvojitá dávka (dávka 1000 jednotek (U) následovaná po 60 minutách druhou 1000jednotkovou dávkou) |
|
^výchozí (U/ml) |
0,31 ± 0,20 (n = 12) |
0,33 ± 0,20 (n = 12) |
|
Cmax (U/ml) |
0,68 ± 0,08 (n = 12) |
0,85 ± 0,12 (n = 13) |
|
Cmax korigovaná vzhledem k výchozí hodnotě (U/ml) |
0,37 ± 0,15 (n= 12) |
0,51 ± 0,19 (n = 12) |
|
tmax (hod) [medián (rozmezí)] |
[1,2 (0,3 -26,0)] (n = 12) |
[2,2 (1,0 -7,5)] (n = 13) |
|
AUC(0-t) (U*hod/ml) |
74,5 ± 30,3 (n = 12) |
95,9 ± 19,6 (n = 13) |
|
AUC(0-t) korigovaná vzhledem k výchozí hodnotě (U*hod/ml) |
24,5 ± 19,1 (n= 12) |
39,1 ± 20,0 (n = 12) |
|
Clearance CL (ml/min) |
0,85 ± 1,07 (n = 7) |
1,17 ± 0,78 (n = 9) |
|
Poločas eliminace (hod) |
56 ± 35 (n = 7) |
62 ± 38 (n = 9) |
n = počet hodnocených subjektů.
*Jedna jednotka (U) je rovna průměrnému množství C1 antiesterasy přítomnému v1 ml normální lidské plazmy.
Po intravenózním podání jednotlivé dávky přípravku Cinryze pacientům s HAE se v průběhu 1 až 2 hodin sérová koncentrace funkční C1 antiesterasy zdvojnásobila. Maximální koncentrace v séru (Cmax) a plocha pod křivkou závislosti sérové koncentrace na čase (AUC) se zvyšovala od jednotlivé k dvojité dávce, přestože zvýšení nebylo úměrné dávce. Průměrný poločas eliminace funkční C1 antiesterasy po podání přípravku Cinryze byl 56 hodin u jednotlivé dávky a 62 hodin u dvojité dávky.
Jelikož je C1 antiesterasa endogenní protein lidské plazmy, nepodléhá metabolizaci izoenzymy cytochromu P450, exkreci ani farmakokinetickým mezilékovým interakcím, které vykazují mnohé sloučeniny o nízké molekulární hmotnosti. Očekávaným výsledkem metabolismu glykoproteinu je jeho degradace na malé peptidy a jednotlivé aminokyseliny. Vzhledem k tomu se neočekává, že by farmakokinetika a exkrece přípravku Cinryze byly narušeny ledvinovou nebo jaterní poruchou.
Pediatrická populace
Aktivita funkční C1 antiesterasy byla měřena u dětí ve dvou otevřených studiích (viz bod 5.1). Průměrné zvýšení aktivity funkční C1 antiesterasy oproti výchozí hodnotě měřené 1 hodinu po podání dávky u dětí ve věku 2 až < 18 let bylo v rozmezí od 20 % do 88 % ve studii LEVP 2006-1 (léčba) a od 22 % do 46 % ve studii LEVP 2006-4 (prevence) ve srovnání s 21 % až 66 %, resp. 25 % až 32 % u dospělých.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních studií obecné toxicity a reprodukční toxicity neodhalily žádné zvláštní riziko pro člověka. Žádné studie genotoxicity nebyly provedeny, protože je nepravděpodobné, že by učinná látka přímo působila na DNA nebo na jiný chromozomální materiál. Žádné studie fertility, časného embryonálního a postnatálního vývoje ani studie karcinogenity nebyly provedeny, protože se předpokládá, že chronické podávání zvířatům by bylo spojeno s vývojem neutralizujících protilátek proti lidskému proteinu.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek:
Chlorid sodný
Sacharosa
Natrium-citrát
Valin
Alanin
Threonin
Rozpouštědlo:
Voda na injekci
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6.
K podání přípravku použijte pouze stříkačku bez silikonu (dodávanou v balení).
6.3 Doba použitelnosti
2 roky.
Po rekonstituci by měl být přípravek použit okamžitě. Chemická a fyzikální stabilita přípravku připraveného k použití však byla prokázána po dobu 3 hodin při pokojové teplotě (15 °C - 25 °C).
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C. Chraňte před mrazem. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem. Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení 500 jednotek C1 antiesterasy v injekční lahvičce z bezbarvého skla (typu I) uzavřené pryžovou zátkou (typu I) a hliníkovým uzávěrem s plastovým odlamovacím víčkem (flip-off).
5 ml vody na injekci v injekční lahvičce z bezbarvého skla (typu I) uzavřené pryžovou zátkou (typu I) a hliníkovým uzávěrem s plastovým odlamovacím víčkem.
Jedno balení obsahuje:
dvě injekční lahvičky s práškem,
dvě injekční lahvičky s rozpouštědlem,
2 přepouštěcí filtry, 1 jednorázovou 10ml injekční stříkačku, 1 soupravu pro venepunkci a 1 ochrannou podložku.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Rekonstituce a podávání přípravku Cinryze
Rekonstituce, podávání přípravku a zacházení se soupravou pro podání a jehlami se musí provádět opatrně.
Používejte buď přepouštěcí filtr dodávaný společně s přípravkem Cinryze, nebo komerčně dostupnou dvojitou jehlu.
Příprava a zacházení
Přípravek Cinryze je určen pro intravenózní podání po rekonstituci vodou na injekci.
Injekční lahvička přípravku Cinryze je pouze na jednorázové použití.
Rekonstituce
Jedna injekční lahvička s přípravkem se rekonstituuje v 5 ml vody na injekci.
Dvě injekční lahvičky rekonstituovaného přípravku Cinryze se spojí do jedné dávky (1000 jednotek).
1. Pracujte na dodané podložce a před provedením následujících kroků si umyjte ruce.
2. Při rekonstituci je potřeba pracovat asepticky.
3. Zajistěte, aby injekční lahvička s práškem a injekční lahvička s rozpouštědlem měly pokojovou teplotu (15 °C - 25 °C).
4. Uvolněte štítek injekční lahvičky s práškem odtržením perforovaného proužku označeného otočeným trojúhelníkem.
5. Odstraňte plastová víčka z injekční lahvičky s práškem a rozpouštědlem.
6. Zátky otřete desinfekčním tamponem a před použitím je nechte oschnout.
7. Odstraňte ochranný kryt z krabičky přepouštěcího filtru. Nevyndávejte filtr z krabičky.
8. Poznámka: přepouštěcí filtr musí být nejdříve připojen k injekční lahvičce s rozpouštědlem před připojením k injekční lahvičce s práškem, aby se zamezilo porušení vakua uvnitř injekční lahvičky s práškem. Umístěte injekční lahvičku s rozpouštědlem na rovný povrch a vsuňte modrý konec přepouštěcího filtru do injekční lahvičky s rozpouštědlem tak, že budete tlačit hrotem do středu zátky injekční lahvičky s rozpouštědlem, dokud hrot nepronikne dovnitř a filtr nezapadne na své místo. Přepouštěcí filtr musí být před proděravěním zátkového uzávěru ve vertikální poloze.
9. Odstraňte plastovou krabičku z přepouštěcího filtru a vyhoďte ji. Dávejte pozor, abyste se nedotkli nechráněného konce přepouštěcího filtru.
10. Umístěte injekční lahvičku s práškem na rovný povrch. Převraťte přepouštěcí filtr a injekční lahvičku s rozpouštědlem obsahující vodu na injekci a vsuňte průhledný konec přepouštěcího filtru do injekční lahvičky s práškem tak, že budete tlačit hrotem do pryžové zátky, dokud hrot nepronikne dovnitř a filtr nezapadne na své místo. Přepouštěcí filtr musí být před proděravěním zátkového uzávěru injekční lahvičky s práškem ve vertikální poloze. Vakuum v injekční lahvičce s práškem nasaje rozpouštědlo. Není-li v injekční lahvičce vakuum, přípravek nepoužívejte.
11. Zlehka míchejte injekční lahvičkou s práškem, dokud se všechen prášek nerozpustí. Netřepejte injekční lahvičkou s práškem. Ujistěte se, že všechen prášek je zcela rozpuštěný.
12. Odpojte injekční lahvičku s rozpouštědlem tak, že jí otočíte proti směru hodinových ručiček. Nevyjímejte průhledný konec přepouštěcího filtru z injekční lahvičky s práškem.
Jedna injekční lahvička rekonstituovaného přípravku Cinryze obsahuje 500 jednotek C1 antiesterasy v 5 ml, z čehož vyplývá koncentrace 100 jednotek/ml.
Musí se rekonstituovat dvě injekční lahvičky přípravku Cinryze, aby vznikla jedna dávka (1000 jednotek/10 ml). Proto zopakujte pokyny 1 až 12 uvedené výše s použitím další krabičky obsahující přepouštěcí filtr k rekonstituci druhé ze dvou injekčních lahviček s práškem. Nepoužívejte přepouštěcí filtr opakovaně.
Postup podávání
1. Při podávání je potřeba pracovat asepticky.
2. Po rekonstituci je roztok přípravku Cinryze bezbarvý až slabě namodralý a čirý. Nepoužívejte přípravek, jestliže je roztok zakalený nebo jinak zabarvený.
3. Do sterilní 10 ml injekční stříkačky na jedno použití natáhněte potáhnutím pístu přibližně 5 ml vzduchu.
4. Připojte stříkačku na vrchní část průhledného konce přepouštěcího filtru otočením po směru hodinových ručiček.
5. Pozvolna převraťte injekční lahvičku a vstříkněte vzduch do roztoku, a potom pomalu natáhněte rekonstituovaný roztok přípravku Cinryze do stříkačky.
6. Odpojte stříkačku od injekční lahvičky tak, že jí pootočíte proti směru hodinových ručiček a uvolníte z průhledného konce přepouštěcího filtru.
7. Použijte stejnou stříkačku a s druhou injekční lahvičkou rekonstituovaného přípravku Cinryze zopakujte kroky 3 až 6, aby vznikla jedna celá 10 ml dávka.
8. Před podáním zkontrolujte, zda v rekonstituovaném roztoku přípravku Cinryze nejsou přítomny částice; nepoužívejte, pokud vidíte částice.
9. Připojte ke stříkačce obsahující roztok přípravku Cinryze soupravu pro venepunkci a vstříkněte intravenózně pacientovi. Podejte 1000 jednotek (rekonstituovaných v 10 ml vody na injekci) přípravku Cinryze intravenózní injekcí rychlostí 1 ml za minutu v průběhu 10 minut.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Shire Services BVBA Rue Montoyer 47 B - 1000 Brusel Belgie
8. REGISTRAČNÍ ČÍSLO
EU/1/11/688/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 15. června 2011 Datum posledního prodloužení registrace:
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE/VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY / BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY / BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce biologické léčivé látky
Sanquin Blood Supply Foundation Plesmanlaan 125 NL-1066 CX Amsterdam Nizozemsko
Název a adresa výrobce odpovědného za propouštění šarží
Shire Services BVBA Rue Montoyer 47 B - 1000 Brusel Belgie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
TTV 1 ř V, V f V V r
• Úřední propouštění sarzí
Podle článku 114 směrnice 2001/83/ES bude úřední propouštění šarží provádět některá státní laboratoř nebo laboratoř k tomuto účelu určená.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES ajakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Další opatření k minimalizaci rizik
Před uvedením přípravku do každého členského státu musí držitel rozhodnutí o registraci odsouhlasit obsah a formu informačního materiálu s národním kompetentním orgánem.
Držitel rozhodnutí o registraci musí zajistit, aby všichni lékaři, u kterých se předpokládá, že budou předepisovat přípravek Cinryze, obdrželi informační balíček.
Informační balíček musí obsahovat následující položky:
Souhrn údajů o přípravku a příbalovou informaci pro pacienty k přípravku Cinryze Edukační materiál pro lékaře Edukační materiál pro nelékaře
Edukační materiál pro lékaře musí obsahovat informace o následujících klíčových bodech:
Existují omezené údaje o použití tohoto léčivého přípravku v domácí péči a při samopodávání.
Je na zodpovědnosti předepisujícího lékaře, aby rozhodnul o tom, kteří pacienti jsou vhodní pro domácí léčbu nebo samopodávání přípravku Cinryze.
Je na zodpovědnosti předepisujícího lékaře, aby zajistil vhodnou instruktáž osobám (nelékařům), které budou podávat přípravek doma, např. pacient při samopodávání nebo člen rodiny. Je potřeba provádět pravidelnou kontrolu podávání pacientem/pečovatelem, aby bylo zajištěno udržení optimální techniky podávání.
Požadovaná instruktáž musí být zaměřena na následující body Opatření pro uchovávání Dávky a indikace k léčbě
Příprava jedné dávky přípravku Cinryze (1000 jednotek) rekonstitucí dvou injekčních lahviček Způsob rekonstituce jedné injekční lahvičky Technika intravenózní injekce
Způsob a rychlost podávání jedné dávky přípravku Cinryze (1000 jednotek)
Pokyny pro vyhledání akutního lékařského ošetření v případě, že se nepodaří zajistit přístup do žíly,
nebo v případě nedostatečné účinnosti
Pokyny pro zvládnutí možných nežádoucích účinků
Informace o nutnosti vést deník, do kterého se zaznamená každé podání provedené doma, a o nutnosti nosit ho na každou návštěvu lékaře. Zaznamenané informace musí zahrnovat:
Datum a čas podání
Číslo šarže a podanou dávku
Indikaci k léčbě (akutní ataka nebo profylaxe)
Odpověď na léčbu Jakékoliv nežádoucí účinky
Je na zodpovědnosti předepisujícího lékaře, aby ověřil, že pacient/pečovatel zvládnul všechny dovednosti nezbytné k podání dávky a že přípravek Cinryze může být bezpečně a účinně podáván doma.
Existence postmarketingového registru, do něhož mají lékaři zadávat pacienty.
Edukační materiál pro nelékaře musí obsahovat informace o následujících klíčových bodech:
Existují omezené údaje o použití tohoto léčivého přípravku v domácí péči nebo při samopodávání.
U některých pacientů může předepisující lékař rozhodnout, že přípravek Cinryze může podávat doma např. člen rodiny nebo si ho pacient může podávat sám.
Dovednosti nezbytné k podání dávky, které musí nelékař zvládnout před tím, než může přípravek Cinryze podávat bezpečně a účinně doma.
Předepisující lékař zajistí instruktáž týkající se následujících bodů:
Opatření pro uchovávání Dávky a indikace k léčbě
Příprava jedné dávky přípravku Cinryze (1000 jednotek) rekonstitucí dvou injekčních lahviček Způsob rekonstituce jedné injekční lahvičky Technika intravenózní injekce
Způsob a rychlost podávání jedné dávky přípravku Cinryze (1000 jednotek)
Pokyny pro vyhledání akutního lékařského ošetření v případě, že se nepodaří zajistit přístup do žíly,
nebo v případě nedostatečné účinnosti
Pokyny pro zvládnutí možných nežádoucích účinků
Informace o nutnosti vést deník, do kterého se zaznamená každé podání provedené doma, a o nutnosti nosit ho na každou návštěvu lékaře. Zaznamenané informace musí zahrnovat:
Datum a čas podání
Číslo šarže a podanou dávku
Indikaci k léčbě (akutní ataka nebo profylaxe)
Odpověď na léčbu Jakékoliv nežádoucí účinky
Informace obsahující podrobné informace o klíčových bodech instruktáže, která bude uschována doma pro pozdější potřebu.
• Povinnost uskutečnit poregistrační opatření
Držitel rozhodnutí o registraci uskuteční v daném termínu níže uvedená opatření:
|
Popis |
Termín splnění |
|
Postmarketingový registr by měl být zřízen s cílem získání dodatečných informací o bezpečnosti a použití přípravku Cinryze v EU. Další informace, které budou sbírány, zahrnují údaje o expozici léku, nežádoucích účincích, frekvenci atak, údaje o dlouhodobé bezpečnosti, použití u těhotných pacientek s výsledky těhotenství, stejně jako použití v pediatrické populaci. Zvláštní pozornost by měla být věnována sledování případů závažných a laryngálních atak, stejně jako případů, u nichž léčba začala později než za 4 hodiny po vzniku ataky; podrobnosti o podané dávce, časovém rozvržení dávek a výsledcích bezpečnosti a účinnosti je nutno hlásit. Údaje shromážděné v tomto registru je nutno hlásit CHMP (Výbor pro humánní léčivé přípravky) v době předložení PSUR (periodicky aktualizovaná zpráva o bezpečnosti). |
Cyklus PSUR |
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Cinryze 500 jednotek, prášek pro injekční roztok a rozpouštědlo Antiesterasum-Cl (humanum)
2. OBSAH LÉČIVÉ LÁTKY
Po rekonstituci obsahuje jedna injekční lahvička 500 jednotek C1 antiesterasy (lidské) v 5 ml, což odpovídá koncentraci 100 jednotek/ml. Dvě injekční lahvičky rekonstituovaného přípravku Cinryze se spojí do jedné dávky.
3. SEZNAM POMOCNÝCH LÁTEK
Injekční lahvička s práškem: chlorid sodný, sacharosa, natrium-citrát, valin, alanin, threonin Injekční lahvička s rozpouštědlem: voda na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek pro injekční roztok a rozpouštědlo.
2 injekční lahvičky s práškem 2 injekční lahvičky s rozpouštědlem 2 přepouštěcí filtry 1 jednorázová 10ml injekční stříkačka 1 souprava pro venepunkci 1 ochranná podložka
5. ZPŮSOB A CESTA PODÁNÍ
Intravenózní podání.
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 25 °C. Chraňte před mrazem. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Shire Services BVBA Rue Montoyer 47 B - 1000 Brusel Belgie
12. REGISTRAČNÍ ČÍSLO
EU/1/11/688/001
13. ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Cinryze
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR - DATA ČITELNÁ OKEM
PC:
SN:
NN:
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Cinryze 500 jednotek, prášek pro injekční roztok Antiesterasum-Cl (humanum)
I.v. podání
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
500 jednotek
6. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Rozpouštědlo přípravku Cinryze Voda na injekci
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
5 ml
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
Cinryze 500 jednotek, prášek pro injekční roztok a rozpouštědlo
Antiesterasum-C1 (humanum)
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
• Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je přípravek Cinryze a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Cinryze užívat
3. Jak se přípravek Cinryze užívá
4. Možné nežádoucí účinky
5. Jak přípravek Cinryze uchovávat
6. Obsah balení a další informace
1. Co je přípravek Cinryze a k čemu se používá
Přípravek Cinryze obsahuje jako léčivou látku lidskou bílkovinu nazývanou „C1 antiesterasa“.
C1 antiesterasa je přirozeně se vyskytující bílkovina, která je normálně přítomná v krvi. Jestliže máte v krvi nízké množství C1 antiesterasy nebo C1 antiesterasa nepracuje správně, mohou se vyskytovat ataky otoků (zvané angioedém). Mezi příznaky může patřit bolest břicha a otoky:
• rukou a nohou (od kotníků dolů)
• tváří, očních víček, rtů nebo jazyka
• hrtanu (laryngu), což může ztěžovat dýchání
• pohlavních orgánů
U dospělých a dospívajících ve věku 12 až 17 let lze přípravkem Cinryze zvýšit množství C1 antiesterasy v krvi, čímž se buď předejde (rutinně nebo před podstoupením lékařských či zubních zákroků) vzniku atak otoku, nebo se ataka zastaví, pokud již začala.
2. Čemu musíte věnovat pozornost, než začnete přípravek Cinryze užívat
Neužívejte přípravek Cinryze
• jestliže jste alergický(á) na C1 antiesterasu nebo na kteroukoli další složku přípravku Cinryze (uvedenou v bodě 6). Je důležité, abyste svého lékaře informoval(a), jestliže máte pocit, že jste někdy měl(a) alergickou reakci na kteroukoli složku přípravku Cinryze.
Upozornění a opatření
• Před zahájením léčby přípravkem Cinryze je důležité, abyste svého lékaře informoval(a), jestliže máte nebo jste měl(a) potíže se srážlivostí krve (trombotické příhody). Je-li toto váš případ, budete pozorně sledován(a).
• Jestliže se u vás po podání přípravku Cinryze objeví vyrážky, stísněný pocit na hrudi, sípání nebo zrychlený tlukot srdce, okamžitě informujte svého lékaře. Viz bod 4.
• Vyrábí-li se léky z lidské krve nebo plazmy, zavádějí se určitá opatření, která zamezují přenosu infekce na pacienty. Ta zahrnují pečlivý výběr dárců krve a plazmy, aby se zajistilo, že budou vyřazeni možní přenašeči infekce, a vyšetření každé odebrané dávky a poolu plazmy na přítomnost viru/infekce. Výrobci těchto přípravků také začleňují do procesu zpracování krve nebo plazmy takové kroky, které viry zničí nebo odstraní. Pokud se léky připravené z lidské krve nebo plazmy podávají, nelze ani přes tato opatření možnost přenosu infekce zcela vyloučit. Totéž platí pro jakékoli neznámé nebo vznikající viry a další typy infekcí.
Předpokládá se, že přijatá opatření jsou účinná na obalené viry, jako virus lidské imunodeficience (HIV), virus hepatitidy B a hepatitidy C, a na neobalené viry - virus hepatitidy A a parvovirus B19.
Jestliže pravidelně nebo opakovaně dostáváte přípravky s C1 antiesterasou, které byly vyrobeny z lidské plazmy, může vám lékař doporučit, abyste zvážil(a) očkování proti hepatitidě A a B.
Důrazně se doporučuje, aby sestra nebo lékař pokaždé, když dostanete dávku přípravku Cinryze, zaznamenali název a číslo šarže přípravku, aby se zachoval záznam použitých šarží.
Děti
Přípravek Cinryze není určen pro použití u dětí ve věku do 12 let.
Další léčivé přípravky a přípravek Cinryze
Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete užívat přípravek Cinryze. Existují jen omezené informace o bezpečnosti přípravku Cinryze při podávání v průběhu těhotenství a kojení. Váš lékař s vámi pohovoří o rizicích a přínosech užívání tohoto léku.
Řízení dopravních prostředků a obsluha strojů
Přípravek Cinryze má malý vliv na schopnost řídit a obsluhovat stroje.
Přípravek Cinryze obsahuje sodík
Jedna injekční lahvička přípravku Cinryze obsahuje přibližně 11,5 mg sodíku. Nutno vzít v úvahu u pacientů na dietě s nízkým obsahem sodíku.
3. Jak se přípravek Cinryze užívá
Vaše léčba bude zahájena a vedena pod dohledem lékaře se zkušenostmi s péčí o pacienty s hereditárním angioedémem (HAE).
Přípravek Cinryze vám může připravit a podat lékař nebo sestra. Jestliže Váš lékař rozhodne, že si můžete lék podávat sám/sama, lékař nebo zdravotní sestra Vás nebo člena Vaší rodiny naučí, jak připravit a podat injekci přípravku Cinryze. Váš lékař s Vámi nebo členem Vaší rodiny v pravidelných intervalech zkontroluje způsob přípravy a podání.
Doporučená dávka přípravku Cinryze pro dospělé, dospívající, starší osoby nebo pacienty s potížemi s ledvinami nebo játry je následující:
Léčba atak otoku
• Přípravek Cinryze v dávce 1000 jednotek (dvě injekční lahvičky) se podává při první známce ataky otoku.
• Druhou injekci 1000 jednotek lze podat, pokud se příznaky nezlepší po 60 minutách.
• Pokud máte silnou ataku, zejména otok hrtanu (laryngu), nebo pokud se započetí léčby opozdí, je možné podat druhou dávku o velikosti 1000 jednotek dříve než za 60 minut po první dávce v závislosti na vaší klinické odpovědi.
• Přípravek Cinryze se podává nitrožilně (do žíly).
Prevence atak otoku
• Přípravek Cinryze v dávce 1000 jednotek (dvě injekční lahvičky) se podává při běžné prevenci atak otoku každé 3 až 4 dny.
• Lékař může interval mezi dávkováním přizpůsobit v závislosti na vaší odpovědi na přípravek Cinryze.
• Přípravek Cinryze se podává nitrožilně (do žíly).
Prevence atak otoku před chirurgickým zákrokem
• Přípravek Cinryze v dávce 1000 jednotek (dvě injekční lahvičky) se podává až 24 hodin před lékařským, zubařským nebo chirurgickým zákrokem.
• Přípravek Cinryze se podává nitrožilně (do žíly).
Rekonstituce a způsob podání
Přípravek Cinryze většinou lékař nebo zdravotní sestra vstřikuje do žíly (intravenózně). Vy nebo váš pečovatel/vaše pečovatelka můžete také podávat přípravek Cinryze jako injekci, avšak pouze tehdy, absolvujete-li odpovídající instruktáž. Pokud si injekci přípravku Cinryze podáváte sám/sama, vždy jej používejte přesně podle pokynů svého lékaře. Jestliže si nejste jistý(á), poraďte se se svým lékařem. Jestliže váš lékař rozhodne, že jste vhodný/á pro takovou domácí léčbu, dá vám podrobné pokyny. Budete si muset vést deník, do kterého zaznamenáte každé podání provedené doma, a přinesete ho na každou návštěvu u lékaře. Vaše injekční technika, příp. injekční technika vašeho pečovatele/pečovatelky bude pravidelně kontrolována, aby i nadále byla zajištěna správná manipulace.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i přípravek Cinryze nežádoucí účinky, které se ale nemusí vyskytnout u každého.
To může zahrnovat reakce alergického typu.
Jestliže po použití tohoto léku zaznamenáte kterýkoli z následujících příznaků, okamžitě informujte svého lékaře. Přestože se vyskytují vzácně, mohou být závažné.
Náhlé sípání, dechové potíže, otok očních víček, tváří nebo rtů, vyrážka nebo svědění (zejména pokud postihuje celé tělo).
Časté nežádoucí účinky (mohou postihnout až 1 z 10 lidí): vyrážka.
Méně časté nežádoucí účinky (mohou postihnout až 1 ze 100 lidí): vysoká hladina krevního cukru, závrať, bolest hlavy, krevní sraženiny, bolestivé žíly, návaly horka, kašel, pocit na zvracení, zvracení, bolest břicha, průjem, šupinatění, svědění nebo zarudnutí kůže, otoky a bolest kloubů, bolest svalů, vyrážka nebo bolestivost v místě vpichu, nepříjemný pocit na hrudi a horečka.
Očekává se, že nežádoucí účinky u dospívajících pacientů jsou podobné jako u dospělých.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové
informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Cinryze uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte přípravek Cinryze po uplynutí doby použitelnosti uvedené na krabičce a injekčních lahvičkách za EXP.
Uchovávejte při teplotě do 25 °C. Chraňte před mrazem. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Po rekonstituci roztok přípravku Cinryze okamžitě použijte.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Cinryze obsahuje
Léčivou látkou je C1 antiesterasa (lidská) vyrobená z plazmy lidských dárců. Jedna injekční lahvička s práškem obsahuje 500 jednotek C1 antiesterasy. Po rekonstituci obsahuje jedna injekční lahvička 500 jednotek (U) C1 antiesterasy (lidské) v 5 ml. Pro přípravu jedné dávky, odpovídající koncentraci 100 U/ml, jsou potřeba dvě lahvičky rekonstituovaného přípravku Cinryze.
Celkový obsah bílkovin v rekonstituovaném roztoku je 15 ± 5 mg/ml.
Jedna jednotka je ekvivalentní průměrnému množství C1 antiesterasy přítomnému v 1 ml normální lidské plazmy.
Dalšími složkami (pomocnými látkami) jsou:
Injekční lahvička s práškem: chlorid sodný, sacharosa, natrium-citrát, valin, alanin, threonin (viz bod 2).
Injekční lahvička s rozpouštědlem: voda na injekci
Jak přípravek Cinryze vypadá a co obsahuje toto balení
Přípravek Cinryze je bílý prášek v injekční lahvičce.
Po rozpuštění ve vodě na injekci je roztok čirý a bezbarvý až slabě namodralý.
Jedno balení přípravku Cinryze obsahuje:
2 injekční lahvičky přípravku Cinryze 500 jednotek, prášek pro přípravu injekčního roztoku 2 injekční lahvičky s vodou na injekci (každá obsahující 5 ml)
2 přepouštěcí filtry
1 jednorázovou 10ml injekční stříkačku 1 soupravu pro venepunkci 1 ochrannou podložku
K podání přípravku použijte pouze stříkačku bez silikonu (dodávanou v balení).
Držitel rozhodnutí o registraci a výrobce:
Shire Services BVBA Rue Montoyer 47 B - 1000 Brusel, Belgie medinfoeuceemea@shire.com
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/. Na těchto stránkách naleznete též odkazy na další webové stránky týkající se vzácných onemocnění a jejich léčby.
Následující informace jsou určeny pouze pro lékaře:
Rekonstituce a podávání přípravku Cinrvze
Rekonstituce, podávání přípravku a zacházení se soupravou pro podání a jehlami se musí provádět opatrně.
Používejte buď přepouštěcí filtr dodávaný společně s přípravkem Cinryze, nebo komerčně dostupnou dvojitou jehlu.
K podání přípravku použijte pouze stříkačku bez silikonu (dodávanou v balení).
Příprava a zacházení
Přípravek Cinryze je určen pro intravenózní podání (do žíly) po rekonstituci vodou na injekci. Injekční lahvička přípravku Cinryze je pouze na jednorázové použití.
Rekonstituce
Jedna injekční lahvička s přípravkem se rekonstituuje v 5 ml vody na injekci.
Dvě injekční lahvičky rekonstituovaného přípravku Cinryze se spojí do jedné dávky (1000 jednotek).
1. Pracujte na dodané podložce a před provedením následujících kroků si umyjte ruce.
2. Při rekonstituci je potřeba pracovat asepticky.
3. Zajistěte, aby injekční lahvička s práškem a injekční lahvička s rozpouštědlem měly pokojovou teplotu (15 °C - 25 °C).
4. Uvolněte štítek injekční lahvičky s práškem odtržením perforovaného proužku označeného otočeným trojúhelníkem.
5. Odstraňte plastová víčka z injekční lahvičky s práškem a rozpouštědlem.
6. Zátky otřete desinfekčním tamponem a před použitím je nechte oschnout.
7. Odstraňte ochranný kryt z krabičky přepouštěcího filtru. Nevyndávejte filtr z krabičky.
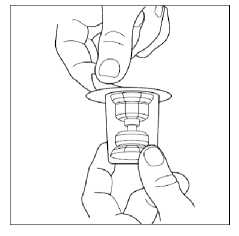
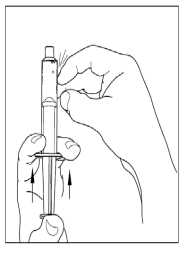
8. Poznámka: přepouštěcí filtr musí být nejdříve připojen k injekční lahvičce s rozpouštědlem před připojením k injekční lahvičce s práškem, aby se zamezilo porušení vakua uvnitř injekční lahvičky s práškem. Umístěte injekční lahvičku s rozpouštědlem na rovný povrch a vsuňte modrý konec přepouštěcího filtru do injekční lahvičky s rozpouštědlem tak, že budete tlačit hrotem do středu zátky injekční lahvičky s rozpouštědlem, dokud hrot nepronikne dovnitř a filtr nezapadne na své místo. Přepouštěcí filtr musí být před proděravěním zátkového uzávěru ve vertikální poloze.
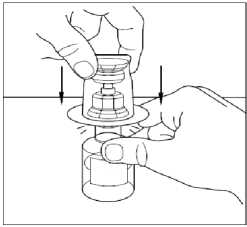
9. Odstraňte plastovou krabičku z přepouštěcího filtru a vyhoďte ji. Dávejte pozor, abyste se nedotkli nechráněného konce přepouštěcího filtru.
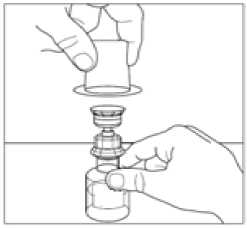
10. Umístěte injekční lahvičku s práškem na rovný povrch. Převraťte přepouštěcí filtr a injekční lahvičku s rozpouštědlem obsahující vodu na injekci a vsuňte průhledný konec přepouštěcího filtru do injekční lahvičky s práškem tak, že budete tlačit hrotem do pryžové zátky, dokud hrot nepronikne dovnitř a filtr nezapadne na své místo. Přepouštěcí filtr musí být před proděravěním zátkového uzávěru injekční lahvičky s práškem ve vertikální poloze. Vakuum v injekční lahvičce s práškem nasaje rozpouštědlo. Není-li v injekční lahvičce vakuum, přípravek nepoužívejte.
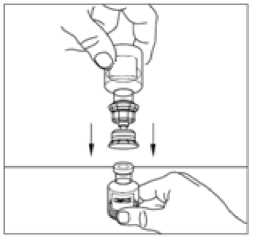
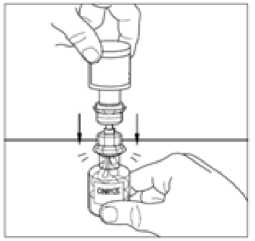
11. Zlehka míchejte injekční lahvičkou s práškem, dokud se všechen prášek nerozpustí. Netřepejte injekční lahvičkou s práškem. Ujistěte se, že všechen prášek je zcela rozpuštěný.
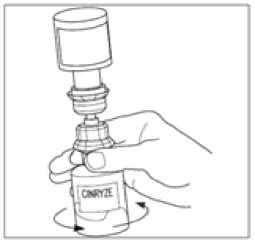
12. Odpojte injekční lahvičku s rozpouštědlem tak, že jí otočíte proti směru hodinových ručiček. Nevyjímejte průhledný konec přepouštěcího filtru z injekční lahvičky s práškem.
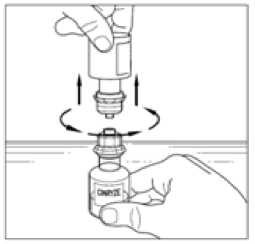
Jedna injekční lahvička rekonstituovaného přípravku Cinryze obsahuje 500 jednotek C1 antiesterasy v 5 ml, z čehož vyplývá koncentrace 100 jednotek/ml.
Musí se rekonstituovat dvě injekční lahvičky přípravku Cinryze, aby vznikla jedna dávka (1000 jednotek/10 ml). Proto zopakujte pokyny 1 až 12 uvedené výše s použitím další krabičky obsahující přepouštěcí filtr k rekonstituci druhé ze dvou injekčních lahviček s práškem. Nepoužívejte přepouštěcí filtr opakovaně.
Postup podávání
1. Při podávání je potřeba pracovat asepticky.
2. Po rekonstituci je roztok přípravku Cinryze bezbarvý až slabě namodralý a čirý. Nepoužívejte přípravek, jestliže je roztok zakalený nebo jinak zabarvený.
3. Do sterilní 10 ml injekční stříkačky na jedno použití natáhněte potáhnutím pístu přibližně 5 ml vzduchu.
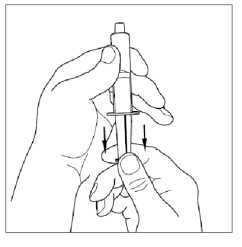
4. Připojte stříkačku na vrchní část průhledného konce přepouštěcího filtru otočením po směru hodinových ručiček.
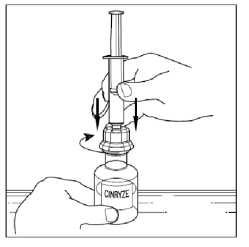
5. Pozvolna převraťte injekční lahvičku a vstříkněte vzduch do roztoku, a potom pomalu natáhněte rekonstituovaný roztok přípravku Cinryze do stříkačky.
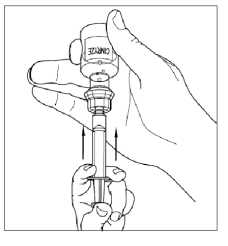
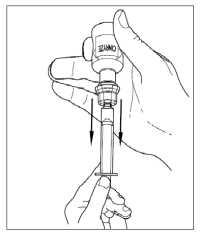
6. Odpojte stříkačku od injekční lahvičky tak, že jí pootočíte proti směru hodinových ručiček a uvolníte z průhledného konce přepouštěcího filtru.
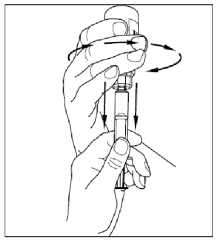
7. Použijte stejnou stříkačku a s druhou injekční lahvičkou rekonstituovaného přípravku Cinryze zopakujte kroky 3 až 6, aby vznikla jedna celá 10 ml dávka.
8. Před podáním zkontrolujte, zda v rekonstituovaném roztoku přípravku Cinryze nejsou přítomny částice; nepoužívejte, pokud vidíte částice.
9. Připojte ke stříkačce obsahující roztok přípravku Cinryze soupravu pro venepunkci a vstříkněte intravenózně (do žíly) pacientovi. Podejte 1000 jednotek (rekonstituovaných v 10 ml vody na injekci) přípravku Cinryze intravenózní injekcí (do žíly) rychlostí 1 ml za minutu v průběhu
10 minut.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
33