Ciambra 500 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
CIAMBRA 100 mg prášek pro koncentrát pro infuzní roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna injekční lahvička obsahuje pemetrexedum 100 mg (jako pemetrexedum dinatricum dihemihydricum).
Po rekonstituci (viz bod 6.6) obsahuje jedna injekční lahvička pemetrexedum 25 mg/ml.
Pomocná látka se známým účinkem
Jedna injekční lahvička obsahuje přibližně 11 mg sodíku.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek pro koncentrát pro infuzní roztok.
Bílý až téměř bílý lyofilizovaný prášek. pH rekonstituovaného roztoku je v rozmezí 6,6 a 7,8. Osmolalita rekonstituovaného roztoku je 230-270 mosmol/kg.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Maligní mezoteliom pleury
Přípravek CIAMBRA je v kombinaci s cisplatinou indikován k léčbě pacientů bez předchozí chemoterapie s neresekovatelným maligním mezoteliomem pleury.
Nemalobuněčný karcinom plic
Přípravek CIAMBRA je v kombinaci s cisplatinou indikován v první linii k léčbě pacientů s lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic jiného histologického typu, než predominantně z dlaždicových buněk (viz bod 5.1).
Přípravek CIAMBRA je indikován jako monoterapie k udržovací léčbě lokálně pokročilého nebo metastazujícího nemalobuněčného karcinomu plic jiného histologického typu, než predominantně z dlaždicových buněk u pacientů, u kterých po chemoterapii založené na platině nedošlo k bezprostřední progresi onemocnění (viz bod 5.1).
Přípravek CIAMBRA je indikován ve druhé linii jako monoterapie k léčbě pacientů s lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic jiného histologického typu, než predominantně z dlaždicových buněk (viz bod 5.1).
4.2 Dávkování a způsob podání
CIAMBRA se smí podávat pouze pod dohledem lékaře s kvalifikací pro používání protinádorové chemoterapie.
Dávkování
Přípravek CIAMBRA v kombinaci s cisplatinou
Doporučená dávka přípravku CIAMBRA je 500 mg/m2 tělesného povrchu (body surface area - BSA), podávaná jako intravenózní infUze po dobu 10 minut první den každého 21denního cyklu. Doporučená dávka cisplatiny je 75 mg/m2 BSA, podaná infuzí během dvou hodin, přibližně 30 minut po ukončení infuze pemetrexedu v první den každého 21dennního cyklu. Pacienti musejí dostávat přiměřenou antiemetickou terapii a hydrataci před a/nebo po podání cisplatiny (viz také Souhrn údajů o přípravku pro cisplatinu, kde jsou uvedena specifická doporučení k dávkování).
Přípravek CIAMBRA v monoterapii
U pacientů léčených pro nemalobuněčný karcinom plic po předcházející chemoterapii je doporučená dávka přípravku CIAMBRA 500 mg/m2 BSA podávaná jako intravenózní infuze po dobu 10 minut v první den každého 21denního cyklu.
Režim premedikace
Ke snížení výskytu a závažnosti kožních reakcí se podá kortikosteroid den před podáním pemetrexedu, v den jeho podání a v den po jeho podání. Kortikosteroid by měl být ekvivalentní 4 mg dexamethasonu podávanému perorálně dvakrát denně (viz bod 4.4).
Ke snížení toxicity musí pacienti léčení pemetrexedem dostávat rovněž vitamínovou suplementaci (viz bod 4.4). Pacienti musí denně užívat kyselinu listovou perorálně nebo multivitamíny s obsahem kyseliny listové (350 až 1000 mikrogramů). Během sedmi dnů před první dávkou pemetrexedu se musí podat nejméně pět dávek kyseliny listové a její podávání musí pokračovat v průběhu celé léčby a po dobu 21 dní po poslední dávce pemetrexedu. Pacienti musejí rovněž dostat intramuskulární injekci vitamínu B12 (1000 mikrogramů) v týdnu před první dávkou pemetrexedu a poté jednou za každé tři cykly. Další injekce vitamínu B12 se mohou podávat ve stejný den jako pemetrexed.
Monitorování
Pacienti používající pemetrexed musejí mít před každou dávkou monitorovaný celý krevní obraz, včetně diferenciálu a počtu trombocytů. Před každým podáním chemoterapie musí být provedeno biochemické vyšetření krve za účelem vyhodnocení funkce ledvin a jater. Před zahájením každého cyklu chemoterapie je nutné, aby pacienti měli následující výsledky vyšetření: absolutní počet neutrofilů (ANC) musí být > 1500 buněk/mm3 a počet trombocytů musí být > 100 000 buněk/mm3. Clearance kreatininu musí být > 45 ml/min.
Celkový bilirubin musí být < 1,5násobek horní hranice normálních hodnot. Alkalická fosfatáza (ALP), aspartátaminotransferáza (AST neboli SGOT) a alaninaminotransferáza (ALT neboli SGPT) musí být < 3násobek horní hranice normálních hodnot. V případě postižení jater tumorem jsou akceptovatelné hodnoty ALP, AST a ALT < 5násobek horní hranice normálních hodnot.
Úprava dávek
Úprava dávky při zahájení následného cyklu se provede na základě krevního obrazu v době nejhlubšího poklesu nebo na základě maximální nehematologické toxicity zjištěné v předchozím cyklu terapie. Léčbu lze odložit, aby byl dostatek času k úpravě. Po úpravě se pacienti léčí podle pokynů uvedených v tabulkách 1, 2 a 3, které se použijí v případě podávání přípravku CIAMBRA v monoterapii nebo v kombinaci s cisplatinou.
|
Tabulka 1 - Úprava dávek přípravku CIAMBRA (v monoterapii nebo v kombinaci) a cisplatiny - hematologické toxicity | |
|
ANC v době nejhlubšího poklesu < 500 /mm3 a počet trombocytů v době nejhlubšího poklesu > 50 000 /mm3 |
75 % předchozí dávky (přípravku CIAMBRA i cisplatiny) |
|
Počet trombocytů v době nejhlubšího poklesu < 50 000 /mm3 bez ohledu na ANC v době nejhlubšího poklesu |
75 % předchozí dávky (přípravku CIAMBRA i cisplatiny) |
|
Počet trombocytů v době nejhlubšího poklesu < 50 000/mm3 s krvácením a, bez ohledu na ANC v době nejhlubšího poklesu |
50 % předchozí dávky (přípravku CIAMBRA i cisplatiny) |
a dle obecných kritérií toxicity (CTC) podle National Cancer Institute (CTC v2.0, NCI 1998) definice krvácení > 2. stupně podle CTC.
Pokud u pacientů dojde k rozvoji nehematologické toxicity > 3. stupně (s výjimkou neurotoxicity), musí se přípravek CIAMBRA vysadit až do úpravy na hodnoty nižší nebo stejné, jako byly hodnoty před léčbou. Léčba se zahájí podle pokynů uvedených v tabulce 2.
|
Tabulka 2 - Úprava dávek přípravku CIAMBRA (v monoterapii nebo v kombinaci) a cisplatiny - nehematologické toxicity a’ b | ||
|
Dávka přípravku CIAMBRA (mg/m2) |
Dávka cisplatiny (mg/m2) | |
|
Jakákoli toxicita stupně 3 nebo 4 s výjimkou mukozitidy |
75 % předchozí dávky |
75 % předchozí dávky |
|
Jakýkoli průjem s nutností hospitalizace (bez ohledu na stupeň) nebo průjem stupně 3 |
75 % předchozí dávky |
75 % předchozí dávky |
|
Mukozitida stupně 3 nebo 4 |
50 % předchozí dávky |
100 % předchozí dávky |
|
a Obecná kritéria toxicity (CTC) podle |
National Cancer Institute (CTC v2.0; NCI 1998) b S výjimkou | |
neurotoxicity
V případě neurotoxicity je doporučená úprava dávky pro přípravek CIAMBRA a cisplatinu uvedena v tabulce 3. Pokud se vyskytnou projevy neurotoxicity stupně 3 nebo 4, pacienti musí léčbu přerušit.
|
Tabulka 3 - Úpravy dávek přípravku CIAMBRA (v monoterapii nebo v kombinaci) a cisplatiny - neurotoxicita | ||
|
Stupeň toxicity podle CTCa |
Dávka přípravku CIAMBRA (mg/m2) |
Dávka cisplatiny (mg/m2) |
|
0 - 1 |
100 % předchozí dávky |
100 % předchozí dávky |
|
2 |
100 % předchozí dávky |
50 % předchozí dávky |
a Obecná kritéria běžné toxicity podle National Cancer Institute (CTC v2.0; NCI 1998)
Léčba přípravkem CIAMBRA musí být přerušena, pokud se u pacienta vyskytnou jakékoli projevy hematologické nebo nehematologické toxicity stupně 3 nebo 4 po 2 sníženích dávky nebo ihned, pokud se vyskytnou projevy neurotoxicity stupně 3 nebo 4.
Starší pacienti
V klinických studiích nebyly žádné známky, že by pacienti ve věku 65 let nebo starší měli zvýšené riziko nežádoucích účinků v porovnání s pacienty mladšími 65 let. Není nutné žádné snížení dávky kromě případů, kdy je toto snížení nezbytné pro všechny pacienty.
Pediatrická populace
Použití přípravku CIAMBRA u maligního mezoteliomu pleury a nemalobuněčného karcinomu plic není u pediatrické populace relevantní.
Pacienti s poruchou funkce ledvin (standardní Cockcroftův a Gaultův vzorec nebo rychlost glomerulární filtrace měřená metodou clearance Tc99m-DPTA v séru)
Pemetrexed se primárně vylučuje v nezměněné formě ledvinami. V klinických studiích nebyla u pacientů s clearance kreatininu > 45 ml/min zapotřebí žádná úprava dávky, kromě úprav doporučovaných pro všechny pacienty. Údaje o použití pemetrexedu u pacientů s clearance kreatininu pod 45 ml/min jsou nedostatečné , a proto se u těchto pacientů používání pemetrexedu nedoporučuje (viz bod 4.4).
Pacienti s poruchou funkce jater
Nebyl zjištěn žádný vztah mezi AST (SGOT), ALT (SGPT) nebo celkovým bilirubinem a farmakokinetikou pemetrexedu. Nicméně, pacienti s poruchou funkce jater a bilirubinem >1,5krát vyšším, než je horní hranice normální hodnoty a/nebo aminotransferázami >3,0krát vyššími, než je horní hranice normálních hodnot (při absenci metastáz do jater) nebo >5,0krát vyššími, než je horní hranice normálních hodnot (při přítomnosti metastáz v játrech) nebyli specificky studováni.
Způsob podání
Opatření, která jsou nutná před zacházením s léčivým přípravkem CIAMBRA nebo před jeho podáním, naleznete v bodě 6.6.
CIAMBRA se podává jako intravenózní infuze po dobu 10-ti minut první den každého 21denního cyklu. Pokyny pro rekonstituci a naředění přípravku CIAMBRA před jeho podáním naleznete v bodě 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Kojení (viz bod 4.6).
Současné podávání vakcíny proti žluté zimnici (viz bod 4.5).
4.4 Zvláštní upozornění a opatření pro použití
Pemetrexed může potlačit funkci kostní dřeně, která se manifestuje jako neutropenie, trombocytopenie a anémie (nebo pancytopenie) (viz bod 4.8). Útlum kostní dřeně představuje obvykle toxicitu, která limituje velikost použité dávky. Pacienti musí být během léčby sledováni z hlediska myelosuprese a pemetrexed se nesmí podat do doby, než se absolutní počet neutrofilů (ANC) nevrátí na hodnoty >
1 500 buněk/mm3 a počet trombocytů se nevrátí na hodnoty > 100 000 buněk/mm3. Úprava dávek v následujících cyklech je dána hodnotami absolutního počtu neutrofilů v době nejhlubšího poklesu, počtem trombocytů a maximální nehematologickou toxicitou pozorovanou v předchozím cyklu (viz bod 4.2).
Pokud byla před léčbou podávána kyselina listová a vitamin B12, byla hlášena menší toxicita a snížení hematologické a nehematologické toxicity stupně 3 nebo 4, jako je neutropenie, febrilní neutropenie a infekce s neutropenií stupně 3 nebo 4. Proto musejí být všichni pacienti léčení pemetrexedem poučeni, aby užívali kyselinu listovou a vitamín B12 jako profylaktické opatření ke snížení toxicity související s léčbou (viz bod 4.2).
U pacientů, kteří nedostávali před léčbou kortikosteroid, byly popsány kožní reakce. Podávání dexamethasonu (nebo ekvivalentního kortikosteroidu) před léčbou pemetredexem může snížit výskyt a závažnost kožních reakcí (viz bod 4.2).
Nebyl studován dostatečný počet pacientů s clearance kreatininu pod 45 ml/min. Proto se nedoporučuje používání pemetrexedu u pacientů s clearance kreatininu < 45 ml/min (viz bod 4.2).
Pacienti s lehkou až středně těžkou renální insuficiencí (clearance kreatininu 45 až 79 ml/min) by se měli vyvarovat užívání nesteroidních protizánětlivých léků (NSA), jako je ibuprofen a kyselina acetylsalicylová (> 1,3 g denně) dva dny před podáním pemetrexedu, v den jeho podání a dva dny po podání pemetrexedu (viz bod 4.5).
U pacientů s lehkou až středně těžkou renální insuficiencí, u kterých je terapie pemetrexedem vhodná, má být přerušeno užívání NSA s dlouhým eliminačním poločasem nejméně 5 dnů před podáním pemetrexedu, v den jeho podání a nejméně dva dny po podání pemetrexedu (viz bod 4.5).
V souvislosti s podáváním pemetrexedu samotného nebo v kombinaci s jinými chemoterapeutiky byly hlášeny závažné renální příhody, včetně akutního selhání ledvin. U mnoha pacientů, u kterých
k renálním příhodám došlo, existovaly rizikové faktory pro rozvoj těchto příhod, včetně dehydratace, preexistující hypertenze nebo diabetu.
Efekt tekutiny ve třetím prostoru, jako je pleurální výpotek nebo ascites, na pemetrexed není zcela stanoven. Klinická studie fáze 2 s pemetrexedem u 31 pacientů se solidním tumorem a se stabilním výpotkem ve třetím prostoru neprokázala žádný rozdíl v plazmatických koncentracích normalizovaných podle dávky a v clearance pemetrexedu oproti pacientům bez přítomnosti tekutiny ve třetím prostoru. Proto je vhodné před začátkem léčby pemetrexedem zvážit drenáž tekutiny z třetího prostoru, ale nemusí to být nutné.
V důsledku gastrointestinální toxicity pemetrexedu podávaného v kombinaci s cisplatinou byly popsány případy vážné dehydratace. Proto mají pacienti dostávat přiměřenou antiemetickou terapii a odpovídající hydrataci před podáním a případně i po podání medikace.
V průběhu klinických studií s pemetrexedem byly méně často hlášeny závažné kardiovaskulární příhody, zahrnující infarkt myokardu a cerebrovaskulární příhody, obvykle, když byl pemetrexed podáván v kombinaci s dalšími cytostatiky. Většina pacientů, u kterých byly tyto příhody pozorovány, měla preexistující kardiovaskulární rizikové faktory (viz bod 4.8).
Pokles imunity je častým jevem u pacientů s onkologickým onemocněním. Proto se nedoporučuje současné podávání živých oslabených vakcín (viz bod 4.3 a 4.5).
Pemetrexed může mít geneticky škodlivé účinky. Pohlavně zralým mužům se doporučuje, aby během léčby a až 6 měsíců po po jejím ukončení nepočali dítě. Doporučuje se používání antikoncepčních metod nebo abstinence. Vzhledem k možnosti, že by pemetrexed způsobil ireverzibilní neplodnost, se mužům doporučuje, aby před zahájením léčby vyhledali konzultaci o možnosti uchování spermií.
Ženy ve fertilním věku musejí během léčby pemetrexedem používat účinnou antikoncepční metodu (viz bod 4.6).
U pacientů léčených ozařováním před léčbou, v průběhu nebo následovně po léčbě pemetrexedem, byly hlášeny případy postradiační pneumonitidy. Těmto pacientům by měla být věnována zvýšená pozornost a opatrnost je také zapotřebí při použití dalších radiosenzibilizujících látek.
Byly hlášeny případy kožní reakce v místě předchozího ozařování (radiation recall) u pacientů ozařovaných před delší dobou - před týdny až roky.
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) v jedné lahvičce, tj. v podstatě je bez obsahu sodíku.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Pemetrexed se vylučuje hlavně ledvinami v nezměněné formě, a to tubulámí sekrecí a v menším rozsahu glomerulární filtrací. Souběžné podávání nefrotoxických léků (např. aminoglykosidy, kličková diuretika, sloučeniny platiny, cyklosporin) může vést k opožděné clearance pemetrexedu. Tato kombinace se musí používat s opatrností. Pokud je to nutné, má být pečlivě monitorována clearance kreatininu.
Souběžné podávání látek, které se rovněž vylučují tubulární sekrecí (např. probenecid, penicilin), může vést k opožděné clearance pemetrexedu. Při kombinaci těchto látek s pemetrexedem je zapotřebí zvýšené opatrnosti. Pokud je to nutné, má být pečlivě monitorována clearance kreatininu.
U pacientů s normální renální funkcí (clearance kreatininu > 80 ml/min) mohou vysoké dávky nesteroidních protizánětlivých léků (NSA, jako je ibuprofen >1 600 mg denně) a vysoké dávky kyseliny acetylsalicylové (> 1,3 g denně) snížit eliminaci pemetrexedu a tím zvýšit výskyt nežádoucích účinků. Proto je zapotřebí při současném podávání vyšších dávek NSA nebo kyseliny acetylsalicylové společně s pemetrexedem u pacientů s normální renální funkcí (clearance kreatininu > 80 ml/min) zvýšené opatrnosti.
Pacienti s lehkou až středně těžkou renální insuficiencí (clearance kreatininu 45 až 79 ml/min) se mají vyvarovat současného používání pemetrexedu s NSA (např. ibuprofen) nebo s vyššími dávkami kyseliny acetylsalicylové 2 dny před podáním pemetrexedu, v den jeho podání a 2 dny po podání pemetrexedu (viz bod 4.4).
Jelikož nejsou k dispozici údaje o potenciální interakci mezi pemetrexedem a NSA s delším poločasem, jako je piroxikam a rofekoxib, je potřebné jejich podávání pacientům s lehkou až středně těžkou renální insuficiencí přerušit nejméně 5 dní před podáním pemetrexedu, v den jeho podání a nejméně 2 dny po podání pemetrexedu (viz bod 4.4). Pokud je současné podávání NSA nezbytné, mají být pacienti důkladně monitorováni z hlediska toxicity, zejména myelosuprese a gastrointestinální toxicity.
Pemetrexed prochází omezeným jaterním metabolismem. Výsledky studií in vitro s lidskými jaterními mikrozomy ukázaly, že nelze předpovědět, zda pemetrexed způsobí klinicky významnou inhibici metabolické clearance léků metabolizovaných CYP3A, CYP2D6, CYP2C9 a CYP1A2.
Interakce běžné u všech cytotoxických látek
Vzhledem ke zvýšenému riziku trombózy u pacientů s maligním onemocněním je časté používání antikoagulační léčby. Vysoká intraindividuální variabilita koagulačního stavu při těchto chorobách a možnost interakce mezi perorálními antikoagulancii a protinádorovou chemoterapií vyžaduje zvýšenou frekvenci monitorování INR (International Normalised Ratio), pokud se rozhodneme léčit pacienta perorálními antikoagulancii.
Kontraindikované současné používání: vakcína proti žluté zimnici: riziko fatálního generalizovaného vakcinačního onemocnění (viz bod 4.3).
Nedoporučené současné používání: živé oslabené vakcíny (vyjma žluté zimnice, kdy je současné používání kontraindikováno): riziko systémové reakce s možným fatálním vyústěním. Toto riziko je zvýšeno u osob s již existujícím poklesem imunity způsobeným základním onemocněním. Kde je to možné, použijte inaktivované vakcíny (poliomyelitis) (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Antikoncepce u mužů a u žen
Ženy ve fertilním věku musí v průběhu léčby pemetrexedem používat účinnou antikoncepci. Pemetrexed může mít geneticky škodlivé účinky. Pohlavně zralým mužům se doporučuje, aby během léčby a až 6 měsíců po jejím ukončení nepočali dítě. Doporučuje se používání antikoncepčních metod nebo abstinence.
Neexistují údaje o použití pemetrexedu u těhotných žen, avšak je podezření, že pemetrexed tak jako ostatní antimetabolity způsobuje vážné vrozené vady, pokud je podáván v těhotenství. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Pemetrexed se nemá používat v těhotenství, pokud to není jednoznačně nezbytné a po pečlivém zvážení potřeby léčby u matky a rizika pro plod (viz bod 4.4).
Kojení
Není známo, zda se pemetrexed vylučuje do lidského mateřského mléka a nežádoucí účinky u kojeného dítěte nelze vyloučit. Při léčbě pemetrexedem musí být kojení přerušeno (viz bod 4.3).
Fertilita
Vzhledem k možnosti způsobit léčbou pemetrexedem ireverzibilní neplodnost se mužům doporučuje, aby před zahájením léčby vyhledali konzultaci o možnosti uchování spermií.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit a obsluhovat stroje nebyly provedeny. Bylo však popsáno, že pemetrexed může způsobovat únavu. Pacienti proto mají být upozorněni, aby neřídili nebo neobsluhovali stroje v případě, že se tyto nežádoucí účinky objeví.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nejčastěji hlášenými nežádoucími účinky v souvislosti s pemetrexedem používaným ať už v monoterapii nebo v kombinaci jsou útlum kostní dřeně, manifestující se jako anémie, neutropenie, leukopenie, trombocytopenie a gastrointestinální toxicita, manifestující se jako anorexie, nauzea, zvracení, průjem, zácpa, faryngitida, mukozitida a stomatitida. Další nežádoucí účinky zahrnují renální toxicitu, zvýšení hladin aminotransferáz, alopecii, únavu, dehydrataci, vyrážku, infekci /sepsi a neuropatii. Mezi vzácné nežádoucí účinky patří Stevens-Johnsonův syndrom a toxická epidermální nekrolýza.
Seznam nežádoucích účinků v tabulce
V tabulce níže je uvedena frekvence a závažnost nežádoucích účinků, které byly hlášeny u více než 5% ze 168 pacientů s mezoteliomem, kteří byli randomizováni k léčbě cisplatinou a pemetrexedem a u 163 pacientů s mezoteliomem, kteří byli randomizováni k léčbě cisplatinou v monoterapii. V obou léčebných ramenech byla pacientům, u kterých dosud nebyla prováděna chemoterapie, plně doplňována kyselina listová a vitamín B12.
Frekvence nežádoucích účinků je definována: Velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (>1/10 000 až <1/1000), velmi vzácné (<1/10 000) a není známo (z dostupných údajů nelze určit).
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Třída orgánových systémů |
F rekvence |
Nežádoucí účinek* |
pemetrexed/cisplatina |
cisplatina | ||
|
(N = 168) |
(N = 163) | |||||
|
Všechny stupně toxicity (%) |
T oxicita stupně 3-4 (%) |
Všechny stupně toxicity (%) |
Toxicita stupně 3-4 (%) | |||
|
Poruchy krve a lymfatického systému |
Velmi časté |
Neutrofily / granulocyty -snížení |
56,0 |
23,2 |
13,5 |
3,1 |
|
Leukocyty -snížení |
53,0 |
14,9 |
16,6 |
0,6 | ||
|
Hemoglobin -snížení |
26,2 |
4,2 |
10,4 |
0,0 | ||
|
Trombocyty -snížení |
23,2 |
5,4 |
8,6 |
0,0 | ||
|
Poruchy metabolismu a výživy |
v Časté |
Dehydratace |
6,5 |
4,2 |
0,6 |
0,6 |
|
Poruchy nervového systému |
Velmi časté |
Neuropatie -senzorická |
10,1 |
0,0 |
9,8 |
0,6 |
|
Časté |
Porucha chuti |
7,7 |
0,0*** |
6,1 |
0,0*** | |
|
Poruchy oka |
Časté |
Konjunktivitida |
5,4 |
0,0 |
0,6 |
0,0 |
|
Gastrointestinální poruchy |
Velmi časté |
16,7 |
3,6 |
8,0 |
0,0 | |
|
56,5 |
10,7 |
49,7 |
4,3 | |||
|
Stomatitida / faryngitida |
23,2 |
3,0 |
6,1 |
0,0 | ||
|
82,1 |
11,9 |
76,7 |
5,5 | |||
|
20,2 |
1,2 |
14,1 |
0,6 | |||
|
Zácpa |
11,9 |
0,6 |
7,4 |
0,6 | ||
|
Časté |
5,4 |
0,6 |
0,6 |
0,0 | ||
|
Poruchy kůže a podkožní tkáně |
Velmi časté |
16,1 |
0,6 |
4,9 |
0,0 | |
|
Alopecie |
11,3 |
0,0*** |
5,5 |
0,0*** | ||
|
Poruchy ledvin a močových cest |
Velmi časté |
Kreatinin -zvýšení |
10,7 |
0,6 |
9,8 |
1,2 |
|
Snížení clearance kreatininu** |
16,1 |
0,6 |
17,8 |
1,8 | ||
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Únava |
47,6 |
10,1 |
42,3 |
9,2 |
* Viz obecná kritéria toxicity (CTC) podle National Cancer Institute verze 2 pro každý stupeň toxicity s výjimkou termínu „snížení clearance kreatininu“
** který je odvozen z termínu „renální / urogenitální, jiné“
*** V souladu s CTC vydanými National Cancer Institute (v2.0; NCI 1998) by případy poruchy chuti a alopecie měly být hlášeny pouze jako stupeň 1 nebo 2.
Pro účely této tabulky byla použita hraniční hodnota 5 % pro zařazení všech příhod, kdy hlásící osoba považovala souvislost mezi příhodou a léčbou pemetrexedem a cisplatinou za možnou.
Klinicky relevantní projevy toxicity (dle CTC), které byly hlášeny v > 1 % a < 5 % u pacientů náhodným výběrem přidělených k léčbě cisplatinou a pemetrexedem, jsou: renální selhání, infekce, horečka, febrilní neutropenie, zvýšení AST, ALT a GGT, kopřivka a bolest na hrudi.
Klinicky relevantní projevy toxicity (dle CTC), které byly hlášeny u < 1% pacientů náhodným výběrem přidělených k léčbě cisplatinou a pemetrexedem, jsou: arytmie a motorická neuropatie.
V tabulce níže je uvedena frekvence a závažnost nežádoucích účinků, které byly hlášeny u více než 5% z 265 pacientů, kteří byli randomizováni k léčbě pemetrexedem v monoterapii, a kterým byla doplňována kyselina listová a vitamín B12 a u 276 pacientů, kteří byli randomizováni k léčbě docetaxelem v monoterapii. U všech pacientů byla stanovena diagnóza lokálně pokročilého nebo metastazujícího nemalobuněčného karcinomu plic a již byli léčeni chemoterapií.
|
Třída orgánových systémů |
Frekvence |
Nežádoucí účinek* |
pemetrexed N = 265 |
docetaxel N = 276 | ||
|
Všechny stupně toxicity (%) |
Toxicita stupně 3-4 (%) |
Všechny stupně toxicity (%) |
Toxicita stupně 3-4 (%) | |||
|
Poruchy krve a lymfatického systému |
Velmi časté |
Neutrofily / granulocyty -snížení |
10,9 |
5,3 |
45,3 |
40,2 |
|
Leukocyty - snížení |
12,1 |
4,2 |
34,1 |
27,2 | ||
|
Hemoglobin - snížení |
19,2 |
4,2 |
22,1 |
4,3 | ||
|
Časté |
Trombocyty -snížení |
8,3 |
1,9 |
1,1 |
0,4 | |
|
Gastrointe stinální poruchy |
Velmi časté |
12,8 |
0,4 |
24,3 |
2,5 | |
|
16,2 |
1,5 |
12,0 |
1,1 | |||
|
Stomatitida / faryngitida |
14,7 |
1,1 |
17,4 |
1,1 | ||
|
30,9 |
2,6 |
16,7 |
1,8 | |||
|
21,9 |
1,9 |
23,9 |
2,5 | |||
|
Časté |
Zácpa |
5,7 |
0,0 |
4,0 |
0,0 | |
|
Poruchy jater a žlučových cest |
Časté |
(SGPT (ALT) - zvýšení |
7,9 |
1,9 |
1,4 |
0,0 |
|
SGOT (AST) - zvýšení |
6,8 |
1,1 |
0,7 |
0,0 | ||
|
Poruchy kůže a podkožní tkáně |
Velmi časté |
Vyrážka / deskvamace |
14,0 |
0,0 |
6,2 |
0,0 |
|
Časté |
Pruritus |
6,8 |
0,4 |
1,8 |
0,0 | |
|
Alopecie |
6,4 |
0,4** |
37,7 |
2,2** | ||
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Únava |
34,0 |
5,3 |
35,9 |
5,4 |
|
Časté |
8,3 |
0,0 |
7,6 |
0,0 | ||
Viz obecná kritéria toxicity (CTC) podle Nationa
Cancer Institute verze 2 pro každý stupeň toxicity.
** V souladu s CTC vydanými National Cancer Institute (v2.0; NCI 1998) by případy alopecie měly být hlášeny pouze jako stupeň 1 nebo 2.
Pro účely této tabulky byla použita hraniční hodnota 5 % pro zařazení všech příhod, kdy hlásící osoba považovala souvislost mezi příhodou a léčbou pemetrexedem za možnou.
Klinicky relevantní projevy toxicity (dle CTC), které byly hlášeny v > 1 % a < 5 % u pacientů náhodným výběrem přidělených k léčbě pemetrexedem, jsou: infekce bez neutropenie, febrilní neutropenie, alergická reakce / hypersenzitivita, zvýšení kreatininu, motorická neuropatie, senzorická neuropatie, erythema multiforme a bolest břicha.
Klinicky relevantní projevy toxicity (dle CTC), které byly hlášeny u < 1 % pacientů náhodným výběrem přidělených k léčbě pemetrexedem, jsou supraventrikulární arytmie.
Klinicky relevantní laboratorní projevy toxicity stupně 3 a 4 byly obdobné při hodnocení integrovaných výsledků 3 studií fáze 2 sledujících monoterapii pemetrexedem (n = 164) a studie fáze 3 sledující monoterapii pemetrexedem (popsána výše), s výjimkou neutropenie (12,8 % oproti 5,3 %) a zvýšení alaninaminotransferázy (15,2 % vs. 1,9 %). Tyto rozdíly byly pravděpodobně dány rozdíly v populaci pacientů, protože do studií fáze 2 byli zařazeni pacienti dosud neléčení chemoterapií a pacientky s karcinomem prsu, předem intenzivně léčené, s již existujícími metastázami do jater a/nebo s patologickými výchozími funkčními jaterními testy.
V tabulce níže je uvedena frekvence a závažnost nežádoucích účinků pravděpodobně souvisejících se studovanou medikací, které byly hlášeny u více než 5 % z 839 pacientů s NSCLC, kteří byli randomizováni k léčbě cisplatinou v kombinaci s pemetrexedem a z 830 pacientů s NSCLC, kteří byli randomizováni k léčbě cisplatinou v kombinaci s gemcitabinem. Všichni pacienti obdrželi studijní léčbu jako zahajovací léčbu lokálně pokročilého nebo metastazujícího nemalobuněčného karcinomu plic a pacienti v obou skupinách byli plně suplementováni kyselinou listovou a vitamínem B12.
|
Třída orgánových systémů |
Frekvence |
Nežádoucí účinek** |
pemetrexed / cisplatina (N = 839) |
gemcitabin / cisplatina (N = 830) | ||
|
Všechny stupně toxicity (%) |
Toxicita stupně 3-4 (%) |
Všechny stupně toxicity (%) |
T oxicita stupně 3-4 (%) | |||
|
Poruchy krve a lymfatického systému |
Velmi časté |
Hemoglobin -snížení |
33,0* |
5,6 * |
45,7* |
9,9* |
|
Neutrofily / granulocyty - snížení |
29,0* |
15,1* |
38,4* |
26,7* | ||
|
Leukocyty - snížení |
17,8 |
4,8 * |
20,6 |
7,6* | ||
|
Trombocyty -snížení |
10,1* |
4,1 * |
26,6* |
12,7* | ||
|
Poruchy nervového systému |
Časté |
Neuropatie - senzorická |
8,5* |
0,0 * |
12,4* |
0,6* |
|
Porucha chuti |
8,1 |
0,0*** |
8,9 |
0,0*** | ||
|
Gastrointe stinální poruchy |
Velmi časté |
56,1 |
7,2* |
53,4 |
3,9* | |
|
39,7 |
6,1 |
35,5 |
6,1 | |||
|
26,6 |
2,4* |
24,2 |
0,7* | |||
|
Zácpa |
21,0 |
0,8 |
19,5 |
0,4 | ||
|
Stomatitida / faryngitida |
13,5 |
0,8 |
12,4 |
0,1 | ||
|
Průjem bez kolostomie |
12,4 |
1,3 |
12,8 |
1,6 | ||
|
Časté |
Dyspepsie / pálení žáhy |
5,2 |
0,1 |
5,9 |
0,0 | |
|
Poruchy kůže a podkožní tkáně |
Velmi časté |
Alopecie |
11,9* |
0*** |
21,4* |
0,5*** |
|
Časté |
Vyrážka / deskvamace |
6,6 |
0,1 |
8,0 |
0,5 | |
|
Poruchy ledvin a močových cest |
Velmi časté |
Kreatinin - zvýšení |
10,1* |
0,8 |
6,9* |
0,5 |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Únava |
42,7 |
6,7 |
44,9 |
4,9 |
* hodnota p <0,05 při srovnání kombinace pemetrexed /cisplatina a gemcitabin /cisplatina při použití Fisherova exaktního testu.
** Viz obecná kritéria toxicity (CTC) podle National Cancer Institute (verze 2; NCI 1998) pro každý stupeň toxicity.
*** V souladu s CTC vydanými National Cancer Institute (v2.0; NCI 1998) se porucha chuti a alopecie hlásí pouze jako stupeň 1 nebo 2.
Pro účely této tabulky byla použita hraniční hodnota 5 % pro zařazení všech příhod, kdy hlásící osoba považovala souvislost mezi příhodoua léčbou pemetrexedem a cisplatinou za možnou.
Klinicky relevantní toxicita, která byla hlášena u > 1 % a < 5 % pacientů náhodným výběrem přidělených k léčbě pemetrexedem a cisplatinou, zahrnovala: zvýšení hodnot AST, zvýšení hodnot ALT, infekci, febrilní neutropenii, renální selhání, pyrexii, dehydrataci, konjunktivitidu a snížení clearance kreatininu. Klinicky relevantní toxicita, která byla hlášena u < 1 % pacientů náhodným výběrem přidělených k léčbě pemetrexedem a cisplatinou, zahrnovala: zvýšení hodnot GGT, bolest na hrudi, arytmie a motorickou neuropatii.
Klinicky relevantní toxicita byla v celkové populaci u pacientů používajících pemetrexed v kombinaci s cisplatinou podobná bez ohledu na pohlaví.
V tabulce níže je uvedena frekvence a závažnost nežádoucích účinků pravděpodobně souvisejících se studijní medikací, které byly v klinických hodnoceních udržovací léčby pemetrexedem v monoterapii (JMEN: N=663) a pokračující udržovací léčby pemetrexedem (PARAMOUNT: N=539) hlášeny u více než 5 % z 800 pacientů, kteří byli randomizováni k léčbě samotným pemetrexedem a 402 pacientů, kteří byli randomizováni k léčbě placebem. U všech pacientů byl diagnostikován NSCLC stadia IIIB nebo IV a všichni podstoupili předchozí terapii založenou na platině. Pacientům v obou ramenech studie byla plně doplňována kyselina listová a vitamín B12.
|
Třída orgánových systémů |
Frekvence* |
Nežádoucí účinek** |
pemetrexed*** (N =800) |
placebo*** (N =402) | ||
|
Všechny stupně toxicity (%) |
T oxicita stupně 3-4 (%) |
Všechny stupně toxicity (%) |
Toxicita stupně 3-4 (%) | |||
|
Poruchy krve a lymfatického systému |
Velmi časté |
Hemoglobin - snížení |
18,0 |
4,5 |
5,2 |
0,5 |
|
Časté |
Leukocyty - snížení |
5,8 |
1,9 |
0,7 |
0,2 | |
|
Neutrofily -snížení |
8,4 |
4,4 |
0,2 |
0,0 | ||
|
Poruchy nervového systému |
Časté |
Neuropatie -senzorická |
7,4 |
0,6 |
5,0 |
0,2 |
|
Gastrointestinální poruchy |
Velmi časté |
17,3 |
0,8 |
4,0 |
0,2 | |
|
12,8 |
1,1 |
3,2 |
0,0 | |||
|
Časté |
8,4 |
0,3 |
1,5 |
0,0 | ||
|
Mukozitida / stomatitida |
6,8 |
0,8 |
1,7 |
0,0 | ||
|
Poruchy jater a žlučových cest |
Časté |
SGPT (ALT) -vzestup |
6,5 |
0,1 |
2,2 |
0,0 |
|
SGOT (AST) -vzestup |
5,9 |
0,0 |
1,7 |
0,0 | ||
|
Poruchy kůže a podkožní tkáně |
Časté |
Vyrážka / deskvamace |
8,1 |
0,1 |
3,7 |
0,0 |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Únava |
24,1 |
5,3 |
10,9 |
0,7 |
|
Časté |
Bolest |
7,6 |
0,9 |
4,5 |
0,0 | |
|
Edém |
5,6 |
0,0 |
1,5 |
0,0 | ||
|
Poruchy ledvin |
Časté |
Renální poruchy |
7,6 |
0,9 |
1,7 |
0,0 |
Zkratky: ALT (SGPT) = alaninaminotransferáza; AST (SGOT) = aspartátaminotransferáza; CTCAE = obecná terminologická kritéria nežádoucích účinků (Common Terminology Criteria for Adverse Event); NCI = National Cancer Institute;
* Definice frekvence nežádoucích účinků: velmi časté - > 10%; časté - > 5% a < 10%. Pro účely této tabulky byla použita hraniční hodnota 5% pro zařazení všech příhod, kdy hlásící osoba považovala příhodu za možná související s léčbou pemetrexedem.
** Viz NCI CTCAE kritéria (verze 3.0; NCI 2003) pro každý stupeň toxicity. Výskyt toxicit uveden podle CTCAE verze 3.0.
*** V integrované tabulce nežádoucích účinků j sou kombinovány výsledky klinických hodnocení udržovací léčby pemetrexedem JMEN (N=663) a pokračující udržovací léčby pemetrexedem PARAMOUNT (N=539).
**** Souhrnné označení zahrnuje zvýšení kreatininu v séru/krvi, pokles glomerulární filtrace, renální selhání a renální / urogenitální - jiné.
Klinicky relevantní projevy toxicity (dle CTC) jakéhokoli stupně, které byly hlášeny u > 1 % a < 5 % pacientů náhodným výběrem přidělených k léčbě pemetrexedem zahrnují: febrilní neutropenii, infekci, snížení počtu trombocytů, průjem, zácpu, alopecii, pruritus /svědění, horečku (bez neutropenie), onemocnění očního povrchu (včetně konjunktivitidy), zvýšené slzení, závrať a motorickou neuropatii.
Klinicky relevantní projevy toxicity (dle CTC), které byly hlášeny u < 1% pacientů náhodným výběrem přidělených k léčbě pemetrexedem, jsou: alergická reakce / hypersenzitivita, multiformní erytém, supraventrikulární arytmie a plicní embolie.
Bezpečnost byla hodnocena u pacientů, kteří byli randomizováni k léčbě pemetrexedem (N=800). Výskyt nežádoucích účinků byl hodnocen u pacientů, kteří dostali < 6 cyklů udržovací léčby pemetrexedem (N=519) a srovnán s výskytem u pacientů, kteří dostali > 6 cyklů léčby pemetrexedem (N=281). S déle trvající expozicí bylo pozorováno zvýšení výskytu nežádoucích účinků (všech stupňů). Významné zvýšení výskytu neutropenie stupně 3/4 potenciálně související s hodnoceným lékem, bylo pozorováno při delší expozici pemetrexedu (< 6 cyklů: 3,3%, > 6 cyklů: 6,4%: p=0,046). U dalších jednotlivých stupňů 3/4/5 nežádoucích účinků nebyly při delší expozici pozorovány statisticky významné rozdíly.
V průběhu klinických studií s pemetrexedem byly méně často hlášeny závažné kardiovaskulární a cerebrovaskulární příhody, zahrnující infarkt myokardu, anginu pectoris a tranzitorní ischemické ataky obvykle, když byl pemetrexed podáván v kombinaci s dalšími cytostatiky. Většina pacientů, u kterých byly tyto příhody pozorovány, měla preexistující kardiovaskulární rizikové faktory.
V průběhu klinických studií s pemetrexedem byly vzácně hlášeny případy potenciálně závažné hepatitidy.
Méně často byla u pacientů v průběhu klinických studií s pemetrexedem hlášena pancytopenie.
Méně často byly v klinických studiích u pacientů léčených pemetrexedem hlášeny případy kolitidy (včetně intestinálního a rektálního krvácení, někdy s fatálním průběhem, intestinální perforace, nekrózy a zánětu céka).
Méně často byly v klinických studiích u pacientů léčených pemetrexedem hlášeny případy intersticiální pneumonitidy s respirační nedostatečností, někdy s fatálním průběhem.
U pacientů léčených pemetrexedem byly méně často hlášeny případy edému.
Méně často byla u pacientů v průběhu klinických studií s pemetrexedem hlášena ezofagitida / radiační ezofagitida.
V průběhu klinických studií s pemetrexedem byly často hlášeny sepse, někdy s fatálním průběhem.
V průběhu postmarketingového sledování byly hlášeny u pacientů léčených pemetrexedem následující nežádoucí účinky:
V souvislosti s podáváním pemetrexedu samotného nebo v kombinaci s jinými chemoterapeutiky byly méně často hlášeny případy akutního selhání ledvin (viz bod 4.4).
U pacientů léčených ozařováním před léčbou, v průběhu nebo následně po léčbě pemetrexedem byly méně často hlášeny případy postradiační pneumonitidy (viz bod 4.4).
U pacientů, kteří dříve podstoupili léčbu ozařováním, byly vzácně hlášeny případy kožní reakce v místě předchozího ozařování (radiation recall) (viz bod 4.4).
Méně často byly hlášeny případy periferní ischémie, které někdy vedly k nekróze končetiny.
Vzácně byly hlášeny případy tvorby puchýřů včetně Stevens-Johnsonova syndromu a toxické epidermální nekrolýzy, které byly v některých případech fatální.
Vzácně byla u pacientů léčených pemetrexedem hlášena hemolytická anémie, vyvolaná imunitní reakcí.
Vzácně byly hlášeny případy anafylaktického šoku.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v dodatku V.
4.9 Předávkování
K popsaným symptomům předávkování patří neutropenie, anémie, trombocytopenie, mukozitida, senzorická polyneuropatie a vyrážka. K předpokládaným komplikacím předávkování patří útlum kostní dřeně, který se manifestuje neutropenií, trombocytopenií a anemií. Kromě toho lze pozorovat infekce s horečkou nebo bez ní, průjem a/nebo mukozitidu. V případě podezření na předávkování musí být u pacientů sledován krevní obraz a pacienti mají dostávat podle potřeby podpůrnou léčbu. V léčbě předávkování pemetrexedem se má zvážit podávání kalcium-folinátu nebo kyseliny folinové.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antineoplastika, analogy kyseliny listové, ATC kód: L01BA04
CIAMBRA (pemetrexed) je tzv. „multi-targeted“ antifolikum, protinádorová látka působící narušení několika klíčových metabolických procesů závislých na kyselině listové, které jsou nezbytné pro replikaci buněk.
Studie in vitro prokázaly, že pemetrexed se chová jako „multi-targeted“ antifolikum tím, že inhibuje thymidylátsyntázu (TS), dihydrofolátreduktázu (DHFR) a glycinamid ribonukleotid formyltransferázu (GARFT), které jsou klíčové enzymy závislé na folátu pro biosyntézu thymidinu a purinových nukleotidů de novo. Pemetrexed je transportován do buněk redukovaným nosičem folátu a membránovým folátovým vazebným proteinovým transportním systémem. Jakmile je pemetrexed v buňce, přeměňuje se rychle a efektivně na polyglutamátové formy pomocí enzymu folylpolyglutamátsyntetáza. Polyglutamátové formy se zadržují v buňkách a jsou ještě silnějšími inhibitory TS a GARFT. Polyglutamace je proces závislý na čase a koncentraci, ke kterému dochází v nádorových buňkách a v menší míře i v normálních tkáních. Polyglutamátové metabolity mají zvýšený intracelulární poločas, což vede k protrahovanému účinku léku v maligních buňkách.
Klinická, účinnost.
Mezoteliom
Studie EMPHACIS byla multicentrická, randomizovaná, jednoduše zaslepená studie fáze 3 s pemetrexedem a cisplatinou oproti cisplatině u pacientů s maligním mezoteliomem pleury, kteří dosud nepodstoupili chemoterapii. V této studii bylo prokázáno, že pacienti léčení pemetrexedem a cisplatinou měli klinicky významnou výhodu mediánu přežívání, trvající 2,8 měsíce v porovnání s pacienty léčenými cisplatinou v monoterapii.
Během studie byla k léčbě zavedena dlouhodobá suplementace nízkými dávkami kyseliny listové a vitamínu B12 s cílem snížit toxicitu. Primární analýza této studie byla provedena na populaci všech pacientů randomizovaně přidělených do léčebné skupiny, kteří dostávali hodnocený lék (randomizovaní a léčení). Byla provedena analýza podskupin u pacientů, kteří dostávali suplementaci kyselinou listovou a vitamínem B12 v průběhu celé léčebné kúry hodnoceným lékem (úplná suplementace). Výsledky těchto analýz účinnosti jsou shrnuty v tabulce níže:
Účinnost pemetrexedu v kombinaci s cisplatinou oproti cisplatině u pacientů s maligním
|
Randomizovaní a léčení pacienti |
Plně suplementovaní pacienti | |||
|
Parametr účinnosti |
pemetrexed / cisplatina |
cisplatina |
pemetrexed / cisplatina |
cisplatina |
|
(N = 226) |
(N = 222) |
(N = 168) |
(N = 163) | |
|
Medián celkového přežití (měsíce) |
12,1 |
9,3 |
13,3 |
10,0 |
|
(95% CI) |
(10,0 - 14,4) |
(7,8 - 10,7) |
(11,4 - 14,9) |
(8,4 - 11,9) |
|
Log Rank hodnota p* |
0,020 |
0,051 | ||
|
Medián doby do progrese nádoru (měsíce) |
5,7 |
3,9 |
6,1 |
3,9 |
|
(95% CI) |
(4,9 - 6,5) |
(2,8 - 4,4) |
(5,3 - 7,0) |
(2,8 - 4,5) |
|
Log Rank hodnota p* |
0,001 |
0,008 | ||
|
Doba do selhání léčby (měsíce) (95% |
4,5 |
2,7 |
4,7 |
2,7 |
|
CI) |
(3,9 - 4,9) |
(2,1 - 2,9) |
(4,3 - 5,6) |
(2,2 - 3,1) |
|
Log Rank hodnota p* |
0,001 |
0,001 | ||
|
Poměr celkové odpovědi** |
41,3 % |
16,7 % |
45,5 % |
19,6 % |
|
(95% CI) |
(34,8 - 48,1) |
(12,0 - 22,2) |
(37,8 - 53,4) |
(13,8 - 26,6) |
|
Fisherova přesná hodnota p* |
< 0,001 |
< 0,001 | ||
Zkratka: CI = interval spolehlivosti * hodnota p se týká srovnání mezi rameny.
** V rameni pemetrexed/cisplatina, randomizovaní a léčení (N = 225) a plně suplementovaní (N = 167) pacienti
Statisticky významné zlepšení klinicky významných symptomů (bolest a dušnost) vyskytujících se při maligním mezoteliomu pleury v rameni s pemetrexedem/cisplatinou (212 pacientů) oproti rameni s léčbou pouze cisplatinou (218 pacientů) bylo prokázáno pomocí škály symptomů karcinomu plic.
Byly rovněž pozorovány statisticky významné rozdíly v plicních funkčních testech. Oddělení mezi léčebnými rameny bylo dosaženo zlepšením plicní funkce v rameni pemetrexed/cisplatina a zhoršením plicní funkce v čase u kontrolního ramene.
Existují omezené údaje u pacientů s maligním mezoteliomem pleury léčených pemetrexedem v monoterapii. Pemetrexed v dávce 500 mg/m2 byl studován jako lék podávaný v monoterapii u 64 pacientů s maligním mezoteliomem pleury dosud neléčených chemoterapií. Celkový výskyt odpovědi na léčbu byl 14,1 % pacientů.
NSCLC, léčba v druhé linii:
V multicentrické, randomizované, otevřené studii fáze 3 s pemetrexedem a docetaxelem u pacientů s lokálně pokročilým nebo metastatickým nemalobuněčným karcinomem plic po předchozí
chemoterapii byl prokázán medián doby přežívání 8,3 měsíce u pacientů léčených pemetrexedem (populace se záměrem léčit - ITT, n = 283) a 7,9 měsíců u pacientů léčených docetaxelem ( ITT, n = 288). Předchozí chemoterapie nezahrnovala pemetrexed. Výsledky analýzy vlivu histologie NSCLC na léčebné ovlivnění celkového přežití svědčí ve prospěch pemetrexedu oproti docetaxelu u pacientů s NSCLC jiného histologického typu než predominantně z dlaždicových buněk (n = 399, 9,3 vs. 8,0 měsíců, upravený HR = 0,78; 95% CI = 0,61-1,00, p = 0,047) a ve prospěch docetaxelu u karcinomu s histologickou strukturou z dlaždicových buněk (n = 172, 6,2 vs. 7,4 měsíců, adjustovaný HR = 1,56; 95% CI = 1,08-2,26, p = 0,018). V histologických podskupinách nebyly pozorovány žádné klinicky důležité rozdíly v bezpečnostním profilu pemetrexedu.
Omezené klinické údaje z jiného randomizovaného, kontrolovaného klinického hodnocení fáze 3 naznačují, že údaje o účinnosti pemetrexedu (celková doba přežití, doba přežívání bez progrese) jsou podobné pro skupinu pacientů s předchozí léčbou docetaxelem (n = 41) a pacientů bez předchozí léčby docetaxelem (n = 540).
pemetrexed
docetaxel
Doba přežívání (měsíce)
□ Medián (m)
□ 95% CI pro medián
□ HR
□ 95% CI pro HR
□ Hodnota p pro neinferioritu (HR)
Doba přežití bez progrese (měsíce)
Medián
□ HR (95% CI)_
Doba do selhání léčby (TTTF - měsíce)
Medián
□ HR (95% CI)
Odpověď (n: kvalifikovaní pro odpověď)
□ Výskyt odpovědi (%) (95% CI)
□ Stabilní onemocnění (%)
(n = 283) (n = 288)
8,3 7,9
(7,0 - 9,4) (6,3 - 9,2)
0,99
(0,82-1,20)
0,226
(n = 283) (n = 288)
2,9 2,9
_0,97 (0,82-1,16)_
(n = 283) (n = 288)
2,3 2,1
0,84 (0,71-0,997)
(n = 264) 9,1 (5,9-13,2) 45,8
(n = 274) 8,8 (5,7-12,8) 46,4
Zkratky: CI = interval spolehlivosti; HR = poměr rizik; ITT = záměr léčit; n = celková velikost populace
NSCLC, léčba v první linii:
Multicentrická, randomizovaná, otevřená studie fáze 3 s pemetrexedem a cisplatinou oproti gemcitabinu s cisplatinou u pacientů bez předchozí chemoterapie s lokálně pokročilým nebo metastazujícím (stadium IIIb nebo IV) nemalobuněčným karcinomem plic (NSCLC) prokázala, že pemetrexed v kombinaci s cisplatinou (populace ITT Intent-to-treat , n = 862) dosáhl primárního cílového parametru a prokázal podobný klinický účinek jako gemcitabin v kombinaci s cisplatinou (ITT n = 863) na celkové přežití (adjustovaný poměr rizik 0,94; 95% CI = 0,84-1,05). Všichni pacienti účastnící se této studie měli ECOG výkonnostní stav 0 nebo 1.
Primární analýza účinnosti byla založena na ITT populaci. Analýzy citlivosti pro hlavní cílové parametry studie byly také vyhodnoceny u populace pacientů splňujících vstupní kritéria protokolu (Protocol Qualified - PQ). Výsledky analýz účinnosti u populace PQ jsou v souladu s analýzami populace ITT a podporující noninferioritu kombinace AC oproti GC.
Doba přežití bez progrese (PFS) a celková odpověď na léčbu byly podobné v obou ramenech léčby: medián PFS byl 4,8 měsíců pro pemetrexed v kombinaci s cisplatinou oproti 5,1 měsíců pro gemcitabin v kombinaci s cisplatinou (adjustovaný poměr rizik 1,04; 95% CI = 0,94-1,15) a četnost celkové odpovědi byla 30,6% (95% CI = 27,3-33,9) pro pemetrexed s cisplatinou oproti 28,2% (95% CI = 25,0-31,4) pro gemcitabin s cisplatinou. Údaje o PFS byly částečně potvrzeny nezávislým přezkoumáním (pro přezkoumání bylo náhodně vybráno 400/1725 pacientů).
Analýza vlivu histologického původu NSCLC na celkovou dobu přežití prokázala klinicky významné rozdíly mezi jednotlivými histologickými typy, viz níže uvedená tabulka.
Účinnost kombinace pemetrexed + cisplatina oproti kombinaci gemcitabin + cisplatina v první linii nemalobuněčného karcinomu plic - ITT populace a histologické podskupiny
|
ITT populace a histologické podskupiny |
Medián celkové doby přežití v měsících (95% CI) |
Adjustova ný poměr rizik (HR) (95% CI) |
Superiorita hodnota p | |||
|
pemetrexed + cisplatina |
gemcitabin + cisplatina | |||||
|
ITT populace (N = 1725) |
10,3 (9,8-11,2) |
N=862 |
10,3 (9,6-10,9) |
N=863 |
0,94a (0,84-1,05) |
0,259 |
|
Adenokarcinom (N=847) |
12,6 (10,7-13,6) |
N=436 |
10,9 (10,2-11,9) |
N=411 |
0,84 (0,71-0,99) |
0,033 |
|
Velkobuněčný (N=153) |
10,4 (8,6-14,1) |
N=76 |
6,7 (5,5-9,0) |
N=77 |
0,67 (0,48-0,96) |
0,027 |
|
Jiný (N=252) |
8,6 (6,8-10,2) |
2 II O Os |
9,2 (8,1-10,6) |
N=146 |
1,08 (0,81-1,45) |
0,586 |
|
Dlaždicobuněčný (N=473) |
9,4 (8,4-10,2) |
N=244 |
10,8 (9,5-12,1) |
N=229 |
1,23 (1,00-1,51) |
0,050 |
Zkratky: CI = interval spolehlivosti; ITT = záměr léčit; n = celková velikost souboru a Statisticky významné pro noninferioritu, s celkovým intervalem spolehlivosti pro HR dostatečně pod hranicí noninferiority1,17645 (p <0,001).
Kaplan-Meierova křivka celkové doby přežití podle histologického typu
Adenocarcinoma
Survival Time (months)
Large Cell Carcinoma
0.4 -
Survival Time (months)
|
Adenokarcinom |
Velkobuněčný karcinom |
|
Y: Pravděpodobnost přežití |
Y: Pravděpodobnost přežití |
|
X: Doba přežití (měsíce) |
X: Doba přežití (měsíce) |
V histologických podskupinách nebyly pozorovány žádné klinicky významné rozdíly v bezpečnostním profilu pemetrexedu v kombinaci s cisplatinou.
U pacientů léčených pemetrexedem v kombinaci s cisplatinou byl zapotřebí menší počet transfuzí (16,4% oproti 28,9%, p<0,001), transfúzí erytrocytů (16,1% oproti 27,3%, p<0,001) a transfúzí trombocytů (1,8% vs. 4,5%, p=0,002). Rovněž byl zapotřebí menší počet podání erytropoetinu / darbopoetinu (10,4% oproti 18,1%, p<0,001), G-CSF/GM-CSF (3,1% oproti 6,1%, p=0,004) a přípravků obsahujících železo (4,3% oproti 7,0%, p=0,021).
NSCLC, udržovací léčba:
JMEN
Multicentrická, randomizovaná, dvojitě zaslepená, studie fáze 3 kontrolovaná placebem (JMEN) srovnávala účinnost a bezpečnost udržovací léčby pemetrexedem spolu s nejlepší možnou podpůrnou léčbou (BSC) (n = 441) a podávání placeba spolu s BSC (n = 222) u pacientů s lokálně pokročilým (stadium IIIB) nebo metastazujícím (stadium IV) nemalobuněčným karcinomem plic (NSCLC), u kterých nedošlo k progresi po 4 cyklech terapie první linie dvojokmbinací obsahující cisplatinu nebo karboplatinu v kombinaci s gemcitabinem, paklitaxelem nebo docetaxelem. Kombinovaná léčba obsahující v první linii v dvojkombinaci pemetrexed nebyla zahrnuta. Všichni pacienti účastnící se této studie měli ECOG výkonnostní stav 0 nebo 1. Udržovací léčba byla pacientům podávána do doby progrese nemoci. Účinnost a bezpečnost byly měřeny od doby randomizace po dokončení (indukční) terapie první linie. Střední hodnota počtu cyklů podaných pacientům byla 5 cyklů udržovací léčby pemetrexedem a 3,5 cyklů podávání placeba. Celkem 213 pacientů (48,3%) dokončilo > 6 cyklů a celkem 103 pacientů (23,4%) dokončilo > 10 cyklů léčby pemetrexedem.
Studie dosáhla primárního cílového parametru a prokázala statisticky významné zlepšení PFS ve skupině s pemetrexedem oproti skupině placeba (n = 581, nezávisle hodnocená populace; medián 4,0 měsíce, resp. 2,0 měsíce) (poměr rizika = 0,60, 95% CI = 0,49-0,73, p < 0,00001). Nezávislé hodnocení pacientských skenů potvrdilo závěry hodnocení PFS ze strany zkoušejících. Střední hodnota celkové doby přežití (OS) pro celkovou populaci (n = 663) byla 13,4 měsíců ve skupině s pemetrexedem a 10,6 ve skupině placeba, poměr rizika = 0,79 (95% CI = 0,65-0,95, p = 0,01192).
V souladu s dalšími studiemi pemetrexedu byl ve studii JMEN pozorován rozdíl v účinnosti s ohledem na histologii NSCLC. U pacientů s NSCLC jiného histologického typu než predominantně
z dlaždicových buněk (n = 430, nezávisle hodnocená populace) byla střední doba přežití bez progrese (PFS) 4,4 měsíce pro pemetrexed a 1,8 měsíce u skupiny placeba, poměr rizika = 0,47 (95% CI = 0,37-0,60, p = 0,00001). Střední hodnota celkové doby přežití (OS) u pacientů s NSCLC jiného histologického typu než predominantně z dlaždicových buněk (n = 481) byla 15,5 měsíců ve skupině pemetrexedu a 10,3 měsíců ve skupině placeba (poměr rizika = 0,70,95% CI = 0,56-0,88, p = 0,002). Střední doba OS včetně indukční fáze byla u pacientů s NSCLC jiného histologického typu než predominantně z dlaždicových buněk 18,6 měsíců pro pemetrexed a 13,6 měsíců ve skupině placeba (poměr rizika = 0,71, 95% CI = 0,56-0,88, p = 0,002).
U pacientů s karcinomem histologického typu z dlaždicových buněk nenaznačují výsledky PFS a OS výhodu léčby pemetrexedem oproti placebu.
V histologických podskupinách nebyly pozorovány žádné klinicky významné rozdíly v bezpečnostním profilu pemetrexedu.
Progression-Free Survival
Overall Survival
Pemetrexed
Placebo
Pemetrexed
P acebo
PFS Time (months)
Surnval Time (months)
|
Přežití bez progrese |
Celkové přežití |
|
Y: Pravděpodobnost PFS |
Y: Pravděpodobnost přežití |
|
X: Doba PFS (měsíce) |
X: Doba přežití (měsíce) |
JMEN: Kaplan-Meierova křivka doby přežití bez progrese (PFS) a celkové doby přežití u pacientů s NSCLC jiného histologického typu než predominantně z dlaždicových buněk užívajících pemetrexed nebo placebo
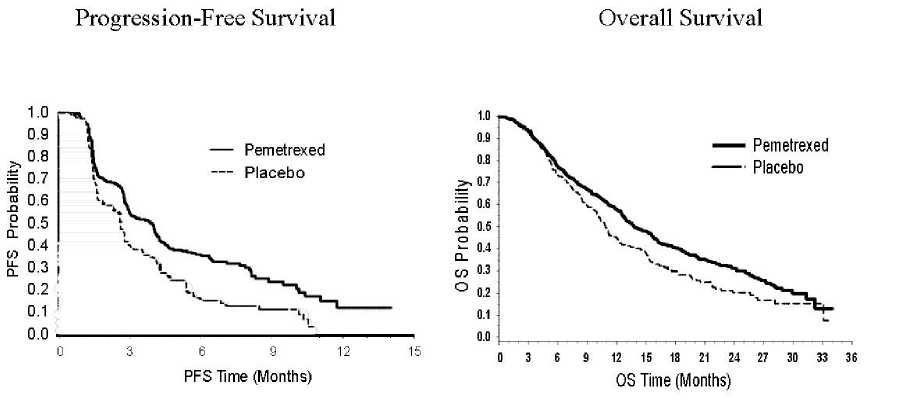
PARAMOUNT
Multicentrická, randomizovaná, dvojitě zaslepená, placebem kontrolovaná klinická studie fáze 3 (PARAMOUNT) porovnávala účinnost a bezpečnost pokračující udržovací léčby pemetrexedem plus BSC (n = 359) s léčbou placebem plus BSC (n = 180) u pacientů s lokálně pokročilým (stadium IIIB) nebo metastazujícím (stadium IV) NSCLC jiného histologického typu než predominantně z dlaždicových buněk, u kterých nedošlo k progresi onemocnění po 4 cyklech léčby první linie kombinací pemetrexedu s cisplatinou. Z celkového počtu 939 pacientů léčených indukcí pemetrexedem s cisplatinou bylo 539 pacientů randomizováno na udržovací léčbu pemetrexedem nebo placebem. Z randomizovaných pacientů mělo 44,9 % úplnou /částečnou odpověď a u 51,9 % došlo ke stabilizaci onemocnění po indukci pemetrexedem s cisplatinou. Pacienti, kteří byli randomizováni k udržovací léčbě, museli mít výkonnostní stav ECOG 0 nebo 1. Medián doby od začátku indukční léčby pemetrexedem s cisplatinou do začátku udržovací léčby byl 2,96 měsíce jak v rameni s pemetrexedem, tak v rameni s placebem. Randomizovaní pacienti dostávali udržovací léčbu do doby progrese onemocnění. Účinnost a bezpečnost byly měřeny od doby randomizace po ukončení (indukční) léčby první linie. Střední hodnota počtu cyklů podaných pacientům byla 4 cykly léčby pemetrexedem a 4 cykly placeba. Celkem dokončilo > 6 cyklů udržovací léčby pemetrexedem 169 pacientů (47,1 %), což představovalo nejméně 10 cyklů pemetrexedu celkem.
Studie splnila svůj primární cílový parametr a ukázala statisticky významné zlepšení PFS v rameni s pemetrexedem ve srovnání s placebovým ramenem (n = 472, nezávisle hodnocená populace; medián
3,9 měsíců a 2,6 měsíce v tomto pořadí) (poměr rizika = 0,64, 95% CI = 0,51-0,81, p < 0,0002). Nezávislé posouzení vyšetření pacientů potvrdilo nálezy z hodnocení PFS zkoušejícími. Pro randomizované pacienty byl, měřeno od zahájení první linie indukční léčby pemetrexedem s cisplatinou, medián PFS stanovený zkoušejícím 6,9 měsícův rameni s pemetrexedem a 5,6 měsíce v rameni s placebem (poměr rizika = 0,59 95% CI = 0,47-0,74).
Po indukci pemetrexedem s cisplatinou (4 cykly) byla léčba pemetrexedem statisticky lepší než placebo z hlediska celkového přežití (medián 13,9 měsíce versus 11,0 měsíců, poměr rizika = 0,78, 95%CI = 0,64-0,96, p = 0,0195). V době, kdy byla tato finální analýza přežití provedena, bylo v rameni s pemetrexedem 28,7% pacientů naživu nebo byl kontakt s nimi ztracen oproti 21,7% pacientům v rameni s placebem. Relativní léčebný účinek pemetrexedu byl napříč podskupinami (včetně stadia nemoci, odpovědi na indukci, ECOG PS, kuřáckého statusu, pohlaví, histologie a věku) vnitřně konzistentní a podobný tomu, který byl pozorován v neupravených analýzách OS a PFS. 1 a 2 letá četnost přežívání pacientů s pemetrexedem byla 58 %, resp. 32 % ve srovnání s 45 %, resp. 21 % u pacientů s placebem. Od začátku indukční léčby pemetrexedem s cisplatinou v první linii byl medián OS pacientů 16,9 měsíce u ramene s pemetrexedem a 14,0 měsíců u ramene s placebem (poměr rizika = 0,78, 95% CI= 0,64-0,96). Procento pacientů, kteří byli po studii léčeni bylo 64,3 % u pemetrexedu a 71,7% pro placebo.
PARAMOUNT: Kaplan-Meierova křivka přežití bez progrese (PFS) a celkového přežití (OS) u pacientů s NSCLC jiného histologického typu než predominantně z dlaždicových buněk pokračujících v udržovací léčbě pemetrexedem nebo placebem (měřeno od randomizace)
|
Přežití bez progrese |
Celkové přežití |
|
Y: Pravděpodobnost PFS |
Y: Pravděpodobnost OS |
|
X: Doba PFS (měsíce) |
X: Doba OS (měsíce) |
Bezpečnostní profily udržovací léčby pemetrexedem ze dvou klinických hodnocení JMEN a PARAMOUNT byly podobné.
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s pemetrexedem u všech podskupin pediatrické populace ve schválených indikacích (viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Farmakokinetické vlastnosti pemetrexedu po jeho podání v monoterapii byly hodnoceny u 426 pacientů s různými maligními solidními tumory, kterým byl lék podáván v dávkách od 0,2 do 838 mg/m2 infuzí po dobu 10 minut. Distribuční objem pemetrexedu v ustáleném stavu činil 9 l/m2. Studie in vitro ukazují, že pemetrexed se přibližně z 81 % váže na plazmatické proteiny. Různý stupeň poruchy funkce ledvin nevede k významnému ovlivnění této vazby. Pemetrexed podstupuje v omezené míře metabolismus v játrech. Pemetrexed se primárně vylučuje močí, přičemž 70-90 % podané dávky se odstraní močí v nezměněné formě během prvních 24 hodin po jeho podání. Studie in vitro naznačují, že pemetrexed je aktivně vylučován pomocí OAT3 (přenašeč organických aniontů). Celková systémová clearance pemetrexedu je 91,8 ml/min a eliminační poločas z plazmy je 3,5 hodin u pacientů s normální funkcí ledvin (clearance kreatininu 90 ml/min).
Variabilita clearance mezi pacienty je střední, a to 19,3 %. Celková systémová expozice pemetrexedu (AUC) a maximální plazmatická koncentrace rostou proporcionálně s dávkou. Farmakokinetika pemetrexedu je stejná i při více léčebných cyklech.
Farmakokinetické vlastnosti pemetrexedu nejsou ovlivněny souběžně podanou cisplatinou. Suplementace kyselinou listovou perorálně a vitaminem B12 intramuskulárně neovlivňuje farmakokinetiku pemetrexedu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Podání pemetrexedu březím myším vedlo ke snížení viability plodů, ke snížení hmotnosti plodů, neúplné osifikaci některých kosterních struktur a rozštěpu patra.
Podání pemetrexedu samcům myší vedlo k reprodukční toxicitě charakterizované snížením fertility a testikulámí atrofií. V devítiměsíční studii provedené na bíglech s použitím intravenózní bolusové injekce byl pozorován nález na varlatech (degenerace/nekróza seminiferní výstelky). To naznačuje, že pemetrexed může poškodit mužskou fertilitu. Fertilita žen nebyla studována.
Pemetrexed nebyl mutagenní in vitro ani u testu chromozomální aberace na buňkách ovarií čínských křečků ani v Amesově testu. V mikronukleárním testu in vivo u myši bylo prokázáno, že pemetrexed je klastogenní.
Studie hodnotící kancerogenní potenciál pemetrexedu nebyly provedeny.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Mannitol (E 421)
Kyselina chlorovodíková (k nastavení pH)
Hydroxid sodný (k nastavení pH)
6.2 Inkompatibility
Pemetrexed je fyzikálně inkompatibilní s ředidly obsahujícími kalcium, jako je laktátový Ringerův roztok a Ringerův roztok. Tento léčivý přípravek se nesmí mísit s jinými léčivými přípravky kromě přípravků uvedených v bodě 6.6.
6.3 Doba použitelnosti
Neotevřená lahvička 2 roky
Rekonstituované a. infíizní roztoky
Chemická a fyzikální stabilita po otevření před použitím připraveného infuzního roztoku pemetrexedu byla prokázána na dobu 24 hodin při teplotě 2-8 °C nebo 15-25 °C. Rekonstituovaný roztok má být použit okamžitě k přípravě infuzního roztoku. Z mikrobiologického hlediska má být infuzní roztok použit okamžitě. Není-li použit okamžitě, doba a podmínky uchovávání přípravku po otevření před použitím jsou v zodpovědnosti uživatele a normálně by doba neměla být delší než 24 hodin při teplotě 2-8 °C nebo 15-25 °C.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci/zředění jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
Prášek ve skleněné injekční lahvičce třídy I s chlorobutylovou pryžovou zátkou s hliníkovým uzávěrem a odtrhovacím víčkem, injekční lahvička je zatavena v plastové folii. Jedna 10ml lahvička obsahuje 100 mg pemetrexedu (ve formě pemetrexedum dinatricum dihemihydricum).
Balení po 1 lahvičce.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
1. Při rekonstituci a dalším ředění pemetrexedu k podání intravenózní infuze používejte aseptickou techniku.
2. Vypočtěte dávku a počet potřebných injekčních lahviček přípravku CIAMBRA. Injekční lahvička obsahuje větší množství pemetrexedu k usnadnění přenosu označeného množství.
3. Rekonstituujte obsah 100mg injekční lahvičky se 4,2 ml injekčního roztoku chloridu sodného 9 mg/ml (0,9 %) bez konzervačních látek, čímž vznikne roztok obsahující 25 mg/ml pemetrexedu. Pohybujte jemným krouživým pohybem každou injekční lahvičkou, dokud se prášek zcela nerozpustí. Výsledný roztok je čirý a jeho barva kolísá od bezbarvé po žlutou nebo žlutozelenou, aniž by byla narušena jeho kvalita. pH rekonstituovaného roztoku se pohybuje mezi 6,6 a 7,8. Potřebné je další ředění.
4. Náležitý objem rekonstituovaného roztoku pemetrexedu se dále musí naředit na 100 ml injekčním roztokem chloridu sodného 9 mg/ml (0,9 %) bez konzervačních látek a podá se intravenózní infuzí trvající 10 minut.
5. Infuzní roztoky pemetrexedu připravené podle výše uvedeného návodu jsou kompatibilní s polyvinylchloridovými a polyolefinovými infuzními sety a infuzními vaky.
6. Léčivé přípravky pro parenterální použití se musí před podáním vizuálně zkontrolovat, zda neobsahují pevné částice a nedošlo ke změně barvy. Jestliže zpozorujete pevné částice, přípravek nepodávejte.
7. Roztok pemetrexedu je určen pouze na jedno použití. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Bezpečnostní opatření při přípravě a podání:
Tak jako i u jiných potenciálně toxických protinádorových látek je nutné udržovat pozornost při zacházení s infuzním roztokem pemetrexedu a při jeho přípravě. Doporučuje se používat ochranné rukavice. Pokud dojde ke kontaktu roztoku pemetrexedu s kůží, umyjte ihned a důkladně kůži mýdlem a vodou. Pokud dojde ke kontaktu roztoku pemetrexedu se sliznicemi, opláchněte je důkladně vodou. Pemetrexed není zpuchýřující látka. V případě podání mimo žílu neexistuje specifické antidotum. Bylo popsáno několik případů podání pemetrexedu mimo žílu, které hodnotící lékař nepovažoval za závažné. Únik pemetrexedu mimo žílu se léčí podle místních standardních postupů jako u jiných látek nepůsobících vznik puchýřů.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Menarini International Operations Luxembourg S.A.
1, Avenue de la Gare L-1611, Luxembourg Lucembursko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/15/1055/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
NÁZEV PŘÍPRAVKU
1.
CIAMBRA 500 mg prášek pro koncentrát pro infuzní roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna injekční lahvička obsahuje pemetrexedum 500mg (jako pemetrexedum dinatricum dihemihydricum).
Po rekonstituci (viz bod 6.6) obsahuje jedna injekční lahvička pemetrexedum 25 mg/ml.
Pomocná látka se známým účinkem
Jedna injekční lahvička obsahuje přibližně 54 mg sodíku.
Úplný seznam pomocných látek viz bod 6.1
3. LÉKOVÁ FORMA
Prášek pro koncentrát pro infuzní roztok.
Bílý až téměř bílý lyofilizovaný prášek. pH rekonstituovaného roztoku je v rozmezí 6,6 a 7,8. Osmolalita rekonstituovaného roztoku je 230-270 mosmol/kg.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Maligní mezoteliom pleury
Přípravek CIAMBRA je v kombinaci s cisplatinou indikován k léčbě pacientů bez předchozí chemoterapie s neresekovatelným maligním mezoteliomem pleury.
Nemalobuněčný karcinom plic
Přípravek CIAMBRA je v kombinaci s cisplatinou indikován v první linii k léčbě pacientů s lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic jiného histologického typu, než predominantně z dlaždicových buněk (viz bod 5.1).
Přípravek CIAMBRA je indikován jako monoterapie k udržovací léčbě lokálně pokročilého nebo metastazujícího nemalobuněčného karcinomu plic jiného histologického typu, než predominantně z dlaždicových buněk u pacientů, u kterých po chemoterapii založené na platině nedošlo k bezprostřední progresi onemocnění (viz bod 5.1).
Přípravek CIAMBRA je indikován ve druhé linii jako monoterapie k léčbě pacientů s lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic jiného histologického typu, než predominantně z dlaždicových buněk(viz bod 5.1).
4.2 Dávkování a způsob podání
CIAMBRA se smí podávat pouze pod dohledem lékaře s kvalifikací pro používání protinádorové chemoterapie.
Dávkování
Přípravek CIAMBRA v kombinaci s cisplatinou
Doporučená dávka přípravku CIAMBRA je 500 mg/m2 tělesného povrchu ( body surface area - BSA), podávaná jako intravenózní infuze po dobu 10 minut první den každého 21denního cyklu. Doporučená dávka cisplatiny je 75 mg/m2 BSA, podaná infuzí během dvou hodin, přibližně 30 minut po ukončení infuze pemetrexedu v první den každého 21dennního cyklu. Pacienti musejí dostávat přiměřenou antiemetickou terapii a hydrataci před a/nebo po podání cisplatiny (viz také Souhrn údajů o přípravku pro cisplatinu, kde jsou uvedena specifická doporučení k dávkování).
Přípravek CIAMBRA v monoterapii
U pacientů léčených pro nemalobuněčný karcinom plic po předcházející chemoterapii je doporučená dávka přípravku CIAMBRA 500 mg/m2 BSA podávaná jako intravenózní infuze po dobu 10 minut v první den každého 21denního cyklu.
Režim premedikace
Ke snížení výskytu a závažnosti kožních reakcí se podá kortikosteroid den před podáním pemetrexedu, v den jeho podání a v den po jehopodání. Kortikosteroid by měl být ekvivalentní 4 mg dexamethasonu podávanému perorálně dvakrát denně (viz bod 4.4).
Ke snížení toxicity musí pacienti léčení pemetrexedem dostávat rovněž vitamínovou suplementaci (viz bod 4.4). Pacienti musí denně užívat kyselinu listovou perorálně nebo multivitamíny s obsahem kyseliny listové (350 až 1000 mikrogramů). Během sedmi dnů před první dávkou pemetrexedu se musí podat nejméně pět dávek kyseliny listové a její podávání musí pokračovat v průběhu celé léčby a po dobu 21 dní po poslední dávce pemetrexedu. Pacienti musejí rovněž dostat intramuskulární injekci vitamínu B12 (1000 mikrogramů) v týdnu před první dávkou pemetrexedu a poté jednou za každé tři cykly . Další injekce vitamínu B12 se mohou podávat ve stejný den jako pemetrexed.
Monitorování
Pacienti používající pemetrexed musejí mít před každou dávkou monitorovaný celý krevní obraz, včetně diferenciálu a počtu trombocytů. Před každým podáním chemoterapie musí být provedeno biochemické vyšetření krve za účelem vyhodnocení funkce ledvin a jater. Před zahájením každého cyklu chemoterapie je nutné, aby pacienti měli následující výsledky vyšetření: absolutní počet neutrofilů (ANC) musí být > 1500 buněk/mm3 a počet trombocytů musí být > 100 000 buněk/mm3. Clearance kreatininu musí být > 45 ml/min.
Celkový bilirubin musí být < 1,5násobek horní hranice normálních hodnot. Alkalická fosfatáza (ALP), aspartátaminotransferáza (AST neboli SGOT) a alaninaminotransferáza (ALT neboli SGPT) musí být < 3násobek horní hranice normálních hodnot. V případě postižení jater tumorem jsou akceptovatelné hodnoty ALP, AST a ALT < 5násobek horní hranice normálních hodnot.
Úprava dávek
Úprava dávky při zahájení následného cyklu se provede na základě krevního obrazu v době nejhlubšího poklesu nebo na základě maximální nehematologické toxicity zjištěné v předchozím cyklu terapie. Léčbu lze odložit, aby byl dostatek času k úpravě. Po úpravě se pacienti léčí podle pokynů uvedených v tabulkách 1, 2 a 3, které se použijí v případě podávání přípravku CIAMBRA v monoterapiinebo v kombinaci s cisplatinou.
|
Tabulka. 1 -Úprava dávek přípravku CIAMBRA (v monoterapii nebo v kombinaci) a cisplatiny - hematologické toxicity | |
|
ANC v době nejhlubšího poklesu < 500 /mm3 a počet trombocytů v době nejhlubšího poklesu > 50 000 /mm3 |
75 % předchozí dávky (přípravku CIAMBRA i cisplatiny) |
|
Počet trombocytů v době nejhlubšího poklesu <50 000 /mm3 bez ohledu na ANC v době nejhlubšího poklesu |
75 % předchozí dávky (přípravku CIAMBRA i cisplatiny) |
|
Počet trombocytů v době nejhlubšího poklesu <50 000/mm3 s krvácením a, bez ohledu na ANC v době nejhlubšího poklesu |
50 % předchozí dávky (přípravku CIAMBRA i cisplatiny) |
a dle obecných kritérií toxicity (CTC) podle National Cancer Institute (CTC v2.0, NCI 1998) definici krvácení > 2. stupně podle CTC
Pokud u pacientů dojde k rozvoji nehematologické toxicity > 3. stupně (s výjimkou neurotoxicity), musí se přípravek CIAMBRA vysadit až do úpravy na hodnoty nižší nebo stejné, jako byly hodnoty před léčbou. Léčba se zahájí podle pokynů uvedených v tabulce. 2.
|
Tabulka. 2 - Úprava dávek přípravku CIAMBRA (v monoterapii nebo v kombinaci) a cisplatiny - nehematologické toxicity a’ b | ||
|
Dávka přípravku CIAMBRA (mg/m2) |
Dávka cisplatiny (mg/m2) | |
|
Jakákoli toxicita stupně 3 nebo 4 s výjimkou mukozitidy |
75 % předchozí dávky |
75 % předchozí dávky |
|
Jakýkoli průjem s nutností hospitalizace (bez ohledu na stupeň) nebo průjem stupně 3 |
75 % předchozí dávky |
75 % předchozí dávky |
|
Mukozitida stupně 3 nebo 4 |
50 % předchozí dávky |
100 % předchozí dávky |
|
a Obecná kritéria toxicity (CTC) podle |
National Cancer Institute (CTC v2.0; NCI 1998) b S výjimkou | |
neurotoxicity
V případě neurotoxicity je doporučená úprava dávky pro přípravek CIAMBRA a cisplatinu uvedena v tab. 3. Pokud se vyskytnou projevy neurotoxicity stupně 3 nebo 4, pacienti musí léčbu přerušit.
|
Tabulka. 3 - Úpravy dávek přípravku CIAMBRA (v monoterapii nebo v kombinaci) a cisplatiny - neurotoxicita | ||
|
Stupeň toxicity podle CTCa |
Dávka přípravku CIAMBRA (mg/m2) |
Dávka cisplatiny (mg/m2) |
|
0 - 1 |
100 % předchozí dávky |
100 % předchozí dávky |
|
2 |
100 % předchozí dávky |
50 % předchozí dávky |
a Obecná kritéria běžné toxicity podle National Cancer Institute (CTC v2.0; NCI 1998)
Léčba přípravkem CIAMBRA musí být přerušena, pokud se u pacienta vyskytnou jakékoli projevy hematologické nebo nehematologické toxicity stupně 3 nebo 4 po 2 sníženích dávky nebo ihned, pokud se vyskytnou projevy neurotoxicity stupně 3 nebo 4.
Starší pacienti
V klinických studiích nebyly žádné známky, že by pacienti ve věku 65 let nebo starší měli zvýšené riziko nežádoucích účinků v porovnání s pacienty mladšími 65 let. Není nutné žádné snížení dávky kromě případů, kdy je toto snížení nezbytné pro všechny pacienty.
27
Pediatrická populace
Použití přípravku CIAMBRA u maligního mezoteliomu pleury a nemalobuněčného karcinomu plic není u pediatrické populace relevantní.
Pacienti s poruchou funkce ledvin (standardní Cockcroftův a Gaultův vzorec nebo rychlost glomerulární filtrace měřená metodou clearance Tc99m-DPTA v séru)
Pemetrexed se primárně vylučuje v nezměněné formě ledvinami. V klinických studiích nebyla u pacientů s clearance kreatininu > 45 ml/min zapotřebí žádná úprava dávky, kromě úprav doporučovaných pro všechny pacienty. Údaje o použití pemetrexedu u pacientů s clearancí kreatininu pod 45 ml/min jsou nedostatečné , a proto se u těchto pacientů používání pemetrexedu nedoporučuje (viz bod 4.4).
Pacienti s poruchou funkce jater
Nebyl zjištěn žádný vztah mezi AST (SGOT), ALT (SGPT) nebo celkovým bilirubinem a farmakokinetikou pemetrexedu. Nicméně, pacienti s poruchou funkce jater a bilirubinem >1,5krát vyšším, než je horní hranice normální hodnoty a/nebo aminotransferázami >3,0krát vyššími, než je horní hranice normálních hodnot (při absenci metastáz do jater) nebo >5,0krát vyššími, než je horní hranice normálních hodnot (při přítomnosti metastáz v játrech) nebyli specificky studováni.
Způsob podání
Opatření, která jsou nutná před zacházením s léčivým přípravkem CIAMBRA nebo před jeho podáním naleznete v bodě 6.6.
CIAMBRA se podává jako intravenózní infuze po dobu 10-ti minut první den každého 21denního cyklu. Pokyny pro rekonstituci a naředění přípravku CIAMBRA před jeho podáním naleznete v bodě 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku uvedenou v bodě 6.1.
Kojení (viz bod 4.6).
Současné podávání vakcíny proti žluté zimnici (viz bod 4.5).
4.4 Zvláštní upozornění a opatření pro použití
Pemetrexed může potlačit funkci kostní dřeně, která se manifestuje jako neutropenie, trombocytopenie a anémie (nebo pancytopenie) (viz bod 4.8). Útlum kostní dřeně představuje obvykle toxicitu, která limituje velikost použité dávky. Pacienti musí být během léčby sledováni z hlediska myelosuprese a pemetrexed se nesmí podat do doby, než se absolutní počet neutrofilů (ANC) nevrátí na hodnoty >
1 500 buněk/mm3 a počet trombocytů se nevrátí na hodnoty > 100 000 buněk/mm3. Úprava dávek v následujících cyklech je dána hodnotou absolutního počtu neutrofilů v době nejhlubšího poklesu, počtem trombocytů a maximální nehematologickou toxicitou pozorovanou v předchozím cyklu (viz bod 4.2).
Pokud byla před léčbou podávána kyselina listová a vitamin B12, byla hlášena menší toxicita a snížení hematologické a nehematologické toxicity stupně 3 nebo 4, jako je neutropenie, febrilní neutropenie a infekce s neutropenií stupně 3 nebo 4. Proto musejí být všichni pacienti léčení pemetrexedem poučeni, aby užívali kyselinu listovou a vitamín B12 jako profylaktické opatření ke snížení toxicity související s léčbou (viz bod 4.2).
U pacientů, kteří nedostávali před léčbou kortikosteroid, byly popsány kožní reakce. Podávání dexamethasonu (nebo ekvivalentního kortikosteroidu) před léčbou pemetrexedem může snížit výskyt a závažnost kožních reakcí (viz bod 4.2).
Nebyl studován dostatečný počet pacientů s clearance kreatininu pod 45 ml/min. Proto se nedoporučuje používání pemetrexedu u pacientů s clearance kreatininu <45 ml/min (viz bod 4.2).
Pacienti s lehkou až středně těžkou renální insuficiencí (clearance kreatininu 45 až 79 ml/min) by se měli vyvarovat užívání nesteroidních protizánětlivých léků (NSA), jako je ibuprofen a kyselina acetylsalicylová (>1,3 g denně) dva dny před podáním pemetrexedu, v den jeho podání a dva dny po podání pemetrexedu (viz bod 4.5).
U pacientů s lehkou až středně těžkou renální insuficiencí, u kterých je terapie pemetrexedem vhodná, má být přerušeno užívání NSA s dlouhým eliminačním poločasem nejméně 5 dnů před podáním pemetrexedu, v den jeho podání a nejméně dva dny po podání pemetrexedu (viz bod 4.5).
V souvislosti s podáváním pemetrexedu samotného nebo v kombinaci s jinými chemterapeutiky byly hlášeny závažné renální příhody, včetně akutního selhání ledvin. U mnoha pacientů, u kterých
k renálním příhodám došlo, existovaly rizikové faktory pro rozvoj těchto příhod, včetně dehydratace, preexistujícíhypertenze nebo diabetu.
Efekt tekutiny ve třetím prostoru, jako je pleurální výpotek nebo ascites, na pemetrexed není zcela stanoven. Klinická studie fáze 2 s pemetrexedem u 31 pacientů se solidním tumorem a se stabilním výpotkem ve třetím prostoru neprokázala žádný rozdíl v plazmatických koncentracích normalizovaných podle dávky a v clearance pemetrexedu oproti pacientům bez přítomnosti tekutiny ve třetím prostoru. Proto je vhodné před začátkem léčby pemetrexedem zvážit drenáž tekutiny z třetího prostoru, ale nemusí to být nutné.
V důsledku gastrointestinální toxicity pemetrexedu podávaného v kombinaci s cisplatinou byly popsány případy vážné dehydratace. Proto mají pacienti dostávat přiměřenou antiemetickou terapii a odpovídající hydrataci před podáním a případně i po podání medikace.
V průběhu klinických studií s pemetrexedem byly méně často hlášeny závažné kardiovaskulární příhody, zahrnující infarkt myokardu a cerebrovaskulární příhody, obvykle, když byl pemetrexed podáván v kombinaci s dalšími cytostatiky. Většina pacientů, u kterých byly tyto příhody pozorovány, měla preexistující kardiovaskulární rizikové faktory (viz bod 4.8).
Pokles imunity je častým jevem u pacientů s onkologickým onemocněním. Proto se nedoporučuje současné podávání živých oslabených vakcín (viz bod 4.3 a 4.5).
Pemetrexed může mít geneticky škodlivé účinky. Pohlavně zralým mužům se doporučuje, aby během léčby a až 6 měsíců po po jejím ukončení nepočali dítě. Doporučuje se používání antikoncepčních metod nebo abstinence. Vzhledem k možnosti, že by pemetrexed způsobil ireverzibilní neplodnost, se mužům doporučuje, aby před zahájením léčby vyhledali konzultaci o možnosti na uchování spermií.
Ženy ve fertilním věku musejí během léčby pemetrexedem používat účinnou antikoncepční metodu (viz bod 4.6).
U pacientů léčených ozařováním před léčbou, v průběhu nebo následovně po léčbě pemetrexedem, byly hlášeny případy postradiační pneumonitidy. Těmto pacientům by měla býtvěnována zvýšená pozornost a opatrnost je také zapotřebí při použití dalších radiosenzibilizujících látek.
Byly hlášeny případy kožní reakce v místě předchozího ozařování (radiation recall) u pacientů ozařovaných před delší dobou - před týdny až roky.
Tento léčivý přípravek obsahuje 2,34 mmol sodíku (54 mg) v jedné lahvičce. To je nutno zvážit u pacientů na dietě s kontrolovaným obsahem sodíku.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Pemetrexed se vylučuje hlavně ledvinami v nezměněné formě, a to tubulámí sekrecí a v menším rozsahu glomerulární filtrací. Souběžné podávání nefrotoxických léků (např. aminoglykosidy, kličková diuretika, sloučeniny platiny, cyklosporin) může vést k opožděné clearance pemetrexedu. Tato kombinace se musí používat s opatrností. Pokud je to nutné, má být pečlivě monitorována clearance kreatininu.
Souběžné podávání látek, které se rovněž vylučují tubulární sekrecí (např. probenecid, penicilin), může vést k opožděné clearance pemetrexedu. Při kombinaci těchto látek s pemetrexedem je zapotřebí zvýšené opatrnosti. Pokud je to nutné, má být pečlivě monitorována clearance kreatininu.
U pacientů s normální renální funkcí (clearance kreatininu > 80 ml/min) mohou vysoké dávky nesteroidních protizánětlivých léků (NSA, jako je ibuprofen >1 600 mg denně) a vysoké dávky kyseliny acetylsalicylové (> 1,3 g denně) snížit eliminaci pemetrexedu a tím zvýšit výskyt nežádoucích účinků. Proto je zapotřebí při současném podávání vyšších dávek NSA nebo kyseliny acetylsalicylové společně s pemetrexedem u pacientů s normální renální funkcí (clearance kreatininu > 80 ml/min) zvýšené opatrnosti.
Pacienti s lehkou až středně těžkou renální insuficiencí (clearance kreatininu 45 až 79 ml/min) se mají vyvarovat současného používání pemetrexedu s NSA (např. ibuprofen) nebo s vyššími dávkami kyseliny acetylsalicylové 2 dny před podáním pemetrexedu, v den jeho podání a 2 dny po podání pemetrexedu (viz bod 4.4).
Jelikož nejsou k dispozici údaje o potenciální interakci mezi pemetrexedem a NSA s delším poločasem, jako je piroxikam a rofekoxib, je potřebné jejich podávání pacientům s lehkou až středně těžkou renální insuficiencí přerušit nejméně 5 dní před podáním pemetrexedu, v den jeho podání a nejméně 2 dny po podání pemetrexedu (viz bod 4.4). Pokud je současné podávání NSA nezbytné, mají být pacienti důkladně monitorováni z hlediska toxicity, zejména myelosuprese a gastrointestinální toxicity.
Pemetrexed prochází omezeným jaterním metabolismem. Výsledky studií in vitro s lidskými jaterními mikrozomy ukázaly, že nelze předpovědět, zda pemetrexed způsobí klinicky významnou inhibici metabolické clearance léků metabolizovaných CYP3A, CYP2D6, CYP2C9 a CYP1A2.
Interakce běžné u všech cvtotoxickvch látek:
Vzhledem ke zvýšenému riziku trombózy u pacientů s maligním onemocněním je časté používání antikoagulační léčby. Vysoká intraindividuální variabilita koagulačního stavu při těchto chorobách a možnost interakce mezi perorálními antikoagulancii a protinádorovou chemoterapií vyžaduje zvýšenou frekvenci monitorování INR (International Normalised Ratio), pokud se rozhodneme léčit pacienta perorálními antikoagulancii.
Kontraindikované současné používání: vakcína proti žluté zimnici: riziko fatálního generalizovaného vakcinačního onemocnění (viz bod 4.3).
Nedoporučené současné používání: živé oslabené vakcíny (vyjma žluté zimnice, kdy je současné používání kontraindikováno): riziko systémové reakce s možným fatálním vyústěním. Toto riziko je zvýšeno u osob s již existujícím poklesem imunity způsobeným základním onemocněním. Kde je to možné, použijte inaktivované vakcíny (poliomyelitis) (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Antikoncepce u mužů a žen
Ženy ve fertilním věku musí v průběhu léčby pemetrexedem používat účinnou antikoncepci. Pemetrexed může mít geneticky škodlivé účinky. Pohlavně zralým mužům se doporučuje, aby během léčby a až 6 měsíců po jejím ukončení nepočali dítě. Doporučuje se používání antikoncepčních metod nebo abstinence.
Neexistují údaje o použití pemetrexedu u těhotných žen, avšak je podezření, že pemetrexed tak jako ostatní antimetabolity způsobuje vážné vrozené vady, pokud je podáván v těhotenství. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Pemetrexed se nemá používat v těhotenství, pokud to není jednoznačně nezbytné a po pečlivém zvážení potřeby léčby u matky a rizika pro plod (viz bod 4.4).
Kojení
Není známo, zda se pemetrexed vylučuje do lidského mateřského mléka a nežádoucí účinky u kojeného dítěte nelze vyloučit. Při léčbě pemetrexedem musí být kojení přerušeno (viz bod 4.3).
Fertilita
Vzhledem k možnosti způsobit léčbou pemetrexedem ireverzibilní nepodnost, se mužům doporučuje, aby před zahájením léčby vyhledali konzultaci o možnosti uchování spermií.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit a obsluhovat stroje nebyly provedeny. Bylo však popsáno, že pemetrexed může způsobovat únavu. Pacienti proto mají být upozorněni, aby neřídili nebo neobsluhovali stroje v případě, že se tyto nežádoucí účinky objeví.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nejčastěji hlášenými nežádoucími účinky v souvislosti s pemetrexedem používaným, ať už v monoterapii nebo v kombinaci jsou útlum kostní dřeně, manifestující se jako anémie, neutropenie, leukopenie, trombocytopenie a gastrointestinální toxicita, manifestující se jako anorexie, nauzea, zvracení, průjem, zácpa, faryngitida, mukozitida a stomatitida. Další nežádoucí účinky zahrnují renální toxicitu, zvýšení hladin aminotransferáz, alopecii, únavu, dehydrataci, vyrážku, infekci /sepsi a neuropatii. Mezi vzácné nežádoucí účinky patří Stevens-Johnsonův syndrom a toxická epidermální nekrolýza.
Seznam nežádoucích účinkův tabulce
V tabulce níže je uvedena frekvence a závažnost nežádoucích účinků, které byly hlášeny u více než 5% ze 168 pacientů s mezoteliomem, kteří byli randomizováni k léčbě cisplatinou a pemetrexedem a u 163 pacientů s mezoteliomem, kteří byli randomizováni k léčbě cisplatinou v monoterapii. V obou léčebných ramenech byla pacientům,, u kterých dosud nebyla prováděna chemoterapie, plně doplňována kyselina listová a vitamín B12.
Frekvence nežádoucích účinků je definována: Velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (>1/10 000 až <1/1000), velmi vzácné (<1/10 000) a není známo (z dostupných údajů nelze určit).
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Třída orgánových systémů |
F rekvence |
Nežádoucí účinek* |
pemetrexed/cisplatina |
cisplatina | ||
|
(N = 168) |
(N = 163) | |||||
|
Všechny stupně toxicity (%) |
T oxicita stupně 3 - 4 (%) |
Všechny stupně toxicity (%) |
Toxicita stupně 3 - 4 (%) | |||
|
Poruchy krve a lymfatického systému |
Velmi časté |
Neutrofily / granulocyty -snížení |
56,0 |
23,2 |
13,5 |
3,1 |
|
Leukocyty -snížení |
53,0 |
14,9 |
16,6 |
0,6 | ||
|
Hemoglobin -snížení |
26,2 |
4,2 |
10,4 |
0,0 | ||
|
Trombocyty-snížení počtu |
23,2 |
5,4 |
8,6 |
0,0 | ||
|
Poruchy metabolismu a výživy |
Časté |
Dehydratace |
6,5 |
4,2 |
0,6 |
0,6 |
|
Poruchy nervového systému |
Velmi časté |
Neuropatie -senzorická |
10,1 |
0,0 |
9,8 |
0,6 |
|
Časté |
Porucha chuti |
7,7 |
0,0*** |
6,1 |
0,0*** | |
|
Poruchy oka |
Časté |
Konjunktivitida |
5,4 |
0,0 |
0,6 |
0,0 |
|
Gastrointestinální poruchy |
Velmi časté |
16,7 |
3,6 |
8,0 |
0,0 | |
|
56,5 |
10,7 |
49,7 |
4,3 | |||
|
Stomatitida / faryngitida |
23,2 |
3,0 |
6,1 |
0,0 | ||
|
82,1 |
11,9 |
76,7 |
5,5 | |||
|
20,2 |
1,2 |
14,1 |
0,6 | |||
|
Zácpa |
11,9 |
0,6 |
7,4 |
0,6 | ||
|
Časté |
5,4 |
0,6 |
0,6 |
0,0 | ||
|
Poruchy kůže a podkožní tkáně |
Velmi časté |
16,1 |
0,6 |
4,9 |
0,0 | |
|
Alopecie |
11,3 |
0,0*** |
5,5 |
0,0*** | ||
|
Poruchy ledvin a močových cest |
Velmi časté |
Kreatinin -zvýšení |
10,7 |
0,6 |
9,8 |
1,2 |
|
Snížení clearance kreatininu** |
16,1 |
0,6 |
17,8 |
1,8 | ||
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Únava |
47,6 |
10,1 |
42,3 |
9,2 |
* Viz obecná kritéria toxicity (CTC) podle National Cancer Institute verze 2 pro každý stupeň toxicity s výjimkou termínu„snížení clearance kreatininu“
** který je odvozen z termínu „renální / urogenitální, jiné“
*** V souladu s CTC vydanými National Cancer Institute (v2.0; NCI 1998), by případy poruchy chuti a alopecie měly být hlášeny pouze jako stupeň 1 nebo 2.
Pro účely této tabulky byla použita hraniční hodnota 5 % pro zařazení všech příhod, kdy hlásící osoba považovala souvislost mezi příhodou a léčbou pemetrexedem a cisplatinou za možnou.
Klinicky relevantní projevy toxicity (dle CTC), které byly hlášeny v > 1 % a < 5 % u pacientů náhodným výběrem přidělených k léčbě cisplatinou a pemetrexedem, jsou: renální selhání, infekce, horečka, febrilní neutropenie, zvýšení AST, ALT a GGT, kopřivka a bolest na hrudi.
Klinicky relevantní projevy toxicity (dle CTC), které byly hlášeny u <1% pacientů náhodným výběrem přidělených k léčbě cisplatinou a pemetrexedem, jsou: arytmie a motorická neuropatie.
V tabulce níže je uvedena frekvence a závažnost nežádoucích účinků, které byly hlášeny u více než 5 % z 265 pacientů, kteří byli randomizováni k léčbě pemetrexedem v monoterapii, a kterým byla doplňována kyselina listová a vitamín B12 a u 276 pacientů, kteří byli randomizováni k léčbě docetaxelem v monoterapii. U všech pacientů byla stanovena diagnóza lokálně pokročilého nebo metastazujícího nemalobuněčného karcinomu plic a již byli léčeni chemoterapií.
|
Třída orgánových systémů |
Frekvence |
Nežádoucí účinek* |
pemetrexed N = 265 |
docetaxel N = 276 | ||
|
Všechny stupně toxicity (%) |
Toxicita stupně 3 - 4 (%) |
Všechny stupně toxicity (%) |
Toxicita stupně 3 - 4 (%) | |||
|
Poruchy krve a lymfatického systému |
Velmi časté |
Neutrofily / granulocyty -snížení |
10,9 |
5,3 |
45,3 |
40,2 |
|
Leukocyty - snížení |
12,1 |
4,2 |
34,1 |
27,2 | ||
|
Hemoglobin - snížení |
19,2 |
4,2 |
22,1 |
4,3 | ||
|
Časté |
Trombocyty-snížení počtu |
8,3 |
1,9 |
1,1 |
0,4 | |
|
Gastrointe stinální poruchy |
Velmi časté |
12,8 |
0,4 |
24,3 |
2,5 | |
|
16,2 |
1,5 |
12,0 |
1,1 | |||
|
Stomatitida / faryngitida |
14,7 |
1,1 |
17,4 |
1,1 | ||
|
30,9 |
2,6 |
16,7 |
1,8 | |||
|
21,9 |
1,9 |
23,9 |
2,5 | |||
|
Časté |
Zácpa |
5,7 |
0,0 |
4,0 |
0,0 | |
|
Poruchy jater a žlučových cest |
Časté |
SGPT (ALT)-zvvšení |
7,9 |
1,9 |
1,4 |
0,0 |
|
SGOT (AST)-zvýšení |
6,8 |
1,1 |
0,7 |
0,0 | ||
|
Poruchy kůže a podkožní tkáně |
Velmi časté |
Vyrážka / deskvamace |
14,0 |
0,0 |
6,2 |
0,0 |
|
Časté |
Pruritus |
6,8 |
0,4 |
1,8 |
0,0 | |
|
Alopecie |
6,4 |
0,4** |
37,7 |
2,2** | ||
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Únava |
34,0 |
5,3 |
35,9 |
5,4 |
|
Časté |
8,3 |
0,0 |
7,6 |
0,0 | ||
Cancer Institute, verze 2 pro každý stupeň
* Viz obecná kritéria toxicity (CTC) podle Nationa toxicity.
** V souladu s CTC vydanými National Cancer Institute (v2.0; NCI 1998) by případy alopecie měly být hlášeny pouze jako stupeň 1 nebo 2.
Pro účely této tabulky byla použita hraniční hodnota 5 % pro zařazení všech příhod, kdy hlásící osoba považovala souvislost mezi příhodou a léčbou pemetrexedem za možnou.
Klinicky relevantní projevy toxicity (dle CTC), které byly hlášeny v > 1 % a < 5 % u pacientů náhodným výběrem přidělených k léčbě pemetrexedem, j sou: infekce bez neutropenie, febrilní neutropenie, alergická reakce / hypersenzitivita, zvýšení kreatininu, motorická neuropatie, senzorická neuropatie, erythema multiforme a bolesti břicha.
Klinicky relevantní projevy toxicity (dle CTC), které byly hlášeny u < 1 % pacientů náhodným výběrem přidělených k léčbě pemetrexedem, jsou supraventrikulární arytmie.
Klinicky relevantní laboratorní projevy toxicity stupně 3 a 4 byly obdobné při hodnocení integrovaných výsledků 3 studií fáze 2 sledujících monoterapii pemetrexedem (n = 164) a studie fáze 3sledující monoterapii pemetrexedem (popsána výše), s výjimkou neutropenie (12,8 % oproti 5,3 %) a zvýšení alanin aminotransferázy (15,2 % vs. 1,9 %). Tyto rozdíly byly pravděpodobně dány rozdíly v populaci pacientů, protože do studií fáze 2 byli zařazeni pacienti dosud neléčení chemoterapií a pacientky s karcinomem prsu, předem intenzivně léčené s již existujícími metastázami do jater a/nebo s patologickými výchozími funkčními jaterními testy.
V tabulce níže je uvedena frekvence a závažnost nežádoucích účinků pravděpodobně souvisejících se studovanou medikací, které byly hlášeny u více než 5 % z 839 pacientů s NSCLC, kteří byli randomizováni k léčbě cisplatinou v kombinaci s pemetrexedem a z 830 pacientů s NSCLC, kteří byli randomizováni k léčbě cisplatinou v kombinaci s gemcitabinem. Všichni pacienti obdrželi studijní léčbu jako zahajovací léčbu lokálně pokročilého nebo metastazujícího nemalobuněčného karcinomu plic a pacienti v obou skupinách byli plně suplementováni kyselinou listovou a vitamínem B12.
|
Třída orgánových systémů |
Frekvence |
Nežádoucí účinek** |
pemetrexed / cisplatina (N = 839) |
gemcitabin / cisplatina (N = 830) | ||
|
Všechny stupně toxicity (%) |
Toxicita stupně 3 - 4 (%) |
Všechny stupně toxicity (%) |
T oxicita stupně 3 - 4 (%) | |||
|
Poruchy krve a lymfatického systému |
Velmi časté |
Hemoglobin -snížení |
33,0* |
5,6 * |
45,7* |
9,9* |
|
Neutrofily / granulocyty - snížení |
29,0* |
15,1* |
38,4* |
26,7* | ||
|
Leukocyty - snížení |
17,8 |
4,8 * |
20,6 |
7,6* | ||
|
Trombocyty-snížení počtu |
10,1* |
4,1 * |
26,6* |
12,7* | ||
|
Poruchy nervového systému |
Časté |
Neuropatie -senzorická |
8,5* |
0,0 * |
12,4* |
0,6* |
|
Porucha chuti |
8,1 |
0,0*** |
8,9 |
0,0*** | ||
|
Gastrointe stinální poruchy |
Velmi časté |
56,1 |
7,2* |
53,4 |
3,9* | |
|
39,7 |
6,1 |
35,5 |
6,1 | |||
|
26,6 |
2,4* |
24,2 |
0,7* | |||
|
Zácpa |
21,0 |
0,8 |
19,5 |
0,4 | ||
|
Stomatitida / faryngitida |
13,5 |
0,8 |
12,4 |
0,1 | ||
|
Průjem bez kolostomie |
12,4 |
1,3 |
12,8 |
1,6 | ||
|
Časté |
Dyspepsie / pálení žáhy |
5,2 |
0,1 |
5,9 |
0,0 | |
|
Poruchy kůže a podkožní tkáně |
Velmi časté |
Alopecie |
11,9* |
0*** |
21,4* |
0,5*** |
|
Časté |
Vyrážka / |
6,6 |
0,1 |
8,0 |
0,5 | |
|
Poruchy ledvin a močových cest |
Velmi časté |
Kreatinin-zvýšení |
10,1* |
0,8 |
6,9* |
0,5 |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Únava |
42,7 |
6,7 |
44,9 |
4,9 |
* hodnota p <0,05 při srovnání kombinace pemetrexed /cisplatina a gemcitabin /cisplatina při použití Fisherova exaktního testu.
** Viz obecná kritéria toxicity (CTC) podle National Cancer Institute (verze 2; NCI 1998) pro každý stupeň toxicity.
*** V souladu s CTC vydanými National Cancer Institute (v2.0; NCI 1998) se porucha chuti a alopecie hlásí pouze jako stupeň 1 nebo 2.
Pro účely této tabulky byla použita hraniční hodnota 5 % pro zařazení všech příhod, kdy hlásící osoba považovala souvislost mezi příhodou a léčbou pemetrexedem a cisplatinou za možnou.
Klinicky relevantní toxicita, která byla hlášena u > 1 % a < 5 % pacientů náhodným výběrem přidělených k léčbě pemetrexedem a cisplatinou, zahrnovala: zvýšení hodnot AST, zvýšení hodnot ALT, infekci, febrilní neutropenii, renální selhání, pyrexii, dehydrataci, konjunktivitidu a snížení clearance kreatininu. Klinicky relevantní toxicita, která byla hlášena u < 1 % pacientů náhodným výběrem přidělených k léčbě pemetrexedem a cisplatinou, zahrnovala: zvýšení hodnot GGT, bolest na hrudi, arytmie a motorickou neuropatii.
Klinicky relevantní toxicita byla v celkové populaci u pacientů používajících pemetrexed v kombinaci s cisplatinou podobná bez ohledu na pohlaví.
V tabulce níže je uvedena frekvence a závažnost nežádoucích účinků pravděpodobně souvisejících se studijní medikací, které byly v klinických hodnoceních udržovací léčby pemetrexedem v monoterapii (JMEN: N=663) a pokračující udržovací léčby pemetrexedem (PARAMOUNT: N=539) hlášeny u více než 5% z 800 pacientů, kteří byli randomizováni k léčbě samotným pemetrexedem a 402 pacientů, kteří byli randomizováni k léčbě placebem. U všech pacientů byl diagnostikován NSCLC stadia IIIB nebo IV a všichni podstoupili předchozí terapii založenou na platině. Pacientům v obou ramenech studie byla plně doplňována kyselina listová a vitamín B12.
|
Třída orgánových systémů |
Frekvence* |
Nežádoucí účinek** |
pemetrexed*** (N =800) |
placebo*** (N =402) | ||
|
Všechny stupně toxicity (%) |
T oxicita stupně 3 - 4 (%) |
Všechny stupně toxicity (%) |
Toxicita stupně 3 - 4 (%) | |||
|
Poruchy krve a lymfatického systému |
Velmi časté |
Hemoglobin - snížení |
18,0 |
4,5 |
5,2 |
0,5 |
|
Časté |
Leukocyty -snížení |
5,8 |
1,9 |
0,7 |
0,2 | |
|
Neutrofily -snížení |
8,4 |
4,4 |
0,2 |
0,0 | ||
|
Poruchy nervového systému |
Časté |
Neuropatie -senzorická |
7,4 |
0,6 |
5,0 |
0,2 |
|
Gastrointestinální poruchy |
Velmi časté |
17,3 |
0,8 |
4,0 |
0,2 | |
|
12,8 |
1,1 |
3,2 |
0,0 | |||
|
Časté |
8,4 |
0,3 |
1,5 |
0,0 | ||
|
Mukozitida / stomatitida |
6,8 |
0,8 |
1,7 |
0,0 | ||
|
Poruchy jater a žlučových cest |
Časté |
SGPT (ALT) -vzestup |
6,5 |
0,1 |
2,2 |
0,0 |
|
SGOT (AST) -vzestup |
5,9 |
0,0 |
1,7 |
0,0 | ||
|
Poruchy kůže a podkožní tkáně |
Časté |
Vyrážka / deskvamace |
8,1 |
0,1 |
3,7 |
0,0 |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Únava |
24,1 |
5,3 |
10,9 |
0,7 |
|
Časté |
Bolest |
7,6 |
0,9 |
4,5 |
0,0 | |
|
Edém |
5,6 |
0,0 |
1,5 |
0,0 | ||
|
Poruchy ledvin |
Časté |
Renální poruchy **** |
7,6 |
0,9 |
1,7 |
0,0 |
Zkratky: ALT (SGPT) = alaninaminotransferáza; AST (SGOT) = aspartátaminotransferáza; CTCAE = obecná terminologická kritéria nežádoucích účinků (Common Terminology Criteria for Adverse Event); NCI = National Cancer Institute; * Definice frekvence nežádoucích účinků: velmi časté - > 10%; časté - > 5% a < 10%. Pro účely této tabulky byla použita hraniční hodnota 5% pro zařazení všech příhod, kdy hlásící osoba považovala příhodu za možná související s léčbou pemetrexedem.
** Viz NCI CTCAE kritéria (verze 3.0; NCI 2003) pro každý stupeň toxicity. Výskyt toxicit uveden podle CTCAE verze 3.0.
*** V integrované tabulce nežádoucích účinků j sou kombinovány výsledky klinických hodnocení udržovací léčby pemetrexedem JMEN (N=663) a pokračující udržovací léčby pemetrexedem PARAMOUNT (N=539).
**** Souhrnné označení zahrnuje zvýšení kreatininu v séru/krvi, pokles glomerulární filtrace, renální selhání a renální / urogenitální - jiné.
Klinicky relevantní projevy toxicity (dle CTC) jakéhokoli stupně, které byly hlášeny u > 1 % a < 5 % pacientů náhodným výběrem přidělených k léčbě pemetrexedem zahrnují: febrilní neutropenii, infekci, snížení počtu trombocytů, průjem, zácpu, alopecii, pruritus /svědění, horečku (bez neutropenie), onemocnění očního povrchu (včetně konjunktivitidy), zvýšené slzení, závrať a motorickou neuropatii.
Klinicky relevantní projevy toxicity (dle CTC), které byly hlášeny u <1% pacientů náhodným výběrem přidělených k léčbě pemetrexedem, jsou: alergická reakce / hypersenzitivita, multiformní erytém, supraventrikulární arytmie a plicní embolie.
Bezpečnost byla hodnocena u pacientů, kteří byli randomizováni k léčbě pemetrexedem (N=800). Výskyt nežádoucích účinků byl hodnocen u pacientů, kteří dostali < 6 cyklů udržovací léčby pemetrexedem (N=519) a srovnán s výskytem u pacientů, kteří dostali > 6 cyklů léčby pemetrexedem (N=281). S déle trvající expozicí bylo pozorováno zvýšení výskytu nežádoucích účinků (všech stupňů). Významné zvýšení výskytu neutropenie stupně 3/4 potenciálně související s hodnoceným lékem bylo pozorováno při delší expozici pemetrexedu (<6 cyklů: 3,3%, > 6 cyklů: 6,4%: p=0,046).
U dalších jednotlivých stupňů 3/4/5 nežádoucích účinků nebyly při delší expozici pozorovány statisticky významné rozdíly.
V průběhu klinických studií s pemetrexedem byly méně často hlášeny závažné kardiovaskulární a cerebrovaskulární příhody, zahrnující infarkt myokardu, anginu pectoris a tranzitorní ischemické ataky obvykle, když byl pemetrexed podáván v kombinaci s dalšími cytostatiky. Většina pacientů, u kterých byly tyto příhody pozorovány, měla preexistující kardiovaskulární rizikové faktory.
V průběhu klinických studií s pemetrexedem byly vzácně hlášeny případy potenciálně závažné hepatitidy.
Méně často byla u pacientů v průběhu klinických studií s pemetrexedem hlášena pancytopenie.
Méně často byly v klinických studiích u pacientů léčených pemetrexedem hlášeny případy kolitidy (včetně intestinálního a rektálního krvácení, někdy s fatálním průběhem, intestinální perforace, nekrózy a zánětu céka).
Méně často byly v klinických studiích u pacientů léčených pemetrexedem hlášeny případy intersticiální pneumonitidy s respirační nedostatečností, někdy s fatálním průběhem.
U pacientů léčených pemetrexedem byly méně často hlášeny případy edému.
Méně často byla u pacientů v průběhu klinických studií s pemetrexedem hlášena ezofagitida / radiační ezofagitida.
V průběhu klinických studií s pemetrexedem byly často hlášeny sepse, někdy fatálním průběhem.
V průběhu postmarketingového sledování byly hlášeny u pacientů léčených pemetrexedem následující nežádoucí účinky:
V souvislosti s podáváním pemetrexedu samotného nebo v kombinaci s jinými chemoterapeutiky byly méně často hlášeny případy akutního selhání ledvin (viz bod 4.4).
U pacientů léčených ozařováním před léčbou, v průběhu nebo následně po léčbě pemetrexedem byly méně často hlášeny případy postradiační pneumonitidy (viz bod 4.4).
U pacientů, kteří dříve podstoupili léčbu ozařováním, byly vzácně hlášeny případy kožní reakce v místě předchozího ozařování (radiation recall) (viz bod 4.4).
Méně často byly hlášeny případy periferní ischémie, které někdy vedly k nekróze končetin.
Vzácně byly hlášeny případy tvorby puchýřů včetně Stevens-Johnsonova syndromu a toxické epidermální nekrolýzy, které byly v některých případech fatální.
Vzácně byla u pacientů léčených pemetrexedem hlášena hemolytická anémie, vyvolaná imunitní reakcí.
Vzácně byly hlášeny případy anafylaktického šoku.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v dodatku V.
4.9 Předávkování
K popsaným symptomům předávkování patří neutropenie, anémie, trombocytopenie, mukozitida, senzorická polyneuropatie a vyrážka. K předpokládaným komplikacím předávkování patří útlum kostní dřeně, který se manifestuje neutropenií, trombocytopenií a anemií. Kromě toho lze pozorovat infekce s horečkou nebo bez ní, průjem a/nebo mukozitidu. V případě podezření na předávkování musí být u pacientů sledován krevní obraz a pacienti mají dostávat podle potřeby podpůrnou léčbu. V léčbě předávkování pemetrexedem se má zvážit podávání kalcium-folinátu nebo kyseliny folinové.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antineoplastika, analogy kyseliny listové, ATC kód: L01BA04
CIAMBRA (pemetrexed) je tzv. „multi-targeted“ antifolikum, protinádorová látkapůsobící narušení několika klíčových metabolických procesů závislých na kyselině listové, které jsou nezbytné pro replikaci buněk.
Studie in vitro prokázaly, že pemetrexed se chová jako „multi-targeted“ antifolikum tím, že inhibuje thymidylátsyntázu (TS), dihydrofolátreduktázu (DHFR) a glycinamid ribonukleotid formyltransferázu (GARFT), které jsou klíčové enzymy závislé na folátu pro biosyntézu thymidinu a purinových nukleotidů de novo. Pemetrexed je transportován do buněk redukovaným nosičem folátu a membránovým folátovým vazebným proteinovým transportním systémem. Jakmile je pemetrexed v buňce, přeměňuje se rychle a efektivně na polyglutamátové formy pomocí enzymu folylpolyglutamátsyntetáza. Polyglutamátové formy se zadržují v buňkách a jsou ještě silnějšími inhibitory TS a GARFT. Polyglutamace je proces závislý na čase a koncentraci, ke kterému dochází v nádorových buňkách a v menší míře i v normálních tkáních. Polyglutamátové metabolity mají zvýšený intracelulární poločas, což vede k protrahovanému účinku léku v maligních buňkách.
Klinická, účinnost.
Mezoteliom
Studie EMPHACIS byla multicentrická, randomizovaná, jednoduše zaslepená studie fáze 3 s pemetrexedem a cisplatinou oproti cisplatině u pacientů s maligním mezoteliomem pleury, kteří dosud nepodstoupili chemoterapii. V této studii bylo prokázáno, že pacienti léčení pemetrexedem a cisplatinou měli klinicky významnou výhodu mediánu přežívání, trvající 2,8 měsíce v porovnání s pacienty léčenými cisplatinou v monoterapii.
Během studie byla k léčbě zavedena dlouhodobá suplementace nízkými dávkami kyseliny listové a vitamínu B12 s cílem snížit toxicitu. Primární analýza této studie byla provedena na populaci všech pacientů randomizovaně přidělených do léčebné skupiny, kteří dostávali hodnocený lék (randomizovaní a léčení). Byla provedena analýza podskupin u pacientů, kteří dostávali suplementaci kyselinou listovou a vitamínem B12 v průběhu celé léčebné kúry hodnoceným lékem (úplná suplementace). Výsledky těchto analýz účinnosti jsou shrnuty v tabulce níže:
Účinnost pemetrexedu v kombinaci s cisplatinou oproti cisplatině u pacientů s maligním
|
Randomizovaní a léčení pacienti |
Plně suplementovaní pacienti | |||
|
Parametr účinnosti |
pemetrexed / cisplatina |
cisplatina |
pemetrexed / cisplatina |
cisplatina |
|
(N = 226) |
(N = 222) |
(N = 168) |
(N = 163) | |
|
Medián celkového přežití (měsíce) |
12,1 |
9,3 |
13,3 |
10,0 |
|
(95% CI) |
(10,0 - 14,4) |
(7,8 - 10,7) |
(11,4 - 14,9) |
(8,4 - 11,9) |
|
Log Rank hodnota p* |
0,020 |
0,051 | ||
|
Medián doby do progrese nádoru (měsíce) |
5,7 |
3,9 |
6,1 |
3,9 |
|
(95% CI) |
(4,9 - 6,5) |
(2,8 - 4,4) |
(5,3 - 7,0) |
(2,8 - 4,5) |
|
Log Rank hodnota p* |
0,001 |
0,008 | ||
|
Doba do selhání léčby (měsíce) (95% |
4,5 |
2,7 |
4,7 |
2,7 |
|
CI) |
(3,9 - 4,9) |
(2,1 - 2,9) |
(4,3 - 5,6) |
(2,2 - 3,1) |
|
Log Rank hodnota p* |
0,001 |
0,001 | ||
|
Poměr celkové odpovědi** |
41,3 % |
16,7 % |
45,5 % |
19,6 % |
|
(95% CI) |
(34,8 - 48,1) |
(12,0 - 22,2) |
(37,8 - 53,4) |
(13,8 - 26,6) |
|
Fisherova přesná hodnota p* |
< 0,001 |
< 0,001 | ||
Zkratka: CI = interval spolehlivosti * hodnota p se týká srovnání mezi rameny.
** V rameni pemetrexed/cisplatina, randomizovaní a léčení (N = 225) a plně suplementovaní (N = 167) pacienti
Statisticky významné zlepšení klinicky významných symptomů (bolest a dušnost) vyskytujících se při maligním mezoteliomu pleury v rameni s pemetrexedem/cisplatinou (212 pacientů) oproti rameni s léčbou pouze cisplatinou (218 pacientů) bylo prokázáno pomocí škály symptomů karcinomu plic.
Byly rovněž pozorovány statisticky významné rozdíly v plicních funkčních testech. Oddělení mezi léčebnými rameny bylo dosaženo zlepšením plicní funkce v rameni pemetrexed/cisplatina a zhoršením plicní funkce v čase u kontrolního ramene.
Existují omezené údaje u pacientů s maligním mezoteliomem pleury, léčených pemetrexedem v monoterapii. Pemetrexed v dávce 500 mg/m2 byl studován jako lék podávaný v monoterapii u 64 pacientů s maligním mezoteliomem pleury dosud neléčených chemoterapií. Celkový výskyt odpovědi na léčbu bylo14,1 % pacientů.
NSCLC, léčba v druhé linii:
V multicentrické, randomizované, otevřené studii fáze 3 s pemetrexedem a docetaxelem u pacientů s lokálně pokročilým nebo metastatickým nemalobuněčným karcinomem plic po předchozí chemoterapii byl prokázán medián doby přežívání 8,3 měsíce u pacientů léčených pemetrexedem (populace se záměrem léčit - ITT, n = 283) a 7,9 měsíců u pacientů léčených docetaxelem (ITT, n = 288). Předchozí chemoterapie nezahrnovala pemetrexed. Výsledky analýzy vlivu histologie NSCLC na léčebné ovlivnění celkového přežití svědčí ve prospěch pemetrexedu oproti docetaxelu u pacientů s NSCLC jiného histologického typu než predominantně z dlaždicových buněk (n = 399, 9,3 vs. 8,0 měsíců, upravený HR = 0,78; 95% CI = 0,61-1,00, p = 0,047) a ve prospěch docetaxelu u karcinomu s histologickou strukturou z dlaždicových buněk (n = 172, 6,2 vs. 7,4 měsíců, adjustovaný HR = 1,56; 95% CI = 1,08-2,26, p = 0,018). V histologických podskupinách nebyly pozorovány žádné klinicky důležité rozdíly v bezpečnostním profilu pemetrexedu.
Omezené klinické údaje z jiného randomizovaného, kontrolovaného klinického hodnocení fáze 3 naznačují, že údaje o účinnosti pemetrexedu (celková doba přežívání, doba přežití bez progrese) jsou podobné pro skupinu pacientů s předchozí léčbou docetaxelem (n = 41) a pacientů bez předchozí léčby docetaxelem (n = 540).
pemetrexed
docetaxel
Doba přežívání (měsíce)
□ Medián (m)
□ 95% CI pro medián
□ HR
□ 95% CI pro HR
□ Hodnota p pro neinferioritu (HR)
Doba přežití bez progrese (měsíce)
Medián
□ HR (95% CI)_
Doba do selhání léčby (TTTF - měsíce)
Medián
□ HR (95% CI)_
Odpověď (n: kvalifikovaní pro odpověď)
□ Výskyt odpovědi (%) (95% CI)
□ Stabilní onemocnění (%)_
(n = 283) (n = 288)
8,3 7,9
(7,0 - 9,4) (6,3 - 9,2)
0,99
(0,82 -1,20)
0,226
(n = 283) (n = 288)
2,9 2,9
_0,97 (0,82 - 1,16)_
(n = 283) (n = 288)
2,3 2,1
0,84 (0,71 -0,997)_
(n = 264)
9,1 (5,9 - 13,2) 45,8
(n = 274)
8,8 (5,7 - 12,8) 46,4
Zkratky: CI = interval spolehlivosti; HR = poměr rizik; ITT = záměr léčit; n = celková velikost populace
NSCLC, léčba v první linii:
Multicentrická, randomizovaná, otevřená studie fáze 3 s pemetrexedem a cisplatinou oproti gemcitabinu s cisplatinou u pacientů bez předchozí chemoterapie s lokálně pokročilým nebo metastazujícím (stadiumIIIb nebo IV) nemalobuněčným karcinomem plic (NSCLC) prokázala, že pemetrexed v kombinaci s cisplatinou (populace ITT Intent-to-treat, n = 862) dosáhl primárního cílového parametru a prokázal podobný klinický účinek jako gemcitabin v kombinaci s cisplatinou (ITT n = 863) nacelkové přežití (adjustovaný poměr rizik 0,94; 95% CI = 0,84-1,05). Všichni pacienti účastnící se této studie měli ECOG výkonnostní stav 0 nebo 1.
Primární analýza účinnosti byla založena na ITT populaci. Analýzy citlivosti pro hlavní cíle studie byly také vyhodnoceny u populace pacientů splňujících vstupní kritéria protokolu (Protocol Qualified - PQ). Výsledky analýz účinnosti u populace PQ jsou v souladu s analýzami populace ITT a podporující noninferioritu kombinace AC oproti GC.
Doba přežití bez progrese (PFS) a celková odpověď na léčbu byly podobné v obou ramenech léčby: medián PFS byl 4,8 měsíců pro pemetrexed v kombinaci s cisplatinou oproti 5,1 měsíců pro gemcitabin v kombinaci s cisplatinou (adjustovaný poměr rizik 1,04; 95% CI = 0,94-1,15) a četnost celkové odpovědi byla 30,6% (95% CI = 27,3-33,9) pro pemetrexed s cisplatinou oproti 28,2% (95% CI = 25,0-31,4) pro gemcitabin s cisplatinou. Údaje o PFS byly částečně potvrzeny nezávislým přezkoumáním (pro přezkoumání bylo náhodně vybráno 400/1725 pacientů).
Analýza vlivu histologického původu NSCLC na celkovou dobu přežití prokázala klinicky významné rozdíly mezi jednotlivými histologickými typy, viz níže uvedená tabulka.
Účinnost kombinacepemetrexed + cisplatina oproti kombinaci gemcitabin + cisplatina v první linii nemalobuněčného karcinomu plic - ITT populace a histologické podskupiny
|
ITT populace a histologické podskupiny |
Medián celkové doby přežití v měsících (95% CI) |
Adjustova ný poměr rizik (HR) (95% CI) |
Superiorita hodnota p | |||
|
pemetrexed + cisplatina |
gemcitabin + cisplatina | |||||
|
ITT populace (N = 1725) |
10,3 (9,8 - 11,2) |
N=862 |
10,3 (9,6 - 10,9) |
N=863 |
0,94a (0,84 - 1,05) |
0,259 |
|
Adenokarcinom (N=847) |
12,6 (10,7 - 13,6) |
N=436 |
10,9 (10,2 - 11,9) |
N=411 |
0,84 (0,71-0,99) |
0,033 |
|
Velkobuněčný (N=153) |
10,4 (8,6 - 14,1) |
N=76 |
6,7 (5,5 - 9,0) |
N=77 |
0,67 (0,48-0,96) |
0,027 |
|
Jiný (N=252) |
8,6 (6,8 - 10,2) |
2 II O Os |
9,2 (8,1 - 10,6) |
N=146 |
1,08 (0,81-1,45) |
0,586 |
|
Dlaždicobuněčný (N=473) |
9,4 (8,4 - 10,2) |
N=244 |
10,8 (9,5 - 12,1) |
N=229 |
1,23 (1,00-1,51) |
0,050 |
Zkratky: CI = interval spolehlivosti; ITT = záměr léčit; n = celková velikost souboru a Statisticky významné pro noninferioritu, s celkovým intervalem spolehlivosti pro HR dostatečně pod hranicí noninferiority 1,17645 (p <0,001).
Kaplan-Meierova křivka celkové doby přežití podle histologického typu
ftdenocarcinoma
Survival Time (months)
Large Cell Carcinoma
0.4 -
Survival Time (months)
|
Adenokarcinom |
Velkobuněčný karcinom |
|
Y: Pravděpodobnost přežití |
Y: Pravděpodobnost přežití |
|
X: Doba přežití (měsíce) |
X: Doba přežití (měsíce) |
V histologickýchpodskupinách nebyly pozorovány žádné klinicky významné rozdíly v bezpečnostním profilu pemetrexedu v kombinaci s cisplatinou.
U pacientů léčených pemetrexedem v kombinaci s cisplatinou byl zapotřebí menší počet transfúzí (16,4% oproti 28,9%, p<0,001), transfuzí erytrocytů (16,1% oproti 27,3%, p<0,001) a transfúzí trombocytů (1,8% vs. 4,5%, p=0,002). Rovněž byl zapotřebímenší počet podání erytropoetinu / darbopoetinu (10,4% oproti 18,1%, p<0,001), G-CSF/GM-CSF (3,1% oproti 6,1%, p=0,004) a přípravků obsahujících železo (4,3% oproti 7,0%, p=0,021).
NSCLC, udržovací léčba: JMEN
Multicentrická, randomizovaná, dvojitě zaslepená, studie fáze 3 kontrolovaná placebem (JMEN) srovnávala účinnost a bezpečnost udržovací léčby pemetrexedem spolu s nejlepší možnou podpůrnou léčbou (BSC) (n = 441) a podávání placeba spolu s BSC (n = 222) u pacientů s lokálně pokročilým (stadium IIIB) nebo metastazujícím (stadium IV) nemalobuněčným karcinomem plic (NSCLC), u kterých nedošlo k progresi po 4 cyklech terapie první linie dvojokmbinací obsahující cisplatinu nebo karboplatinu v kombinaci s gemcitabinem, paklitaxelem nebo docetaxelem. Kombinovaná léčba obsahující v první linii v dvojkombinaci pemetrexed nebyla zahrnuta. Všichni pacienti účastnící se této studie měli ECOG výkonnostní stav 0 nebo 1. Udržovací léčba byla pacientům podávána do doby progrese nemoci. Účinnost a bezpečnost byly měřeny od doby randomizace po dokončení (indukční) terapie první linie. Střední hodnota počtu cyklů podaných pacientům byla 5 cyklů udržovací léčby pemetrexedem a 3,5 cyklů podávání placeba. Celkem 213 pacientů (48,3%) dokončilo > 6 cyklů a celkem 103 pacientů (23,4%) dokončilo > 10 cyklů léčby pemetrexedem.
Studie dosáhla primárního cílového parametru a prokázala statisticky významné zlepšení PFS ve skupině s pemetrexedem oproti skupině placeba (n = 581, nezávisle hodnocená populace; medián 4,0 měsíce, resp. 2,0 měsíce) (poměr rizika = 0,60, 95% CI = 0,49-0,73, p < 0,00001). Nezávislé hodnocení pacientských skenů potvrdilo závěry hodnocení PFS ze strany zkoušejících. Střední hodnota celkové doby přežití (OS) pro celkovou populaci (n = 663) byla 13,4 měsíců ve skupině s pemetrexedem a 10,6 ve skupině placeba, poměr rizika = 0,79 (95% CI = 0,65-0,95, p = 0,01192).
V souladu s dalšími studiemi pemetrexedu byl ve studii JMEN pozorován rozdíl v účinnosti s ohledem na histologii NSCLC. U pacientů s NSCLC jiného histologického typu než predominantně
z dlaždicových buněk (n = 430, nezávisle hodnocená populace) byla střední doba přežití bez progrese (PFS) 4,4 měsíce pro pemetrexeda 1,8 měsíce u skupiny placeba, poměr rizika = 0,47 (95% CI = 0,370,60, p = 0,00001). Střední hodnota celkové doby přežití (OS) u pacientů s NSCLC jiného histologického typu než predominantně z dlaždicových buněk (n = 481) byla 15,5 měsíců ve skupině pemetrexedu a 10,3 měsíců ve skupině placeba ( poměr rizika = 0,70,95% CI = 0,56-0,88, p =
0,002). Střední doba OS včetně indukční fáze byla u pacientů s NSCLC jiného histologického typu než predominantně z dlaždicových buněk 18,6 měsíců pro pemetrexed a 13,6 měsíců ve skupiněplaceba ( poměr rizika = 0,71, 95% CI = 0,56-0,88, p = 0,002).
U pacientů s karcinomem histologického typu z dlaždicových buněk nenaznačují výsledky PFS a OS výhodu léčby pemetrexedem oproti placebu.
V histologických podskupinách nebyly pozorovány žádné klinicky významné rozdíly v bezpečnostním profilu pemetrexedu.
Overall Survival
Progression-Free Survival
Pemetrexed
Placebo
Pemetrexed
P acebo
PFS Time (months)
Survival Time (months)
Přežití bez progrese Y: Pravděpodobnost PFS X: Doba PFS (měsíce)
Celkové přežití Y: Pravděpodobnost přežití X: Doba přežití (měsíce)
JMEN: Kaplan-Meierova křivka doby přežití bez progrese (PFS) a celkové doby přežití u pacientů s NSCLC jiného histologického typu než predominantně z dlaždicových buněk užívajících pemetrexed nebo placebo
PARAMOUNT
Multicentická, randomizovaná, dvojitě zaslepená, placebem kontrolovaná klinická studie fáze 3 (PARAMOUNT) porovnávala účinnost a bezpečnost pokračující udržovací léčby pemetrexedem plus BSC (n = 359) s léčbou placebem plus BSC (n = 180) u pacientů s lokálně pokročilým (stadium IIIB) nebo metastazujícím (stadium IV) NSCLC jiného histologického typu než predominantně z dlaždicových buněk, u kterých nedošlo k progresi onemocnění po 4 cyklech léčby první linie kombinací pemetrexedu s cisplatinou. Zcelkového počtu 939 pacientů léčených indukcí pemetrexedem s cisplatinou bylo 539 pacientů randomizováno na udržovací léčbu pemetrexedem nebo placebem. Z randomizovaných pacientů mělo 44,9% úplnou /částečnou odpověď a u 51,9% došlo ke stabilizaci onemocnění po indukci pemetrexedem s cisplatinou. Pacienti, kteří byli randomizováni k udržovací léčbě, museli mít výkonnostní stav ECOG 0 nebo 1. Medián doby od začátku indukční léčby pemetrexedem s cisplatinou do začátku udržovací léčby byl 2,96 měsíce jak v rameni s pemetrexedem, tak v rameni s placebem. Randomizovaní pacienti dostávali udržovací léčbu do doby progrese onemocnění. Účinnost a bezpečnost byly měřeny od doby randomizace po ukončení (indukční) léčby první volby. Střední hodnota počtu cyklů podaných pacientům byla 4 cykly léčby pemetrexedem a 4 cykly placeba. Celkem dokončilo > 6 cyklů udržovací léčby pemetrexedem 169 pacientů (47,1%), což představovalo nejméně 10 cyklů pemetrexedu celkem.
Studie splnila svůj primární cílový parametr a ukázala statisticky významné zlepšení PFS v rameni s pemetrexedem ve srovnání s placebovým ramenem (n = 472, nezávisle hodnocená populace; medián
3,9 měsíců a 2,6 měsíce v tomto pořadí) (poměr rizika = 0,64, 95% CI = 0,51-0,81, p < 0,0002). Nezávislé posouzení vyšetření pacientů potvrdilo nálezy z hodnocení PFS zkoušejícími. Pro randomizované pacienty byl, měřeno od zahájení první linie indukční léčby pemetrexedem s cisplatinou, medián PFS stanovený zkoušejícím 6,9 měsícův rameni s pemetrexedem a 5,6 měsíce v rameni s placebem (poměr rizika = 0,59 95% CI = 0,47-0,74).
Po indukci pemetrexedem s cisplatinou (4 cykly) byla léčba pemetrexedem statisticky lepší než placebo z hlediska celkového přežití (medián 13,9 měsíce versus 11,0 měsíců, poměr rizika = 0,78, 95%CI = 0,64-0,96, p = 0,0195). V době, kdy byla tato finální analýza přežití provedena, bylo v rameni s pemetrexedem 28,7% pacientů naživu nebo byl kontakt s nimi ztracen oproti 21,7% pacientům v rameni s placebem. Relativní léčebný účinek pemetrexedu byl napříč podskupinami (včetně stadia nemoci, odpovědi na indukci, ECOG PS, kuřáckého statusu, pohlaví, histologie a věku) vnitřně konzistentní a podobný tomu, který byl pozorován v neupravených analýzách OS a PFS. 1 a 2 letá četnost přežívání pacientů s pemetrexedem byla 58%, resp. 32%, ve srovnání s 45%, resp. 21% u pacientů s placebem. Od začátku indukční léčby pemetrexedem s cisplatinou v první linii byl medián OS pacientů 16,9 měsíce u ramene s pemetrexedem a 14,0 měsíců u ramene s placebem (poměr rizika = 0,78, 95% CI= 0,64-0,96). Procento pacientů, kteří byli po studii léčenibylo 64,3 % u pemetrexedu a 71,7% pro placebo.
PARAMOUNT: Kaplan-Meierova křivka přežití bez progrese (PFS) a celkového přežití (OS) u pacientů s NSCLC jiného histologického typu než predominantně z dlaždicových buněk pokračujících v udržovací léčbě pemetrexedem nebo placebem (měřeno od randomizace)
Progres sion-Free Survival
Overal! Survival
Pemetrexed
Peme trexed
Placebo
0.7
Pacebo
PFS Time (Months)
OS Time (Months)
|
Přežití bez progrese |
Celkové přežití |
|
Y: Pravděpodobnost PFS |
Y: Pravděpodobnost OS |
|
X: Doba PFS (měsíce) |
X: Doba OS (měsíce) |
Bezpečnostní profily udržovací léčby pemetrexedem ze dvouklinických hodnocení JMEN a PARAMOUNT byly podobné.
Evropská agenturapro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s pemetrexedem u všech podskupin pediatrické populace ve schválených indikacích (viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Farmakokinetické vlastnosti pemetrexedu po jeho podání v monoterapii byly hodnoceny u 426 pacientů s různými maligními solidními tumory, kterým byl lék podáván v dávkách od 0,2 do 838 mg/m1 infuzí po dobu 10 minut. Distribuční objem pemetrexedu v ustáleném stavu činil 9 l/m1. Studie in vitro ukazují, že pemetrexed se přibližně z 81 % váže na plazmatické proteiny. Různý stupeň poruchy funkce ledvin nevede k významnému ovlivnění této vazby. Pemetrexed podstupuje v omezené míře metabolismus v játrech. Pemetrexed se primárně vylučuje močí, přičemž 70-90 % podané dávky se odstraní močí v nezměněné formě během prvních 24 hodin po jeho podání. Studie in vitro naznačují, že pemetrexed je aktivně vylučován pomocí OAT3 (přenašeč organických aniontů). Celková systémová clearance pemetrexedu je 91,8 ml/min a eliminační poločas plazmy je 3,5 hodin u pacientů s normální funkcí ledvin (clearance kreatininu 90 ml/min.).
Variabilita clearance mezi pacienty je střední, a to 19,3 %. Celková systémová expozice pemetrexedu (AUC) a maximální plazmatická koncentrace rostou proporcionálně s dávkou. Farmakokinetika pemetrexedu je stejná i při více léčebných cyklech.
Farmakokinetické vlastnosti pemetrexedu nejsou ovlivněny souběžně podanou cisplatinou. Suplementace kyselinou listovou perorálně a vitaminem B12 intramuskulárně neovlivňuje farmakokinetiku pemetrexedu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Podání pemetrexedu březím myším vedlo ke snížení viability plodů, ke snížení hmotnosti plodů, neúplné osifikaci některých kosterních struktur a rozštěpu patra.
Podání pemetrexedu samcům myší vedlo k reprodukční toxicitě charakterizované snížením fertility a testikulární atrofií. V devítiměsíční studii provedené na bíglech s použitím intravenózní bolusové injekce byl pozorován nález na varlatech (degenerace/nekróza seminiferní výstelky). To naznačuje, že pemetrexed může poškodit mužskou fertilitu. Fertilita žen nebyla studována.
44
Pemetrexed nebyl mutagenní in vitro ani u testu chromozomální aberace na buňkách ovarií čínských křečků ani v Amesově testu. V mikronukleárním testu in vivo u myši bylo prokázáno, že pemetrexed je klastogenní.
Studie hodnotící kancerogenní potenciál pemetrexedu nebyly provedeny.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Mannitol (E 421)
Kyselina chlorovodíková (k nastavení pH)
Hydroxid sodný (k nastavení pH)
6.2 Inkompatibility
Pemetrexed je fyzikálně inkompatibilní s ředidly obsahujícími kalcium, jako je laktátový Ringerův roztok a Ringerův roztok. Tento léčivý přípravek se nesmí mísit s jinými léčivými přípravky kromě přípravků uvedených v bodě 6.6.
6.3 Doba použitelnosti
Neotevřená lahvička 2 roky
Rekonstituované a infuzní roztoky:
Chemická a fyzikální stabilita po otevření před použitím připraveného infuzního roztoku pemetrexedu byla prokázána na dobu 24 hodin při teplotě 2-8 °C nebo 15-25 °C. Rekonstituovaný roztok má být použit okamžitě k přípravě infuzního roztoku. Z mikrobiologického hlediska má být infuzní roztok použit okamžitě. Není-li použit okamžitě, pak doba a podmínky uchovávání přípravku po otevření před použitím jsou v zodpovědnosti uživatele anormálně by doba neměla být delší než 24 hodin při teplotě 2-8 °C nebo 15-25 °C.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci/zředění jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
Prášek ve skleněné injekční lahvičce třídy I s chlorobutylovou pryžovou zátkou s hliníkovým závěrem a odtrhovacím víčkem, injekční lahvička je zatavena v plastové folii. Jedna 50ml lahvička obsahuje 500 mg pemetrexedu (ve formě pemetrexedum dinatricum dihemihydricum).
Balení po 1 lahvičce.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
1. Při rekonstituci a dalším ředění pemetrexedu k podání intravenózní infuze používejte aseptickou techniku. 1
3. Rekonstituujte obsah 500mg injekční lahvičky se 20 ml injekčního roztoku chloridu sodného 9 mg/ml (0,9 %) pro injekci bez konzervačních látek, čímž vznikne roztok obsahující 25 mg/ml pemetrexedu. Pohybujte jemným krouživým pohybem každou injekční lahvičkou, dokud se prášek zcela nerozpustí. Výsledný roztok je čirý a jeho barva kolísá od bezbarvé po žlutou nebo žlutozelenou, aniž by byla narušena jeho kvalita. pH rekonstituovaného roztoku se pohybuje mezi 6,6 a 7,8. Potřebné je další ředění.
4. Náležitý objem rekonstituovaného roztoku pemetrexedu se dále musí naředit na 100 ml injekčním roztokem chloridu sodného 9 mg/ml (0,9 %) bez konzervačních látek a podá se intravenózní infuzí trvající 10 minut.
5. Infuzní roztoky pemetrexedu připravené podle výše uvedeného návodu jsou kompatibilní s polyvinylchloridovými a polyolefinovými infuzními sety a infuzními vaky.
6. Léčivé přípravky pro parenterální použití se musí před podáním vizuálně zkontrolovat, zda neobsahují pevné částice a nedošlo ke změně barvy. Jestliže zpozorujete pevné částice, přípravek nepodávejte.
7. Roztok pemetrexedu je určen pouze na jedno použití. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Bezpečnostní opatření při přípravě a podání:
Tak jako i u jiných potenciálně toxických protinádorových látek je nutné udržovat pozornost při zacházení s infuzním roztokem pemetrexedu a při jeho přípravě. Doporučuje se používat ochranné rukavice. Pokud dojde ke kontaktu roztoku pemetrexedu s kůží, umyjte ihned a důkladně kůži mýdlem a vodou. Pokud dojde ke kontaktu roztoku pemetrexedu se sliznicemi, opláchněte je důkladně vodou. Pemetrexed není zpuchýřující látka. V případě podání mimo žílu neexistuje specifické antidotum. Bylo popsáno několik případů podání pemetrexedu mimo žílu, které hodnotící lékař nepovažoval za závažné. Únik pemetrexedu mimo žílu se léčípodle místních standardních postupů jako u jiných látek nezpůsobujících vznik puchýřů..
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Menarini International Operations Luxembourg S.A.
1, Avenue de la Gare L-1611, Luxembourg Lucembursko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/15/1055/002
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Oncotec Pharma Produktion GmbH Am Pharmapark 06861 Dessau-Rosslau Německo
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
CIAMBRA 100 mg prášek pro koncentrát pro infuzní roztok pemetrexedum
2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK
Jedna lahvička obsahuje pemetrexedum 100 mg (jako pemetrexedum dinatricum dihemihydricum). Po rekonstituci obsahuje jedna injekční lahvička pemetrexedum 25 mg/ml.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: Mannitol, kyselina chlorovodíková (k nastavení pH), hydroxid sodný (k nastavení pH) (další informace jsou uvedené v příbalové informaci).
|
4. LÉKOVÁ FORMA A OBSAH BALENÍ | |
|
Prášek pro koncentrát pro infuzní roztok. | |
|
1 injekční lahvička | |
|
5. ZPŮSOB A CESTA/CESTY PODÁNÍ | |
Pouze pro jednorázové podání.
Intravenózní podání po rekonstituci a naředění. Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Cytotoxické
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10.ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Menarini International Operations Luxembourg S.A. 1, Avenue de la Gare L-1611 Lucembursko
12. REGISTRAČNÍ ČÍSLO
EU/1/15/1055/001
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
CIAMBRA 100 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
CIAMBRA 100 mg prášek pro koncentrát pro infuzní roztok pemetrexedum
Intravenózní podání po rekonstituci a zředění
2. ZPŮSOB PODÁNÍ
|
3. |
POUŽITELNOST |
|
EXP | |
|
4. |
ČÍSLO ŠARŽE |
|
Lot | |
|
5. |
OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK |
|
100 |
mg |
|
6. |
JINÉ |
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
CIAMBRA 500 mg prášek pro koncentrát pro infuzní roztok pemetrexedum
2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK
Jedna lahvička obsahuje pemetrexedum 500 mg (jako pemetrexedum dinatricum dihemihydricum). Po rekonstituci obsahuje jedna injekční lahvička pemetrexedum 25 mg/ml.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: Mannitol, kyselina chlorovodíková (k nastavení pH), hydroxid sodný (k nastavení pH) (další informace jsou uvedené v příbalové informaci).
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek pro koncentrát pro infuzní roztok 1 injekční lahvička
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Pouze pro jednorázové podání.
Intravenózní podání po rekonstituci a zředění. Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Cytotoxické
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Menarini International Operations Luxembourg S.A. 1, Avenue de la Gare L-1611 Lucembursko
12. REGISTRAČNÍ ČÍSLO
EU/1/15/1055/002
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
CIAMBRA 500 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
CIAMBRA 500 mg prášek pro koncentrát pro infuzní roztok pemetrexedum
Intravenózní podání po rekonstituci a zředění
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET DÁVEK
500 mg
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: Informace pro uživatele
CIAMBRA 100 mg prášek pro koncentrát pro infuzní roztok CIAMBRA 500 mg prášek pro koncentrát pro infuzní roztok
pemetrexedum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete dostávat tento přípravek, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Pokud se u Vás vyskytne kterýkoliv z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek CIAMBRA a k čemu se používá?
2. Čemu musíte věnovat pozornost, než začnete přípravek CIAMBRA používat.
3. Jak se přípravek CIAMBRA používá
4. Možné nežádoucí účinky
5. Jak přípravek CIAMBRA uchovávat
6. Obsah balení a další informace
1. Co je přípravek CIAMBRA a k čemu se používá
CIAMBRA je léčivý přípravek používaný k léčbě zhoubných nádorů.
Přípravek CIAMBRA se podává pacientům bez předchozí chemoterapie v kombinaci s dalším protinádorovým lékem cisplatinou k léčbě maligního mezoteliomu pleury, což je forma nádoru postihující plicní výstelku.
Přípravek CIAMBRA se v kombinaci s cisplatinou podává také jako počáteční léčba u pacientů s pokročilými stádii rakoviny plic.
Přípravek CIAMBRA Vám může být předepsán i pokud máte rakovinu plic v pokročilém stadiu a pokud Vaše onemocnění příznivě reagovalo na léčbu nebo zůstalo po počáteční chemoterapii převážně nezměněno.
Přípravek CIAMBRA je rovněž určený k léčbě pacientů s pokročilými stadii rakoviny plic, u kterých došlo k dalšímu rozvoji onemocnění poté, co byla použita jiná úvodní chemoterapie.
2. Čemu musíte věnovat pozornost, než začnete přípravek CIAMBRA používat
Nepoužívejte přípravek CIAMBRA :
- jestliže j ste alergický(á) (přecitlivělý(á)) na pemetrexed nebo na kteroukoli další složku přípravku CIAMBRA (uvedenou v bodě 6).
- pokud kojíte, musíte během léčby přípravkem CIAMBRA přestat kojit.
- pokud jste nedávno byl(a) nebo máte být očkován(a) vakcinou proti žluté zimnici.
Upozornění a opatření
Před použitím přípravku CIAMBRA se poraďte se svým lékařem nebo lékárníkem.
Pokud máte nebo jste měl(a) problémy s ledvinami, oznamte to svému lékaři nebo nemocničnímu lékárníkovi, protože by nemuselo být vhodné, abyste dostával(a) přípravek CIAMBRA,
Před každou infuzí Vám bude odebrána krev k vyšetření, zda máte v pořádku funkci ledvin a jater ke kontrole, zda máte dostatečný počet krvinek, abyste mohl(a) dostat přípravek CIAMBRA, Váš lékař se může rozhodnout změnit dávku nebo odložit léčbu v závislosti na Vašem celkovém zdravotním stavu a v případě, že máte příliš nízký počet krvinek, Pokud používáte také cisplatinu, Váš lékař se přesvědčí, že jste dostatečně hydratován(a) a před léčbou cisplatinou a po ní dostanete vhodné léky, které zabrání zvracení.
Oznamte svému lékaři, pokud jste podstoupil(a) nebo máte podstoupit léčbu ozařováním, protože může dojít k časné nebo opožděné reakci na ozařování při používání přípravku CIAMBRA.
Oznamte svému lékaři, jestliže jste byl(a) nedávno očkován(,) protože pak může při používání přípravku CIAMBRA dojít k nežádoucím účinkům,
Oznamte svému lékaři, že máte nebo jste měl(a) srdeční onemocnění.
Pokud u Vás došlo k nahromadění tekutiny okolo plic, může se lékař rozhodnout před podáním přípravku CIAMBRA tuto tekutinu odstranit,
Děti a dospívající
Použití přípravku CIAMBRA u pediatrické populace není relevantní.
Další léčivé přípravky a přípravek CIAMBRA
Oznamte svému lékaři, pokud užíváte nějaké léky proti bolesti nebo zánětu (otokům), jako jsou tzv. nesteroidní protizánětlivé léky (NSA), včetně léků, které jsou volně prodejné bez lékařského předpisu (jako je např, ibuprofen). Existuje mnoho druhů NSA s různou dobou účinnosti, Na základě plánovaného data infuze přípravku CIAMBRA a/nebo stavu funkce ledvin Vám lékař doporučí, které léky smíte užívat a kdy je smíte užívat. Pokud si nejste jistý(á), zeptejte se svého lékaře nebo lékárníka, zda některý z Vašich léků není NSA,
Prosím, informujte svého lékaře nebo nemocničního lékárníka o všech lécích, které užíváte nebo které jste v nedávné době užíval(a), a to i o lécích, které jsou dostupné bez lékařského předpisu,
Těhotenství, kojení a plodnost Těhotenství
Pokud jste těhotná, domníváte se, že můžete být těhotná nebo plánujete otěhotnět, oznamte to svému lékaři. Přípravku CIAMBRA je třeba se v těhotenství vyvarovat, Váš lékař s Vámi probere možná rizika používání přípravku CIAMBRA během těhotenství, Během léčby přípravkem CIAMBRA musejí ženy používat vhodnou antikoncepci.
Kojení
Pokud kojíte, oznamte to svému lékaři,
Během léčby přípravkem CIAMBRA se musí kojení přerušit,
Plodnost
Muži by neměli počít dítě během léčby a po dobu 6 měsíců po skončení léčby přípravkem CIAMBRA a z těchto důvodů by měli během léčby přípravkem CIAMBRA a po dobu 6 měsíců po jejím skončení
59
používat účinnou antikoncepci. Pokud během léčby tímto přípravkem nebo během 6 měsíců po ukončení této léčby chcete počít dítě, poraďte se se svým lékařem nebo lékárníkem. Můžete vyhledat konzultaci ohledně uchovávání spermií před zahájením léčby.
Řízení dopravních prostředků a obsluha strojů
Přípravek CIAMBRA může vyvolat únavu. Při řízení dopravních prostředků a obsluze strojů buďte opatrný(á).
CIAMBRA obsahuje sodík
CIAMBRA 100 mg obsahuje přibližně 11 mg sodíku v jedné injekční lahvičce, v podstatě je tedy bez sodíku
CIAMBRA 500 mg obsahuje přibližně 54 mg sodíku v jedné injekční lahvičce. Nutno vzít v úvahu u pacientů na dietě s nízkým obsahem sodíku.
3. Jak se přípravek CIAMBRA používá
Dávka přípravku CIAMBRA je 500 mg na jeden čtvereční metr plochy povrchu těla. Tato plocha se vypočítá z Vaší výšky a tělesné hmotnosti. Lékař poté z tohoto údaje vypočte potřebnou dávku. Tato dávka může být upravena, případně léčba může být oddálena v závislosti na počtu Vašich krvinek a Vašem celkovém zdravotním stavu. Než Vám bude přípravek podán, nemocniční lékárník, zdravotní sestra nebo lékař smíchá prášek z přípravku CIAMBRA s injekčním roztokem chloridu sodného o koncentraci 0,9 mg/ml (0,9%).
Přípravek CIAMBRA dostanete vždy v infuzi do žíly. Tato infuze bude trvat přibližně 10 minut. Pokud dostanete přípravek CIAMBRA v kombinaci s cisplatinou:
Lékař nebo nemocniční lékárník vypočítá potřebnou dávku na základě Vaší výšky a tělesné hmotnosti. Cisplatina se podává rovněž do žíly a podává se přibližně 30 minut po ukončení infuze přípravku CIAMBRA. Infuze cisplatiny bude trvat přibližně 2 hodiny.
Infuze budete obvykle dostávat jednou za 3 týdny.
Další léky:
Kortikosteroidy: Váš lékař Vám předepíše tablety se steroidem (v dávce odpovídající 4 mg dexamehtasonu dvakrát denně), které budete užívat den před léčbou přípravkem CIAMBRA, v den jeho podání a následující den po jeho podání. Tento lék budete dostávat ke snížení frekvence a závažnosti kožních reakcí, které lze předpokládat během protinádorové léčby.
Doplňování léčby o vitamíny: během léčby přípravkem CIAMBRA Vám Váš lékař předepíše užívat kyselinu listovou (vitamín) nebo multivitamín s obsahem kyseliny listové (350 až 1000 mikrogramů), které musíte užívat perorálně jednou denně. Během sedmi dní před první dávkou přípravku CIAMBRA si musíte vzít nejméně 5 dávek kyseliny listové. Po poslední dávce přípravku CIAMBRA musíte pokračovat 21 dní v užívání kyseliny listové. Dostanete rovněž injekci vitaminu B12 (1000 mikrogramů), a to v týdnu před podáním přípravku CIAMBRA a dále přibližně každých 9 týdnů (což odpovídá 3 cyklům léčby přípravkem CIAMBRA). Vitamin B12 a kyselinu listovou dostanete ke snížení možných toxických účinků protinádorové léčby.
Máte-li jakékoli další otázky týkající se používání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Jestliže zaznamenáte jakýkoliv z níže uvedených nežádoucích účinků, musíte ihned kontaktovat svého lékaře:
■ Horečka nebo infekce: pokud máte teplotu 38 °C nebo vyšší, pocení nebo jiné známky infekce (protože můžete mít méně bílých krvinek, než je obvyklé). Infekce (sepse) může mít závažný průběh a může vést k úmrtí.
■ Pokud začnete pociťovat bolest na hrudi nebo máte rychlou srdeční frekvenci .
■ Pokud máte bolest, zarudnutí, otok nebo vřídky v ústech .
■ Alergická reakce: pokud se vyvine kožní vyrážka / pocity pálení nebo brnění nebo horečka . Ve vzácných případech může být kožní reakce závažná a může vést k úmrtí.
■ Obraťte se na svého lékaře, pokud se u Vás vyskytne závažná vyrážka nebo svědění anebo puchýře (Stevens-Johnsonův syndrom nebo toxická epidermální nekrolýza).
■ Pokud pozorujete únavu, slabost, pocit na omdlení, snadnější zadýchávání nebo jste bledý(á) (protože můžete mít méně krevního barviva hemoglobinu, než je tomu normálně).
■ Pokud pozorujete krvácení z dásní, nosu nebo úst, případně jiné krvácení, které se obtížně zastavuje, načervenalou nebo narůžovělou moč, neočekávanou tvorbu modřin (protože můžete mít nižší počet krevních destiček, než jeobvyklé).
■ Pokud pozorujete náhlou dušnost, intenzivní bolest na hrudi nebo kašel s vykašláváním krve (může to znamenat přítomnost krevní sraženiny v plicních cévách).
Nežádoucí účinky přípravku CIAMBRA mohou zahrnovat:
Velmi časté nežádoucí účinky (mohou postihnout více než 1 z 10 lidí)
Snížení počtu bílých krvinek Nízké hladiny hemoglobinu (anémie)
Snížení počtu krevních destiček
Bolest, zarudnutí, otok nebo vřídky v ústech Pocit na zvracení Ztráta chuti k jídlu Únava
Kožní vyrážka Vypadávání vlasů Zácpa
Ztráta hmatového citu
Ledviny: abnormální nálezy při vyšetření krve
Časté nežádoucí účinky (mohou postihnout až 1z 10 lidí)
Alergická reakce: kožní vyrážka / pocit pálení nebo brnění
Infekce včetně sepse
Dehydratace
Selhání ledvin
Podráždění kůže a svědění
Svalová slabost
Zánět spojivek
Žaludeční nevolnost
Změny vnímání chuti
Játra: abnormální nálezy při vyšetření krve
Zvýšené slzení
Méně časté nežádoucí účinky (mohou postihnout až 1ze 100 lidí)
Náhlé selhání ledvin Zrychlené srdečního tepu
Zánět výstelky jícnu byl zaznamenán při kombinaci přípravku CIAMBRA a ozařování.
Kolitida (zánět výstelky tlustého střeva, který může být doprovázen střevním krvácením nebo krvácením z konečníku)
Intersticiální pneumonitida (zjizvení plicních sklípků)
Otok (hromadění tekutin v tělesných tkáních způsobující otékání)
U některých pacientů se při používání přípravku CIAMBRA vyskytla náhlá srdeční příhoda, cévní mozková příhoda nebo malá mozková příhoda, obvykle při používání v kombinaci s další protinádorovou terapií.
Pancytopenie - kombinované nízké počty bílých krvinek, červených krvinek a krevních destiček.
U některých pacientů., kteří podstoupili před léčbou, v průběhu nebo po léčbě přípravkem CIAMBRA ozařování, se může vyskytnout postradiační pneumonitida (zjizvení plicních sklípků v souvislosti s léčbou ozařováním).
Byly hlášeny případy bolesti, snížené teploty a změny zbarvení končetin.
Krevní sraženiny v plicních cévách (plicní embolie)
Vzácné nežádoucí účinky (mohou postihnout až 1 z 1000 lidí)
Reakce zvaná „radiation recall " (kožní vyrážka podobná výraznému spálení od slunce), která se objeví na kůži, která byla před delší dobou vystavena záření - před dny až roky.
Výskyt puchýřů (zpuchýřující onemocnění kůže) - včetně Stevens-Johnsonova syndromu a toxické epidermální nekrolýzy
Hemolytická anémie vyvolaná imunitní reakcí (rozpad červených krvinek vyvolaný protilátkami) Hepatitida (zánět jater)
Anafylaktický šok (těžká alergická reakce)
Může se u Vás vyskytnout jakýkoliv z těchto příznaků a/nebo onemocnění. Pokud zpozorujete některý z těchto nežádoucích účinků, musíte to oznámit svému lékaři, jakmile to bude možné.
Pokud se obáváte některých nežádoucích účinků, řekněte to svému lékaři.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoliv z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek CIAMBRA uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a na štítku za „EXP“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Tento přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Chemická a fyzikální stabilita po otevření před použitím infuzního roztoku pemetrexedu byla prokázána na dobu 24 hodin při teplotě 2-8 °C nebo 15-25 °C. Rekonstituovaný roztok má být ihned použit k přípravě infuzního roztoku. Z mikrobiologického hlediska má být infuzní roztok použit okamžitě. Není-li použit okamžitě, doba a podmínky uchovávání po otevření před použitím jsou v odpovědnosti uživatele a normálně by doba neměla být delší než 24 hodin při teplotě 2-8 °C nebo 1525 °C.
Tento léčivý přípravek je určen pouze pro jednorázové podání, jakýkoliv nespotřebovaný roztok je nutné zlikvidovat v souladu s místními požadavky.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek CIAMBRA obsahuje
Léčivou látkou je pemetrexedum.
CIAMBRA 100 mg: Jedna injekční lahvička obsahuje pemetrexedum 100 miligramů (jako pemetrexedum dinatricum dihemihydricum).
CIAMBRA 500 mg: Jedna injekční lahvička obsahuje pemetrexedum 500 miligramů (jako pemetrexedum dinatricum dihemihydricum).
Po rekonstituci obsahuje roztok 25 mg/ml pemetrexedu. Před podáním je nutné další naředění, které provede zdravotnický pracovník.
- Dalšími složkami jsou mannitol (E421), kyselina chlorovodíková (k nastavení pH) a hydroxid sodný (k nastavení pH) (viz bod 2, „CIAMBRA obsahuje sodík“).
Jak přípravek CIAMBRA vypadá a co obsahuje toto balení
CIAMBRA je prášek pro koncentrát pro infuzní roztok v injekční lahvičce. Jedná se o bílý až téměř bílý lyofilizovaný prášek.
Balení přípravku CIAMBRA se skládá z jedné skleněné injekční lahvičky s pryžovou zátkou, hliníkovým uzávěrem a odtrhávacím víčkem a je zatavené v plastové folii. Injekční lahvička obsahuje 100 mg nebo 500 mg pemetrexedu (ve formě pemetrexedum dinatricum dihemihydricum).
Balení obsahuje 1 lahvičku.
Držitel rozhodnutí o registraci
MENARINI INTERNATIONAL OPERATIONS LUXEMBOURG S.A.,
1, Avenue de la Gare L-1611 Luxembourg Lucembursko
Výrobce:
Oncotec Pharma Produktion GmbH Am Pharmapark 06861 Dessau-RoBlau Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci.
AT A. Menarini Pharma GmbH. Tel: +43 1 879 95 85-0
BE Menarini Benelux NV/SA Tél/Tel: + 32 (0)2 721 4545
BG Tn “EepnHH-XeMH Ar” Ten.: +359 2 96 55 365
CY MENARINI HELLAS AE Tpk: +30 210 8316111-13
CZ Berlin-Chemie/A.Menarini Ceska republika s.r.o. Tel: +420 267 199 333
DE Berlin-Chemie AG Tel: +49 (0) 30 67070
DK Berlin-Chemie/A.Menarini Danmark ApS Tlf: +4548 217 110
EE OU Berlin-Chemie Menarini Eesti Tel: +372 667 5001
ES Laboratorios Menarini S.A. Tel: +34-93 462 88 00
63
FI Berlin-Chemie/A.Menarini Suomi OY Puh/Tel: +358 403 000 760
FR MENARINI France Tél: +33 (0)1 45 60 77 20
GR MENARINI HELLAS AE Tqk +30 210 8316111-13
HR Berlin-Chemie Menarini Hrvatska d.o.o. Tel: + 385 1 4821 361
HU Berlin-Chemie/A. Menarini Kft. Tel.: +36 23501301
IE A. Menarini Pharmaceuticals Ltd Tel: +353 1 284 6744
IS Menarini International Operations Luxembourg S.A. Sími: +352 264976
IT A. Menarini Industrie Farmaceutiche Riunite s.r.l. Tel: +39-055 56801
LT UAB “BERLIN-CHEMIE MENARINI BALTIC” Tel: +370 52 691 947
LU Menarini Benelux NV/SA Tél/Tel: + 32 (0)2 721 4545
LV SIA Berlin-Chemie/Menarini Baltic Tel: +371 67103210
MT Menarini International Operations Luxembourg S.A. Tel: +352 264976
NO Menarini International Operations Luxembourg S.A. Tlf: +352 264976
NL Menarini Benelux NV/SA Tel: +32 (0)2 721 4545
PL Berlin-Chemie/Menarini Polska Sp. z o.o. Tel.: +48 22 566 21 00
PT A. Menarini Portugal - Farmaceutica, S.A. Tel: +351 210 935 500
RO Berlin-Chemie A.Menarini S.R.L. Tel: +40 21 232 34 32
SE Menarini International Operations Luxembourg S.A. Tel. : +352 264976
SK Berlin-Chemie AG - obchodné zastúpenie v SR Tel: +421 2 544 30 730
SI Berlin-Chemie AG, Podružnica Ljubljana Tel: +386 01 300 2160
UK A. Menarini Farmaceutica Internazionale S.R.L. Tel: +44 (0)1628 856400
Tato příbalová informace byla naposledy revidována
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu. Na těchto stránkách naleznete též odkazy na další webové stránky týkající se vzácných onemocnění a jejich léčby.
Na webových stránkách Evropské agentury pro léčivé přípravky je tato příbalová informace k dispozici ve všech úředních jazycích EU/EHP.
<........................................................................................................................>
Následující informace je určena pouze pro zdravotnické pracovníky
Návod k použití přípravku, zacházení s ním a k jeho likvidaci
1. Při rekonstituci a dalším ředění pemetrexedu k podání intravenózní infuze používejte aseptickou techniku.
2. Vypočtěte dávku a počet potřebných injekčních lahviček přípravku CIAMBRA. Injekční lahvička obsahuje větší množství pemetrexedu k usnadnění přenosu označeného množství.
3. CIAMBRA 100 mg:
Rekonstituujte obsah 100mg injekční lahvičky se 4,2 ml injekčního roztoku chloridu sodného 9 mg/ml (0,9 %) bez konzervačních látek, čímž vznikne roztok obsahující 25 mg/ml pemetrexedu.
CIAMBRA 500 mg:
Rekonstituujte obsah 500mg injekční lahvičky s 20 ml injekčního roztoku chloridu sodného 9 mg/ml (0,9 %) bez konzervačních látek, čímž vznikne roztok obsahující 25 mg/ml pemetrexedu.
Pohybujte jemným krouživým pohybem každou injekční lahvičkou, dokud se prášek zcela nerozpustí. Výsledný roztok je čirý a jeho barva kolísá od bezbarvé po žlutou nebo žlutozelenou, aniž by byla narušena jeho kvalita. pH rekonstituovaného roztoku se pohybuje mezi 6,6 a 7,8. Potřebné je další ředění.
4. Náležitý objem rekonstituovaného roztoku pemetrexedu musí být dále naředěn na 100 ml injekčním roztokem chloridu sodného 9 mg/ml (0,9 %) bez konzervačních látek a podá se intravenózní infuzí trvající 10 minut.
5. Infuzní roztoky pemetrexedu připravené podle výše uvedeného návodu jsou kompatibilní s polyvinylchloridovými a polyolefinovými infuzními sety a infuzními vaky. Pemetrexed je inkompatibilní s rozpouštědly obsahujícími kalcium, jako je laktátový Ringerův roztok a Ringerův roztok.
6. Léčivé přípravky pro parenterální použití se musí být před podáním vizuálně zkontrolovat, zda neobsahují částice a nedošlo ke změně barvy. Jestliže zpozorujete pevné částice, přípravek nepodávejte.
7. Roztok pemetrexedu je určen pouze na jedno použití. Veškerý nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Bezpečnostní opatření při přípravě a podání: Tak jako i u jiných potenciálně toxických protinádorových látek je nutné udržovat pozornost při zacházení s infuzním roztokem pemetrexedu a při jeho přípravě. Doporučuje se používat ochranné rukavice. Pokud dojde ke kontaktu roztoku pemetrexedu s kůží, umyjte ihned a důkladně kůži mýdlem a vodou. Pokud dojde ke kontaktu roztoku pemetrexedu se sliznicemi, opláchněte je důkladně vodou. Pemetrexed není zpuchýřující látka. V případě podání mimo žílu neexistuje specifické antidotum. Bylo popsáno několik případů podání pemetrexedu mimo žílu, které hodnotící lékař nepovažoval za závažné. Únik pemetrexedu mimo žílu se léčí podle místních standardních postupů jako u jiných nezpuchýřujících látek.
65
Vypočtěte dávku a počet potřebných injekčních lahviček přípravku CIAMBRA. Injekční lahvička obsahuje větší množství pemetrexedu k usnadnění přenosu označeného množství.