Cetrotide 0,25 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Cetrotide 0,25 mg prášek a rozpouštědlo pro injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna injekční lahvička obsahuje cetrorelixum 0,25 mg (ve formě cetrorelixi acetas).
Po rekonstituci přiloženým rozpouštědlem obsahuje jeden ml roztoku 0,25 mg cetrorelixu.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční roztok.
Vzhled prášku: bílý lyofilizát
Vzhled rozpouštědla: čirý a bezbarvý roztok
pH vzniklého roztoku je 4,0-6,0.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Prevence předčasné ovulace u pacientek podstupujících kontrolovanou ovariální stimulaci, následovanou odběrem oocytů a technikami asistované reprodukce.
V klinických studiích byl přípravek Cetrotide používán v kombinaci s humánním menopauzálním gonadotropinem (hMG). Omezené zkušenosti s kombinací s rekombinantním folikulostimulačním hormonem (FSH) však svědčí o podobné účinnosti.
4.2 Dávkování a způsob podání
Přípravek Cetrotide má předepisovat pouze odborný lékař se zkušenostmi v této oblasti.
Dávkování
První podání přípravku Cetrotide by mělo být provedeno pod dohledem lékaře a v podmínkách, kdy je okamžitě dostupná léčba případných alergických/pseudo-alergických reakcí (včetně život ohrožující anafylaxe). Další injekce si pacientka může podávat sama, pokud je poučena o známkách a symptomech, které mohou nasvědčovat hypersenzitivě, o důsledcích takové reakce a nutnosti okamžitého lékařského zásahu.
Obsah 1 injekční lahvičky (0,25 mg cetrorelixu) se má podávat jednou denně, ve 24 hodinových intervalech, buď ráno, nebo večer. Po prvním podání se doporučuje, aby pacientka zůstala pod lékařským dohledem po dobu 30 minut k vyloučení alergické/pseudo-alergické reakce na injekci.
Starší lidé
Neexistují žádné relevantní indikace pro použití přípravku Cetrotide u geriatrické populace
Pediatrická populace
Neexistuje žádné relevantní použití přípravku Cetrotide u pediatrické populace.
Způsob podání
Přípravek Cetrotide se podává podkožní injekcí do spodní části břišní stěny.
Reakce v místě vpichu se dají minimalizovat střídáním místa vpichu, čímž se oddálí podání injekce do stejného místa, a pomalým podáním přípravku k usnadnění jeho progresivní absorpce.
Ranní_podávání: Léčba přípravkem Cetrotide se má zahájit 5. nebo 6. den ovariální stimulace (přibližně 96 až 120 hodin po začátku ovariální stimulace) urinárními nebo rekombinantními gonadotropiny a má pokračovat po dobu podávání gonadotropinů, včetně dne, v němž se provede indukce ovulace.
Večerní_podávání: Léčba přípravkem Cetrotide se má zahájit 5. den ovariální stimulace (přibližně 96 až 108 hodin po začátku ovariální stimulace) urinárními nebo rekombinantními gonadotropiny a má pokračovat po dobu podávání gonadotropinů, až do předvečera dne, v němž bude provedena indukce ovulace.
Návod k rekonstituci tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Cetrorelix nemá být používán, pokud se vyskytují jakékoli stavy uvedené níže:
• Hypersenzitivita na léčivou látku nebo strukturální analogy hormonu uvolňujícího gonadotropin (GnRH), exogenní peptidové hormony nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
• Během těhotenství a kojení.
• Pacienti s těžkou renální dysfunkcí.
4.4 Zvláštní upozornění a opatření pro použití
Alergické stavy
Při podání první dávky byly hlášeny případy alergické/pseudo-alergické reakce, včetně život ohrožující anafylaxe (viz bod 4.8).
Zvláštní opatrnosti je třeba u žen se známkami a symptomy aktivních alergických stavů nebo alergické predispozice v anamnéze. Léčba přípravkem Cetrotide se nedoporučuje u žen s vážnými alergickými stavy.
Ovariální hyperstimulační syndrom (OHSS)
Během ovariální stimulace nebo po ní se může vyskytnout ovariální hyperstimulační syndrom. Tuto příhodu je nutno považovat za riziko vlastní stimulační procedury prováděné gonadotropiny.
Ovariální hyperstimulační syndrom se má léčit symptomaticky, např. klidem na lůžku, intravenózní aplikací elektrolytů/koloidů a terapií heparinem.
Podpora luteální fáze má být prováděna způsobem odpovídajícím praxi příslušného pracoviště asistované reprodukce.
Opakovaná procedura ovariální stimulace
S aplikací cetrorelixu k opakované ovariální stimulaci jsou dosud jen omezené zkušenosti.
V opakovaných cyklech se proto má cetrorelix aplikovat pouze po pečlivém zvážení poměru mezi prospěšností a rizikem.
Vrozené vady
Prevalence vrozených vad po použití technik asistované reprodukce (ART) s antagonisty GnRH nebo bez nich může být mírně vyšší než po spontánních otěhotněních, ačkoli není jasné, zda to souvisí s faktory neplodnosti páru nebo postupy ART. Omezené údaje z klinických prodloužených studií u 316 novorozenců žen, kterým byl podáván cetrorelix pro léčbu neplodnosti, naznačují, že cetrorelix nezvyšuje riziko vrozených vad u potomků.
Jatemí dysfukce
Cetrorelix nebyl hodnocen u pacientů s jatemí dysfunkcí a je proto nutná opatrnost.
Renální dysfunkce
Cetrorelix nebyl hodnocen u pacientů s renální dysfunkcí a je proto nutná opatrnost.
Cetrorelix je kontraindikován u pacientů s těžkou renální dysfunkcí (viz bod 4.3).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné formální studie interakcí s cetrorelixem. Výzkumy in vitro ukázaly, že nejsou pravděpodobné interakce s léčivými přípravky metabolizovanými cytochromem P450 ani s léčivými přípravky podléhajícími glukuronidaci nebo jinému druhu konjugace. Možnost interakcí s gonadotropiny nebo přípravky, které mohou vyvolat uvolňování histaminu u citlivých jedinců, však nelze zcela vyloučit.
4.6 Fertilita, těhotenství a kojení
Těhotenství a kojení
Přípravek Cetrotide není určen k použití v období těhotenství a kojení (viz bod 4.3).
Fertilita
Studie na zvířatech ukázaly, že cetrorelix má na dávce závislý vliv na fertilitu, celkovou reprodukční schopnost a graviditu. Při podávání tohoto léčivého přípravku v citlivé fázi gestace se nevyskytly teratogenní účinky.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Cetrotide nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky Shrnutí bezpečnostního profilu
Nejčastěji hlášené nežádoucí účinky jsou reakce v místě vpichu, jako je erytém, otok a svědění, které jsou obvykle přechodné a mírné intenzity. V klinických studiích byly tyto účinky pozorovány po opakovaném podání přípravku Cetrotide 0,25 mg s četností 9,4%.
Často byl hlášen mírný až středně závažný ovariální hyperstimulační syndrom (OHSS) (WHO stupeň I nebo II), který se má považovat za vlastní riziko stimulační procedury. Naopak závažný syndrom OHSS je méně častý.
Byly hlášeny méně časté případy hypersenzitivních reakcí včetně pseudoalergických/anafylaktoidních reakcí.
Seznam nežádoucích účinků
Nežádoucí účinky uváděné níže jsou seřazeny podle četnosti výskytu následujícím způsobem: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000).
Poruchy imunitního systému
Méně časté: Systémové alergické/pseudo-alergické reakce, včetně život ohrožující anafylaxe
Poruchy nervového systému Méně časté: Bolest hlavy
Gastrointestinální poruchy Méně časté: Nauzea
Poruchy reprodukčního systému a prsu
Časté: Může se vyskytnout mírný až středně závažný ovariální hyperstimulační syndrom (WHO
stupeň I nebo II), což je vlastní riziko stimulační procedury (viz bod 4.4).
Méně časté: Závažný ovariální hyperstimulační syndrom (WHO stupeň III).
Celkové poruchy a reakce v místě aplikace
Časté: Byly zaznamenány lokální reakce v místě vpichu (např. erytém, otok a svědění).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Předávkování může u lidí vést k prodloužení účinku, avšak není pravděpodobné, že by bylo spjato s akutními toxickými účinky.
Po intraperitoneálním podání cetrorelixu v dávkách, jež byly více než 200násobkem dávky, která je farmakologicky účinná po podkožním podání, byly ve studiích akutní toxicity u hlodavců pozorovány symptomy nespecifické toxicity.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antagonista gonadotropin uvolňujícího hormonu, ATC kód: H01CC02. Mechanismus účinku
Cetrorelix je antagonista hormonu uvolňujícího gonadotropiny (luteinising hormone releasing hormone, LHRH). LHRH se váže na membránové receptory buněk hypofýzy. Cetrorelix soutěží o obsazení těchto receptorů s endogenním LHRH. Tímto mechanismem účinku cetrorelix kontroluje sekreci gonadotropinů (LH a FSH).
Cetrorelix v závislosti na dávce inhibuje sekreci LH a FSH z hypofýzy. Inhibiční účinek nastupuje prakticky okamžitě, bez iniciálního stimulačního efektu, a udržuje se při pokračující aplikaci.
Klinická účinnost a bezpečnost
U žen cetrorelix oddaluje vzestup LH a tím ovulaci. U žen podstupujících ovariální stimulaci závisí délka účinku cetrorelixu na velikosti dávky. Při dávkování po 0,25 mg v jedné injekci se účinek cetrorelixu udrží injekcemi opakovanými každých 24 hodin.
Hormonálně antagonistické účinky cetrorelixu byly po ukončení jeho aplikace jak u zvířat, tak u lidí plně reverzibilní.
5.2 Farmakokinetické vlastnosti
Absorpce
Absolutní biologická dostupnost cetrorelixu po podkožní injekci je přibližně 85%.
Distribuce
Distribuční objem (Vd) je 1,1 l x kg-1.
Eliminace
Hodnota celkové plazmatické clearance činí 1,2 ml x min-1 kg-1, hodnota renální clearance je 0,1 ml x min-1 kg-1.
Průměrný terminální plazmatický poločas je po nitrožilním podání kolem 12 h, po podkožním podání kolem 30 h. Tento rozdíl ukazuje na vliv absorpčních procesů v místě injekce.
Linearita
Po podkožním jednorázovém podání (0,25 mg až 3 mg cetrorelixu) jakož i při opakovaném každodenním podávání po dobu 14 dnů byla prokázána lineární plazmatická farmakokinetika.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu a reprodukční toxicity neodhalily žádné zvláštní riziko pro člověka.
Ve studiích akutní, subakutní a chronické toxicity, v nichž byl cetrorelix podáván podkožně potkanům a psům, nebyla zjištěna cílená orgánová toxicita. U psů nebyly ani po nitrožilní, nitrotepenné a mimožilní injekci cetrorelixu v dávkách zřetelně překračujících dávky předpokládané při použití u člověka pozorovány známky s léčivým přípravkem související lokální dráždivosti nebo nesnášenlivosti.
V testech genových a chromosomových mutací cetrorelix nevykázal mutagenní ani klastogenní potenciál.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek:
Mannitol
Rozpouštědlo:
Voda na injekci
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti
2 roky.
Roztok je třeba aplikovat bezprostředně po přípravě.
6.4 Zvláštní opatření pro uchovávání
Neuchovávejte při teplotě nad 25 °C.
Uchovávejte injekční lahvičku(ky) v krabičce, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
Balení s 1 nebo 7 injekčními lahvičkami ze skla I. třídy uzavřenými pryžovou zátkou.
Balení dále obsahují ke každé injekční lahvičce:
1 předplněnou injekční stříkačku (zásobní vložka ze skla I. třídy, uzavřená pryžovými zátkami) s 1 ml rozpouštědla pro parenterální použití 1 injekční jehlu (20 gauge)
1 subkutánní injekční jehlu (27 gauge)
2 tampony napuštěné alkoholem.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Prášek přípravku Cetrotide se má rozpouštět pouze v přiloženém rozpouštědle opatrným krouživým pohybem. Je třeba se vyhnout intenzivnímu protřepávání, aby se zabránilo vzniku bublin.
Vzniklý roztok neobsahuje částice a je čirý. Roztok se nesmí použít, obsahuje-li viditelné částice, nebo není-li čirý.
Po přípravě roztoku je do stříkačky třeba natáhnout celý tekutý obsah injekční lahvičky. Tím se zajistí, aby pacientka obdržela dávku nejméně 0,23 mg cetrorelixu.
Roztok je třeba injikovat bezprostředně po přípravě.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Merck Serono Europe Limited 56 Marsh Wall London E14 9TP Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/99/100/001
EU/1/99/100/002
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 13. dubna 1999
Datum prvního prodloužení registrace : 15. dubna 2004
Datum posledního prodloužení registrace: 13. dubna 2009
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobců odpovědných za propouštění šarží
Sterna Zentaris GmbH WeismullerstraBe 50 D-60314 Frankfurt Německo
Merck KGaA,
Frankfurter StraBe 250 D-64293 Darmstadt Německo
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
KRABIČKA S 1 INJEKČNÍ LAHVIČKOU A 1 PŘEDPLNĚNOU INJEKČNÍ STŘÍKAČKOU KRABIČKA SE 7 INJEKČNÍMI LAHVIČKAMI A 7 PŘEDPLNĚNÝMI INJEKČNÍMI STŘÍKAČKAMI
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Cetrotide 0,25 mg prášek a rozpouštědlo pro injekční roztok cetrorelixum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna injekční lahvička s práškem obsahuje: cetrorelixum 0,25 mg (ve formě cetrorelixi acetas).
3. SEZNAM POMOCNÝCH LÁTEK
Pomocná látka: mannitol
Jedna předplněná injekční stříkačka s rozpouštědlem obsahuje: 1 ml vody na injekci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
1 injekční lahvička s práškem pro injekční roztok 1 předplněná injekční stříkačka s rozpouštědlem pro parenterální použití Balení také obsahuje:
1 injekční jehlu (velikost 20)
1 subkutánní injekční jehlu (velikost 27)
2 tampóny napuštěné alkoholem
7 injekčních lahviček s práškem pro injekční roztok
7 předplněných injekčních stříkaček s rozpouštědlem pro parenterální použití Balení také obsahuje:
7 injekčních jehel (velikost 20)
7 subkutánních injekčních jehel (velikost 27)
14 tampónů napuštěných alkoholem
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Subkutánní podání.
Před použitím si přečtěte příbalovou informaci
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Neuchovávejte při teplotě nad 25 °C. Uchovávejte injekční lahvičku v krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Merck Serono Europe Limited 56 Marsh Wall London E14 9TP Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/99/100/001
EU/1/99/100/002
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
cetrotide 0,25 mg
17. JEDINEČNÝ IDENTIFIKÁTOR - 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
|
18. JEDINEČNÝ IDENTIFIKÁTOR - |
- DATA ČITELNÁ OKEM |
|
PC: {číslo} SN: {číslo} NN: {číslo} |
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Cetrotide 0,25 mg prášek pro injekční roztok
cetrorelixum
Subkutánní podání
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
0,25 mg
6. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Rozpouštědlo pro přípravek Cetrotide 0,25 mg Voda na injekci
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 ml
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
Cetrotide 0,25 mg prášek a rozpouštědlo pro injekční roztok
Cetrorelixi acetas
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Cetrotide a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Cetrotide používat
3. Jak se přípravek Cetrotide používá
4. Možné nežádoucí účinky
5. Jak přípravek Cetrotide uchovávat
6. Obsah balení a další informace
Příprava injekčního roztoku Cetrotide a jeho aplikace
1. Co je přípravek Cetrotide a k čemu se používá Co je přípravek Cetrotide
Přípravek Cetrotide obsahuje léčivou látku zvanou „cetrorelix-acetát“. Toto léčivo brání v těle uvolnění vajíčka z vaječníku (ovulace) během menstruačního cyklu. Cetrotide patří do skupiny léčiv zvaných „antagonisté gonadotropin uvolňujících hormonů“.
K čemu se přípravek Cetrotide používá
Přípravek Cetrotide je jedno z léčiv používaných během „metod asistované reprodukce“ pro podporu otěhotnění. Brání okamžitému uvolnění vajíčka. V případě, že se vajíčka uvolňují příliš brzy (předčasná ovulace), může tím být znemožněn jejich odběr lékařem.
Jak přípravek Cetrotide působí
Přípravek Cetrotide blokuje přirozený hormon zvaný LHRH („hormon uvolňující luteinizační hormon“) v těle.
• LHRH reguluje jiný hormon, zvaný LH („luteinizační hormon“).
• LH stimuluje ovulaci během menstruačního cyklu.
To znamená, že přípravek Cetrotide zastavuje řetězec reakcí, které vedou k uvolnění vajíčka z vaječníku. Jakmile jsou vajíčka připravena k odběru, podá se jiné léčivo, které je uvolní (vyvolání ovulace).
2. Čemu musíte věnovat pozornost, než začnete přípravek Cetrotide používat Nepoužívejte přípravek Cetrotide
• jestliže jste alergická na cetrorelix-acetát nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6),
• jestliže jste alergická na léčiva podobná přípravku Cetrotide (nebo jiným peptidovým hormonům),
• jestliže jste těhotná nebo kojíte-li,
• máte-li těžké onemocnění ledvin.
Přípravek Cetrotide nepoužívejte, pokud se Vás týká alespoň jeden z výše uvedených bodů. V případě pochybností se před použitím léčiva poraďte s lékařem.
Upozornění a opatření
Alergie
V případě, že trpíte alergií nebo jste trpěli alergiemi v minulosti, informujte o tom před použitím přípravku Cetrotide svého lékaře.
Ovariální hyperstimulační syndrom (OHSS)
Přípravek Cetrotide se používá spolu s jinými léčivy, která stimulují vaječníky k větší produkci vajíček připravených k uvolnění. Během užívání nebo po podání těchto léčiv se může rozvinout ovariální hyperstimulační syndrom (OHSS). K tomu dojde v případě, že se nadměrně vyvíjejí folikuly, které se přemění ve velké cysty.
Více informací o projevech, prevenci a opatřeních v těchto případech naleznete v bodě 4 „Možné nežádoucí účinky“.
Použití přípravku Cetrotide během více než jednoho cyklu
Zkušenosti s použitím přípravku Cetrotide během více než jednoho cyklu jsou malé. Lékař pečlivě zváží výhody a rizika případného použití přípravku Cetrotide během více než jednoho cyklu.
Onemocnění jater
Informujte svého lékaře před použitím přípravku Cetrotide, pokud máte onemocnění jater. Přípravek Cetrotide nebyl hodnocen u pacientek s onemocněním jater.
Onemocnění ledvin
Informujte svého lékaře před použitím přípravku Cetrotide, pokud máte onemocnění ledvin. Přípravek Cetrotide nebyl hodnocen u pacientek s onemocněním ledvin.
Děti a dospívající
Cetrotide není indikován pro použití u dětí a dospívajících.
Další léčivé přípravky a přípravek Cetrotide
Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užívala nebo které možné budete užívat.
Těhotenství a kojení
Nepoužívejte přípravek Cetrotide v případě, že jste těhotná nebo domníváte-li se, že byste mohla být těhotná, nebo kojíte-li.
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
Řízení dopravních prostředků a obsluha strojů
Neočekává se, že by přípravek Cetrotide mohl ovlivnit Vaši schopnost řídit dopravní prostředky a obsluhovat stroje.
3. Jak se přípravek Cetrotide používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistá, poraďte se se svým lékařem.
Použití léčiva
Toto léčivo je určeno pouze k podkožnímu podání do břicha (subkutánní). Kvůli omezení podráždění pokožky zvolte každý den jinou část břicha.
• Váš lékař musí dohlédnout na aplikaci první injekce. Lékař nebo sestra Vám předvede přípravu a aplikaci injekčního roztoku léčiva.
• Další injekce můžete provádět sami, pokud Vás lékař upozornil na symptomy, které mohou být projevem alergie a mohou mít vážné nebo život ohrožující následky, které by vyžadovaly okamžité ošetření (viz bod 4 „Možné nežádoucí účinky“).
• Pečlivě si prostudujte a následujte pokyny na konci této informace s názvem „Příprava injekčního roztoku a aplikace přípravku Cetrotide"".
• 1. den léčebného cyklu začnete užívat jiné léčivo. Za několik dnů pak začnete používat přípravek Cetrotide. (Viz další část „Použité množství".)
Použité množství
Aplikujte obsah jedné injekční lahvičky (0,25 mg Cetrotide) jednou denně. Doporučuje se podávat léčivo
každý den ve stejnou dobu s 24hodinovými intervaly, mezi jednotlivými dávkami.
Injekční podávání můžete provádět každé ráno nebo každý večer.
• Ranní podávání injekce: zahajte injekční podávání 5. nebo 6. den léčebného cyklu. Lékař Vám sdělí přesné datum a čas. V užívání léčiva budete pokračovat až do rána (včetně), kdy proběhne odběr vajíček (stimulace ovulace).
NEBO
• Večerní podávání injekce: zahajte injekční podávání 5. den léčebného cyklu. Lékař Vám sdělí přesné datum a čas. V užívání léčiva budete pokračovat až do večera (včetně), kdy proběhne odběr vajíček (stimulace ovulace).
Jestliže jste použila více přípravku Cetrotide, než jste měla
V případě náhodného injekčního podání většího množství léčiva, než bylo třeba není pravděpodobné, že
by došlo k nežádoucím účinkům. Účinek léčiva bude delší. Většinou není nutné provádět zvláštní
opatření.
Jestliže jste zapomněla použít přípravek Cetrotide
• Pokud jste si zapomněla vzít dávku, vezměte ji ihned, jak si vzpomenete a poraďte se s lékařem.
• Nezdvojnásobujte injekční dávku, abyste nahradila vynechanou dávku.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout
u každého.
Alergické reakce
• Horká, zčervenalá pokožka, svědění (často v oblasti třísel nebo podpaží), zčervenalé, svědící oblasti s vyrážkou, rýma, rychlý nebo nepravidelný puls, otok jazyka a krku, kýchání, sípání nebo závažné dýchací potíže nebo závratě. Mohou se objevit závažné, život ohrožující alergické reakce na léčivo. Tyto reakce jsou méně časté (postihují méně než 1 % žen).
V případě, že zaznamenáte jakýkoli nežádoucí účinek uvedený výše, přestaňte přípravek Cetrotide užívat
a ihned kontaktujte svého lékaře.
Ovariální hyperstimulační syndrom (OHSS)
Tento syndrom se může objevit v důsledku jiných léčiv, která užíváte pro stimulaci vaječníků.
• Příznakem ovariálního hyperstimulačního syndromu (OHSS) může být bolest v podbřišku s pocitem nevolnosti (pocit na zvracení) nebo nevolnost (zvracení). To může znamenat, že vaječníky nadměrně reagovaly na léčbu a vytvořila se velká cysta na vaječníku. Tento průběh je častý (může postihnout až 1 z 10 žen).
• OHSS může přejít v závažný stav se zřetelně zvětšenými vaječníky, sníženou tvorbou moči, přírůstkem tělesné hmotnosti, dýchacími potížemi nebo tekutinou v břiše nebo v hrudníku. Tento průběh není častý (může postihnout až 1 ze 100 žen).
V případě, že zaznamenáte jakýkoli nežádoucí účinek uvedený výše, ihned kontaktujte svého lékaře.
Jiné nežádoucí účinky
Časté (mohou postihnout až 1 z 10 žen):
• V místě vpichu se může vyskytnout mírné a krátce trvající podráždění pokožky, například zarudnutí, svědění nebo otok.
Méně časté (mohou postihnout až 1 ze 100 žen):
• Pocit nevolnosti (pocit na zvracení)
• Bolest hlavy.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Cetrotide uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na injekční lahvičce za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Prášek Cetrotide v injekční lahvičce a sterilní voda (rozpouštědlo) v předplněné injekční stříkačce mají stejné datum uplynutí doby použitelnosti. Toto datum je vytištěno na štítcích a na krabičce.
Neuchovávejte při teplotě nad 25 °C.
Uchovávejte injekční lahvičku v krabičce, aby byl přípravek chráněn před světlem.
Roztok je nutno použít bezprostředně po přípravě.
Nepoužívejte tento přípravek, pokud si všimnete, že došlo ke změně vzhledu bílých pelet. Nepoužívejte, pokud připravený roztok v injekční lahvičce není čirý a bezbarvý nebo pokud jsou v něm částice.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
Pokud máte nějaké další otázky, obraťte se na svého lékaře nebo lékárníka.
6. Obsah balení a další informace Co přípravek Cetrotide obsahuje
• Léčivou látkou je cetrorelixi acetas. Jedna injekční lahvička obsahuje cetrorelixum 0,25 mg (ve formě cetrorelixi acetas)
• Další složkou j e mannitol.
• Rozpouštědlem j e sterilní voda na injekci.
Jak přípravek Cetrotide vypadá a co obsahuje toto balení
Cetrotide je bílý prášek pro injekční roztok ve skleněné injekční lahvičce s pryžovou zátkou. Je k dostání v baleních obsahujících jednu injekční lahvičku nebo sedm injekčních lahviček (na trhu nemusí být všechny velikosti balení).
Balení obsahují ke každé injekční lahvičce:
• jednu předplněnou injekční stříkačku se sterilní vodou na injekci (rozpouštědlem). Voda je určena k rozpuštění prášku v injekční lahvičce
• jednu jehlu se žlutým označením - určenou ke vstříknutí sterilní vody do injekční lahvičky a k odběru roztoku připraveného léčiva z injekční lahvičky
• jednu jehlu s šedým označením - určenou k vlastní aplikaci injekce léčiva do břicha
• dva tampóny napuštěné alkoholem k dezinfekci.
Držitel rozhodnutí o registraci
Merck Serono Europe Limited, 56 Marsh Wall, London E14 9TP, Velká Británie Výrobce
Sterna Zentaris GmbH, WeismullerstraBe 50, D-60314 Frankfurt, Německo nebo
Merck KGaA, Frankfurter StraBe 250, D-64293 Darmstadt, Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien
MERCK NV/SA Tél/Tel: +32 2 686 07 11
EtnrapHH
„MepK Etnrapna“ EAfl Ten.: +359 24461 111
Česká republika
Merck spol.s.r.o Tel: +420 272084211
Danmark
Merck A/S Tlf: +45 35253550
Deutschland
Merck Serono GmbH Tel: +49-6151-6285-0
Eesti
Merck Serono OU Tel: +372 682 5882
EXXáSa
Merck A.E.
T^Z: +30-210-61 65 100
Espaňa
Merck S.L.
Tel: +34-91-745 44 00
Línea de Información: 900 102 964
France
Merck Serono s.a.s.
Tél.: +33-4-72 78 25 25 Numéro vert : 0 800 888 024
Lietuva
Merck Serono UAB Tel: +370 37320603
Luxembourg/Luxemburg
MERCK NV/SA, Belgique/Belgien Tél/Tel: +32 2 686 07 11
Magyarország
Merck Kft.
Tel: +36-1-463-8100
Malta
Vivian Corporation Ltd Tel: +356-22-588600
Nederland
Merck BV
Tel: +31-20-6582800 Norge
Merck Serono Norge Tlf: +47 67 90 35 90
Osterreich
Merck GesmbH.
Tel: +43 1 57600-0
Polska
Merck Sp. z o.o.
Tel.: +48 22 53 59 700
|
Hrvatska Merck d.o.o, Tel: +385 1 4864 111 |
Románia MERCK d.o.o., Slovenia Tel: +386 1 560 3 800 |
|
Íreland Merck Serono Ltd, United Kingdom Tel: +44-20 8818 7200 |
Slovenija MERCK d.o.o. Tel: +386 1 560 3 800 |
|
Ísland Icepharma hf Tel: + 354 540 8000 |
Slovenská republika Merck spol. s r.o. Tel: + 421 2 49 267 111 |
|
Italia Merck Serono S.p.A. Tel: +39-06-70 38 41 |
Suomi/Finland Merck Oy Puh/Tel: +358-9-8678 700 |
|
Kúnpoq Xp. r. nana^or^ou AtS TqA..: +357 22490305 |
Sverige Merck AB Tel: +46-8-562 445 00 |
|
Latvija Merck Serono SIA Tel: +371 67152500 |
United Kingdom Merck Serono Ltd Tel: +44-20 8818 7200 |
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
PŘÍPRAVA INJEKČNÍHO PŘÍPRAVKU CETROTIDE A JEHO POUŽITÍ
- V této části je uvedeno, jak smíchat prášek se sterilní vodou (rozpouštědlem) a dále jak aplikovat injekci léčiva.
- Před použitím léčiva si nejprve přečtěte všechny pokyny.
- Toto léčivo je určeno pouze pro Vás - nedávejte je k použití nikomu jinému.
- Každou jehlu, injekční lahvičku a injekční stříkačku použijte pouze jednou.
Před použitím
1. Umyjte si ruce
- Důležité je, abyste měla ruce a věci, které používáte, co nejčistější.
2. Vše, co potřebujete, položte na čistou plochu
- jednu injekční lahvičku s práškem.
- jednu předplněnou injekční stříkačku se sterilní vodou (rozpouštědlem).
- jednu jehlu se žlutým označením - pro vstříknutí sterilní vody do injekční lahvičky a natažení připraveného léčiva z injekční lahvičky.
- jednu jehlu s šedým označením - pro injekci léčiva do břicha.
- dva tampóny napuštěné alkoholem.
Smíchání prášku a vody k přípravě léčiva
1. Odstranění plastového víčka z injekční lahvičky
- Pod víčkem je pryžová zátka - neodstraňujte ji z injekční lahvičky.
- Otřete pryžovou zátku a kovový kroužek jedním tampónem napuštěným alkoholem.
2. Přidání vody z předplněné injekční stříkačky k prášku v injekční lahvičce
- Obnažte jehlu se žlutým označením.
- Odstraňte víčko z předplněné injekční stříkačky a nasuňte na ni jehlu se žlutým označením. Odstraňte víčko z jehly.
- Zatlačte jehlu se žlutým označením do středu pryžové zátky v injekční lahvičce.
- Pomalu tlačte na píst injekční stříkačky k vstříknutí vody do injekční lahvičky. Nepoužívejte žádnou jinou vodu.
- Injekční stříkačku ponechte v pryžové zátce.
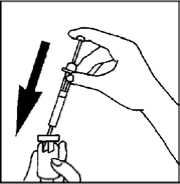
3. Smíchání prášku a vody v injekční lahvičce
- Opatrně držte injekční stříkačku a injekční lahvičku a jemným krouživým pohybem smíchejte prášek s vodou. Smíchání je úplné, když je roztok čirý a bez nerozpuštěných částic.
- Netřepejte lahvičkou, jinak se vytvoří v léčivu bublinky.
4. Opětovné naplnění injekční stříkačky léčivem z injekční lahvičky
- Obraťte injekční lahvičku shora dolů.
- Vysuňte píst z injekční stříkačky, abyste léčivem z injekční lahvičky opět naplnila injekční stříkačku.
- Pokud v injekční lahvičce ještě zůstalo léčivo, vysouvejte jehlu se žlutým označením tak, až se špička jehly dostane dovnitř pryžové zátky. Když se podíváte z boku přes otvor v pryžové zátce, můžete kontrolovat pohyb jehly a tekutiny.
Ujistěte se, že jste natáhla veškeré léčivo z lahvičky.
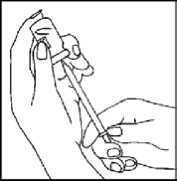
- Opět nasuňte víčko na jehlu se žlutým označením. Odšroubujte jehlu se žlutým označením z injekční stříkačky a injekční stříkačku odložte.
Příprava místa pro injekci a aplikování injekce léčiva
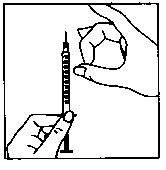
1. Odstranění vzduchových bublin
- Obnažte jehlu s šedým označením. Nasuňte jehlu na injekční stříkačku a odstraňte víčko z jehly s šedým označením.
- Držte injekční stříkačku s jehlou s šedým označením směrem vzhůru a zkontrolujte, zda se nevytvořily vzduchové bubliny.
- Pro odstranění vzduchových bublin jemně třepejte injekční stříkačkou, až se veškerý vzduch nahromadí na povrchu - pak pomalu stlačujte píst, až se všechny vzduchové bubliny odstraní.
- Nedotýkejte se jehly s šedým označením a dbejte na to, aby se jehla ničeho nedotkla.
2. Očistění místa pro injekci
- Zvolte místo pro injekci na břiše. Nejlépe v okolí pupku. Kvůli omezení podráždění pokožky volte každý den jiné místo na břiše.
- Očistěte pokožku v místě injekce druhým tampónem napuštěným alkoholem - krouživým pohybem.
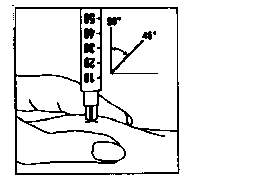
3. Propíchnutí pokožky
- Držte injekční stříkačku v jedné ruce - jako byste držela pero.
- Jemně zmáčkněte pokožku v okolí místa, kde chcete aplikovat injekci a pevně ji držte druhou rukou.
- Pomalu zatlačte celou jehlu s šedým označením do pokožky pod úhlem přibližně 45 až 90 stupňů - pak kůži uvolněte.
4. Injekce léčiva
- Jemně zasouvejte píst injekční stříkačky. V případě, že se objeví krev, opakujte bod 5 níže.
- Pokud se krev neobjeví, pomalu tlačte na píst a aplikujte injekci léčiva.
- Jakmile je injekční stříkačka prázdná, pomalu vysouvejte jehlu s šedým označením pod
stejným úhlem.
- Po injekci použijte druhý tampón napuštěný alkoholem jemným tlakem na místo.
5. V případě, že se objeví krev:
- pomalu vysuňte jehlu s šedým označením pod stejným úhlem.
- v místě propíchnutí kůže použijte druhý tampón napuštěný alkoholem
- veškeré léčivo zlikvidujte do odpadu a pokračujte podle kroku 6 níže
- umyjte si ruce a opakujte celý postup od začátku s novou injekční lahvičkou a předplněnou injekční stříkačkou.
6. Likvidace odpadu
- Jehlu, injekční lahvičku a injekční stříkačku použijte pouze jednou.
- Vracejte víčka zpět na jehly, aby byla jejich likvidace bezpečná.
- Pro informace o bezpečné likvidaci použitých jehel, injekčních lahviček a injekčních stříkaček se obraťte na lékárníka.
26