Cerenia 16 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Cerenia 16 mg tablety pro psy Cerenia 24 mg tablety pro psy Cerenia 60 mg tablety pro psy Cerenia 160 mg tablety pro psy
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka:
Každá tableta obsahuje 16 mg, 24 mg, 60 mg nebo 160 mg Maropitantum jako Maropitanti citras monohydricus.
Pomocné látky:
Každá tableta obsahuje jako barvivo 0,075 hm. % oranžové žluti (E110)
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Světle oranžová tableta
Tablety mají na obou stranách dělící rýhu, která umožní půlení tablety. Každá tableta je označena logem Pfizer na zadní straně. Na vrchní straně je každá polovina označená písmeny „MPT“ a znaky označující množství maropitantu.
4. KLINICKÉ ÚDAJE
4.1 Cílové druhy zvířat
Psi.
4.2 Indikace s upřesněním pro cílový druh zvířat
• Na prevenci nauzey vyvolané chemoterapií.
• Na prevenci zvracení vyvolaného kinetózou.
• Na prevenci a léčbu zvracení v kombinaci s Cerenia injekčním roztokem a v kombinaci s jinými podpůrnými opatřeními.
4.3 Kontraindikace
Nejsou.
4.4 Zvláštní upozornění pro každý cílový druh
Zvracení může být spojené s vážnými a těžkými vysilujícími stavy včetně neprůchodností gastrointestinálního traktu. Proto by se měla použít vhodná diagnostická zhodnocení.
Cerenia tablety se ukázaly být účinné při léčbě zvracení, nicméně tam kde je vysoká frekvence zvracení, nemusí být perorálně podaná Cerenia před dalším zvracením absorbována. Proto se doporučuje zahájit léčbu zvracení s Cerenia injekčním roztokem.
Dle správné veterinární praxe je doporučeno používat léky potlačující zvracení společně s jinými veterinárními a podpůrnými opatřeními jako jsou dieta a doplnění tekutin v rámci stanovení základní příčiny zvracení. Bezpečnost maropitantu při léčbě trvající déle než 5 dní nebyla u cílové skupiny (tj.
mladí psi trpící virovou enteritidou) zkoumána. Pokud je léčba trvající déle než 5 dní považována za nutnou, je třeba pečlivě sledovat možné nežádoucí účinky.
4.5 Zvláštní opatření pro použití
Zvláštní opatření pro použití u zvířat
Bezpečnost veterinárního léčivého přípravku nebyla stanovena u psů mladších 16 týdnů pro dávku 8 mg/kg (kinetóza), a u psů mladších než 8 týdnů pro dávku 2 mg/kg (zvracení), stejně jako nebyla bezpečnost stanovena u lakujících a březích fen. Použít pouze po zvážení poměru terapeutického prospěchu a rizika příslušným veterinárním lékařem.
Maropitant je metabolizován v játrech a proto by se měl u zvířat s jaterními onemocněními používat obezřetně. Při léčbě trvající 14 dní dochází k akumulaci maropitantu v těle zvířete kvůli metabolické saturaci. Při dlouhodobé léčbě by tak kromě jakýchkoliv nežádoucích účinků měla být sledována také funkce jater.
Cerenia by se měla použít obezřetně u zvířat trpících nebo majících predispozici k onemocněním srdce, jelikož maropitant má afinitu k Ca- a K-iontovým kanálům. Nárůst o přibližně 10 % v QT intervalu EKG byl pozorován v studii na zdravých psech plemene bígl, kterým byla perorálně aplikována dávka 8 mg/kg; nicméně, takový nárůst nemá pravděpodobně klinický význam.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům
Po použití umýt ruce. V případě náhodného požití vyhledejte ihned lékařskou pomoc a ukažte příbalovou informaci nebo etiketu praktickému lékaři.
4.6 Nežádoucí účinky (frekvence a závažnost)
Případy předcestovního zvracení, obvykle v průběhu 2 hodin po podání, byly běžně hlášeny po podání dávky 8 mg/kg.
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
- velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
4.7 Použití v průběhu březosti, laktace nebo snášky
Používat pouze po zvážení terapeutického přínosu a rizika příslušným veterinárním lékařem, protože nebyly provedeny průkazné studie reprodukční toxicity u žádných živočišných druhů.
4.8 Interakce s dalšími léčivými přípravky a další formy interakce
Cerenia by se neměla používat současně s blokátory Ca kanálů, protože maropitant má afinitu k Ca kanálům.
Maropitant se dobře váže na plazmatické proteiny a může soutěžit s jinými léky se silnou vazbou.
4.9 Podávané množství a způsob podání Pro perorální podání.
U kinetózy se doporučuje lehké jídlo nebo pamlsek před podáním, dlouhotrvajícímu hladovění před podáním se třeba vyhnout. Cerenia tablety by se neměly podávat zabalené nebo obalené v jídle, protože to může zpomalit rozpuštění tablety a následně nástup účinnosti.
Psi by měli být po podání pečlivě sledováni, aby se zajistilo, že každá tableta je polknutá.
Na prevenci nauzey vyvolané chemoterapií a léčbu a prevenci zvracení (mimo kinetózy), (pouze pro psy starší 8 týdnů).
Na léčbu nebo prevenci zvracení podat Cerenia tablety jednou denně v dávce 2 mg maropitantu/kg ž.hm., použitím počtu tablet podle níže uvedené tabulky. Tablety jsou dělitelné podél dělící rýhy na tabletě.
Na prevenci zvracení by se tablety měly podat více než 1 hodinu předem. Délka účinku je přibližně 24 hodin, a proto se mohou tablety podat večer před podáním látky, která může způsobit zvracení (např. chemoterapie).
Cerenia může být použita na léčbu nebo k prevenci zvracení a to buď podáváním tablet, nebo injekčního roztoku, jednou denně. Cerenia injekční roztok může být podáván po dobu až 5 dnů a Cerenia tablety po dobu až 14 dnů.
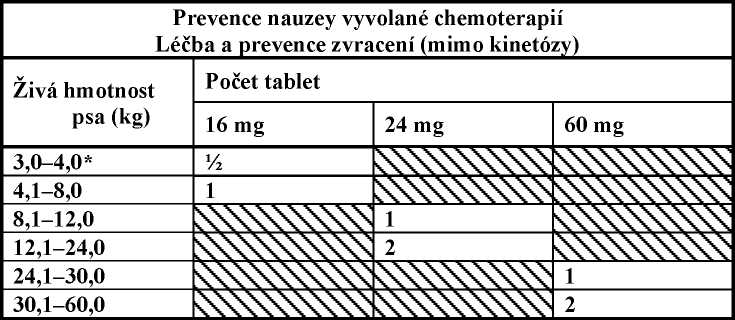
* správná dávka pro psy menší než 3 kg nemůže být přesně dosažena
Na prevenci zvracení vyvolaného kinetózou, (pouze pro psy starší 16 týdnů)
Na prevenci zvracení vyvolaného kinetózou podat Cerenia tablety jednou denně v dávce 8 mg maropitantu/kg ž. hm., použitím počtu tablet podle níže uvedené tabulky. Tablety jsou dělitelné podél dělící rýhy na tabletě.
Tablety by se měli podat alespoň 1 hodinu před začátkem cesty. Antiemetický účinek přetrvává nejméně 12 hodin, což pro pohodlí umožňuje aplikaci večer před časným ranním cestováním. Léčba se může opakovat maximálně po dobu 2 po sobě následujících dnů.
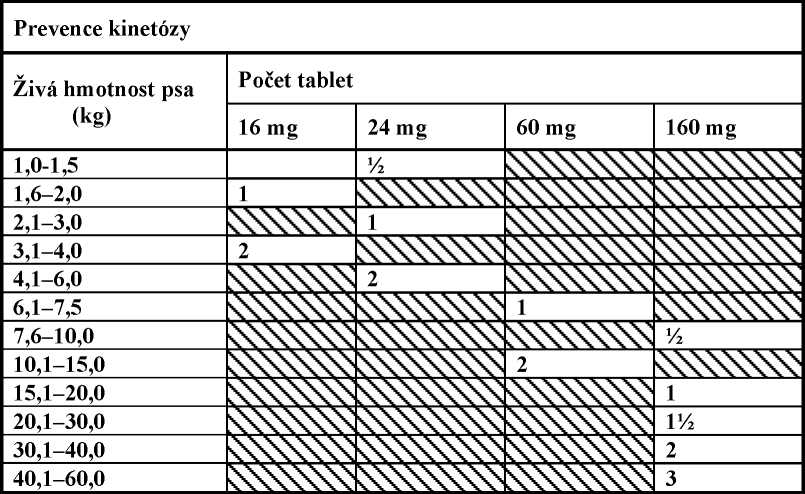
Protože farmakokinetická odchylka je velká a maropitant se po opakovaném každodenním podání jedné dávky hromadí v těle, nižší dávky než jako jsou doporučené, mohou být u některých jedinců při opakovaném podání dostatečné.
4.10 Předávkování (symptomy, první pomoc, antidota), pokud je to nutné
Cerenia tablety byly dobře snášeny při denní dávce do 10 mg/kg živé hmotnosti podávané po dobu 15 dnů.
Klinické příznaky včetně zvracení při prvním podání, zvýšené slinění a vodnatá stolice byly pozorovány při podání léku při dávce přesahující 20 mg/kg.
4.11 Ochranné lhůty
Není určeno pro potravinová zvířata.
5. FARMAKOLOGICKÉ VLASTNOSTI
Farmakoterapeutická skupina: Antiemetika.
ATCvet kód: QA04AD90
Maropitant je potentní a selektivní antagonista působící na neurokininových receptorech (NK-1), který účinkuje prostřednictvím inhibice vazby substance P s těmito receptory v CNS. Substance P je neuropeptid ze skupiny tachykininů.
5.1 Farmakodynamické vlastnosti
Zvracení je komplexní proces řízený centrálně z emetického centra v mozku. Toto centrum se skládá z několika jader v mozkovém kmenu (area postrema, nucleus tractus solitarius, dorzální motorické jádro nervus vagus), které přijímají a vzájemně spojují senzorické podněty z centrálních a periferních zdrojů a chemické podněty z cirkulace a mozkomíšního moku.
Maropitant je antagonista působící na neurokinin 1 receptorech (NK-1), který účinkuje prostřednictvím inhibice vazby substance P na tyto receptory. Substance P je neuropeptid ze skupiny tachykininů a nachází se ve významných koncentracích v jádru, které je součástí emetického centra a považuje se za klíčový neurotransmiter ovlivňující zvracení. Inhibicí vazby substance P v emetickém centru působí maropitant účinně proti nervovým a humorálním (centrálním a periferním) příčinám zvracení. Různými in vitro testy bylo prokázáno, že maropitant se selektivně váže na receptory NK-1 v rámci funkčního a na dávce závislého antagonismu s účinky substance P. Ve studiích prováděných in vivo byl prokázán antiemetický účinek maropitantu proti centrálně i periferně působícím emetikům, jako je apomorfin, cisplatin a ipekakuanhový sirup.
Maropitant nevykazuje sedativní účinky a neměl by se používat jako sedativum při kinetózách.
Maropitant je účinný proti zvracení. Příznaky nauzey spojené s kinetózou včetně nadměrného slinění a apatie mohou během léčby přetrvávat.
5.2 Farmakokinetické údaje
Farmakokinetický profil maropitantu po podání jedné perorální dávky 2 mg/kg ž.hm. psům byl charakterizován maximální koncentraci (Cmax) v plazmě přibližně 81 ng/ml, táto hodnota byla dosažena během 1,9 hodiny po aplikaci (Tmax). Maximální koncentrace byly následovány poklesem v systémové expozici se zdánlivým poločasem eliminace (t1/2) 4,03 hodiny.
Při dávce 8 mg/kg, dosahovala Cmax hodnoty 776 ng/ml za 1,7 hodiny po aplikaci. Poločas eliminace byl při dávce 8 mg/kg 5,47 hodin.
Rozdíly v kinetice mezi jednotlivci mohou být velké, do 70 CV % pro AUC.
Během klinické studie byla prokázána účinnost plazmatických hladin maropitantu po 1 hodině po aplikaci.
Odhad biologické dostupnosti maropitantu po perorálním podání je 23,7 % při dávce 2 mg/kg ž.hm. a 37,0 % při dávce 8 mg/kg ž.hm. Distribuční objem se po intravenózním podání dávky 1-2 mg/kg ž.hm. pohyboval v ustáleném stavu (Vss) přibližně od 4,4 do 7,0 l/kg ž.hm. Pokud se maropitant podá perorálně v dávce v rozmezí od 1 do 16 mg/kg ž.hm., vykazuje nelineární farmakokinetické vlastnosti (se zvyšující se dávkou se AUC zvyšuje více než úměrně).
Po opakovaném perorálním podání v průběhu pěti po sobě jdoucích dnů v denní dávce 2 mg/kg byla zjištěna 151 % akumulace. Po opakovaném perorálním podání v průběhu dvou po sobě jdoucích dnů v denní dávce 8 mg/kg byla akumulace 218 %. Maropitant je v játrech metabolizován cytochromem P450 (CYP). V rámci biotransformace maropitantu v játrech byly u psů identifikovány dvě izoformy: CYP2D15 a CYP3A12.
Vylučování ledvinami je minoritním způsobem vylučování přičemž méně než 1 % z perorální dávky 8 mg/kg ž.hm. se objevuje v moči buď jako maropitant nebo jeho hlavní metabolit. Vazba maropitantu na plazmatické proteiny u psů je více než 99 %.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Sodná sůl kroskarmelosy Monohydrád laktosy Magnesium-stearát Mikrokrystalická celulosa Oranžová žluť (E110) jako barvivo
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
Doba použitelnosti veterinárního léčivého přípravku v neporušeném obalu: 3 roky Doba použitelnosti rozpůlené tablety: 2 dny
6.4 Zvláštní opatření pro uchovávání
Tento veterinární léčivý přípravek nevyžaduje žádné zvláštní podmínky pro uchovávání.
Nepoužitou rozpůlenou tabletu vraťte do otevřeného blistru a uchovávejte v kartónové krabičce.
6.5 Druh a složení vnitřního obalu
Kartonová krabička obsahující jeden aluminiový (Al/Al) blistr obsahující 4 tablety v balení.
Cerenia tablety jsou dostupné v síle 16 mg, 24 mg, 60 mg a 160 mg.
6.6 Zvláštní opatření pro zneškodňování nepoužitého veterinárního léčivého přípravku nebo odpadu, který pochází z tohoto přípravku
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z tohoto přípravku, musí být likvidován podle místních právních předpisů.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Zoetis Belgium SA Rue Laid Burniat 1 1348 Louvain-la-Neuve BELGIE
8. REGISTRAČNÍ ČÍSLO(A)
EU/2/06/062/001 (16 mg tablety) EU/2/06/062/002 (24 mg tablety) EU/2/06/062/003 (60 mg tablety) EU/2/06/062/004 (160 mg tablety)
9. DATUM REGISTRACE/ PRODLOUŽENÍ REGISTRACE
Datum registrace: 29/09/2006
Datum posledního prodloužení: 29/09/2011
10. DATUM REVIZE TEXTU
Podrobné informace o veterinárním léčivém přípravku jsou k dispozici na webové stránce Evropské lékové agentury http://www.ema.europa.eu/
ZÁKAZ PRODEJE, VÝDEJE A/NEBO POUŽITÍ
Neuplatňuje se.
Cerenia 10 mg/ml injekční roztok pro psy a kočky
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 ml roztoku obsahuje:
Léčivá látka:
Maropitantum (jako Maropitanti citras monohydricus) 10 mg
Pomocné látky:
Metakresol (jako konzervační prostředek) 3,3 mg
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok
Čirý, bezbarvý až světležlutý roztok.
4. KLINICKÉ ÚDAJE
4.1 Cílové druhy zvířat
Psi a kočky.
4.2 Indikace s upřesněním pro cílový druh zvířat Psi:
• Na léčbu a prevenci nauzey vyvolané chemoterapií.
• Na prevenci zvracení, kromě případů vyvolaných kinetózou.
• Na léčbu zvracení v kombinaci s jinými podpůrnými opatřeními.
• Na prevenci perioperační nauzey a zvracení a zlepšení zotavení z celkové anestezie po užití p-opiátových receptorových agonistů morfinu
Kočky:
• Na prevenci zvracení a zmírnění nauzey, kromě případů vyvolaných kinetózou.
• Na léčbu zvracení v kombinaci s jinými podpůrnými opatřeními.
4.3 Kontraindikace
Nejsou.
4.4 Zvláštní upozornění pro každý cílový druh
Zvracení může být spojené s vážnými, vysilujícími stavy včetně neprůchodností gastrointestinálního traktu. Proto by se měla použít vhodná diagnostická zhodnocení.
Dle správné veterinární praxe je doporučeno používat léky potlačující zvracení v kombinaci s jinými veterinárními a podpůrnými opatřeními jako jsou dieta a doplnění tekutin v rámci stanovení základní příčiny zvracení.
Nedoporučuje se použití Cerenia injekčního roztoku proti zvracení vyvolaného kinetózou.
Psi:
Přestože Cerenia prokázala účinnost při léčbě a prevenci zvracení vyvolaného chemoterapií, zjistilo se, že je účinnější při preventivním podání. Proto se doporučuje podat lék potlačující zvracení před podáním chemoterapeutické látky.
Kočky:
Účinnost Cerenia pro zmírnění nauzey byla prokázána v modelových studiích (nauzea vyvolaná xylazinem).
4.5 Zvláštní opatření pro použití
Zvláštní opatření pro použití u zvířat
Bezpečnost veterinárního léčivého přípravku nebyla stanovena u psů mladších 8 týdnů nebo u koček mladších 16 týdnů, a u laktujících a březích fen a koček. Používat pouze po zvážení terapeutického prospěchu a rizika příslušným veterinárním lékařem.
Maropitant je metabolizován v játrech a proto by se měl u zvířat s jaterními onemocněními používat obezřetně. Při léčbě trvající 14 dní dochází k akumulaci maropitantu v těle zvířete kvůli metabolické saturaci. Při dlouhodobé léčbě by tak kromě jakýchkoliv nežádoucích účinků měla být sledována také funkce jater.
Cerenia by se měla použít obezřetně u zvířat trpících nebo majících predispozici k onemocněním srdce, jelikož maropitant má afinitu k Ca a K iontovým kanálům. Nárůst o přibližně 10 % v QT intervalu EKG byl pozorován v studii na zdravých psech plemene bígl, kterým byla perorálně aplikována dávka 8 mg/kg; nicméně, takový nárůst nemá pravděpodobně klinický význam.
Kvůli častému výskytu přechodné bolesti při subkutánním vpichu by měl být použit vhodný postup k fixaci zvířat. Podání chlazeného přípravku může zmírnit bolest při vpichu.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům
Po použití umýt ruce. V případě náhodného samopodání vyhledejte ihned lékařskou pomoc a ukažte příbalovou informaci nebo etiketu praktickému lékaři. Laboratorní testy prokázaly, že maropitant může dráždit oči. Pokud dojde k náhodnému kontaktu s očima, vypláchněte oči dostatečným množstvím vody a vyhledejte lékařské ošetření.
4.6 Nežádoucí účinky (frekvence a závažnost)
V místě subkutánního vpichu se může objevit bolestivost. U koček je velmi často pozorována střední až silná odezva na injekci (zhruba u jedné třetiny koček).
Ve velmi vzácných případech se může objevit anafylaktický typ reakce (alergické otoky, kopřivka, erytém, kolaps, dušnost, bledé sliznice).
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
- velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
4.7 Použití v průběhu březosti, laktace nebo snášky
Používat pouze po zvážení terapeutického prospěchu a rizika příslušným veterinárním lékařem, protože nebyly provedeny průkazné studie reprodukční toxicity u žádných živočišných druhů.
4.8 Interakce s dalšími léčivými přípravky a další formy interakce
Cerenia by se neměla používat současně s blokátory Ca kanálů, protože maropitant má afinitu k Ca kanálům.
Maropitant se dobře váže na plazmatické proteiny a může soutěžit s jinými léky se silnou vazbou.
4.9 Podávané množství a způsob podání
Pro subkutánní nebo intravenózní podání u psů a koček.
Cerenia injekční roztok by měl být aplikovaný subkutánně nebo intravenózně, jednou denně v dávce 1 mg/kg živé hmotnosti (1 ml/10 kg živé hmotnosti) až po dobu 5 dnů. Při intravenózním podání by měl být přípravek Cerenia podán jako jednorázový bolus bez smíchání s jakoukoliv jinou kapalinou.
U psů může být Cerenia použita na léčbu nebo prevenci zvracení a to buď podáváním tablet, nebo injekčního roztoku, jednou denně. Cerenia injekční roztok může být podáván po dobu až 5 dnů a Cerenia tablety po dobu až 14 dnů.
Na prevenci zvracení by se měl Cerenia injekční roztok podat více než 1 hodinu předem. Délka účinku je přibližně 24 hodin a proto může být léčba podána večer před podáním látky, která může vyvolat zvracení, např. chemoterapie.
Protože farmakokinetická odchylka je velká a maropitant se po opakovaném každodenním podání jedné dávky hromadí v těle, nižší dávky než jako jsou doporučené, mohou být u některých jedinců při opakovaném podání dostatečné.
4.10 Předávkování (symptomy, první pomoc, antidota), pokud je to nutné
Kromě přechodných reakcí v místě subkutánního vpichu byl Cerenia injekční roztok dobře snášen u psů a mladých koček, kterým se denně aplikovalo do 5 mg/kg (5násobek doporučené dávky) po dobu 15 po sobě následujících dní (3násobek doporučené délky podávání). Nejsou dostupná data pro předávkování u dospělých koček.
4.11 Ochranné lhůty
Není určeno pro potravinová zvířata.
5. FARMAKOLOGICKÉ VLASTNOSTI
Farmakoterapeutická skupina: Antiemetika.
ATCvet kód: QA04AD90
Maropitant je potentní a selektivní antagonista působící na neurokininových receptorech (NK-1), který účinkuje prostřednictvím inhibice vazby substance P s těmito receptory v CNS. Substance P je neuropeptid ze skupiny tachykininů.
5.1 Farmakodynamické vlastnosti
Zvracení je komplexní proces řízený centrálně z emetického centra v mozku. Toto centrum se skládá z několika jader v mozkovém kmenu (area postrema, nucleus tractus solitarius, dorzální motorické jádro
nervus vagus), které přijímají a vzájemně spojují senzorické podněty z centrálních a periferních zdrojů a chemické podněty z cirkulace a mozkomíšního moku.
Maropitant je antagonista působící na neurokinin 1 receptorech (NK-1), který účinkuje prostřednictvím inhibice vazby substance P na tyto receptory. Substance P je neuropeptid ze skupiny tachykininů a nachází se ve významných koncentracích v jádru, které je součástí emetického centra a považuje se za klíčový neurotransmiter ovlivňující zvracení. Inhibicí vazby substance P v emetickém centru působí maropitant účinně proti nervovým a humorálním (centrálním a periferním) příčinám zvracení.
Různými in vitro testy bylo prokázáno, že maropitant se selektivně váže na receptory NK-1 v rámci funkčního a na dávce závislého antagonismu s účinky substance P.
Maropitant je účinný proti zvracení. Antiemetický účinek maropitantu proti centrálně i periferně působícím emetikům byl prokázán v experimentálních studiích zahrnujících apomorfin, cisplatin a ipekakuanhový sirup (psi) a xylazin (kočky).
Příznaky nauzey u psů včetně nadměrného slinění a apatie mohou po léčbě přetrvávat.
5.2 Farmakokinetické údaje Psi:
Farmakokinetický profil maropitantu po podání jedné subkutánní dávky 1 mg/kg ž.hm. psům byl charakterizován maximální koncentraci (cmax) v plazmě přibližně 92 ng/kg, tato hodnota byla dosažena během 0,75 hodiny po aplikaci (tmax). Maximální koncentrace byly následovány poklesem v systémové expozici se zdánlivým poločasem eliminace (t1/2) 8,84 hodin. Po podání jedné intravenózní dávky 1 mg/kg byla počáteční koncentrace v plasmě 363 ng/ml. Distribuční objem v ustáleném stavu (Vss) byl 9,3 l/kg a systémová clearance byla 1,5 l/h/kg. Poločas eliminace t1/2 po intravenózním podání byl zhruba 5,8 h.
Během klinické studie byla prokázána účinnost plazmatických hladin maropitantu po 1 hodině po aplikaci.
Biologická dostupnost maropitantu po subkutánním podání je 90,7 %. Pokud se maropitant podá subkutánně v dávce v rozmezí od 0,5 do 2 mg/kg ž.hm. vykazuje lineární farmakokinetické vlastnosti.
Po opakovaném subkutánním podání v průběhu pěti po sobě jdoucích dnů v jedné denní dávce 1 mg/kg ž.hm. byla zjištěna 146 % akumulace. Maropitant je v játrech metabolizován cytochromem P450 (CYP). V rámci biotransformace maropitantu v játrech byly u psů identifikovány dvě izoformy: CYP2D15 a CYP3A12.
Vylučování ledvinami je minoritním způsobem vylučování přičemž méně než 1 % ze subkutánní dávky 1 mg/kg se objevuje v moči buď jako maropitant nebo jeho hlavní metabolit. Vazba maropitantu na plazmatické proteiny u psů je více než 99 %.
Kočky:
Farmakokinetický profil maropitantu po podání jedné subkutánní dávky 1 mg/kg ž.hm. kočkám byl charakterizován maximální koncentraci (cmax) v plazmě přibližně 165 ng/kg, tato hodnota byla dosažena v průměru během 0,32 hodiny (19 min) po aplikaci (tmax). Maximální koncentrace byly následovány poklesem v systémové expozici se zdánlivým poločasem eliminace (t1/2) 16,8 hodin.
Po podání jedné intravenózní dávky 1 mg/kg byla počáteční koncentrace v plasmě 1040 ng/ml. Distribuční objem v ustáleném stavu (Vss) byl 2,3 l/kg a systémová clearance byla 0,51 l/h/kg. Poločas eliminace t1/2 po intravenózním podání byl zhruba 4,9 h. Zdá se, že existuje vzájemná závislost mezi stářím koček a farmakokinetikou maropitantu, přičemž koťata mají vyšší clearance než dospělé kočky.
Během klinické studie byla prokázána účinnost plazmatických hladin maropitantu po 1 hodině po aplikaci.
Biologická dostupnost maropitantu po subkutánním podání je 91,3 %. Pokud se maropitant podá subkutánně v dávce v rozmezí od 0,25 do 3 mg/kg ž.hm., vykazuje lineární farmakokinetické vlastnosti.
Po opakovaném subkutánním podání v průběhu pěti po sobě jdoucích dnů v jedné denní dávce 1 mg/kg ž.hm. byla zjištěna 250 % akumulace. Maropitant je v játrech metabolizován cytochromem P450 (CYP). V rámci jaterní biotransformace maropitantu u koček byly identifikovány dvě izoformy: CYP1A a CYP3A.
Vylučování ledvinami a stolicí je minoritním způsobem vylučování maropitantu, přičemž méně než 1 % ze subkutánní dávky 1 mg/kg se objevuje v moči nebo stolici jako maropitant. Pro hlavní metabolit bylo objeveno 10,4 % dávky maropitantu v moči a 9,3 % ve stolici. Vazba maropitantu na plazmatické proteiny u koček je více než 99,1 %.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Sulfobutoxybetadex (SBECD)
Metakresol Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto se tento veterinární léčivý přípravek nesmí míchat s jinými veterinárními léčivými přípravky ve stejné stříkačce.
6.3 Doba použitelnosti
Doba použitelnosti veterinárního léčivého přípravku v neporušeném obalu: 3 roky Doba použitelnosti po prvním otevření vnitřního obalu: 28 dní
6.4 Zvláštní opatření pro uchovávání
Tento veterinární léčivý přípravek nevyžaduje žádné zvláštní podmínky pro uchovávání.
6.5 Druh a složení vnitřního obalu
Injekční lahvička typu 1 z tmavého lisovaného skla, 20 ml. Chlórbutylová gumová zátka a hliníkový uzávěr. Každá kartonová krabička obsahuje 1 injekční lahvičku.
6.6 Zvláštní opatření pro zneškodňování nepoužitého veterinárního léčivého přípravku nebo odpadu, který pochází z tohoto přípravku
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z tohoto přípravku, musí být likvidován podle místních právních předpisů.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Zoetis Belgium SA Rue Laid Burniat 1 1348 Louvain-la-Neuve BELGIE
8. REGISTRAČNÍ ČÍSLO(A)
EU/2/06/062/005
9. DATUM REGISTRACE/ PRODLOUŽENÍ REGISTRACE
Datum registrace: 29/09/2006
Datum posledního prodloužení: 29/09/2011
10. DATUM REVIZE TEXTU
Podrobné informace o veterinárním léčivém přípravku jsou k dispozici na webové stránce Evropské lékové agentury (http://www.ema.europa.eu/).
ZÁKAZ PRODEJE, VÝDEJE A/NEBO POUŽITÍ
Neuplatňuje se.
PŘÍLOHA II
A. DRŽITEL POVOLENÍ K VÝROBĚ ODPOVĚDNÝ ZA UVOLNĚNÍ ŠARŽE
B. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ
C. DEKLARACE HODNOT MRL
D. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
A. DRŽITEL POVOLENÍ K VÝROBĚ ODPOVĚDNÝ ZA UVOLNĚNÍ ŠARŽE
Jméno a adresa výrobce odpovědného za uvolnění šarže
FAREVA AMBOISE Zone Industrielle,
29 route des Industries 37530 Pocé-sur-Cisse FRANCIE
B. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ
Veterinární léčivý přípravek je vydáván pouze na předpis.
C. DEKLARACE HODNOT MRL
Neuplatňuje se
D. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
Rozšířením doby podávání Cerenia tablet u psů z 5 na 14 následujících dnů byl k 30. červnu 2014 obnoven cyklus předkládání Pravidelných zpráv o bezpečnosti (PSURs) pro Cerenia s předkládáním 6měsíčních zpráv (pokrývajících všechna schválená balení přípravku) po dobu následujících 2 let, poté ročních zpráv po následující 2 roky a následně v tříletých intervalech.
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
Cerenia 16mg tablety pro psy Cerenia 24 mg tablety pro psy Cerenia 60 mg tablety pro psy Cerenia 160 mg tablety pro psy
Maropitantum
Každá tableta obsahuje 16 mg Maropitantum jako Maropitanti citras monohydricus. Každá tableta obsahuje 24 mg Maropitantum jako Maropitanti citras monohydricus. Každá tableta obsahuje 60 mg Maropitantum jako Maropitanti citras monohydricus. Každá tableta obsahuje 160 mg Maropitantum jako Maropitanti citras monohydricus.
Tablety také obsahují oranžovou žluť (E110) jako barvivo.
Tablety
4 tablety
Psi
Perorální podání.
Před použitím čtěte příbalovou informaci.
Před použitím čtěte příbalovou informaci.
Doporučuje se zahájit léčbu zvracení s Cerenia injekční roztok.
EXP: {měsíc/rok}
Zneškodňování odpadu: čtěte příbalovou informaci.
13. OZNAČENÍ „POUZE PRO ZVÍŘATA“ A PODMÍNKY NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ, POKUD JE JICH TŘEBA
Pouze pro zvířata. Veterinární léčivý přípravek je vydáván pouze na předpis.
Uchovávat mimo dosah dětí.
Zoetis Belgium SA Rue Laid Burniat 1 1348 Louvain-la-Neuve BELGIE
EU/2/06/062/001
EU/2/06/062/002
EU/2/06/062/003
EU/2/06/062/004
Šarže: {číslo}
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH NEBO STRIPECH BLISTER/Tablety_
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Cerenia 16 mg tablety pro psy Cerenia 24 mg tablety pro psy Cerenia 60 mg tablety pro psy Cerenia 160 mg tablety pro psy Maropitantum
2. JMÉNO DRŽITELE ROZHODNUTÍ O REGISTRACI
Zoetis (logo)
3. DATUM EXSPIRACE
EXP: {měsíc/rok}
4. ČÍSLO ŠARŽE
Šarže: {číslo}
5. OZNAČENÍ „POUZE PRO ZVÍŘATA“
Pouze pro zvířata.
Cerenia 10 mg/ml injekční roztok pro psy a kočky Maropitantum
1 ml roztoku obsahuje 10 mg Maropitantum (jako Maropitanti citras monohydricus)
Injekční roztok
20 ml
Psi a kočky.
s.c., i.v.
Před použitím čtěte příbalovou informaci.
V případě náhodného samopodání vyhledejte ihned lékařskou pomoc a ukažte příbalovou informaci nebo etiketu praktickému lékaři.
Před použitím čtěte příbalovou informaci.
EXP: {měsíc/rok}
Po 1. otevření spotřebujte do...
11. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
12. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA
Zneškodňování odpadu: čtěte příbalovou informaci
13. OZNAČENÍ „POUZE PRO ZVÍŘATA“ A PODMÍNKY NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ, POKUD JE JICH TŘEBA
Pouze pro zvířata. Veterinární léčivý přípravek je vydáván pouze na předpis.
14. OZNAČENÍ „UCHOVÁVAT MIMO DOSAH DĚTÍ“
Uchovávat mimo dosah dětí.
15. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Zoetis Belgium SA Rue Laid Burniat 1 1348 Louvain-la-Neuve BELGIE
16. REGISTRAČNÍ ČÍSLO(A)
EU/2/06/062/005
17. ČÍSLO ŠARŽE OD VÝROBCE
Šarže{číslo}
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU MALÉ VELIKOSTI Skleněná injekční lahvička/Injekční roztok
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU_
Cerenia 10 mg/ml injekční roztok pro psy a kočky Maropitantum
2. MNOŽSTVÍ LÉČIVÉ(ÝCH) LÁTKY(EK)_
10 mg/ml
3. OBSAH VYJÁDŘENÝ HMOTNOSTÍ, OBJEMEM NEBO POČTEM DÁVEK
20 ml
4. CESTA(Y) PODÁNÍ
s.c., i.v.
5. OCHRANNÁ LHŮTA
6. ČÍSLO ŠARŽE
Šarže: {číslo}
7. DATUM EXSPIRACE
EXP: {měsíc/rok}
Po 1. otevření spotřebujte do 28 dní.
8. OZNAČENÍ „POUZE PRO ZVÍŘATA“
Pouze pro zvířata.
B. PŘÍBALOVÁ INFORMACE
1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
Držitel rozhodnutí o registraci:
Zoetis Belgium SA Rue Laid Burniat 1 1348 Louvain-la-Neuve BELGIE
Výrobce odpovědný za uvolnění šarže:
FAREVA AMBOISE Zone Industrielle,
29 route des Industries 37530 Pocé-sur-Cisse FRANCIE
2. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Cerenia 16mg tablety pro psy Cerenia 24 mg tablety pro psy Cerenia 60 mg tablety pro psy Cerenia 160 mg tablety pro psy
Maropitantum
3. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
Každá tableta obsahuje 16 mg, 24 mg, 60 mg nebo 160 mg Maropitantum jako Maropitanti citras monohydricus. Tablety také obsahují oranžovou žluť (E110) jako barvivo.
Tablety jsou světle oranžové a mají na obou stranách dělící rýhu, která umožní půlení tablety. Každá tableta je označena logem Pfizer na zadní straně. Na vrchní straně je každá polovina označená písmeny „MPT“ a znaky označující množství maropitantu.
4. INDIKACE
• Na prevenci nauzey vyvolané chemoterapií.
• Na prevenci zvracení vyvolaného kinetózou.
• Na prevenci a léčbu zvracení v kombinaci s Cerenia injekčním roztokem a v kombinaci s jinými podpůrnými opatřeními.
5. KONTRAINDIKACE
Nejsou.
Podání Cerenia při úplně prázdném žaludku může způsobit zvracení vašeho psa. Podání lehkého jídla nebo pamlsku vašemu psovi před podáním tablety může pomáhat při předcházení tomuto následku. Dlouhotrvajícímu hladovění před podáním by se mělo vyhnout.
Cerenia není sedativum a u některých psů trpících kinetózou se mohou projevit nauzee podobné příznaky během cestování jako je slinění a apatie. Tyto příznaky j sou dočasné a měly by ustoupit po skončení cesty.
Jestliže zaznamenáte jakékoliv závažné nežádoucí účinky či jiné reakce, které nejsou uvedeny v této příbalové informaci, oznamte to prosím vašemu veterinárnímu lékaři.
7. CÍLOVÝ DRUH ZVÍŘAT
Psi.
8. DÁVKOVÁNÍ PRO KAŽDÝ DRUH, CESTA(Y) A ZPŮSOB PODÁNÍ
Pro perorální podání.
Na prevenci nauzey vyvolané chemoterapií a léčbu a prevenci zvracení (mimo kinetózy), pouze pro psy starší 8 týdnů:
Na léčbu a/nebo prevenci zvracení mimo kinetózy podat Cerenia tablety jednou denně v dávce 2 mg maropitantu/kg ž.hm., použitím počtu tablet podle níže uvedené tabulky. Tablety jsou dělitelné podél dělící rýhy na tabletě.
Na prevenci zvracení by se tablety měly podat více než 1 hodinu předem. Délka účinku je přibližně 24 hodin, a proto se mohou tablety podat večer před podáním látky, která může způsobit zvracení (např. chemoterapie).
Cerenia může být použita na léčbu nebo k prevenci zvracení a to buď podáváním tablet, nebo injekčního roztoku, jednou denně. Cerenia injekční roztok může být podáván po dobu až 5 dnů a Cerenia tablety po dobu až 14 dnů.
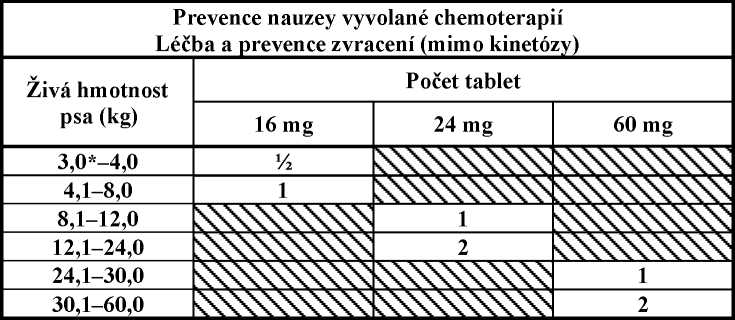
* správná dávka pro psy menší než 3 kg nemůže být přesně dosažena
Na prevenci zvracení vyvolaného kinetózou, pouze pro psy starší 16 týdnů
Na prevenci zvracení vyvolaného kinetózou podat Cerenia tablety jednou denně v dávce 8 mg maropitantu/kg ž. hm., použitím počtu tablet podle níže uvedené tabulky. Tablety jsou dělitelné podél dělící rýhy na tabletě.
Tablety by se měli podat alespoň 1 hodinu před začátkem cesty. Antiemetický účinek přetrvává nejméně 12 hodin, což pro pohodlí umožňuje aplikaci večer před časným ranním cestováním. Léčba se může opakovat maximálně po dobu 2 po sobě následujících dnů.
U některých psů při opakované léčbě mohou být dostatečné nižší dávky, než které jsou doporučené.
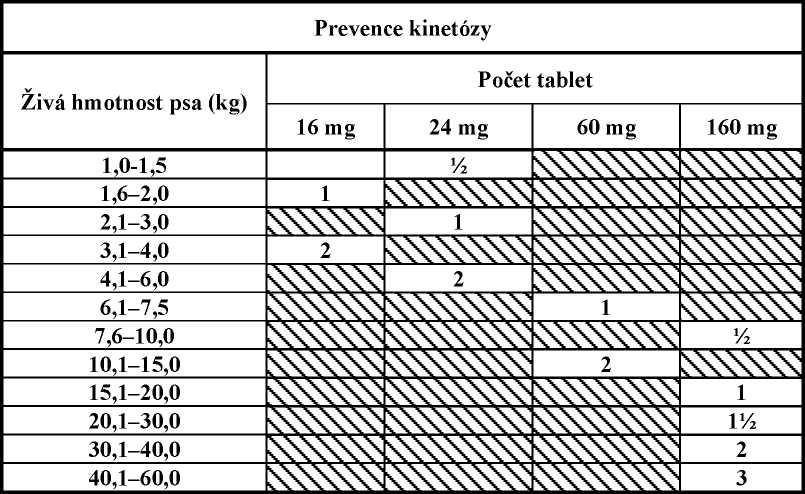
9. POKYNY PRO SPRÁVNÉ PODÁNÍ
Při vybrání tablety z blistru by měl být dodržen následující postup:
• Nejprve, přeložit nebo stříhat podél perforace mezi tabletami jak je naznačené symbolem nůžek
• Najít stahující zářez (nebo řez) jako je naznačené symbolem šipky ^.
• Pevně přidržovat jednu stranu řezu, tahat druhou stranu směrem k středu blistru dokud není vidět tabletu
• Vybrat tabletu z blistru a podat podle návodu.
Poznámka: Nevybírat tabletu tlačením přes zadní stranu blistru, protože to způsobí poškození tablety a blistru.
U kinetózy se doporučuje lehké jídlo nebo pamlsek před podáním, dlouhotrvajícímu hladovění před podáním by se mělo vyhnout. Cerenia tablety by se neměly podávat zabalené nebo obalené v jídle, protože to může zpomalit rozpuštění tablety a následně nástup účinku.
Psi by měli být po podání pečlivě sledováni, aby se zajistilo, že každá tableta je polknutá.
10. OCHRANNÁ LHŮTA
Není určeno pro potravinová zvířata.
11. ZVLÁŠTNÍ OPATŘENÍ PRO UCHOVÁVÁNÍ
Uchovávat mimo dosah dětí.
Tento veterinární léčivý přípravek nevyžaduje žádné zvláštní podmínky pro uchovávání.
Rozpůlenou tabletu uchovávejte maximálně 2 dny po vyjmutí z blistru.
Rozpůlenou tabletu vraťte do otevřeného blistru a uchovávejte v kartónové krabičce.
Nepoužívejte tento veterinární léčivý přípravek po uplynutí doby použitelnost uvedené na blistru po EXP.
12. ZVLÁŠTNÍ UPOZORNĚNÍ
Zvláštní upozornění pro každý cílový druh:
Zvracení může být spojené s vážnými a těžkými vysilujícími stavy a příčiny by se měli vyšetřit. Přípravky jako Cerenia by se měly používat v kombinaci s jinými postupy jako například dietní opatření a rehydratační léčba, dle doporučení vašeho veterinárního lékaře. Bezpečnost maropitantu při léčbě trvající déle než 5 dní nebyla u cílové skupiny (tj. mladí psi trpící virovou enteritidou) zkoumána. Pokud je léčba trvající déle než 5 dní považována za nutnou, je třeba pečlivě sledovat možné nežádoucí účinky.
Maropitant je metabolizován v játrech a proto by se měl u zvířat s jaterními onemocněními používat obezřetně. Při léčbě trvající 14 dní dochází k akumulaci maropitantu v těle zvířete kvůli metabolické saturaci. Při dlouhodobé léčbě by tak kromě jakýchkoliv nežádoucích účinků měla být sledována také funkce jater.
Zvláštní opatření pro použití u zvířat:
Bezpečnost Cerenia nebyla stanovena u psů mladších 16 týdnů pro dávku 8 mg/kg (kinetóza), a u psů mladších než 8 týdnů pro dávku 2 mg/kg (zvracení), stejně jako nebyla stanovena bezpečnost u březích a laktujících fen. Použití přípravku Cerenia u zvířat mladších 8 nebo 16 týdnů, nebo u březích a laktujících fen je možné pouze na zvážení poměru terapeutického prospěchu a rizika příslušným veterinárním lékařem.
Klinické příznaky včetně zvracení při prvním podání, zvýšené slinění a vodnatá stolice byly pozorovány při podání léku při dávce přesahující 20 mg/kg.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům:
Po použití umýt ruce. V případě náhodného požití vyhledejte ihned lékařskou pomoc a ukažte příbalovou informaci nebo etiketu praktickému lékaři.
13. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z tohoto přípravku, musí být likvidován podle místních právních předpisů.
14. DATUM POSLEDNÍ REVIZE PŘÍBALOVÉ INFORMACE
Podrobné informace o veterinárním léčivém přípravku jsou k dispozici na webové stránce Evropské lékové agentury (http://www.ema.europa.eu/)
15. DALŠÍ INFORMACE
Cerenia tablety se dodávají v blistrech obsahujících 4 tablety v balení.
Pokud chcete získat informace o tomto veterinárním léčivém přípravku, kontaktujte prosím příslušného místního zástupce držitele rozhodnutí o registraci.
1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
Držitel rozhodnutí o registraci:
Zoetis Belgium SA Rue Laid Burniat 1 1348 Louvain-la-Neuve BELGIE
Výrobce odpovědný za uvolnění šarže:
FAREVA AMBOISE Zone Industrielle,
29 route des Industries 37530 Pocé-sur-Cisse FRANCIE
2. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Cerenia 10 mg/ml injekční roztok pro psy a kočky Maropitantum
3. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
Injekční roztok obsahuje 10 mg Maropitantum v ml jako Maropitanti citras monohydricus jako čirý, bezbarvý až světležlutý roztok.
Také obsahuje metakresol jako konzervační prostředek.
4. INDIKACE
Psi
• Na léčbu a prevenci nauzey vyvolané chemoterapií.
• Na prevenci zvracení kromě případů vyvolaných kinetózou.
• Na léčbu zvracení v kombinaci s jinými podpůrnými opatřeními.
• Na prevenci perioperační nauzey a zvracení a zlepšení zotavení z celkové anestezie po užití g-opiátových receptorových agonistů morfinu
Kočky
• Na prevenci zvracení a zmírnění nauzey kromě případů vyvolaných kinetózou.
• Na léčbu zvracení v kombinaci s jinými podpůrnými opatřeními.
5. KONTRAINDIKACE
Nejsou.
6. NEŽÁDOUCÍ ÚČINKY
V místě subkutánního vpichu se může objevit bolestivost.
U koček je velmi často pozorována střední až silná odezva na injekci (zhruba u jedné třetiny koček).
Ve velmi vzácných případech se může objevit anafylaktický typ reakce (alergické otoky, kopřivka, erytém, kolaps, dušnost, bledé sliznice).
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
- velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
Jestliže zaznamenáte jakékoliv závažné nežádoucí účinky či jiné reakce, které nejsou uvedeny v této příbalové informaci, oznamte to prosím vašemu veterinárnímu lékaři.
7. CÍLOVÝ DRUH ZVÍŘAT
Psi a kočky.
8. DÁVKOVÁNÍ PRO KAŽDÝ DRUH, CESTA(Y) A ZPŮSOB PODÁNÍ
Pro subkutánní nebo intravenózní podání u psů a koček.
Cerenia injekční roztok by měl být aplikovaný subkutánně nebo intravenózně, jednou denně v dávce 1 mg/kg ž.hm. (1 ml/10 kg ž.hm). Léčba může být opakována po dobu 5 po sobě následujících dnů.
Při intravenózním podání by měl být přípravek Cerenia podán jako jednorázový bolus bez smíchání s jakoukoliv jinou kapalinou,
U psů může být Cerenia injekční roztok použit na léčbu nebo prevenci zvracení jednou denně po dobu až 5 dnů.
9. POKYNY PRO SPRÁVNÉ PODÁNÍ
Na prevenci zvracení by se měl Cerenia injekční roztok podat více než 1 hodinu předem. Délka účinku je přibližně 24 hodin a proto může být léčba podána večer před podáním látky, která může způsobit zvracení např. chemoterapie.
Kvůli častému výskytu přechodné bolesti při subkutánním vpichu by měl být použit vhodný postup k fixaci zvířat. Podávání chlazeného přípravku může zmírnit bolest při vpichu.
10. OCHRANNÁ LHŮTA
Není určeno pro potravinová zvířata.
11. ZVLÁŠTNÍ OPATŘENÍ PRO UCHOVÁVÁNÍ
Uchovávat mimo dosah dětí.
Tento veterinární léčivý přípravek nevyžaduje žádné zvláštní podmínky pro uchovávání. Doba použitelnosti po prvním otevření vnitřního obalu: 28 dní
Nepoužívejte tento veterinární léčivý přípravek po uplynutí doby použitelnost uvedené na etiketě injekční lahvičky po EXP.
12. ZVLÁŠTNÍ UPOZORNĚNÍ
Zvláštní upozornění pro každý cílový druh:
Zvracení může být spojené s vážnými, vysilujícími stavy a příčiny by se měly vyšetřit. Přípravky jako Cerenia by se měly používat v kombinaci s jinými podpornými opatřeními jako například dietní opatření a rehydratační léčba, dle doporučení vašeho veterinárního lékaře.
Maropitant je metabolizován v játrech a proto by se měl u psů a koček s jaterními onemocněními používat obezřetně. Cerenia by se měla použít obezřetně u zvířat trpících nebo majících predispozici k onemocněním srdce.
Nedoporučuje se použití Cerenia injekčního roztoku proti zvracení vyvolaného kinetózou.
Účinnost Cerenia pro zmírnění nauzey byla prokázána v modelových studiích (nauzea vyvolaná xylazinem).
Zvláštní opatření pro použití u zvířat:
Bezpečnost Cerenia nebyla stanovena u psů mladších 8 týdnů nebo u koček mladších 16 týdnů, a u březích a laktujících fen a koček. Příslušný veterinární lékař by měl zvážit přínos a riziko před použitím Cerenia u psů mladších 8 týdnů nebo u koček mladších 16 týdnů, nebo u březích nebo laktujících fen a koček.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům:
Po použití umýt ruce. V případě náhodného samopodání vyhledejte ihned lékařskou pomoc a ukažte příbalovou informaci nebo etiketu praktickému lékaři. Maropitant byl prokázán jako potenciálně dráždící oči, pokud dojde k náhodnému kontaktu s očima, vypláchněte oči dostatečným množstvím vody a vyhledejte lékařské ošetření.
Březost a laktace:
Používejte pouze po vyhodnocení přínosu a rizik ošetřujícím veterinárním lékařem, protože nebyly provedeny studie toxického vlivu na reprodukci pro žádný druh zvířete.
Interakce s dalšími léčivými přípravky a další formy interakce:
Cerenia by se neměla používat současně s blokátory Ca kanálů, protože maropitant má afinitu k Ca kanálům.
Maropitant se dobře váže na plazmatické proteiny a může soutěžit s jinými léky se silnou vazbou. Předávkování (symptomy, první pomoc, antidota):
Kromě přechodných reakcí v místě subkutánního vpichu byl Cerenia injekční roztok dobře snášen u psů a mladých koček, kterým se denně aplikovalo do 5 mg/kg (5násobek doporučené dávky) po dobu 15 po sobě následujících dní (3násobek doporučené délky podávání). Nejsou dostupná data pro předávkování u dospělých koček.
Inkompatibility:
Cerenia se nesmí míchat s jinými veterinárními léčivými přípravky ve stejné stříkačce, protože nebyla testována kompatibilita s jinými přípravky.
13. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA
O možnostech likvidace nepotřebných léčivých přípravků se poraďte s vaším veterinárním lékařem. Tato opatření napomáhají chránit životní prostředí.
14. DATUM POSLEDNÍ REVIZE PŘÍBALOVÉ INFORMACE
Podrobné informace o veterinárním léčivém přípravku jsou k dispozici na webové stránce Evropské lékové agentury (http://www.ema.europa.eu/).
15. DALŠÍ INFORMACE
Cerenia 10 mg/ml injekční roztok pro psy a kočky se dodává v 20 ml injekčních lahvičkách z tmavého skla. Každá kartonová krabička obsahuje 1 injekční lahvičku.
Pokud chcete získat informace o tomto veterinárním léčivém přípravku, kontaktujte prosím příslušného místního zástupce držitele rozhodnutí o registraci.
32