Ceplene 0,5 Mg/0,5 Ml
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Ceplene 0,5 mg/0,5 ml injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna injekční lahvička s 0,5 ml roztoku obsahuje histamini dihydrochloridum 0,5 mg. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok.
Čirý, bezbarvý vodný roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Udržovací terapie přípravkem Ceplene je indikována u dospělých pacientů s akutní myeloidní leukemií (AML) v první remisi, kteří jsou současně léčeni interleukinem-2 (IL-2). Účinnost přípravku Ceplene nebyla plně prokázána u pacientů starších 60 let.
4.2 Dávkování a způsob podání
Udržovací terapie přípravkem Ceplene by měla být podávána po dokončení konsolidační léčby u pacientů současně léčených IL-2 pod dohledem lékaře, který má zkušenosti s léčbou akutní myeloidní leukemie.
Dávkování
Pokyny týkající se dávkování přípravku Ceplene v kombinaci s IL-2 jsou uvedeny níže.
Interleukin-2 (IL-2)
IL-2 se podává dvakrát denně subkutánní injekcí 1 až 3 minuty před podáním přípravku Ceplene; jedna dávka IL-2 činí 16 400 IU/kg (1 pg/kg).
Interleukin-2 (IL-2) je komerčně dostupný ve formě rekombinantního IL-2; aldesleukinu. Následující pokyny pro přípravu a uchovávání jsou specifické pro aldesleukin.
IL-2 (aldesleukin) má být asepticky rekonstituován, ředěn a připraven v polypropylenových tuberkulinových injekčních stříkačkách s krytem v lékárně na základě tělesné hmotnosti daného pacienta (viz tabulka pro podávání aldesleukinu níže) v doporučené dávce 16 400 IU/kg (1 pg/kg). Pacientům může být pro domácí aplikaci vydána zásoba předplněných tuberkulinových injekčních stříkaček s krytem až na dva týdny, s poučením, že injekční stříkačky musí být před podáním uchovávány v chladničce při teplotě 2°C - 8°C.
Studie prokázaly chemickou stabilitu a sterilitu naředěného aldesleukinu (připraveného v tuberkulinových injekčních stříkačkách s nasazeným krytem) po dobu až tří týdnů po přípravě v kontrolovaných aseptických podmínkách a při uchovávání v chladničce při teplotě 2°C - 8°C.
POZN.: Příprava aldesleukinu musí probíhat za kontrolovaných aseptických podmínek.
Příprava naředěného IL-2 (aldesleukinu) pro jednotlivého pacienta
Naředěný IL-2 (aldesleukin) se asepticky natáhne do sterilních polypropylenových tuberkulinových injekčních stříkaček a nasadí se kryt pro každého pacienta v dávce 1 pg/kg, s minimálním standardním objemem dávky 0,25 ml (50 pg) a maximální dávkou 0,5 ml (100 pg). Objemy dávky dle hmotnosti pacienta jsou uvedeny níže v Tabulce 1. Tato tabulka též uvádí objem nutný v případě, že je předepsáno 20% snížení dávky.
Tabulka 1: Dávkovači tabulka IL-2 (aldesleukinu)
|
Tělesná hmotnost pačienta (kg) |
Standardní dávkováni (pg) |
Objem injekce* (ml) |
Objem injekce při 20% snížení dávky (ml)** |
|
<50 |
50 |
0,25 |
0,20 |
|
>50 až <60 |
60 |
0,30 |
0,25 |
|
>60 až <70 |
70 |
0,35 |
0,30 |
|
>70 až <80 |
80 |
0,40 |
0,30 |
|
>80 až <90 |
90 |
0,45 |
0,35 |
|
>90 až <100 |
100 |
0,50 |
0,40 |
|
>100 |
100 |
0,50 |
0,40 |
* Objem injekce se zaokrouhlí na nejbližších 0,05 ml
** Objem injekce při 20 % snížení dávky je zaokrouhlen, takže skutečné snížení dávky se může pohybovat mezi 15% - 25%
0,5 ml roztoku představuje dostačující jednotlivou dávku (viz oddíl 6.6).
Injekce přípravku Ceplene se aplikuje 1 až 3 minuty po každé injekci IL-2. Každá 0,5ml dávka přípravku Ceplene se injekčně aplikuje pomalu po dobu 5-15 minut.
Léčebné cykly
Přípravek Ceplene a IL-2 se podávají v 10 léčebných cyklech: každý cyklus se skládá z 21 dnů léčby (3 týdny), které jsou následovány třítýdenním nebo šestitýdenním obdobím bez léčby.
Cykly 1-3 se skládají ze 3 týdnů léčby, které jsou následovány 3týdenním obdobím bez léčby. Cykly 4-10 se skládají ze 3 týdnů léčby, které jsou následovány 6týdenním obdobím bez léčby.
Doporučený režim dávkování je uveden v tabulce 2 a 3.
Tabulka 2: Pro cykly 1-3 léčby přípravkem Ceplene a IL-2
|
Číslo týdne (t)* |
Léčba* | ||
|
Cyklus 1 |
Cyklus 2 |
Cyklus 3 | |
|
t.1 až t.3 (dny 1-21) |
t.7 až t.9 (dny 1-21) |
t.13 až t.15 (dny 1-21) |
IL-2 16 400 IU/kg a následně 0,5 ml přípravku Ceplene. Dvakrát denně. |
|
t.4 až t.6 |
t.10 až t.12 |
t.16 až t.18 |
Bez léčby (3 týdny) |
|
* podmínky úpravy dávek a dáv |
kovacího rozvrhu jsou uvedeny v úpravě dávkování | ||
Tabulka 3: Pro cykly 4-10 léčby přípravkem Ceplene a IL-2 - stejně jako v tabulce 2 výše s výjimkou čísel cyklů a délkou trvání klidových intervalů
|
Číslo týdne (t)* |
Léčba* | ||||||
|
Cykly | |||||||
|
4 |
5 |
6 |
7 |
8 |
9 |
10 | |
|
t.19 |
t.28 |
t.37 |
t.46 |
t.55 |
t.64 |
t.73 |
IL-2 16 400 IU/kg a následně 0,5 ml |
|
až |
až |
až |
až |
až |
až |
až |
přípravku Ceplene. Dvakrát denně. |
|
t.21 |
t.30 |
t.39 |
t.48 |
t.57 |
t.66 |
t.75 | |
|
t.22 |
t.31 |
t.40 |
t.49 |
t.58 |
t.67 |
t.76 |
Bez léčby (6 týdnů) |
|
až |
až |
až |
až |
až |
až |
až | |
|
t.27 |
t.36 |
t.45 |
t.54 |
t.63 |
t.72 |
t.81 | |
podmínky úpravy dávek a dávkovacího rozvrhu j sou uvedeny v úpravě dávkování
Úprava dávkování
U pacientů by měl být sledován výskyt očekávaných symptomatických nežádoucích účinků a laboratorních změn, které jsou spojeny s touto léčbou. Dávky přípravku Ceplene a IL-2 je třeba upravit podle potřeby na základě individuální tolerance léčby ze strany pacienta. Doporučuje se provést úpravu dávkování v časném stadiu léčby. Redukce dávek mohou být dočasné nebo trvalé. Pokud se objeví známky toxicity související s přípravkem Ceplene (jako hypotenze, bolest hlavy), doba aplikace injekce může být prodloužena z 5 minut na maximální délku trvání 15 minut.
Pro pacienty, kteří vykazují známky toxicity stupně 1
Žádná doporučená změna dávkování s výjimkou neurologické toxicity stupně 1 a generalizované toxické dermatitidy stupně 1. Doporučené dávkování pro tyto známky toxicity stupně 1 je uvedeno v příslušném odstavci níže:
Pro pacienty, kteří vykazují známky neurologické toxicity stupně 1 - 4
- při toxicitě stupně 1 až 3 by měla být léčba přerušena až do doby, než je dosaženo toxicity stupně 0. Poté by měla léčba pokračovat při snížení dávky přípravků Ceplene i IL-2 o
20 %;
- při toxicitě stupně 4 by mělo být zváženo přerušení léčby.
Pro pacienty, kteří vykazují známky generalizované toxické dermatitidy stupně 1 - 4
- při toxicitě stupně 1 by měla být léčba odložena o 48 hodin, nebo dokud nevymizí všechny příznaky. Poté by měla léčba pokračovat s použitím plné dávky přípravku Ceplene, ale dávky IL-2 snížené o 20 %;
- při toxicitě stupně 2 by měla být dávka IL-2 snížena o 50 % a opět zvýšena na plnou dávku pouze v případě, že se příznaky znovu neobjeví. Mezi dávkami přípravku Ceplene a IL-2 by měl být 60minutový interval, který by se měl dodržovat po celou dobu léčby;
- při toxicitě stupně 3 a 4 by léčba měla být přerušena a neměla by pokračovat až do doby vymizení příznaků. Léčba by měla pokračovat teprve po zvážení rizik a přínosů pro pacienta.
Pro pacienty, kteří vykazují známky toxicity stupně 2 (včetně toxicity pro srdeční funkce, renální, hepatální toxicity)
- léčba by měla být přerušena do doby, než se příznaky vrátí ke stupni 1;
- doba aplikace injekce dávky přípravku Ceplene by měla být prodloužena na maximálních 15 minut;
- v případě srdeční, hepatální nebo renální toxicity by dávky přípravků Ceplene i IL-2 měly být sníženy o 20%.
Pro pacienty, kteří vykazují známky toxicity stupně 3 a 4 (včetně hypotenze, arytmie)
- léčba by měla být přerušena do doby vymizení příznaků. K úpravě příznaků toxicity stupně 3 a 4 může být zváženo odložení léčby maximálně o jeden léčebný cyklus.
Při trvalé hypotenzi, bolesti hlavy, arytmii, srdeční, hepatální a renální toxicitě
- doba aplikace injekce dávky přípravku Ceplene by měla být prodloužena na maximálních 15 minut;
- dávky přípravku Ceplene i IL-2 by měly být sníženy o 20%.
- podávání IL-2 může být přerušeno na 24 hodin a poté lze znovu začít s jeho podáváním při 20% snížení dávky.
Abnormální počty bílých krvinek (WBC)
- dávka IL-2 může být snížena o 20% po zbývající dobu léčebného cyklu, a pokud se objeví abnormální počty bílých krvinek znovu během následujícího cyklu, doporučuje se trvalé snížení dávky IL-2.
Lokalizovaná toxická dermatitida
- léčba by měla být přerušena do doby vymizení příznaků. Léčba může pokračovat podáváním plné dávky přípravku Ceplene a 50% dávky IL-2.
Zvláštní skupiny _pacientů
Porucha funkce ledvin
Pacienti s poruchou funkce ledvin mohou být citlivěj ší k vlivům přípravku Ceplene na pokles krevního tlaku. Ačkoliv stupeň renálního poškození nemá žádný prokazatelný efekt na farmakokinetiku přípravku Ceplene, je třeba zvýšená opatrnost při podávání přípravku Ceplene pacientům s těžkou poruchou funkce ledvin. Běžně se však nedoporučuje žádné snížení dávky přípravku Ceplene u pacientů s poruchou funkce ledvin.
Přípravek Ceplene by měl být užíván opatrně u pacientů se středně těžkou až těžkou poruchou funkce jater (viz bod 5.2). Plazmatické hladiny přípravku Ceplene jsou u pacientů se středně těžkou až těžkou poruchou funkce jater vyšší a tyto skupiny pacientů mají větší sklon k tachykardii a snížení krevního tlaku po podání dávky přípravku Ceplene než pacienti s normálními jaterními funkcemi nebo pacienti s lehkou poruchou funkce. Výskyt nežádoucích účinků ovšem nelze předvídat na základě plazmatických hladin léčiva a účinky nekorelují úzce s expozicí léčivu. Redukce dávky přípravku Ceplene u pacientů s poruchou funkce jater není běžně doporučována, ale u těchto pacientů je třeba dbát zvýšené opatrnosti.
Pediatrická populace
Bezpečnost a účinnost přípravku Ceplene u dětí mladších 18 let nebyla dosud stanovena. K dispozici nejsou žádné údaje.
Způsob podání
Přípravek Ceplene je pouze pro subkutánní podání.
Jednu až tři minuty po dokončení subkutánního podání IL-2 by měl být podán přípravek Ceplene pomalou subkutánní injekcí rychlostí nepřesahující 0,1 ml (0,1 mg histamin-dihydrochloridu) za minutu. Obvyklá doba podání 0,5ml dávky přípravku Ceplene je 5 minut. Pro omezení potenciálních nežádoucích účinků může být doba podání prodloužena na maximálně 15 minut, viz níže. Přípravek Ceplene může být podán přes ambulantní injekční infuzní pumpu nebo kontrolovanou manuální subkutánní injekcí injekční stříkačkou s časovačem.
První dávka přípravku Ceplene a IL-2 v den 1 zahájení prvního cyklu léčby by měla být podána ve zdravotnickém zařízení pod přímým dohledem lékaře. Sledování pacienta během dne 1 by mělo zahrnovat sledování vitálních funkcí, včetně pulsu, krevního tlaku a dechové frekvence. Pokud se u pacienta objevují významné změny ve vitálních funkcích, měl by lékař posoudit stav pacienta a pokračovat ve sledování vitálních funkcí; tito pacienti by měli být během následující léčby sledováni.
Další injekce přípravku Ceplene mohou být aplikovány doma samotným pacientem, jenž prokáže, že dobře rozumí nezbytným opatřením a že je dostatečně zručný v aplikaci injekce.
Injekce by měly být pokud možno aplikovány pod dohledem, v přítomnosti dospělého člena rodiny, přítele nebo jiného pečovatele, který je schopen adekvátně reagovat v případě, že se objeví známky či příznaky hypotenze.
Preferovaná místa pro injekce jsou stehna a břicho. Přípravek Ceplene by neměl být aplikován do stejné anatomické oblasti jako IL-2.
Dávky IL-2 a přípravku Ceplene dvakrát denně by měly být odděleny minimálně 6hodinovým intervalem. Po injekci přípravku Ceplene by pacienti měli zůstat 20 minut v klidu.
Návod k rekonstituci a naředění interleukinu-2 (aldesleukin) před podáním, viz bod 6.6.
4.3 Kontraindikace
• Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
• Pacienti s významně sníženou srdeční funkcí, např. třída NYHA III/IV.
• Pacienti léčení systémovými steroidy, klonidinem a H2 blokátory.
• Pacienti po alogenní transplantaci kmenových buněk.
• Těhotenství.
• Kojení.
4.4 Zvláštní upozornění a opatření pro použití
Přípravek Ceplene by měl být podáván 1 až 3 minuty po podání IL-2, nikoliv současně.
Rychlá podkožní injekce nebo injekce do cévního prostoru může vyústit v závažnou hypotenzi, tachykardii nebo synkopu.
Léčba přípravkem Ceplene současně s IL-2 by měla být prováděna opatrně u pacientů se špatně kompenzovanými srdečními funkcemi. U pacientů s onemocněním srdce by měla být echokardiograficky nebo zátěžovou scintigrafií ověřena ejekční frakce a funkce stěny a poté by měli být opatrně léčeni.
Pacienti by měli být v průběhu léčby sledováni kvůli možným klinickým komplikacím v důsledku hypotenze nebo hypovolemie. Přípravek Ceplene by měl být v den 1 úvodního léčebného cyklu podáván ve zdravotnickém zařízení pod dohledem lékaře. Sledování pacienta během dne 1 by mělo zahrnovat sledování vitálních funkcí, včetně pulsu, krevního tlaku a dechové frekvence.
Sledování pacienta během následné léčby by mělo být prováděno tak dlouho, dokud pacient vykazuje významné změny ve vitálních funkcích při podávání přípravku Ceplene. Pokud jsou v následných léčebných cyklech pozorovány závažné příznaky hypotenze nebo jiné související příznaky, mělo by být zahájeno snižování dávky, a pokud je to nutné, přípravek by měl být podáván za hospitalizace, dokud odpověď na léčbu nedovolí aplikaci léku doma.
Je třeba opatrnosti u pacientů trpících některým z následujících stavů: symptomatické onemocnění periferních tepen, prodělaná nebo probíhající peptická vředová choroba nebo vředová choroba jícnu s anamnézou krvácení, klinicky významné onemocnění ledvin a cévní mozková příhoda v posledních 12 měsících. Tam, kde je to vhodné, by měla být zvážena současná léčba inhibitorem protonové pumpy.
Zvláštní pozornost by měla být věnována léčbě pacientů s klinicky významnou infekcí, která vyžaduje podání antibiotik, antimykotik nebo antivirotik, nebo pacientů, kteří ukončili protiinfekční terapii v průběhu 14 dnů před zahájením léčby, pokud nešlo o profylaktické použití antibiotik a antivirotik.
Pacienti s předchozí anamnézou autoimunitní choroby (včetně systémového lupusu, zánětlivých střevních onemocnění, psoriázy a revmatoidní artritidy) by měli být léčeni se zvýšenou opatrností. Doporučuje se sledovat výsledky laboratorních vyšetření zahrnujících hematologické testy a biochemické krevní testy.
Pacienti užívající následující léčivé přípravky by měli být léčeni se zvýšenou opatrností (viz bod 4.5):
- Beta-blokátory nebo jiná antihypertenziva
- Hj blokátory a neuroleptika (antipsychotika) s blokujícím účinkem na H receptory
- Tricyklická antidepresiva, která mohou mít blokující účinek na Hj a H2 receptory
- Inhibitory monoaminooxidázy a antimalarika a léčiva proti trypanosomám
- Látky blokující neuromuskulární přenos, narkotická analgetika a různé kontrastní látky.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Při odlišném dávkování, kdy je přípravek Ceplene používán současně s IL-2, by lékaři měli nahlédnout také do souhrnu údajů o přípravku (SPC) pro IL-2 a sledovat interakce tohoto léčivého přípravku.
Antagonisté H2 receptorů s imidazolovou strukturou podobnou histaminu, např. cimetidin, systémové steroidy a klonidin, nesmí být během léčby přípravkem Ceplene užívány (viz bod 4.3).
Beta-blokátory a další antihypertenziva by měly být v průběhu léčby přípravkem Ceplene užívány se zvýšenou opatrností. Současné podávání léčivých přípravků vykazujících kardiotoxicitu nebo snižujících krevní tlak může zvyšovat toxicitu přípravku Ceplene.
Pacienti by se měli vyhnout užívání antihistaminik blokujících Hi receptory nebo neuroleptik (antipsychotik) s blokujícími účinky na H1 receptory, které by mohly snižovat účinnost přípravku Ceplene.
Pacienti by se měli vyhnout užívání tricyklických antidepresiv, která mohou mít blokující účinky na H1 a H2 receptory.
Pacienti by se měli vyhnout užívání inhibitorů monoaminooxidázy, antimalarik a léčiv proti trypanozomám, jejichž účinné látky mohou měnit metabolizaci přípravku Ceplene (viz bod 4.4).
Bylo zaznamenáno, že látky blokující neuromuskulární přenos, narkotická analgetika a různé kontrastní látky mohou vyvolat uvolnění endogenního histaminu; u pacientů, kteří podstupují diagnostickou či chirurgickou proceduru, by před touto procedurou měl proto být vzat v úvahu přídatný efekt léčby přípravkem Ceplene (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Antikoncepce u mužů a žen
Ženy ve fertilním věku a sexuálně aktivní muži musí během léčby přípravkem Ceplene a IL-2 používat účinnou antikoncepci.
Klinické údaje o podávání přípravku Ceplenu během těhotenství nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu, ale jen v dávkách toxických pro matku, a nenaznačily žádné přímé škodlivé účinky na průběh těhotenství, embryonální/fetální vývoj, porod nebo postnatální vývoj (viz bod 5.3). Přípravek Ceplene současně s IL-2 nesmí být užíván během těhotenství.
Kojení
Není známo, zda je histamin u lidí vylučován do mateřského mléka. Vylučování histaminu do mléka nebylo studováno na zvířatech, ale potomstvo potkaních samic, kterým byla podávána toxická dávka, vykazovalo lehké známky toxicity v průběhu časné laktace (viz bod 5.3). Přípravek Ceplene současně s IL-2 nesmí být užíván v průběhu kojení.
Pro informace o používání IL-2 během těhotenství a kojení nahlédněte do souhrnu údajů o přípravku pro IL-2.
Fertilita
Nejsou k dispozici žádné klinické údaje o účincích přípravku Ceplene na fertilitu. Studie na zvířatech neukázaly žádné nežádoucí účinky na fertilitu kromě mírného snížení počtu implantací a životaschopných plodů (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Ceplene má malý nebo mírný vliv na schopnost řídit nebo obsluhovat stroje. Podání přípravku Ceplene může způsobit hypotenzi, a tím točení hlavy, závratě a rozmazané vidění. Pacienti by neměli řídit ani obsluhovat přístroje nebo stroje nejméně 1 hodinu po podání injekce přípravku Ceplene.
4.8 Nežádoucí účinky
Akutní mveloidní leukemie
Nežádoucí účinky, které byly hodnoceny jako přinejmenším možná související s léčbou IL-2 a přípravkem Ceplene, byly hlášeny téměř u všech pacientů ve studiích týkajících se AML.
Nejčastějšími nežádoucími účinky, které se objevily u 30 % či více pacientů léčených IL-2 a přípravkem Ceplene (seřazeny podle klesající frekvence), byly: zčervenání, bolesti hlavy, únava, granulom v místě injekce, horečka a erytém v místě injekce.
Nežádoucí účinky, které jsou považovány přinejmenším možná související s léčbou nízkými dávkami IL-2 s přípravkem Ceplene ve studiích týkajících se AML (n=280 pro rameno léčby IL-2 a přípravkem Ceplene), jsou uvedeny níže, seřazené podle třídy orgánových systémů a frekvence. V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti. Frekvence jsou definovány jako velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1 000 až <1/100), vzácné (> 1/10 000 až <1/1 000) a velmi vzácné (<1/10 000). Nežádoucí účinky, které byly zjištěny pouze během postmarketingového sledování a pro které nemůže být frekvence odhadnuta, jsou uvedeny v části "není známo".
|
Třídy orgánových systémů |
velmi časté |
časté |
|
Poruchy krve a lymfatického systému |
eozinofilie, trombocytopenie |
leukopenia, neutropenie |
|
Infekční a parazitární onemocnění |
infekce horních cest dýchacích | |
|
Poruchy metabolismu a výživy | ||
|
Psychiatrické poruchy | ||
|
Poruchy nervového systému |
bolest hlavy, závratě, dysgeuzie | |
|
Srdeční poruchy |
palpitace | |
|
Cévní poruchy |
zčervenání, hypotenze | |
|
Respirační, hrudní a mediastinální poruchy |
nosní kongesce | |
|
Gastrointestinální poruchy |
zvracení, bolest v horní části břicha, sucho v ústech, gastritida, abdominální distenze | |
|
Poruchy kůže a podkožní tkáně |
erytém, zvýšené pocení, noční poty, pruritus | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
artralgie, myalgie |
bolesti končetin, bolesti zad |
|
Celkové poruchy a reakce v místě aplikace |
granulom v místě injekce, únava, horečka, zarudnutí v místě injekce, pocit tepla, reakce v místě injekce, svědění místa injekce, onemocnění podobné chřipce, zimnice, zánět v místě injekce, bolest v místě injekce |
kopřivka v místě injekce, podlitina v místě injekce, vyrážka v místě injekce, otok v místě injekceastenie, bolesti na hrudi |
Další onkologické studie (pokročilých nádorových onemocnění)
Podávání přípravku Ceplene a nízkých dávek IL-2 bylo studováno také v dalších klinických studiích s odlišným dávkováním (1,0 mg histamin-dihydrochloridu dvakrát denně) a s odlišnými dávkovacími režimy nízkých dávek IL-2 a interferonu-alfa. Následující nežádoucí účinky, které nebyly uvedeny výše, přinejmenším možná související se studovaným léčivým přípravkem:
|
Třídy orgánových systémů |
velmi časté (> 1/10) |
časté (> 1/100 do < 1/10) |
|
Poruchy krve a lymfatického systému | ||
|
Endokrinní poruchy |
hypotyreóza | |
|
Poruchy metabolismu a výživy |
snížená chuť k jídlu |
dehydratace |
|
Psychiatrické poruchy | ||
|
Poruchy nervového systému |
parestézie | |
|
Poruchy ucha a labyrintu | ||
|
Cévní poruchy | ||
|
Respirační, hrudní a mediastinální poruchy |
sípání | |
|
Gastrointestinální poruchy |
zácpa, distenze břicha, stomatitida | |
|
Poruchy kůže a podkožní tkáně |
suchá kůže | |
|
Celkové poruchy a reakce v místě aplikace |
malátnost, periferní otoky |
fibróza v místě injekce, bolest |
|
Vyšetření |
Úbytek tělesné hmotnosti |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Podání přípravku Ceplene nebo IL-2 rychlou infuzí nebo do cévního prostoru, ve vyšším dávkování, než je doporučeno, může umocnit nežádoucí účinky spojené s užíváním přípravku Ceplene.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Imunostimulancia, jiná imunostimulancia, ATC kód: L03AX14. Mechanismus účinku
Ceplene/IL-2 je imunoterapie, které pomáhá indukovat imunitním systémem zprostředkované zničení reziduálních myeloidních leukemických buněk a tím zabránit relapsu leukemie. Přípravek Ceplene hraje roli v ochraně lymfocytů, zvláště NK buněk a T buněk, které jsou zodpovědné za imunitním systémem zprostředkované zničení reziduálních leukemických buněk. Role IL-2 spočívá v nastartování funkcí NK buněk a T buněk aktivací antileukemických schopností těchto buněk a v zmnožení těchto buněčných populací indukcí proliferační části buněčného cyklu.
Farmakodynamické účinky
Mechanismus, kterým přípravek Ceplene vylepšuje antileukemické funkce lymfocytů v případě AML, ještě nebyl kompletně rozpoznán; předpokládá se, že působí inhibici reaktivních kyslíkových radikálů (ROS), které jsou syntetizovány v monocytech/makrofázích a v granulocytech. Je známo, že ROS omezují antileukemické účinky aktivátorů lymfocytů, jakým je i IL-2, tím, že spouští kaskády reakcí způsobujících dysfunkci NK a T buněk a jejich zánik apoptózou. Přípravek Ceplene inhibuje NADPH oxidázu, která zahajuje vznik a uvolnění ROS z fagocytů. Inhibicí funkce této oxidázy a následným snížením produkce ROS přípravek Ceplene chrání NK buňky a T buňky aktivované pomocí IL-2 před útlumem jejich funkcí a apoptózou, které jsou vyvolány volnými kyslíkovými radikály. Současné podávání přípravků Ceplene a IL-2 tak napomáhá optimalizaci antileukemických funkcí NK a T buněk.
Klinická účinnost a bezpečnost
Byly provedeny dvě klinické studie, které měly ověřit účinnost přípravku Ceplene při udržení remise u dospělých pacientů s AML. Studie AML-1 byla exploratorní, zahrnovala 39 pacientů s AML v remisi a jejím cílem bylo určit dávku a vhodný způsob aplikace přípravku Ceplene společně s IL-2. Výsledky této pilotní studie byly použity k návrhu a realizaci mezinárodní studie fáze 3. Randomizovaná studie fáze 3 (0201) porovnávala léčbu přípravkem Ceplene+IL-2 oproti nepoužití žádné léčby u 261 pacientů v první remisi (CR1) a u dalších 59 pacientů v remisi, která následovala po relapsu (CR>1). U pacientů CR1 vzrostla průměrná doba přežití bez známek leukemie z 291 dní (9,7 měsíce) na 450 dní (15 měsíců) při léčbě přípravkem Ceplene/IL-2 ve srovnání se skupinou bez udržovací léčby (ITT, p=0,01, n=261). Pacientů, u kterých nedošlo k relapsu leukemie po 3 roky, bylo 40 % po léčbě přípravkem Ceplene+IL-2 ve srovnání s 26 % pacientů, kteří nedostávali tuto léčbu
(p=0,01).
Tento léčivý přípravek byl registrován za „výjimečných okolností“ Znamená to, že vzhledem k vzácnosti onemocnění, pro které je indikován, nebylo možné získat úplné informace o prospěšnosti a rizicích tohoto léčivého přípravku. Evropská agentura pro léčivé přípravky každoročně vyhodnotí jakékoli nové informace, které budou dostupné, a tento souhrn údajů o přípravku bude podle potřeby aktualizován.
Pediatrická populace
Ceplene je určen pro použití u dospělých. Údaje o farmakodynamických vlastnostech u dětí mladších 18 let nejsou k dispozici.
5.2 Farmakokinetické vlastnosti
Absorpce
Histamin se po subkutánní injekci rychle vstřebává. Maximální plazmatické koncentrace dosahuje přibližně za 10 minut po ukončení subkutánní infuze. Koncentrace a farmakokinetika histaminu se napříč studiemi významně lišily, stejně jako ve skupinách zdravých dobrovolníků a pacientů.
Distribuce
Pacienti vykazovali ve srovnání se zdravými subjekty větší stupeň variability systémové expozice. Celkový stupeň systémové expozice přípravku Ceplene byl větší u pacientů oproti zdravým jedincům. Tento rozdíl však nebyl statisticky významný.
Není známo, zda histamin prochází placentou.
Biotransformace/Eliminace
Histamin je vylučován metabolizací v ledvinách, játrech a dalších tkáních. Hlavní enzymy, které se podílejí na metabolismu histaminu, jsou HNMT (histamin-N-methyltransferáza) a DAO (diaminoxidáza). Metabolity jsou vylučovány především močí. Průměrný poločas se u pacientů pohyboval od 0,75 do 1,5 hodiny.
Věk ani tělesná hmotnost nemají významný vliv na farmakokinetické vlastnosti histaminu. Clearance přípravku Ceplene je u žen téměř dvojnásobná, což má za následek podstatně nižší systémovou expozici než u mužů.
Porucha funkce ledvin
Farmakokinetika histaminu je u zdravých dobrovolníků s normální funkcí ledvin srovnatelná s farmakokinetikou u dobrovolníků s lehkou, středně těžkou či těžkou poruchou funkce ledvin. U osob s těžkou poruchou funkce ledvin se objevoval pokles systolického i diastolického tlaku při plazmatických koncentracích histaminu, které nepůsobily znatelný pokles krevního tlaku u ostatních osob. Osoby s těžkou poruchou funkce ledvin tedy mohou být náchylnější k účinkům exogenně podaného histaminu na snížení krevního tlaku než osoby s normálními jaterními funkcemi nebo osoby s lehkou nebo středně těžkou poruchou funkce ledvin. I když stupeň poruchy funkce ledvin má jen malý vliv na farmakokinetickou dostupnost histaminu, při jeho podávání pacientům s těžkou poruchou funkce ledvin je třeba dbát zvýšené opatrnosti.
Porucha funkce jater
Byla provedena studie, která se zabývala farmakokinetikou histaminu u zdravých dobrovolníků ve srovnání s pacienty s lehkou, středně těžkou a těžkou poruchou funkce jater. Nebyly pozorovány žádné významné rozdíly v bezpečnostních parametrech či farmakodynamice. Plazmatické koncentrace histaminu byly značně variabilní a byly znatelně vyšší ve skupině pacientů se středně těžkou nebo těžkou poruchou funkce jater (mediány 10krát, respektive 5krát vyšší než u zdravých dobrovolníků). Pacienti s jakoukoli poruchou funkce jater mohou mít tachykardii nebo hypotenzi po dobu 30-60 minut po podání přípravků Ceplene+IL-2.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií týkajících se toxicity po opakovaném podávání, lokální snášenlivosti a genotoxicity neodhalily žádné zvláštní riziko pro člověka. Účinky v neklinických studiích byly pozorovány pouze po expozicích dostatečně převyšujících maximální expozici u člověka, což svědčí o malém významu při klinickém použití. Pro přípravek Ceplene nebyly provedeny žádné studie kancerogenity.
Histamin-dihydrochlorid nebyl teratogenní u potkanů ani králíků v dávkách působících několikasetnásobně vyšší systémovou expozici, než je expozice klinická. U potkaních samic, které dostávaly dávky od doby před pářením až do 7. dne gestace, došlo k mírnému snížení počtu implantací a životaschopných plodů, ale bez závislosti na velikosti dávky a v rozsahu, který odpovídal údajům z historických kontrol. Ve studii peri-postnatálního vývoje vyvolávaly vysoké dávky histamin-dihydrochloridu toxicitu u matky a potomci vykazovali toxicitu během laktace (méně živých mláďat ve dni 21 ve srovnání s laktací v den 4), ale nikoli po odstavení.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Chlorid sodný
Hydroxid sodný (k úpravě pH)
Kyselina chlorovodíková (k úpravě pH)
Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
Neotevřené injekční lahvičky 3 roky
6.4 Zvláštní opatření pro uchovávání
Ceplene
Chraňte před mrazem.
Tnterleukin-2 (IL-2; aldesleukin)
Naředěný IL-2 (aldesleukin) vydávaný v polypropylenových tuberkulinových injekčních stříkačkách s krytem se uchovává v chladničce (2°C - 8°C).
6.5 Druh obalu a velikost balení
2ml skleněné injekční lahvičky typu I s bromobutylovou gumovou zátkou a hliníkovým flip-off odklápěcím krytem, obsahující 0,5 ml roztoku (0,70 ml včetně přeplnění).
Jedna krabička obsahuje 14 injekčních lahviček.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Ceplene
Injekční lahvičky obsahují 0,70 ml roztoku (včetně přeplnění) k usnadnění nabrání jednotlivé 0,5 ml dávky.
Pacienti by měli být vybaveni polypropylenovými injekčními stříkačkami s krytem a poučeni, jak nabrat 0,5 ml roztoku do injekční stříkačky.
Roztok by měl být před aplikací vizuálně zkontrolován, zda neobsahuje částečky nebo zda nedošlo ke změně barvy. Roztok musí být čirý a bezbarvý.
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Tnterleiikin-2 (IL-2: aldesleukin)
Naředěný IL-2 vydávaný v polypropylenových tuberkulinových injekčních stříkačkách s krytem se připravuje v lékárně za kontrolovaných aseptických podmínek a uchovává v chladničce při teplotě 2°C - 8°C.
Prvotní rekonstituce
Jedna injekční lahvička aldesleukinu (1,3 mg v lahvičce) se asepticky rekonstituuje v 1,2 ml vody na injekci (viz Souhrn údajů o přípravku komerčně dostupného aldesleukinu). Ředící roztok nasměrujte proti stěně lahvičky, aby se předešlo nadměrnému pěnění. Jemně lahvičkou otáčejte, aby se usnadnilo úplné rozpuštění prášku. Během celého postupu rekonstituce lahvičkou NETŘEPEJTE. Výsledný roztok obsahuje 22 x 106 TU (1300 pg) aldesleukinu v 1,2 ml.
Následné ředění na 200 us/ml
Celý obsah rekonstituované lahvičky (1,2 ml) se dále asepticky naředí injekčním roztokem 5,3 ml glukózy 5% w/v na celkový objem 6,5 ml poskytující finální koncentraci 200 pg/ml (3,3 x 106 TU/ml) TL-2 (aldesleukinu).
Po rekonstituci a ředění dle pokynů uvedených v bodě 4.2 byla stabilita naředěného IL-2 (aldesleukinu) v tuberkulinových injekčních stříkačkách s krytem prokázána po dobu až 21 dnů při uchovávání v chladničce při teplotě (2°C - 8°C).
Návod pro přípravu IL-2 viz bod 4.2.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Meda AB Box 906 SE 170 09 Solna Švédsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/08/477/001
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 07/10/2008 Datum prodloužení registrace: 26/08/2013
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
A. VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
E. ZVLÁŠTNÍ POVINNOST USKUTEČNIT POREGISTRAČNÍ OPATŘENÍ PRO REGISTRACI PŘÍPRAVKU ZA VÝJIMEČNÝCH OKOLNOSTÍ
VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
A.
Název a adresa výrobce odpovědného za propouštění šarží
Labiana Pharmaceuticals, S.L.U.
C/ Casanova, 27-31
08757 Corbera de Llobregat (Barcelona)
Španělsko
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2)
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci dále předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky:
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
E. ZVLÁŠTNÍ POVINNOST USKUTEČNIT POREGISTRAČNÍ OPATŘENÍ PRO REGISTRACI PŘÍPRAVKU ZA VÝJIMEČNÝCH OKOLNOSTÍ
Tato registrace byla schválena za „výjimečných okolností“, a proto podle článku 14(8) nařízení (ES) č. 726/2004 držitel rozhodnutí o registraci uskuteční v daném termínu následující opatření:
|
Popis |
Termín splnění |
|
Vyhodnotit minimální reziduální nemoc (MRN) na začátku a v návaznosti na |
Výroční |
|
klinické studie nebo registr, podle potřeby, aby mohla být stanovena antileukemická aktivita přípravku Ceplene plus Interleukin-2 na dostatečném počtu dospělých pacientů rozdělených podle věku na starší či mladší 60 let s akutní myeloidní leukemií v první kompletní remisi |
zprávy v rámci každoročního přehodnocení |
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Ceplene 0,5 mg/0,5 ml injekční roztok Histamini dihydrochloridum
2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK
Jedna injekční lahvička s 0,5 ml roztoku obsahuje 0,5 mg histamin-dihydrochloridu.
3. SEZNAM POMOCNÝCH LÁTEK
Chlorid sodný, voda na injekci a hydroxid sodný a/nebo kyselina chlorovodíková k úpravě pH.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok 14 injekčních lahviček
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Pouze subkutánní podání.
Injekčně pomalu aplikujte po dobu 5-15 minut.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH
PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Meda AB Box 906 SE 170 09 Solna Švédsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/08/477/001
13. ČÍSLO ŠARŽE
Č. š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
Před podáním přípravku vizuálně zkontrolujte každou injekční lahvičku, zda neobsahuje částice či nemá nežádoucí zabarvení. Používejte pouze čirý a bezbarvý roztok.
16. INFORMACE V BRAILLOVĚ PÍSMU
Ceplene
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Ceplene 0,5 mg/0,5 ml injekční roztok Histamini dihydrochloridum Pouze subkutánní podání.
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
3. POUŽITELNOST
Použitelné do:
4. ČÍSLO ŠARŽE
Č. š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
0,5 ml
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Ceplene 0,5 mg/0,5 ml injekční roztok
Histamini dihydrochloridum
'VTento léčivý přípravek podléhá dalšímu sledování. To umožní rychlou identifikaci nových informací o bezpečnosti. Zdravotničtí odborníci jsou žádáni, aby hlásili jakékoli podezření na nežádoucí účinky. Viz bod 4.8, jak hlásit nežádoucí účinky.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
• Tento přípravek byl předepsán pouze Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné příznaky jako Vy.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Ceplene a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Ceplene používat
3. Jak se přípravek Ceplene používá
4. Možné nežádoucí účinky
5. Jak přípravek uchovávat
6. Obsah balení a další informace
1. Co je přípravek Ceplene a k čemu se používá
Přípravek Ceplene patří do skupiny léčivých přípravků zvaných imunomodulátory. Tyto léčivé přípravky pomáhají imunitnímu systému bojovat s chorobami, jako je nádorové onemocnění, tím, že posílí přirozenou roli imunitního systému v boji s nemocí. Léčivá látka v přípravku Ceplene je histamin-dihydrochlorid; ten je totožný s látkou přirozeně se vyskytující v organismu. Používá se současně s nízkými dávkami interleukinu-2 (IL-2), dalším přípravkem, který pomáhá imunitnímu systému v boji s chorobami, jako je nádorové onemocnění.
Přípravek Ceplene se používá, společně s IL-2, k léčbě zvláštního druhu leukemie zvané akutní myeloidní leukemie (AML, což je nádorové onemocnění postihující buňky kostní dřeně). Používá se k udržení remise (období, během něhož je choroba méně závažná nebo nezjistitelná). Přípravek Ceplene s IL-2 pomohou Vašemu imunitnímu systému napadat nádorové buňky, které v organismu zůstaly po předcházející léčbě nádorového onemocnění.
Během léčby budete vždy používat IL-2 SPOLU s přípravkem Ceplene. Máte-li jakékoliv další otázky týkající se přípravku Ceplene nebo IL-2, zeptejte se svého lékaře.
2. Čemu musíte věnovat pozornost, než začnete přípravek Ceplene používat Neužívejte přípravek Ceplene
• jestliže jste alergický(á)/ (přecitlivělý(á) na histamin nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6)
• jestliže máte závažné onemocnění srdce;
• jestliže užíváte některý z následujících léků:
- steroidy jako prednison a dexamethason, užívají se k omezení aktivity imunitního systému (imunosupresiva) a k tlumení zánětu;
- klonidin, lék užívaný ke snížení vysokého krevního tlaku;
- H2 blokátory jako cimetidin, ranitidin, famotidin či nizatidin, které se užívají k léčbě žaludečních vředů, zažívacích potíží (dyspepsie) nebo pálení žáhy;
• jestliže jste po transplantaci kmenových buněk (druh transplantace kostní dřeně) od dárce;
• jestliže j ste těhotná;
• jestliže kojíte.
Upozornění a opatření
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete používat přípravek Ceplene.
Přípravek Ceplene a IL-2 se nesmí aplikovat současně. IL-2 musí být aplikován jako první. Přípravek Ceplene musí být aplikován o 1 až 3 minuty později.
Injekce přípravku Ceplene musí být aplikována pomalu do vrstvy tkáně těsně pod kůží (subkutánně), po dobu přibližně 5 až 10 minut. Rychlá aplikace může způsobit pokles krevního tlaku a Vy můžete pociťovat slabost, nebo dokonce omdlít.
Léčbu přípravkem Ceplene začnete ve zdravotnickém zařízení pod dohledem lékaře. Musíte být sledován(a), aby se ověřila Vaše odpověď na léčbu. Váš lékař Vám bude kontrolovat krevní tlak, tepovou frekvenci a plicní funkce. Váš lékař bude během léčby rovněž provádět vyšetření krve.
Pokud se u Vás v minulosti vyskytl některý z následujících stavů, budete v průběhu dalších dní léčby nebo v průběhu dalších cyklů léčby sledován(a) v nemocnici:
• krvácení z vředu,
• cévní mozková příhoda,
• zúžení tepen (systémové onemocnění periferních tepen),
• onemocnění srdce (při závažných onemocněních srdce viz výše „Neužívejte přípravek
Ceplene“),
• prodělané autoimunitní onemocnění (choroba, kdy imunitní systém útočí na tělu vlastní buňky nebo tkáně, jako například systémový lupus, revmatoidní artritida, zánětlivá střevní onemocnění nebo lupénka).
Pokud užíváte jakékoli další léčivé přípravky zmiňované v části „Další léčivé přípravky a přípravek Ceplene“, nebo pokud máte podstoupit operaci či speciální rentgenové vyšetření vyžadující aplikaci injekce, poraďte se se svým lékařem.
Pokud máte infekci, Váš lékař Vás bude pečlivě sledovat. Pokud jste měl(a) infekci, která vyžadovala podání protiinfekčních léků (antibiotika, antimykotika nebo antivirotika) v průběhu 14 dní před začátkem této léčby, Váš lékař Vás bude bedlivě sledovat.
Pokud máte potíže s ledvinami, poraďte se se svým lékařem dříve, než začnete používat tento léčivý přípravek. Může se objevit pokles krevního tlaku.
Pokud máte potíže s játry, poraďte se se svým lékařem dříve, než začnete používat tento léčivý
přípravek. Váš lékař může rozhodnout o změně dávky.
Použití u dětí a dospívajících
Přípravek Ceplene není doporučen pro děti a dospívající, neboť neexistují žádné dostupné informace o používání tohoto léčivého přípravku v této věkové skupině.
Další léčivé přípravky a přípravek Ceplene
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste užíval(a) v nedávné době nebo které možná budete užívat, a to i o lécích, které jsou dostupné bez lékařského předpisu.
Pokud užíváte některý z následujících léků, prosím, poraďte se v každém případě se svým lékařem nebo lékárníkem dříve, než začnete používat přípravek Ceplene. Některé z nich se během léčby přípravkem Ceplene nesmí užívat nebo je třeba zvláštní opatrnosti:
• Steroidy jako prednison a dexamethason, užívají se k potlačení aktivity imunitního systému (imunosupresiva) a k tlumení zánětu (viz výše „Neužívejte přípravek Ceplene“).
• H2 blokátory jako cimetidin, ranitidin, famotidin či nizatidin.Ty se užívají k léčbě žaludečních vředů, zažívacích potíží (dyspepsie) nebo pálení žáhy (viz výše „Neužívejte přípravek Ceplene“).
• Antihistaminika užívaná k léčbě alergie.
• Některá antipsychotika, například chlorpromazin, flupenthixol, thoridazin, klozapin a risperidon. Užívají se k léčbě různých psychických obtíží.
• Tricyklická antidepresiva jako amitryptilin, imipramin, nebo inhibitory monoaminooxidázy,
například fenelzin, izokarboxazid, tranylcypromin nebo moklobemid. Používají se k léčbě deprese.
• Antimalarika nebo léky používané k léčbě infekcí způsobujících spavou nemoc.
• Beta-blokátory jako propranolol, metoprolol, atenolol. Ty se užívají k léčbě anginy pectoris a poruch srdečního rytmu
• Jakákoliv léčba vysokého krevního tlaku (například thiazidová diuretika [bendrofluazid],
ACE inhibitory [kaptopril], antagonisté vápníku [nifedipin] a alfa-blokátory [prazosin].
Než podstoupíte operaci nebo speciální rentgenové vyšetření vyžadující aplikaci injekce, nejprve se ujistěte, že Váš lékař ví, že užíváte přípravek Ceplene. Určité léky užívané při operaci (například léky blokující nervově-svalový přenos a léky proti bolesti ze skupiny narkotik) nebo kontrastní látky používané pro některá rentgenová vyšetření mohou mít vliv na účinky tohoto přípravku.
Ceplene s jídlem, pitím a alkoholem
K dispozici nejsou žádné údaje o interakcích přípravku Ceplene s jídlem, pitím a alkoholem. Ceplene je aplikován subkutánně, proto absorpce z gastrointestinálního traktu není ovlivněna příjmem jídla a pití.
Těhotenství a kojení
Nejsou k dispozici žádné informace o podávání přípravku Ceplene během těhotenství.
Léčba přípravkem Ceplene a IL-2 proto nesmí být během těhotenství prováděna.
Muži i ženy, kteří podstupují tuto léčbu, musí používat účinnou antikoncepci, jelikož je důležité, aby během léčby přípravkem Ceplene a IL-2 nedošlo k početí dítěte.
Není známo, zda se přípravek Ceplene objevuje v mateřském mléku. Přípravek Ceplene a IL-2 tedy nesmí být podávány v průběhu kojení.
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
Řízení dopravních prostředků a obsluha strojů
Neřiďte dopravní prostředek ani neobsluhujte žádné přístroje nebo stroje jednu hodinu po podání injekce přípravku Ceplene, protože může snížit krevní tlak a tím působit točení hlavy, závratě a rozmazané vidění. To může ovlivnit Vaši schopnost řízení dopravních prostředků a obsluhy strojů.
3. Jak se přípravek Ceplene používá
Vždy používejte přípravek Ceplene přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem, lékárníkem nebo zdravotní sestrou.
Tato léčba musí být předepsána a kontrolována lékařem se znalostí akutní myeloidní leukemie. Dávkování
Vzhledem k tomu, že budete používat kombinaci IL-2 i přípravku Ceplene, jsou uvedeny údaje o dávkování obou přípravků:
Interleukin-2 (IL-2)
IL-2 se aplikuje dvakrát denně ve formě podkožní injekce (do vrstvy tkáně těsně pod kůží) 1 až 3 minuty před injekcí přípravku Ceplene. Jednotlivá dávka se počítá z Vaší tělesné hmotnosti. Váš lékař Vás poučí, kolik to je a jak si dávku aplikovat.
Přípravek Ceplene
Obvyklá dávka přípravku Ceplene je 0,5 ml roztoku dvakrát denně podaná ve formě pomalé podkožní injekce (do vrstvy tkáně těsně pod kůží).
Přípravek Ceplene musí být aplikován 1 až 3 minuty po aplikaci IL-2.
Oba léčivé přípravky, IL-2 i Ceplene, se aplikují dvakrát denně s minimálně 6hodinovým intervalem mezi injekcemi.
Léčebná období a přestávky v léčbě
Léčba IL-2 a přípravkem Ceplene trvá 81 týdnů a je cyklická.
• Prvních 18 týdnů: budete používat IL-2 a přípravek Ceplene denně po dobu 3 týdnů, po kterých bude vždy následovat 3týdenní pauza (bez jakékoliv léčby).
• Následujících 63 týdnů: budete pouužívat IL-2 a přípravek Ceplene denně po dobu 3 týdnů, po kterých bude vždy následovat 6týdenní pauza (bez jakékoliv léčby).
Aplikace injekce přípravku Ceplene pacientem samotným
Váš lékař může rozhodnout, že pro Vás bude pohodlnější, budete-li si aplikovat injekce IL-2 a přípravku Ceplene sám(sama).
Váš lékař nebo zdravotní sestra Vás poučí, jak si aplikovat injekci. Nezkoušejte si injekci aplikovat sám(sama), dokud nebudete proškolen(a) kvalifikovaným pracovníkem.
Doporučuje se, aby Vám v době, kdy si aplikujete injekci, byl vždy někdo nablízku, jako například dospělý člen rodiny, přítel nebo jiný pečovatel, který by Vám mohl pomoci, pokud budete pociťovat závrať nebo pocit na omdlení.
Pro další instrukce, jak si aplikovat tento přípravek sám(sama), si přečtěte, prosím, bod „INSTRUKCE PRO UŽIVATELE, KTEŘÍ SI INJEKCI PŘÍPRAVKU CEPLENE APLIKUJÍ SAMI“ na konci této příbalové informace.
Pokud je to vhodné, může Vám Váš lékař doporučit použití injekční pumpy, která slouží k regulaci aplikace přípravku Ceplene. Pokud používáte injekční pumpu, řiďte se instrukcemi poskytovanými výrobcem této pumpy a školením, které Vám udělil Váš lékař nebo zdravotní sestra.
Jestliže jste použil(a) více přípravku Ceplene, než jste měl(a)
Tento léčivý přípravek musíte používat přesně tak, jak Vám byl předepsán. Pokud jste si náhodně aplikoval(a) více, než jste měl(a), kontaktujte ihned svého lékaře nebo lékárníka.
Jestliže jste si zapomněl(a) aplikovat přípravek Ceplene
Neaplikujte si žádnou další dávku, abyste nahradil(a) vynechané dávky. Pokračujte v léčbě tak, jak Vám byla předepsána. Pokud jste vynechal(a) jednu ze svých denních dávek, kontaktujte svého lékaře nebo lékárníka.
Jestliže jste přestal(a) používat přípravek Ceplene
Pokud chcete přestat používat přípravek Ceplene, měl(a) byste se předem poradit se svým lékařem. Pokud jste přestal(a) používat přípravek Ceplene na základě svého vlastního rozhodnutí, informujte, prosím, svého lékaře.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Nežádoucí účinky, které byly pozorovány při použití přípravku Ceplene tak, jak je uvedeno v příbalové informaci:
Velmi často se může objevit hypotenze (nízký krevní tlak), který vede k závrati a mdlobám. Pokud si všimnete, že po použití přípravku Ceplene došlo k výraznému poklesu krevního tlaku, informujte svého lékaře ihned nebo alespoň před podáním další injekce přípravku Ceplene.
Velmi časté nežádoucí účinky (mohou se objevit u více než 1 z 10 lidí)
• Zvýšení počtu jistého typu bílých krvinek v krvi (eozinofilie) a pokles počtu krevních destiček (trombocytopenie)
• Bolest hlavy a závratě
• Změněná chuť (dysgeuzie)
• Rychlá tepová frekvence (tachykardie)
• Zčervenání
• Kašel, obtíže s dýcháním (dyspnoe)
• Infekce horních dýchacích cest (respiračního traktu)
• Nevolnost, trávicí potíže (dyspepsie) a průjem
• Vyrážka
• Bolesti kloubů a svalů (artralgie a myalgie)
• Zarudlá hrbolatá kůže v místě injekce, únava, horečka (pyrexie), zčervenání místa injekce, pocit
horka, reakce v místě vpichu, svědění v místě injekce, příznaky podobné chřipce, třesavka (zimnice), zánět a bolest v místě injekce.
Časté nežádoucí účinky (mohou se objevit až u 1 z 10 lidí)
• Snížení počtu bílých krvinek (leukopenie)
• Snížení počtu určitého typu bílých krvinek (neutropenie)
• Zápal plic (pneumonie)
• Ztráta chuti k j ídlu (anorexie)
• Potíže se spánkem (nespavost)
• Bušení srdce (palpitace)
• Pocit ucpaného nosu (nosní kongesce)
• Zvracení, bolest v horní části břicha (abdominální bolest) a sucho v ústech
• Zánět žaludku (gastritida)
• Nadýmání břicha (abdominální distenze)
• Abnormálně červená pokožka (erytém), zvýšené pocení (hyperhidróza), noční pocení a svědění (pruritus)
• Bolesti končetin a zad
• Kopřivka, podlitiny, vyrážka a otok v místě injekce, slabost (astenie) a bolest na hrudi
Další nežádoucí účinky, které byly pozorovány při použití přípravku Ceplene v jiných typech léčby:
Velmi časté nežádoucí účinky (mohou se objevit u více než 1 z 10 lidí)
• Suchá kůže
• Úzkost
• Pocit celkové nepohody a tísně
• Hromadění tekutin v těle, především v dolních končetinách (otok)
• Ztráta tělesné hmotnosti
Časté nežádoucí účinky (mohou se objevit až u 1 z 10 lidí)
• Pocit točení hlavy (závratě)
• Vaše tělo neprodukuje dostatek tyroxinu, chemická látky nazývané hormon (hypotyroidismus)
• Snížení počtu červených krvinek (anémie)
• Ztráta tekutin (dehydratace)
• Deprese
• Brnění, píchání nebo snížená citlivost kůže (parestézie)
• Návaly horka
• Sípání
• Zácpa, vzedmutí břicha, zanícení úst
• Bolest a vznik nové tkáně v kůži v okolí místa injekce
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Přípravek Ceplene
Nepoužívejte přípravek Ceplene po uplynutí doby použitelnosti uvedené na krabičce a na štítku injekční lahvičky. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Chraňte před mrazem.
Roztok by měl být před aplikací vizuálně zkontrolován, zda neobsahuje částečky nebo zda nedošlo ke změně barvy. Roztok musí být čirý a bezbarvý.
Interleukin-2 (IL-2, aldesleukin)
Předplněné injekční stříkačky naředěného IL-2 s nasazeným krytem připravené ékárníkem uchovávejte v chladničce (při teplotě 2°C - 8°C) až do použití.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Ceplene obsahuje
• Léčivou látkou je histamini dihydrochloridum. Jedna lahvička obsahuje 0,5 mg histamin-dihydrochloridu v 0,5 ml roztoku.
• Pomocnými látkami jsou voda na injekci a chlorid sodný, může obsahovat také hydroxid sodný a/nebo kyselinu chlorovodíkovou k úpravě pH.
Jak přípravek Ceplene vypadá a co obsahuje toto balení
Přípravek Ceplene je čirá bezbarvá tekutina. Je dodáván ve skleněných injekčních lahvičkách se šedou gumovou zátkou a modrým hliníkovým flip-off odklápěcím krytem.
Přípravek Ceplene je dostupný v baleních po 14 injekčních lahvičkách.
Držitel rozhodnutí o registraci
Meda AB Box 906 SE 170 09 Solna Švédsko
Výrobce
Labiana Pharmaceuticals, S.L.U.
C/ Casanova, 27-31
08757 Corbera de Llobregat (Barcelona)
Španělsko
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien Meda Pharma S.A./N.V. Chaussée de la Hulpe 166 Terhulpsesteenweg 166 1170 Brussels Tél/Tel: +32 (0)2 5 04 08 11 |
Lietuva Meda Pharma SIA Ukmergés g. 369A LT-12142 Vilnius Tel.: +370 52059367 |
|
Btarapna Tn Mega OapMacoňTHKaac Ya. OgpHH 71-75, eT.2, an 7 1303 Co$Ha Tea.: +359 2 4177977 |
Luxembourg/Luxemburg Meda Pharma S.A./N.V. Chaussée de la Hulpe 166 Terhulpsesteenweg 166 B-1170 Brussels Belgique / Belgien Tél/Tel: +32 (0)2 5 04 08 11 |
|
Česká republika MEDA Pharma s.r.o. Kodaňská 1441 / 46 CZ-100 10 Praha 10 Tel: +420 234 064 201 |
Magyarország MEDA Pharma Hungary Kereskedelmi Kft. H-1139 Budapest Váci ut 91 Tel: +36 1 236 3410 |
|
Danmark Meda AS Solvang 8 DK-3450 Allerad Tlf: +45 44 52 88 88 |
Malta Alfred Gera & Sons Ltd. 10 Triq Il Masgar Qormi MT-Qrm 3217 |
|
Deutschland MEDA Pharma GmbH & Co. KG BenzstraBe 1 D-61352 Bad Homburg Tel: +49 (0) 6172 888 01 |
Nederland MEDA Pharma B.V. Krijgsman 20 NL-1186 DM Amstelveen Tel: +31 (0)20 751 65 00 |
|
Eesti Meda Pharma SIA Narva mnt. 11D EE10151 Tallinn Tel: +372 62 61 025 |
Norge Meda A/S Askerveien 61 N-1384 Asker Tlf: +47 66 75 33 00 |
|
EAláda MEDA Pharmaceuticals A.E. EupuTCivíaQ 3 GR-15231 XaAávčpi -Attikh TqA: +30 210 6 77 5690 |
Osterreich MEDA Pharma GmbH Guglgasse 15 A-1110 Wien Tel: + 43 (0)1 86 390 0 |
|
Espaňa Meda Pharma S.A.U. Avenida de Castilla, 2 Parque Empresarial San Fernando Edificio Berlín E-28830 San Fernando de Henares (Madrid) Tel: +34 91 669 93 00 |
Polska Meda Pharmaceuticals Sp.z.o.o. Al. Jana Pawla II 15 PL-00-828 Warszawa Tel: +48 22 697 7100 |
|
France MEDA Pharma SAS 25 Boulevard de lAmiral Bruix |
Portugal MEDA Pharma - Produtos Farmaceuticos, S.A Rua do Centro Cultural, 13 |
|
F-75016 Paris Tél: +33 (0)1 56 64 10 70 |
P-1749-066 Lisboa Tel: +351 21 842 0300 |
|
Hrvatska Medical Intertrade d.o.o. Dr. Franje Tudmana 3 10431 Sveta Nedelja Tel: +385 1 3374 010 |
Románia Meda Pharmaceuticals Switzerland GmbH, Reprezentatei Calea Floreasca, Primul District 141-143-RO Bucure§ti Tel.: +40212309030 |
|
Ireland Meda Health Sales Ireland Ltd. 34/35 Block A Dunboyne Business Park Dunboyne IRL-Co Meath Tel: +353 1 802 66 24 |
Slovenija MEDA Pharmaceuticals Switzerland GmbH, Podružnica Ljubljana Cesta 24. junija 23 SI-1231 Ljubljana Tel: +386 (0)59 096 951 |
|
Island Meda AB Box 906 S-170 09 Solna Sví^jóó Sími: +46 8 630 1900 |
Slovenská republika MEDA Pharma spol. s. r.o. Trnavská cesta 50 SK-821 02 Bratislava Tel: +421 2 4914 0172 |
|
Italia Meda Pharma S.p.A. Viale Brenta, 18 I-20139 Milano Tel: +39 02 57 416 1 |
Suomi/Finland Meda Oy Vaisalantie 4/Vaisalavágen 4 FI-02130 Espoo/Esbo Puh/Tel: +358 20 720 9550 |
|
Kúnpoq MEDA Pharmaceuticals A.E. EupuTOvía^ 3 GR-15231 XaAávčpi -Attikh Tr|A: +30 210 6 77 5690 EAMSa |
Sverige Meda AB Box 906 S-170 09 Solna Tel: +46 (0)8 630 1900 |
|
Latvija Meda Pharma SIA Ojára Vštieša iela 13 LV-1004 Riga Talr: +371 7 805 140 |
United Kingdom Meda Pharmaceuticals Ltd. Skyway House Parsonage Road Takeley Bishops Stortford CM22 6PU-UK Tel.: + 44 845 460 0000 |
Tato příbalová informace byla naposledy revidována
Tento léčivý přípravek byl registrován za „výjimečných okolností“ Znamená to, že vzhledem ke vzácné povaze tohoto onemocnění nebylo možné získat o tomto léčivém přípravku úplné informace. Evropská agentura pro léčivé přípravky každoročně vyhodnotí jakékoli nové informace týkající se tohoto léčivého přípravku a tato příbalová informace bude podle potřeby aktualizována.
Podrobné informace o tomto léčivém přípravku j sou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/. Na těchto stránkách naleznete též odkazy na další webové stránky, týkající se vzácných onemocnění a jejich léčby.
INSTRUKCE PRO UŽIVATELE, KTEŘÍ SI INJEKCI PŘÍPRAVKU CEPLENE APLIKUJÍ SAMI
Tato část obsahuje návod, jak si aplikovat injekci přípravku Ceplene.
Pokud chcete získat obecné informace o dávkování a užívání přípravku Ceplene a IL-2, nahlédněte, prosím, do bodu 3 „Jak se přípravek Ceplene používá“.
Přečtěte si pozorně následující instrukce. Je důležité, abyste si nezkoušel(a) aplikovat injekci sám(sama), dokud nebudete proškolen(a) svým lékařem nebo zdravotní sestrou. Pokud si nebudete jist(a), jak si injekci aplikovat, nebo budete mít jakékoli otázky, požádejte, prosím, o pomoc svého lékaře nebo zdravotní sestru.
Pokud budete pociťovat závratě nebo slabost v průběhu aplikace injekce nebo po ní, oznamte to svému lékaři dříve, než budete aplikovat další dávku. Váš lékař může následně prodloužit dobu, po kterou si budete aplikovat injekci, nebo změnit dávku.
Přípravek Ceplene a IL-2 si budete aplikovat dvakrát denně formou subkutánní (podkožní) injekce (do vrstvy tkáně těsně pod kůží) podle pokynů svého lékaře.
Vždy aplikujte nejprve IL-2. Přípravek Ceplene musí být aplikován o 1 až 3 minuty později. Přípravek Ceplene nesmí být mísen s žádnými jinými přípravky a nesmí být ředěn.
Váš lékař Vám vysvětlí, jak připravit a aplikovat injekci IL-2.
Doporučuje se, aby ve chvíli, kdy si budete aplikovat injekci přípravku Ceplene, byl někdo nablízku, například dospělý člen rodiny, přítel nebo jiný pečovatel, aby Vám mohl pomoci, pokud budete pociťovat závrať nebo slabost.
PŘÍPRAVA INJEKCE PŘÍPRAVKU CEPLENE
K přípravě dávky přípravku Ceplene budete potřebovat následující:
• 1 injekční lahvičku roztoku Ceplene (0,5 ml)
• 1 sterilní kalibrovanou injekční stříkačku s jehlou
• 1 tampon navlhčený alkoholem
Postup
1. Vyjměte z krabičky 1 injekční lahvičku. Zkontrolujte dobu použitelnosti (Použitelné do:) na štítku lahvičky.
2. Nepoužívejte ji, pokud již uplynul poslední den uvedeného měsíce.
3. Umyjte si důkladně ruce vodou a mýdlem.
4. Překontrolujte dvakrát štítek lahvičky, abyste se ujistil(a), že užíváte správný lék. Roztok musí být čirý a bezbarvý. Pokud není, použijte jinou injekční lahvičku a informujte svého lékaře nebo lékárníka.
5. Odstraňte plastový kryt z injekční lahvičky. Pod ní se objeví zátka s vnitřním gumovým kroužkem.
6. Gumovou část zátky otřete tamponem navlhčeným alkoholem. Nedotýkejte se zátky rukama.
7. Vezměte si sterilní injekční stříkačku. Všimněte si značek, které jsou na ní uvedeny. Každá značka (0,1, 0,2, 0,3 atd.) představuje jednu desetinu mililitru (0,1 ml). S krytkou nasazenou na jehle zatáhněte za píst a nasajte vzduch do stříkačky až k požadované úrovni (číslo v mililitrech), kterou Vám určil Váš lékař. Viz obrázek 1.
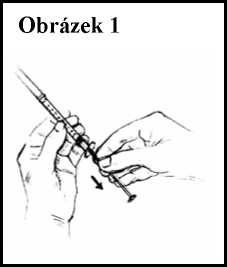
8. Přímým tahem odstraňte krytku jehly. Vpíchněte jehlu přímo skrz gumovou zátku do injekční lahvičky, stojící na rovném povrchu.
9. Zatlačte píst stříkačky dolů, abyste vstříkl(a) vzduch do lahvičky. Viz obrázek 2.

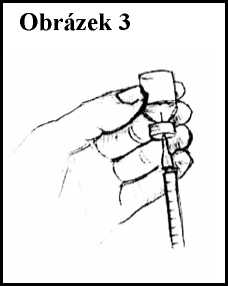
10. Držte zároveň injekční lahvičku i injekční stříkačku a obraťte injekční lahvičku dnem vzhůru. Upravte polohu injekční stříkačky tak, aby špička jehly byla jen mírně nad gumovou zátkou, ale stále ještě v roztoku. Viz obrázek 3.
11. Pomalu zatáhněte za píst, abyste dovnitř injekční stříkačky natáhl (a) roztok a naplnil(a) ji až k požadované úrovni (číslo v mililitrech), kterou Vám určil Váš lékař. Pokud se uvnitř injekční stříkačky objeví bubliny vzduchu, vstříkněte roztok pomalu zpátky do lahvičky a natáhněte jej znovu.
12. Vyjměte jehlu z injekční lahvičky. Nepokládejte injekční stříkačku ani se jehlou ničeho nedotýkejte.
13. Opět nasaďte krytku jehly. Položte injekční stříkačku na čistý rovný povrch.
14. V lahvičce může zůstat malé množství roztoku. Vraťte ji lékárníkovi k likvidaci.
POZNÁMKA: Injekční lahvička přípravku Ceplene obsahuje přeplnění k usnadnění natažení jedné dávky 0,5 ml.
15. Zkontrolujte dvakrát injekční stříkačku, abyste se ujistil(a), že jste natáhl(a) správné množství.
16. Vezměte si stříkačku a řiďte se informacemi v části „INSTRUKCE K APLIKACI INJEKCE“ níže.
INSTRUKCE K APLIKACI INJEKCE
Obvykle si budete aplikovat dvě 0,5ml dávky za den, pokud Vám lékař nepředepsal nižší dávkování.
Pro aplikaci injekce budete potřebovat následující:
• 1 připravenou injekční stříkačku pro injekci IL-2 (řiďte se pokyny v příbalové informaci přípravku IL-2 a instrukcemi svého lékaře o jeho dávkování),
• 1 připravenou injekční stříkačku obsahující přípravek Ceplene,
• Tampon/tampony navlhčené alkoholem,
• Budík, hodiny nebo hodinky se sekundovou ručičkou,
• Nádobu odolnou proti propíchnutí, abyste mohli bezpečně odstranit použité injekční
stříkačky.
Postup
1. Najděte si pohodlné, dobře osvětlené místo, kde se posadíte a kde si můžete i lehnout. Umístěte předpřipravené injekční stříkačky obsahující IL-2, přípravek Ceplene a otevřený tampon navlhčený alkoholem tak, abyste na ně dosáhl(a). Pro Vaši bezpečnost je důležité, abyste seděl(a) tam, kde se po aplikaci injekce můžete opřít nebo si lehnout na záda.
2. Aplikujte inj ekci IL-2 tak, jak jste byl(a) poučen(a).
3. Počkejte 1 až 3 minuty.
4. Rozhodněte se, kam si budete aplikovat injekci přípravku Ceplene. Můžete si vybrat vnitřní nebo vnější stranu stehen, paže nebo břicho. Přípravek Ceplene a IL-2 nesmí být aplikovány do stejné oblasti. Pokud si například aplikujete přípravek IL-2 do levé paže, můžete si aplikovat přípravek Ceplene do levého nebo pravého stehna, břicha nebo pravé paže. Vždy měňte místo vpichu. Možná místa vpichu jsou vidět na obrázku 4.
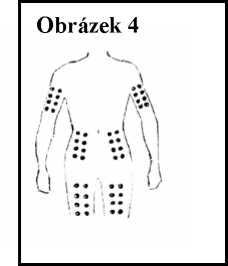
5. Ujistěte se, že oblast kůže, kterou jste si vybral(a), je odhalená. K jejímu očištění použijte tampon navlhčený alkoholem. Nechte oblast 10 sekund schnout.
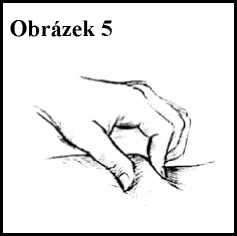
6. Stiskněte část očištěné kůže mezi palcem a ukazováčkem, aniž byste ji mačkal(a). Viz obrázek 5.
7. Držte jehlu buď vertikálně (90°), nebo pod úhlem 45° vzhledem ke kůži a vpíchněte ji pod kůži jediným rychlým pohybem tak hluboko, jak to lze. Jehla musí být vpíchnuta pod kůží, ale nikoli do podkožní krevní cévy. Viz obrázek 6.
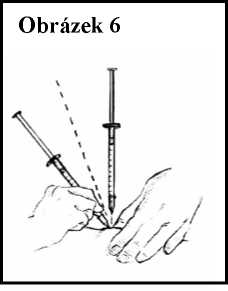
8. Povytáhněte mírně píst. Pokud se objeví krev, nevstřikujte přípravek Ceplene, protože jehla
pronikla do krevní cévy. Vytáhněte stříkačku a zlikvidujte ji podle instrukcí. Vezměte si nové pomůcky a začněte celý postup znovu, a to i když již uplynuly 3 minuty od podání injekce IL-2.
9. Všimněte si očíslovaných značek na každé injekční stříkačce. Každá značka (0,1, 0,2, 0,3 atd.) představuje jednu desetinu mililitru (0,1 ml).
10. Stiskněte píst injekční stříkačky a vstřikujte jednu desetinu mililitru (0,1 ml) každou minutu nebo pomaleji, pokud Vám to určil Váš lékař. Viz obrázek 7.
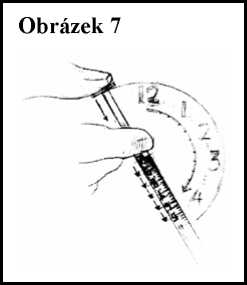
11. Nikdy nevstřikujte přípravek Ceplene rychleji nebo najednou.
12. Až bude injekční stříkačka prázdná, vytáhněte ji z kůže.
13. Tamponem navlhčeným alkoholem jemně stlačujte místo injekce, ale netřete jej.
14. Po aplikaci injekce přípravku Ceplene zůstaňte 20 minut sedět nebo ležet.
15. Odstraňte injekční stříkačku do nádoby odolné proti propíchnutí podle návodu.
36