Cayston 75 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Cayston 75 mg prášek a rozpouštědlo pro roztok k rozprašování.
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna injekční lahvička obsahuje aztreonamum lysinicum, což odpovídá aztreonamum 75 mg. Po rekonstituci obsahuje roztok k rozprašování aztreonamum 75 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro roztok k rozprašování. Bílý až téměř bílý prášek.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Cayston je indikován k supresivní léčbě chronických plicních infekcí způsobených Pseudomonas aeruginosa u pacientů s cystickou fibrózou (CF) ve věku 6 let a starších.
Je třeba zvážit oficiální nařízení pro příslušné používání antibakteriálních látek.
4.2 Dávkování a způsob podání
Dávkování
Před každou dávkou přípravku Cayston mají pacienti použít bronchodilatátor. Krátkodobě působící bronchodilatátory je možné použít 15 minut až 4 hodiny a dlouhodobě působící bronchodilatátory je možné použít 30 minut až 12 hodin před každou dávkou přípravku Cayston.
U pacientů podstupujících několik inhalačních terapií se doporučuje následující pořadí podání:
1. bronchodilatátor,
2. mukolytika,
3. a nakonec přípravek Cayston.
Dospělí a děti ve věku 6 let starší
Doporučená dávka pro dospělé je 75 mg třikrát během 24 hodin po dobu 28 dnů.
Dávky se mají užívat s odstupem alespoň 4 hodin.
Cayston se může podávat v opakovaných 28denních léčebných cyklech následovaných 28denní přestávkou v léčbě přípravkem Cayston.
Dávkování u dětí ve věku 6 let a starších je stejné jako u dospělých.
Starší pacienti
Klinické studie s přípravkem Cayston nezahrnovaly pacienty léčené přípravkem Cayston ve věku 65 let a starší, aby bylo možné zjistit, zda je jejich odpověď na léčbu jiná než u mladších pacientů. Jestliže je přípravek Cayston předepsán starším pacientům, je dávkování stejné jako u dospělých.
Porucha funkce ledvin
Je známo, že aztreonam se vylučuje ledvinami, proto se má Cayston pacientům s poruchou funkce ledvin (sérový kreatinin > 2násobek horní hranice normy) podávat opatrně. V případě poruchy funkce ledvin není potřeba upravovat dávky, jelikož systémová koncentrace aztreonamu po inhalaci přípravku Cayston je velmi nízká (asi1% koncentrace po dávce 500 mg aztreonamu pro injekční podání).
Porucha funkce jater
Údaje o používání přípravku Cayston u pacientů s těžkou poruchou funkce jater (ALT nebo AST vyšší než 5násobek horní hranice normy) neexistují. V případě poruchy funkce jater není potřeba upravovat dávky.
Pediatrická populace
Bezpečnost a účinnost přípravku Cayston u dětí mladších než 6 let nebyla stanovena. V současnosti dostupné údaje jsou popsány v bodě 5.1, ale na jejich základě nelze učinit žádná doporučení ohledně dávkování.
Způsob podání Inhalační podání.
Cayston se má používat pouze se soupravou nebulizátoru Altera a vyvíječem aerosolu Altera připojeným k ovladači eBase nebo k ovládací jednotce eFlow rapid. Návod k rekonstituci tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Alergické reakce
Pokud se objeví alergická reakce na aztreonam, ukončete podávání léčivého přípravku a podle potřeby zahajte příslušnou léčbu. Příznakem alergické reakce na aztreonam může být výskyt vyrážky.
U pacientů s anamnézou alergie na beta-laktamová antibiotika jako jsou penicilin, cefalosporiny a/nebo karbapenemy se může vyskytnout zkřížená reaktivita. Údaje ze studií u zvířat a lidí prokázaly nízké riziko vzniku zkřížené reaktivity mezi aztreonamem a beta-laktamovými antibiotiky.
Aztreonam, který patří mezi monobaktamy, je pouze slabě imunogenní. U pacientů s anamnézou alergie na beta-laktamová antibiotika je potřeba podávat Cayston opatrně.
Následující vzácné a těžké nežádoucí účinky byly hlášeny po parenterálním použití jiných přípravků
obsahujících aztreonam: toxická epidermální nekrolýza, anafylaxe, purpura, multiformní erytém, exfoliativní dermatitida, kopřivka, petechie, svědění, diaforéza.
Comment [LC1]: There should be a comma after “antibiotika” and "karbapenemy”. It is a clause and it should be enclosed in commas.
Comment [LC2]: For Authority: We suggest not to implement this change as both terms are acceptable, however when the other terms in the list are translated into Czech, this one should be also translated for consistency
Bronchospazmus
Bronchospazmus (akutní snížení > 15 % FEVi) je komplikace související s terapiemi podávanými pomocí nebulizátoru. Bronchospazmus byl hlášen po podání přípravku Cayston (viz bod 4.8). Pacienti mají použít bronchodilatátor před každou dávkou přípravku Cayston. V případě podezření, že je výskyt bronchospazmu částí alergické reakce, je nutné zahájit příslušnou léčbu (viz odstavec „alergické reakce“ výše).
Hemoptýza
Inhalování roztoků pomocí nebulizátoru může vyvolávat kašlací reflex. Používání přípravku Cayston u pediatrických pacientů s CF bylo během léčebných cyklů spojené s hemoptýzou a mohlo mít za následek zhoršení základního onemocnění. Přípravek Cayston se má u pacientů s CF a s aktivní hemoptýzou podat pouze tehdy, když přínos léčby převyšuje riziko vyvolání dalšího krvácení.
Další opatření
Účinnost nebyla stanovena u pacientů s předpokládanou hodnotou FEV1 > 75 %. Pacienti s Burkholderia cepacia izolovanou ze sputa během posledních 2 let byli z klinických studií vyřazeni.
Aztreonam pro injekční podání se nesmí používat v nebulizátoru Altera ani v jiných nebulizátorech. Aztreonam pro injekční podání nebyl vytvořen pro inhalaci a obsahuje arginin, látku, o které je známo, že způsobuje zánět plic.
Rezistence na aztreonam, další antibiotika a mikroorganizmy, které se objeví během léčby
Vývoj rezistence bakterie P. aeruginosa na antibiotika a superinfekce způsobená dalšími patogeny představují potenciální rizika spojená s léčbou antibiotiky. Vývoj rezistence během inhalační léčby aztreonamem může omezit možnosti léčby během akutních exacerbací. V klinických studiích s přípravkem Cayston byl pozorován pokles citlivosti u P. aeruginosa na aztreonam a další beta-laktamová antibiotika. Ve 24týdenní kontrolované klinické studii u pacientů léčených Caystonem bylo pozorováno zvýšení hodnoty MtC90 pro všechny izoláty P. aeruginosa a rovněž procentuálního podílu pacientů s P. aeruginosa rezistentní (MIC nad parenterální hraniční hodnotou) na aztreonam, na alespoň jedno beta-laktamové antibiotikum a na všech 6 testovaných beta-laktamových antibiotik (viz bod 5.1). Snížená citlivost P. aeruginosa však nebyla prediktivní pro klinickou účinnost přípravku Cayston během studie. U pacientů s multirezistentní P. aeruginosa bylo po léčbě přípravkem Cayston pozorováno zlepšení respiračních symptomů a funkce plic. Vznik parenterální rezistence P. aeruginosa na aztreonam nebo další beta-laktamová antibiotika může mít potenciální důsledky pro léčbu akutních plicních exacerbací systémovými antibiotiky.
U pacientů léčených několika cykly přípravku Cayston byl časem pozorován nárůst rozšíření kmenů methicillin-rezistentního Staphylococcus aureus (methicillin-resistant Staphylococcus aureus,
MRSA), methicillin-citlivého S. aureus (methicillin-sensitive S. aureus, MSSA), Aspergillus a Candida. V literatuře se uvádí souvislost mezi přetrvávající přítomností MRSA a zhoršeným klinickým výsledkem. Během klinických studií s přípravkem Cayston neměla přítomnost MRSA za následek zhoršení funkce plic.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí. V klinických studiích, ve kterých byl podáván aztreonam souběžně s bronchodilatátory, alfa dornázou, pankreatickými enzymy, azithromycinem, tobramycinem, perorálními steroidy (méně než 10 mg denně/20 mg každý druhý den) a inhalačními steroidy však nebyl zaznamenán žádný výskyt lékové interakce s přípravkem Cayston.
4.6 Fertilita, těhotenství a kojení
Údaje o podávání aztreonamu těhotným ženám nejsou k dispozici. Studie reprodukční toxicity na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky (viz bod 5.3).
Systémová koncentrace aztreonamu po inhalačním podání přípravku Cayston je v porovnání se standardní dávkou aztreonamu pro injekční podání nízká (asi 1 % koncentrace po 500 mg dávce aztreonamu pro injekční podání).
Cayston lze v těhotenství použít pouze tehdy, když klinický stav ženy vyžaduje léčbu aztreonamem. Kojení
Po podání aztreonamu pro injekční podání se aztreonam vylučuje do lidského mateřského mléka ve velmi nízkých koncentracích. Systémová koncentrace aztreonamu po inhalačním podání přípravku Cayston představuje asi 1 % koncentrace po standardní dávce aztreonamu pro injekční podání. Z tohoto důvodu a vzhledem k nízké perorální absorpci je pravděpodobné, že expozice aztreonamem u kojenců kojených matkami užívajícími Cayston je velmi nízká.
Cayston lze během kojení podávat.
Fertilita
Neklinické údaje o fertilitě pro aztreonam pro injekční podání nenaznačují žádné nežádoucí účinky.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Cayston nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky Shrnutí profilu bezpečnosti
Hodnocení nežádoucích účinků je založeno na zkušenostech ze čtyř klinických studií fáze 3 zahrnujících pacienty s CF s chronickou infekcí způsobenou bakterií P. aeruginosa a na základě spontánních postmarketinkových hlášení. V těchto dvou klinických studiích fáze 3 kontrolovaných placebem, ve kterých dostávali pacienti přípravek Cayston po dobu 28 dnů, byly nejčastěji se vyskytujícími nežádoucími účinky na Cayston kašel (58 %), nazální kongesce (18 %), dušnost (15 %),
faryngolaryngeální bolest (13,0 %), pyrexie (12 %) a dyspnoe (10 %).
Akutní snížení FEV1 o > 15 % je komplikace související s terapiemi podávanými pomocí nebulizátoru,
Comment [LC3]: For Authority: We suggest not to implement this change as the word “sipani” does not mean exactly the same as “dyspone”
včetně přípravku Cayston (vrz bod 4.4).
Tabulkový přehled nežádoucích účinků
Nežádoucí účinky zjištené v klinických studiích a po uvedení přípravku na trh, u kterých se uvažuje s alespoň možným vztahem k léčbě, jsou uvedeny níže podle tříd orgánových systémů a četnosti.
Četnost nežádoucích účinků je definována následujícím způsobem: velmi časté (> 1/10), časté (> 1/100 až < 1/10) a méně časté (> 1/1 000 až < 1/100).
|
Respirační, hrudní a |
mediastinální poruchy: |
|
Velmi časté: |
kašel, nazální kongesce, sípání, faryngolaryngeální bolest, dyspnoe |
|
Časté: |
bronchospazmus1, diskomfort v oblasti hrudníku, rinorea, hemoptýza1 |
|
Poruchy kůže a podkožní tkáně: | |
|
Časté: | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně: | |
|
Časté |
artralgie |
|
Méně časté: |
otoky kloubů |
|
Celkové poruchy a reakce v místě aplikace: | |
|
Velmi časté: |
pyrexie |
|
Vyšetření | |
|
Časté: |
snížení hodnot v testech funkční vyšetření plicfunkcí1 |
1 Viz bod c. Popis vybraných nežádoucích účinků
Popis vybraných nežádoucích účinků Bronchospasmus
Léčba pomocí nebulizátoru, včetně přípravku Cayston, může být spojena s bronchospasmem (akutní snížení FEV1 o > 15 %). Podívejte se na bod 4.4.
Hemoptýza
Inhalování roztoků pomocí nebulizátoru může vyvolávat kašlací reflex, který by mohl zhoršit základní onemocnění (viz bod 4.4).
Alergické reakce
V souvislosti s užíváním přípravku Cayston byla hlášena vyrážka, která může být příznakem alergické reakce na aztreonam (viz bod 4.4).
Snížení hodnot funkčních plicních testůtestů
Při používání přípravku Cayston bylo hlášeno snížení hodnot funkčních plicních testůtestů c, které však nebylo spojeno s trvalým poklesem FEV1 (viz bod 5.1).
Následující vzácné a těžké nežádoucí účinky byly hlášeny po parenterálním použití jiných přípravků obsahujících aztreonam: toxická epidermální nekrolýza, anafylaxe, purpura, erythema multiforme, exfoliativní dermatitida, kopřivka, petechie, svědění, diaforéza.
Pediatrická populace
V klinických studiích fáze 2 a fáze 3 bylo celkem 137 pediatrických pacientů ve věku od 6 do 17 let s chronickou infekcí způsobenou bakterií P. aeruginosa a předpokládanou hodnotou FEV1 < 75 % léčeno přípravkem Cayston (6-12 let, n=35; 13-17 let, n=102).
Pyrexie byla ve větší míře pozorována u pediatrických pacientů ve věku od 6 do 17 let v porovnání s dospělými.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Nežádoucí účinky specificky související s předávkováním přípravkem Cayston nebyly zjištěny. Jelikož plazmatická koncentrace aztreonamu po podání přípravku Cayston (75 mg) je přibližně 0,6 pg/ml, v porovnání k sérovým hladinám 54 pg/ml po podání aztreonamu pro injekční podání (500 mg), neočekávají se v souvislosti s předávkováním aztreonamem žádné bezpečnostní problémy.
5. FARMAKOLOGICKE VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antibakteriální látky pro systémovou aplikaci, jiná beta-laktamová antibiotika, ATC kód: J01DF01
Mechanismus účinku
Aztreonam účinkuje in vitro proti gramnegativním aerobním patogenům včetně P. aeruginosa. Aztreonam se váže na penicilin vázající proteiny citlivých bakterií, což vede k inhibici syntézy bakteriální buněčné stěny a následné filamentaci a lýze buněk.
Mechanizmus rezistence
Ztráta citlivosti na aztreonam u pacientů s CF infikovaných bakterií aeruginosa byla způsobena buď selekcí kmenů s mutacemi lokalizovanými na chromozomu, nebo vzácně získáním genů prostřednictvím plasmidu/integronu.
Známý mechanizmus rezistence na aztreonam způsobený mutací chromozomálních genů zahrnuje hyperexpresi AmpC beta-laktamázy skupiny C a zvýšenou regulaci efluxní pumpy MexAB-OprM. Známý mechanizmus rezistence na aztreonam, způsoben získáním genů zahrnuje získání beta-laktamáz rozšířeného spektra účinku (extended spectrum beta-lactamases, ESBL), které hydrolyzují čtyřčlenný řetězec aztreonamu obsahující dusík.
ESBL beta-laktamázy ze skupiny A, B a D mohou vykazovat aktivitu proti aztreonamu. Beta-laktamázy skupiny A hydrolyzující aztreonam zahrnují VEB typ (zejména jihovýchodní Asie), typ PER (Turecko) a typy GES a IBC (Francie, Řecko a Jižní Afrika). Vzácně je hlášen výskyt organizmů rezistentních na aztreonam obsahující metalo-beta-laktamázy (MBL) skupiny B, VIM-5 (K. pneumoniae a P. aeruginosa - Turecko), VIM-6 (P. putida - Singapur) a VIM-7 (P. aeruginosa -Spojené státy americké). Je však možné, že tyto organizmy exprimovaly vícenásobný mechanizmus rezistence a MBL nebyla odpovědná za pozorovanou rezistenci na aztreonam. Vzácně jsou hlášeny beta-laktamázy skupiny D z klinických izolátů P. aeruginosa, OXA-11 (Turecko) a OXA-45 (Spojené státy americké), které hydrolyzují aztreonam.
Mikrobiologie
Jeden vzorek sputa od pacienta s CF může obsahovat více izolátů P. aeruginosa a každý izolát může mít různou úroveň in vitro citlivosti na aztreonam. Ke sledování citlivosti P. aeruginosa izolované od pacientů s CF se mohou použít in vitro metody testování antimikrobiální citlivosti používané při terapii aztreonamem na parenterální použití.
Ve studiích fáze 3 kontrolovaných placebem s přípravkem Cayston obvykle překračovaly lokální koncentrace aztreonamu hodnoty MIC aztreonamu pro P. aeruginosa, bez ohledu na úroveň jejich citlivosti.
Léčba až devíti 28denními cykly 75 mg přípravku Cayston 3krát denně měla za následek klinicky významné zlepšení respiračních symptomů, plicních funkcí a hustoty CFU (Colony Forming Unit)
P. aeruginosa ve sputu; nebylo zjištěno zvýšení hodnot MIC50 pro P. aeruginosa (± 2 změny ředění),
zatímco hodnota MIC90 se přerušovaně zvyšovala až na 4násobek počáteční hodnoty MIC. Ve 24tý denní kontrolované klinické studii u pacientů léčených Caystonem nebylo zjištěno zvýšení hodnot MIC50 pro P. aeruginosa (± 2 změny ředění), zatímco hodnota MIC90 se zvyšovala na 4násobek počáteční hodnoty MIC. Na konci studie se procento pacientů s MIC aztreonamu pro P. aeruginosa nad parenterální hraniční hodnotou (> 8 pg/ml) zvýšilo z 34 % na začátku studie na 49 %, procento pacientů s P. aeruginosa rezistentní na alespoň 1 beta-laktamové antibiotikum se zvýšilo z 56 % na začátku studie na 67 %, a procento pacientů s P. aeruginosa rezistentní na všechna testovaná beta-laktamová antibiotika se zvýšilo ze 13 % na začátku studie na 18 %. Existuje riziko, že se u pacientů léčených přípravkem Cayston vyvinou izoláty P. aeruginosa rezistentní na aztreonam nebo jiná beta-laktamová antibiotika. Vznik parenterální rezistence P. aeruginosa na aztreonam a na další beta-laktamová antibiotika může mít potencionální důsledky pro další léčbu akutních plicních exacerbací systémovými antibiotiky. Po léčbě přípravkem Cayston však byla pozorována podobná zlepšení funkce plic u pacientů s izoláty P. aeruginosa citlivými nebo rezistentními na aztreonam.
Ve studiích s přípravkem Cayston s až devíti 28denními cykly nebyly pozorovány žádné klinicky významné nárůsty dalších - gramnegativních bakteriálních patogenů dýchacích cest (kmeny Burkholderia, Stenotrophomonas maltophilia a kmeny Alcaligenes) izolovaných během léčby. Během 6měsíční randomizované fáze studie GS-US-205-0110 se MSSA a MRSA izolované během léčby vyskytovaly častěji u pacientů léčených aztreonamem než u pacientů léčených roztokem tobramycinu pro nebulizátor (Tobramycin Nebuliser Solution, TNS). Výskyt většiny izolatů vyvinutých během léčby byl přerušovaný. Přetrvávající přítomnost MSSA během léčby (definované jako nepřítomný při vyšetření/na začátku studie a potom přítomný ve 3 nebo více po sobě následujících kontrolách) se vyskytla u 6 % pacientů léčených aztreonamem v porovnání se 3 % pacientů léčených TNS. Přerušovaná přítomnost izolátů MRSA během léčby se vyskytla u 7 % pacientů léčených aztreonamem ve srovnání s 1 % pacientů léčených pomocí TNS a přetrvávající přítomnost izolátů MRSA se vyskytla u 3 % pacientů léčených aztreonamem a nevyskytla se u žádného pacienta léčeného TNS. V literatuře se uvádí souvislost mezi přetrvávajícím výskytem MRSA a závažnějším onemocněním a vyšší mortalitou. Během klinických studií s přípravkem Cayston neměla přítomnost MRSA za následek zhoršení funkce plic.
Klinická účinnost a bezpečnost
Přípravek Cayston byl porovnáván s léčbou TNS po dobu tří 28denních cyklů léčby v randomizované, multicentrické studii kontrolované léčivou látkou (GS-US-205-0110). Pacienti účastnící se studie v Evropě, kteří ukončili alespoň 1 cyklus léčby přípravkem Cayston nebo TNS během randomizované fáze, mohli být následně léčeni až třemi 28denními cykly léčby přípravkem Cayston v otevřené pokračující fázi. Kritéria pro zařazení zahrnovala CF, předpokládanou hodnotu FEV1 < 75 %, stabilní plicní onemocnění, pozitivní kultivační test pro P. aeruginosa ze sputa a předchozí léčbu antibiotiky v aerosolu bez prokázané lékové intolerance.
Cayston byl hodnocen během 28denní léčby (jeden cyklus) ve dvou randomizovaných, dvojitě zaslepených, multicentrických studiích kontrolovaných placebem (CP-AI-005 a CP-AI-007). Pacienti kteří se účastnili těchto studií měli možnost následné léčby více cykly přípravku Cayston v otevřené sledovací studii (CP-AI-006). Podmínky pro zařazení do studie zahrnovaly CF s počáteční hodnotou FEV1 předpokládananou mezi 25 % a 75 % a chronickou plicní infekci P. aeruginosa.
Celkem bylo v těchto studiích léčeno 539 pacientů (78 % dospělých). Studie byly prováděny s použitím systému nebulizátoru Altera pro podaní přípravku Cayston.
GS-US-205-0110
Do studie GS-US-205-0110 bylo randomizováno 268 pacientů s CF a chronickou plicní infekcí P. aeruginosa, kteří byli léčeni přípravkem Cayston (n=136) nebo TNS (n=132). Do studie bylo zařazeno 59 pediatrických pacientů ve věku od 6 do 17 let. Pacienti byli randomizováni v poměru 1:1 pro léčbu buď aztreonamem (75 mg) podávaným inhalací 3krát denně nebo TNS (300 mg) podávaným 2krát denně. Léčby byly podávány ve třech 28denních cyklech léčby následovaných 28denní přestávkou v léčbě. Společným hlavním cílem byla srovnatelnost přípravku Cayston a TNS v relativní změně přepokládané hodnoty FEVi % od začátku studie do 28. dne a lepší výsledky přípravku Cayston v porovnání s TNS v aktuální změně přepokládané hodnoty FEV1 % od začátku studie přes 3 léčebné cykly (průměrná hodnota aktuálních změn předpokládaných hodnot FEV1% pozorovaných na konci každého léčebného cyklu).
Upravená průměrná procentuální změna předpokládané hodnoty FEV1 % od začátku studie do 28. dne byla ve skupině s přípravkem Cayston 8,35 a ve skupině s TNS 0,55 (rozdíl mezi léčbami: 7,80; p=0,0001; 95 % CI: 3,86, 11,73). Upravená průměrná aktuální procentuální změna předpokládané hodnoty FEV1 % od začátku studie přes 3 léčebné cykly byla 2,05 ve skupině s přípravkem Cayston a -0,66 ve skupině s TNS (rozdíl mezi léčbami: 2,70; p=0,0023; 95 % CI: 0,98, 4,43). U pacientů léčených aztreonamem byla doba do potřeby použití i.v. antipseudomonálních antibiotik v souvislosti s respiračními příhodami delší než u pacientů léčených TNS (p=0.0025). Odhady podle Kaplan-Meiera pro míru těchto příhod ve 24. týdnu byly 36 % pro pacienty léčené aztreonamem a 54 % pro pacienty léčené TNS. Dodatečně se u pacientů léčených aztreonamem vyskytl nižší počet hospitalizací z důvodů respiračních příhod (40 oproti 58, p=0,044) a méně respiračních příhod vyžadujících použití i.v. nebo inhalovaných antipseudomonálních antibiotik (84 oproti 121, p=0,004) než u pacientů léčených TNS. Pacienti léčení aztreonamem vykazovali rovněž větší průměrné zlepšení skóre respiračních symptomů CFQ-R v porovnání s pacienty léčenými TNS v průběhu 3 léčebných cyklů (6,30 oproti 2,17, p=0,019).
V limitované podskupině pacientů, kteří byli léčeni inhalovaným tobramycinem po dobu méně než 84 dnů během předcházejících 12 měsíců (n=40), bylo zlepšení funkce plic v 28. den a přes tři 28denní léčebné cykly v počtu menší u pacientů léčených aztreonamem než u pacientů léčených TNS.
CP-AI-007
Do studie CP-AI-007 bylo zařazeno 164 dospělých (převážně) a pediatrických pacientů randomizovaných v poměru 1:1 přičemž se porovnávalo 75 mg přípravku Cayston (80 pacientů) s placebem (84 pacientů) podávaných 3krát denně po dobu 28 dnů (jeden cyklus). U pacientů bylo před začátkem léčby studijním přípravkem vyžadováno alespoň 28denní období bez léčby antipseudomonálními antibiotiky.
U pacientů léčených jedním cyklem přípravku Cayston se od počátečního stavu do 28. dne výrazně zlepšila funkce plic a respirační symptomy.
CP-AI-005
Do studie CP-AI-005 bylo zařazeno 246 dospělých (převážně) a pediatrických pacientů. Všichni pacienti byli léčeni roztokem 300 mg tobramycinu pro nebulizátor 2krát denně po dobu čtyř týdnů bezprostředně před podáváním přípravku Cayston nebo placeba 2krát nebo 3krát denně po dobu 28 dnů. Pacienti pokračovali ve své počáteční medikaci, včetně užívání makrolidových antibiotik. Pacienti byli randomizováni v poměru 2:2:1:1 pro léčbu 75 mg aztreonamu 2krát nebo 3krát denně nebo stejným objemem placeba 2krát nebo 3krát denně po dobu 28 dnů, bezprostředně po 28denním úvodním otevřeném cyklu léčby s TNS.
Terapie aztreonamem vedla k výraznému zlepšení funkce plic a respiračních symptomů v 28. den léčby u 66 pacientů léčených jedním cyklem 75 mg přípravku Cayston 3krát denně.
CP-AI-006
CP-AI-006 byla otevřená sledovací studie ke studiím CP-AI-005 a CP-AI-007 hodnotící bezpečnost opakované expozice aztreonamu a účinek na cíl léčby související s onemocěním ve více 28denních cyklech. Pacienti dostávali přípravek Cayston ve stejné frekvenci (2krát nebo 3krát denně) jako přípravek Cayston nebo placebo v randomizovaných studiích. Pacienti pokračovali ve své počáteční medikaci a u většiny pacientů byla používána další antibiotika při kterékoliv indikaci k léčbě exacerbací. Každý 28denní cyklus přípravku Cayston byl následován 28denní přestávkou bez používání přípravku. Hodnoty funkce plic (FEV1), skóre respiračních symptomů CFQ-R a hustoty
P. aeruginosa ve sputu naměřené během devíti 28denních cyklů terapie prokázaly tendenci k zlepšování během léčby ve srovnání s přestávkami v léčbě. Vzhledem k nekontrolované povaze studie a další souběžné medikaci nelze vyvodit žádné závěry na podporu udržitelnosti pozorovaného krátkodobého přínosu během následných cyklů léčby.
Pediatrická populace
V klinických studiích fáze 2 a fáze 3 bylo léčeno přípravkem Cayston celkem 137 pediatrických pacientů ve věku od 6 do 17 let s chronickou infekcí způsobenou P. aeruginosa a předpokládanou hodnotou FEVi < 75 %. Pediatričtí pacienti zaznamenali klinická zlepšení při léčbě aztreonamem vyjádřené zvýšením hodnoty FEV1, zlepšením skóre respiračních symptomů CFQ-R a poklesem hustoty P. aeruginosa ve sputu. Na základě výše uvedených klinických zkušeností je přípravek Cayston indikován pro použití u pediatrických pacientů ve věku od 6 let s opakovanými28denními léčebnými cykly následovanými 28denní přestávkou v léčbě přípravkem Cayston.
V otevřené studii fáze 2 (GS-US-205-0162) dostávalo 105 pediatrických pacientů ve věku 3 měsíce až < 18 let (24 pacientů ve věku 3 měsíce až < 2 roky; 25 pacientů ve věku od 2 do < 6 let; 56 pacientů ve věku do 6 do < 18 let) s CF a dokumentovanou úvodní/nově vzniklou infekcí/kolonizací způsobenou P. aeruginosa přípravek Cayston 3krát denně v jednom 28denním cyklu.
Ze 101 pacientů, z nichž všichni měli pozitivní kultivaci na P. aeruginosa během 30 dnů od zařazení do studie, z nichž 56 (55,4 %) bylo bez P. aeruginosa při vstupu do studie, kteří dokončili 28denní léčebný cyklus, bylo 89,1 % (n=90) bez P. aeruginosa na konci léčby (28. den) a 75,2 % (n=76) bez P. aeruginosa 1 měsíc po ukončení léčby (56. den). Celkem 79 pacientů, kteří dokončili 28denní léčebný cyklus a kteří nedostali další antipseudomonální antibiotikum během léčebné fáze, bylo hodnotitelných 6 měsíců po ukončení léčby; z těchto pacientů bylo 58,2 % (n=46) bez P. aeruginosa během tohoto období.
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem Cayston u jedné nebo více podskupin pediatrické populace pacientů s cystickou fibrózou s plicní infekcí způsobenou bakterií Pseudomonas aeruginosa/plicní kolonizací Pseudomonas aeruginosa (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Absorpce
Koncentrace ve sputu
Koncentrace aztreonamu ve sputu vykazovaly u jednotlivých pacientů značný rozptyl.
V kombinovaných, placebem kontrolovaných studiích fáze 3 ve dnech 0, 14 a 28 byly průměrné koncentrace aztreonamu ve sputu u 195 pacientů s CF 10 minut po podání jedné 75 mg dávky inhalovaného aztreonamu 726 pg/g, 711 pg/g a 715 pg/g, což nenaznačuje žádnou akumulaci aztreonamu po opakovaném podávání.
Koncentrace v plazmě
Koncentrace aztreonamu v plazmě vykazovaly u jednotlivých pacientů značný rozptyl.
Jednu hodinu po podání jedné 75 mg dávky inhalovaného atreonamu (přibližný vrchol plazmatické koncentrace) byla průměrná plazmatická hladina u pacientů s CF 0,59 pg/ml. Průměrné nejvyšší plazmatické hladiny ve dnech 0, 14 a 28 léčebného cyklu s 75 mg inhalovaného aztreonamu podávanými 3krát denně byly 0,55 pg/ml, 0,67 pg/ml a 0,65 pg/ml, což nenaznačuje žádnou systémovou akumulaci aztreonamu při podávání 3krát denně. Sérová koncentrace aztreonamu po injekčním podání aztreonamu (500 mg) je naproti tomu přibližně 54 pg/ml.
Koncentrace aztreonamu v plazmě u pediatrických pacientů ve věku 3 měsíce až < 6 let jsou srovnatelné s koncentracemi pozorovanými u dětí ve věku > 6 let, dospívajících a dospělých.
Distribuce
Vazba aztreonamu na proteiny v plazmě činí přibližně 77 % při klinicky významných koncentracích v plazmě.
Metabolismus
Aztreonam není rozsáhle metabolizován. Hlavní metabolit (SQ26,992) je neaktivní a je tvořen otevřením beta-laktamového kruhu hydrolýzou. Údaje o eliminaci naznačují, že přibližně 10 % dávky se vyloučí jako tento metabolit.
Eliminace
Poločas eliminace aztreonamu ze séra je přibližně 2,1 hodiny pro inhalační podání, což je podobné hodnotě hlášené po injekčním podání aztreonamu. Přibližně 10 % celkové dávky inhalovaného aztreonamu se vyloučilo močí jako nezměněný lék, v porovnání s 60-65 % po intravenózním injekčním podání aztreonamu. Systémově absorbovaný aztreonam je vylučován přibližně stejnou mírou aktivní tubulární sekrecí a glomerulární filtrací.
Farmakokinetické vlastnosti u zvláštních populací
Věk a pohlaví
Klinicky relevantní vliv věku a pohlaví na farmakokinetické vlastnosti atreonamu nebyl zjištěn. Porucha funkce ledvin a jater
U pacientů s poruchou funkce ledvin nebo jater nebyly studie farmakokinetických vlastností provedeny.
Farmakokinetické vlastnosti aztreonamu pro injekční podání
Nejvyšší hladiny aztreonamu byly dosaženy asi jednu hodinu po i.m. podání. Po jedné identické i.m. nebo i.v. dávce jsou sérové koncentrace po 1 hodině srovnatelné (1,5 hodiny po zahájení i.v. infuze), s následným podobně probíhajícím spádem koncentrace. U jedinců s normální funkcí ledvin byl průměrný poločas aztreonamu v séru 1,7 hodiny, bez ohledu na dávku a cestu podání. U zdravých jedinců se 60-70 % jedné i.m. nebo i.v. dávky vyloučilo močí po 8 hodinách, přičemž k úplnému vyloučení močí došlo v podstatě po 12 hodinách.
Pediatrická populace
Registrační studie fáze 2 a 3 kontrolované placebem umožnily porovnání koncentrací v plazmě 1 hodinu po podání dávky přípravku Cayston podle věku (6 až 12 let, 13 až 17 let a >18 let). Údaje z těchto studií ukázaly minimální rozdíly v průměrných plazmatických koncentracích aztreonamu mezi věkovými skupinami pacientů léčených přípravkem Cayston 3krát denně.
Sdružené údaje o koncentracích ve sputu z registračních studií fáze 2 a 3 odhalily výskyt nižších průměrných koncentrací ve sputu u pacientů ve věku od 13 do 17 let po jedné dávce přípravku Cayston 3krát denně. Všechny hodnoty koncentrací ve sputu však byly spojeny s relativně velkými směrodatnými odchylkami.
5.3 Předklinické údaje vztahující se k bezpečnosti
104týdenní toxikologická studie na potkanech, provedená za účelem zjištění kancerogenního potenciálu vzestupných inhalačních dávek aztreonamu, neprokázala žádné zvýšení výskytu maligních tumorů související s tímto přípravkem.
Studie genotoxicity (testy chromosomální aberace a mutační testy na buňkách myšího lymfomu) s aztreonamem byly negativní.
Byly provedeny perinatální a postnatální studie fertility a teratologie u potkanů s aztreonamem pro i.v. injekční podání v denních dávkách až 750 mg/kg bez výskytu nežádoucích účinků. Míra přežívání během kojení se mírně snížila u potomků potkaních samiček, které dostávaly nejvyšší dávky.
6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek
Prášek
Lysin
Rozpouštědlo
Chlorid sodný Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
Injekční lahvička s práškem: 4 roky.
Rozpouštědlo: 3 roky.
Po rekonstituci se doporučuje Cayston ihned použít. Pokud se nepoužije okamžitě, musí se rekonstituovaný roztok uchovávat při teplotě 2 °C - 8 °C a použít do 8 hodin. Za podmínky a dobu uchování před použitím rekonstituovaného roztoku zodpovídá uživatel.
6.4 Zvláštní opatření pro uchovávání
Prášek v injekční lahvičce a rozpouštědlo v ampulce: Uchovávejte v chladničce (2 °C - 8 °C). Může se uchovávat mimo chladničku, avšak při teplotách nižších než 25 °C po dobu až 28 dnů.
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
Injekční lahvička s práškem: Skleněná injekční lahvička třídy I jantarové barvy se šedou silikonizovanou pryžovou zátkou a hliníkovým odtrhávacím krytem s modrým víčkem nebo bez něj.
Rozpouštědlo: 1ml ampulka z polyethylenu nízké hustoty.
Jedno 28denní balení přípravku Cayston obsahuje 84 injekčních lahviček lyofilizovaného aztreonamu a 88 ampulek s rozpouštědlem. Jsou dodávány čtyři ampulky s rozpouštědlem navíc pro případ vylití.
K dispozici jsou následující velikosti balení:
• 28denní balení přípravku Cayston
• Balení obsahující jedno 28denní balení přípravku Cayston a jednu soupravu nebulizátoru Altera Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Rekonstituce
Cayston se smí rekonstituovat pouze s dodávaným rozpouštědlem. Po rekonstituci je Cayston čirý, bezbarvý až lehce zabarvený roztok.
Doporučuje se, aby se přípravek Cayston použil okamžitě po rozpuštění v rozpouštědle. Přípravek Cayston se nemá rekonstituovat, pokud dávka není připravena k podání. Jedna skleněná injekční lahvička obsahující přípravek Cayston se otevře odtržením a oddělením modrého víčka nebo zdvihnutím kovové chlopně, odstraněním kovového kroužku opatrným přetažením chlopně (je li třeba, je možné k odstranění použít pinzetu nebo kleštičky) a odstraněním šedé pryžové zátky. Tekutina z jedné ampulky s rozpouštědlem se vymačká do skleněné injekční lahvičky. Injekčními lahvičkami se potom opatrně krouží, až se obsah zcela rozpustí. Rekonstituovaný přípravek Cayston se potom nalije do soupravy nebulizátoru Altera a podá se dávka.
Cayston se podává inhalací po dobu 2 až 3 minut pomocí speciální soupravy nebulizátoru Altera pro Cayston a vyvíječe aerosolu Altera připojeného k ovladači eBase nebo k ovládací jednotce eFlow rapid. Cayston se nesmí používat s jiným typem soupravy nebo vyvíječe aerosolu. Cayston se nesmí mísit s jinými léčivými přípravky v soupravě nebulizátoru Altera. Do soupravy Altera nedávejte žádné jiné léčivé přípravky.
Nerekonstituujte ani nesměšujteCayston s jinými rozpouštědly nebo léčivými přípravky. Nemá se rekonstituovat více než jedna dávka najednou. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Gilead Sciences International Ltd
Granta Park
Abington
Cambridge
CB216GT
Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/09/543/001
EU/1/09/543/002
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 21. září 2009 Datum posledního prodloužení registrace:
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného/výrobců odpovědných za propouštění šarží
Gilead Sciences Ireland UC
IDA Business & Technology Park
Carrigtohill
County Cork
Irsko
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ KRABIČKA PŘÍPRAVKU CAYSTON
(S Blue Boxem - Není určeno pro balení dohromady se soupravou nebulizátoru Altera)
Cayston 75 mg prášek a rozpouštědlo pro roztok k rozprašování aztreonamum
Jedna injekční lahvička s práškem obsahuje aztreonamum 75 mg.
Po rekonstituci obsahuje jeden ml roztoku k rozprašování aztreonamum 75 mg (jako aztreonamum lysinicum).
Injekční lahvička s práškem obsahuje také l-ysin
Ampulka s rozpouštědlem obsahuje chlorid sodný, vodu na injekci
Prášek a rozpouštědlo pro roztok k rozprašování
84 jednorázových injekčních lahviček 88 jednorázových 1ml ampulek s rozpouštědlem
Před použitím si přečtěte příbalovou informaci.
Pouze inhalační podání. Před použitím rekonstituujte. Prášek se smí mísit pouze s dodávaným rozpouštědlem.
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávejte v chladničce. Může se uchovávat mimo chladničku, avšak při teplotách nižších než 25 °C po dobu až 28 dnů.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Gilead Sciences International Ltd
Granta Park
Abington
Cambridge
CB21 6GT
Velká Británie
EU/1/09/543/001: 28 denní balení přípravku Cayston
Lot
Cayston 75 mg
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ KRABIČKA
(Vnější krabička s Blue Boxem obsahující jedno 28denní balení přípravku Cayston a jednu soupravu nebulizátoru Altera)
Cayston 75 mg prášek a rozpouštědlo pro roztok k rozprašování aztreonamum
Jedna injekční lahvička s práškem obsahuje aztreonamum 75 mg.
Po rekonstituci obsahuje jeden ml roztoku k rozprašování aztreonamum 75 mg (jako aztreonamum lysinicum).
Injekční lahvička s práškem obsahuje také l-ysin
Ampulka s rozpouštědlem obsahuje chlorid sodný, vodu na injekci
Prášek a rozpouštědlo pro roztok k rozprašování
84 jednorázových injekčních lahviček 88 jednorázových 1ml ampulek s rozpouštědlem
Toto balení obsahuje jednu soupravu nebulizátoru Altera.
Před použitím si přečtěte příbalovou informaci.
Pouze inhalační podání. Před použitím rekonstituujte. Prášek se smí mísit pouze s dodávaným rozpouštědlem.
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávejte v chladničce. Může se uchovávat mimo chladničku, avšak při teplotách nižších než 25 °C po dobu až 28 dnů.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Gilead Sciences International Ltd
Granta Park
Abington
Cambridge
CB21 6GT
Velká Británie
EU/1/09/543/002: 28denní balení přípravku Cayston a jedna souprava nebulizátoru Altera
Lot
Cayston 75 mg
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ KRABIČKA PŘÍPRAVKU CAYSTON
(Bez Blue Boxu - použít pouze pro balení dohromady se soupravou nebulizátoru Altera)
Cayston 75 mg prášek a rozpouštědlo pro roztok k rozprašování aztreonamum
Jedna injekční lahvička s práškem obsahuje 75 mg aztreonamum. Comment [E4]: Opravte dle textu výše
Po rekonstituci obsahuje jeden ml roztoku k rozprašování 75 mg aztreonamum (jako lysinicum).
3. SEZNAM POMOCNÝCH LÁTEK_
Injekční lahvička s práškem obsahuje také l-Lysin
Ampulka s rozpouštědlem obsahuje chlorid sodný, vodu na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek a rozpouštědlo pro roztok k rozprašování
84 jednorázových injekčních lahviček 88 jednorázových 1 ml ampulek s rozpouštědlem
Toto balení je samostatně neprodejné.
5. ZPŮSOB A CESTA/CESTY PODÁNÍ_
Před použitím si přečtěte příbalovou informaci.
Pouze pro inhalační podání. Před použitím rekonstituovat. Prášek se smí mísit pouze s dodávaným rozpouštědlem.
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávejte v chladničce. Může se uchovávat mimo chladničku, avšak při teplotách nižších než 25°C po dobu až 28 dnů.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Gilead Sciences International Ltd
Granta Park
Abington
Cambridge
CB21 6GT
Velká Británie
EU/1/09/543/002: 28 denní balení přípravku Cayston a jedna souprava nebulizátoru Altera
Lot
Cayston 75 mg
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNITŘNÍ KRABIČKA PŘÍPRAVKU CAYSTON T NÁZEV LÉČIVÉHO PŘÍPRAVKU
Cayston 75 mg prášek a rozpouštědlo pro roztok k rozprašování aztreonamum
Jedna injekční lahvička s práškem obsahuje 75 mg aztreonamum.
Po rekonstituci obsahuje jeden ml roztoku k rozprašování 75 mg aztreonamum (jako lysinicum).
3. SEZNAM POMOCNÝCH LÁTEK_
Injekční lahvička s práškem obsahuje také l-Lysin
Ampulka s rozpouštědlem obsahuje chlorid sodný, vodu na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek a rozpouštědlo pro roztok k rozprašování
42 jednorázových injekčních lahviček 44 jednorázových 1 ml ampulek s rozpouštědlem
5. ZPŮSOB A CESTA/CESTY PODÁNÍ_
Před použitím si přečtěte příbalovou informaci.
Pouze pro inhalační podání. Před použitím rekonstituovat. Prášek se smí mísit pouze s dodávaným rozpouštědlem.
Uchovávejte mimo dohled a dosah dětí.
EXP
Uchovávejte v chladničce. Může se uchovávat mimo chladničku, avšak při teplotách nižších než 25°C po dobu až 28 dnů.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
Gilead Sciences International Ltd
Granta Park
Abington
Cambridge
CB21 6GT
Velká Británie
EU/1/09/543/001: 28denní balení přípravku Cayston
EU/1/09/543/002: denní balení přípravku Cayston a jedna souprava nebulizátoru Altera 28
Lot
Cayston 75 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Cayston 75 mg prášek pro přípravu roztoku k rozprašování aztreonamum
Pouze inhalační podání.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
75 mg
6. JINÉ
GILEAD
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Solvent for Cayston Sodium Chloride 0.17 %
2. ZPŮSOB PODÁNÍ
Inhalation use only
3. POUŽITELNOST
4. ČÍSLO ŠARŽE
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 ml
6. JINÉ
GILEAD SCIENCES
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
Cayston 75 mg prášek a rozpouštědlo pro roztok k rozprašování
Aztreonamum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je přípravek Cayston a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Cayston používat
3. Jak se přípravek Cayston používá
4. Možné nežádoucí účinky
5. Jak přípravek Cayston uchovávat
6. Obsah balení a další informace
1. Co je přípravek Cayston a k čemu se používá
Přípravek Cayston obsahuje léčivou látku aztreonam. Přípravek Cayston je antibiotikum, které se používá k potlačení chronické infekce plic způsobené bakteriemi Pseudomonas aeruginosa u pacientů s cystickou fibrózou ve věku 6 let a starších. Cystická fibróza, nazývaná také mukoviscidóza, je dědičná, život ohrožující nemoc, která postihuje hlenotvorné žlázy vnitřních orgánů, zejména plic, avšak také jater, slinivky břišní a trávicího systému. Cystická fibróza vede k ucpávání plic hustým lepkavým hlenem. To způsobuje potíže při dýchání.
2. Čemu musíte věnovat pozornost, než začnete přípravek Cayston používat Nepoužívejte přípravek Cayston
- jestliže jste alergický(á) na aztreonam nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před použitím přípravku Cayston se poraďte se svým lékařem:
- jestliže jste alergický(á) na další antibiotika (například penicilín, cefalosporiny, a/nebo karbapenemy)
- jestliže nesnášíte jiné inhalované léčivé přípravky nebo po jejich použití pociťujete tíseň na hrudi
- jestliže máte problémy s ledvinami
- j estliže j ste někdy vykašlával(a) krev
- jestliže jste někdy měl(a) snížené hodnoty funkčních plicních vyšetření.
Pokud se Vás něco z výše uvedeného týká, informujte svého lékaře před tím, než přípravek Cayston použijete.
Jako všechny léky podávané inhalací, může přípravek Cayston způsobit kašel a ten může vést k vykašlávání krve. Pokud jste někdy vykašlával(a) krev, můžete používat přípravek Cayston pouze v případě, že podle názoru Vašeho lékaře výhody používání převáží riziko vykašlávání krve.
Během léčby přípravkem Cayston může u vás dojít dočasně ke snížení hodnot výsledků funkčních plicních vyšetření, v typickém případě se však nejedná o trvalý účinek.
Comment [LC5]: funkčních vyšetření plic
Děti
Přípravek Cayston není určen k použití u dětí mladších 6 let.
Další léčivé přípravky a přípravek Cayston
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek používat.
O používání přípravku Cayston u těhotných žen neexistují klinické údaje, proto nemáte přípravek Cayston používat během těhotenství bez předchozí domluvy s lékařem.
Jestliže plánujete kojit, poraďte se se svým lékařem, dříve než začnete používat přípravek Cayston. Během léčby přípravkem Cayston můžete kojit, protože množství, které může během kojení projít do těla Vašeho dítěte, je velmi malé.
Řízení dopravních prostředků a obsluha strojů
Neočekává se, že by přípravek Cayston ovlivňoval Vaši schopnost řídit a obsluhovat stroje.
3. Jak se přípravek Cayston používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se
se svým lékařem nebo lékárníkem.
Doporučená dávka přípravku je:
- Přípravek Cayston používejte 3krát denně v opakovaných 28denních léčebných cyklech s 28denní přestávkou v léčbě přípravkem Cayston. Každou ze tří dávek je třeba podávat inhalací, nejméně s čtyřhodinovým odstupem, pomocí soupravy nebulizátoru Altera. Se soupravou Altera můžete použít buď ovladač eBase nebo ovládací jednotku eFlow rapid.
- Jedna dávka se skládá z jedné injekční lahvičky přípravku Cayston smísené s obsahem jedné ampulky rozpouštědla. Přípravek Cayston se před inhalací pomocí nebulizátoru Altera musí smísit s rozpouštědlem.
Nalijte připravený roztok Cayston do soupravy nebulizátoru Altera (viz níže). Jedna inhalace trvá
přibližně 2 až 3 minuty.
Před podáním každé dávky přípravku Cayston použijte bronchodilatátor (látka rozšiřující průdušky).
Krátkodobě působící bronchodilatátory je možné použít 15 minut až 4 hodiny a dlouhodobě působící
bronchodilatátory je možné použít 30 minut až 12 hodin před každou dávkou přípravku Cayston.
Pokud používáte jiné inhalační léčby cystické fibrózy, doporučuje se následující pořadí podání:
1. bronchodilatátor
2. mukolytika (přípravek, který pomáhá rozpouštět hustý hlen tvořený v plicích) a nakonec:
3. přípravek Cayston.
Nemiste přípravek Cayston s žádnými dalšími léčivými přípravky v soupravě nebulizátoru Altera.
- Do soupravy nebulizátoru Altera nedávejte žádné jiné léky.
- Do soupravy nebulizátoru Altera nedávejte intravenózní (injekční) formu aztreonamu. Intravenózní forma aztreonamu není vhodná k inhalaci.
Jak se pomocí soupravy nebulizátoru Altera přípravek Cayston používá
Budete potřebovat:
■ jednu injekční lahvičku jantarové barvy s přípravkem Cayston s modrým víčkem nebo bez něj.
■ jednu plastovou ampulku s rozpouštědlem (0,17 % hm./obj roztok chloridu sodného). Údaje uváděné na ampulce s rozpouštědlem jsou pouze v angličtině (viz bod 6).
■ Soupravu nebulizátoru Altera obsahující vyvíječ aerosolu Altera připojený k ovládací jednotce eFlow typu 178 (eFlow rapid) nebo typu 678 (ovladač eBase).
Pro přípravek Cayston musíte používat speciální soupravu nebulizátoru Altera, obsahující vyvíječ aerosolu Altera. Nepokoušejte se použít přípravek Cayston s jinými typy souprav nebulizátorů (ani se soupravou nebulizátoru eFlow rapid).
Před zahájením léčby přípravkem Cayston zkontrolujte, zda Váš nebulizátor pracuje správně.
Přečtěte si pozorně návod k použití od výrobce dodávaného se systémem nebulizátoru Altera.
Příprava přípravku Cayston k inhalaci
- Přípravek Cayston nepřipravujte, pokud nejste sami připraveni použít dávku.
- Nepoužívejte přípravek Cayston, pokud si všimnete, že je obal poškozen.
- Nepoužívejte přípravek Cayston, pokud byl uchováván mimo chladničku po dobu delší než 28 dnů.
- Nepoužívejte rozpouštědlo nebo připravený roztok Cayston, pokud jsou zakalené, nebo pokud se v roztoku nacházejí částice.
1. Vyberte jednu injekční lahvičku přípravku Cayston jantarové barvy a jednu ampulku s rozpouštědlem z krabičky. Ampulky s rozpouštědlem se musí oddělit opatrným zatažením od sebe.
2. Opatrně poklepte na injekční lahvičku jantarové barvy obsahující přípravek Cayston, aby se prášek usadil na dně lahvičky. Tak zajistíte správnou dávku přípravku.
3. Otevřete injekční lahvičku jantarové barvy: odtrhněte a oddělte modré víčko nebo zdvihněte kovovou chlopeň na vrchu injekční lahvičky (obrázek 1a) a tahem dolů (obrázek 1b) opatrně odstraňte kovový kroužek a krycí víčko z injekční lahvičky (obrázek 1c). Bezpečně zlikvidujte kroužek. Opatrně odstraňte pryžovou zátku.
4. Otevřete ampulku s rozpouštědlem otáčením špičky. Vymačkejte celý obsah ampulky do injekční lahvičky (obrázek 1d). Potom opatrně kroužete obsahem injekční lahvičky, až se prášek zcela rozpustí a tekutina je čirá.
Nejlepší je použít přípravek Cayston okamžitě po naředění roztoku. Pokud však nemůžete použít připravenou dávku okamžitě, uzavřete injekční lahvičku zátkou a uchovejte ji v chladničce. Připravený roztok použijte během 8 hodin.
Obrázek 1d
|
ýjí-y w |
(S | |
|
n- m i | ||
|
nS \ \ | ||
|
Obrázek 1a |
Obrázek 1b |
Obrázek 1c |

Příprava nebulizátoru Altera k podání přípravku Cayston
1. Ujistěte se, že souprava nebulizátoru Altera je na rovném, pevném povrchu.
2. Otáčením proti směru hodinových ručiček sejměte víčko nádobky na přípravek.
3. Nalijte všechen roztok přípravku Cayston z injekční lahvičky do nádobky pro přípravek Cayston soupravy nebulizátoru Altera (obrázek 2a). Ujistěte se, že jste vyprázdnili celý obsah injekční lahvičky. Je-li to potřeba, opatrně poklepejte injekční lahvičkou o stěnu nádobky na přípravek.
4. Uzavřete nádobku na přípravek nasměrováním výstupků víčka nádobky na přípravek na zářezy na nádobce. Víčko zatlačte směrem dolů a otočte ve směru hodinových ručiček až na doraz (obrázek 2b).

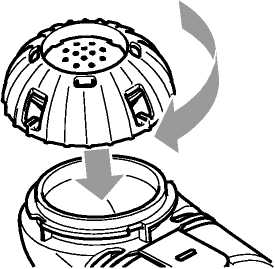
Obrázek 2b
Použití nebulizátoru Altera k podání přípravku Cayston
1. Zahajte léčbu. Seďte ve vzpřímené, pohodlné poloze. Držte soupravu ve vodorovné poloze, vložte náustek do úst a obemkněte ho rty (obrázek 3).
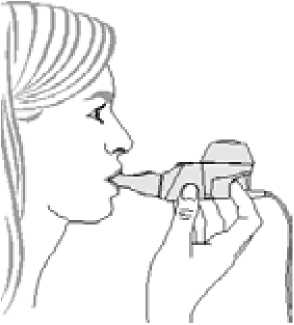
Obrázek 3
Soupravu držte stále ve vodorovné poloze.
2. Stiskněte a několik sekund držte tlačítko zapnuto/vypnuto na ovládací jednotce. Uslyšíte „pípnutí“ a kontrolka stavu začne svítit zeleně.
3. Po několika sekundách začne do komory soupravy nebulizátoru Altera proudit aerosolová mlha. Jestliže aerosolová mlha nezačne proudit, prosím, informujte se v návodu k použití soupravy Altera.
4. Normálně dýchejte (vdechujte a vydechujte) přes náustek. Nedýchejte nosem. Pokračujte ve vdechování a vydechování do konce léčby.
5. Po podání celé dávky přípravku uslyšíte tón oznamující, že je léčba dokončena (2 „pípnutí“).
6. Po dokončení inhalace otevřete víčko nádobky na přípravek a ujistěte se, že všechen přípravek byl použit. Po ukončení léčby smí v nádobce zůstat pouze několik kapek přípravku. Pokud se zde nachází více než několik kapek tekutiny, uzavřete nádobku víkem a dokončete léčbu.
7. Po dokončení léčby odpojte ovládací jednotku a rozeberte soupravu nebulizátoru Altera na vyčištění a dezinfekci. Podrobné informace o čištění a dezinfekci naleznete v návodu k použití dodávaném se soupravou nebulizátoru Altera.
Co když musím přerušit léčbu před jejím ukončením?
8. Pokud z jakéhokoli důvodu musíte předčasně přerušit inhalaci, stiskněte tlačítko zapnuto/vypnuto na jednu sekundu. K dokončení léčby stiskněte tlačítko zapnuto/vypnuto na jednu sekundu a začněte opět inhalovat.
Výměna soupravy nebulizátoru Altera
Souprava nebulizátoru Altera je vyrobena tak, aby vydržela tři 28denní léčebné cykly přípravkem Cayston, pokud je používána podle pokynů. Po této době je třeba soupravu nebulizátoru Altera včetně vyvíječe aerosolu vyměnit. Pokud zjistíte, že se její účinnost změnila ještě před uplynutím této doby (například, pokud tvorba aerosolové mlhy trvá déle než 5 minut), prostudujte si prosím návod k použití nebulizátoru Altera.
Jestliže jste použil(a) více přípravku Cayston, než jste měl(a)
Pokud jste použil(a) více přípravku Cayston, než jste měl(a), informujte okamžitě lékaře nebo lékárníka.
Jestliže jste zapomněl(a) použít přípravek Cayston
Pokud zapomenete dávku, stále můžete použít 3 dávky denně, pokud je použijete s alespoň 4hodinovým odstupem. Pokud nemůžete dodržet 4hodinový odstup, zapomenutou dávku jednoduše vynechte.
Jestliže jste přestal(a) používat přípravek Cayston
Neukončujte používání přípravku Cayston bez toho, abyste se poradili se svým lékařem.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pokud se u Vás objeví vyrážka, informujte okamžitě svého lékaře, protože to může znamenat, že máte alergickou reakci na přípravek Cayston.
Velmi časté nežádoucí účinky (postihují více než 1 pacienta z 10)
- kašel
- ucpaný nos
- sípání
- bolest v krku
- dušnost
- horečka. Může se vyskytovat častěji u dětí než u dospělých.
Časté nežádoucí účinky (postihují 1 až 10 pacientů ze 100)
- dýchací obtíže
- nepříjemný pocit na hrudi
- zvýšený výtok z nosu
- vykašlávání krve
- vyrážka
- bolesti kloubů
- snížené hodnoty funkčních plicních vyšetření
Méně časté nežádoucí účinky (postihují 1 až 10 pacientů z 1 000)
- otoky kloubů
Následující nežádoucí účinky byly pozorovány po použití aztreonamu pro injekční podání, nebyly však pozorovány po použití přípravku Cayston: otoky obličeje, rtů, jazyka a/nebo hrdla spojené s obtížemi při polykání nebo dýchání, pocení, podráždění nebo olupování kůže, svědící vyrážka, zrudnutí, malé červené skvrny na kůži a velmi vzácně půchýře na kůži. Všechny tyto známky mohou být příznaky alergické reakce.
Pokud se u Vás vyskytnou některé z těchto nežádoucích účinků, informujte svého lékaře.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Cayston uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku injekční lahvičky, na ampulce s rozpouštědlem a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Injekční lahvička s práškem a ampulka s rozpouštědlem:
Uchovávejte v chladničce (2 °C - 8 °C). Neotevřené injekční lahvičky se mohou uchovávat mimo chladničku, avšak při teplotách nižších než 25 °C po dobu až 28 dnů.
Přípravek Cayston použijte ihned po připravení. Pokud se nepoužije okamžitě, musí se připravený roztok uchovávat při teplotě 2 °C - 8 °C a použít do 8 hodin. Nepřipravujte více než jednu dávku najednou.
Nepoužívejte přípravek Cayston, pokud si všimnete, že je obal poškozen.
Nepoužívejte přípravek Cayston, pokud byl uchováván mimo chladničku po dobu delší než 28 dnů.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Cayston a rozpouštědlo obsahují
- Injekční lahvička s práškem obsahuje aztreonamum 75 mg (jako aztreonamum lysinicum).
- Ampulka s rozpouštědlem obsahuje vodu na injekci a chlorid sodný. Údaje na ampulce jsou vytištěny pouze v angličtině. Údaje uváděné na ampulce jsou uvedeny níže:
Rozpouštedlo pro Cayston Chlorid sodný 0,17 % Pouze inhalační podání
1 ml_
GILEAD SCIENCES
Jak přípravek Cayston vypadá a co obsahuje toto balení
Přípravek Cayston je bílý až téměř bílý prášek a rozpouštědlo pro roztok k rozprašování.
Přípravek Cayston se dodává ve 2ml skleněné injekční lahvičce jantarové barvy se šedou pryžovou zátkou a hliníkovým odtrhávacím krytem s modrým víčkem nebo bez něj.
1 ml rozpouštědla se dodává v plastikové ampulce.
Comment [LC6]: For Authority: We suggest no to implement this change as it’s part of already approved legacy text and outside of the scope of the variation.
Jedno 28denní balení přípravku Cayston obsahuje 84 injekčních lahviček lyofilizovaného přípravku
Cayston a 88 ampulek s rozpouštědlem. Jsou dodávány čtyři ampulky s rozpouštědlem navíc pro případ vylití.
Comment [LC7]: For Authority: We suggest no to implement this change as it’s part of already approved legacy text and outside of the scope of the variation.
K dispozici jsou následující velikosti balení:
• 28denní balení přípravku Cayston
• Balení obsahující jedno 28denní balení přípravku Cayston a jednu soupravu nebulizátoru Altera Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci:
Gilead Sciences International Ltd
Granta Park
Abington
Cambridge
CB21 6GT
Velká Británie
Výrobce:
Gilead Sciences Ireland UC
IDA Business & Technology Park
Carrigtohill
County Cork
Irsko
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Belgie/Belgique/Belgien Lietuva
Gilead Sciences Belgium SPRL-BVBA Gilead Sciences Sweden AB
Tél/Tel: + 32 (0) 2 401 35 50 Tel: + 46 (0) 8 5057 1849
Etirapna Luxembourg/Luxemburg
Gilead Sciences International Ltd Gilead Sciences Belgium SPRL-BVBA
Ten.: + 44 (0) 20 7136 8820 Tél/Tel: + 32 (0) 2 401 35 79
Magyarország
Gilead Sciences International Ltd
Česká republika
Gilead Sciences s.r.o Tel: + 420 910 871 9862
Tel: + 44 (0) 20 7136 8820
Danmark
Gilead Sciences Sweden AB
Tlf: + 46 (0) 8 5057 1849
Malta
Gilead Sciences International Ltd Tel: + 44 (0) 20 7136 8820
Nederland
Gilead Sciences Netherlands B.V.
Deutschland
Gilead Sciences GmbH Tel: + 49 (0) 89 899890-0
Eesti
Gilead Sciences Sweden AB Tel: + 46 (0) 8 5057 1849
Tel: + 31 (0) 20 718 36 98
Norge
Gilead Sciences Sweden AB
Tlf: + 46 (0) 8 5057 1849
Osterreich
Gilead Sciences GesmbH Tel: + 43 1 260 830
EkkáSa
Gilead Sciences Ekká^ M.EnE. Tpk: +30 210 8930 100
|
Espaňa Gilead Sciences, S.L. Tel: + 34 91 378 98 30 |
Polska Gilead Sciences Poland Sp. z o.o. Tel: + 48 22 262 8702 |
|
France Gilead Sciences Tél: + 33 (0) 1 46 09 41 00 |
Portugal Gilead Sciences, Lda. Tel: + 351 21 7928790 |
|
Hrvatska Gilead Sciences International Ltd Tel: + 44 (0) 20 7136 8820 |
Románia Gilead Sciences International Ltd Tel: + 44 (0) 20 7136 8820 |
|
Ireland Gilead Sciences Ltd Tel: + 44 (0) 8000 113700 |
Slovenija Gilead Sciences International Ltd Tel: + 44 (0) 20 7136 8820 |
|
Ísland Gilead Sciences Sweden AB Sími: + 46 (0) 8 5057 1849 |
Slovenská republika Gilead Sciences International Ltd Tel: + 421 232 121 210 |
|
Italia Gilead Sciences S.r.l. Tel: + 39 02 439201 |
Suomi/Finland Gilead Sciences Sweden AB Puh/Tel: + 46 (0) 8 5057 1849 |
|
Kúnpo^ Gilead Sciences EXXá^ M.EnE. TpX: + 30 210 8930 100 |
Sverige Gilead Sciences Sweden AB Tel: + 46 (0) 8 5057 1849 |
|
Latvija Gilead Sciences Sweden AB Tel: + 46 (0) 8 5057 1849 |
United Kingdom Gilead Sciences Ltd Tel: + 44 (0) 8000 113700 |
Tato příbalová informace byla naposledy revidována .
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
38