Capd/Dpca 4
sp.zn. sukls238876/2009, sukls238879/2009, sukls238883/2009
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
CAPD/DPCA 2 CAPD/DPCA 3 CAPD/DPCA 4
roztok pro peritoneální dialýzu
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 000 ml obsahuje:
|
CAPD/DPCA |
2 |
3 |
4 |
|
natrii chloridum |
5,786 g |
5,786 g |
5,786 g |
|
natrii lactatis S solutio (odpovídá natrii lactas S 3,925 g) |
7,85 g |
7,85 g |
7,85 g |
|
calcii chloridum dihydricum |
0,2573 g |
0,2573 g |
0,2573 g |
|
magnesii chloridum hexahydricum |
0,1017 g |
0,1017 g |
0,1017 g |
|
glucosum monohydricum |
16,5 g |
46,75 g |
25,0 g |
|
(odpovídá glucosum) |
(15,0 g) |
(42,5 g) |
(22,73 g) |
|
Na+ |
134 mmol/l |
134 mmol/l |
134mmol/l |
|
Ca++ |
1,75 mmol/l |
1,75 mmol/l |
1,75mmol/l |
|
Mg++ |
0,5 mmol/l |
0,5 mmol/l |
0,5 mmol/l |
|
Cl- |
103,5 mmol/l |
103,5mmol/l |
103,5mmol/l |
|
laktát |
35 mmol/l |
35 mmol/l |
35 mmol/l |
3. LÉKOVÁ FORMA
Roztok pro peritoneální dialýzu.
Popis přípravku: čirý, bezbarvý, nejvýše nažloutlý roztok.
|
teoretická osmolarita |
358 mosm/l |
511 mosm/l |
401 mosm/l |
|
pH - |
5,5 |
5,5 |
5,5 |
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Pro použití u pacientů v terminálním stadiu renálního selhání různé patogenese.
4.2 Dávkování a způsob podání
Dávkování
CAPD/DPCA je indikováno výlučně pro intraperitoneální podání.
Způsob terapie, frekvence podávání a požadovaná doba ponechání v peritoneu budou určeny ošetřujícím lékařem.
Kontinuální ambulantní peritoneální dialýza (CAPD)
Není-li stanoveno jinak, podává se při terapii 2000 ml roztoku. Pokud se na začátku terapie objeví bolesti z napětí v břišní dutině, množství dialyzátu se má dočasně snížit na 500 - 1500 ml na jednu terapii.
U dětí je doporučena dávka 500 - 1500 ml (30-40 ml/kg tělesné váhy) v závislosti na věku a tělesné hmotnosti.
U dospělých s vyšší tělesnou hmotností, nebo u pacientů s tolerancí většího objemu, může být podávána dávka až 2500 - 3000 ml.
Automatizovaná peritoneální dialýza (APD)
Pro přerušovanou nebo kontinuální cyklickou peritoneální dialýzu s použitím přístroje je doporučeno použít vaky s větším obsahem. Používá se sleep safe nebo stay safe systém.
Starší pacienti
Žádná zvláštní doporučení pro dávkování u starších pacientů nejsou k dispozici.
Způsob podání
Při intervalech 4-8 hodin podávejte každých 24 hodin čtyřikrát dávku 2000 ml (celková dávka 8000 ml), nebo dávku adekvátně zmenšenou nebo zvětšenou (dávkování je pouze doporučené, dávka musí být individuálně přizpůsobena pacientovi).
Zahřejte roztok připravený k použití na teplotu těla, podrobnosti viz bod 6.6.
Určená dávka je po dobu 5-20 minut zaváděna do peritoneální dutiny s použitím peritoneálního katétru.
Dávka se ponechává v peritoneální dutině po dobu 4 - 8 hodin (rovnovážná doba), poté má být vypuštěna a nahrazena.
Podle stavu tekutiny a koncentrace elektrolytů může být CAPD/DPCA použit v kombinaci s jiným roztokem pro peritoneální dialýzu s nižším/vyšším obsahem glukózy (tj. s nižší/vyšší osmolaritou) nebo s jinou koncentrací draslíku nebo sodíku.
Aby se chránilo peritoneum a aby se zabránilo riziku dehydratace, měly by se vysoké koncentrace glukózy, přítomné např. v CAPD/DPCA 3, používat pokud možno co nejméně. Většinou postačuje jedna nebo dvě výměny s vysokou koncentrací glukózy; pro další výměny se používají ostatní roztoky s nižší koncentrací glukózy
Terapie se podle předepsaných dávek provádí denně. Probíhá do té doby, dokud je jí potřeba pro nahrazení renálních funkcí.
4.3 Kontraindikace
Pro CAPD/DPCA 2, CAPD/DPCA 4:
hypokalémie
hyperkalcinémie
Pro CAPD/DPCA 3
hypovolémie, nízký krevní tlak, hypokalémie, hyperkalémie.
Pro peritoneální dialýzu obecně:
Peritoneální dialýza nesmí být prováděna při následujících obtížích:
- nemoci, které mají vliv na integritu břišní stěny nebo peritoneální dutiny, jako například: nedávné břišní zranění, popáleniny břicha, jiné rozsáhlé zánětlivé stavy na kůži břicha (dermatitida) v oblasti vývodu katetru, peritonitida, abdominální perforace, série více břišních operací s fibrózními srůsty, zánětlivé onemocnění střev (Crohnova nemoc, ulcerózní kolitida, divertikulitida), intraabdominální nádory, nedávné břišní chirurgické zákroky, ileus, abdominální kýly; vnitřní nebo zevní abdominální píštěl,
- plicní onemocnění, zejména pneumonie,
- sepse,
- laktacidóza,
- kachexie a extrémní úbytek tělesné hmotnosti, zvláště když není možné zajistit adekvátní výživu,
- ve výjimečných případech urémie, která již nemůže být zvládnuta peritoneální dialýzou,
- extrémní hyperlipidémie,
- u pacientů psychicky nebo mentálně neschopných vykonávat peritoneální dialýzu podle instrukcí lékaře.
Pokud se během léčby peritoneální dialýzou vyvine jakékoliv z výše uvedených onemocnění, o dalším postupu léčby rozhodne ošetřující lékař.
4.4 Zvláštní upozornění a opatření pro použití
Roztok pro peritoneální dialýzu nesmí být použit pro intravenózní infuzi.
Nerovnováha elektrolytů způsobená zvracením nebo průjmem může vyžadovat dočasné použití dialyzačního roztoku s obsahem draslíku.
V případech hyperkalcinémie, např. v důsledku vysokých dávek fosfátových pojiv s obsahem vápníku a/nebo vitamínu D, je nutné dočasně nebo trvale použít roztoku s nižším obsahem vápníku.
U dětí musí být množství dialyzátu redukováno podle věku a tělesné hmotnosti (viz také bod 4.2). U starších pacientů musí být před peritoneální dialýzou zvážen častější výskyt kýly.
Přesné záznamy stavu tekutin a tělesné hmotnosti musí být zajištěny, aby nedošlo k dehydrataci nebo hyperhydrataci s potenciálním ohrožením života. Pravidelně má být monitorován fyzický stav, koncentrace elektrolytů, kreatininu a močoviny, proteiny v séru, hladina glukózy v krvi a pokud je třeba, další laboratorní hodnoty (např. krevní plyny, acidobazická rovnováha).
U diabetických pacientů musí být upravena dávka inzulínu podle zvýšeného příjmu glukózy. Jsou proto třeba pravidelné kontroly glukózy v krvi.
Během dlouhotrvající peritoneální dialýzy se může změnit propouštěcí schopnost peritoneální membrány, primárně indikovaná úbytkem ultrafiltrace. Ve vážných případech musí být zastavena peritoneální dialýza a zavedena hemodialýza.
V průběhu výměny vaků s roztokem musí být udržovány aseptické podmínky, aby se snížilo riziko infekce.
Používejte CAPD/DPCA pouze pokud je roztok čirý a obal nepoškozený. Všechny nepoužité zbytky roztoku musí být zlikvidovány.
Bezpodmínečně je nutné sledovat zákal vypouštěného dialyzátu, snížení jeho množství a břišní bolesti, neboť tyto ukazatele mohou indikovat peritonitidu.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Používání roztoku pro peritoneální dialýzu může snížit působení jiných léků, které prostupují peritoneální membránou. Proto dávkování těchto léků může být nutné upravit.
Pokud jsou při terapii CAPD/DPCA podávány sloučeniny vápníku nebo vitamin D, musí být zvážena možnost hyperkalcémie.
Souběžné podávání diuretik může pomoci udržování zbývající funkce ledvin, ale zároveň může vézt k nerovnováze tekutin a elektrolytů.
Úroveň draslíku musí být pečlivě monitorována, pokud se současně provádí terapie léky obsahujícími digitális, protože citlivost na tyto léky je zvýšena u pacientů s hypokalémií.
U diabetických pacientů musí být upravena denní dávka inzulinu nebo perorálních antidiabetik podle zvýšeného příjmu glukosy.
4.6 Fertilita, těhotenství a kojení
Klinické údaje o použití roztoku CAPD/DPCA u těhotných nebo kojících žen nejsou k dispozici. Nebyly provedeny žádné studie reprodukční toxicity na zvířatech. Peritoneální dialýza roztokem CAPD/DPCA může být prováděna pouze tehdy, pokud potenciální přínos převýší možná rizika pro matku a plod/dítě.
4.7 Účinky na schopnost řídit a obsluhovat stroje
CAPD/DPCA nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
CAPD/DPCA je roztok elektrolytů, jehož složení je v zásadě podobné lidské krvi.
Nežádoucí účinky mohou být vyvolané samotnou peritoneální dialýzou, nebo způsobené dialyzačním roztokem.
Nežádoucí účinky léčebné procedury:
Velmi častou komplikací při všech terapiích peritoneální dialýzou, včetně CAPD/DPCA je peritonitida a infekce výstupního místa a průběhu katetru. Neléčená peritonitida může vézt k sepsi. Příznakem vznikající peritonitidy je zakalený vypouštěný dialyzát, horečka a bolest břicha.
V dialyzátu musí být určeno množství patogenů a leukocytů; pokud existují další příznaky, chybějící zvýšení leukocytů nutně peritonitidu nevylučuje. Je nezbytné okamžitě zajistit léčení (peritoneální a/nebo systémové), které bude odpovídat nejnovějším vědeckým poznatkům a bude používat účinné látky proti předpokládanému patogenu, i když ještě nebudou známé výsledky kultivace.
Relativní úbytek proteinů (5-15 g/den), aminokyselin (1,2-3,4 g/den) a vitamínů rozpustných ve vodě je nevyhnutelný při peritoneální dialýze. Vyrovnat nedostatek je třeba zajištěním adekvátního příjmu ve výživě. Pokud příjem proteinů nevyrovnává ztrátu, může docházet k hypoproteinémii.
Další možné nežádoucí účinky peritoneální dialýzy jsou abdominální napětí a pocit plnosti (bolest břicha), poruchy při vpouštění a vypouštění dialyzačního roztoku, kýla, bederní bolesti, dýchací obtíže způsobené zvednutím bránice, diarea nebo obstipace.
Nežádoucí účinky dialyzačního roztoku:
Dialyzační roztok může způsobit narušení rovnováhy elektrolytů a tekutin, např. hypokalémii.
V kombinaci se zvýšeným příjmem vápníku, např. podáváním fosfátových pojiv s obsahem vápníku, se může vyvinout hyperkalcémie. Tyto poruchy elektrolytů mohou být odstraněny použitím jiného roztoku pro peritoneální dialýzu (hyperkalcémie) nebo upravenou výživou (hypokalémie).
V případech nerovnováhy tekutin se může objevit hyperhydratace nebo dehydratace. Vážná dehydratace (zvláště při terapii s roztokem s vyšší koncentrací glukózy) se může projevit hypotenzí, zvýšením srdeční frekvence, závratí a svalovou křečí; opačný stav, hyperhydratace, může způsobit zvýšenou tělesnou hmotnost, hypertenzi, otok končetin a problémy s dýcháním.
Mohou se objevit poruchy metabolismu lipidů (dislipoproteinémie nebo hyperlipémie).
Pokud není pacientova strava přizpůsobena zvýšenému kalorickému příjmu, může stálý přísun glukózy z dialyzačního roztoku výjimečně způsobit obezitu.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 10041 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci -ucinek
4.9 Předávkování
V souvislosti s předávkováním nebyly hlášeny žádné závažné události.
Pokud došlo k napuštění nadměrného množství dialyzačního roztoku, může být jednoduše vypuštěn do prázdného vaku. Pokud ovšem dochází k příliš časté nebo rychlé výměně vaků, může se objevit dehydratace a/nebo problémy s obsahem elektrolytů v krvi, které vyžadují okamžitou lékařskou péči.
Pokud byla výměna vynechána, v tomto případě je pravidlem zkrátit interval před následující výměnou tak, aby mohlo být dosaženo celkové množství pro 24 hodin (např. 4 x 2000 ml). Nesprávná rovnováha tekutin může vést k hyperhydrataci nebo dehydrataci a k narušení elektrolytové rovnováhy.
Nejpravděpodobnějším důsledkem předávkování CAPD/DPCA 2, 3, 4 je dehydratace. Nízké dávky, přerušení nebo zastavení léčby může vézt k životu nebezpečné hyperhydrataci s periferním edémem a kardiální dekompenzací a/nebo k jiným projevům urémie, které mohou ohrozit život.
Musí být použita všeobecně uznávaná pravidla pro neodkladnou péči a musí být zahájena intenzivní léčba. Pacient může vyžadovat okamžitou hemodialýzu.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1. Farmakodynamické vlastnosti
Farmakoterapeutická skupina: peritoneální dialýza, hypertonické roztoky ATC kód: B05DB
CAPD/DPCA představuje laktátem tlumený roztok elektrolytů obsahující glukózu, s indikací peritoneálně aplikované dialýzy dekompenzovaného renálního onemocnění různého původu.
Pro souvislou ambulantní peritoneální dialýzu (CAPD) je charakteristická víceméně nepřetržitá přítomnost většinou 2 litrů dialyzačního roztoku v peritoneální dutině, který je nahrazován čerstvým roztokem třikrát až pětkrát denně.
Základním principem peritoneální dialýzy je použití peritonea jako semipermeabilní membrány, která dovoluje výměnu rozpuštěných látek a vody mezi krví a dialyzačním roztokem, a to difuzí a přenosem podle jejich fyzikálně-chemických vlastností.
Elektrolytový profil roztoku je v podstatě stejný jako u fyziologického séra, ačkoli byl upraven (např. obsah draslíku) pro použití u pacientů s urémií, aby umožňoval terapii nahrazující funkci ledvin pomocí interperitoneální substance a výměny tekutin. Látky, které jsou normálně vylučovány močí jako uremické odpadní produkty, například močovina a kreatinin, anogranický fosfát, kyselina močová, další rozpuštěné látky a voda, jsou odstraňovány z těla do dialyzačního roztoku. Je třeba si uvědomit, že během dialýzy mohou být rovněž vylučovány z těla léčivé látky, a proto je nutné jejich dávkování přizpůsobit.
Homeostáza hydratovaného stavu může být udržována podáváním různých koncentrací glukózy v roztoku vyvolávajícím odvádění tekutin (ultrafiltrace).
Metabolická acidóza, druhotná při dekompenzovaném renálním onemocnění, je vyvážena přítomností laktátu v roztoku. Celkový metabolismus laktátu vede k vytváření bikarbonátu.
5.2 Farmakokinetické vlastnosti
Uremické odpadní produkty (močovina, kreatinin, kyselina močová), anogranický fosfát a elektrolyty jako sodík, draslík, vápník a hořčík jsou odstraňovány z těla do dialyzačního roztoku difuzí a konvekcí.
Dialyzační glukóza, použitá v CAPD/DPCA jako osmotický prostředek, je pomalu absorbována za snižování difúzního gradientu mezi dialyzačním roztokem a extracelulární tekutinou. Ultrafiltrace je maximální na začátku časového intervalu a dosahuje vrcholu přibližně po 2 až 3 hodinách. Později začíná absorpce s progresivním úbytkem ultrafiltrátu. Po 4 hodinách činí ultrafiltrát v průměru 100 ml při 1,5% roztoku glukózy, 400 ml při 2,3%, 800 ml při 4,25%. V průběhu šestihodinového časového intervalu je absorbováno 60 až 80% glukózy dialyzátu.
Laktát používaný jako tlumivý roztok je po šestihodinovém intervalu takřka zcela absorbován. U pacientů s normální funkcí jater je laktát rychle metabolizován; to se projeví normálními hodnotami intermediálních metabolitů.
Hromadný přesun vápníku závisí na koncentraci glukózy v dialyzačním roztoku, na vypouštěném objemu, na množství ionizovaného vápníku v séru a na koncentraci vápníku v dialyzačním roztoku. Čím vyšší je koncentrace glukózy, vypouštění objem a koncentrace ionizovaného vápníku v séru, a zároveň čím nižší je koncentrace vápníku v dialyzačním roztoku, tím vyšší je přesun vápníku od pacienta do dialyzátu.
5.3 Předklinické údaje vztahující se k bezpečnosti
S CAPD/DPCA nebyly prováděny žádné preklinické studie toxicity, ale klinické studie peritoneálního dialyzačního roztoku s podobným složením neindikovaly žádné vážné riziko toxicity.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
kyselina chlorovodíková 25% k úpravě pH hydroxid sodný k úpravě pH voda na injekci
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti
2 roky.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25°C. Chraňte před chladem nebo mrazem.
6.5 Druh obalu a obsah balení
Stay safe:
Stay safe je systém se dvěma vaky, obsahující vak pro roztok z vícevrstvé polyolefinové folie, systém hadiček z polyolefinu, konektor systému (DISC) s otočným přepínačem (polypropylen) a drenážní vak z vícevrstvé polyolefinové fólie; vše zataveno ve fólii.
Velikost balení:
1 x 1 500 ml, 1 x 2000 ml, 1 x 2500 ml, 1 x 3000 ml 4 x 1 500 ml, 4 x 2000 ml, 4 x 2500 ml, 3 x 3000 ml, 6 x 1500 ml
Sleep safe:
Sleep safe systém je systém s jedním vakem z vícevrstvé polyolefínové fólie, systém hadiček a konektor z polyolefínové fólie a vstřikovací výstup z polyolefínosyntetické pryže; vše zataveno ve fólii.
Velikost balení:
1 x 5000 ml
2 x 5000 ml
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Návod k použití systému stay^safe
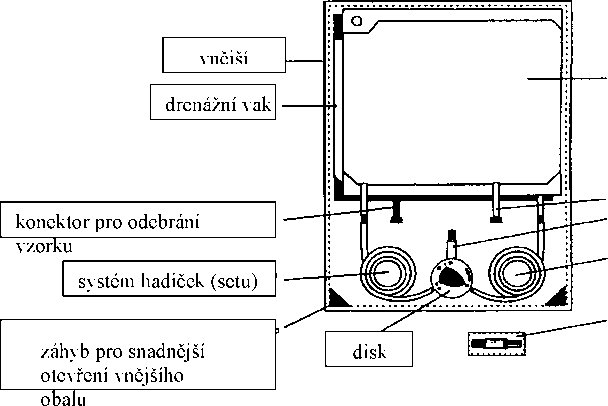
vak s roztokem
|
konektor pro aplikaci medikamentů | ||
|
čepička | ||
|
systém hadiček (setů) | ||
dezinfekční čepička
1. Zkontrolujte vak s roztokem (potisk, datum expirace a ujistěte se, že je roztok čirý) - otevřete vnější obal a balení dezinfekčního krytu.
2. Umyjte si ruce v dezinfekčním roztoku
3. Umístěte DISC do organizéru (zavěste vak s roztokem na infúzní stojan na horní úchyt - rozviňte hadičku s nápisem „ solution bag-DISC“ - umístěte DISC do organizéru - nakonec umístěte vypouštěcí vak do dolního držáku infúzního stojanu).
4. Umístěte adaptér katetru do organizéru.
5. Vydesinfikujte si ruce a odstraňte ochranný kryt z DISCu.
6. Připojte adaptér katetru k DISCu:
7. Otevřete svorku katetru - poloha “o” - zahájeno vypouštění.
8. Poloha “oo” - propláchnutí čerstvým dialyzátem do vypou-štěcího vaku (přibližně 5 sekund).
9. Napouštění - poloha “ooo” -propojení mezi vakem s roztokem a katetrem.
10. Bezpečnostní krok - poloha “oooo”- automatické uzavření adaptéru katetru sponkou PIN.
11. Rozpojení (odpojte adaptér katetru od DISCu) - našroubujte adaptér katetru do nového desinfekčního krytu.
12. Zavřete DISC. Zavřete DISC otevřeným koncem ochranného krytu (který je umístěn v pravém otvoru stojánku).
13. Zkontrolujte vypuštěný dialyzát a odstraňte ho.
Návod kpoužití systému sleep^safe:
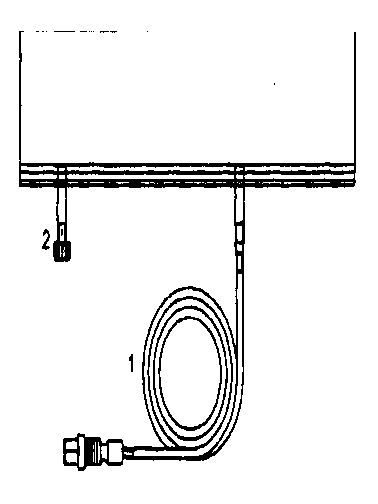
Rozbalte hadičky (1) vaku.
1. Připojte konektor do volného Sleep safeTM vstupu.
2. Vak je nyní připraven k použití se Sleep safe™ sadou.
Další oddělená léčba může být provedena z druhého vstřikovacího výstupu (2). Manipulace
Plastové nádoby mohou být občas poškozeny při přepravě nebo při uchovávání. To může způsobit kontaminaci a produkci mikroorganismů v dialyzačním roztoku. Proto musí být před připojením vaku a použitím dialyzačního roztoku vždy provedena pečlivá kontrola. Každé, i malé poškození uzávěru a svárů nebo okrajů obalu musí být prověřeno, protože roztok by mohl být kontaminován.
Poškozené vaky nebo vaky se zakaleným obsahem se nesmí nikdy použít!
Používejte roztok pro peritoneální dialýzu, pouze pokud kontejner a uzávěr nenesou žádné známky poškození.
Vnější obal má být odstraněn pouze před podáním.
V průběhu výměny vaků s roztokem musí být udržovány aseptické podmínky, aby se snížilo riziko infekce.
Přidání léků do dialyzačního roztoku:
Do roztoku pro peritoneální dialýzu se nesmí přidávat léky z důvodu nebezpečí kontaminace a inkompatibility přidaného léku s dialyzátem.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Fresenius Medical Care Deutschland GmbH
61346 Bad Homburg
Německo
8. REGISTRAČNÍ ČÍSLO(A)
CAPD/DPCA 2: 87/385/95-A/C CAPD/DPCA 3: 87/385/95-B/C CAPD/DPCA 4: 87/385/95-C/C
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE
Datum první registrace: 14. 6. 1995
Datum posledního prodloužení registrace: 29.9.2016
10. DATUM REVIZE TEXTU
29.9.2016
10/10