Byetta 5 Mikrogramů
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Byetta 5 mikrogramů injekční roztok v předplněném peru Byetta 10 mikrogramů injekční roztok v předplněném peru
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna dávka obsahuje exenatidum 5 mikrogramů (pg) ve 20 mikrolitrech (pl), (exenatidum 0,25 mg v 1 ml).
Jedna dávka obsahuje exenatidum 10 mikrogramů (pg) ve 40 mikrolitrech (pl), (exenatidum 0,25 mg v 1 ml).
Pomocné látky se známým účinkem:
Byetta 5 pg: Jedna dávka obsahuje 44 pg metakresolu.
Byetta 10 pg: Jedna dávka obsahuje 88 pg metakresolu.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok (injekce). Čirý bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Byetta je indikována k léčbě diabetes mellitus typu 2 v kombinaci s:
- metforminem
- deriváty sulfonylmočoviny
- thiazolidindiony
- metforminem a sulfonylmočovinou
- metforminem a thiazolidindionem
u dospělých osob, u kterých není dosaženo dostatečné kontroly glykemie při podávání maximálních tolerovaných dávek perorálních přípravků.
Přípravek Byetta je také indikován jako doplňková léčba k bazálnímu inzulinu s metforminem nebo bez metforminu a/nebo pioglitazonu u dospělých, u kterých nebylo dosaženo dostatečné kontroly glykemie, při léčbě těmito léčivými přípravky.
4.2 Dávkování a způsob podání
Dávkování
Léčba přípravkem Byetta s okamžitým uvolňováním exenatidu se má zahájit dávkou 5 pg podávanou dvakrát denně alespoň po dobu jednoho měsíce, aby se zlepšila snášenlivost. Potom může být dávka exenatidu zvýšena na 10 pg dvakrát denně pro další zlepšení kontroly glykemie. Dávky vyšší než 10 pg dvakrát denně se nedoporučují.
Exenatid s okamžitým uvolňováním je dostupný v předplněném peru s dávkami buď 5 pg nebo 10 pg exenatidu.
Exenatid s okamžitým uvolňováním může být podán v libovolnou dobu v časovém intervalu 60 minut před ranním a večerním j ídlem (nebo před j akýmikoli dvěma hlavními j ídly během dne, oddělenými intervalem alespoň 6 hodin). Exenatid s okamžitým uvolňováním nesmí být podán po jídle. Jestliže dojde k opomenutí podání dávky, léčba by měla pokračovat až následující dávkou.
Exenatid s okamžitým uvolňováním je doporučen pro použití u pacientů s diabetes mellitus typu 2, kteří již užívají metformin, sulfonylmočovinu, pioglitazon a/nebo bazální inzulin. Je-li k stávající základní léčbě přidán bazální inzulin, je možné v užívání exenatidu s okamžitým uvolňováním pokračovat. Jestliže je exenatid s okamžitým uvolňováním přidán k léčbě metforminem a/nebo pioglitazonem, je možné pokračovat v dosavadní dávce metforminu a/nebo pioglitazonu, protože se neočekává zvýšení rizika hypoglykemie ve srovnání s podáváním samotného metforminu nebo pioglitazonu. Jestliže je exenatid s okamžitým uvolňováním přidán k sulfonylmočovině, má být zvážena redukce dávky sulfonylmočoviny, aby se snížilo riziko hypoglykemie (viz bod 4.4). Jestliže je Exenatid s okamžitým uvolňováním užíván v kombinaci s bazálním inzulinem, měla by být přehodnocena dávka bazálního inzulinu. U pacientů se zvýšeným rizikem hypoglykemie se má zvážit snížení dávky bazálního inzulinu (viz bod 4.8).
Dávku exenatidu s okamžitým uvolňováním není nutné upravovat na základě každodenního měření glykemie prováděného pacientem. Toto měření může být ovšem nezbytné pro úpravu dávky sulfonylmočoviny nebo dávky bazálního inzulinu.
Specifické populace
Starší pacienti
U pacientů nad 70 let je nutné používat exenatid s okamžitým uvolňováním se zvýšenou opatrností a zvyšování dávky z 5 pg na 10 pg by mělo probíhat obezřetně. Klinické zkušenosti u pacientů nad 75 let jsou velmi omezené.
Renální nedostatečnost
U pacientů s mírnou renální nedostatečností (clearance kreatininu 50 až 80 ml/min) není zapotřebí úprava dávkování.
U pacientů se středně závažnou renální nedostatečností (clearance kreatininu 30 až 50 ml/min) by zvyšování dávky z 5 pg na 10 pg mělo probíhat obezřetně (viz bod 5.2).
Exenatid není doporučen u pacientů v konečném stádiu renálního selhávání nebo se závažnou renální nedostatečností (clearance kreatininu < 30 ml/min) (viz bod 4.4).
Jaterní nedostatečnost
U pacientů s jaterní nedostatečností není zapotřebí úprava dávkování (viz bod 5.2).
Pediatrická populace
Bezpečnost a účinnost podávání exenatidu nebyla stanovena u dětí a dospívajících ve věku do 18 let (viz bod 5.2)
V současnoti dostupné údaje jsou popsány v bodě 5.2, ale na jejich základě nelze doporučit dávkování u dětí.
Způsob podání
Jednotlivá dávka by měla být podána ve formě subkutánní injekce do stehna, břišní oblasti nebo horní části paže.
Exenatid s okamžitým uvolňováním a bazální inzulin musí být podávány ve dvou oddělených injekcích.
Návod k použití pera viz bod 6.6 a instrukce uvedené v informacích pro pacienta.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Exenatid se nemá používat u pacientů s diabetes mellitus typu 1 nebo k léčbě diabetické ketoacidózy. Exenatid s okamžitým uvolňováním nesmí být podán intravenózní nebo intramuskulární injekcí. Renální nedostatečnost
U dialyzovaných pacientů v konečném stádiu renálního selhávání jednotlivé dávky 5 pg exenatidu s okamžitým uvolňováním zvýšily frekvenci výskytu a závažnost gastrointestinálních nežádoucích účinků. Exenatid není doporučen u pacientů v konečném stádiu renálního selhávání nebo se závažnou renální nedostatečností (clearance kreatininu < 30 ml/min). U pacientů se středně závažnou renální nedostatečností jsou klinické zkušenosti velmi omezené (viz bod 4.2).
Méně často byly spontánně hlášeny případy změny renálních funkcí, včetně zvýšení sérového kreatininu, poruchy funkce ledvin, zhoršení chronického renálního selhání a akutní renální selhání, někdy vyžadující hemodialýzu. K některým z těchto příhod došlo u pacientů s nauzeou, zvracením a/nebo průjmem, tj. u stavů, které mohou ovlivňovat hydrataci, a/nebo u pacientů užívajících léčivé přípravky, u kterých je znám jejich vliv na renální funkce/celkovou hydrataci. Současně podávané léčivé přípravky zahrnovaly inhibitory angiotenzin konvertujícího enzymu, antagonisty angiotenzinu-II, nesteroidní antiflogistika a diuretika. Reverzibilita porušených renálních funkcí byla pozorována při podpůrné léčbě a po vysazení potenciálně působících léčivých přípravků, včetně exenatidu.
Akutní pankreatitida
Použití agonistů GLP-1 je spojeno s rizikem vývoje akutní pankreatitidy. U exenatidu byly spontánně hlášeny případy akutní pankreatitidy. Při použití podpůrné léčby byl pozorován ústup pankreatitidy, ale velmi vzácně byly hlášeny případy nekrotizující nebo hemoragické pankreatitidy a/nebo úmrtí. Pacienti mají být informováni o charakteristických symptomech akutní pankreatitidy: přetrvávající, silná bolest břicha. V případě podezření na pankreatitidu má být léčba exenatidem ukončena, pokud je pankreatitida potvrzena, léčba exenatidem nesmí být znovu zahájena. Opatrnosti je třeba u pacientů s anamnézou pankreatitidy.
Závažné gastrointestinální onemocnění
Exenatid nebyl hodnocen u pacientů se závažným gastrointestinálním onemocněním včetně gastroparézy. Použití přípravku je často spojeno s nežádoucími účinky v oblasti gastrointestinálního traktu, včetně nauzey, zvracení a průjmu. Z tohoto důvodu není použití exenatidu doporučeno u pacientů se závažným gastrointestinálním onemocněním.
Hypoglykemie
Výskyt hypoglykemie byl vyšší při použití exenatidu s okamžitým uvolňováním v kombinaci se sulfonylmočovinou ve srovnání s kombinací sulfonylmočoviny a placeba. V klinických studiích měli pacienti s mírnou renální insufuciencí užívající kombinaci se sulfonylmočovinou zvýšený výskyt hypoglykemie v porovnání s pacienty s normální renální funkcí. Pro snížení rizika hypoglykemie spojeného s užíváním sulfonylmočoviny má být zvážena redukce dávky sulfonylmočoviny.
Rychlé snížení tělesné hmotnosti
U přibližně 5 % pacientů užívajících exenatid v klinických hodnoceních bylo pozorováno snížení hmotnosti o více než 1,5 kg za týden. Takto vysoký hmotnostní úbytek může mít škodlivé důsledky. Pacienti s rychlým úbytkem tělesné hmotnosti mají být sledováni na známky a příznaky cholelithiázy.
Současné užívání s dalšími léčivými přípravky
Účinek exenatidu s okamžitým uvolňováním způsobující zpomalení vyprazdňování žaludku může snížit rozsah a rychlost absorpce perorálně podávaných léčiv. Exenatid s okamžitým uvolňováním se má používat s opatrností u pacientů, kteří užívají přípravky vyžadující rychlou gastrointestinální absorpci a léčivé přípravky s úzkým terapeutickým indexem. Zvláštní doporučení týkající se podávání těchto léčivých přípravků ve vztahu k exenatidu s okamžitým uvolňováním jsou uvedena v bodě 4.5.
Současné podávání exenatidu s okamžitým uvolňováním s deriváty D-fenylalaninu (meglitinidy), nebo inhibitory alfa-glukosidázy, inhibitory dipeptyl peptidázy-4 nebo s dalšími agonisty GLP-1 receptorů nebylo studováno, a proto se nedoporučuje.
Pomocné látky
Tento léčivý přípravek obsahuje metakresol, který může způsobit alergické reakce.
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku v jedné dávce, tj. v podstatě je „bez sodíku“.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Účinek exenatidu s okamžitým uvolňováním způsobující zpomalení vyprazdňování žaludku může snížit rozsah a rychlost absorpce perorálně podávaných léčiv. Pacienti užívající léčivé přípravky s úzkým terapeutickým indexem nebo přípravky vyžadující důkladné klinické monitorování mají být pečlivě sledováni. Tyto léčivé přípravky mají být podávány standardizovaným způsobem ve vztahu k aplikaci injekce exenatidu s okamžitým uvolňováním. Jestliže musí být tyto přípravky podávány společně s jídlem, pacienti by je měli užívat s jídlem, kdy není podáván exenatid s okamžitým uvolňováním.
U perorálních přípravků, jejichž účinnost zvláště závisí na prahových koncentracích, jako j sou antibiotika, je nutné pacienty poučit, aby tyto léky užili alespoň 1 hodinu před aplikací injekce exenatidu s okamžitým uvolňováním.
Enterosolventní lékové formy obsahující léčiva citlivá na degradaci v žaludku, jako jsou např. inhibitory protonové pumpy, mají být užity alespoň 1 hodinu před nebo 4 hodiny po aplikaci injekce exenatidu s okamžitým uvolňováním.
Digoxin, lisinopril a warfarin
Při podání digoxinu, lisinoprilu nebo warfarinu 30 minut po aplikaci exenatidu bylo pozorováno zpoždění t max přibližně o 2 hodiny. Nebyl pozorován žádný klinicky relevantní vliv na Cmax nebo AUC. Od uvedení přípravku na trh však byly spontánně hlášeny případy zvýšení INR během současného užívání warfarinu a exenatidu. Během zahájení podávání exenatidu s okamžitým uvolňováním a zvyšování dávky má být u pacientů užívajících warfarin a/nebo kumarinové deriváty hodnota INR pečlivě monitorována (viz bod 4.8).
Metformin a deriváty sulfonylmočoviny
Nepředpokládá se, že by exenatid s okamžitým uvolňováním měl jakékoli klinicky významné účinky na farmakokinetiku metforminu nebo sulfonylmočoviny. Z tohoto důvodu nejsou potřebná žádná časová omezení týkající se podání těchto přípravků ve vztahu k aplikaci exenatidu s okamžitým uvolňováním.
Paracetamol
Paracetamol byl použit jako modelové léčivo k hodnocení účinku exenatidu na žaludeční vyprazdňování. Po podání 1000 mg paracetamolu společně s exenatidem s okamžitým uvolňováním v dávce 10 pg (0 h) a následně 1 h, 2 h a 4 h po injekci, byly AUC paracetamolu sníženy o 21 %,
23 %, 24 %, resp. 14 %, Cmax byla snížena o 37 %, 56 %, 54 %, resp. 41 %; tmax byl zvýšen z 0,6 h v kontrolní periodě na 0,9 h; 4,2 h; 3,3 h; resp. 1,6 h. Hodnoty AUC, Cmax a tmax paracetamolu nebyly signifikantně změněny, pokud byl paracetamol podán 1 hodinu před injekcí exenatidu s okamžitým uvolňováním. Na základě výsledků této studie není zapotřebí žádná úprava dávkování paracetamolu.
Inhibitory reduktázv hvdroxv metyl glutaryl koenzymu A (HMG CoA)
Jestliže byl exenatid s okamžitým uvolňováním (10 gg dvakrát denně) podán společně s jednorázovou dávkou lovastatinu (40 mg), AUC a Cmax lovastatinu byly sníženy o 40 %, resp. 28 % a tmax byl zpožděn asi o 4 hodiny ve srovnání s podáním samotného lovastatinu. V 30týdenních placebem kontrolovaných klinických studiích nebylo současné podávání exenatidu s okamžitým uvolňováním a inhibitorů HMG CoA reduktázy spojeno s určitými změnami v lipidovém profilu (viz bod 5.1). Ačkoliv není dopředu vyžadována žádná úprava dávky, je třeba mít na paměti možné změny LDL-C nebo celkového cholesterolu. Lipidové profily se mají pravidelně monitorovat.
Ethinylestradiol a levonorgestrel
Podání kombinovaných perorálních kontraceptiv (30 ^g ethinylestradiolu a 150 ^g levonorgestrelu) hodinu před podáním exenatidu s okamžitým uvolňováním (10 ^g dvakrát denně) neovlivnilo AUC, Cmax nebo Cmin ethinylestradiolu ani levonorgestrelu. Podání perorálních kontraceptiv 30 minut po podání exenatidu s okamžitým uvolňováním neovlivnilo AUC, ale mělo za následek snížení C max ethinylestradiolu o 45 % a Cmax levonorgestrelu o 27—41 % a prodloužilo tmax o 2 až 4 hodiny v důsledku zpomaleného vyprazdňování žaludku. Snížení maximální koncentrace C max není klinicky významné a úprava dávky perorálních kontraceptiv není nutná.
Pediatrická populace
Interakční studie byly provedeny pouze u dospělých.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku
Pokud si pacientka přeje otěhotnět, nebo dojde k otěhotnění, léčba exenatidem se má ukončit. Těhotenství
Adekvátní údaje o podávání exenatidu těhotným ženám nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Případné riziko pro člověka není známé. V průběhu těhotenství nesmí být exenatid podáván a je doporučeno podávání inzulinu.
Kojení
Není známo, zda je exenatid vylučován do lidského mateřského mléka. Exenatid se nemá podávat kojícím ženám.
Fertilita
Studie fertility u lidí nebyly provedeny.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Exenatid má mírný vliv na schopnost řídit a obsluhovat stroje. Jestliže je exenatid podáván v kombinaci se sulfonylmočovinou nebo s bazálním inzulinem, pacienti mají být poučeni o preventivních opatřeních k zabránění hypoglykemii v průběhu řízení nebo obsluhy strojů.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nejčastější nežádoucí účinky byly především gastrointestinální (nauzea, zvracení a průjem). Nejčastěji hlášeným nežádoucím účinkem byla nauzea v souvislosti se zahájením léčby, postupem času se frekvence snižovala. Při současném používání exenatidu s okamžitým uvolňováním se sulfonylmočovinou se u pacientů může vyskytnout hypoglykemie. Většina nežádoucích účinků spojených s používáním exenatidu s okamžitým uvolňováním je mírné až středně závažné intenzity.
Od uvedení exenatidu s okamžitým uvolňováním na trh byl hlášen výskyt akutní pankreatitidy s frekvencí není známo a akutního renálního selhání s frekvencí méně často (viz bod 4.4).
Tabulkové shrnutí nežádoucích účinků
Tabulka 1 uvádí seznam nežádoucích účinků hlášených u exenatidu s okamžitým uvolňovánímz klinických studií a spontánně (které nebyly pozorovány v klinickém hodnocení, frekvence není známo).
Základní léčba v klinických studiích zahrnovala metformin, sulfonylmočovinu, thiazolidindion, nebo kombinaci perorálních antidiabetik.
Účinky jsou vyjmenovány podle tříd orgánových systémů a četnosti výskytu preferenčních termínů MedDRA. Vyjadřování frekvence: velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1000 až < 1/100), vzácné (> 1/10000 až < 1/1000), velmi vzácné (< 1/10000) a není známo (z dostupných údajů nelze určit).
Tabulka 1: Nežádoucí účinky exenatidu s okamžitým uvolňováním identifikované v průběhu klinických hodnocení a ze spontánních hlášení
|
Třída orgánových systémů/nežádoucí účinek |
Frekvence | |||||
|
Velmi časté |
Časté |
Méně časté |
Vzácné |
Velmi vzácné |
Není známo | |
|
Poruchy imunitního systému | ||||||
|
Anafylaktická reakce |
X1 | |||||
|
Poruchy metabolismu a výživy | ||||||
|
Hypoglykemie (v kombinaci s metforminem a sulfonylmočovinou)2 |
X1 | |||||
|
Hypoglykemie (v kombinaci se sulfonylmočovinou) |
X1 | |||||
|
Snížení chuti k jídlu |
X1 | |||||
|
Dehydratace, celkově spojená s nauzeou, zvracením a/nebo průjmem |
X1 | |||||
|
Poruchy nervového systému | ||||||
|
X1 | ||||||
|
Závratě |
X1 | |||||
|
Poruchy chuti |
X1 | |||||
|
Somnolence |
X1 | |||||
|
Gastrointestinální poruchy | ||||||
|
Obstrukce střeva |
X1 | |||||
|
X1 | ||||||
|
X1 | ||||||
|
X1 | ||||||
|
X1 | ||||||
|
X1 | ||||||
|
Gastroezofageální reflux |
X1 | |||||
|
Abdominální distenze |
X1 | |||||
|
Akutní pankreatitida (viz bod 4.4) |
X3 | |||||
|
Říhání |
X1 | |||||
|
Zácpa |
X1 | |||||
|
Flatulence |
X1 | |||||
|
Poruchy kůže a podkožní tkáně | ||||||
|
Hyperhidróza2 |
X1 | |||||
|
Alopecie |
X1 | |||||
|
Makulární a papulární vyrážka |
X3 | |||||
|
Svrbění a/nebo kopřivka |
X1 | |||||
|
Angioneurotický edém |
X3 | |||||
|
Poruchy ledvin a | ||||||
|
močových cest | ||||||
|
Pozměněná renální funkce včetně akutního renálního selhání, zhoršení chronického renálního selhání, zvýšená hladina kreatininu v séru |
X1 | |||||
|
Celkové poruchy a reakce v místě aplikace | ||||||
|
Pocit nervozity |
X1 | |||||
|
Astenie2 |
X1 | |||||
|
Lokální reakce po podání |
X1 | |||||
|
Vyšetření | ||||||
|
Snížení tělesné hmotnosti |
X1 | |||||
|
Zvýšení INR (International Normalised Ratio) při konkomitantním užívání warfarinu, někdy hlášeno ve spojení s krvácením |
X3 |
1 Frekvence odvozena z dokončených klinických studií účinnosti a bezpečnosti s exenatidem s okamžitým uvolňováním n = 5763 celkově (pacientů na sulfonylmočovině n = 2971).
2 V kontrolovaném klinickém hodnocení, kde byl jako komparátor použit inzulin a jako přidružená medikace metformin a sulfonylmočovina, byl výskyt těchto nežádoucích účinků podobný u pacientů léčených inzulinem i pacientů léčených exenatidem s okamžitým uvolňováním.
3
Údaje ze spontánních hlášení (neznámá četnost).
Když byl exenatid s okamžitým uvolňováním používán v kombinaci s terapií bazálním inzulinem, pozorovaný výskyt a typy dalších nežádoucích účinků byly podobné těm, které byly pozorovány v kontrolovaných klinických hodnoceních s exenatidem v monoterapii, s metforminem a/nebo sulfonylmočovinou nebo thiazolidindionem, s metforminem nebo bez metforminu.
Popis vybraných nežádoucích účinků
Hypoglykemie
Ve studiích u pacientů léčených exenatidem s okamžitým uvolňováním v kombinaci se sulfonylmočovinou (s nebo bez metforminu) byla incidence hypoglykemie vyšší ve srovnání s placebem (23,5 % a 25,2 % oproti 12,6 % a 3,3 %) a zdá se být závislá jak na dávce exenatidu s okamžitým uvolňováním, tak na dávce sulfonylmočoviny.
Ve výskytu a závažnosti hypoglykemie u exenatidu nejsou ve srovnání s placebem, v kombinaci s thiazolidindionem, s metforminem nebo bez metforminu, klinicky relevantní rozdíly. Hypoglykemie byla hlášena u 11 % a 7 % pacientů lečených exenatidem resp. placebem.
Většina epizod hypoglykemie byla mírné až střední intenzity a všechny byly vyřešeny perorálním podáním sacharidů.
Ve 30týdenní studii, kdy byl exenatid s okamžitým uvolňováním nebo placebo přidán ke stávající terapii bazálním inzulinem (inzulin glargin), bylo podle studijního protokolu dávkování bazálního inzulinu u pacientů s HbA1c < 8,0 % sníženo o 20 % s cílem minimalizovat riziko hypoglykemie.
U obou léčených skupin bylo titrováno dávkování, aby bylo dosaženo cílových plazmatických hladin glukózy nalačno (viz bod 5.1). Ve výskytu hypoglykemických epizod nebyly zjištěny klinicky významné rozdíly ve skupině s exenatidem s okamžitým uvolňováním ve srovnání s placebovou skupinou (25 %, resp. 29 %). Ve skupině s exenatidem s okamžitým uvolňováním nebyly žádné závažné hypoglykemie.
Ve 24týdenní studii, kde byla k existující terapii exenatidem s okamžitým uvolňováním a metforminem nebo metforminem a thiazolidindionem přidána buď protaminová suspenze inzulin lispro nebo inzulin glargin, se vyskytla alespoň jedna epiozoda mírné hypoglykemie u 18 %, resp. 9 % pacientů a jeden pacient ohlásil hypoglykémii závažnou. U pacientů, u kterých existující terapie zahrnovala také sulfonylmočovinu, se nejméně jedna mírná epizoda hypoglykemie vyskytla u 48 %, resp. 54 % pacientů a jeden pacient ohlásil hypoglykemii závažnou.
Nejčastěji hlášený nežádoucí účinek byla nauzea. U pacientů léčených exenatidem s okamžitým uvolňováním v dávce 5 pg nebo 10 pg popisovalo nejméně 36 % pacientů jednu epizodu nauzey. Ve většině případů byla nauzea mírná až středně závažná a vyskytovala se v závislosti na dávce.
U většiny pacientů s nauzeou na počátku léčby se frekvence a závažnost s dalším pokračováním léčby snižovala.
V dlouhodobých (16 a více týdnů) kontrolovaných klinických hodnoceních došlo k ukončení léčby
z důvodu nežádoucích účinků u 8 % pacientů léčených exenatidem s okamžitým uvolňováním, u 3 % pacientů léčených placebem a u 1 % pacientů léčených inzulinem. Nejčastějším nežádoucím účinkem vedoucím k vyřazení ze studie byla u pacientů léčených exenatidem s okamžitým uvolňováním nauzea (4 % pacientů) a zvracení (1 %). Mezi pacienty léčenými placebem nebo inzulinem došlo k vyřazení z důvodu nauzey u méně než 1 % pacientů.
U pacientů léčených exenatidem s okamžitým uvolňováním v otevřených pokračovacích 82týdenních studiích byly zaznamenané nežádoucí účinky podobné těm, pozorovaným v kontrolovaných studiích.
Reakce v místě aplikace
V dlouhodobých (16 a více týdnů) kontrolovaných klinických hodnoceních byly hlášeny reakce
v místě aplikace přibližně u 5,1 % pacientů léčených exenatidem s okamžitým uvolňováním. Tyto reakce byly většinou mírné a obvykle nevedly k ukončení léčby exenatidem s okamžitým uvolňováním.
Imunogenicita
V souladu s potenciálními imunogenními vlastnostmi léčivých přípravků na bázi proteinů a peptidů se u pacientů léčených exenatidem s okamžitým uvolňováním mohou vytvořit protilátky proti exenatidu. U většiny pacientů, u kterých k tvorbě protilátek došlo, se titr protilátek časem snižoval a v průběhu 82 týdnů zůstal na nízké úrovni.
Celkový podíl pacientů s pozitivním titrem protilátek byl stálý ve všech klinických hodnoceních. Pacienti, u kterých dochází ke tvorbě protilátek proti exenatidu, mají větší sklon k výskytu reakcí v místě vpichu (např. zarudnutí a svědění kůže), ale jinak podobné typy a četnost výskytu nežádoucích účinků jako pacienti bez anti-exenatidových protilátek. Ve třech placebem kontrolovaných klinických hodnoceních (n = 963) se nízký titr anti-exenatidových protilátek ve 30. týdnu vyskytl u 38 % pacientů. Úroveň kontroly glykemie (HbA1c) byla u této skupiny celkově srovnatelná jako u skupiny bez nalezených protilátek. U dalších 6 % pacientů byl ve 30. týdnu titr protilátek vyšší. Asi u jedné poloviny pacientů z této skupiny (3 % z celkového počtu pacientů léčených exenatidem s okamžitým uvolňováním v kontrolovaných studiích) se neprojevila glykemická odpověď na léčbu exenatidem s okamžitým uvolňováním. Ve třech kontrolovaných klinických hodnoceních s inzulinem jako komparátorem (n = 790) byla pozorována srovnatelná účinnost a výskyt nežádoucích účinků u pacientů léčených exenatidem s okamžitým uvolňováním bez ohledu na titr protilátek.
Vyšetření vzorků s pozitivním nálezem protilátek z jedné dlouhodobé studie (bez srovnávací skupiny) neodhalilo signifikantní zkříženou reaktivitu s podobnými endogenními peptidy (glukagon nebo GLP-1).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Příznaky a symptomy předávkování mohou zahrnovat vážnou nauzeu, silné zvracení a rychlé snížení koncentrace glukózy v krvi. V případě předávkování by měla být s ohledem na pacientovy klinické projevy a příznaky zahájena odpovídající podpůrná léčba (eventuálně podávaná parenterálně).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antidiabetika kromě inzulínů; jiná antidiabetika, ATC kód: A10BX04 Mechanismus účinku
Exenatid je agonista receptoru peptidu podobného glukagonu 1 (GLP-1), který vykazuje některé antihyperglykemické účinky jako peptid podobný glukagonu 1 (glucagon-like peptid-1, GLP-1) Sekvence aminokyselin exenatidu se částečně překrývá se sekvencí lidského GLP-1. U exenatidu se prokázala vazba a aktivace známého lidského GLP-1 receptoru in vitro, mechanismus účinku je zprostředkován cyklickým AMP a/nebo dalšími nitrobuněčnými signálními cestami.
Exenatid zvyšuje, v závislosti na hladině glukózy, sekreci inzulinu v beta-buňkách pankreatu. Se snižováním koncentrace glukózy klesá i produkce inzulinu. Při podávaní exenatidu v kombinaci se samotným metforminem nebylo pozorováno žádné zvýšení výskytu hypoglykemie v porovnání s placebem v kombinaci s metforminem, což může být způsobeno tímto glukózo-dependentním inzulinotropním mechanismem účinku (viz bod 4.4).
Exenatid potlačuje sekreci glukagonu, jejíž nepřiměřené zvýšení je známé u diabetu typu 2. Nižší hladiny glukagonu vedou ke snížení produkce glukózy v játrech. Exenatid však nemá vliv na normální reakci glukagonu a dalších hormonů v odpovědi na hypoglykemii.
Exenatid zpomaluje vyprazdňování žaludečního obsahu a snižuje tedy rychlost absorpce glukózy z potravy do krevního oběhu.
Farmakodynamické účinky
Exenatid s okamžitým uvolňováním zlepšuje kontrolu glykemie prostřednictvím okamžitého i dlouhodobého působení, kdy snižuje postprandiální hladiny glukózy i hladiny glukózy nalačno u pacientů s diabetem typu 2.
Klinická účinnost a bezpečnost
Klinická hodnocení exenatidu s okamžitým uvolňováním s metforminem, sulfonylmočovinou nebo s oběma _ jako základní léčbou
Klinická hodnocení zahrnovala 3945 osob (2997 léčených exenatidem), 56 % mužů a 44 % žen,
319 osob (230 léčených exenatidem) bylo ve věku > 70 let a 34 osob (27 léčených exenatidem) bylo ve věku > 75 let.
Exenatid s okamžitým uvolňováním snižoval HbA1c a tělesnou hmotnost u pacientů léčených po dobu 30 týdnů ve třech placebem kontrolovaných studiích bez ohledu na to, zda byl přidán k metforminu, sulfonylmočovině nebo k jejich kombinaci. Tato snížení HbA1c byla obvykle pozorována 12 týdnů po zahájení léčby. Viz tabulka 2. Snížení HbA1c bylo zachováno a úbytek hmotnosti pokračoval minimálně po dobu 82 týdnů ve skupině pacientů léčených 10 ^g dvakrát denně, kteří dokončili jak placebem kontrolované studie, tak i nekontrolované pokračující studie (n = 137).
Tabulka 2: Kombinované výsledky 30týdenních placebem kontrolovaných studií (intent— to-treat pacienti)
|
Placebo |
Exenatid s okamžitým uvolňováním 5 pg dvakrát denně |
Exenatid s okamžitým uvolňováním 10 pg dvakrát denně | |
|
N |
483 |
480 |
483 |
|
Výchozí HbAJc(%) |
8,48 |
8,42 |
8,45 |
|
HbAJc (%) změna oproti výchozí hodnotě |
0,08 |
-0,59 |
-0,89 |
|
Podíl pacientů (%) dosahujících HbAJc < 7% |
7,9 |
25,3 |
33,6 |
|
Podíl pacientů (%) dosahujících HbA1c < 7% (pacienti, kteří dokončili studii) |
10,0 |
29,6 |
38,5 |
|
Výchozí tělesná hmotnost (kg) |
99,26 |
97,10 |
98,11 |
|
Změna tělesné hmotnosti oproti výchozí hodnotě (kg) |
-0,65 |
-1,41 |
-1,91 |
V kontrolovaných studiích, kde byl použit jako komparátor inzulin, vedlo podání exenatidu
s okamžitým uvolňováním (5 pg dvakrát denně po dobu 4 týdnů následované 10 pg dvakrát denně) v kombinaci s metforminem a sulfonylmočovinou k signifikantnímu (statisticky i klinicky) zlepšení kontroly glykemie měřeno snížením HbA1c. Tento účinek léčby byl srovnatelný s účinkem inzulinu glargin ve 26týdenní studii (průměrná dávka inzulinu 24,9 IU/den, rozmezí 4—95 IU/den na konci studie) a s účinky bifázického inzulinu aspart v 52týdenní studii (průměrná dávka inzulinu 24,4 IU/den, rozmezí 3—78 IU/den na konci studie). Exenatid s okamžitým uvolňováním snížil hodnotu HbA1c z 8,21 (n = 228) a 8,6 % (n = 222) o 1,13 a 1,01 %, zatímco inzulin glargin snížil z 8,24 (n = 227) o 1,10 % a bifázický inzulin aspart z 8,67 (n = 224) o 0,86 %. Ve 26týdenní studii bylo při podávání exenatidu s okamžitým uvolňováním dosaženo úbytku tělesné hmotnosti 2,3 kg (2,6 %) a v 52týdenní studii úbytku 2,5 kg (2,7 %), zatímco léčba inzulinem byla spojena s přírůstkem tělesné hmotnosti. Rozdíly v léčbě (exenatid s okamžitým uvolňováním mínus komparátor) byly -
4,1 kg v 26týdenní studii a -5,4 kg v 52týdenní studii. Sedmibodové glykemické profily při selfmonitoringu (vždy před a po jídle a ve 3 hodiny ráno) prokázaly signifikantní snížení hladin glukózy v postprandiálních obdobích po podání exenatidu s okamžitým uvolňováním ve srovnání inzulinem. Hladiny krevní glukózy před jídlem byly obecně nižší u pacientů užívajících inzulin ve srovnání s exenatidem s okamžitým uvolňováním. Průměrné denní hodnoty hladiny glukózy v krvi byly podobné u exenatidu s okamžitým uvolňováním i u inzulinu. Výskyt hypoglykemie v těchto studiích byl podobný u exenatidu s okamžitým uvolňováním i u inzulinu.
Klinická hodnocení exenatidu s okamžitým uvolňováním s metforminem, thiazolidindionem nebo s oběma _ jako základní léčbou
Byly provedeny 2 placebem kontrolované studie: jedna trvající 16 a jedna 26 týdnů, se 121 a 111 pacienty, kterým byl podáván exenatid s okamžitým uvolňováním, a se 112 a 54 pacienty, kterým bylo podáváno placebo přidané k existující léčbě thalizolidindiony s metforminem nebo bez metforminu. 12 % pacientů s exenatidem s okamžitým uvolňováním byl podáván thiazolidindion a exenatid s okamžitým uvolňováním a 82 % byl podáván thiazolidindion, metformin a Byetta.
V 16týdenní studii vedlo ve srovnání s placebem podávání přípravku Byetta (5 pg dvakrát denně po dobu 4 týdnů následované 10 pg dvakrát denně) k signifikantnímu snížení HbA1c (-0,7 % oproti +0,1 %), stejně tak jako k signifikantnímu snížení tělesné hmotnosti (-1,5 kg oproti 0 kg). 26 týdenní studie ukázala podobné výsledky se statisticky významným snížením vstupního HbA1c v porovnání s placebem (-0,8 % oproti -0,1 %). Mezi léčenými skupinami nebyl významný rozdíl ve změně tělesné hmotnosti při srovnání výchozí a konečné hodnoty (-1,4 oproti -0,8 kg).
Pokud byl exenatid s okamžitým uvolňováním podán v kombinaci s thiazolidindionem, incidence hypoglykemie byla podobná jako v případě placeba v kombinaci s thiazolidindionem. Zkušenosti s podáváním pacientům starším 65 let a pacientům s postižením renálních funkcí jsou omezené. Četnost výskytu a typy jiných nežádoucích účinků byly podobné, jako byly pozorovány v 30týdenních kontrolovaných klinických studiích se sulfonylmočovinou, metforminem nebo s oběma látkami.
Klinická hodnocení exenatidu s okamžitým uvolňováním v kombinaci s bazálním inzulinem
V 30týdenní studii byl buď exenatid s okamžitým uvolňováním (5 pg dvakrát denně po dobu 4 týdnů následované 10 pg dvakrát denně) nebo placebo přidáno k inzulinu glargin (s metforminem, pioglitazonem, s oběma nebo bez obou). V průběhu studie byl v obou léčených skupinách inzulin glargin titirován s použitím algoritmu odrážejícího současnou klinickou praxi pro dosažení cílových hodnot plazmatických hladin glukózy nalačno přibližně 5,6 mmol/l. Průměrný věk subjektů hodnocení byl 59 let a průměrná délka onemocnění diabetem byla 12,3 let.
Na konci hodnocení exenatid s okamžitým uvolňováním (n = 137) prokázal statisticky významné snížení HbA1c a hmotnosti ve srovnání s placebem (n = 122). Exenatid s okamžitým uvolňováním snížil hladinu HbA1c o 1,7 % oproti výchozí hodnotě 8,3 %, zatímco placebo snížilo HbA1c o 1,0 % oproti výchozí hodnotě 8,5 %. Podíl pacientů, kteří dosáhli HbA 1c < 7 % a HbA1c < 6,5 % byl 56 % a 42 % u exenatidu s okamžitým uvolňováním a 29 % a 13 % u placeba. U exenatidu s okamžitým uvolňováním byl hmotnostní úbytek 1,8 kg z výchozí hodnoty 95 kg, zatímco u placeba byl pozorován přírůstek hmotnosti 1,0 kg oproti výchozí hodnotě 94 kg.
Ve skupině s exenatidem s okamžitým uvolňováním byla zvýšena dávka inzulinu o 13 jednotek na den ve srovnání s 20 jednotkami na den ve skupině s placebem. Exenatid s okamžitým uvolňováním snížil hladinu glukózy v séru nalačno o 1,3 mmol/l ,a placebo o 0,9 mmol/l. Skupina léčená exenatidem s okamžitým uvolňováním měla ve srovnání s placebem signifikantní snížení odchylek postprandiálních hladin glykemie po ranním jídle (-2,0 oproti -0,2 mmol/l) a po večerním jídle (-1,6 oproti +0,1 mmol/l), v poledne nebyly žádné rozdíly.
Ve 24týdenní studii, ve které byla přidána buď suspenze inzulin lispro protamin nebo inzulin glargin k stávající léčbě exenatidem s okamžitým uvolňováním a metforminem, metforminem a sulfonylmočovinou nebo metforminem a pioglitazonem, byl HbA1c snížen o 1,2 % (n = 170), resp. o 1,4 % (n = 167) z výchozí hodnoty 8,2 %. U pacientů na protaminové suspenzi inzulinu lispro byl pozorován hmotnostní přírůstek 0,2 kg a u pacientů léčených inzulinem glarginem 0,6 kg z výchozích hodnot 102 kg, resp. 103 kg.
V 30týdenní otevřené klinické studii noninferiority kontrolované aktivní léčbou byla hodnocena bezpečnost a účinnost exenatidu s okamžitým uvolňováním (n = 315) vs titrovaný inzulin lispro třikrát denně (n = 312) při základní léčbě optimalizovanou dávkou bazálního inzulinu glargin a metforminem u pacientů s diabetem typu 2.
Pacienti s HbA1c > 7,0 % po fázi optimalizace dávky bazálního inzulinu (BIO) byli randomizováni do větve s exenatidem s okamžitým uvolňováním nebo inzulinem lispro ke stávajícímu režimu léčby inzulin glargin a metformin. V obou léčebných skupinách pacienti pokračovali v titraci dávky inzulinu glargin za použití algoritmu zohledňujícího současnou klinickou praxi.
Všichni pacienti zařazení do větve s exenatidem s okamžitým uvolňováním dostávali na počátku dávku 5 pg dvakrát denně po dobu čtyř týdnů. Po čtyřech týdnech jim byla dávka zvýšena na 10 pg dvakrát denně. U pacientů léčených exenatidem s okamžitým uvolňováním s HbA1C < 8,0 % na konci BIO fáze byla snížena jejich dávka inzulinu glargin o nejméně 10 %.
Exenatid s okamžitým uvolňováním snížil hodnotu HbA1C o 1,1 % z výchozí hodnoty 8,3 % a inzulím lispro snížil HbA1C o 1,1 % z výchozí hodnoty 8,2 % a tím byla prokázána noniferiorita exenatidu s okamžitým uvolňováním ve srovnání s titrovaným inzulinem lispro. Podíl pacientů, kteří dosáhli hodnoty HbAiC < 7 %, byl u exenatidu s okamžitým uvolňováním 47,9 % a u inzulínu lispro 42,8 %.
U exenatidu s okamžitým uvolňováním byl pozorován hmotnostní úbytek o 2,6 kg z výchozí hmotnosti 89,9 kg a u inzulinu lispro hmotnostní přírůstek o 1,9 kg z výchozí hodnoty 89,3 kg.
Hladiny lipidů nalačno
Exenatid s okamžitým uvolňováním nevykazuje nežádoucí účinky na lipidové parametry. Se snížením tělesné hmotnosti byl pozorován trend ke snížení hladin triglyceridů.
Funkce beta-buněk
Klinická hodnocení prováděná s exenatidem s okamžitým uvolňováním indikovala zlepšení funkce beta-buněk pankreatu, při použití hodnocení funkce beta-buněk pomocí homeostatického modelu (HOMA-B) a poměru proinzulin-inzulin.
Farmakodynamická studie u pacientů s diabetes mellitus 2. typu (n = 13) v odpovědi na intravenózní bolus glukózy prokázala zlepšení funkce beta-buněk obnovením první fáze sekrece inzulinu a zlepšením sekrece inzulinu ve druhé fázi.
Tělesná hmotnost
V dlouhodobých kontrolovaných studiích v délce trvání do 52 týdnů byl pozorován úbytek tělesné hmotnosti u pacientů léčených exenatidem s okamžitým uvolňováním bez ohledu na to, zda se u nich vyskytovala nauzea nebo ne, ačkoli snížení bylo větší ve skupině pacientů s nauzeou (průměrné snížení o 2,4 kg oproti 1,7 kg).
Bylo prokázáno, že podání exenatidu snižuje příjem potravy prostřednictvím snížené chuti k jídlu a zvýšením pocitu sytosti.
Pediatrická populace
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s exenatidem s okamžitým uvolňováním u jedné nebo více podskupin pediatrické populace s diabetes mellitus 2.typu (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Absorpce
Po subkutánním podání pacientům s diabetem typu 2 dosahuje exenatid medián maximální plazmatické koncentrace za 2 hodiny. Po subkutánním podání exenatidu v dávce 10 pg byla maximální plazmatická koncentrace (Cmax) 211 pg/ml a celková plocha pod křivkou (AUC 0_inf) byla 1036 pg h/ml. Expozice exenatidu se v průběhu terapeutické dávky od 5 pg do 10 pg zvyšuje proporcionálně. Podobná expozice je dosažena při subkutánním podání do abdominální oblasti, stehna nebo paže.
Distribuce
Průměrný zdánlivý distribuční objem exenatidu po subkutánním podání jednorázové dávky exenatidu je 28 litrů.
Biotransformace a eliminace
Neklinické studie ukázaly, že exenatid je eliminován převážně glomerulární filtrací s následnou proteolytickou degradací. V klinických studiích je průměrná zdánlivá clearance exenatidu 9 l/h a průměrný terminální poločas eliminace je 2,4 hodiny. Tyto farmakokinetické parametry exenatidu jsou nezávislé na dávce.
Specifické populace
Renální nedostatečnost
U pacientů s mírnou (clearance kreatininu 50 až 80 ml/min) nebo středně závažnou renální insuficiencí (clearance kreatininu 30 až 50 ml/min) byla clearance exenatidu snížena pouze mírně ve srovnání s pacienty s normální funkcí ledvin (13% snížení u mírné a 36% snížení u středně závažné renální insuficience). Clearance byla signifikantně snížena o 84 % u dialyzovaných pacientů v konečné fázi renálního selhávání (viz bod 4.2).
Jaterní nedostatečnost
U pacientů s jaterní nedostatečností nebyly prováděny žádné farmakokinetické studie. Exenatid je primárně eliminován ledvinami, proto se neočekává, že by jaterní dysfunkce ovlivňovala koncentrace exenatidu v krvi.
Pohlaví a rasa
Pohlaví a rasa nemají na farmakokinetiku exenatidu klinicky významný vliv.
Starší pacienti
Dlouhodobá kontrolovaná data o starších pacientech jsou omezená, nenaznačují však žádné výrazné změny v expozici exenatidu s rostoucím věkem až do věku 75 let. Ve farmakokinetické studii u pacientů s diabetem 2. typu vedlo podávání exenatidu (10 pg) ke střednímu zvýšení celkové plochy pod křivkou exenatidu o 36 % u 15 starších subjektů ve věku 75-85 let ve srovnání s 15 subjekty ve věku 45-65 let pravděpodobně z důvodů snížené renální funkce u starší věkové skupiny (viz bod 4.2).
Pediatrická populace
Ve farmakokinetické studii jednorázového podání provedené u 13 pacientů ve věku 12 až 16 let s diabetem 2. typu mělo podání exenatidu (5 pg) za následek mírné snížení průměrné celkové plochy pod křivkou (nižší o 16 %) a maximální plazmatické koncentrace Cmax (nižší o 25 %) ve srovnání s hodnotami pozorovanými u dospělých.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podání a genotoxicity neodhalily žádné zvláštní riziko pro člověka.
U samic laboratorních potkanů, kterým byl podáván exenatid 2 roky, byl pozorován zvýšený výskyt benigního thyreoidního adenomu z C-buněk při podávání nejvyšší dávky 250 pg/kg/den, což odpovídá 130 násobku plazmatických hladin exenatidu při klinickém užití u člověka. Po upravení na přežití nebyl tento výskyt statisticky významný. Tumorogenní odpověď nebyla pozorována u samců potkanů ani u obou pohlaví u myší.
Studie na zvířatech nenaznačují přímé škodlivé účinky na plodnost nebo těhotenství. Vysoké dávky exenatidu ve střední gestační fázi způsobovaly poruchy vývoje kostry a zpomalení fetálního růstu u myší a zpomalení fetálního růstu u králíků. Neonatální růst byl zpomalený u myší, které byly vystaveny vysokým dávkám v průběhu pozdní gestační fáze a laktace.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Metakresol
Mannitol
Kyselina octová ledová Natrium-acetát trihydrát Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti 3 roky
Používané pero:
30 dnů
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce při teplotě 2 °C až 8 °C.
Chraňte před mrazem.
Při používání
Uchovávejte při teplotě do 25 °C.
Pero se nesmí uchovávat s nasazenou jehlou.
Nasazujte na pero zpět kryt, aby bylo chráněno před světlem.
6.5 Druh obalu a obsah balení
Skleněná zásobní vložka typ I s pryžovým (bromobutyl) pístem, pryžovým uzávěrem a hliníkovým uzávěrem. Náplň je součástí jednorázového injekčního aplikátoru (pero).
5 pg: Jedno předplněné pero obsahuje 60 dávek (přibližně 1,2 ml roztoku).
10 pg: Jedno předplněné pero obsahuje 60 dávek (přibližně 2,4 ml roztoku).
Balení obsahující 1 nebo 3 pera. Na trhu nemusí být všechny velikosti balení.
Injekční jehly nejsou součástí balení.
Pro použití s perem Byetta jsou vhodné jehly společnosti Becton Dickinson and Company.
6.6 Zvláštní opatření pro likvidaci přípravku
Pacienti mají dostat instrukci znehodnotit jehlu po každé injekci.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Instrukce pro použití
Přípravek Byetta je určen k použití pouze pro jednu osobu.
Instrukce pro použití pera, které jsou součástí příbalové informace, musí být pečlivě dodržovány. Pero se nesmí uchovávat s nasazenou jehlou.
Přípravek Byetta nesmí být použit, pokud roztok obsahuje částice, je zakalený a/nebo zbarvený. Přípravek Byetta, který zmrznul, se nesmí používat.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
AstraZeneca AB SE-151 85 Sodertálje Švédsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/06/362/001-4
9. DATUM PRVNÍ REGISRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 20. listopadu 2006
Datum posledního prodloužení registrace: 20. listopadu 2011
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
PŘÍLOHA II
A. VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
AstraZeneca UK Limited Silk Road Business Park,
Macclesfield, Cheshire, SK10 2NA Velká Británie
Swords Laboratories T/A Lawrence Laboratories
Unit 12 Distribution Centre, Shannon Industrial Estate, Shannon, Co. Clare Irsko
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Byetta 5 mikrogramů injekční roztok v předplněném peru exenatidum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna dávka obsahuje exenatidum 5 mikrogramů.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: mannitol, kyselina octová ledová, natrium-acetát trihydrát, voda na injekci. Obsahuje také metakresol. Další informace jsou uvedeny v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok 1 pero (60 dávek)
3 pera (3x60 dávek)
5. ZPŮSOB A CESTA /CESTY PODÁNÍ
Dvakrát denně.
Před použitím si přečtěte příbalovou informaci a návod k používání pera.
Subkutánní podání.
6 ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
Znehodnoťte pero 30 dnů po prvním použití.
9 ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Při používání uchovávejte po dobu 30 dnů při teplotě do 25 °C. Neuchovávejte s nasazenou jehlou.
Kryt nasaďte zpět na pero, aby bylo chráněno před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
AstraZeneca AB SE-151 85 Sodertalje Švédsko
12 REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/06/362/001
EU/1/06/362/002
13 ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis. 15 NÁVOD K POUŽITÍ
16 INFORMACE V BRAILLOVĚ PÍSMU
|
byetta 5 | |
|
17. JEDINEČNÝ IDENTIFIKÁTOR |
- 2D ČÁROVÝ KÓD |
|
2D čárový kód s jedinečným identifikátorem. | |
|
18. JEDINEČNÝ IDENTIFIKÁTOR |
- DATA ČITELNÁ OKEM |
PC:
SN:
NN:
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Byetta 5 pg injekční roztok
exenatidum
Subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4 ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
60 dávek (1,2 ml) 6 JINÉ
AstraZeneca AB
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Byetta 10 mikrogramů injekční roztok v předplněném peru exenatidum
2 OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna dávka obsahuje exenatidum 10 mikrogramů.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: mannitol, kyselina octová ledová, natrium-acetát trihydrát, voda na injekci. Obsahuje také metakresol. Další informace jsou uvedeny v příbalové informaci.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok 1 pero (60 dávek)
3 pera (3x60 dávek)
5. ZPŮSOB A CESTA /CESTY PODÁNÍ
Dvakrát denně.
Před použitím si přečtěte příbalovou informaci a návod k používání pera.
Subkutánní podání.
6 ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ 8. POUŽITELNOST
EXP
Znehodnoťte pero 30 dnů po prvním použití.
9 ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Při používání uchovávejte po dobu 30 dnů při teplotě do 25 °C. Neuchovávejte s nasazenou jehlou.
Kryt nasaďte zpět na pero, aby bylo chráněno před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ
NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
AstraZeneca AB SE-151 85 Sodertalje Švédsko
12 REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/06/362/003
EU/1/06/362/004
13 ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis. 15 NÁVOD K POUŽITÍ
16 INFORMACE V BRAILLOVĚ PÍSMU
|
byetta 10 | |
|
17. JEDINEČNÝ IDENTIFIKÁTOR |
- 2D ČÁROVÝ KÓD |
|
2D čárový kód s jedinečným identifikátorem. | |
|
18. JEDINEČNÝ IDENTIFIKÁTOR |
- DATA ČITELNÁ OKEM |
PC:
SN:
NN:
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Byetta 10 pg injekční roztok
exenatidum
Subkutánní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET 60 dávek (2,4 ml)
6. JINÉ
AstraZeneca AB
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro pacienta
Byetta 5 mikrogramů injekční roztok v předplněném peru Byetta 10 mikrogramů injekční roztok v předplněném peru
exenatidum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité informace.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoliv další otázky, zeptejte se svého lékaře, lékárníka nebo diabetologické sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo diabetologické sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Byetta a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Byetta používat
3. Jak se přípravek Byetta používá
4. Možné nežádoucí účinky
5. Jak přípravek Byetta uchovávat
6. Obsah balení a další informace
1. Co je přípravek Byetta a k čemu se používá
Přípravek Byetta obsahuje léčivou látku exenatid. Jde o injekční léčivý přípravek používaný ke zlepšení kontroly hladiny cukru v krvi u dospělých pacientů s cukrovkou typu 2 (diabetes mellitus nezávislý na inzulinu).
Přípravek Byetta se užívá v kombinaci s dalšími přípravky používanými k léčbě cukrovky nazývanými metformin , deriváty sulfonylmočoviny, thiazolidindiony a bazální nebo dlouhodobě působící inzuliny. Lékař Vám nyní předepsal přípravek Byetta jako doplňující lék ke zlepšení kontroly hladiny cukru v krvi. Pokračujte v dodržování Vašeho dosavadního dietetického programu a programu cvičení.
Trpíte cukrovkou, protože Vaše tělo nevytváří dostatek inzulinu ke kontrole hladiny cukru v krvi nebo Vaše tělo není schopno využívat vlastní inzulin. Léčivá látka v přípravku Byetta pomáhá tělu zvýšit tvorbu inzulinu v případě, kdy je hladina cukru v krvi vysoká.
2. Čemu musíte věnovat pozornost, než začnete přípravek Byetta používat
Nepoužívejte přípravek Byetta:
- jestliže j ste alergický(á) na exenatid nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před použitím tohoto přípravku se poraďte se svým lékařem, nebo lékárníkem nebo diabetologickou
sestrou.
- Při používání tohoto přípravku v kombinaci se sulfonylmočovinou, může dojít k přílišnému snížení hladiny cukru v krvi (hypoglykemie). Zeptejte se svého lékaře, nebo lékárníka nebo diabetické sestry, pokud si nejste jist(a), zda Vaše další léky obsahují sulfonylmočovinu.
- Tento přípravek byste nesmíte používat, pokud máte diabetes 1. typu nebo diabetickou ketoacidózu (nebezpečný stav, který se může objevit při onemocnění diabetem).
- Jak podávat tento léčivý přípravek. Tento přípravek má být podáván pod kůži a ne do žíly nebo do svalu.
- Jestliže máte vážné problémy s pomalým vyprazdňováním žaludku (včetně gastroparézy) nebo se zažíváním potravy, podávání tohoto přípravku se nedoporučuje. Léčivá látka tohoto přípravku zpomaluje vyprazdňování žaludku, takže potrava prochází žaludkem pomaleji.
- Informujte svého lékaře, pokud jste někdy měl(a) zánět slinivky břišní (pankreatitidu) (viz bod 4).
- Jestliže máte závažné onemocnění ledvin nebo chodíte na dialýzu (umělá ledvina), nedoporučuje se podávat tento přípravek. Zkušenosti s použitím tohoto přípravku u pacientů s poruchou funkce ledvin jsou pouze omezené.
Děti a dospívající
Nepodávejte tento přípravek dětem a dospívajícím do 18 let, neboť nejsou žádné zkušenosti s použitím tohoto přípravku u této věkové skupiny.
Další léčivé přípravky a přípravek Byetta
Prosím, informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste užíval(a) nebo které možná budete užívat, zejména:
- léčivé přípravky používané k léčbě diabetu 2. typu, které působí podobně jako Byetta (např. liraglutid a exenatid s prodlouženým uvolňováním), neboť souběžné podávání s přípravkem Byetta se nedoporučuje.
- léčivé přípravky používané k ředění krve (antikoagulancia), např. warfarin, neboť bude potřebné další sledování hodnot INR (měření naředění krve) v průběhu zahajování léčby tímto přípravkem.
Zeptejte se svého lékaře, zda je nutné změnit dobu, kdy užíváte jakékoliv tablety. Tento přípravek zpomaluje vyprazdňování žaludku a může tak mít vliv na léčivé přípravky, u kterých je zapotřebí rychlý průchod žaludkem, např.:
- tablety nebo tobolky odolné k působení žaludečních šťáv (např. léčivé přípravky snižující žaludeční kyselost (inhibitory protonové pumpy)), které by neměly zůstávat v žaludku delší dobu, by mohlo být potřeba užít hodinu před nebo 4 hodiny po podání tohoto přípravku.
- některá antibiotika je třeba užít jednu hodinu před podáním injekce přípravku Byetta.
- některé tablety, které se užívají s jídlem, může být vhodnější užívat je s jídlem v době, kdy nyní podáván přípravek Byetta.
Přípravek Byetta s jídlem
Tento přípravek použijte kdykoliv v průběhu 60 minut (1 hodiny) před jídlem. (viz bod 3 „Jak se přípravek Byetta používá”). Nepoužívejte tento přípravek po jídle.
Těhotenství a kojení
Není známo, zda tento přípravek může poškodit nenarozené dítě. Pokud jste těhotná, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek používat, protože tento přípravek nesmí být podáván v průběhu těhotenství.
Není známo, zda exenatid přechází do mateřského mléka. V období kojení nesmí být tento přípravek podáván.
Řízení dopravních prostředků a obsluha strojů
Jestliže používáte tento přípravek v kombinaci se sulfonylmočovinou nebo s inzulinem, může dojít k přílišnému snížení hladiny cukru v krvi (hypoglykemie). Hypoglykemie může snížit Vaši schopnost se soustředit. Berte, prosím, tento možný problém v úvahu ve všech situacích, které mohou být pro Vás nebo pro ostatní riskantní (např. řízení auta nebo obsluha strojů).
Přípravek Byetta obsahuje metakresol.
Metakresol může vyvolat alergickou reakci.
Přípravek Byetta obsahuje sodík.
Tento přípravek obsahuje méně než 1 mmol sodíku (23 mg) v jedné dávce, tj. v podstatě je „bez sodíku“.
3. Jak se přípravek Byetta používá
Vždy používejte tento přípravek přesně podle pokynů lékaře, nebo lékárníka nebo diabetologické sestry. Jestliže si nejste používáním jist(a), kontaktujte, prosím, svého lékaře, lékárníka, nebo diabetologickou sestru.
K dispozici jsou dvě různé síly přípravku Byetta: Byetta 5 mikrogramů a Byetta 10 mikrogramů.
Lékař může zahájit Vaši léčbu přípravkem Byetta 5 mikrogramů dvakrát denně. Po 30 dnech používání přípravku Byetta 5 mikrogramů dvakrát denně může lékař dávku zvýšit na léčbu přípravkem Byetta 10 mikrogramů dvakrát denně.
Je-li Vám více než 70 let nebo máte li problémy s ledvinami, může trvat déle než 30 dní než si Vaše tělo zvykne na přípravek Byetta 5 mikrogramů a Váš lékař tedy nemusí dávkování zvýšit.
Předepsanou dávku si podáte aplikací jedné injekce pomocí předplněného pera. Neměňte si dávku bez doporučení lékaře.
Tento přípravek se má podat injekcí kdykoliv v průběhu 60 minut (1 hodina) před ranním a večerním jídlem, nebo před dvěma hlavními denními jídly, které od sebe dělí nejméně 6 hodin. Nepoužívejte tento přípravek po jídle.
Tento přípravek se má podat injekcí pod kůži (subkutánní injekce) do horní části nohy (stehna), oblasti žaludku (břicha) nebo horní části paže. Používáte-li přípravek Byetta a inzulin, musíte si aplikovat dvě jednotlivé injekce.
Pro nastavení dávky přípravku Byetta si nemusíte každodenně kontrolovat hladinu cukru v krvi. Nicméně jestliže užíváte také sulfonylmočovinu nebo inzulin, lékař Vás může požádat o kontrolu hladiny cukru v krvi, pro úpravu dávky sulfonylmočoviny nebo inzulinu.
Pro správné používání pera Byetta si přečtěte přiložený Návod k použití pera.
Lékař nebo sestra Vás musí naučit, jak správně podávat injekci přípravku Byetta před tím, než pero použijete poprvé.
Pro použití s perem Byetta jsou vhodné jehly společnosti Becton Dickinson and Company. Jehly nejsou součástí balení pera.
Ke každé injekci použijte novou jehlu, kterou po podání znehodnoťte. Tento přípravek je určen pouze pro Vás, nikdy se o pero Byetta nedělte s dalšími osobami.
Jestliže jste použil(a) více přípravku Byetta, než jste měl(a)
Jestliže použijete příliš mnoho tohoto přípravku, kontaktujte lékaře nebo navštivte nemocnici. Podání příliš velkého množství tohoto přípravku může způsobit pocit na zvracení, zvracení, závratě nebo příznaky nízké hladiny cukru v krvi (viz bod 4).
Jestliže jste zapomněl(a) použít přípravek Byetta
Jestliže zapomenete použít dávku tohoto přípravku, přeskočte tuto dávku a pokračujte následující dávkou v příštím předepsaném čase. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) používat přípravek Byetta
Jestliže se domníváte, že byste měl(a) přestat používat tento přípravek, poraďte se s lékařem. Jestliže přestanete používat tento přípravek, může to ovlivnit hladinu Vašeho cukru v krvi.
Máte-li jakékoli další otázky týkající se používání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo diabetologické sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Vzácně byl hlášen výskyt závažných alergických reakcí (anafylaktická reakce) (projevuje se až u 1 osoby z 1000).
Kontaktujte neprodleně lékaře v případě výskytu následujících příznaků:
• otok obličeje, jazyka nebo hrdla (angioedém)
• vyrážky, svědění a náhlý otok v oblasti krku, obličeje, úst nebo hrdla
• obtížné polykání
• vyrážka a potíže s dýcháním
U pacientů používajících tento přípravek hlášen výskyt zánětu slinivky břišní (pankreatitida) (frekvence neznámá). Pankreatitida může být závažný, potenciálně život ohrožující zdravotní stav.
• Informujte svého lékaře, pokud j ste prodělal(a) pankreatitidu, trpíte žlučovými kameny, alkoholismem nebo vysokou hladinou tuků v krvi. Tyto stavy mohou zvýšit možnost, že u Vás dojde k onemocnění pankreatitidou, nebo se pankreatitida znovu projeví, a to nezávisle na tom, zda používáte tento přípravek, nebo ne.
• PŘESTAŇTE používat tento přípravek a kontaktujte ihned svého lékaře v případě, že se u Vás objeví silná a přetrvávající bolest v oblasti žaludku, ať už se zvracením, nebo bez něj, protože se může jednat o zánět slinivky břišní (pankreatitidu).
Velmi časté nežádoucí účinky tohoto přípravku (projevují se u více než 1 osoby z 10)
• pocit na zvracení (pocit na zvracení je nejčastější při zahájení podávání tohoto přípravku, u většiny pacientů se s časem snižuje)
• zvracení
• průjem
• hypoglykemie
Jestliže je tento přípravek podáván společně s léky obsahujícími sulfonylmočovinu nebo inzulin, velmi často může dojít k případům přílišného snížení hladiny cukru v krvi (hypoglykemie, obvykle mírné až střední). V případě, že používáte tento přípravek, může být zapotřebí snížit dávku léku se sulfonylmočovinou nebo inzulinem. Známky a příznaky nízké hladiny cukru v krvi mohou zahrnovat bolest hlavy, ospalost, slabost, závratě, zmatek, podrážděnost, hlad, zrychlení srdečního tepu, pocení a pocit nervozity. Váš lékař by Vám měl sdělit, jak nízkou hladinu cukru v krvi léčit.
Časté nežádoucí účinky tohoto přípravku (projevují se až u 1 osoby z 10)
• závratě
• bolest hlavy
• pocit nervozity
• zácpa
• bolest v žaludeční oblasti
• nadýmání
• trávicí potíže
• svědění (s nebo bez vyrážky)
• nadýmání (plynatost)
• zvýšené pocení
• ztráta energie a síly
• pálení žáhy
• snížení chuti k jídlu
Tento přípravek může snižovat chuť k jídlu, množství přijímané potravy a Vaši tělesnou hmotnost. Pokud se Vaše hmotnost snižuje příliš rychle (více než 1,5 kg za týden), konzultujte to se svým lékařem, protože to může vyvolat např. tvorbu žlučových kamenů.
Méně časté nežádoucí účinky tohoto přípravku (projevují se až u 1 osoby ze 100)
• zhoršení funkce ledvin
• ztráta a nedostatek vody v organismu (dehydratace), obvykle doprovázená pocitem na zvracení, zvracením a/nebo průjmem
• nezvyklá chuť v ústech
• říhání
• reakce v místě injekce (zarudnutí)
• ospalost
• vypadávání vlasů
• snížení tělesné hmotnosti
Vzácné nežádoucí účinky tohoto přípravku (projevují se až u 1 osoby z 1000)
• neprůchodnost střeva
Mimo to byly hlášeny některé další nežádoucí účinky (četnost výskytu není známa, není možné ji z dostupných údajů určit)
• v případě používání společně s warfarinem byly hlášeny změny tzv. INR (míra srážlivosti krve). Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, nebo lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Byetta uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku a krabičce za „EXP“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v chladničce (2 °C - 8 °C). Jakmile začnete pero používat, mělo by být uchováno při teplotě do 25 °C po dobu 30 dnů. Po 30 dnech používání pero zlikvidujte, i když v něm zbývá nějaký léčivý přípravek.
Kryt nasazujte zpět na pero, aby bylo chráněno před světlem. Chraňte před mrazem. Pokud přípravek Byetta zmrznul, pero znehodnoťte.
Nepoužívejte tento přípravek, pokud si všimnete, že roztok obsahuje částice, j e zakalený nebo zbarvený.
Pero neuchovávejte s nasazenou jehlou. Jestliže je jehla ponechána nasazená na peru, přípravek může z pera vytékat nebo se do náplně mohou dostat vzduchové bubliny.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Byetta obsahuje
- Léčivou látkou je exenatidum.
- Jsou dostupné dva typy předplněných per. Jedním se aplikuje dávka 5 mikrogramů, druhým
dávka 10 mikrogramů.
- Jedna dávka přípravku Byetta 5 mikrogramů injekční roztok (injekce) obsahuje exenatidum 5 mikrogramů ve 20 mikrolitrech.
- Jedna dávka přípravku Byetta 10 mikrogramů injekční roztok (injekce) obsahuje exenatidum 10 mikrogramů ve 40 mikrolitrech.
- Jeden mililitr (ml) injekčního roztoku obsahuje exenatidum 0,25 miligramů (mg).
- Pomocnými látkami jsou metakresol (44 mikrogramů v jedné dávce přípravku Byetta
5 mikrogramů injekční roztok a 88 mikrogramů v jedné dávce přípravku Byetta 10 mikrogramů injekční roztok), mannitol, kyselina octová ledová, natrium-acetát trihydrát a voda na injekci (viz bod 2).
Jak přípravek Byetta vypadá a co obsahuje toto balení
Přípravek Byetta je čirá bezbarvá tekutina (injekční roztok) obsažená ve skleněné zásobní vložce (náplni). Náplň je součástí injekčního pera. Jestliže je pero prázdné, nemůže být znovu použito. Každé pero obsahuje 60 dávek umožňujících podání injekce dvakrát denně po dobu 30 dnů.
Byetta je dostupná v balení po 1 nebo 3 předplněných perech. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
AstraZeneca AB SE-151 85 Sodertálje Švédsko
Výrobce
AstraZeneca UK Limited Silk Road Business Park,
Macclesfield, Cheshire, SK10 2NA Velká Británie

;ko
Swords Laboratories T/A Lawrence Laboratories
nit 12 Distribution Centre, Shannon Industrial Estate, Shannon, Co. Clare
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Česká republika AstraZeneca Czech Republic s.r.o. Tel: +420 222 807 111 |
Magyarország AstraZeneca Kft. Tel.: +36 1 883 6500 |
|
Danmark AstraZeneca A/S Tlf: +45 43 66 64 62 |
Malta Associated Drug Co. Ltd Tel: +356 2277 8000 |
|
Deutschland AstraZeneca GmbH Tel: +49 41 03 7080 |
Nederland AstraZeneca BV Tel: +31 79 363 2222 |
|
Eesti AstraZeneca Tel: +372 6549 600 |
Norge AstraZeneca AS Tlf: +47 21 00 64 00 |
|
EXXába AstraZeneca A.E. T^k: +30 2 10 6871500 |
Osterreich AstraZeneca Osterreich GmbH Tel: +43 1 711 31 0 |
|
Espaňa AstraZeneca Farmacéutica Spain, S.A. Tel: +34 91 301 91 00 |
Polska AstraZeneca Pharma Poland Sp. z o.o. Tel.: +48 22 245 73 00 |
|
France AstraZeneca Tél: +33 1 41 29 40 00 |
Portugal AstraZeneca Produtos Farmaceuticos, Lda. Tel: +351 21 434 61 00 |
|
Hrvatska AstraZeneca d.o.o. Tel: +385 1 4628 000 |
Románia AstraZeneca Pharma SRL Tel: +40 21 317 60 41 |
|
Ireland AstraZeneca Pharmaceuticals (Ireland) Ltd Tel: +353 1609 7100 |
Slovenija AstraZeneca UK Limited Tel: +386 1 51 35 600 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika AstraZeneca AB, o.z. Tel: +421 2 5737 7777 |
|
Italia AstraZeneca S.p.A. Tel: +39 02 9801 1 |
Suomi/Finland AstraZeneca Oy Puh/Tel: +358 10 23 010 |
|
Kúrcpog AksKxrop OappaKeuxiKp AxS T nk: +357 22490305 |
Sverige AstraZeneca AB Tel: +46 8 553 26 000 |
|
Latvija SIA AstraZeneca Latvija Tel: +371 67377100 |
United Kingdom AstraZeneca UK Ltd Tel: +44 1582 836 836 |
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
NÁVOD K OBSLUZE PERA Byetta 5 mikrogramů injekční roztok v předplněném peru (exenatidum)

Část 1 CO POTŘEBUJETE ZNÁT O PERU BYETTA
Před zahájením používání pera si pečlivě přečtěte celou tuto část. Potom přejděte k Části 2 -Zahájení používání.

PŘED zahájením používání pera Byetta si pečlivě přečtěte tyto pokyny. Rovněž si přečtěte Příbalovou informaci přípravku Byetta přiloženou v balení pera Byetta.
K dosažení co největšího přínosu přípravku Byetta musíte pero správně používat. Pokud pokyny nedodržíte, můžete si například podat chybnou dávku, poškodit pero anebo může dojít k infekci.
Tyto pokyny nenahrazují prodiskutování Vašeho zdravotního stavu a léčby se zdravotnickým pracovníkem. Pokud máte při používání pera Byetta potíže, kontaktujte svého zdravotnického pracovníka.
DŮLEŽITÉ INFORMACE O PERU BYETTA
• Přípravek Byetta se podává injekcí dvakrát denně, pero obsahuje dostatek přípravku pro 30denní léčbu. Dávku si nemusíte odměřovat, pero Vám odměří každou dávku.
• NEPŘENDÁVEJTE LÉK OBSAŽENÝ V PERU BYETTA DO STŘÍKAČKY.
• Jestliže se Vám zdá, že jakákoli část pera je zlomená nebo poškozená, pero nepoužívejte.
• Své pero ani jehly s nikým nesdílejte, jinak se vystavujete riziku přenosu infekce.
• Toto pero není určeno nevidomým nebo osobám s poškozeným zrakem. V tomto případě je zapotřebí, aby pomohla osoba, která je se správným používáním přípravku seznámena.
• Zdravotnický personál a ošetřovatelé musí dodržovat místní zásady a pokyny pro zacházení s jehlami a pro jejich likvidaci.
• Dodržujte přesně hygienické injekční techniky doporučené Vaším zdravotnickým pracovníkem.
• Pokyny v části 2 se řiďte pouze při nastavení nového pera před prvním použitím.
• Pokyny v části 3 se musí dodržovat při každé injekci.
INJEKČNÍ JEHLY
Pro použití s Vaším perem Byetta jsou vhodné jehly společnosti Becton Dickinson and Company.
Mám pro každou injekci použít novou jehlu?
• Ano. Jehly nepoužívejte opakovaně.
• Odstraňte jehlu ihned po každé injekci. To zamezí vytékání přípravku Byetta, vniknutí vzduchových bublin, ucpání jehly a sníží riziko infekce.
• Nikdy nemačkejte injekční tlačítko, pokud není jehla připojena k peru.
Jak mám jehly vyhodit?
• Použité jehly vyhoďte do nádoby, která nejde propíchnout nebo podle doporučení lékaře.
• Pero nevyhazujte s nasazenou jehlou.
UCHOVÁVÁNÍ PERA BYETTA
Jak mám pero Byetta uchovávat?
• Uchovávejte v chladničce (2° až 8°C).
• Chraňte před mrazem. Pokud přípravek Byetta zmrznul, pero znehodnoťte.
• Jakmile začnete pero Byetta používat, uchovávejte jej při teplotě do 25 °C.
• Nasaďte kryt pera, aby byl přípravek chráněn před světlem.
• Neuchovávejte pero Byetta s nasazenou jehlou. Jestliže je jehla ponechána nasazená na peru, přípravek může vytékat z pera Byetta nebo se do náplně mohou dostat vzduchové bubliny.
Pero a jehly uchovávejte mimo dohled a dosah dětí.
Jak dlouho mohu pero Byetta používat?
• Po nastavení nového pera Byetta ho používejte pouze 30 dnů.
Po uplynutí 30 dnů používané pero Byetta znehodnoťte, i když v peru ještě nějaký přípravek zbývá.
• Na níže určených místech si poznamenejte datum, kdy pero použijete poprvé a datum o 30 dní později:
Datum prvního použití Datum znehodnocení pera
• Nepoužívejte přípravek Byetta nepoužívejte po uplynutí doby použitelnosti uvedené na štítku a obalu za „EXP“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Jak mám pero Byetta čistit?
• V případě potřeby otřete vnější část pera čistým, vlhkým hadříkem.
• Během normálního používání se na vršku náplně mohou objevit bílé částice. Můžete je odstranit hadříkem namočeným v alkoholu nebo tampónem s alkoholem.
Čtěte prosím přiloženou Příbalovou informaci přípravku Byetta. Pro další informace kontaktujte svého lékaře.
Část 2 ZAHÁJENÍ POUŽÍVÁNÍ
Přečtěte si tyto pokyny a řiďte se jimi až po přečtení Části 1 - Důležité informace o peru Byetta.
Nastavení nového pera proveďte pouze před jeho prvním použitím. Pokyny Nastavení nového pera proveďte pouze jednou. Při běžném používání pokyny Nastavení nového pera neopakujte. Jestliže opakujete nastavení nového pera před každým běžným použitím, přípravek Byetta v peru nevystačí na podávání po dobu 30 dnů.

ČASTI PERA BYETTA

modrý kryt pera
náplň
roztok štítek
s přípravkem Byetta
dávkovači dávkovači injekční okénko knoflík tlačítko
ČASTI JEHLY
(jehly nejsou součástí balení)

vnější kryt vnitřní jehla papírová jehly kryt jehly fólie
SYMBOLY V DÁVKOVACÍM
OKÉNKU
T připraveno k vytáhnutí dávkovacího knoflíku
[+] připraveno k otáčení do dávkovači polohy
fŠj připraveno k podání dávky 5 mikrogramú (pg)
A dávkovači tlačítko je zamáčknuto a připraveno k nastavení dávky
NASTAVENÍ NOVÉHO PERA - PROVEĎTE POUZE JEDNOU KROK A Kontrola pera

• Před použitím si umyjte ruce.
• Zkontrolujte štítek a přesvědčte se, že používáte správné pero 5 mikrogramů.
• Sundejte modrý kryt pera.

Zkontrolujte náplň přípravku Byetta. Tekutina má být čirá bezbarvá a bez viditelných částic. V opačném případě pero nepoužívejte.
Poznámka: Malá vzduchová bublinka v náplni je normální.
KROK B Nasazení jehly

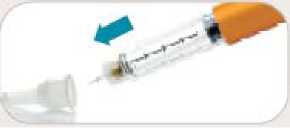
• Z vněj šího krytu j ehly odstraňte papírovou fólii.
• Vnější kryt obsahující jehlu nasaďte přímo na konec pera a potom jehlu našroubujte až do utažení.
• Odstraňte vněj ší kryt j ehly. Nevyhazujte j ej. Vněj ší kryt j ehly použij ete při odšroubovávání jehly z pera po aplikaci injekce.
• Odstraňte vnitřní kryt jehly a vyhoďte jej. Může se objevit malá kapka tekutiny. To je normální. KROK C Nastavení dávky

0
Zkontrolujte, že v dávkovacím okénku je symbol LJ . V opačném případě otáčejte dávkovacím knoflíkem po směru hodinových ručiček, dokud se nezastaví a v dávkovacím okénku se neobjeví symbol 0

• Vytáhněte dávkovači knoflík, dokud se nezastaví a v dávkovacím okénku se neobjeví symbol


• Otáčejte dávkovacím knoflíkem po směru hodinových ručiček, dokud se nezastaví a
v dávkovacím okénku se neobjeví symbol ©. Ujistěte se, že se symbol 5 společně se spodním podtržítkem nachází ve středu dávkovacího okénka.

Poznámka: Pokud nejde otočit dávkovacím knoflíkem po směru hodinových ručiček na symbol řiďte se instrukcemi v Části 4 tohoto návodu, Často kladené otázky, č. 9.

• Držte pero jehlou vzhůru směrem od sebe.
ZMÁČKNOUT & DRŽET
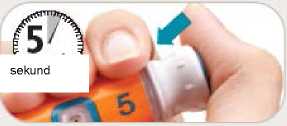
• Palcem pevně stiskněte injekční tlačítko, dokud se nezastaví. Držte dále injekční tlačítko, dokud pomalu nenapočítáte do pěti.
• Pokud nevidíte vytékat ze špičky jehly proud nebo několik kapek tekutiny, opakujte kroky C a D.


a vidíte ze
Příprava pera je kompletní, když se ve středu dávkovacího okénka objeví symbol špičky jehly vytékat proud nebo kapky tekutiny.
Poznámka: Jestliže ani po 4 opakováních nevidíte vytékat tekutinu, řiďte se pokyny v Části 4 tohoto návodu, Často kladené otázky, č. 3.
KROK E Dokončení nastavení nového pera
Otáčejte dávkovacím knoflíkem po směru hodinových ručiček, dokud se nezastaví a
0.
v dávkovacím okénku se neobjeví symbol
Nastavení nového pera je nyní dokončeno. Při běžném používání neopakujte nastavení pera jako poprvé, jak je uvedeno v krocích v Části 2, jinak Vám přípravek Byetta v peru nevystačí po celou dobu 30 dnů léčby.
Nyní jste připraven(a) k aplikaci první dávky přípravku Byetta.
Pro pokyny, jak aplikovat dávku při běžném používání, přejděte k Části 3.
Poznámka: Pokud nejde otočit dávkovacím knoflíkem, řiďte se instrukcemi v Části 4 tohoto návodu, Často kladené otázky, č. 9.
Část 3 BĚŽNÉ POUŽÍVÁNÍ
Po nastavení nového pera nyní při každé aplikaci dodržujte pokyny v Části 3. KROK 1 Kontrola pera

• Před použitím si umyjte ruce.
• Zkontrolujte štítek a přesvědčte se, že používáte správné pero 5 mikrogramů.
• Sundejte modrý kryt pera.

• Zkontrolujte náplň přípravku Byetta.
• Tekutina by měla být čirá bezbarvá a bez viditelných částic. V opačném případě pero nepoužívejte.
Poznámka: Malá vzduchová bublinka v náplni je normální.
KROK 2 Nasazení jehly

• Z vněj šího krytu j ehly odstraňte papírovou fólii.
• Vnější kryt obsahující jehlu nasaďte přímo na konec pera a potom jehlu našroubujte až do utažení.
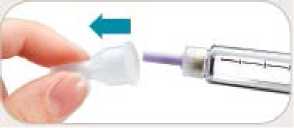
• Odstraňte vněj ší kryt j ehly. Nevyhazujte j ej. Vněj ší kryt j ehly použij ete při odšroubovávání jehly z pera po aplikaci injekce.
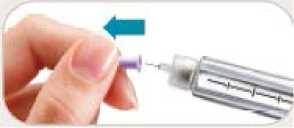
• Odstraňte vnitřní kryt jehly a vyhoďte jej. Může se objevit malá kapka tekutiny. To je normální.

• Zkontrolujte, že v dávkovacím okénku je symbol Cl . V opačném případě otáčejte dávkovacím
knoflíkem po směru hodinových ručiček, dokud se nezastaví a v dávkovacím okénku se neobjeví symbol 0
• Vytáhněte dávkovači knoflík, dokud se nezastaví a v dávkovacím okénku se neobjeví symbol


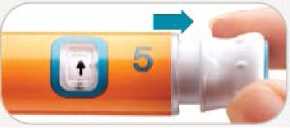
• Otáčejte dávkovacím knoflíkem po směru hodinových ručiček, dokud se nezastaví a
v dávkovacím okénku se neobjeví symbol @. Ujistěte se, že se symbol 5 společně se spodním podtržítkem nachází ve středu dávkovacího okénka.

Poznámka: Pokud nejde otočit dávkovacím knoflíkem po směru hodinových ručiček na symbol řiďte se instrukcemi v Části 4 tohoto návodu, Často kladené otázky, č.9.
KROK 4 Podání dávky
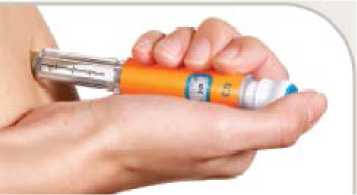
• Uchopte pero pevně do ruky.
• Před vpichem injekce netiskněte kůži příliš pevně. Vbodněte jehlu pod kůži podle hygienického postupu doporučeného Vaším zdravotnickým pracovníkem.
ZMÁČKNOUT & DRŽET
• Palcem silně stiskněte injekční tlačítko, dokud se nezastaví. Abyste si podal(a) celou dávku, držte dále injekční tlačítko, dokud pomalu nenapočítáte do pěti.
• Držte injekční tlačítko zmáčknuté, dokud si nevytáhnete jehlu z kůže. Viz Často kladené otázky, otázka č.4.

• Aplikace je kompletní, pokud je ve středu dávkovacího tlačítka vidět symbol
• Pero je nyní připraveno k nastavení do původní polohy.
Poznámka: Pokud vidíte po podání vytékat z jehly přípravek Byetta, injekční tlačítko nebylo stisknuto úplně. Řiďte se instrukcemi v Části 4 tohoto návodu, Často kladené otázky, č. 5.
KROK 5 Nastavení pera do původní polohy

Otáčejte dávkovacím knoflíkem po směru hodinových ručiček, dokud se nezastaví a
0
v dávkovacím okénku se neobjeví symbol
Poznámka: Pokud nemůžete otáčet dávkovacím knoflíkem, nebo z pera vytéká tekutina, nepodal(a) jste si celou dávku. Řiďte se instrukcemi v Části 4 tohoto návodu, Často kladené otázky, č. 5 a 9.
KROK 6 Odstranění a znehodnocení jehly
• Jehlu odstraňte po každé injekci.
• Opatrně nasaďte na jehlu vnější kryt.

• Odšroubujte jehlu.
• Vraťte zpět na pero modrý kryt.

• Jehlu vyhoďte do nádoby, která nejde propíchnout nebo podle doporučení lékaře.
KROK 7 Uchovávání pera před podáním další dávky
• Pero Byetta řádně uchovávejte (pro více informací viz Uchovávání pera Byetta v Části 1 tohoto návodu).
• V čase další běžné dávky přejděte k Části 3, Krok 1 a opakujte kroky 1-7.
Část 4 ČASTO KLADENÉ OTÁZKY
1. Musím provést krok Nastavení nového pera před aplikací každé dávky?
• Ne. Nastavení nového pera se provede pouze jednou před nastavením nového pera před prvním použitím.
• Důvodem je, aby pero Byetta bylo připraveno pro používání po dobu 30 dnů.
• Jestliže opakujete nastavení nového pera před každým běžným použitím, přípravek Byetta v peru nevystačí na podávání 30 dnů. Malé množství přípravku použité při nastavení nového pera neovlivní množství přípravku Byetta potřebného pro 30denní léčbu.
2. Proč jsou v náplni vzduchové bubliny?
• Malá vzduchová bublinka je normální, neublíží Vám a neovlivní dávku.
• Jestliže je pero uchováváno s nasazenou jehlou, v náplni se mohou tvořit vzduchové bubliny. Neuchovávejte pero s nasazenou jehlou.
3. Co bych měl(a) udělat, jestliže v průběhu Nastavení nového pera nevychází ze špičky jehly přípravek Byetta ani po čtyřech pokusech?
• Opatrně nasaďte vnější kryt jehly a jehlu odstraňte. Jehlu odšroubujte a znehodnoťte podle pokynů.
• Nasaďte novou jehlu a opakujte kroky B - E, Nastavení nového pera v části 2 tohoto návodu. Jakmile uvidíte vytékat proud nebo kapky tekutiny ze špičky jehly, nastavení je kompletní.
4. Proč jsou po dokončení injekce v náplni viditelné pevné částečky?
Pevné částečky nebo změna barvy se mohou po dokončení injekce v náplni objevit. Může se to stát, je-li kůže příliš pevně stisknuta, nebo je zmáčknuté injekční tlačítko uvolněno předtím, než je jehla vytažena z kůže.
5. Proč vidím přípravek Byetta vytékat z jehly, když jsem ukončil(a) podání dávky?
Po dokončení injekce může na jehle zůstat jedna kapka přípravku. To je normální.
Pokud uvidíte více než jednu kapku:
• Nepodal(a) jste si celou dávku. Další dávku si neaplikujte. Podání neúplné dávky konzultujte se svým lékařem.
• Při příští dávce se tomu vyhnete tak, že před vytažením jehly z kůže stisknete injekční tlačítko a držíte jej, dokud pomalu nenapočítáte do pěti (viz část 3, krok 4: Podání dávky).
máte vytáhnout nebo otočit dávkovací knoflík v dalším kroku. Tento symbol dávkovací knoflík je zamáčknut a pero je připraveno k nastavení.
ukazují směr, kterým
znamená, že
7. Jak mohu rozeznat, kdy je injekce dokončena?
Injekce je dokončena, když:
• palcem pevně stisknete injekční tlačítko, dokud se nezastaví. a
• před vytažením jehly z kůže injekční tlačítko stále držíte, dokud pomalu nenapočítáte do pěti
ve středu dávkovacího okénka se objeví symbol

8. Kam bych měl(a) přípravek Byetta aplikovat?
Přípravek Byetta má být podán v injekci pod kůži do oblasti břicha, stehna nebo horní části paže za použití injekční techniky doporučené Vaším zdravotnickým pracovníkem.
Pohled zepředu Pohled zezadu


9. Co bych měl(a) udělat, jestliže nemohu vytáhnout, nastavit nebo stisknout dávkovací knoflík?
Zkontrolujte symbol v dávkovacím okénku. Pokračujte pokyny odpovídajícími danému symbolu.

• Vytáhněte dávkovací knoflík, dokud se neobjeví symbol

Pokud je v dávkovacím okénku symbol L+J a dávkovacím knoflíkem nelze otáčet:
• V náplni Vašeho pera Byetta může být nedostatek přípravku pro podání celé dávky. Malé
množství přípravku Byetta v náplni vždy zůstane. Jestliže náplň obsahuje malé množství nebo se zdá prázdná, opatřete si nové pero Byetta.
0
Jestliže se v dávkovacím okénku objeví symbol > a pouze část symbolu a dávkovací knoflík nelze stisknout:
• Dávkovací knoflík nebyl nastaven úplně. Pokračujte v nastavení, dokud se v dávkovacím
okénku neobjeví symbol zřetelně.
Jestliže se v dávkovacím okénku objeví neúplný symbol LU a neúplný symbol O a dávkovací knoflík nelze stisknout:
• Jehla může být ucpaná, ohnutá nebo nesprávně nasazená.
• Nasaďte novou jehlu. Ujistěte se, že je jehla nasazena přímo a našroubována do utažení.
• Pevně stiskněte injekční tlačítko. Přípravek Byetta by měl vytékat ze špičky jehly.
Jestliže se v dávkovacím okénku objeví symbol O a dávkovacím knoflíkem nelze otáčet:
• Injekční tlačítko nebylo stlačeno úplně a nebyla podána celá dávka. Podání neúplné dávky konzultujte se svým lékařem.
• Pro nastavení pera pro příští injekci dodržujte tyto pokyny:
- Silně stiskněte injekční tlačítko, dokud se nezastaví. Držte stále injekční tlačítko stisknuté a pomalu počítejte do 5. Otáčejte potom dávkovacím knoflíkem, dokud se dávkovacím okénku
0
neobjeví symbol
- Pokud nelze otáčet dávkovacím knoflíkem, jehla může být ucpaná. Vyměňte jehlu a výše uvedené kroky opakujte.
Ujistěte se při příští aplikaci, že injekční tlačítko pevně stisknete a před vytažením jehly z kůže jej stále držíte stisknuté po dobu, dokud pomalu nenapočítáte do pěti.
Přečtěte si prosím přiloženou Příbalovou informaci. Pro další informace kontaktujte svého lékaře.
NÁVOD K OBSLUZE PERA
Byetta 10 mikrogramů injekční roztok v předplněném peru
(exenatidum)

Část 1 CO POTŘEBUJETE ZNÁT O PERU BYETTA
Před zahájením používání pera si pečlivě přečtěte celou tuto část. Potom přejděte k Části 2 -Zahájení používání.

PŘED zahájením používání pera Byetta si pečlivě přečtěte tyto pokyny. Rovněž si přečtěte Příbalovou informaci přípravku Byetta přiloženou v balení pera Byetta.
K dosažení co největšího přínosu přípravku Byetta musíte pero správně používat. Pokud pokyny nedodržíte, můžete si například podat chybnou dávku, poškodit pero anebo může dojít k infekci.
Tyto pokyny nenahrazují prodiskutování Vašeho zdravotního stavu a léčby se zdravotnickým pracovníkem. Pokud máte při používání pera Byetta potíže, kontaktujte svého zdravotnického pracovníka.
DŮLEŽITÉ INFORMACE O PERU Byetta
• Přípravek Byetta se podává injekcí dvakrát denně, pero obsahuje dostatek přípravku pro 30denní léčbu. Dávku si nemusíte odměřovat, pero Vám odměří každou dávku.
• NEPŘENDÁVEJTE LÉK OBSAŽENÝ V PERU Byetta DO STŘÍKAČKY.
• Jestliže se Vám zdá, že jakákoli část pera je zlomená nebo poškozená, pero nepoužívejte.
• Své pero ani jehly s nikým nesdílejte, jinak se vystavujete riziku přenosu infekce.
• Toto pero není určeno nevidomým nebo osobám s poškozeným zrakem. V tomto případě je zapotřebí, aby pomohla osoba, která je se správným používáním přípravku seznámena.
• Zdravotnický personál a ošetřovatelé musí dodržovat místní zásady a pokyny pro zacházení s jehlami a pro jejich likvidaci.
• Dodržujte přesně hygienické injekční techniky doporučené Vaším zdravotnickým pracovníkem.
• Pokyny v části 2 se řiďte pouze při nastavení nového pera před prvním použitím.
• Pokyny v části 3 se musí dodržovat při každé injekci.
INJEKČNÍ JEHLY
Pro použití s Vaším perem Byetta jsou vhodné jehly společnosti Becton Dickinson and Company.
Mám pro každou injekci použít novou jehlu?
• Ano. Jehly nepoužívejte opakovaně.
• Odstraňte jehlu ihned po každé injekci. To zamezí vytékání přípravku Byetta, vniknutí vzduchových bublin, ucpání jehly a sníží riziko infekce.
• Nikdy nemačkejte injekční tlačítko, pokud není jehla připojena k peru.
Jak mám jehly vyhodit?
• Použité jehly vyhoďte do nádoby, která nejde propíchnout nebo podle doporučení lékaře.
• Pero nevyhazujte s nasazenou jehlou.
UCHOVÁVÁNÍ PERA Byetta
Jak mám pero Byetta uchovávat?
• Uchovávejte v chladničce (2° až 8°C).
• Chraňte před mrazem. Pokud přípravek Byetta zmrznul, pero znehodnoťte.
• Jakmile začnete pero Byetta používat, uchovávejte jej při teplotě do 25 °C.
• Nasaďte kryt pera, aby byl přípravek chráněn před světlem.
• Neuchovávejte pero Byetta s nasazenou jehlou. Jestliže je jehla ponechána nasazená na peru, přípravek může vytékat z pera Byetta nebo se do náplně mohou dostat vzduchové bubliny.
Pero a jehly uchovávejte mimo dohled a dosah dětí.
Jak dlouho mohu pero Byetta používat?
• Po nastavení nového pera Byetta ho používejte pouze 30 dnů.
Po uplynutí 30 dnů používané pero Byetta znehodnoťte, i když v peru ještě nějaký přípravek zbývá.
• Na níže určených místech si poznamenejte datum, kdy pero použijete poprvé a datum o 30 dní později:
Datum prvního použití Datum znehodnocení pera
Nepoužívejte přípravek Byetta po uplynutí doby použitelnosti uvedené na štítku a obalu za „EXP“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Jak mám pero Byetta čistit?
• V případě potřeby otřete vnější část pera čistým, vlhkým hadříkem.
• Během normálního užívání se na vršku náplně mohou objevit bílé částice. Můžete je odstranit hadříkem namočeným v alkoholu nebo tampónem s alkoholem.
Čtěte prosím přiloženou Příbalovou informaci přípravku Byetta. Pro další informace kontaktujte svého lékaře.
Část 2 ZAHÁJENÍ POUŽÍVÁNÍ
Přečtěte si tyto pokyny a řiďte se jimi až po přečtení Části 1 - Důležité informace o peru Byetta.
Nastavení nového pera proveďte pouze před jeho prvním použitím. Pokyny Nastavení nového pera proveďte pouze jednou. Při běžném používání pokyny Nastavení nového pera neopakujte. Jestliže opakujete nastavení nového pera před každým běžným použitím, přípravek Byetta v peru nevystačí na podávání po dobu 30 dnů.

modrý kryt pera
ČÁSTI PERA BYETTA

roztok
s přípravkem Byetta
štítek
dávkovači
okénko
náplň
dávkovači
knoflík
injekční
tlačítko
ČÁSTI JEHLY
(jehly nejsou součástí balení)


vnější kryt vnitřní jehla jehly kryt jehly
papírová
fólie
SYMBOLY V DÁVKOVACÍM
OKÉNKU
T připraveno k vytáhnutí dávkovacího knoflíku
[+j připraveno k otáčení do dávkovači polohy
(m) připraveno k podání dávky 10 mikrogramú (pg)
A dávkovači tlačítko je zamáčknuto a připraveno k nastavení dávky
NASTAVENÍ NOVÉHO PERA - PROVEĎTE POUZE JEDNOU
KROK A Kontrola pera

• Před použitím si umyjte ruce.
• Zkontrolujte štítek a přesvědčte se, že používáte správné pero 10 mikrogramů.
• Sundejte modrý kryt pera.

Zkontrolujte náplň přípravku Byetta. Tekutina má být čirá bezbarvá a bez viditelných částic. V opačném případě pero nepoužívejte.
Poznámka: Malá vzduchová bublinka v náplni je normální.
KROK B Nasazení jehly

• Z vněj šího krytu j ehly odstraňte papírovou fólii.
• Vnější kryt obsahující jehlu nasaďte přímo na konec pera a potom jehlu našroubujte až do utažení.
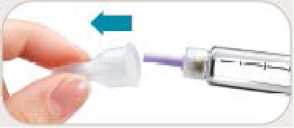
• Odstraňte vněj ší kryt j ehly. Nevyhazujte j ej. Vněj ší kryt j ehly použij ete při odšroubovávání jehly z pera po aplikaci injekce.
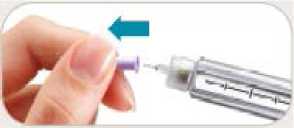
• Odstraňte vnitřní kryt jehly a vyhoďte jej. Může se objevit malá kapka tekutiny. To je normální. KROK C Nastavení dávky

0.
Zkontrolujte, že v dávkovacím okénku je symbol LJ . V opačném případě otáčejte dávkovacím knoflíkem po směru hodinových ručiček, dokud se nezastaví a v dávkovacím okénku se neobjeví symbol 0

• Vytáhněte dávkovači knoflík, dokud se nezastaví a v dávkovacím okénku se neobjeví symbol


• Otáčejte dávkovacím knoflíkem po směru hodinových ručiček, dokud se nezastaví a
v dávkovacím okénku se neobjeví symbol ® Ujistěte se, že se symbol 10 společně se spodním podtržítkem nachází ve středu dávkovacího okénka.

Poznámka: Pokud nejde otočit dávkovacím knoflíkem po směru hodinových ručiček na symbol řiďte se instrukcemi v Části 4 tohoto návodu, Často kladené otázky, č. 9.

• Držte pero jehlou vzhůru směrem od sebe.
ZMÁČKNOUT & DRŽET
• Palcem pevně stiskněte injekční tlačítko, dokud se nezastaví. Držte dále injekční tlačítko, dokud pomalu nenapočítáte do pěti.
• Pokud nevidíte vytékat ze špičky jehly proud nebo několik kapek tekutiny, opakujte kroky C a D.


a vidíte ze
Příprava pera je kompletní, když se ve středu dávkovacího okénka objeví symbol špičky jehly vytékat proud nebo kapky tekutiny.
Poznámka: Jestliže ani po 4 opakováních nevidíte vytékat tekutinu, řiďte se pokyny v Části 4 tohoto návodu, Často kladené otázky, č. 3.
KROK E Dokončení nastavení nového pera
Otáčejte dávkovacím knoflíkem po směru hodinových ručiček, dokud se nezastaví a
0.
v dávkovacím okénku se neobjeví symbol
Nastavení nového pera je nyní dokončeno. Při běžném používání neopakujte nastavení pera jako poprvé, jak je uvedeno v krocích v Části 2, jinak Vám přípravek Byetta v peru nevystačí po celou dobu 30 dnů léčby.
Nyní jste připraven(a) k aplikaci první dávky přípravku Byetta.
Pro pokyny, jak aplikovat dávku při běžném používání, přejděte k Části 3.
Poznámka: Pokud nejde otočit dávkovacím knoflíkem, řiďte se instrukcemi v Části 4 tohoto návodu, Často kladené otázky, č. 9.
Část 3 BĚŽNÉ POUŽÍVÁNÍ
Po nastavení nového pera nyní při každé aplikaci dodržujte pokyny v Části 3. KROK 1 Kontrola pera

• Před použitím si umyjte ruce.
• Zkontrolujte štítek a přesvědčte se, že používáte správné pero 10 mikrogramů.
• Sundejte modrý kryt pera.

• Zkontrolujte náplň přípravku Byetta.
• Tekutina by měla být čirá bezbarvá a bez viditelných částic. V opačném případě pero nepoužívejte.
Poznámka: Malá vzduchová bublinka v náplni je normální.
KROK 2 Nasazení jehly

• Z vněj šího krytu j ehly odstraňte papírovou fólii.
• Vnější kryt obsahující jehlu nasaďte přímo na konec pera a potom jehlu našroubujte až do utažení.
• Odstraňte vněj ší kryt j ehly. Nevyhazujte j ej. Vněj ší kryt j ehly použij ete při odšroubovávání jehly z pera po aplikaci injekce.
• Odstraňte vnitřní kryt jehly a vyhoďte jej. Může se objevit malá kapka tekutiny. To je normální.

0
Zkontrolujte, že v dávkovacím okénku je symbol LJ . V opačném případě otáčejte dávkovacím knoflíkem po směru hodinových ručiček, dokud se nezastaví a v dávkovacím okénku se neobjeví symbol 0

• Vytáhněte dávkovači knoflík, dokud se nezastaví a v dávkovacím okénku se neobjeví symbol


• Otáčejte dávkovacím knoflíkem po směru hodinových ručiček, dokud se nezastaví a
v dávkovacím okénku se neobjeví symbol ® Ujistěte se, že se symbol 10 společně se spodním podtržítkem nachází ve středu dávkovacího okénka.

Poznámka: Pokud nejde otočit dávkovacím knoflíkem po směru hodinových ručiček na symbol řiďte se instrukcemi v Části 4 tohoto návodu, Často kladené otázky, č. 9.
KROK 4 Podání dávky
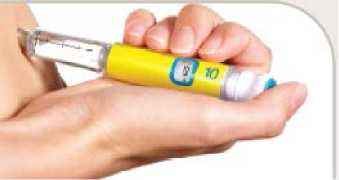
• Uchopte pero pevně do ruky.
• Před vpichem injekce netiskněte kůži příliš pevně. Vbodněte jehlu pod kůži podle hygienického postupu doporučeného Vaším zdravotnickým pracovníkem.
sekund
ZMÁČKNOUT & DRŽET
• Palcem silně stiskněte injekční tlačítko, dokud se nezastaví. Abyste si podal(a) celou dávku, držte dále injekční tlačítko, dokud pomalu nenapočítáte do pěti.
• Držte injekční tlačítko zmáčknuté, dokud si nevytáhnete jehlu z kůže. Viz Často kladené otázky, č. 4.


Aplikace je kompletní, pokud je ve středu dávkovacího tlačítka vidět symbol Pero je nyní připraveno k nastavení do původní polohy.
Poznámka: Pokud vidíte po podání vytékat z jehly přípravek Byetta, injekční tlačítko nebylo stisknuto úplně. Řiďte se instrukcemi v Části 4 tohoto návodu, Často kladené otázky, č. 5.
KROK 5 Nastavení pera do původní polohy

symbol
0
Poznámka: Pokud nemůžete otáčet dávkovacím knoflíkem, nebo z pera vytéká tekutina, nepodal(a) jste si celou dávku. Řiďte se instrukcemi v Části 4 tohoto návodu, Často kladené otázky, č. 5 a 9.
KROK 6 Odstranění a znehodnocení jehly
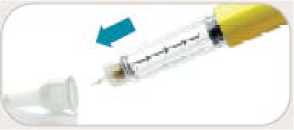
• Jehlu odstraňte po každé injekci.
• Opatrně nasaďte na jehlu vnější kryt.

• Odšroubujte jehlu.
• Vraťte zpět na pero modrý kryt.

• Jehlu vyhoďte do nádoby, která nejde propíchnout, nebo podle doporučení lékaře.
KROK 7 Uchovávání pera před podáním další dávky
• Pero Byetta řádně uchovávejte (pro více informací viz Uchovávání pera Byetta v Části 1 tohoto návodu).
• V čase další běžné dávky přejděte k Části 3, Krok 1 a opakujte kroky 1-7.
Část 4 ČASTO KLADENÉ OTÁZKY
1. Musím provést krok Nastavení nového pera před aplikací každé dávky?
• Ne. Nastavení nového pera se provede pouze jednou před nastavením nového pera před prvním použitím.
• Důvodem je, aby pero Byetta bylo připraveno pro používání po dobu 30 dnů.
• Jestliže opakujete nastavení nového pera před každým běžným použitím, přípravek Byetta v peru nevystačí na podávání po dobu 30 dnů. Malé množství přípravku použité při nastavení nového pera neovlivní množství přípravku Byetta potřebného pro 30denní léčbu.
2. Proč jsou v náplni vzduchové bubliny?
• Malá vzduchová bublinka je normální, neublíží Vám a neovlivní dávku.
• Jestliže je pero uchováváno s nasazenou jehlou, v náplni se mohou tvořit vzduchové bubliny. Neuchovávejte pero s nasazenou jehlou.
3. Co bych měl(a) udělat, jestliže v průběhu Nastavení nového pera nevychází ze špičky jehly přípravek Byetta ani po čtyřech pokusech?
• Opatrně nasaďte vnější kryt jehly a jehlu odstraňte. Jehlu odšroubujte a znehodnoťte podle pokynů.
• Nasaďte novou jehlu a opakujte kroky B - E, Nastavení nového pera v části 2 tohoto návodu. Jakmile uvidíte vytékat proud nebo kapky tekutiny ze špičky jehly, nastavení je kompletní.
4. Proč jsou po dokončení injekce v náplni viditelné pevné částečky?
Pevné částečky nebo změna barvy se mohou po dokončení injekce v náplni objevit. Může se to stát, je-li kůže příliš pevně stisknuta, nebo je zmáčknuté injekční tlačítko uvolněno předtím, než je jehla vytažena z kůže.
5. Proč vidím přípravek Byetta vytékat z jehly, když jsem ukončil(a) podání dávky?
Po dokončení injekce může na jehle zůstat jedna kapka přípravku. To je normální.
Pokud uvidíte více než jednu kapku:
• Nepodal(a) jste si celou dávku. Další dávku si neaplikujte. Podání neúplné dávky konzultujte se svým lékařem.
• Při příští dávce se tomu vyhnete tak, že před vytažením jehly z kůže stisknete injekční tlačítko a držíte jej, dokud pomalu nenapočítáte do pěti (viz část 3, krok 4: Podání dávky).
máte vytáhnout nebo otočit dávkovací knoflík v dalším kroku. Tento symbol dávkovací knoflík je zamáčknut a pero je připraveno k nastavení.
ukazují směr, kterým
znamená, že
7. Jak mohu rozeznat, kdy je injekce dokončena?
Injekce je dokončena, když:
• palcem pevně stisknete injekční tlačítko, dokud se nezastaví. a
• před vytažením jehly z kůže injekční tlačítko stále držíte, dokud pomalu nenapočítáte do pěti.
ve středu dávkovacího okénka se objeví symbol

8. Kam bych měl(a) přípravek Byetta aplikovat?
Přípravek Byetta má být podán v injekci pod kůži do oblasti břicha, stehna nebo horní části paže za použití injekční techniky doporučené Vaším lékařem.
Pohled zepředu Pohled zezadu


9. Co bych měl(a) udělat, jestliže nemohu vytáhnout, nastavit nebo stisknout dávkovací knoflík?
Zkontrolujte symbol v dávkovacím okénku. Pokračujte pokyny odpovídajícími danému symbolu.

• Vytáhněte dávkovací knoflík, dokud se neobjeví symbol

Pokud je v dávkovacím okénku symbol L+J a dávkovacím knoflíkem nelze otáčet:
• V náplni Vašeho pera Byetta může být nedostatek přípravku pro podání celé dávky. Malé
množství přípravku Byetta v náplni vždy zůstane. Jestliže náplň obsahuje malé množství nebo se zdá prázdná, opatřete si nové pero Byetta.
0
HI
Jestliže se v dávkovacím okénku objeví symbol 0-> a pouze část symbolu «=) a dávkovací knoflík nelze stisknout:
• Dávkovací knoflík nebyl nastaven úplně. Pokračujte v nastavení, dokud se v dávkovacím okénku neobjeví symbol © zřetelně.
Jestliže se v dávkovacím okénku objeví neúplný symbol QS) a neúplný symbol O a dávkovací knoflík nelze stisknout:
• Jehla může být ucpaná, ohnutá nebo nesprávně nasazená.
• Nasaďte novou jehlu. Ujistěte se, že je jehla nasazena přímo a našroubována do utažení.
• Pevně stiskněte injekční tlačítko. Přípravek Byetta by měl vytékat ze špičky jehly.
0
Jestliže se v dávkovacím okénku objeví symbol LU a dávkovacím knoflíkem nelze otáčet:
• Injekční tlačítko nebylo stlačeno úplně a nebyla podána celá dávka. Podání neúplné dávky konzultujte se svým lékařem.
• Pro nastavení pera pro příští injekci dodržujte tyto pokyny:
- Silně stiskněte injekční tlačítko, dokud se nezastaví. Držte stále injekční tlačítko stisknuté a pomalu počítejte do 5. Otáčejte potom dávkovacím knoflíkem, dokud se dávkovacím okénku
0
neobjeví symbol
- Pokud nelze otáčet dávkovacím knoflíkem, jehla může být ucpaná. Vyměňte jehlu a výše uvedené kroky opakujte.
Ujistěte se při příští aplikaci, že injekční tlačítko pevně stisknete a před vytažením jehly z kůže jej stále držíte stisknuté po dobu, dokud pomalu nenapočítáte do pěti.
Přečtěte si prosím přiloženou Příbalovou informaci. Pro další informace kontaktujte svého lékaře.
58