Buccolam 7,5 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
BUCCOLAM 2,5 mg orální roztok BUCCOLAM 5 mg orální roztok BUCCOLAM 7,5 mg orální roztok BUCCOLAM 10 mg orální roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
BUCCOLAM 2,5 mg orální roztok
Jedna předplněná stříkačka pro perorální podání obsahuje midazolamum 2,5 mg (jako midazolami hydrochloridum) v 0,5 ml roztoku
BUCCOLAM 5 mg orální roztok
Jedna předplněná stříkačka pro perorální podání obsahuje midazolamum 5 mg (jako midazolami hydrochloridum) v 1 ml roztoku
BUCCOLAM 7,5 mg orální roztok
Jedna předplněná stříkačka pro perorální podání obsahuje midazolamum 7,5 mg (jako midazolami hydrochloridum) v 1,5 ml roztoku
BUCCOLAM 10 mg orální roztok
Jedna předplněná stříkačka pro perorální podání obsahuje midazolamum 10 mg (jako midazolami hydrochloridum) ve 2 ml roztoku
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Orální roztok Čirý bezbarvý roztok pH 2,9 až 3,7
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Léčba dlouhotrvajících, akutních, konvulzivních záchvatů u kojenců, batolat, dětí a dospívajících (od 3 měsíců do <18 let).
Přípravek BUCCOLAM smí rodiče/pečovatelé používat pouze, pokud byla u pacienta diagnostikována epilepsie.
U kojenců mezi 3-6 měsíci věku má léčba probíhat v nemocničním prostředí, kde je možný monitoring a je dostupné resuscitační vybavení. Viz bod 4.2.
4.2 Dávkování a způsob podání
Dávkování
Standardní dávky jsou uvedeny níže:
|
Věkové rozpětí |
Dávka |
Barva štítku |
|
3 až 6 měsíců hospitalizace |
2,5 mg |
Žlutá |
|
> 6 měsíců až < 1 rok |
2,5 mg |
Žlutá |
|
1 rok až < 5 let |
5 mg |
Modrá |
|
5 let až < 10 let |
7,5 mg |
Nachová |
|
10 let až < 18 let |
10 mg |
Oranžová |
Pečovatelé smí podat pouze jednu dávku midazolamu. Pokud záchvat neskončí do 10 minut po podání midazolamu, je nutné vyhledat okamžitou lékařskou pomoc a zdravotníkovi předat prázdnou injekční stříkačku, podle níž získá informace o dávce, kterou pacient dostal.
Pokud se záchvaty znovu objeví po počáteční odpovědi, nelze druhou nebo opakovanou dávku podat bez konzultace s lékařem (viz bod 5.2).
Zvláštní populace
Porucha funkce ledvin
Není třeba přizpůsobovat dávku, přípravek BUCCOLAM je však nutno používat s opatrností u pacientů s chronickým renálním selháním, protože eliminace midazolamu může být opožděná a účinky prodloužené (viz bod 4.4).
Porucha funkce jater
Porucha funkce jater snižuje clearance midazolamu s následným prodloužením terminálního poločasu. Z tohoto důvodu mohou být klinické účinky silnější a prodloužené, a proto se po podání midazolamu pacientům s poruchou funkce jater doporučuje pozorné sledování klinických účinků a životních funkcí (viz bod 4.4).
Přípravek BUCCOLAM je kontraindikován u pacientů s těžkou poruchou funkce jater (viz bod 4.3). Pediatrická populace
Bezpečnost a účinnost midazolamu u dětí ve věku od 0 do 3 měsíců nebyla stanovena. Nejsou dostupné žádné údaje.
Způsob podání
BUCCOLAM je určen k orálnímu podání. Celý objem roztoku je nutné pomalu aplikovat do prostoru mezi dásní a tváří. Laryngotracheální aplikaci je nutné zamezit, aby se předešlo náhodné aspiraci roztoku. V případě nutnosti (u větších objemů a/nebo menších pacientů) je nutné přibližně polovinu dávky pomalu podat na jednu stranu úst, a poté druhou polovinu pomalu podat na druhou stranu.
Podrobný návod k podávání tohoto léčivého přípravku je uveden v bodě 6.6.
Opatření, která je nutno učinit před zacházením s léčivým přípravkem nebo před jeho podáním
Ke stříkačce pro perorální podání se nesmí připojovat jehly, intravenózní kanyly ani žádná jiná zařízení pro parenterální aplikaci.
Přípravek BUCCOLAM není určen k intravenóznímu podání.
Uzávěr stříkačky pro perorální podání je nutno před použitím odstranit, aby se zamezilo riziku dušení.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku, benzodiazepiny nebo na kteroukoli pomocnou látku uvedenou
v bodě 6.1
Myasthenia gravis
Těžká respirační insuficience
Syndrom spánkové apnoe
Těžká porucha funkce jater
4.4 Zvláštní upozornění a opatření pro použití
Respirační isuficience
Midazolam je nutné používat s opatrností u pacientů s chronickou respirační insuficiencí, neboť midazolam může dýchání dále potlačovat.
Pediatričtí pacienti ve věku od 3 do 6 měsíců
Vzhledem k vyššímu poměru metabolitu k původní látce u mladších dětí nelze vyloučit opožděnou respirační depresi jako důsledek vysokých koncentrací aktivního metabolitu ve věkové skupině 3-6 měsíců. Proto je nutné omezit používání přípravku BUCCOLAM ve věkové skupině 3-6 měsíců pouze na použití pod dohledem zdravotnického pracovníka tam, kde je dostupné resuscitační vybavení, kde lze monitorovat respirační funkci a kde je dostupné vybavení pro asistovanou ventilaci, pokud je to potřeba.
Změny v eliminaci midazolamu
Midazolam je nutné používat s opatrností u pacientů s chronickým selháním ledvin, poruchou funkce jater nebo srdce. Midazolam se může akumulovat u pacientů s chronickým selháním ledvin nebo poruchou funkce jater, zatímco zhoršená srdeční funkce může způsobit sníženou clearance midazolamu.
Souběžné používání s dalšími benzodiazepiny
Oslabení pacienti jsou náchylnější k účinkům benzodiazepinů na centrální nervový systém (CNS), a proto mohou být potřeba nižší dávky.
Nadměrná konzumace alkoholu a užívání drog v anamnéze
Midazolamu je třeba se vyvarovat u pacientů, v jejichž anamnéze se objevuje užívání drog nebo nadměrná konzumace alkoholu.
Amnesie
Midazolam může způsobovat anterográdní amnesii.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Midazolam je metabolizován prostřednictvím CYP3A4. Inhibitory a induktory CYP3A4 mají potenciál zvyšovat, respektive snižovat plazmatické koncentrace, a tedy i účinky midazolamu, a proto jsou nutné příslušné úpravy dávky. Farmakokinetické interakce s inhibitory nebo induktory CYP3A4 jsou výraznější u perorálně podávaného midazolamu oproti orálně nebo parenterálně podávanému midazolamu, protože enzymy CYP3A4 jsou přítomné také v horní části gastrointestinálního traktu. Po orálním podání bude ovlivněna pouze systémová clearance. Po orálním podání jedné dávky midazolamu bude dopad na maximální klinický účinek v důsledku inhibice CYP3A4 malý, zatímco doba trvání účinku může být prodloužená. Proto se v průběhu používání midazolamu s inhibitory CYP3A4, i po jednotlivé dávce, doporučuje pečlivé sledování klinických účinků a životních funkcí.
Anestetika a narkotická analgetika
Fentanyl může snižovat clearance midazolamu.
Antiepileptika
Souběžné podávání s midazolamem může způsobit zvýšenou sedaci nebo respirační či kardiovaskulární depresi. Midazolam může reagovat s jinými léčivými přípravky metabolizovanými játry, např. fenytoinem, což může způsobovat zesílení jeho účinku.
Blokátory kalciových kanálů
Bylo prokázáno, že diltiazem a verapamil snižují clearance midazolamu a jiných benzodiazepinů a mohou zesilovat jejich účinky.
Léčivé přípravky k hojení vředů
Bylo prokázáno, že cimetidin, ranitidin a omeprazol snižují clearance midazolamu a jiných benzodiazepinů a mohou zesilovat jejich účinky.
Xantiny
Xantiny urychlují metabolismus midazolamu a jiných benzodiazepinů.
Dopaminergní léčivé přípravky
Midazolam může způsobovat inhibici levodopy.
Svalová relaxancia
Např. baclofen. Midazolam může způsobovat zesílení účinku svalových relaxancií a zároveň zvýšení depresivních účinků na CNS.
Nabilon
Souběžné podání s midazolamem může způsobit zvýšenou sedaci nebo respirační a kardiovaskulární depresi.
Léčivé přípravky, které inhibují CYP3A4
Lékové interakce po orálním podání midazolamu budou pravděpodobně podobné interakcím pozorovaným po intravenózním podání midazolamu, spíše než po jeho perorálním podání.
Jídlo
Grapefruitová šťáva snižuje clearance midazolamu a zesiluje jeho účinek.
Azolová antimykotika
Ketokonazol zvýšil plazmatické koncentrace intravenózně podaného midazolamu pětinásobně, zatímco terminální poločas vzrostl přibližně trojnásobně.
Vorikonazol zvýšil expozici intravenózně podaného midazolamu trojnásobně, zatímco jeho poločas eliminace vzrostl přibližně trojnásobně.
Flukonazol i itrakonazol zvýšily plazmatické koncentrace intravenózně podaného midazolamu dvoj-až trojnásobně; došlo také k prodloužení terminálního poločasu 2,4násobně u itrakonazolu a 1,5násobně u flukonazolu.
Posakonazol zvýšil plazmatické koncentrace intravenózně podaného midazolamu přibližně dvojnásobně.
Makrolidová antibiotika
Erythromycin měl za následek zvýšení plazmatických koncentrací intravenózně podaného midazolamu přibližně 1,6- až dvojnásobně; došlo také k 1,5- až 1,8násobnému prodloužení terminálního poločasu midazolamu.
Klarithromycin zvýšil plazmatické koncentrace intravenózně podaného midazolamu až 2,5násobně, přičemž došlo i k 1,5- až dvojnásobnému prodloužení terminálního poločasu.
Inhibitory HIV proteázy
Souběžné podávání s inhibitory proteázy (např. sachinavirem a jinými inhibitory HIV proteázy) může způsobovat velké zvýšení koncentrace midazolamu. Po souběžném podávání s lopinavirem potencovaným ritonavirem došlo ke zvýšení plazmatických koncentrací intravenózně podaného midazolamu 5,4násobně, přičemž došlo i k podobnému prodloužení terminálního poločasu.
Blokátory kalciových kanálů
Jedna dávka diltiazemu zvýšila plazmatické koncentrace intravenózně podaného midazolamu přibližně o 25 % a terminální poločas se prodloužil o 43 %.
Různé léčivé přípravky
Atorvastatin vykázal 1,4násobné zvýšení plazmatických koncentrací intravenózně podaného midazolamu ve srovnání s kontrolní skupinou.
Léčivé přípravky, které indukují CYP3A4
Rifampicin
Dávka 600 mg jednou denně po 7 dní snížila plazmatické koncentrace intravenózně podaného midazolamu přibližně o 60 %. Terminální poločas poklesl přibližně o 50-60 %.
Byliny
Třezalka tečkovaná snížila plazmatické koncentrace midazolamu přibližně o 20-40 %, což bylo spojeno s poklesem terminálního poločasu přibližně o 15-17 %. V závislosti na specifitě extraktu z třezalky tečkované se může účinek na indukci CYP3A4 měnit.
Farmakodynamické lékové interakce (Drug-Drug Interactions, DDI)
Souběžné podávání midazolamu s jinými sedativními/hypnotickými léčivými přípravky a látkami tlumícími CNS, včetně alkoholu, bude mít s velkou pravděpodobností za následek zvýšenou sedaci a respirační depresi.
Příklady těchto látek zahrnují deriváty opia (používané jako analgetika, antitusika nebo substituční léčba), antipsychotika, jiné benzodiazepiny používané jako anxiolytika nebo hypnotika, barbituráty, propofol, ketamin, etomidát; sedativní antidepresiva, starší H1 antihistaminika a centrálně účinkující antihypertenziva.
Alkohol (včetně léčivých přípravků obsahujících alkohol) může výrazně zvýšit sedativní účinek midazolamu. Příjem alkoholu je nutné v případě podávání midazolamu naprosto vyloučit (viz bod 4.4).
Midazolam snižuje minimální alveolární koncentraci (MAC) inhalačních anestetik.
Účinek inhibitorů CYP3A4 může být větší u kojenců, protože může dojí k spolknutí části orální dávky a absorpci v gastrointestinálním traktu.
4.6 Fertilita, těhotenství a kojení
Údaje o podávání midazolamu těhotným ženám jsou omezené nebo nejsou k dispozici.. Studie reprodukční toxicity na zvířatech nenaznačují teratogenní účinek, ale stejně jako u jiných benzodiazepinů byla u lidí pozorována fetotoxicita. Pro první dva trimestry těhotenství nejsou k dispozici žádné údaje o exponovaných těhotenstvích.
Bylo hlášeno, že podávání vysokých dávek midazolamu v posledním trimestru těhotenství nebo během porodu má za následek vznik nežádoucích účinků u matky či plodu (riziko aspirace tekutin a obsahu žaludku v průběhu porodu u matky, nepravidelnosti v srdečním rytmu plodu, hypotonie, nedostatečné sání, hypotermie a respirační deprese u novorozence).
Pokud je to nezbytně nutné, může se midazolam během těhotenství použít. V případě podávání midazolamu ve třetím trimestru těhotenství je nutné brát v úvahu riziko pro novorozence.
Kojení
Midazolam se vylučuje do lidského mateřského mléka v malých množstvích (0,6 %). Proto nemusí být nutné po podání jedné dávky midazolamu ukončovat kojení.
Fertilita
Ve studiích na zvířatech nebylo prokázáno zhoršení fertility (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Midazolam má výrazný vliv na schopnost řídit nebo obsluhovat stroje.
Sedace, amnesie, zhoršená pozornost a zhoršená svalová funkce mohou nežádoucím způsobem ovlivnit schopnost řídit, jezdit na kole nebo obsluhovat stroje. Po podání midazolamu je nutné pacienta upozornit, aby neřídil dopravní prostředek ani neobsluhoval stroj, dokud se zcela nezotaví.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Publikované klinické studie ukazují, že midazolam byl orálně podán přibližně 443 dětem se záchvaty. Respirační deprese se objevuje s výskytem až do 5 %, ačkoli to je známá komplikace konvulzivních záchvatů, stejně jako je známé spojení s použitím midazolamu. Jedna epizoda pruritu byla posouzena jako pravděpodobně související s bukálním podáním midazolamu.
Seznam nežádoucích účinků v tabulce
V níže uvedené tabulce jsou uvedeny nežádoucí účinky, jejichž výskyt byl hlášen v klinických studiích při orálním podávání midazolamu dětem.
Frekvence nežádoucích účinků je klasifikována následovně:
Časté: > 1/100 až < 1/10
Méně časté: > 1/1000 až < 1/100 Velmi vzácné: < 1/10000
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti:
|
Třídy orgánových systémů |
Frekvence: Nežádoucí účinek léčivého přípravku |
|
Psychiatrické poruchy |
Velmi vzácné: Agresivita , agitovanost , zlost , stavy zmatenosti , euforická nálada , halucinace , nepřátelské chování , poruchy pohybu , fyzický útok |
|
Poruchy nervového systému |
Časté: Sedace, somnolence, snížené hladiny vědomí Respirační deprese Velmi vzácné: Anterográdní amnesie , ataxie , závrať , bolest hlavy , ** ** záchvat , paradoxní reakce |
|
Srdeční poruchy |
Velmi vzácné: Bradykardie , srdeční zástava , hypotenze , vazodilatace |
|
Respirační, hrudní a mediastinální poruchy |
Velmi vzácné: Apnoe , dyspnoe , laryngospasmus , zástava dýchání |
|
Gastrointestinální poruchy |
Časté: Nauzea a zvracení Velmi vzácné: Zácpa , sucho v ústech |
|
Poruchy kůže a podkožní tkáně |
Méně časté: Pruritus, vyrážka a kopřivka |
|
Celkové poruchy a reakce v místě aplikace |
Velmi vzácné: únava**, škytavka |
**Tyto nežádoucí účinky byly zaznamenány u injekčně aplikovaného midazolamu u dětí a/nebo dospělých a mohou být relevantní při orálním podání.
Popis vybraných nežádoucích účinků
Zvýšené riziko pádů a zlomenin bylo zaznamenáno u starších pacientů užívajících benzodiazepiny.
Život ohrožující příhody se s větší pravděpodobností objeví u pacientů s preexistující respirační insuficiencí nebo zhoršenou funkcí srdce, zejména pokud se podá vysoká dávka (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Příznaky
Předávkování midazolamem může představovat ohrožení života, pokud má pacient preexistující respirační nebo srdeční nedostatečnost nebo pokud se midazolam kombinuje s jinými látkami tlumícími CNS (včetně alkoholu).
Předávkování benzodiazepiny se většinou manifestuje určitým stupněm deprese centrálního nervového systému v rozmezí od ospalosti do kómatu. V mírných případech zahrnují symptomy ospalost, mentální zmatenost a letargii, ve vážnějších případech mohou symptomy zahrnovat ataxii, hypotonii, hypotenzi, respirační depresi, vzácně kóma a velmi vzácně úmrtí.
Léčba
Při léčbě předávkování jakýmkoli léčivým přípravkem je třeba mít na paměti, že mohlo dojít k užití více látek.
Po předávkování perorálním midazolamem je nutné vyvolat zvracení (do jedné hodiny), pokud je pacient při vědomí, nebo provést výplach žaludku, při kterém je nutné chránit dýchací cesty, pokud je pacient v bezvědomí. Jestliže vyprázdnění žaludku není výhodné, je nutné podat živočišné uhlí, aby se snížila absorpce. Při intenzivní péči je nutné věnovat zvláštní pozornost respiračním a kardiovaskulárním funkcím.
Jako antidotum lze použít flumanezil.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Psycholeptika, benzodiazepinové deriváty ATC kód: N05CD08. Mechanismus účinku
Midazolam je derivát ze skupiny imidazobenzodiazepinů. Jeho volná báze je lipofilní látka s nízkou rozpustností ve vodě. Bazický dusík v poloze 2 systému imidazobenzodiazepinového kruhu umožňuje midazolamu vytvářet hydrochloridovou sůl s kyselinami. Takto vzniká stabilní roztok vhodný k orálnímu podání.
Farmakodynamické účinky
Farmakologický účinek midazolamu je charakterizován krátkým trváním z důvodu rychlé metabolické transformace. Midazolam má antikonvulzivní účinek. Vyznačuje se také sedativním a spánek navozujícím účinkem výrazné intenzity a také anxiolytickým a myorelaxačním účinkem.
Klinická účinnost a bezpečnost
Ve čtyřech studiích kontrolovaných rektálně podávaným diazepamem a jedné studii s intravenózně podávaným diazepamem u celkového počtu 688 dětí bylo vymizení viditelných známek záchvatů do 10 minut pozorováno u 65 % až 78 % dětí, kterým byl orálně podáván midazolam. Ve dvou z těchto studií pak bylo vymizení viditelných známek záchvatů do 10 minut bez opětovného návratu do 1 hodiny po podání pozorováno u 56 % až 70 % dětí. Frekvence a závažnost nežádoucích účinků hlášených u orálně podávaného midazolamu v průběhu publikovaných klinických studií byla podobná nežádoucím účinkům hlášeným ve srovnávací skupině používající rektálně podávaný diazepam.
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem BUCCOLAM u podskupiny pediatrické populace < 3 měsíce věku na základě toho, že tento specifický léčivý přípravek nepředstavuje pro tyto pediatrické pacienty významný terapeutický prospěch oproti existujícím způsobům léčby.
5.2 Farmakokinetické vlastnosti
Simulované farmakokinetické parametry pro doporučené dávkování u dětí ve věku od 3 měsíců do méně než 18 let založené na studii populační farmakokinetiky jsou uvedeny v tabulce níže:
|
Dávka |
Věk |
Parametr |
Průměr |
Směrodatná odchylka |
|
2,5 mg |
3 m < 1 rok |
AUC0-inf (ng.h/ml) |
168 |
98 |
|
Cmax (ng/ml) |
104 |
46 | ||
|
5 mg |
1 rok < 5 let |
AUC0-inf (ng.h/ml) |
242 |
116 |
|
Cmax (ng/ml) |
148 |
62 | ||
|
7,5 mg |
5 let < 10 let |
AUC0-inf (ng.h/ml) |
254 |
136 |
|
Cmax (ng/ml) |
140 |
60 | ||
|
10 mg |
10 let < 18 let |
AUC0-inf (ng.h/ml) |
189 |
96 |
|
Cmax (ng/ml) |
87 |
44 |
Absorpce
Midazolam se po orálním podání rychle vstřebává. Maximální plazmatické koncentrace se u dětí dosahuje do 30 minut. Absolutní biologická dostupnost orálně podávaného midazolamu činí u dospělých přibližně 75 %. Biologická dostupnost orálního midazolamu byla u dětí s těžkou malárií a křečmi odhadnuta na 87 %.
Distribuce
Midazolam je vysoce lipofilní a je široce distribuován. Distribuční objem v rovnovážném stavu po orálním podání se odhaduje na 5,3 l/kg.
Přibližně 96-98 % midazolamu se váže na plazmatické bílkoviny. Hlavní podíl na vazbě na plazmatické bílkoviny má albumin. Midazolam pomalu a nevýznamně proniká do mozkomíšního moku. U lidí bylo prokázáno, že midazolam pomalu prostupuje placentou a vstupuje do fetálního krevního oběhu. Malá množství midazolamu se nachází v mateřském mléce.
Biotransformace
Midazolam se téměř úplně eliminuje biotransformací. Podíl dávky vylučovaný játry se odhaduje na 30-60 %. Midazolam je hydroxylován izoenzymem cytochromu P450 3A4 a hlavním metabolitem v moči i v plazmě je alfa-hydroxymidazolam. Po orálním podání u dětí činí poměr plochy pod křivkou alfa-hydroxymidazolamu k midazolamu 0,46.
Ve studii populační farmakokinetiky bylo prokázáno, že hladiny metabolitu jsou vyšší u mladších než u starších pediatrických pacientů, a tak je pravděpodobné, že budou důležitější u dětí než u dospělých.
Eliminace
Plazmatická clearance midazolamu u dětí po orálním podání činí 30 ml/kg/min. Počáteční a terminální poločasy eliminace jsou 27, respektive 204 minut. Midazolam se vylučuje především ledvinami (6080 % injekčně aplikované dávky) jako alfa-hydroxymidazolam konjugovaný s kyselinou glukuronovou. Méně než 1 % dávky léčivého přípravku se objeví v moči v nezměněné podobě.
Farmakokinetika u zvláštních populací
Obezita
Průměrný poločas je vyšší u obézních než u neobézních pacientů (5,9 oproti 2,3 hodinám). Je to způsobeno nárůstem distribučního objemu upraveného podle celkové tělesné hmotnosti přibližně o 50 %. Clearance se u obézních a neobézních pacientů významně neliší.
Porucha funkce jater
Poločas eliminace u pacientů s jaterní cirhózou může být delší a clearance nižší než u zdravých dobrovolníků (viz bod 4.4).
Porucha funkce ledvin
Poločas eliminace u pacientů s chronickým selháním ledvin je podobný poločasu elimince u zdravých dobrovolníků.
Poločas eliminace midazolamu je u kriticky nemocných pacientů až šestkrát delší.
Srdeční insuficience
Poločas eliminace je u pacientů s městnavým srdečním selháním delší než u zdravých pacientů (viz bod 4.4).
Expozice po druhé dávce během stejné epizody záchvatu
Simulované údaje o expozici ukazují, že celková plocha pod křivkou se při podání druhé dávky po 10, 30 a 60 minutách po první dávce přibližně zdvojnásobila. Druhá dávka po 10 minutách má za následek významný nárůst průměrné hodnoty Cmax, a to přibližně 1,7 až 1,9krát. Po 30 a 60 minutách již došlo k výrazné eliminaci midazolamu, a proto není nárůst průměrné hodnoty Cmax tak výrazný: 1,3 až 1,6krát, resp. 1,2 až 1,5krát (viz bod 4.2).
5.3 Předklinické údaje vztahující se k bezpečnosti
Ve studii fertility na potkanech nebyly pozorovány žádné nežádoucí účinky na fertilitu při dávkování zvířatům až desetinásobně vyšším, než je klinická dávka.
Pro předepisujícího lékaře nejsou k dispozici žádné další relevantní předklinické údaje, které by již nebyly zmíněny v jiných bodech tohoto souhrnu údajů o přípravku.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Chlorid sodný Voda na injekci
Kyselina chlorovodíková (k úpravě pH a konverzi midazolamu na hydrochloridovou sůl)
Hydroxid sodný (k úpravě pH)
6.2 Inkompatibility
Neuplatňuje se
6.3 Doba použitelnosti
18 měsíců
6.4 Zvláštní opatření pro uchovávání
Uchovávejte stříkačku pro perorální podání v ochranné plastové tubě.
Chraňte před chladem nebo mrazem.
6.5 Druh obalu a obsah balení
Předplněná stříkačka pro perorální podání (polypropylen) jantarově hnědé barvy bez jehly, s pístem (polypropylen) a uzávěrem (polyetylen s vysokou hustotou), zabalená v ochranné plastové tubě s uzávěrem.
|
Síla |
Objem roztoku |
Objem injekční stříkačky |
Věkové rozpětí |
Barva štítku |
|
2,5 mg |
0,5 ml |
1 ml |
3 měsíce až <1 rok |
Žlutá |
|
5 mg |
1 ml |
3 ml |
1 rok až < 5 let |
Modrá |
|
7,5 mg |
1,5 ml |
3 ml |
5 let až < 10 let |
Nachová |
|
10 mg |
2 ml |
3 ml |
10 let až <18 let |
Oranžová |
Přípravek BUCCOLAM je k dispozici v krabičkách obsahujících 4 předplněné stříkačky.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Podávání přípravku BUCCOLAM
Přípravek BUCCOLAM není určen k intravenóznímu podání.
Krok 1
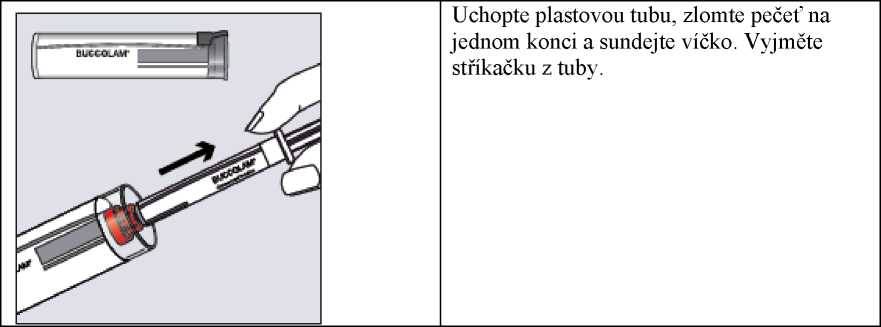
Krok 2
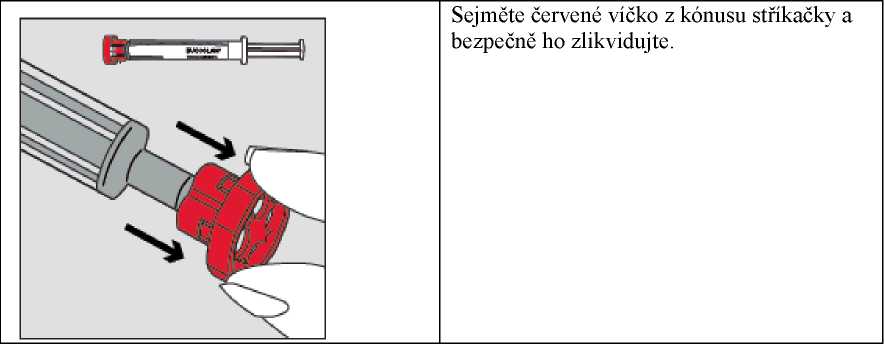
Krok 3
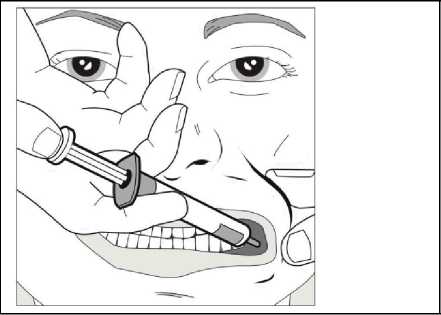
Za použití palce a dalšího prstu jemně uchopte a odtáhněte tvář dítěte. Vložte kónus stříkačky do zadní části prostoru mezi vnitřní stranou tváře a dolní dásní.
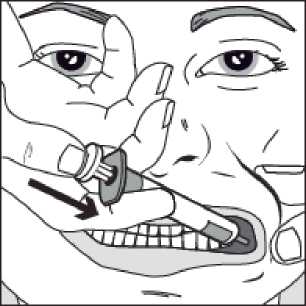
Pomalu stlačujte píst stříkačky, dokud se píst nezastaví.
Celé množství roztoku je nutné pomalu aplikovat do prostoru mezi dásní a tváří (dutiny ústní).
V případě nutnosti (u větších objemů a/nebo menších pacientů) je nutné přibližně polovinu dávky pomalu podat na jednu stranu úst, a poté druhou polovinu pomalu podat na druhou stranu.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Shire Services BVBA rue Montoyer 47 1000 Brusel Belgie
8. REGISTRAČNÍ ČÍSLO(A)
BUCCOLAM 2,5 mg orální roztok EU/1/11/709/001 BUCCOLAM 5 mg orální roztok
EU/1/11/709/002
BUCCOLAM 7,5 mg orální roztok
EU/1/11/709/003
BUCCOLAM 10 mg orální roztok EU/1/11/709/004
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 5. září 2011 Datum posledního prodloužení registrace:
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Shire Services BVBA rue Montoyer 47 1000 Brusel Belgie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Síla 2,5 mg:
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
Síly 5 mg, 7,5 mg a 10 mg:
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES ajakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
- na žádost Evropské agentury pro léčivé přípravky,
- při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
BUCCOLAM 2,5 mg orální roztok midazolamum
Pro děti ve věku od 3 měsíců do méně než 1 roku
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna předplněná stříkačka pro perorální podání (0,5 ml) obsahuje midazolamum 2,5 mg (jako midazolami hydrochloridum)
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Orální roztok
4 předplněné stříkačky pro perorální podání
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Pouze k orálnímu podání.
Každá stříkačka je pouze k jednorázovému použití.
Před použitím sundejte uzávěr stříkačky pro perorální podání, abyste zamezil(a) možnému riziku udušení.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Chraňte před chladem nebo mrazem.
Uchovávejte stříkačku pro perorální podání v ochranné plastové tubě.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Shire Services BVBA rue Montoyer 47 1000 Brusel Belgie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/11/709/001
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
BUCCOLAM 2,5 mg
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH NEBO STRIPECH Štítek plastové tuby 2,5 mg /0,5 ml_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
BUCCOLAM 2,5 mg orální roztok midazolamum
Pro děti ve věku od 3 měsíců do méně než 1 roku.
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Logo Shire
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE c.s.:
5. JINÉ
Pouze k orálnímu podání
Před použitím sundejte uzávěr stříkačky pro perorální podání Uchovávejte stříkačku pro perorální podání v ochranné plastové tubě
\ „otevřete zde”
Jak se tento lék podává
Přípravek BUCCOLAM se nesmí podávat injekčně. Nepřipojujte ke stříkačce jehlu. Jednu dávku tvoří celý obsah jedné stříkačky. Nepodávejte více než jednu dávku.
Krok 1
Krok 3
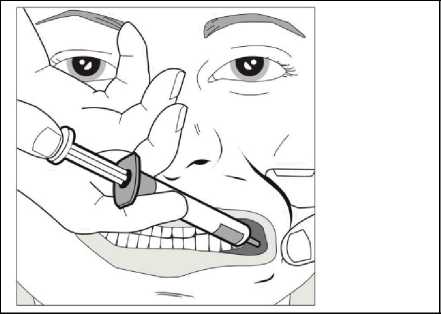
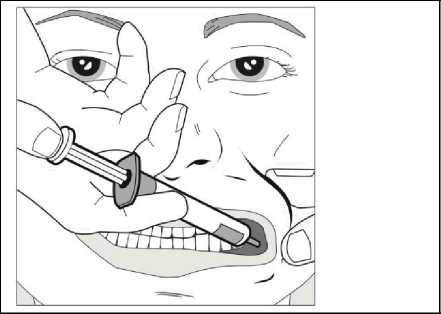
Za použití palce a dalšího prstu jemně uchopte a odtáhněte tvář dítěte. Vložte kónus stříkačky do zadní části prostoru mezi vnitřní stranou tváře a dolní dásní.
Krok 4
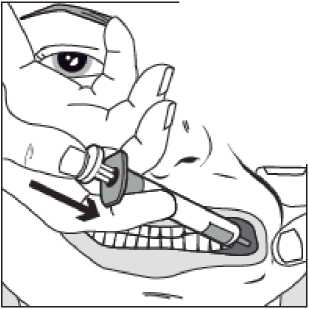
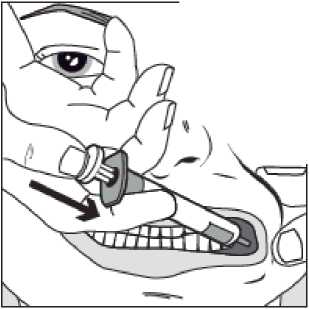
Pomalu stlačujte píst stříkačky, dokud se píst nezastaví.
Celé množství roztoku je nutné pomalu aplikovat do prostoru mezi dásní a tváří (dutiny ústní).
Předepíše-li tak lékař (u větších objemů a/nebo menších pacientů), je možné pomalu podat přibližně polovinu dávky na jednu stranu úst a zbytek na druhou stranu úst dítěte.
Kdy je nutné přivolat záchrannou službu
VŽDY postupujte podle pokynů k léčbě, které Vám dal lékař pacienta nebo zdravotnický pracovník. V případě jakýchkoliv pochybností přivolejte okamžitě lékařskou pomoc:
• jestliže záchvat neodezní do 10 minut,
• jestliže nemůžete vyprázdnit celou stříkačku nebo se část obsahu vylije,
• jestliže se dýchání dítěte zpomaluje nebo se zastaví, např. pomalé nebo mělké dýchání nebo modré rty,
• jestliže pozorujete známky srdečního záchvatu (infarktu), které mohou zahrnovat bolest na hrudi nebo bolest, která vyzařuje do krku, ramen a do levé paže,
• jestliže je dítěti nevolno (zvrací) a záchvat neodezní do 10 minut.
• jestliže podáte příliš velkou dávku přípravku BUCCOLAM a objeví se známky předávkování zahrnující:
o ospalost, únavu, vyčerpání o zmatenost nebo pocit dezorientace
o nepřítomnost patelárního reflexu nebo odpovědi na štípnutí o dýchací obtíže (pomalý nebo mělký dech) o nízký krevní tlak (závrať nebo pocit na omdlení) o kóma (hluboké bezvědomí)
Ponechte si stříkačku, abyste ji mohl(a) ukázat sanitnímu personálu nebo lékaři.
Nepodávejte větší množství léku, než jaké pro pacienta předepsal lékař._
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
BUCCOLAM 2,5 mg orální roztok midazolamum
Pro děti ve věku od 3 měsíců do méně než 1 roku. Pouze k orálnímu podání.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE c.s.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET 2,5 mg
6. JINÉ
Pouze k jednorázovému použití
Před použitím sundejte uzávěr stříkačky pro perorální podání.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
BUCCOLAM 5 mg orální roztok midazolamum
Pro děti ve věku od 1 roku do méně než 5 let
2 OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna předplněná stříkačka pro perorální podání (1 ml) obsahuje 5 mg midazolamu (jako hydrochlorid)
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Orální roztok
4 předplněné stříkačky pro perorální podání
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Pouze k orálnímu podání.
Každá stříkačka je pouze k jednorázovému použití.
Před použitím sundejte uzávěr stříkačky pro perorální podání, abyste zamezil/a možnému riziku udušení.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Chraňte před chladem nebo mrazem.
Uchovávejte stříkačku pro perorální podání v ochranné plastové tubě.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Shire Services BVBA rue Montoyer 47 1000 Brusel Belgie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/11/709/002
13. ČÍSLO ŠARŽE
č.s.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
BUCCOLAM 5 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
BUCCOLAM 5 mg orální roztok midazolamum
Pro děti ve věku od 1 roku do méně než 5 let
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Logo Shire
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE c.s.:
5. JINÉ
Pouze k orálnímu podání
Před použitím sundejte uzávěr stříkačky pro perorální podání Uchovávejte stříkačku pro perorální podání v ochranné plastové tubě
\ „otevřete zde”
Jak se tento lék podává
Přípravek BUCCOLAM se nesmí podávat injekčně. Nepřipojujte ke stříkačce jehlu. Jednu dávku tvoří celý obsah jedné stříkačky. Nepodávejte více než jednu dávku.
Krok 1
Krok 3
Za použití palce a dalšího prstu jemně uchopte a odtáhněte tvář dítěte. Vložte kónus stříkačky do zadní části prostoru mezi vnitřní stranou tváře a dolní dásní.
Krok 4
Pomalu stlačujte píst stříkačky, dokud se píst nezastaví.
Celé množství roztoku je nutné pomalu aplikovat do prostoru mezi dásní a tváří (dutiny ústní).
Předepíše-li tak lékař (u větších objemů a/nebo menších pacientů), je možné pomalu podat přibližně polovinu dávky na jednu stranu úst a zbytek na druhou stranu úst dítěte.
Kdy je nutné přivolat záchrannou službu
VŽDY postupujte podle pokynů k léčbě, které Vám dal lékař pacienta nebo zdravotnický pracovník. V případě jakýchkoliv pochybností přivolejte okamžitou lékařskou pomoc:
• jestliže záchvat neodezní do 10 minut,
• jestliže nemůžete vyprázdnit celou stříkačku nebo se část obsahu vylije,
• jestliže se dýchání dítěte zpomaluje nebo se zastaví, např. pomalé nebo mělké dýchání nebo modré rty,
• jestliže pozorujete známky srdečního záchvatu (infarktu), které mohou zahrnovat bolest na hrudi nebo bolest, která vyzařuje do krku, ramen a do levé paže,
• jestliže je dítěti nevolno (zvrací) a záchvat neodezní do 10 minut.
• jestliže podáte příliš velkou dávku přípravku BUCCOLAM a objeví se známky předávkování zahrnující:
o ospalost, únavu, vyčerpání o zmatení nebo pocit dezorientace o absenci patelárního reflexu nebo odpovědi na štípnutí o dýchací obtíže (pomalý nebo mělký dech) o nízký krevní tlak (závrať nebo pocit na omdlení) o koma
Ponechte si stříkačku, abyste ji mohl(a) ukázat sanitnímu personálu nebo lékaři.
Nepodávejte větší množství léku než jaké pro pacienta předepsal lékař._
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
BUCCOLAM 5 mg orální roztok midazolamum
Pro děti ve věku od 1 roku do méně než 5 let. Pouze k orálnímu podání.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE c.s.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET 5 mg
6. JINÉ
Pouze k jednorázovému použití.
Před použitím sundejte uzávěr stříkačky pro perorální podání.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
BUCCOLAM 7,5 mg orální roztok midazolamum
Pro děti ve věku od 5 let do méně než 10 let
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna předplněná stříkačka pro perorální podání (1,5 ml) obsahuje 7,5 mg midazolamu (jako hydrochlorid)
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Orální roztok
4 předplněné stříkačky pro perorální podání
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Pouze k orálnímu podání.
Každá stříkačka je pouze k jednorázovému použití.
Před použitím sundejte uzávěr stříkačky pro perorální podání, abyste zamezil/a možnému riziku udušení.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Chraňte před chladem nebo mrazem.
Uchovávejte stříkačku pro perorální podání v ochranné plastové tubě.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Shire Services BVBA rue Montoyer 47 1000 Brusel Belgie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/11/709/003
13. ČÍSLO ŠARŽE
č.s.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
BUCCOLAM 7,5 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
BUCCOLAM 7,5 mg orální roztok midazolamum
Pro děti ve věku od 5 let do méně než 10 let
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Logo Shire
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE c.s.:
5. JINÉ
Pouze k orálnímu podání
Před použitím sundejte uzávěr stříkačky pro perorální podání Uchovávejte stříkačku pro perorální podání v ochranné plastové tubě
\ „otevřete zde”
Jak se tento lék podává
Přípravek BUCCOLAM se nesmí podávat injekčně. Nepřipojujte ke stříkačce jehlu. Jednu dávku tvoří celý obsah jedné stříkačky. Nepodávejte více než jednu dávku.
Krok 1
Krok 3
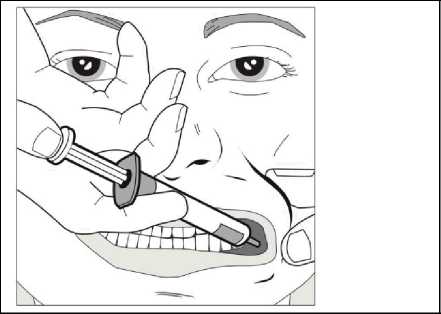
Za použití palce a dalšího prstu jemně uchopte a odtáhněte tvář dítěte. Vložte kónus stříkačky do zadní části prostoru mezi vnitřní stranou tváře a dolní dásní.
Krok 4
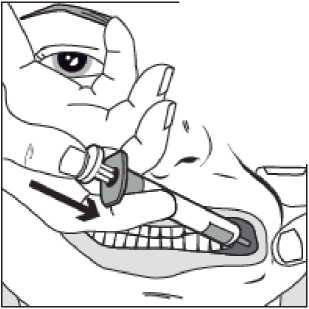
Pomalu stlačujte píst stříkačky, dokud se píst nezastaví.
Celé množství roztoku je nutné pomalu aplikovat do prostoru mezi dásní a tváří (dutiny ústní).
Předepíše-li tak lékař (u větších objemů a/nebo menších pacientů), je možné pomalu podat přibližně polovinu dávky na jednu stranu úst a zbytek na druhou stranu úst dítěte.
Kdy je nutné přivolat záchrannou službu
VŽDY postupujte podle pokynů k léčbě, které Vám dal lékař pacienta nebo zdravotnický pracovník. V případě jakýchkoliv pochybností přivolejte okamžitou lékařskou pomoc:
• jestliže záchvat neodezní do 10 minut,
• jestliže nemůžete vyprázdnit celou stříkačku nebo se část obsahu vylije,
• jestliže se dýchání dítěte zpomaluje nebo se zastaví, např. pomalé nebo mělké dýchání nebo modré rty,
• jestliže pozorujete známky srdečního záchvatu (infarktu), které mohou zahrnovat bolest na hrudi nebo bolest, která vyzařuje do krku, ramen a do levé paže,
• jestliže je dítěti nevolno (zvrací) a záchvat neodezní do 10 minut.
• jestliže podáte příliš velkou dávku přípravku BUCCOLAM a objeví se známky předávkování zahrnující:
o ospalost, únavu, vyčerpání o zmatení nebo pocit dezorientace o absenci patelárního reflexu nebo odpovědi na štípnutí o dýchací obtíže (pomalý nebo mělký dech) o nízký krevní tlak (závrať nebo pocit na omdlení) o koma
Ponechte si stříkačku, abyste ji mohl(a) ukázat sanitnímu personálu nebo lékaři.
Nepodávejte větší množství léku než jaké pro pacienta předepsal lékař._
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
BUCCOLAM 7,5 mg orální roztok midazolamum
Pro děti ve věku od 5 let do méně než 10 let. Pouze k orálnímu podání.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE c.s.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET 7,5 mg
6. JINÉ
Pouze k jednorázovému použití.
Před použitím sundejte uzávěr stříkačky pro perorální podání.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
BUCCOLAM 10 mg orální roztok midazolamum
Pro děti ve věku od 10 let do méně než 18 let
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna předplněná stříkačka pro perorální podání (2 ml) obsahuje 10 mg midazolamu (jako hydrochlorid)
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Orální roztok
4 předplněné stříkačky pro perorální podání
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Pouze k orálnímu podání.
Každá stříkačka je pouze k jednorázovému použití.
Před použitím sundejte uzávěr stříkačky pro perorální podání, abyste zamezil/a možnému riziku udušení.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Chraňte před chladem nebo mrazem.
Uchovávejte stříkačku pro perorální podání v ochranné plastové tubě.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Shire Services BVBA rue Montoyer 47 1000 Brusel Belgie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/11/709/004
13. ČÍSLO ŠARŽE
c.s.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
BUCCOLAM 10 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
BUCCOLAM 10 mg orální roztok midazolamum
Pro děti ve věku od 10 let do méně než 18 let
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Logo Shire
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE c.s.:
5. JINÉ
Pouze k orálnímu podání
Před použitím sundejte uzávěr stříkačky pro perorální podání Uchovávejte stříkačku pro perorální podání v ochranné plastové tubě
\ „otevřete zde”
Jak se tento lék podává
Přípravek BUCCOLAM se nesmí podávat injekčně. Nepřipojujte ke stříkačce jehlu. Jednu dávku tvoří celý obsah jedné stříkačky. Nepodávejte více než jednu dávku.
Krok 1
Krok 3
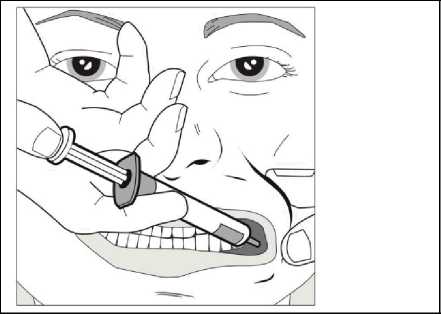
Za použití palce a dalšího prstu jemně uchopte a odtáhněte tvář dítěte. Vložte kónus stříkačky do zadní části prostoru mezi vnitřní stranou tváře a dolní dásní.
Krok 4
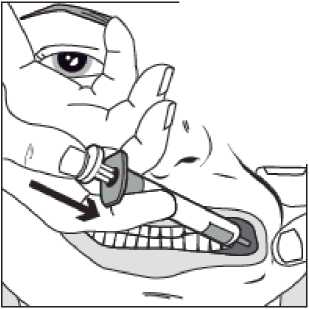
Pomalu stlačujte píst stříkačky, dokud se píst nezastaví.
Celé množství roztoku je nutné pomalu aplikovat do prostoru mezi dásní a tváří (dutiny ústní).
Předepíše-li tak lékař (u větších objemů a/nebo menších pacientů), je možné pomalu podat přibližně polovinu dávky na jednu stranu úst a zbytek na druhou stranu úst dítěte.
Kdy je nutné přivolat záchrannou službu
VŽDY postupujte podle pokynů k léčbě, které Vám dal lékař pacienta nebo zdravotnický pracovník. V případě jakýchkoliv pochybností přivolejte okamžitou lékařskou pomoc:
• jestliže záchvat neodezní do 10 minut,
• jestliže nemůžete vyprázdnit celou stříkačku nebo se část obsahu vylije,
• jestliže se dýchání dítěte zpomaluje nebo se zastaví, např. pomalé nebo mělké dýchání nebo modré rty,
• jestliže pozorujete známky srdečního záchvatu (infarktu), které mohou zahrnovat bolest na hrudi nebo bolest, která vyzařuje do krku, ramen a do levé paže,
• jestliže je dítěti nevolno (zvrací) a záchvat neodezní do 10 minut.
• jestliže podáte příliš velkou dávku přípravku BUCCOLAM a objeví se známky předávkování zahrnující:
o ospalost, únavu, vyčerpání o zmatení nebo pocit dezorientace o absenci patelárního reflexu nebo odpovědi na štípnutí o dýchací obtíže (pomalý nebo mělký dech) o nízký krevní tlak (závrať nebo pocit na omdlení) o koma
Ponechte si stříkačku, abyste ji mohl(a) ukázat sanitnímu personálu nebo lékaři.
Nepodávejte větší množství léku než jaké pro pacienta předepsal lékař._
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
BUCCOLAM 10 mg orální roztok midazolamum
Pro děti ve věku od 10 let do méně než 18 let Pouze k orálnímu podání.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE c.s.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET 10 mg
6. JINÉ
Pouze k jednorázovému použití.
Před použitím sundejte uzávěr stříkačky pro perorální podání.
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
BUCCOLAM 2,5 mg orální roztok Pro děti ve věku od 3 měsíců do méně než 1 roku
BUCCOLAM 5 mg orální roztok Pro děti ve věku od 1 roku do méně než 5 let
BUCCOLAM 7,5 mg orální roztok Pro děti ve věku od 5 let do méně než 10 let
BUCCOLAM 10 mg orální roztok Pro děti ve věku od 10 let do méně než 18 let
Midazolamum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek dítěti podávat, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
• Tento přípravek byl předepsán Vašemu dítěti. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako dítě, kterému byl lék předepsán.
• Pokud se vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek BUCCOLAM a k čemu se používá
2. Čemu musíte věnovat pozornost, než začněte přípravek BUCCOLAM podávat
3. Jak se přípravek BUCCOLAM podává
4. Možné nežádoucí účinky
5. Jak přípravek BUCCOLAM uchovávat
6. Obsah balení a další informace
1. Co je přípravek BUCCOLAM a k čemu se používá
Přípravek BUCCOLAM obsahuje lék zvaný midazolam. Midazolam patří do skupiny léků známých jako benzodiazepiny. Přípravek BUCCOLAM se používá k zastavení náhlého, dlouhotrvajícího křečového epileptického záchvatu u kojenců, batolat, dětí a dospívajících (od 3 měsíců do méně než 18 let věku).
U kojenců od 3 měsíců do méně než 6 měsíců ho lze použít pouze v nemocničním prostředí, kde je možné sledování a kde je dostupné vybavení pro resuscitaci.
Tento lék smí rodiče/pečovatelé používat pouze, pokud byla u pacienta diagnostikována epilepsie.
2. Čemu musíte věnovat pozornost, než začněte přípravek BUCCOLAM podávat Nepodávejte přípravek BUCCOLAM, jestliže má pacient:
• Alergii na midazolam, benzodiazepiny (například diazepam) nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6)
• Onemocnění nervů a svalů způsobující svalovou slabost (myasthenia gravis)
• Závažné dýchací potíže v klidu (přípravek BUCCOLAM může zhoršit dýchací potíže)
• Onemocnění, které způsobuje časté přerušení dýchání během spánku (syndrom spánkové apnoe)
• Závažné jaterní potíže.
Upozornění a opatření
Před podáním přípravku BUCCOLAM pacientovi se poraďte se svým lékařem nebo lékárníkem, jestliže pacient:
• má onemocnění ledvin, jater nebo srdce
• má onemocnění plic, které často způsobuje dýchací potíže.
Tento přípravek může způsobit, že lidé zapomenou, co se stalo poté, co ho dostali. Pacienty je nutno po podání přípravku pečlivě sledovat.
Tento přípravek se nemá používat u pacientů, kteří mají nebo měli problémy s užíváním drog nebo nadměrnou konzumací alkoholu.
Život ohrožující příhody jsou pravděpodobnější u pacientů s dýchacími potížemi nebo srdečními problémy, zejména pokud se podávají vyšší dávky přípravku BUCCOLAM.
Děti do 3 měsíců věku: Přípravek BUCCOLAM se nemá podávat dětem do 3 měsíců, protože o této věkové skupině není dostatek informací.
Pokud si nejste jistý(á), zda se na pacienta vztahuje některý z výše uvedených bodů, poraďte se před podáním tohoto přípravku s lékařem nebo lékárníkem.
Další léčivé přípravky a přípravek BUCCOLAM
Informujte svého lékaře nebo lékárníka o všech lécích, které pacient užívá, které v nedávné době užíval nebo které možná bude užívat. Pokud máte pochybnosti o tom, jestli lék, který pacient užívá, může ovlivnit použití přípravku BUCCOLAM, sdělte to prosím svému lékaři nebo lékárníkovi.
Toto je nesmírně důležité, protože užívání více než jednoho léku ve stejnou dobu může zesílit nebo zeslabit účinek některého z léků.
Účinky přípravku BUCCOLAM mohou být zesíleny léky, jako jsou:
• antiepileptika (k léčbě epilepsie), např. fenytoin
• antibiotika, např. erythromycin, klarithromycin
• protiplísňové přípravky, např. ketokonazol, vorikonazol, flukonazol, itrakonazol, pozakonazol
• protivředové léky, např. cimetidin, ranitidin a omeprazol
• léky používané k léčbě krevního tlaku, např. diltiazem, verapamil
• některé léky používané k léčbě HIV a AIDS, např. sachinavir, kombinace lopinavir/ritonavir
• narkotická analgetika (velmi silné léky proti bolesti), např. fentanyl
• léky používané ke snižování tuku v krvi, např. atorvastatin
• léky používané k léčbě pocitu na zvracení, např. nabilon
• hypnotika (léky na spaní)
• sedativní antidepresiva (léky používané k léčbě deprese, které způsobují ospalost)
• sedativa (léky, které Vás uvolní)
• anestetika (k úlevě od bolesti)
• antihistaminika (k léčbě alergií).
Účinky přípravku BUCCOLAM mohou být oslabeny léky, jako jsou:
• rifampicin (používaný k léčbě tuberkulózy)
• xanthiny (používané k léčbě astmatu)
• třezalka tečkovaná (rostlinný přípravek). Pacienti užívající přípravek BUCCOLAM by ji neměli užívat.
Přípravek BUCCOLAM může zvýšit účinek některých přípravků k uvolnění svalového napětí, např. baklofenu (způsobuje zvýšenou ospalost). Tento přípravek může rovněž zastavit působení některých léků, např. levodopy (léku používaného k léčbě Parkinsonovy nemoci).
Poraďte se s lékařem nebo lékárníkem, kterým lékům by se měl pacient během užívání přípravku BUCCOLAM vyhnout.
Přípravek BUCCOLAM s jídlem a pitím
Pacient nesmí pít alkohol, jestliže užívá přípravek BUCCOLAM. Alkohol může zvýšit tlumivé účinky tohoto přípravku a pacient se může cítit velmi ospalý.
Pacient nesmí pít grapefruitovou šťávu, jestliže užívá přípravek BUCCOLAM. Grapefruitová šťáva může zvýšit tlumivé účinky tohoto přípravku a pacient se může cítit velmi ospalý.
Těhotenství
Pokud je pacientka, které má být tento lék podán, těhotná nebo kojí, domnívá se, že může být těhotná nebo plánuje otěhotnět, poraďte se před užitím tohoto přípravku s lékařem.
Podávání vysokých dávek přípravku BUCCOLAM v průběhu posledních 3 měsíců těhotenství může způsobit abnormální srdeční tep u nenarozeného dítěte. Děti narozené po podání tohoto přípravku během porodu mohou také špatně sát, mohou mít dýchací potíže a mohou mít nízké svalové napětí při porodu.
Kojení
Informujte lékaře, pokud pacientka kojí. Přestože mohou malá množství přípravku BUCCOLAM přecházet do mléka, nemusí být nutné ukončovat kojení. Lékař rozhodne, zda by pacientka měla po podání tohoto přípravku pokračovat v kojení.
Řízení dopravních prostředků a obsluha strojů
Po podání přípravku BUCCOLAM se pacient může cítit ospalý, může zapomínat nebo může být ovlivněno jeho soustředění a koordinace. To může ovlivnit jeho výkony při úkolech vyžadujících zručnost, jako je řízení, jízda na kole nebo používání strojů.
Po podání tohoto přípravku pacient nesmí řídit dopravní prostředek, jezdit na kole ani obsluhovat stroj, dokud se zcela nezotaví. Prosím, poraďte se se svým lékařem, pokud potřebujete další informace.
3. Jak se přípravek BUCCOLAM podává
Vždy podávejte tento přípravek přesně podle pokynů lékaře. Pokud si nejste jistý(á), poraďte se s lékařem nebo lékárníkem.
Dávkování
Váš lékař předepíše vhodnou dávku přípravku BUCCOLAM, kterou Vaše dítě potřebuje, obvykle podle věku dítěte. Každá dávka má jinou barvou, kterou je označena krabička, tuba a stříkačka obsahující lék.
Vaše dítě obdrželo v závislosti na svém věku jednu z následujících dávek, která je v balení označeném štítkem určité barvy:
3 měsíce až méně než 1 rok: 2,5 mg - balení označené žlutým štítkem 1 rok až méně než 5 let: 5 mg - balení označené modrým štítkem 5 let až méně než 10 let: 7,5 mg - balení označené nachovým štítkem 10 let až méně než 18 let: 10 mg - balení označené oranžovým štítkem
Jednu dávku tvoří celý obsah jedné stříkačky pro perorální podání. Nepodávejte více než jednu dávku.
Kojenci ve věku od 3 měsíců do méně než 6 měsíců mohou být léčeni pouze v nemocničních zařízeních s možností sledování a s dostupným resuscitačním vybavením.
Příprava na podání dávky
Prodělává-li dítě právě záchvat, umožněte jeho tělu volný pohyb, nesnažte se ho omezovat. Pouze ho posuňte, pokud je v nebezpečí, například od hluboké vody, ohně nebo ostrých předmětů.
Podložte dítěti hlavu něčím měkkým, například polštářem, nebo si ji položte do klína.
Zkontrolujte, že máte lék ve správné dávce podle věku dítěte.
Jak se tento lék podává
Požádejte lékaře, lékárníka nebo zdravotní sestru, aby vám ukázali, jak užívat nebo podávat tento lék. Kdykoliv si nejste jistý(á), poraďte se s nimi.
Informace týkající se podávání tohoto přípravku jsou uvedeny také na štítku tuby.
Přípravek BUCCOLAM se nesmí podávat injekčně. Nepřipojujte ke stříkačce jehlu.
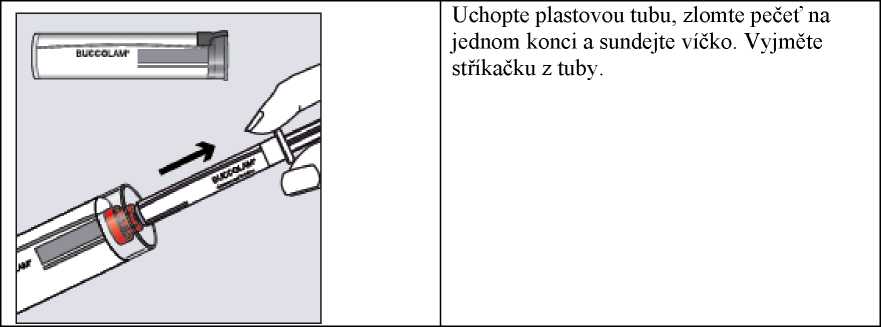
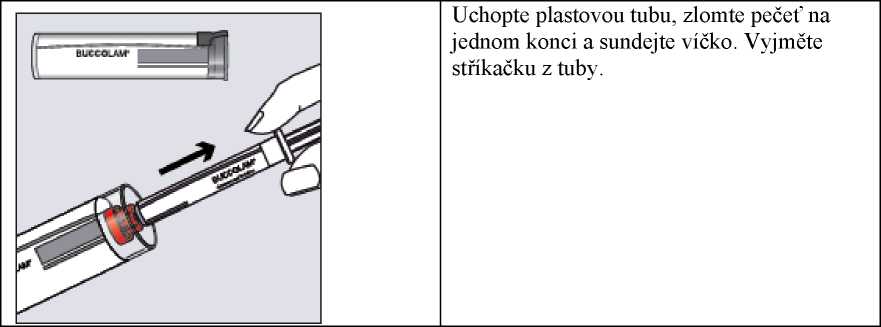
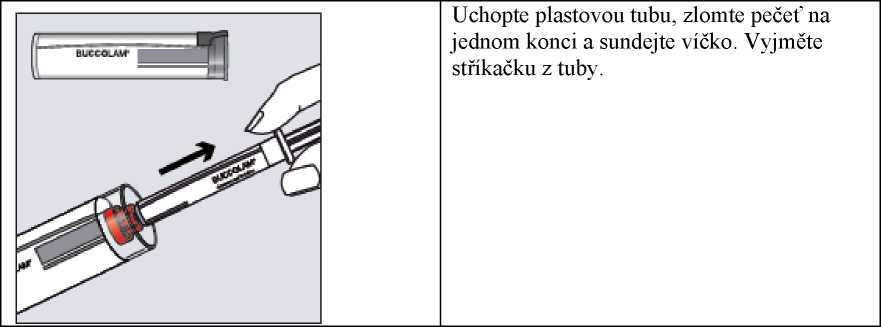
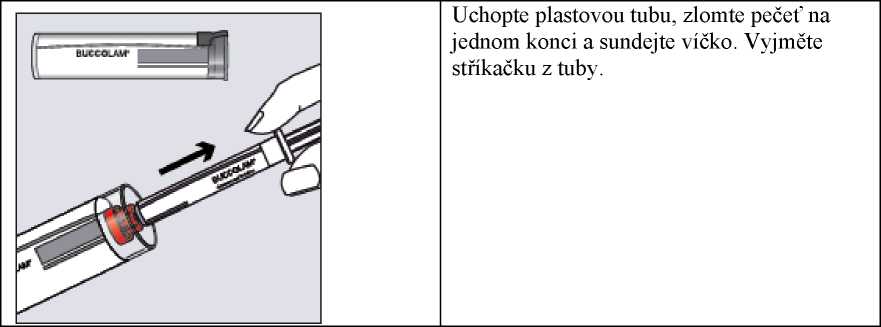
Krok 1
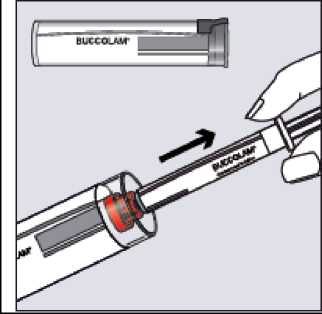
Uchopte plastovou tubu, zlomte pečeť na jednom konci a sundejte víčko. Vyjměte stříkačku z tuby.
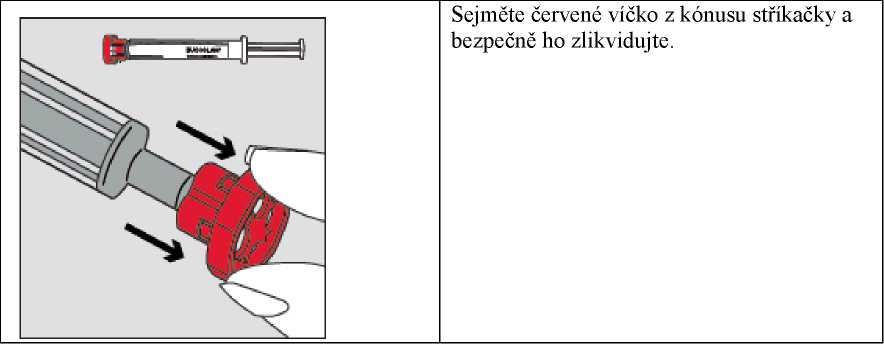
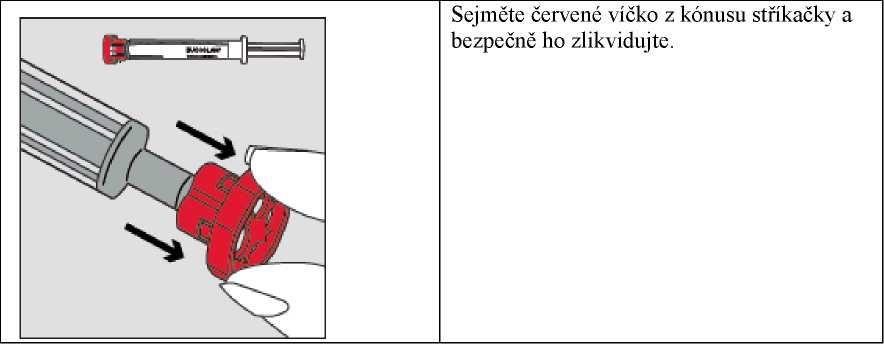
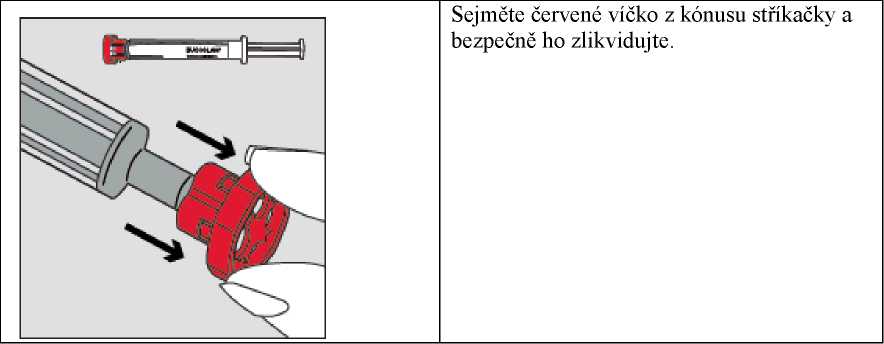
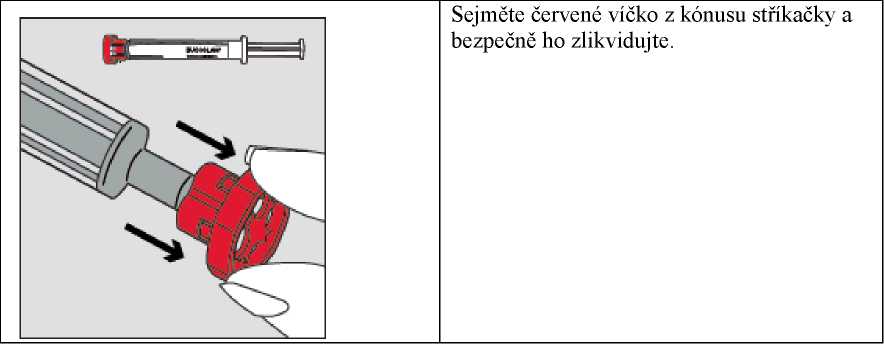
Krok 2
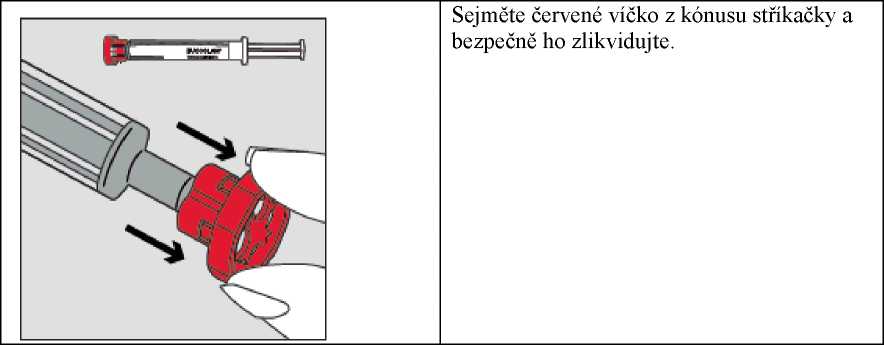

Krok 4
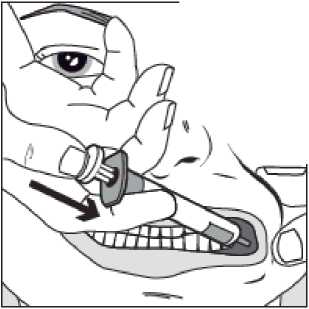
Pomalu stlačujte píst stříkačky, dokud se píst nezastaví.
Celé množství roztoku je nutné pomalu aplikovat do prostoru mezi dásní a tváří (dutiny ústní).
Předepíše-li tak lékař (u větších objemů a/nebo menších pacientů), je možné pomalu podat přibližně polovinu dávky na jednu stranu úst a zbytek na druhou stranu úst dítěte.
Kdy je nutné přivolat záchrannou službu
VŽDY postupujte podle pokynů k léčbě, které Vám dal lékař pacienta nebo zdravotnický pracovník. V případě jakýchkoliv pochybností přivolejte okamžitou lékařskou pomoc:
• jestliže záchvat neodezní do 10 minut,
• jestliže nemůžete vyprázdnit celou stříkačku nebo se část obsahu vylije,
• jestliže se dýchání dítěte zpomaluje nebo se zastaví, např. pomalé nebo mělké dýchání nebo modré rty,
• jestliže pozorujete známky srdečního záchvatu (infarktu), které mohou zahrnovat bolest na hrudi nebo bolest, která vyzařuje do krku, ramen a do levé paže,
• jestliže je dítěti nevolno (zvrací) a záchvat neodezní do 10 minut,
• jestliže podáte příliš velkou dávku přípravku BUCCOLAM a objeví se známky předávkování zahrnující:
o ospalost, únavu, vyčerpání
o zmatenost nebo pocit dezorientace
o nepřítomnost patelárního reflexu nebo odpovědi na štípnutí o dýchací obtíže (pomalý nebo mělký dech) o nízký krevní tlak (závrať nebo pocit na omdlení) o kóma (hluboké bezvědomí)
Ponechte si stříkačku, abyste ji mohl(a) ukázat sanitnímu personálu nebo lékaři.
Nepodávejte větší množství léku než jaké pro pacienta předepsal lékař.
Jestliže je dítěti nevolno (zvrací)
• Nepodávejte pacientovi další dávku přípravku BUCCOLAM.
• Jestliže záchvat neodezní do 10 minut, přivolejte záchrannou službu.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se lékaře nebo lékárníka.
Možné nežádoucí účinky
4.
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Závažné nežádoucí účinky
Neprodleně vyhledejte lékařskou pomoc nebo zavolejte záchrannou službu, jestliže se u pacienta vyskytnou následující nežádoucí účinky:
• Závažné dýchací potíže, např. pomalé nebo mělké dýchání nebo modré rty. Ve velmi vzácných případech se může dýchání zastavit.
• Srdeční záchvat (infarkt). Známky mohou zahrnovat bolest na hrudi, která může vyzařovat do krku, ramen a do levé paže dítěte.
Další nežádoucí účinky
Pokud se u pacienta vyskytne kterýkoli z nežádoucích účinků, sdělte to jeho lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci.
Časté nežádoucí účinky (mohou postihnout až 1 z 10 osob):
• Nevolnost a zvracení.
• Ospalost nebo ztráta vědomí.
Méně časté nežádoucí účinky (mohou postihnout až 1 ze 100 osob): • Vyrážka, kopřivka, svědění
Velmi vzácné nežádoucí účinky (mohou postihnout až 1 z 10000 osob):
• Rozčilení, neklid, nepřátelské chování, zuřivost nebo agresivita, podráždění, zmatenost, euforie (nadměrný pocit štěstí nebo vzrušení) nebo halucinace (vidění a možná slyšení věcí, které tam doopravdy nejsou)
• Svalové křeče a svalový třes (třes svalů, který nelze kontrolovat)
• Snížená bdělost
• Bolest hlavy
• Závratě
• Potíže s koordinací svalů
• Záchvaty (křeče)
• Dočasná ztráta paměti. Jak dlouho to trvá, závisí na tom, kolik přípravku BUCCOLAM bylo podáno. Nízký krevní tlak, pomalá tepová frekvence nebo zčervenání ve tváři a na krku
• Laryngospazmus (napnutí hlasivkových vazů způsobující ztížené a hlasité dýchání)
• Zácpa
• Sucho v ústech
• Únava
• Škytavka
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek BUCCOLAM uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepodávejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce, na tubě a stříkačce pro perorální podání za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Chraňte před chladem nebo mrazem.
Uchovávejte stříkačku pro perorální podání v ochranné plastové tubě.
Nepoužívejte tento přípravek, pokud si všimnete otevřeného nebo poškozeného obalu.
Likvidace stříkaček pro perorální podání
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek BUCCOLAM obsahuje
• Léčivou látkou je midazolamum
• Jedna 2,5mg předplněná stříkačka pro perorální podání obsahuje midazolamum 2,5 mg (jako midazolami hydrochloridum) v 0,5 ml roztoku.
• Jedna 5mg předplněná stříkačka pro perorální podání obsahuje midazolamum 5 mg (jako midazolami hydrochloridum) v 1 ml roztoku.
• Jedna 7,5mg předplněná stříkačka pro perorální podání obsahuje midazolamum 7,5 mg (jako midazolami hydrochloridum) v 1,5 ml roztoku.
• Jedna 10mg předplněná stříkačka pro perorální podání obsahuje midazolamum 10 mg (jako midazolami hydrochloridum) ve 2 ml roztoku.
Pomocnými látkami jsou chlorid sodný, voda na injekci, kyselina chlorovodíková a hydroxid sodný (k úpravě pH).
Jak přípravek BUCCOLAM vypadá a co obsahuje toto balení
3 měsíce až méně než 1 rok: 2,5 mg - balení označené žlutým štítkem 1 rok až méně než 5 let: 5 mg - balení označené modrým štítkem 5 let až méně než 10 let: 7,5 mg - balení označené nachovým štítkem 10 let až méně než 18 let: 10 mg - balení označené oranžovým štítkem
Přípravek BUCCOLAM orální roztok je čirá bezbarvá tekutina. Dodává se v předplněné, jednorázové stříkačce pro perorální podání jantarově hnědé barvy. Každá stříkačka pro perorální podání je zvlášť zabalena v ochranné plastové tubě. Přípravek BUCCOLAM je k dispozici v krabičkách obsahujících 4 předplněné stříkačky pro perorální podání/tuby (se stejnou dávkou).
Držitel rozhodnutí o registraci a výrobce
Shire Services BVBA rue Montoyer 47 1000 Brusel Belgie
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
51