Bronchitol 40 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Bronchitol 40 mg prášek k inhalaci v tvrdé tobolce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tvrdá tobolka obsahuje 40 mg mannitolum.
Průměrná podaná dávka na jednu tobolku činí 32,2 mg. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek k inhalaci v tvrdé tobolce.
Čiré bezbarvé tvrdé tobolky označené nápisem „PXS 40 mg“ obsahující bílý či téměř bílý prášek.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Bronchitol je indikován k léčbě cystické fibrózy (CF) u dospělých od věku 18 let výše jako přídavná léčba k nejlepšímu standardu péče.
4.2 Dávkování a způsob podání
Zahajovací dávku přípravku Bronchitol (400 mg) musí pacient užít pod dohledem a za sledování zkušeným lékařem nebo jiným náležitě vyškoleným zdravotnickým pracovníkem, který je vybaven zařízením na provádění spirometrie, sledování saturace kyslíkem (SpO2) a který zvládá léčbu akutního bronchospasmu (viz body 4.4 a 4.8), včetně správného použití resuscitační vybavení.
Dávkování
Vyhodnocení zahajovací dávky
Před zahájením léčby přípravkem Bronchitol by se měla u všech pacientů vyšetřit hyperreaktivita bronchů na inhalovaný mannitol během podávání zahajovací dávky (viz body 4.4 a 5.1).
Pacient by se měl po změření výchozích hodnot FEVi a SpO2 (saturace krve kyslíkem) premedikovat bronchodilatanciem 5-15 minut před podáním zahajovací dávky. Veškerá měření FEV1 a sledování SpO2 by se měla provádět 60 sekund po inhalaci dávky.
Je důležité pacienta zaškolit, aby během hodnocení zahajovací dávky používal správnou inhalační techniku.
Vyhodnocení zahajovací dávky se musí provést v následujících krocích:
Krok 1: Před podáním zahajovací dávky se pacientovi změří výchozí hodnoty FEV1 a SpO2
Krok 2: Pacient inhaluje 40 mg (1 x 40 mg tobolku), přičemž se sleduje SpO2
Krok 3: Pacient inhaluje 80 mg (2 x 40 mg tobolky), přičemž se sleduje SpO2
Krok 4: Pacient inhaluje 120 mg (3 x 40 mg tobolky), přičemž se změří FEV1 a sleduje SpO2
Krok 5: Pacient inhaluje 160 mg (4 x 40 mg tobolky), přičemž se změří FEV1 a sleduje SpO2
Krok 6: 15 minut po podání zahajovací dávky se u pacienta změří FEV1.
U pacientů s astmatem se může po provedení hodnocení zahajovací dávky vyskytnout mírný reverzibilní dočasný bronchospasmus, a proto by se měli pacienti sledovat, dokud se jejich hodnoty FEVi nevrátí k výchozím hodnotám.
Léčebný režim dávkování
Léčebný režim dávkování by se neměl předepisovat, dokud se neprovede vyhodnocení zahajovací dávky. Před zahájením léčby přípravkem Bronchitol musí pacient absolvovat a splnit vyhodnocení zahajovací dávky.
U pacientů, kteří užívají několik respiračních léků, se doporučuje toto pořadí:
1. Bronchodilatancium
2. Bronchitol
3. Fyzioterapie/cvičení
4. Dornáza alfa (je-li to vhodné)
5. Inhalační antibiotika (je-li to vhodné)
5-15 minut před každou dávkou Bronchitol je nutno podat bronchodilatátor.
Doporučená dávka přípravku Bronchitol je 400 mg dvakrát denně. To vyžaduje inhalaci obsahu deseti tobolek pomocí inhalátoru dvakrát denně.
Zvláštní populace
Pacienti s poškozením ledvin nebo jater
Přípravek Bronchitol nebyl speciálně studován u pacientů s poškozením funkce ledvin nebo jater. Dostupné údaje ze studií DPM-CF-301 a 302 naznačují, že u těchto populací pacientů není třeba upravovat dávkování.
Starší pacienti (> 65 let)
U této populace není k dispozici dostatek údajů na podporu doporučení, zda upravit či neupravit dávkování.
Pediatrická populace
Bezpečnost a účinnost přípravku Bronchitol u dětí a dospívajících ve věku od 6 do 18 let nebyla dosud stanovena. Stávající dostupné údaje jsou popsány v bodě 4.8, 5.1 a 5.2, avšak na jejich základě nelze učinit žádná doporučení ohledně dávkování.
Bezpečnost a účinnost přípravku Bronchitol u dětí mladších 6 let nebyla dosud stanovena. Nej sou dostupné žádné údaje.
Způsob podání
Přípravek Bronchitol se podává cestou perorální inhalace pomocí inhalátoru, který je součástí balení. Nesmí se podávat žádnou jinou cestou, ani pomocí žádného jiného inhalátoru. Tobolky se nesmí polykat.
Dávky by se měly užívat ráno a večer, přičemž večerní dávka by se měla užít 2-3 hodiny před spaním.
Každou tobolku je třeba vložit do přístroje zvlášť. Obsahy tobolek se inhalují pomocí inhalátoru jedním nebo dvěma vdechy. Po inhalaci se každá prázdná tobolka vyhodí před tím, než se do inhalátoru vloží další tobolka, se zachováním co možná nejmenší prodlevy mezi tobolkami.
Po jednom týdnu používání je nutné inhalátor vyměnit. Je-li potřeba inhalátor vyčistit, ujistěte se, že je přístroj prázdný, a poté jej umyjte teplou vodou. Před dalším použitím jej nechte řádně vyschnout.
Podrobný návod, jak používat inhalátor, naleznete v příbalové informaci. Pacienti by měli být poučeni, aby si ho pečlivě přečetli.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku.
Hyperreaktivita bronchů na inhalovaný mannitol (viz bod 4.4).
4.4 Zvláštní upozornění a opatření pro použití
Hyperreaktivita na mannitol
Před zahájením léčebného dávkovacího režimu přípravku Bronchitol se musí pacienti sledovat s ohledem na hyperreaktivitu bronchů vůči inhalovanému mannitolu v průběhu hodnocení zahajovací dávky. Pokud není možné provést pacientovi spirometrii nebo provést vyhodnocení zahajovací dávky, nesmí se mu přípravek Bronchitol předepisovat. Pacientům s hyperreaktivitou se nesmí předepisovat léčebný dávkovací režim přípravku Bronchitol (viz bod 4.3). Pro sledování hyperreaktivity bronchů platí obvyklá opatření (viz bod 4.2).
Pokud se u pacienta během vyhodnocení zahajovací dávky vyskytne kterýkoli z následujících stavů, považuje se pacient za hyperreaktivního vůči inhalovanému mannitolu a léčebný dávkovací režim se mu nesmí předepsat:
- > 10% pokles SpO2 oproti výchozí hodnotě v kterémkoli okamžiku hodnocení,
- pokles FEVi oproti výchozí hodnotě je > 20 % při kumulativní dávce 240 mg,
- FEV1 na konci hodnocení poklesl o 20 až < 50 % (oproti výchozí hodnotě) a nevrací se k hodnotám poklesu o méně než 20 % během 15 minut,
- FEV1 na konci hodnocení poklesl o > 50 % (oproti výchozí hodnotě).
Je-li podezření na hyperreaktivní reakci vyvolanou léčbou, mělo by se podávání přípravku Bronchitol ukončit.
Bronchospasmus
Při inhalaci léčivého přípravku může dojít k bronchospasmu. Bronchospasmus byl při podávání přípravku Bronchitol hlášen v klinických studiích dokonce i u pacientů, kteří nevykazovali hyperreaktivitu vůči zahajovací dávce inhalovaného mannitolu (viz bod 4.8). Bronchospasmus by se měl léčit bronchodilatanciem, či jak je z lékařského hlediska vhodné.
Existují-li důkazy o bronchospasmu vyvolaném léčbou, měl by lékař pečlivě zvážit, zda přínosy dalšího užívání přípravku Bronchitol převyšují rizika pro pacienta.
Všichni pacienti by měli být přibližně po šesti týdnech léčby přípravkem Bronchitol oficiálně znovu vyšetřeni za účelem vyhodnocení známek a příznaků naznačujících na bronchospasmus vyvolaný lékem. Existuje-li nejistota, mělo by se zopakovat hodnocení zahajovací dávky popsané v bodě 4.2.
Bezpečnost/účinnost mannitolu u pacientů s astmatem nebyla řádně studována. Pacienti s astmatem se musí po podání zahajovací dávky přípravku Bronchitol pečlivě sledovat, zda u nich nedojde ke zhoršení známek a příznaků astmatu.
Pacienti musí být poučeni, že mají svému lékaři oznámit každé zhoršení známek a příznaků astmatu během léčebného užívání přípravku. Existují-li důkazy o bronchospasmu vyvolaném léčbou, měl by lékař pečlivě zvážit, zda přínosy dalšího užívání přípravku Bronchitol převyšují rizika pro pacienta. Bronchospasmus by se měl léčit bronchodilatanciem či jak je z lékařského hlediska vhodné.
Hemoptýza
Hemoptýza byla v klinických studiích s přípravkem Bronchitol hlášena často. Přípravek Bronchitol nebyl studován u pacientů s významnými epizodami hemoptýzy (> 60 ml) v předešlých třech měsících. V důsledku toho by se měli tito pacienti pečlivě sledovat a podávání přípravku Bronchitol by se mělo v případě masivní hemoptýzy pozastavit. Za masivní/závažnou hemoptýzu se považuje:
• akutní krvácení > 240 ml během 24 hodin,
• opakované krvácení > 100 ml/den v několika po sobě jdoucích dnech.
Znovuzavedení či pozastavení podávání přípravku Bronchitol po menších epizodách hemoptýzy by se mělo zakládat na klinickém posouzení.
Kašel byl v klinických studiích s přípravkem Bronchitol hlášen velmi často (viz bod 4.8). Pacienti by měli být zaškoleni v použití správné inhalační techniky během léčby a měli by být poučeni, že mají přetrvávající kašel při používání přípravku Bronchitol oznámit svému lékaři.
Poškození funkce plic
Bezpečnost a účinnost přípravku nebyla prokázána u pacientů s hodnotou FEVi nižší než 30 % předpokládané hodnoty (viz bod 5.1). Užívání přípravku Bronchitol se těmto pacientům nedoporučuje.
Bronchiektázie jiného původu než CF
Bezpečnost a účinnost přípravku nebyla u pacientů s bronchiektáziemi jiného původu než CF stanovena. Proto se jim léčba přípravkem Bronchitol nedoporučuje.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Formální studie interakcí nebyly provedeny.
Nicméně přípravek Bronchitol se v klinických studiích používal společně se standardními léky na cystickou fibrózu, jako jsou mukolytika, antibiotika (včetně tobramycinu a sodné soli kolistimetátu), bronchodilatancia, pankreatické enzymy, vitamíny, inhalační a systémové kortikosteroidy a analgetika.
4.6 Fertilita, těhotenství a kojení
Údaje o podávání mannitolu těhotným ženám jsou omezené (méně než 300 výsledků týkajících se těhotenství). Studie na zvířatech nenaznačují přímé ani nepřímé škodlivé účinky, co se týče reprodukční toxicity (viz bod 5.3). Jelikož účinky možné hyperreaktivity na matku a/nebo plod nejsou známy, mělo by se při předepisování přípravku Bronchitol těhotným ženám postupovat obezřetně. Podávání přípravku Bronchitol v těhotenství se z preventivních důvodů nedoporučuje.
Kojení
Není známo, zda se mannitol vylučuje do mateřského mléka. Vylučování mannitolu do mléka nebylo u zvířat studováno. Riziko pro novorozence/kojence nelze vyloučit. Na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby přípravkem Bronchitol pro ženu je nutno rozhodnout, zda přerušit kojení, nebo přerušit podávání přípravku Bronchitol.
Fertilita
Nejsou k dispozici žádné klinické údaje týkající se fertility při podávání mannitolu. Studie reprodukce u zvířat při inhalačním podání mannitolu nebyly provedeny. Studie s perorálně podávaným mannitolem však nenaznačují žádné účinky na fertilitu (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Bronchitol nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Vyhodnocení zahajovací dávky
Nejčastěji pozorovaným nežádoucím účinkem při podávání přípravku Bronchitol během hodnocení zahajovací dávky je kašel (3,6 % pacientů) (viz bod 4.4).
Nej závažnějším nežádoucím účinkem spojeným s použitím přípravku Bronchitol během hodnocení zahajovací dávky je bronchospasmus (viz bod 4.4).
Léčebný režim dávkování
Nejčastěji pozorovaným nežádoucím účinkem spojeným s užíváním přípravku Bronchitol je kašel (viz bod 4.4). Ten byl pozorován u 10,2 % pacientů v porovnání s 5,0 % pacientů v kontrolní skupině. Kašel, který vedl k ukončení léčby, se také vyskytoval často a byl pozorován u 4,7 % pacientů ve skupině léčené přípravkem Bronchitol.
Nejzávažnějším nežádoucím účinkem spojeným s užíváním přípravku Bronchitol je hemoptýza. Podíl pacientů, u kterých se jako nežádoucí účinek vyskytla hemoptýza, činil 7,3 % a 2,9 % u skupin léčených přípravkem Bronchitol ve studii 301 a 302, oproti 3,4 % a 0 % v kontrolních skupinách. Celková incidence hemoptýzy včetně v průběhu exacerbace činila u skupiny s mannitolem 15,8 % a u kontrolní skupiny 14,6 % (viz bod 4.4).
Tabulkový souhrn nežádoucích účinků
Četnosti uvedené v tabulce 1 a 2 se zakládají na pozorování v den screeningu a v průběhu dvou hlavních srovnávacích klinických studií zkoumajících účinek přípravku Bronchitol (populace ke stanovení bezpečnosti, 361 pacientů na přípravku Bronchitol).
Četnosti jsou definovány následujícím způsobem:
Velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1 000 až < 1/100), vzácné
(> 1/10 000 až < 1/1 000), velmi vzácné (> 1/100 000 až < 1/10 000), není známo (z dostupných údajů
nelze určit).
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Tabulka 1: Četnost nežádoucích účinků při podávání přípravku Bronchitol během léčebné fáze a v den screeningu____
|
Třída orgánových systémů |
Velmi časté |
Časté |
Méně časté |
|
Infekce a infestace |
Bacilonosič Orální kandidóza Stafylokoková infekce | ||
|
Poruchy metabolismu a výživy |
Snížená chuť k j ídlu Diabetes související s CF Dehydratace1 | ||
|
Psychiatrické poruchy |
Počáteční insomnie Chorobné myšlenky | ||
|
Poruchy nervového systému |
Závrať2 | ||
|
Poruchy ucha a labyrintu |
Bolest ucha | ||
|
Respirační, hrudní a mediastinální poruchy |
Hemoptýza Zhoršení stavu2 Faryngolaryngeální |
Dušnost (sípání) 1 Bakterie ve sputu Astma |
|
bolest Tlak na hrudi2 Dušnost (sípání) Produktivní kašel Dráždění v krku |
Rinorhea Bronchospasmus2 Pozitivní mykologické vyšetření sputa Dysfonie Hyperventilace Obstrukční onemocnění dýchacích cest Kongesce dýchacích cest Zbarvené sputum Bronchitida Bronchopneumonie Plicní infekce Faryngitida Infekce horních cest dýchacích Hypoxie1 Produktivní kašel1 Snížení objemu usilovně vydechnutého vzduchu (FEV) 1 Bolest na hrudi1 Dráždění v krku1 | ||
|
Gastrointestinální poruchy |
Říhání Flatulence Refluxní choroba jícnu Glosodynie Nutkání na zvracení2 Stomatitida Bolest v horní oblasti břicha1 Aftózní stomatitida1 Odynofagie1 Zvracení po kašli1 | ||
|
Poruchy kůže a podkožní tkáně |
Akné Studený pot Pruritus Vyrážka Svědivá vyrážka | ||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Muskuloskeletální bolest hrudníku Artralgie Bolest zad Ztuhlost kloubů Muskuloskeletální bolest | ||
|
Poruchy ledvin a močových cest |
Inkontinence moči | ||
|
Celkové poruchy a reakce v místě aplikace |
Onemocnění podobající se chřipce Únava2 |
|
Bolest v zádech | |||
|
Vyšetření |
Zvýšená hladina alkalické fosfatázy v krvi1 | ||
|
1Nežádoucí účinek se vyskytl v d |
en screeningu | ||
2Nežádoucí účinek se vyskytl jak v průběhu léčebné fáze, tak v den screeningu.
Dvacet sedm (7 %) z 389 pacientů zařazených do studie 301 a 14 (4,1 %) ze 342 pacientů zařazených do studie 302 nebylo randomizováno v důsledku pozitivního výsledku testu snášenlivosti mannitolu (MTT). Ve studii 301 byl celkově nejčastěji hlášenou příhodou v průběhu testu MTT kašel u 18 (4,8 %) subjektů, dušnost/bronchospasmus u 8 (2,1 %) subjektů a nepříjemné pocity na hrudi u 6 (1,6 %) subjektů. Ve studii 302 byl nejčastější hlášenou klinickou známkou nebo příznakem v průběhu testu MTT kašel (7,9 %).
Pediatrická populace (ve věku 6 až 17 let)
Četnost, typ a závažnost nežádoucích účinků u dětí j sou podobné těm, které byly pozorovány u dospělých.
Zahajovací dávka
Nejčastěji pozorovaným nežádoucím účinkem při podávání přípravku Bronchitol během hodnocení zahajovací dávky u pediatrické populace byl kašel (4,8 % pacientů).
Nejzávažnějším nežádoucím účinkem spojeným s použitím přípravku Bronchitol během hodnocení zahajovací dávky u pediatrické populace je bronchospasmus.
Léčebný režim dávkování
Nejčastěji pozorovaným nežádoucím účinkem spojeným s užíváním přípravku Bronchitol je kašel. Ten byl pozorován u 7,8 % pacientů v porovnání s 3,8 % pacientů v kontrolní skupině.
Nejzávažnějším nežádoucím účinkem spojeným s užíváním přípravku Bronchitol je hemoptýza.
Tabulka 2: Četnost nežádoucích účinků při podávání přípravku Bronchitol během léčebné fáze a v den screeningu - pediatrická populace___
|
Třída orgánových systémů |
Velmi časté |
Časté |
Méně časté |
|
Psychiatrické poruchy |
Počáteční insomnie | ||
|
Poruchy nervového systému |
Závrať2 | ||
|
Poruchy ucha a labyrintu |
Bolest ucha | ||
|
Respirační, hrudní a mediastinální poruchy |
Zhoršení stavu Hemoptýza Faryngolaryngeální bolest Bakterie ve sputu Tlak na hrudi Dušnost (sípání) Astma |
Bronchitida Bronchopneumonie Dysfonie Hyperventilace Zbarvené sputum Dráždění v krku Faryngitida Infekce horních cest dýchacích Bronchospasmus1 | |
|
Gastrointestinální poruchy |
Zvracení Zvracení po kašli |
Odynofagie1 | |
|
Poruchy kůže a podkožní tkáně |
Pruritus Svědivá vyrážka | ||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Muskuloskeletální bolest hrudníku | ||
|
Poruchy ledvin a močových cest |
Inkontinence moči | ||
|
Celkové poruchy a reakce v místě aplikace | |||
|
1Nežádoucí účinek se vyskytl v c |
en screeningu | ||
2Nežádoucí účinek se vyskytl jak v průběhu léčebné fáze, tak v den screeningu.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V*.
4.9 Předávkování
Citlivé osoby mohou v případě předávkování inhalační cestou trpět bronchokonstrikcí. Objeví-li se kašel a bronchokonstrikce, měl by se pacientovi podat beta2 agonista a v případě potřeby i kyslík.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Přípravky proti nachlazení a kašli, mukolytikum. ATC kód: R05CB16 Mechanismus účinku
Přípravek Bronchitol je inhalační hyperosmotický léčivý přípravek. Ačkoliv přesný mechanismus účinku není znám, inhalovaný mannitol může změnit viskoelastické vlastnosti hlenu, zvýšit hydrataci vrstvy periciliární tekutiny a přispět k zvýšenému odstraňování hlenu ze zadržených sekretů prostřednictvím mukociliární aktivity. Produktivní kašel může přispět k odstranění sputa.
Farmakodynamické účinky
V populaci ITT otevřené studie reakce na dávku, DPM-CF-202 činila průměrná (SD) procentuální změna FEV1 u dávky 400 mg 8,75 (SD: 12,4) a -1,569 (SD: 9,0) u dávky 40 mg (p < 0,000 1).
Klinická účinnost a bezpečnost
Byly provedeny dvě 26týdenní, dvojitě zaslepené, randomizované, kontrolované intervenční studie paralelních skupin fáze 3 (DPM-CF-301 a DPM-CF-302), ve kterých bylo randomizováno 324 (DPM-CF-301) a 318 (DPM-CF-302) pacientů ve věku od 6 let výše v poměru 3:2 do skupiny s inhalací mannitolu 400 mg dvakrát denně nebo do kontrolní skupiny (inhalace mannitolu 50 mg dvakrát denně). Dvacet sedm (7 %) z 389 pacientů zařazených do studie 301 a 14 (4,1 %) ze 342 zařazených do studie 302 nebylo randomizováno v důsledku pozitivního výsledku testu snášenlivosti mannitolu (MTT), který byl definován buď jako 1) pokles FEVi > 20 % oproti výchozí hodnotě uprostřed testu (krok 4), nebo 2) pokles FEV1 > 20 % oproti výchozí hodnotě na konci testu, který se neupravil na < 20 % během 15 minut, nebo 3) pokles FEV1 > 50 % oproti výchozí hodnotě na konci testu (krok 6), nebo 4) pokles Sp02 na < 89 % během procedury. Další 4 % (n = 27) pacientů z těchto dvou studií test MTT nedokončila a nebyla randomizována.
Průměrný (SD) výchozí procentuální předpokládaný FEV1 ve studii DPM-CF-301 (populace ke stanovení bezpečnosti, N = 295) činil 62,4 (SD: 16,45) ve skupině s mannitolem a 61,4 (SD: 16,13) v kontrolní skupině. U studie DPM-CF-302 (N = 305) byla tato čísla následující: 65,24 (SD: 13,90) a 64,35 (SD: 15,29). Ve studii DPM-CF-301 tvořili dospělí jedinci 64,4 % populace pacientů, zatímco ve studii DPM-CF-302 představovali 49,5 %. Padesát pět procent pacientů ve studii DPM-CF-301 užívalo rhDNázu, zatímco ve studii DPM-CF-302 tento počet činil 75 %. Procento pacientů, které užívalo inhalační antibiotika, činilo ve studii DPM-CF-301 55 % a ve studii DPM-CF-302 56 %. Souběžné podávání hypertonického roztoku chloridu sodného nebylo v těchto studiích povoleno.
Předem stanovený primární cílový parametr, tj. změna FEV1 (ml) oproti výchozí hodnotě u modifikované populace ITT (mITT) (n = 269 ve studii DPM-CF-301 a n = 297 ve studii DPM-CF-302) ve srovnání s kontrolou během období 26 týdnů, je uveden v tabulce 1 spolu s hodnotou FEV1, vyjádřenou jako absolutní a relativní změna procentuální předpokládané hodnoty.
Tabulka 1 - Změna FEVi oproti výchozí hodnotě během 26 týdnů v populaci mITT a populaci dospělých
|
Odhad efektivní velikosti | ||||
|
DPM-CF-301 |
DPM-CF-302 | |||
|
FEV |
p- |
FEV |
p- | |
|
(95 % CI) |
hodnota |
(95 % CI) |
hodnota | |
|
Celková populace | ||||
|
N = 269 |
N = 297 | |||
|
94,5 |
54,1 | |||
|
Absolutní hodnota v ml |
(46,2, |
< 0,001 |
(-1,97, |
0,059 |
|
142,7) |
110,3) | |||
|
Absolutní změna % |
2,4 |
0,001 |
1,9 |
0,052 |
|
předpokládaná |
(0,9, 3,9) |
(-0,02, 3,8) | ||
|
Relativní změna % předpokládaná |
3,5 (1,0, 6,1) |
0,007 |
3,6 (0,3, 6,9) |
0,033 |
|
Populace dospělých | ||||
|
N = 171 |
N = 144 | |||
|
108,5 | ||||
|
85,9 | ||||
|
Absolutní hodnota v ml |
(47,6, 169,4) |
< 0,001 |
(4,6, 167,3) |
0,038 |
|
Absolutní změna % |
2,7 |
0,004 |
2,3 |
0,095 |
|
předpokládaná |
(0,9, 4,5) |
(-0,4, 5,1) | ||
|
Relativní změna % předpokládaná |
4,3 (1,1, 7,5) |
0,008 |
5,0 (0,2, 9,8) |
0,040 |
U pacientů užívajících rhDNázu ve studii 301 činila předpokládaná relativní procentuální změna hodnoty FEV1 oproti výchozí hodnotě během 26 týdnů léčby 2,83 (95 % CI -0,62, 6,27). U pacientů, kteří rhDNázu neužívali, činila relativní změna 4,30 (95 % CI 0,53, 8,07). Ve studii 302 činila relativní změna (95 % CI) u pacientů užívajících rhDNázu 3,21 (-0,61, 7,03) a u neužívajících 4,73 (1,93, 11,40).
Počet subjektů s alespoň jednou plicní exacerbací, jak ji definuje protokol (PDPE, definována přítomností nejméně 4 příznaků a známek plus podáním nitrožilních antibiotik), činil ve studii 301 (populace ITT) 18,1 % u skupiny s mannitolem a 28 % u kontrolní skupiny. Ve studii 302 mělo PDPE 15,2 % subjektů ve skupině s mannitolem a 19 % v kontrolní skupině.
Odhadovaný účinek léčby (průměrná změna a 95 % CI oproti výchozí hodnotě během 26 týdnů v populaci mITT) na hodnotu FVC byl 108,78 ml (95 % CI: 49,21, 168,35) ve studii 301 a 71,4 ml (95 % CI: 10,57, 132,13) ve studii 302.
Pediatrická populace
Jak je uvedeno v bodě 4.2, bezpečnost a účinnost přípravku Bronchitol u dětí a dospívajících mladších 18 let nebyla dosud stanovena.
Předpokládaná relativní procentuální hodnota FEVi se v případě dětí (ve věku od 6 do 11 let) během 26 týdnů (p = 0,892 a 0,104) ve studii DPM-CF-301 v porovnání s kontrolou zlepšila o 0,44 % (95 % CI -5,90, 6,77, N = 43) a ve studii DPM-CF-302 o 6,1 % (95 % CI -1,28, 13,54, N = 59).
U dospívajících (ve věku od 12 do 17 let) se předpokládaná relativní procentuální hodnota FEV1 v porovnání s kontrolou zlepšila během 26 týdnů (p = 0,245 a 0,888) o 3,31 % (95 % CI -2,29, 8,90, N = 55) ve studii DPM-CF-301 a 0,42 % (95 % CI -5,45, 6,29, N = 94) ve studii DPM-CF-302.
5.2 Farmakokinetické vlastnosti
Absorpce
Ve studii s 18 zdravými mužskými dospělými dobrovolníky činila absolutní biologická dostupnost mannitolu ve formě prášku k inhalaci v porovnání s mannitolem podávaným nitrožilně 0,59 %± 0,15. Rychlost a rozsah absorpce mannitolu po inhalačním podání byly velmi podobné hodnotám pozorovaným po perorálním podání. Tmax po inhalačním podání činila 1,5 ± 0,5 hodin.
Ve studii 9 pacientů s cystickou fibrózou (6 dospělých, 3 dospívající), kteří užívali inhalačně 400 mg mannitolu v jedné dávce (den 1), a poté dvakrát denně po celkem 7 dní (dny 2-7), se farmakokinetické parametry u dospělých a dospívajících podobaly, s výjimkou delšího průměrného zdánlivého terminálního poločasu u dospívajících (den 1 = 7,29 hodin, den 7 = 6,52 hodin) v porovnání s dospělými (den 1 = 6,10 hodin, den 7 = 5,42 hodin). Celkově ukázalo porovnání AUC mezi dnem 1 a dnem 7 nezávislost farmakokinetiky na čase, svědčící o linearitě při úrovni dávky podávané v této studii.
Biotransformace
Malé procento systémově vstřebaného mannitolu je v játrech metabolizováno na glykogen a oxid uhličitý. Studie na potkanech, myších a lidech prokázaly, že mannitol nemá toxické metabolity. Metabolická dráha inhalovaného mannitolu nebyla ve farmakokinetických studiích zkoumána.
Distribuce v organismu
Studie ukládání v plicích prokázaly, že se v plicích ukládá 24,7 % inhalovaného mannitolu, čímž potvrdily jeho distribuci do cílového orgánu. Neklinické toxikologické studie naznačují, že mannitol inhalovaný do plic se vstřebává do krevního řečiště, přičemž maximální dosažená koncentrace v séru se objevuje za 1 hodinu. Neexistují žádné důkazy o tom, že by se mannitol v organismu akumuloval, a proto nebyla distribuce inhalovaného mannitolu ve studiích FK zkoumána.
Eliminace z organismu
Kumulativní množství mannitolu vyloučeného do moči za 24hodinové období sběru bylo u inhalovaného (55 %) a perorálního (54 %) mannitolu podobné. Podává-li se mannitol nitrožilně, vylučuje se z velké části nezměněný glomerulární filtrací a během 24 hodin se v moči vyloučí 87 % dávky. Průměrný terminální poločas u dospělých činil přibližně 4 až 5 hodin ze séra a přibližně 3,66 hodin z moči.
Pediatrická populace
Bezpečnost a účinnost přípravku Bronchitol u dětí a dospívajících ve věku od 6 do 18 let nebyla dosud stanovena.
Dospívající ve věku 12 až 17 let. Omezené údaje, které jsou u této populace k dispozici, naznačují, že farmakokinetické parametry inhalovaného mannitolu jsou podobné jako u populace dospělých. Pro děti mladší 12 let nejsou k dispozici žádné údaje.
5.3 Předklinické údaje vztahující se k bezpečnosti
U samců potkanů byl po 13 týdnech podávání inhalovaného mannitolu pozorován zvýšený počet lymfocytů kolujících v krvi a plasmocytóza mandibulárních lymfatických uzlin při dávkách větších než 9,3násobek maximální dávky. Zvýšený počet lymfocytů se nacházel v rozmezí historických kontrolních hodnot, nezvyšoval se a byl v zásadě vyřešen ukončením in-life fáze studie a následným skončením léčby. U žádného jiného druhu nebyl tento účinek zaznamenán a nevedl ke klinickým příznakům.
U psů byl pozorován zvýšený výskyt kašle jak během, tak ihned po podání dávky při inhalačním podání nízké a vysoké dávky mannitolu. Při více než 13násobku maximální léčebné dávky se neobjevil žádný nežádoucí účinek související s léčbou.
Při analýze mannitolu standardní sadou testů genotoxicity nebyly odhaleny žádné mutagenní nebo genotoxické účinky.
V testu se separovaným hovězím okem a při aplikaci mannitolu do očí králíka se prokázalo, že mannitol není dráždivý.
Při podávání mannitolu (< 5 %) v potravě myším a potkanům po dobu 2 let nebyly pozorovány žádné důkazy karcinogenity. Studie karcinogenity při inhalačním podání mannitolu nebyly provedeny.
Studie reprodukční a vývojové toxicity při inhalačním podání mannitolu nebyly provedeny. Nicméně studie provedené s mannitolem podávaným jinými cestami neukázaly žádný účinek na přežití plodu u myší, potkanů a křečků a na vývoj embrya a plodu u potkanů a králíků.
Studie reprodukce u zvířat při inhalačním podání mannitolu nebyly provedeny. Nicméně studie provedené s perorálně podávaným mannitolem neukázaly žádné teratogenní účinky u myší či potkanů při dávkách až 1,6 g/kg ani u křečků při 1,2 g/kg.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Žádné.
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
Inhalátor a jeho víčko vyhoďte po 1 týdnu používání.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 30°C.
Tobolky přípravku Bronchitol se musí vždy uchovávat v blistru, aby byly chráněny před vlhkostí, a vyjímají se z něho až těsně před použitím.
6.5 Druh obalu a obsah balení
40mg tobolky přípravku Bronchitol se dodávají v dvojitých hliníkových blistrech v krabičkách obsahujících 10 tobolek pro zahajovací dávku nebo 280 tobolek pro léčebné použití.
Krabička se zahajovací dávkou obsahuje 1 blistr (s 10 tobolkami) a jeden inhalátor.
Krabička k dvoutýdenní léčbě obsahuje 28 blistrů (každý s 10 tobolkami) a dva inhalátory.
6.6 Zvláštní opatření pro likvidaci přípravku Žádné zvláštní požadavky.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Pharmaxis Pharmaceuticals Limited,
25 Moorgate,
London,
EC2R 6AY Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/12/760/001 -002
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 13. dubna 2012
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku j sou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu.
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
Mawdsleys Clinical Services Unit 22, Quest Park,
Wheatley Hall Road,
Doncaster, DN2 4LT,
Velká Británie.
nebo
Arvato distribution GmbH Gottlieb-Daimler StraPe 1 33428 Harsewinkel North Rhine-Westphalia Německo
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
• Další opatření k minimalizaci rizik
Před uvedením přípravku na trh v každém členském státě se držitel rozhodnutí o registraci dohodne s příslušným vnitrostátním orgánem na obsahu a formě vzdělávacích materiálů.
Držitel rozhodnutí o registraci zajistí, aby byl při uvedení přípravku na trh všem zdravotnickým pracovníkům, u nichž se očekává, že budou přípravek Bronchitol předepisovat, poskytnut vzdělávací balíček.
Vzdělávací balíček by měl obsahovat:
■ Souhrn údajů o přípravku a příbalovou informaci
■ Vzdělávací materiál pro zdravotnické pracovníky
Vzdělávací materiál pro zdravotnické pracovníky by měl být prospekt obsahující následující klíčové informace:
■ Riziko bronchospasmu během léčby
o Nutnost provést vyhodnocení zahajovací dávky přípravku Bronchitol, aby se
identifikovali pacienti, kteří vykazují bronchiální hyperreaktivitu vůči inhalovanému mannitolu, pomocí měření stupně bronchokonstrikce objevující se po postoupných podáních mannitolu.
o Jak bezpečně provádět vyhodnocení zahajovací dávky přípravku Bronchitol a jak dlouho je třeba pacienta sledovat.
o Jak interpretovat výsledky vyhodnocení zahajovací dávky přípravku Bronchitol kategoriemi „prošel“, „neprošel“ a „nedokončil“.
o Skutečnost, že léčebné dávky přípravku Bronchitol by se měly předepisovat jen v případě, kdy pacient úspěšně prošel vyhodnocením zahajovací dávky.
o Potřeba premedikace bronchodilatanciem 5-15 minut před provedením vyhodnocení zahajovací dávky přípravku Bronchitol a před každým léčebným podáním přípravku Bronchitol.
o Nutnost ověřit, zda pacient ví, jak správně užívat bronchodilatancium.
o Nutnost znovu zkontrolovat pacienta po přibližně šesti týdnech, aby se vyšetřily známky a příznaky bronchospasmu.
o Riziko bronchospasmu během dlouhodobé léčby, a to i tehdy, prošel-li pacient úspěšně vyhodnocením zahajovací dávky přípravku Bronchitol a potřeba hodnocení zopakovat v případě pochybností.
■ Riziko hemoptýzy během léčby
o Skutečnost, že přípravek Bronchitol nebyl studován u pacientů s významnou hemoptýzou (> 60 ml) v předešlých třech měsících.
o Potřeba sledování pacienta a kdy j e nutné léčbu pozastavit.
■ Možné riziko následků souvisejících s kašlem během léčby
o Potřeba naučit pacienta minimalizovat kašel během podávání přípravku a používat správnou inhalační techniku.
• Povinnost uskutečnit poregistrační opatření
Držitel rozhodnutí o registraci uskuteční v daném termínu níže uvedená opatření:
|
Popis |
Termín splnění |
|
Držitel rozhodnutí o registraci by měl dále zkoumat účinnost a bezpečnost přípravku Bronchitol u dětí a dospívajících s cystickou fibrózou. Protokol studie bude odsouhlasen s CHMP před zahájením studie a konečné výsledky (závěrečná zpráva o studii) budou předány CHMP a EMA do června 2016. |
červen 2016 |
Po žadateli se požaduje, aby po dobu 3 let každých 6 měsíců a po dobu 2 let jednou za rok pravidelně předkládal analýzu studie zkoumající cystickou fibrózu. Závěrečná zpráva se očekává v 1. čtvrtletí 2018.
1. čtvrtletí 2018
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Bronchitol 40 mg, prášek k inhalaci v tvrdé tobolce Mannitolum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK_
Jedna tvrdá tobolka obsahuje 40 mg mannitolum.
3. SEZNAM POMOCNÝCH LÁTEK_
4. LÉKOVÁ FORMA A OBSAH BALENÍ_
Prášek k inhalaci v tvrdé tobolce.
10 tvrdých tobolek a 1 inhalátor
5. ZPŮSOB A CESTA/CESTY PODÁNÍ_
Zahajovací dávka se musí podávat pod lékařským dohledem a musí zahrnovat sledování funkce plic. Užívejte tak, jak Vám nařídil lékař.
Pokyny k použití inhalátoru naleznete v příbalové informaci.
Tobolky obsahují prášek k orální inhalaci pomocí přiloženého inhalátoru.
Tobolky vyndávejte z blistru až těsně před použitím.
Před použitím si přečtěte příbalovou informaci.
Pouze k inhalačnímu podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOSAH A DOHLED DĚTÍ_
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ_
Tobolky se nesmí polykat.
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do30°C.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Pharmaxis Pharmaceuticals Limited
25 Moorgate
London
EC2R 6AY
Velká Británie
12. REGISTRAČNÍ ČÍSLO/ ČÍSLA
EU/1/12/760/001
13. ČÍSLO ŠARŽE
c.s.
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Bronchitol 40 mg
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Bronchitol 40 mg, prášek k inhalaci v tvrdé tobolce Mannitol
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK_
Jedna tvrdá tobolka obsahuje 40 mg mannitolu.
3. SEZNAM POMOCNÝCH LÁTEK_
4. LÉKOVÁ FORMA A OBSAH BALENÍ_
Prášek k inhalaci v tvrdé tobolce.
Balení na 2 týdny léčby obsahující 280 tvrdých tobolek a 2 inhalátory
5. ZPŮSOB A CESTA/CESTY PODÁNÍ_
Užívejte tak, jak Vám nařídil lékař.
Pokyny k použití inhalátoru naleznete v příbalové informaci.
Tobolky obsahují prášek k perorální inhalaci pomocí přiloženého inhalátoru.
Tobolky vyndávejte z blistru až těsně před použitím.
Před použitím si přečtěte příbalovou informaci.
Pouze pro inhalační podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN
MIMO DOSAH A DOHLED DĚTÍ_
Uchovávejte mimo dosah a dohled dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ_
Tobolky se nesmí polykat.
8. POUŽITELNOST_
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do30°C.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Pharmaxis Pharmaceuticals Limited
25 Moorgate
London
EC2R 6AY
Spojené království
12. REGISTRAČNÍ ČÍSLO(A)
EU/1/12/760/002
13. ČÍSLO ŠARŽE
c.s.
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Bronchitol 40 mg
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA BLISTRECH NEBO STRIPECH BLISTRY
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Bronchitol 40 mg, prášek k inhalaci v tvrdé tobolce Mannitolum
2. NÁZEV DRŽITELE ROZHODNUTÍ O REGISTRACI
Pharmaxis
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
c.s.
5. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: Informace pro uživatele
Bronchitol 40 mg, prášek k inhalaci v tvrdé tobolce
Mannitolum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Bronchitol a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Bronchitol používat
3. Jak se přípravek Bronchitol používá
4. Možné nežádoucí účinky
5. Jak přípravek Bronchitol uchovávat
6. Obsah balení a další informace
1. Co je přípravek Bronchitol a k čemu se používá Co je přípravek Bronchitol
Přípravek Bronchitol obsahuje léčivou látku zvanou mannitol, což je mukolytikum (lék snižující vazkost hlenu v dýchacích cestách).
K čemu se přípravek Bronchitol používá
Přípravek Bronchitol se používá u dospělých pacientů ve věku 18 let a více. Během užívání přípravku Bronchitol budete nadále běžně užívat další léky, které berete na cystickou fibrózu.
Jak přípravek Bronchitol působí
Přípravek Bronchitol se inhaluje (vdechuje) do plic, aby pomohl při cystické fibróze, což je dědičné onemocnění, které ovlivňuje žlázy v plicích, střevech a slinivce břišní, které vylučují tekutiny, jako jsou hlen a trávicí šťávy.
Přípravek Bronchitol pomáhá tím, že zvyšuje množství vody na povrchu dýchacích cest a v hlenech. Díky tomu se plíce snadněji zbaví hlenů. Rovněž pomáhá obecně zlepšit stav plic a dýchání. Následkem toho se u Vás může vyskytnout „produktivní kašel“ (kašel s vykašláváním), který ovšem také pomáhá odstranit hlen z plic.
2. Čemu musíte věnovat pozornost, než začnete přípravek Bronchitol používat
Nepoužívejte přípravek Bronchitol
- j estliže j ste alergický(á) na mannitol,
- jestliže Vám Váš lékař neprovedl test citlivosti na mannitol. Než začnete přípravek Bronchitol užívat, lékař zkontroluje, zda nemáte dýchací cesty příliš citlivé na mannitol. Pokud jste příliš citlivý(á) na mannitol, zúží se Vám dýchací cesty a může se Vám hůře dýchat.
Pokud se Vás cokoli z výše uvedeného týká, nebo si tím nejste jist(a), obraťte se před užíváním tohoto přípravku na svého lékaře nebo lékárníka.
Upozornění a opatření
- máte-li astma,
- jestliže jste někdy vykašlával(a) krev nebo měl(a) krev ve sputu (vykašlaném hlenu),
- jestliže máte závažnou cystickou fibrózu, zejména pokud je funkce Vašich plic, měřená pomocí objemu vzduchu vydechnutého během první vteřiny usilovného výdechu (FEV1), obvykle menší než 30 %.
Upozorněte před užíváním tohoto přípravku svého lékaře nebo lékárníka.
Inhalování léčivých přípravků může způsobovat pocit tísně na hrudi a dušnost (sípání), k čemuž může dojít ihned po užití tohoto léčivého přípravku. Váš lékař Vám pomůže vzít si první dávku přípravku Bronchitol a zkontroluje Vám funkci plic před, během a po užití dávky. Váš lékař Vás může požádat, abyste si před užitím přípravku Bronchitol vzali jiné léčivé přípravky, jako je například bronchodilatancium (lék k rozšíření dýchacích cest).
Inhalování léčivých přípravků může rovněž vyvolat kašel, a to se může stát i v případě přípravku Bronchitol. Pokud kašel neodezní, nebo Vás znepokojuje, obraťte se na svého lékaře.
Děti a dospívající
Přípravek Bronchitol se nesmí podávat dětem a dospívajícím mladším 18 let. Je tomu tak proto, že u této skupiny lidí není k dispozici dostatek informací.
Další léčivé přípravky a přípravek Bronchitol
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a), nebo které možná budete užívat.
Během užívání přípravku Bronchitol můžete nadále užívat své léky na cystickou fibrózu, patří sem inhalační antibiotika jako tobramycin a sodná sůl kolistimetátu. Pokud si nejste jistý(á), obraťte se na svého lékaře nebo lékárníka předtím, než začnete přípravek Bronchitol užívat.
Těhotenství a kojení
- Pokud jste těhotná, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat. Pokud jste těhotná, neměla byste tento léčivý přípravek užívat.
- Pokud kojíte nebo plánujete kojit, poraďte se se svým lékařem dříve, než začnete tento přípravek užívat. Není známo, jestli tento léčivý přípravek přechází do mateřského mléka.
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat.
Řízení dopravních prostředků a obsluha strojů
Není pravděpodobné, že by přípravek Bronchitol ovlivňoval schopnost řídit, používat nástroje a obsluhovat stroje.
3. Jak se přípravek Bronchitol používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Nejste-li si jisti, poraďte se se svým lékařem nebo lékárníkem.
Přípravek Bronchitol se vdechuje (inhaluje) jako prášek z kapsle pomocí inhalátoru, který je součástí balení. Kapsle Bronchitolu mohou být užity pouze s inhalátorem dodaným v balení.
Před použitím přípravku Bronchitol si vždy vezměte svoje bronchodilatancium.
Doporučená dávka přípravku je 400 mg (10 tobolek) dvakrát denně.
Kdy se tento přípravek užívá
Používejte přípravek Bronchitol jako součást svého běžného denního režimu léčby. Jestliže Vám Váš lékař nedoporučil jinak, je vhodné následující pořadí:
1. Užijte své bronchodilatancium;
2. Počkejte 5 až 15 minut;
3. Vezměte si přípravek Bronchitol před fyzioterapií, pokud je součástí Vašeho režimu léčby.
4. Dornáza alfa (Pulomozyme), pokud je součástí Vašeho režimu léčby
5. Inhalační antibiotika, pokud jsou součástí Vašeho režimu léčby
Jaké množství užít
Dospělí ve věku 18 let a více Zahajovací dávka
Dříve, než Vám lékař přípravek Bronchitol předepíše, pomůže Vám užít první dávku přípravku Bronchitol a vyšetří Vám v každém kroku funkci plic, aby se ujistil, že nejste citlivý(á) vůči mannitolu. První dávka se užívá ve 4 krocích:
Krok 1 - 1 tobolka (40 mg)
Krok 2 - 2 tobolky (80 mg)
Krok 3 - 3 tobolky (120 mg)
Krok 4 - 4 tobolky (160 mg)
Na konci podávání zahajovací dávky za sebou budete mít užití 10 tobolek (400 mg), což je množství rovnající se obvyklé dávce.
Léčebná dávka (dvoutýdenní balení)
- Přípravek Bronchitol musíte užívat každý den.
- Obvyklá dávka je 10 tobolek (400 mg) inhalovaných ráno a 10 tobolek inhalovaných večer.
- Večerní dávku si vezměte alespoň 2 až 3 hodiny před spaním.
- Abyste dosáhli optimálních výsledků, inhalujte tobolky postupně jednu po druhé, s co nejmenší prodlevou mezi jednotlivými tobolkami.
Jak máte léčivý přípravek užívat
- Kapsle jsou určeny pouze pro inhalační užití a nesmí se polykat.
- Prášek obsažený v tobolkách se smí pouze inhalovat pomocí inhalátoru, který je součástí balení.
- Každý týden použijte nový inhalátor.
- Tobolky vkládejte do inhalátoru po jedné.
- Vdechněte obsah tobolky pomocí inhalátoru jedním nebo dvěma vdechy.
Pokyny pro používání inhalátoru naleznete na konci příbalové informace.
Jestliže jste užil(a) více přípravku Bronchitol, než jste měl(a)
Domníváte-li se, že jste užil(a) příliš velké množství přípravku, okamžitě to oznamte svému lékaři nebo lékárníkovi. Můžete:
- mít pocit, že nemůžete dýchat,
- začít sípavě dýchat,
- hodně kašlat.
Lékař Vám může dát kyslík a léky, které Vám pomohou dýchat.
Jestliže jste zapomněl(a) užít přípravek Bronchitol
- Jestliže jste si zapomněl(a) vzít dávku, vezměte si ji hned, jak si to uvědomíte, a pokračujte
s užíváním přípravku jako obvykle. Pokud však již je čas na další dávku, vynechte dávku, na kterou jste zapomněl(a).
- Nezdvojnásobujte následující dávku, abyste nahradil(a) dávku vynechanou.
Jestliže jste přestal(a) používat přípravek Bronchitol
Pokud přestanete přípravek Bronchitol užívat, Vaše příznaky se mohou zhoršit. Nepřestávejte přípravek Bronchitol užívat, aniž byste se o tom předem poradil(a) se svým lékařem, a to i v případě, že se cítíte lépe. Váš lékař Vám sdělí, jak dlouho máte tento léčivý přípravek užívat.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Jestliže zaznamenáte následující závažné nežádoucí účinky, přestaňte přípravek Bronchitol užívat a okamžitě vyhledejte lékaře:
- Obtížné dýchání, které může být způsobené zúžením dýchacích cest, zhoršení příznaků astmatu nebo sípavé dýchání. Dochází k tomu často, může to postihnout až 1 z 10 lidí.
- Vykašlávání krve nebo krev ve sputu (vykašlaných hlenech). K tomu dochází často.
Jestliže zaznamenáte následující nežádoucí účinky, ihned o tom informujte svého lékaře:
- Silný kašel. K tomu dochází často.
- Zhoršení příznaků. K tomu dochází často.
Mezi další nežádoucí účinky patří:
Velmi časté (mohou postihnout více než 1 osobu z 10)
- Kašel
Časté
- Tlak na hrudi
- Bolest hlavy
- Bolest v zadní části ústní dutiny a v hrdle a nepříjemný pocit při polykání
- Dráždění v krku
- Zvracení, zvracení po kašli
Méně časté (mohou postihnout až 1 osobu ze 100)
- Pálení nebo bolest jazyka
- Diabetes související s CF
- Bolest hrudníku a břicha
- Změny v hlase
- Studený pot
- Překrvení tkáně
- Dehydratace
- Snížená chuť k j ídlu
- Průjem
- Bolest ucha
- Pocit únavy
- Pocit závratě
- Malátnost
- Chřipka a horečka
- Větry
- Pálení žáhy
- Bolest v kýle
- Hyperventilace (zrychlené a prohloubené dýchání)
- Svědění, vyrážka, akné
- Ztuhlost a bolesti kloubů
- Chorobné myšlenky
- Vředy v ústech
- Infekce dýchacích cest
- Vodnatá rýma
- Infekce ve sputu (vykašlaném hlenu)
- Poruchy spánku
- Kvasinková infekce v ústech (moučnivka)
- Nechtěný únik moči
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V*. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Bronchitol uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte po uplynutí doby použitelnosti uvedené na krabičce a blistru za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte při teplotě do 30°C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
Jakmile se tobolka vyjme z blistru, měla by se okamžitě použít.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Bronchitol obsahuje:
Léčivou látkou je mannitolum. Jedna tobolka obsahuje 40 miligramů mannitolu. Průměrná inhalovaná dávka na tobolku je 32,2 miligramů mannitolu.
Jak přípravek Bronchitol vypadá a co obsahuje toto balení:
Přípravek Bronchitol je prášek k inhalaci, kterým jsou naplněny tobolky. Přípravek Bronchitol 40 mg, prášek k inhalaci v tvrdé tobolce, obsahuje bílý či téměř bílý prášek, kterým jsou naplněny čiré, bezbarvé, tvrdé tobolky s nápisem „PXS 40 mg”. Prášek se vdechuje do plic pomocí inhalátoru, který je součástí balení.
Jedno balení přípravku Bronchitol se zahajovací dávkou obsahuje 1 blistr s 10 tobolkami a 1 inhalátor. Balení se zahajovací dávkou se používá při úvodním vyhodnocení dávky, které provádí Váš lékař.
Jedno dvoutýdenní balení přípravku Bronchitol obsahuje 28 blistrů, každý s 10 tobolkami (280 tobolek celkem) a 2 inhalátory. Dvoutýdenní balení se používá při léčbě.
Držitel rozhodnutí o registraci
Pharmaxis Pharmaceuticals Limited, 25 Moorgate, London, EC2R 6AY, Velká Británie.
Výrobce
Mawdsleys Clinical Services, Unit 22, Quest Park, Wheatley Hall Road, Doncaster, DN2 4LT, Velká Británie.
nebo
Arvato distribution GmbH, Gottlieb-Daimler StraPe 1, 33428 Harsewinkel,
North Rhine-Westphalia, Německo.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
|
Belgie/Belgique/Belgien Pharmaxis Pharmaceuticals Limited Tél/Tel: + 44 (0) 1628 902121 |
Lietuva UAB "PharmaSwiss Tel: + 370 5 279 07 62 |
|
Etarapna Pharmaxis Pharmaceuticals Limited Tea.: + 44 (0) 1628 902121 |
Luxembourg/Luxemburg Pharmaxis Pharmaceuticals Limited Tél/Tel: + 44 (0) 1628 902121 |
|
Česká republika 4 Life Pharma CZ, s.r.o. Tel: +420 244 403 003 |
Magyarország Zalunder ltd Tel.: +36305259040 |
|
Danmark Pharmaxis Pharmaceuticals Limited Tlf: + 44 (0) 1628 902121 |
Malta Pharmaxis Pharmaceuticals Limited Tel: + 44 (0) 1628 902121 |
|
Deutschland Chiesi GmbH Tel: +49 (0) 40 897 240 |
Nederland Pharmaxis Pharmaceuticals Limited Tel: + 44 (0) 1628 902121 |
|
Eesti PharmaSwiss Eesti OU Tel: + 372 6827400 |
Norge Pharmaxis Pharmaceuticals Limited Tlf: + 44 (0) 1628 902121 |
|
ElXáóa Pharmaswiss Hellas SA TqL + 30 210 8108460 |
Osterreich Pharmaxis Pharmaceuticals Limited Tel: + 44 (0) 1628 902121 |
|
Espaňa Medicare Pharma S.L.C Tel: +34 91 848 9534 |
Polska IMED Poland Sp. z o. o. Tel: +48 22 663 43 10 |
|
France Pharmaxis Pharmaceuticals Limited Tél: + 44 (0) 1628 902121 |
Portugal Pharmaxis Pharmaceuticals Limited Tel: + 44 (0) 1628 902121 |
|
Hrvatska PharmaSwiss d.o.o Tel: + 385(1)6311-833 |
Románia Pharmaxis Pharmaceuticals Limited Tel: + 44 (0) 1628 902121 |
{MM/RRRR}
Ireland
Cheisi Limited
Tel: + 44 (0)161 488 5555
Ísland
Pharmaxis Pharmaceuticals Limited Sími: +44 (0) 1628 902121
Italia
Pharmaxis Pharmaceuticals Limited Tel: + 44 (0) 1628 902121
Kúnpo^
Pharmaswiss Hellas SA TqL: + 30 210 8108460
Latvija
PharmaSwiss Latvia SIA Tel: + 371 67502185
Slovenija
PharmaSwiss d.o.o Tel: + 386 (0) 1 2364 700
Slovenská republika
4 Life Pharma SK, s.r.o.
Tel: + 420 244 403 003
Suomi/Finland
Pharmaxis Pharmaceuticals Limited Puh/Tel: + 44 (0) 1628 902121
Sverige
Pharmaxis Pharmaceuticals Limited Tel: + 44 (0) 1628 902121
United Kingdom
Cheisi Limited
Tel: + 44 (0)161 488 5555
Tato příbalová informace byla naposledy revidována
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu/. Na těchto stránkách naleznete též odkazy na další webové stránky, týkající se vzácných onemocnění a jejich léčby.
Jak se používá inhalátor
Níže je uveden nákres, který ukazuje, jak inhalátor vypadá. Kapsle bronchitolu mohou být užity pouze s inhalátorem, který je součástí balení.
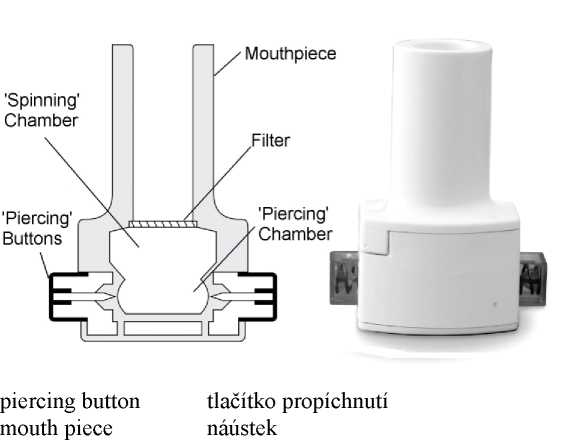
piercing chamber spinning chamber filter
děrovací komora otočná komora filtr
Inhalátor
V následujících krocích je vysvětleno, jak se inhalátor používá. Další pokyny k péči o inhalátor
naleznete na konci těchto instrukcí.
1. Sundejte víčko
- Držte inhalátor oběma rukama ve svislé
poloze a sundejte víčko.
2. Otevřete inhalátor
- Jednou rukou pevně držte spodní část inhalátoru.
- Měl(a) byste držet inhalátor podélně zespodu, abyste náhodou nestlačil(a) tlačítka propíchnutí.
- Poté jej otevřete pootočením náustku ve směru šipky na inhalátoru.
3. Vložte tobolku
- Nejprve se ujistěte, že máte suché ruce.
- Poté vyndejte tobolku z blistru (tobolku vyndávejte těsně před použitím).
- Vložte tobolku do místa ve tvaru tobolky na dně inhalátoru.
4. Zavřete inhalátor
- Držte inhalátor ve svislé poloze.
- Poté otočte náustek do uzavřené pozice - při uzavření uslyšíte cvaknutí.
5. Udělejte v tobolce otvor
- Tím se umožní, aby se prášek z tobolky uvolnil, když vdechnete. V této příbalové instrukci nazýváme tento krok „propíchnutí”.
- Držte inhalátor ve svislé poloze a zcela zmáčkněte obě tlačítka propíchnutí po stranách inhalátoru současně a poté je
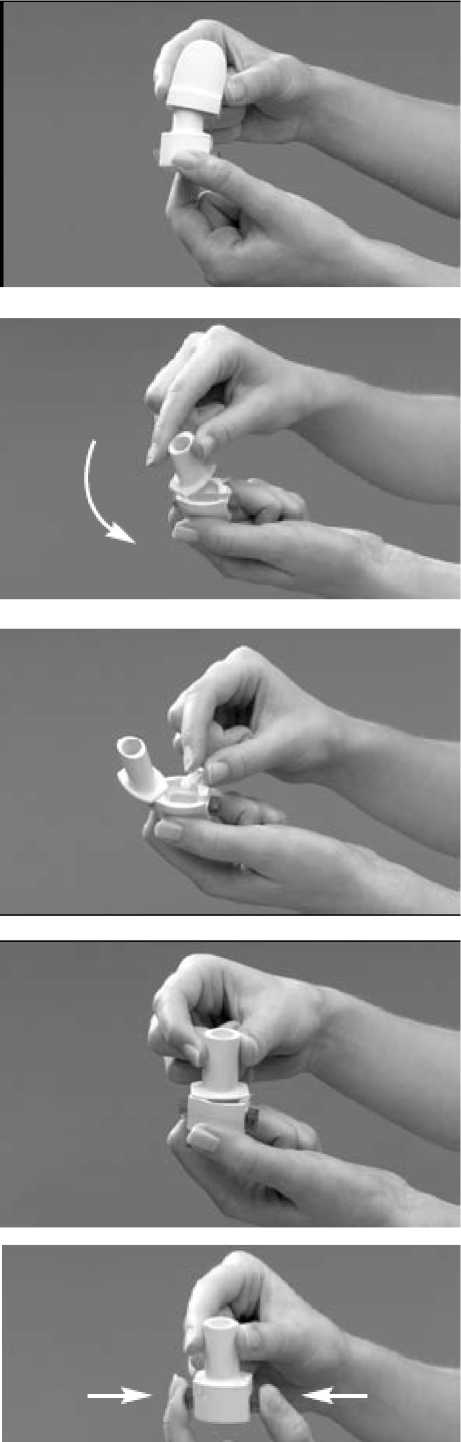
r
uvolněte. Proveďte to pouze jednou. Pokud byste tobolku propíchnul(a) více než jednou, mohla by se tobolka rozpůlit anebo rozpadnout.

Připravte se na inhalaci
Překlopte inhalátor tak, aby náustek směřoval mírně dolů.
To umožní, aby tobolka propadla vpřed do otočné komory.
Držte inhalátor skloněný a úplně vydechněte (stranou od inhalátoru).

7.
Inhalujte
Zakloňte hlavu mírně dozadu.
Držte inhalátor skloněný dolů, vložte jej do úst a těsně sevřete rty okolo náustku.
Plynule se zhluboka nadechněte, aby se Vám naplnily plíce - poté dech na 5 vteřin zadržte.
Při nadechování byste měli slyšet „hrkavý” zvuk, jak se tobolka otáčí v inhalátoru. Pokud zvuk neslyšíte, je možné, že se tobolka zasekla.
V takovém případě podržte inhalátor náustkem dolů a silně klepněte do dna. Nesnažte se tobolku uvolnit tím, že znovu zmáčknete tlačítka propichování. Zopakujte inhalaci, abyste užili svou dávku.
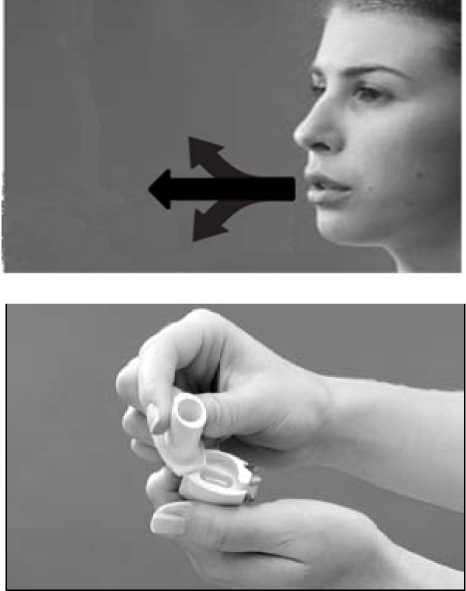
8. Vydechněte
- Vyndejte inhalátor z úst.
- Vydechněte, a poté opět normálně dýchejte.
9. Zkontrolujte tobolku
- Podívejte se, zda je tobolka prázdná - tobolka se musí v inhalátoru otáčet, aby se vyprázdnila. Jestliže se tobolka nevyprázdnila, budete muset zopakovat kroky 6 až 8.
10. Vyndejte použitou tobolku
- Obraťte inhalátor dnem vzhůru, klepněte na dno a vyhoďte prázdnou tobolku.
11. Zopakujte krok 3 až 10 s každou tobolkou
- Proveďte tyto kroky u každé z deseti tobolek.
- Abyste dosáhli s přípravkem Bronchitol optimálních výsledků, inhalujte tobolky jednu za druhou, bez přestávky.
Dodatečné informace o péči o inhalátor
- Udržujte inhalátor suchý a před použitím se vždy ujistěte, že máte suché ruce.
- Nikdy do inhalátoru nedýchejte, ani nekašlete.
- Nikdy inhalátor nerozebírejte.
- Nikdy nedávejte tobolku přímo do náustku inhalátoru.
- Nikdy nenechávejte použitou tobolku v komoře inhalátoru.
- Každý týden použijte nový inhalátor.
- Pokud se Vám inhalátor rozbije, použijte svůj druhý inhalátor a oznamte to svému lékaři.
Čištění inhalátoru - Inhalátor Vám bude obvykle dávat správnou dávku léčivého přípravku po 7 dní, aniž by bylo nutné jej čistit. Pokud však inhalátor potřebuje vyčistit, je nutné se řídit následujícími kroky:
1. Ujistěte se, že je inhalátor prázdný.
2. Umyjte inhalátor s otevřeným náustkem teplou vodou.
3. Třepejte s ním tak dlouho, až v něm nezbudou žádné velké kapky vody.
4. Nechte jej na vzduchu vyschnout - položte jej na bok a nechte náustek otevřený.
5. Musíte jej nechat úplně vyschnout, což může trvat až 24 hodin. Zatímco inhalátor schne, používejte svůj druhý inhalátor.
35