Breakyl 600 Mikrogramů
Sp.zn.sukls48894/2015 Sp.zn.sukls22584/2015, sukls80853/2014
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
BREAKYL 200 mikrogramů, bukální film BREAKYL 400 mikrogramů, bukální film BREAKYL 600 mikrogramů, bukální film BREAKYL 800 mikrogramů, bukální film
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Breakyl 200 mikrogramů, bukální film Jeden bukální film obsahuje:
fentanylum 200 mikrogramů (ve formě fentanyli citras).
Breakyl 400 mikrogramů, bukální film Jeden bukální film obsahuje:
fentanylum 400 mikrogramů (ve formě fentanyli citras).
Breakyl 600 mikrogramů, bukální film Jeden bukální film obsahuje:
fentanylum 600 mikrogramů (ve formě fentanyli citras).
Breakyl 800 mikrogramů, bukální film Jeden bukální film obsahuje:
fentanylum 800 mikrogramů (ve formě fentanyli citras). Pomocné látky se známým účinkem:
|
Pomocná látka/Breakyl, síla (v mikrogramech) |
200 |
400 |
600 |
800 |
|
propylenglykol (E1520) (mg) |
0.17 |
0.35 |
0.52 |
0.70 |
|
natrium-benzoát (E211) (mg) |
0.11 |
0.23 |
0.34 |
0.46 |
|
methylparaben (E218) (mg) |
0.12 |
0.24 |
0.36 |
0.48 |
|
propylparaben (E216) (mg) |
0.03 |
0.06 |
0.09 |
0.12 |
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Bukální film.
Přípravek Breakyl je rozpustný, obdélníkový, plochý, pružný bukální film s růžovou stranou a bílou stranou, který dodává fentanyl přímo do krevního oběhu. Růžová strana obsahuje léčivou látku fentanyl. Bílá strana minimalizuje uvolňování fentanylu do slin, aby se zabránilo polknutí léčivé látky.
Následující ilustrace ukazuje velikost dostupných sil přípravku Breakyl:


mikrogramů mikrogramů mikrogramů mikrogramů
0,78 cm2 1,56 cm2
2,34 cm2
3,11 cm2
(při elektronickém prohlížení se mohou rozměry zobrazit nesprávně).
Každý bukální film je samostatně zabalen v sáčku chráněném proti otevření dětmi.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Breakyl je indikován k léčbě pronikavé bolesti (breakthrough pain - BTP) u dospělých s nádorovým onemocněním, kteří již užívají udržovací terapii opioidy pro chronickou bolest při nádorovém onemocnění.
BTP je přechodná exacerbace bolesti, ke které dochází na pozadí jinak kontrolované perzistentní bolesti.
Pacienti užívající udržovací terapii opioidy jsou ti, kteří užívají nejméně 60 mg morfinu perorálně denně, nejméně 25 mikrogramů transdermálního fentanylu za hodinu, nejméně 30 mg oxykodonu denně, nejméně 8 mg hydromorfonu perorálně denně nebo ekvianalgetickou dávku jiného opioidu po dobu jednoho týdne nebo déle.
4.2 Dávkování a způsob podání
Léčbu má zahajovat lékař se zkušenostmi s terapií opioidy u pacientů s nádorovým onemocněním a měla by i nadále probíhat pod jeho dohledem. Aby se minimalizovala rizika nežádoucích účinků vyvolaných opioidy a určila „úspěšná“ dávka, je nezbytné, aby pacienti byli během titrace pečlivě monitorováni zdravotnickým personálem.
Jelikož úspěšná dávka přípravku Breakyl u pronikavé nádorové bolesti nemůže být předpovězena na základě denní udržovací dávky opioidů nebo jiné medikace proti pronikavé nádorové bolesti, musí být určena pomocí titrace dávky.
Titrace dávky
Před zahájením titrace dávky přípravku Breakyl u pacientů se předpokládá, že jejich trvalé bolesti jsou kontrolovány udržovacím podáváním opioidů. V případě, že u pacienta dochází k více než čtyřem atakám pronikavé bolesti denně, je třeba před zahájením procesu titrace dávky přípravku Breakyl zvážit zvýšení udržovací dávky opioidů.
Titrace pacientů převáděných z jiných přípravků obsahujících fentanyl
Kvůli odlišným absorpčním profilům se převádění nesmí provádět v poměru 1:1. Jestliže se přechází z jiného perorálního přípravku obsahujícího fentanyl-citrát, je nutná nezávislá titrace dávky přípravku
Breakyl, protože se biologická dostupnost jednotlivých přípravků významně liší (viz graf pod bodem 5.2).
Počáteční dávka
Počáteční dávka přípravku Breakyl má být 200 mikrogramů a je podle potřeby postupně navyšována v rozsahu dostupných sil (200, 400, 600, 800, 1200 mikrogramů). Postup titrace musí být pečlivě monitorován, dokud není dosaženo dávky poskytující adekvátní analgézii s přijatelnými nežádoucími účinky po jedné dávce během ataky pronikavé bolesti. To je definováno jako úspěšná dávka. Dávka přípravku Breakyl musí být podávána s odstupem nejméně 4 hodin.
K titraci dávky je k dispozici následující forma přípravku Breakyl:
Přípravek Breakyl 200 mikrogramů, bukální film.
Při použití přípravku Breakyl 200 mikrogramů, bukální film je možno dosáhnout vyšší dávky podáním kombinace bukálních filmů současně:
1 bukální film Breakylu 200 odpovídá dávce 200 mikrogramů
2 bukální filmy Breakylu 200 odpovídají dávce 400 mikrogramů
3 bukální filmy Breakylu 200 odpovídají dávce 600 mikrogramů
4 bukální filmy Breakylu 200 odpovídají dávce 800 mikrogramů
Pokud se po podání určité síly dávky dosáhne adekvátní úlevy od bolesti, následující ataky pronikavé bolesti mají být léčeny touto dávkou přípravku Breakyl.
Pokud není dosaženo adekvátní úlevy od bolesti do 30 minut po podání určité dávky přípravku Breakyl a pacient příslušnou dávku snášel, následující ataky pronikavé bolesti mají být léčeny následující vyšší dávkou přípravku Breakyl.
Pokud není dosaženo adekvátní úlevy od bolesti do 30 minut po podání bukálního filmu o síle 1200 mikrogramů přípravku Breakyl (nejvyšší dostupná síla), pacient má s lékařem probrat možnosti léčby. Během titrace je možné použít kombinaci nižších dávek bukálních filmů k dosažení následující vyšší dávky. Kombinované použití dávek celkově převyšujících 1200 mikrogramů nebylo hodnoceno za kontrolovaných podmínek.
V průběhu jakékoli ataky pronikavé bolesti, kdy není dosaženo adekvátní úlevy od bolesti během 30 minut po podání bukálního filmu přípravku Breakyl, pacient může použít záchrannou medikaci ke zvládnutí pronikavé bolesti, jestliže jej tak instruoval lékař. Opiodní záchranná medikace by však neměla být použita v případě, že došlo k nepřijatelným nežádoucím účinkům při použití přípravku Breakyl nebo projevům toxicity související s opioidy.
Titrace dávky - podrobnosti viz předchozí text

Přípravek BREAKYL je dostupný ve 4 silách: 200, 400, 600, 800_
Mezi jednotlivými dávkami přípravku BREAKYL musí být odstup nejméně 4 hodin. Během každé ataky pronikavé bolesti, není-li dosaženo adekvátní úlevy od bolesti do 30 minut po podání, pacient může použít záchrannou medikaci dle instrukcí lékaře.
Udržovací léčba
Jakmile byla během titrace stanovena účinná dávka, použití přípravku Breakyl je omezeno na čtyři či méně atak pronikavé bolesti denně, vždy s odstupem nejméně 4 hodin. Během jedné ataky lze přípravek Breakyl použít pouze jednou.
Znovunastavení dávky
K tomu, aby bylo nadále dosaženo adekvátní úlevy od pronikavé bolesti, může být nutné u některých pacientů znovunastavení dávky přípravku Breakyl nebo udržovací (celodenní) opiodní analgézie. Zvýšení celodenní dávky opioidů k léčbě trvalé bolesti má být zváženo u pacientů, u nichž dochází k více než čtyřem atakám pronikavé bolesti denně během více než čtyř po sobě jdoucích dnů. Pokud se zvýší dávka dlouhodobě působících opioidů může být nutná úprava dávky přípravku Breakyl k léčbě pronikavé bolesti. Je nezbytné, aby opětovná titrace dávky jakéhokoli analgetika byla monitorována lékařem.
Vysazení léčby
Pokud u pacienta již nedochází k epizodám akutních atak bolesti, přípravek Breakyl je třeba ihned vysadit. Léčba přetrvávající základní bolesti má být zachována tak, jak je předepsána.
Pokud je potřeba vysadit veškerou léčbu opioidy, musí lékař pacienta pečlivě sledovat a řešit riziko náhlých příznaků z vysazení.
Způsob podání Pacient má
• otevřít sáček s přípravkem Breakyl těsně před použitím dle pokynů vytištěných na sáčku,
• jazykem navlhčit vnitřní stranu tváře nebo vypláchnout si ústa vodou ke zvlhčení místa, kam bude přípravek Breakyl umístěn
• suchýma rukama uchopit bukální film přípravku Breakyl mezi ukazováček a palec s růžovou stranou směrem k palci,
• umístit bukální film přípravku Breakyl do ústní dutiny tak, aby růžová strana jemně přiléhala ke sliznici uvnitř tváře,
• stlačit film a držet jej na místě nejméně 5 vteřin, dokud pevně nepřilne, poté má být viditelná bílá strana.
(Pozn.: následující odrážka se týká pouze přípravku Breakyl 200 mikrogramů, bukální film)
• Při aplikaci více než jednoho bukálního filmu naráz se pacient musí ujistit, že každý film pevně přilnul ke sliznici. Aby se zabránilo překrytí, je možné filmy aplikovat na obě strany, levou i pravou sliznici tváře.
Přípravek Breakyl bukální film má poté sám držet na místě. Po uplynutí 5 minut je možno pít tekutiny.
Přípravek Breakyl bukální film se obvykle zcela rozpustí během 15 až 30 minut po aplikaci. V ojedinělých případech může rozpuštění trvat i déle než 30 minut, absorpce fentanylu tím však není ovlivněna. Pacient má být poučen, aby nemanipuloval bukálním filmem pomocí jazyka či prstu(ů) a aby nekonzumoval potraviny, dokud se film zcela nerozpustí.
Pokud by se bukální film přípravku Breakyl rozžvýkal a spolknul, mohlo by být dosaženo nižších maximálních koncentrací a nižší biologické dostupnosti než při použití v souladu s pokyny (viz bod 5.2).
Pediatrická populace
Bezpečnost a účinnost přípravku Breakyl u dětí ve věku od 0 do 18 let nebyla stanovena.
Nejsou dostupné žádné údaje.
Použití u starších pacientů
Bylo zjištěno, že starší pacienti jsou citlivější vůči účinkům fentanylu podávaného intravenózně v porovnání s mladší populací. U starších pacientů je pomalejší eliminace fentanylu a delší terminální poločas, což může vést ke kumulaci léčivé látky a vyššímu riziku nežádoucích účinků. Proto je nutno k titraci dávky přistupovat se zvláštní opatrností. V klinických studiích však nebyl zaznamenán rozdíl ve střední titrované dávce přípravku Breakyl u pacientů ve věku 65 let a starších v porovnání s pacienty mladšími než 65 let.
Použití u zvláštních skupin pacientů
Speciální péče má být věnována titraci dávky u pacientů s renální či jaterní dysfunkcí.
Pacienti s mukozitidou 1. stupně mají být pečlivě monitorováni, může být nutná úprava dávkování. Účinnost a bezpečnost přípravku Breakyl u pacientů s mukozitidou vyššího stupně nebyla hodnocena.
Bukální film nesmí být použit, jestliže byl sáček před otevřením poškozen.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku fentanyl nebo na kteroukoliv pomocnou látku uvedenou v bodě 6.1.
Souběžné použití inhibitorů monoaminooxidázy (MAO) nebo období 2 týdnů po vysazení léčby inhibitory monoaminooxidázy (viz také bod 4.5).
Závažná respirační deprese nebo závažná obstrukční plicní onemocnění.
Pacienti bez udržovací léčby opioidy (viz bod 4.1), protože zde existuje zvýšené riziko respirační deprese.
Léčba jiné akutní bolesti, než bolesti průlomové.
4.4 Zvláštní upozornění a opatření pro použití
Pacienti a jejich pečovatelé musí být informováni, že přípravek Breakyl obsahuje léčivou látku v množství, které může být pro dítě fatální, a proto je nutné uchovávat přípravek Breakyl po celou dobu vždy mimo dohled a dosah dětí a lidí, kteří nepoužívají tento lék.
Pro minimalizaci rizik nežádoucích účinků souvisejících s opioidy a pro rozpoznání účinné dávky je naprosto nevyhnutelné, aby zdravotnický personál pacienty během titrace pečlivě sledoval.
Je důležité, aby se stabilizovala léčba dlouhodobě působícími opioidy užívaná k léčbě perzistentní bolesti pacienta dříve, než bude zahájena terapie přípravkem Breakyl.
Respirační deprese
Existuje riziko klinicky významné respirační deprese v souvislosti s podáním fentanylu. Zvláštní pozornosti je zapotřebí při titraci přípravku Breakyl u pacientů s nezávazným chronickým obstrukčním plicním onemocněním nebo jinými zdravotními obtížemi, které je predisponují k respirační depresi, protože i normální terapeutické dávky přípravku Breakyl mohou dále snižovat respirační úsilí až do bodu respiračního selhání.
Zvýšený nitrolební tlak
Přípravek Breakyl se má podávat pouze za zvýšené opatrnosti u pacientů, kteří mohou být zvláště citliví na intrakraniální účinky retence CO2, například u pacientů s prokazatelně zvýšeným intrakraniálním tlakem nebo s poruchou vědomí.
U pacientů s poraněním hlavy mohou opioidy zastírat klinický průběh a mají se používat pouze tehdy, je-li to klinicky oprávněné.
Srdeční onemocnění
Fentanyl může vyvolat bradykardii. Proto má být fentanyl používán s opatrností u pacientů s předchozí nebo přetrvávající bradykardií..
Je nutné pečlivě zvážit podání pacientům s hypovolémií a hypotenzí.
Porucha funkce ledvin nebo jater
Dále má být přípravek Breakyl podáván s opatrností pacientům s renální či jaterní dysfunkcí. Vliv poruchy funkce jater a ledvin na farmakokinetiku léčivého přípravku nebyl hodnocen. Při intravenózním podání se ovšem ukázalo, že se clearance fentanylu změnila u poruchy funkce jater a ledvin kvůli změnám v metabolické clearance a plazmových proteinech.
Po podání přípravku Breakyl může porucha funkce jater a ledvin zvýšit biologickou dostupnost fentanylu i snížit jeho systémovou clearance, což by mohlo vést ke zvýšení a prodloužení účinku opioidů. Proto je zapotřebí
zvláštní opatrnost během titrace u pacientů se středně těžkým nebo těžkým poškozením j ater nebo ledvin.
Serotoninový syndrom
Opatrnost se doporučuje při současném podání přípravku Breakyl s léčivými přípravky, které ovlivňují serotonergní neurotransmiterové systémy.
K vývoji potenciálně život ohrožujícího serotoninového syndromu může dojít při současném užití se serotonergními léčivými přípravky, jako jsou selektivní inhibitory zpětného vychytávání serotoninu (SSRI) a inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI) a s léčivými přípravky, které ovlivňují metabolismus serotoninu (včetně inhibitorů monoaminooxidázy [IMAO]). K tomu může dojít v rámci doporučeného dávkování.
Serotoninový syndrom může zahrnovat změny duševního stavu (např. agitovanost, halucinace, koma), nestabilitu autonomního systému (např. tachykardie, kolísání krevního tlaku, hypertermie), neuromuskulámí abnormality (např. hyperreflexie, porucha koordinace, rigidita), a/nebo gastrointestinální symptomy (např. nauzea, zvracení, průjem).
V případě podezření na serotoninový syndrom je nutno ukončit léčbu přípravkem Breakyl.
Tolerance, závislost
Při opakovaném podávání opioidů, jako je například fentanyl, se může rozvinout tolerance a fyzická a/nebo psychická závislost. Nicméně iatrogenní závislost po terapeutickém použití opioidů je vzácná.
Sportovci by měli být informováni, že léčba fentanylem může vyvolat pozitivní výsledek antidopingových testů.
Přípravek Breakyl obsahuje natrium-benzoát, methylparaben, propylparaben a propylenglykol. Natrium-benzoát je mírně dráždivý pro pokožku, oči a sliznice. Methylparaben a propylparaben mohou vyvolat alergické reakce (někdy i pozdní). Propylenglykol může vyvolat podráždění kůže.
Pacienti s mukozitidou 1. stupně mají být pečlivě monitorováni, může být nutná úprava dávkování. Účinnost a bezpečnost přípravku Breakyl u pacientů s mukozitidou vyššího stupně nebyla hodnocena.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Používání přípravku Breakyl se nedoporučuje u pacientů, kteří užívají nebo během posledních 14 dnů užívali inhibitory monoaminooxidázy (MAO), protože se může objevit závažná a nepředvídatelná potenciace opioidních analgetik inhibitory MAO (viz bod 4.3).
Serotonergní léky
Souběžné podávání fentanylu se serotonergní látkou, jako je inhibitor zpětného vychytávání serotoninu (SSRI), inhibitor zpětného vychytávání serotoninu a noradrenalinu (SNRI) nebo inhibitory monoaminooxidázy (IMAO) (viz bod 4.3), může zvýšit riziko serotoninového syndromu, což je potenciálně život ohrožující stav.
Fentanyl je metabolizován hlavně systémem isoenzymu CYP3A4 v játrech a střevní sliznici (viz také bod 5.2). Inhibitory CYP3A4 jako:
• makrolidová antibiotika (např. erytromycin, klaritromycin, telitromycin)
• azolová antimykotika (např. ketokonazol, itrakonazol, flukonazol)
• některé inhibitory proteázy (např. ritonavir, indinavir, nelfinavir, sachinavir)
• blokátory kalciových kanálů (např. diltiazem nebo verapamil)
• antiemetika (např. aprepitant nebo dronabinol)
• antidepresiva (např. fluoxetin)
• antacida (např. cimetidin)
mohou zvýšit biologickou dostupnost polknutého fentanylu a mohou snížit jeho systémovou clearance, což může vést ke zvýšení či prodloužení opiodních účinků a k potenciálně fatální respirační depresi. Podobné účinky mohou být pozorovány po souběžné konzumaci grapefruitové šťávy, která je známým inhibitorem CYP3A4. Je tedy nutná opatrnost při podávání fentanylu současně s inhibitory CYP3A4. Pacienti léčení přípravkem Breakyl, kteří zahajují léčbu nebo se jim zvyšuje dávka inhibitorů CYP3A4 mají být dlouhodobě pečlivě sledováni z hlediska projevů toxicity opiodů.
Souběžné použití přípravku Breakyl se silnými induktory CYP3A4 jako
• barbituráty a další sedativa (např. fenobarbital)
• antiepileptiky (např. karbamazepin, fenytoin, oxkarbazepin)
• některá antivirotika (např. efavirenz, nevirapin)
• antiflogistika či imunosupresiva (např. glukokortikoidy)
• antidiabetika (např. pioglitazon)
• antibiotika k léčbě tuberkulózy (např. rifabutin, rifampicin)
• psychotropní látky (např. modafinil)
• antidepresiva (např. Třezalka tečkovaná)
může vést ke snížení plazmatických koncentrací fentanylu, což může snížit účinnost přípravku Breakyl. Pacienti léčení přípravkem Breakyl, kteří ukončili léčbu nebo se jim sníží dávka induktorů CYP3A4, mají být sledováni z hlediska projevů zvýšené aktivity přípravku Breakyl či jeho toxicity a dávka přípravku Breakyl má být adekvátně upravena.
Současné podávaní jiných látek tlumících centrální nervový systém včetně jiných opioidů, sedativ nebo hypnotik, celkových anestetik, fenothiazinů, trankvilizérů, myorelaxancií, sedativních antihistaminik a alkoholu může produkovat aditivní depresivní účinky.
Není doporučeno současné užívání parciálních opioidních agonistů/antagonistů (např. buprenorfinu, nalbufinu, pentazocinu). Mají vysokou afinitu k opioidním receptorům s relativně nízkou vlastní aktivitou, a proto působí zčásti antagonisticky proti analgetickému účinku fentanylu a u pacientů se závislostí na opioidech mohou navozovat příznaky z vysazení.
4.6 Fertilita, těhotenství a kojení
O použití fentanylu u těhotných žen nejsou k dispozici příslušné údaje. Studie se zvířaty prokázaly reprodukční toxicitu (viz bod 5.3). Potenciální riziko pro člověka není známé. Fentanyl nemá být podáván v těhotenství, pokud to není nezbytně nutné.
Po dlouhodobém podávání může fentanyl způsobovat abstinenční příznaky u novorozenců. Nedoporučuje se používat fentanyl na začátku porodu a během něj (včetně císařského řezu), protože fentanyl prochází placentou a může u plodu vyvolat respirační depresi. Pokud se přípravek Breakyl bude podávat, mělo by být pro dítě snadno dostupné antidotum.
Kojení
Fentanyl přechází do mateřského mléka a u kojeného dítěte může působit sedativně nebo vyvolat respirační depresi. Kojící ženy nemají fentanyl užívat a kojení se má znovu zahájit nejdříve za 5 dní po posledním podání fentanylu.
Fertilita
Nejsou k dispozici žádné klinické údaje týkající se fertility. Ve studiích na zvířatech byla při sedativních dávkách mužská i ženská fertilita narušena (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit a obsluhovat stroje nebyly provedeny.
Opioidní analgetika však zhoršují mentální a/nebo fyzickou schopnost požadovanou pro provádění potenciálně nebezpečných úkolů (např. řízení vozidla nebo obsluha stroje). Pacienti musí být poučeni, aby při používání přípravku Breakyl neřídili ani neobsluhovali stroje, pokud budou cítit somnolenci, závratě, rozmazané či zdvojené vidění.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
U přípravku Breakyl lze očekávat typické nežádoucí účinky opioidů. S pokračujícím používáním léčivého přípravku jejich intenzita často klesá či mizí s tím, jak je pacient titrován na nejvhodnější dávku. Ovšem nejzávažnějšími nežádoucími účinky spojenými se všemi opioidy včetně přípravku Breakyl jsou respirační deprese (potenciálně vedoucí k respirační zástavě), oběhová deprese, hypotenze a šok a všichni pacienti by proto měli být pečlivě sledováni.
Jelikož klinické studie přípravku Breakyl byly navrženy tak, aby hodnotily bezpečnost a účinnost u pacientů s pronikavou bolestí v důsledku nádorového onemocnění, všichni pacienti rovněž užívali k léčbě perzistentní bolesti souběžně opioidy, například morfin s řízeným uvolňováním, oxykodon s řízeným uvolňováním nebo transdermální fentanyl. Proto není možné s konečnou platností oddělit účinky samotného přípravku Breakyl.
Zde uváděné údaje o nežádoucích účincích odráží jednak současné zkušenosti s přípravkem Breakyl u pronikavé bolesti používaným současně s opioidy proti trvalé bolesti a jednak nežádoucí účinky uvedené jako velmi vzácné, které byly dříve spojovány s látkou fentanyl, ale nebyly dosud zaznamenány během klinických studií s přípravkem Breakyl. Nebyla provedena korekce na základě souběžného použití jiných opioidů, délky terapie přípravkem Breakyl nebo symptomů spojených s nádorovým onemocněním.
Nejčastěji hlášenými nežádoucími účinky byly nauzea, somnolence a závrať.
Tabulkový přehled nežádoucích účinků
Nežádoucí účinky jsou uváděny dle následujících frekvencí výskytu: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (> 1/1000 až < 1/100), vzácné (>1/10 000 až <1/1000), velmi vzácné (<1/10 000) nebo není známo (z dostupných údajů nelze určit).
Následující nežádoucí účinky byly považovány za přinejmenším možná související s léčbou:
|
Třída orgánových systémů |
Časté |
Méně časté |
Velmi vzácné nebo není r # známo |
|
Poruchy metabolismu a výživy | |||
|
Psychiatrické poruchy |
Stavy zmatenosti |
Úzkost, halucinace, deziluze, abnormální sny, nervozita, insomnie, neklid |
Abnormální myšlení, depersonalizace, deprese, emoční labilita, euforie |
|
Poruchy nervového systému |
Somnolence, závratě, bolesti hlavy, sedace |
Dysgeusie, letargie, amnézie, kognitivní poruchy |
Myoklonus, parestezie (včetně hyperestezie/cirkumorální parestezie), abnormální chůze/nekoordinovanost, křeče |
|
Poruchy oka |
Abnormální vidění (rozmazané, diplopie) | ||
|
Cévní poruchy |
Nával horka |
Vasodilatace | |
|
Respirační, hrudní a mediastinální poruchy |
Respirační deprese, překrvení vedlejší nosní dutiny |
|
Gastrointestinální poruchy |
Průjem, stomatitida, krvácení z dásně, dyspepsie, vřed úst, bolest úst, odynofagie |
Bolest břicha, flatulence, zvětšené | |
|
Poruchy kůže a podkožní tkáně |
Pruritus |
Hyperhidróza, zvýšené sklony k tvorbě modřin | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně Méně časté: |
Svalové fascikulace, artralgie, svalová slabost, muskuloskeletální bolest, bolest v končetine, bolest v čelisti | ||
|
Poruchy ledvin a močových cest |
Močová inkontinence |
Retence moči | |
|
Celkové poruchy a reakce v místě aplikace |
Únava |
Astenie, třesavka, pyrexie, žízeň |
Malátnost, periferní edém, syndrom z vysazení léku* |
|
Vyšetření |
Zvýšení krevního tlaku | ||
|
Poranění, otravy a procedurální komplikace |
Náhodný úraz (např. pády) |
není známo: syndrom z vysazení léku
u transmukózního fentanylu byly pozorovány příznaky z vysazení opioidů jako nauzea, zvracení, průjem, úzkost, zimnice, třes a pocení
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí přímo na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: http: //www .sukl. cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Symptomy
Očekává se, že příznaky předávkování fentanylem nebo příznaky toxicity budou svojí povahou podobné příznakům u intravenózně podávaného fentanylu a jiných opioidů, a jsou rozšířením jeho farmakologických účinků, přičemž respirační deprese je nejzávažnějším příznakem. Dalšími příznaky
mohou být hluboká sedace, kóma, bradykardie, hypotonie, hypotermie, snížený svalový tonus, ataxie, křeče a mióza.
Léčba
Ke zvládnutí respirační deprese je třeba zahájit okamžitá protiopatření. Mezi ně patří odstranění jakéhokoli filmu přípravku Breakyl, je-li ještě v ústech, fyzickou a verbální stimulaci pacienta, zhodnocení úrovně vědomí a stavu ventilace a oběhu. Pokud to vyžaduje klinická situace, je třeba zajistit a udržovat průchodnost dýchacích cest (např. za použití ústního vzduchovodu či endotracheální intubace), dle potřeby je nutno podávat kyslík a zavést podpůrnou či řízenou ventilaci.
Je nutné získat intravenózní přístup a podávat podle klinické indikace naloxon nebo jiné antagonisty opioidů.
Doba trvání respirační deprese po předávkování může být delší než účinky působení antagonisty opioidů (např. poločas naloxonu se pohybuje v rozmezí 30 až 81 minut) a může být nezbytné opakované podání nebo kontinuální infuze naloxonu či jiného antagonisty opioidů.
Zvrat narkotického účinku může vyvolat akutní nástup bolesti a uvolnění katecholaminů. U pacientů léčených opioidy, je používání naloxonu nebo jiného antagonisty opioidů spojeno s rizikem vyvolání akutního abstinenčního syndromu.
Dále je nutné udržovat adekvátní tělesnou teplotu a zajistit příjem tekutin. Jestliže dojde k závažné či přetrvávající hypotenzi, tato může vzniknout v důsledku hypovolémie. Tento stav by měl být adekvátně léčen infuzní terapií. Při případném výskytu svalové ztuhlosti je zapotřebí léčba pomocí asistované ventilace, podáním antagonisty opioidů a v poslední řadě podáním látky blokující neuromuskulární převod.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: analgetika; opioidy, deriváty fenylpiperidinu;
ATC kód: N02AB03
Fentanyl je čistě opioidní agonista, který převážně interaguje s opioidním ^-receptorem v mozku, míše a hladkých svalech. Primárním místem jeho působení je centrální nervový systém (CNS). Klinicky nejvýznamnějším farmakologickým účinkem interakce fentanylu s opioidním ^-receptorem je analgézie.
U pacientů s chronickou nádorovou bolestí na stabilních dávkách pravidelně podávaných opioidů ke kontrole trvalé bolesti přípravek Breakyl signifikantně snižuje intenzitu bolesti hodnocenou jako součet rozdílů v intenzitě bolesti (SPID) v porovnání s placebem za 15, 30, 45, 60 minut po podání.
Analgetické účinky fentanylu souvisí s hladinou léčivé látky v krvi, je-li zajištěn správný příjem pro dobu zdržení do a z CNS (proces s poločasem 3 - 5 minut). U osob dosud neléčených opioidy dochází k analgézii při krevních hladinách 1 až 2 ng/ml, zatímco krevní hladiny 10-20 ng/ml by vyvolaly chirurgickou anestezii a hlubokou respirační depresi.
Sekundárními účinky jsou mióza, zvýšení tonu a snížení kontrakcí gastrointestinálního hladkého svalstva, což vede k prodloužení doby průchodu gastrointestinálním traktem a může být důvodem, proč opioidy vyvolávají zácpu.
Ačkoli opioidy obecně zvyšují tonus hladkého svalstva močových cest, celkový účinek má sklony k variabilitě, v některých případech vyvolává nucení na močení, jindy zase problémy s močením.
Všechny agonisté opioidního p-receptoru včetně fentanylu vyvolávají respirační depresi závislou na dávce. Riziko respirační deprese je nižší u pacientů na chronické terapii opioidy, u nichž se rozvine tolerance vůči respirační depresi a dalším účinkům opioidů.
5.2 Farmakokinetické vlastnosti
Obecný úvod
Fentanyl je vysoce lipofilní a může se velmi rychle absorbovat ústní sliznicí a pomaleji konvenční gastrointestinální cestou. Fentanyl podléhá metabolismu prvního průchodu v játrech a střevnímu metabolismu a jeho metabolity se nepodílejí na terapeutickém účinku fentanylu.
Absorpce
Ve farmakokinetické studii byl přípravek Breakyl po bukální aplikaci rychle absorbován a jeho absolutní biologická dostupnost byla 71 %. Tato studie absolutní biologické dostupnosti též prokázala podobnou farmakokinetiku u podskupiny 6 dospělých zdravých dobrovolníků a 6 dospělých zdravých dobrovolnic.
Absorpční farmakokinetika fentanylu z přípravku Breakyl je kombinací úvodní rychlé absorpce z bukální sliznice a dlouhodobější absorpce polknutého fentanylu z GI traktu. Na základě studie absolutní biologické dostupnosti je přibližně 51 % celkové dávky přípravku Breakyl rychle absorbováno z bukální sliznice a stává se systémově dostupnou. Zbývající 49 % celkové dávky přípravku se polkne se slinami, a poté se pomalu vstřebává z GI traktu. Asi 1/3 tohoto množství (20 % celkové dávky) obchází jaterní a střevní metabolismus prvního průchodu a stává se systémově dostupným. Tudíž zaznamenaná 71 % absolutní biologická dostupnost přípravku Breakyl se dělí mezi rychlou transmukózní a pomalejší GI absorpci. Jednotková dávka přípravku Breakyl, bude-li rozkousána a polknuta, pravděpodobně vyvolá nižší maximální koncentrace a pomalej ší biologickou dostupnost než po aplikaci dle pokynů.
Byla prokázána linearita dávky v dostupném rozmezí dávkování (200 až 1200 mikrogramů) přípravku Breakyl. Po použití jednoho bukálního filmu přípravku Breakyl (200 až 1200 mikrogramů) se průměrná Cmax obvykle pohybuje od 0,38 do 2,19 ng/ml (v závislosti na dávce) a Tmax se pohybuje od 45 do 240 minut (medián 60 minut). Aplikace přípravku Breakyl na aktivní místo mukozitidy (1. stupně) ve skupině onkologických pacientů byla spojena se snížením Cmax a AUCinf. Doporučuje se, aby pacienti s mukozitidou 1. stupně byli pečlivě sledování a může být uvažováno o snížení dávky. Účinnost a bezpečnost přípravku Breakyl u pacientů s mukozitidou závažnějšího stupně nebyla hodnocena.
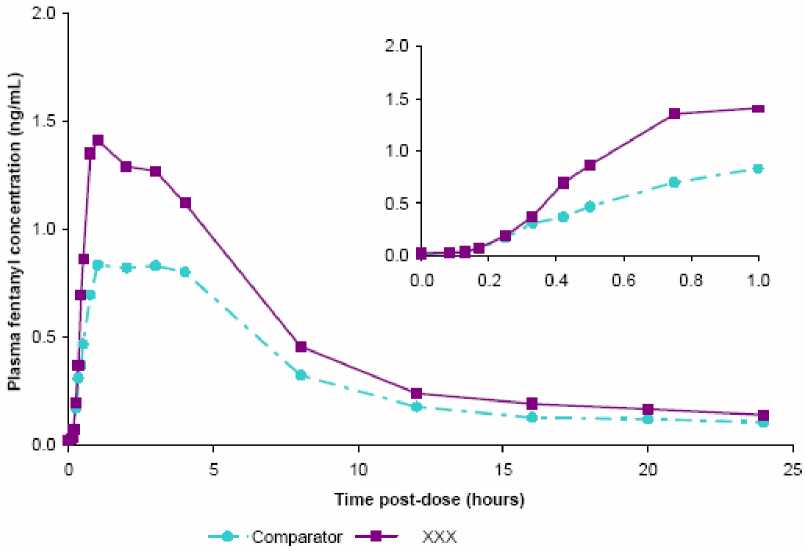
Průměrné plazmatické koncentrace fentanylu v plazmě versus časové profily (24 hodin a pouze 1. hodina) po jedné dávce 800 ^g přípravku BREAKYLu (XXX) nebo 800 ^g referenčního přípravku (comparator) (fentanyl s oromukózním aplikátorem) u zdravých dospělých subjektů
Vysvětlivky: osa y - Plazmatické koncentrace fentanylu (ng/ml), osa x - Čas po podání dávky (hodin) Distribuce
Fentanyl je vysoce lipofilní. Údaje získané na zvířatech ukazují, že po absorpci je fentanyl rychle distribuován do mozku, srdce, plic, ledvin a sleziny, načež následuje pomalejší re-distribuce do svalů a tukové tkáně. Vazba fentanylu na plazmatické proteiny činí 80 až 85%. Hlavním vazebním proteinem je alfa-1-acidoglykoprotein, ale do určité míry přispívá jak albumin, tak lipoproteiny. S acidózou roste volná frakce fentanylu. Průměrný distribuční objem v ustáleném stavu (Vss) je 4 l/kg.
Biotransformace
Fentanyl je metabolizován v játrech a ve střevní sliznici na norfentanyl prostřednictvím cytochromu P450, izoformou CYP3A4. Norfentanyl nebyl ve studiích se zvířaty farmakologicky aktivní. Fentanyl se primárně (z více než 90 %) eliminuje biotransformací na N-dealkylované a hydroxylované neaktivní metabolity.
Eliminace
Méně než 7 % podané dávky je vylučováno bez změny močí a pouze asi 1 % se vylučuje nezměněné stolicí. Metabolity se vylučují hlavně močí, zatímco exkrece stolicí je méně důležitá. Celková clearance fentanylu v plazmě je 0,5 l/hod/kg (rozmezí 0,3 až 0,7 l/hod/kg). Klinicky relevantní poločas fentanylu po podání přípravku Breakyl je přibližně 7 hodin a terminální eliminační poločas je asi 14 hodin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity a karcinogenity neodhalily žádné zvláštní riziko pro člověka.
Studie embryo-fetální vývojové toxicity provedené na potkanech a králících nezjistily žádné malformace či vývojové odchylky podáváním během organogeneze.
Ve studii fertility a časného embryonálního vývoje u potkanů byl při vysokých dávkách (300 mcg/kg/den) zaznamenán účinek zprostředkovaný samcem, který je konzistentní se sedativními účinky fentanylu ve studiích na zvířatech. Ve studiích prenatálního a postnatálního vývoje u potkanů byla míra přežití potomstva signifikantně snížena při dávkách, které vedly k závažné toxicitě pro matku. Dalšími nálezy u mláďat F1 generace při dávkách toxických pro matku byly opožděný fyzický vývoj, vývoj senzorických funkcí, reflexů a chování. Tyto účinky by mohly představovat buď nepřímé účinky změny mateřské péče a/nebo snížené míry kojení, nebo přímý účinek fentanylu na mláďata.
Studie karcinogenity (26 týdenní dermální alternativní biologické zkoušky na Tg.AC transgenních myších, dvouletá studie subkutánní karcinogenity u potkanů) nevedly k žádným nálezům svědčícím o onkogenním potenciálu. Hodnocení vzorků mozku ze studie u potkanů odhalilo mozkové léze u zvířat, kterým byly podávány vysoké dávky fentanyl citrátu. Význam těchto nálezů pro člověka není známý.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Aktivní vrstva: propylenglykol (E1520) natrium-benzoát (E211) methylparaben (E218) propylparaben (E216) červený oxid železitý (E172) kyselina citronová tokoferol-alfa-acetát dihydrogenfosforečnan sodný hydroxid sodný forforečnan sodný polykarbofil hyprolosa hyetylosa
sodná sůl karmelosy
Zadní vrstva: natrium-benzoát (E211) methylparaben (E218) propylparaben (E216) kyselina citronová tokoferol-alfa-acetát hyprolosa hyetylosa
oxid titaničitý (E171) dihydrát sodné soli sacharinu silice máty peprné
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 30°C.
Neuchovávejte v chladničce.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
6.5 Druh obalu a obsah balení
Každý bukální film je samostatně balen v sáčku chráněném před otevřením dětmi z polyakrylonitrilu/aluminia/polyetylentereftalátu (PET)/papírového laminátu.
BREAKYL 200, 400, 600 a 800 mikrogramů:
Krabička obsahující 4, 10 nebo 28 sáčků s jedním bukálním filmem.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Všechen nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
MEDA Pharma s.r.o.
Kodaňská 1441/46 100 00 Praha 10
8. REGISTRAČNÍ ČÍSLO(A)
BREAKYL 200 mikrogramů: 65/382/11-C BREAKYL 400 mikrogramů: 65/383/11-C BREAKYL 600 mikrogramů: 65/384/11-C BREAKYL 800 mikrogramů: 65/385/11-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 8.6.2011
Datum posledního prodloužení registrace: 8.4.2013
10. DATUM REVIZE TEXTU
26.3.2015
1 5/15