Bravecto Stř. Kočky (>2,8-6,25 Kg), 250 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Bravecto 112, 5 mg žvýkací tablety pro velmi malé psy (2-4,5 kg) Bravecto 250 mg žvýkací tablety pro malé psy (>4,5-10 kg) Bravecto 500 mg žvýkací tablety pro střední psy (>10-20 kg) Bravecto 1000 mg žvýkací tablety pro velké psy (>20-40 kg) Bravecto 1400 mg žvýkací tablety pro extra velké psy (>40-56 kg)
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky:
Každá žvýkací tableta obsahuje:
|
Bravecto žvýkací tablety |
Fluralanerum (mg) |
|
Velmi malí psi (2-4,5 kg) |
112,5 |
|
Malí psi (>4,5-10 kg) |
250 |
|
Střední psi (>10-20 kg) |
500 |
|
Velcí psi (>20-40 kg) |
1000 |
|
Extra velcí psi (>40-56 kg) |
1400 |
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Žvýkací tablety.
Světle hnědé až hnědé kulaté tablety s hladkým nebo mírně drsným povrchem, se zřetelným mramorováním, flíčky nebo oběma.
4. KLINICKÉ ÚDAJE
4.1 Cílové druhy zvířat
Psi
4.2 Indikace s upřesněním pro cílový druh zvířat
Léčba infestace klíšťaty a blechami u psů.
Veterinární léčivý přípravek má systémový insekticidní a akaricidní účinek poskytující
- okamžitý a trvalý usmrcující účinek na blechy (Ctenocephalides felis) trvající 12 týdnů
- okamžitý a trvalý usmrcující účinek na klíšťata (Ixodes ricinus, Dermacentor reticulatus
a D. variabilis) trvající 12 týdnů
- okamžitý a trvalý usmrcující účinek na klíště (Rhipicephalus sanguineus) trvající 8 týdnů.
Blechy a klíšťata jsou vystaveny působení účinné látky okamžitě po kousnutí nebo přisátí na hostitele, kdy přijdou do kontaktu s tělními tekutinami. K nástupu účinku dochází u blech (C. felis) do 8 hodin a u klíšťat (I. ricinus) do 12 hodin po uchycení.
Přípravek může být použit jako součást léčebné strategie alergické dermatitidy způsobené bleším kousnutím (FAD).
4.3 Kontraindikace
Nepoužívat v případě přecitlivělosti na léčivé látky, nebo na některou z pomocných látek.
4.4 Zvláštní upozornění pro každý cílový druh
Nelze vyloučit riziko přenosu onemocnění přenášených parazity, protože účinek fluralaneru je spojen se zahájením příjmu potravy na hostiteli.
4.5 Zvláštní opatření pro použití
Zvláštní opatření pro použití u zvířat
Pro nedostatek dostupných údajů by veterinární léčivý přípravek neměl být použit u psů mladších 8 týdnů anebo u psů s hmotností nižší 2 kg.
Nepodávat v intervalech kratších než 8 týdnů, protože bezpečnost přípravku nebyla v kratším intervalu testována.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům
Uchovávejte přípravek v originálním balení až do doby použití, aby se zabránilo přímému přístupu dětí k přípravku.
Nejezte, nepijte, nekuřte při manipulaci s veterinárním léčivým přípravkem.
Bezprostředně po použití si pečlivě umyjte ruce mýdlem a vodou.
4.6 Nežádoucí účinky (frekvence a závažnost)
V klinických studiích byly často pozorovány tyto nežádoucí účinky (1,6 % léčených psů): mírné a přechodné gastrointestinální účinky jako jsou průjem, zvracení, nechutenství a slintání.
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
- velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
4.7 Použití v průběhu březosti, laktace nebo snášky
Bezpečnost veterinárního léčivého přípravku byla stanovena pro použití u chovných zvířat, během březosti a laktace. Lze použít u chovných zvířat a u březích a laktujících fen.
4.8 Interakce s dalšími léčivými přípravky a další formy interakce
Nejsou známy.
Fluralaner se ve vysoké míře váže na plazmatické proteiny a může konkurovat jiným přípravkům, které se významně vážou, jako jsou nesteroidní antiflogistické přípravky (NSAIDs) a kumarinové deriváty warfarinu. Inkubace fluralaneru v plazmě psů v přítomnosti kaprofenu nebo warfarinu v maximálních očekávaných plazmatických koncentracích nesnižuje proteinovou vazbu fluralaneru, kaprofenu nebo warfarinu.
V průběhu terénních klinických studií nebyly pozorovány žádné interakce mezi žvýkacími tabletami Bravecto a běžně používanými veterinárními léčivými přípravky.
4.9 Podávané množství a způsob podání
Pro perorální podání.
Bravecto podávejte v souladu s následující tabulkou (v závislosti na doporučené dávce 25 - 56 mg fluralaneru/kg živé hmotnosti v jedné hmotnostní kategorii):
|
Živá hmotnost psa (kg) |
Síla a množství podaných tablet | ||||
|
Bravecto 112,5 mg |
Bravecto 250 mg |
Bravecto 500 mg |
Bravecto 1000 mg |
Bravecto 1400 mg | |
|
2-4,5 kg |
1 | ||||
|
> 4,5-10 kg |
1 | ||||
|
>10-20 kg |
1 | ||||
|
>20-40 kg |
1 | ||||
|
>40-56 kg |
1 | ||||
Žvýkací tablety nelámat a nepůlit.
Pro psy se živou hmotností přesahující 56 kg podávat kombinaci dvou tablet, které jsou nejblíž k požadované hmotnosti.
Způsob podání:
Tablety Bravecto podávat s krmením nebo během krmení.
Bravecto žvýkací tablety jsou dobře přijímány většinou psů. Pokud nenastane dobrovolné přijetí, lze tablety Bravecto podat psům zamíchané do krmiva nebo přímo do tlamy. V době podání by měl být pes pozorován, zda došlo ke spolknutí tablety.
Léčebné schéma:
Pro optimální kontrolu bleší infestace podávejte veterinární léčivý přípravek ve 12 týdenních intervalech. Pro optimální kontrolu infestace klíšťaty je potřeba přizpůsobit interval podávání druhu klíšťat. Viz bod 4.2.
4.10 Předávkování (symptomy, první pomoc, antidota), pokud je to nutné
U perorálně léčených štěňat ve věku 8 - 9 týdnů a s hmotností 2,0 - 3,6 kg nebyly pozorovány žádné nežádoucí účinky po 5- násobném překročení maximální doporučené dávky (56 mg, 168 mg a 280 mg fluralaneru/kg živé hmotnosti) podané 3krát a v intervalech kratších než j sou doporučené intervaly (8 týdnů).
Nebyl pozorován žádný vliv na rozmnožování a žádný vliv na životaschopnost potomstva při podávání fluralaneru psům plemene bígl při 3násobném překročení maximální doporučené dávky (až 168 mg fluralaneru/kg živé hmotnosti).
Veterinární léčivý přípravek byl dobře tolerován u psů plemene kolie s deficientním multidrug-resistence proteinem 1 (MDR 1-/-) po jednorázovém perorálním podání 3-násobku doporučené dávky (168 mg/kg živé hmotnosti). Nebyly pozorovány žádné klinické příznaky spojené s léčbou.
4.11 Ochranné lhůty
Není určeno pro potravinová zvířata.
5. FARMAKOLOGICKÉ VLASTNOSTI
Farmakoterapeutická skupina: Ektoparazitika pro systémové podání.
ATCvet kód: QP53BX05.
5.1 Farmakodynamické vlastnosti
Fluralaner je akaricid a insekticid. Působí proti klíšťatům (Ixodes spp., Dermacentor spp. a Rhipicephalus sanguineus) a blechám (Ctenocephalides spp.) psů.
Fluralaner má vysokou účinnost proti klíšťatům a blechám, které jej přijímají při krmení, tj. působí systémově na cílové parazity.
Fluralaner je silný inhibitor částí nervového systému parazita, kde působí antagonisticky na ligandem řízených chloridových kanálech (GABA- receptory a glutamát-receptory).
Při molekulárních cílených studiích prováděných na GABA-receptorech blech a much nebyl fluralaner ovlivňován rezistencí dieldrinu.
V in-vitro studiích není fluralaner ovlivněn prokázanou terénní rezistencí vůči amidinu (klíšťata), organofosfátům (klíšťata, ostatní roztoči), cyklodienům (klíšťata, blechy, mouchy), makrocyklickým laktonům (mořská veš), fenylpyrazolům (klíšťata, blechy), benzofenyl močovinám (klíšťata), pyretroidům (klíšťata a blechy) a karbamátům (roztoči).
Přípravek přispívá ke kontrole bleší populace v prostředí, ve kterém se léčení psi pohybují.
Blechy nově napadající psa jsou usmrceny ještě předtím, než začnou klást vajíčka. In vitro studie rovněž prokazují, že k zastavení produkce vajíček blechami postačují velmi malé koncentrace fluralaneru. Vývojový cyklus blech je přerušen díky rychlému nástupu účinku, dlouhotrvající účinnosti proti dospělým blechám a absenci ovipozice (kladení vajíček).
5.2 Farmakokinetické údaje
Po perorální aplikaci je fluralaner rychle vstřebáván a dosahuje maximálních plazmatických koncentrací během jednoho dne. Podání krmiva usnadňuje absorpci. Fluralaner je distribuován do dalších tkání a nejvyšších koncentrací dosahuje v tuku, poté v játrech, ledvinách a svalstvu. Prolongovaná perzistence, pomalá eliminace z plazmy (t1/2 = 12 dnů) a minimální metabolizace zajišťují přítomnost účinných koncentrací fluralaneru po dobu mezi jednotlivými aplikacemi přípravku. Byly pozorovány individuální rozdíly mezi Cmax a 11/2. Fluralaner je vylučován v nezměněné podobě zejména stolicí (~90% dávky). Renální clearance je minimální.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
aroma z prasečích jater
sacharosa
kukuřičný škrob
natrium-lauryl-sulfát
monohydrát dinatrium-embonátu
magnesium-stearát
aspartam
glycerol
sójový olej
makrogol 3350
6.2 Inkompatibility
Nejsou známy.
6.3 Doba použitelnosti
Doba použitelnosti veterinárního léčivého přípravku v neporušeném obalu: 2 roky
6.4 Zvláštní opatření pro uchovávání
Tento veterinární léčivý přípravek nevyžaduje žádné zvláštní podmínky pro uchovávání.
6.5 Druh a složení vnitřního obalu
Lepenková krabička s 1 aluminiovým blistrem zataveným fólií skládající se z vrstev: PET aluminiová fólie. Blistr obsahuje 1,2 nebo 4 žvýkací tablety.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro zneškodňování nepoužitého veterinárního léčivého přípravku nebo odpadu, který pochází z tohoto přípravku
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z tohoto přípravku, musí být likvidován podle místních právních předpisů.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Intervet International BV Wim de Korverstraat 35 5831 AN Boxmeer Nizozemsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/2/13/158/001-015
9. DATUM REGISTRACE/ PRODLOUŽENÍ REGISTRACE
11/02/2014
10. DATUM REVIZE TEXTU
Podrobné informace o veterinárním léčivém přípravku j sou k dispozici na webové stránce Evropské lékové agentury (EMA) http://www.ema.europa.eu/.
ZÁKAZ PRODEJE, VÝDEJE A/NEBO POUŽITÍ
Neuplatňuje se.
Bravecto 112, 5 mg roztok pro nakapání na kůži - spot-on pro velmi malé psy (2-4,5 kg) Bravecto 250 mg roztok pro nakapání na kůži - spot-on pro malé psy (>4,5-10 kg) Bravecto 500 mg roztok pro nakapání na kůži - spot-on pro střední psy (>10-20 kg) Bravecto 1000 mg roztok pro nakapání na kůži - spot-on pro velké psy (>20-40 kg) Bravecto 1400 mg roztok pro nakapání na kůži - spot-on pro extra velké psy (>40-56 kg)
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka:
Jeden ml obsahuje 280 mg fluralanerum.
Každá jednotlivá dávka pipety dodává:
|
Obsah pipety (ml) |
Fluralanerum (mg) | |
|
Velmi malí psi (2-4,5 kg) |
0,4 |
112,5 |
|
Malí psi (>4,5-10 kg) |
0,89 |
250 |
|
Střední psi (>10-20 kg) |
1,79 |
500 |
|
Velcí psi (>20-40 kg) |
3,57 |
1000 |
|
Extra velcí psi (>40-56 kg) |
5,0 |
1400 |
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Roztok pro nakapání na kůži- spot on.
Čirý, bezbarvý až žlutý roztok.
4. KLINICKÉ ÚDAJE
4.1 Cílové druhy zvířat
Psi.
4.2 Indikace s upřesněním pro cílový druh zvířat
Léčba infestace klíšťaty a blechami u psů.
Veterinární léčivý přípravek má systémový insekticidní a akaricidní účinek poskytující
- okamžitý a trvalý usmrcující účinek na blechy (Ctenocephalides felis a Ctenocephalides canis) trvající 12 týdnů a
- okamžitý a trvalý usmrcující účinek na klíšťata (Ixodes ricinus, Rhipicephalus sanguineus a Dermacentor reticulatus) trvající 12 týdnů.
Blechy a klíšťata jsou vystaveny působení účinné látky po kousnutí nebo přisátí na hostitele, kdy přijdou do kontaktu s tělními tekutinami.
Přípravek může být použit jako součást léčebné strategie alergické dermatitidy způsobené bleším kousnutím (FAD).
4.3 Kontraindikace
Nepoužívat v případě přecitlivělosti na léčivé látky, nebo na některou z pomocných látek.
4.4 Zvláštní upozornění pro každý cílový druh
Nelze vyloučit riziko přenosu onemocnění přenášených parazity, protože účinek fluralaneru je spojen se zahájením příjmu potravy na hostiteli.
4.5 Zvláštní opatření pro použití
Zvláštní opatření pro použití u zvířat Vyhněte se kontaktu přípravku s očima zvířete.
Nepodávat na místa s poraněnou kůží.
Nekoupejte psa nebo mu nedovolte ponořit se do vody nebo plavat ve vodních tocích 3 dny po aplikaci přípravku.
Pro nedostatek dostupných údajů by veterinární léčivý přípravek neměl být použit u psů mladších 8 týdnů a/anebo u psů s hmotností nižší 2 kg.
Nepodávat v intervalech kratších 8 týdnů, protože bezpečnost přípravku nebyla v kratším intervalu testována.
Přípravek je určen pro povrchové podání a nesmí být podáván perorálně.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům Přípravek je nebezpečný při pozření. Uchovávejte přípravek v originálním balení až do doby použití, aby se zabránilo přímému přístupu dětí k přípravku. Po použití pipety okamžitě zlikvidujte. V případě náhodného pozření vyhledejte ihned lékařskou pomoc a ukažte příbalovou informaci nebo etiketu praktickému lékaři.
Přípravek nebo přípravkem zmáčená kůže zvířete může lehce iritovat kůži a/nebo oči. Vyhněte se kontaktu s kůží a očima, včetně kontaktu rukou s očima. Nejezte, nepijte, nekuřte při manipulaci s veterinárním léčivým přípravkem. Nedotýkejte se nebo nedovolte dětem dotýkat se místa aplikace do zaschnutí, doporučuje se proto aplikovat přípravek zvířatům večer. V den léčby nedovolte léčeným zvířatům spát v posteli se svými majiteli, především dětmi. Bezprostředně po aplikaci přípravku si pečlivě umyjte mýdlem a vodou ruce a kůži, které byly v kontaktu s přípravkem. V případě zasažení očí je okamžitě důkladně vypláchněte vodou.
Přípravek je vysoce hořlavý. Uchovávejte mimo dosah tepla, jisker, otevřeného ohně nebo jiných zdrojů pálení.
Léčivá látka přípravku je ve vysoké míře lipofilní a váže se na kůži. Může se také vázat na povrchy, které se přípravkem potřísní.
Doporučují se následující opatření:
• Při manipulaci s přípravkem a jeho aplikaci psům a kočkám použijte vhodné ochranné rukavice.
• Po rozlití přípravku například na stůl nebo podlahu, odstraňte přípravek pomocí papírové utěrky a vyčistěte povrch detergentem.
Dokud místo aplikace přípravku nebude suché, nedovolte ošetřeným zvířatům být v kontaktu s neošetřenými zvířaty.
4.6 Nežádoucí účinky (frekvence a závažnost)
V klinických studiích byly často pozorovány tyto nežádoucí účinky (1,2 % léčených psů): mírné a přechodné reakce na kůži v místě aplikace jako jsou zarudnutí nebo alopecie.
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat) - velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
4.7 Použití v průběhu březosti, laktace nebo snášky
Bezpečnost veterinárního léčivého přípravku byla stanovena pro použití u chovných zvířat, během březosti a laktace. Může být použit u chovných, březích a laktujících zvířat.
4.8 Interakce s dalšími léčivými přípravky a další formy interakce
Nejsou známy.
Fluralaner se ve vysoké míře váže na plazmatické proteiny a může konkurovat jiným přípravkům, které se významně vážou, jako jsou nesteroidní antiflogistické přípravky (NSAIDs) a kumarinové deriváty warfarinu. Inkubace fluralaneru v plazmě psů v přítomnosti kaprofenu nebo warfarinu v maximálních očekávaných plazmatických koncentracích nesnižuje proteinovou vazbu fluralaneru, kaprofenu nebo warfarinu.
V průběhu terénních klinických studií nebyly pozorovány žádné interakce mezi Bravecto roztokem pro nakapání na kůži- spot-on a běžně používanými veterinárními léčivými přípravky.
4.9 Podávané množství a způsob podání
Pro podání nakapáním na kůži- spot-on.
Bravecto podávejte v souladu s následující tabulkou (v závislosti na doporučené dávce 25 - 56 mg fluralaneru/kg živé hmotnosti):
|
Živá hmotnost psa (kg) |
Síla a množství použitých pipet | ||||
|
Bravecto 112,5 mg |
Bravecto 250 mg |
Bravecto 500 mg |
Bravecto 1000 mg |
Bravecto 1400 mg | |
|
2-4,5 kg |
1 | ||||
|
> 4,5-10 kg |
1 | ||||
|
>10-20 kg |
1 | ||||
|
>20-40 kg |
1 | ||||
|
>40-56 kg |
1 | ||||
Pro psy se živou hmotností přesahující 56 kg podávat kombinaci dvou pipet, které jsou nejblíž k požadované hmotnosti.
Způsob podání:

Krok 1: Bezprostředně pře podáním otevřete jeden sáček a vyjměte pipetu. Pro otevření držte pipetu ve svislé poloze (špička nahoru) na bázi nebo na horní pevné častí pod víčkem. Otočte víčkem ve směru nebo proti směru hodinových ručiček o jednu celou otáčku. Víčko zůstává na pipetě, není možné jej odstranit. Pokud bylo cítit lámání těsnění, pipeta je otevřena a připravena k aplikaci.
Krok 2: Při aplikaci by měl pes stát nebo ležet se hřbetem v horizontální poloze. Umístěte špičku pipety vertikálně na kůži mezi lopatkami psa.
Krok 3: Jemně zmáčkněte pipetu a aplikujte celý obsah pipety přímo na kůži psa na jedno (pokud je obsah pipety malý) nebo více míst podél linie hřbetu od lopatek po kořen ocasu. Nepoužijte na kterémkoliv místě více než 1 ml roztoku, aby nemohlo dojít k odtečení nebo okapání části roztoku ze
psa.
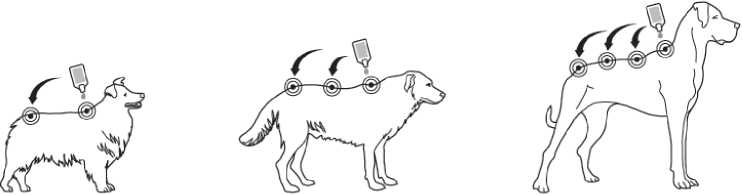
Léčebné schéma:
Pro optimální kontrolu infestace klíšťaty a bleší infestace podávejte veterinární léčivý přípravek ve 12týdenních intervalech.
4.10 Předávkování (symptomy, první pomoc, antidota), pokud je to nutné
Nebyly pozorovány žádné nežádoucí účinky po povrchovém podání přípravku u štěňat ve věku 8 - 9 týdnů a s hmotností 2,0 - 3,7 kg při 5násobném překročení maximální doporučené dávky (56 mg, 168 mg a 280 mg fluralaneru/kg živé hmotnosti) podané 3krát a v intervalech kratších než jsou doporučené intervaly (intervaly 8 týdnů).
Nebyly pozorovány žádné změny v reprodukční schopnosti a životaschopnosti potomků
při 3násobném překročení maximální doporučené dávky (do 168 mg fluralaneru/kg živé hmotnosti)
po perorálním podání psům plemene beagle.
Fluralaner byl dobře tolerován u psů plemene kolie s deficientním multidrug-resistence proteinem 1 (MDR 1-/-) po jednorázovém perorálním podání 3násobku doporučené dávky (168 mg fluralaneru/kg živé hmotnosti). Nebyly pozorovány žádné klinické příznaky spojené s léčbou.
4.11 Ochranné lhůty
Není určeno pro potravinová zvířata.
5. FARMAKOLOGICKÉ IMUNOLOGICKÉ VLASTNOSTI
Farmakoterapeutická skupina: Ektoparazitika pro systémové použití.
ATCvet kód: QP53BE02.
5.1 Farmakodynamické vlastnosti
Fluralaner je akaricid a insekticid. Působí proti klíšťatům (Ixodes spp., Dermacentor spp. a Rhipicephalus sanguineus) a blechám (Ctenocephalides spp.) psů.
K nástupu účinku dochází u blech (C. felis)do 8 hodin a u klíšťat (I. ricinus) do 12 hodin.
Fluralaner má vysokou účinnost proti klíšťatům a blechám, které jej přijímají při krmení, tj. působí systémově na cílové parazity.
Fluralaner je silný inhibitor částí nervového systému parazita, kde působí antagonisticky na ligandem řízených chloridových kanálech (GABA- receptory a glutamát-receptory).
Při molekulárních cílených studiích prováděných na GABA-receptorech blech a much nebyl fluralaner ovlivňován rezistencí dieldrinu.
V in-vitro studiích není fluralaner ovlivněn prokázanou terénní rezistencí vůči amidinu (klíšťata), organofosfátům (klíšťata, ostatní roztoči), cyklodienům (klíšťata, blechy, mouchy), makrocyklickým laktonům (mořská veš), fenylpyrazolům (klíšťata, blechy), benzofenyl močovinám (klíšťata), pyretroidům (klíšťata a roztoči) a karbamátům (roztoči).
Přípravek přispívá ke kontrole bleší populace v prostředí, ve kterém se léčeni psi pohybují.
Blechy nově napadající psa jsou usmrceny ještě předtím, než začnou klást vajíčka. In vitro studie rovněž prokazují, že k zastavení produkce vajíček blechami postačují velmi malé koncentrace fluralaneru.
Vývojový cyklus blech je přerušen díky rychlému nástupu účinku, dlouhotrvající účinnosti proti dospělým blechám a absenci ovipozice (kladení vajíček).
5.2 Farmakokinetické údaje
Po povrchové aplikaci je fluralaner rychle vstřebáván do chlupů, kůže a podložní tkáně, odkud se pomalu absorbuje do vaskulárního systému. Maximálních plazmatických koncentrací dosahuje během 7 až 63 dnů po aplikaci, poté se koncentrace pomalu snižuje. Prolongovaná perzistence, pomalá eliminace z plazmy (t1/2 = 21 dnů) a minimální metabolizace zajišťují přítomnost účinných koncentrací fluralaneru po dobu mezi jednotlivými aplikacemi přípravku. Fluralaner je vylučován v nezměněné podobě zejména stolicí. Renální clearance je minimální.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Dimethylacetamid
Glykofurol
Diethyltoluamid
Aceton
6.2 Inkompatibility
Nejsou známy.
6.3 Doba použitelnosti
Doba použitelnosti veterinárního léčivého přípravku v neporušeném obalu: 2 roky
6.4 Zvláštní opatření pro uchovávání
Tento veterinární léčivý přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání. Pipety uchovávejte ve vnějším obalu, aby bylo zabráněno ztrátě roztoku nebo absorpci vlhkosti. Sáček otevřete bezprostředně před aplikací.
6.5 Druh a složení vnitřního obalu
Jednodávková pipeta z laminované aluminium/polypropylenové fólie uzavřena HDPE víčkem a balena v laminovaném aluminiovém sáčku v papírové krabici. Krabice obsahuje 1 nebo 2 pipety.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro zneškodňování nepoužitého veterinárního léčivého přípravku nebo odpadu, který pochází z tohoto přípravku
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z tohoto přípravku, musí být likvidován podle místních právních předpisů.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Intervet International B. V.
Wim de Korverstraat 35 5831 AN Boxmeer Nizozemsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/2/13158/016-017 112,5 mg
EU/2/13158/020-021 250 mg EU/2/13158/024-025 500 mg
EU/2/13158/028-029 1000 mg
EU/2/13158/030-031 1400 mg
9. DATUM REGISTRACE/ PRODLOUŽENÍ REGISTRACE
Datum registrace: 11/02/2014
10. DATUM REVIZE TEXTU
{MM/RRRR}
Podrobné informace o veterinárním léčivém přípravku j sou k dispozici na webové stránce Evropské lékové agentury http://www.ema.europa.eu/.
ZÁKAZ PRODEJE, VÝDEJE A/NEBO POUŽITÍ
Neuplatňuje se.
Bravecto 112,5 mg roztok pro nakapání na kůži - spot-on pro malé kočky (1,2-2,8 kg) Bravecto 250 mg roztok pro nakapání na kůži - spot-on pro střední kočky (>2,8-6,25 kg) Bravecto 500 mg roztok pro nakapání na kůži - spot-on pro velké kočky (>6,25-12,5 kg)
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka:
Jeden ml obsahuje 280 mg fluralanerum.
Jedna pipeta dodává:
|
Obsah pipety (ml) |
Fluralanerum (mg) | |
|
pro malé kočky (1,2-2,8 kg) |
0,4 |
112,5 |
|
pro střední kočky (>2,8-6,25 kg) |
0,89 |
250 |
|
pro velké kočky (>6,25-12,5 kg) |
1,79 |
500 |
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Roztok pro nakapání na kůži- spot on.
Čirý, bezbarvý až žlutý roztok.
4. KLINICKÉ ÚDAJE
4.1 Cílové druhy zvířat
Kočky.
4.2 Indikace s upřesněním pro cílový druh zvířat
Léčba infestace klíšťaty a blechami u koček.
Veterinární léčivý přípravek má systémový insekticidní a akaricidní účinek poskytující okamžitý a trvalý usmrcující účinek na blechy (Ctenocephalides felis) a klíšťata (Ixodes ricinus) trvající 12 týdnů.
Blechy a klíšťata jsou vystaveny působení účinné látky po kousnutí nebo přisátí na hostitele, kdy přijdou do kontaktu s tělními tekutinami.
Přípravek může být použit jako součást léčebné strategie alergické dermatitidy způsobené bleším kousnutím (FAD).
4.3 Kontraindikace
Nepoužívat v případě přecitlivělosti na léčivé látky, nebo na některou z pomocných látek.
4.4 Zvláštní upozornění pro každý cílový druh
Nelze vyloučit riziko přenosu onemocnění přenášených parazity, protože účinek fluralaneru je spojen se zahájením příjmu potravy na hostiteli.
4.5 Zvláštní opatření pro použití
Zvláštní opatření pro použití u zvířat
Vyhněte se kontaktu přípravku s očima zvířete. Nepodávat na místa s poraněnou kůží.
Pro nedostatek dostupných údajů by veterinární léčivý přípravek neměl být použit u koček mladších 11 týdnů a/nebo u koček s hmotností nižší 1,2 kg.
Nepodávat v intervalech kratších 8 týdnů, protože bezpečnost přípravku nebyla v kratším intervalu testována.
Přípravek je určen pro povrchové podání a nesmí být podáván perorálně.
Nedovolte čerstvě ošetřeným zvířatům vzájemné olizování.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům Přípravek je nebezpečný při pozření. Uchovávejte přípravek v originálním balení až do doby použití, aby se zabránilo přímému přístupu dětí k přípravku. Po použití pipety okamžitě zlikvidujte. V případě náhodného pozření vyhledejte ihned lékařskou pomoc a ukažte příbalovou informaci nebo etiketu praktickému lékaři.
Přípravek nebo přípravkem zmáčená kůže zvířete může lehce iritovat kůži a/nebo oči. Vyhněte se kontaktu s kůží a očima, včetně kontaktu rukou s očima. Nejezte, nepijte, nekuřte při manipulaci s léčivým přípravkem. Nedotýkejte se nebo nedovolte dětem dotýkat se místa aplikace do zaschnutí; doporučuje se proto aplikovat přípravek zvířatům večer. V den aplikace nedovolte léčeným zvířatům spát v posteli se svým majitelem, především s dětmi. Bezprostředně po použití si pečlivě umyjte mýdlem a vodou ruce a kůži, která byla v kontaktu s přípravkem. V případě zasažení očí je okamžitě důkladně vypláchněte vodou.
Léčivý přípravek je vysoce hořlavý. Uchovávejte mimo dosah tepla, jisker, otevřeného ohně nebo jiných zdrojů pálení.
Léčivá látka přípravku je vysoké míře lipofilní a váže se na kůži. Může se také vázat na povrchy, které se přípravkem potřísní.
Doporučují se následující opatření:
• Při manipulaci s přípravkem a jeho aplikaci psům a kočkám použijte vhodné ochranné
rukavice.
• Po rozlití přípravku například na stůl nebo podlahu, odstraňte přípravek pomocí papírové utěrky
a vyčistěte povrch detergentem.
Dokud místo aplikace přípravku nebude suché, nedovolte ošetřeným zvířatům být v kontaktu s neošetřenými zvířaty.
4.6 Nežádoucí účinky (frekvence a závažnost)
Často pozorované nežádoucí účinky v klinických studiích: mírné a přechodné reakce kůže v místě podání (2,2 % léčených koček), jako jsou zarudnutí a škrábání nebo alopecie.
Následující jiné účinky byly pozorovány krátce po podání: netečnost/třes/nechutenství (0,9% léčených koček) nebo zvracení/nadměrné slinění (0,4 % léčených koček).
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
- velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
4.7 Použití v průběhu březosti, laktace nebo snášky
Nebyla stanovena bezpečnost veterinárního léčivého přípravku pro použití během březosti a laktace. Použít pouze po zvážení terapeutického prospěchu/rizika příslušným veterinárním lékařem.
4.8 Interakce s dalšími léčivými přípravky a další formy interakce
Nej sou známy.
Fluralaner se ve vysoké míře váže na plazmatické proteiny a může konkurovat jiným přípravkům, které se významně vážou, jako jsou nesteroidní antiflogistické přípravky (NSAIDs) a kumarinové deriváty warfarinu. Inkubace fluralaneru v plazmě psů v přítomnosti kaprofenu nebo warfarinu v maximálních očekávaných plazmatických koncentracích nesnižuje proteinovou vazbu fluralaneru, kaprofenu nebo warfarinu.
V průběhu terénních klinických studií nebyly pozorovány žádné interakce mezi Bravecto roztokem pro nakapání na kůži -spot-on pro kočky a běžně používanými veterinárními léčivými přípravky.
4.9 Podávané množství a způsob podání
Pro podání nakapáním na kůži- spot-on.
Bravecto podávejte v souladu s následující tabulkou (odpovídá doporučené dávce 40 - 94 mg fluralaneru/kg živé hmotnosti):
|
Živá hmotnost kočky (kg) |
Síla a množství podaných pipet | ||
|
Bravecto 112,5 mg |
Bravecto 250 mg |
Bravecto 500 mg | |
|
1,2-2,8 kg |
1 | ||
|
> 2,8-6,25 kg |
1 | ||
|
>6,25-12,5 kg |
1 | ||
Pro kočky se živou hmotností přesahující 12,5 kg podávat kombinaci dvou pipet, které jsou nejblíž k požadované hmotnosti.
Způsob podání:

Krok 1: Bezprostředně pře podáním otevřete jeden sáček a vyjměte pipetu. Pro otevření držte pipetu ve svislé poloze (špička nahoru) na bázi nebo na horní pevné častí pod víčkem. Otočte víčkem ve směru nebo proti směru hodinových ručiček o jednu celou otáčku. Víčko zůstává na pipetě, není možné jej odstranit. Pokud bylo cítit lámání těsnění pipeta je otevřena a připravena k aplikaci.
poloze. Umístěte špičku
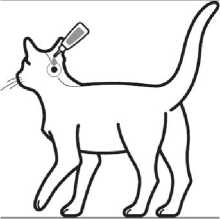
Krok 2: Při aplikaci by měla kočka stát nebo ležet se hřbetem v horizontální pipety vertikálně na bázi lebky kočky.
Krok 3: Jemně zmáčkněte pipetu a aplikujte celý obsah pipety přímo na kůži kočky. U kočky s hmotností do 6,25 kg aplikujte přípravek na jedno místo na bázi hlavy, a u koček s hmotností přesahující 6,25 kg na dvě místa.
Léčebné schéma:
Pro optimální kontrolu infestace klíšťaty a bleší infestace podávejte veterinární léčivý přípravek ve 12týdenních intervalech.
4.10 Předávkování (symptomy, první pomoc, antidota), pokud je to nutné
Nebyly pozorovány žádné nežádoucí účinky po povrchovém podání u koťat ve věku 11 - 13 týdnů a s hmotností 1,2 - 1,5 kg po 5násobném překročení maximální doporučené dávky (93 mg, 279 mg a 465 mg fluralaneru/kg živé hmotnosti) podané 3krát v intervalech kratších než jsou doporučené (intervaly 8 týdnů).
Perorální příjem maximální doporučené dávky 93 mg fluralaneru/kg živé hmotnosti byl u koček dobře tolerován kromě nepatrného slinění, které samovolně vymizí a kašle nebo zvracení bezprostředně po aplikaci.
4.11 Ochranné lhůty
Není určeno pro potravinová zvířata.
5. FARMAKOLOGICKÉ IMUNOLOGICKÉ VLASTNOSTI
Farmakoterapeutická skupina: Ektoparazitika pro systémové požití.
ATCvet kód: QP53BE02
5.1 Farmakodynamické vlastnosti
Fluralaner je akaricid a insekticid. Působí proti klíšťatům (Ixodes spp.) a blechám (Ctenocephalides spp.) u koček.
K nástupu účinku dochází u blech (C. felis)do 12 hodin a do 48 hodin u klíšťat (I. ricinus).
Fluralaner má vysokou účinnost proti klíšťatům a blechám, které jej přijímají při krmení, tj. působí systémově na cílové parazity.
Fluralaner je silný inhibitor částí nervového systému parazita, kde působí antagonisticky na ligandem řízených chloridových kanálech (GABA- receptory a glutamát-receptory).
Při molekulárních cílených studiích prováděných na GABA-receptorech blech a much nebyl fluralaner ovlivňován rezistencí dieldrinu.
V in-vitro studiích není fluralaner ovlivněn prokázanou terénní rezistencí vůči amidinu (klíšťata), organofosfátům (klíšťata, ostatní roztoči), cyklodienům (klíšťata, blechy, mouchy), makrocyklickým laktonům (mořská veš), fenylpyrazolům (klíšťata, blechy), benzofenyl močovinám (klíšťata), pyretroidům (klíšťata a roztoči) a karbamátům (roztoči).
Přípravek přispívá ke kontrole bleší populace v prostředí, ve kterém se léčené kočky pohybují.
Blechy nově napadající kočku jsou usmrceny ještě předtím, než začnou klást vajíčka. In vitro studie rovněž prokazují, že k zastavení produkce životaschopných vajíček blechami postačují velmi malé koncentrace fluralaneru. Vývojový cyklus blech je přerušen díky rychlému nástupu účinku, dlouhotrvající účinnosti proti dospělým blechám a absenci ovipozice (kladení vajíček).
5.2 Farmakokinetické údaje
Z místa povrchové aplikace je fluralaner snadno systémově vstřebáván a dosahuje maximálních plazmatických koncentrací mezi 3. a 21. dnem po aplikaci. Prolongovaná perzistence, pomalá eliminace z plazmy (ty2 = 12 dnů) a minimální metabolizace zajišťují přítomnost účinných koncentrací fluralaneru po dobu mezi jednotlivými aplikacemi přípravku. Fluralaner je vylučován v nezměněné podobě zejména výkaly. Renální clearance je minimální.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Dimethylacetamid
Glykofurol
Diethyltoluamid
Aceton
6.2 Inkompatibility
Nejsou známy.
6.3 Doba použitelnosti
Doba použitelnosti veterinárního léčivého přípravku v neporušeném obalu: 2 roky
6.4 Zvláštní opatření pro uchovávání
Tento veterinární léčivý přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání. Pipety uchovávejte ve vnějším obalu, aby bylo zabráněno ztrátě roztoku nebo absorpci vlhkosti. Sáček otevřete bezprostředně před aplikací.
6.5 Druh a složení vnitřního obalu
Jednodávková pipeta z laminované aluminium/polypropylenové fólie uzavřena HDPE víčkem a balena v laminovaném aluminiovém sáčku v papírové krabici. Krabice obsahuje 1 nebo 2 pipety.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro zneškodňování nepoužitého veterinárního léčivého přípravku nebo odpadu, který pochází z tohoto přípravku
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z tohoto přípravku, musí být likvidován podle místních právních předpisů.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Intervet International B. V.
Wim de Korverstraat 35 5831 AN Boxmeer Nizozemsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/2/13/158/018-019 112,5 mg
EU/2/13/158/022-023 250 mg
EU/2/13/158/026-027 500 mg
9. DATUM REGISTRACE/ PRODLOUŽENÍ REGISTRACE
Datum registrace: 11/02/2014
10. DATUM REVIZE TEXTU
{MM/RRRR}
Podrobné informace o veterinárním léčivém přípravku j sou k dispozici na webové stránce Evropské lékové agentury http://www.ema.europa.eu/.
ZÁKAZ PRODEJE, VÝDEJE A/NEBO POUŽITÍ
Neuplatňuje se.
A. DRŽITEL POVOLENÍ K VÝROBĚ ODPOVĚDNÝ ZA UVOLNĚNÍ ŠARŽE
B. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ
C. DEKLARACE HODNOT MRL
D. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
A. DRŽITEL POVOLENÍ K VÝROBĚ ODPOVĚDNÝ ZA UVOLNĚNÍ ŠARŽE
Jméno a adresa výrobce odpovědného za uvolnění šarže
Žvýkací tablety Intervet GesmbH Siemensstrasse 107 1210 Vienna Rakousko
Roztok pro nakapání Intervet UK Limited Walton Manor, Walton,
Milton Keynes,
Buckinghamshire, MK7 7AJ Spojené Království
B. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE NEBO POUŽITÍ
Veterinární léčivý přípravek je vydáván pouze na předpis.
C. DEKLARACE HODNOT MRL
Neuplatňuje se
D. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
Specifické farmakovigilanční požadavky:
Cyklus předkládání periodicky aktualizované zprávy o bezpečnosti přípravku (PSUR) by měl být znovu nastaven na předkládání šestiměsíčních zpráv (pokrývající všechny registrované prezentace přípravku) po dobu příštích dvou let, následován zasíláním ročních zpráv v období následujících dvou let a poté ve tříletých intervalech. Datum uzavření údajů (Data Lock Point (DLP)) pro příští PSUR by měl být stanoven k 31. srpnu 2016.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
Bravecto 112, 5 mg žvýkací tablety pro velmi malé psy (2-4,5 kg) Bravecto 250 mg žvýkací tablety pro malé psy (>4,5-10 kg) Bravecto 500 mg žvýkací tablety pro střední psy (>10-20 kg) Bravecto 1000 mg žvýkací tablety pro velké psy (>20-40 kg) Bravecto 1400 mg žvýkací tablety pro extra velké psy (>40-56 kg)
Fluralaner
Fluralaner 112,5 mg Fluralaner 250 mg Fluralaner 500 mg Fluralaner 1000 mg Fluralaner 1400 mg
Žvýkací tablety
1 žvýkací tableta 4 žvýkací tablety 6 žvýkacích tablet
Psi
Perorální podání.
Před použitím čtěte příbalovou informaci.
Není určeno pro potravinová zvířata.
EXP {měsíc/rok}
Před použitím čtěte příbalovou informaci
Před použitím čtěte příbalovou informaci
13. OZNAČENÍ „POUZE PRO ZVÍŘATA“ A PODMÍNKY NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ, POKUD JE JICH TŘEBA_
Pouze pro zvířata. Veterinární léčivý přípravek je vydáván pouze na předpis.
Uchovávat mimo dosah dětí.
Intervet International BV Wim de Korverstraat 35 5831 AN Boxmeer Nizozemsko
EU/2/13/158/001
EU/2/13/158/002
EU/2/13/158/003
EU/2/13/158/004
EU/2/13/158/005
EU/2/13/158/006
EU/2/13/158/007
EU/2/13/158/008
EU/2/13/158/009
EU/2/13/158/010
EU/2/13/158/011
EU/2/13/158/012
EU/2/13/158/013
EU/2/13/158/014
EU/2/13/158/015
17. ČÍSLO ŠARŽE OD VÝROBCE
Lot:{číslo}
Bravecto 112, 5 mg (2-4,5 kg) Bravecto 250 mg (>4,5-10 kg) Bravecto 500 mg (>10-20 kg) Bravecto 1000 mg (>20-40 kg) Bravecto 1400 mg (>40-56 kg)
Fluralaner
Intervet International B.V.
EXP {měsíc/rok}
Lot:{číslo}
Pouze pro zvířata.
Bravecto 112, 5 mg roztok pro nakapání na kůži - spot-on pro velmi malé psy (2-4,5 kg) Bravecto 250 mg roztok pro nakapání na kůži - spot-on pro malé psy (>4,5-10 kg) Bravecto 500 mg roztok pro nakapání na kůži - spot-on pro střední psy (>10-20 kg) Bravecto 1000 mg roztok pro nakapání na kůži - spot-on pro velké psy (>20-40 kg) Bravecto 1400 mg roztok pro nakapání na kůži - spot-on pro extra velké psy (>40-56 kg) fluralanerum
|
Fluralanerum |
112,5 mg |
|
Fluralanerum |
250 mg |
|
Fluralanerum |
500 mg |
|
Fluralanerum |
1000 mg |
|
Fluralanerum |
1400 mg |
Roztok pro nakapání na kůži - spot-on
1 x 0,4 ml 1 x 0,89 ml 1 x 1,79 ml 1 x 3,57 ml
1 x 5,0 ml
2 x 0,89 ml 2 x 1,79 ml 2 x 3,57 ml 2 x 5,0 ml
Psi
Podání nakapáním na kůži - spot-on.
Před použitím čtěte příbalovou informaci. Pokyny pro podání:
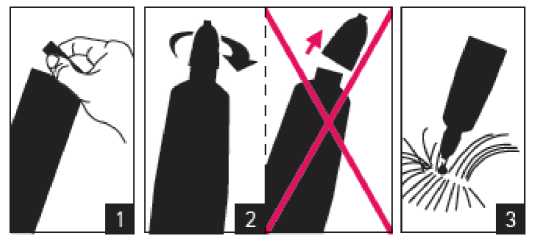
|
8. OCHRANNÁ LHŮTA | |
|
Není určeno pro potravinová zvířata | |
|
9. ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE (JSOU) NUTNÉ(Á) | |
Přípravek uchovávejte do doby použití v původním obalu, aby se dětem zabránilo v přístupu k přípravku.
Před použitím čtěte příbalovou informaci.
10. DATUM EXSPIRACE
EXP {měsíc/rok}
11. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Před použitím čtěte příbalovou informaci
12. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA_
Před použitím čtěte příbalovou informaci
13. OZNAČENÍ „POUZE PRO ZVÍŘATA“ A PODMÍNKY NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ, POKUD JE JICH TŘEBA_
Pouze pro zvířata. Veterinární léčivý přípravek je vydáván pouze na předpis.
14. OZNAČENÍ „UCHOVÁVAT MIMO DOSAH DĚTÍ“
Uchovávat mimo dosah dětí.
15. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Intervet International BV Wim de Korverstraat 35 5831 AN Boxmeer Nizozemsko
16. REGISTRAČNÍ ČÍSLO(A)
EU/2/13158/016 (112,5 mg, 1 pipeta) EU/2/13158/017 (112,5 mg, 2 pipety) EU/2/13158/020 (250 mg, 1 pipeta) EU/2/13158/021 (250 mg, 2 pipety) EU/2/13158/024 (500 mg, 1 pipeta) EU/2/13158/025 (500 mg, 2 pipety) EU/2/13158/028 (1000 mg, 1 pipeta) EU/2/13158/029 (1000 mg, 2 pipety) EU/2/13158/030 (1400 mg, 1 pipeta) EU/2/13158/031 (1400 mg, 2 pipety)
17. ČÍSLO ŠARŽE OD VÝROBCE
Lot:{číslo}
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU MALÉ VELIKOSTI {SÁČEK }_
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Bravecto 112, 5 mg roztok pro nakapání na kůži - spot-on pro velmi malé psy (2-4,5 kg) Bravecto 250 mg roztok pro nakapání na kůži - spot-on pro malé psy (>4,5-10 kg) Bravecto 500 mg roztok pro nakapání na kůži - spot-on pro střední psy (>10-20 kg) Bravecto 1000 mg roztok pro nakapání na kůži - spot-on pro velké psy (>20-40 kg) Bravecto 1400 mg roztok pro nakapání na kůži - spot-on pro extra velké psy (>40-56 kg) fluralanerum
2. MNOŽSTVÍ LÉČIVÉ(ÝCH) LÁTKY(EK)
|
Fluralanerum |
112,5 mg |
|
Fluralanerum |
250 mg |
|
Fluralanerum |
500 mg |
|
Fluralanerum |
1000 mg |
|
Fluralanerum |
1400 mg |
3. OBSAH VYJÁDŘENÝ HMOTNOSTÍ, OBJEMEM NEBO POČTEM DÁVEK
0,4 ml 0,89 ml 1,79 ml 3,57 ml 5,0 ml
4. CESTA(Y) PODÁNÍ
Pokyny pro podání:
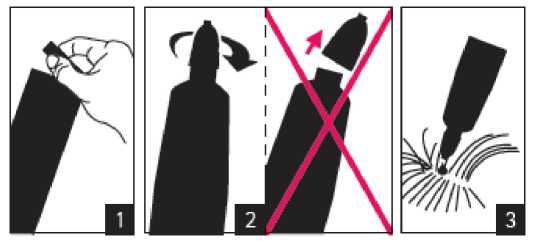
1. Otevřete sáček. 2. Otočte víčkem (víčko nesundávejte). 3. Nakapejte na kůži. Pipetu uchovávejte v sáčku až do použití.
|
5. OCHRANNÁ LHŮTA | |
|
Není určeno pro potravinová zvířata | |
|
6. ČÍSLO ŠARŽE | |
Lot {číslo}
7. DATUM EXSPIRACE
EXP: {měsíc/rok}
8. OZNAČENÍ „POUZE PRO ZVÍŘATA“
Pouze pro zvířata.
Bravecto 112, 5 mg roztok pro nakapání na kůži - spot-on pro malé kočky (1,2-2,8 kg) Bravecto 250 mg roztok pro nakapání na kůži - spot-on pro střední kočky (>2,8-6,25 kg) Bravecto 500 mg roztok pro nakapání na kůži - spot-on pro velké kočky (>6,25-12,5 kg) fluralanerum
Fluralanerum 112,5 mg
Fluralanerum 250 mg
Fluralanerum 500 mg
Roztok pro nakapání na kůži - spot-on
1 x 0,4 ml 1 x 0,89 ml
1 x 1,79 ml
2 x 0,4 ml 2 x 0,89 ml 2 x 1,79 ml
Kočky
Podání nakapáním na kůži - spot-on.
Před použitím čtěte příbalovou informaci. Pokyny pro podání:
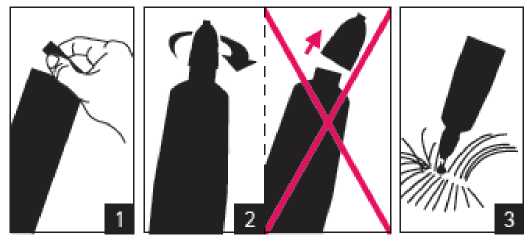
|
8. OCHRANNÁ LHŮTA | |
|
Není určeno pro potravinová zvířata | |
|
9. ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE (JSOU) NUTNÉ(Á) | |
Přípravek uchovávejte do doby použití v původním obalu, aby se dětem zabránilo v přístupu k přípravku.
Před použitím čtěte příbalovou informaci.
10. DATUM EXSPIRACE
EXP {měsíc/rok}
11. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Před použitím čtěte příbalovou informaci
12. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA_
Před použitím čtěte příbalovou informaci
13. OZNAČENÍ „POUZE PRO ZVÍŘATA“ A PODMÍNKY NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ, POKUD JE JICH TŘEBA_
Pouze pro zvířata. Veterinární léčivý přípravek je vydáván pouze na předpis.
14. OZNAČENÍ „UCHOVÁVAT MIMO DOSAH DĚTÍ“
Uchovávat mimo dosah dětí.
15. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Intervet International BV Wim de Korverstraat 35 5831 AN Boxmeer
Nizozemsko
16. REGISTRAČNÍ ČÍSLO(A)
EU/2/13/158/018 (112,5 mg, 1 pipeta) EU/2/13/158/019 (112,5 mg, 2 pipety) EU/2/13/158/022 (250 mg, 1 pipeta) EU/2/13/158/023 (250 mg, 2 pipety) EU/2/13/158/026 (500 mg, 1 pipeta) EU/2/13/158/027 (500 mg, 2 pipety)
17. ČÍSLO ŠARŽE OD VÝROBCE
Lot: {číslo}
Bravecto 112, 5 mg roztok pro nakapání na kůži - spot-on pro malé kočky (1,2-2,8 kg) Bravecto 250 mg roztok pro nakapání na kůži - spot-on pro střední kočky (>2,8-6,25 kg) Bravecto 500 mg roztok pro nakapání na kůži - spot-on pro velké kočky (>6,25-12,5 kg) fluralanerum
Fluralanerum 112,5 mg
Fluralanerum 250 mg
Fluralanerum 500 mg
0,4 ml 0,89 ml 1,79 ml
Pokyny pro podání:

1. Otevřete sáček. 2. Otočte víčkem (víčko nesundávejte). 3. Nakapejte na kůži. Pipetu uchovávejte v sáčku až do použití.
Není určeno pro potravinová zvířata.
Lot {číslo}
EXP: {měsíc/rok}
8. OZNAČENÍ „POUZE PRO ZVÍŘATA“
Pouze pro zvířata.
B. PŘÍBALOVÁ INFORMACE
PŘÍBALOVÁ INFORMACE Bravecto žvýkací tablety pro psy
1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
Držitel rozhodnutí o registraci:
Intervet International B.V.
Wim de Korverstraat 35 5831 AN Boxmeer Nizozemsko
Výrobce odpovědný za uvolnění šarže:
Intervet GesmbH Siemensstrasse 107 1210 Vienna Rakousko
2. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Bravecto 112, 5 mg žvýkací tablety pro velmi malé psy (2-4,5 kg) Bravecto 250 mg žvýkací tablety pro malé psy (>4,5-10 kg) Bravecto 500 mg žvýkací tablety pro střední psy (>10-20 kg) Bravecto 1000 mg žvýkací tablety pro velké psy (>20-40 kg) Bravecto 1400 mg žvýkací tablety pro extra velké psy (>40-56 kg)
Fluralanerum
3. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
Každá žvýkací tableta obsahuje:
|
Bravecto žvýkací tablety |
Fluralanerum (mg) |
|
Velmi malí psi (2-4,5 kg) |
112,5 |
|
Malí psi (>4,5-10 kg) |
250 |
|
Střední psi (>10-20 kg) |
500 |
|
Velcí psi (>20-40 kg) |
1000 |
|
Extra velcí psi (>40-56 kg) |
1400 |
Světle hnědé až hnědé kulaté tablety s hladkým nebo mírně drsným povrchem, se zřetelným mramorováním, flíčky nebo oběma.
4. INDIKACE
Léčba infestace klíšťaty a blechami u psů.
Veterinární léčivý přípravek má systémový insekticidní a akaricidní účinek poskytující
- okamžitý a trvalý usmrcující účinek na blechy (Ctenocephalides felis) trvající 12 týdnů
- okamžitý a trvalý usmrcující účinek na klíšťata (Ixodes ricinus, Dermacentor reticulatus
a D. variabilis) trvající 12 týdnů
- okamžitý a trvalý usmrcující účinek na klíště (Rhipicephalus sanguineus) trvající 8 týdnů.
Blechy a klíšťata jsou vystaveny působení účinné látky okamžitě po kousnutí nebo přisátí na hostitele, kdy přijdou do kontaktu s tělními tekutinami. K nástupu účinku dochází u blech (C. felis) do 8 hodin a u klíšťat (I. ricinus) do 12 hodin po uchycení.
Přípravek může být použit jako součást léčebné strategie alergické dermatitidy způsobené bleším kousnutím (FAD).
5. KONTRAINDIKACE
Nepoužívat v případě přecitlivělosti na léčivé látky, nebo na některou z pomocných látek.
6. NEŽÁDOUCÍ ÚČINKY
V klinických studiích byly často pozorovány tyto nežádoucí účinky (1,6 % léčených psů): mírné a přechodné gastrointestinální účinky jako jsou průjem, zvracení, nechutenství a slintání.
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
- velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
Jestliže zaznamenáte jakékoliv závažné nežádoucí účinky či jiné reakce, které nejsou uvedeny v této příbalové informaci, oznamte to prosím vašemu veterinárnímu lékaři.
7. CÍLOVÝ DRUH ZVÍŘAT
Psi
8. DÁVKOVÁNÍ PRO KAŽDÝ DRUH, CESTA(Y) A ZPŮSOB PODÁNÍ
Pro perorální podání.
Bravecto podávejte v souladu s následující tabulkou (v závislosti na doporučené dávce 25 - 56 mg fluralaneru/kg živé hmotnosti v jedné hmotnostní kategorii):
|
Živá hmotnost psa (kg) |
Síla a množství a podaných tablet | ||||
|
Bravecto 112,5 mg |
Bravecto 250 mg |
Bravecto 500 mg |
Bravecto 1000 mg |
Bravecto 1400 mg | |
|
2-4,5 kg |
1 | ||||
|
> 4,5-10 kg |
1 | ||||
|
>10-20 kg |
1 | ||||
|
>20-40 kg |
1 | ||||
|
>40-56 kg |
1 | ||||
Pro psy se živou hmotností přesahující 56 kg podávat kombinaci dvou tablet, které jsou nejblíž k požadované hmotnosti.
9. POKYNY PRO SPRÁVNÉ PODÁNÍ
Žvýkací tablety nelámat a nepůlit.
Tablety Bravecto podávat s krmením nebo během krmení.
Bravecto žvýkací tablety jsou dobře přijímány většinou psů. Pokud nenastane dobrovolné přijetí, lze tablety Bravecto podat psům zamíchané do krmiva nebo přímo do tlamy. V době podání by měl být pes pozorován, zda došlo ke spolknutí tablety.
Léčebné schéma:
Pro optimální kontrolu bleší infestace podávejte veterinární léčivý přípravek ve 12 týdenních intervalech. Pro optimální kontrolu infestace klíšťaty je potřeba přizpůsobit interval podávání druhu klíšťat. Viz bod 4.
10. OCHRANNÁ LHŮTA
Není určeno pro potravinová zvířata.
11. ZVLÁŠTNÍ OPATŘENÍ PRO UCHOVÁVÁNÍ
Uchovávat mimo dosah dětí.
Nepoužívejte veterinární léčivý přípravek po uplynutí doby použitelnost uvedené na blistru po EXP. Datum použitelnosti končí posledním dnem v uvedeném měsíci.
12. ZVLÁŠTNÍ UPOZORNĚNÍ
Zvláštní upozornění pro každý cílový druh
Nelze vyloučit riziko přenosu onemocnění přenášených parazity, protože účinek fluralaneru je spojen se zahájením příjmu potravy na hostiteli.
Zvláštní opatření pro použití u zvířat
Pro nedostatek dostupných údajů by veterinární léčivý přípravek neměl být použit u psů mladších 8 týdnů anebo u psů s hmotností nižší 2 kg.
Nepodávat v intervalech kratších než 8 týdnů, protože bezpečnost přípravku nebyla v kratším intervalu testována.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům Uchovávejte přípravek v originálním balení až do doby použití, aby se zabránilo přímému přístupu dětí k přípravku.
Nejezte, nepijte, nekuřte při manipulaci s veterinárním léčivým přípravkem.
Bezprostředně po použití si pečlivě umyjte ruce mýdlem a vodou.
Březost, laktace a plodnost:
Veterinární léčivý přípravek lze použít i u chovných zvířat, během březosti a laktace.
Interakce s dalšími léčivými přípravky a další formy interakce Nejsou známy.
Fluralaner se ve vysoké míre váže na plazmatické proteiny a může konkurovat jiným přípravkům, které se významně vážou, jako jsou nesteroidní antiflogistické přípravky (NSAIDs) a kumarinové deriváty warfarinu. Inkubace fluralaneru v plazmě psů v přítomnosti kaprofenu nebo warfarinu v maximálních očekávaných plazmatických koncentracích nesnižuje proteinovou vazbu fluralaneru, kaprofenu nebo warfarinu.
V průběhu terénních klinických studií nebyly pozorovány žádné interakce mezi žvýkacími tabletami Bravecto a běžně používanými veterinárními léčivými přípravky.
Předávkování (symptomy, první pomoc, antidota), pokud je to nutné
U perorálně léčených štěňat ve věku 8 - 9 týdnů a s hmotností 2,0 - 3,6 kg nebyly pozorovány žádné nežádoucí účinky po 5- násobném překročení maximální doporučené dávky (56 mg, 168 mg a 280 mg fluralaneru/kg živé hmotnosti) podané 3krát a v intervalech kratších než j sou doporučené intervaly (8 týdnů).
Nebyl pozorován žádný vliv na rozmnožování a žádný vliv na životaschopnost potomstva při podávání fluralaneru psům plemene bígl při 3 násobném překročení maximální doporučené dávky (až 168 mg fluralaneru/kg živé hmotnosti).
Veterinární léčivý přípravek byl dobře tolerován u psů plemene kolie s deficientním multidrug-resistence proteinem 1 (MDR 1-/-) po jednorázovém perorálním podání 3-násobku doporučené dávky (168 mg/kg živé hmotnosti). Nebyly pozorovány žádné klinické příznaky spojené s léčbou.
Inkompatibility Nejsou známy.
13. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA
Léčivé přípravky se nesmí likvidovat prostřednictvím odpadní vody či domovního odpadu.
O možnostech likvidace nepotřebných léčivých přípravků se poraďte s vaším veterinárním lékařem. Tato opatření napomáhají chránit životní prostředí.
14. DATUM POSLEDNÍ REVIZE PŘÍBALOVÉ INFORMACE
Podrobné informace o veterinárním léčivém přípravku j sou k dispozici na webové stránce Evropské lékové agentury (http: //www .ema.europa.eu/).
15. DALŠÍ INFORMACE
Přípravek přispívá ke kontrole bleší populace v prostředí, ve kterém se léčení psi pohybují.
Lepenková krabička s 1 aluminiovým blistrem zataveným fólií skládající se z vrstev: PET aluminiová fólie. Blistr obsahuje 1,2 nebo 4 žvýkací tablety.
Na trhu nemusí být všechny velikosti balení.
PŘÍBALOVÁ INFORMACE
Bravecto 112, 5 mg roztok pro nakapání na kůži - spot-on pro velmi malé psy (2-4,5 kg) Bravecto 250 mg roztok pro nakapání na kůži - spot-on pro malé psy (>4,5-10 kg) Bravecto 500 mg roztok pro nakapání na kůži - spot-on pro střední psy (>10-20 kg) Bravecto 1000 mg roztok pro nakapání na kůži - spot-on pro velké psy (>20-40 kg) Bravecto 1400 mg roztok pro nakapání na kůži - spot-on pro extra velké psy (>40-56 kg)
1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
Držitel rozhodnutí o registraci:
Intervet International B.V.
Wim de Korverstraat 35 5831 AN Boxmeer Nizozemsko
Výrobce odpovědný za uvolnění šarže:
Intervet UK Limited Walton Manor, Walton Milton Keynes Buckinghamshire, MK7 7AJ Spojené Království
2. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Bravecto 112, 5 mg roztok pro nakapání na kůži - spot-on pro velmi malé psy (2-4,5 kg) Bravecto 250 mg roztok pro nakapání na kůži - spot-on pro malé psy (>4,5-10 kg) Bravecto 500 mg roztok pro nakapání na kůži - spot-on pro střední psy (>10-20 kg) Bravecto 1000 mg roztok pro nakapání na kůži - spot-on pro velké psy (>20-40 kg) Bravecto 1400 mg roztok pro nakapání na kůži - spot-on pro extra velké psy (>40-56 kg) fluralanerum
3. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
Jeden ml obsahuje 280 mg fluralanerum.
Každá jednotlivá dávka pipety dodává:
|
Jednotlivá dávka (ml) |
Fluralanerum (mg) | |
|
Velmi malí psi (2-4,5 kg) |
0,4 |
112,5 |
|
Malí psi (>4,5-10 kg) |
0,89 |
250 |
|
Střední psi (>10-20 kg) |
1,79 |
500 |
|
Velcí psi (>20-40 kg) |
3,57 |
1000 |
|
Extra velcí psi (>40-56 kg) |
5,0 |
1400 |
Čirý, bezbarvý až žlutý roztok.
4. INDIKACE
Léčba infestace klíšťaty a blechami u psů.
Veterinární léčivý přípravek má systémový insekticidní a akaricidní účinek poskytující
- okamžitý a trvalý usmrcující účinek na blechy (Ctenocephalides felis a C. canis) trvající 12 týdnů,
- okamžitý a trvalý usmrcující účinek na klíšťata (Ixodes ricinus, Rhipicephalus sanguineus a Dermacentor reticulatus) trvající 12 týdnů
Blechy a klíšťata jsou vystaveny působení účinné látky po kousnutí nebo přisátí na hostitele, kdy přijdou do kontaktu s tělními tekutinami.
Přípravek může být použit jako součást léčebné strategie alergické dermatitidy způsobené bleším kousnutím (FAD).
5. KONTRAINDIKACE
Nepoužívat v případě přecitlivělosti na léčivé látky, nebo na některou z pomocných látek.
6. NEŽÁDOUCÍ ÚČINKY
V klinických studiích často pozorované nežádoucí účinky, jako je erytém nebo alopecie (1,2 % léčených psů) byly mírné a přechodné reakce na kůži v místě aplikace.
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
- velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
Jestliže zaznamenáte jakékoliv závažné nežádoucí účinky či jiné reakce, které nejsou uvedeny v této příbalové informaci, oznamte to prosím vašemu veterinárnímu lékaři.
7. CÍLOVÝ DRUH ZVÍŘAT
Psi
8. DÁVKOVÁNÍ PRO KAŽDÝ DRUH, CESTA(Y) A ZPŮSOB PODÁNÍ
Pro podání nakapáním na kůži- spot-on.
Bravecto podávejte v souladu s následující tabulkou (v závislosti na doporučené dávce 25 - 56 mg fluralaneru/kg živé hmotnosti):
|
Živá hmotnost psa (kg) |
Síla a množství použitých pipet | ||||
|
Bravecto 112,5 mg |
Bravecto 250 mg |
Bravecto 500 mg |
Bravecto 1000 mg |
Bravecto 1400 mg | |
|
2-4,5 kg |
1 | ||||
|
> 4,5-10 kg |
1 | ||||
|
>10-20 kg |
1 | ||||
|
>20-40 kg |
1 | ||||
|
Živá hmotnost psa (kg) |
Síla a množství použitých pipet | ||||
|
Bravecto 112,5 mg |
Bravecto 250 mg |
Bravecto 500 mg |
Bravecto 1000 mg |
Bravecto 1400 mg | |
|
>40-56 kg |
1 | ||||
Pro psy se živou hmotností přesahující 56 kg podávat kombinaci dvou pipet, které jsou nejblíž k požadované hmotnosti.
9. POKYNY PRO SPRÁVNÉ PODÁNÍ
Způsob podání:

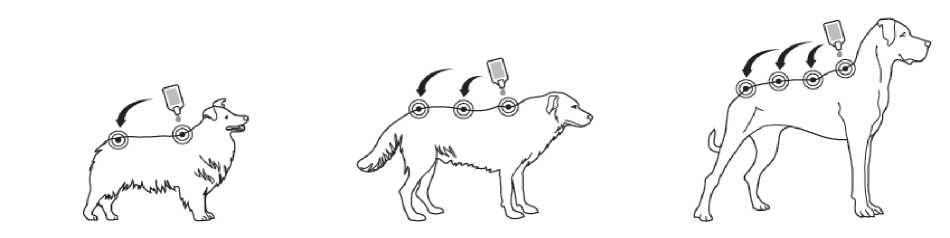
Krok 1: Bezprostředně pře podáním otevřete jeden sáček a vyjměte pipetu. Pro otevření držte pipetu ve svislé poloze (špička nahoru) na bázi nebo na horní pevné častí pod víčkem. Otočte víčkem ve směru nebo proti směru hodinových ručiček o jednu celou otáčku. Víčko zůstává na pipetě, není možné jej odstranit. Pokud bylo cítit lámání těsnění pipeta je otevřena a připravena k aplikaci.
Krok 2: Při aplikaci by mělo zvíře stát nebo ležet se hřbetem v horizontální poloze. Umístěte špičku pipety vertikálně na kůži mezi lopatkami psa.
Krok 3: Jemně zmáčkněte pipetu a aplikujte celý obsah pipety přímo na kůži psa na jedno (pokud je obsah pipety malý) nebo více míst podél linie hřbetu od lopatek po kořen ocasu. Nepoužijte na kterémkoliv místě více než 1 ml roztoku, aby nemohlo dojít k odtečení nebo okapání části roztoku ze
psa.
Léčebné schéma:
Pro optimální kontrolu infestace klíšťaty a bleší infestace podávejte veterinární léčivý přípravek ve 12týdenních intervalech.
10. OCHRANNÁ LHŮTA
Není určeno pro potravinová zvířata.
11. ZVLÁŠTNÍ OPATŘENÍ PRO UCHOVÁVÁNÍ
Uchovávat mimo dosah dětí.
Tento veterinární léčivý přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání. Pipety uchovávejte v původním obalu, aby bylo zabráněno ztrátě roztoku a aby byl přípravek chráněn před vlhkostí. Sáček otevřít bezprostředně před aplikací.
Nepoužívejte veterinární léčivý přípravek po uplynutí doby použitelnosti uvedené na blistru po EXP. Datum použitelnosti končí posledním dnem v uvedeném měsíci.
12. ZVLÁŠTNÍ UPOZORNĚNÍ
Zvláštní upozornění pro každý cílový druh
Nelze vyloučit riziko přenosu onemocnění přenášených parazity, protože účinek fluralaneru je spojen se zahájením příjmu potravy na hostiteli.
Zvláštní opatření pro použití u zvířat
Vyhněte se kontaktu přípravku s očima zvířete. Nepodávat na místa s poraněnou kůží.
Nekoupejte psa nebo mu nedovolte ponořit se do vody nebo plavat ve vodních tocích 3 dny po aplikaci přípravku.
Pro nedostatek dostupných údajů by veterinární léčivý přípravek neměl být použit u psů mladších 8 týdnů a/anebo u psů s hmotností nižší 2 kg.
Nepodávat v intervalech kratších 8 týdnů, protože bezpečnost přípravku nebyla v kratším intervalu testována.
Přípravek je určen pro povrchové podání a nesmí být podáván perorálně.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům Přípravek je nebezpečný při pozření. Uchovávejte přípravek v originálním balení až do doby použití, aby se zabránilo přímému přístupu dětí k přípravku. Po použití pipety okamžitě zlikvidujte. V případě náhodného pozření vyhledejte ihned lékařskou pomoc a ukažte příbalovou informaci nebo etiketu praktickému lékaři.
Přípravek nebo přípravkem zmáčená kůže zvířete může lehce iritovat kůži a/nebo oči. Vyhněte se kontaktu s kůží a/nebo očima, včetně kontaktu rukou s očima. Nejezte, nepijte, nekuřte při manipulaci s veterinárním léčivým přípravkem. Nedotýkejte se, nebo nedovolte dětem dotýkat se místa aplikace do zaschnutí, proto se doporučuje aplikovat přípravek zvířatům večer. V den léčby nedovolte léčeným zvířatům spát v posteli s majitelem, především s dětmi. Bezprostředně po použití si pečlivě umyjte mýdlem a vodou ruce a kůži, která byla v kontaktu s přípravkem. V případě zasažení očí je okamžitě důkladně vypláchněte vodou.
Přípravek je vysoce hořlavý. Uchovávejte mimo dosah tepla, jisker, otevřeného ohně nebo jiných zdrojů pálení.
Léčivá látka přípravku je vysoké míře lipofilní a váže se na kůži. Může se také vázat na povrchy, které se přípravkem potřísní.
Doporučují se následující opatření:
• Při manipulaci s přípravkem a jeho aplikaci psům a kočkám použijte vhodné ochranné rukavice.
• Po rozlití přípravku například na stůl nebo podlahu, odstraňte přípravek pomocí papírové utěrky a vyčistěte povrch detergentem.
Dokud místo aplikace přípravku nebude suché, nedovolte ošetřeným zvířatům být v kontaktu s neošetřenými zvířaty.
Březost, laktace a plodnost:
Veterinární léčivý přípravek lze použít i u chovných zvířat, během březosti a laktace.
Interakce s dalšími léčivými přípravky a další formy interakce Nejsou známy.
Fluralaner se ve vysoké míře váže na plazmatické proteiny a může konkurovat jiným přípravkům, které se významně vážou, jako j sou nesteroidní antiflogistické přípravky (NSAIDs) a kumarinové deriváty warfarinu. Inkubace fluralaneru v plazmě psů v přítomnosti kaprofenu nebo warfarinu v maximálních očekávaných plazmatických koncentracích nesnižuje proteinovou vazbu fluralaneru, kaprofenu nebo warfarinu.
V průběhu terénních klinických studií nebyly pozorovány žádné interakce mezi roztokem pro nakapání na kůži Bravecto a běžně používanými veterinárními léčivými přípravky.
Předávkování (symptomy, první pomoc, antidota), pokud je to nutné
Bezpečnost byla prokázána u štěňat ve věku 8 - 9 týdnů a s hmotností 2,0 - 3,7 kg po 5násobném překročení maximální doporučené dávky podané 3krát a v intervalech kratších než j sou doporučené (intervaly 8 týdnů).
Bezpečnost byla prokázána u chovných zvířat, během březosti a laktace při 3násobném překročení maximální doporučené dávky.
Veterinární léčivý přípravek byl dobře tolerován u psů plemene kolie s deficientním multidrug-resistence proteinem 1 (MDR 1-/-) po jednorázovém perorálním podání 3násobku doporučené dávky.
Tnkompatibility Nejsou známy.
13. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA
Léčivé přípravky se nesmí likvidovat prostřednictvím odpadní vody či domovního odpadu.
O možnostech likvidace nepotřebných léčivých přípravků se poraďte s vaším veterinárním lékařem. Tato opatření napomáhají chránit životní prostředí.
14. DATUM POSLEDNÍ REVIZE PŘÍBALOVÉ INFORMACE
Podrobné informace o veterinárním léčivém přípravku j sou k dispozici na webové stránce Evropské lékové agentury (http: //www .ema.europa.eu/).
15. DALŠÍ INFORMACE
Přípravek přispívá ke kontrole bleší populace v prostředí, ve kterém se léčeni psi pohybují.
K nástupu účinku dochází u blech (C. felis)do 8 hodin a u klíšťat (I. ricinus) do 12 hodin. Jednodávková pipeta z laminované aluminium/polypropylenové fólie uzavřena HDPE víčkem a balena v laminovaném aluminiovém sáčku v papírové krabici s 1 nebo 2 pipetami.
Na trhu nemusí být všechny velikosti balení.
PŘÍBALOVÁ INFORMACE
Bravecto 112, 5 mg roztok pro nakapání na kůži - spot-on pro malé kočky (1,2-2,8 kg) Bravecto 250 mg roztok pro nakapání na kůži - spot-on pro střední kočky (>2,8-6,25 kg) Bravecto 500 mg roztok pro nakapání na kůži - spot-on pro velké kočky (>6,25-12,5 kg)
1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
Držitel rozhodnutí o registraci:
Intervet International B.V.
Wim de Korverstraat 35 5831 AN Boxmeer Nizozemsko
Výrobce odpovědný za uvolnění šarže:
Intervet UK Limited Walton Manor, Walton Milton Keynes Buckinghamshire, MK7 7AJ Spojené Království
2. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Bravecto 112, 5 mg roztok pro nakapání na kůži - spot-on pro malé kočky (1,2-2,8 kg) Bravecto 250 mg roztok pro nakapání na kůži - spot-on pro střední kočky (>2,8-6,25 kg) Bravecto 500 mg roztok pro nakapání na kůži - spot-on pro velké kočky (>6,25-12,5 kg) fluralanerum
3. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
Jeden ml obsahuje 280 mg fluralanerum.
Jedna pipeta dodává:
|
Jednotlivá dávka (ml) |
Fluralanerum (mg) | |
|
pro malé kočky (1,2-2,8 kg) |
0,4 |
112,5 |
|
pro střední kočky (>2,8-6,25 kg) |
0,89 |
250 |
|
pro velké kočky (>6,25-12,5 kg) |
1,79 |
500 |
Čirý, bezbarvý až žlutý roztok.
4. INDIKACE
Léčba infestace klíšťaty a blechami u koček.
Veterinární léčivý přípravek má systémový insekticidní a akaricidní účinek poskytující okamžitý a trvalý usmrcující účinek na blechy (Ctenocephalides felis) a klíšťata (Ixodes ricinus) trvající 12 týdnů.
Blechy a klíšťata jsou vystaveny působení účinné látky po kousnutí nebo přisátí na hostitele, kdy přijdou do kontaktu s tělními tekutinami.
Přípravek může být použit jako součást léčebné strategie alergické dermatitidy způsobené bleším kousnutím (FAD).
5. KONTRAINDIKACE
Nepoužívat v případě přecitlivělosti na léčivé látky, nebo na některou z pomocných látek.
6. NEŽÁDOUCÍ ÚČINKY
V klinických studiích byly často pozorovány tyto nežádoucí účinky: mírné a přechodné reakce na kůži v místě aplikace (u 2,2 % léčených koček), jako jsou zarudnutí a škrábání nebo ztráta chlupů.
Jiné účinky pozorovány krátce po podání jsou: netečnost/třes/nechutenství (0,9% léčených koček), nebo zvracení/nadměrné slinění (0,4 % léčených koček).
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
- velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
Jestliže zaznamenáte jakékoliv závažné nežádoucí účinky či jiné reakce, které nejsou uvedeny v této příbalové informaci, oznamte to prosím vašemu veterinárnímu lékaři.
7. CÍLOVÝ DRUH ZVÍŘAT
Kočky.
8. DÁVKOVÁNÍ PRO KAŽDÝ DRUH, CESTA(Y) A ZPŮSOB PODÁNÍ
Pro podání nakapáním na kůži- spot-on.
Bravecto podávejte v souladu s následující tabulkou (v závislosti na doporučené dávce 40 - 94 mg fluralaneru/kg živé hmotnosti):
|
Živá hmotnost kočky (kg) |
Síla a množství podaných pipet | ||
|
Bravecto 112,5 mg |
Bravecto 250 mg |
Bravecto 500 mg | |
|
1,2-2,8 kg |
1 | ||
|
> 2,8-6,25 kg |
1 | ||
|
>6,25-12,5 kg |
1 | ||
Pro kočky se živou hmotností přesahující 12,5 kg podávat kombinaci dvou pipet, které jsou nejblíž k požadované hmotnosti.
9. POKYNY PRO SPRÁVNÉ PODÁNÍ
Způsob podání:
Krok 1: Bezprostředně pře podáním otevřete jeden sáček a vyjměte pipetu. Pro otevření držte pipetu ve svislé poloze (špička nahoru) na bázi nebo na horní pevné častí pod víčkem. Otočte víčkem ve směru nebo proti směru hodinových ručiček o jednu celou otáčku. Víčko zůstává na pipetě, není možné jej odstranit. Pokud bylo cítit lámání těsnění pipeta je otevřena a připravena k aplikaci.

Krok 2: Při aplikaci by měla kočka stát nebo ležet se hřbetem v horizontální poloze. Umístěte špičku pipety vertikálně na bázi lebky kočky.
Krok 3: Jemně zmáčkněte pipetu a aplikujte celý obsah pipety přímo na kůži kočky. U kočky s hmotností do 6,25 kg aplikujte přípravek na jedno místo na bázi hlavy, a u koček s hmotností
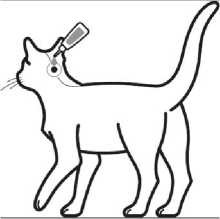
přesahující 6,25 kg na dvě místa.
Léčebné schéma:
Pro optimální kontrolu infestace klíšťaty a bleší infestace podávejte veterinární léčivý přípravek ve 12 týdenních intervalech.
10. OCHRANNÁ LHŮTA
Není určeno pro potravinová zvířata.
11. ZVLÁŠTNÍ OPATŘENÍ PRO UCHOVÁVÁNÍ
Uchovávat mimo dosah dětí.
Tento veterinární léčivý přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání. Pipety uchovávejte v původním obalu, aby bylo zabráněno ztrátě roztoku a aby byl přípravek chráněn před vlhkostí. Sáček otevřít bezprostředně před aplikací.
Nepoužívejte veterinární léčivý přípravek po uplynutí doby použitelnosti uvedené na obalu po EXP. Datum použitelnosti končí posledním dnem v uvedeném měsíci.
12. ZVLÁŠTNÍ UPOZORNĚNÍ
Zvláštní upozornění pro každý cílový druh
Nelze vyloučit riziko přenosu onemocnění přenášených parazity, protože účinek fluralaneru je spojen se zahájením příjmu potravy na hostiteli.
Zvláštní opatření pro použití u zvířat
Vyhněte se kontaktu přípravku s očima zvířete. Nepodávat na místa s poraněnou kůží.
Pro nedostatek dostupných údajů by veterinární léčivý přípravek neměl být použit u koček mladších 11 týdnů a/nebo u koček s hmotností nižší 1,2 kg.
Nepodávat v intervalech kratších 8 týdnů, protože bezpečnost přípravku nebyla v kratším intervalu testována.
Přípravek je určen pro povrchové podání a nesmí být podáván perorálně.
Nedovolte čerstvě ošetřeným zvířatům vzájemné olizování.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům Přípravek je nebezpečný při pozření. Uchovávejte přípravek v originálním balení až do doby použití, aby se zabránilo přímému přístupu dětí k přípravku. Po použití pipety okamžitě zlikvidujte. V případě náhodného pozření vyhledejte ihned lékařskou pomoc a ukažte příbalovou informaci nebo etiketu praktickému lékaři.
Přípravek nebo přípravkem zmáčená kůže zvířete může lehce iritovat kůži a/nebo oči. Vyhněte se kontaktu s kůží a/nebo očima, včetně kontaktu rukou s očima. Nejezte, nepijte, nekuřte při manipulaci s veterinárním léčivým přípravkem. Nedotýkejte se nebo nedovolte dětem dotýkat se místa aplikace do zaschnutí; doporučuje se proto aplikovat přípravek zvířatům večer. V den aplikace nedovolte léčeným zvířatům spát v posteli se svým majitelem, především s dětmi. Bezprostředně po použití si pečlivě umyjte mýdlem a vodou ruce a kůži, která byla v kontaktu s přípravkem. V případě zasažení očí je okamžitě důkladně vypláchněte vodou.
Přípravek je vysoce hořlavý. Uchovávejte mimo dosah tepla, jisker, otevřeného ohně nebo jiných zdrojů pálení.
Léčivá látka přípravku je vysoké míře lipofilní a váže se na kůži. Může se také vázat na povrchy, které se přípravkem potřísní.
Doporučují se následující opatření:
• Při manipulaci s přípravkem a jeho aplikaci psům a kočkám použijte vhodné ochranné
rukavice.
• Po rozlití přípravku například na stůl nebo podlahu, odstraňte přípravek pomocí papírové utěrky
a vyčistěte povrch detergentem.
Dokud místo aplikace přípravku nebude suché, nedovolte ošetřeným zvířatům být v kontaktu s neošetřenými zvířaty.
Březost, laktace a plodnost:
Nebyla stanovena bezpečnost veterinárního léčivého přípravku pro použití během březosti a laktace. Použít pouze po zvážení terapeutického přínosu/rizika příslušným veterinárním lékařem.
Interakce s dalšími léčivými přípravky a další formy interakce Nejsou známy.
Fluralaner se ve vysoké míře váže na plazmatické proteiny a může konkurovat jiným přípravkům, které se významně vážou, jako jsou nesteroidní antiflogistické přípravky (NSAIDs) a kumarinové deriváty warfarinu. Inkubace fluralaneru v plazmě psů v přítomnosti kaprofenu nebo warfarinu v maximálních očekávaných plazmatických koncentracích nesnižuje proteinovou vazbu fluralaneru, kaprofenu nebo warfarinu.
V průběhu terénních klinických studií nebyly pozorovány žádné interakce mezi roztokem pro nakapání na kůži Bravecto pro kočky a běžně používanými veterinárními léčivými přípravky.
Předávkování (symptomy, první pomoc, antidota), pokud je to nutné
Bezpečnost byla prokázána u koťat ve věku 11 - 13 týdnů a s hmotností 1,2 - 1,5 kg po 5- násobném překročení maximální doporučené dávky podané 3krát a v intervalech kratších než j sou doporučené (intervaly 8 týdnů).
Perorální příjem maximální doporučené dávky přípravku byl u koček dobře tolerován kromě nepatrného slinění, které samovolně odezní, a kašlu nebo zvracení bezprostředně po aplikaci.
Inkompatibility Nejsou známy.
13. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA
Léčivé přípravky se nesmí likvidovat prostřednictvím odpadní vody či domovního odpadu.
O možnostech likvidace nepotřebných léčivých přípravků se poraďte s vaším veterinárním lékařem. Tato opatření napomáhají chránit životní prostředí.
14. DATUM POSLEDNÍ REVIZE PŘÍBALOVÉ INFORMACE
Podrobné informace o veterinárním léčivém přípravku jsou k dispozici na webové stránce Evropské lékové agentury (http: //www .ema.europa.eu/).
15. DALŠÍ INFORMACE
Přípravek přispívá ke kontrole bleší populace v prostředí, ve kterém se léčení psi pohybují.
K nástupu účinku dochází u blech (C. felis) do 12 hodin a u klíšťat (I. ricinus) do 48 hodin po uchycení.
Jednodávková pipeta z laminované aluminium/polypropylenové fólie uzavřena HDPE víčkem a balena v laminovaném aluminiovém sáčku v papírové krabici s 1 nebo 2 pipetami.
Na trhu nemusí být všechny velikosti balení.
51