Blastomat 250 Mg
Sp.zn. sukls196748/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Blastomat 5 mg Blastomat 20 mg Blastomat 100 mg Blastomat 140 mg Blastomat 180 mg Blastomat 250 mg Tvrdé tobolky
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Blastomat 5 mg: Jedna tvrdá tobolka obsahuje temozolomidum 5 mg. Blastomat 20 mg: Jedna tvrdá tobolka obsahuje temozolomidum 20 mg. Blastomat 100 mg: Jedna tvrdá tobolka obsahuje temozolomidum 100 mg. Blastomat 140 mg: Jedna tvrdá tobolka obsahuje temozolomidum 140 mg. Blastomat 180 mg: Jedna tvrdá tobolka obsahuje temozolomidum 180 mg. Blastomat 250 mg: Jedna tvrdá tobolka obsahuje temozolomidum 250 mg.
Pomocné látky se známým účinkem:
Blastomat 5 mg: Jedna 5 mg tvrdá tobolka obsahuje 399,3 mg laktosy.
Blastomat 20 mg: Jedna 20 mg tvrdá tobolka obsahuje 384,3 mg laktosy.
Blastomat 100 mg: Jedna 100 mg tvrdá tobolka obsahuje 61,7 mg laktosy.
Blastomat 140 mg: Jedna 140 mg tvrdá tobolka obsahuje 86,4 mg laktosy.
Blastomat 180 mg: Jedna 180 mg tvrdá tobolka obsahuj e 111,1 mg laktosy.
Blastomat 250 mg: Jedna 250 mg tvrdá tobolka obsahuje 154,3 mg laktosy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tvrdá tobolka
5 mg: Tvrdé želatinové tobolky mají velikost 0 a mají zelené neprůhledné víčko a bílé neprůhledné tělo s černě vytištěným číslem 5 na těle.
20 mg: Tvrdé želatinové tobolky mají velikost 0 a mají oranžové neprůhledné víčko a bílé neprůhledné tělo s černě vytištěným číslem 20 na těle.
100 mg: Tvrdé želatinové tobolky mají velikost 0 a mají fialové neprůhledné víčko a bílé neprůhledné tělo s černě vytištěným číslem 100 na těle.
140 mg: Tvrdé želatinové tobolky mají velikost 0 a mají modré neprůhledné víčko a bílé neprůhledné tělo s černě vytištěným číslem 140 na těle.
180 mg: Tvrdé želatinové tobolky mají velikost 0 a mají čokoládově hnědé neprůhledné víčko a bílé neprůhledné tělo s černě vytištěným číslem 180 na těle.
250 mg: Tvrdé želatinové tobolky mají velikost 0 a mají bílé neprůhledné víčko a bílé neprůhledné tělo s černě vytištěným číslem 250 na těle.
4.
KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Blastomat tvrdé tobolky je určen k léčbě:
- dospělých pacientů s nově diagnostikovaným multiformním glioblastomem souběžně s radioterapií (RT) a následně jako monoterapeutická léčba.
- dětí ve věku od tří let, dospívajících a dospělých pacientů s maligním gliomem, jako je multiformní glioblastom nebo anaplastický astrocytom, u nichž se po standardní léčbě objevují rekurence nebo progrese.
4.2 Dávkování a způsob podání
Blastomat tvrdé tobolky smí být předepisován výhradně lékařem se zkušenostmi s onkologickou léčbou
nádorů mozku.
Může se podávat antiemetická léčba (viz bod 4.4).
Dávkování
Dospělí _pacienti s nově diagnostikovaným multiformním glioblastomem
Blastomat tvrdé tobolky je podáván v kombinaci s fokální radioterapií (fáze souběžné léčby) s následnými až 6 cykly monoterapie temozolomidem (TMZ), (monoterapeutická fáze).
Fáze souběžné léčby
TMZ se podává perorálně v dávce 75 mg/m2 denně po dobu 42 dnů souběžně s fokální radioterapií (60 Gy podáno ve 30 frakcích). Snižování dávek se nedoporučuje, ale každý týden by se mělo rozhodnout o pozdržení nebo přerušení podávání TMZ podle kritérií hematologické a nehematologické toxicity. Podávání TMZ může pokračovat po celou dobu 42 dnů souběžné fáze (až do 49 dnů), jestliže jsou splněny všechny následující podmínky:
- absolutní počet neutrofilů (ANC) > 1,5 x 109/l
- počet trombocytů > 100 x 109/l
- běžná kritéria toxicity (CTC) nehematologické toxicity < stupeň 1 (s výjimkou alopecie, nauzey a zvracení).
Během léčby je nutné každý týden vyšetřit celkový krevní obraz. Podávání TMZ má být během fáze souběžné léčby dočasně přerušeno nebo trvale ukončeno podle kritérií hematologické a nehematologické toxicity, jak je uvedeno v Tabulce 1.
|
Tabulka 1. Přerušení nebo ukončení podávání TMZ během souběžné léčby radioterapií a TMZ | ||
|
Toxicita |
TMZ přerušení1 |
TMZ ukončení |
|
Absolutní počet neutrofilů |
> 0,5 a < 1,5 x 109/l |
< 0,5 x 109/l |
|
Počet trombocytů |
> 10 a < 100 x 109/l |
< 10 x 109/l |
|
CTC nehematologická toxicita (s výjimkou alopecie, nauzey, zvracení) |
CTC stupeň 2 |
CTC stupeň 3 nebo 4 |
a: Léčba se souběžně podávaným TMZ může pokračovat, jestliže jsou splněny všechny následující podmínky: absolutní počet neutrofilů > 1,5 x 109 / l; počet trombocytů > 100 x 109 / l; CTC nehematologická toxicita < stupeň 1 (s výjimkou alopecie, nauzey, zvracení).
Monoterapeutická fáze
Čtyři týdny po ukončení souběžné fáze TMZ + RT se TMZ podává až v 6 cyklech monoterapeutické léčby. Dávka Cyklu 1 (monoterapie) je 150 mg/m2 jednou denně po dobu 5 dnů, následovaná 23 dny bez léčby. Na začátku Cyklu 2 je dávka zvýšena na 200 mg/m2, jestliže CTC nehematologická toxicita pro Cyklus 1 je stupeň < 2 (s výjimkou alopecie, nauzey a zvracení), absolutní počet neutrofilů (ANC) je >
1,5 x 109/l a počet trombocytů je > 100 x 109/l. Jestliže není dávka zvýšena v Cyklu 2, nemá být zvýšení prováděno v následných cyklech. Je-li jednou zvýšena, zůstává dávka 200 mg/m2 na den pro prvních 5 dnů každého následujícího cyklu s výjimkou vzniku toxicity. Snížení dávky a ukončení podávání v průběhu monoterapeutické fáze se má provádět podle Tabulek 2 a 3.
V průběhu léčby má být ve dni 22 (21 dnů po první dávce TMZ) vyšetřen celkový krevní obraz. Dávka má být redukována nebo podávání přípravku ukončeno podle Tabulky 3.
|
Tabulka 2. Úrovně dávky TMZ pro monoterapeutickou léčbu | ||
|
Úroveň dávky |
Dávka TMZ (mg/m2/den) |
Poznámky |
|
-1 |
100 |
Redukce kvůli předchozí toxicitě |
|
0 |
150 |
Dávka během Cyklu 1 |
|
1 |
200 |
Dávka během Cyklů 2-6 při absenci toxicity |
|
Tabulka 3. Snížení dávky nebo ukončení podávání TMZ během monoterapeutické léčby | ||
|
Toxicita |
Redukce TMZ o 1 úroveň dávkya |
Ukončení TMZ |
|
Absolutní počet neutrofilů |
< 1,0 x 109/l |
Viz poznámka pod čarou 3 |
|
Počet trombocytů |
< 50 x 109/l |
Viz poznámka pod čarou 3 |
|
CTC nehematologická toxicita (s výjimkou alopecie, nauzey, zvracení) |
CTC stupeň 3 |
CTC stupeň 4b |
a Úrovně dávky TMZ jsou uvedeny v Tabulce 2. b TMZ se ukončí, jestliže:
• výsledkem úrovně dávky -1 (100 mg/m2) je stále neakceptovatelná toxicita
• se po redukci dávky znovu objeví stejný stupeň 3 nehematologické toxicity (s výjimkou alopecie, nauzey, zvracení).
Dospělí_pacienti a děti ve věku 3 let nebo starší s rekurentním nebo _progredujícím maligním gliomem: Léčebný cyklus zahrnuje 28 dnů. U pacientů, kteří dosud nebyli léčeni chemoterapií, se TMZ podává perorálně v dávce 200 mg/m2 jedenkrát denně po dobu prvních 5 dnů s následným přerušením léčby po dobu 23 dnů (celkem 28 dnů). U nemocných, kteří již dříve prodělali chemoterapii, činí zahajovací dávka 150 mg/m2 jedenkrát denně, která se pak ve druhém cyklu zvyšuje na 200 mg/m2 jedenkrát denně po dobu 5 dnů, pokud nejsou přítomny známky hematotoxicity (viz bod 4.4).
Zvláštní skupiny _pacientů
Pediatrická populace
U dětí ve věku 3 let nebo starších se může TMZ používat pouze pro léčbu rekurentního nebo progredujícího maligního gliomu. Nejsou žádné klinické zkušenosti s podáváním TMZ u dětí mladších 3 let. Zkušenosti s podáváním u starších dětí jsou velmi omezené (viz body 4.4 a 5.1).
Pacienti s poruchou funkce jater nebo ledvin
Farmakokinetika TMZ je u pacientů s normální jatemí funkcí a s mírnou nebo středně těžkou poruchou funkce jater srovnatelná. Údaje o podání TMZ u pacientů s těžkou poruchou fujnkce jater (Třída C podle Childovy klasifikace), ani s poruchou funkce ledvin nejsou k dispozici. Vzhledem k uvedeným farmakokinetickým vlastnostem TMZ je však pravděpodobné, že ani u nemocných s těžkou poruchou funkce jater nebo poruchou funkce ledvin kteréhokoli stupně není snižování jeho dávek nutné. Při podávání TMZ těmto nemocným je však nutná zvýšená opatrnost.
Starší pacienti
Z populační analýzy farmakokinetiky u pacientů ve věku 19-78 let vyplývá, že clearance TMZ není ovlivňována věkem. Nicméně se zdá, že starší pacienti (ve věku > 70 let) mají vyšší riziko vzniku neutropenie a trombocytopenie (viz bod 4.4).
Způsob podávání
Blastomat tvrdé tobolky se má užívat nalačno.
Tobolky se musejí polykat vcelku a zapíjet sklenicí vody a nesmějí se otevírat nebo kousat.
Pokud se po podání dávky dostaví zvracení, nemá být další dávka podána tentýž den.
4.3 Kontraindikace
- Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku (viz bod 6.1).
- Hypersenzitivita na dakarbazin (DTIC).
- Těžká myelosuprese (viz bod 4.4).
4.4 Zvláštní upozornění a opatření pro použití
Oportunní infekce a reaktivace infekcí
Během léčby pomocí TMZ byly pozorovány oportunní infekce (jako je pneumonie způsobená Pneumocystis jiroveci) a reaktivace infekcí (jako jsou HBV, CMV) (viz bod 4.8).
Pneumonie vyvolaná Pneumocystis _ jiroveci
U pacientů, kteří dostávali souběžně TMZ a RT v pilotní studii s prodlouženým harmonogramem 42 dnů, bylo zjištěno zvýšené riziko vzniku pneumonie způsobené Pneumocystis jiroveci (PCP). Proto je nutná profylaxe PCP u všech pacientů, kteří dostávají souběžně TMZ a RT po dobu 42 denního režimu (maximálně 49 dnů) bez ohledu na počet lymfocytů. Jestliže se objeví lymfopenie, je třeba pokračovat v profylaxi, dokud se neobnoví stupeň lymfopenie < 1.
Výskyt PCP může být vyšší, když je TMZ podáván během delšího dávkovacího režimu. Nicméně všichni pacienti, kteří dostávají TMZ, zvláště pacienti dostávající steroidy, mají být pečlivě sledováni pro vznik PCP, bez ohledu na režim. Případy fatálního respiračního selhání byly hlášeny u pacientů užívajících TMZ, zvláště v kombinaci s dexametazonem nebo jinými steroidy.
HBV
Byla hlášena hepatitida způsobená reaktivací viru hepatitidy B (HBV), v některých případech vedoucí ke smrti. Před zahájením léčby pacientů s pozitivní sérologií na hepatitidu B (včetně těch s aktivním onemocněním) je nezbytná konzultace s odborníky na onemocnění jater. Během léčby musí být pacienti náležitě monitorováni a vedeni.
Hepatotoxicita
U pacientů léčených TMZ byla hlášena porucha funkce jater, včetně smrtelného jaterního selhání (viz bod 4.8). Před zahájením léčby je nutné provést testy jaterních funkcí. Pokud jsou výsledky abnormální, musí lékař před zahájením léčby temozolomidem vyhodnotit poměr přínosů a rizik, včetně potenciálu ke smrtelnému selhání jater. U pacientů s 42denním léčebným cyklem je nutné opakovat testy jatemích funkcí uprostřed léčebného cyklu. Pro všechny pacienty platí, že jaterní funkce je nutno zkontrolovat po každém léčebném cyklu. U pacientů s výraznými abnormalitami jaterních funkcí musí lékař vyhodnotit poměr přínosů a rizik vyplývajících z pokračování v léčbě. Jaterní toxicita se může projevit několik nebo i více týdnů po poslední léčbě temozolomidem.
Malignity
Byly též velmi vzácně hlášeny případy myelodysplastického syndromu a sekundárních malignit, včetně myeloidní leukemie (viz bod 4.8).
Antiemetická léčba
Nauzea a zvracení jsou velmi často spojené s TMZ. Před nebo po podání TMZ se může podávat antiemetická léčba.
Dospělí pacienti s nově diagnostikovaným multiformním glioblastomem
Antiemetická profylaxe se doporučuje před počáteční dávkou souběžné fáze a velmi doporučuje během monoterapeutické fáze.
Pacienti s rekurentním nebo progredujícím maligním gliomem
Antiemetika může být třeba podat pacientům, u nichž v předchozích léčebných cyklech došlo k těžšímu zvracení (stupeň 3 nebo 4).
Laboratorní parametry
U pacientů léčených TMZ může dojít myelosupresi, včetně prodloužené pancytopenie, která může vést k aplastické anémii, která v některých případech vedla k úmrtí. V některých případech expozice současně užívaným léčivým přípravkům spojená s aplastickou anémií, zahrnující karbamazepin, fenytoin a sulfamethoxazol / trimethoprim, komplikuje posouzení. Před zahájením podávání přípravku mají být splněny následující laboratorní parametry: ANC > 1,5 x 109/l a počet trombocytů > 100 x 109/l.
Kompletní krevní obraz je třeba vyšetřit ve 22. dni (21 dnů po podání 1. dávky) nebo v průběhu 48 hodin po tomto dni, a pak v týdenních intervalech do té doby, dokud není ANC > 1,5 x 109/l a počet trombocytů > 100 x 109/l. Jestliže v průběhu kteréhokoli cyklu poklesne ANC na < 1,0 x 109/l nebo počet trombocytů na < 50 x 109/l, má být v následném cyklu dávka o jeden stupeň snížena (viz bod 4.2). Jednotlivé stupně dávky činí 100 mg/m2, 150 mg/m2 a 200 mg/m2. Nejnižší doporučená dávka je 100 mg/m2.
Pediatrická populace
S podáváním TMZ dětem ve věku nižším než 3 roky nejsou dosud žádné klinické zkušenosti. U starších dětí a dospívajících jsou zkušenosti velmi omezené (viz body 4.2 a 5.1).
Starší pacienti (ve věku > 70 let)
U starších pacientů je ve srovnání s mladšími osobami pravděpodobně vyšší riziko neutropenie a trombocytopenie. Vzhledem k tomu je při podávání TMZ ve vyšším věku nutná zvýšená opatrnost.
Pacienti mužského pohlaví
Muži léčení TMZ mají být upozorněni, aby se do 6 měsíců od užití poslední dávky nestali otci a aby se před zahájením léčby informovali o možnosti kryokonzervace spermatu (viz bod 4.6).
Laktóza
Tento léčivý přípravek obsahuje laktózu. Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným deficitem laktázy nebo glukózo-galaktózovou malabsorpcí by proto neměli tento přípravek užívat.
4.5
Interakce s jinými léčivými přípravky a jiné formy interakce
Podávání TMZ spolu s ranitidinem nemělo v oddělené studii fáze I za následek žádné změny rozsahu absorpce temozolomidu nebo expozice jeho aktivnímu metabolitu monomethyl- triazenoimidazol-karboxamidu (MTIC).
Podávání TMZ spolu s jídlem vedlo k poklesu Cmax o 33 % a zmenšení plochy pod křivkou koncentrace (AUC) o 9 %. Protože nelze vyloučit, že změna Cmax může být klinicky významná, nemá se Blastomat podávat současně s jídlem.
Výsledky analýzy populační farmakokinetiky ve II. fázi klinických studií prokazují, že nebyla clearance TMZ ovlivněna současným podáním dexamethasonu, prochlorperazinu, fenytoinu, karbamazepinu, ondansetronu, antagonistů H2 receptorů nebo fenobarbitalu. Současné podávání kyseliny valproové bylo spojeno s malým, nicméně statisticky významným poklesem clearance TMZ.
Dosud nebyly provedeny žádné studie, které by hodnotily účinek TMZ na metabolismus nebo eliminaci jiných léků. Nicméně vzhledem k tomu, že TMZ neprochází přeměnou v játrech a na plazmatické bílkoviny se váže jen v malé míře, je málo pravděpodobné, že by ovlivňoval farmakokinetiku jiných léčivých přípravků (viz bod 5.2).
V kombinaci s jinými myelosupresivními látkami může TMZ zvýšit pravděpodobnost myelosuprese. Pediatrická populace
Studie interakcí byly provedeny pouze u dospělých pacientů.
4.6 Fertilita, těhotenství a kojení
Adekvátní údaje o podávání léčivé látky těhotným ženám nejsou k dispozici. V preklinických studiích u potkanů a králíků, kteří TMZ dostávali v dávce 150 mg/m2, byly prokázány teratogenní a/nebo toxické účinky na plod (viz bod 5.3). Blastomat tvrdé tobolky nemají být podávány těhotným ženám. Pokud je přece jen nutno zvážit použití během těhotenství, je třeba pacientku seznámit s potenciálním rizikem pro plod.
Kojení
Není známo, zda se TMZ vylučuje do mateřského mléka; kojení se proto má po dobu léčby TMZ přerušit. Ženy ve fertilním věku
Ženám ve fertilním věku je třeba doporučit užívání účinné antikoncepce k zabránění otěhotnění v průběhu užívání TMZ.
Mužská fertilita
TMZ může mít genotoxické účinky. Proto se mužům léčeným temozolomidem nedoporučuje, aby se do 6 měsíců od užití poslední dávky stali otci,s a naopak se doporučuje, vzhledem k možnosti ireverzibilní infertilitě po léčbě TMZ, ještě před jejím zahájením konzultovat s lékařem možnost kryokonzervace předem odebraných spermií.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Schopnost řízení motorových vozidel a obsluhy strojů může být u pacientů užívajících TMZ v důsledku únavy a ospalosti snížena (viz bod 4.8).
4.8 Nežádoucí účinky
Zkušenosti z klinických hodnocení
U pacientů léčených TMZ, ať už užívaným v kombinaci s RT nebo ve formě monoterapie následující po RT v případě nově diagnostikovaného multiformního glioblastomu, nebo ve formě monoterapie pacientů s rekurentním nebo progredujícím gliomem, byly velmi často hlášené podobné nežádoucí účinky: nauzea, zvracení, zácpa, anorexie, bolest hlavy a únava. Křeče byly hlášeny velmi často u nově diagnostikovaných pacientů s multiformním glioblastomem léčených monoterapií, vyrážka byla hlášena velmi často u nově diagnostikovaných pacientů s multiformním glioblastomem léčených TMZ v kombinaci s RT nebo také ve formě monoterapie a často u pacientů s rekurentním gliomem. Většina hematologických nežádoucích účinků byla hlášena u obou indikací často nebo velmi často (Tabulky 4 a 5); četnost laboratorních nálezů stupně 3 a 4 je uvedena za každou tabulkou.
V tabulkách jsou nežádoucí účinky klasifikovány podle orgánových systémů a četnosti. Zařazení do skupin četností se provádí podle následujícího pravidla: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1 000 až < 1/100); vzácné (>1/10000 až <1/1000) a velmi vzácné (<1/10000). V každé skupině četností jsou nežádoucí účinky seřazeny /podle klesající závažnosti.
Nově diagnostikovaný multiformní glioblastom
Tabulka 4 ukazuje nežádoucí účinky, které se objevily při léčbě u pacientů s nově diagnostikovaným multiformním glioblastomem během souběžné a monoterapeutické fáze léčby.
|
Tabulka 4: Nežádoucí účinky, které se objevily během souběžné a monoterapeutické léčby u pacientů s nově diagnostikovaným multiformním glioblastomem | |||
|
Třída orgánového systému |
TMZ + souběžná RT n=288* |
TMZ monoterapie n = 224 | |
|
Infekce a infestace | |||
|
Časté: |
Infekce, herpes simplex, ranná infekce, faryngitida, orální kandidóza |
Infekce, orální kandidóza | |
|
Méně časté: |
Herpes simplex, herpes zoster, symptomy podobné chřipce | ||
|
Poruchy krve a lymfatického systému | |||
|
Časté: |
Neutropenie, trombocytopenie, lymfopenie, leukopenie |
Febrilní neutropenie, trombocytopenie, anémie, leukopenie | |
|
Méně časté: |
Febrilní neutropenie, anémie |
Lymfopenie, petechie | |
|
Endokrinní poruchy | |||
|
Méně časté: |
Cushingoidní syndrom |
Cushingoidní syndrom | |
|
Poruchy metabolismu a výživy | |||
|
Velmi časté: | |||
|
Časté: |
Hyperglykemie, pokles hmotnosti |
Pokles tělesné hmotnosti | |
|
Méně časté: |
Hypokalemie, zvýšení alkalické fosfatázy, zvýšení tělesné hmotnosti |
Hyperglykemie, zvýšení tělesné hmotnosti | |
|
Psychiatrické poruchy | |||
|
Časté: |
Úzkost, emoční labilita, nespavost | ||
|
Méně časté: |
Neklid, apatie, poruchy chování, deprese, halucinace |
Halucinace, amnézie | |
|
Poruchy nervového systému | |||
|
Velmi časté: |
Konvulze, bolest hlavy | ||
|
Časté: |
Konvulze, porucha vědomí, somnolence, afázie, porucha rovnováhy, závrať, zmatenost, porucha paměti, porucha koncentrace, neuropatie, parestézie, porucha řeči, třes |
Hemiparéza, afázie, porucha rovnováhy, somnolence, zmatenost, závrať, porucha paměti, porucha koncentrace, dysfázie, neurologická porucha (NOS), neuropatie, periferní neuropatie, parestézie, porucha řeči, třes |
|
Méně časté: |
Status epilepticus, extrapyramidální porucha, hemiparéza, ataxie, poruchy kognice, dysfázie, abnormální chůze, hyperestézie, hypestézie, neurologická porucha (NOS), periferní neuropatie |
Hemiplegie, ataxie, abnormální koordinace, abnormální chůze, hyperestézie, senzorická porucha |
|
Poruchy oka | ||
|
Časté: |
Rozmazané vidění |
Defekt zorného pole, rozmazané vidění, diplopie |
|
Méně časté: |
Hemianopie, zmenšená ostrost vidění, poruchy zraku, defekt zorného pole, bolest oka |
Snížená ostrost vidění, bolest oka, suché oči |
|
Poruchy ucha a labyrintu | ||
|
Časté: |
Porucha sluchu |
Porucha sluchu, tinitus |
|
Méně časté: |
Otitis media, tinitus, hyperakuze, bolest ucha |
Hluchota, závratě, bolest ucha |
|
Srdeční poruchy | ||
|
Méně časté: |
Palpitace | |
|
Cévní poruchy | ||
|
Časté: |
Hemoragie, edém, edém nohou |
Hemoragie, hluboká žilní trombóza, edém nohou |
|
Méně časté: |
Cerebrální hemoragie, hypertenze |
Plicní embolie, edém, periferní edém |
|
Respirační, hrudní a mediastinální poruchy | ||
|
Časté: | ||
|
Méně časté: |
Pneumonie, infekce horních cest dýchacích, nosní kongesce |
Pneumonie, sinusitida, infekce horních cest dýchacích, bronchitida |
|
Gastrointestinální poruchy | ||
|
Velmi časté: | ||
|
Časté: |
Stomatitida, průjem, bolest břicha, dyspepsie, dysfagie | |
|
Méně časté: |
Abdominální distenze, fekální inkontinence, gastrointestinální porucha (NOS), gastroenteritida, hemoroidy | |
|
Poruchy kůže a podkožní tkáně | ||
|
Velmi časté: |
Vyrážka, alopecie |
Vyrážka, alopecie |
|
Časté: |
Dermatitida, suchá kůže, erytém, svědění |
Suchá kůže, svědění |
|
Méně časté: |
Exfoliace kůže, fotosenzitivní reakce, abnormální pigmentace |
Erytém, abnormální pigmentace, zvýšené pocení | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | |||
|
Časté: |
Svalová slabost, artralgie |
Svalová slabost, artralgie, muskuloskeletální bolest, myalgie | |
|
Méně časté: |
Myopatie, bolest v zádech, muskuloskeletální bolest, myalgie |
Myopatie, bolest v zádech | |
|
Poruchy ledvin a močových cest | |||
|
Časté: |
Časté močení, močová inkontinence |
Močová inkontinence | |
|
Méně časté: | |||
|
Poruchy reprodukčního systému a prsu | |||
|
Méně časté: |
Impotence |
Vaginální hemoragie, menoragie, amenorea, vaginitida, bolest prsou | |
|
Celkové poruchy a reakce v místě aplikace | |||
|
Velmi časté: |
Únava |
Únava | |
|
Časté: |
Alergická reakce, horečka, radiační poškození, edém obličeje, bolest, změna chuti |
Alergická reakce, horečka, radiační poškození, bolest, změna chuti | |
|
Méně časté: |
Astenie, zrudnutí, návaly horka, zhoršení stavu, rigor, změna barvy j azyka, parosmie, žízeň |
Astenie, edém obličeje, bolest, zhoršení stavu, rigor, zubní potíže | |
|
Vyšetření | |||
|
Časté: |
Zvýšené ALT |
Zvýšené ALT | |
|
Méně časté: |
Zvýšené jaterní enzymy, zvýšené gama GT, zvýšené AST | ||
*Pacient, který byl randomizován pouze do větve RT, obdržel temozolomid + RT.
Laboratorní výsledky
Byla zjištěna myelosuprese (neutropenie a trombocytopenie), která je známou toxicitou limitující dávku většiny cytotoxických látek včetně TMZ. Když byly zkombinovány abnormality laboratorních testů a nežádoucí účinky v souběžných a monoterapeutických fázích léčby, byly pozorovány u 8 % pacientů abnormality neutrofilů stupeň 3 nebo stupeň 4, včetně neutropenických případů. Stupeň nebo stupeň 4 abnormalit trombocytů, včetně trombocytopenických případů, byl pozorován u 14 % pacientů, kteří dostávali TMZ.
Rekurentní nebo progredující maligní gliom
Nejčastěji se vyskytujícími nežádoucími účinky ve vztahu k léčbě byly v provedených klinických studiích gastrointestinální poruchy, především nauzea (43 %) a zvracení (36 %). Tyto reakce dosahovaly obvykle pouze stupně 1 nebo 2 (0-5 epizod zvracení během 24 hodin) a buď spontánně odezněly, nebo byly snadno léčitelné standardní antiemetickou léčbou. Incidence těžké nauzey a zvracení činila 4 %.
Tabulka 5 obsahuje nežádoucí účinky, které byly hlášeny v průběhu klinických studií pro rekurentní nebo progredující maligní gliom a po uvedení temozolamidu na trh.
Tabulka 5. Nežádoucí účinky u pacientů s rekurentním nebo progredujícím maligním gliomem Infekce a infestace
|
způsobené PCP | |
|
Poruchy krve a lymfatického systému | |
|
Velmi časté: |
Neutropenie nebo lymfopenie (stupeň 3-4), trombocytopenie (stupeň 3-4) |
|
Méně časté: |
Pancytopenie, anémie (stupeň 3-4), leukopenie |
|
Poruchy metabolismu a výživy | |
|
Velmi časté: | |
|
Časté: |
Pokles tělesné hmotnosti |
|
Poruchy nervového systému | |
|
Velmi časté: | |
|
Časté: |
Somnolence, závratě, parestézie |
|
Respirační, hrudní a mediastinální poruchy | |
|
Časté: | |
|
Gastrointestinální poruchy | |
|
Velmi časté: | |
|
Časté: | |
|
Poruchy kůže a podkožní tkáně | |
|
Časté: |
Vyrážka, pruritus, alopecie |
|
Velmi vzácné: |
Multiformní erytém, erytrodermie, urtikarie, exantém |
|
Celkové poruchy a reakce v místě aplikace | |
|
Velmi časté: |
Únava |
|
Časté: | |
|
Velmi vzácné: |
Alergické reakce včetně anafylaxe, angioedém |
Laboratorní výsledky
Trombocytopenie a neutropenie stupně 3 nebo 4 byly zaznamenány u 19 %, resp. 17 % pacientů léčených pro maligní gliom. K hospitalizaci a/nebo přerušení léčby TMZ vedly v 8 %, resp. 4% případů. Myelosuprese byla předvídatelná (obvykle k ní došlo během několika prvních cyklů, s nadirem mezi 21. dnem a 28. dnem) a úprava k normě byla rychlá, obvykle v průběhu 1 - 2 týdnů. Kumulace myelosupresivních účinků prokázána nebyla. Přítomnost trombocytopenie může zvýšit riziko krvácení a přítomnost neutropenie nebo leukopenie může zvýšit riziko infekce.
Pohlaví
Do analýzy populační farmakokinetiky založené na zkušenostech z klinického hodnocení bylo zahrnuto 101 žen a 169 mužů, u kterých byla dostupná měření nadiru neutrofilů, a 110 žen a 174 mužů, u kterých byla dostupná měření nadiru trombocytů. U žen bylo ve srovnání s muži v prvním cyklu terapie zaznamenáno více neutropenií stupně 4 (ANC< 0,5 x 109/l ), 12% vs 5 %, a trombocytopenií (< 20 x 109/l), 9% vs 3 %. V souboru dat od 400 jedinců s rekurentním gliomem se v prvním cyklu terapie objevila neutropenie stupně 4 u 8 % žen vs 4 % mužů a trombocytopenie stupně 4 u 8 % žen vs 3 % mužů. Ve studii s 288 jedinci s nově diagnostikovaným multiformním glioblastomem se v prvním cyklu terapie vyskytla neutropenie stupně 4 u 3 % žen vs 0 % mužů a trombocytopenie stupně 4 u 1 % žen vs 0 % mužů.
Pediatrická populace
Perorální TMZ byl zkoumán u pediatrických pacientů (věk 3-18 let) s rekurentním gliomem mozkového kmene a rekurentním astrocytomem vysokého stupně v denním režimu podávání po dobu pěti dnů každých 28 dnů. Ačkoliv je omezené množství dat, očekává se, že tolerance u dětí bude stejná jako u dospělých. Bezpečnost TMZ u dětí mladších tří let nebyla stanovena.
Zkušenosti po uvedení na trh
Po uvedení na trh byly identifikovány následující další závažné nežádoucí účinky:
|
Tabulka 6. Souhrn nežádoucích účinků hlášených u temozolomidu po uvedení na trh * | |
|
Infekce a infestace* | |
|
Méně časté: |
infekce způsobená cytomegaloviry, reaktivace infekce způsobené virem jako je cytomegalovirus, virus hepatitidy Bf |
|
Poruchy krve a lymfatického systému | |
|
Velmi vzácné: |
dlouhodobá (prolongovaná) pancytopenie, aplastická anémief |
|
Novotvary benigní, maligní a blíže neurčené (za |
írnující cysty a polypy) |
|
Velmi vzácné: |
myelodysplastický syndrom (MDS), druhotné (sekundární) malignity včetně myeloidní leukémie |
|
Endokrinní poruchy* | |
|
Méně časté: |
diabetes insipidus |
|
Respirační, hrudní a mediastinální poruchy | |
|
Velmi vzácné: |
intersticiální pneumonie/pneumonie, plicní fibróza, respirační selháníf |
|
Poruchy jater a žlučových cest* | |
|
Časté: |
zvýšení hladin jaterních enzymů |
|
Méně časté: |
hyperbilirubinémie, cholestáza, hepatitida, porucha funkce jater, jaterní selháníf |
|
Poruchy kůže a podkožní tkáně | |
|
Velmi vzácné: |
toxická epidermální nekrolýza, Stevens-Johnsonův syndrom |
f včetně případů s fatálními následky
Četnost výskytu odhadována na základě relevantních klinických studií.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Klinicky byly u pacientů ověřeny dávky 500, 750, 1 000, a 1 250 mg/m2 (celková dávka za 5denní cyklus). Toxicita limitující dávku byla toxicita hematologická a byla pozorována u všech dávek, ale lze očekávat, že při vyšších dávkách bude závažnější. U jednoho pacienta došlo k předávkování, když užil dávku 10 000 mg (celková dávka během jednoho 5denního cyklu), nežádoucí účinky hlášené v tomto případě byly pancytopenie, pyrexie, multiorgánové selhání a úmrtí. Byly popsány případy, kdy pacienti doporučenou dávku užívali po dobu delší než 5 dnů (až 64 dnů) s hlášenými nežádoucími příhodami zahrnujícími supresi kostní dřeně s nebo bez rozvoje infekce, v některých případech závažné, dlouhotrvající a vedoucí ke smrti. V případě předávkování je nezbytné hematologické zhodnocení. Podle potřeby má být zajištěna podpůrná léčba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: cytostatika, jiné alkylační látky, ATC kód: L01A X03 Mechanismus účinku
Temozolomid je triazen, který za fyziologické hodnoty pH prochází rychlou chemickou konverzí na aktivní monomethyl-triazenoimidazol-karboxamid (MTIC). Předpokládá se, že cytotoxické účinky MTIC jsou primárně důsledkem alkylace na O6 pozici guaninu, s následnou alkylací rovněž na pozici N7. Následně vznikající cytotoxické léze jsou vysvětlovány nejspíše aberantní reparací methylovaného zbytku.
Klinická účinnost a bezpečnost
Nově diagnostikovaný multiformní glioblastom
Celkem 573 pacientů bylo randomizováno do skupin dostávajících buď TMZ + RT (n = 287) nebo RT samotnou (n = 286). Pacienti ve větvi TMZ + RT dostávali souběžně TMZ (75 mg/m2) jednou denně od prvního až do posledního dne RT po dobu 42 dnů (maximálně 49 dnů). Pak následovala monoterapie TMZ (150 - 200 mg/m2) ve dnech 1-5 každého 28-denního cyklu, až v 6 cyklech, začínající 4 týdny po ukončení RT. Pacienti v kontrolní větvi dostávali pouze RT. Během RT a souběžné TMZ terapie byla nutná profylaxe pneumonie Pneumocystis jiroveci (PCP).
TMZ byl podáván jako záchranná terapie v následné fázi 161 pacientům z 282 (57 %) ve větvi dostávající pouze RT a 62 pacientům z 277 (22 %) ve větvi dostávající TMZ + RT.
Poměr rizika (HR) pro celkové přežívání byl 1,59 (95 % CI pro HR=1,33 - 1,91) s log-rank p < 0,0001 ve prospěch TMZ větve. Odhadnutá pravděpodobnost přežívání 2 roky nebo více (26 % vs 10 %) byla vyšší ve větvi RT + TMZ. Přidání souběžně podávaného TMZ k RT následované monoterapií TMZ v léčbě pacientů s nově diagnostikovaným multiformním glioblastomem prokázalo statisticky významné zlepšení v celkovém přežívání (overall survival = OS) ve srovnání s RT samotnou (Graf 1).
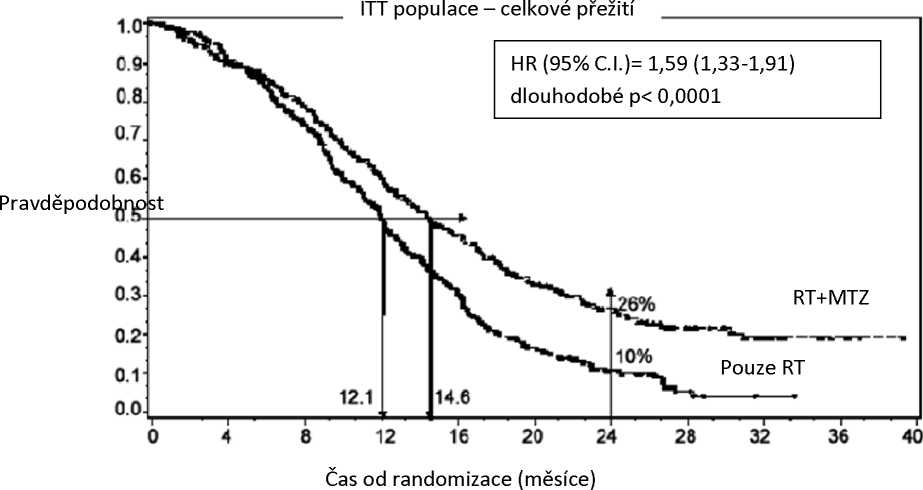
Graf 1 Kaplan-Meierovy křivky pro celkové přežívání (ITTpopulace=intent-to-treat population)
Výsledky studie nebyly konzistentní v podskupině pacientů se slabým výkonnostním statusem (WHO PS = 2, n = 70), kde celkové přežívání a čas do progrese byly podobné v obou větvích. Zdá se však, že u této skupiny pacientů nejsou přítomna žádná nepřijatelná rizika.
Rekurentní nebo progredující maligní gliom
Data o klinické účinnosti u pacientů s multiformním glioblastomem (Karnofského výkonnostní status [KPS] > 70), u něhož dochází k progresi nebo rekurenci po chirurgickém výkonu a RT, vycházela ze dvou klinických studií s perorálním TMZ. V prvním případě šlo o nekomparativní studii u 138 pacientů (29 % bylo předtím léčeno chemoterapií), ve druhém o randomizovanou studii kontrolovanou léčivou látkou s TMZ vs prokarbazinem u celkem 225 pacientů (67 % z nich bylo předtím léčeno chemoterapií na bázi nitrosourey). V obou studiích bylo primárním hodnotícím kritériem přežívání bez známek progrese (PFS - progression-free survival), hodnocených na základě zobrazení magnetickou rezonancí (MRI) nebo na základě zhoršení neurologických funkcí. V nekomparativní studii bylo u 19 % pacientů dosaženo 6ti měsíční PFS, medián přežívání bez známek progrese byl 2,1 měsíce a medián celkové doby přežívání byl
5,4 měsíce. Objektivní počet terapeutických odpovědí na základě hodnocení MRI dosahoval 8 %.
V randomizované studii kontrolované léčivou látkou bylo šestiměsíční PFS u pacientů léčených TMZ významně vyšší než u těch, kteří dostávali prokarbazin (21 % vs 8 %; chr-kvadrát p = 0,008) s mediánem 2,89, respektive 1,88 měsíce (log rank p = 0,0063). Medián přežití byl 7,34 měsíce pro TMZ a 5,66 měsíce pro prokarbazin (log rank p = 0,33). Po 6 měsících byl podíl přežívajících pacientů v TMZ skupině významně vyšší (60 %) než ve skupině prokarbazinové (44 %; chí-kvadrát p = 0,019). U pacientů, kteří byli předtím léčeni chemoterapií, bylo dosaženo kladného efektu u těch, kteří měli KPS > 80.
Údaje o době do zhoršení neurologického statusu, jakož i o době do zhoršení výkonnostního statusu (pokles na KPS < 70 nebo pokles nejméně o 30 bodů), hovoří ve prospěch TMZ oproti prokarbazinu. Medián doby do progrese v těchto hodnotících kritériích byl u TMZ o 0,7 - 2,1 měsíce delší než u prokarbazinu (log rank p < 0,01 - 0,03).
Rekurentní anaplastický astrocytom
V multicentrické prospektivní studii fáze II, v níž byly hodnoceny bezpečnost a účinnost perorálně podávaného TMZ v léčbě pacientů s anaplastickým astrocytomem při prvním relapsu, bylo zjištěno šestiměsíční PSF u 46 % léčených. Medián PSF činil 5,4 měsíce. Medián celkového přežití činil 14,6 měsíce. Procento odpovědí na léčbu, hodnocené centrálně činilo 35 % (13 % kompletních, 43% částečných odpovědí) pro populaci intent-to-treat (ITT), n = 162. U 43 pacientů došlo ke stabilizaci onemocnění. Šestiměsíční přežití bez klinické příhody bylo pro populaci intent-to-treat 44 %, přičemž medián přežití bez klinické příhody činil 4,6 měsíce, což je podobné výsledkům hodnocení přežívání bez známek progrese. Z histologického hlediska byla účinnost obdobná. Objektivní radiologicky prokázaná odpověď na léčbu nebo zachování stavu beze známek progrese velmi dobře korelovaly se zachovanou nebo zlepšenou kvalitou života.
Pediatrická populace
Perorální TMZ byl hodnocen u dětských pacientů (ve věku 3-18 let) s rekurentním gliomem mozkového kmene nebo rekurentním astrocytomem vysokého stupně v režimu denního podávání po dobu 5 dnů každých 28 dnů. Tolerance TMZ byla podobná jako u dospělých.
5.2 Farmakokinetické vlastnosti
TMZ se spontánně hydrolyzuje při fyziologickém pH primárně na aktivní látku, 3-metyl-(triazen-1-yl) -imidazol-4-karboxamid (MTIC). MTIC se spontánně hydrolyzuje na 5-amino-imidazol-4- karboxamid (AIC), známý meziprodukt biosyntézy purinů a nukleových kyselin, a na methylhydrazin, o kterém se předpokládá, že je aktivní alkylační látkou. Předpokládá se, že cytotoxicita MTIC je primárně způsobena alkylací DNA zejména na pozicích guaninu O6 a N7. Expozice MTIC a AIC je ~2,4 %, respektive 23 % v poměru k AUC TMZ. In vivo byl t1/2 MTIC podobný jako pro TMZ, 1,8 hodiny.
Absorpce
Po perorálním podání dospělým pacientům se TMZ rychle absorbuje a vrcholné koncentrace dosahuje již za 20 minut po podání (střední doba je mezi 0,5 a 1,5 hodiny). Po perorálním podání 14C-značeného TMZ byla průměrná fekální exkrece 14C v průběhu 7 dnů po podání dávky 0,8 %, což svědčilo o úplné absorpci.
Distribuce
TMZ vykazuje nízkou vazebnou afinitu k proteinům (10 % až 20 %), proto se neočekává, že by interagoval s látkami s vysokou vazebnou afinitou k proteinům. PET studie u lidí a preklinické údaje ukazují, že TMZ rychle prostupuje hematoencefalickou bariérou a je přítomný v mozkomíšním moku. Průnik do mozkomíšního moku (CSF) byl potvrzen u jednoho pacienta; expozice CSF na základě AUC TMZ byla přibližně 30 % plazmatické expozice, což odpovídá údajům u zvířat.
Eliminace
Plazmatický poločas (t1/2) je přibližně 1,8 hodiny. Hlavní cesta eliminace 14C je ledvinami. Po perorálním podání se objevuje přibližně 5 až 10 % dávky v nezměněné podobě v moči v průběhu 24 hodin a zbytek se vylučuje ve formě temozolomidové kyseliny, 5-aminoimidazol-4-karboxamidu (AIC) nebo neidentifikovaných polárních metabolitů. Plazmatické koncentrace vzrůstají v závislosti na velikosti dávky. Plazmatická clearance, distribuční objem a poločas jsou na velikosti dávky nezávislé.
Zvláštní skupiny pacientů
V analýze populační farmakokinetiky TMZ bylo zjištěno, že plazmatická clearance TMZ nezávisí na věku, renální funkci nebo kouření. V oddělené farmakokinetické studii byly plazmatické farmakokinetické profily u pacientů s mírnou až středně těžkou poruchou funkce jater stejné jako profily u pacientů s normální funkcí jater. U dětských pacientů byla AUC větší než u dospělých; nicméně maximální tolerovaná dávka (MTD) činila 1 000 mg/m2 na jeden cyklus jak u dětí, tak u dospělých.
5.3 Předklinické údaje vztahující se k bezpečnosti
U potkanů a psů byly prováděny studie toxicity s jednotlivým cyklem (5 dnů podávání přípravku, 23 dnů bez léčby), 3 a 6 cykly léčby. Primární cíle toxických účinků tvořila kostní dřeň, lymforetikulámí systém, testes, gastrointestinální ústrojí a při vyšších dávkách, které byly pro 60 % - 100 % testovaných potkanů a psů letální, docházelo k degeneraci retiny. Většina toxických účinků byla reverzibilní, s výjimkou nežádoucích účinků na mužský reprodukční systém a degeneraci retiny. Nicméně vzhledem k tomu, že dávky podmiňující retinální degeneraci se pohybovaly v rozmezí dávek letálních, a v klinických studiích nebyl žádný srovnatelný účinek pozorován, nepřikládá se tomuto nálezu klinická významnost.
TMZ je embryotoxická, teratogenní a genotoxická alkylační látka. TMZ má toxické účinky větší u potkanů a psů než u člověka a klinická dávka se blíží minimální letální dávce u potkanů a psů. Za citlivé ukazatele toxicity se považují poklesy počtu leukocytů a trombocytů v závislosti na velikosti dávky. Ve studii u potkanů, v níž bylo aplikováno šest cyklů terapie, bylo zjištěno několik druhů novotvarů, včetně karcinomu mléčné žlázy, kožního keratoakantomu a adenomu bazálních buněk, zatímco ve studiích u psů žádné nádorové ani prenádorové změny pozorovány nebyly. Zdá se, že potkani jsou vůči onkogenním účinkům TMZ mimořádně citliví, neboť první tumory se u nich objevují již po třech měsících od zahájení podávání přípravku. Jde o dobu krátkou dokonce i pro alkylační látky.
Výsledky aberačních testů s chromosomy Ames/salmonella a lymfocytů z lidské periferní krve prokázaly pozitivní mutagenní reakci.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Obsah tvrdé tobolky Laktosa
Koloidní bezvodý oxid křemičitý Sodná sůl karboxymethylškrobu (typ A)
Kyselina vinná Kyselina stearová
Tobolka, Velikost 0:
Blastomat 5 mg:
Želatina
Oxid titaničitý (E 171)
Žlutý oxid železitý (E 172)
Indigokarmín (E132)
Blastomat 20 mg:
Želatina
Oxid titaničitý (E 171)
Červený oxid železitý (E 172)
Žlutý oxid železitý (E 172)
Blastomat 100 mg:
Želatina
Oxid titaničitý (E 171)
Červený oxid železitý (E 172)
Indigokarmín (E 132)
Blastomat 140 mg:
Želatina
Oxid titaničitý (E 171)
Indigokarmín (E 132)
Blastomat 180 mg:
Želatina
Oxid titaničitý (E 171)
Červený oxid železitý (E 172)
Černý oxid železitý (E 172)
Žlutý oxid železitý (E 172)
Blastomat 250 mg:
Želatina
Oxid titaničitý (E 171)
Černý inkoust:
Šelak
Propylenglykol Čištěná voda Roztok amoniaku 30 %
Hydroxid draselný Černý oxid železitý (E 172)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
HDPE lahvičky: 2 roky Sáčky: 5 mg 18 měsíců
20 mg, 100 mg, 140 mg, 180 mg, 250 mg: 2 roky
6.4 Zvláštní opatření pro uchovávání HDPE lahvička
Uchovávejte při teplotě do 30 °C.
Uchovávejte v lahvičce, aby byl přípravek chráněn před vlhkostí.
Uchovávejte lahvičku těsně uzavřenou.
Sáček
5 mg, 20 mg: Uchovávejte při teplotě do 25 °C.
100 mg, 140 mg, 180 mg and 250 mg: Uchovávejte při teplotě do 30 °C.
6.5 Druh obalu a velikost balení
Dětský bezpečnostní obal, vyrobený z neprůhledných vysokohustotních polyethylenových lahviček s polypropylenovým dětským bezpečnostním uzávěrem, s polyesterovou cívkou a vysoušedlem, obsahující 5 tobolek.
Sáčky složené z papíru na lineárním nízkohustotním polyethylenu (vnější vrstva), hliníku a kopolymeru ethylenu a kyseliny akrylové (vnitřní vrstva). Každý sáček obsahuje 1 tvrdou tobolku a je uložen v papírové krabičce.
Krabička obsahuje 5 nebo 20 tvrdých tobolek, jednotlivě zatavených v sáčcích.
Na trhu nemusí být k dispozici všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Tvrdé tobolky se nesmějí otvírat. Je-li tvrdá tobolka poškozená, vyhněte se kontaktu práškového obsahu s kůží nebo sliznicí. Pokud temozolomid přijde do styku s kůží nebo sliznicí, je třeba je okamžitě a důkladně omýt vodou a mýdlem.
Pacienti musejí být poučeni, aby tobolky byly drženy mimo dosah a dohled dětí, nejlépe v uzamčené skříni. Náhodné požití může být pro děti smrtelné.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Alvogen IPCo S.a r.l.
5, rue Heienhaff L-1736 Senningerberg Lucembursko
8. REGISTRAČNÍ ČÍSLA
Blastomat 5 mg : 44/138/12-C Blastomat 20 mg: 44/139/12-C Blastomat 100 mg:44/140/12-C Blastomat 140 mg: 44/141/12-C Blastomat 180 mg: 44/142/12-C Blastomat 250 mg: 44/143/12-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 27.3.2014