Biopoin 10000 Iu/1 Ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Biopoin 1 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce Biopoin 2 000 IU/0.5 ml injekční roztok v předplněné injekční stříkačce Biopoin 3 000 IU/0.5 ml injekční roztok v předplněné injekční stříkačce Biopoin 4 000 IU/0.5 ml injekční roztok v předplněné injekční stříkačce Biopoin 5 000 IU/0.5 ml injekční roztok v předplněné injekční stříkačce Biopoin 10 000 IU/1 ml injekční roztok v předplněné injekční stříkačce
Biopoin 20 000 IU/1 ml injekční roztok v předplněné injekční stříkačce
Biopoin 30 000 IU/1 ml injekční roztok v předplněné injekční stříkačce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Biopoin 1 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
Jedna předplněná injekční stříkačka obsahuje 1 000 mezinárodních jednotek (IU) (8,3 ^g) epoetinum theta v 0,5 ml injekčního roztoku, což odpovídá 2 000 IU (16,7 ^g) epoetinum theta v jednom ml.
Biopoin 2 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
Jedna předplněná injekční stříkačka obsahuje 2 000 mezinárodních jednotek (IU) (16,7 ^g) epoetinum theta v 0,5 ml injekčního roztoku, což odpovídá 4 000 IU (33,3 ^g) epoetinum theta v jednom ml.
Biopoin 3 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
Jedna předplněná injekční stříkačka obsahuje 3 000 mezinárodních jednotek (IU) (25 ^g) epoetinum theta v 0,5 ml injekčního roztoku, což odpovídá 6 000 IU (50 ^g) epoetinum theta v jednom ml.
Biopoin 4 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
Jedna předplněná injekční stříkačka obsahuje 4 000 mezinárodních jednotek (IU) (33,3 ^g) epoetinum theta v 0,5 ml injekčního roztoku, což odpovídá 8 000 IU (66,7 ^g) epoetinum theta v jednom ml.
Biopoin 5 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
Jedna předplněná injekční stříkačka obsahuje 5 000 mezinárodních jednotek (IU) (41,7 ^g) epoetinum theta v 0,5 ml injekčního roztoku, což odpovídá 10 000 IU (83,3 ^g) epoetinum theta v jednom ml.
Biopoin 10 000 IU/1 ml injekční roztok v předplněné injekční stříkačce Jedna předplněná injekční stříkačka obsahuje 10 000 mezinárodních jednotek (IU) (83,3 ^g) epoetinum theta v 1 ml injekčního roztoku, což odpovídá 10 000 IU (83,3 ^g) epoetinum theta v jednom ml.
Biopoin 20 000 IU/1 ml injekční roztok v předplněné injekční stříkačce Jedna předplněná injekční stříkačka obsahuje 20 000 mezinárodních jednotek (IU) (166,7 ^g) epoetinum theta v 1 ml injekčního roztoku, což odpovídá 20 000 IU (166,7 ^g) epoetinum theta v jednom ml.
Biopoin 30 000 IU/1 ml injekční roztok v předplněné injekční stříkačce
Jedna předplněná injekční stříkačka obsahuje 30 000 mezinárodních jednotek (IU) (250 ^g) epoetinum theta v 1 ml injekčního roztoku, což odpovídá 30 000 IU (250,7 ^g) epoetinum theta v jednom ml.
Epoetin theta (rekombinantní lidský erytropoetin) se vyrábí v ovariálních buňkách čínských křečků (CHO-K1) technologií rekombinantní DNA.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok (injekce).
Roztok je čirý a bezbarvý.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
- Léčba symptomatické anémie spojené s chronickým renálním selháním u dospělých pacientů.
- Léčba symptomatické anémie u dospělých pacientů s nemyeoloidními malignitami, kteří dostávají chemoterapii.
4.2 Dávkování a způsob podání
Léčba epoetinem theta by měla být zahájena pouze lékařem se zkušenostmi s výše uvedenými indikacemi.
Dávkování
Symptomatické anémie spojená s chronickým renálním selháním
Příznaky a následky anémie se mohou lišit v závislosti na věku, pohlaví a celkovém zátížení onemocněním; je nezbytné, aby lékař individuálně zhodnotil klinický průběh a stav pacienta. Epoetin theta by měl být podáván subkutánně nebo intravenózně, tak aby se zvýšila hladina hemoglobinu na hodnotu nepřesahující 12 g/dl (7,45 mmol/l).
Vzhledem k variabilitě mezi pacienty, mohou být někdy pozorovány individuální hladiny hemoglobinu nad nebo pod požadovanou hodnotou. Variabilita hemoglobinu by měla být vyrovnána úpravou dávkování s ohledem na cílovou hladinu hemoglobinu v rozsahu 10 g/dl (6,21 mmol/l) až 12 g/dl (7,45 mmol/l). Nemělo by dojít k trvalému zvýšení hladiny hemoglobinu nad 12 g/dl (7,45 mmol/l); doporučení pro vhodnou úpravu dávkování při hodnotách hemoglobinu překračujících 12 g/dl (7,45 mmol/l) jsou popsána níže.
Je třeba se vyhnout zvýšení hemoglobinu vyššímu než 2 g/dl (1,24 mmol/l) během 4 týdnů.
Jestliže dojde ke zvýšení hemoglobinu o více než 2 g/dl (1,24 mmol/l) během 4 týdnů nebo hodnota hemoglobinu přesáhne hodnotu 12 g/dl (7,45 mmol/l), měla by být dávka snížena o 25 až 50 %. Doporučuje se monitorovat hemoglobin každé dva týdny než dojde ke stabilizaci hladin a dále pokračovat v pravidelných kontrolách. Jestliže se hladina hemoglobinu dále zvyšuje, měla by se léčba přerušit do té doby, než se začne hladina hemoglobinu snižovat. Tehdy může být léčba znovu zahájena dávkou zhruba o 25 % nižší než byla předchozí podávaná dávka.
Při hypertenzi nebo kardiovaskulárních a cerebrovaskulárních onemocněních nebo chorobách periferních cév by měl být vestup hemoglobinu nebo cílová hodnota hemoglobinu stanoveny induividuálně s přihlédnutím ke klinickému obrazu.
Léčba epoetinem theta je rozdělena do dvou fází.
Fáze korekční
Subkutánní podání: Počáteční dávka je 20 IU/kg tělesné hmotnosti 3x týdně. Dávka může být po 4 týdnech zvýšena na 40 IU/kg 3x týdně, jestliže není dosaženo adekvátního zvýšení hemoglobinu (< 1 g/dl (0,62 mmol/l) během 4 týdnů. Další zvýšení o 25 % předchozí dávky je možné v měsíčních intervalech, dokud není dosaženo individuální cílové hladiny hemoglobinu.
Intravenózní podání: Počáteční dávka je 40 IU/kg tělesné hmotnosti 3x týdně. Dávka může být po 4 týdnech zvýšena na 80 IU/kg 3x týdně a pokud je třeba, dále zvýšena o 25 % předchozí dávky v měsíčních intervalech.
Při obou způsobech podání by neměla maximální dávka přesáhnout 700 IU/kg tělesné hmotnosti za týden.
Fáze udržovací
Dávka by měla být upravena podle potřeby, aby byla zachována individuální cílová hodnota hladiny hemoglobinu v rozmezí 10 g/dl (6,21 mmol/l) až 12 g/dl (7,45 mmol/l), přičemž by neměla být překročena hladina hemoglobinu 12 g/dl (7,45 mmol/l). Jestliže je potřeba úpravit dávkování pro zachování požadované hladiny hemoglobinu, doporučuje se upravit dávku o přibližně 25 %.
Subkutánní podání: Týdenní dávka může být podána v jedné injekci týdně nebo rozdělena do tří dávek týdně.
Intravenózní podání: Pacienti, kteří jsou stabilní na režimu podávání třikrát týdně, mohou být převedeni na dávkování dvakrát týdně.
Jestliže se změní frekvence podávání, je třeba pečlivě monitorovat hladinu hemoglobinu a v případě potřeby může být nezbytné dávku upravit.
Maximální dávka by neměla překročit 700 IU/kg tělesné hmotnosti za týden.
Jestliže je epoetin theta nahrazen jiným epoetinem, hladina hemoglobinu by měla být pozorně sledována a tento by měl být podán stejným způsobem.
Pacienti mají být pozorně sledováni, aby bylo zajištěno, že je podávána nejnižší schválená účinná dávka epoetinu theta, která zajišťuje odpovídající kontrolu příznaků anémie při udržení koncentrace hemoglobinu 12 gl/dl (7,45 mmol/l) nebo nižší.
Opatrnosti je třeba při zvyšování dávek epoetinu theta u pacientů s chronickým selháním ledvin. U pacientů se slabou odpovědí hemoglobinu na epoetin theta mají být zvážena alternativní vysvětlení pro tuto slabou odpověď (viz body 4.4 a 5.1).
Symptomatická anémie u pacientů s nemyeloidními malignitami, kteří jsou léčeni chemoterapií Epoetin theta by měl být podáván subkutánně pacientům s anémií (např. koncentrace hemoglobinu <
10 g/dl (6,21 mmol/l)). Příznaky a následky anémie se mohou lišit v závislosti na věku, pohlaví a celkovém zatížení chorobou; je nutné, aby lékař individuálně zhodnotil klinický průběh a stav pacienta.
Kvůli variabilitě mezi pacienty mohou být někdy pozorovány individuální hladiny hemoglobinu nad nebo pod požadovanou hodnotou. Variabilita hemoglobinu by měla být usměrněna úpravou dávkování s ohledem na cílové rozmezí hladin hemoglobinu 10 g/dl (6,21 mmol/l) až 12 g/dl (7,45 mmol/l). Je třeba se vyvarovat trvalého zvýšení hladiny hemoglobinu nad 12 g/dl (7,45 mmol/l); doporučení pro vhodnou úpravu dávkování při hodnotách hemoglobinu překračujících 12 g/dl (7,45 mmol/l) jsou popsána níže.
Doporučená úvodní dávka je 20 000 IU, nezávislá na tělesné hmotnosti, podávaná jednou týdně.
Pokud dojde po 4 týdnech léčby ke zvýšení hodnot hemoglobinu alespoň o 1 g/dl (0,62 mmol/l), mělo by se dále pokračovat v podávání této dávky. Pokud se hladina hemoglobinu nezvýší alespoň o 1 g/dl (0,62 mmol/l), mělo by být zváženo zdvojnásobení týdenní dávky na 40 000 IU. Pokud ani po dalších 4 týdnech léčby není zvýšení hemoglobinu dostatečné, mělo by být zváženo zvýšení týdenní dávky na 60 000 IU.
Maximální dávka by neměla překročit 60 000 IU týdně.
Pokud by se po 12 týdnech léčby hodnoty hemoglobinu nezvýšily alespoň o 1 g/dl (0,62 mmol/l), je odpověď nepravděpodobná a léčba by měla být ukončena.
Pokud je vzestup hemoglobinu v průběhu 4 týdnů vyšší než 2 g/dl (1,24 mmol/l) nebo překročí-li hladina hemoglobinu 12 g/dl (7,45 mmol/l), měla by být dávka snížena o 25 až 50 %. Pokud hladina hemoglobinu překročí 13 g/dl (8,07 mmol/l), měla by být léčba epoetinem theta dočasně přerušena.
Pokud hladina hemoglobinu klesne na 12 g/dl (7,45 mmol/l) nebo níže, měla by být léčba opět zahájena dávkou nižší přibližně o 25 %, než byla dávka předchozí.
Léčba by měla pokračovat až 4 týdny po ukončení chemoterapie.
Pacienti by měli být podrobně monitorováni, aby bylo ověřeno, že byla použita nejnižší schválená dávka epoetinu theta postačující pro adekvátní kontrolu symptomů anémie.
Zvláštní skupiny pacientů Pediatrická populace
Bezpečnost a účinnost přípravku Biopoin u dětí a dospívajících ve věku do 17 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
Způsob _ podání
Injekční roztok může být podán subkutánně nebo intravenózně. U pacientů, kteří podstupují hemodialýzu se dává přednost subkutánnímu podání, aby se předešlo vpichům do periferních žil. Jestliže se epoetin theta nahrazuje jiným epoetinem, měl by se použít stejný způsob podání. U pacientů s nemyeloidními malignitami, léčených chemoterapií, by měl být epoetin theta podáván pouze subkutánně.
Subkutánní injekce se mají podávat do oblasti břicha, paže nebo stehna.
Místa pro aplikaci injekcí se mají měnit a roztok se má aplikovat pomalu, aby se zabránilo nepříjemnému pocitu v místě vpichu.
Návod k manipulaci s léčivým přípravkem před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
- Hypersenzitivita na léčivou látku, jiné epoetiny a deriváty nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
- Nekontrolovaná hypertenze.
4.4 Zvláštní upozornění a opatření pro použití
Obecná
Substituční léčba železem se doporučuje u všech pacientů s hladinami feritinu v séru pod 100 ^g/l nebo se saturací transferinu pod 20 %. Aby byla zajištěna účinná erytropoéza, je třeba zhodnotit u všech pacientů hladinu železa před léčbou a v průběhu léčby.
Chybění odpovědi na léčbu epoetinem theta by mělo vést k promptnímu hledání kauzálních faktorů. Deficit železa, kyseliny listové nebo vitaminu BJ2 snižuje účinnost epoetinů a měl by být proto korigován. Interkurentní infekce, zánětlivé nebo traumatické epizody, okultní krvácení, hemolýza, intoxikace hliníkem, současné základní hematologické onemocnění nebo fibróza kostní dřeně mohou také snížit erytropoetickou odpověď. Součástí hodnocení by měl být počet retikulocytů.
Čistá aplazie buněk červené krevní řady (PRCA)
V případě, že jsou vyloučeny typické příčiny chybějící odpovědi, a u pacienta dojde k náhlému poklesu hemoglobinu spojenému s retikulocytopenií, mělo by se zvážit vyšetření anti-erytropoetinových protilátek a vyšetření kostní dřeně pro stanovení diagnózy čisté aplazie buněk červené krevní řady. Mělo by se zvážit přerušení léčby epoetinem theta.
PRCA způsobená neutralizujícími anti-erytropoetinovými protilátkami byla hlášená ve spojení s léčbou erytropetiny,včetně epoetinu theta. Bylo prokázáno, že tyto protilátky reagují zkříženě se všemi epoetiny, proto by pacienti, u nichž je podezření nebo je potvrzen výskyt neutralizujících protilátek proti erytropoetinu, neměli být převáděni na erytropoetin theta (viz bod 4.8).
Pro zlepšení dohledatelnosti epoetinů má být název podávaného epoetinu jasně zaznamenán do zdravotní dokumentace pacienta.
Paradoxní snížení hladiny hemoglobinu a rozvoj závažné anémie související s nízkým počtem retikulocytů by měly vést k okamžitému ukončení podávání epoetinu a provedení testů na protilátky proti erytropoetinu. Takové případy byly zaznamenány u pacientů s hepatitidou C léčených interferonem a ribavirinem při souběžném podávání epoetinů. Ke zvládání anémie spojené s hepatitidou C nejsou epoetiny schváleny.
Hypertenze
U pacientů léčených epoetinem se může objevit zvýšení krevního tlaku nebo zhoršení přítomné hypertenze, zvláště během počáteční fáze léčby.
Proto je zapotřebí u pacientů léčených epoetinem věnovat zvláštní péči pečlivému monitorování a kontrole krevního tlaku. Krevní tlak by měl být kontrolován dostatečně před začátkem a v průběhu léčby, aby se zamezilo akutním komplikacím, jako je hypertenzní krize s příznaky podobnými encefalopatii (např. bolesti hlavy, stav zmatenosti, poruchy řeči, poruchy chůze) a souvisejícím komplikacím (záchvaty, cévní mozková příhoda), které se mohou vyskytnout u jednotlivých pacientů s jinak normálním nebo nízkým krevním tlakem. Pokud se tyto reakce objeví, vyžadují okamžitou pozornost lékaře a intenzivní lékařskou péči. Zvláštní pozornost je třeba věnovat náhlé ostré migrenózní bolesti hlavy, jakožto možnému varovnému signálu.
Zvýšení krevního tlaku může vyžadovat léčbu antihypertenzními léčivými přípravky nebo zvýšení dávky současné antihypertenzní léčby. Navíc, je třeba zvážit snížení podávané dávky epoetinu theta. Jakmile se dosáhne kontroly hypertenze intenzivnější léčbou, je možné znovu začít léčbu sníženou dávkou epoetinu theta.
Nesprávné _ použití
Nesprávné používání epoetinu theta zdravými osobami může vést k nadměrnému zvýšení hemoglobinu a hematokritu. To může být spojeno s život ohrožujícími kardiovaskulárními komplikacemi.
Zvláštní skupiny pacientů
Vzhledem k nedostatečné zkušenosti, nemohla být stanovena účinnost a bezpečnost epoetinu theta u pacientů se sníženou funkcí jater nebo homozygotní srpkovitou anémií.
V klinických studiích měli pacienti starší 75 let vyšší výskyt závažných nežádoucích účinků bez ohledu na kauzální souvislost s léčbou epoetinem theta. Dále byly v této skupině častější případy úmrtí než u mladších pacientů.
Laboratorní vyšetření
Doporučuje se provádět pravidelné kontroly hemoglobinu, vyšetření kompletního krevního obrazu a počtu krevních destiček.
Symptomatická anémie spojená s chronickým selháním ledvin
Použití epoetinu theta u pacientů s nefrosklerózou, kteří ještě nejsou dialyzovaní, by mělo být zváženo individuálně, protože u těchto pacientů nelze s jistotou vyloučit urychlení progrese renálního selhání.
Během dialýzy mohou pacienti léčení epoetinem theta vyžadovat zvýšenou antikoagulační léčbu, aby se předešlo srážení krve v arterio-venózním shuntu.
U pacientů s chronickým selháním ledvin by udržovací koncentrace hemoglobinu neměla překročit horní limit cílové koncentrace hemoglobinu doporučovaný v bodě 4.2. V klinických studiích bylo pozorováno zvýšené riziko úmrtí a závažných kardiovaskulárních příhod, když byly podávány epoetiny k dosažení cílových hodnot hemoglobinu vyšších než 12 g/dl (7,45 mmol/l).
V kontrolovaných klinických studiích se neprokázal signifikantní přínos podávání epoetinů, pokud byla koncentrace hemoglobinu zvyšována nad hladinu nezbytně nutnou pro kontrolu symptomů anémie a předcházení krevní transfuzi.
Opatrnosti je třeba při zvyšování dávek epoetinu theta u pacientů s chronickým selháním ledvin, protože vysoké kumulující se dávky epoetinu mohou souviset se zvýšeným rizikem mortality, závažnými kardiovaskulárními a cerebrovaskulárními příhodami. U pacientů se slabou odpovědí hemoglobinu na epoetiny mají být zvážena alternativní vysvětlení pro tuto slabou odpověď (viz body 4.2 a 5.1).
Symptomatická anémie u pacientů s nemyeloidními malignitami, kteří jsou léčeni chemoterapií Vliv na růst nádorů
Epoetiny jsou růstové faktory, které primárně podporují tvorbu červených krvinek. Erytropoetinové receptory mohou být přítomny na povrchu různých nádorových buněk. Stejně jako u všech růstových faktorů, je třeba mít na zřeteli, že i epoetiny mohou stimulovat růst jakéhokoli typu nádoru (viz bod 5.1).
V několika kontrolovaných klinických studiích nebylo ve spojení s epoetiny prokázáno zlepšení celkové doby přežití ani snížení rizika progrese nádorů u pacientů s anémií spojenou s nádorovým onemocněním. Použití epoetinů v kontrolovaných klinických studiích prokázalo:
- zkrácení doby do progrese nádoru u pacientů s pokročilým nádorovým onemocněním hlavy a krku léčených radioterapií, pokud byly dosahovány cílové hodnoty hemoglobinu nad 14 g/dl (8,69 mmol/l),
- zkrácení celkové doby přežití a zvýšení počtu úmrtí souvisejících s progresí onemocnění během 4 měsíců léčby u pacientů s metastazujícím karcinomem prsu léčených chemoterapií, pokud byly dosahovány cílové hladiny hemoglobinu 12-14 g/dl (7,45-8,69 mmol/l),
- zvýšené riziko úmrtí při dosahování cílové hodnoty hemoglobinu 12 g/dl (7,45 mmol/l) u pacientů a aktivními maligními chorobami, kteří nedostávali ani chemoterapii ani ozařování.
V této populaci pacientů není použití epoetinů indikováno.
Na základě výše uvedených skutečností by za určitých klinických okolností při léčbě anémie u pacientů s nádorovým onemocněním měla být upřednostněna transfuze krve. Rozhodnutí podat rekombinantní erytropoetiny by mělo být přijato na základě zvážení poměru přínosu a rizika a individuálního posouzení každého pacienta za daných specifických klinických podmínek. Faktory, které by měly být zváženy, zahrnují typ nádoru a jeho stadia, stupeň anémie, očekávanou délku přežití, podmínky, za kterých je pacient léčen a volbu pacienta (viz bod 5.1).
Pomocné látky
Tento přípravek obsahuje méně než 1 mmol (23 mg) sodíku v jedné předplněné injekční stříkačce, tj. v podstatě je „bez sodíku“.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí.
4.6 Fertilita, těhotenství a kojení
Údaje o podávání epoetinu theta těhotným ženám jsou omezené (méně než 300 ukončených těhotenství) nebo nejsou k dispozici. Studie reprodukční toxicity na zvířatech provedené s jinými epoetiny nenaznačují přímé škodlivé účinky (viz bod 5.3). Podávání přípravku Biopoin v těhotenství se z preventivních důvodů nedoporučuje.
Kojení
Není známo, zda se epoetin theta/metabolity vylučují do lidského mateřského mléka, ale údaje u novorozenců neprokazují absorpci nebo farmakologickou aktivitu erytropoetinu, když je podáván současně s mateřským mlékem. Na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku je nutno rozhodnout, zda přerušit kojení nebo ukončit/přerušit podávání přípravku Biopoin.
Fertilita
Nejsou dostupné žádné údaje.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Epoetin theta nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Lze očekávat, že zhruba u 9 % pacientů se vyskytnou nežádoucí účinky. Nejčastější nežádoucí účinky jsou hypertenze, příznaky podobné chřipce a bolest hlavy.
Tabulkový seznam nežádoucích účinků
Bezpečnost epoetinu theta byla hodnocena na základě výsledků klinických studií zahrnujících 972 pacientů.
Nežádoucí účinky uvedené níže v tabulce 1 jsou klasifikovány podle Třídy orgánových systémů. V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Velmi časté: Časté:
Méně časté: Vzácné:
Velmi vzácné:
> 1/10;
> 1/100 až < 1/10;
> 1/1 000 až < 1/100;
> 1/10 000 až < 1/1 000; < 1/10 000;
Není známo:z dostupných údajů nelze určit
|
Třídv orgánových systémů |
Nežádoucí účinek |
Frekvence | |
|
Symptomatická anémie spojená s chronickým renálním selháním |
Symptomatická anémie u pacientů s nemyeloidními malignitami léčených chemoterapií | ||
|
Poruchy krve a lymfatického systému |
Čistá aplazie buněk červené krevní řady (PRCA)* |
Není známo | |
|
Poruchy imunitního systému |
Hypersenzitivní reakce |
Není známo | |
|
Poruchy nervového systému |
Časté | ||
|
Cévní poruchy |
Hypertenze* |
Časté | |
|
Hypertenzní krize* |
Časté |
— | |
|
Trombóza shuntu* |
Časté |
— | |
|
Tromboembolické příhody |
— |
Není známo | |
|
Poruchy kůže a podkožní tkáně |
Kožní reakce* |
Časté | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Bolesti kloubů |
Časté | |
|
Celkové poruchy a reakce v místě aplikace |
Příznaky podobné chřipce* |
Časté | |
*Viz podbod „Popis vybraných nežádoucích účinků“ níže.
Popis vybraných nežádoucích účinků
U pacientů s chronickou renální insuficiencí byla po uvedení na trh v souvislosti s léčbou epoetinem theta hlášena čistá aplazie červených krvinek (PRCA), způsobená neutralizujícími anti-erytropoetinovými protilátkami. Jestliže je diagnostikována čistá aplazie červených krvinek (PRCA), léčba epoetinem theta musí být ukončena a pacient by neměl být převáděn na léčbu jiným rekombinantním epoetinem (viz bod 4.4).
Jedním z nejčastějších nežádoucích účinků během léčby epoetinem theta je zvýšení krevního tlaku nebo zhoršení již přítomné hypertenze, zejména během počáteční fáze léčby. Hypertenze se vyskytuje u pacientů s chronickým renálním selháním častěji během fáze korekční než během fáze udržovací. Hypertenzi lze léčit vhodnými léčivými přípravky (viz bod 4.4).
Hypertenzní krize s příznaky podobnými encefalopatii (např. bolesti hlavy, stav zmatenosti, porucha řeči, porucha chůze) a související komplikace (záchvaty, cévní mozková příhoda) se mohou také vyskytnout u jednotlivých pacientů s jinak normálním nebo nízkým krevním tlakem (viz bod 4.4).
Může dojít k trombóze shuntu, zvláště u pacientů, kteří mají tendenci k hypotenzi nebo u pacientů s komplikacemi arteriovenózní spojky (např. stenózy, aneuryzmata) (viz bod 4.4).
Mohou se objevit kožní reakce jako je vyrážka, svědění nebo reakce v místě vpichu.
Byly zaznamenány příznaky podobné chřipce, jako horečka, zimnice, stavy slabosti.
Hlášení _podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky,
aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Terapeutický rozsah epoetinu theta je velmi široký. V případě předávkování se může objevit polycytemie. V takovém případě by mělo být podávání epoetinu theta přechodně přerušeno.
Pokud se objeví závažná polycytemie, mohou být indikovány konvenční metody ke snížení hladiny hemoglobinu (flebotomie).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: jiné antianemické přípravky, ATC kód: B03XA01
Mechanismus účinku
Lidský erytropoetin je endogenní glykoproteinový hormon, který je primárním regulátorem erytropoezy, působícím prostřednictvím specifické interakce s erytropoetinovým receptorem na erytroidních progenitorových buňkách kostní dřeně. Působí jako faktor stimulující mitózu kmenových buněk a hormon působící na jejich diferenciaci. Erytropoetin se tvoří především v ledvině a jeho tvorba je regulována reakcí ledviny na změny tkáňové oxygenace. U pacientů s chronickým selháním ledvin je tvorba endogenního erytropoetinu snížená a primární příčinou jejich anémie je deficit erytropoetinu. U pacientů s nádorovým onemocněním, kteří se léčí chemoterapií, je příčina anémie multifaktoriální. Deficit erytropoetinu a snížená odpověď kmenových buněk na endogenní erytropoetin u těchto pacientů přispívá významně ke vzniku anémie.
Co se týká sekvence aminokyselin, je epoetin theta identický s endogenním lidským erytropoetinem a je podobný složením karbohydrátové složky (glykosylace).
Preklinická účinnost
Biologická účinnost epoetinu theta byla demonstrována po intravenózním a subkutánním podání u různých zvířat in vivo (myši, potkani, psi). Po podání epoetinu theta se zvyšuje počet erytrocytů, hodnoty hematokritu a množství retikulocytů.
Klinická účinnost a bezpečnost
Symptomatická anémie spojená s chronickým selháním ledvin
Údaje z korekční fáze studií provedených u 284 pacientů s chronickým selháním ledvin ukazují, že míra odpovědi hemoglobinu (definovaná jako hladina hemoglobinu vyšší než 11 g/dl ve dvou po sobě následujících měřeních) ve skupině s epoetinem theta (88,4% a 89,4% ve studiích s dialyzovanými pacienty resp. s pacienty, kteří ještě nepodstupovali dialýzu) byla srovnatelná s eopoetinem beta (86,2% a 81,0%). Střední doba potřebná k odpovědi byla 56 dnů v léčebné skupině hemodialyzovaných pacientů a 49 dnů u pacientů, kteří ještě dialýzu nepodstupovali.
Dvě randomizované kontrolované studie byly provedeny u 270 hemodialyzovaných pacientů a 288 pacientů, kteří ješte dialýzu nepodstoupili a byli trvale léčeni epoetinem beta. Pacienti byli randomizováni na skupinu, která pokračovala v dosavadní léčbě a skupinu, která byla převedena na léčbu epoetinem theta (stejná dávka jako epoetinu beta), aby byly zachovány hladiny hemoglobinu. Během hodnoceného období (týdny 15 až 26), byla průměrná a střední hodnota hemoglobinu u pacientů léčených epoetinem theta prakticky stejná jako základní hladina hmoglobinu. V těchto dvou studiích bylo 180 hemodialyzovaných pacientů a 193 pacientů nepodstupujících dialýzu převedeno z udržovací fáze s epoetinem beta na léčbu epoetinem theta na dobu 6 měsíců, během níž byly hodnoty hemoglobinu stabilní a bezpečnostní profil byl podobný jako u epoetinu beta. V klinických studiích přerušovali pacienti, kteří ještě nepodstupovali hemodialýzu (subkutánní podání), studii mnohem častěji než pacienti hemodialyzovaní (intravenózní podání), protože museli ukončit studii, když začínali hemodialýzu.
Ve dvou dlouhodobých studiích byla účinnost epoetinu theta hodnocena u 124 hemodialyzovaných pacientů a 289 pacientů ještě nepodstupujících dialýzu. Hladiny hemoglobinu zůstaly v požadovaném rozsahu a epoetin theta byl dobře tolerován během období až 15 měsíců.
V klinických studiích byli pre-dialyzovaní pacienti léčeni jednou týdně epoetinem theta, 174 pacientů v udržovací fázi studie a 111 pacientů v dlouhodobé studii.
Souhrnné post-hoc analýzy klinických studií u epoetinů byly provedeny u pacientů s chronickým selháním ledvin (na dialýze, bez dialýzy, u diabetických a nediabetických pacientů). Byla pozorována tendence směrem ke zvýšení odhadovaného rizika mortality z jakýchkoli příčin, kardiovaskulárních a cerebrovaskulárních příhod spojených s vyššími kumulativními dávkami epoetinu nezávisle na stavu diabetu nebo dialýzy (viz body 4.2 a 4.4).
Symptomatická anémie u pacientů s nemyeloiodními malignitami léčených chemoterapií 409 pacientů, kteří dostávali chemoterapii, bylo zahrnuto do dvou prospektivních, randomizovaných dvojitě zaslepených, placebem kontrolovaných studií. První studie byla provedena u 186 anemických pacientů s nemyeloidními malignitami (55% s hematologickými malignitami a 45% se solidními nádory), kteří byli léčeni neplatinovou chemoterapií. Druhá studie byla provedena u 223 pacientů s různými solidními nádory, kteří byli léčeni chemoterapií obsahující platinu. V obou studiích vedla léčba epoetinem theta k signifikantní odpovědi hemoglobinu (p < 0,001), definované jako zvýšení hemoglobinu o > 2 g/dl bez transfuze a signifikantnímu snížení potřeby transfuze (p < 0,05) ve srovnání s placebem.
Účinek na růst nádoru
Erytropoetin je růstový faktor primárně podporující tvorbu červených krvinek. Receptory pro erytropoetin mohou být exprimovány na povrchu mnoha nádorových buněk.
Přežití a progrese nádoru byla zkoumána v pěti velkých kontrolovaných klinických studiích zahrnujících celkem 2 833 pacientů; čtyři z těchto studií byly dvojitě zaslepené placebem kontrolované, jedna studie byla otevřená. Dvou studií se zúčastnili pacienti léčení chemoterapií.
Cílová koncentrace hemoglobinu byla ve dvou studiích > 13 g/dl; v ostatních třech studiích 12-14 g/dl.V otevřené studii nebyl z hlediska celkového přežití zjištěn žádný rozdíl mezi pacienty léčenými rekombinantím lidským erytropoetinem a mezi kontrolní skupinou. Ve čtyřech placebem kontrolovaných studiích se poměry rizik pro celkové přežití pohybovaly mezi 1,25 a 2,47 ve prospěch kontrolních skupin. Při srovnání s kontrolními skupinami tyto studie ukázaly konzistentní nevysvětlitelné, statisticky významné zvýšení mortality u pacientů, kteří měli anémii spojenou s různými maligními nádory a kteří dostávali rekombinantní lidský erytropoetin. Výsledek celkového přežití zjištěný v klinických studiích nebylo možné uspokojivě vysvětlit rozdílem v incidenci trombózy a přidružených komplikací mezi skupinou dostávající rekombinantní lidský erytropoetin a mezi skupinou kontrolní.
Údaje ze tří placebem kontrolovaných klinických studií u 586 anemických pacientů s malignitami provedených s epoetinem theta neprokázaly negativní efekt epoetinu theta na přežití. Mortalita během studií byla nižší ve skupině s epoetinem theta (6,9%) ve srovnání s placebem (10,3%).
Bylo provedeno systematické retrospektivní zhodnocení zahrnující více než 9 000 pacientů s rakovinou, kteří se zúčastnili 57 klinických studií. Metaanalýza údajů týkajících se celkové doby přežití určila odhadem poměr rizik 1,08 ve prospěch kontrol (95% interval spolehlivosti: 0,99;1,18;
42 klinických studií a 8 167 pacientů). U pacientů dostávajících rekombinantní lidský erytropoetin bylo pozorováno zvýšení relativního rizika tromboembolických příhod (RR 1,67, 95% interval spolehlivosti: 1,35; 2,06, 35 klinických studií a 6 769 pacientů). Existují tedy konzistentní důkazy vypovídající o možnosti signifikantního poškození zdraví u pacientů s rakovinou, kteří jsou léčeni rekombinantním lidským erytropoetinem. Není jasné, jakou důležitost mají tyto výsledky při podávání erytropoetinu pacientům s maligními nádory, kteří jsou léčeni chemoterapií a kteří mají koncentraci hemoglobinu nižší než 13 g/dl, protože retrospektivní zhodnocení dat zahrnovalo jen několik pacientů s touto charakteristikou.
Byla rovněž provedena analýza údajů na úrovni jednotlivých pacientů, do které bylo zařazeno přes 13 900 pacientů s rakovinou (podstupujících chemoterapii, radioterapii, kombinovanou chemoterapii a radioterapii nebo nepodstupujících žádnou léčbu) účastnících se 53 kontrolovaných klinických studií zkoumajících několik epoetinů. Metaanalýza údajů týkajících se celkové doby přežití určila odhadem poměr rizik 1,06 ve prospěch kontrol (95% interval spolehlivosti: 1,00; 1,12; 53 studií a 13 933 pacientů). U pacientů s rakovinou podstupujících chemoterapii byl poměr rizik u celkového přežití 1,04 (95% interval spolehlivosti: 0,97; 1,11; 38 studií a 10 441 pacientů). Z těchto metaanalýz také jednoznačně vyplývá, že u pacientů s rakovinou užívajících rekombinantní lidský erytropoetin je významně zvýšené riziko tromboembolické příhody (viz bod 4.4).
5.2 Farmakokinetické vlastnosti
Obecné
Farmakokinetika epoetinu theta byla vyšetřována u zdravých dobrovolníků, pacientů s chronickým selháním ledvin a pacientů s rakovinou, kteří byli léčeni chemoterapií. Farmakokinetické vlastnosti epoetinu theta nejsou závislé na věku nebo pohlaví.
Subkutánní _ podání
Po subkutánním podání injekce epoetinu theta obsahující 40 IU/kg tělesné hmotnosti na třech různých místech (horní část paže, břicho, stehno) zdravým dobrovolníkům byly pozorovány podobné profily plazmatické hladiny. Rozsah absorpce (AUC) byl lehce vyšší po injekci v oblasti břicha ve srovnání s ostatními místy podání. Maximální koncentrace v plazmě je dosažena po přibližně 10 až 14 hodinách a průměrný terminální poločas kolísá přibližně od 22 do 41 hodin.
Průměrná biologická dostupnost epoetinu theta po podkožní aplikaci je asi 31% ve srovnání s intravenózním podáním.
Protrahovaná absorpce epoetinu theta po subkutánním podání 40 IU/kg tělesné hmotnosti predialyzovaným pacientům s chronickým selháním ledvin vede ke vzniku koncentračního plató, přičemž maximální koncentrace je dosaženo v půměru za 14 hodin. Terminální poločas je delší než po intravenózním podání s průměrem 25 hodin po jedné dávce a 34 hodin při ustáleném stavu po opakovaném podávání třikrát týdně, aniž by došlo k akumulaci epoetinu theta.
U pacientů s rakovinou léčených chemoterapií po opakovaném subkutánním podání 20 000 IU epoetinu theta jednou týdně je terminální poločas 29 hodin po první dávce a 28 hodin v ustáleném stavu. Nebyla pozorována akumulace epoetinu theta.
Intravenózní _ podání
U pacientů s chronickým renálním selháním podstupujících hemodialýzu je poločas eliminace epoetinu theta 6 hodin po jedné dávce a 4 hodiny v ustáleném stavu po opakovaném intravenózním podání 40 IU/kg tělesné hmotnosti epoetinu theta třikrát týdně. Nebyla pozorována akumulace epoetinu theta. Po intravenózním podání odpovídá distribuční objem celkovému objemu krve.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti a toxicity po opakovaném podávání epoetinu theta neodhalily žádné zvláštní riziko pro člověka.
Neklinické údaje s jinými epoetiny získané na základě konvenčních studiích genotoxicity a reprodukční toxicity neodhalily žádné zvláštní riziko pro člověka.
Ve studiích reprodukční toxicity provedených s jinými epoetiny byly účinky, interpretované jako sekundární ke snížené mateřské tělesné hmotnosti, pozorované po dávkách značně převyšujících doporučené dávky u lidí.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Dihydrát dihydrogenfosforečnanu sodného Chlorid sodný Polysorbát 20 Trometamol
Kyselina chlorovodíková (6 M) (k úpravě pH)
Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
2 roky.
Při ambulantním použití může pacient přípravek vyjmout z chladničky a uchovávat jej při teplotě do 25 °C po jednotlivé období až 7 dnů, a to při zachování doby použitelnosti. Jakmile je přípravek vyjmut z chladničky, musí být během této doby spotřebován nebo po uplynutí této doby zlikvidován.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
Biopoin 1 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce 0,5 ml injekčního roztoku v předplněné injekční stříkačce (sklo třídy I) se špičatým víčkem (bromobutylová pryž), pístovou zátkou (chlorobutylová pryž potažená teflonem) a injekční jehlou (nerezavějící ocel) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním krytem (bezpečnostní jehla) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním zařízením.
Velikost balení: 6 předplněných injekčních stříkaček; 6 předplněných injekčních stříkaček s bezpečnostní jehlou nebo 6 předplněných injekčních stříkaček s bezpečnostním zařízením.
Na trhu nemusí být všechny velikosti balení.
Biopoin 2 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
0,5 ml injekčního roztoku v předplněné injekční stříkačce (sklo třídy I) se špičatým
víčkem (bromobutylová pryž), pístovou zátkou (chlorobutylová pryž potažená teflonem) a injekční
jehlou (nerezavějící ocel) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním krytem
(bezpečnostní jehla) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním zařízením.
Velikost balení: 6 předplněných injekčních stříkaček; 6 předplněných injekčních stříkaček s bezpečnostní jehlou nebo 6 předplněných injekčních stříkaček s bezpečnostním zařízením.
Na trhu nemusí být všechny velikosti balení.
Biopoin 3 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
0,5 ml injekčního roztoku v předplněné injekční stříkačce (sklo třídy I) se špičatým
víčkem (bromobutylová pryž), pístovou zátkou (chlorobutylová pryž potažená teflonem) a injekční
jehlou (nerezavějící ocel) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním krytem
(bezpečnostní jehla) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním zařízením.
Velikost balení: 6 předplněných injekčních stříkaček; 6 předplněných injekčních stříkaček s bezpečnostní jehlou nebo 6 předplněných injekčních stříkaček s bezpečnostním zařízením.
Na trhu nemusí být všechny velikosti balení.
Biopoin 4 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
0,5 ml injekčního roztoku v předplněné injekční stříkačce (sklo třídy I) se špičatým
víčkem (bromobutylová pryž), pístovou zátkou (chlorobutylová pryž potažená teflonem) a injekční
jehlou (nerezavějící ocel) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním krytem
(bezpečnostní jehla) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním zařízením.
Velikost balení: 6 předplněných injekčních stříkaček; 6 předplněných injekčních stříkaček s bezpečnostní jehlou nebo 6 předplněných injekčních stříkaček s bezpečnostním zařízením.
Na trhu nemusí být všechny velikosti balení.
Biopoin 5 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
0,5 ml injekčního roztoku v předplněné injekční stříkačce (sklo třídy I) se špičatým
víčkem (bromobutylová pryž), pístovou zátkou (chlorobutylová pryž potažená teflonem) a injekční
jehlou (nerezavějící ocel) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním krytem
(bezpečnostní jehla) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním zařízením.
Velikost balení: 6 předplněných injekčních stříkaček; 6 předplněných injekčních stříkaček s bezpečnostní jehlou nebo 6 předplněných injekčních stříkaček s bezpečnostním zařízením.
Na trhu nemusí být všechny velikosti balení.
Biopoin 10 000 IU/1 ml injekční roztok v předplněné injekční stříkačce 1 ml injekčního roztoku v předplněné injekční stříkačce (sklo třídy I) se špičatým víčkem (bromobutylová pryž), pístovou zátkou (chlorobutylová pryž potažená teflonem) a injekční jehlou (nerezavějící ocel) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním krytem (bezpečnostní jehla) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním zařízením.
Velikost balení: 1, 4 a 6 předplněných injekčních stříkaček; 6 předplněných injekčních stříkaček s bezpečnostní jehlou nebo 1, 4 a 6 předplněných injekčních stříkaček s bezpečnostním zařízením.
Na trhu nemusí být všechny velikosti balení.
Biopoin 20 000 IU/1 ml injekční roztok v předplněné injekční stříkačce 1 ml injekčního roztoku v předplněné injekční stříkačce (sklo třídy I) se špičatým víčkem (bromobutylová pryž), pístovou zátkou (chlorobutylová pryž potažená teflonem) a injekční jehlou (nerezavějící ocel) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním krytem (bezpečnostní jehla) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním zařízením.
Velikost balení: 1, 4 a 6 předplněných injekčních stříkaček; 6 předplněných injekčních stříkaček s bezpečnostní jehlou nebo 1, 4 a 6 předplněných injekčních stříkaček s bezpečnostním zařízením.
Na trhu nemusí být všechny velikosti balení.
Biopoin 30 000 IU/1 ml injekční roztok v předplněné injekční stříkačce 1 ml injekčního roztoku v předplněné injekční stříkačce (sklo třídy I) se špičatým víčkem (bromobutylová pryž), pístovou zátkou (chlorobutylová pryž potažená teflonem) a injekční jehlou (nerezavějící ocel) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním krytem (bezpečnostní jehla) nebo injekční jehlou (nerezavějící ocel) s bezpečnostním zařízením.
Velikost balení: 1, 4 a 6 předplněných injekčních stříkaček; 6 předplněných injekčních stříkaček s bezpečnostní jehlou nebo 1, 4 a 6 předplněných injekčních stříkaček s bezpečnostním zařízením.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Předplněné injekční stříkačky jsou určeny pouze k jednomu použití.
Roztok je třeba před použitím vizuálně zkontrolovat. Aplikován může být pouze roztok, který je čirý, bezbarvý a bez viditelných částic. Injekční roztok se nemá protřepávat. Je povoleno dosáhnout komfortní teplotu (15 °C - 25 °C) pro injekci.
Návod na aplikaci injekce tohoto léčivého přípravku je uveden v příbalové informaci.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
TEVA GmbH Graf-Arco-StraBe 3 89079 Ulm Německo
8. REGISTRAČNÍ ČÍSLO(A)
Biopoin 1 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
EU/1/09/565/001
EU/1/09/565/002
EU/1/09/565/029
Biopoin 2 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
EU/1/09/565/003
EU/1/09/565/004
EU/1/09/565/030
Biopoin 3 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
EU/1/09/565/005
EU/1/09/565/006
EU/1/09/565/031
Biopoin 4 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
EU/1/09/565/007
EU/1/09/565/008
EU/1/09/565/032
Biopoin 5 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
EU/1/09/565/009
EU/1/09/565/010
EU/1/09/565/033
Biopoin 10 000 IU/1 ml injekční roztok v předplněné injekční stříkačce
EU/1/09/565/011
EU/1/09/565/012
EU/1/09/565/013
EU/1/09/565/014
EU/1/09/565/015
EU/1/09/565/016
EU/1/09/565/034
EU/1/09/565/035
EU/1/09/565/036
Biopoin 20 000 IU/1 ml injekční roztok v předplněné injekční stříkačce
EU/1/09/565/017
EU/1/09/565/018
EU/1/09/565/019
EU/1/09/565/020
EU/1/09/565/021
EU/1/09/565/022
EU/1/09/565/037
EU/1/09/565/038
EU/1/09/565/039
Biopoin 30 000 IU/1 ml injekční roztok v předplněné injekční stříkačce
EU/1/09/565/023
EU/1/09/565/024
EU/1/09/565/025
EU/1/09/565/026
EU/1/09/565/027
EU/1/09/565/028
EU/1/09/565/040
EU/1/09/565/041
EU/1/09/565/042
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 23.10.2009
Datum posledního prodloužení registrace: 26. 08. 2014
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce biologické léčivé látky
Teva Biotech GmbH DornierstraPe 10 89079 Ulm Německo
Název a adresa výrobce odpovědného za propouštění šarží
Teva Biotech GmbH DornierstraPe 10 89079 Ulm Německo
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz Příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
Biopoin 1 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
epoetinum theta
Jedna předplněná injekční stříkačka obsahuje 1 000 mezinárodních jednotek (IU) (8,3 mikrogramů) epoetinum theta v 0,5 ml injekčního roztoku, což odpovídá 2 000 IU (16,7 mikrogramů) epoetinum theta v jednom ml.
Pomocné látky: dihydrát dihydrogenfosforečnanu sodného, chlorid sodný, polysorbát 20, trometamol, kyselina chlorovodíková (6 M) (k úpravě pH), voda na injekci.
injekční roztok
6 předplněných injekčních stříkaček s 0,5 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostní jehlou s 0,5 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostním zařízením s 0,5 ml roztoku
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Pouze k jednomu použití.
Prosím, používejte následujícím způsobem: Rámeček pro předepsané dávkování
Subkutánní nebo intravenózní podání
Uchovávejte mimo dohled a dosah dětí.
EXP:
Lze uchovávat při pokojové teplotě (do 25 °C) po dobu 7 dnů během doby použitelnosti.
Konec 7denní doby při pokojové teplotě:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
TEVA GmbH Graf-Arco-StraBe 3 89079 Ulm Německo
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/565/001 6 předplněných injekčních stříkaček
EU/1/09/565/002 6 předplněných injekčních stříkaček s bezpečnostním zařízením EU/1/09/565/029 6 předplněných injekčních stříkaček s bezpečnostní jehlou
13. ČÍSLO ŠARŽE
č.š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Biopoin 2 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
epoetinum theta
Jedna předplněná injekční stříkačka obsahuje 2 000 mezinárodních jednotek (IU) (16,7 mikrogramů) epoetinum theta v 0,5 ml injekčního roztoku, což odpovídá 4 000 IU (33,3 mikrogramů) epoetinum theta v jednom ml.
Pomocné látky: dihydrát dihydrogenfosforečnanu sodného, chlorid sodný, polysorbát 20, trometamol, kyselina chlorovodíková (6 M) (k úpravě pH), voda na injekci.
injekční roztok
6 předplněných injekčních stříkaček s 0,5 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostní jehlou s 0,5 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostním zařízením s 0,5 ml roztoku
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Pouze k jednomu použití.
Prosím, používejte následujícím způsobem: Rámeček pro předepsané dávkování
Subkutánní nebo intravenózní podání
Uchovávejte mimo dohled a dosah dětí.
EXP:
Lze uchovávat při pokojové teplotě (do 25 °C) po dobu 7 dnů během doby použitelnosti.
Konec 7denní doby při pokojové teplotě:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
TEVA GmbH Graf-Arco-StraBe 3 89079 Ulm Německo
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/565/003 6 předplněných injekčních stříkaček
EU/1/09/565/004 6 předplněných injekčních stříkaček s bezpečnostním zařízením EU/1/09/565/030 6 předplněných injekčních stříkaček s bezpečnostní jehlou
13. ČÍSLO ŠARŽE
č.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Biopoin 3 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
epoetinum theta
Jedna předplněná injekční stříkačka obsahuje 3 000 mezinárodních jednotek (IU) (25 mikrogramů) epoetinum theta v 0,5 ml injekčního roztoku, což odpovídá 6 000 IU (50 mikrogramů) epoetinum theta v jednom ml.
Pomocné látky: dihydrát dihydrogenfosforečnanu sodného, chlorid sodný, polysorbát 20, trometamol, kyselina chlorovodíková (6 M) (k úpravě pH), voda na injekci.
injekční roztok
6 předplněných injekčních stříkaček s 0,5 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostní jehlou s 0,5 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostním zařízením s 0,5 ml roztoku
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Pouze k jednomu použití.
Prosím, používejte následujícím způsobem: Rámeček pro předepsané dávkování
Subkutánní nebo intravenózní podání
Uchovávejte mimo dohled a dosah dětí.
EXP:
Lze uchovávat při pokojové teplotě (do 25 °C) po dobu 7 dnů během doby použitelnosti.
Konec 7denní doby při pokojové teplotě:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
TEVA GmbH Graf-Arco-StraBe 3 89079 Ulm Německo
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/565/005 6 předplněných injekčních stříkaček
EU/1/09/565/006 6 předplněných injekčních stříkaček s bezpečnostním zařízením EU/1/09/565/031 6 předplněných injekčních stříkaček s bezpečnostní jehlou
13. ČÍSLO ŠARŽE
č.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Biopoin 4 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
epoetinum theta
Jedna předplněná injekční stříkačka obsahuje 4 000 mezinárodních jednotek (IU) (33,3 mikrogramů) epoetinum theta v 0,5 ml injekčního roztoku, což odpovídá 8 000 IU (66,7 mikrogramů) epoetinum theta v jednom ml.
Pomocné látky: dihydrát dihydrogenfosforečnanu sodného, chlorid sodný, polysorbát 20, trometamol, kyselina chlorovodíková (6 M) (k úpravě pH), voda na injekci.
injekční roztok
6 předplněných injekčních stříkaček s 0,5 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostní jehlou s 0,5 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostním zařízením s 0,5 ml roztoku
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Pouze k jednomu použití.
Prosím, používejte následujícím způsobem: Rámeček pro předepsané dávkování
Subkutánní nebo intravenózní podání
Uchovávejte mimo dohled a dosah dětí.
EXP:
Lze uchovávat při pokojové teplotě (do 25 °C) po dobu 7 dnů během doby použitelnosti.
Konec 7denní doby při pokojové teplotě:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
TEVA GmbH Graf-Arco-StraBe 3 89079 Ulm Německo
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/565/007 6 předplněných injekčních stříkaček
EU/1/09/565/008 6 předplněných injekčních stříkaček s bezpečnostním zařízením EU/1/09/565/032 6 předplněných injekčních stříkaček s bezpečnostní jehlou
13. ČÍSLO ŠARŽE
č.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Biopoin 5 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce
epoetinum theta
Jedna předplněná injekční stříkačka obsahuje 5 000 mezinárodních jednotek (IU) (41,7 mikrogramů) epoetinum theta v 0,5 ml injekčního roztoku, což odpovídá 10 000 IU (83,3 mikrogramů) epoetinum theta v jednom ml.
Pomocné látky: dihydrát dihydrogenfosforečnanu sodného, chlorid sodný, polysorbát 20, trometamol, kyselina chlorovodíková (6 M) (k úpravě pH), voda na injekci.
injekční roztok
6 předplněných injekčních stříkaček s 0,5 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostní jehlou s 0,5 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostním zařízením s 0,5 ml roztoku
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Pouze k jednomu použití.
Prosím, používejte následujícím způsobem: Rámeček pro předepsané dávkování
Subkutánní nebo intravenózní podání
Uchovávejte mimo dohled a dosah dětí.
EXP:
Lze uchovávat při pokojové teplotě (do 25 °C) po dobu 7 dnů během doby použitelnosti.
Konec 7denní doby při pokojové teplotě:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
TEVA GmbH Graf-Arco-StraBe 3 89079 Ulm Německo
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/565/009 6 předplněných injekčních stříkaček
EU/1/09/565/010 6 předplněných injekčních stříkaček s bezpečnostním zařízením EU/1/09/565/033 6 předplněných injekčních stříkaček s bezpečnostní jehlou
13. ČÍSLO ŠARŽE
č.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Biopoin 10 000 IU/1 ml injekční roztok v předplněné injekční stříkačce
epoetinum theta
Jedna předplněná injekční stříkačka obsahuje 10 000 mezinárodních jednotek (IU) (83,3 mikrogramů) epoetinum theta v 1 ml injekčního roztoku, což odpovídá 10 000 IU (83,3 mikrogramů) epoetinum theta v jednom ml.
Pomocné látky: dihydrát dihydrogenfosforečnanu sodného, chlorid sodný, polysorbát 20, trometamol, kyselina chlorovodíková (6 M) (k úpravě pH), voda na injekci.
injekční roztok
1 předplněná injekční stříkačka s 1 ml roztoku 1 předplněná injekční stříkačka s bezpečnostní jehlou s 1 ml roztoku 1 předplněná injekční stříkačka s bezpečnostním zařízením s 1 ml roztoku 4 předplněné injekční stříkačky s 1 ml roztoku 4 předplněné injekční stříkačky s bezpečnostní jehlou s 1 ml roztoku 4 předplněné injekční stříkačky s bezpečnostním zařízením s 1 ml roztoku 6 předplněných injekčních stříkaček s 1 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostní jehlou s 1 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostním zařízením s 1 ml roztoku
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Pouze k jednomu použití.
Prosím, používejte následujícím způsobem: Rámeček pro předepsané dávkování
Subkutánní nebo intravenózní podání
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ_
8. POUŽITELNOST
EXP:
Lze uchovávat při pokojové teplotě (do 25 °C) po dobu 7 dnů během doby použitelnosti.
Konec 7denní doby při pokojové teplotě:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
TEVA GmbH Graf-Arco-StraBe 3 89079 Ulm Německo
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/565/011 1 předplněná injekční stříkačka
EU/1/09/565/012 1 předplněná injekční stříkačka s bezpečnostním zařízením EU/1/09/565/013 4 předplněné injekční stříkačky
EU/1/09/565/014 4 předplněné injekční stříkačky s bezpečnostním zařízením EU/1/09/565/015 6 předplněných injekčních stříkaček
EU/1/09/565/016 6 předplněných injekčních stříkaček s bezpečnostním zařízením EU/1/09/565/034 1 předplněná injekční stříkačka s bezpečnostní jehlou EU/1/09/565/035 4 předplněné injekční stříkačky s bezpečnostní jehlou EU/1/09/565/036 6 předplněných injekčních stříkaček s bezpečnostní jehlou
13. ČÍSLO ŠARŽE č.s.:
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Biopoin 10 000 IU/1 ml
Biopoin 20 000 IU/1 ml injekční roztok v předplněné injekční stříkačce
epoetinum theta
Jedna předplněná injekční stříkačka obsahuje 20 000 mezinárodních jednotek (IU) (166,7 mikrogramů) epoetinum theta v 1 ml injekčního roztoku, což odpovídá 20 000 IU (166,7 mikrogramů) epoetinum theta v jednom ml.
Pomocné látky: dihydrát dihydrogenfosforečnanu sodného, chlorid sodný, polysorbát 20, trometamol, kyselina chlorovodíková (6 M) (k úpravě pH), voda na injekci.
injekční roztok
1 předplněná injekční stříkačka s 1 ml roztoku 1 předplněná injekční stříkačka s bezpečnostní jehlou s 1 ml roztoku 1 předplněná injekční stříkačka s bezpečnostním zařízením s 1 ml roztoku 4 předplněné injekční stříkačky s 1 ml roztoku 4 předplněné injekční stříkačky s bezpečnostní jehlou s 1 ml roztoku 4 předplněné injekční stříkačky s bezpečnostním zařízením s 1 ml roztoku 6 předplněných injekčních stříkaček s 1 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostní jehlou s 1 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostním zařízením s 1 ml roztoku
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Pouze k jednomu použití.
Prosím, používejte následujícím způsobem: Rámeček pro předepsané dávkování
Subkutánní nebo intravenózní podání
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ_
8. POUŽITELNOST
EXP:
Lze uchovávat při pokojové teplotě (do 25 °C) po dobu 7 dnů během doby použitelnosti.
Konec 7denní doby při pokojové teplotě:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
TEVA GmbH Graf-Arco-StraBe 3 89079 Ulm Německo
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/565/017 1 předplněná injekční stříkačka
EU/1/09/565/018 1 předplněná injekční stříkačka s bezpečnostním zařízením EU/1/09/565/019 4 předplněné injekční stříkačky
EU/1/09/565/020 4 předplněné injekční stříkačky s bezpečnostním zařízením EU/1/09/565/021 6 předplněných injekčních stříkaček
EU/1/09/565/022 6 předplněných injekčních stříkaček s bezpečnostním zařízením EU/1/09/565/037 1 předplněná injekční stříkačka s bezpečnostní jehlou EU/1/09/565/038 4 předplněné injekční stříkačky s bezpečnostní jehlou EU/1/09/565/039 6 předplněných injekčních stříkaček s bezpečnostní jehlou
13. ČÍSLO ŠARŽE č.s.:
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Biopoin 20 000 IU/1 ml
Biopoin 30 000 IU/1 ml injekční roztok v předplněné injekční stříkačce
epoetinum theta
Jedna předplněná stříkačka obsahuje 30 000 mezinárodních jednotek (IU) (250 mikrogramů) epoetinum theta v 1 ml injekčního roztoku, což odpovídá 30 000 IU (250 mikrogramů) epoetinum theta v jednom ml.
Pomocné látky: dihydrát dihydrogenfosforečnanu sodného, chlorid sodný, polysorbát 20, trometamol, kyselina chlorovodíková (6 M) (k úpravě pH), voda na injekci.
injekční roztok
1 předplněná injekční stříkačka s 1 ml roztoku 1 předplněná injekční stříkačka s bezpečnostní jehlou s 1 ml roztoku 1 předplněná injekční stříkačka s bezpečnostním zařízením s 1 ml roztoku 4 předplněné injekční stříkačky s 1 ml roztoku 4 předplněné injekční stříkačky s bezpečnostní jehlou s 1 ml roztoku 4 předplněné injekční stříkačky s bezpečnostním zařízením s 1 ml roztoku 6 předplněných injekčních stříkaček s 1 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostní jehlou s 1 ml roztoku 6 předplněných injekčních stříkaček s bezpečnostním zařízením s 1 ml roztoku
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci.
Pouze k jednomu použití.
Prosím, používejte následujícím způsobem: Rámeček pro předepsané dávkování
Subkutánní nebo intravenózní podání
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ_
8. POUŽITELNOST
EXP:
Lze uchovávat při pokojové teplotě (do 25 °C) po dobu 7 dnů během doby použitelnosti.
Konec 7denní doby při pokojové teplotě:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ_
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
TEVA GmbH Graf-Arco-StraBe 3 89079 Ulm Německo
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/09/565/023 1 předplněná injekční stříkačka
EU/1/09/565/024 1 předplněná injekční stříkačka s bezpečnostním zařízením EU/1/09/565/025 4 předplněné injekční stříkačky
EU/1/09/565/026 4 předplněné injekční stříkačky s bezpečnostním zařízením EU/1/09/565/027 6 předplněných injekčních stříkaček
EU/1/09/565/028 6 předplněných injekčních stříkaček s bezpečnostním zařízením EU/1/09/565/040 1 předplněná injekční stříkačka s bezpečnostní jehlou EU/1/09/565/041 4 předplněné injekční stříkačky s bezpečnostní jehlou EU/1/09/565/042 6 předplněných injekčních stříkaček s bezpečnostní jehlou
13. ČÍSLO ŠARŽE č.s.:
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Biopoin 30 000 IU/1 ml
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Biopoin 1 000 IU/0,5 ml injekce epoetinum theta s.c. i.v.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
0,5 ml
6. JINÉ
IU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Biopoin 2 000 IU/0,5 ml injekce epoetinum theta s.c. i.v.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
0,5 ml
6. JINÉ
IU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Biopoin 3 000 IU/0,5 ml injekce epoetinum theta s.c. i.v.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
0,5 ml
6. JINÉ
IU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Biopoin 4 000 IU/0,5 ml injekce epoetinum theta s.c. i.v.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
0,5 ml
6. JINÉ
IU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Biopoin 5 000 IU/0,5 ml injekce epoetinum theta s.c. i.v.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
0,5 ml
6. JINÉ
IU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Biopoin 10 000 IU/1 ml injekce epoetinum theta s.c. i.v.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 ml
6. JINÉ
IU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Biopoin 20 000 IU/1 ml injekce epoetinum theta s.c. i.v.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 ml
6. JINÉ
IU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Biopoin 30 000 IU/1 ml injekce epoetinum theta s.c. i.v.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
č.š.:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
1 ml
6. JINÉ
IU
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
Biopoin 1 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce Biopoin 2 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce Biopoin 3 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce Biopoin 4 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce Biopoin 5 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce Biopoin 10 000 IU/ 1 ml injekční roztok v předplněné injekční stříkačce Biopoin 20 000 IU/ 1 ml injekční roztok v předplněné injekční stříkačce Biopoin 30 000 IU/ 1 ml injekční roztok v předplněné injekční stříkačce
Epoetinum theta
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Biopoin a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Biopoin používat
3. Jak se přípravek Biopoin používá
4. Možné nežádoucí účinky
5 Jak přípravek Biopoin uchovávat
6. Obsah balení a další informace
7. Informace pro samostatnou aplikaci injekce
1. Co je přípravek Biopoin a k čemu se používá Co je Biopoin
Biopoin obsahuje léčivou látku epoetin theta, který je téměř identický s erytropoetinem, což je přirozený hormon, který se tvoří v těle. Epoetin theta je bílkovina vyráběná biotechnologickým postupem. Působí naprosto stejným způsobem jako erytropoetin. Erytropoetin se vytváří v ledvinách a stimuluje kostní dřeň, aby vytvářela červené krvinky. Červené krvinky jsou velmi důležité pro přenos kyslíku v těle.
K čemu se Biopoin používá
Biopoin se používá k léčbě anémie provázené určitými příznaky (například únava, slabost a dušnost). Anémie se objevuje, když krev neobsahuje dostatečné množství červených krvinek. Léčbu anémie dostávají dospělí pacienti s chronickým selháváním ledvin nebo dospělí pacienti s nemyeloidním nádorovým onemocněním (rakovina, která nemá původ v kostní dřeni), kteří jsou současně léčeni chemoterapií (léky k léčbě rakoviny).
2. Čemu musíte věnovat pozornost, než začnete přípravek Biopoin používat Nepoužívejte přípravek Biopoin
- jestliže jste alergický(á) na epoetin theta, jiný epoetin nebo na kteroukoli další složku tohoto
přípravku (uvedenou v bodě 6),
- jestliže máte vysoký krevní tlak, který je špatně kontrolovatelný.
Upozornění a opatření
Obecně
Tento přípravek nemusí být vhodný pro následující pacienty. Poraďte se prosím se svým lékařem, jestliže patříte do jedné z těchto skupin pacientů:
- pacienti s jaterními problémy,
- pacienti s patologickými změnami červených krvinek (homozygotní srpkovitá anémie).
Při léčbě tímto přípravkem je třeba, aby Vám lékař zkontroloval krevní tlak dříve, než začnete přípravek používat a dále pravidelně kontroloval krevní tlak během léčby. Pokud se krevní tlak zvyšuje, lékař Vám může předepsat léky na snížení krevního tlaku. Pokud již užíváte lék na snížení krevního tlaku, lékař Vám může zvýšit dávkování. Možná bude nutné snížit dávku přípravku Biopoin nebo léčbu přípravkem Biopoin na krátkou dobu přerušit.
Pokud se dostaví bolesti hlavy, zejména náhlé, ostré a bodavé, migrenózní bolesti, zmatenost, poruchy řeči, nestabilní chůze, křeče, informujte okamžitě lékaře. Může se jednat o známky silně zvýšeného krevního tlaku, i když obvykle máte krevní tlak normální nebo nízký. Je třeba, aby jeho léčba začala ihned.
Lékař Vám bude pravidelně provádět vyšetření krve, aby byly kontrolovány různé krevní složky a jejich hladiny. Navíc Vám bude zkontrolována hladina železa v krvi před a v průběhu léčby tímto přípravkem. V případě, že budete mít nízkou hladinu železa, lékař Vám může též předepsat přípravky s obsahem železa.
Jestliže se cítíte unavený(á) a slabý(á) nebo pociťujete dušnost, musíte se poradit s lékařem. Tyto příznaky mohou naznačovat, že léčba tímto přípravkem není účinná. Váš lékař zjistí, zda nemáte jiné příčiny anémie a může provést krevní testy nebo vyšetření kostní dřeně.
Váš odborný zdravotnický pracovník vždy zaznamená přesně ten přípravek, který používáte. To může pomoci poskytnout více informací o bezpečnosti léků, jako je tento.
Zdravé osoby by neměly Biopoin používat. Používání tohoto přípravku zdravými osobami může nadměrně zvýšit některé krevní parametry a tím způsobit problémy se srdcem nebo cévami, které mohou být život ohrožující.
Anémie způsobená chronickým selháním ledvin
Jestliže jste pacient s chronickým selháním ledvin, lékař zkontroluje, zda určitý krevní parametr (hemoglobin) nepřesahuje stanovenou prahovou hodnotu. Jestliže je tato hodnota příliš vysoká, mohou se objevit srdeční nebo cévní problémy, které zvyšují riziko úmrtí.
Pokud jste pacient s chronickým selháním ledvin a zvláště pokud odpovídajícím způsobem nereagujete na léčbu přípravkem Biopoin, Váš lékař zkontroluje Vaši dávku přípravku Biopoin, protože opakované zvyšování této dávky přípravku Biopoin, v případě, že neodpovídáte na léčbu, může zvýšit riziko problémů se srdcem nebo krevními cévami a může zvýšit riziko srdečního infarktu, cévní mozkové příhody a úmrtí.
Jestliže trpíte ztvrdnutím krevních cév v ledvinách (nefroskleróza), ale nepotřebujete podstoupit dialýzu, lékař zváží, zda tato léčba je pro Vás vhodná. Je to proto, že nelze s naprostou jistotou vyloučit možné urychlení zhoršování onemocnění ledvin.
Pokud jste na dialýze, podávají se léky, které zabraňují srážení krve. Jestliže jste léčen(a) přípravkem Biopoin, je možné, že dávku protisrážlivého léku bude třeba zvýšit. Zvýšený počet červených krvinek by mohl způsobit ucpání arterio-venózní spojky (uměle vytvořené spojení mezi tepnou a žílou, které je chirurgicky vytvořené u dialyzovaných pacientů).
Anémie u pacientů s rakovinou
Jestliže trpíte rakovinou, měl(a) byste vědět, že tento přípravek může působit jako růstový faktor pro krevní buňky a za některých okolností může mít negativní vliv na Vaše onemocnění. V závislosti na individuální situaci může být vhodnější podání krevní transfuze. Je třeba se o tom poradit s lékařem.
Děti a dospívající
Nepodávejte tento přípravek dětem a dospívajícím do 18 let věku, protože nejsou k dispozici žádné údaje, které by prokázaly, že tento přípravek je bezpečný a účinkuje u této věkové skupiny.
Další léčivé přípravky a přípravek Biopoin
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Těhotenství a kojení
Přípravek Biopoin nebyl zkoušen u těhotných žen. Je důležité informovat svého lékaře, pokud jste těhotná, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, protože lékař může rozhodnout, že byste neměla tento lék používat.
Není známo, zda léčivá látka tohoto přípravku přechází do mateřského mléka. Lékař proto může rozhodnout, že byste neměla tento lék používat, jestliže kojíte.
Řízení dopravních prostředků a obsluha strojů
Tento léčivý přípravek neovlivňuje schopnost řídit motorová vozidla a obsluhovat stroje.
Přípravek Biopoin obsahuje sodík
Tento přípravek obsahuje méně než 1 mmol (23 mg) sodíku v jedné předplněné injekční stříkačce, tj. v podstatě je „bez sodíku“.
3. Jak se přípravek Biopoin používá
Léčbu tímto přípravkem zahajuje lékař, který má zkušenosti s výše uvedenými indikacemi.
Vždy používejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Doporučená dávka přípravku je...
Dávka přípravku Biopoin (vyjádřená v Mezinárodních jednotkách nebo IU) závisí na stavu Vaší choroby, Vaší tělesné hmotnosti a způsobu podání injekce (pod kůži [subkutánní injekce] nebo do žíly [intravenózní injekce]). Lékař Vám určí správnou dávku.
Anémie způsobená chronickým selháním ledvin
Injekce se podávají subkutánně nebo intravenózně. Hemodialyzovaní pacienti dostávají injekci obvykle na konci dialýzy do arteriovenózní spojky. Pacienti, kteří nepodstupují dialýzu, dostávají injekci obvykle pod kůži. Lékař bude provádět pravidelně vyšetření krve a bude-li třeba, upraví dávku nebo dočasně přeruší léčbu. Hodnoty hemoglobinu by neměly přesáhnout hodnotu 12 g/dl (7,45 mmol/l). Váš lékař použije nejnižší účinnou dávku pro kontrolu příznaků Vaší anémie. Pokud nebudete na přípravek Biopoin odpovídajícím způsobem reagovat, zkontroluje Váš lékař dávku a informuje Vás, zda potřebujete změnit dávku přípravku Biopoin.
Léčba přípravkem Biopoin je rozdělena do dvou fází: a) Úprava anémie
Úvodní dávka pro subkutánní injekce je 20 IU na kg tělesné hmotnosti, podávaná 3krát týdně. Pokud je to nutné, lékař Vám bude zvyšovat dávku v měsíčních intervalech.
Úvodní dávka pro intravenózní injekce je 40 IU na kg tělesné hmotnosti, podávaná 3krát týdně. Pokud je to nutné, lékař Vám bude zvyšovat dávku v měsíčních intervalech.
b) Udržení dostatečných hladin buněk červené krevní řady
Jakmile bylo dosaženo uspokojivého počtu buněk červené krevní řady, lékař určí udržovací dávku k zajištění jejich konstantního počtu.
V případě subkutánních injekcí může být týdenní dávka podávána buď v 1 injekci týdně nebo může být dávka rozdělena do 3 injekcí týdně.
V případě intravenózních injekcí může být dávka rozdělena do 2 injekcí týdně.
Pokud se změní způsob podání, je nezbytné upravit dávkování.
Léčba přípravkem Biopoin je obvykle dlouhodobá.
Maximální dávka by neměla překročit 700 IU na kg tělesné hmotnosti týdně.
Anémie u pacientů s rakovinou
Injekce se podávají subkutánně. Injekce se podávají jednou týdně. Úvodní dávka je 20 000 IU. Lékař Vám bude provádět pravidelné kontroly krevních vzorků a podle výsledků může dávku upravit nebo dočasně léčbu přerušit, pokud je to nutné. Hodnoty hemoglobinu by neměly překročit hodnotu 12 g/dl (7,45 mmol/l). Obvykle budete dostávat Biopoin po dobu až 1 měsíce po ukončení chemoterapie.
Maximální dávka by neměla přesáhnout 60 000 IU týdně.
Jak se injekce podávají?
Tento léčivý přípravek se podává injekčně za použití předplněných injekčních stříkaček. Injekce se podává buď do žíly (intravenózní injekce) nebo do tkáně těsně pod kůží (subkutánní injekce).
Jestliže dostáváte Biopoin jako subkutánní injekci, Váš lékař Vám může navrhnout, abyste se naučil(a) podávat injekci s tímto lékem sám(sama). Váš lékař nebo zdravotní sestra Vám vysvětlí, jak to provést. Nepokoušejte se podat si sám(sama) tento přípravek bez této instruktáže. Některé informace požadované pro použití předplněných injekčních stříkaček můžete nalézt na konci této příbalové informace (viz bod „7, Informace pro samostatnou aplikaci injekce“). Správná léčba Vašeho onemocnění však v každém případě vyžaduje těsnou a trvalou spolupráci s Vaším lékařem.
Jedna předplněná injekční stříkačka je určena pouze k jednomu použití.
Jestliže jste použil(a) více přípravku Biopoin, než jste měl(a)
Nezvyšujte dávku, kterou Vám určil lékař. Jestliže se domníváte, že jste si podal(a) více přípravku Biopoin než jste měl(a), vyhledejte lékaře. Je nepravděpodobné, že by to bylo vážné. I při velmi vysokých hladinách v krvi nebyly pozorovány příznaky otravy.
Jestliže jste zapomněl(a) použít přípravek Biopoin
Jestliže jste vynechal(a) injekci, nebo jste si podal(a) příliš malé množství, poraďte se s lékařem. Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) používat přípravek Biopoin
Dříve než přestanete tento přípravek používat, poraďte se s lékařem.
Máte-li jakékoli další otázky týkající se používání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
r-g r V r V a I r r V • I
Závažné nežádoucí účinky:
- Závažné zvýšení krevního tlaku:
Pokud se dostaví bolesti hlavy, zejména náhlé, ostré a bodavé, migrenózní bolesti, zmatenost, poruchy řeči, nestabilní chůze, křeče nebo záchvaty, informujte okamžitě lékaře. Může se jednat o známky silně zvýšeného krevního tlaku (časté u pacientů s chronickým selháním ledvin, může postihnout až 1 z 10 lidí), i když obvykle máte krevní tlak normální nebo nízký. Je třeba, aby léčba začala ihned.
- Alergické reakce:
Byly zaznamenány alergické reakce, jako je kožní vyrážka, vyvýšené oblasti kůže, které svědí, a silné alergické reakce s pocitem slabosti, poklesem krevního tlaku, dýchacími obtížemi a otokem obličeje (frekvence není známá, z dostupných údajů nelze určit). Pokud se domníváte, že máte tento typ reakce, musíte přestat s podáváním injekcí Biopoin a vyhledat okamžitě lékařskou pomoc.
Můžete pociťovat další nežádoucí účinky, ktere následují:
Časté (mohou postihnout až 1 z 10 lidí)
- bolest hlavy,
- vysoký krevní tlak,
- příznaky podobné chřipce, jako je horečka, zimnice, pocit slabosti, únava,
- kožní reakce, jako je vyrážka, svědění nebo reakce v okolí místa vpichu.
Časté u pacientů s chronickým selháním ledvin (mohou postihnout až 1 z 10 lidí)
- srážení krve v arteriovenózní spojce u pacientů podstupujících dialýzu
Časté u pacientů s rakovinou (mohou postihnout až 1 z 10 lidí)
- bolesti kloubů.
Není známo u pacientů s chronickým selháním ledvin (frekvenci nelze z dostupných údajů určit)
- Byly zaznamenány případy stavu nazývaného čistá aplazie buněk červené krevní řady (PRCA). PRCA znamená, že se ve Vašem těle zastavila nebo snížila tvorba červených krvinek, což způsobuje závažnou anémii. Jestliže má Váš lékař podezření nebo potvrdí, že máte tento stav, nesmíte být léčen(a) přípravkem Biopoin nebo jiným epoetinem.
Není známo u pacientů s rakovinou (frekvenci nelze z dostupných údajů určit)
- tromboembolické příhody, např. nárůst krevních sraženin
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Biopoin uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a na předplněné injekční stříkačce za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v chladničce (2 °C - 8 °C)
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
Biopoin můžete vyjmout z chladničky a uchovávat (do 25 °C) jednorázově po dobu až 7 dnů bez překročení doby použitelnosti. Jakmile vyjmete přípravek z chladničky, musí být použit během této doby nebo musí být zlikvidován.
Nepoužívejte tento přípravek, pokud si všimnete, že je roztok zakalený nebo jsou v něm částice.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Biopoin obsahuje
- Léčivou látkou je epoetinum theta.
Biopoin 1 000 IU/0,5 ml: Jedna předplněná injekční stříkačka obsahuje 1 000 mezinárodních jednotek (IU) (8,3 mikrogramů) epoetinu theta v 0,5 ml injekčního roztoku, což odpovídá 2 000 mezinárodních jednotek (IU) (16,7 mikrogramů) v jednom ml.
Biopoin 2 000 IU/0,5 ml: Jedna předplněná injekční stříkačka obsahuje 2 000 mezinárodních jednotek (IU) (16,7 mikrogramů) epoetinu theta v 0,5 ml injekčního roztoku, což odpovídá 4 000 mezinárodních jednotek (IU) (33,3 mikrogramů) v jednom ml.
Biopoin 3 000 IU/0,5 ml: Jedna předplněná injekční stříkačka obsahuje 3 000 mezinárodních jednotek (IU) (25 mikrogramů) epoetinu theta v 0,5 ml injekčního roztoku, což odpovídá 6 000 mezinárodních jednotek (IU) (50 mikrogramů) v jednom ml.
Biopoin 4 000 IU/0,5 ml: Jedna předplněná injekční stříkačka obsahuje 4 000 mezinárodních jednotek (IU) (33,3 mikrogramů) epoetinu theta v 0,5 ml injekčního roztoku, což odpovídá 8 000 mezinárodních jednotek (IU) (66,7 mikrogramů) v jednom ml.
Biopoin 5 000 IU/0,5 ml: Jedna předplněná injekční stříkačka obsahuje 5 000 mezinárodních jednotek (IU) (41,7 mikrogramů) epoetinu theta v 0,5 ml injekčního roztoku, což odpovídá 10 000 mezinárodních jednotek (IU) (83,3 mikrogramů) v jednom ml.
Biopoin 10 000 IU/1 ml: Jedna předplněná injekční stříkačka obsahuje 10 000 mezinárodních jednotek (IU) (83,3 mikrogramů) epoetinu theta v 1 ml injekčního roztoku, což odpovídá 10 000 mezinárodních jednotek (IU) (83,3 mikrogramů) v jednom ml.
Biopoin 20 000 IU/1 ml: Jedna předplněná injekční stříkačka obsahuje 20 000 mezinárodních jednotek (IU) (166,7 mikrogramů) epoetinu theta v 1 ml injekčního roztoku, což odpovídá 20 000 mezinárodních jednotek (IU) (166,7 mikrogramů) v jednom ml.
Biopoin 30 000 IU/1 ml: Jedna předplněná injekční stříkačka obsahuje 30 000 mezinárodních jednotek (IU) (250 mikrogramů) epoetinu theta v 1 ml injekčního roztoku, což odpovídá 30 000 mezinárodních jednotek (IU) (250 mikrogramů) v jednom ml.
- Dalšími složkami jsou dihydrát dihydrogenfosforečnanu sodného, chlorid sodný, polysorbát 20, trometamol, kyselina chlorovodíková (6 M) (k úpravě pH), voda na injekci.
Jak přípravek Biopoin vypadá a co obsahuje toto balení
Biopoin je čirý a bezbarvý injekční roztok v předplněné injekční stříkačce s injekční jehlou.
Biopoin 1 000 IU/0,5 ml, Biopoin 2 000 IU/0,5 ml, Biopoin 3 000 IU/0,5 ml, Biopoin 4 000 IU/0,5 ml, Biopoin 5 000 IU/0,5 ml: Jedna předplněná injekční stříkačka obsahuje 0,5 ml injekčního roztoku. Velikost balení: 6 předplněných injekčních stříkaček; 6 předplněných injekčních stříkaček s bezpečnostní jehlou nebo 6 předplněných injekčních stříkaček s bezpečnostním zařízením.
Biopoin 10 000 IU/1 ml, Biopoin 20 000 IU/1 ml, Biopoin 30 000 IU/1 ml: Jedna předplněná injekční stříkačka obsahuje 1 ml injekčního roztoku.
Velikost balení: 1, 4 a 6 předplněných injekčních stříkaček; 1, 4 a 6 předplněných injekčních stříkaček s bezpečnostní jehlou nebo 1, 4 a 6 předplněných injekčních stříkaček s bezpečnostním zařízením.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci výrobce
TEVA GmbH Graf-Arco-StraBe 3 89079 Ulm Německo
Výrobce
Teva Biotech GmbH Dornierstrasse 10 89079 Ulm Německo
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci
|
Belgie/Belgique/Belgien Teva Pharma Belgium N.V./S.A./AG Tél/Tel: +32 3 820 73 73 |
Lietuva UAB "Sicor Biotech" Tel: +370 5 266 0203 |
|
BtnrapHH TeBa OapMacmraKMC Etarapna EOOfl Ten: +359 2 489 95 82 |
Luxembourg/Luxemburg Teva Pharma Belgium N.V./S.A./AG, Belgique/Belgien Tél/Tel: +32 3 820 73 73 |
|
Česká republika Teva Pharmaceuticals CR, s.r.o. Tel: +420 251 007 111 |
Magyarország Teva Gyógyszergyár Zrt. Tel.: +36 1 288 64 00 |
|
Danmark Teva Denmark A/S Tlf: +45 44 98 55 11 |
Malta Teva Pharmaceuticals Ireland, L-Irlanda. Tel: +353 51 321740 |
|
Deutschland TEVA GmbH Tel: +49 731 402 08 |
Nederland Teva Nederland B.V. Tel: +31 800 0228 400 |
|
Eesti UAB "Sicor Biotech" Eesti filiaal Tel: +372 661 0801 |
Norge Teva Norway AS Tlf: +47 66 77 55 90 |
|
EXláSa Teva EAAág A.E. T^: +30 210 72 79 099 |
Osterreich ratiopharm Arzneimittel Vertriebs-GmbH Tel: +43 1 97 007 |
|
Espaňa Teva Pharma, S.L.U. Tél: +34 91 387 32 80 |
Polska Teva Pharmaceuticals Polska Sp. z o.o. Tel.: +48 22 345 93 00 |
|
France Teva Santé Tél: +33 1 55 91 78 00 |
Portugal Teva Pharma - Produtos Farmaceuticos, Lda Tel: +351 21 476 75 50 |
|
Hrvatska |
Románia |
Pliva Hrvatska d.o.o.
Tel: +385 1 37 20 000
Ireland
Teva Pharmaceuticals Ireland Tel: +353 51 321740
Ísland
ratiopharm Oy, Finnland Sími: +358 20 180 5900
Italia
Teva Italia S.r.l.
Tel: +39 02 89 17 98 1
Kúrcpog
Teva EkMg A.E., EkMSa Tnk: +30 210 72 79 099
Latvija
UAB "Sicor Biotech" filiale Latvija Tel: +371 673 23 666
Teva Pharmaceuticals S.R.L Tel: +40 21 230 65 24
Slovenija
Pliva Ljubljana d.o.o.
Tel: +386 1 58 90 390
Slovenská republika
TEVA Pharmaceuticals Slovakia s.r.o. Tel: +421 2 57 26 79 11
Suomi/Finland
ratiopharm Oy Puh/Tel: +358 20 180 5900
Sverige
Teva Sweden AB Tel: +46 42 12 11 00
United Kingdom
Teva UK Limited Tel: +44 1977 628500
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
7. Informace pro samostatnou aplikaci injekce
Tato část obsahuje informace o tom, jakým způsobem si sám(sama) můžete aplikovat injekci přípravku Biopoin pod kůži. Je důležité, abyste se nesnažil(a) podat si injekci sám(sama), pokud Vás nezaškolil Váš lékař nebo zdravotní sestra. Pokud si nejste jistý(á), jak si máte injekci sám(sama) aplikovat, nebo máte jakékoli otázky, požádejte o pomoc svého lékaře nebo zdravotní sestru.
Jak se přípravek Biopoin aplikuje
Injekci je třeba aplikovat do tkáně přímo pod kůži. Tento způsob se nazývá podkožní (subkutánní) injekce.
Vybavení nezbytné pro podání injekce
K samostatné aplikaci injekce pod kůži budete potřebovat:
- předplněnou injekční stříkačku přípravku Biopoin,
- alkoholem napuštěné tampony,
- kousek gázového obinadla nebo sterilní gázový tampon,
- odpadní nádobu odolnou proti propíchnutí (plastová nádoba poskytovaná nemocnicí nebo lékárnou), do níž můžete injekční stříkačky bezpečně odhazovat.
Co je třeba udělat před vlastní aplikací injekce
1. Vyjměte jeden blistr s předplněnou injekční stříkačkou z chladničky.
2. Blistr otevřete a vyndejte předplněnou injekční stříkačku a pouzdro s jehlou z blistru. Předplněnou injekční stříkačku nezdvihejte za píst ani víčko.
3. Zkontrolujte datum použitelnosti na předplněné injekční stříkačce (EXP). Přípravek nepoužívejte po uplynutí posledního dne uvedeného měsíce.
4. Zkontrolujte vzhled přípravku Biopoin. Roztok musí být čirý a bezbarvý. Pokud roztok obsahuje částečky nebo je zakalený, nepoužívejte ho.
5. Na konci krytu jehly je víčko. Na vyznačeném místě rozlomte a sejměte víčko (viz obr.1).
6. Sejměte víčko ze špičky předplněné injekční stříkačky (viz obr. 2).
7. Připojte jehlu ke stříkačce (viz obr. 3). Neodstraňujte ještě kryt jehly.
8. Pro pohodlnější aplikaci ponechte injekční stříkačku 30 minut při pokojové teplotě (maximálně do 25 °C) nebo lehce podržte stříkačku několik minut v ruce. Neohřívejte přípravek Biopoin jiným způsobem ( např. v mikrovlnné troubě nebo horké vodě).
9. Neodstraňujte kryt jehly ze stříkačky dříve, než jste připraven(a) si injekci aplikovat.
10. Najděte si pohodlné, dobře osvětlené místo. Všechny potřebné pomůcky si rozmístěte tak, abyste na ně pohodlně dosáhl(a) (předplněnou injekční stříkačku s přípravkem Biopoin, tampony napuštěné alkoholem, kousek gázového obinadla nebo sterilní gázový tampon a odpadní nádobu odolnou proti propíchnutí).
11. Důkladně si umyjte ruce.
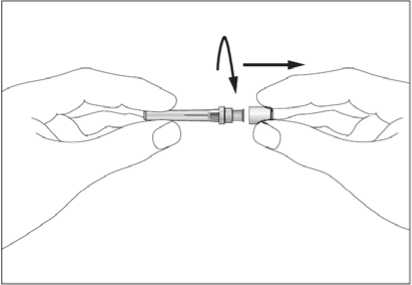
1
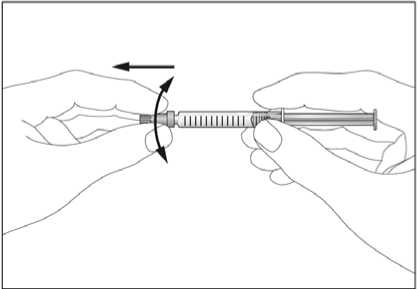
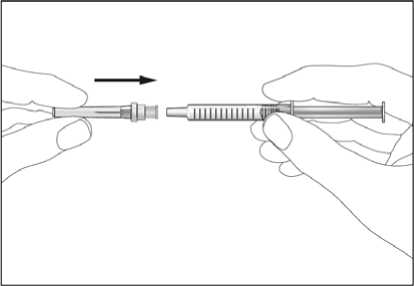
3
Jak se připravit na injekci
Před tím, než si sám(sama) píchnete injekci Biopoin, musíte učinit následující kroky:
1. Držte stříkačku a pomalu odstraňte kryt jehly, aniž byste s ním otáčel(a). Kryt vodorovně stáhněte, jak je znázorněno na obrázku 4. Nedotýkejte se jehly a netlačte na píst.
2. V předplněné injekční stříkačce mohou být malé vzduchové bubliny. Pokud jsou vzduchové bubliny přítomny, poklepejte lehce na stříkačku prsty, až se bubliny přesunou do horní části stříkačky. Injekční stříkačku namiřte směrem vzhůru a pomalým tlakem na píst vzduch vytlačte.
3. Injekční stříkačka má na válci stupnici. Posuňte píst k číslu (IU) na stříkačce, které odpovídá dávce přípravku Biopoin předepsané Vaším lékařem.
4. Znovu zkontrolujte, zda injekční stříkačka obsahuje správnou dávku přípravku Biopoin.
5. Nyní můžete předplněnou injekční stříkačku použít.
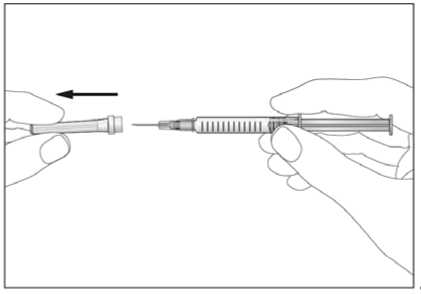
Kam injekci aplikovat
Nejvhodnější místa pro aplikaci jsou:
- horní plocha stehena
- břicho, kromě oblasti kolem pupku (viz šedé oblasti na obrázku 5).
Pokud Vám injekci aplikuje někdo jiný, může využít také zadní a boční plochu horních končetin (viz šedé oblasti na obrázku 6).
Místa aplikace je lépe každý den střídat, a tím předejít riziku bolestivosti na kterémkoli místě.
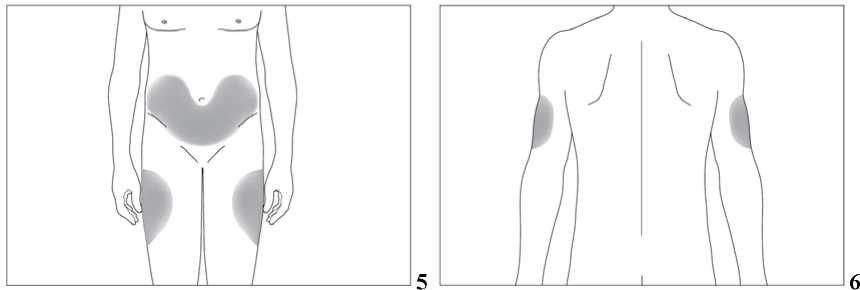
Jak injekci sám sobě aplikovat
1. Kůži v místě aplikace dezinfikujte pomocí alkoholového tamponu a mezi palec a ukazováček uchopte bez mačkání kožní řasu (viz obrázek 7).
2. Zaveďte celou jehlu do kůže, tak jak Vám to předvedl Váš lékař nebo Vaše zdravotní sestra. Úhel mezi injekční stříkačkou a kůží by neměl být příliš úzký (alespoň 45°, viz obrázek 8).
3. Tekutinu vystřikujte do tkáně pomalu a rovnoměrně, kožní řasu stále držte.
4. Po aplikaci injekčního roztoku jehlu vytáhněte a uvolněte kožní řasu.
5. Zmáčkněte místo vpichu kouskem gázového obinadla nebo sterilním gázovým tamponem na několik vteřin.
6. Každou stříkačku použijte jen jednou. Přípravek Biopoin, který ve stříkačce zbude, znovu nepoužívejte.
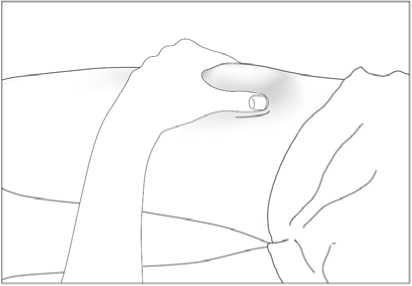
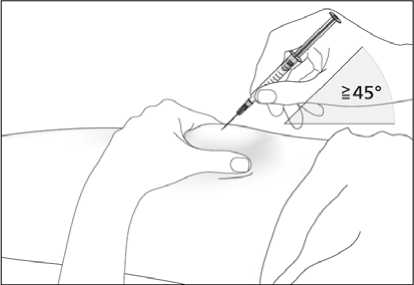
Pamatujte
Pokud budete mít jakékoliv problémy, požádejte o pomoc nebo radu svého lékaře nebo zdravotní sestru.
Likvidace použitých injekčních stříkaček
- Na použité injekční jehly nenasazujte zpět kryt.
- Použité injekční stříkačky vyhoďte do odpadní nádoby odolné proti propíchnutí a tuto nádobu uchovávejte mimo dohled a dosah dětí.
- Plnou nádobu zlikvidujte podle pokynů svého lékaře, lékárníka nebo zdravotní sestry.
- Nikdy nevyhazujte použité stříkačky do běžného odpadkového koše v domácnosti.
7. Informace pro samostatnou aplikaci injekce
Tato část obsahuje informace o tom, jakým způsobem si sám(sama) můžete aplikovat injekci přípravku Biopoin pod kůži. Je důležité, abyste se nesnažil(a) podat si injekci sám(sama), pokud Vás nezaškolil Váš lékař nebo zdravotní sestra. Pokud si nejste jistý(á), jak si máte injekci sám(sama) aplikovat, nebo máte jakékoli otázky, požádejte o pomoc svého lékaře nebo zdravotní sestru.
Jak se přípravek Biopoin aplikuje
Injekci je třeba aplikovat do tkáně přímo pod kůži. Tento způsob se nazývá podkožní (subkutánní) injekce.
Vybavení nezbytné pro podání injekce
K samostatné aplikaci injekce pod kůži budete potřebovat:
- předplněnou injekční stříkačku přípravku Biopoin,
- alkoholem napuštěné tampony
- kousek gázového obinadla nebo sterilní gázový tampon,
- odpadní nádobu odolnou proti propíchnutí (plastová nádoba poskytovaná nemocnicí nebo lékárnou), do níž můžete injekční stříkačky bezpečně odhazovat.
Co je třeba udělat před vlastní aplikací injekce
1. Vyjměte jeden blistr s předplněnou injekční stříkačkou z chladničky.
2. Blistr otevřete a vyndejte předplněnou injekční stříkačku a sáček s jehlou z blistru. Předplněnou injekční stříkačku nezdvihejte za píst ani víčko.
3. Zkontrolujte datum použitelnosti na předplněné injekční stříkačce (EXP). Přípravek nepoužívejte po uplynutí posledního dne uvedeného měsíce.
4. Zkontrolujte vzhled přípravku Biopoin. Roztok musí být čirý a bezbarvý. Pokud roztok obsahuje částečky nebo je zakalený, nepoužívejte ho.
5. Na konci sáčku s jehlou jsou chlopně. Otevřete sáček s jehlou v místě chlopní (viz obr 1).
6. Sejměte víčko ze špičky předplněné injekční stříkačky (viz obr. 2).
7. Připojte jehlu ke stříkačce (viz obr. 3). Neodstraňujte ještě kryt jehly.
8. Vysuňte bezpečnostní kryt z jehly a směrem k tělu injekční stříkačky. Bezpečnostní kryt zůstane v pozici, kterou nastavíte (viz obr. 4).
Pro pohodlnější aplikaci ponechte injekční stříkačku 30 minut při pokojové teplotě (maximálně do 25 °C) nebo lehce podržte stříkačku několik minut v ruce. Neohřívejte přípravek Biopoin jiným způsobem (např. v mikrovlnné troubě nebo horké vodě).
Neodstraňujte kryt jehly ze stříkačky dříve, než jste připraven(a) si injekci aplikovat.
Najděte si pohodlné, dobře osvětlené místo. Všechny potřebné pomůcky si rozmístěte tak, abyste na ně pohodlně dosáhl(a) (předplněnou injekční stříkačku s přípravkem Biopoin, tampony napuštěné alkoholem, kousek gázového obinadla nebo sterilní gázový tampon a odpadní nádobu odolnou proti propíchnutí).
Důkladně si umyjte ruce.
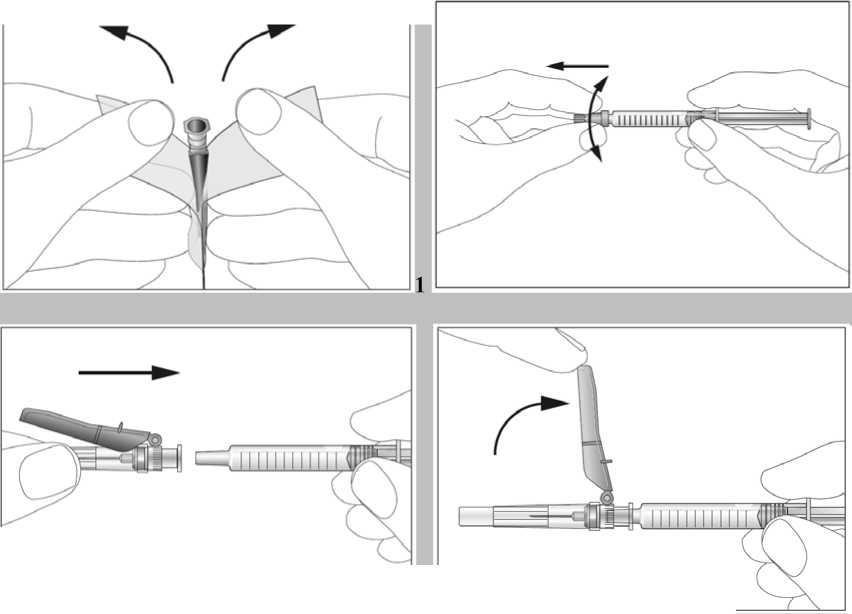
Jak se připravit na injekci
Před tím, než si sám(sama) píchnete injekci Biopoin, musíte učinit následující kroky:
Držte stříkačku a pomalu odstraňte kryt jehly, aniž byste s ním otáčel(a). Kryt vodorovně stáhněte, jak je znázorněno na obrázku 5. Nedotýkejte se jehly a netlačte na píst.
V předplněné injekční stříkačce mohou být malé vzduchové bubliny. Pokud jsou vzduchové bubliny přítomny, poklepejte lehce na stříkačku prsty, až se bubliny přesunou do horní části stříkačky. Injekční stříkačku namiřte směrem vzhůru a pomalým tlakem na píst vzduch vytlačte. Injekční stříkačka má na válci stupnici. Posuňte píst k číslu (IU) na stříkačce, které odpovídá dávce přípravku Biopoin předepsané Vaším lékařem.
Znovu zkontrolujte, zda injekční stříkačka obsahuje správnou dávku přípravku Biopoin.
Nyní můžete předplněnou injekční stříkačku použít.
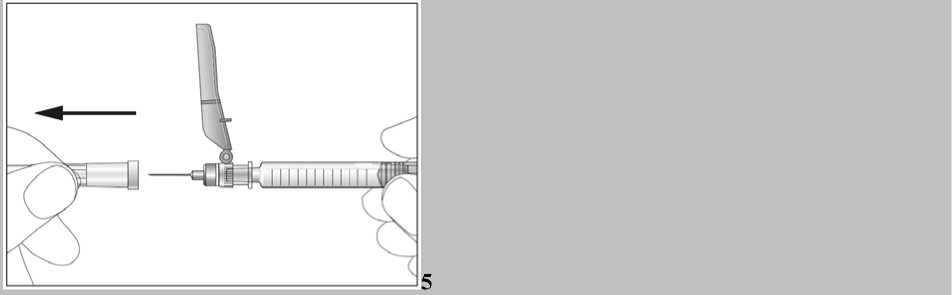
Kam injekci aplikovat
Nejvhodnější místa pro aplikaci jsou:
- horní plocha stehen
- břicho, kromě oblasti kolem pupku (viz šedé oblasti na obrázku 6).
Pokud Vám injekci aplikuje někdo jiný, může využít také zadní a boční plochu horních končetin (viz šedé oblasti na obrázku 7).
Místa aplikace je lépe každý den střídat, a tím předejít riziku bolestivosti na kterémkoli místě.
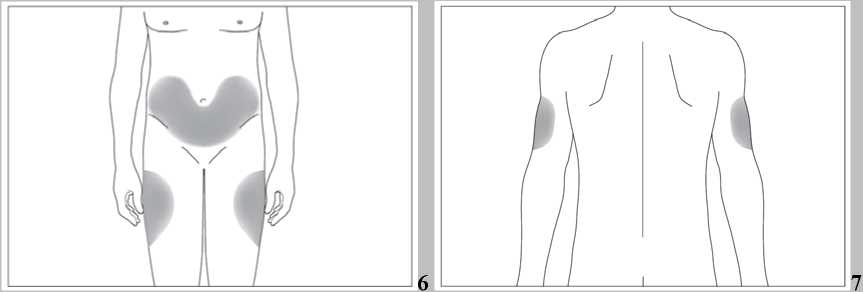
Jak injekci sám sobě aplikovat
1. Kůži v místě aplikace dezinfikujte pomocí alkoholového tamponu a mezi palec a ukazováček uchopte bez mačkání kožní řasu (viz obrázek 8).
2. Zaveďte celou jehlu do kůže, tak jak Vám to předvedl Váš lékař nebo Vaše zdravotní sestra. Úhel mezi injekční stříkačkou a kůží by neměl být příliš úzký (alespoň 45°, viz obrázky 9 a 10).
3. Tekutinu vystřikujte do tkáně pomalu a rovnoměrně, kožní řasu stále držte (viz obrázek 11).
4. Po aplikaci injekčního roztoku jehlu vytáhněte a uvolněte kožní řasu.
5. Zmáčkněte místo vpichu kouskem gázového obinadla nebo sterilním gázovým tamponem na několik vteřin.
6. Nasaďte bezpečnostní kryt zpět na jehlu (viz obrázek 12).
7. Bezpečnostní kryt přiložte přibližně pod úhlem 45° proti povrchu (viz obrázek 13).
8. Vmáčkněte jehlu pomocí pevného a rychlého pohybu, dokud neuslyšíte cvaknutí (viz obrázek 14).
9. Ujistěte se zrakem, že je jehla plně uzamčena v bezpečnostním krytu (viz obrázek 15).
10. Každou stříkačku použijte jen jednou. Přípravek Biopoin, který ve stříkačce zbude, znovu nepoužívejte.
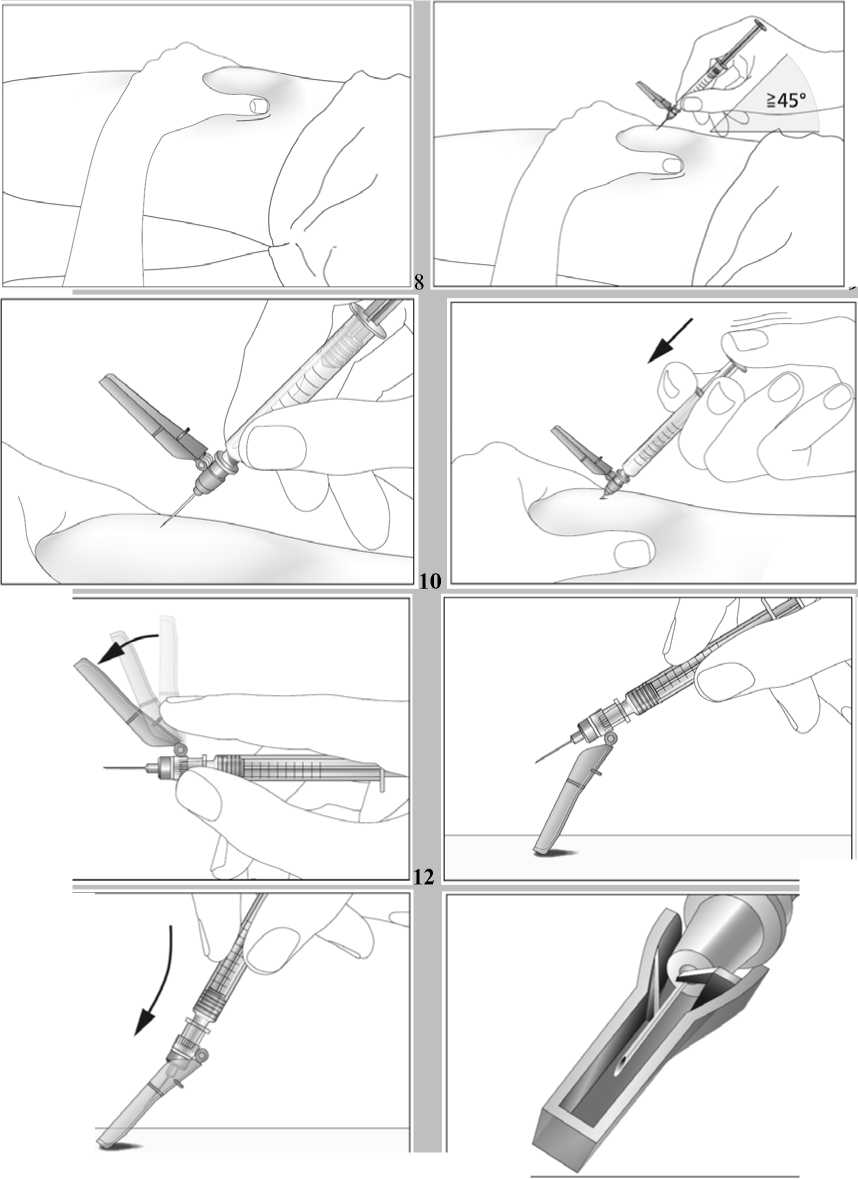
Pamatujte
Pokud budete mít jakékoliv problémy, požádejte o pomoc nebo radu svého lékaře nebo zdravotní sestru.
Likvidace použitých injekčních stříkaček
- Použité injekční stříkačky vyhoďte do odpadní nádoby odolné proti propíchnutí a tuto nádobu uchovávejte mimo dohled a dosah dětí.
- Plnou nádobu zlikvidujte podle pokynů svého lékaře, lékárníka nebo zdravotní sestry.
- Nikdy nevyhazujte použité stříkačky do běžného odpadkového koše v domácnosti.
Tato část obsahuje informace o tom, jakým způsobem si sám(sama) můžete aplikovat injekci přípravku Biopoin pod kůži. Je důležité, abyste se nesnažil(a) podat si injekci sám(sama), pokud Vás nezaškolil Váš lékař nebo zdravotní sestra. Pokud si nejste jistý(á), jak si máte injekci sám(sama) aplikovat, nebo máte jakékoli otázky, požádejte o pomoc svého lékaře nebo zdravotní sestru.
Jak se přípravek Biopoin aplikuje
Injekci je třeba aplikovat do tkáně přímo pod kůži. Tento způsob se nazývá podkožní (subkutánní) injekce.
Vybavení nezbytné pro podání injekce
K samostatné aplikaci injekce pod kůži budete potřebovat:
- předplněnou injekční stříkačku přípravku Biopoin,
- alkoholem napuštěné tampony
- kousek gázového obinadla nebo sterilní gázový tampon.
Co je třeba udělat před vlastní aplikací injekce
1. Vyjměte jeden blistr s předplněnou injekční stříkačkou z chladničky.
2. Blistr otevřete a vyndejte předplněnou injekční stříkačku a pouzdro s jehlou z blistru. Předplněnou injekční stříkačku nezdvihejte za píst ani víčko.
3. Zkontrolujte datum použitelnosti na předplněné injekční stříkačce (EXP). Přípravek nepoužívejte po uplynutí posledního dne uvedeného měsíce.
4. Zkontrolujte vzhled přípravku Biopoin. Roztok musí být čirý a bezbarvý. Pokud roztok obsahuje částečky nebo je zakalený, nepoužívejte ho.
5. Na konci krytu jehly je víčko. Na vyznačeném místě rozlomte a sejměte víčko (viz obr.1).
6. Sejměte víčko ze špičky předplněné injekční stříkačky (viz obr. 2).
7. Připojte jehlu ke stříkačce (viz obr. 3). Neodstraňujte ještě kryt jehly.
8. Pro pohodlnější aplikaci ponechte injekční stříkačku 30 minut při pokojové teplotě (maximálně do 25 °C) nebo lehce podržte stříkačku několik minut v ruce. Neohřívejte přípravek Biopoin jiným způsobem ( např. v mikrovlnné troubě nebo horké vodě).
9. Neodstraňujte kryt jehly ze stříkačky dříve, než jste připraven(a) si injekci aplikovat.
10. Najděte si pohodlné, dobře osvětlené místo. Všechny potřebné pomůcky si rozmístěte tak, abyste na ně pohodlně dosáhl(a) (předplněnou injekční stříkačku s přípravkem Biopoin, tampony napuštěné alkoholem a kousek gázového obinadla nebo sterilní gázový tampon).
11. Důkladně si umyjte ruce.
1
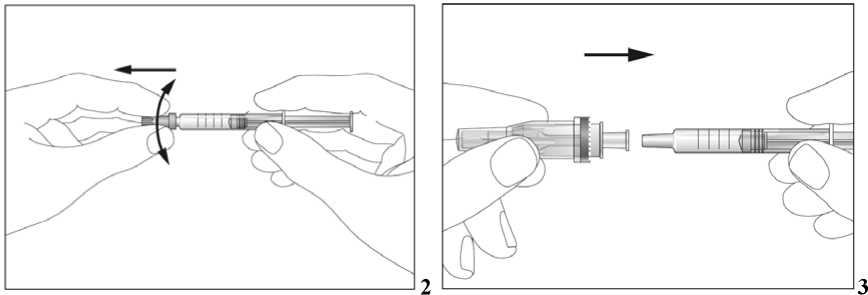
Jak se připravit na injekci
Před tím, než si sám(sama) píchnete injekci Biopoin, musíte učinit následující kroky:
1. Držte stříkačku a pomalu odstraňte kryt jehly, aniž byste s ním otáčel(a). Kryt vodorovně stáhněte, jak je znázorněno na obrázku 4. Jehla je obklopena ochranným štítem zatahování jehly. Nedotýkejte se jehly ani ochranného štítu a netlačte na píst (viz obrázek 5).
2. V předplněné injekční stříkačce mohou být malé vzduchové bubliny. Pokud jsou vzduchové bubliny přítomny, poklepejte lehce na stříkačku prsty, až se bubliny přesunou do horní části stříkačky. Injekční stříkačku namiřte směrem vzhůru a pomalým tlakem na píst vzduch vytlačte.
3. Injekční stříkačka má na válci stupnici. Posuňte píst k číslu (IU) na stříkačce, které odpovídá dávce přípravku Biopoin předepsané Vaším lékařem.
4. Znovu zkontrolujte, zda injekční stříkačka obsahuje správnou dávku přípravku Biopoin.
5. Nyní můžete předplněnou injekční stříkačku použít.
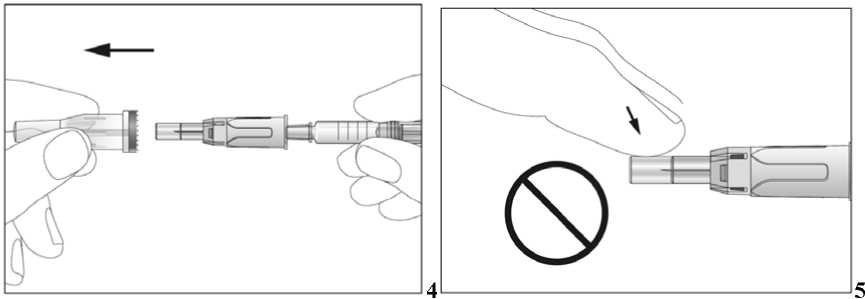
Kam injekci aplikovat
Nejvhodnější místa pro aplikaci jsou:
- horní plocha stehena
- břicho, kromě oblasti kolem pupku (viz šedé oblasti na obrázku 6).
Pokud Vám injekci aplikuje někdo jiný, může využít také zadní a boční plochu horních končetin (viz šedé oblasti na obrázku 7).
Místa aplikace je lépe každý den střídat, a tím předejít riziku bolestivosti na kterémkoli místě.
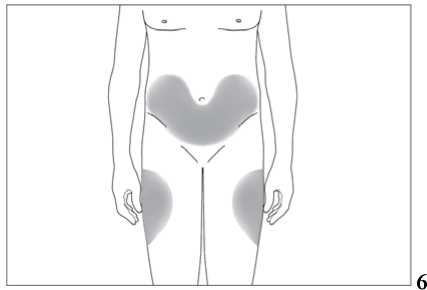
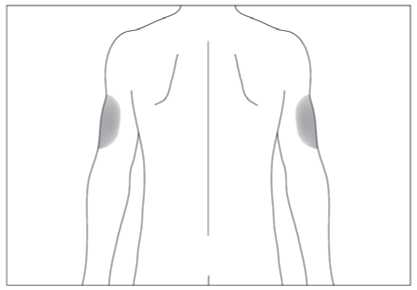
Jak injekci sám sobě aplikovat
1. Kůži v místě aplikace dezinfikujte pomocí alkoholového tamponu a mezi palec a ukazováček uchopte bez mačkání kožní řasu (viz obrázek 8).
2. Zaveďte celou jehlu se štítem bez zaváhání a jedním plynulým pohybem do kůže, tak jak Vám to předvedl Váš lékař nebo Vaše zdravotní sestra. Úhel mezi injekční stříkačkou a kůží by neměl být příliš úzký (alespoň 45°, viz obrázek 9). Štít jehly se celý zasune, když se jehla zavede do kůže (viz obrázek 10).
3. Tekutinu vystřikujte do tkáně pomalu a rovnoměrně, kožní řasu stále držte (viz obrázek 11).
4. Po aplikaci injekčního roztoku jehlu vytáhněte a uvolněte kožní řasu. Jehla bude chráněna a automaticky uzamčena, takže se nemůžete poranit (viz obrázek 12).
5. Zmáčkněte místo vpichu kouskem gázového obinadla nebo sterilním gázovým tamponem na několik vteřin.
6. Každou stříkačku použijte jen jednou. Přípravek Biopoin, který ve stříkačce zbude, znovu nepoužívejte.
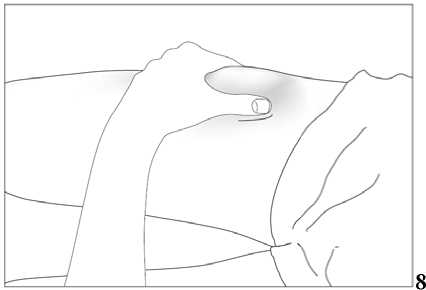
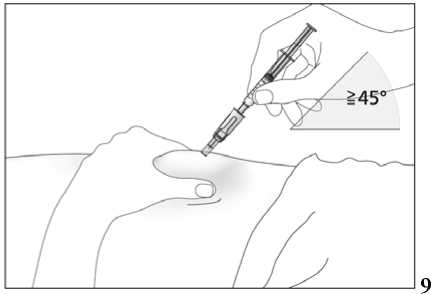
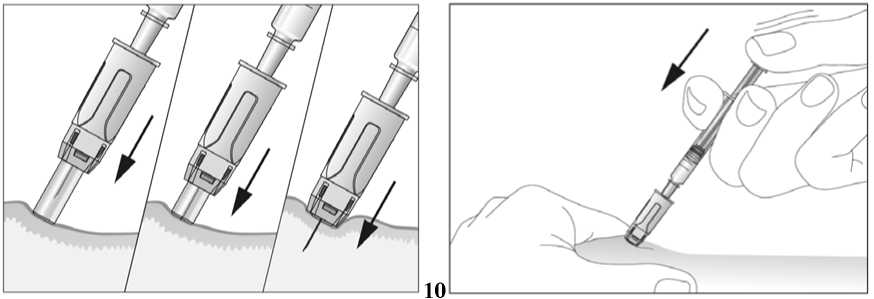
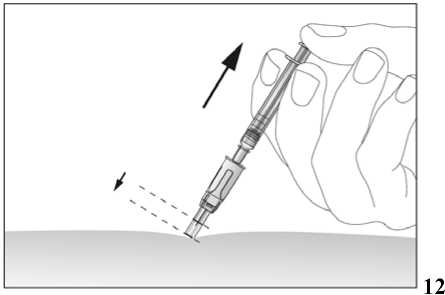
Pamatujte
Pokud budete mít jakékoliv problémy, požádejte o pomoc nebo radu svého lékaře nebo zdravotní sestru.
Likvidace použitých injekčních stříkaček
Bezpečnostní zařízení zabraňuje poranění jehlou po použití, takže žádná zvláštní bezpečnostní opatření pro likvidaci nejsou nutná. Injekční stříkačku s bezpečnostním zařízením zlikvidujte podle pokynů svého lékaře, lékárníka nebo zdravotní sestry.
66