Azopt 10 Mg/Ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
AZOPT 10 mg/ml oční kapky, suspenze
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml suspenze obsahuje brinzolamidumlO mg.
Pomocná látka se známým účinkem:
Jeden ml suspenze obsahuje 0,1 mg benzalkonium-chloridu.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Oční kapky, suspenze.
Bílá až téměř bílá suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
AZOPT je indikován ke snížení zvýšeného nitroočního tlaku při:
■ oční hypertenzi
■ glaukomu s otevřeným úhlem
jako monoterapie u dospělých pacientů, nereagujících na betablokátory, nebo u dospělých pacientů, u kterých jsou betablokátory kontraindikovány, nebo j ako přídatná terapie k betablokátorům nebo analogům prostaglandinu (viz také bod 5.1).
4.2 Dávkování a způsob podání
Dávkování
Pokud se přípravek používá pro monoterapii nebo přídatnou terapii, dávkou je jedna kapka přípravku AZOPT do spojivkového vaku postiženého oka (postižených očí) dvakrát denně. U některých pacientů se docílí lepší reakce při dávkování jedna kapka třikrát denně.
Zvláštní populace
Používání u starších pacientů
U starších pacientů není potřeba žádná úprava dávkování.
Používání při poruše funkce jater a ledvin
U pacientů s poruchou funkce jater nebyl přípravek AZOPT hodnocen, a proto se u těchto pacientů jeho použití nedoporučuje.
AZOPT nebyl hodnocen u pacientů s těžkou poruchou funkce ledvin (s clearance kreatininu nižší než 30 ml/min) nebo u pacientů s hyperchloremickou acidózou. Protože brinzolamid a jeho hlavní metabolit jsou vylučovány především ledvinami, je přípravek AZOPT u těchto pacientů kontraindikován (viz také bod 4.3).
Pediatrická populace
Bezpečnost a účinnost přípravku AZOPT u novorozenců, dětí a dospívajících ve věku 0 až 17 let nebyla stanovena. V současnosti dostupné údaje jsou popsány v bodech 4.8 a 5.1. Použití přípravku
AZOPT u novorozenců, dětí a dospívajících se nedoporučuje.
Způsob podání Oční podání.
Po nakapání se doporučuje nasolakrimální okluze nebo mírné zavření očního víčka. To může snížit systémovou absorpci léčivého přípravku podaného oční cestou a snížit tak systémové nežádoucí účinky.
Je třeba poučit pacienta, aby před použitím přípravek dobře protřepal. Pokud je po sejmutí víčka bezpečnostní kroužek uvolněný, je třeba jej před použitím léčivého přípravku odstranit.
Aby se zamezilo kontaminaci hrotu kapátka a suspenze, je třeba dbát na to, aby se hrot kapátka lahvičky nedotkl očního víčka, přilehlých oblastí nebo jiných povrchů. Vysvětlete pacientům, že mají uchovávat lahvičku pevně uzavřenou v době, kdy se přípravek nepoužívá.
V případě že má přípravek AZOPT nahradit jiný oční přípravek proti glaukomu, přeruší se podávání jiného přípravku a další den se začne podávat přípravek AZOPT.
Používá-li se více než jeden lokální oční léčivý přípravek, je třeba, aby byly jednotlivé přípravky podávány s odstupem nejméně 5 minut. Oční masti je třeba aplikovat jako poslední.
Pokud byla dávka vynechána, léčba by měla pokračovat další plánovanou dávkou. Dávka by neměla překročit jednu kapku do postiženého oka (očí) třikrát denně.
4.3 Kontraindikace
■
■
■
■
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Známá hypersenzitivita na sulfonamidy (viz také bod 4.4).
Těžké poškození ledvin.
Hyperchloremická acidóza.
4.4 Zvláštní upozornění a opatření pro použití
Systémové účinky
Přípravek AZOPT je sulfonamidový inhibitor karboanhydrázy a i když je podáván lokálně, dochází k systémové absorpci. U lokálního podání se mohou vyskytnout stejné typy nežádoucích účinků, které jsou známy u sulfonamidů. Pokud se vyskytnou známky závažných reakcí nebo hypersenzitivity, užívání tohoto přípravku přerušte.
Po perorálním podání inhibitorů karboanhydrázy byly hlášeny acidobazické poruchy. U pacientů s rizikem poruchy funkce ledvin používejte přípravek s opatrností z důvodu rizika metabolické acidózy (viz bod 4.2).
Brinzolamid nebyl hodnocen u předčasně narozených dětí (méně než 36 týdnů gestačního vývoje) a u dětí ve věku do 1 týdne. Pacienti s významnou nezralostí nebo abnormalitami ledvinových tubulů by měli dostávat brinzolamid pouze po pečlivém zvážení poměru rizika a přínosu vzhledem k možnému riziku metabolické acidózy.
Perorální inhibitory karboanhydrázy mohou zhoršit schopnost vykonávat úkony vyžadující mentální pozornost a/nebo koordinaci pohybů. AZOPT je absorbován systémově, a proto k tomu může docházet i při lokálním podání.
Souběžná terapie
U pacientů užívajících současně perorální inhibitory karboanhydrázy a AZOPT může dojít ke kumulaci známých systémových účinků inhibitorů karboanhydrázy. Současné užívání perorálních inhibitorů karboanhydrázy a přípravku AZOPT nebylo dosud hodnoceno a nedoporučuje se (viz také bod 4.5).
AZOPT byl primárně hodnocen při současném podávání timololu v průběhu adjuvantní terapie glaukomu. Dále byl hodnocen účinek přípravku AZOPT na snížení nitroočního tlaku při adjuvantní terapii s analogem prostaglandinu travoprost. Nejsou k dispozici žádné dlouhodobé údaje o použití přípravku AZOPT jako adjuvantní terapie k travoprostu (viz také bod 5.1).
S léčbou pacientů trpících pseudoexfoliativním glaukomem nebo pigmentovým glaukomem existují u přípravku AZOPT pouze omezené zkušenosti. Těmto pacientům by měla být věnována zvýšená pozornost a je doporučováno časté měření nitroočního tlaku. AZOPT nebyl hodnocen u pacientů trpících glaukomem s úzkým úhlem a jeho použití není u těchto pacientů doporučováno.
U pacientů se sníženou funkcí rohovky (především u pacientů s malým počtem endoteliálních buněk) nebyl zjišťován možný účinek brinzolamidu na endoteliální funkci rohovky. Nebyl například sledován účinek u pacientů s kontaktními čočkami, a tak se při podávání brinzolamidu doporučuje pečlivé monitorování těchto pacientů, protože inhibitory karboanhydrázy mohou ovlivnit hydrataci rohovky a nošení kontaktních čoček by mohlo zvýšit riziko poškození rohovky. Doporučuje se pečlivé monitorování pacientů s poškozením rohovky, jako jsou pacienti s cukrovkou nebo dystrofií rohovky.
O benzalkonium-chloridu, běžně používaném jako konzervační přísada do očních přípravků, bylo zjištěno, že vyvolává tečkovitou keratopatii a/nebo toxickou ulcerativní keratopatii. Protože AZOPT benzalkonium-chlorid obsahuje, je nezbytné pečlivé monitorování, pokud je často nebo dlouhodobě používán u pacientů trpících suchostí očí nebo u pacientů se sníženou funkcí rohovky.
U pacientů nosících kontaktní čočky nebyl přípravek AZOPT hodnocen. AZOPT obsahuje benzalkonium-chlorid, který může způsobit podráždění oka, a je známo, že způsobuje změnu barvy měkkých kontaktních čoček. Měkké kontaktní čočky nemají přijít s přípravkem do styku. Pacienti musí být instruováni, aby po nakapání přípravku AZOPT vyčkali alespoň 15 minut a teprve pak nasadili kontaktní čočky zpět do oka.
Případný účinek po vysazení přípravku AZOPT nebyl hodnocen; předpokládá se, že účinek na snížení nitroočního tlaku přetrvává po dobu 5-7 dnů.
Pediatrická populace
Bezpečnost a účinnost přípravku AZOPT u novorozenců, dětí a dospívajících ve věku 0 až 17 let nebyla stanovena, a proto se jeho použití u novorozenců, dětí a dospívajících nedoporučuje.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné specifické studie interakcí přípravku AZOPT s jinými léčivými přípravky.
V klinických studiích byl přípravek AZOPT používán současně s analogy prostaglandinu a s očními přípravky obsahujícími timolol, aniž by byly zaznamenány nežádoucí účinky. V průběhu adjuvantní terapie glaukomu nebyla hodnocena spojitost mezi přípravkem AZOPT a miotiky nebo adrenergními agonisty.
AZOPT je inhibitor karboanhydrázy a ačkoliv je podáván lokálně, je absorbován systémově. V souvislosti s perorálními inhibitory karboanhydrázy byly hlášeny poruchy acidobazické rovnováhy. U pacientů používajících přípravek AZOPT musí být zvážen potenciál k možným interakcím.
Izoenzymy cytochromu P-450, odpovědné za metabolismus brinzolamidu, jsou CYP3A4 (hlavní), CYP2A6, CYP2C8 a CYP2C9. Předpokládá se, že inhibitory CYP3A4, jako jsou ketokonazol, itrakonazol, klotrimazol, ritonavir a troleandomycin, budou metabolismus brinzolamidu prostřednictvím CYP3A4 inhibovat. Pokud jsou inhibitory CYP3A4 podávány současně s přípravkem, doporučuje se opatrnost. Kumulace brinzolamidu je však nepravděpodobná, protože vylučování probíhá především ledvinami. Brinzolamid není inhibitorem izoenzymů cytochromu P-450.
Údaje o očním podání brinzolamidu těhotným ženám jsou omezené nebo nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu po systémovém podání (viz také bod 5.3).
Podávání přípravku AZOPT se v těhotenství a u žen v reprodukčním věku, které nepoužívají antikoncepci, nedoporučuje.
Kojení
Není známo, zda se brinzolamid/metabolity vylučují do lidského mateřského mléka po lokálním očním podání. Studie na zvířatech prokázaly vylučování minimálního množství brinzolamidu do mateřského mléka po perorálním podání.
Riziko pro kojené novorozence/děti nelze vyloučit. Na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku je nutno rozhodnout, zda přerušit kojení nebo ukončit/přerušit podávání přípravku AZOPT
Fertilita
Studie brinzolamidu na zvířatech neprokázaly žádný účinek na fertilitu. Nebyly provedeny studie hodnotící účinek brinzolamidu při lokálním očním podání na fertilitu u člověka.
4.7 Účinky na schopnost řídit a obsluhovat stroje
AZOPT má malý vliv na schopnost řídit nebo obsluhovat stroje.
Přechodně rozmazané vidění nebo jiné poruchy vidění mohou ovlivnit schopnost řídit nebo obsluhovat stroje (viz také bod 4.8). Pokud dojde po vkapání přípravku k rozmazanému vidění, musí pacient počkat s řízením nebo používáním strojů, dokud se vidění neprojasní.
Perorální inhibitory karboanhydrázy mohou zhoršit schopnost vykonávat úkony vyžadující mentální pozornost a/nebo koordinaci pohybů (viz také body 4.4 a 4.8).
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
V klinických studiích, které zahrnovaly 2732 pacientů léčených přípravkem AZOPT, jako monoterapie nebo jako adjuvantní terapie k maleinátu timololu 5 mg/ml, byly nejčastěji hlášenými nežádoucími účinky spojenými s léčbou: dysgeuzie (6,0 %) (hořká nebo neobvyklá chuť, viz popis níže) a přechodně rozmazané vidění (5,4 %) po nakapání, trvající od několika sekund až po několik minut (viz také bod 4.7).
Tabulkový přehled nežádoucích účinků
Následující nežádoucí účinky byly hlášeny při použití brinzolamidu 10 mg/l ve formě očních kapek, suspenze a byly roztříděny do skupin podle následujících pravidel: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (>1/10 000 až <1/1000), velmi vzácné (<1/10 000) nebo není známo (z dostupných údajů nelze určit). V každé skupině četnosti jsou nežádoucí účinky seřazeny podle klesající závažnosti. Nežádoucí účinky byly získány z klinických studií a ze spontánních hlášení po uvedení přípravku na trh.
|
Třídy orgánových systémů |
Preferované termíny MedDRA (v. 15.1) |
|
Infekce a infestace |
Méně časté: nazofaryngitida, farvngitida, sinusitida Není známo: rinitida |
|
Poruchy krve a lymfatického systému |
Méně časté: snížení počtu ervtrocytů, zvýšení koncentrace chloridů v krvi |
|
Poruchy imunitního systému |
Není známo: hypersenzitivita |
|
Poruchy metabolismu a výživy |
Není známo: snížení chuti k jídlu |
|
Psychiatrické poruchy |
Méně časté: apatie, deprese, depresivní nálada, snížení libida, noční můry, nervozita Vzácné: insomnie |
|
Poruchy nervového systému |
Méně časté: motorická dysfunkce, amnézie, závrať, parestezie, bolest hlavy Vzácné: porucha paměti, somnolence Není známo: třes, hypestezie, ageuzie |
|
Poruchy oka |
Časté: rozmazané vidění, podráždění oka, bolest oka, pocit cizího tělíska v oku, oční hyperemie Méně časté: eroze rohovky, keratitida, keratitis punctata, keratopatie, depozita v oku, skvrny na rohovce, defekt epitelu rohovky, onemocnění rohovkového epitelu, blefaritida, svědění oka, konjunktivitida, otok oka, meibomianitida, oslnění, fotofobie, suché oči, alergická konjunktivitida, pterygium, pigmentace skléry, astenopie, oční diskomfort, abnormální pocit v oku, keratoconjunctivitis sicca, subkonjunktivální cysta, hyperemie spojivky, svědění očních víček, výtok z oka, tvorba krust na okrajích víček, nadměrné slzení Vzácné: edém rohovky, diplopie, snížení zrakové ostrosti, fotopsie, hypestezie oka, periorbitální edém, zvýšení nitroočního tlaku, zvýšení poměru pohárku/terče zrakového nervu Není známo: onemocnění rohovky, porucha vidění, oční alergie, madaróza, onemocnění očního víčka, erytém očního víčka |
|
Poruchy ucha a labyrintu |
Vzácné: tinitus Není známo: vertigo |
|
Srdeční poruchy |
Méně časté: kardiorespirační tíseň, bradykardie, palpitace Vzácné: anaina pectoris, nepravidelnost srdečního rvtmu Není známo: arytmie, tachykardie, hypertenze, zvýšení krevního tlaku, snížení krevního tlaku, zrychlení srdeční frekvence |
|
Respirační, hrudní a mediastinální poruchy |
Méně časté: dyspnoe, epistaxe, orofaryngeální bolest, faryngolaryngeální bolest, podráždění v krku, syndrom kašle z horních cest dýchacích, rinorea, kýchání Vzácné: bronchiální hyperaktivita, překrvení horních cest dýchacích, překrvení sliznice vedlejších nosních dutin, nazální překrvení, kašel, sucho v nose Není známo: astma |
|
Gastrointestinální poruchy |
Časté: dysaeuzie Méně časté: ezofagitida, diarea, nauzea, zvracení, dyspepsie, bolest v horní části břicha, břišní diskomfort, žaludeční diskofort, nadýmání, časté vyprazdňování střev, gastrointestinální porucha, orální hypestezie, orální parestezie, sucho v ústech |
|
Poruchy jater a žlučových cest |
Není známo: abnormální testy funkce jater |
|
Poruchy kůže a podkožní tkáně |
Méně časté: vyrážka, makulopapulózní vyrážka, napnutí kůže Vzácné: kopřivka, alopecie, svědění celého těla Není známo: dermatitida, erytém |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Méně časté: bolest zad, svalové spasmy, myalgie Není známo: artralgie, bolest končetiny |
|
Poruchy ledvin a močových cest |
Méně časté: bolest ledvin Není známo: polakisurie |
|
Poruchy reprodukčního systému a prsu |
Méně časté: dysfunkce erekce |
|
Celkové poruchy a reakce v místě |
Méně časté: bolest, diskomfort na hrudi, únava, neobvyklý |
|
aplikace |
pocit Vzácné: bolest na hrudi, pocit nervozity, astenie, podrážděnost Není známo: periferní edém, malátnost |
|
Poranění, otravy a procedurální komplikace |
Méně časté: cizí tělísko v oku |
Popis vybraných nežádoucích účinků
Dysgeuzie (hořká nebo neobvyklá chuť v ústech po nakapání) byla nejčastěji hlášeným systémovým nežádoucím účinkem spojeným s použitím přípravku AZOPT v průběhu klinických studií. Je pravděpodobně vyvolána průnikem očních kapek do nosohltanu slznými kanálky. Snížení výskytu tohoto účinku může pomoci nasolakrimální okluze nebo lehké zavření víčka po vkápnutí (viz také bod 4.2).
AZOPT je sulfonamidový inhibitor karboanhydrázy se systémovou absorpcí. Účinky na zažívací ústrojí, nervový systém, hematologické účinky, účinky na ledviny a metabolické účinky jsou obecně spojeny se systémovými inhibitory karboanhydrázy. Stejný typ nežádoucích účinků, které lze připsat perorálním inhibitorům karboanhydrázy, se mohou vyskytnout i při lokálním podání.
Při použití přípravku AZOPT jako adjuvantní terapie k travoprostu nebyly hlášeny žádné neočekávané nežádoucí účinky. Nežádoucí účinky zjištěné při adjuvantní terapii byly pozorovány u každé léčivé látky podávané samostatně.
Pediatrická populace
V malých krátkodobých klinických studiích bylo zjištěno, že u zhruba 12,5 % pediatrických pacientů došlo k nežádoucím účinkům, přičemž u většiny z nich se jednalo o lokální nezávažné účinky na oko, jako jsou hyperemie spojivky, podráždění oka, výtok z oka a nadměrné slzení (viz také bod 5.1).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Nebyl hlášen žádný případ předávkování.
Léčba by měla být symptomatická a podpůrná. Může dojít k nerovnováze elektrolytů, rozvoji acidózního stavu a možným účinkům na nervový systém. Je třeba monitorovat hladiny sérových elektrolytů (především draslíku) a hodnoty pH krve.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antiglaukomatika a miotika, inhibitory karboanhydrázy, ATC kód: S01EC04.
Mechanismus účinku
Karboanhydráza (CA) je enzym, nacházející se v mnoha tělesných tkáních včetně oka. Karboanhydráza katalyzuje reverzibilní reakci zahrnující hydrataci oxidu uhličitého a dehydrataci kyseliny uhličité.
Inhibice karboanhydrázy v ciliárních procesech oka snižuje sekreci komorové vody, pravděpodobně tím, že zpomaluje tvorbu hydrogenuhličitanových iontů s následnou redukcí transportu sodíku a tekutin. Výsledkem je snížení nitroočního tlaku (IOP), který je hlavním rizikovým faktorem patogeneze poškození optického nervu a glaukomatózní ztráty vizuálního pole. Brinzolamid je inhibitor karboanhydrázy II (CA-II), převládajícího izoenzymu v oku, s in vitro IC50 3,2 nM a K 0,13 nM proti CA-II.
Klinická účinnost a bezpečnost
Byl hodnocen účinek přípravku AZOPT na snížení nitroočního tlaku při adjuvantní terapii s analogem prostaglandinu, travoprostem. Po 4 týdnech léčby s travoprostem byli pacienti s nitroočním tlakem NOT > 19 mmHg randomizováni do skupin s přidanou léčbou brinzolamidem nebo timololem. Bylo pozorováno další snížení průměrné hodnoty denního nitroočního tlaku o 3,2 až 3,4 mmHg pro brinzolamidovou skupinu a 3,2 až 4,2 mmHg pro timololovou skupinu. Došlo k obecně většímu výskytu nezávazných nežádoucích účinků na oko, hlavně spojených s příznaky lokálního podráždění, ve skupinách brinzolamid/travoprost. Nežádoucí účinky byly mírné a neměly vliv na celkovou četnost předčasného ukončení léčby ve studiích (viz také bod 4.8).
S přípravkem AZOPT byla provedena klinická studie na 32 pediatrických pacientech ve věku méně než 6 let, s diagnostikovaným glaukomem nebo oční hypertenzí. Někteří pacienti byli do té doby bez terapie na snížení nitroočního tlaku, zatímco jiní užívali jiný léčivý přípravek (přípravky) snižující nitrooční tlak. U pacientů, kteří již užívali léčivé přípravky na snížení tlaku, nebylo požadováno, aby přerušili podávání léčivých přípravků snižujících nitrooční tlak až do počátku monoterapie přípravkem AZOPT.
Mezi pacienty, kteří do té doby nepoužívali léky snižující nitrooční tlak (10 pacientů), byla účinnost přípravku AZOPT podobná účinnosti pozorované předtím u dospělých, s průměrným snížením nitroočního tlaku oproti počáteční hodnotě až do 5 mmHg. U pacientů, kteří užívali lokální léčivé přípravky na snížení nitroočního tlaku (22 pacientů), se průměrný nitrooční tlak u skupiny užívající AZOPT oproti počátečnímu stavu mírně zvýšil.
5.2 Farmakokinetické vlastnosti
Po lokálním podání do oka se brinzolamid absorbuje do systémového oběhu. Vzhledem k vysoké afinitě k CA-II se brinzolamid distribuuje rozsáhle do červených krvinek a vykazuje v plné krvi dlouhý poločas (průměr přibližně 24 týdnů). U lidí se vytváří metabolit N-desetyl-brinzolamid, který se také váže na CA a akumuluje se v červených krvinkách. V přítomnosti brinzolamidu se tento metabolit váže hlavně na CA-I. V plazmě jsou koncentrace brinzolamidu i N-desetyl-brinzolamidu nízké a obecně pod kvantitativní hranicí pro jejich stanovení (< 7,5 ng/ml).
Vazba na plazmatické bílkoviny není rozsáhlá (zhruba 60 %). Brinzolamid se vylučuje především renální exkrecí (přibližně z 60 %). Kolem 20 % dávky se nachází v moči ve formě metabolitu. Brinzolamid a N-desetyl-brinzolamid jsou převládajícími složkami v moči spolu se stopovými hladinami (< 1 %) N-desmetoxypropyl a O-desmetyl-metabolitů.
Ve farmakokinetické studii s perorálním podáním obdrželi zdraví dobrovolníci jednomiligramové tobolky brinzolamidu dvakrát denně po dobu až 32 týdnů a byla měřena aktivita CA v červených krvinkách, aby se stanovila míra systémové inhibice CA.
Nasycení CA-II v červených krvinkách brinzolamidem se dosáhlo do čtyř týdnů (koncentrace v červených krvinkách přibližně 20 ^M). N-desetyl-brinzolamid se akumuloval v červených krvinkách do ustáleného stavu během 20-28 týdnů a dosáhl koncentrací 6-30 ^M. Inhibice celkové aktivity CA v červených krvinkách činila v ustáleném stavu zhruba 70-75 %.
Subjektům se středním poškozením ledvin (s clearance kreatininu 30-60 ml/min) byl podáván 1 mg brinzolamidu dvakrát denně perorálně po dobu až 54 týdnů. Koncentrace brinzolamidu v červených krvinkách pak byla ve čtvrtém týdnu léčby v rozmezí 20 až 40 ^M. V ustáleném stavu byly koncentrace brinzolamidu a jeho metabolitu v červených krvinkách od 22,0 do 46,1, resp. 17,1 až 88,6 |aM.
Koncentrace N-desetyl-brinzolamidu v červených krvinkách se zvýšila a celková aktivita CA
v červených krvinkách se snížila s poklesem clearance kreatininu, koncentrace brinzolamidu v červených krvinkách a aktivita CA-II však zůstaly nezměněny. U subjektů s nejvyšším stupněm poškození ledvin byla inhibice celkové aktivity CA vyšší, ačkoliv byla nižší než 90 % aktivity v ustáleném stavu.
Ve studii s lokálním podáním do oka byly v ustáleném stavu koncentrace brinzolamidu v červených krvinkách podobné koncentracím zjištěným ve studii s perorálním podáním, hladiny N-desetyl-brinzolamidu však byly nižší. Aktivita karboanhydrázy činila zhruba 40-70 % hladiny před podáním dávky.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu neodhalily žádné zvláštní riziko pro člověka.
Studie vývojové toxicity u králíků s perorálními dávkami brinzolamidu až 6 mg/kg/den (125krát převyšujícími doporučenou dávku pro člověka při podání do oka) neodhalily žádný účinek na vývoj plodu navzdory významné toxicitě pro matku. Podobné studie na potkanech vedly k lehce snížené osifikaci lebky a sternebrae plodů samic, které dostávaly brinzolamid v dávkách 18 mg/kg/den (375krát více než doporučená dávka pro člověka při podání do oka), ne však při dávkách 6 mg/kg/den. Tyto výsledky se objevily při dávkách, vyvolávajících metabolickou acidózu se snížením přírůstků hmotnosti u samic a snížením hmotnosti plodu. Snížení hmotnosti plodu související s dávkou bylo pozorováno u březích samic, které dostávaly brinzolamid perorálně, přičemž toto snížení se pohybovalo od malého (zhruba 5-6 %) při dávkách 2 mg/kg/den až ke zhruba 14% při dávkách 18 mg/kg/den. Během laktace se nevyskytl žádný nežádoucí účinek u potomků při dávkách 5 mg/kg/den.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Benzalkonium-chlorid Mannitol (E421)
Karbomer 974P Tyloxapol
Dihydrát dinatrium-edetátu Chlorid sodný
Kyselina chlorovodíková / hydroxid sodný (k úpravě pH)
Čištěná voda
6.2 Inkompability
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
4 týdny po prvním otevření.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
5ml a 10ml neprůhledné LDPE kapací lahvičky s PP šroubovacím uzávěrem (,,droptainer“).
K dispozici jsou následující velikosti balení: krabička obsahující 1 x 5ml, 3 x 5 ml, 1 x 10 ml. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Alcon Laboratories (UK) Ltd.
Frimley Business Park Frimley Camberley Surrey GU16 7SR Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/00/129/001-3
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 9. března 2000
Datum posledního prodloužení registrace: 9. března 2005
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE ODPOVĚDNÝ /VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ /VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
S.A. Alcon-Couvreur N.V.
Rijksweg 14 B-2870, Puurs Belgie
nebo
Alcon Cusí, SA Camil Fabra 58 08320 El Masnou (Barcelona)
Španělsko
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
KRABIČKA NA 1 LAHVIČKU, 5 ml, 10 ml + KRABIČKA NA 3 x 5ml LAHVIČKY
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
AZOPT 10 mg/ml oční kapky, suspenze Brinzolamidum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden ml suspenze obsahuje brinzolamidum 10 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Obsahuje benzalkonium-chlorid, mannitol (E421), karbomer 974P, tyloxapol, dihydrát dinatrium-edetátu, chlorid sodný, kyselinu chlorovodíkovou / hydroxid sodný (pro úpravu pH) a čištěnou vodu. Další informace viz příbalová informace.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Oční kapky, suspenze; 5 ml 10 ml 3 x 5 ml
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Oční podání.
Před použitím si přečtěte příbalovou informaci. Před použitím dobře protřepat.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP:
Zlikvidujte čtyři týdny po prvním otevření. Otevřeno:
Otevřeno (1):
Otevřeno (2):
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Alcon Laboratories (UK) Ltd.
Frimley Business Park
Frimley
Camberley
Surrey GU16 7SR
Velká Británie
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
|
EU/1/00/129/001 |
1 x 5 ml |
|
EU/1/00/129/002 |
1 x 10 ml |
|
EU/1/00/129/003 |
3 x 5 ml |
13. ČÍSLO ŠARŽE
Lot:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
azopt
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK NA LAHVIČCE, 5 ml A 10 ml_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
AZOPT 10 mg/ml oční kapky, suspenze
Brinzolamidum
Oční podání.
2. ZPŮSOB PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Zlikvidujte čtyři týdny po prvním otevření. Otevřeno:
3. POUŽITELNOST
EXP:
4. ČÍSLO ŠARŽE
Lot:
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
5 ml 10 ml
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
AZOPT 10 mg/ml oční kapky, suspenze
Brinzolamidum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoliv z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je AZOPT a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete AZOPT používat
3. Jak se přípravek AZOPT používá
4. Možné nežádoucí účinky
5. Jak přípravek AZOPT uchovávat
6. Obsah balení a další informace
1. Co je AZOPT a k čemu se používá
AZOPT obsahuje brinzolamid, který patří do skupiny léčivých látek nazývaných inhibitory karboanhydrázy. Tyto látky snižují nitrooční tlak.
Oční kapky AZOPT se používají k léčbě vysokého tlaku v oku. Tento tlak může vést až k onemocnění, kterému se říká glaukom neboli zelený zákal.
Je-li tlak v oku příliš vysoký, mohlo by dojít k poškození Vašeho zraku.
2. Čemu musíte věnovat pozornost, než začnete AZOPT používat
Nepoužívejte AZOPT
• jestliže máte vážné potíže s ledvinami.
• jestliže jste alergický(á) na kteroukoli složku přípravku AZOPT. Úplný seznam pomocných látek viz bod 6.
• jestliže jste alergický(á) na léky, které se nazývají sulfonamidy. Například jsou to léky k léčbě cukrovky a infekcí, dále diuretika (tablety na odvodnění). AZOPT může vyvolat stejnou alergii.
• jestliže máte nadměrně kyselou krev (onemocnění zvané hyperchloremická acidóza).
Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
Upozornění a opatření
Před použitím přípravku AZOPT se poraďte se svým lékařem nebo lékárníkem:
• pokud máte potíže s ledvinami nebo játry.
• pokud máte problémy se suchostí očí nebo rohovky.
• pokud užíváte jiné sulfonamidy.
Děti a dospívající
AZOPT by neměli používat kojenci, děti a dospívající mladší 18 let, pokud lékař nedoporučí jinak.
Další léčivé přípravky a AZOPT
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste v nedávné době užíval(a) nebo které možná budete užívat, a to i o lécích, které jsou dostupné bez lékařského podpisu.
Používáte-li ještě jiný inhibitor karboanhydrázy (acetazolamid nebo dorzolamid, viz bod 1 Co je AZOPT a k čemu se používá), poraďte se se svým lékařem.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek používat.
Ženám, které by mohly otěhotnět, se doporučuje používat v průběhu léčby přípravkem AZOPT účinnou antikoncepci. Použití přípravku AZOPT během těhotenství nebo kojení se nedoporučuje. Nepoužívejte přípravek AZOPT, pokud Vám to nenařídil lékař.
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
Řízení dopravních prostředků a obsluha strojů
Neřiďte ani neobsluhujte žádné stroje, dokud se Vaše vidění neprojasní. Po použití přípravku AZOPT můžete zjistit, že je Vaše vidění rozmazané.
Přípravek AZOPT může zhoršit schopnost vykonávat úkony vyžadující mentální pozornost a/nebo koordinaci pohybů. Pokud na Vás přípravek takto působí, buďte při řízení a obsluhování strojů opatrní.
AZOPT obsahuje benzalkonium-chlorid
Přípravek AZOPT obsahuje konzervační látku (benzalkonium-chlorid), která může způsobit podráždění oka a je známo, že měkké kontaktní čočky zbarvuje. Kontaktu přípravku s měkkými kontaktními čočkami je třeba se vyhnout. Pokud nosíte kontaktní čočky, vyjměte je před aplikací přípravku AZOPT a s opětným nasazením čoček vyčkejte po aplikaci kapek nejméně 15 minut.
3. Jak se AZOPT používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře nebo lékárníka. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Používejte AZOPT pouze k nakapání do očí. Nepolykejte jej ani nepodávejte injekcí.
Doporučená dávka přípravku je 1 kapka do postiženého oka nebo očí dvakrát denně - ráno a večer. Toto dávkování dodržujte, pokud Vám lékař neřekne, že máte postupovat jinak. Do obou očí kapejte přípravek AZOPT, pouze když to lékař výslovně uvedl. Kapky používejte tak dlouho, jak Vám lékař řekl.
Jak se AZOPT používá
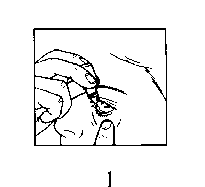
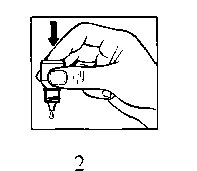

3
• Vezměte lahvičku s přípravkem AZOPT a zrcátko.
• Umyjte si ruce.
• Protřepejte lahvičku a odšroubujte uzávěr. Pokud je po sejmutí víčka bezpečnostní kroužek
uvolněný, před použitím přípravku jej odstraňte.
• Lahvičku držte směrem dolů mezi palcem a prostředníčkem.
• Zakloňte hlavu dozadu. Čistým prstem si stáhněte víčko dolů tak, by se mezi očním víčkem a okem vytvořila „kapsa“. Tam se umístí kapka (viz obr. 1).
• Hrot lahvičky dejte těsně k oku. Můžete si pomoci zrcátkem.
• Kapátkem se nedotýkejte oka nebo očního víčka, okolních tkání nebo jiných povrchů. Oční kapky by se tím mohly infikovat.
• Lehce zatlačte na dno lahvičky tak, aby se uvolnila jedna kapka přípravku AZOPT.
• Lahvičku nestlačujte; je vyrobena tak, aby k uvolnění kapky stačil lehký tlak na dno (obrázek 2).
• Po použití přípravku AZOPT stiskněte prstem koutek oka u nosu (obrázek 3) po dobu alespoň 1 minuty. To pomůže, aby se přípravek AZOPT nedostal do jiných částí těla.
• Pokud máte kapat do obou očí, pokračujte stejným způsobem u druhého oka.
• Ihned po použití nasaďte pevně zpět uzávěr.
• Nejdříve doužívejte jedno balení, než otevřete další.
Jestliže se Vám nepodaří kapku umístit do oka, celý úkon opakujte.
Používáte-li ještě jiné oční kapky, ponechte mezi aplikací jednotlivých přípravků interval alespoň 5 minut. Oční masti je třeba aplikovat jako poslední.
Jestliže jste použil(a) více přípravku AZOPT, než jste měl(a)
Jestliže se Vám do oka dostalo příliš velké množství přípravku, vypláchněte jej teplou vodou. Další kapky již do oka nekapejte a počkejte do okamžiku, kdy máte brát další pravidelnou dávku.
Jestliže jste zapomněl(a) použít přípravek AZOPT
Kápněte si jednu kapku, jakmile si vzpomenete, a pak se vraťte ke svému pravidelnému schématu. Nezdvojnásobujte následující dávku, abyste nahradila(a) vynechanou dávku.
Jestliže jste přestal(a) používat přípravek AZOPT
Jestliže jste přestal(a) používat přípravek AZOPT bez doporučení lékaře, tlak ve Vašem oku nebude kontrolován, což může vést ke ztrátě vidění.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí
vyskytnout u každého.
U přípravku AZOPT byly pozorovány následující nežádoucí účinky.
Časté nežádoucí účinky
(mohou se objevit až u 1 z 10 osob)
- Účinky na oko: rozmazané vidění, podráždění oka, bolest oka, výtok z oka, svědění oka, suché oko, neobvyklý pocit v oku, červené oči.
- Celkové nežádoucí účinky: špatná chuť.
Méně časté nežádoucí účinky
(mohou se objevit až u 1 ze 100 osob)
- Účinky na oko: citlivost na světlo, zanícení nebo infekce spojivky, otok oka, svědění, zčervenání nebo otok očního víčka, nerovnosti na povrchu oka, zvýšená pigmentace oka, únava očí, tvorba krust na okraji očních víček, zvýšená tvorba slz.
- Celkové nežádoucí účinky: snížená nebo omezená srdeční činnost, bušení srdce, zpomalení srdečního rytmu, obtíže s dýcháním, dušnost, kašel, snížení počtu červených krvinek v krvi, zvýšení iontů chloru v krvi, závrať, ospalost, obtíže s pamětí, deprese, nervozita, celková slabost, únava, neobvyklý pocit, bolest, třesení, snížení sexuální touhy, sexuální obtíže u mužů, příznaky nachlazení, překrvení v oblasti hrudníku, zánět vedlejších nosních dutin, podráždění krku, bolest krku, neobvyklá nebo snížená citlivost v ústech, zánět sliznice jícnu, bolest břicha, pocit na zvracení, zvracení, podráždění žaludku, časté vyprazdňování střev, průjem, plynatost, zažívací obtíže, bolest ledvin, bolest svalů, svalové křeče, bolest zad, krvácení z nosu, příznaky rýmy, ucpaný nos, kýchání, vyrážka, neobvyklý pocit na kůži, svědění, bolest hlavy, sucho v ústech.
Vzácné nežádoucí účinky
(mohou se objevit až u 1 z 1000 osob)
- Účinky na oko: otok rohovky, zdvojené nebo snížené vidění, abnormální vidění, snížení citlivosti očí, otok okolí oka, zvýšený tlak v oku, poškození zrakového nervu.
- Celkové nežádoucí účinky: poruchy paměti, ospalost, bolest na hrudi, překrvení horních cest dýchacích, překrvení sliznice vedlejších nosních dutin, překrvení nosní sliznice, sucho v nose, ušní šelest, ztráta vlasů, svědění po celém těle, pocit nervozity, podrážděnost, nepravidelný srdeční rytmus, tělesná slabost, obtíže se spánkem.
Není známo (z dostupných údajů nelze určit):
- Účinky na oko: abnormality očního víčka, poruchy zraku, poškození rohovky, oční alergie, snížený růst nebo počet očních řas.
- Celkové nežádoucí účinky: zvýšené příznaky alergie, snížená citlivost, třes, ztráta nebo snížení chuťového vnímání, snížený krevní tlak, zvýšený krevní tlak, zrychlení srdečního rytmu, bolest kloubů, astma, bolest končetin, zarudnutí, zánět nebo svědění kůže, abnormální jaterní testy z krve, otok končetin, časté močení, snížená chuť k jídlu.
Pokud se kterýkoliv nežádoucí účinek vyskytne v závažné míře, oznamte to prosím svému lékaři nebo lékárníkovi.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek AZOPT uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívej te tento přípravek po uplynutí doby použitelnosti uvedené na lahvičce a krabičce za „EXP“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Po čtyřech týdnech od prvního otevření lahvičky musíte lahvičku vyhodit, abyste tak předešel (předešla) infekci. Zapište si proto do níže uvedené kolonky pro každou lahvičku datum, kdy jste lahvičku otevřel(a), a totéž zapište i do kolonky na štítku lahvičky a na krabičce. Pro balení obsahující pouze jedinou lahvičku napište pouze jedno datum.
Otevřeno (1):
Otevřeno (2):
Otevřeno (3):
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co AZOPT obsahuje
- Léčivou látkou je brinzolamidum. Jeden mililitr obsahuje brinzolamidum 10 mg.
- Dalšími složkami jsou: benzalkonium-chlorid, karbomer 974P, dihydrát dinatrium-edetátu , mannitol (E421), čištěná voda, chlorid sodný, tyloxapol. Přidávají se malá množství kyseliny chlorovodíkové nebo hydroxidu sodného pro udržení hladiny kyselosti (pH) na normální hodnotě.
Jak přípravek AZOPT vypadá a co obsahuje toto balení
AZOPT je mléčná tekutina (suspenze) dodávaná v balení obsahující 5ml nebo 10ml plastovou kapací lahvičku („droptainer“) se šroubovacím uzávěrem nebo v balení obsahující tři 5ml plastové kapací lahvičky („droptainer“) se šroubovacím uzávěrem. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Alcon Laboratories (UK) Ltd.
Frimley Business Park
Frimley
Camberley
Surrey GU16 7SR
Velká Británie
Výrobce
S.A. Alcon - Couvreur N.V. Rijksweg 14 B-2870 Puurs Belgie
Výrobce
Alcon Cusí, S.A. Camil Fabra 58 08320 El Masnou Španělsko
|
Belgie/Belgique/Belgien Luxembourg/Luxemburg Alcon NV @ + 32 (0)2 754 32 10 (Belgie/Belgique/Belgien) |
Latvija Alcon Pharmaceuticals Ltd ® + 371 67 321 121 |
|
Btarapna Ahkoh Etarapua EOOfl ® + 359 2 950 15 65 |
Lietuva Alcon Pharmaceuticals Ltd atstovybé ® + 370 5 2 314 756 |
|
Česká republika Alcon Pharmaceuticals (Czech Republic) s.r.o. ® + 420 225 775 111 |
Magyarország Alcon Hungária Gyógyszerkereskedelmi Kft ® + 36-1-463-9080 |
|
Danmark Alcon Nordic A/S ® + 45 3636 4300 |
Nederland Alcon Nederland BV ® + 31 (0) 183 654321 |
|
Deutschland Alcon Pharma GmbH ® + 49 (0)761 1304-0 |
Norge Alcon Nordic A/S ® + 45 3636 4300 |
|
EXXába Kúnpoq A^kov Aagnopáxopig EXkáq AEBE ® + 30 210 68 78 300 (EMá5a) |
Osterreich Alcon Ophthalmika GmbH ® + 43 (0)1 596 69 70 |
|
Eesti Alcon Pharmaceuticals Ltd. Eesti filiaal ® + 372 6 313 214 |
Polska Alcon Polska Sp. z o.o. ® + 48 22 820 3450 |
|
Espaňa Alcon Cusí, S.A. ® + 34 93 497 7000 |
Portugal Alcon Portugal -Produtos e Equipamentos Oftalmológicos, Lda. ® + 351 214 400 300 |
|
France Laboratoires Alcon ® + 33 (0)1 47 10 47 10 |
Románia S.C. Alcon Romania S.R.L. ® + 40 21 203 93 24 |
|
Hrvatska Alcon Farmaceutika d.o.o. ® + 385 1 4611 988 |
Slovenija Alcon d.o.o. ® + 386 1 422 5280 |
|
Ireland Malta United Kingdom Alcon Laboratories (UK) Ltd ® + 44 (0) 871 376 1402 (United Kingdom) |
Slovenská republika Novartis Slovakia s.r.o. Alcon Division ® + 421 2 5441 0378 |
Island
Suomi/Finland
Alcon Nordic A/S ® + 45 3636 4300
Sverige
Alcon Nordic A/S ® + 45 3636 4300
Alcon Nordic A/S ® + 45 3636 4300
Italia
Alcon Italia S.p.A. ® + 39 02 81 80 31
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
25