Arnette 0,15 Mg/0,03 Mg
Sp.zn.sukls108296/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Amette 0,15 mg/ 0,03 mg tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tableta obsahuje desogestrelum 0,15 mg a ethinylestradiolum 0,03 mg.
Pomocné látky se známým účinkem: 1 nepotahovaná tableta obsahuje 58 mg laktózy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA Tableta
Každá tableta je kulatá, bílá až téměř bílá nepotahovaná bikonvexní, průměr 5 mm, na jedné straně vyraženo “142”, druhá strana hladká.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Perorální antikoncepce
Rozhodnutí předepsat přípravek Arnette 0,15 mg/ 0,03 mg by mělo být provedeno po zvážení jednotlivých současných rizikových faktorů ženy, zvláště rizikových faktorů pro žilní tromboembolismus (VTE), a toho, jaké je riziko VTE u přípravku Arnette 0,15 mg/ 0,03 mg v porovnání s dalšími přípravky CHC (viz body 4.3 a 4.4).
4.2 Dávkování a způsob podání
Dávkování
Jak se přípravek Arnette 0,15 mg/ 0,03 mg užívá
Tablety je nutné užívat každý den ve stejnou dobu, podle potřeby s malým množstvím tekutiny, v pořadí uvedeném na blistru. Jedna tableta se užívá denně po 21 následujících dnů. Každý následný blistr se zahajuje po 7denním přerušení bez užívání tablet, během kterého se obvykle objeví krvácení z vysazení. Krvácení se obvykle dostaví během 2 až 3 dnů po užití poslední tablety a nemusí skončit před zahájením užívání dalšího blistru.
Jak zahájit užívání přípravku Arnette 0,15 mg/ 0,03 mg
• Žádná předchozí hormonální antikoncepce (v posledním měsíci)
Užívání tablety se zahájí v 1. den přirozeného cyklu ženy (tzn. první den jejího menstruačního krvácení). Užívání tablety je také možné zahájit v den 2 až 5, ale během prvního cyklu se doporučuje souběžné použití bariérové metody po dobu prvních 7 dnů užívání tablet.
• Změna z jiné kombinované hormonální antikoncepce (kombinovaná perorální antikoncepce (COC), vaginální kroužek či transdermální náplast)
Žena by měla začít užívat přípravek Amette 0,15 mg/ 0,03 mg nejlépe v den následující po dni poslední účinné tablety (poslední tableta obsahující účinné látky) její předchozí COC, avšak nejpozději v den po obvyklém období bez tablety nebo po období užívání tablet placeba z její předcházející COC. V případě použití vaginálního kroužku nebo transdermální náplasti by měla žena zahájit používání přípravku Amette 0,15 mg/ 0,03 mg nejlépe v den vyjmutí, ale nejpozději v den, kdy měla být provedena další aplikace.
• Přechod z progestogenové metody (pouze progestogen obsahující pilulka, injekce či implantát, nebo nitroděložní tělísko uvolňující progestogen).
Žena může přejít kterýkoliv den z čistě progestogenové minipilulky (u implantátu nebo nitroděložního systému v den jeho vyjmutí; u injekčních přípravků v den, kdy má být podána další injekce), ale měla by ve všech těchto případech být poučena o nutnosti použití další bariérové metody po dobu prvních 7 dnů užívání tablet.
• Po potratu nebo interrupci v prvním trimestru
Žena může začít užívání okamžitě. Pokud tak učiní, není třeba žádné další antikoncepční opatření.
• Po porodu nebo potratu v druhém trimestru
Ženu je třeba poučit o zahájení užívání v 21. až 28. dni po porodu, nebo po potratu v druhém trimestru. Pokud začne později, ženu je třeba poučit o dalším použití bariérové metody po dobu prvních 7 dnů. Pokud však již žena měla pohlavní styk, je třeba těhotenství před skutečným zahájením COC vyloučit nebo musí žena počkat na své další menstruační krvácení.
Pro kojící ženy - viz bod 4.6.
Postup v případě opomenutí užití tablety
Pokud se žena opozdí o méně než 12 hodin s užitím jakékoliv tablety, antikoncepční ochrana není snížená.
Žena by měla užít tabletu, jakmile si vzpomene, a další tablety by měla užít v obvyklou dobu.
Pokud se opozdí o více než 12 hodin s užitím jakékoliv tablety, antikoncepční ochrana může být snížená. Postup v případě vynechaných tablet může vycházet z následujících dvou základních pravidel:
1. Užívání tablet nesmí být nikdy přerušeno na delší dobu než 7 dnů.
2. 7 dnů nepřerušeného užívání tablet je nutné k dosažení adekvátní suprese osy hypothalamus - hypofýza - vaječníky.
V souladu s tím lze pro každodenní praxi poskytnout následující doporučení:
• 1. týden
Žena by měla užít poslední zapomenutou tabletu co nejdříve, jakmile si vzpomene, i když by to znamenalo užívání dvou tablet ve stejnou dobu. Potom pokračuje v užívání dalších tablet v obvyklou dobu. Současně by se měla použít bariérová antikoncepční metoda, jako je kondom, po dobu dalších 7 dnů. Pokud došlo k pohlavnímu styku v předcházejících 7 dnech, je třeba zvážit možnost těhotenství. Čím více tablet vynecháte a čím blíže jsou k pravidelnému přerušení podávání, tím vyšší riziko otěhotnění existuje.
• 2. týden
Žena by měla užít poslední zapomenutou tabletu co nejdříve, jakmile si vzpomene, i když by to znamenalo užívání dvou tablet ve stejnou dobu. Potom pokračuje v užívání dalších tablet v obvyklou dobu. Za předpokladu, že žena užila své tablety správně během 7 dnů před první vynechanou tabletou, není potřeba používat žádné další antikoncepční prostředky. Nicméně pokud zapomněla užít více než 1 tabletu, je třeba ženě doporučit použití dalších opatření po dobu 7 dnů.
• 3. týden
Riziko snížené spolehlivosti hrozí z důvodu nadcházejících 7 dnů bez tablety. Nicméně upravením plánu užívání tablet je možné snížené antikoncepční ochraně i nadále zabránit. Při dodržení některé z následujících dvou možností proto není nutné používat žádná další opatření za předpokladu, že všechny tablety byly užity správně během 7 dnů předtím, než žena zapomněla první tabletu. Pokud to není tento případ, žena by měla pokračovat v první z následujících dvou možností a měla by používat další dodatečné antikoncepční opatření také po dobu následujících 7 dnů.
1. Žena by měla užít poslední zapomenutou tabletu co nejdříve, jakmile si vzpomene, i kdyby to znamenalo užívání dvou tablet ve stejnou dobu. Potom pokračuje v užívání dalších tablet v obvyklou dobu. Užívání z dalšího blistru je nutné zahájit co nejdříve po dokončení současného blistru, tzn. mezi jednotlivými blistry by neměla být žádná prodleva. U uživatelky nedojde pravděpodobně k žádnému krvácení z vysazení až do ukončení užívání druhého blistru, ale může se vyskytnout špinění nebo krvácení z průniku ve dnech užívání tablet.
2. Ženě je možné také doporučit, aby ukončila užívání tablet ze současného blistru. Pak by měla mít pauzu 7 dnů bez tablet, včetně dnů kdy zapomněla tablety vzít, a pak pokračuje dalším blistrem.
Pokud žena zapomene užít tablety a nevyskytne se žádné krvácení z vysazení v prvním normálním období bez podávání tablet, je třeba zvážit možnost těhotenství.
Doporučení pro případ gastrointestinálních poruch
V případě těžkých gastrointestinálních poruch (např. zvracení nebo průjem) nemusí být vstřebávání kompletní a je třeba využít další antikoncepční opatření. Pokud dojde ke zvracení během 3 až 4 hodin po užití tablet, je třeba co nejdříve užít novou (náhradní) tabletu. Novou tabletu je třeba dle možností užít během 12 hodin od doby, kdy se tablety obvykle užívají. Pokud uběhne více než 12 hodin, platí doporučení týkající se vynechaných tablet v bodě „Postup v případě vynechání tablet“. Pokud žena nechce měnit svůj normální plán užívání tablet, musí užít další tabletu(y) z dalšího blistru.
Jak oddálit krvácení z vysazení
Pro oddálení menstruace by měla žena pokračovat s dalším blistrem přípravku Arnette 0,15 mg/ 0,03 mg bez intervalu bez tablety. V prodloužení užívání je možné pokračovat jak dlouho si bude žena přát až do konce druhého blistru. Během tohoto období se u ženy může vyskytnout krvácení z průniku nebo špinění. Pravidelné užívání přípravku Arnette 0,15 mg/ 0,03 mg je potom obnoveno po obvyklém 7denním období bez užívání tablet.
Při nutnosti přesunout menstruaci na jiný den v týdnu, než bylo u ženy obvyklé při jejím současném schématu, je možné jí doporučit zkrácení jejího následného intervalu bez tablety o tolik dnů, kolik bude chtít. Čím kratší je pauza, tím vyšší je riziko, že se nevyskytne žádné krvácení z vysazení a že se u ženy objeví krvácení z průniku nebo špinění při užívání následujícího blistru (tak jako při oddalování menstruačního krvácení).
Pediatrická populace
Bezpečnost a účinnost desogestrelu u dospívajících do 18 let nebyla dosud stanovena. Nejsou k dispozici žádné údaje.
Způsob podání Perorální podání
4.3 Kontraindikace
Kombinovaná hormonální antikoncepce (CHC) by se neměla používat u následujících stavů. Pokud by se některé stavy objevily poprvé při užívání CHC, použití přípravku musí být okamžitě zastaveno.
- Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
- Přítomnost nebo riziko žilního tromboembolismu (VTE)
• žilní tromboembolismus - současný žilní tromboembolismus (léčený pomocí antikoagulancií) nebo anamnéza VTE (např. hluboká žilní trombóza [DVT] nebo plicní embolie [PE])
• známá dědičná nebo získaná predispozice pro žilní tromboembolismus, jako je rezistence na APC (včetně faktoru V Leiden), deficit antitrombinu III, deficit proteinu C, deficit proteinu S
• velký chirurgický zákrok s déletrvající imobilizací (viz bod 4.4)
• vysoké riziko žilního tromboembolismu v důsledku přítomnosti více rizikových faktorů (viz bod 4.4);
- Přítomnost nebo riziko arteriálního tromboembolismu (ATE)
• arteriální tromboembolismus - současný arteriální tromboembolismus, anamnéza arteriálního tromboembolismu (např. infarkt myokardu) nebo prodromální stav (např. angina pectoris);
• cerebrovaskulární onemocnění - současná cévní mozková příhoda, anamnéza cévní mozkové příhody nebo prodromálního stavu (např. tranzitorní ischemická ataka, TIA);
• známá hereditární nebo získaná predispozice k arteriálnímu tromboembolismu, jako je hyperhomocysteinémie a antifosfolipidové protilátky (antikardiolipinové protilátky, lupus antikoagulans);
• anamnéza migrény s fokálními neurologickými příznaky;
• vysoké riziko arteriálního tromboembolismu v důsledku vícečetných rizikových faktorů (viz bod 4.4) nebo přítomnosti jednoho závažného rizikového faktoru, jako je:
■ diabetes mellitus s cévními příznaky;
■ závažná hypertenze;
■ závažná dyslipoproteinémie.
- Pankreatitida nebo její výskyt v anamnéze, pokud je asociována s těžkou hypertriglyceridemií.
- Přítomnost závažného jaterního onemocnění nebo jeho výskyt v anamnéze, dokud se hodnoty jaterních testů nevrátí k normě.
- Přítomnost nádoru jater (benigní nebo maligní) nebo jeho výskyt v anamnéze,
- Známé nebo suspektní malignity ovlivněné pohlavními steroidy (například nádory pohlavních orgánů nebo nádory prsu).
- Hyperplazie endometria.
- Nediagnostikované vaginální krvácení.
4.4 Zvláštní upozornění a opatření pro použití Upozornění
Pokud jsou přítomna jakákoli onemocnění nebo rizikové faktory uvedené níže, měla by být vhodnost přípravku Arnette 0,15 mg/ 0,03 mg s ženou prodiskutována.
V případě zhoršení nebo prvního výskytu jakéhokoli z těchto stavů nebo rizikových faktorů by mělo být ženě doporučeno, aby kontaktovala svého lékaře, který stanoví, zda by měla užívání přípravku Arnette 0,15 mg/ 0,03 mg ukončit.
Poruchy krevního oběhu
Riziko žilního tromboembolismu (VTE)
Užívání jakékoli kombinované hormonální antikoncepce (CHC) zvyšuje riziko žilního tromboembolismu (VTE) ve srovnání s jejím neužíváním. Přípravky, které obsahují levonorgestrel, norgestimát nebo norethisteron jsou spojovány s nejnižším rizikem VTE. Další přípravky, jako je přípravek Arnette 0,15 mg/ 0,03 mg mohou mít až dvakrát vyšší úroveň rizika. Rozhodnutí používat jakýkoli přípravek jiný než ten, který má nejnižší riziko VTE, by mělo být učiněno po diskusi se ženou, aby se zajistilo, že rozumí riziku VTE u přípravku Arnette 0,15 mg/ 0,03 mg, rozumí, jak její současné rizikové faktory toto riziko ovlivňují a že riziko VTE je nejvyšší v prvním roce užívání léku. Existují také některé důkazy, že riziko je zvýšené, když je CHC opětovně zahájena po pauze v užívání trvající 4 týdny nebo déle.
U žen, které neužívají CHC a nejsou těhotné, se asi u 2 z 10 000 vyvine VTE v průběhu jednoho roku. U každé jednotlivé ženy však může být riziko daleko vyšší v závislosti na jejích základních rizikových faktorech (viz níže).
Odhaduje se1 , že z 10 000 žen, které používají CHC obsahující desogestrel se u 9 až 12 žen vyvine VTE během jednoho roku; v porovnání s přibližně 62 případy u žen, které používají CHC obsahující levonorgestrel.
V obou případech je tento počet VTE za rok menší než počet očekávaný u žen během těhotenství nebo po porodu.
VTE může být fatální v 1-2 % případů.
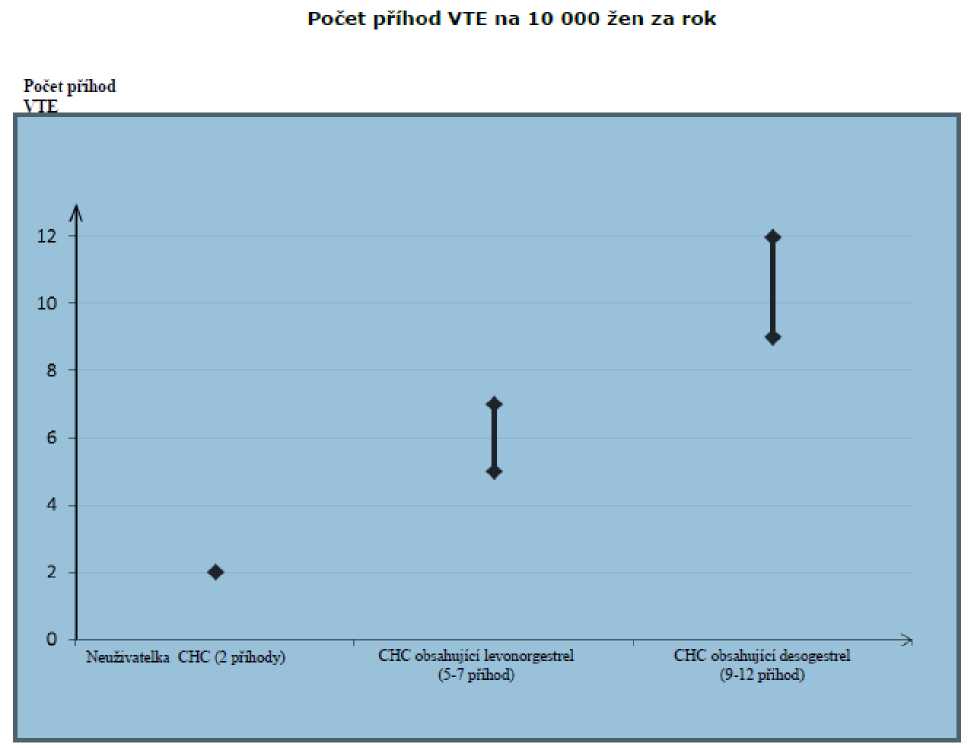
1 Tyto incidence byly odhadnuty ze souhrnu dat z epidemiologických studií s použitím relativních rizik pro různé přípravky ve srovnání s CHC obsahující levonorgestrel.
2 Střední bod rozmezí 5-7 na 10 000 WY (žen-roků) na základě relativního rizika pro CHC obsahující levonorgestrel oproti jejímu nepoužívání přibližně 2,3 až 3,6
Extrémně vzácně byla hlášena trombóza u uživatelek CHC v dalších cévách, např. jaterních, mezenterických, renálních nebo retinálních žilách a tepnách.
Rizikové faktory VTE:
Riziko žilních tromboembolických komplikací u uživatelek CHC se může podstatně zvyšovat u ženy, která má další rizikové faktory, zvláště pokud je přítomno více rizikových faktorů (viz tabulka).
Přípravek Amette 0,15 mg/ 0,03 mg je kontraindikován, pokud má žena více rizikových faktorů, které pro ni představují vysoké riziko žilní trombózy (viz bod 4.3). Pokud má žena více než jeden rizikový faktor, je možné, že zvýšení rizika je vyšší než součet jednotlivých faktorů - v tomto případě by mělo být zváženo její celkové riziko VTE. Pokud je poměr přínosů a rizik považován za negativní, neměla by být CHC předepisována (viz bod 4.3).
|
Rizikový faktor |
Poznámka |
|
Obezita (index tělesné hmotnosti nad 30 kg/m2) |
Při zvýšení BMI se významně zvyšuje riziko Zvláště důležité je zvážit, zda jsou také přítomny další rizikové faktory. |
|
Prodloužená imobilizace , velký chirurgický zákrok, jakýkoli chirurgický zákrok na nohách a pánvi, neurochirurgický zákrok nebo větší trauma. Poznámka: dočasná imobilizace, včetně cestování letadlem > 4 hodiny může být také rizikovým faktorem VTE, zvláště u žen s dalšími rizikovými faktory |
V těchto situacích je doporučeno ukončit používání/užívání náplasti/pilulky/kroužku (v případě plánovaného chirurgického výkonu minimálně 4 týdny předem) a nezahajovat užívání/používání do dvou týdnů po kompletní remobilizaci. Měla by se použít další antikoncepční metoda pro zabránění nechtěnému těhotenství. Antitrombotická léčba by měla být zvážena, pokud přípravek Arnette 0,15 mg/ 0,03 mg nebyl předem vysazen. |
|
Pozitivní rodinná anamnéza (žilní tromboembolismus kdykoli u sourozence nebo rodiče, zvláště v relativně nízkém věku např. do 50 let věku). |
Pokud je suspektní hereditární predispozice, měla by být žena před rozhodnutím o používání jakékoli CHC odeslána k odborníkovi na konzultaci |
|
Další onemocnění související s VTE |
Zhoubné onemocnění, systémový lupus erytematodes, hemolyticko-uremický syndrom, chronické zánětlivé onemocnění střev (Crohnova choroba nebo ulcerózní kolitida) a srpkovitá anémie |
|
Vyšší věk |
Zvláště nad 35 let |
Není žádná shoda o možné roli varixů a povrchové tromboflebitidy v nástupu nebo progresi žilní trombózy.
Zvýšené riziko tromboembolismu v těhotenství a zvláště během šestinedělí musí být zváženo (pro informaci o „Těhotenství a kojení “ viz bod 4.6).
V případě příznaků by mělo být ženě doporučeno, aby vyhledala naléhavou lékařskou péči a informovala lékaře, že užívá CHC.
Příznaky hluboké žilní trombózy (DVT) mohou zahrnovat:
- jednostranný otok nohy a/nebo chodidla nebo podél žíly v noze;
- bolest nebo citlivost v noze, která může být pociťována pouze vstoje nebo při chůzi;
- zvýšenou teplotu postižené nohy, zarudnutí nebo změnu barvy kůže nohy.
Příznaky plicní embolie (PE) mohou zahrnovat:
- náhlý nástup nevysvětlitelné dušnosti nebo rychlého dýchání;
- náhlý kašel, který může být spojený s hemoptýzou;
- ostrou bolest na hrudi;
- těžké točení hlavy nebo závrať způsobené světlem;
- rychlý nebo nepravidelný srdeční tep.
Některé z těchto příznaků (např. „dušnost“, „kašel“) nejsou specifické a mohou být nesprávně interpretovány jako častější nebo méně závažné příhody (např. infekce dýchacího traktu).
Dalšími známkami cévní okluze mohou být: náhlá bolest, otok a světle modré zbarvení končetin.
Pokud nastane okluze v oku, mohou se příznaky pohybovat od nebolestivého rozmazaného vidění, které může přejít do ztráty zraku. Někdy může nastat ztráta zraku téměř okamžitě.
Riziko arteriálního tromboembolismu (ATE)
Epidemiologické studie spojovaly používání CHC se zvýšeným rizikem arteriálního tromboembolismu (infarkt myokardu) nebo cerebrovaskulární příhody (např. tranzitorní ischemická ataka, cévní mozková příhoda). Arteriální tromboembolické příhody mohou být fatální.
Rizikové faktory ATE
Riziko arteriálních tromboembolických komplikací nebo cerebrovaskulární příhody u uživatelek CHC se zvyšuje u žen s rizikovými faktory (viz tabulka). Přípravek Arnette 0,15 mg/ 0,03 mg je kontraindikován, pokud má žena jeden závažný rizikový faktor nebo více rizikových faktorů ATE, které pro ni představují riziko arteriální trombózy (viz bod 4.3). Pokud má žena více než jeden rizikový faktor, je možné, že zvýšení rizika je vyšší než součet jednotlivých faktorů - v tomto případě by mělo být zváženo její celkové riziko. Pokud je poměr přínosů a rizik považován za negativní, neměla by být CHC předepisována (viz bod 4.3).
|
Rizikový faktor |
Poznámka |
|
Vyšší věk |
Zvláště nad 35 let |
|
Kouření |
Ženě by mělo být doporučeno, aby nekouřila, pokud chce používat CHC. Ženám ve věku nad 35 let, které dále kouří, by mělo být důrazně doporučeno, aby používaly jinou metodu antikoncepce. |
|
Hypertenze | |
|
Obezita (index tělesné hmotnosti nad 30 kg/m2) |
Při zvýšení BMI se významně zvyšuje riziko. Zvláště důležité u žen s dalšími rizikovými faktory |
|
Pozitivní rodinná anamnéza (arteriální tromboembolismus kdykoli u sourozence nebo rodiče, zvláště v relativně nízkém věku např. do 50 let věku). |
Pokud je suspektní hereditární predispozice, měla by být žena odeslána k odborníkovi na konzultaci před rozhodnutím o používání jakékoli CHC |
|
Migréna |
Zvýšení frekvence nebo závažnosti migrény během používání CHC (což může být prodromální známka cévní mozkové příhody) může být důvodem okamžitého ukončení léčby |
|
Další onemocnění související s nežádoucími cévními příhodami |
Diabetes mellitus, hyperhomocysteinémie, chlopenní srdeční vada a fibrilace síní, dyslipoproteinémie a systémový lupus erytematodes. |
Příznaky ATE
V případě příznaků bv mělo být ženě doporučeno, abv vyhledala naléhavou lékařskou péči a informovala lékaře, že užívá CHC.
Příznaky cévní mozkové příhody mohou zahrnovat:
- náhlou necitlivost nebo slabost obličeje. paže nebo nohy, zvláště na jedné straně těla;
- náhlé potíže s chůzí. závratě. ztrátu rovnováhy nebo koordinace;
- náhlou zmatenost, problémy s řečí nebo porozuměním;
- náhlé potíže se zrakem na jednom nebo obou očích;
- náhlou, závažnou nebo prodlouženou bolest hlavy neznámé příčiny;
- ztrátu vědomí nebo omdlení s nebo bez záchvatu.
Dočasné příznaky naznačují, že se jedná o tranzitorní ischemickou ataku (TIA).
Příznaky infarktu myokardu (IM) mohou zahrnovat:
- bolest, nepříjemný pocit, tlak, těžkost, pocit stlačení nebo plnosti na hrudi, v paži nebo pod hrudní kostí;
- nepříjemný pocit vyzařující do zad, čelisti, hrdla, paže, žaludku;
- pocit plnosti, poruchu trávení nebo dušení;
- pocení, nauzeu, zvracení nebo závratě;
- extrémní slabost, úzkost nebo dušnost;
- rychlý nebo nepravidelný srdeční tep.
Nádory
Epidemiologické studie naznačují, že dlouhodobé užívání perorální antikoncepce představuje rizikový faktor pro vznik rakoviny děložního hrdla u žen infikovaných lidským papilloma virem (HPV). Nicméně stále panuje nejistota, do jaké míry je toto zjištění ovlivněno zkreslujícími faktory (např. rozdílný počet sexuálních partnerů nebo používání bariérové antikoncepce).
Metaanalýza 54 epidemiologických studií ukázala, že existuje lehce zvýšené relativní riziko (RR = 1,24) diagnózy rakoviny prsu u žen, které současně užívají COC. Zvýšené riziko postupně mizí v průběhu 10 let po ukončení použití COC. Vzhledem k tomu, že je rakovina prsu u žen mladších 40 let vzácná, je zvýšení počtu diagnóz rakoviny prsu u současných a dřívějších uživatelek COC malé v poměru s celkovým rizikem rakoviny prsu. Tyto studie neposkytují důkaz pro kauzalitu. Pozorovaný vzorec zvýšeného rizika může být důsledkem časnější diagnózy karcinomu prsu u uživatelek COC, biologických účinků COC nebo kombinace obou. Karcinomy prsu diagnostikované u předchozích uživatelek mají tendenci být méně klinicky pokročilé než rakovina diagnostikovaná u uživatelek, které přípravek nikdy neužívaly.
Ve vzácných případech byly u uživatelek COC hlášené benigní nádory jater a dokonce ve vzácných případech maligní nádory jater. V izolovaných případech vedly tyto nádory k život ohrožujícímu nitrobřišnímu krvácení. Nádory jater by měly být zvažovány v diferenciální diagnóze, pokud se u žen užívajících COC vyskytuje závažná bolest v horní části břicha, zvětšení jater nebo známky nitrobřišního krvácení.
Při použití COC ve vyšších dávkách (50 ^g ethinylestradiolu) je riziko endometriálního a ovariálního karcinomu snížené. Zda se toto týká také COC s nižší dávkou, musí být potvrzeno.
Další stavy
Ženy s hypertriglyceridémií nebo její rodinnou anamnézou mohou mít zvýšené riziko pankreatitidy při užívání COC.
I když bylo hlášeno malé zvýšení krevního tlaku u mnoha žen užívajících COC, klinicky relevantní zvýšení je vzácné. Pouze v těchto vzácných případech je okamžité přerušení podávání COC oprávněné. Systematický vztah mezi použitím COC a klinickou hypertenzí nebyl stanoven. Pokud během použití COC při preexistující hypertenzi nereaguje konstantně zvýšený krevní tlak nebo významně zvýšený krevní tlak adekvátně na antihypertenzní léčbu, musí být COC vysazena. Pokud je to považováno za vhodné, může být použití kombinované perorální antikoncepce obnoveno, pokud je možné dosáhnout normotenzních hodnot s antihypertenzní terapií.
Následující stavy byly dávány do souvislosti se vznikem nebo zhoršením v těhotenství a při použití COC, ale důkazy o souvislosti s COC nejsou jednoznačné: žloutenka anebo svědění související s cholestázou, tvorba žlučových kamenů, porfyrie, systémový lupus erytematodes, hemolyticko-uremický syndrom, Sydenhamova chorea, gestační herpes, ztráta sluchu v důsledku otosklerózy, (vrozený) angioedém.
Akutní nebo chronické narušení funkce jater může vyžadovat přerušení podávání COC, dokud se jaterní testy nevrátí k normě. Recidiva cholestatické žloutenky, která se objevila dříve během těhotenství nebo předchozího užívání pohlavních steroidů, vyžaduje přerušení podávání COC.
I když může mít COC vliv na periferní inzulinovou rezistenci a glukózovou toleranci, neexistují důkazy pro nutnost změny terapeutického režimu u diabetiček užívajících COC. Ženy s diabetem by však měly být během užívání COC pozorně monitorovány.
S užíváním COC může mít souvislost Crohnova choroba a ulcerózní kolitida.
Během použití COC bylo hlášeno zhoršení endogenní deprese a epilepsie.
Občas se může objevit chloasma, zejména u žen s anamnézou chloasma gravidarum. Ženy s tendencí ke vzniku chloasmy by se měly při užívání COC vyhýbat expozici slunci nebo ultrafialovému záření.
Arnette 0,15 mg/ 0,03 mg obsahuje laktózu. Pacientky se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným nedostatkem laktázy nebo malabsorpcí glukózy a galaktózy, by neměly tento léčivý přípravek užívat.
Lékařské vyšetření/konzultace
Před prvním zahájením nebo opětovným zahájením léčby přípravkem Amette 0,15 mg/ 0,03 mg by měla být získána kompletní anamnéza (včetně rodinné anamnézy) a musí být vyloučeno těhotenství. Měl by se změřit krevní tlak a mělo by být provedeno tělesné vyšetření při zvážení kontraindikací (viz bod 4.3) a varování (viz bod 4.4). Je důležité, aby byla žena upozorněna na informace o žilní a arteriální trombóze, včetně rizika přípravku Amette 0,15 mg/ 0,03 mg v porovnání s dalšími typy CHC, na příznaky VTE a ATE, známé rizikové faktory a co by měla dělat v případě suspektní trombózy.
Žena by také měla být informována, aby si pečlivě přečetla příbalovou informaci pro uživatele a aby dodržovala uvedené instrukce. Frekvence a povaha vyšetření by měly být založeny na stanovených postupech a upraveny podle individuálních potřeb ženy.
Ženy by měly být informovány, že perorální antikoncepce nechrání před infekcí HIV (AIDS) a dalšími sexuálně přenosnými chorobami.
Snížená účinnost
Účinnost COC může být snížená v případě např. vynechaných tablet (bod 4.2), gastrointestinálních poruch (bod 4.2) nebo v případě souběžně užívaných přípravků (bod 4.5).
Rostlinné přípravky obsahující třezalku tečkovanou (Hypericum perforatum) nemají být užívány současně s přípravkem Arnette 0,15 mg/0,03 mg kvůli možnému riziku snížení plazmatických koncentrací a snížení klinického účinku přípravku Arnette 0,15 mg/0,03 mg (viz bod 4.5).
Snížená kontrola cyklu
U všech COC se může objevit nepravidelné krvácení (špinění nebo krvácení z průniku), zejména během prvních měsíců užívání. Proto má hodnocení jakéhokoliv nepravidelného krvácení význam pouze v období adaptace, které trvá asi tři cykly.
Pokud přetrvávají nepravidelnosti krvácení nebo se objeví po dříve pravidelných cyklech, potom by měly být zváženy nehormonální příčiny a adekvátní diagnostická opatření dle indikace pro vyloučení malignity nebo těhotenství. To může zahrnovat kyretáž.
U některých žen se v období bez užívání tablety nemusí krvácení z vysazení objevit. Pokud byla kombinovaná perorální antikoncepce užívána dle pokynů popsaných v bodě 4.2, je nepravděpodobné, že by byla žena těhotná. Nicméně, pokud nebyla COC užívána dle těchto pokynů před krvácením z vysazení u první zapomenuté dávky nebo pokud dojde k vynechání dvou krvácení z vysazení, je nutné před pokračováním s užíváním COC vyloučit těhotenství.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Vliv jiných léčivých přípravků na přípravek Arnette 0,15 mg/ 0,03 mg
Interakce mezi perorální antikoncepcí a dalšími léčivými přípravky může vést ke krvácení z průniku anebo selhání antikoncepce. Následující interakce byly hlášené v literatuře.
Jaterní metabolismus
Interakce se mohou objevit u léčivých látek, které indukují mikrosomální enzymy, které mohou vést ke zvýšené clearance pohlavních hormonů (např. hydantoiny, barbituráty, primidon, bosentan, karbamazepin, rifampicin, rifabutin a možná také oxkarbazepin, modafinil, topiramát, felbamát, griseofulvin a přípravky obsahující třezalku tečkovanou. Také inhibitory HIV proteázy s indukujícím potenciálem (např. ritonavir a nelfinavir) a nenukleosidové inhibitory reverzní transkriptázy (např. nevirapin a efavirenz) mohou ovlivnit jaterní metabolismus. Maximální enzymová indukce není obecně zaznamenána 2-3 týdny, ale může pak přetrvávat po dobu nejméně 4 týdnů po ukončení lékové terapie.
Strategie léčby
Ženy užívající některé z těchto přípravků mají dočasně používat bariérovou metodu antikoncepce současně s COC nebo zvolit jinou metodu antikoncepce.
S léčivými látkami indukujícími mikrosomální enzymy má být bariérová metoda používána během doby současného užívání a 28 dní po ukončení užívání. V případě dlouhodobé léčby induktory mikrosomálních enzymů má být zvolena jiná metoda antikoncepce.
Pokud období, kdy je používána ještě bariérová metoda trvá déle než je zásoba tablet v blistru COC, další blistr COC by se měl zahájit bez obvyklého intervalu bez tablet.
Vliv přípravku Arnette 0,15 mg/ 0,03 mg na jiné léčivé přípravky
Perorální antikoncepce může mít vliv na metabolismus určitých dalších léčivých látek. V souvislosti s tím může docházet ke zvýšení (např. cyklosporin) nebo snížení (např. lamotrigin) plasmatických a tkáňových koncentrací.
Pozn.: U současně užívaných přípravků je potřeba se seznámit s informací pro předepisování, aby se identifikovaly potenciální interakce.
Laboratorní testy
Použití kontracepčních steroidů může ovlivňovat výsledky určitých laboratorních testů, mezi něž patří biochemické parametry jater, štítné žlázy, nadledvinek a funkce ledvin, anebo plazmatické hladiny (transportních) proteinů, např. globulinů vázajících kortikosteroidy a lipidové/lipoproteinové frakce, parametry metabolismu karbohydrátů a parametry krevní koagulace a fibrinolýzy. Změny obvykle zůstávají v rámci normálního laboratorního rozsahu.
4.6 Fertilita, těhotenství a kojení
Přípravek Arnette 0,15 mg/ 0,03 mg není indikován v těhotenství.
Pokud dojde během použití přípravku Arnette 0,15 mg/ 0,03 mg k otěhotnění, další užívání má být zastaveno. Většina epidemiologických studií však neukázala zvýšené riziko porodních defektů u dětí narozených ženám, které užívaly COC před těhotenstvím, ani teratogenní účinek, pokud byla COC užívána nechtěně během těhotenství.
Zvýšené riziko VTE během poporodního období je třeba brát v úvahu při znovuzahájení užívání přípravku Arnette 0,15 mg/ 0,03 mg (viz bod 4.2 a 4.4).
Kojení
Kojení může být ovlivněno působením kombinované perorální antikoncepce, protože může snížit množství mateřského mléka a změnit jeho složení. Proto by se nemělo použití kombinované perorální antikoncepce obecně doporučovat, dokud kojící matka kompletně neodstaví své dítě. Malá množství kontracepčních steroidů anebo jejich metabolity mohou být vylučovány do mateřského mléka, ale není důkaz o jejich nežádoucích účincích na zdraví dítěte.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly pozorovány žádné účinky na schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Jako u všech COC se mohou vyskytnout změny vaginálního krvácení, zvláště během prvních měsíců užívání. Mohou se vyskytnout změny ve frekvenci krvácení (žádné, nižší, vyšší frekvence nebo trvalé), intenzitě (snížená nebo zvýšená) nebo délce krvácení.
Popis vybraných nežádoucích účinků
U žen užívajících CHC bylo pozorováno zvýšené riziko arteriálních a žilních trombotických a tromboembolických příhod, včetně infarktu myokardu, cévní mozkové příhody, tranzitorních ischemických atak, žilní trombózy a plicní embolie a je podrobněji popsáno v bodě 4.4.
V tabulce níže jsou uvedeny možné nežádoucí účinky, které byly hlášeny u uživatelek přípravku Amette 0,15 mg/0,03 mg nebo obecně u uživatelek kombinované perorální antikoncepce*.
Nežádoucí účinky jsou seřazeny podle tříd orgánových systémů a frekvence: časté (> 1/100 až <1/10), méně časté (> 1/1000 až < 1/100) a vzácné (>1/10 000 až <1/1000).
|
Orgánové systémy |
Časté (>1/100 až <1/10) |
Méně časté (> 1/1 000 až < 1/100) |
Vzácné (>1/10 000 až <1/1 000) |
|
Infekce a infestace |
Vaginální kandidóza | ||
|
Poruchy imunitního systému |
Přecitlivělost | ||
|
Poruchy metabolismu a výživy |
Retence tekutin | ||
|
Psychiatrické poruchy |
Depresivní nálada Změna nálady |
Snížení libida |
Zvýšení libida |
|
Poruchy nervového systému |
Závrať Migréna | ||
|
Poruchy oka |
Intolerance kontaktních čoček | ||
|
Poruchy ucha a labyrintu |
Otoskleróza | ||
|
Cévní poruchy |
Hypertenze |
Tromboembolie (VTE, ATE) |
|
Gastrointestinální poruchy |
Nauzea Bolest břicha | ||
|
Poruchy kůže a podkožní tkáně |
Akné Kopřivka |
Erythema nodosum Erythema multiforme Pruritus Alopecie | |
|
Poruchy reprodukčního systému a prsu |
Citlivost prsů Bolesti prsů Nepravidelné krvácení |
Amenorea Zvětšení prsů Metroragie |
Vaginální výtok Výtok z prsu |
|
Celkové poruchy a reakce v místě podání |
Zvýšení tělesné hmotnosti |
Snížení tělesné hmotnosti |
*K popisu nežádoucích účinků jsou použity nejvhodnější termíny dle MedDRA (verze 11.0). Synonyma nebo související stavy nejsou zahrnuty, ale mají být take vzaty v úvahu.
U žen užívajících kombinovanou perorální antikoncepci byla hlášena řada nežádoucích účinků, které jsou podrobně popsány v bodě 4.4. Mezi ně patří:
- žilní tromboembolická porucha,
- arteriální tromboembolická porucha,
- hypertenze,
- hormon-dependentní nádory (např. jaterní tumory, rakovina prsu),
- vznik nebo zhoršení stavů, pro které není jednoznačně stanovený vztah s perorální antikoncepcí:
Crohnova choroba, ulcerózní kolitida, epilepsie, migréna, endometrióza, myom dělohy, porfyrie, systémový lupus erytematodes, gestační herpes, Sydenhamova chorea, hemolyticko uremický syndrom, cholestatická žloutenka,
- chloasma,
- akutní nebo chronické narušení funkce jater může vyžadovat přerušení podávání COC, dokud se
jaterní testy nevrátí k normě;
- u žen s hereditárním angioedémem mohou exogenní estrogeny indukovat nebo zhoršovat příznaky angioedému.
Frekvence diagnózy karcinomu prsu je u uživatelek perorální antikoncepce velmi mírně zvýšená. Vzhledem k tomu, že je rakovina prsu vzácná u žen ve věku nižším než 40 let, je zvýšení počtu malé vzhledem k celkovému riziku rakoviny prsu. Není znám kauzální vztah s použitím kombinované perorální antikoncepce. Další informace naleznete v bodě 4.3 a 4.4.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: http: //www .sukl .cz/nahlasit-nezadouci-ucinek
Nejsou k dispozici žádné případy o závažných škodlivých účincích předávkování. V těchto případech se mohou vyskytnout následující příznaky: nauzea, zvracení a u mladých děvčat mírné vaginální krvácení. Neexistují antidota a další léčba by měla být symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: progestageny a estrogeny, fixní kombinace, ATC kód: G 03 AA 09
Antikoncepční účinek COC je založen na interakci různých faktorů, z nichž nejdůležitější je inhibice ovulace a změna cervikální sekrece. Mimo ochranu před těhotenstvím má COC několik pozitivních vlastností, které mimo negativních vlastností (viz části „Upozornění“ a „Nežádoucí účinky“), mohou být užitečné při rozhodování o metodě kontroly početí. Cyklus je pravidelnější a menstruace je méně bolestivá a krvácení je mírnější. Mírnější krvácivost může vést ke snížení výskytu deficitu železa. V největší multicentrické studii (n=23 258 cyklů) byl Pearlův index (bez korekce) odhadován na 0,1 (95% konfidenční interval: 0,0 až 0,3). Dále 4,5 % žen uvádělo absenci krvácení z vysazení a 9,2 % uvádělo vznik nepravidelného krvácení po 6 léčebných cyklech.
Přípravek Arnette 0,15 mg/ 0,03 mg je COC obsahující ethinylestradiol a progestogen desogestrel. Ethinylestradiol je dobře známý syntetický estrogen.
Desogestrel je syntetický progestogen. Při perorálním podání má silný inhibiční účinek na ovulaci.
Při použití vyšších dávek COC (50 pg ethinylestradiolu) je riziko endometriálního a ovariálního karcinomu snížené. Zda se toto vztahuje také na COC s nižší dávkou musí být ještě potvrzeno.
Pediatrická populace
Nejsou dostupné žádné klinické údaje o účinnosti a bezpečnosti u dospívajících do 18 let.
5.2 Farmakokinetické vlastnosti Desogestrel
Absorpce
Po perorálním podání přípravku Arnette 0,15 mg/ 0,03 mg je desogestrel rychle vstřebáván a konvertován na 3-keto-desogestrel. Vrcholová plazmatická hladina je dosažena za 1,5 hodiny. Absolutní biologická dostupnost 3-keto-desogestrelu je 62 až 81 %.
Distribuce
3-keto-desogestrel je vázán z 95,5 až 99 % na plazmatické proteiny, zejména albumin a SHBG. Ethinylestradiolem indukované zvýšení SHBG ovlivňuje množství vazeb a distribuci 3-keto-deosgestrelu na plazmatické proteiny. V důsledku toho se koncentrace 3-keto-desogestrelu pomalu zvyšuje během léčby, dokud není, během 3 až 13 dnů, dosaženo ustáleného stavu.
Biotransformace
Fáze I metabolismu desogestrelu zahrnuje cytochromem P-450 katalyzovanou hydroxylaci a následnou dehydrogenaci na C3. Účinný metabolit 3-keto-desogestrel je dále redukován a degradační produkty jsou konjugovány na sulfát a glukoronidy. Studie u zvířat ukazují, že enterohepatální cirkulace nemá žádný vliv na gestagenní účinek desogestrelu.
Eliminace
3-keto-desogestrel je eliminován s průměrným poločasem asi 31 hodin (24 až 38 hodin), plazmatická clearance je v rozsahu od 5,0 do 9,5 l/hodinu. Desogestrel a jeho metabolity jsou eliminovány močí a stolicí, buď jako volné steroidy nebo konjugáty. Poměr eliminace v moči nebo stolici je 1,5:1.
Linearita/nelinearita
V podmínkách ustáleného stavu je sérová hladina 3-keto-desogestrelu zvýšená dvakrát až třikrát. Ethinylestradiol
Absorpce
Ethinylestradiol je rychle vstřebáván a vrcholová plazmatická hladina je dosažena za 1,5 hodiny.
V důsledku presystémové konjugace a metabolismu prvního průchodu je absolutní biologická dostupnost 60 %. Plocha pod křivkou a Cmax se obvykle po čase zvyšuje.
Distribuce
Ethinylestradiol je z 98,8 % vázán na plazmatické proteiny, prakticky výlučně na albumin.
Biotransformace
Ethinylestradiol podstupuje presystémovou konjugaci v sliznici tenkého střeva a v játrech. Hydrolýza přímo konjugovaného ethinylestradiolu poskytuje s pomocí střevní flóry ethinylestradiol, který pak může být znovu absorbován a tak je umožněna enterohepatální cirkulace. Primární cesta metabolismu ethinylestradiolu je hydroxylace zprostředkovaná cytochromem P-450, při níž vznikají primárními metabolity 2-OH-EE a 2-methoxy-EE. 2-OH-EE je dále metabolizován na chemicky reaktivní metabolity.
Eliminace
Ethinylestradiol mizí z plazmy s poločasem asi 29 hodin (26 až 33 hodin), plazmatická clearance je v rozsahu 10 až 30 l/hodinu. Konjugáty ethinylestradiolu a jeho metabolity jsou vylučovány močí a stolicí (poměr 1:1)
Linearita/nelinearita
Podmínky ustáleného stavu jsou dosaženy za 3 až 4 dny, kdy sérová hladina léku dosáhne hodnot asi o 30 až 40% vyšších, než po podání jediné dávky.
5.3 Předklinické údaje vztahující se k bezpečnosti
Toxikologické studie neukázaly jiné účinky, než ty, které mohou být vysvětleny na základě hormonálního profilu přípravku Arnette 0,15 mg/ 0,03 mg.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Vitamin E Bramborový škrob Povidon (E1201)
Kyselina stearová (E570)
Koloidní bezvodý oxid křemičitý (E551)
Laktóza
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C v původním obalu, aby byl přípravek chráněn před vlhkostí a světlem.
6.5 Druh obalu a obsah balení
Čirý průsvitný PVC/PVdC/Al blistr s označením kalendářních dnů, každý blistr uložen v třívrstvém sáčku
Čirý průsvitný PVC/PVdC/Al blistr s označením kalendářních dnů, každý blistr uložen v třívrstvém sáčku spolu s 2 g vysoušedla.
Velikost balení 1 x 21, 3 x 21, 6 x 21 nebo 13 x 21 tablet
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Teva Pharmaceuticals CR s.r.o., Praha, Česká republika
8. REGISTRAČNÍ ČÍSLO
17/004/12-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
11.1.2012 / 14.11.2013
10. DATUM REVIZE TEXTU
14.7.2016
18/18