Amicloton
sp.zn.sukls5401/2014
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU AMICLOTON
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tableta obsahuje 2,84 mg amiloridi hydrochloridum dihydricum, což odpovídá 2,5 mg amiloridi hydrochloridum a 25 mg chlortalidonum.
Pomocná látka se známým účinkem: monohydrát laktosy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tableta
Popis přípravku: slabě nažloutlé, kulaté ploché tablety se zkosenými hranami a půlicí rýhou na jedné straně. Tabletu lze dělit na dvě stejné poloviny.
4. KLINICKÉ ÚDAJE
4.1. Terapeutické indikace
Amicloton je indikován k léčbě lehčích forem hypertenze v monoterapii, nebo středně závažných až závažných forem hypertenze v kombinaci s dalšími antihypertenzivy u dospělých pacientů.
4.2. Dávkování a způsob podání
Dávkování
Terapie hypertenze u dospělých:
Na začátku terapie obvykle 'A-1 tabletu 1x denně. Udržovací dávka je obvykle 'A tablety denně nebo 1 tableta obden. Dávky vyšší než 1 tableta denně již nemají vyšší antihypertenzivní účinek. U starších pacientů by úvodní dávka měla činit nejvýše A tablety lx denně.
Pediatrická populace:
Bezpečnost a účinnost nebyla dosud prokázána.
Tablety se užívají před jídlem, během jídla nebo i po jídle.
4.3. Kontraindikace
Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 tohoto přípravku. Přípravek se nesmí užívat při známé přecitlivělosti na sulfonamidy, při hyperkalémii či hypokalémii, hyponatrémii, hypochlorémii, při těžké insuficienci jater a ledvin, při těžké cerebrální nebo koronární skleróze, dnavé artritidě, při poruchách krvetvorby, v těhotenství a během kojení.
4.4. Zvláštní upozornění a opatření pro použití
Dlouhodobé užívání přípravku může vést k manifestaci latentního diabetů.
Opatrnosti je třeba u hyponatrémie.
Vyšší výskyt nežádoucích účinků je u pacientů s těžkou poruchou funkce jater nebo ledvin či u seniorů, u nichž je zpomalená eliminace amiloridu.
Během terapie je třeba pravidelně monitorovat plazmatické hladiny draslíku, sodíku a hořčíku. Dále je třeba sledovat plazmatické hladiny celkového dusíku a kreatininu. Vhodné je sledovat také vylučování vápníku močí.
Přípravek obsahuje monohydrát laktosy. Pacienti se vzácnou dědičnou poruchou snášenlivosti galaktózy, vrozeným nedostatkem laktázy nebo malabsorpci glukózy-galaktózy by neměli tento léčivý přípravek užívat.
4.5. Interakce s jinými léčivými přípravky a jiné formy interakce
Pro lékové interakce kombinace chlortalidon s amiloridem platí, že jejich rozsah (množství) je výrazně menší ve srovnání se samotným chlortalidonem nebo amiloridem, protože riziko hypokalémie nebo naopak hyperkalémie je při podávání výše uvedené kombinace diuretik sníženo.
Amilorid snižuje renální eliminaci draslíku. Současné podávání amiloridu a solí draslíku je potenciálně nebezpečné pro výrazné riziko hyperkalémie.
Současné podávání ACE-inhibitorů a amiloridu vede ke zvýšení rizika hyperkalémie. Samotné podávání ACE-inhibitorů vede k aldosteronem zprostředkovanému zvýšení plazmatických hladin draslíku. Toto zvýšení je stabilní a s délkou podávání ACE-inhibitorů se dále nemění.
Současné podávání inhibitorů ACE může vést ke zvýšení rizika posturální hypotenze po podání první dávky chlortalidonu. Z tohoto důvodu je u pacientů, kteří jsou již léčeni chlortalidonem, potřeba zahajovat terapii inhibitory ACE s použitím velmi nízké dávky.
Současné podávání amiloridu a triamterenu, heparinu, cyklosporinu nebo takrolimu může vést k hyperkalémii.
Amilorid může (na rozdíl od triamterenu nebo spironolaktonu) vést ke snížení renálního clearance lithia a zvýšení jeho plazmatických hladin a toxicity.
Amilorid zvyšuje proarytmogenní účinky chinidinu. Bylo pozorováno prodloužení intervalu QRS a další změny na EKG a vznik komorové tachykardie.
Amilorid může interferencí při eliminaci zvyšovat plazmatické hladiny, účinnost a toxicitu (především prodloužení intervalu QT) dofetilidu.
Amilorid (dosud ne zcela přesně objasněným mechanismem) snižuje biologickou dostupnost perorálně podávaného amoxicilinu.
Amilorid může zvyšovat renální clearance digoxinu a dosud neznámým mechanismem snižovat jeho pozitivně inotropní účinek. Plazmatické hladiny digoxinu se statisticky významně nemění.
Amilorid dosud neznámým mechanismem snižuje biologickou dostupnost cimetidinu. Antihypertenzivní účinnost amiloridu, podobně jako jiných diuretik, mohou snižovat nesteroidní protizánětlivá léčiva. Indomethacin a další nesteroidní protizánětlivá léčiva redukují natriumuretický účinek amiloridu, vedou k retenci tekutin a sodíku a mohou vyvolat akutní renální selhání.
Současné podávání bepridilu vede ke zvýšení rizika vážných poruch srdečního rytmu (torsades de pointes), které mohou být vyvolány hypokalémií navozenou chlortalidonem. Kombinace chlortalidonu s amiloridem je z tohoto hlediska bezpečná.
Současné podávání kalcitriolu může vést k riziku hyperkalcémie.
Současné podávání solí vápníku a chlortalidonu může vést ke vzniku milk alkali syndromu (hyperkalcémie, metabolická alkalóza, selhání ledvin).
Chlortalidon může navozením hypokalémie zvýšit toxicitu digoxinu. Kombinace chlortalidonu s amiloridem je z tohoto hlediska bezpečná.
Současné podávání kortikosteroidů může vést ke zvýšení rizika hypokalémie. Kombinace chlortalidonu s amiloridem je z tohoto hlediska bezpečná.
Chlortalidon může vést ke snížení renálního clearance lithia a zvýšení jeho plazmatických hladin a toxicity. Antihypertenzivní účinnost chlortalidonu, podobně jako jiných diuretik, mohou snižovat nesteroidní protizánětlivá léčiva. Chlortalidon snižuje účinek perorálních antidiabetik a inzulínu ovlivněním glykémie. V některých případech je nutná úprava dávky antidiabetik.
Absorbci chlortalidonu může snížit cholestyramin nebo colestypol. Chlortalidon je třeba podávat 1 hodinu před nebo 4 hodiny po podání sekvestrantů.
4.6. Fertilita, těhotenství a kojení
Fertilita
V dávkách 20 krát vyšších, respektive 25 krát vyšších než odpovídající dávky používané v humánní medicíně byl amilorid podáván březím králičím respektive myším samicím. Nebyly pozorovány žádné negativní změny u plodů. Dávky přibližně 5 krát vyšší než odpovídající dávky v humánní medicíně byly podávány březím potkaním samicím, bylo pozorováno snížení růstu plodů a zhoršení jejich přežívání. Amilorid v experimentech na potkanech přecházel přes placentu. Studie u lidí nejsou
k dispozici.
V experimentech na zvířatech nevykazoval chlortalidon známky teratogenity nebo jiného poškození plodů. Ve studii na 20 gravidních ženách exponovaných chlortalidonu v prvním trimestru gravidity však byly zjištěny známky zvýšeného rizika vývojových vad plodu. Dle klasifikace rizik v těhotenství používané v USA je chlortalidon řazen do kategorie B, dle australské klasifikace je řazen do kategorie C.
V těhotenství je jeho podávání možné pouze v nezbytně nutných případech.
Kojení
Amilorid přechází u potkaních samic do mateřského mléka v koncentracích, které přibližně odpovídají plazmatickým koncentracím. Přestup do mateřského mléka u lidí není znám.
Chlortalidon přechází do mateřského mléka. Vzhledem k dlouhému biologickému poločasu a vzhledem k retenci chlortalidonu v erytrocytech je patrný přechod chlortalidonu do mateřského mléka ještě dlouho po ukončení terapie. Tři dny po ukončení podávání chlortalidonu v dávce 50 mg denně činily koncentrace v mateřském mléce 0,09-0,83 pg/ml.
Z těchto důvodů se nedoporučuje podávání kombinace amiloridu a chlortalidonu při kojení.
4.7. Účinky na schopnost řídit a obsluhovat stroje
Přípravek může, hlavně na začátku léčby, ovlivnit pozornost při řízení motorových vozidel nebo obsluze strojů.
4.8. Nežádoucí účinky
V následující tabulce jsou shrnuty nežádoucí účinky amiloridu a chlortalidonu rozdělené do skupin dle terminologie MedDRA s uvedením frekvence výskytu: velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1 000 až <1/100); vzácné (>1/10 000 až < 1/1 000); velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
|
Třídy orgánových systémů dle MedDRA |
Frekvence |
Nežádoucí účinek |
|
Poruchy krve a lymfatického systému |
Vzácné |
Neutropenie |
|
Není známo |
Agranulocytóza |
|
Poruchy metabolismu a výživy |
Časté |
Hyperkalémie, hypokalémie, hypochlorémie, hyponatrémie, hyperurikémie, diabetes mellitus (manifestace latentního diabetu nebo zhoršení manifestovaného diabetu) |
|
Méně časté | ||
|
Psychiatrické poruchy |
Vzácné |
Deprese, insomnie |
|
Poruchy nervového systému |
Vzácné |
Somnolence |
|
Cévní poruchy |
Méně časté |
Ortostatická hypotenze |
|
Gastrointestinální poruchy |
Méně časté | |
|
Poruchy kůže a podkožní tkáně |
Méně časté |
Fotosenzitivní reakce, vyrážka, pruritus |
|
Vyšetření |
Vzácné |
Zvýšené hodnoty jaterních enzymů (reverzibilně) |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www .sukl .cz/nahlasit-nezadouci-ucinek
4.9. Předávkování
Hlavními příznaky, které lze očekávat při akutní intoxikaci kombinace amiloridu s chlortalidonem, jsou dehydratace a rozvrat elektrolytové rovnováhy.
Při předávkování nebo při akutní intoxikaci kombinace amiloridu s chlortalidonem je nutné ukončit její podávání, případně zamezit jejímu dalšímu vstřebávání z trávicího ústrojí (vyvoláním zvracení, výplachem žaludku). Specifické antidotum amiloridu ani chlortalidonu neexistuje. Není známo, zda je amilorid eliminován hemodialýzou. Chlortalidon není eliminován hemodialýzou. Terapie akutní intoxikace je symptomatická a podpůrná. Především je třeba sledovat plazmatické hladiny sodíku, draslíku a chloridů a jejich výkyvy náležitě korigovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1. Farmakodynamické vlastnosti
Farmakoterapeutická skupina: kombinace chlortalidonu a kalium šetřícího diuretika ATC kód: C03EA06
Amilorid je substituovaný pyrazinoylguanidin, chemicky se jedná o hydrochlorid 3,5-diamino-N-(aminoiminomethyl) -6 -chlorpyrazinkarboxamidu.
Amilorid hydrochlorid je žlutá až žlutozelená krystalická látka, těžce rozpustná ve vodě (0,52 g ve 100 ml) a ethanolu (1,96 g ve 100 ml), prakticky nerozpustná v éteru. Disociační konstanta (pka) je 8,7. Teplota tání bezvodé báze amiloridu je 240,2-241,5 °C.
Chlortalidon je substituovaný derivát indolu, chemicky se jedná o 2-chlor-5-(2,3-dihydro-1-hydroxy-3-oxo-1H-isoindol-1-yl)benzensulfonamid. Chlortalidon je bílý nebo žlutobílý prášek, prakticky nerozpustný ve vodě (12 mg ve 100 ml), dobře rozpustný v acetonu a v methanolu, těžce rozpustný v ethanolu, prakticky nerozpustný v dichlormethanu; rozpouští se ve zředěných roztocích alkalických hydroxidů. Teplota tání chlortalidonu je 218-264 °C.
Chemický vzorec:
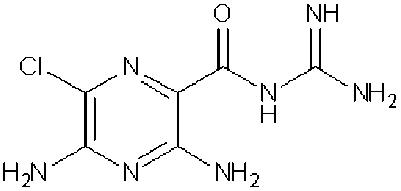
chemický vzorec amiloridu
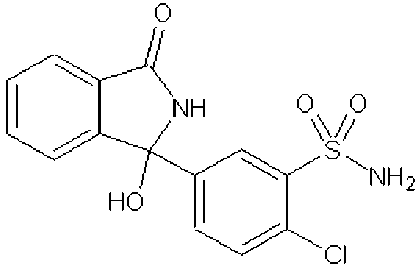
chemický vzorec chlortalidonu
Mechanismus účinku:
Mechanismus účinku amiloridu spočívá v interferenci s mechanismem výměny sodíku (Na+) a draslíku (K+) nebo vodíku (H+) v distální části distálního tubulu a v proximální části sběrného kanálku. Natriumuretický účinek amiloridu je způsoben jeho přímým působením na sodíkové kanály. Natriumuretický účinek amiloridu není způsoben antialdosteronovým působením. Antikaliumuretický účinek je způsoben modulováním elektrochemických pochodů při membránovém transportu draslíku v distálním nefronu (hyperpolarizací membrány).
Mechanismus účinku chlortalidonu spočívá v inhibici reabsorbce sodíku a chloridů v dilučním segmentu kůry (v distálnější části nefronu). V kůře ledvin jsou lokalizovány receptory pro „thiazidová diuretika“, na která se thiazidy i jim chemicky podobná diuretika váží. Není dosud známo, zda je za příslušné farmakologické účinky chlortalidonu zodpovědná jeho vazba na „thiazidové receptory“. Chlortalidon, podobně jako jiná thiazidová diuretika, však může ovlivnit reabsorbci přibližně 5 % sodíku, protože více než 90 % sodíku je reabsorbováno v prostorech před dilučním segmentem kůry ledvin.
5.2. Farmakokinetické vlastnosti
Po perorálním podání se amilorid jen částečně vstřebává a jeho absolutní biologická dostupnost činí 15-90 % a zvyšuje se v případě podání 4 hodiny po jídle. Vazba na plazmatické bílkoviny je nízká a pohybuje se kolem 40 %.
Po perorálním podání účinek nastupuje během 2-3 hodin, maximálních plazmatických hladin je dosaženo za 3-4 hodiny po podání, maximálního účinku je dosaženo za 6-10 hodin po podání a účinek obvykle přetrvává 24 hodin. Mezi výší plazmatických hladin a terapeutickým účinkem nebyla zjištěna pozitivní korelace.
Biologický poločas je 6-9 hodin a prodlužuje se při těžké poruše funkce jater (až na 46,2 hodiny), při cystické fibróze (až na 16 hodin) nebo při těžké poruše funkce ledvin (při Clcr pod 5 ml/min až na 143,5 hodiny). Zdánlivý distribuční objem amiloridu je 4,7-5,1 l/kg.
Amilorid se v organismu nebiotransformuje. Během 72 hodin se po perorálním podání amiloridu vyloučí přibližně 50 % podané dávky v nezměněné formě močí a přibližně 40-50 % podané dávky v nezměněné formě stolicí.
Při těžké poruše funkce jater dochází k prodloužení biologického poločasu amiloridu. Není však nutná úprava dávky, je pouze třeba zvýšeného monitorování pacienta (především elektrolytové rovnováhy). Při těžké poruše funkce ledvin dochází k prodloužení biologického poločasu amiloridu, a to v závislosti na funkčním stavu ledvin. Při Clcr 50-10 ml/min je doporučováno snížení dávky na polovinu, při Clcr pod 10 ml/min se podávání amiloridu nedoporučuje. Není známo, zda lze amilorid eliminovat hemodialýzou. Prodloužení biologického poločasu lze očekávat též u seniorů vzhledem ke snížení renální clearance amiloridu.
Po perorálním podání se chlortalidon dobře vstřebává a jeho biologická dostupnost činí přibližně 65 %.
Vazba chlortalidonu na plazmatické bílkoviny je střední (75 %), výrazně vyšší je vazba chlortalidonu na erythrocyty (98 %). Chlortalidon se výrazně koncentruje v erythrocytech a dosahuje v nich koncentrací odpovídajícím 50-80ti násobku koncentrací plazmatických.
Po perorálním podání účinek nastupuje během 2,6 hodiny, maximálních plazmatických hladin je dosaženo za 1,5-6 hodin po podání, maximálního účinku je dosaženo za 6-10 hodin po podání a účinek obvykle přetrvává 72 hodin.
Maximální plazmatické hladiny po perorální dávce 200 mg chlortalidonu činí 6,3 ^g/ml.
Zdánlivý distribuční objem chlortalidonu je 292 ± 20 l.
Chlortalidon se v organismu jen minimálně biotransformuje.
Biologický poločas chlortalidonu se pohybuje mezi 40-98 hodinami, obvykle činí 40-50 hodin.
Během 24 hodin se po perorálním podání chlortalidonu vyloučí 50-74 % podané dávky prakticky pouze v nezměněné formě močí.
Celkové clearance chlortalidonu je 111 ± 20 ml/min, renální clearance chlortalidonu je 69 ± 11 ml/min.
Při poruše funkce ledvin dochází k prodloužení biologického poločasu chlortalidonu. Jeho podávání při Clcr pod 10 ml/min je nevhodné z důvodu nedostatečné účinnosti, při Clcr nad 10 ml/min je doporučováno prodloužení dávkového intervalu na 48 hodin. Chlortalidon nelze eliminovat hemodialýzou. Funkční stav jater nemá vliv na farmakokinetické vlastnosti chlortalidonu.
Chlortalidon prochází placentární bariérou (v koncentracích odpovídajících 5-16 % koncentrací plazmatických) a vylučuje se do mateřského mléka (v koncentraci 0,09-0,86 ^g/ml).
5.3. Předklinické údaje vztahující se k bezpečnosti
Reprodukční studie provedené u zvířat neprokázaly poškození fertility, teratogenní nebo kancerogenní účinky amiloridu. Amilorid nemá mutagenní vlastnosti. U zvířat prostupuje amilorid placentou a přechází do mateřského mléka.
Toxikologické studie provedené na potkanech, myších a dalších zvířecích druzích prokázaly pouze účinky související s nadměrným farmakologickým působením. Nebyla pozorována žádná specifická orgánová toxicita. Amilorid je po perorálním podání relativně netoxický. LD50 po perorálním podání činilo u potkanů 36-58 mg/kg, u myší 65 mg/kg a u psů byla vyšší než 640 mg/kg.
Reprodukční studie provedené u zvířat neprokázaly poškození fertility, teratogenní nebo kancerogenní účinky chlortalidonu. Není známo, zda má chlortalidon mutagenní vlastnosti. U zvířat prostupuje chlortalidon placentou a přechází do mateřského mléka.
Akutní toxicita chlortalidonu je ve srovnání s amiloridem nízká. LD50 po perorálním podání je u všech zvířecích druhů vyšší než 5.000 mg/kg. Akutní toxicita kombinace amiloridu s chlortalidonem je vyšší než u chlortalidonu, ale nižší než u amiloridu.
Bezpečnost kombinace amiloridu a chlortalidonu byla navíc prověřena její dlouhodobé používání v klinické praxi.
6. FARMACEUTICKÉ ÚDAJE
6.1. Seznam pomocných látek
Dihydrát hydrogenfosforečnanu vápenatého, monohydrát laktosy, kukuřičný škrob, calcium-stearát.
6.2. Inkompatibility
Neuplatňuje se.
6.3. Doba použitelnosti
2 roky
6.4. Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5. Druh obalu a velikost balení
PVC/Al blistr, krabička.
Velikost balení 30 tablet.
6.6. Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Zentiva, a. s., Einsteinova 24, Bratislava, Slovenská republika
8. REGISTRAČNÍ ČÍSLO
50/001/85-S/C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 28.1.1985
Datum posledního prodloužení registrace: 21.8.2013
10. DATUM REVIZE TEXTU
1.1.2014
7/7