Aldara 5%
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
ALDARA 5 % krém
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden sáček obsahuje imiquimodum 12,5 mg ve 250 mg krému (5 %). 100 mg krému obsahuje imiquimodum 5 mg .
Pomocné látky se známým účinkem: methylparaben (E218) 2.0 mg/g krému propylparaben (E216) 0.2 mg/g krému cetylalkohol 22.0 mg/g krému stearylalkohol 31.0 mg/g krému
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Krém
Bílý až nažloutlý krém.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Krém s imichimodem je určen pro topickou léčbu:
• Zevních genitálních a perianálních vegetací (condylomata acuminata) u dospělých.
• Malých povrchových bazocelulárních karcinomů u dospělých.
• Klinicky typických, nehyperkeratotických, nehypertrofických aktinických keratóz v oblasti obličeje nebo kštice u imunokompetentních dospělých pacientů, u nichž by z důvodu velikosti nebo počtu lézí byla kryoterapie nedostatečně účinná a/nebo nepřijatelná a jiné terapeutické možnosti jsou kontraindikovány nebo méně vhodné.
4.2 Dávkování a způsob podání
Dávkování
Frekvence nanášení a trvání léčby krémem s imichimodem se liší podle indikace.
Zevní kondylomata u dospělých:
Krém s imichimodem se aplikuje 3krát týdně (např. pondělí - středa - pátek nebo úterý - čtvrtek -sobota) před ulehnutím ke spánku a ponechá se na kůži až 10 hodin. V léčbě krémem s imichimodem je třeba pokračovat až do vymizení viditelných genitálních či perianálních kondylomat nebo maximálně 16 týdnů v rámci jedné epizody kondylomat.
Množství, které má být aplikováno, je uvedeno v bodě 4.2 Způsob podávání.
Povrchový bazocelulámí karcinom u dospělých:
Krém s imichimodem se aplikuje 5krát týdně po 6 týdnů (např. pondělí až pátek) před ulehnutím ke spánku a ponechá se na kůži přibližně 8 hodin.
Množství, které má být aplikováno, je uvedeno v bodě 4.2 Způsob podávání.
Aktinická keratóza u dospělých
Léčbu musí zahájit a dále sledovat lékař. Krém s imichimodem se aplikuje 3krát týdně (např. pondělí -středa - pátek) po dobu 4 týdnů před ulehnutím ke spánku a ponechá se na kůži přibližně 8 hodin. Použije se dostatečné množství krému, aby se pokryla léčená oblast. Po dalším čtyřtýdenním cyklu bez léčby je třeba posoudit, zda keratóza vymizela. Pokud jakákoli léze přetrvává, léčba se má opakovat, opět po dobu 4 týdnů.
Maximální doporučovaná dávka je 1 sáček. Maximální doporučená doba léčby je 8 týdnů.
Pokud se na léčené ploše objeví výrazná lokální zánětlivá reakce (viz bod 4.4) nebo infekce, je třeba zvážit přerušení léčby. V případě infekce je třeba přijmout i další odpovídající opatření. Celková doba léčebného cyklu by nikdy neměla být delší než 4 týdny, ani v případě, že byla léčba přerušena nebo některé dávky vynechány.
Pokud léze při následném zhodnocení ve 4. - 8. týdnu po druhém léčebném cyklu nevykazují dostatečnou odpověď na léčbu, je třeba dále zvolit jinou terapii (viz bod 4.4).
Informace, které se týkají všech indikací:
Dojde-li k vynechání dávky, krém se má aplikovat ihned, jakmile si pacient vzpomene, a poté se má pokračovat podle pravidelného rozvrhu. Krém se neaplikuje častěji než jednou denně.
Pediatrická _ populace
Použití v populaci pediatrických pacientů se nedoporučuje. Nejsou k dispozici údaje o použití imichimodu u dětí a dospívajících ve schválených indikacích.
Přípravek Aldara by neměl být používán u dětí s molluscum contagiosum vzhledem k nedostatečné účinnosti v této indikaci (viz bod 5.1).
Způsob podávání
Zevní kondylomata:
Krém s imichimodem se nanáší po omytí a osušení v tenké vrstvě do oblasti kondylomat a vtírá se do kůže, dokud se zcela nevstřebá. Krém se aplikuje pouze na postiženou oblast a je třeba dbát, aby nedošlo ke kontaktu s vnitřními povrchy. Aplikuje se před ulehnutím ke spánku. Během 6 až 10 hodin, kdy působí, není možné se koupat ani sprchovat. Po této době je zásadně nutné krém s imichimodem odstranit omytím vodou s použitím jemného mýdla. Nanášení nadměrného množství krému či jeho ponechání na kůži déle než 10 hodin může vést k závažným reakcím v místě aplikace (viz body 4.4,
4.8 a 4.9). Krém v jednom sáčku k jednorázovému použití vystačí k ošetření oblasti s kondylomaty o rozloze 20 cm2. Sáčky nelze po otevření opakovaně používat. Před i po aplikaci krému je třeba si důkladně umýt ruce.
Při léčbě kondylomat souvisejících s předkožkou u mužů bez obřízky je nutno stáhnout předkožku směrem dozadu a postiženou oblast denně umývat (viz bod 4.4).
Povrchový bazocelulámí karcinom:
Před aplikací krému s imichimodem se postižená oblast omyje vodou s použitím jemného mýdla a důkladně osuší. Krém je třeba nanášet v dostatečném množství, pokrývajícím celou léčenou oblast včetně okolní kůže do vzdálenosti jednoho centimetru. Krém se vtírá do postiženého místa, dokud se zcela nevstřebá. Nanáší se před ulehnutím ke spánku a ponechává se na kůži přibližně 8 hodin. Během této doby není možné se sprchovat ani koupat. Po uplynutí této doby je nezbytné zbytek krému s imichimodem odstranit omytím vodou s použitím jemného mýdla.
Sáčky nelze po otevření opakovaně použít. Před i po aplikaci krému je třeba si pečlivě umýt ruce.
Odpověď léčeného nádoru na krém s imichimodem se hodnotí 12 týdnů po ukončení léčby. Vykazuje-li nádor neúplnou odpověď, je třeba volit jiný způsob léčby (viz bod 4.4).
Působí-li lokální kožní reakce na krém s imichimodem pacientovi značné potíže nebo j sou-li v léčeném místě patrné známky infekce, je možné v léčbě udělat několikadenní přestávku (viz bod
4.4) . V případě infekce je rovněž třeba zahájit příslušná další opatření.
Aktinická keratóza
Před aplikací krému s imichimodem se postižená oblast omyje vodou s použitím jemného mýdla a důkladně osuší. Krém je třeba nanášet v dostatečném množství, pokrývajícím celou léčenou oblast. Krém se vtírá do postiženého místa, dokud se zcela nevstřebá. Nanáší se před ulehnutím ke spánku a ponechává se na kůži přibližně 8 hodin. Během této doby se pacient nemá sprchovat ani koupat. Po uplynutí této doby je nezbytné zbytek krému s imichimodem odstranit omytím vodou s použitím jemného mýdla. Sáčky nelze po otevření opakovaně použít. Před i po aplikaci krému je třeba si pečlivě umýt ruce.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
4.4 Zvláštní upozornění a opatření pro použití
Zevní kondylomata, povrchový bazocelulární karcinom a aktinická keratóza:
Zabraňte kontaktu s očima, rty a nosními dírkami.
Krém s imichimodem může zhoršit zánětlivá kožní onemocnění.
Krém s imichimodem je nutno používat s opatrností u pacientů s autoimunitním onemocněním (viz bod 4.5.). Je nutno zvážit poměr mezi přínosy léčby imichimodem u těchto pacientů a rizik spojených s možným zhoršením jejich autoimunitního onemocnění.
Krém s imichimodem je nutno používat s opatrností u pacientů s transplantovanými orgány (viz bod
4.5) . Je nutno zvážit poměr mezi přínosy léčby imichimodem u těchto pacientů a rizik spojených s možností rejekce orgánu nebo reakce štěpu proti hostiteli.
Léčbu krémem s imichimodem se doporučuje zahájit až po zotavení kůže po předchozí farmakologické či chirurgické léčbě. Aplikace na porušenou kůži může mít za následek zvýšenou systémovou absorpci imichimodu vedoucí ke zvýšenému riziku nežádoucích příhod (viz bod 4.8 a 4.9).
Při léčbě krémem s imichimodem se nedoporučuje používat okluzivní obvazy.
Pomocné látky methylhydroxybenzoát (methylparaben) (E218) a propylhydroxybenzoát (E216), mohou způsobit alergické reakce (pravděpodobně zpožděné). Cetylalkohol a stearylalkohol mohou způsobit lokální kožní reakce (např kontaktní dermatitidu).
Vzácně může dojít k intenzivní místní zánětlivé reakci s mokváním nebo erozemi již po několika aplikacích krému s imichimodem. Místní zánětlivé reakce mohou být provázeny nebo dokonce předcházeny systémovými, chřipce podobnými (flu-like) příznaky jako malátnost, horečka, nevolnost, bolesti svalů a ztuhlost. Je nutno zvážit přerušení léčby.
Pacienti se sníženou hematologickou rezervou by měli imichimod používat jen s opatrností.(viz bod 4.8 d).
Zevní kondylomata:
Dosud existují jen omezené zkušenosti s použitím imichimodu ve formě krému v léčbě mužů s kondylomaty v oblasti předkožky. Databáze údajů o bezpečnosti u mužů bez obřízky, léčených krémem s imichimodem třikrát týdně a každodenně hygienicky pečujících o tuto oblast, obsahuje méně než 100 pacientů. V jiných studiích, v nichž každodenní běžná hygiena předkožky nebyla dodržována, se vyskytly dva případy závažné fimózy a jeden případ striktury, vedoucí k obřízce.
Léčba u této populace pacientů se proto doporučuje pouze u mužů, kteří jsou schopni a ochotni dodržovat každodenní hygienu předkožky. Časnými známkami striktury mohou být lokální kožní reakce (např. eroze, ulcerace, edém, indurace) nebo stále větší obtíže při stahování předkožky. Objeví -li se tyto příznaky, musí být léčba ihned zastavena. Na základě současných znalostí není imichimod krém doporučen k léčbě uretrálních, intravaginálních, cervikálních, rektálních či intraanálních kondylomat. V oblastech s otevřenými kožními defekty a ranami lze léčbu krémem zahájit až po jejich zhojení.
Časté jsou lokální kožní reakce, jako: erytém, eroze, exkoriace, šupinatění a otok. Též byly zaznamenány indurace, ulcerace, krusty a vezikuly. Při kožní nesnášenlivosti je nutno krém odstranit z kůže omytím vodou s použitím jemného mýdla. V léčbě krémem s imichimodem je možno pokračovat až po zmírnění kožní reakce. Riziko závažných kožních reakcí se může zvýšit, je-li imichimod užíván ve vyšších než doporučovaných dávkách (viz bod 4.2). Avšak závažné lokální reakce u pacientů, kteří užívali imichimod v souladu s pokyny, jen zřídka vyžadovaly léčbu a/nebo vedly k dočasné neschopnosti. Při lokalizaci těchto reakcí při ústí močové trubice měly některé ženy potíže s močením, které si v několika případech vyžádaly akutní katetrizaci a léčbu postižené oblasti. Nejsou k dispozici žádné klinické zkušenosti s krémem s imichimodem, použitým ihned po léčbě jinými kožně aplikovanými látkami pro léčbu genitálních a perianálních kondylomat.
Krém s imichimodem je třeba omýt z kůže před sexuální aktivitou. Imichimod může zeslabit kondomy a diafragmata, proto nelze doporučit jejich použití současně s krémem. Je třeba zvolit jinou formu antikoncepce.
U pacientů s oslabenou imunitou se nedoporučuje krém s imichimodem používat opakovaně.
Třebaže omezená data ukazují na rychlejší redukci kondylomat u HIV pozitivních pacientů, nebylo u krému s imichimodem prokázáno, že je u této skupiny pacientů stejně účinný s ohledem na vymizení kondylomat.
Povrchový bazocelulární karcinom:
Imichimod nebyl hodnocen v léčbě bazocelulárního karcinomu lokalizovaného do 1 cm od očních víček, nosu, rtů a vlasové linie.
Postižená kůže se nejspíše bude během léčby a až do zhojení viditelně lišit od normální kůže. Lokální kožní reakce jsou časté, ale v průběhu další léčby se snižuje jejich intenzita nebo zcela odezní po ukončení léčby krémem s imichimodem. Existuje souvislost mezi poměrem úplného vymizení a intenzitou lokálních kožních reakcí (např. erytému). Tyto lokální kožní reakce mohou souviset se stimulací lokální imunitní odpovědi. Vyžaduje-li to míra obtíží pacienta nebo závažnost lokální kožní reakce, je možné udělat v léčbě několikadenní přestávku. Po zmírnění kožní reakce je třeba v léčbě krémem s imichimodem pokračovat.
Klinický výsledek léčby je možno určit až po regeneraci léčené kůže, přibližně 12 týdnů po ukončení léčby.
Neexistují žádné zkušenosti s použitím krému s imichimodem u imunokompromitovaných pacientů. Rovněž nejsou žádné klinické zkušenosti u pacientů s recidivujícím a již dříve léčeným povrchovým bazocelulárním karcinomem, proto se krém s imichimodem nedoporučuje používat u nádorů již dříve léčených.
Z otevřených klinických studií vyplývá, že u velkých nádorů (> 7,25 cm2) je menší pravděpodobnost odpovědi na léčbu imichimodem.
Léčenou kožní oblast je třeba chránit před sluncem.
Aktinická keratóza:
Jsou-li léze aktinické keratózy klinicky atypické nebo vzbuzují-li podezření z malignity, je nutno provést biopsii k určení vhodné léčby.
Imichimod nebyl hodnocen v léčbě aktinické keratózy očních víček, vnitřku nosních dírek a zvukovodů a rtů na vnitřní straně od nachové linie.
Jsou k dispozici jen omezené údaje o použití imichimodu v léčbě aktinické keratózy jinde než v oblasti obličeje a kštice. Dostupné údaje o aktinické keratóze na předloktích a rukou nesvědčí pro účinnost v této indikaci, a proto se použití léku v této lokalizaci nedoporučuje.
Imichimodu se nedoporučuje pro léčbu lézí aktinické keratózy s výraznou hyperkeratózou nebo hypertrofií, s jakou se setkáváme u cornu cutaneum.
Postižená kůže se nejspíše bude během léčby a až do zhojení viditelně lišit od normální kůže. Lokální kožní reakce jsou časté, ale v průběhu další léčby se snižuje jejich intenzita nebo zcela odezní po ukončení léčby krémem s imichimodem. Existuje souvislost mezi počtem případů úplného vymizení a intenzitou lokálních kožních reakcí (např. erytému). Tyto lokální kožní reakce mohou souviset se stimulací lokální imunitní odpovědi. Vyžaduje-li to míra obtíží pacienta nebo závažnost lokální kožní reakce, je možné udělat v léčbě několikadenní přestávku. Po zmírnění kožní reakce je třeba v léčbě krémem s imichimodem pokračovat.
Cyklus léčby by nikdy neměl být prodlužován na více než 4 týdny z důvodu vynechaných dávek nebo přestávek v aplikaci.
Klinický výsledek léčby je možno určit až po regeneraci léčené kůže, přibližně 4 - 8 týdnů po ukončení léčby.
Neexistují žádné zkušenosti s použitím krému s imichimodem u imunokompromitovaných pacientů.
Rovněž nejsou žádné klinické údaje o opakované léčbě aktinické keratózy, která vymizela po jednom až dvou cyklech léčby krémem s imichimodem a následně recidivovala. Opětovné použití léku v těchto případech se nedoporučuje.
Z otevřených klinických studií vyplývá, že u osob s více než 8 lézemi aktinické keratózy je úplného vymizení méně pravděpodobné než u pacientů s menším počtem lézí.
Léčenou kožní oblast je třeba chránit před sluncem.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Žádné studie interakcí nebyly provedeny. To se týká také imunosupresiv. Interakce se systémovými léky by měly být omezené vzhledem k minimálnímu kožnímu vstřebávání imichimodu z krému. Vzhledem k imunostimulačním vlastnostem je třeba opatrnosti při podávání krému s imichimodem pacientům, kteří užívají imunosupresivní léky (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Nejsou k dospozici klinické údaje o podávání imichimodu během těhotenství. Studie na zvířatech nenaznačují přímé ani nepřímé škodlivé účinky na průběh těhotentsví, embryonální/fetální vývoj, porod nebo postnatální vývoj (viz bod 5.3). Při předepisování těhotným ženám je nutno postupovat opatrně.
Kojení
Vzhledem k tomu, že po jediné ani opakovaných topických dávkách nejsou v séru zjistitelné žádné měřitelné hladiny imichimodu (>5 ng/ml), není možné podat žádné specifické doporučení, zda lze imichimod krém používat u kojících žen či nikoli.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Aldara krém nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
a)_Obecný popis
Zevní kondylomata:
V základních studiích s dávkováním 3krát týdně byly nejčastěji hlášenými nežádoucími účinky, podle posouzení s pravděpodobným či možným vztahem k léčbě krémem s imichimodem, reakce na lokální aplikaci v místě léčby kondylomat (33,7 % pacientů léčených imichimodem). Dále byly u pacientů léčených krémem s imichimodem hlášeny některé systémové nežádoucí reakce, včetně bolesti hlavy (3,7 %), příznaků podobných chřipce (1,1 %) a myalgie (1,5 %).
Nežádoucí reakce hlášené 2292 pacienty, léčenými krémem s imichimodem v placebem kontrolovaných, otevřených klinických studiích, jsou uvedeny níže. Souvislost mezi těmito nežádoucími příhodami a léčbou imichimodem je hodnocena jako přinejmenším možný kauzální vztah.
Povrchový bazocelulární karcinom:
Ve studiích s dávkováním 5krát týdně prodělalo 58 % pacientů nejméně jednu nežádoucí příhodu.
K nejčastěji hlášeným nežádoucím příhodám z těchto studií, jejichž vztah k léčbě krémem s imichimodem byl posouzen jako pravděpodobný či možný, byly potíže v místě aplikace s frekvencí
28,1 %. Pacienti léčení krémem s imichimodem hlásili i některé systémové nežádoucí reakce, včetně bolestí v zádech (1,1 %) a příznaků podobných chřipce (0,5 %).
Níže jsou uvedeny nežádoucí reakce, které uvedlo 185 pacientů s povrchovým bazocelulárním karcinomem, léčených krémem s imichimodem v placebem kontrolovaných klinických studiích III. fáze. Vztah těchto nežádoucích příhod k léčbě imichimodem byl posouzen jako přinejmenším možný.
Aktinická keratóza:
V pivotních studiích s dávkováním 3krát týdně v jednom nebo dvou čtyřtýdenních cyklech hlásilo 56 % pacientů nejméně jednu nežádoucí příhodu. K nejčastěji hlášeným nežádoucím příhodám v těchto studiích, jejichž vztah k léčbě krémem s imichimodem byl posouzen jako pravděpodobný či možný, byly reakce v místě aplikace (22 % pacientů léčených imichimodem). Pacienti léčení krémem s imichimodem hlásili i některé systémové nežádoucí reakce, včetně bolestí ve svalech (2 %).
Níže jsou uvedeny nežádoucí reakce, které uvedlo 252 pacientů s aktinickou keratózou, léčených krémem s imichimodem v placebem kontrolovaných klinických studiích III. fáze. Vztah těchto nežádoucích příhod k léčbě imichimodem byl posouzen jako přinejmenším možný.
b) Tabulkový seznam nežádoucích příhod:
Frekvence příhod jsou definovány jako velmi časté ((>1/10), časté ((>1/100 až <1/10) a méně časté (>1/1 000 až <1/100). Příhody s ještě nižší frekvencí zde nejsou uvedeny.
|
Zevní kondylomata (3x týdně/16 týdnů) N = 2292 |
Povrchový bazocelulární karcinom (5x týdně, 6 týdnů) N = 185 |
Aktinická keratóza (3x týdně, 4 nebo 8 týdnů) N = 252 | |
|
Infekční a parazitární onemocnění: |
|
Infekce |
časté |
časté |
méně časté |
|
Pustulky |
časté |
méně časté | |
|
Herpes simplex |
méně časté | ||
|
Genitální kandidóza |
méně časté | ||
|
Vaginitída |
méně časté | ||
|
Bakteriální infekce |
méně časté | ||
|
Plísňové infekce |
méně časté | ||
|
Infekce horních cest dýchacích |
méně časté | ||
|
Vulvitída |
méně časté | ||
|
Rinitida |
méně časté | ||
|
Influenza |
méně časté | ||
|
Poruchy krve a lymfatického systému: | |||
|
Lymfadenopatie |
méně časté |
časté |
méně časté |
|
Poruchy metabolizmu a výživy: | |||
|
méně časté |
časté | ||
|
Psychiatrické poruchy: | |||
|
méně časté | |||
|
méně časté |
méně časté | ||
|
méně časté | |||
|
Poruchy nervového systému: | |||
|
časté |
časté | ||
|
Parestezie |
méně časté | ||
|
Závrať |
méně časté | ||
|
Migréna |
méně časté | ||
|
Spavost |
méně časté | ||
|
Oční poruchy: | |||
|
Podráždění spojivky |
méně časté | ||
|
Otok očních víček |
méně časté | ||
|
Ušní poruchy: | |||
|
Ušní šelesty |
méně časté | ||
|
Cévní poruchy: | |||
|
Flush/návaly |
méně časté | ||
|
Respirační, hrudní a mediastinální poruchy: | |||
|
Faryngitida |
méně časté | ||
|
Rinitida |
méně časté | ||
|
Kongesce nosní sliznice |
méně časté | ||
|
Faryngolaryngeální bolest |
méně časté | ||
|
Gastrointestinální poruchy: | |||
|
časté |
méně časté |
časté | |
|
méně časté | |||
|
méně časté |
méně časté | ||
|
méně časté | |||
|
Rektální poruchy: |
méně časté | ||
|
Rektální tenezmy |
méně časté | ||
|
Sucho v ústech |
méně časté | ||
|
Poruchy kůže a podkoží: | |||
|
Pruritus |
méně časté | ||
|
méně časté |
méně časté | ||
|
Folikulitida |
méně časté | ||
|
Erytematózní rash |
méně časté | ||
|
Ekzém |
méně časté | ||
|
Vyrážka/rash |
méně časté | ||
|
Zvýšené pocení |
méně časté | ||
|
Kopřivka |
méně časté |
|
Aktinická keratóza |
méně časté | ||
|
Erytém |
méně časté | ||
|
Edém v obličeji |
méně časté | ||
|
Kožní ulcerace |
méně časté | ||
|
Poruchy pohybového systému a pojivové tkáně | |||
|
Myalgie |
časté |
časté | |
|
Artralgie |
méně časté |
časté | |
|
Bolest vzádech |
méně časté |
časté | |
|
Bolesti v končetinách |
méně časté | ||
|
Poruchy ledvin a močových cest: | |||
|
méně časté | |||
|
Poruchy reprodukčního systému a choroby prsů: | |||
|
Genitální bolest u mužů |
méně časté | ||
|
Postižení penisu |
méně časté | ||
|
Dyspareunie |
méně časté | ||
|
Erektilní dysfunkce |
méně časté | ||
|
Uterovaginální prolaps |
méně časté | ||
|
Vaginální bolest |
méně časté | ||
|
Atrofická vaginitida |
méně časté | ||
|
Postižení vulvy |
méně časté | ||
|
Celkové a jinde nezařazené poruchy a lokální reakce po podání | |||
|
Pruritus v místě aplikace |
velmi časté |
velmi časté |
velmi časté |
|
Bolest v místě aplikace |
velmi časté |
časté |
časté |
|
Pálení v místě aplikace |
časté |
časté |
časté |
|
Podráždění v místě aplikace |
časté |
časté |
časté |
|
Erytém v místě aplikace |
časté |
časté | |
|
Reakce v místě aplikace |
časté | ||
|
Krvácení v místě aplikace |
časté |
méně časté | |
|
Papulky v místě aplikace |
časté |
méně časté | |
|
Parestezie v místě aplikace |
časté |
méně časté | |
|
Rash v místě aplikace |
časté | ||
|
Únava |
časté |
časté | |
|
Pyrexie |
méně časté |
méně časté | |
|
Příznaky podobné chřipce |
méně časté |
méně časté | |
|
Bolest |
méně časté | ||
|
Slabost |
méně časté |
méně časté | |
|
méně časté | |||
|
Ztuhlost |
méně časté |
méně časté | |
|
Dermatitida v místě aplikace |
méně časté | ||
|
Sekrece v místě aplikace |
méně časté |
méně časté | |
|
Hyperestezie v místě aplikace |
méně časté | ||
|
Zánět v místě aplikace |
méně časté | ||
|
Otok v místě aplikace |
méně časté |
méně časté | |
|
Strupy v místě aplikace |
méně časté |
méně časté | |
|
Jizva v místě aplikace |
méně časté | ||
|
Rozpad kůže v místě aplikace |
méně časté | ||
|
Otok v místě aplikace |
méně časté |
méně časté | |
|
Ulcerace/vřed v místě aplikace |
méně časté | ||
|
Puchýřky v místě aplikace |
méně časté |
méně časté | |
|
Horkost v místě aplikace |
méně časté | ||
|
Netečnost |
méně časté | ||
|
Nepříjemný pocit |
méně časté | ||
|
Zánět |
méně časté |
c)_Nežádoucí příhody s častým výskytem
Zevní kondylomata:
Řešitelé v placebem kontrolovaných studiích byli požádáni, aby v souladu s protokolem hodnotili klinické příznaky (kožní reakce). Z těchto protokolem požadovaných klinických posouzení je zřejmé, že lokální kožní reakce včetně erytému (61 %), eroze (30 %), exkoriace/olupování/šupinatění (23 %) a edému (14 %) se v těchto placebem kontrolovaných studiích krému s imichimodem aplikovaným 3x týdně vyskytovaly často (viz bod 4.4). Lokální kožní reakce, např. erytém, jsou nejspíše prohloubením farmakologických účinků krému s imichimodem.
V placebem kontrolovaných studiích byly pozorovány i vzdálené kožní reakce, zejména erytém (44 %). Tyto reakce byly, mimo kondylomata v oblastech, které se mohly dostat do kontaktu s krémem s imichimodem. Většina kožních reakcí byla co do závažnosti mírných až středně vyjádřených a odezněla do dvou týdnů po přerušení léčby. Avšak v některých případech byly kožní reakce závažné a vyžadovaly léčbu a/nebo vedly k pracovní neschopnosti. Velmi zřídka došlo k závažných reakcím při ústí močové trubice s dysurií u žen (viz bod 4.4).
Povrchový bazocelulární karcinom:
Řešitelé v placebem kontrolovaných studiích byli požádáni, aby v souladu s protokolem hodnotili klinické příznaky (kožní reakce). Z těchto protokolem požadovaných klinických posouzení je zřejmé, že v studiích krému s imichimodem aplikovaným 5krát týdně byl častý výskyt erytému (31 %), závažných erozí (13 %), a značných strupů a krust (19 %). Lokální kožní reakce, např. erytém, jsou nejspíše prohloubením farmakologických účinků krému s imichimodem.
Během léčby krémem s imichimodem byly pozorovány kožní infekce. I když neměly závažné následky, je nutno na možnost infekce v porušené kůži vždy pamatovat.
Aktinická keratóza
V klinických studiích krému s imichimodem aplikovaným 3krát týdně po dobu 4 nebo 8 týdnů patřilo k nejčastěji se vyskytujícím reakcím v místě aplikace svědění cílovém místě (14 %) a pálení v cílovém místě (5 %). Výskyt těžkého erytému (24 %) a strupů a krust (20 %) byl velmi častý. Lokální kožní reakce, např. erytém, jsou nejspíše prohloubením farmakologického účinku krému s imichimodem. Ohledně přestávky v léčbě viz body 4.2 a 4.4..
Během léčby krémem s imichimodem byly pozorovány kožní infekce. I když neměly závažné následky, je nutno na možnost infekce v porušené kůži vždy pamatovat.
d) Nežádoucí příhody vztahující se ke všem indikacím
Byly obdrženy zprávy o lokalizované hypopigmentaci a hyperpigmentaci po užívání krému s imichimodem. Další sledování ukazuje, že tyto barevné kožní změny mohou být u některých pacientů trvalé. Při sledování 162 pacientů pět let po léčbě pro malý povrchový bazocelulární karcinom byla u 37 % pacientů pozorována mírná hypopigmentace a u 6 % pacientů střední hypopigmentace. 56 % pacientů bylo bez hypopigmentace; hyperpigmentace nebyla hlášena.
Klinickými studiemi použití krému s imichimodem v léčbě aktinické keratózy byl zjištěn 0,4% (5/1214) výskyt alopecie v místě léčby nebo jeho okolí. Po uvedení na trh nebyly hlášeny žádné případy suspektní alopecie během léčby bazocelulárního karcinomu či zevních kondylomat.
Nálezy klinických studiích zahrnují též snížení hemoglobinu, bílých krvinek a absolutní pokles neutrofilů a destiček. U pacientů s normální hematologickou rezervou nejsou tyto změny považovány za klinicky významné. Pacienti se sníženými hematologickými hodnotami nebyly v klinických studiích zkoumáni. Po uvedení na trh byly hlášeny poklesy v hematologických parametrech vyžadující klinickou intervenci. Po uvedení na trh byly hlášeny případy zvýšení hladiny jatemích enzymů.
Vzácně byly hlášeny případy exacerbace autoimunitních onemocnění.
V klinických studiích byly vzácně hlášeny případy kožních nežádoucích účinků mimo oblast aplikace, včetně erythema multiforme. Mezi závažné nežádoucí účinky hlášené po uvedení přípravku na trh patřily erythema multiforme, Stevensův-Johnsonův syndrom a kožní lupus erythematosus.
e) Pediatrická populace:
Imichimod byl hodnocen v kontrolovaných klinických studiích u pediatrických pacientů (viz bod 4.2 a 5.1). Systémové reakce nebyly prokázány. Reakce v místě podání se častěji vyskytly po podání imichimodu než po podání vehikula, incidence a intenzita těchto reakcí však nebyly odlišné od reakcí pozorovaných u dospělých ve schválených indikacích. Žádné závažné nežádoucí účinky vyvolané imichimodem nebyly u pediatrických pacientů prokázány.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Při topické aplikaci je systémové předávkování imichimodem z krému nepravděpodobné vzhledem k minimálnímu vstřebávání kůží. Ve studiích u králíků byla zjištěna dermální letální dávka vyšší než 5 g/kg. Trvalé dermální předávkování imichimodem v krému by mohlo vést k těžkým lokálním kožním reakcím.
Po náhodném požití jednorázové dávky 200 mg imichimodu, odpovídající obsahu přibližně 16 sáčků, může dojít k žaludeční nevolnosti, zvracení, bolesti hlavy, bolestem ve svalech a horečce. Klinicky nejzávažnější nežádoucí příhodou po perorálním požití mnoha dávek s celkovým obsahem >200 mg imichimodu byla hypotenze, která se upravila po perorálním nebo nitrožilním podání tekutin.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Chemoterapeutika pro místní použití, virostatika: ATC kód: D06BB10.
Imichimod modifikuje imunitní odpověď. Studie vazebné saturace ukazují na existenci membránového receptoru pro imichimod na příslušných imunitních buňkách. Imichimod nemá přímou antivirovou aktivitu. V modelech na zvířatech je imichimod účinný proti virovým infekcím a působí protinádorově, především v důsledku indukce alfa interferonu a dalších cytokinů. V klinických studiích byla prokázána indukce alfa interferonu a dalších cytokinů po aplikaci krému s imichimodem v oblasti genitálu postižené kondylomaty. Zvýšené systémové hladiny alfa-interferonu a dalších cytokinů po topické aplikaci imichimodu byly prokázány farmakokinetickou studií.
Zevní kondylomata:
Klinická účinnost
Výsledky tří stěžejních studií účinnosti fáze III ukázaly, že léčba krémem s imichimodem v trvání 16 týdnů byla významně účinnější než léčba vehikulem při hodnocení z hlediska úplného vymizení léčených kondylomat.
U 119 žen léčených imichimodem bylo kombinované celkové procento vymizení 60 % ve srovnání s 20 % u 105 pacientek léčených vehikulem (95% interval spolehlivosti pro rozdíl ve výskytu: 20 % až 61 %, p<0,001). U pacientek léčených imichimodem, které dosáhly úplného vymizení kondylomat, činila střední doba do vymizení 8 týdnů.
U 157 imichimodem léčených mužů bylo kombinované celkové procento vymizení 23 % ve srovnání s 5 % u 161 pacientů léčených vehikulem (95% interval spolehlivosti pro rozdíl ve výskytu: 3 % proti 36 %, p<0,001). U pacientů léčených imichimodem, kteří dosáhli úplného vymizení kondylomat, činila střední doba do vymizení 12 týdnů.
Povrchový bazocelulární karcinom:
Klinická účinnost:
Účinnost imichimodu 5x týdně po 6 týdnů byla hodnocena ve dvou dvojitě slepých, kontrolovaných studiích. Cílovými nádory byly histologicky potvrzené unilokulární povrchové bazocelulární karcinomy maximální velikosti do 0,5 cm2 s maximálním průměrem 2 cm. Vyloučeny byly nádory lokalizované do 1 cm od očí, nosu, úst, uší a vlasové linie. Ve sloučené analýze těchto dvou studií bylo histologicky ověřené vymizení (clearance) zaznamenáno u 82 % (152/185) pacientů. Po zahrnutí klinického hodnocení bylo vymizení, posuzované pomocí tohoto složeného cílového ukazatele, zaznamenáno u 75 % (139/185) pacientů. Tyto výsledky byly statisticky významné ve srovnání s placebovou skupinou, 3 % (6/179) a 2 % (3/179). Byla zjištěna významná souvislost mezi intenzitou lokálních kožních reakcí (např. erytému) během léčby a úplným vymizením bazocelulárního karcinomu.
Údaje z pětiletého sledování v rámci dlouhodobé nezaslepené nekontrolované studie ukazují, že přibližně u 77,9 % [95% CI (71,9%, 83,8%)] z celkového počtu osob, jimž byla v úvodu podána léčba, došlo ke klinickému vymizení nálezu, které trvá již 60 měsíců.
Aktinická keratóza:
Klinická účinnost:
Účinnost imichimodu, aplikovaného 3x týdně v jednom 4týdenním cyklu léčby nebo dvou 4týdenních cyklech oddělených 4týdenní přestávkou, byla hodnocena ve dvou dvojitě slepých, vehikulem kontrolovaných studiích. Pacienti v obou těchto studiích měli klinicky typické, viditelné, diskrétní, nehyperkeratotické a nehypertrofické léze aktinické keratózy s přilehlou léčenou plochou o velikosti 25 cm2 v oblasti kštice nebo na obličeji. Bylo léčeno 4 až 8 lézí aktinické keratózy. Podíl pacientů, u kterých došlo k úplnému vymizení lézí (imichimod minus placebo) činil po sloučení výsledků z obou studií 46,1 % (CI 39,0 %; 53,1 %).
Údaje sloučené z obou observačních studií ukazují 27 % (35 ze 128 pacientů) podíl recidivy (do 12 měsíců) u pacientů, kteří dosáhli klinického vymizení lézí po jednom nebo dvou cyklech léčby. Frekvence recidivy u jednotlivých lézí činila 5,6 % (41 ze 737 lézí). Odpovídající frekvence recidivy při aplikaci vehikula činily 47 % (8 ze 17 pacientů) a 7,5 % (6 z 80 lézí). Frekvence hlášené progrese do skvamózního karcinomu (SCC) činila 1,6 % (2 ze 128 pacientů).
Údaje o frekvenci recidivy a progrese po uplynutí 1 roku nejsou k dispozici.
Pediatrická populace:
Schválené indikace genitální kondylomata, aktinická keratóza a povrchový bazocelulární karcinom jsou stavy, které se obvykle v pediatrické populaci nevyskytují a nebyly v této populaci studovány.
Přípravek Aldara krém byl hodnocen ve čtyřech randomizovaných, vehikulem kontrolovaných, dvojitě zaslepených studiích u dětí ve věku 2 až 15 let s molluscum contagiosum (imichimod n = 576, vehikulum n = 313). Tyto studie neprokázaly účinnost imichimodu v žádném z testovaných režimů dávkování (3x/týden po dobu < 16 týdnů a 7x/týden po dobu < 8 týdnů).
5.2 Farmakokinetické vlastnosti
Zevní kondylomata, povrchový bazocelulámí karcinom a aktinická keratóza:
U lidí se vstřebalo kůží méně než 0,9 % topicky aplikované jediné dávky radioizotopicky značeného imichimodu. Malé množství léku, absorbované do systémové cirkulace, se rychle vyloučilo močí a stolicí s průměrným poměrem přibližně 3 : 1. Po jediné ani opakovaných topických dávkách nebyly v séru zjistitelné žádné měřitelné hladiny léku (>5 ng/ml).
Systémová expozice (perkutánní průnik) byla vypočtena ze záchytu uhlíku 14C z [14C] imichimodu v moči a stolici.
Minimální systémová kožní absorpce 5% krému s imichimodem, podávaného 3x týdně po 16 týdnů, byla pozorována u 58 pacientů s aktinickou keratózou. Nebylo významného rozdílu v perkutánní absorpci mezi první a poslední dávkou této studie. Vrcholové sérové koncentrace léku koncem 16. týdne, pozorované po 9 až 12 hodinách, činily 0,1 ng/ml při aplikaci v oblasti obličeje (12,5 mg, 1 sáček na jedno použití), 0,2 ng/ml při aplikaci do kštice (25 mg, 2 sáčky) a 1,6 ng/ml při aplikaci na rukou nebo pažích (75 mg, 6 sáčků). Oblast aplikace ve kštici a na rukou či pažích nebyla kontrolována. Nebyla sledována proporcionalita dávek. Byl vypočítán poločas, který byl přibližně 10krát delší než dvouhodinový poločas, zjištěný v dřívější studii po subkutánním podání, což ukazuje na prodlouženou retenci léku v kůži. Močí odcházelo u těchto pacientů v 16. týdnu méně než 0,6 % aplikované dávky.
Pediatrická populace:
Byly hodnoceny farmakokinetické vlastnosti imichimodu po jednorázové a opakované topické aplikaci u pediatrických pacientů s molluscum contagiosum (MC). Údaje o systémové expozici prokázaly, že rozsah absorpce imichimodu po topické aplikaci na kůži zasaženou lézemi MC u pediatrických pacientů ve věku 6 - 12 let byl nízký a srovnatelný s absorpcí pozorovanou u zdravých dospělých a dospělých s aktinickou keratózou či povrchovým bazocelulárním karcinomem. U malých dětí ve věku 2 - 5 let byla absorpce na základě hodnot Cmax vyšší než u dospělých.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje, získané na základě konvenčních studií bezpečnosti, mutagenicity a teratogenicity, neodhalily žádné zvláštní riziko pro člověka.
Ve čtyřměsíční studii dermální toxicity u potkana bylo pozorováno výrazné snížení tělesné hmotnosti a zvýšení váhy sleziny při dávkách 0,5 mg/kg a 2,5 mg/kg, zatímco ve čtyřměsíční dermální studii u myši žádné podobné účinky zjištěny nebyly. U obou druhů bylo pozorováno lokální podráždění kůže, zejména při vyšších dávkách.
V dvouleté studii kancerogenity u myší při dermálním podávání tři dny v týdnu nebyla zjištěna indukce nádorů v místě aplikace. Avšak výskyt hepatocelulárních nádorů byl u léčených zvířat vyšší než u kontrol. Mechanizmus tohoto jevu není znám, ale vzhledem k tomu, že imichimod má nízkou systémovou absorpci lidskou kůží a není mutagenní, je u člověka riziko ze systémové expozice pravděpodobně nízké. Další informace poskytla dvouletá perorální studie kancerogenity u potkanů, neprokazující nádory v žádné lokalizaci.
Krém s imichimodem byl hodnocen v biologické studii na fotokarcinogenitu u albinotických holých myší, vystavených simulovanému slunečnímu ultrafialovému záření (UVR). Zvířata, jimž byl krém s imichimodem aplikován třikrát týdně, byla vystavena záření 5 dnů v týdnu po 40 týdnů. Myši pak byly dále chovány ještě 12 týdnů do celkových 52 týdnů. Byl zjištěn časnější a početnější výskyt nádorů ve skupině myší, kterým byl aplikován krém s vehikulem, než v kontrolní skupině s nízkým UVR. Význam tohoto nálezu pro člověka není jasný. Topické podávání krému s imichimodem nevedla při žádné z dávek k posílení nádorů ve srovnání se skupinou s krémem s vehikulem.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
kyselina isostearová benzylalkohol cetylalkohol stearylalkohol bílá vazelína polysorbát 60 sorbitan-stearát glycerol
methylparaben (E218) propylparaben (E216) xanthanová klovatina čištěná voda
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C.
Sáček nelze po otevření znovu použít.
6.5 Druh obalu a velikost balení
Krabičky s 12 nebo 24 sáčky z polyester-aluminiové folie k jednorázovému použití s obsahem 250 mg krému. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Meda AB Pipers vag 2A 170 73 Solna Švédsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/98/080/001-002
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 18/09/1998 Datum prodloužení registrace: 03/09/2008
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží
3M Health Care Limited, Derby Road, Loughborough, Leicester, LE11 5SF, Velká Británie.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ Léčivý přípravek je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
• Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
Aldara 5% krém imiquimodum
2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
Jeden sáček obsahuje imiquimodum 12,5 mg ve 250 mg krému (5 %). 100 mg krému obsahuje imiquimodum 5 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: kyselina isostearová, benzylalkohol, cetylalkohol, stearylalkohol, bílá vazelína, polysorbát 60, sorbitanstearát, glycerol, methylparaben(E218), propylparaben (E216), xanthanová klovatina, čištěná voda Další informace viz příbalová informace.
4. LÉKOVÁ FORMA A OBSAH
Krém
12 sáčků. Jeden sáček obsahuje 250 mg krému. 24 sáčků. Jeden sáček obsahuje 250 mg krému.
5. ZPŮSOB A CESTA PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Kožní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Pouze pro jednorázové použití. Všechen krém zbylý v sáčku zlikvidujte.
8. POUŽITELNOST
Exp.
9 ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte při teplotě do 25 °C
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
Tt název a adresa držitele rozhodnutí o registraci
Meda AB Box 906 170 09 Solna Švédsko
12. REGISTRAČNÍ ČÍSLO(A)
EU/1/98/080/001 12 sáčků EU/1/98/080/002 24 sáčků
T3 číslo šarže
č.s.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
Neuplatňuje se.
16. INFORMACE V BRAILLOVE PÍSMU
Aldara
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU TEXT NA SÁČCÍCH
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Aldara 5% krém Imiquimodum Kožní podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
Exp.
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
250 mg krému
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele Aldara 5% krém
imiquimodum
Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat znovu pročíst.
- Máte-li jakékoli další otázky, zeptejte se, prosím, svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám, a proto jej nedávejte žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny
_v této příbalové informaci. Viz bod 4._
Co naleznete v této příbalové informaci
1. Co je Aldara krém a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Aldara krém používat
3. Jak se Aldara krém používá
4. Možné nežádoucí účinky
5 Jak Aldara krém uchovávat
6. Obsah balení a další informace
1. Co je Aldara krém a k čemu se používá
Aldara krém se používá na tři různá onemocnění. Váš lékař může předepsat krém Aldara jako léčbu:
• Bradavic (condylomata acuminata) na povrchu genitálu (pohlavních orgánů) a kolem řitního otvoru (konečníku)
• Povrchového bazocelulárního karcinomu.
Jde o častou, pomalu rostoucí formu kožního nádoru s velmi malou pravděpodobností rozšíření na další části těla. Obvykle se vyskytuje ve středním věku a u starších lidí, zejména u těch, kteří mají světlou kůži a je způsoben slunečním zářením. Pokud je ponechán bez léčby, může bazocelulární karcinom způsobit znetvoření, zvláště na obličeji - proto je důležité včasné rozpoznání a léčba.
• Aktinické keratózy
Jako aktinická keratóza se označují ložiska zhrubělé kůže u lidí, kteří byli během celého svého života ve velké míře vystaveni slunečnímu záření. Některá ložiska mohou mít barvu kůže, jiná jsou šedavá, růžová, červená nebo hnědá. Mohou být plochá a šupinatá nebo vyvýšená, zhrubělá, tvrdá a s bradavičnatým povrchem. Aldara by se měla používat pouze na plochá ložiska aktinické keratózy na obličeji a v oblasti kštice, pouze u pacientů, kteří mají v pořádku imunitní systém a ošetřující lékař rozhodne, že je pro ně léčba přípravkem Aldara nejvhodnější.
Aldara krém pomáhá Vašemu imunitnímu systému tvořit tělu vlastní látky, které tělu pomáhají překonat bazocelulární karcinom, aktinickou keratózu nebo virus, který je původcem kondylomat.
2. Čemu musíte věnovat pozornost, než začnete Aldara krém používat Nepoužívejte Aldara krém
- jestliže j ste alergický(á) na imichimod (léčivou látku) nebo na kteroukoliv další složku tohoto přípravku (uvedenou v bodě 6)
Před použitím přípravku Aldara se poraďte se svým lékařem nebo lékárníkem
• Pokud jste v minulosti již užíval(a) Aldara krém či jiné podobné přípravky řekněte o tom ještě před zahájením léčby svému lékaři.
• Informujte svého lékaře, máte-li problémy s imunitou (obranyschopností).
• Nepoužívejte Aldara krém, dokud se oblast, která má být léčena, nezotavila po předchozí farmakologické nebo chirurgické léčbě.
• Zabraňte kontaktu krému s očima.
• Krém nepoužívejte do vnitřních tělních prostor.
• Nikdy nepoužívejte více krému, než Vám předepsal lékař.
• Po nanesení Aldara krému nepřikládejte na postižená místa žádné obvazy ani jiné krytí.
• Působí-li kožní reakce v místě léčby značné potíže, smyjte krém vodou s použitím jemného mýdla. Jakmile problém ustoupí, můžete opět začít krém používat.
• Pokud nemáte normální krevní obraz, informujte o tom svého lékaře.
Vzhledem ke způsobu, jakým Aldara účinkuje, je možné, že krém zhorší stávající kožní zánět v místě léčby.
• Jestliže se léčíte pro genitální bradavice (kondylomata) dbejte těchto dalších pokynů:
Muži s kondylomaty pod předkožkou musí denně stáhnout předkožku směrem dozadu a oblast pod ní umýt. Pokud není předkožka denně omývána, může dojít k jejímu zúžení, otoku a odření a její špatné posunlivosti. Pokud se u Vás tyto příznaky objeví, ihned přestaňte s léčbou a vyhledejte lékaře.
Jestliže máte otevřené rány: nezačínejte s používáním Aldara krému, dokud se tyto defekty nezahojí.
Jestliže máte vnitřní kondylomata: neaplikujte krém Aldara do močové trubice (ústí v místě odtoku moči z těla), pochvy, hrdla děložního (vnitřní ženský orgán) nebo dovnitř konečníku (řiti).
Pokud máte problémy s imunitním systémem (obranyschopností organizmu), ať v důsledku nemoci či vzhledem k již užívaným lékům, nepoužívejte Aldara krém víckrát než na jednu kúru. Domníváte-li se, že toto u Vás platí, řekněte o tom lékaři.
Jste-li HIV pozitivní, je třeba o tom informovat lékaře, protože se ukázalo, že Aldara krém nemá u HIV pacientů takový účinek. Rozhodnete-li se pro sexuální aktivitu ještě před vymizením kondylomat, nanášejte krém po pohlavním styku - nikoli před ním. Aldara krém může zeslabit kondomy a pesary, proto krém nesmí být během sexuální aktivity ponechán na kůži. Pamatujte, že Aldara krém nechrání před přenosem HIV nebo jiných sexuálně přenosných nemocí na jinou osobu.
• Jestliže se léčíte pro bazocelulární karcinom, nebo aktinickou keratózu: dbejte těchto dalších pokynů:
Během léčby Aldara krémem nepoužívejte horské slunce ani jiné způsoby slunění a co nejvíce se vyhýbejte slunečnímu světlu. Při pobytu venku noste oblečení, které Vás ochrání před sluncem, a klobouky s širokým okrajem.
Po dobu užívání Aldara krému a až do zhojení se bude léčená oblast pravděpodobně viditelně lišit od normální kůže.
Děti a dospívající
Použití u dětí a dospívajících se nedoporučuje.
Další léčivé přípravky a Aldara krém
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užívala nebo možná budete užívat.
Nejsou známy žádné léky, které by nebylo možno s Aldara krémem používat/užívat.
Těhotenství a kojení
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
Jste-li těhotná nebo se chystáte otěhotnět, musíte o tom říci lékaři. Váš lékař s Vámi prodiskutuje rizika a výhody používání Aldara krému během těhotenství. Studie na zvířatech nenaznačují žádné přímé ani nepřímé škodlivé účinky během těhotenství
Během léčby Aldara krémem nekojte, protože není známo, zda se imichimod vylučuje do mateřského mléka.
Řízení dopravních prostředků a obsluha strojů
Tento přípravek nemá žádný nebo má zanedbatelný vliv na schopnost řídit a obsluhovat stroje.
Aldara krém obsahuje methylparaben a propylparaben, cetylalkohol a sterylalkohol.
Methylparaben (E218) a propylparaben (E216) mohou způsobit alergické reakce (v některých případech oddálené). Cetylalkohol a stearylalkohol mohou způsobit lokální kožní alergické reakce (např. kontaktní dermatitidu).
3. Jak se Aldara krém používá Děti a dospívající
Použití u dětí a mladistvých se nedoporučuje.
Dospělí
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Před nanášením krému i po něm si vždy pečlivě umyjte ruce. Po nanesení Aldara krému nezakrývejte léčenou oblast žádným obvazem ani jiným krytím. Při každém nanášení krému použijte nový sáček.
Po použití všechen zbylý krém v sáčku vyhoďte. Otevřený sáček neponechávejte pro další použití v následujícím termínu.
To, jak často se krém nanáší i jak dlouho léčba trvá, je různé u genitálních bradavic (kondylomat), bazocelulárního karcinomu a aktinické keratózy (viz konkrétní pokyny pro každou z indikací).
Aldara krém Návod k Aplikaci
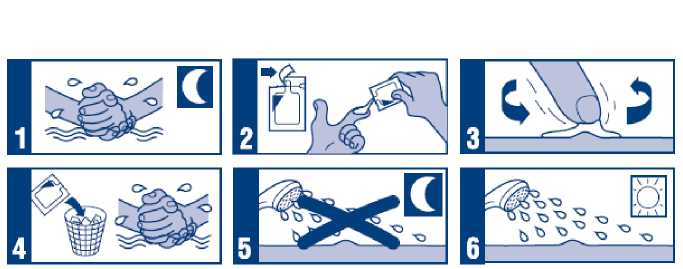
• Jestliže se léčíte pro genitální bradavice (kondylomata):
Návod k aplikaci - (pondělí, středa, pátek)
1. Před ulehnutím ke spánku si vodou a jemným mýdlem umyjte ruce. Stejně omyjte i léčenou oblast a důkladně ji osušte.
2. Otevřete nový sáček a vytlačte Aldara krém na špičku prstu.
3. Naneste tenkou vrstvu Aldara krému na čistou a suchou oblast s bradavicemi. Krém jemně vetřete do kůže, až se zcela vsákne.
4. Po nanesení krému otevřený sáček vyhoďte. Umyjte si ruce vodou a mýdlem.
5. Aldara krém ponechejte na bradavicích 6 - 10 hodin. Během této doby se nesprchujte ani nekoupejte.
6. Po 6 - 10 hodinách omyjte oblast ošetřenou Aldara krémem vodou a jemným mýdlem.
Aldara krém aplikujte 3krát týdně, například v pondělí, středu a pátek. Jeden sáček obsahuje množství krému k pokrytí plochy s kondylomaty o ploše 20 cm2.
Muži s bradavicemi (kondylomaty) pod předkožkou musí předkožku každý den stáhnout dozadu a umýt oblast pod ní (viz bod 2. „ Zvláštní opatrnost u Aldara krému:“).
Aldara krém je nutno užívat podle návodu až do úplného vymizení kondylomat (u poloviny žen, u nichž kondylomata vymizí, se tak stane za 8 týdnů, u poloviny mužů se tak obdobně stane do 12 týdnů, ale u některých pacientů mohou kondylomata zmizet již za 4 týdny).
Aldara krém nepoužívejte déle než 16 týdnů při léčbě jedné epizody kondylomat.
Jestliže máte pocit, že účinek Aldara krému je příliš silný nebo příliš slabý, řekněte to svému lékaři nebo lékárníkovi.
• Jestliže se léčíte pro bazocelulární karcinom:
Návod k aplikaci - (pondělí, úterý, středa, čtvrtek a pátek)
1. Před ulehnutím ke spánku si vodou a jemným mýdlem umyjte ruce. Stejně omyjte i léčenou oblast a důkladně ji osušte.
2. Otevřete nový sáček a vytlačte Aldara krém na špičku prstu.
3. Naneste Aldara krém na postiženou oblast a kolem ní do vzdálenosti jednoho centimetru. Krém jemně vetřete do kůže, až se zcela vsákne.
4. Po nanesení krému otevřený sáček vyhoďte. Umyjte si ruce vodou a mýdlem.
5. Aldara krém ponechejte na kůži asi 8 hodin. Během této doby se nesprchujte ani nekoupejte.
6. Po přibližně 8 hodinách omyjte oblast ošetřenou Aldara krémem vodou a jemným mýdlem.
Po dobu 6 týdnů nanášejte denně 5 po sobě jdoucích dnů v týdnu dostatečné množství Aldara krému tak, aby byla pokryta léčená oblast včetně jednoho centimetru přilehlé kůže. Např. krém nanášejte od pondělí do pátku. V sobotu a v neděli krém nenanášejte.
• Jestliže se léčíte pro aktinickou keratózu
Návod k aplikaci - (pondělí, středa, pátek)
1. Před ulehnutím ke spánku si vodou a jemným mýdlem umyjte ruce. Stejně omyjte i léčenou oblast a důkladně ji osušte.
2. Otevřete nový sáček a vytlačte Aldara krém na špičku prstu.
3. Naneste Aldara krém na postiženou oblast. Krém jemně vetřete do kůže, až se zcela vsákne.
4. Po nanesení krému otevřený sáček vyhoďte. Umyjte si ruce vodou a mýdlem.
5. Aldara krém ponechejte na kůži asi 8 hodin. Během této doby se nesprchujte ani nekoupejte.
6. Po přibližně 8 hodinách omyjte oblast ošetřenou Aldara krémem vodou a jemným mýdlem.
Aldara krém aplikujte 3krát týdně, např. v pondělí, středu a pátek. Jeden sáček obsahuje dostatečné množství krému k pokrytí plochy 25 cm2. V léčbě krémem s imichimodem pokračujte po dobu 4 týdnů. Po dalších čtyřech týdnech, kdy již krém nepoužíváte, zkontroluje léčenou kožní oblast lékař a posoudí, zda keratóza vymizela. Jestliže keratóza v léčené oblasti přetrvává, používá se krém s imichimodem další 4 týdny.
Jestliže jste použil(a) více Aldara krému, než jste měl(a):
Smyjte nadbytečný krém vodou s pomocí jemného mýdla. Po odeznění kožní reakce můžete pokračovat v léčbě.
V případě náhodného požití Aldara krému se prosím obraťte na svého lékaře.
Jestliže jste zapomněl(a) použít Aldara krém:
Pokud jste vynechal(a) dávku, naneste krém hned, jakmile si vzpomenete, a pak pokračujte ve svém pravidelném režimu.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se, prosím, svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Frekvence nežadoucích účinků je určená náesledujícím způsobem:
Velmi časté nežadoucích účinky (pravděpodobnost výskytu u více než 1 z 10 pacientů)
Časté nežadoucích účinky (pravděpodobnost výskytu u méně než 1 z 10 pacientů)
Méně časté nežadoucích účinky (pravděpodobnost výskytu u méně než 1 z 100 pacientů)
Vzácné nežadoucích účinky (pravděpodobnost výskytu u méně než 1 z 1000 pacientů)
Velmi vzácné nežadoucích účinky (pravděpodobnost výskytu u méně než 1 z 10 000 pacientů)
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Jestliže byste se v době užívání Aldara krému necítil(a) dobře, sdělte to svému lékaři nebo lékárníkovi.
Někteří pacienti pozorovali změny ve zbarvení kůže v oblasti nanášení Aldara krému. I když měly tyto změny během doby tendenci k ústupu, u části pacientů mohou být trvalé. Jestliže Vaše kůže na Aldara krém špatně reaguje, přestaňte krém nanášet, oblast omyjte vodou a jemným mýdlem a poraďte se s lékařem nebo lékárníkem.
U malého počtu pacientů došlo po léčbě Aldara krémem k určité ztrátě ochlupení v místě léčby nebo jeho okolí.
U některých jednotlivců bylo zaznamenáno snížení počtu krvinek. Toto snížení může způsobit vyšší náchylnost k infekcím, tvorbu modřin a zvýšenou únavu. Pokud zaznamenáte některý z těchto příznaků, informujte o tom svého lékaře.
Závažné kožní reakce byly hlášeny vzácně. Pokud zaznamenáte na kůži ložiska nebo skvrny, které začínají jako malé červené plošky a později vypadají jako terčíky, případně doprovázené příznaky jako je svědění, horečka, celkový pocit nemoci, bolest v kloubech, problémy s viděním, pálení, bolesti nebo svědění v očích nebo vředy v ústech, přerušte používání přípravku Aldara a ihned informujte svého lékaře.
U malého počtu pacientů došlo k vypadávání vlasů v místě léčby a jeho nejbližším okolí.
• Jestliže se léčíte pro genitální bradavice (kondylomata):
Mnohé nežádoucí účinky Aldara krému jsou dány působením krému na kůži v místě jeho nanášení.
Velmi časté účinky zahrnují zčervenání (61 % pacientů) odřeniny (30 % pacientů), šupinatění a otok kůže. Mohou se objevit i zatuhnutí a návalky pod kůží, drobné otevřené ranky a krusty během hojení. V oblasti ošetřované Aldara krémem můžete pociťovat svědění (32 % pacientů), pálení (26 % pacientů) nebo bolest (8 % pacientů). Většina těchto kožních reakcí je mírných a po ukončení léčby se kůže během dvou týdnů vrátí k normálu.
Často se u některých pacientů (4 % nebo méně) vyskytovaly bolesti hlavy, méně často horečky a příznaky, podobné chřipce, bolesti v kloubech a svalech, prolaps (výhřez) dělohy, bolesti při pohlavním styku u žen, potíže s erekcí, zvýšené pocení, pocity nevolnosti, žaludeční a střevní příznaky, zvonění v uších, návaly horka se zčervenáním, únava, závrať, migréna, brnění, končetin, nespavost, deprese, ztráta chuti k jídlu, otok mízních uzlin, bakteriální, virové a plísňové infekce (např. opary), infekce v pochvě včetně kvasinkových, kašel a nachlazení s bolestmi v krku.
Velmi vzácně došlo k těžkým a bolestivým reakcím, zejména při nanášení většího množství krému, než bylo doporučeno. Velmi vzácně se stalo, že v důsledku bolestivé kožní reakce kolem vchodu do pochvy měly ženy potíže s močením. V případě těchto problémů je nutno se ihned obrátit na lékaře.
• Jestliže se léčíte pro bazocelulární karcinom:
Mnoho nežádoucích účinků krému Aldara je důsledkem jeho lokálního působení na kůži. Lokální kožní reakce mohou být známkou správného účinkování léku.
Velmi často léčená kůže lehce svědí.
Časté účinky zahrnují: pocit mravenčení, malé otoky kůže, bolest, pálení, podráždění, krvácení, zčervenání nebo vyrážka.
Pokud by Vám kožní reakce během léčby působily značné potíže, informujte svého lékaře. Lékař Vám může doporučit, abyste si krém Aldara přestali po několik dní aplikovat (tj. abyste v léčbě udělali krátkou přestávku). Jestliže se objeví hnis nebo jiný náznak infekce, informujte svého lékaře. Kromě reakcí na kůži, další časté účinky zahrnují otok mízních uzlin a bolesti zad.
Méně často pociťují někteří pacienti změny v místě podání (sekret, zánět, otok, svrbění, rozpad kůže, puchýřky, dermatitida) nebo dráždivost, nevolnost, sucho v ústech, příznaky podobné chřipce a únavu.
• Jestliže se léčíte pro aktinickou keratózu:
Mnoho nežádoucích účinků krému Aldara je důsledkem jeho lokálního působení na kůži. Lokální kožní reakce mohou být známkou správného účinkování léku.
Velmi často léčená kůže lehce svědí.
Časté účinky zahrnují: bolest, pálení, podráždění nebo zčervenání.
Pokud by Vám kožní reakce během léčby působily značné potíže, informujte svého lékaře. Lékař Vám může doporučit, abyste si krém Aldara přestali po několik dní aplikovat (tj. abyste v léčbě udělali krátkou přestávku). Jestliže se objeví hnis nebo jiné známky infekce, řekněte o tom lékaři. Kromě reakcí na kůži, další časté účinky zahrnují bolest hlavy, nechutenství, žaludeční nevolnost, bolesti ve svalech a kloubech a únavu.
Méně často se u některých pacientů objevily změny v místě aplikace (krvácení, zánět, výtok, citlivost, otok, drobné okrsky otoku v kůži, mravenčení, strupy, jizvení, vředy, pocity horka nebo nepříjemné pocity) nebo zánět nosní sliznice, ucpání nosu, chřipku nebo příznaky připomínající chřipku, depresi, podráždění očí, otok očních víček, bolest v krku, průjem, aktinická keratóza, zčervenání, otok obličeje, vředy, bolest v končetinách, horečku, slabost nebo třes.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Aldara krém uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Uchovávejte při teplotě do 25 °C
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na obalu.
Sáčky již otevřené nelze znovu použít.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co Aldara Krém obsahuje
- Léčivou látkou je imiquimodum. Jeden sáček obsahuje 250 mg krému (100 mg krému obsahuje 5 mg imichimodu).
- Pomocné látky jsou kyselina isostearová, benzylalkohol, cetylalkohol, stearylalkohol, bílá vazelína, polysorbát 60, sorbitan-stearát, glycerol, methylparaben, propylparaben, xanthanová klovatina, čištěná voda.
Jak Aldara Krém vypadá a co obsahuje toto balení
- Jeden sáček Aldara 5% krému obsahuje 250 mg bílého až nažloutlého krému.
- Jedna krabička obsahuje 12 nebo 24 sáčků z polyester-aluminiové folie k jednorázovému použití. Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci
Meda AB Box 906 170 09 Solna Švédsko
Výrobce:
3M Health Care Limited Derby Road
Loughborough
Leicestershire
LE11 5SF, Velká Británie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci
|
Belgie/Belgique/Belgien Meda Pharma S.A./N.V. Chaussée de la Hulpe 166 Terhulpsesteenweg 1170 Brussels Tél/Tel: +32 (0)2 5 04 08 11 |
Luxembourg/Luxemburg Meda Pharma S.A./N.V. Chaussée de la Hulpe 166 Terhulpsesteenweg B-1170 Brussels Belgique / Belgien Tél/Tel: +32 (0)2 5 04 08 11 |
|
Bt^rapnn MEDA Pharmaceuticals Switzerland GmbH npegcTaBHTencTBO 3a Etnrapna OgpnH 71-75 1303 Co$Ha Ten: +35924177977 |
Magyarország MEDA PHARMA Hungary Kereskedelmi Kft. 1139 Budapest Váci ut 91 Tel: +36 1 236 3410 |
|
Česká republika MEDA Pharma s.r.o. Kodaňská 1441 / 46 100 10 Praha 10 Tel: +420 234 064 203 |
Malta Alfred Gera and Sons Ltd. 10,Triq il -Masgar Qormi QRM3217 Tel: +356 21 446205 |
|
Danmark Meda AS Solvang 8 3450 Allered Tlf: +45 44 52 88 88 |
Nederland MEDA Pharma B.V. Krijgsman 20 1186 DM Amstelveen Tel: +31 (0)20 751 65 00 |
|
Deutschland MEDA Pharma GmbH & Co. KG BenzstraEe 1 61352 Bad Homburg Tel: +49 (0) 6172 888 01 |
Norge Meda A/S Askerveien 61 1384 Asker Tlf: +47 66 75 33 00 |
|
Eesti Meda Pharma SIA Parda tn 4 10151 Tallinn Tel: +372 62 61 025 |
Osterreich MEDA Pharma GmbH Guglgasse 15 1110 Wien Tel: + 43 (0)1 86 390 0 |
|
EkXába MEDA Pharmaceuticals A.E. Enprnavíag, 3 GR-15231 XaMvSpr-AraKq Tr|^: +30 210 67 75 690 |
Polska Meda Pharmaceuticals Sp.z.o.o. ul. Domaniewska 39A02-672 Warszawa Tel: +48 22 697 7100 |
|
Espaňa Meda Pharma S.L. Avenida de Castilla, 2 Parque Empresarial San Fernando Edificio Berlín 28830 San Fernando de Henares (Madrid) Tel: +34 91 669 93 00 |
Portugal MEDA Pharma - Produtos Farmaceuticos, S.A Rua do Centro Cultural, 13 1749-066 Lisboa Tel: +351 21 842 0300 |
|
France MEDA Pharma 42 rue Washington 75008 Paris Tél: +33 (0)1 56 64 10 70 |
Románia MEDA Pharmaceuticals Switzerland Gmbh Reprezentanta Romania Calea Floreasca 141-143, et4 014467 Bucuresti Tel.: +40 21 230 90 30 |
|
Hrvatska Medical Intertrade d.o.o. Dr. Franje Tudmana 3 10431 Sveta Nedelja Tel: +385 1 3374 010 |
Slovenija MEDA Pharmaceuticals Switzerland GmbH, Podružnica Ljubljana Cesta 24. junija 23 Ljubljana Tel: +386 59 096 951 |
|
Ireland Meda Health Sales Ireland Ld Unit 34/35, Block A Dunboyne Business Park Dunboyne Co Meath Tel: +353 1 802 66 24 |
Slovenská republika MEDA Pharma spol. s. r.o. Trnavská cesta 50 821 02 Bratislava Tel: +421 2 4914 0172 |
|
Island Meda AB Box 906 170 09 Solna Svífrjóó Sími: +46 8 630 1900 |
Suomi/Finland Meda Oy Vaisalantie 4/Vaisalavagen 4 FIN-02130 Espoo/Esbo Puh/Tel: +358 20 720 9550 |
|
Italia Meda Pharma S.p.A. Via Felice Casati, 20 20124 Milano Tel: +39 039 73901 |
Sverige Meda AB Box 906 170 09 Solna Tel: +46 (0)8 630 1900 |
|
Kúnpoq Xp.r. nana^o'í'Zou AxS As©^. Ki^kí^ 35, 2234 Aaxoiá TqV +357 22 49 03 05 Latvija SIA Meda Pharma Vienibas gatve 109 Riga LV - 1058 Talr: +371 67616137 |
United Kingdom Meda Pharmaceuticals Ltd. Skyway House Parsonage Road Takeley Bishops Stortford CM22 6PU Tel.: + 44 845 460 0000 |
Lietuva
Meda Pharma SIA
Ukmergés Street 369ALT-12142 Vilnius Tel. + 370 52059367
Tato příbalová informace byla naposledy revidována:
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
33