Adasuve 4,5 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
ADASUVE 4,5 mg dávkovaný prášek k inhalaci
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden jednodávkový inhalátor obsahuje loxapinum 5 mg a dodává loxapinum 4,5 mg.
3. LÉKOVÁ FORMA
Dávkovaný prášek k inhalaci (prášek k inhalaci).
Zařízení bílé barvy s náustkem na jednom konci a vytahovací ochrannou páskou vyčnívající na druhém konci.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek ADASUVE je indikován k rychlé kontrole mírné až střední agitovanosti u dospělých pacientů se schizofrenií nebo bipolární poruchou. Pacientům je nutné ihned po zvládnutí akutních příznaků agitovanosti podat standardní léčbu
4.2 Dávkování a způsob podání
Přípravek ADASUVE se má podávat pouze v nemocničním zařízení pod dohledem zdravotnického pracovníka.
Je nutné mít k dispozici bronchodilatační léčbu beta-agonistou s krátkodobým účinkem k léčbě možných závažných respiračních nežádoucích účinků (bronchospasmu).
Dávkování
Doporučená zahajovací dávka přípravku ADASUVE je 9,1 mg. V případě potřeby lze po 2 hodinách podat druhou dávku. Nesmí se podávat více než dvě dávky.
Jestliže pacient v minulosti netoleroval dávku 9,1 mg, nebo pokud lékař rozhodne, že je vhodnější nižší dávka, lze podat nižší dávku 4,5 mg.
Během první hodiny po každé dávce je třeba pacienta sledovat s ohledem na známky a příznaky bronchospasmu.
Starší pacienti
Bezpečnost a účinnost přípravku ADASUVE u pacientů starších 65 let nebyla stanovena. Nejsou dostupné žádné údaje.
Porucha funkce ledvin a/nebo jater
Přípravek ADASUVE nebyl u pacientů s poruchou funkce ledvin nebo jater hodnocen. Nejsou dostupné žádné údaje.
Pediatrická populace
Bezpečnost a účinnost přípravku ADASUVE u dětí (mladších 18 let) nebyla stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Inhalační podání. Přípravek je balen v zataveném váčku. Důležité: přípravek je třeba uchovávat ve váčku až do vlastního použití.
Když je třeba jej použít, vyjme se přípravek z váčku. Jakmile se zatažením odstraní ochranná páska, rozsvítí se zelená kontrolka, což znamená, že je přípravek připraven k použití. (Pozor: přípravek se musí použít do 15 minut od vytažení ochranné pásky.) K podání léčivého přípravku pacient inhaluje skrz náustek plynulým hlubokým nádechem. Po dokončení inhalace si pacient vyjme náustek z úst a krátce zadrží dech. Léčivý přípravek byl podán, jestliže zelená kontrolka zhasne. Vnější část zařízení se může během použití zahřát. To je normální.
Úplné pokyny k použití přípravku ADASUVE naleznete v oddíle informací pro zdravotnické pracovníky v příbalové informaci.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na amoxapin.
Pacienti s akutními respiračními známkami/příznaky (např. sípotem) nebo s aktivním onemocněním dýchacích cest (např. pacienti s astmatem nebo chronickou obstrukční plicní nemocí [CHOPN]) (viz bod 4.4).
4.4 Zvláštní upozornění a opatření pro použití
Pro podání úplné dávky loxapinu je důležité správné použití inhalátoru ADASUVE.
Zdravotničtí pracovníci musí zajistit, aby pacient použil inhalátor správným způsobem.
Přípravek ADASUVE může mít omezenou účinnost, pokud pacienti souběžně užívají jiné léčivé přípravky, zejména další antipsychotika.
Bronchospasmus
V placebem kontrolovaných klinických studiích u subjektů s astmatem nebo CHOPN byl velmi často pozorován bronchospasmus. Pokud se objevil, obvykle byl hlášen během 25 minut po podání dávky.
Pacienty používající přípravek ADASUVE je proto nutné po podání dávky náležitě sledovat. Přípravek ADASUVE nebyl hodnocen u pacientů s jinými formami plicního onemocnění. Pokud se po léčbě přípravkem ADASUVE objeví bronchospasmus, lze jej léčit beta-agonistickým bronchodilatanciem s krátkodobým účinkem, např. salbutamolem (viz body 4.2 a 4.8). Přípravek ADASUVE se nemá znovu podávat pacientům, u nichž se rozvinuly jakékoli respirační známky/příznaky (viz bod 4.3).
Hypoventilace
Vzhledem k primárním účinkům loxapinu na centrální nervový systém (CNS) je nutné přípravek ADASUVE používat s obezřetností u pacientů s poruchou respirace, jako jsou pacienti se sníženou bdělostí nebo pacienti s depresí CNS v důsledku alkoholu nebo jiných centrálně působících léčivých přípravků, např. anxiolytik, většiny antipsychotik, hypnotik, opiátů atd. (viz bod 4.5).
Starší pacienti s psychózou související s demencí
Přípravek ADASUVE nebyl hodnocen u starších pacientů, včetně pacientů s psychózou související s demencí. Klinické studie s atypickými i konvenčními antipsychotickými léčivými přípravky prokázaly, že starší pacienti s psychózou související s demencí jsou při jejich užívání vystaveni zvýšenému riziku úmrtí v porovnání s placebem. Přípravek ADASUVE není indikován k léčbě pacientů s psychózou související s demencí.
Extrapyramidové příznaky
Extrapyramidové příznaky (včetně akutní dystonie) jsou známým účinkem třídy antipsychotik. Přípravek ADASUVE je nutné u pacientů se známými extrapyramidovými příznaky v anamnéze užívat s obezřetností.
Tardivní dyskineze
Pokud se u pacienta léčeného loxapinem objeví známky a příznaky tardivní dyskineze, je nutné zvážit přerušení léčby. Po přerušení léčby se mohou tyto příznaky přechodně zhoršit nebo se dokonce mohou objevit.
Neuroleptický maligní syndrom (NMS)
Klinickými projevy NMS jsou hyperpyrexie, svalová rigidita, změněný duševní stav a přítomnost autonomní nestability (nepravidelný pulz nebo krevní tlak, tachykardie, diaforéza a srdeční dysrytmie). Další známky mohou zahrnovat zvýšenou hladinu kreatinfosfokinázy, myoglobinurii (rabdomyolýzu) a akutní selhání ledvin. Pokud se u pacienta rozvinou známky a příznaky ukazující na NMS nebo vysoká horečka neznámé etiologie bez dalších klinických projevů NMS, musí se léčba přípravkem ADASUVE přerušit.
V krátkodobých (24hodinových) placebem kontrolovaných studiích byla hlášena mírná hypotenze u agitovaných pacientů, kterým byl podán přípravek ADASUVE. Je-li nutná vasopresorická léčba, upřednostňuje se noradrenalin nebo fenylefrin. Adrenalin se nemá používat, neboť stimulace beta-adrenergních receptorů může v podmínkách loxapinem indukované částečné blokády alfa-adrenergních receptorů hypotenzi zhoršit (viz bod 4.5).
Kardiovaskulární
Nejsou k dispozici žádné údaje o použití přípravku ADASUVE u pacientů se základním kardiovaskulárním onemocněním. Přípravek ADASUVE se nedoporučuje u populací pacientů se známým kardiovaskulárním onemocněním (infarkt myokardu nebo ischemická choroba srdeční v anamnéze, srdeční selhání nebo abnormality vedení), cerebrovaskulárním onemocněním nebo stavy, které mohou pacienty predisponovat k hypotenzi (dehydratace, hypovolemie a léčba antihypertenzivy).
Interval QT
Nezdá se, že by bylo s jednorázovou dávkou nebo s opakovanými dávkami přípravku ADASUVE spojeno klinicky relevantní prodloužení intervalu QT. Při podávání přípravku ADASUVE pacientům se známým kardiovaskulárním onemocněním nebo prodloužením intervalu QT v rodinné anamnéze a při souběžném použití s dalšími léčivými přípravky, o nichž je známo, že prodlužují interval QT, je třeba postupovat opatrně. Potenciální riziko prodloužení intervalu QT způsobené interakcí s léčivými přípravky, o nichž je známo, že prodlužují interval QT, není známo.
Záchvaty/křeče
Loxapin je nutné používat s opatrností u pacientů s křečovými poruchami v anamnéze, neboť snižuje práh pro vznik křečí. U pacientů užívajících perorálně loxapin v dávkách s antipsychotickým účinkem byly hlášeny záchvaty a ty se mohou vyskytnout u epileptických pacientů i při zachování rutinní lékové terapie antikonvulzivy (viz bod 4.5).
Anticholinergní aktivita
Vzhledem k anticholinergnímu účinku je třeba přípravek ADASUVE používat s opatrností u pacientů s glaukomem nebo sklonem k retenci moči, zejména při souběžném podávání antiparkinsonika anticholinergního typu.
Intoxikace nebo tělesné onemocnění (delirium)
Bezpečnost a účinnost přípravku ADASUVE u pacientů agitovaných v důsledku intoxikace nebo tělesného onemocnění (deliria) nebyla hodnocena. Přípravek ADASUVE je třeba používat s opatrností u pacientů, kteří jsou intoxikovaní nebo v deliriu (viz bod 4.5).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Souběžné podávání benzodiazepinů nebo jiných hypnosedativ či přípravků způsobujících respirační útlum může být spojeno s nadměrnou sedací a útlumem dýchání nebo respiračním selháním. Považuje-li se léčba benzodiazepiny za nezbytnou přídatnou léčbu k loxapinu, je třeba pacienty sledovat s ohledem na nadměrnou sedaci a ortostatickou hypotenzi.
Studie provedená s kombinovaným podáním inhalačního loxapinu a intramuskulárně podaného 1 mg lorazepamu neprokázala žádný signifikantní účinek na dechovou frekvenci, pulzní oxymetrii, krevní tlak nebo srdeční frekvenci v porovnání s monoterapií jednotlivými léčivými látkami. Podání vyšších dávek lorazepamu nebylo zkoumáno. Kombinované podání však vykazovalo aditivní účinek na sedaci.
Potenciál přípravku ADASUVE ovlivnit jiné léky
Nepředpokládá se, že by loxapin způsoboval klinicky významné farmakokinetické interakce s léčivými přípravky, které jsou buď metabolizovány izoenzymy cytochromu P450 (CYP450) nebo podléhají glukoridaci lidskou uridin 5 - difosfoglukuronosyl transferázami (UGTs).
Doporučuje se postupovat opatrně při kombinování loxapinu s jinými léčivými přípravky, o nichž je známo, že snižují záchvatový práh, např. fenothiaziny nebo butyrofenony, klozapin, tricyklická antidepresiva nebo selektivní inhibitory zpětného vychytávání serotoninu (SSRI), tramadol, meflochin (viz bod 4.4).
Studie in vitro ukázaly, že loxapin není substrátem P-glykoproteinu (P-gp), avšak inhibuje P-gp. Při terapeutických koncentracích se však nepředpokládá, že by klinicky významným způsobem inhiboval transport jiných léčivých přípravků prostřednictvím P-gp.
Vzhledem k primárním účinkům loxapinu na CNS je nutné přípravek ADASUVE používat s opatrností v kombinaci s alkoholem nebo jinými centrálně působícími léčivými přípravky, např. anxiolytiky, většinou antipsychotik, hypnotiky, opiáty atd. Použití loxapinu u pacientů intoxikovaných alkoholem nebo léčivými přípravky (ať už předepsanými nebo nelegálními léčivými přípravky) nebylo hodnoceno. Loxapin může způsobit závažnou respirační depresi, pokud se kombinuje s dalšími přípravky, které tlumí CNS (viz bod 4.4).
Potenciál jiných léků ovlivnit přípravek ADASUVE
Loxapin je substrátem monooxygenáz obsahujících flavin a několika izoenzymů CYP450 (viz bod 5.2).
Proto je riziko metabolických interakcí způsobených účinkem na jednotlivou izoformu omezené. U pacientů, kteří jsou souběžně léčeni dalšími léčivými přípravky, které jsou buď inhibitory, nebo induktory těchto enzymů, je třeba postupovat opatrně, zejména pokud je o souběžném léčivém přípravku známo, že inhibuje nebo indukuje několik z enzymů podílejících se na metabolismu loxapinu. Takové léčivé přípravky mohou změnit bezpečnost a účinnost přípravku ADASUVE nepředvídaným způsobem. Je třeba se vyvarovat souběžného podávání inhibitorů CYP1A2 (např. fluvoxaminu, ciprofloxacinu, enoxacinu, propranolu a refekoxibu), je-li to možné.
Adrenalin
Souběžné podávání loxapinu a adrenalinu může způsobit zhoršení hypotenze (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
U novorozenců, kteří byli opakovaně vystaveni antipsychotikům během třetího trimestru těhotenství, existuje po porodu riziko nežádoucích účinků zahrnujících extrapyramidové a/nebo abstinenční příznaky, které se mohou lišit v závažnosti a době trvání. Byly hlášeny případy agitovanosti, hypertonie, hypotonie, tremoru, somnolence, respirační tísně nebo poruchy výživy Je proto nutné zvážit sledování novorozenců. Přípravek ADASUVE by se měl v těhotenství používat, pouze pokud jeho potenciální přínos ospravedlňuje potenciální riziko pro plod.
Kojení
Rozsah vylučování loxapinu nebo jeho metabolitů do lidského mateřského mléka není znám. Bylo však prokázáno, že loxapin a jeho metabolity přecházejí do mléka laktujících fen. Pacientky je třeba poučit, aby po užití loxapinu po dobu 48 hodin nekojily a aby zlikvidovaly mléko, které se během této doby vytvoří.
Fertilita
Nejsou k dispozici žádné specifické údaje o účinku loxapinu na fertilitu u člověka. Je známo, že u lidí může dlouhodobá léčba antipsychotiky vést ke ztrátě libida a amenoree. U samic potkanů byly pozorovány účinky na reprodukci (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie účinků loxapinu na schopnost řídit a obsluhovat stroje. Vzhledem k potenciálu přípravku vyvolat sedaci/somnolenci, únavu nebo závratě by pacienti neměli obsluhovat nebezpečné stroje, včetně motorových vozidel, dokud si nejsou dostatečně jistí, že je loxapin neovlivňuje nežádoucím způsobem (viz bod 4.8). Přípravek ADASUVE má výrazný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Vyhodnocení nežádoucích účinků na základě údajů z klinických studií vychází z krátkodobých (24hodinových) placebem kontrolovaných klinických studií, z nichž dvě byly fáze III a jedna fáze IIA. Do těchto studií bylo zařazeno 524 dospělých pacientů s agitovaností spojenou se schizofrenií (včetně 27 pacientů se schizoafektivní poruchou) nebo bipolární poruchou, léčených přípravkem ADASUVE 4,5 mg (265 pacientů) nebo ADASUVE 9,1 mg (259 pacientů).
Ve studiích na agitovaných pacientech byl hlášen bronchospasmus jako méně častý, ale závažný nežádoucí účinek, zatímco u pacientů s aktivním onemocněním dýchacích cest byl bronchospasmus hlášen často a často vyžadoval léčbu beta-agonistickým bronchodilatanciem s krátkodobým účinkem. Nejčastěji hlášenými nežádoucími účinky během léčby přípravkem ADASUVE byly dysgeuzie, sedace/somnolence a závratě (závratě byly častější po léčbě placebem než po léčbě loxapinem).
Tabulkový přehled nežádoucích účinků
Níže uvedené nežádoucí účinky jsou rozděleny do kategorií následujícím způsobem: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1 000 až < 1/100); vzácné (> 1/10 000 až < 1/1 000); velmi vzácné (< 1/10 000).
Tabulka 1: Nežádoucí účinky
Třídy orgánových systémů podle databáze MedDRA_
Poruchy nervového systému
Velmi časté: sedace/somnolence Časté: závrať
Méně časté: dystonie, dyskineze, okulogyrie, tremor, akatizie/neklid Cévní poruchy
Méně časté: hypotenze_
Respirační, hrudní a mediastinální poruchy
Časté: podráždění v krku
Méně časté: bronchospasmus (včetně dušnosti)_
Gastrointestinální poruchy
Velmi časté: dysgeuzie
Časté: suchá ústa_
Celkové poruchy a reakce v místě aplikace
Časté: únava
Popis vybraných nežádoucích účinků
Bronchospasmus
V krátkodobých (24hodinových) placebem kontrolovaných studiích s pacienty s agitovaností spojenou se schizofrenií nebo bipolární poruchou bez aktivního onemocnění dýchacích cest byl bronchospasmus (což zahrnuje hlášení sípotu, dušnosti nebo kašle) u pacientů léčených přípravkem ADASUVE méně častý. Nicméně v placebem kontrolovaných klinických studiích s pacienty s mírným až středně závažným přetrvávajícím astmatem nebo středně závažnou až závažnou CHOPN byly nežádoucí účinky ve formě bronchospasmu hlášeny velmi často. K většině těchto příhod došlo do 25 minut od podání dávky, byly mírné až středně závažné a bylo možné je zmírnit inhalací bronchodilatancia.
Nežádoucí účinky pozorované při dlouhodobém perorálním podávání loxapinu
Při dlouhodobém perorálním podávání loxapinu zahrnovaly hlášené nežádoucí účinky sedaci a ospalost, extrapyramidové příznaky (např. tremor, akatizii, rigiditu a dystonii), kardiovaskulární účinky (např. tachykardii, hypotenzi, hypertenzi, ortostatickou hypotenzi, závrať a synkopu) a anticholinergní účinky (např. suché oči, rozmazané vidění a retenci moči).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
V klinických studiích nebyly hlášeny žádné případy předávkování přípravkem ADASUVE.
V případě náhodného předávkování budou známky a příznaky záviset na počtu použitých jednotek a individuální snášenlivosti pacienta. Jak lze předpokládat na základě farmakologického působení loxapinu, mohou se klinické nálezy pohybovat od mírné deprese CNS a kardiovaskulárního systému až po hlubokou hypotenzi, respirační depresi a bezvědomí (viz bod 4.4). Je třeba mít na paměti možnost výskytu extrapyramidových příznaků a/nebo záchvatů křečí. Rovněž bylo hlášeno selhání ledvin po předávkování perorálním loxapinem.
Léčba předávkování je v zásadě symptomatická a podpůrná. Jako odpověď na podání noradrenalinu nebo fenylefrinu lze očekávat závažnou hypotenzi. Adrenalin se nemá používat, neboť jeho použití u pacienta s částečnou adrenergní blokádou může ještě více snížit krevní tlak (viz body 4.4 a 4.5). Závažné extrapyramidové reakce je nutné léčit anticholinergními antiparkinsoniky nebo difenhydramin-hydrochloridem a v případě indikace je třeba zahájit antikonvulzivní léčbu. Další opatření zahrnují podávání kyslíku a intravenózních tekutin.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: psycholeptika, antipsychotika; ATC kód: N05AH01
Má se za to, že účinnost loxapinu je zprostředkována antagonismem o vysoké afinitě k dopaminovým D2 receptorům a serotoninovým 5-HT2A receptorům. Loxapin se váže na noradrenergní, histaminergní a cholinergní receptory a jeho interakce s těmito systémy může ovlivnit spektrum jeho farmakologických účinků.
U několika zvířecích druhů byly pozorovány změny v míře excitability subkortikálních inhibičních oblastí spojené se zklidňujícími účinky a potlačením agresivního chování.
Klinická, účinnost
Do dvou studií fáze III byli zařazeni pacienti, kteří trpěli akutní agitovaností alespoň středního stupně (skóre 14 nebo vyšší podle škály PANSS-EC, Positive and Negative Syndrome Scale Excited Component) (špatná kontrola impulzů, tenze, hostilita, nespolupráce a vzrušení). Zařazení do studie 004-301 vyžadovalo diagnózu schizofrenie. Zařazení do studie 004-302 vyžadovalo diagnózu bipolární poruchy (stávající epizoda manická nebo smíšená). Pacienti trpěli významným a dlouhodobým psychiatrickým onemocněním (Diagnostic and Statistical Manual of Mental Disorders [Diagnostická a statistická příručka duševních poruch], 4. vydání (DSM-IV)) na základě počtu let od stanovení diagnózy a předchozích hospitalizací. Pacienti byli randomizováni do skupin léčených placebem, přípravkem ADASUVE 4,5 mg a přípravkem ADASUVE 9,1 mg.
Střední věk randomizovaných pacientů činil 43,1 let ve studii 004-301 a 40,8 let ve studii 004-302: mladí dospělí (ve věku 18-25 let) byli v obou studiích zastoupeni málo (7,3 %). Ve studii schizofrenie byly ženy málo zastoupeny (26,5 %) a ve studii 004-302 byla přibližně polovina pacientů muži (49,7 %). Přibližně 35 % pacientů se schizofrenií užívalo souběžná antipsychotika v době podání přípravku, zatímco u pacientů s bipolární poruchou tyto léky užívalo přibližně 13 %. Většina pacientů v obou studiích fáze III byli kuřáci, přičemž přibližně 82 % pacientů se schizofrenií a 74 % pacientů s bipolární poruchou v dané době kouřilo.
Pokud po první dávce agitovanost dostatečně neodezněla, byla nejméně o 2 hodiny později podána dávka druhá. V případě potřeby byla podána třetí dávka, nejméně 4 hodiny po dávce druhé. V případě nutnosti byla podána záchranná medikace (intramuskulárně lorazepam). Primárním cílovým parametrem byla absolutní změna ve skóre PANSS-EC od výchozí hodnoty po 2 hodinách od podání první dávky pro obě dávkování přípravku ADASUVE v porovnání s placebem. Mezi další cílové parametry patřilo skóre PANSS-EC a počet respondérů dle škály CGI-I (Clinical Global Impression - Improvement) po 2 hodinách od podání první dávky a celkový počet pacientů v každé skupině, kterým byla podána 1, 2 nebo 3 dávky hodnoceného léčivého přípravku se záchrannou medikací a bez ní. Za respondéry se považovali pacienti s > 40% poklesem celkového skóre PANSS-EC oproti výchozí hodnotě nebo pacienti se skóre 1 (velmi velké zlepšení) nebo skóre 2 (velké zlepšení) podle škály CGI-I.
Snížení agitovanosti bylo evidentní 10 minut po podání první dávky, což byl první časový bod hodnocení, a při všech dalších hodnoceních během 24hodinového evaluačního období, jak pro dávku 4,5 mg, tak pro dávku 9,1 mg u pacientů se schizofrenií i s bipolární poruchou.
Vyšetření podskupin v populaci (podle věku, rasy a pohlaví) neodhalilo žádné rozdíly ve schopnosti reagovat na léčbu na základě těchto podskupin.
Hlavní výsledky naleznete v tabulce níže.
Hlavní výsledky pivotních studií účinnosti: porovnání mezi přípravkem ADASUVE 4,5 mg, 9,1 mg a placebem
|
Studie Pacienti |
004-301 |
004-302 Bipolární porucha | |||||
|
Léčba N |
PBO 115 |
4,5 mg 116 |
9,1 mg 112 |
PBO 105 |
4,5 mg 104 |
9,1 mg 105 | |
|
Změna PANSS-EC |
Výchozí hodnota |
17,4 |
17,8 |
17,6 |
17,7 |
17,4 |
17,3 |
|
Změna za 2 hod od podání dávky |
-5,5 |
-8,1+ |
-8,6* |
-4,9 |
-8,1* |
-9,0* | |
|
SD |
4,9 |
5,2 |
4,4 |
4,8 |
4,9 |
4,7 | |
|
a 5 U §. a, w í Pí 3 |
30 min po podání dávky |
27,8 % |
46,6 % |
57,1 % |
23,8 % |
59,6 % |
61,9 % |
|
2 hod po podání dávky |
38,3 % |
62,9 % |
69,6 % |
27,6 % |
62,5 % |
73,3 % | |
|
>C NN ■ -o w s O S 3 |
% respondérů dle CGI-I |
35,7 % |
57,4 % |
67,0 % |
27,6 % |
66,3 % |
74,3 % |
|
Počet nutných dávek |
Jedna |
46,1 % |
54,4 % |
60,9 % |
26,7 % |
41,3 % |
61,5 % |
|
Dvě |
29,6 % |
30,7 % |
26,4 % |
41,0 % |
44,2 % |
26,0 % | |
|
Tři |
8,7 % |
8,8 % |
7,3 % |
11,4 % |
5,8 % |
3,8 % | |
|
Záchranná medikace |
15,6 % |
6,1 % |
5,4 % |
21,0 % |
8,6 % |
8,6 % | |
*= p < 0,0001 += p < 0,01
Respondéři dle PAnSs-EC = > 40% změna oproti výchozí hodnotě PANSS-EC Respondéři dle CGI-I = skóre 1 (velmi velké zlepšení) nebo skóre 2 (velké zlepšení) PBO = placebo SD = standardní odchylka
V podpůrné studii fáze II s podáním jednorázové dávky, do níž bylo zařazeno celkem 129 pacientů se schizofrenií a schizoafektivní poruchou činil pokles PANSS-EC po 2 hodinách -5,0 u placeba, -6,7 u přípravku ADASUVE 4,5 mg a -8,6 (p < 0,001) u přípravku ADASUVE 9,1 mg. Záchranná medikace byla podána 32,6 %, 11,1 %, respektive 14,6 % pacientů.
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem ADASUVE u podskupiny pediatrické populace od narození do méně než 12 let věku v léčbě schizofrenie a u podskupiny od narození do méně než 10 let věku v léčbě bipolární poruchy (informace o použití u dětí viz bod 4.2).
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem ADASUVE u podskupiny pediatrické populace ve věku od 12 let do méně než 18 let v léčbě schizofrenie a u podskupiny ve věku od 10 let do méně než 18 let v léčbě bipolární poruchy (informace o použití u dětí viz bod 4.2).
Absorpce
Podání přípravku ADASUVE vedlo k rychlé absorpci loxapinu s mediánem doby maximální plazmatické koncentrace (tmax) 2 minuty. Expozice loxapinu v prvních 2 hodinách po podání (AUC0-2h, měřítko časné expozice, která souvisí s nástupem léčebného účinku) činila 25,6 ng*h/ml u dávky 4,5 mg a 66,7 ng*h/ml u dávky 9,1 mg u zdravých subjektů.
Farmakokinetické parametry loxapinu byly stanoveny po opakovaném podání přípravku ADASUVE každé 4 hodiny, celkem 3 dávek (buď 4,5 mg nebo 9,1 mg), subjektům léčených v dlouhodobém stabilním režimu antipsychotiky. Střední hodnoty maximální plazmatické koncentrace byly podobné po první a třetí dávce přípravku ADASUVE, což ukazuje na minimální akumulaci během 4hodinového intervalu mezi dávkami.
Distribuce v organismu
Loxapin je rychle vychytáván z plazmy a distribuován do tkání. Studie na zvířatech po perorálním podání naznačují úvodní přednostní distribuci do plic, mozku, sleziny, srdce a ledvin. Loxapin se z 96,6 % váže na lidské plazmatické bílkoviny.
Biotransformace
Loxapin je ve velké míře metabolizován v játrech, přičemž vzniká několik metabolitů. Hlavní metabolická dráha zahrnuje hydroxylaci, při níž vzniká 8-OH-loxapin a 7-OH-loxapin, N-oxidaci, při níž vzniká N-oxid loxapinu, a demethylaci, při které vzniká amoxapin. Pořadí metabolitů pozorované u přípravku ADASUVE u lidí (na základě systémové expozice) bylo 8-OH-loxapin > N-oxid loxapinu > 7-OH-loxapin > amoxapin, přičemž plazmatické hladiny 8-OH-loxapinu se podobaly hladinám původní sloučeniny. 8-OH-loxapin není farmakologicky aktivní na receptoru D2, zatímco méně častý metabolit 7-OH-loxapin má vysokou vazebnou afinitu k receptorům D2.
Loxapin je substrátem pro několik izoenzymů CYP450. Studie in vitro prokázaly, že 7-OH-loxapin je vytvářen zejména izoenzymy CYP3A4 a CYP2D6, 8-OH-loxapin je vytvářen zejména izoenzymem CYP1A2, amoxapin je vytvářen zejména izoenzymy CYP3A4, CYP2C19 a CYP2C8 a N-oxid loxapinu je vytvářen monooxygenázami obsahujícími flavin.
Potenciál loxapinu a jeho metabolitů (amoxipan, 7-OH-loxapin, 8-OH-loxapin a loxapin-N-oxid) inhibovat metabolismus léčivých přípravků zprostředkovaný CYP450 byl zkoumán in vitro u izoenzymů CYP 1A1, 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1a 3A4. Nebyla pozorována žádná významná inhibice. In vitro studie ukázaly, že loxapin a 8-OH-loxapin nejsou v klinicky používaných koncentracích induktory enzymů CYP1A2, 2B6 nebo 3A4. Navíc, in vitro studie ukazují, že loxapin a 8-OH-loxapin neinhibují UGT1A1,
1A3, 1A4, 2B7 a 2B15.
Eliminace z organismu
K vylučování loxapinu dochází převážně v prvních 24 hodinách. Metabolity se vylučují v moči ve formě konjugátů a ve stolici v nekonjugované formě. Terminální eliminační poločas (t/2) se pohyboval v rozmezí 6 až 8 hodin.
Linearita/nelinearita
Střední plazmatické koncentrace loxapinu po podání přípravku ADASUVE byly v rozmezí klinických dávek lineární. Hodnoty AUC0-2h, AUCinf, a Cmax se zvyšovaly v závislosti na dávce.
Kuřáci
Populační farmakokinetická analýza, která porovnávala expozici u kuřáků oproti nekuřákům, ukázala, že kouření, které indukuje izoenzym CYP1A2, mělo minimální vliv na expozici přípravku ADASUVE. Nedoporučuje se žádná úprava dávkování v závislosti na tom, zda pacient kouří nebo ne.
U kuřaček je expozice (AUCinf) přípravku ADASUVE a jeho aktivnímu metabolitu 7-OH-loxapinu nižší než u nekuřaček (84% oproti 109% poměr 7-OH-loxapin/loxapin), což je pravděpodobně způsobeno zvýšením clearance loxapinu u kuřaček.
Demografické údaje
Nevyskytly se žádné významné rozdíly v expozici nebo dispozici loxapinu po podání přípravku ADASUVE, které by souvisely s věkem, pohlavím, rasou, tělesnou hmotností nebo indexem tělesné hmotnosti (BMI).
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje o bezpečnosti získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání a genotoxicity neodhalily žádné zvláštní riziko pro člověka s výjimkou změn v reprodukčních tkáních souvisejících s prodlouženým farmakologickým účinkem loxapinu. Podobné změny, např. gynekomastie, jsou u člověka známé, ale pouze po dlouhodobém podávání léků způsobujících hyperprolaktinémii.
Samice potkanů se nepářily v důsledku přetrvávajícího diestru po perorální léčbě loxapinem. Studie embryonálního/fetálního vývoje a perinatální studie ukázaly známky opožděného vývoje (snížená tělesná hmotnost, opožděná osifikace, hydronefróza, hydroureter a/nebo rozšířená ledvinná pánvička s omezeným počtem papil nebo chybějícími papilami) a rovněž zvýšený počet úmrtí v perinatálním stadiu a úmrtí novorozenců v potomstvu potkanů léčených od poloviny březosti perorálními dávkami přípravku ADASUVE, které byly nižší než maximální doporučená dávka pro člověka v přepočtu mg/m2 (viz bod 4.6).
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Žádné
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v původním váčku až do vlastního použití, aby byl přípravek chráněn před světlem a vlhkostí. Tento léčivý přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Přípravek ADASUVE se dodává v zataveném, vícevrstvém váčku z hliníkové folie. Přípravek ADASUVE 4,5 mg se dodává v krabičce obsahující 1 nebo 5 jednotek.
Bílý inhalátor (kryt) je odlit ze zdravotnického polykarbonátu.
6.6 Zvláštní opatření pro likvidaci přípravku
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Ferrer International, S.A.
Gran Vía Carlos III, 94 08028- Barcelona Španělsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/13/823/001 (5 jednodávkových inhalátorů)
EU/1/13/823/003 (1 jednodávkový inhalátor)
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 20. Února 2013
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu.
NÁZEV PŘÍPRAVKU
1.
ADASUVE 9,1 mg dávkovaný prášek k inhalaci
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden jednodávkový inhalátor obsahuje loxapinum 10 mg a dodává loxapinum 9,1 mg.
3. LÉKOVÁ FORMA
Dávkovaný prášek k inhalaci (prášek k inhalaci).
Zařízení bílé barvy s náustkem na jednom konci a vytahovací ochrannou páskou vyčnívající na druhém konci.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek ADASUVE je indikován k rychlé kontrole mírné až střední agitovanosti u dospělých pacientů se schizofrenií nebo bipolární poruchou. Pacientům je nutné ihned po zvládnutí akutních příznaků agitovanosti podat standardní léčbu.
4.2 Dávkování a způsob podání
Přípravek ADASUVE se má podávat pouze v nemocničním zařízení pod dohledem zdravotnického pracovníka.
Je nutné mít k dispozici bronchodilatační léčbu beta-agonistou s krátkodobým účinkem k léčbě možných závažných respiračních nežádoucích účinků (bronchospasmu).
Dávkování
Doporučená zahajovací dávka přípravku ADASUVE je 9,1 mg. V případě potřeby lze po 2 hodinách podat druhou dávku. Nesmí se podávat více než dvě dávky.
Jestliže pacient v minulosti netoleroval dávku 9,1 mg, nebo pokud lékař rozhodne, že je vhodnější nižší dávka, lze podat nižší dávku 4,5 mg.
Během první hodiny po každé dávce je třeba pacienta sledovat s ohledem na známky a příznaky bronchospasmu.
Starší pacienti
Bezpečnost a účinnost přípravku ADASUVE u pacientů starších 65 let nebyla stanovena. Nejsou dostupné žádné údaje.
Porucha funkce ledvin a/nebo jater
Přípravek ADASUVE nebyl u pacientů s poruchou funkce ledvin nebo jater hodnocen. Nejsou dostupné žádné údaje.
Pediatrická populace
Bezpečnost a účinnost přípravku ADASUVE u dětí (mladších 18 let) nebyla stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Inhalační podání. Přípravek je balen v zataveném váčku. Důležité: přípravek je třeba uchovávat ve váčku až do vlastního použití.
Když je třeba jej použít, vyjme se přípravek z váčku. Jakmile se zatažením odstraní ochranná páska, rozsvítí se zelená kontrolka, což znamená, že je přípravek připraven k použití. (Pozor: přípravek se musí použít do 15 minut od vytažení ochranné pásky.) K podání léčivého přípravku pacient inhaluje skrz náustek plynulým hlubokým nádechem. Po dokončení inhalace si pacient vyjme náustek z úst a krátce zadrží dech. Léčivý přípravek byl podán, jestliže zelená kontrolka zhasne. Vnější část zařízení se může během použití zahřát. To je normální.
Úplné pokyny k použití přípravku ADASUVE naleznete v oddíle informací pro zdravotnické pracovníky v příbalové informaci.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na amoxapin.
Pacienti s akutními respiračními známkami/příznaky (např. sípotem) nebo s aktivním onemocněním dýchacích cest (např. pacienti s astmatem nebo chronickou obstrukční plicní nemocí [CHOPN]) (viz bod 4.4).
4.4 Zvláštní upozornění a opatření pro použití
Pro podání úplné dávky loxapinu je důležité správné použití inhalátoru ADASUVE.
Zdravotničtí pracovníci musí zajistit, aby pacient použil inhalátor správným způsobem.
Přípravek ADASUVE může mít omezenou účinnost, pokud pacienti souběžně užívají jiné léčivé přípravky, zejména další antipsychotika.
Bronchospasmus
V placebem kontrolovaných klinických studiích u subjektů s astmatem nebo CHOPN byl velmi často pozorován bronchospasmus. Pokud se objevil, obvykle byl hlášen během 25 minut po podání dávky.
Pacienty používající přípravek ADASUVE je proto nutné po podání dávky náležitě sledovat. Přípravek ADASUVE nebyl hodnocen u pacientů s jinými formami plicního onemocnění. Pokud se po léčbě přípravkem ADASUVE objeví bronchospasmus, lze jej léčit beta-agonistickým bronchodilatanciem s krátkodobým účinkem, např. salbutamolem (viz body 4.2 a 4.8). Přípravek ADASUVE se nemá znovu podávat pacientům, u nichž se rozvinuly jakékoli respirační známky/příznaky (viz bod 4.3).
Hypoventilace
Vzhledem k primárním účinkům loxapinu na centrální nervový systém (CNS) je nutné přípravek ADASUVE používat s obezřetností u pacientů s poruchou respirace, jako jsou pacienti se sníženou bdělostí nebo pacienti s depresí CNS v důsledku alkoholu nebo jiných centrálně působících léčivých přípravků, např. anxiolytik, většiny antipsychotik, hypnotik, opiátů atd. (viz bod 4.5).
Starší pacienti s psychózou související s demencí
Přípravek ADASUVE nebyl hodnocen u starších pacientů, včetně pacientů s psychózou související s demencí. Klinické studie s atypickými i konvenčními antipsychotickými léčivými přípravky prokázaly, že starší pacienti s psychózou související s demencí jsou při jejich užívání vystaveni zvýšenému riziku úmrtí v porovnání s placebem. Přípravek ADASUVE není indikován k léčbě pacientů s psychózou související s demencí.
Extrapyramidové příznaky
Extrapyramidové příznaky (včetně akutní dystonie) jsou známým účinkem třídy antipsychotik. Přípravek ADASUVE je nutné u pacientů se známými extrapyramidovými příznaky v anamnéze užívat s obezřetností.
Tardivní dyskineze
Pokud se u pacienta léčeného loxapinem objeví známky a příznaky tardivní dyskineze, je nutné zvážit přerušení léčby. Po přerušení léčby se mohou tyto příznaky přechodně zhoršit nebo se dokonce mohou objevit.
Neuroleptický maligní syndrom (NMS)
Klinickými projevy NMS jsou hyperpyrexie, svalová rigidita, změněný duševní stav a přítomnost autonomní nestability (nepravidelný pulz nebo krevní tlak, tachykardie, diaforéza a srdeční dysrytmie). Další známky mohou zahrnovat zvýšenou hladinu kreatinfosfokinázy, myoglobinurii (rabdomyolýzu) a akutní selhání ledvin. Pokud se u pacienta rozvinou známky a příznaky ukazující na NMS nebo vysoká horečka neznámé etiologie bez dalších klinických projevů NMS, musí se léčba přípravkem ADASUVE přerušit.
V krátkodobých (24hodinových) placebem kontrolovaných studiích byla hlášena mírná hypotenze u agitovaných pacientů, kterým byl podán přípravek ADASUVE. Je-li nutná vasopresorická léčba, upřednostňuje se noradrenalin nebo fenylefrin. Adrenalin se nemá používat, neboť stimulace beta-adrenergních receptorů může v podmínkách loxapinem indukované částečné blokády alfa-adrenergních receptorů hypotenzi zhoršit (viz bod 4.5).
Kardiovaskulární
Nejsou k dispozici žádné údaje o použití přípravku ADASUVE u pacientů se základním kardiovaskulárním onemocněním. Přípravek ADASUVE se nedoporučuje u populací pacientů se známým kardiovaskulárním onemocněním (infarkt myokardu nebo ischemická choroba srdeční v anamnéze, srdeční selhání nebo abnormality vedení), cerebrovaskulárním onemocněním nebo stavy, které mohou pacienty predisponovat k hypotenzi (dehydratace, hypovolemie a léčba antihypertenzivy).
Interval QT
Nezdá se, že by bylo s jednorázovou dávkou nebo s opakovanými dávkami přípravku ADASUVE spojeno klinicky relevantní prodloužení intervalu QT. Při podávání přípravku ADASUVE pacientům se známým kardiovaskulárním onemocněním nebo prodloužením intervalu QT v rodinné anamnéze a při souběžném použití s dalšími léčivými přípravky, o nichž je známo, že prodlužují interval QT, je třeba postupovat opatrně. Potenciální riziko prodloužení intervalu QT způsobené interakcí s léčivými přípravky, o nichž je známo, že prodlužují interval QT, není známo.
Záchvaty/křeče
Loxapin je nutné používat s opatrností u pacientů s křečovými poruchami v anamnéze, neboť snižuje práh pro vznik křečí. U pacientů užívajících perorálně loxapin v dávkách s antipsychotickým účinkem byly hlášeny záchvaty a ty se mohou vyskytnout u epileptických pacientů i při zachování rutinní lékové terapie antikonvulzivy (viz bod 4.5).
Anticholinergní aktivita
Vzhledem k anticholinergnímu účinku je třeba přípravek ADASUVE používat s opatrností u pacientů s glaukomem nebo sklonem k retenci moči, zejména při souběžném podávání antiparkinsonika anticholinergního typu.
Intoxikace nebo tělesné onemocnění (delirium)
Bezpečnost a účinnost přípravku ADASUVE u pacientů agitovaných v důsledku intoxikace nebo tělesného onemocnění (deliria) nebyla hodnocena. Přípravek ADASUVE je třeba používat s opatrností u pacientů, kteří jsou intoxikovaní nebo v deliriu (viz bod 4.5).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Souběžné podávání benzodiazepinů nebo jiných hypnosedativ či přípravků způsobujících respirační útlum může být spojeno s nadměrnou sedací a útlumem dýchání nebo respiračním selháním. Považuje-li se léčba benzodiazepiny za nezbytnou přídatnou léčbu k loxapinu, je třeba pacienty sledovat s ohledem na nadměrnou sedaci a ortostatickou hypotenzi.
Studie provedená s kombinovaným podáním inhalačního loxapinu a intramuskulárně podaného 1 mg lorazepamu neprokázala žádný signifikantní účinek na dechovou frekvenci, pulzní oxymetrii, krevní tlak nebo srdeční frekvenci v porovnání s monoterapií jednotlivými léčivými látkami. Podání vyšších dávek lorazepamu nebylo zkoumáno. Kombinované podání však vykazovalo aditivní účinek na sedaci.
Potenciál přípravku ADASUVE ovlivnit jiné léky
Nepředpokládá se, že by loxapin způsoboval klinicky významné farmakokinetické interakce s léčivými přípravky, které jsou buď metabolizovány izoenzymy cytochromu P450 (CYP450) nebo podléhají glukoridaci lidskou uridin 5 - difosfoglukuronosyl transferázami (UGTs).
Doporučuje se postupovat opatrně při kombinování loxapinu s jinými léčivými přípravky, o nichž je známo, že snižují záchvatový práh, např. fenothiaziny nebo butyrofenony, klozapin, tricyklická antidepresiva nebo selektivní inhibitory zpětného vychytávání serotoninu (SSRI), tramadol, meflochin (viz bod 4.4).
Studie in vitro ukázaly, že loxapin není substrátem P-glykoproteinu (P-gp), avšak inhibuje P-gp. Při terapeutických koncentracích se však nepředpokládá, že by klinicky významným způsobem inhiboval transport jiných léčivých přípravků prostřednictvím P-gp.
Vzhledem k primárním účinkům loxapinu na CNS je nutné přípravek ADASUVE používat s opatrností v kombinaci s alkoholem nebo jinými centrálně působícími léčivými přípravky, např. anxiolytiky, většinou antipsychotik, hypnotiky, opiáty atd. Použití loxapinu u pacientů intoxikovaných alkoholem nebo léčivými přípravky (ať už předepsanými nebo nelegálními léčivými přípravky) nebylo hodnoceno. Loxapin může způsobit závažnou respirační depresi, pokud se kombinuje s dalšími přípravky, které tlumí CNS (viz bod 4.4).
Potenciál jiných léků ovlivnit přípravek ADASUVE
Loxapin je substrátem monooxygenáz obsahujících flavin a několika izoenzymů CYP450 (viz bod 5.2).
Proto je riziko metabolických interakcí způsobených účinkem na jednotlivou izoformu omezené. U pacientů, kteří jsou souběžně léčeni dalšími léčivými přípravky, které jsou buď inhibitory, nebo induktory těchto enzymů, je třeba postupovat opatrně, zejména pokud je o souběžném léčivém přípravku známo, že inhibuje nebo indukuje několik z enzymů podílejících se na metabolismu loxapinu. Takové léčivé přípravky mohou změnit bezpečnost a účinnost přípravku ADASUVE nepředvídaným způsobem. Je třeba se vyvarovat souběžného podávání inhibitorů CYP1A2 (např. fluvoxaminu, ciprofloxacinu, enoxacinu, propranolu a refekoxibu), je-li to možné.
Adrenalin
Souběžné podávání loxapinu a adrenalinu může způsobit zhoršení hypotenze (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
U novorozenců, kteří byli opakovaně vystaveni antipsychotikům během třetího trimestru těhotenství, existuje po porodu riziko nežádoucích účinků zahrnujících extrapyramidové a/nebo abstinenční příznaky, které se mohou lišit v závažnosti a době trvání. Byly hlášeny případy agitovanosti, hypertonie, hypotonie, tremoru, somnolence, respirační tísně nebo poruchy výživy Je proto nutné zvážit sledování novorozenců. Přípravek ADASUVE by se měl v těhotenství používat, pouze pokud jeho potenciální přínos ospravedlňuje potenciální riziko pro plod.
Kojení
Rozsah vylučování loxapinu nebo jeho metabolitů do lidského mateřského mléka není znám. Bylo však prokázáno, že loxapin a jeho metabolity přecházejí do mléka laktujících fen. Pacientky je třeba poučit, aby po užití loxapinu po dobu 48 hodin nekojily a aby zlikvidovaly mléko, které se během této doby vytvoří.
Fertilita
Nejsou k dispozici žádné specifické údaje o účinku loxapinu na fertilitu u člověka. Je známo, že u lidí může dlouhodobá léčba antipsychotiky vést ke ztrátě libida a amenoree. U samic potkanů byly pozorovány účinky na reprodukci (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie účinků loxapinu na schopnost řídit a obsluhovat stroje. Vzhledem k potenciálu přípravku vyvolat sedaci/somnolenci, únavu nebo závratě by pacienti neměli obsluhovat nebezpečné stroje, včetně motorových vozidel, dokud si nejsou dostatečně jistí, že je loxapin neovlivňuje nežádoucím způsobem (viz bod 4.8). Přípravek ADASUVE má výrazný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Vyhodnocení nežádoucích účinků na základě údajů z klinických studií vychází z krátkodobých (24hodinových) placebem kontrolovaných klinických studií, z nichž dvě byly fáze III a jedna fáze IIA. Do těchto studií bylo zařazeno 524 dospělých pacientů s agitovaností spojenou se schizofrenií (včetně 27 pacientů se schizoafektivní poruchou) nebo bipolární poruchou, léčených přípravkem ADASUVE 4,5 mg (265 pacientů) nebo ADASUVE 9,1 mg (259 pacientů).
Ve studiích na agitovaných pacientech byl hlášen bronchospasmus jako méně častý, ale závažný nežádoucí účinek, zatímco u pacientů s aktivním onemocněním dýchacích cest byl bronchospasmus hlášen často a často vyžadoval léčbu beta-agonistickým bronchodilatanciem s krátkodobým účinkem. Nejčastěji hlášenými nežádoucími účinky během léčby přípravkem ADASUVE byly dysgeuzie, sedace/somnolence a závratě (závratě byly častější po léčbě placebem než po léčbě loxapinem).
Tabulkový přehled nežádoucích účinků
Níže uvedené nežádoucí účinky jsou rozděleny do kategorií následujícím způsobem: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1 000 až < 1/100); vzácné (> 1/10 000 až < 1/1 000); velmi vzácné (< 1/10 000).
Tabulka 1: Nežádoucí účinky
Třídy orgánových systémů podle databáze MedDRA_
Poruchy nervového systému
Velmi časté: sedace/somnolence Časté: závrať
Méně časté: dystonie, dyskineze, okulogyrie, tremor, akatizie/neklid Cévní poruchy
Méně časté: hypotenze_
Respirační, hrudní a mediastinální poruchy
Časté: podráždění v krku
Méně časté: bronchospasmus (včetně dušnosti)_
Gastrointestinální poruchy
Velmi časté: dysgeuzie
Časté: suchá ústa_
Celkové poruchy a reakce v místě aplikace
Časté: únava
Popis vybraných nežádoucích účinků
Bronchospasmus
V krátkodobých (24hodinových) placebem kontrolovaných studiích s pacienty s agitovaností spojenou se schizofrenií nebo bipolární poruchou bez aktivního onemocnění dýchacích cest byl bronchospasmus (což zahrnuje hlášení sípotu, dušnosti nebo kašle) u pacientů léčených přípravkem ADASUVE méně častý. Nicméně v placebem kontrolovaných klinických studiích s pacienty s mírným až středně závažným přetrvávajícím astmatem nebo středně závažnou až závažnou CHOPN byly nežádoucí účinky ve formě bronchospasmu hlášeny velmi často. K většině těchto příhod došlo do 25 minut od podání dávky, byly mírné až středně závažné a bylo možné je zmírnit inhalací bronchodilatancia.
Nežádoucí účinky pozorované při dlouhodobém perorálním podávání loxapinu
Při dlouhodobém perorálním podávání loxapinu zahrnovaly hlášené nežádoucí účinky sedaci a ospalost, extrapyramidové příznaky (např. tremor, akatizii, rigiditu a dystonii), kardiovaskulární účinky (např. tachykardii, hypotenzi, hypertenzi, ortostatickou hypotenzi, závrať a synkopu) a anticholinergní účinky (např. suché oči, rozmazané vidění a retenci moči).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
V klinických studiích nebyly hlášeny žádné případy předávkování přípravkem ADASUVE.
V případě náhodného předávkování budou známky a příznaky záviset na počtu použitých jednotek a individuální snášenlivosti pacienta. Jak lze předpokládat na základě farmakologického působení loxapinu, mohou se klinické nálezy pohybovat od mírné deprese CNS a kardiovaskulárního systému až po hlubokou hypotenzi, respirační depresi a bezvědomí (viz bod 4.4). Je třeba mít na paměti možnost výskytu extrapyramidových příznaků a/nebo záchvatů křečí. Rovněž bylo hlášeno selhání ledvin po předávkování perorálním loxapinem.
Léčba předávkování je v zásadě symptomatická a podpůrná. Jako odpověď na podání noradrenalinu nebo fenylefrinu lze očekávat závažnou hypotenzi. Adrenalin se nemá používat, neboť jeho použití u pacienta s částečnou adrenergní blokádou může ještě více snížit krevní tlak (viz body 4.4 a 4.5). Závažné extrapyramidové reakce je nutné léčit anticholinergními antiparkinsoniky nebo difenhydramin-hydrochloridem a v případě indikace je třeba zahájit antikonvulzivní léčbu. Další opatření zahrnují podávání kyslíku a intravenózních tekutin.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: psycholeptika, antipsychotika; ATC kód: N05AH01
Má se za to, že účinnost loxapinu je zprostředkována antagonismem o vysoké afinitě k dopaminovým D2 receptorům a serotoninovým 5-HT2A receptorům. Loxapin se váže na noradrenergní, histaminergní a cholinergní receptory a jeho interakce s těmito systémy může ovlivnit spektrum jeho farmakologických účinků.
U několika zvířecích druhů byly pozorovány změny v míře excitability subkortikálních inhibičních oblastí spojené se zklidňujícími účinky a potlačením agresivního chování.
Klinická, účinnost
Do dvou studií fáze III byli zařazeni pacienti, kteří trpěli akutní agitovaností alespoň středního stupně (skóre 14 nebo vyšší podle škály PANSS-EC, Positive and Negative Syndrome Scale Excited Component) (špatná kontrola impulzů, tenze, hostilita, nespolupráce a vzrušení). Zařazení do studie 004-301 vyžadovalo diagnózu schizofrenie. Zařazení do studie 004-302 vyžadovalo diagnózu bipolární poruchy (stávající epizoda manická nebo smíšená). Pacienti trpěli významným a dlouhodobým psychiatrickým onemocněním (Diagnostic and Statistical Manual of Mental Disorders [Diagnostická a statistická příručka duševních poruch], 4. vydání (DSM-IV)) na základě počtu let od stanovení diagnózy a předchozích hospitalizací. Pacienti byli randomizováni do skupin léčených placebem, přípravkem ADASUVE 4,5 mg a přípravkem ADASUVE 9,1 mg.
Střední věk randomizovaných pacientů činil 43,1 let ve studii 004-301 a 40,8 let ve studii 004-302: mladí dospělí (ve věku 18-25 let) byli v obou studiích zastoupeni málo (7,3 %). Ve studii schizofrenie byly ženy málo zastoupeny (26,5 %) a ve studii 004-302 byla přibližně polovina pacientů muži (49,7 %). Přibližně 35 % pacientů se schizofrenií užívalo souběžná antipsychotika v době podání přípravku, zatímco u pacientů s bipolární poruchou tyto léky užívalo přibližně 13 %. Většina pacientů v obou studiích fáze III byli kuřáci, přičemž přibližně 82 % pacientů se schizofrenií a 74 % pacientů s bipolární poruchou v dané době kouřilo.
Pokud po první dávce agitovanost dostatečně neodezněla, byla nejméně o 2 hodiny později podána dávka druhá. V případě potřeby byla podána třetí dávka, nejméně 4 hodiny po dávce druhé. V případě nutnosti byla podána záchranná medikace (intramuskulárně lorazepam). Primárním cílovým parametrem byla absolutní změna ve skóre PANSS-EC od výchozí hodnoty po 2 hodinách od podání první dávky pro obě dávkování přípravku ADASUVE v porovnání s placebem. Mezi další cílové parametry patřilo skóre PANSS-EC a počet respondérů dle škály CGI-I (Clinical Global Impression - Improvement) po 2 hodinách od podání první dávky a celkový počet pacientů v každé skupině, kterým byla podána 1, 2 nebo 3 dávky hodnoceného léčivého přípravku se záchrannou medikací a bez ní. Za respondéry se považovali pacienti s > 40% poklesem celkového skóre PANSS-EC oproti výchozí hodnotě nebo pacienti se skóre 1 (velmi velké zlepšení) nebo skóre 2 (velké zlepšení) podle škály CGI-I.
Snížení agitovanosti bylo evidentní 10 minut po podání první dávky, což byl první časový bod hodnocení, a při všech dalších hodnoceních během 24hodinového evaluačního období, jak pro dávku 4,5 mg, tak pro dávku 9,1 mg u pacientů se schizofrenií i s bipolární poruchou.
Vyšetření podskupin v populaci (podle věku, rasy a pohlaví) neodhalilo žádné rozdíly ve schopnosti reagovat na léčbu na základě těchto podskupin.
Hlavní výsledky naleznete v tabulce níže.
Hlavní výsledky pivotních studií účinnosti: porovnání mezi přípravkem ADASUVE 4,5 mg, 9,1 mg a placebem
|
Studie Pacienti |
004-301 |
004-302 Bipolární porucha | |||||
|
Léčba N |
PBO 115 |
4,5 mg 116 |
9,1 mg 112 |
PBO 105 |
4,5 mg 104 |
9,1 mg 105 | |
|
Změna PANSS-EC |
Výchozí hodnota |
17,4 |
17,8 |
17,6 |
17,7 |
17,4 |
17,3 |
|
Změna za 2 hod od podání dávky |
-5,5 |
-8,1+ |
-8,6* |
-4,9 |
-8,1* |
-9,0* | |
|
SD |
4,9 |
5,2 |
4,4 |
4,8 |
4,9 |
4,7 | |
|
a 5 U §. a, w í Pí 3 |
30 min po podání dávky |
27,8 % |
46,6 % |
57,1 % |
23,8 % |
59,6 % |
61,9 % |
|
2 hod po podání dávky |
38,3 % |
62,9 % |
69,6 % |
27,6 % |
62,5 % |
73,3 % | |
|
>C NN ■ -o w s O S 3 |
% respondérů dle CGI-I |
35,7 % |
57,4 % |
67,0 % |
27,6 % |
66,3 % |
74,3 % |
|
Počet nutných dávek |
Jedna |
46,1 % |
54,4 % |
60,9 % |
26,7 % |
41,3 % |
61,5 % |
|
Dvě |
29,6 % |
30,7 % |
26,4 % |
41,0 % |
44,2 % |
26,0 % | |
|
Tři |
8,7 % |
8,8 % |
7,3 % |
11,4 % |
5,8 % |
3,8 % | |
|
Záchranná medikace |
15,6 % |
6,1 % |
5,4 % |
21,0 % |
8,6 % |
8,6 % | |
*= p < 0,0001 += p < 0,01
Respondéři dle PAnSs-EC = > 40% změna oproti výchozí hodnotě PANSS-EC Respondéři dle CGI-I = skóre 1 (velmi velké zlepšení) nebo skóre 2 (velké zlepšení) PBO = placebo SD = standardní odchylka
V podpůrné studii fáze II s podáním jednorázové dávky, do níž bylo zařazeno celkem 129 pacientů se schizofrenií a schizoafektivní poruchou činil pokles PANSS-EC po 2 hodinách -5,0 u placeba, -6,7 u přípravku ADASUVE 4,5 mg a -8,6 (p < 0,001) u přípravku ADASUVE 9,1 mg. Záchranná medikace byla podána 32,6 %, 11,1 %, respektive 14,6 % pacientů.
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem ADASUVE u podskupiny pediatrické populace od narození do méně než 12 let věku v léčbě schizofrenie a u podskupiny od narození do méně než 10 let věku v léčbě bipolární poruchy (informace o použití u dětí viz bod 4.2).
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem ADASUVE u podskupiny pediatrické populace ve věku od 12 let do méně než 18 let v léčbě schizofrenie a u podskupiny ve věku od 10 let do méně než 18 let v léčbě bipolární poruchy (informace o použití u dětí viz bod 4.2).
Absorpce
Podání přípravku ADASUVE vedlo k rychlé absorpci loxapinu s mediánem doby maximální plazmatické koncentrace (tmax) 2 minuty. Expozice loxapinu v prvních 2 hodinách po podání (AUC0-2h, měřítko časné expozice, která souvisí s nástupem léčebného účinku) činila 25,6 ng*h/ml u dávky 4,5 mg a 66,7 ng*h/ml u dávky 9,1 mg u zdravých subjektů.
Farmakokinetické parametry loxapinu byly stanoveny po opakovaném podání přípravku ADASUVE každé 4 hodiny, celkem 3 dávek (buď 4,5 mg nebo 9,1 mg), subjektům léčených v dlouhodobém stabilním režimu antipsychotiky. Střední hodnoty maximální plazmatické koncentrace byly podobné po první a třetí dávce přípravku ADASUVE, což ukazuje na minimální akumulaci během 4hodinového intervalu mezi dávkami.
Distribuce v organismu
Loxapin je rychle vychytáván z plazmy a distribuován do tkání. Studie na zvířatech po perorálním podání naznačují úvodní přednostní distribuci do plic, mozku, sleziny, srdce a ledvin. Loxapin se z 96,6 % váže na lidské plazmatické bílkoviny.
Biotransformace
Loxapin je ve velké míře metabolizován v játrech, přičemž vzniká několik metabolitů. Hlavní metabolická dráha zahrnuje hydroxylaci, při níž vzniká 8-OH-loxapin a 7-OH-loxapin, N-oxidaci, při níž vzniká N-oxid loxapinu, a demethylaci, při které vzniká amoxapin. Pořadí metabolitů pozorované u přípravku ADASUVE u lidí (na základě systémové expozice) bylo 8-OH-loxapin > N-oxid loxapinu > 7-OH-loxapin > amoxapin, přičemž plazmatické hladiny 8-OH-loxapinu se podobaly hladinám původní sloučeniny. 8-OH-loxapin není farmakologicky aktivní na receptoru D2, zatímco méně častý metabolit 7-OH-loxapin má vysokou vazebnou afinitu k receptorům D2.
Loxapin je substrátem pro několik izoenzymů CYP450. Studie in vitro prokázaly, že 7-OH-loxapin je vytvářen zejména izoenzymy CYP3A4 a CYP2D6, 8-OH-loxapin je vytvářen zejména izoenzymem CYP1A2, amoxapin je vytvářen zejména izoenzymy CYP3A4, CYP2C19 a CYP2C8 a N-oxid loxapinu je vytvářen monooxygenázami obsahujícími flavin.
Potenciál loxapinu a jeho metabolitů (amoxipan, 7-OH-loxapin, 8-OH-loxapin a loxapin-N-oxid) inhibovat metabolismus léčivých přípravků zprostředkovaný CYP450 byl zkoumán in vitro u izoenzymů CYP 1A1, 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1a 3A4. Nebyla pozorována žádná významná inhibice. In vitro studie ukázaly, že loxapin a 8-OH-loxapin nejsou v klinicky používaných koncentracích induktory enzymů CYP1A2, 2B6 nebo 3A4. Navíc, in vitro studie ukazují, že loxapin a 8-OH-loxapin neinhibují UGT1A1,
1A3, 1A4, 2B7 a 2B15.
Eliminace z organismu
K vylučování loxapinu dochází převážně v prvních 24 hodinách. Metabolity se vylučují v moči ve formě konjugátů a ve stolici v nekonjugované formě. Terminální eliminační poločas (t/2) se pohyboval v rozmezí 6 až 8 hodin.
Linearita/nelinearita
Střední plazmatické koncentrace loxapinu po podání přípravku ADASUVE byly v rozmezí klinických dávek lineární. Hodnoty AUC0-2h, AUCinf, a Cmax se zvyšovaly v závislosti na dávce.
Kuřáci
Populační farmakokinetická analýza, která porovnávala expozici u kuřáků oproti nekuřákům, ukázala, že kouření, které indukuje izoenzym CYP1A2, mělo minimální vliv na expozici přípravku ADASUVE. Nedoporučuje se žádná úprava dávkování v závislosti na tom, zda pacient kouří nebo ne.
U kuřaček je expozice (AUCinf) přípravku ADASUVE a jeho aktivnímu metabolitu 7-OH-loxapinu nižší než u nekuřaček (84% oproti 109% poměr 7-OH-loxapin/loxapin), což je pravděpodobně způsobeno zvýšením clearance loxapinu u kuřaček.
Demografické údaje
Nevyskytly se žádné významné rozdíly v expozici nebo dispozici loxapinu po podání přípravku ADASUVE, které by souvisely s věkem, pohlavím, rasou, tělesnou hmotností nebo indexem tělesné hmotnosti (BMI).
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje o bezpečnosti získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání a genotoxicity neodhalily žádné zvláštní riziko pro člověka s výjimkou změn v reprodukčních tkáních souvisejících s prodlouženým farmakologickým účinkem loxapinu. Podobné změny, např. gynekomastie, jsou u člověka známé, ale pouze po dlouhodobém podávání léků způsobujících hyperprolaktinémii.
Samice potkanů se nepářily v důsledku přetrvávajícího diestru po perorální léčbě loxapinem. Studie embryonálního/fetálního vývoje a perinatální studie ukázaly známky opožděného vývoje (snížená tělesná hmotnost, opožděná osifikace, hydronefróza, hydroureter a/nebo rozšířená ledvinná pánvička s omezeným počtem papil nebo chybějícími papilami) a rovněž zvýšený počet úmrtí v perinatálním stadiu a úmrtí novorozenců v potomstvu potkanů léčených od poloviny březosti perorálními dávkami přípravku ADASUVE, které byly nižší než maximální doporučená dávka pro člověka v přepočtu mg/m2 (viz bod 4.6).
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Žádné
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
4 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v původním váčku až do vlastního použití, aby byl přípravek chráněn před světlem a vlhkostí. Tento léčivý přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Přípravek ADASUVE se dodává v zataveném, vícevrstvém váčku z hliníkové folie. Přípravek ADASUVE 9,1 mg se dodává v krabičce obsahující 1 nebo 5 jednotek.
Bílý inhalátor (kryt) je odlit ze zdravotnického polykarbonátu.
6.6 Zvláštní opatření pro likvidaci přípravku
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Ferrer International, S.A.
Gran Vía Carlos III, 94 08028- Barcelona Španělsko
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/13/823/002 (5 jednodávkových inhalátorů)
EU/1/13/823/004 (1 jednodávkový inhalátor)
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 20. Února 2013
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu.
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ / VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného za propouštění šarží FERRER INTERNACIONAL, S.A.
Joan Buscalla, 1-9, 08173 Sant Cugat del Valles, Barcelona, Španělsko
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2).
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předloží první pravidelně aktualizovanou zprávu o bezpečnosti pro tento léčivý přípravek do 6 měsíců od jeho registrace. Držitel rozhodnutí o registraci dále předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP se předkládá každoročně až do prodloužení registrace.
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je třeba je předložit současně.
Dále je třeba aktualizovaný RMP předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo
z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
• Další opatření k minimalizaci rizik
Před uvedením přípravku na trh v každém členském státě se držitel rozhodnutí o registraci dohodne na programu vzdělávání s příslušným národním orgánem.
Držitel rozhodnutí o registraci, po diskuzi a dohodě s příslušnými národními orgány v každém členském státě, kde je přípravek ADASUVE uváděn na trh, zajistí, aby při jeho uvedení na trh a po něm všichni zdravotničtí pracovníci, kteří budou přípravek ADASUVE používat, obdrželi informační balíček obsahující následující položky:
• Souhrn údajů o přípravku a příbalovou informaci a označení na obalu
• Vzdělávací materiály pro zdravotnické pracovníky
Hlavní součásti, které musí vzdělávací materiály obsahovat:
Obecné:
• Úvodní vyjádření týkající se účelu vzdělávacího materiálu
• Informace o akutních podmínkách indikace Riziko bronchospasmu:
• Uvedení kontraindikací a souvisejících upozornění
• Jasné doporučení, že u pacientů s respiračním onemocněním v anamnéze se nemá léčba přípravkem ADASUVE zahajovat
• Léčba přípravkem ADASUVE se má provádět výhradně v nemocničním prostředí
• Dostupnost záchranné medikace (beta-agonistické bronchodilatancia s krátkodobým účinkem) během léčby
• Sledování pacientů po dobu 1 hodiny po každé dávce přípravku ADASUVE Riziko prodloužení intervalu QT:
• Podání maximálně 2 dávek
• Při podávání přípravku ADASUVE pacientům se známým kardiovaskulárním onemocněním nebo výskytem prodloužením intervalu QT v rodinné anamnéze a při souběžném použití s dalšími léčivými přípravky, o nichž je známo, že prodlužují interval QT, je třeba postupovat opatrně.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
ADASUVE 4,5 mg dávkovaný prášek k inhalaci loxapinum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden inhalátor dodává loxapinum 4,5 mg.
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ_
Dávkovaný prášek k inhalaci 1 jednodávkový inhalátor 5 jednodávkových inhalátorů
5. ZPŮSOB A CESTA/CESTY PODÁNÍ_
Před použitím si přečtěte příbalovou informaci.
Inhalační podání
Pouze k jednorázovému použití
Tento přípravek je balen v zataveném váčku a musí být uchováván ve váčku až do vlastního použití.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním váčku až do vlastního použití, aby byl přípravek chráněn před světlem a vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Ferrer International, S.A. Gran Vía Carlos III, 94 08028- Barcelona Španělsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/823/001(5 jednodávkových inhalátorů) EU/1/13/823/003 (1 jednodávkový inhalátor)
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU
VÁČEK_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
ADASUVE 4,5 mg prášek k inhalaci loxapinum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden inhalátor dodává loxapinum 4,5 mg.
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek k inhalaci
Jeden jednodávkový inhalátor
5. ZPŮSOB A CESTA/CESTY PODÁNÍ_
Pokyny k použití naleznete uvnitř.
Před použitím si přečtěte příbalovou informaci.
Váček otevřete až bezprostředně před použitím.
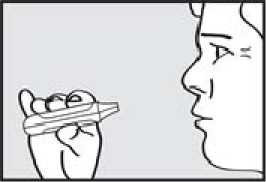
Inhalační podání Pokyny k použití
Před podáním přípravku ADASUVE pacientovi si přečtěte těchto 5 kroků: 1. Otevřete váček. Váček otevřete až bezprostředně před použitím.
Roztrhnutím foliový váček otevřete a vyjměte inhalátor z obalu.
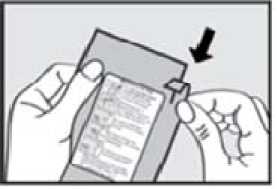
2. Vytáhněte ochrannou pásku. Pevně zatáhněte za plastovou ochrannou pásku na konci inhalátoru. Rozsvítí se zelená kontrolka indikující, že inhalátor je připraven k použití.
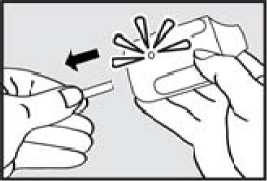
Použijte přípravek do 15 minut po vytažení ochranné pásky (nebo dokud zelená kontrolka nezhasne), abyste zabránili automatické deaktivaci inhalátoru.
Dejte pacientovi pokyn, aby:
3. vydechnul. Držte inhalátor stranou od úst a úplně vydechněte, abyste vyprázdnil(a) plíce.
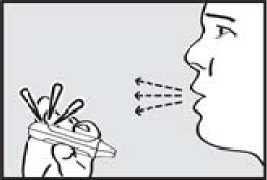
4. se nadechnul. Zhluboka a plynule se nadechněte skrz náustek.
DŮLEŽITÉ: Zkontrolujte, zda zelená kontrolka po pacientově nádechu zhasla.
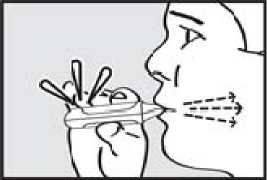
5. zadržel dech. Vyjměte náustek z úst a na chvilku zadržte dech.
Pozor: Jestliže zelená kontrolka zůstane po pacientově nádechu rozsvícená, požádejte pacienta, aby zopakoval kroky 3 až 5.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Nepoužívejte u pacientů s astmatem nebo chronickou obstrukční plicní nemocí nebo akutními respiračními příznaky.
Je nutné mít k dispozici beta-agonistické bronchodilatancium s krátkodobým účinkem k léčbě případného bronchospasmu.
Během první hodiny po každé dávce je třeba pacienty sledovat s ohledem na známky a příznaky bronchospasmu.
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním váčku až do vlastního použití, aby byl přípravek chráněn před světlem a vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Ferrer Internacional, S.A. Gran Vía Carlos III, 94 08028- Barcelona Španělsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/823/001(5 jednodávkových inhalátorů) EU/1/13/823/003 (1 jednodávkový inhalátor)
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU KRYT PROSTŘEDKU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
ADASUVE 4,5 mg prášek k inhalaci loxapinum
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
4,5 mg
6. JINÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
ADASUVE 9,1 mg dávkovaný prášek k inhalaci loxapinum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden inhalátor dodává loxapinum 9,1 mg.
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ_
Dávkovaný prášek k inhalaci 1 jednodávkový inhalátor 5 jednodávkových inhalátorů
5. ZPŮSOB A CESTA/CESTY PODÁNÍ_
Před použitím si přečtěte příbalovou informaci.
Inhalační podání
Pouze k jednorázovému použití
Tento přípravek je balen v zataveném váčku a musí být uchováván ve váčku až do vlastního použití.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním váčku až do vlastního použití, aby byl přípravek chráněn před světlem a vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Ferrer International, S.A. Gran Vía Carlos III, 94 08028- Barcelona Španělsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/823/002(5 jednodávkových inhalátorů) EU/1/13/823/004 (1 jednodávkový inhalátor)
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku vázán na lékařský předpis.
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se - odůvodnění přijato
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU
VÁČEK_
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
ADASUVE 9,1 mg prášek k inhalaci loxapinum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden inhalátor dodává loxapinum 9,1 mg.
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Prášek k inhalaci
Jeden jednodávkový inhalátor
5. ZPŮSOB A CESTA/CESTY PODÁNÍ_
Pokyny k použití naleznete uvnitř.
Před použitím si přečtěte příbalovou informaci.
Váček otevřete až bezprostředně před použitím.
Inhalační podání Pokyny k použití
Před podáním přípravku ADASUVE pacientovi si přečtěte těchto 5 kroků: 1. Otevřete váček. Váček otevřete až bezprostředně před použitím.
Roztrhnutím foliový váček otevřete a vyjměte inhalátor z obalu.
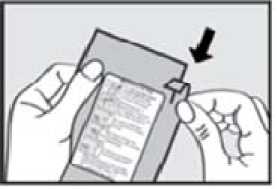
2. Vytáhněte ochrannou pásku. Pevně zatáhněte za plastovou ochrannou pásku na konci inhalátoru. Rozsvítí se zelená kontrolka indikující, že inhalátor je připraven k použití.
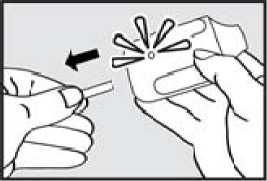
Použijte přípravek do 15 minut po vytažení ochranné pásky (nebo dokud zelená kontrolka nezhasne), abyste zabránili automatické deaktivaci inhalátoru.
Dejte pacientovi pokyn, aby:
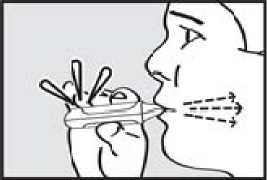
3. vydechnul. Držte inhalátor stranou od úst a úplně vydechněte, abyste vyprázdnil(a) plíce.
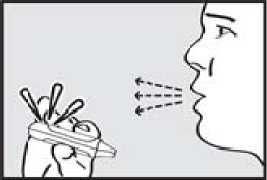
4. se nadechnul. Zhluboka a plynule se nadechněte skrz náustek.
DŮLEŽITÉ: Zkontrolujte, zda zelená kontrolka po pacientově nádechu zhasla.
5. zadržel dech. Vyjměte náustek z úst a na chvilku zadržte dech.
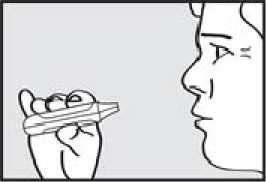
Pozor: Jestliže zelená kontrolka zůstane po pacientově nádechu rozsvícená, požádejte pacienta, aby zopakoval kroky 3 až 5.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
Nepoužívejte u pacientů s astmatem nebo chronickou obstrukční plicní nemocí nebo akutními respiračními příznaky.
Je nutné mít k dispozici beta-agonistické bronchodilatancium s krátkodobým účinkem k léčbě případného bronchospasmu.
Během první hodiny po každé dávce je třeba pacienty sledovat s ohledem na známky a příznaky bronchospasmu.
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním váčku až do vlastního použití, aby byl přípravek chráněn před světlem a vlhkostí.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Ferrer Internacional, S.A. Gran Vía Carlos III, 94 08028- Barcelona Španělsko
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/13/823/002(5 jednodávkových inhalátorů) EU/1/13/823/004 (1 jednodávkový inhalátor)
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU KRYT PROSTŘEDKU
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
ADASUVE 9,1 mg prášek k inhalaci loxapinum
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
9,1 mg
6. JINÉ
Příbalová informace: informace pro uživatele
ADASUVE 4,5 mg dávkovaný prášek k inhalaci loxapinum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo zdravotní sestry.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek ADASUVE a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek ADASUVE používat
3. Jak se přípravek ADASUVE používá
4. Možné nežádoucí účinky
5. Jak přípravek ADASUVE uchovávat
6. Obsah balení a další informace
1. Co je přípravek ADASUVE a k čemu se používá
Přípravek ADASUVE obsahuje léčivou látku loxapin, která patří do skupiny léků zvané antipsychotika. Přípravek ADASUVE působí tak, že blokuje určité chemické látky v mozku (neurotransmitery), jako je dopamin a serotonin, což vede ke zklidňujícím účinkům a utišení agresivního chování.
Přípravek ADASUVE se používá k léčbě akutních příznaků mírné až středně silné agitovanosti (neklidu), která se může vyskytnout u dospělých pacientů, kteří trpí schizofrenií nebo bipolární poruchou. To jsou nemoci, které jsou charakterizovány například těmito příznaky:
• (schizofrenie) slyšení, vidění nebo pociťování věcí, které ve skutečnosti neexistují, podezíravost, mylná přesvědčení, nesourodá řeč a chování a emoční oploštělost. Lidé trpící touto nemocí se rovněž mohou cítit v depresi, provinile, pociťovat úzkost nebo napětí.
• (bipolární porucha) pocit nadšení, nadměrné množství energie, menší potřeba spánku než obvykle, rychlé mluvení a překotné myšlenky a někdy silná podrážděnost.
2. Čemu musíte věnovat pozornost, než začnete přípravek ADASUVE používat
Nepoužívejte přípravek ADASUVE
• jestliže jste alergický(á) na loxapin nebo amoxapin,
• jestliže máte příznaky sípotu nebo dušnosti,
• jestliže máte plicní potíže, jako je astma nebo chronická obstrukční plicní nemoc (kterou Váš lékař možná nazývá „CHOPN“).
Upozornění a opatření
Váš lékař nebo zdravotní sestra si s Vámi před použitím přípravku ADASUVE promluví a stanoví, zda je tento přípravek pro Vás vhodný.
• Přípravek ADASUVE může způsobit zúžení dýchacích cest (bronchospasmus) a může u Vás vyvolat sípot, kašel, svírání na hrudi nebo dušnost. Obvykle k tomu dojde do 25 minut po použití.
• Neuroleptický maligní syndrom (NMS) je soubor příznaků, které se u Vás mohou objevit, pokud užíváte antipsychotika, včetně přípravku ADASUVE. Tyto příznaky mohou zahrnovat vysokou horečku, ztuhlé
svaly, nepravidelnou nebo rychlou srdeční frekvenci nebo pulz. NMS může vést k úmrtí. Nepoužívejte znovu přípravek ADASUVE, jestliže se u Vás vyskytl NMS.
• Antipsychotika, jako je přípravek ADASUVE, mohou vyvolat pohyby, které nemusíte být schopen (schopna) ovládat, včetně grimas, vystrkování jazyka, mlaskání nebo špulení rtů, rychlého mrkání nebo rychlých pohybů nohama, pažemi nebo prsty. Jestliže se tyto příznaky objeví, může být nutné léčbu přípravkem ADASUVE ukončit.
• Přípravek ADASUVE je třeba používat s opatrností u pacientů, kteří jsou intoxikovaní nebo v deliriu.
Před zahájením léčby přípravkem ADASUVE informujte svého lékaře nebo zdravotní sestru, jestliže:
• máte nebo jste měl(a) dechové potíže, jako je astma, nebo jiné chronické plicní onemocnění, jako je bronchitida nebo emfyzém,
• máte nebo jste měl(a) srdeční potíže nebo cévní mozkovou příhodu,
• máte nebo jste měl(a) nízký nebo vysoký krevní tlak,
• máte nebo jste měl(a) záchvaty (křeče),
• máte nebo jste měl(a) glaukom (zvýšený nitrooční tlak),
• máte nebo jste měl(a) retenci moči (neúplné vyprázdnění močového měchýře),
• jste již v minulosti používal(a) přípravek ADASUVE a rozvinuly se u Vás příznaky sípotu nebo dušnosti,
• se u Vás někdy vyskytly pohyby svalů nebo očí, které jste nemohl(a) ovládat, nedostatek koordinace, přetrvávající svalová kontrakce, pocit neklidu či neschopnosti sedět v klidu,
• jste starší osoba a trpíte demencí (ztrátou paměti a dalších duševních schopností).
Jestliže se u Vás po použití přípravku ADASUVE rozvinou kterékoli z těchto příznaků, sdělte to svému lékaři.
Děti a dospívající
Přípravek ADASUVE není určen k podávání dětem a dospívajícím mladším 18 let.
Další léčivé přípravky a přípravek ADASUVE
Informujte svého lékaře o všech lécích, které používáte, které jste v nedávné době používal(a) nebo které možná budete používat, včetně:
• adrenalinu,
• léků k léčbě dechových potíží,
• léků, které Vás mohou vystavit riziku záchvatů (například klozapin, tricyklická antidepresiva nebo selektivní inhibitory zpětného vychytávání serotoninu (SSRI), tramadol, meflochin),
• léků k léčbě Parkinsonovy choroby,
• lorazepamu nebo jiných centrálně působících léků (k léčbě úzkosti, deprese, bolesti nebo nespavosti) či jakýchkoli dalších léků, které způsobují ospalost,
• rekreačních (ilegálních) drog,
• léků, jako je fluvoxamin, propranolol a enoxacin, a dalších léků, které inhibují určitý jaterní enzym zvaný „CYP450 1A2“,
• léků k léčbě schizofrenie, deprese nebo bolesti, neboť můžete být vystaven(a) většímu riziku záchvatů. Používání přípravku ADASUVE společně s adrenalinem může vést k poklesu Vašeho krevního tlaku.
Přípravek ADASUVE s alkoholem
Protože přípravek ADASUVE ovlivňuje nervový systém, je třeba vyvarovat se konzumace alkoholu během používání přípravku ADASUVE.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek používat. Po použití přípravku ADASUVE po dobu 48 hodin nekojte a mléko, které se během této doby vytvoří, zlikvidujte.
Následující příznaky se mohou objevit u novorozenců matek, které opakovaně používaly antipsychotika v posledních třech měsících těhotenství: třes, svalová ztuhlost a/nebo slabost, ospalost, agitovanost, dechové potíže a potíže s krmením. Jestliže se u Vašeho dítěte rozvine kterýkoli z těchto příznaků, možná se budete muset obrátit na svého lékaře.
Řízení dopravních prostředků a obsluha strojů
Neřiďte dopravní prostředky ani nepoužívejte žádné nástroje a neobsluhujte stroje po použití přípravku ADASUVE, dokud nebudete vědět, jak na Vás přípravek ADASUVE působí, neboť jako potenciální nežádoucí účinek přípravku ADASUVE byla hlášena závrať, útlum a ospalost.
3. Jak se přípravek ADASUVE používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře nebo zdravotní sestry. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo zdravotní sestrou.
Doporučená zahajovací dávka přípravku je 9,1 mg. Po 2 hodinách Vám může Váš lékař předepsat druhou dávku poté, co pečlivě zváží Váš stav, a může Vám dávku snížit na 4,5 mg, pokud se domnívá, že je tato dávka vhodnější k léčbě Vašeho stavu.
Přípravek ADASUVE budete používat pod dohledem lékaře nebo zdravotní sestry.
Přípravek ADASUVE je k inhalačnímu podání. Jakmile pro Vás lékař nebo zdravotní sestra přípravek ADASUVE připraví k použití, požádá Vás, abyste vzal(a) inhalátor do ruky, vydechl(a) a poté vložil(a) náustek do úst, vdechl(a) lék z inhalátoru a poté na chvilku zadržel(a) dech.
Jestliže jste použil(a) více přípravku ADASUVE, než jste měl(a)
Jestliže máte obavy, že Vám bylo podáno více přípravku ADASUVE, než považujete za nutné, sdělte tyto své obavy lékaři nebo zdravotní sestře. Pacienti, kterým bylo podáno více přípravku ADASUVE, než mělo, mohou mít některé z následujících příznaků: velká únava nebo ospalost, dechové potíže, nízký krevní tlak, podráždění v krku nebo nepříjemná chuť v ústech, pohyby svalů nebo očí, které nemůžete ovládat.
Máte-li jakékoli další otázky ohledně používání tohoto léčivého přípravku, zeptejte se svého lékaře nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u
každého.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z následujících nežádoucích účinků, sdělte to ihned svému lékaři a
přestaňte lék používat:
• jakékoli dechové příznaky, jako je sípot, kašel, dušnost, svírání na hrudi, neboť to by mohlo znamenat, že lék dráždí Vaše dýchací cesty (vyskytuje se méně často, pokud nemáte astma nebo CHOPN),
• závrať nebo mdloby, neboť to by mohlo znamenat, že lék snižuje Váš krevní tlak (vyskytuje se méně často),
• zhoršování agitovanosti nebo zmatenosti, zejména v kombinaci s horečkou nebo ztuhlostí svalů (vyskytuje se vzácně). Tyto příznaky mohou být spojeny se závažným stavem nazývaným neuroleptický maligní syndrom (NMS).
Pokud se u Vás vyskytne kterýkoli z následujících nežádoucích účinků, který se může vyskytnout i při
užívání jiných lékových forem tohoto léku, sdělte to také svému lékaři:
Velmi časté (mohou postihnout více než 1 osobu z 10): nepříjemná chuť v ústech nebo ospalost.
Časté (mohou postihnout až 1 osobu z 10): závrať, podráždění v krku, suchá ústa nebo únava.
Méně časté (mohou postihnout až 1 osobu ze 100): pohyby svalů nebo očí, které nemůžete ovládat, nedostatek koordinace, přetrvávající svalová kontrakce, pocit neklidu či neschopnost sedět v klidu.
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře.
Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
Další nežádoucí účinky, které byly spojeny s dlouhodobým perorálním používáním loxapinu a které se mohou vztahovat i na přípravek ADASUVE, zahrnují mdloby při postavení se, zvýšená srdeční frekvence, zvýšený krevní tlak, rozmazané vidění, suché oči a omezené močení.
5. Jak přípravek ADASUVE uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte přípravek ADASUVE po uplynutí doby použitelnosti uvedené na štítku. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v původním váčku až do vlastního použití, aby byl přípravek chráněn před světlem a vlhkostí.
Nepoužívejte přípravek ADASUVE, pokud si všimnete, že je váček otevřený nebo natržený, nebo přípravek nese jakékoli známky fyzického poškození.
Nevyhazujte přípravek ADASUVE do domácího odpadu. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek ADASUVE obsahuje
Léčivou látkou je loxapinum. Jeden jednodávkový inhalátor obsahuje 5 mg loxapinu a dodává 4,5 mg loxapinu.
Jak přípravek ADASUVE vypadá a co obsahuje toto balení
Přípravek ADASUVE 4,5 mg dávkovaný prášek k inhalaci se skládá z bílého plastového jednodávkového inhalátoru určeného k jednorázovému použití, který obsahuje loxapin. Přípravek ADASUVE je zabalen v zataveném foliovém váčku, který obsahuje jeden jednodávkový inhalátor. Přípravek ADASUVE 4,5 mg se dodává v krabičce s 1 nebo 5 jednotkami.
Držitel rozhodnutí o registraci
Ferrer International, S.A.
Gran Vía Carlos III, 94 08028- Barcelona Španělsko
Výrobce
Ferrer International, S.A.
Joan Buscalla, 1-9, 08173 Sant Cugat del Valles Barcelona, Španělsko
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci. Belgie/Belgique/Belgien Lietuva
Ferrer Internacionál, S.A. Tél/Tel: +34 93 600 37 00
|
EtnrapHH AOP Orphan Pharmaceuticals AG BG Ten.: +35 988 6666096 |
Luxembourg/Luxemburg Ferrer International, S.A. Tél/Tel: +34 93 600 37 00 |
|
Česká republika AOP Orphan Pharmaceuticals AG CZ Tel: +420 251 512 947 |
Magyarország AOP Orphan Pharmaceuticals AG HU Tel.: +36 1 3192633 |
|
Danmark Medivir AB Tlf: +46 8 407 64 30 |
Malta Ferrer International, S.A. Tel.: +34 93 600 37 00 |
|
Deutschland Trommsdorff GmbH & Co. KG Tel: +49-(0) 2404/553-01 |
Nederland Ferrer International, S.A. Tel.: +34 93 600 37 00 |
|
Eesti AOP Orphan Pharmaceuticals AG LT Tel: +370 672 12222 |
Norge Medivir AB Tlf: +46 8 407 64 30 |
|
EXláSa Ferrer Galenica S.A. T^: +30 210 52 81 700 |
Osterreich AOP Orphan Pharmaceuticals AG Tel: +43 1 5037244-0 |
|
Espaňa Ferrer International, S.A. Tel.: +34 93 600 37 00 |
Polska AOP Orphan Pharmaceuticals S.A. PL Tel: +48 22 5424068 |
|
France Ferrer International, S.A. Tél: +34 93 600 37 00 |
Portugal Ferrer Portugal, S.A. Tel: +351 214449600 |
|
Hrvatska AOP Orphan Pharmaceuticals AG Tel: +43 1 5037244-0 |
Románia Galenica S.A. Tel: +30 210 52 81 700 |
|
Ireland Galen Limited Tel: +44 (0)28 38334974 |
Slovenija AOP Orphan Pharmaceuticals AG Tel: +43 1 5037244-0 |
|
Ísland Medivir AB Sími: +46 8 407 64 30 |
Slovenská republika AOP Orphan Pharmaceuticals AG SK Tel: +421 31 5502271 |
|
Italia Angelini S.p.A. Tel: +39 06 780531 |
Suomi/Finland Medivir AB Puh/Tel: +46 8 407 64 30 |
|
Kúnpoq Galenica S.A. T^: +30 210 52 81 700 |
Sverige Medivir AB Tel: +46 8 407 64 30 |
|
Latvija |
United Kingdom |
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu.
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Pouze k inhalačnímu podání
Před použitím si přečtěte všechny pokyny. Více informací naleznete v souhrnu údajů o přípravku.
Seznámení se s přípravkem ADASUVE: Níže uvedené obrázky ukazují důležité znaky přípravku ADASUVE.
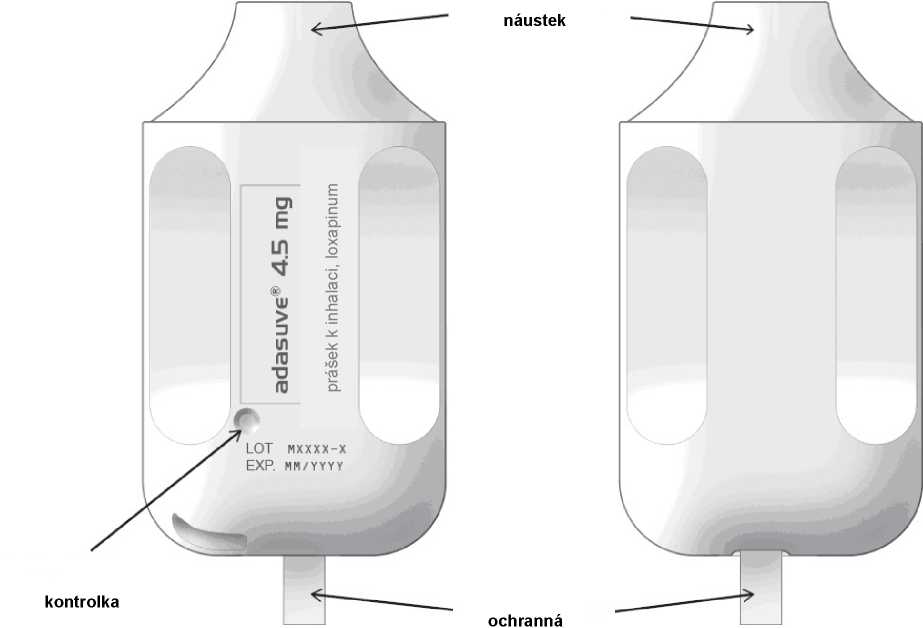
páska
• Přípravek ADASUVE se dodává v zataveném váčku.
• Když se přípravek ADASUVE z váčku vyjme, je světlo kontrolky vypnuté.
• Kontrolka se rozsvítí (zeleně), jakmile se vytáhne ochranná páska. Inhalátor je pak připraven k použití.
• Po inhalaci léku kontrolka opět automaticky zhasne.
Před podáním přípravku ADASUVE pacientovi si přečtěte těchto 5 kroků:
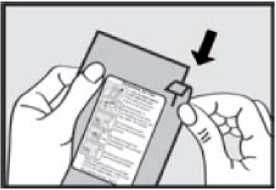
1. Otevřete váček
Váček otevřete až bezprostředně před použitím. Roztrhnutím foliový váček otevřete a vyjměte inhalátor z obalu.
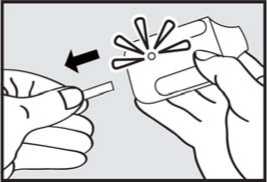
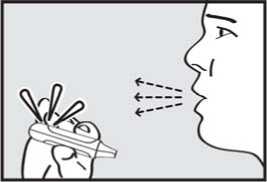
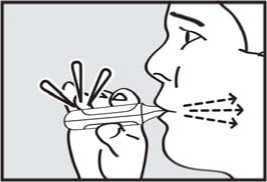
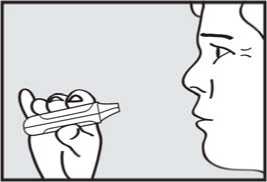
2. Vytáhněte ochrannou pásku
Pevně zatáhněte za plastovou ochrannou pásku na konci inhalátoru. Rozsvítí se zelená kontrolka indikující, že inhalátor je připraven k použití.
Použijte přípravek do 15 minut po vytažení ochranné pásky (nebo dokud zelená kontrolka nezhasne), abyste zabránili automatické deaktivaci inhalátoru.
Dejte pacientovi pokyn, aby:
3. vydechnul
Držte inhalátor stranou od úst a úplně vydechněte, abyste vyprázdnil(a) plíce.
4. se nadechnul
Zhluboka a plynule se nadechněte skrz náustek.
DŮLEŽITÉ: Zkontrolujte, zda zelená kontrolka po pacientově nádechu zhasla.
5. zadržel dech
Vyjměte náustek z úst a na chvilku zadržte dech.
POZOR: Jestliže zelená kontrolka zůstane po pacientově nádechu rozsvícená, požádejte pacienta, aby zopakoval kroky 3 až 5.
Příbalová informace: informace pro uživatele
ADASUVE 9,1 mg dávkovaný prášek k inhalaci loxapinum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo zdravotní sestry.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek ADASUVE a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek ADASUVE používat
3. Jak se přípravek ADASUVE používá
4. Možné nežádoucí účinky
5. Jak přípravek ADASUVE uchovávat
6. Obsah balení a další informace
1. Co je přípravek ADASUVE a k čemu se používá
Přípravek ADASUVE obsahuje léčivou látku loxapin, která patří do skupiny léků zvané antipsychotika. Přípravek ADASUVE působí tak, že blokuje určité chemické látky v mozku (neurotransmitery), jako je dopamin a serotonin, což vede ke zklidňujícím účinkům a utišení agresivního chování.
Přípravek ADASUVE se používá k léčbě akutních příznaků mírné až středně silné agitovanosti (neklidu), která se může vyskytnout u dospělých pacientů, kteří trpí schizofrenií nebo bipolární poruchou. To jsou nemoci, které jsou charakterizovány například těmito příznaky:
• (schizofrenie) slyšení, vidění nebo pociťování věcí, které ve skutečnosti neexistují, podezíravost, mylná přesvědčení, nesourodá řeč a chování a emoční oploštělost. Lidé trpící touto nemocí se rovněž mohou cítit v depresi, provinile, pociťovat úzkost nebo napětí.
• (bipolární porucha) pocit nadšení, nadměrné množství energie, menší potřeba spánku než obvykle, rychlé mluvení a překotné myšlenky a někdy silná podrážděnost.
2. Čemu musíte věnovat pozornost, než začnete přípravek ADASUVE používat
Nepoužívejte přípravek ADASUVE
• jestliže jste alergický(á) na loxapin nebo amoxapin,
• jestliže máte příznaky sípotu nebo dušnosti,
• jestliže máte plicní potíže, jako je astma nebo chronická obstrukční plicní nemoc (kterou Váš lékař možná nazývá „CHOPN“).
Upozornění a opatření
Váš lékař nebo zdravotní sestra si s Vámi před použitím přípravku ADASUVE promluví a stanoví, zda je tento přípravek pro Vás vhodný.
• Přípravek ADASUVE může způsobit zúžení dýchacích cest (bronchospasmus) a může u Vás vyvolat sípot, kašel, svírání na hrudi nebo dušnost. Obvykle k tomu dojde do 25 minut po použití.
• Neuroleptický maligní syndrom (NMS) je soubor příznaků, které se u Vás mohou objevit, pokud užíváte antipsychotika, včetně přípravku ADASUVE. Tyto příznaky mohou zahrnovat vysokou horečku, ztuhlé
svaly, nepravidelnou nebo rychlou srdeční frekvenci nebo pulz. NMS může vést k úmrtí. Nepoužívejte znovu přípravek ADASUVE, jestliže se u Vás vyskytl NMS.
• Antipsychotika, jako je přípravek ADASUVE, mohou vyvolat pohyby, které nemusíte být schopen (schopna) ovládat, včetně grimas, vystrkování jazyka, mlaskání nebo špulení rtů, rychlého mrkání nebo rychlých pohybů nohama, pažemi nebo prsty. Jestliže se tyto příznaky objeví, může být nutné léčbu přípravkem ADASUVE ukončit.
• Přípravek ADASUVE je třeba používat s opatrností u pacientů, kteří jsou intoxikovaní nebo v deliriu.
Před zahájením léčby přípravkem ADASUVE informujte svého lékaře nebo zdravotní sestru, jestliže:
• máte nebo jste měl(a) dechové potíže, jako je astma, nebo jiné chronické plicní onemocnění, jako je bronchitida nebo emfyzém,
• máte nebo jste měl(a) srdeční potíže nebo cévní mozkovou příhodu,
• máte nebo jste měl(a) nízký nebo vysoký krevní tlak,
• máte nebo jste měl(a) záchvaty (křeče),
• máte nebo jste měl(a) glaukom (zvýšený nitrooční tlak),
• máte nebo jste měl(a) retenci moči (neúplné vyprázdnění močového měchýře),
• jste již v minulosti používal(a) přípravek ADASUVE a rozvinuly se u Vás příznaky sípotu nebo dušnosti,
• se u Vás někdy vyskytly pohyby svalů nebo očí, které jste nemohl(a) ovládat, nedostatek koordinace, přetrvávající svalová kontrakce, pocit neklidu či neschopnosti sedět v klidu,
• jste starší osoba a trpíte demencí (ztrátou paměti a dalších duševních schopností).
Jestliže se u Vás po použití přípravku ADASUVE rozvinou kterékoli z těchto příznaků, sdělte to svému lékaři.
Děti a dospívající
Přípravek ADASUVE není určen k podávání dětem a dospívajícím mladším 18 let.
Další léčivé přípravky a přípravek ADASUVE
Informujte svého lékaře o všech lécích, které používáte, které jste v nedávné době používal(a) nebo které možná budete používat, včetně:
• adrenalinu,
• léků k léčbě dechových potíží,
• léků, které Vás mohou vystavit riziku záchvatů (například klozapin, tricyklická antidepresiva nebo selektivní inhibitory zpětného vychytávání serotoninu (SSRI), tramadol, meflochin),
• léků k léčbě Parkinsonovy choroby,
• lorazepamu nebo jiných centrálně působících léků (k léčbě úzkosti, deprese, bolesti nebo nespavosti) či jakýchkoli dalších léků, které způsobují ospalost,
• rekreačních (ilegálních) drog,
• léků, jako je fluvoxamin, propranolol a enoxacin, a dalších léků, které inhibují určitý jaterní enzym zvaný „CYP450 1A2“,
• léků k léčbě schizofrenie, deprese nebo bolesti, neboť můžete být vystaven(a) většímu riziku záchvatů. Používání přípravku ADASUVE společně s adrenalinem může vést k poklesu Vašeho krevního tlaku.
Přípravek ADASUVE s alkoholem
Protože přípravek ADASUVE ovlivňuje nervový systém, je třeba vyvarovat se konzumace alkoholu během používání přípravku ADASUVE.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek používat. Po použití přípravku ADASUVE po dobu 48 hodin nekojte a mléko, které se během této doby vytvoří, zlikvidujte.
Následující příznaky se mohou objevit u novorozenců matek, které opakovaně používaly antipsychotika v posledních třech měsících těhotenství: třes, svalová ztuhlost a/nebo slabost, ospalost, agitovanost, dechové potíže a potíže s krmením. Jestliže se u Vašeho dítěte rozvine kterýkoli z těchto příznaků, možná se budete muset obrátit na svého lékaře.
Řízení dopravních prostředků a obsluha strojů
Neřiďte dopravní prostředky ani nepoužívejte žádné nástroje a neobsluhujte stroje po použití přípravku ADASUVE, dokud nebudete vědět, jak na Vás přípravek ADASUVE působí, neboť jako potenciální nežádoucí účinek přípravku ADASUVE byla hlášena závrať, útlum a ospalost.
3. Jak se přípravek ADASUVE používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře nebo zdravotní sestry. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo zdravotní sestrou.
Doporučená zahajovací dávka přípravku je 9,1 mg. Po 2 hodinách Vám může Váš lékař předepsat druhou dávku poté, co pečlivě zváží Váš stav, a může Vám dávku snížit na 4,5 mg, pokud se domnívá, že je tato dávka vhodnější k léčbě Vašeho stavu.
Přípravek ADASUVE budete používat pod dohledem lékaře nebo zdravotní sestry.
Přípravek ADASUVE je k inhalačnímu podání. Jakmile pro Vás lékař nebo zdravotní sestra přípravek ADASUVE připraví k použití, požádá Vás, abyste vzal(a) inhalátor do ruky, vydechl(a) a poté vložil(a) náustek do úst, vdechl(a) lék z inhalátoru a poté na chvilku zadržel(a) dech.
Jestliže jste použil(a) více přípravku ADASUVE, než jste měl(a)
Jestliže máte obavy, že Vám bylo podáno více přípravku ADASUVE, než považujete za nutné, sdělte tyto své obavy lékaři nebo zdravotní sestře. Pacienti, kterým bylo podáno více přípravku ADASUVE, než mělo, mohou mít některé z následujících příznaků: velká únava nebo ospalost, dechové potíže, nízký krevní tlak, podráždění v krku nebo nepříjemná chuť v ústech, pohyby svalů nebo očí, které nemůžete ovládat.
Máte-li jakékoli další otázky ohledně používání tohoto léčivého přípravku, zeptejte se svého lékaře nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u
každého.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z následujících nežádoucích účinků, sdělte to ihned svému lékaři a
přestaňte lék používat:
• jakékoli dechové příznaky, jako je sípot, kašel, dušnost, svírání na hrudi, neboť to by mohlo znamenat, že lék dráždí Vaše dýchací cesty (vyskytuje se méně často, pokud nemáte astma nebo CHOPN),
• závrať nebo mdloby, neboť to by mohlo znamenat, že lék snižuje Váš krevní tlak (vyskytuje se méně často),
• zhoršování agitovanosti nebo zmatenosti, zejména v kombinaci s horečkou nebo ztuhlostí svalů (vyskytuje se vzácně). Tyto příznaky mohou být spojeny se závažným stavem nazývaným neuroleptický maligní syndrom (NMS).
Pokud se u Vás vyskytne kterýkoli z následujících nežádoucích účinků, který se může vyskytnout i při
užívání jiných lékových forem tohoto léku, sdělte to také svému lékaři:
Velmi časté (mohou postihnout více než 1 osobu z 10): nepříjemná chuť v ústech nebo ospalost.
Časté (mohou postihnout až 1 osobu z 10): závrať, podráždění v krku, suchá ústa nebo únava.
Méně časté (mohou postihnout až 1 osobu ze 100): pohyby svalů nebo očí, které nemůžete ovládat, nedostatek koordinace, přetrvávající svalová kontrakce, pocit neklidu či neschopnost sedět v klidu.
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře.
Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V
Další nežádoucí účinky, které byly spojeny s dlouhodobým perorálním používáním loxapinu a které se mohou vztahovat i na přípravek ADASUVE, zahrnují mdloby při postavení se, zvýšená srdeční frekvence, zvýšený krevní tlak, rozmazané vidění, suché oči a omezené močení.
5. Jak přípravek ADASUVE uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte přípravek ADASUVE po uplynutí doby použitelnosti uvedené na štítku. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v původním váčku až do vlastního použití, aby byl přípravek chráněn před světlem a vlhkostí.
Nepoužívejte přípravek ADASUVE, pokud si všimnete, že je váček otevřený nebo natržený, nebo přípravek nese jakékoli známky fyzického poškození.
Nevyhazujte přípravek ADASUVE do domácího odpadu. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek ADASUVE obsahuje
Léčivou látkou je loxapinum. Jeden jednodávkový inhalátor obsahuje 10 mg loxapinu a dodává 9,1 mg loxapinu.
Jak přípravek ADASUVE vypadá a co obsahuje toto balení
Přípravek ADASUVE 9,1 mg dávkovaný prášek k inhalaci se skládá z bílého plastového jednodávkového inhalátoru určeného k jednorázovému použití, který obsahuje loxapin. Přípravek ADASUVE je zabalen v zataveném foliovém váčku, který obsahuje jeden jednodávkový inhalátor. Přípravek ADASUVE 9,1 mg se dodává v krabičce s 1 nebo 5 jednotkami.
Držitel rozhodnutí o registraci
Ferrer International, S.A.
Gran Vía Carlos III, 94 08028- Barcelona Španělsko
Výrobce
Ferrer International, S.A.
Joan Buscalla, 1-9, 08173 Sant Cugat del Valles Barcelona, Španělsko
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci. Belgie/Belgique/Belgien Lietuva
Ferrer Internacionál, S.A. Tél/Tel: +34 93 600 37 00
|
EtnrapHH AOP Orphan Pharmaceuticals AG BG Ten.: +35 988 6666096 |
Luxembourg/Luxemburg Ferrer International, S.A. Tél/Tel: +34 93 600 37 00 |
|
Česká republika AOP Orphan Pharmaceuticals AG CZ Tel: +420 251 512 947 |
Magyarország AOP Orphan Pharmaceuticals AG HU Tel.: +36 1 3192633 |
|
Danmark Medivir AB Tlf: +46 8 407 64 30 |
Malta Ferrer International, S.A. Tel.: +34 93 600 37 00 |
|
Deutschland Trommsdorff GmbH & Co. KG Tel: +49-(0) 2404/553-01 |
Nederland Ferrer International, S.A. Tel.: +34 93 600 37 00 |
|
Eesti AOP Orphan Pharmaceuticals AG LT Tel: +370 672 12222 |
Norge Medivir AB Tlf: +46 8 407 64 30 |
|
EXláSa Ferrer Galenica S.A. T^: +30 210 52 81 700 |
Osterreich AOP Orphan Pharmaceuticals AG Tel: +43 1 5037244-0 |
|
Espaňa Ferrer International, S.A. Tel.: +34 93 600 37 00 |
Polska AOP Orphan Pharmaceuticals S.A. PL Tel: +48 22 5424068 |
|
France Ferrer International, S.A. Tél: +34 93 600 37 00 |
Portugal Ferrer Portugal, S.A. Tel: +351 214449600 |
|
Hrvatska AOP Orphan Pharmaceuticals AG Tel: +43 1 5037244-0 |
Románia Galenica S.A. Tel: +30 210 52 81 700 |
|
Ireland Galen Limited Tel: +44 (0)28 38334974 |
Slovenija AOP Orphan Pharmaceuticals AG Tel: +43 1 5037244-0 |
|
Ísland Medivir AB Sími: +46 8 407 64 30 |
Slovenská republika AOP Orphan Pharmaceuticals AG SK Tel: +421 31 5502271 |
|
Italia Angelini S.p.A. Tel: +39 06 780531 |
Suomi/Finland Medivir AB Puh/Tel: +46 8 407 64 30 |
|
Kúnpoq Galenica S.A. T^: +30 210 52 81 700 |
Sverige Medivir AB Tel: +46 8 407 64 30 |
|
Latvija |
United Kingdom |
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky na adrese http://www.ema.europa.eu.
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Pouze k inhalačnímu podání
Před použitím si přečtěte všechny pokyny. Více informací naleznete v souhrnu údajů o přípravku.
Seznámení se s přípravkem ADASUVE: Níže uvedené obrázky ukazují důležité znaky přípravku ADASUVE.
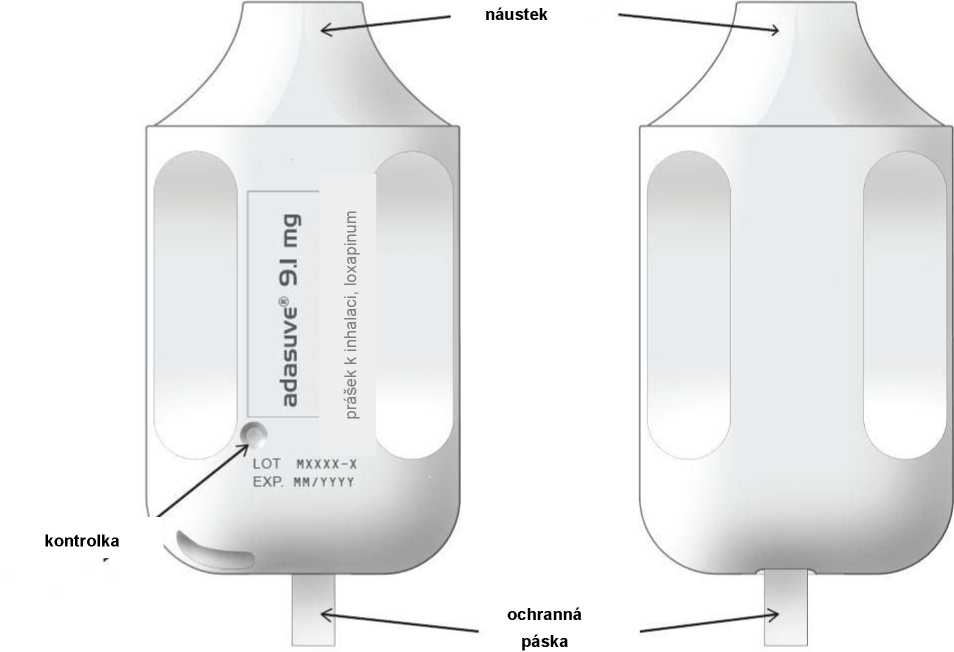
• Přípravek ADASUVE se dodává v zataveném váčku.
• Když se přípravek ADASUVE z váčku vyjme, je světlo kontrolky vypnuté.
• Kontrolka se rozsvítí (zeleně), jakmile se vytáhne ochranná páska. Inhalátor je pak připraven k použití.
• Po inhalaci léku kontrolka opět automaticky zhasne.
Před podáním přípravku ADASUVE pacientovi si přečtěte těchto 5 kroků:
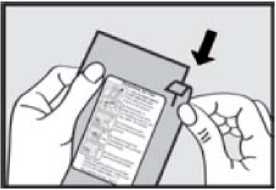
1. Otevřete váček
Váček otevřete až bezprostředně před použitím. Roztrhnutím foliový váček otevřete a vyjměte inhalátor z obalu.
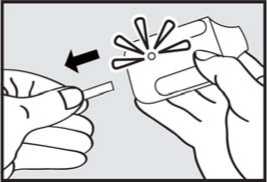
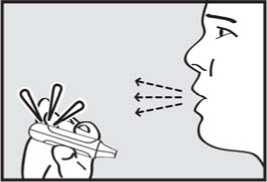
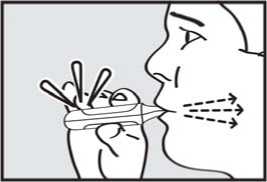
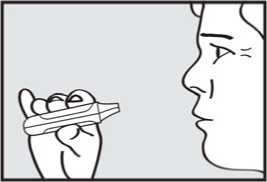
2. Vytáhněte ochrannou pásku
Pevně zatáhněte za plastovou ochrannou pásku na konci inhalátoru. Rozsvítí se zelená kontrolka indikující, že inhalátor je připraven k použití.
Použijte přípravek do 15 minut po vytažení ochranné pásky (nebo dokud zelená kontrolka nezhasne), abyste zabránili automatické deaktivaci inhalátoru.
Dejte pacientovi pokyn, aby:
3. vydechnul
Držte inhalátor stranou od úst a úplně vydechněte, abyste vyprázdnil(a) plíce.
4. se nadechnul
Zhluboka a plynule se nadechněte skrz náustek.
DŮLEŽITÉ: Zkontrolujte, zda zelená kontrolka po pacientově nádechu zhasla.
5. zadržel dech
Vyjměte náustek z úst a na chvilku zadržte dech.
POZOR: Jestliže zelená kontrolka zůstane po pacientově nádechu rozsvícená, požádejte pacienta, aby zopakoval kroky 3 až 5.
57