Abilify Maintena 300 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním Jedna injekční lahvička obsahuje aripiprazolum 300 mg.
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním Jedna injekční lahvička obsahuje aripiprazolum 400 mg.
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce
Jedna předplněná injekční stříkačka obsahuje aripiprazolum 300 mg.
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce
Jedna předplněná injekční stříkačka obsahuje aripiprazolum 400 mg.
Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním Prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce
Prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce
Prášek: bílý až téměř bílý Rozpouštědlo: čirý roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Abilify Maintena je indikován k udržovací léčbě schizofrenie u dospělých pacientů stabilizovaných pomocí perorálně podávaného aripiprazolu.
4.2 Dávkování a způsob podání
Dávkování
U pacientů, kteří nikdy neužívali aripiprazol, musí být před zahájením léčby pomocí Abilify Maintena zjištěna snášenlivost perorálně podávaného aripiprazolu.
Doporučená počáteční a udržovací dávka přípravku Abilify Maintena je 400 mg.
Titrace dávky tohoto léčivého přípravku se nevyžaduje. Podává se jednou měsíčně jako jedna injekce (nejdříve 26 dnů po předchozí injekci).
Po první injekci během zahajovacího období léčby by měla léčba pomocí 10 mg až 20 mg perorálně podávaného aripiprazolu pokračovat po dobu 14 po sobě jdoucích dnů, aby byla udržena terapeutická koncentrace aripiprazolu.
Pokud se při dávce 400 mg vyskytnou nežádoucí účinky, mělo by se zvážit snížení dávky na 300 mg jednou měsíčně.
Vynechané dávky
|
Vynechané dávky | |
|
Pokud se vynechá 2. nebo 3. dávka a pokud je doba od poslední injekce: |
Postup |
|
> 4 týdny a < 5 týdnů |
Injekce se podá co nejdříve a pak by se mělo pokračovat v režimu injekcí jednou měsíčně. |
|
> 5 týdnů |
Mělo by se na dobu 14 dnů zahájit současné užívání perorálního aripiprazolu s následně podanou injekcí a dále pokračovat v režimu injekcí jednou měsíčně. |
|
Pokud se vynechá 4. nebo jakákoliv další následná dávka (tj. po dosažení stabilního stavu) a pokud je doba od poslední injekce: |
Postup |
|
> 4 týdny a < 6 týdnů |
Injekce se podá co nejdříve a pak by se mělo pokračovat v režimu injekcí jednou měsíčně. |
|
> 6 týdnů |
Mělo by se na dobu 14 dnů zahájit současné užívání perorálního aripiprazolu s následně podanou injekcí a dále pokračovat v režimu injekcí jednou měsíčně. |
Zvláštní populace
Starší osoby
Bezpečnost a účinnost přípravku Abilify Maintena v léčbě schizofrenie u pacientů ve věku 65 let a starších nebyla stanovena (viz bod 4.4).
Porucha funkce ledvin
Pacienti s poruchou funkce ledvin nevyžadují úpravu dávkování (viz bod 5.2).
Porucha funkce jater
Pacienti s mírnou až středně těžkou poruchou funkce jater nevyžadují úpravu dávkování. Doporučení pro pacienty s těžkou poruchou funkce jater nelze stanovit, protože dostupná data nejsou dostatečná. U těchto pacientů, u kterých je zapotřebí opatrné dávkování, by měla být upřednostněna perorální forma (viz bod 5.2).
Osoby se známým pomalým metabolismem CYP2D6
U pacientů se známým pomalým metabolismem CYP2D6 by měla být úvodní a udržovací dávka 300 mg. V případě současného podávání se silnými inhibitory CYP3A4 by měla být dávka snížena na 200 mg (viz bod 4.5).
Úpravy dávky z důvodu interakcí
Úpravy dávky musí být provedeny u pacientů současně užívajících silné inhibitory CYP3A4 nebo silné inhibitory CYP2D6 po dobu delší než 14 dnů. Pokud se inhibitor CYP3A4 nebo inhibitor CYP2D6 přestane užívat, dávkování může být zvýšeno na předchozí dávku (viz bod 4.5). V případě nežádoucích účinků navzdory úpravě dávky přípravku Abilify Maintena by měla být znovu vyhodnocena nutnost současného používání inhibitoru CYP2D6 nebo CYP3A4.
Induktory CYP3A4 by se neměly podávat současně s přípravkem Abilify Maintena po dobu delší než 14 dnů, protože hladiny aripiprazolu v krvi se sníží a mohou se snížit až pod účinnou mez (viz bod 4.5).
Úpravy dávek přípravku Abilify Maintena u pacientů, kteří současně užívají silné inhibitory CYP2D6, silné inhibitory CYP3A4 a/nebo induktory CYP3A4 po dobu delší než 14 dnů
|
Upravená dávka | |
|
Pacienti užívající 400 mg přípravku Abilify Maintena | |
|
Silné inhibitory CYP2D6 nebo silné inhibitory CYP3A4 |
300 mg |
|
Silné inhibitory CYP2D6 a silné inhibitory CYP3A4 |
200 mg* |
|
Induktory CYP3A4 |
Vyhněte se užívání |
|
Pacienti užívající 300 mg přípravku Abilify Maintena | |
|
Silné inhibitory CYP2D6 nebo silné inhibitory CYP3A4 |
200 mg* |
|
Silné inhibitory CYP2D6 a silné inhibitory CYP3A4 |
160 mg* |
|
Induktory CYP3A4 |
Vyhněte se užívání |
Upravených dávek 200 mg a160 mg je dosaženo pouze použitím prášku Abilify Maintena a rozpouštědla pro injekční suspenzi s prodlouženým uvolňováním
Pediatrická populace
Bezpečnost a účinnost přípravku Abilify Maintena u dětí a dospívajících ve věku od 0 do 17 let nebyla stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Přípravek Abilify Maintena je určen pouze k intramuskulárnímu podání a nesmí se podávat intravenózně nebo subkutánně. Měl by ho podávat pouze zdravotnický pracovník.
Abilify Maintena prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním Suspenze má být injekčně aplikována okamžitě po rekonstituci, ale je možné ji uskladnit v injekční lahvičce při teplotě nižší než 25 °C po dobu až 4 hodin.
Abilify Maintena prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce
Suspenze má být injekčně aplikována okamžitě po rekonstituci, ale lze ji uchovat ve stříkačce při teplotě do 25 °C po dobu až 2 hodin.
Suspenze se má aplikovat pomalu v jedné injekci do hýžďového nebo deltového svalu (dávky se nesmí dělit). Je třeba dbát na to, aby se injekce náhodně neaplikovala do cévy.
Podání do hýžďového svalu
Pro aplikaci do hýžďového svalu je doporučena hypodermická bezpečnostní jehla 22G o délce 38 mm. U obézních pacientů (BMI > 28 kg/m2) by se měla použít hypodermická bezpečnostní jehla 21G o délce 50 mm. Injekce do hýžďového svalu se mají střídat do obou hýžďových svalů.
Podání do deltového svalu
Pro aplikaci do deltového svalu je doporučena hypodermická bezpečnostní jehla 23G o délce 25 mm.
U obézních pacientů by se měla použít hypodermická bezpečnostní jehla 22G o délce 38 mm. Injekce do deltového svalu se mají střídat do obou deltových svalů.
Lahvičky s práškem a rozpouštědlem a předplněné stříkačky jsou pouze na jedno použití.
Úplné pokyny k použití a zacházení s přípravkem Abilify Maintena jsou uvedeny v příbalové informaci (informace určené pro zdravotnické pracovníky).
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Zlepšení klinického stavu pacienta se v průběhu antipsychotické léčby může objevit po několika dnech až týdnech. Pacienti mají být pečlivě sledováni po celou dobu tohoto období.
Použití u pacientů ve stavu akutní agitovanosti nebo těžké psychózy
Abilify Maintena se nesmí používat při ošetřování pacientů ve stavu akutní agitovanosti nebo těžké psychózy, kdy je okamžitě nutno dostat příznaky pod kontrolu.
Suicidalita
Výskyt sebevražedného chování je vlastní psychotickým onemocněním a v některých případech byl hlášen časně po zahájení nebo změně antipsychotické léčby včetně léčby aripiprazolem (viz bod 4.8). U vysoce rizikových pacientů by antipsychotická léčba by měla být provázena důkladným dohledem.
Kardiovaskulární onemocnění
Aripiprazolu by se měl používat s opatrností u pacientů se známým kardiovaskulárním onemocněním (infarkt myokardu nebo ischemická choroba srdeční v anamnéze, srdeční selhání nebo abnormality převodu), s cerebrovaskulárním onemocněním, se stavy, které by mohly pacienty predisponovat k hypotenzi (dehydratace, hypovolemie a léčba antihypertenzivy) nebo hypertenzi včetně akcelerované nebo maligní. V souvislosti s užíváním antipsychotik byly hlášeny případy žilního tromboembolismu (VTE). Protože se u pacientů léčených antipsychotiky často vyskytují získané rizikové faktory pro VTE, měly by být před a během léčby aripiprazolem rozpoznány všechny možné rizikové faktory pro VTE a měla by být provedena preventivní opatření (viz bod 4.8).
Prodloužení QT intervalu
V klinických studiích léčby s perorálně podávaným aripiprazolem byla incidence prodloužení QT intervalu srovnatelná s placebem. Aripiprazol by se měl používat s opatrností u pacientů s prodloužením QT intervalu v rodinné anamnéze (viz bod 4.8).
Tardivní dyskineze
V jednoročních nebo kratších klinických studiích byly případy akutní dyskineze vzniklé při léčbě aripiprazolem hlášeny méně často. Pokud se u pacienta užívajícího aripiprazol známky a příznaky tardivní dyskineze objeví, mělo by se zvážit snížení dávky nebo přerušení léčby (viz bod 4.8). Tyto příznaky se mohou dočasně zhoršit nebo mohou dokonce vzniknout až po přerušení léčby.
Neuroleptický maligní syndrom (NMS)
NMS je potenciálně fatální komplex příznaků související s antipsychotickými léky. V klinických studiích byly v souvislosti s léčbou aripiprazolem hlášeny vzácné případy NMS. NMS se klinicky manifestuje hyperpyrexií, svalovou rigiditou, alterací duševního stavu a projevy nestability autonomního nervového systému (nepravidelný tep nebo krevní tlak, tachykardie, pocení a srdeční dysrytmie). Mezi další příznaky může patřit zvýšení kreatinfosfokinázy, myoglobinurie (rhabdomyolýza) a akutní selhání ledvin. Avšak byly hlášeny také případy, kdy zvýšení kreatinfosfokinázy a rhabdomyolýza nebyly jednoznačně v souvislosti s NMS. Objeví-li se u pacienta známky a příznaky příznačné pro NMS nebo nevysvětlitelná vysoká horečka bez dalších klinických projevů NMS, podávání všech antipsychotických léčivých přípravků, včetně aripiprazolu, musí být přerušeno (viz bod 4.8).
V klinických studiích byly vzácně hlášeny případy epileptických záchvatů v průběhu léčby aripiprazolem. Proto se u pacientů, kteří mají záchvatovité onemocnění v anamnéze nebo mají stavy provázené záchvaty, vyžaduje při užívání aripiprazolu opatrnost (viz bod 4.8).
Starší pacienti s psychózou spojenou s demencí
Zvýšená mortalita
Ve třech placebem kontrolovaných studiích s perorálně užívaným aripiprazolem u starších pacientů s psychózou spojenou s Alzheimerovou nemocí (n = 938; průměrný věk: 82,4 let; rozpětí: 56-99 let) měli pacienti léčení aripiprazolem zvýšené riziko úmrtí ve srovnání s placebem. Úmrtnost ve skupině pacientů léčených perorálně podávaným aripiprazolem byla 3,5 % ve srovnání s 1,7 % v placebo skupině. Ačkoliv příčiny úmrtí byly různé, zdá se, že většina úmrtí byla buď původu kardiovaskulárního (např. srdeční selhání, náhlá smrt) nebo infekčního (např. pneumonie) (viz bod 4.8).
Cerebrovaskulární nežádoucí účinky
Ve stejných studiích s perorálně podávaným aripiprazolem byly u pacientů (průměrný věk: 84 let; rozpětí: 78-88 let) zaznamenány cerebrovaskulární nežádoucí účinky (např. cévní mozková příhoda, tranzitorní ischemická ataka) včetně úmrtí. Celkově byly v těchto studiích u pacientů léčených perorálně podávaným aripiprazolem zaznamenány cerebrovaskulární nežádoucí účinky u 1,3 % pacientů ve srovnání s 0,6 % pacientů v placebo skupině. Tento rozdíl nebyl statisticky významný. Avšak v jedné z těchto studii s fixní dávkou byl signifikantní vztah mezi dávkou a výskytem cerebrovaskulárních nežádoucích účinků u pacientů léčených aripiprazolem (viz bod 4.8).
Aripiprazol není určen k léčbě pacientů s psychózou spojenou s demencí.
Hyperglykemie a diabetes mellitus
Hyperglykemie, v některých případech extrémní a spojená s ketoacidózou nebo hyperosmolárním kómatem nebo úmrtím, byla zaznamenána u pacientů léčených atypickými antipsychotiky, včetně aripiprazolu. Rizikové faktory, které mohou predisponovat pacienty k těžkým komplikacím, zahrnují obezitu a výskyt diabetu v rodinné anamnéze. V klinických studiích s aripiprazolem nebyly zaznamenány žádné signifikantní rozdíly ve výskytu nežádoucích účinků spojených s hyperglykemií (včetně diabetu) nebo abnormálními glykemickými laboratorními hodnotami ve srovnání s placebem. Konkrétní odhady rizika nežádoucích účinků, spojených s hyperglykemií u pacientů léčených aripiprazolem a jinými atypickými antipsychotiky, nejsou pro přímá srovnání dostupné. Pacienti léčení jakýmikoli antipsychotickými přípravky včetně aripiprazolu by měli být sledováni kvůli známkám a příznakům hyperglykemie (např. polydipsie, polyurie, polyfagie a slabost) a pacienti s diabetem mellitus nebo s faktory rizikovými pro diabetes mellitus by měli být pravidelně sledováni z hlediska možného zhoršení glukosové tolerance (viz bod 4.8).
Hypersenzitivita
U aripiprazolu se mohou objevit hypersenzitivní reakce, vyznačující se alergickými příznaky.
Zvýšení tělesné hmotnosti
Zvýšení tělesné hmotnosti, které může vést k závažným komplikacím, je často zaznamenáno u pacientů se schizofrenií kvůli užívání antipsychotik, o nichž je známo, že způsobují zvýšení tělesné hmotnosti, kvůli komorbiditám a kvůli nevhodnému životnímu stylu. Během postmarketingového sledování bylo u pacientů, kterým byl předepsán perorálně užívaný aripiprazol, zaznamenáno zvýšení tělesné hmotnosti. Pokud k němu dojde, je obvykle spojeno s významnými rizikovými faktory, jako jsou diabetes v anamnéze, onemocnění štítné žlázy nebo adenom hypofýzy. V klinických studiích nebylo prokázáno, že aripiprazol způsobuje klinicky významné zvýšení tělesné hmotnosti (viz bod 4.8).
Dysfagie
Ezofageální dysmotilita a aspirace byly pozorovány ve spojení s užíváním antipsychotických přípravků, včetně aripiprazolu. Aripiprazol by měl být užíván s opatrností u pacientů s rizikem aspirační pneumonie.
Patologické hráčství
Případy patologického hráčství se vyskytly v postmarketingových hlášeních u pacientů, kterým byl předepsán perorálně užívaný aripiprazol, a to bez ohledu na to, zda měli předchozí hráčství v anamnéze. U pacientů s patologickým hráčstvím v anamnéze může být zvýšené riziko a měli by být pečlivě sledováni (viz bod 4.8).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Pro přípravek Abilify Maintena nebyly prováděny žádné studie interakcí. Informace uvedené níže byly převzaty ze studií s perorálně podávaným aripiprazolem.
Aripiprazol může zvyšovat účinek některých antihypertenziv kvůli svému antagonismu k a1-adrenergním receptorům. Vzhledem k primárnímu účinku aripiprazolu na CNS je zapotřebí věnovat zvýšenou pozornost, pokud je aripiprazol podáván v kombinaci s alkoholem nebo jinými léčivými přípravky působícími na CNS, které mají podobné nežádoucí účinky, jako je např. sedace (viz bod 4.8). Pokud je aripiprazol podáván současně s léčivými přípravky, o nichž je známo, že prodlužují QT interval nebo způsobují nerovnováhu elektrolytů, je nutné postupovat s opatrností.
Možnost ovlivnění aripiprazolu jinými léčivými přípravky
Aripiprazol je metabolizován více cestami pomocí enzymů CYP2D6 a CYP3A4, ale nikoli pomocí enzymů CYP1A. Tudíž kuřáci nevyžadují žádnou úpravu dávkování.
Chinidin a jiné silné inhibitory CYP2D6
V klinické studii s perorálně podávaným aripiprazolem u zdravých subjektů zvýšil silný inhibitor CYP2D6 (chinidin) hodnoty AUC aripiprazolu o 107 %, zatímco hodnota Cmax se nezměnila. Hodnoty AUC a Cmax aktivního metabolitu, dehydroaripiprazolu, byly sníženy o 32 %, resp. o 47 %. Lze očekávat, že ostatní silné inhibitory CYP2D6, jako je fluoxetin a paroxetin, mají podobný účinek, a tudíž by se mělo použít podobné snížení dávkování (viz bod 4.2).
Ketokonazol a jiné silné inhibitory CYP3A4
V klinické studii s perorálně podávaným aripiprazolem u zdravých subjektů zvýšil silný inhibitor CYP3A4 (ketokonazol) hodnoty AUC a Cmax aripiprazolu o 63 % resp. o 37 %. Hodnoty AUC a Cmax dehydroaripiprazolu se zvýšily o 77 % resp. o 43 %. Současné užití silných inhibitorů CYP3A4 u osob s pomalým metabolismem CYP2D6 může vyústit ve vyšší plazmatické koncentrace aripiprazolu ve srovnání s osobami, které mají rychlý metabolismus CYP2D6 (viz bod 4.2). Pokud se zvažuje současné podání ketokonazolu nebo jiných silných CYP3A4 inhibitorů s aripiprazolem, možný přínos pro pacienta by měl převážit možná rizika. Lze očekávat, že ostatní silné inhibitory CYP3A4, jako je itrakonazol a inhibitory HIV proteáz, mají podobný účinek, a proto by se mělo použít podobné snížení dávkování (viz bod 4.2). Po vysazení inhibitorů CYP2D6 nebo CYP3A4 by se dávka aripiprazolu měla zvýšit na úroveň, která předcházela zahájení současné terapie. Při současném podávání slabých inhibitorů CYP3A4 (např. diltiazem) nebo CYP2D6 (např. escitalopram) s tímto léčivým přípravkem lze očekávat mírné zvýšení koncentrací aripiprazolu v plazmě.
Karbamazepin a jiné induktory CYP3A4
Při současném podávání karbamazepinu, silného induktoru CYP3A4, a perorálně podávaného aripiprazolu pacientům se schizofrenií nebo schizoafektivní poruchou byly geometrické průměry hodnot Cmax a AUC pro aripiprazol o 68 % resp. 73 % nižší ve srovnání s podáváním samotného aripiprazolu (30 mg). Obdobně byly geometrické průměry hodnot Cmax a AUC pro dehydroaripiprazol po podání karbamazepinu o 69 %, resp. 71 % nižší než ty, které byly zjištěny po léčbě samotným perorálně podávaným aripiprazolem. Je-li přípravek Abilify Maintena podáván současně s ostatními induktory CYP3A4 (jako je rifampicin, rifabutin, fenytoin, fenobarbital, primidon, efavirenz, nevirapin a třezalka), lze očekávat, že mají podobné účinky. Současné podávání induktorů CYP3A4 s přípravkem Abilify Maintena není vhodné, protože se snižují hladiny aripiprazolu v krvi a mohou se snížit až pod účinnou mez.
Valproát a lithium
Byl-li současně s aripiprazolem podáván valproát nebo lithium, k žádným signifikantním změnám koncentrací aripiprazolu nedošlo, a proto není třeba jakkoliv upravovat dávku, pokud se současně s přípravkem Abilify Maintena podává valproát nebo lithium.
Možnost ovlivnění jiných léčivých přípravků aripiprazolem
V klinických studiích neměl perorálně podávaný aripiprazol v dávkách 10-30 mg/den signifikantní vliv na metabolismus substrátů CYP2D6 (poměr dextromethorfan/3-methoxymorfinan), CYP2C9 (warfarin), CYP2C19 (omeprazol) a CYP3A4 (dextromethorfan). Navíc aripiprazol a dehydroaripiprazol in vitro neprokázal schopnost ovlivnit metabolismus zprostředkovávaný CYP1A2. Tudíž je nepravděpodobné, že by přípravek Abilify Maintena způsobil klinicky významné lékové interakce léčivých přípravků zprostředkované těmito enzymy.
Při současném podávání aripiprazolu s lamotriginem, dextromethorfanem, warfarinem, omeprazolem, escitalopramem nebo venlafaxinem nedošlo k žádným klinicky významným změnám v koncentracích těchto léčivých přípravků. Proto se při současném podávání těchto léčivých přípravků s přípravkem Abilify Maintena nevyžaduje žádná úprava dávkování těchto léčivých přípravků.
Serotoninový syndrom
Byly hlášeny případy serotoninového syndromu u pacientů užívajících aripiprazol; možné známky a příznaky tohoto stavu se mohou objevit zejména při současném užívání s jinými serotonergními léčivými přípravky, jako jsou SSRI/SNRI, nebo s jinými léčivými přípravky, o kterých je známo, že zvyšují koncentrace aripiprazolu (viz bod 4.8).
4.6 Fertilita, těhotenství a kojení
Neexistují adekvátní a dobře kontrolované studie aripiprazolu u těhotných žen. Byly hlášeny vrozené vady, nicméně příčinná souvislost s aripiprazolem nemohla být stanovena. Studie na zvířatech nemohly vyloučit možnost vývojové toxicity (viz bod 5.3). Pacientky musí být poučeny, aby v průběhu léčby aripiprazolem informovaly svého lékaře o tom, že otěhotněly nebo otěhotnět v průběhu léčby přípravkem Abilify Maintena zamýšlejí. Vzhledem k nedostatečným informacím o bezpečnosti u lidí a vzhledem k výsledkům reprodukčních studií na zvířatech by se tento lék neměl během těhotenství užívat, aniž by očekávaný přínos jasně odůvodnil potenciální riziko pro plod.
Lékaři předepisující přípravek Abilify Maintena by si měli být vědomi jeho dlouhodobého působení.
U novorozenců, kteří byli vystaveni antipsychotikům (včetně aripiprazolu) během třetího trimestru těhotenství, existuje riziko výskytu nežádoucích účinků zahrnujících extrapyramidové příznaky a/nebo příznaky z vysazení, které se mohou po porodu lišit v závažnosti a délce trvání. Byly hlášeny případy agitovanosti, hypertonie, hypotonie, tremoru, somnolence, dechové tísně nebo potíží při krmení. Novorozenci proto musí být pečlivě sledováni (viz bod 4.8).
Kojení
Aripiprazol se vylučuje do lidského mléka. Na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku je nutno rozhodnout, zda přerušit kojení nebo ukončit/přerušit podávání přípravku Abilify Maintena.
Fertilita
Na základě údajů ze studií reprodukční toxicity aripiprazol nenarušil fertilitu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Aripiprazol má malý nebo mírný vliv na schopnost řídit nebo obsluhovat stroje kvůli potenciálním účinkům na nervový systém a zrak, jako je sedace, somnolence, synkopa, rozmazané vidění, diplopie (viz bod 4.8). Proto by se mělo pacientům doporučit, aby neřídili ani neobsluhovali stroje, dokud nebude známá jejich individuální citlivost na tento léčivý přípravek.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nejčastější nežádoucí účinky, hlášené u > 5 % pacientů v dvojitě zaslepených dlouhodobých studiích s přípravkem Abilify Maintena, zahrnovaly zvýšení tělesné hmotnosti (9,0 %), akatizii (7,9 %), insomnii (5,8 %) a bolest v místě injekce (5,1 %).
Tabulkový seznam nežádoucích účinků
Incidence nežádoucích účinků souvisejících s léčbou aripiprazolem jsou uvedeny v tabulce níže. Tabulka vychází z nežádoucích účinků hlášených během klinických studií a/nebo post-marketingovém užívání.
Všechny nežádoucí účinky jsou uvedeny podle třídy orgánových systémů a frekvence; velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1,000 až < 1/100), vzácné (> 1/10,000 až < 1/1,000), velmi vzácné (< 1/10,000) a není známo (z dostupných údajů nelze určit). V rámci každé skupiny frekvence jsou nežádoucí účinky uvedeny v pořadí s klesající závažností.
Frekvence nežádoucích účinků hlášených během postmarketingového používání nelze určit, protože se odvozuje od spontánních hlášení. V důsledku toho je frekvence těchto nežádoucích účinků kvalifikována jako „není známo”.
|
Časté |
Méně časté |
Není známo | |
|
Poruchy krve a lymfatického systému |
Neutropenie Anemie T rombocytopenie Snížený počet neutrofilů Snížený počet bílých krvinek |
Leukopenie | |
|
Poruchy imunitního systému |
Hypersenzitivita |
Alergické reakce (např. anafylaktická reakce, angioedém, včetně zduřelého jazyka, edému jazyka, edému obličeje, pruritu nebo kopřivky) |
|
Časté |
Méně časté |
Není známo | |
|
Endokrinní poruchy |
Snížená hladina prolaktinu v krvi Hyperprolaktinémie |
Diabetické kóma hyperosmolární Diabetická ketoacidóza | |
|
Poruchy metabolismu a výživy |
Zvýšená tělesná hmotnost Diabetes mellitus Snížená tělesná hmotnost |
Hyperglykemie Hypercholesterolemie Hyperinzulinemie Hyperlipidemie Hypertriglyceridemie Porucha chuti k jídlu |
Hyponatremie |
|
Psychiatrické poruchy |
Agitovanost Úzkost Neklid Insomnie |
Sebevražedná představa Psychotická porucha Halucinace Blud Hypersexualita Panická reakce Deprese Afektivní labilita Apatie Dysforie Porucha spánku Bruxismus Snížené libido Změněná nálada |
Dokonaná sebevražda Sebevražedný pokus Patologické hráčství Nervozita Agrese |
|
Poruchy nervového systému |
Extrapyramidová porucha Akatizie Tremor Dyskineze Sedace Somnolence Závrať |
Dystonie Tardivní dyskineze Parkinsonismus Porucha pohybu Psychomotorická hyperaktivita Syndrom neklidných nohou Fenomén ozubeného kola Hypertonie Bradykineze Slintání Dysgeuzie Parosmie |
Neuroleptický maligní syndrom Grand mal záchvat Serotoninový syndrom Porucha řeči |
|
Poruchy oka |
Okulogyrická krize Rozmazané vidění Bolest oka Diplopie | ||
|
Srdeční poruchy |
Komorové extrasystoly Bradykardie Snížení amplitudy T vlny na elektrokardiogramu Elektrokardiogram abnormální Inverze T vlny na elektrokardiogramu |
Náhlá nevysvětlitelná smrt Srdeční zástava Torsades de pointes Komorové Prodloužení QT intervalu | |
|
Cévní poruchy |
Hypertenze Ortostatická hypotenze Zvýšený krevní tlak |
Synkopa Žilní tromboembolismus (včetně plicní embolie a hluboké žilní trombózy) |
|
Časté |
Méně časté |
Není známo | |
|
Respirační, hrudní a mediastinální poruchy |
Škytavka |
Orofaryngeální spasmus Laryngospasmus Pneumonie aspirační | |
|
Gastrointesti nální poruchy |
Sucho v ústech |
Gastroesofageální refluxní choroba Diarea Bolest horní části břicha Břišní diskomfort Obstipace Časté vyprazdňování střev Hypersekrece slin |
Pankreatitida Dysfagie |
|
Poruchy jater a žlučových cest |
Abnormální funkční jaterní test Zvýšené jaterní enzymy Zvýšená alaninaminotransferáza Zvýšená gamaglutamyltransferáza Zvýšený bilirubin v krvi Zvýšená aspartátaminotransferáza |
Selhání jater Ikterus Hepatitida Zvýšená alkalická fosfatáza | |
|
Poruchy kůže a podkožní tkáně |
Alopecie Akné Rosacea Ekzém Kožní indurace |
Fotosenzitivní reakce Hyperhidróza | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Muskuloskeletální ztuhlost |
Svalová rigidita Svalové spasmy Svalové fascikulace Tuhost svalů Myalgie Bolest v končetině Artralgie Bolest zad Omezená kloubní hybnost Rigidita šíje Trismus |
Rhabdomyolýza |
|
Poruchy ledvin a močových cest |
Nefrolitiáza Glykosurie |
Močová retence Močová inkontinence | |
|
Stavy spojené s těhotenstvím, šestinedělím a perinatálním obdobím |
Syndrom z vysazení léku u novorozenců (viz bod 4.6) | ||
|
Poruchy reprodukční- |
Erektilní dysfunkce |
Galaktorea Gynekomastie |
Priapismus |
|
Časté |
Méně časté |
Není známo | |
|
ho systému a prsu |
Citlivost prsu Vulvovaginální suchost | ||
|
Celkové poruchy a reakce v místě aplikace |
Bolest v místě injekce Indurace v místě injekce Únava |
Pyrexie Astenie Porucha chůze Hrudní diskomfort Reakce v místě injekce Erytém v místě injekce Zduření v místě injekce Diskomfort v místě injekce Pruritus v místě injekce Žízeň Pomalost |
Porucha termoregulace (tj. hypotermie, pyrexie) Bolest na hrudi Periferní otok |
|
Vyšetření |
Zvýšená kreatinfosfokináz a v krvi |
Zvýšená glykemie Snížená glykemie Zvýšený glykosylovaný hemoglobin Zvýšený obvod pasu Snížený cholesterol v krvi Snížené triglyceridy v krvi |
Kolísání hladiny glukosy v krvi |
Popis vybraných nežádoucích účinků
Reakce v místě injekce
Během dvojitě zaslepených kontrolovaných fází dvou dlouhodobých studií byly pozorovány reakce v místě injekce; byly obecně mírné až středně závažné a během času vymizely. Bolest v místě injekce (incidence 5,1 %) měla střední hodnotu výskytu 2. den po aplikaci injekce a střední hodnotu doby trvání 4 dny.
V otevřené studii srovnávající biodostupnost přípravku Abilify Maintena podávaného do deltového nebo hýžďového svalu byly reakce v místě aplikace injekce mírně častější v případě aplikace do deltového svalu. Většina z nich byla mírná a zlepšila se při následných injekcích. Při srovnání se studiemi, kdy byl přípravek Abilify Maintena injekčně aplikován do hýžďového svalu, byl opakovaný výskyt bolesti v místě aplikace častější v případě aplikace do deltového svalu.
Leukopenie
Neutropenie byla hlášena v klinickém programu s přípravkem Abilify Maintena, obvykle začínala okolo 16. dne po první injekci a trvala průměrně 18 dnů.
Extrapyramidové symptomy (EPS)
Ve studiích byl u stabilních pacientů trpících schizofrenií přípravek Abilify Maintena spojen s vyšší frekvencí výskytu příznaků EPS (18,4 %) než u léčby perorálním aripiprazolem (11,7 %). Akatizie byla nejčastěji pozorovaným příznakem (8,2 %), obvykle začínala kolem 10. dne po první injekci a trvala průměrně 56 dnů. U subjektů s akatizií byla obvykle nasazena léčba anticholinergiky, primárně benzatropin-mesylátem a trihexyfenidylem. Méně často byl ke zvládnutí akatizie podáván propranolol nebo benzodiazepiny (klonazepam a diazepam). Ve frekvenci výskytu následoval parkinsonismus v míře 6,9 % u přípravku Abilify Maintena, 4,15 % u aripiprazolu 10-30 mg v tabletové formě a 3,0 % u placeba.
Dystonie
Účinky terapeutické skupiny: Symptomy dystonie, dlouhotrvající abnormální kontrakce svalových skupin, se mohou objevit u citlivých jedinců během několika prvních dnů léčby. Mezi symptomy dystonie patří: křeče krčních svalů, někdy progredujících až do ztuhlosti hrdla, potíže s polykáním, obtížné dýchání a/nebo protruze jazyka. Zatímco se mohou tyto příznaky objevit při nízkých dávkách, objevují se častěji a s větší závažností u vysoce účinných a ve vyšších dávkách podávaných antipsychotik první generace. Zvýšené riziko akutní dystonie bylo pozorováno u mužů a mladších věkových skupin.
Tělesná hmotnost
Během dvojitě zaslepené fáze s aktivní kontrolou 38týdenní dlouhodobá studie byla incidence nárůstu tělesné hmotnosti > o 7 % mezi počáteční a poslední návštěvou 9,5 % u přípravku Abilify Maintena a 11,7 % u perorálních 10-30mg tablet aripiprazolu. Incidence snížení tělesné hmotnosti o > 7 % od počáteční po poslední návštěvu byla 10,2 % u Abilify Maintena a 4,5 % u perorálních 10-30mg tablet aripiprazolu. Během dvojitě zaslepené, placebem kontrolované fáze 52týdenní dlouhodobá studie byla incidence nárůstu tělesné hmotnosti o > 7 % od počátečního stavu po poslední návštěvu 6,4 % u přípravku Abilify Maintena a 5,2 % u placeba.
Incidence snížení tělesné hmotnosti o > 7 % od počátečního stavu po poslední návštěvu byla 6,4 % u přípravku Abilify Maintena a 6,7 % u placeba. Během dvojitě zaslepené léčby byla střední hodnota změny tělesné hmotnosti od počáteční po poslední návštěvu -0,2 kg u přípravku Abilify Maintena a -0,4 kg u placeba (p = 0,812).
Prolaktin
V klinických studiích pro schválené indikace a v postmarketingových studiích bylo u aripiprazolu pozorováno jak zvýšení, tak snížení hladiny prolaktinu v séru ve srovnání s počátečním stavem (bod 5.1).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
V klinických studiích s přípravkem Abilify Maintena nebyly hlášeny žádné případy předávkování související s nežádoucími účinky. Je třeba dbát na to, aby nedošlo k náhodné injekci tohoto léčivého přípravku do cévy. Po jakémkoliv potvrzeném předávkování/náhodné nitrožilní aplikaci, nebo při takovém podezření, je potřeba pozorně pacienta pozorovat a pokud se objeví jakákoliv medicínsky závažná známka nebo příznak, vyžaduje se monitorování, včetně průběžného monitoringu EKG. Lékařský dohled a monitorování by mělo trvat až do pacientova zotavení.
Simulace nekontrolovaného uvolnění léčivé látky ukázala, že předpokládaný medián koncentrace aripiprazolu dosahuje vrcholu 4 500 ng/ml nebo přibližně 9násobku horní terapeutické hranice. V případě nekontrolovaného uvolnění léčivé látky se předpokládá, že koncentrace aripiprazolu rychle klesají na horní limit terapeutického okna asi po 3 dnech. Po 7 dnech střední koncentrace aripiprazolu dále klesají na koncentrace odpovídající depotní i.m. dávce bez nekontrolovaného uvolnění léčivé látky. U parenterálního podání je předávkování méně pravděpodobné než u perorálně podávaných léčivých přípravků, referenční informace pro předávkování perorálním podáním aripiprazolu jsou uvedeny níže.
Známky a příznaky
V klinických studiích a v postmarketingových zkušenostech bylo pozorováno náhodné nebo záměrné akutní předávkování aripiprazolem u dospělých pacientů s hlášenými odhadovanými dávkami až
1 260 mg (41násobek nejvyšší doporučené denní dávky aripiprazolu) bez fatálních následků. Potenciálně medicínsky důležité známky a příznaky zahrnovaly letargii, zvýšení krevního tlaku, somnolenci, tachykardii, nauzeu, zvracení a průjem. Kromě toho bylo hlášeno náhodné předávkování samotným aripiprazolem (do hodnoty 195 mg) u dětí bez fatálních následků. Potenciálně medicínsky závažné hlášené příznaky zahrnovaly somnolenci, přechodnou ztrátu vědomí a extrapyramidové symptomy.
Léčba předávkování
Léčba předávkování by se měla zaměřit na podpůrnou terapii, zajišťující dostatečně průchodné dýchací cesty, oxygenaci a ventilaci, a na zvládání příznaků. Měla by být zvážena možnost působení dalších léčivých přípravků. Ihned by se tudíž mělo začít s monitorováním kardiovaskulárního systému včetně průběžného monitoringu EKG k odhalení možných arytmií. Po jakémkoli potvrzeném předávkování aripiprazolem nebo při podezření na něj by měl lékařský dohled a sledování trvat až do pacientova zotavení.
Hemodialýza
Přestože nejsou žádné informace o účinku hemodialýzy v léčbě předávkování aripiprazolem, není pravděpodobné, že by hemodialýza byla při léčbě předávkování užitečná, jelikož vazba aripiprazolu na plazmatické bílkoviny je vysoká.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: psycholeptika, jiná antipsychotika, ATC kód: N05AX12 Mechanismus účinku
Předpokládá se, že účinnost aripiprazolu u schizofrenie se děje prostřednictvím kombinace částečného agonismu dopaminových D2 a serotoninových 5-HT1A receptorů a antagonismu serotoninových 5-HT2A receptorů. Na zvířecích modelech dopaminergní hyperaktivity vykazoval aripiprazol antagonistické vlastnosti a na zvířecích modelech dopaminergní hypoaktivity agonistické vlastnosti. Aripiprazol in vitro vykazuje vysokou vazebnou afinitu k dopaminovým D2 a D3, serotoninovým 5-HT1A a 5-HT2A receptorům, mírnou afinitu k dopaminovým D4, serotoninovým 5-HT2C a 5-HT7, alfa-1 adrenergním a histaminovým H1 receptorům. Aripiprazol také vykazoval mírnou vazebnou afinitu k místu zpětného vychytávání serotoninu a žádnou zjevnou afinitu k cholinergním muskarinovým receptorům. Některé další klinické účinky aripiprazolu mohou být vysvětleny interakcí s jinými receptory, než jsou subtypy dopaminových a serotoninových receptorů.
Dávky perorálního aripiprazolu v rozsahu od 0,5 do 30 mg podávané jednou denně zdravým jedincům po dobu 2 týdnů vyvolaly na dávce závislou redukci vazby 11C-raclopridu, ligandu receptoru D2/D3, v nc. caudatus a putamen, zjištěnou pozitronovou emisní tomografií.
Klinická účinnost a bezpečnost
Udržovací léčba schizofrenie u dospělých
Účinnost přípravku Abilify Maintena v udržovací léčbě pacientů se schizofrenií byla stanovena ve dvou randomizovaných dvojitě zaslepených dlouhodobých studiích.
Pivotní studií byla 38týdenní, randomizovaná, dvojitě zaslepená, aktivně kontrolovaná studie navržená za účelem prokázat účinnost, bezpečnost a snášenlivost tohoto léčivého přípravku, podávaného jako injekce jednou měsíčně ve srovnání s perorálními 10-30mg tabletami aripiprazolu, podávanými jednou denně v udržovací léčbě u dospělých pacientů trpících schizofrenií. Tato studie se skládala ze screeningové fáze a 3 léčebných fází: konverzní fáze, fáze perorální stabilizace a dvojitě zaslepené, aktivně kontrolované fáze.
Šest set šedesát dva pacientů. vyhovujících pro 38týdenní, dvojitě zaslepenou, aktivně kontrolovanou fázi, bylo náhodně zařazeno v poměru 2:2:1 do jedné z 3 léčebných skupin dvojitě zaslepené léčby: 1)
Abilify Maintena 2) stabilizační dávka perorálního aripiprazolu 10-30 mg nebo 3) aripiprazol s dlouhodobým účinkem, injekční, 50 mg/25 mg. Injekční dávka aripiprazolu s dlouhodobým účinkem, 50 mg/25 mg byla zařazena jako nízká dávka aripiprazolu k testování kontrolní citlivosti pro design noninferiority.
Výsledky analýzy primárního cílového parametru účinnosti, odhadovaného podílu pacientů s hrozícím relapsem do konce 26. týdne dvojitě zaslepené, aktivně kontrolované fáze prokázaly, že Abilify Maintena 400 mg/300 mg je noninferiorní vůči perorálním 10-30mg tabletám aripiprazolu. Odhadovaná míra relapsu do konce 26. týdne byla 7,12 % u přípravku Abilify Maintena a 7,76 % u perorálních 10-30mg tablet aripiprazolu, rozdíl -0,64 %.
Interval spolehlivosti 95 % CI (-5,26, 3,99) pro rozdíl v odhadovaném podílu pacientů s hrozícím relapsem do konce 26. týdne vylučoval předem definovanou mez noninferiority, 11,5 %. Proto je přípravek Abilify Maintena noninferiorní vůči perorálním 10-30mg tabletám aripiprazolu.
Odhadovaný podíl pacientů s hrozícím relapsem do konce 26. týdne pro přípravek Abilify Maintena byl 7,12 %, což je statisticky významně méně než u injekčního aripiprazolu s dlouhodobým účinkem, 50 mg/25 mg (21,80 %; p — 0,0006). Proto byla stanovena superiorita přípravku Abilify Maintena oproti injekčnímu aripiprazolu s dlouhodobým účinkem, 50 mg/25 mg, a byla potvrzena validita designu studie.
Kaplanovy-Meierovy křivky času od randomizace k hrozícímu relapsu během 38týdenní, dvojitě zaslepené aktivně kontrolované fáze u přípravku Abilify Maintena, u perorálního aripiprazolu 10-30 mg a u injekčně podávaného aripiprazolu s dlouhodobým účinkem 50 mg/25 mg jsou uvedeny na obrázku 1.
Obrázek 1 Kaplanův-Meierův graf product-limit pro čas do zhoršení psychotických příznaků/Hrozící relaps
ARIP IMD 400/ 300 mg
— — - ARIP 10-30 mg
— — ARIP IMD 50/25 mg
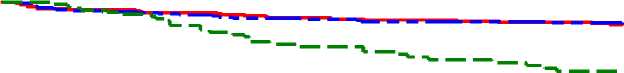
|
Log-rank test ARIP IMD 400/300 mg oproti ARIP 10-30 mg: hodnota p 0,9920 ARIP IMD 400/300 mg oproti ARIP IMD 50/25 mg: hodnota p < 0,0001 |
Počet rizikových subjektů
|
265 |
259 |
253 252 |
248 |
242 |
24 1 |
233 |
227 |
225 |
222 217 216 215 |
2 1 2 |
210 207 205 202 |
173 |
|
256 |
254 |
252 245 |
237 |
225 |
222 |
2 1 4 |
2 1 0 |
208 |
206 204 201 201 |
196 |
193 189 183 183 |
163 |
|
1 3 1 |
130 |
124 117 |
1 1 3 |
108 |
0 1 |
95 |
90 |
86 |
84 80 76 72 |
7 1 |
70 68 65 62 |
59 |
|
0 |
1 4 |
2 8 4 2 |
56 |
70 |
84 |
98 |
1 1 |
2 1 2 |
6 140 154 168 182 |
196 |
210 224 238 252 |
266 |
POZNÁMKA: ARIP IMD 400/300 mg — Abilify Maintena; ARIP 10-30 mg — perorální aripiprazol; ARIP IMD 50/25 mg — S
dlouhodobým účinkem pro injekční aplikaci
Dnů od randomizace
1,0 0,8 0,6 0,4 0,2
0,0
IMD 400/300 mg ARIP 10-30 mg IMD 50/25 mg
Kromě toho je non-inferiorita přípravku Abilify Maintena ve srovnání s perorálním aripiprazolem 10-30 mg podpořena výsledky analýzy škály Positive and Negative Syndrome Scale Score (PANSS).
Tabulka 1 Celkové skóre PANSS - Změna mezi výchozí návštěvou a 38. týdnem LOCF: Randomizovaný vzorek účinnosti a b
|
Celkové skóre PANSS - Změna mezi počáteční návštěvou a 38. týdnem LOCF: Randomizovaný vzorek účinnosti a’ b | |||
|
Abilify Maintena 400 mg/300 mg (n = 263) |
Perorální aripiprazol 10-30 mg/den (n = 266) |
Aripiprazol s dlouhodobým účinkem, injekční 50 mg/25 mg (n = 131) | |
|
Průměrná výchozí hodnota (SD) |
57,9 (12,94) |
56,6 (12,65) |
56,1 (12,59) |
|
Průměrná změna (SD) |
-1,8 (10,49) |
0,7 (11,60) |
3,2 (14,45) |
|
P-hodnota |
Nevztahuje se |
0,0272 |
0,0002 |
a: Záporná změna ve skóre naznačuje zlepšení.
b: Byli zařazeni pouze pacienti, kteří měli j ak počáteční, tak alespoň j ednu následnou hodnotu. P-hodnoty byly odvozeny ze srovnání pro
změnu oproti počáteční hodnotě v rámci analýzy modelu kovariance, kde léčba byla členem a počáteční hodnota kovariátem.
Druhá studie byla 52týdenní, randomizovaná vysazovací dvojitě zaslepená a byla provedena v USA u dospělých pacientů s aktuální diagnózou schizofrenie. Tato studie se skládala ze screeningové fáze a 4 léčebných fází: konverze, perorální stabilizace, stabilizace pomocí přípravku Abilify Maintena a dvojitě zaslepená, placebem kontrolovaná fáze. Pacienti splňující požadavek perorální stabilizace ve fázi perorální stabilizace byli zařazeni do podávání přípravku Abilify Maintena s jednoduchým zaslepením a zahájili fázi stabilizace pomocí přípravku Abilify Maintena minimálně po dobu 12 týdnů a maximálně po dobu 36 týdnů. Pacienti vyhovující pro dvojitě zaslepenou, placebem kontrolovanou fázi byli náhodně zařazeni v poměru 2:1 do dvojitě zaslepené léčby s přípravkem Abilify Maintena, resp. placebem.
Finální analýza účinnosti zahrnovala 403 randomizovaných pacientů a 80 zhoršení psychotických příznaků/hrozících relapsů. Ve skupině s placebem 39,6 % pacientů postoupilo k hrozícímu relapsu, zatímco u skupiny s přípravkem Abilify Maintena se hrozící relaps objevil u 10 % pacientů; tedy ve skupině s placebem bylo 5,03násobně vyšší riziko hrozícího relapsu.
Prolaktin
V dvojitě zaslepené, aktivně kontrolované fázi 38týdenní studie došlo mezi počáteční a poslední návštěvou k mírnému poklesu hodnot prolaktinu ve skupině s přípravkem Abilify Maintena (-0,33 ng/ml) ve srovnání se střední hodnotou zvýšení ve skupině s perorálně podávanými 10-30mg tabletami aripiprazolu (0,79 ng/ml; p < 0,01). Incidence u pacientů užívajících přípravek Abilify Maintena s hladinami prolaktinu > 1krát nad horní hranicí normálních hodnot (ULN) v jakémkoliv hodnocení byla 5,4 % ve srovnání s 3,5 % pacientů, kteří užívali perorálně 10-30mg tablety aripiprazolu. U mužů byla obecně vyšší incidence než u žen v každé léčebné skupině.
V dvojitě zaslepené, placebem kontrolované fázi 52týdenní studie došlo mezi počáteční a poslední návštěvou k mírnému poklesu hodnot prolaktinu ve skupině s přípravkem Abilify Maintena
(-0,38 ng/ml) ve srovnání se střední hodnotou zvýšení ve skupině s placebem (1,67 ng/ml). Incidence u pacientů užívajících přípravek Abilify Maintena s hladinami prolaktinu > 1krát nad horní hranicí normálních hodnot (ULN) byla 1,9 % ve srovnání se 7,1 % pacientů s placebem.
Akutní léčba schizofrenie u dospělých
Účinnost přípravku Abilify Maintena u dospělých pacientů s akutním relapsem schizofrenie byla stanovena v krátkodobé (12týdenní), randomizované, dvojitě zaslepené, placebem kontrolované studii (n = 339).
Primární cílový parametr (změna celkového skóre PANSS z výchozí hodnoty do týdne 10) prokázal superioritu přípravku Abilify Maintena (n = 167) oproti placebu (n = 172).
Podobně jako u celkového skóre PANSS, došlo ke zlepšení (snížení) skóre také v pozitivní a negativní dílčí škále PANSS oproti výchozí hodnotě.
Tabulka 2 Celkové skóre PANSS - Změna z výchozí hodnoty do 10. týdne: Randomizovaný vzorek účinnosti
|
Celkové skóre PANSS - Změna z výchozí hodnoty do 10. týdne: Randomizovaný vzorek účinnosti a | ||
|
Abilify Maintena 400 mg/300 mg |
Placebo | |
|
Střední výchozí hodnota (SD) |
102,4 (11,4) |
103,4 (11,1) |
|
n = 162 |
n = 167 | |
|
Střední hodnota změny LS (SE) |
-26,8 (1,6) |
-11,7 (1,6) |
|
n = 99 |
n = 81 | |
|
P-hodnota |
< 0,0001 | |
|
Rozdíl v léčběb (95 % CI) |
-15,1 (-19,4, -10,8) | |
a Data byla podrobena analýze s použitím přístupu opakovaných měření modelováním smíšených efektů (Mixed-Effects Model Repeated-Measures Analysis - MMRM). Analýza zahrnovala pouze pacienty, kteří byli náhodně zařazeni k léčbě, byla jim podána minimálně jedna injekce a absolvovali základní a minimálně jedno následné hodnocení účinnosti. b Rozdíl (Abilify Maintena minus placebo) v nejmenších čtvercích znamenají změnu oproti výchozímu stavu.
Přípravek Abilify Maintena také vykázal statisticky signifikantní zlepšení příznaků vyjádřených změnou skóre CGIS z výchozí hodnoty do týdne 10.
Osobní a sociální fungování bylo vyhodnoceno pomocí stupnice osobní a sociální výkonnosti (Personal and Social Performance, PSP). PSP je validovaná stupnice určená pro hodnocení lékařem, která hodnotí osobní a sociální fungování ve čtyřech oblastech: společensky prospěšné aktivity (např. práce a studium), osobní a sociální vztahy, péče o sebe sama a rušivé a agresivní chování. Byl prokázán statisticky signifikantní léčebný rozdíl ve prospěch přípravku Abilify Maintena 400 mg/300 mg ve srovnání s placebem v týdnu 10 (+ 7,1; p < 0,0001; 95 % Ci: 4,1; 10,1 s použitím modelu ANCOVA (LOCF)).
Bezpečnostní profil byl stejný jako u přípravku Abilify Maintena. Nicméně, byly zaznamenány rozdíly oproti udržovací léčbě schizofrenie. V krátkodobé (12týdenní), randomizované, dvojitě zaslepené, placebem kontrolované studii byla incidence zvýšení tělesné hmotnosti a akatizie u pacientů léčených přípravkem Abilify Maintena minimálně dvakrát vyšší než u placeba. Incidence zvýšení tělesné hmotnosti o > 7 % z výchozí hodnoty do poslední návštěvy (týden 12) byla 21,5 % u přípravku Abilify Maintena ve srovnání s 8,5 % u skupiny s placebem. Akatizie byla nejčastěji pozorovaným příznakem EPS (Abilify Maintena 11,4 % a skupina s placebem 3,5 %).
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem Abilify Maintena u všech podskupin pediatrické populace trpící schizofrenií (viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Absorpce
Po podání přípravku Abilify Maintena je absorpce aripiprazolu do systémového oběhu pomalá a prodloužená v důsledku nízké rozpustnosti částic aripiprazolu. Průměrný poločas absorpce přípravku Abilify Maintena je 28 dnů. Absorpce aripiprazolu z i.m. depotní formy byla úplná v porovnání se standardní i.m. formou (okamžité uvolnění). Hodnoty upravené pro dávku Cmax pro depotní formu byly přibližně 5 % Cmax standardní i.m. formy. Po podání jedné dávky přípravku Abilify Maintena do deltového a hýžďového svalu byl rozsah absorpce (AUC) podobný u obou míst aplikace injekce, ale rychlost absorpce (Cmax) byla vyšší po podání do deltového svalu. Po intramuskulární aplikaci několika dávek koncentrace aripiprazolu v plazmě postupně rostou do maximální koncentrace v plazmě se středním časem tmax 7 dnů v případě hýžďového svalu a 4 dnů v případě deltového svalu. Stabilních koncentrací bylo u typického subjektu dosaženo čtvrtou dávkou při obou místech aplikace. Po injekcích přípravku Abilify Maintena 300 mg a 400 mg bylo pozorováno nižší než na dávce závislé zvýšení koncentrace aripiprazolu, dehydroaripiprazolu a hodnot AUC.
Distribuce
Na základě výsledků ze studií perorálního podávání aripiprazolu je aripiprazol dobře distribuován do celého těla a zdánlivý distribuční objem 4,9 l/kg svědčí pro rozsáhlou extravaskulární distribuci. V terapeutických koncentracích se aripiprazol a dehydroaripiprazol váže na sérové proteiny více než v 99 %, především na albumin.
Biotransformace
Aripiprazol se extenzivně metabolizuje v játrech převážně třemi biotransformačními cestami: dehydrogenací, hydroxylací a N-dealkylací. Na základě studií in vitro jsou za dehydrogenaci a hydroxylaci aripiprazolu zodpovědné enzymy CYP3A4 a CYP2D6, N-dealkylace je katalyzována pomocí CYP3A4. Aripiprazol představuje v systémovém oběhu převládající podíl. Po opakovaném podání dávky přípravku Abilify Maintena představuje aktivní metabolit dehydroaripiprazol, kolem 29,1-32,5 % AUC aripiprazolu v plazmě.
Eliminace
Po opakovaném podání dávek 400 mg nebo 300 mg přípravku Abilify Maintena je střední terminální poločas eliminace aripiprazolu 46,5 a 29,9 dnů, pravděpodobně v důsledku kinetiky s omezenou mírou absorpce. Po jednorázové perorální dávce aripiprazolu označeného [14C] bylo přibližně 27 % podané radioaktivity nalezeno v moči a přibližně 60 % ve stolici. Méně než 1 % nezměněného aripiprazolu se vyloučilo močí a asi 18 % se vyloučilo v nezměněné formě stolicí.
Farmakokinetika u zvláštních skupin pacientů
Osoby s pomalým metabolismem CYP2D6
Na základě farmakokinetického hodnocení populace pro přípravek Abilify Maintena byla celková clearance aripiprazolu 3,71 l/h u osob s rychlým metabolismem CYP2D6 a asi 1,88 l/h (asi o 50 % nižší) u osob s pomalým metabolismem CYP2D6 (pro doporučení dávky viz bod 4.2).
Starší osoby
Po perorálním podání aripiprazolu neexistují žádné rozdíly ve farmakokinetice aripiprazolu mezi staršími a mladšími zdravými jedinci. Nebyl ani zjištěn žádný vliv věku v populační farmakokinetické analýze přípravku Abilify Maintena u pacientů se schizofrenií.
Pohlaví
Po perorálním podání aripiprazolu neexistují žádné rozdíly ve farmakokinetice aripiprazolu mezi zdravými osobami mužského a ženského pohlaví. Nebyl ani zjištěn žádný vliv pohlaví v populační farmakokinetické analýze přípravku Abilify Maintena v klinických hodnoceních u pacientů se schizofrenií.
Kouření
Hodnocení farmakokinetiky aripiprazolu v populaci neodhalilo žádné klinicky podstatné vlivy kouření na farmakokinetiku aripiprazolu.
Rasa
Hodnocení farmakokinetiky aripiprazolu v populaci neodhalilo žádné odlišnosti ve farmakokinetice aripiprazolu související s rasou.
Porucha funkce ledvin
Ve studii jednotlivých dávek perorálně podávaného aripiprazolu bylo zjištěno, že farmakokinetické vlastnosti aripiprazolu a dehydroaripiprazolu jsou podobné u pacientů s těžkým onemocněním ledvin i u mladých zdravých subjektů.
Porucha funkce jater
Studie jednotlivých dávek perorálně podávaného aripiprazolu subjektům s různým stupněm jaterní cirhózy (třída A, B a C dle Childa-Pugha) neodhalila významný vliv jaterního onemocnění na farmakokinetiku aripiprazolu a dehydroaripiprazolu, ale do studie byli zařazeni pouze 3 pacienti s jatemí cirhózou třídy C, což je nedostatečné pro vyvození závěrů na základě jejich metabolické kapacity.
5.3 Předklinické údaje vztahující se k bezpečnosti
Toxikologický profil aripiprazolu podávaného experimentálním zvířatům intramuskulární injekcí je obecně podobný profilu u perorálního podávání při srovnatelných hladinách v plazmě. U intramuskulární injekce byla však v místě injekce pozorována zánětlivá reakce, která zahrnovala granulomatózní zánět, ložiska (uložené léčivo), buněčné infiltráty, edém (otok) a u opic fibrózu. Tyto účinky postupně vymizely při přerušení podávání.
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu, reprodukční a vývojové toxicity perorálně podávaného aripiprazolu neodhalily žádné zvláštní riziko pro člověka.
Perorální aripiprazol
U perorálního aripiprazolu byly toxikologicky signifikantní účinky pozorovány pouze po dávkách nebo expozicích dostatečně převyšujících maximální dávky nebo expozici u člověka, což ukazuje, že účinky jsou omezené nebo nemají význam při klinickém použití. Účinky zahrnovaly: adrenokortikální toxicitu závislou na dávce u potkanů po 104 týdnech perorálního podávání při 3 až 10násobku středních hodnot AUC v rovnovážném stavu při maximální doporučené dávce u člověka a zvýšený výskyt adrenokortikálních karcinomů a kombinovaných adrenokortikálních adenomů/karcinomů u samic potkanů při 10násobku středních hodnot AUC v rovnovážném stavu při maximální doporučené dávce u lidí. Nejvyšší nekarcinogenní expozice u samic potkanů byla 7krát vyšší než expozice u člověka doporučenou dávkou.
Dalším nálezem byla cholelithiáza jako následek precipitace sulfátových konjugátů hydroxymetabolitů aripiprazolu ve žluči opic po opakovaných perorálních dávkách 25 až 125 mg/kg/den nebo přibližně 16 až 81násobku maximální doporučené dávky u člověka stanovené v mg/m2.
Avšak koncentrace sulfátových konjugátů hydroxyaripiprazolu v lidské žluči při nejvyšší doporučené dávce 30 mg denně nebyly vyšší než 6 % koncentrací ve žluči zjištěných u opic v 39týdenní studii a jsou značně pod jejich limitem rozpustnosti in vitro (6 %).
Ve studiích toxicity opakovaných dávek podávaných mláďatům potkanů a psů byl profil toxicity aripiprazolu srovnatelný s tím, který byl pozorován u dospělých zvířat, neurotoxicita nebo nežádoucí účinky na vývoj se nevyskytly.
Na základě výsledků kompletní škály standardních testů genotoxicity není aripiprazol pokládán za genotoxický. Ve studiích reprodukční toxicity aripiprazol nenarušil fertilitu.
Vývojová toxicita, včetně na dávce závislé opožděné osifikace u plodu a možných teratogenních účinků, byla pozorována u potkanů při dávkách vedoucích k subterapeutické expozici (odvozené od AUC) a u králíků při dávkách vedoucích k expozici 3 a 11násobné, než jsou průměrné hodnoty AUC v rovnovážném stavu u maximálně doporučené klinické dávky. Toxické působení na matku se objevilo při dávkách podobných těm, které vyvolaly vývojovou toxicitu.
6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek
Prášek
Sodná sůl karmelosy mannitol
monohydrát dihydrogenfosforečnanu sodného hydroxid sodný
Rozpouštědlo Voda na injekci
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
Po rekonstituci
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním Chemická a fyzická stabilita po otevření před použitím byla prokázána po dobu 4 hodin při teplotě do 25 °C. Z mikrobiologického hlediska má být přípravek použit okamžitě, pokud příprava/rekonstituce nevylučuje riziko mikrobiální kontaminace. Není-li použit okamžitě, doba a podmínky uchovávání přípravku po otevření před použitím jsou v odpovědnosti uživatele. Třepejte injekční lahvičkou nejméně po dobu 60 sekund, aby se obsah rozpustil před podáním injekce. Neuchovávejte rekonstituovanou suspenzi ve stříkačce.
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce
Pokud se injekce neprovádí okamžitě po rekonstituci, injekční stříkačku lze uchovat při teplotě do 25 °C po dobu až 2 hodin. Pokud stříkačka ležela déle než 15 minut, intenzivně s ní třepejte minimálně po dobu 20 sekund, aby se před injekcí přípravek resuspendoval.
6.4 Zvláštní opatření pro uchovávání
Chraňte před mrazem.
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce
Uchovávejte předplněnou injekční stříkačku ve vnější krabičce, aby byl přípravek chráněn před světlem.
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení Injekční lahvička
Injekční lahvička ze skla třídy I se zátkou z vrstvené pryže a utěsněná odklápěcím hliníkovým víčkem. Rozpouštědlo
2ml injekční lahvička ze skla třídy 1 se zátkou z vrstvené pryže a utěsněná odklápěcím hliníkovým víčkem.
Jednotlivé balení
Jedno jednotlivé balení obsahuje jednu injekční lahvičku prášku, 2 ml injekční lahvičku rozpouštědla, jednu 3 ml stříkačku s nástavcem luer lock s předem nasazenou hypodermickou bezpečnostní jehlou 21G o délce 38 mm, s ochranným obalem jehly, jednu 3 ml jednorázovou stříkačku s nástavcem luer lock, jeden adaptér na injekční lahvičku a tři hypodermické bezpečnostní jehly: jednu 23G o délce 25 mm, jednu 22G o délce 38 mm a jednu 21G o délce 50 mm.
Multipack (vícečetné balení)
Balení 3 jednotlivých balení.
Předplněná injekční stříkačka
Předplněná injekční stříkačka ze skla třídy I obsahující prášek v přední komoře a rozpouštědlo v zadní komoře.
Jednotlivé balení
Jedno jednotlivé balení obsahuje jednu předplněnou injekční stříkačku a tři hypodermické bezpečnostní jehly: jednu 23G o délce 25 mm, jednu 22G o délce 38 mm a jednu 21G o délce 50 mm.
Multipack (vícečetné balení)
Balení 3 jednotlivých balení.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Úplné pokyny k použití a zacházení s přípravkem Abilify Maintena jsou uvedeny v příbalové informaci (informace určené pro zdravotnické pracovníky).
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Velká Británie
8. REGISTRAČNÍ ČÍSLO(A)
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním
EU/1/13/882/001
EU/1/13/882/003
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním
EU/1/13/882/002
EU/1/13/882/004
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním
v předplněné injekční stříkačce
EU/1/13/882/005
EU/1/13/882/007
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním
v předplněné injekční stříkačce
EU/1/13/882/006
EU/1/13/882/008
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 15. listopadu 2013
10. DATUM REVIZE TEXTU {MM.RRRR}
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
PŘÍLOHA II
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobce odpovědného/výrobců odpovědných za propouštění šarží
H. Lundbeck A/S Ottiliavej 9 DK-2500 Valby Dánsko
Elaiapharm
2881 Route des Cretes Z.I Les Bouillides Sophia Antipolis
06550 Valbonne
Francie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním aripiprazolum
Jedna injekční lahvička obsahuje aripiprazolum 300 mg.
Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
Prášek
Sodná sůl karmelosy, mannitol, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný
Rozpouštědlo Voda na injekci
Jedna injekční lahvička s práškem
Jedna injekční lahvička se 2 ml rozpouštědla
Dvě sterilní stříkačky, jedna s jehlou pro rekonstituci
Tři hypodermické bezpečnostní jehly
Jeden adaptér injekční lahvičky
Před použitím si přečtěte příbalovou informaci.
Pouze pro intramuskulární podání
Silně injekční lahvičkou třepejte po dobu minimálně 30 sekund, dokud se suspenze nebude zdát jednolitá. Pokud se injekce nepodává okamžitě po rekonstituci, před injekcí jí silně třepejte po dobu minimálně 60 sekund, aby se obsah znovu rozpustil.
Uchovávejte mimo dohled a dosah dětí.
Doba použitelnosti po rekonstituci: 4 hodiny při teplotě do 25 °C
Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Vhodným způsobem zlikvidujte injekční lahvičku, adaptér, stříkačku, jehly, nepoužitou suspenzi a vodu na injekci.
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Velká Británie
EU/1/13/882/001
Lot
Výdej léčivého přípravku vázán na lékařský předpis.
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním aripiprazolum
Jedna injekční lahvička obsahuje aripiprazolum 400 mg.
Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
Prášek
Sodná sůl karmelosy, mannitol, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný
Rozpouštědlo Voda na injekci
Jedna injekční lahvička s práškem
Jedna injekční lahvička se 2 ml rozpouštědla
Dvě sterilní stříkačky, jedna s jehlou pro rekonstituci
Tři hypodermické bezpečnostní jehly
Jeden adaptér injekční lahvičky
Před použitím si přečtěte příbalovou informaci.
Pouze pro intramuskulární podání
Silně injekční lahvičkou třepejte po dobu minimálně 30 sekund, dokud se suspenze nebude zdát jednolitá. Pokud se injekce nepodává okamžitě po rekonstituci, před injekcí jí silně třepejte po dobu minimálně 60 sekund, aby se obsah znovu rozpustil.
Uchovávejte mimo dohled a dosah dětí.
Doba použitelnosti po rekonstituci: 4 hodiny při teplotě do 25 °C
Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Vhodným způsobem zlikvidujte injekční lahvičku, adaptér, stříkačku, jehly, nepoužitou suspenzi a vodu na injekci.
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Velká Británie
EU/1/13/882/002
Lot
Výdej léčivého přípravku vázán na lékařský předpis.
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním aripiprazolum
Jedna injekční lahvička obsahuje aripiprazolum 300 mg.
Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
Prášek
Sodná sůl karmelosy, mannitol, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný
Rozpouštědlo Voda na injekci
Multipack: Tři jednotlivá balení, každé obsahující:
Jednu injekční lahvičku s práškem
Jednu injekční lahvičku se 2 ml rozpouštědla
Dvě sterilní stříkačky, jedna s jehlou pro rekonstituci
Tři hypodermické bezpečnostní jehly
Jeden adaptér injekční lahvičky
Před použitím si přečtěte příbalovou informaci.
Pouze pro intramuskulární podání
Silně injekční lahvičkou třepejte po dobu minimálně 30 sekund, dokud se suspenze nebude zdát jednolitá. Pokud se injekce nepodává okamžitě po rekonstituci, před injekcí jí silně třepejte po dobu minimálně 60 sekund, aby se obsah znovu rozpustil.
Uchovávejte mimo dohled a dosah dětí.
EXP
Doba použitelnosti po rekonstituci: 4 hodiny při teplotě do 25 °C
Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Vhodným způsobem zlikvidujte injekční lahvičku, adaptér, stříkačku, jehly, nepoužitou suspenzi a vodu na injekci.
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Velká Británie
EU/1/13/882/003
Lot
Výdej léčivého přípravku vázán na lékařský předpis
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním aripiprazolum
Jedna injekční lahvička obsahuje aripiprazolum 300 mg.
Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
Prášek
Sodná sůl karmelosy, mannitol, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný
Rozpouštědlo Voda na injekci
Jednotlivé balení obsahuje:
Jednu injekční lahvičku s práškem
Jednu injekční lahvičku se 2 ml rozpouštědla
Dvě sterilní stříkačky, jedna s jehlou pro rekonstituci
Tři hypodermické bezpečnostní jehly
Jeden adaptér injekční lahvičky
Jednotlivé součásti balení multipack nelze prodávat samostatně.
Před použitím si přečtěte příbalovou informaci.
Pouze pro intramuskulární podání
Silně injekční lahvičkou třepejte po dobu minimálně 30 sekund, dokud se suspenze nebude zdát jednolitá. Pokud se injekce nepodává okamžitě po rekonstituci, před injekcí jí silně třepejte po dobu minimálně 60 sekund, aby se obsah znovu rozpustil.
Uchovávejte mimo dohled a dosah dětí.
EXP
Doba použitelnosti po rekonstituci: 4 hodiny při teplotě do 25 °C
Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Vhodným způsobem zlikvidujte injekční lahvičku, adaptér, stříkačku, jehly, nepoužitou suspenzi a vodu na injekci.
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Velká Británie
EU/1/13/882/003
Lot
Výdej léčivého přípravku vázán na lékařský předpis
Nevyžaduje se - odůvodnění přijato.
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním aripiprazolum
Jedna injekční lahvička obsahuje aripiprazolum 400 mg.
Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
Prášek
Sodná sůl karmelosy, mannitol, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný
Rozpouštědlo Voda na injekci
Multipack: Tři jednotlivá balení, každé obsahující:
Jednu injekční lahvičku s práškem
Jednu injekční lahvičku se 2 ml rozpouštědla
Dvě sterilní stříkačky, jedna s jehlou pro rekonstituci
Tři hypodermické bezpečnostní jehly
Jeden adaptér injekční lahvičky
Před použitím si přečtěte příbalovou informaci.
Pouze pro intramuskulární podání
Silně injekční lahvičkou třepejte po dobu minimálně 30 sekund, dokud se suspenze nebude zdát jednolitá. Pokud se injekce nepodává okamžitě po rekonstituci, před injekcí jí silně třepejte po dobu minimálně 60 sekund, aby se obsah znovu rozpustil.
Uchovávejte mimo dohled a dosah dětí.
EXP
Doba použitelnosti po rekonstituci: 4 hodiny při teplotě do 25 °C
Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Vhodným způsobem zlikvidujte injekční lahvičku, adaptér, stříkačku, jehly, nepoužitou suspenzi a vodu na injekci.
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Velká Británie
EU/1/13/882/004
Lot
Výdej léčivého přípravku vázán na lékařský předpis
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním aripiprazolum
Jedna injekční lahvička obsahuje aripiprazolum 400 mg.
Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
Prášek
Sodná sůl karmelosy, mannitol, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný
Rozpouštědlo Voda na injekci
Jednotlivé balení obsahuje:
Jednu injekční lahvičku s práškem
Jednu injekční lahvičku se 2 ml rozpouštědla
Dvě sterilní stříkačky, jedna s jehlou pro rekonstituci
Tři hypodermické bezpečnostní jehly
Jeden adaptér injekční lahvičky
Jednotlivé součásti balení multipack nelze prodávat samostatně.
Před použitím si přečtěte příbalovou informaci.
Pouze pro intramuskulární podání
Silně injekční lahvičkou třepejte po dobu minimálně 30 sekund, dokud se suspenze nebude zdát jednolitá. Pokud se injekce nepodává okamžitě po rekonstituci, před injekcí jí silně třepejte po dobu minimálně 60 sekund, aby se obsah znovu rozpustil.
Uchovávejte mimo dohled a dosah dětí.
EXP
Doba použitelnosti po rekonstituci: 4 hodiny při teplotě do 25 °C
Chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Vhodným způsobem zlikvidujte injekční lahvičku, adaptér, stříkačku, jehly, nepoužitou suspenzi a vodu na injekci.
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Velká Británie
EU/1/13/882/004
Lot
Výdej léčivého přípravku vázán na lékařský předpis
Nevyžaduje se - odůvodnění přijato.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Abilify Maintena 300 mg prášek pro injekci s prodlouženým uvolňováním aripiprazolum
1. m.
2. ZPŮSOB PODÁNÍ_
3. POUŽITELNOST_
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
300 mg
6. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Abilify Maintena 400 mg prášek pro injekci s prodlouženým uvolňováním aripiprazolum
1. m.
2. ZPŮSOB PODÁNÍ_
3. POUŽITELNOST_
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
400 mg
6. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Rozpouštědlo pro přípravek Abilify Maintena Voda na injekci
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
2 ml
6. JINÉ
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním
v předplněné injekční stříkačce
aripiprazolum
Jedna předplněná injekční stříkačka obsahuje aripiprazolum 300 mg. Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
Prášek
Sodná sůl karmelosy, mannitol, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný
Rozpouštědlo Voda na injekci
Jedna předplněná injekční stříkačka obsahující prášek v přední komoře a rozpouštědlo v zadní komoře Tři hypodermické bezpečnostní jehly
Před použitím si přečtěte příbalovou informaci.
Pouze pro intramuskulární podání
Intenzivně třeste injekční stříkačkou ve vertikální poloze po dobu 20 sekund, dokud nebude léčivo stejnoměrně mléčně bílé, a okamžitě jej použijte. Pokud se injekce neaplikuje okamžitě po rekonstituci, injekční stříkačku lze uchovat při teplotě do 25 °C po dobu až 2 hodin. Intenzivně stříkačkou třepejte minimálně po dobu 20 sekund, aby se před injekcí přípravek resuspendoval, pokud stříkačka ležela déle než 15 minut.
Uchovávejte mimo dohled a dosah dětí.
Doba použitelnosti po rekonstituci: 2 hodiny při teplotě do 25 °C
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku ve vnější krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Po injekci vhodným způsobem zlikvidujte předplněnou injekční stříkačku a jehly.
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Velká Británie
EU/1/13/882/005
Lot
Výdej léčivého přípravku vázán na lékařský předpis.
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním
v předplněné injekční stříkačce
aripiprazolum
Jedna předplněná injekční stříkačka obsahuje aripiprazolum 400 mg. Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
Prášek
Sodná sůl karmelosy, mannitol, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný
Rozpouštědlo Voda na injekci
Jedna předplněná injekční stříkačka obsahující prášek v přední komoře a rozpouštědlo v zadní komoře Tři hypodermické bezpečnostní jehly
Před použitím si přečtěte příbalovou informaci.
Pouze pro intramuskulární podání
Intenzivně třeste injekční stříkačkou ve vertikální poloze po dobu 20 sekund, dokud nebude léčivo stejnoměrně mléčně bílé, a okamžitě jej použijte. Pokud se injekce neaplikuje okamžitě po rekonstituci, injekční stříkačku lze uchovat při teplotě do 25 °C po dobu až 2 hodin. Intenzivně stříkačkou třepejte minimálně po dobu 20 sekund, aby se před injekcí přípravek resuspendoval, pokud stříkačka ležela déle než 15 minut.
Uchovávejte mimo dohled a dosah dětí.
Doba použitelnosti po rekonstituci: 2 hodiny při teplotě do 25 °C
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku ve vnější krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Po injekci vhodným způsobem zlikvidujte předplněnou injekční stříkačku a jehly.
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Velká Británie
EU/1/13/882/006
Lot
Výdej léčivého přípravku vázán na lékařský předpis.
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým až v předplněné
injekční stříkačce
aripiprazolum
Jedna předplněná injekční stříkačka obsahuje aripiprazolum 300 mg. Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
Prášek
Sodná sůl karmelosy, mannitol, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný
Rozpouštědlo Voda na injekci
Multipack: Tři jednotlivá balení, každé obsahující:
Jedna předplněná injekční stříkačka obsahující prášek v přední komoře a rozpouštědlo v zadní komoře Tři hypodermické bezpečnostní jehly
Před použitím si přečtěte příbalovou informaci.
Pouze pro intramuskulární podání
Intenzivně třeste injekční stříkačkou ve vertikální poloze po dobu 20 sekund, dokud nebude léčivo stejnoměrně mléčně bílé, a okamžitě jej použijte. Pokud se injekce neaplikuje okamžitě po rekonstituci, injekční stříkačku lze uchovat při teplotě do 25 °C po dobu až 2 hodin. Intenzivně stříkačkou třepejte minimálně po dobu 20 sekund, aby se před injekcí přípravek resuspendoval, pokud stříkačka ležela déle než 15 minut.
Uchovávejte mimo dohled a dosah dětí.
EXP
Doba použitelnosti po rekonstituci: 2 hodiny při teplotě do 25 °C
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku ve vnější krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Po injekci vhodným způsobem zlikvidujte předplněnou injekční stříkačku a jehly.
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Velká Británie
EU/1/13/882/007
Lot
Výdej léčivého přípravku vázán na lékařský předpis
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním
v předplněné injekční stříkačce
aripiprazolum
Jedna předplněná injekční stříkačka obsahuje aripiprazolum 300 mg. Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
Prášek
Sodná sůl karmelosy, mannitol, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný
Rozpouštědlo Voda na injekci
Jednotlivé balení obsahuje:
Jedna předplněná injekční stříkačka obsahující prášek v přední komoře a rozpouštědlo v zadní komoře Tři hypodermické bezpečnostní jehly
Jednotlivé součásti balení multipack nelze prodávat samostatně.
Před použitím si přečtěte příbalovou informaci.
Pouze pro intramuskulární podání
Intenzivně třeste injekční stříkačkou ve vertikální poloze po dobu 20 sekund, dokud nebude léčivo stejnoměrně mléčně bílé, a okamžitě jej použijte. Pokud se injekce neaplikuje okamžitě po rekonstituci, injekční stříkačku lze uchovat při teplotě do 25 °C po dobu až 2 hodin. Intenzivně stříkačkou třepejte minimálně po dobu 20 sekund, aby se před injekcí přípravek resuspendoval, pokud stříkačka ležela déle než 15 minut.
Uchovávejte mimo dohled a dosah dětí.
EXP
Doba použitelnosti po rekonstituci: 2 hodiny při teplotě do 25 °C
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku ve vnější krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Po injekci vhodným způsobem zlikvidujte předplněnou injekční stříkačku a jehly.
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Velká Británie
EU/1/13/882/007
Lot
Výdej léčivého přípravku vázán na lékařský předpis
Nevyžaduje se - odůvodnění přijato.
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým až v předplněné
injekční stříkačce
aripiprazolum
Jedna předplněná injekční stříkačka obsahuje aripiprazolum 400 mg. Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
Prášek
Sodná sůl karmelosy, mannitol, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný
Rozpouštědlo Voda na injekci
Multipack: Tři jednotlivá balení, každé obsahující:
Jedna předplněná injekční stříkačka obsahující prášek v přední komoře a rozpouštědlo v zadní komoře Tři hypodermické bezpečnostní jehly
Před použitím si přečtěte příbalovou informaci.
Pouze pro intramuskulární podání
Intenzivně třeste injekční stříkačkou ve vertikální poloze po dobu 20 sekund, dokud nebude léčivo stejnoměrně mléčně bílé, a okamžitě jej použijte. Pokud se injekce neaplikuje okamžitě po rekonstituci, injekční stříkačku lze uchovat při teplotě do 25 °C po dobu až 2 hodin. Intenzivně stříkačkou třepejte minimálně po dobu 20 sekund, aby se před injekcí přípravek resuspendoval, pokud stříkačka ležela déle než 15 minut.
Uchovávejte mimo dohled a dosah dětí.
EXP
Doba použitelnosti po rekonstituci: 2 hodiny při teplotě do 25 °C
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku ve vnější krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Po injekci vhodným způsobem zlikvidujte předplněnou injekční stříkačku a jehly.
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Velká Británie
EU/1/13/882/008
Lot
Výdej léčivého přípravku vázán na lékařský předpis
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním
v předplněné injekční stříkačce
aripiprazolum
Jedna předplněná injekční stříkačka obsahuje aripiprazolum 400 mg. Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
Prášek
Sodná sůl karmelosy, mannitol, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný
Rozpouštědlo Voda na injekci
Jednotlivé balení obsahuje:
Jedna předplněná injekční stříkačka obsahující prášek v přední komoře a rozpouštědlo v zadní komoře Tři hypodermické bezpečnostní jehly
Jednotlivé součásti balení multipack nelze prodávat samostatně.
Před použitím si přečtěte příbalovou informaci.
Pouze pro intramuskulární podání
Intenzivně třeste injekční stříkačkou ve vertikální poloze po dobu 20 sekund, dokud nebude léčivo stejnoměrně mléčně bílé, a okamžitě jej použijte. Pokud se injekce neaplikuje okamžitě po rekonstituci, injekční stříkačku lze uchovat při teplotě do 25 °C po dobu až 2 hodin. Intenzivně stříkačkou třepejte minimálně po dobu 20 sekund, aby se před injekcí přípravek resuspendoval, pokud stříkačka ležela déle než 15 minut.
Uchovávejte mimo dohled a dosah dětí.
EXP
Doba použitelnosti po rekonstituci: 2 hodiny při teplotě do 25 °C
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku ve vnější krabičce, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
Po injekci vhodným způsobem zlikvidujte předplněnou injekční stříkačku a jehly.
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road, Wexham, SL3 6PJ - Velká Británie
EU/1/13/882/008
Lot
Výdej léčivého přípravku vázán na lékařský předpis
Nevyžaduje se - odůvodnění přijato.
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Abilify Maintena 300 mg injekce
aripiprazolum
i.m.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
300 mg
6. JINÉ
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
Abilify Maintena 400 mg injekce
aripiprazolum
i.m.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
400 mg
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým
uvolňováním
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým
uvolňováním
aripiprazolum
Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek podáván, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo zdravotní sestry.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Abilify Maintena a k čemu se používá
2. Čemu musíte věnovat pozornost, než vám bude podán přípravek Abilify Maintena
3. Jak se přípravek Abilify Maintena podává
4. Možné nežádoucí účinky
5. Jak přípravek Abilify Maintena uchovávat
6. Obsah balení a další informace
1. Co je přípravek Abilify Maintena a k čemu se používá
Přípravek Abilify Maintena obsahuje léčivou látku aripiprazol a patří do skupiny léků, které se označují jako antipsychotika. Používá se k léčbě schizofrenie - onemocnění charakterizované příznaky, jako jsou sluchové, zrakové nebo hmatové vjemy, které neexistují, podezřívavost, bludy, nesouvislá řeč, poruchy chování a emoční oploštění. Lidé s těmito obtížemi se mohou také cítit depresivní, provinilí, úzkostní nebo nervózní.
Přípravek Abilify Maintena je určen pro dospělé pacienty se schizofrenií, kteří jsou dostatečně stabilizováni během léčby perorálním aripiprazolem.
2. Čemu musíte věnovat pozornost, než vám bude podán přípravek Abilify Maintena Nepoužívejte Abilify Maintena:
- jestliže j ste alergický(á) na aripiprazol nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před zahájením léčby přípravkem Abilify Maintena se poraďte se svým lékařem nebo zdravotní sestrou.
Během léčby aripiprazolem byly hlášeny sebevražedné úmysly a chování. Okamžitě informujte svého lékaře, pokud máte úmysly nebo pocity, že si chcete ublížit.
Před léčbou přípravkem Abilify Maintena, informujte svého lékaře, pokud máte:
• vysokou hladinu cukru v krvi (charakterizovanou příznaky, jako je nadměrná žízeň, močení ve zvýšené míře, zvýšená chuť k jídlu a pocity slabosti) nebo výskyt cukrovky v rodině
• záchvaty, kvůli kterým Vás možná bude lékař chtít více sledovat
• samovolné, nepravidelné svalové záškuby, zejména v obličeji
• kardiovaskulární onemocnění (onemocnění srdce a oběhového systému), výskyt kardiovaskulárního onemocnění v rodině, cévní mozkovou příhodu nebo přechodnou mozkovou příhodu, abnormální krevní tlak
• krevní sraženiny nebo výskyt krevních sraženin v rodině, protože antipsychotika mívají spojitost s tvorbou krevních sraženin
• zkušenost s nadměrným hráčstvím v minulosti
• vážné problémy s j átry
Pokud si všimnete, že přibíráte na váze, objevují se u Vás neobvyklé pohyby, spavost, která Vám brání vykonávat běžné denní činnosti, máte potíže s polykáním nebo máte alergické příznaky, okamžitě o tom informujte svého lékaře.
Děti a dospívající
Tento přípravek není určen k používání u dětí a dospívajících mladších 18 let. Není známo, zda je u těchto pacientů bezpečný a účinný.
Další léčivé přípravky a Abilify Maintena
Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které plánujete užívat, včetně těch, které jsou dostupné bez lékařského předpisu.
Léky na snížení krevního tlaku: přípravek Abilify Maintena může zvýšit účinek léků užívaných ke snížení krevního tlaku. Informujte svého lékaře o tom, že užíváte lék ke snížení krevního tlaku.
Užívání přípravku Abilify Maintena s některými léky může vést k tomu, že lékař bude muset upravit Vaši dávku přípravku Abilify Maintena nebo ostatních léků. Je obzvlášť důležité informovat svého lékaře o tom, že užíváte:
• léky na úpravu srdečního rytmu (např. chinidin, amiodaron, flekainid)
• antidepresiva nebo rostlinné přípravky používané k léčbě deprese a úzkosti (např. fluoxetin, paroxetin, venlafaxin, třezalka tečkovaná)
• protiplísňové léky (např. ketokonazol, itrakonazol)
• některé léky k léčbě HIV infekce (jako je efavirenz, nevirapin, inhibitory proteázy, např. indinavir, ritonavir)
• protikřečové léky používané k léčbě epilepsie (např. karbamazepin, fenytoin, fenobarbital)
• některá antibiotika používaná k léčbě tuberkulózy (rifabutin, rifampicin)
Tyto léky mohou zvyšovat riziko nežádoucích účinků nebo snižovat účinek přípravku Abilify Maintena; pokud máte při současném užívání těchto léků s přípravkem Abilify Maintena jakékoliv neobvyklé příznaky, měl(a) byste kontaktovat lékaře.
Léky, které zvyšují hladinu serotoninu, se obvykle používají při problémech, jako je deprese, generalizovaná úzkostná porucha, obsedantně kompulzivní choroba a sociální fobie, ale také při migréně a bolesti:
• triptany, tramadol a tryptofan, používané při problémech, jako je deprese, generalizovaná úzkostná porucha, obsedantně kompulzivní choroba (OCD) a sociální fobie, ale také migréna a bolest
• SSRI (jako je paroxetin a fluoxetin) používaný při depresi, OCD, panice a úzkosti
• jiná antidepresiva (jako je venlafaxin a tryptofan) používaná k léčbě deprese
• tricyklická antidepresiva (jako je klomipramin a amitriptylin) používaná při depresivním onemocnění
• třezalka tečkovaná (Hypericum perforatum) používaná jako bylinná léčba mírné deprese
• silná analgetika (např. tramadol a pethidin) používaná k úlevě od bolesti
• triptany (jako je sumatriptan a zolmitripitan) používané k léčbě migrény
Tyto léky mohou zvyšovat riziko nežádoucích účinků; pokud máte při současném užívání těchto léků s přípravkem Abilify Maintena jakékoliv neobvyklé příznaky, měl(a) byste kontaktovat lékaře.
Abilify Maintena s alkoholem
Alkohol by se neměl konzumovat.
Těhotenství, kojení a plodnost
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než Vám bude tento přípravek podáván.
Pokud jste těhotná, neměl by Vám být aplikován přípravek Abilify Maintena bez konzultace s lékařem. Pokud jste těhotná, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, ihned to oznamte lékaři.
Následující příznaky se mohou objevit u novorozenců, jejichž matkám byl podáván přípravek Abilify Maintena v posledním trimestru (posledních třech měsících těhotenství): třes, svalová ztuhlost a/nebo slabost, ospalost, agitovanost, dýchací potíže a potíže při krmení.
Jestliže se u dítěte objeví kterýkoliv z těchto příznaků, obraťte se na svého lékaře.
Pokud dostáváte přípravek Abilify Maintena, lékař s Vámi projedná, zda byste měla kojit s ohledem na výhody léčby pro Vás a výhody kojení pro Vaše dítě. Neměla byste současně používat přípravek Abilify Maintena a kojit. Poraďte se se svým lékařem, jaký je nejlepší způsob krmení Vašeho dítěte, pokud dostáváte přípravek Abilify Maintena.
Řízení dopravních prostředků a obsluha strojů
Neřiďte dopravní prostředek ani neobsluhujte žádné přístroje nebo stroje, dokud nevíte, jak na Vás přípravek Abilify Maintena působí, protože u tohoto léčivého přípravku se mohou vyskytnout nežádoucí účinky, které již byly hlášeny, např. závrať, útlum, dvojité vidění a ospalost.
3. Jak se přípravek Abilify Maintena podává
Abilify Maintena je ve formě prášku, ze kterého lékař nebo zdravotní sestra připraví suspenzi. Lékař Vám přípravek podá každý měsíc ve formě jedné injekce aplikované do hýžďového nebo deltového svalu (hýždě nebo rameno). Během injekce můžete cítit mírnou bolest. Lékař bude střídat injekce mezi pravou a levou stranou. Injekce nebudou podávány do žíly.
Lékař rozhodne, jaká dávka přípravku Abilify Maintena je pro Vás správná. Doporučená a počáteční dávka je 400 mg, pokud lékař nerozhodne, že Vám bude podána nižší počáteční nebo pokračovací dávka (300 mg, 200 mg nebo 160 mg). Léčba aripiprazolem podávaným ústy bude pokračovat po dobu 14 dnů po první injekci. Poté budete k léčbě dostávat injekce přípravku Abilify Maintena, pokud Vám lékař neřekne jinak.
Jestliže Vám bude podáno více přípravku Abilify Maintena, než je zapotřebí
Tento lék Vám bude podáván pod lékařským dohledem; je proto nepravděpodobné, že by Vám bylo aplikováno příliš mnoho léku. Pokud navštěvujete více než jednoho lékaře, řekněte jim, že dostáváte přípravek Abilify Maintena.
Pacienti, kterým bylo podáno příliš mnoho aripiprazolu, pozorovali následující příznaky:
• zrychlený srdeční tep, agitovanost/agresivitu, problémy s řečí,
• neobvyklé pohyby (zejména tváře nebo jazyka) a sníženou úroveň vědomí.
Další příznaky mohou být:
• akutní zmatenost, záchvaty (epilepsie), kóma, kombinace horečky, zrychleného dechu, pocení,
• ztuhlost svalů a netečnost nebo ospalost; pomalejší dýchání, dušení, vysoký nebo nízký krevní tlak, abnormální srdeční rytmus.
Okamžitě kontaktujte svého lékaře nebo navštivte nemocnici, pokud pozorujete cokoliv z výše uvedeného.
Pokud vynecháte injekci Abilify Maintena
Je důležité, abyste svou plánovanou dávku nevynechal(a). Injekce by Vám měla být aplikována každý měsíc, ale ne dříve než po 26 dnech od poslední injekce. Pokud injekci vynecháte, měl(a) byste kontaktovat svého lékaře a dohodnout se na další injekci v co nejkratším termínu. Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo zdravotní sestry.
Jestliže jste přestal(a) používat přípravek Abilify Maintena
Nepřerušujte léčbu jen proto, že se cítíte lépe. Je důležité, abyste pokračoval(a) v podávání přípravku Abilify Maintena tak dlouho, jak Vám sdělil lékař.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí
vyskytnout u každého.
Okamžitě informujte svého lékaře, pokud máte jakékoliv z následujících vážných nežádoucích účinků:
• kombinace těchto příznaků: nadměrná ospalost, závrať, zmatenost, dezorientace, obtížná řeč, obtížná chůze, svalová ztuhlost nebo třes, horečka, slabost, podrážděnost, agresivita, úzkost, zvýšený krevní tlak nebo záchvaty, kterou mohou vést k bezvědomí.
• neobvyklý pohyb, zejména obličeje nebo jazyka, kvůli kterým Vám lékař možná bude chtít snížit dávku.
• pokud máte příznaky, jako je otok, bolest a zarudnutí na noze, může to znamenat, že máte krevní sraženinu, která může putovat cévami do plic a způsobit bolest na hrudi a dýchací obtíže. Pokud pozorujete kterýkoliv z těchto příznaků, okamžitě vyhledejte lékařskou pomoc.
• kombinace horečky, zrychleného dechu, pocení, svalové ztuhlosti a netečnosti nebo ospalosti, protože to může být známkou stavu nazývaného neuroleptický maligní syndrom (NMS).
• žízeň větší než obvykle, potřebu močení větší než obvykle, veliký hlad, pocit slabosti nebo únavy, pocit nevolnosti, pocit zmatenosti nebo dech, který je cítit po ovoci, protože to může být příznakem diabetu (cukrovky).
Nežádoucí účinky uvedené níže se mohou objevit i po podání přípravku Abilify Maintena.
Časté nežádoucí účinky (mohou postihnout až 1 z 10 osob):
• zvýšení tělesné hmotnosti, úbytek tělesné hmotnosti
• pocity úzkosti, obtíže se spánkem (nespavost)
• pocit neklidu a neschopnost zůstat v klidu, problém sedět v klidu, třes, nekontrolované záškuby, trhavé nebo svíjivé pohyby, pocit neklidu v nohách
• výkyvy bdělosti, ospalost
• svalové pohyby, které nemůžete kontrolovat, j ako j sou grimasy, mlaskání rty a pohyby j azyka. Obvykle je nejprve ovlivněn obličej a ústa, ale mohou být ovlivněny i jiné části těla. Mohou to být projevy stavu, kterému se říká „tardivní dyskineze”.
• parkinsonismus; jde o lékařský termín, který zahrnuje několik příznaků, jako je svalová ztuhlost, záškuby při ohýbání končetin, pomalé nebo narušené pohyby těla, žádný výraz v tváři, tuhost svalů, šourání, spěšné kroky a nedostatek normálního pohybu paží při chůzi
• trhavý odpor proti pasivnímu pohybu, když se svaly napínají a uvolňují, abnormálně zvýšené svalové napětí, svalová ztuhlost, pomalý pohyb těla
• závrať, bolest hlavy
• sucho v ústech
• bolest v místě injekce, zatvrdnutí kůže v místě injekce
• slabost, ztráta síly nebo extrémní únava
• vysoké hodnoty enzymu kreatinfosfokinázy v krvi
Méně časté nežádoucí účinky (mohou postihnout až 1 ze 100 osob):
• snížená nebo zvýšená chuť k jídlu, narušení vnímání chuti a čichu
• nízká hladina specifického typu bílých krvinek (neutropenie), nízké hodnoty hemoglobinu nebo červených krvinek, nízká hodnota krevních destiček
• alergické reakce (přecitlivělost)
• snížené nebo zvýšené hladiny hormonu prolaktinu v krvi
• vysoký krevní cukr, snížený krevní cukr
• zvýšené tuky v krvi, jako je vysoká hladina cholesterolu a/nebo triglyceridů, nízká hladina cholesterolu a/nebo triglyceridů
• zvýšené hodnoty inzulinu, hormonu regulujícího hodnoty cukru v krvi
• sebevražedné myšlenky
• mentální porucha charakterizovaná narušeným kontaktem s realitou nebo jeho ztrátou, halucinacemi, bludy
• změněný nebo zvýšený zájem o sex
• panická reakce, deprese, kolísání nálady, stav netečnosti s nedostatkem emocí, pocity emočního
a mentálního nepohodlí, změny nálady
• porucha spánku
• cenění zubů nebo svírání čelisti
• škytavka
• fixace očních bulev v jedné pozici, rozmazané vidění, bolest oka, dvojité vidění
• abnormální tlukot srdce, pomalá nebo rychlá tepová frekvence, abnormální elektrická vodivost v srdci, abnormální hodnoty EKG srdce
• závrať při vstávání z pozice vleže nebo vsedě v důsledku poklesu krevního tlaku, vysoký krevní tlak
• kašel
• žaludeční potíže, zažívací potíže, slinění, více slin v ústech než je běžné, zvracení, pocit na zvracení, průjem, zácpa, bolest nebo nepříjemný pocit v břiše, časté vyprazdňování střev
• abnormální krevní jaterní hodnoty
• abnormální padání vlasů
• akné, stav kůže, kdy jsou tváře a nos neobvykle červené, ekzém, zatvrdnutí kůže
• svalová ztuhlost, svalové křeče, svalové záškuby, tuhost svalů, bolest svalů (myalgie), bolest
v končetině, porucha chůze, bolest kloubů (artralgie), bolest zad, omezená kloubní hybnost, ztuhlá šíje, omezené otevírání úst
• ledvinové kameny, cukr (glukosa) v moči
• zvětšení prsu u mužů, citlivost prsu, suchost pochvy
• ztráta síly
• nepříj emné pocity na hrudi
• reakce v místě injekce, jako je zarudnutí, otok, nepříjemné pocity a svědění v místě injekce
• zvětšený obvod pasu
Od uvedení perorálního (užívaného ústy) aripiprazolu na trh byly hlášeny následující nežádoucí účinky, ale jejich frekvence není známa:
• nízké hodnoty bílých krvinek
• neobvyklý tlukot srdce, náhlá nevysvětlitelná smrt, srdeční příhoda
• alergická reakce (např. zduření v ústech, zduřelý jazyk, obličej a hrdlo, svědění, kopřivka), vyrážka
• ketoacidóza (ketony v krvi a moči) nebo kóma, nízká hodnota sodíku v krvi
• ztráta chuti k jídlu (anorexie), obtížné polykání
• agrese
• nervozita, nadměrné hráčství, pokus o sebevraždu a sebevražda; porucha řeči, záchvat, serotoninový syndrom (reakce, která může způsobit pocity velkého štěstí, ospalost, nemotornost, neklid, pocit opilosti, horečku, pocení nebo ztuhlé svaly), kombinace horečky, svalové ztuhlosti, zrychleného dýchání, pocení, sníženého vědomí a náhlých změn krevního tlaku a tepové frekvence (neuroleptický maligní syndrom)
• mdloba, křeče svalů okolo hrtanu, náhodné vdechnutí jídla s rizikem zápalu plic (plicní infekce), zánět slinivky břišní
• jaterní selhání, zánět jater, zežloutnutí kůže a bělma očí, citlivost na světlo, nadměrné pocení, ztuhlost nebo křeče, bolest svalů, slabost
• mimovolní únik moči (inkontinence), obtížné močení
• dlouhá a/nebo bolestivá erekce
• potíže s regulací tělesné teploty nebo přehřátí, bolest na hrudi a otok rukou, kotníků nebo nohou Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Abilify Maintena uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Chraňte před mrazem.
Rekonstituovaná suspenze by měla být použita okamžitě, ale je možné ji uchovávat v injekční lahvičce při teplotě do 25 °C po dobu až 4 hodin. Neuchovávejte rekonstituovanou suspenzi ve stříkačce.
Nevyhazujte žádné léčivé přípravky do odpadních vod. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Abilify Maintena obsahuje
- Léčivou látkou je aripiprazolum.
Jedna injekční lahvička obsahuje aripiprazolum 300 mg.
Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
Jedna injekční lahvička obsahuje aripiprazolum 400 mg.
Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
- Dalšími složkami jsou Prášek
Sodná sůl karmelosy, mannitol, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný Rozpouštědlo
Voda na injekci
Jak přípravek Abilify Maintena vypadá a co obsahuje toto balení
Abilify Maintena je prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem.
Abilify Maintena je bílý až téměř bílý prášek v čiré skleněné injekční lahvičce. Váš lékař nebo zdravotní sestra z něj připraví suspenzi, která Vám bude podána jako injekce, s použitím injekční lahvičky rozpouštědla pro Abilify Maintena, což je čirý roztok v čiré skleněné injekční lahvičce.
Jednotlivé balení
Jedno jednotlivé balení obsahuje jednu injekční lahvičku prášku, 2 ml injekční lahvičku rozpouštědla, jednu 3 ml stříkačku s nástavcem luer lock s předem nasazenou hypodermickou bezpečnostní jehlou 21G o délce 38 mm, s ochranným obalem jehly, jednu 3 ml jednorázovou stříkačku s nástavcem luer lock, jeden adaptér na injekční lahvičku a tři hypodermické bezpečnostní jehly: jednu 23G o délce 25 mm, jednu 22G o délce 38 mm a jednu 21G o délce 50 mm.
Multipack (vícečetné balení)
Balení 3 jednotlivých balení.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road,
Wexham, SL3 6PJ - Velká Británie
Výrobce
H. Lundbeck A/S Ottiliavej 9, 2500 Valby Dánsko
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Lietuva
H. Lundbeck A/S Tel: +45 36301311
Belgie/Belgique/Belgien
Lundbeck S.A./N.V. Tél/Tel: +32 2 535 79 79
BtnrapHH
Lundbeck Export A/S Representative Office
Tel: +359 2 962 4696
Luxembourg/Luxemburg
Lundbeck S.A.
Tél: +32 2 535 79 79
Česká republika
Lundbeck Česká republika s.r.o.
Tel: +36 1 4369980
Tel: +420 225 275 600
Magyarország
Lundbeck Hungaria Kft.
Danmark
Otsuka Pharma Scandinavia AB Tel: +46 8 54528660
Deutschland
Otsuka Pharma GmbH Tel: +49 69 1700860
Eesti
H. Lundbeck A/S Tel: +45 36301311
Malta
H. Lundbeck A/S Tel: +45 36301311
Nederland
Lundbeck B.V.
Tel: +31 20 697 1901
Norge
Otsuka Pharma Scandinavia AB Tel: +46 8 54528660
Eiiába
Lundbeck Hellas S.A.
Tni: +30 210 610 5036
Espaňa
Otsuka Pharmaceutical S.A.
Tel: +34 93 208 10 20
France
Otsuka Pharmaceutical France SAS Tél: +33 (0)1 47 08 00 00
Hrvatska
Lundbeck Croatia d.o.o.
Tel.: +385 1 644 82 63
Ireland
Lundbeck (Ireland) Limited Tel: +353 1 468 9800
Island
Vistor hf.
Sími: +354 535 7000 Italia
Otsuka Pharmaceutical Italy S.r.l Tel: +39 02 00 63 27 10
Kórcpog
Lundbeck Hellas A.E Tni.: +357 22490305
Latvija
H. Lundbeck A/S Tel: +45 36301311
Osterreich
Lundbeck Austria GmbH Tel: +43 1 266 91 08
Polska
Lundbeck Poland Sp. z o. o.
Tel.: +48 22 626 93 00
Portugal
Lundbeck Portugal Lda Tel: +351 21 00 45 900
Románia
Lundbeck Export A/S Reprezentanta din Romania Tel: +40 21319 88 26
Slovenija
Lundbeck Pharma d.o.o.
Tel.: +386 2 229 4500
Slovenská republika
Lundbeck Slovensko s.r.o.
Tel: +421 2 5341 42 18
Suomi/Finland
Otsuka Pharma Scandinavia AB Tel: +46 8 54528660
Sverige
Otsuka Pharma Scandinavia AB Tel: +46 8 54528660
United Kingdom
Otsuka Pharmaceuticals (UK) Ltd. Tel: +44 203 747 5300
Tato příbalová informace byla naposledy revidována {MM.RRRR}
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Následující informace jsou určeny pouze pro zdravotnické pracovníky: POKYNY PRO ZDRAVOTNICKÉ PRACOVNÍKY
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem
aripiprazol
Krok 1: Příprava před rekonstitucí prášku
Rozložte jednotlivé součásti a ujistěte se, že máte všechny níže uvedené:
- Příbalová informace a informace pro zdravotnické pracovníky pro přípravek Abilify Maintena
- Injekční lahvička s práškem
- 2 ml injekční lahvička s rozpouštědlem
Důležité: injekční lahvička s rozpouštědlem obsahuje přeplnění.
- Jedna 3 ml stříkačka s nástavcem luer lock s předem nasazenou hypodermickou bezpečnostní jehlou 21G o délce 38 mm, s ochranným obalem jehly
- Jedna 3 ml jednorázová stříkačka s nástavcem luer lock
- Jeden adaptér injekční lahvičky
- Jedna hypodermická bezpečnostní jehla 23G o délce 25 mm s ochranným obalem jehly
- Jedna hypodermická bezpečnostní jehla 22G o délce 38 mm s ochranným obalem jehly
- Jedna hypodermická bezpečnostní jehla 21G o délce 50 mm s ochranným obalem jehly
- Návod k použití stříkačky a jehly
Krok 2: Rekonstituce prášku
a) Odstraňte víčka injekční lahvičky s rozpouštědlem a práškem a otřete horní stranu sterilním tamponem napuštěným alkoholem.
b) S použitím stříkačky s předem nasazenou jehlou natáhněte předem určený objem rozpouštědla z injekční lahvičky s rozpouštědlem do stříkačky.
300 ml injekční lahvička:
přidejte 1,5 ml rozpouštědla k rekonstituci prášku.
400 ml injekční lahvička:
přidejte 1,9 ml rozpouštědla k rekonstituci prášku.
Malé množství zbytkového rozpouštědla zůstane po odebrání v injekční lahvičce. Jakékoliv přebytečné množství je třeba zlikvidovat.
Voda
c) Pomalu injekčně aplikujte rozpouštědlo do injekční lahvičky obsahující prášek.
d) Odstraňte vzduch k vyrovnání tlaku v injekční lahvičce tak, že mírně zatáhnete píst zpět.
e) Následně vytáhněte jehlu z injekční lahvičky.
Nasaďte ochranný obal jehly jednou rukou.
Jemně zatlačte kryt proti rovnému povrchu, dokud není jehla pevně nasazená do ochranného krytu jehly.
Zrakem se přesvědčte, že jehla je zcela nasazená do ochranného krytu jehly a zlikvidujte ji.
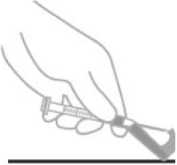
Zajistěte krytem
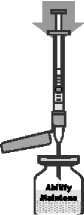
f) Silně injekční lahvičkou třepejte po dobu 30 sekund, dokud se suspenze nebude zdát jednolitá.
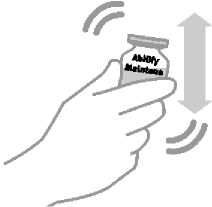
g) Před podáváním zrakem zkontrolujte rekonstituovanou suspenzi, zda neobsahuje nerozpuštěné kousky a nezměnila barvu. Rekonstituovaný lék je bílá až téměř bílá tekutá suspenze. Nepoužívejte, pokud rekonstituovaná suspenze obsahuje nerozpuštěné kousky nebo jakkoliv změnila barvu.
h) Pokud se injekce nepodává okamžitě po rekonstituci, udržujte injekční lahvičku při teplotě do 25 °C po dobu maximálně 4 hodin a před injekcí jí silně třepejte po dobu minimálně 60 sekund, aby se obsah znovu rozpustil.
i) Neuchovávejte rekonstituovanou suspenzi ve stříkačce.
Krok 3: Příprava před injekcí
a) Z obalu odstraňte kryt, ale ne adaptér.
b) Pomocí obalu adaptéru injekční lahvičky k manipulaci s adaptérem injekční lahvičky připojte předem zabalenou stříkačku s nástavcem luer lock k adaptéru injekční lahvičky.
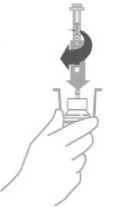
c) Použijte stříkačku s nástavcem luer lock k vynětí adaptéru injekční lahvičky z balení a obal adaptéru injekční lahvičky zlikvidujte. Nikdy se nedotýkejte hrotu adaptéru.

d) Stanovte doporučený objem injekce.
|
Abilify Maintena 300 mg injekční lahvička | |
|
Dávka |
Objem k injekci |
|
— |
— |
|
300 mg |
1,5 ml |
|
200 mg |
1,0 ml |
|
160 mg |
0,8 ml |
|
Abilify Maintena 4 |
00 mg injekční lahvička |
|
Dávka |
Objem k injekci |
|
400 mg |
2,0 ml |
|
300 mg |
1,5 ml |
|
200 mg |
1,0 ml |
|
160 mg |
0,8 ml |
e) Otřete horní stranu injekční lahvičky s rekonstituovanou suspenzí sterilním tamponem napuštěným alkoholem.
f) Položte injekční lahvičku s rekonstituovanou suspenzí na tvrdý povrch a nechejte ji tam. Připojte sestavu adaptér-stříkačka k injekční lahvičce tak, že budete držet vnější stranu adaptéru a zatlačíte hrot adaptéru pevně přes pryžovou pojistku, dokud adaptér nezapadne na své místo.
g) K přípravě injekce pomalu vytáhněte doporučený objem z injekční lahvičky do stříkačky
s nástavcem luer lock. Malé množství přebytečného přípravku zůstane v injekční lahvičce.

Krok 4: Injekční postup
a) Uvolněte stříkačku s nástavcem luer lock obsahující doporučený objem rekonstituované suspenze přípravku Abilify Maintena z injekční lahvičky.
b) Zvolte jednu z přiložených hypodermických bezpečnostních jehel v závislosti na místě aplikace injekce a hmotnosti pacienta a nasaďte jehlu na stříkačku s nástavcem luer lock obsahující suspenzi pro injekci. Zajistěte, aby byla jehla pevně nasazená na ochranném krytu jehly, a to tak, že zatlačíte a otočíte po směru hodinových ručiček a pak vytáhnete kryt jehly přímo od jehly.
|
Tělesný typ |
Místo aplikace injekce |
Velikost jehly |
|
Neobézní |
Deltový sval |
23G, 25 mm |
|
Hýžďový sval |
22G, 38 mm | |
|
Obézní |
Deltový sval |
22G, 38 mm |
|
Hýžďový sval |
21G, 50 mm |
c) Pomalu aplikujte doporučený objem formou jedné intramuskulámí injekce do hýžďového nebo deltového svalu. Místo injekce netřete. Je třeba dbát na to, aby se injekce náhodně neaplikovala do cévy. Neaplikujte injekci do místa, kde jsou známky zánětu, poškození kůže, boule a/nebo modřiny.
Pouze pro hlubokou intramuskulámí injekci do hýždí nebo deltového svalu.


Pamatujte na to, že je třeba střídat injekce do obou hýžďových nebo deltových svalů. Sledujte, zda se neobjeví známky nebo příznaky náhodného podání do cévy.
Krok 5: Postupy po injekci
Nasaďte bezpečnostní kryt jehly podle popisu v kroku 2 e). Po injekci vhodným způsobem zlikvidujte injekční lahvičky, adaptér, jehly a stříkačku.
Lahvičky s práškem a rozpouštědlem jsou pouze na jedno použití.


Příbalová informace: informace pro uživatele
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce
aripiprazolum
Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek podáván, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo zdravotní sestry.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Abilify Maintena a k čemu se používá
2. Čemu musíte věnovat pozornost, než vám bude podán přípravek Abilify Maintena
3. Jak se přípravek Abilify Maintena podává
4. Možné nežádoucí účinky
5. Jak přípravek Abilify Maintena uchovávat
6. Obsah balení a další informace
1. Co je přípravek Abilify Maintena a k čemu se používá
Přípravek Abilify Maintena obsahuje léčivou látku aripiprazol a patří do skupiny léků, které se označují jako antipsychotika. Používá se k léčbě schizofrenie - onemocnění charakterizované příznaky, jako jsou sluchové, zrakové nebo hmatové vjemy, které neexistují, podezřívavost, bludy, nesouvislá řeč, poruchy chování a emoční oploštění. Lidé s těmito obtížemi se mohou také cítit depresivní, provinilí, úzkostní nebo nervózní.
Přípravek Abilify Maintena je určen pro dospělé pacienty se schizofrenií, kteří jsou dostatečně stabilizováni během léčby perorálním aripiprazolem.
2. Čemu musíte věnovat pozornost, než vám bude podán přípravek Abilify Maintena Nepoužívejte Abilify Maintena:
- jestliže j ste alergický(á) na aripiprazol nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před zahájením léčby přípravkem Abilify Maintena se poraďte se svým lékařem nebo zdravotní sestrou.
Během léčby aripiprazolem byly hlášeny sebevražedné úmysly a chování. Okamžitě informujte svého lékaře, pokud máte úmysly nebo pocity, že si chcete ublížit.
Před léčbou přípravkem Abilify Maintena, informujte svého lékaře, pokud máte:
• vysokou hladinu cukru v krvi (charakterizovanou příznaky, jako je nadměrná žízeň, močení ve zvýšené míře, zvýšená chuť k jídlu a pocity slabosti) nebo výskyt cukrovky v rodině
• záchvaty, kvůli kterým Vás možná bude lékař chtít více sledovat
• samovolné, nepravidelné svalové záškuby, zejména v obličeji
• kardiovaskulární onemocnění (onemocnění srdce a oběhového systému), výskyt kardiovaskulárního onemocnění v rodině, cévní mozkovou příhodu nebo přechodnou mozkovou příhodu, abnormální krevní tlak
• krevní sraženiny nebo výskyt krevních sraženin v rodině, protože antipsychotika mívají spojitost s tvorbou krevních sraženin
• zkušenost s nadměrným hráčstvím v minulosti
• vážné problémy s j átry
Pokud si všimnete, že přibíráte na váze, objevují se u Vás neobvyklé pohyby, spavost, která Vám brání vykonávat běžné denní činnosti, máte potíže s polykáním nebo máte alergické příznaky, okamžitě o tom informujte svého lékaře.
Děti a dospívající
Tento přípravek není určen k používání u dětí a dospívajících mladších 18 let. Není známo, zda je u těchto pacientů bezpečný a účinný.
Další léčivé přípravky a Abilify Maintena
Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které plánujete užívat, včetně těch, které jsou dostupné bez lékařského předpisu.
Léky na snížení krevního tlaku: přípravek Abilify Maintena může zvýšit účinek léků užívaných ke snížení krevního tlaku. Informujte svého lékaře o tom, že užíváte lék ke snížení krevního tlaku.
Užívání přípravku Abilify Maintena s některými léky může vést k tomu, že lékař bude muset upravit Vaši dávku přípravku Abilify Maintena nebo ostatních léků. Je obzvlášť důležité informovat svého lékaře o tom, že užíváte:
• léky na úpravu srdečního rytmu (např. chinidin, amiodaron, flekainid)
• antidepresiva nebo rostlinné přípravky používané k léčbě deprese a úzkosti (např. fluoxetin, paroxetin, venlafaxin, třezalka tečkovaná)
• protiplísňové léky (např. ketokonazol, itrakonazol)
• některé léky k léčbě HIV infekce (jako je efavirenz, nevirapin, inhibitory proteázy, např. indinavir, ritonavir)
• protikřečové léky používané k léčbě epilepsie (např. karbamazepin, fenytoin, fenobarbital)
• některá antibiotika používaná k léčbě tuberkulózy (rifabutin, rifampicin)
Tyto léky mohou zvyšovat riziko nežádoucích účinků nebo snižovat účinek přípravku Abilify Maintena; pokud máte při současném užívání těchto léků s přípravkem Abilify Maintena jakékoliv neobvyklé příznaky, měl(a) byste kontaktovat lékaře.
Léky, které zvyšují hladinu serotoninu, se obvykle používají při problémech, jako je deprese, generalizovaná úzkostná porucha, obsedantně kompulzivní choroba a sociální fobie, ale také při migréně a bolesti:
• triptany, tramadol a tryptofan, používané při problémech, jako je deprese, generalizovaná úzkostná porucha, obsedantně kompulzivní choroba (OCD) a sociální fobie, ale také migréna a bolest
• SSRI (jako je paroxetin a fluoxetin) používaný při depresi, OCD, panice a úzkosti
• jiná antidepresiva (jako je venlafaxin a tryptofan) používaná k léčbě deprese
• tricyklická antidepresiva (jako je klomipramin a amitriptylin) používaná při depresivním onemocnění
• třezalka tečkovaná (Hypericum perforatum) používaná jako bylinná léčba mírné deprese
• silná analgetika (např. tramadol a pethidin) používaná k úlevě od bolesti
• triptany (jako je sumatriptan a zolmitripitan) používané k léčbě migrény
Tyto léky mohou zvyšovat riziko nežádoucích účinků; pokud máte při současném užívání těchto léků s přípravkem Abilify Maintena jakékoliv neobvyklé příznaky, měl(a) byste kontaktovat lékaře.
Abilify Maintena s alkoholem
Alkohol by se neměl konzumovat.
Těhotenství, kojení a plodnost
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než Vám bude tento přípravek podáván.
Pokud jste těhotná, neměl by Vám být aplikován přípravek Abilify Maintena bez konzultace s lékařem. Pokud jste těhotná, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, ihned to oznamte lékaři.
Následující příznaky se mohou objevit u novorozenců, jejichž matkám byl podáván přípravek Abilify Maintena v posledním trimestru (posledních třech měsících těhotenství): třes, svalová ztuhlost a/nebo slabost, ospalost, agitovanost, dýchací potíže a potíže při krmení.
Jestliže se u dítěte objeví kterýkoliv z těchto příznaků, obraťte se na svého lékaře.
Pokud dostáváte přípravek Abilify Maintena, lékař s Vámi projedná, zda byste měla kojit s ohledem na výhody léčby pro Vás a výhody kojení pro Vaše dítě. Neměla byste současně používat přípravek Abilify Maintena a kojit. Poraďte se se svým lékařem, jaký je nejlepší způsob krmení Vašeho dítěte, pokud dostáváte přípravek Abilify Maintena.
Řízení dopravních prostředků a obsluha strojů
Neřiďte dopravní prostředek ani neobsluhujte žádné přístroje nebo stroje, dokud nevíte, jak na Vás přípravek Abilify Maintena působí, protože u tohoto léčivého přípravku se mohou vyskytnout nežádoucí účinky, které již byly hlášeny, např. závrať, útlum, dvojité vidění a ospalost.
3. Jak se přípravek Abilify Maintena podává
Abilify Maintena je v předplněné injekční stříkačce. Lékař Vám přípravek podá každý měsíc ve formě jedné injekce aplikované do hýžďového nebo deltového svalu (hýždě nebo rameno). Během injekce můžete cítit mírnou bolest. Lékař bude střídat injekce mezi pravou a levou stranou. Injekce nebudou podávány do žíly.
Lékař rozhodne, jaká dávka přípravku Abilify Maintena je pro Vás správná. Doporučená a počáteční dávka je 400 mg, pokud lékař nerozhodne, že Vám bude podána nižší počáteční nebo pokračovací dávka (300 mg, 200 mg nebo 160 mg). Léčba aripiprazolem podávaným ústy bude pokračovat po dobu 14 dnů po první injekci. Poté budete k léčbě dostávat injekce přípravku Abilify Maintena, pokud Vám lékař neřekne jinak.
Jestliže Vám bude podáno více přípravku Abilify Maintena, než je zapotřebí
Tento lék Vám bude podáván pod lékařským dohledem; je proto nepravděpodobné, že by Vám bylo aplikováno příliš mnoho léku. Pokud navštěvujete více než jednoho lékaře, řekněte jim, že dostáváte přípravek Abilify Maintena.
Pacienti, kterým bylo podáno příliš mnoho aripiprazolu, pozorovali následující příznaky:
• zrychlený srdeční tep, agitovanost/agresivitu, problémy s řečí,
• neobvyklé pohyby (zejména tváře nebo jazyka) a sníženou úroveň vědomí.
Další příznaky mohou být:
• akutní zmatenost, záchvaty (epilepsie), kóma, kombinace horečky, zrychleného dechu, pocení,
• ztuhlost svalů a netečnost nebo ospalost; pomalejší dýchání, dušení, vysoký nebo nízký krevní tlak, abnormální srdeční rytmus.
Okamžitě kontaktujte svého lékaře nebo navštivte nemocnici, pokud pozorujete cokoliv z výše uvedeného.
Pokud vynecháte injekci Abilify Maintena
Je důležité, abyste svou plánovanou dávku nevynechal(a). Injekce by Vám měla být aplikována každý měsíc, ale ne dříve než po 26 dnech od poslední injekce. Pokud injekci vynecháte, měl(a) byste kontaktovat svého lékaře a dohodnout se na další injekci v co nejkratším termínu. Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo zdravotní sestry.
Jestliže jste přestal(a) používat přípravek Abilify Maintena
Nepřerušujte léčbu jen proto, že se cítíte lépe. Je důležité, abyste pokračoval(a) v podávání přípravku Abilify Maintena tak dlouho, jak Vám sdělil lékař.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí
vyskytnout u každého.
Okamžitě informujte svého lékaře, pokud máte jakékoliv z následujících vážných nežádoucích účinků:
• kombinace těchto příznaků: nadměrná ospalost, závrať, zmatenost, dezorientace, obtížná řeč, obtížná chůze, svalová ztuhlost nebo třes, horečka, slabost, podrážděnost, agrese, úzkost, zvýšený krevní tlak nebo záchvaty, kterou mohou vést k bezvědomí.
• neobvyklý pohyb, zejména obličeje nebo jazyka, kvůli kterým Vám lékař možná bude chtít snížit dávku.
• pokud máte příznaky, jako je otok, bolest a zarudnutí na noze, může to znamenat, že máte krevní sraženinu, která může putovat cévami do plic a způsobit bolest na hrudi a dýchací obtíže. Pokud pozorujete kterýkoliv z těchto příznaků, okamžitě vyhledejte lékařskou pomoc.
• kombinace horečky, zrychleného dechu, pocení, svalové ztuhlosti a netečnosti nebo ospalosti, protože to může být známkou stavu nazývaného neuroleptický maligní syndrom (NMS).
• žízeň větší než obvykle, potřebu močení větší než obvykle, veliký hlad, pocit slabosti nebo únavy, pocit nevolnosti, pocit zmatenosti nebo dech, který je cítit po ovoci, protože to může být příznakem diabetu (cukrovky).
Nežádoucí účinky uvedené níže se mohou objevit i po podání přípravku Abilify Maintena.
Časté nežádoucí účinky (mohou postihnout až 1 z 10 osob):
• zvýšení tělesné hmotnosti, úbytek tělesné hmotnosti
• pocity úzkosti, obtíže se spánkem (nespavost)
• pocit neklidu a neschopnost zůstat v klidu, problém sedět v klidu, třes, nekontrolované záškuby, trhavé nebo svíjivé pohyby, pocit neklidu v nohách
• výkyvy bdělosti, ospalost
• svalové pohyby, které nemůžete kontrolovat, j ako j sou grimasy, mlaskání rty a pohyby j azyka. Obvykle je nejprve ovlivněn obličej a ústa, ale mohou být ovlivněny i jiné části těla. Mohou to být projevy stavu, kterému se říká „tardivní dyskineze”.
• parkinsonismus; jde o lékařský termín, který zahrnuje několik příznaků, jako je svalová ztuhlost, záškuby při ohýbání končetin, pomalé nebo narušené pohyby těla, žádný výraz v tváři, tuhost svalů, šourání, spěšné kroky a nedostatek normálního pohybu paží při chůzi
• trhavý odpor proti pasivnímu pohybu, když se svaly napínají a uvolňují, abnormálně zvýšené svalové napětí, svalová ztuhlost, pomalý pohyb těla
• závrať, bolest hlavy
• sucho v ústech
• bolest v místě injekce, zatvrdnutí kůže v místě injekce
• slabost, ztráta síly nebo extrémní únava
• vysoké hodnoty enzymu kreatinfosfokinázy v krvi
Méně časté nežádoucí účinky (mohou postihnout až 1 ze 100 osob):
• snížená nebo zvýšená chuť k jídlu, narušení vnímání chuti a čichu
• nízká hladina specifického typu bílých krvinek (neutropenie), nízké hodnoty hemoglobinu nebo červených krvinek, nízká hodnota krevních destiček
• alergické reakce (přecitlivělost)
• snížené nebo zvýšené hladiny hormonu prolaktinu v krvi
• vysoký krevní cukr, snížený krevní cukr
• zvýšené tuky v krvi, jako je vysoká hladina cholesterolu a/nebo triglyceridů, nízká hladina
cholesterolu a/nebo triglyceridů
• zvýšené hodnoty inzulinu, hormonu regulujícího hodnoty cukru v krvi
• sebevražedné myšlenky
• mentální porucha charakterizovaná narušeným kontaktem s realitou nebo jeho ztrátou, halucinacemi, bludy
• změněný nebo zvýšený zájem o sex
• panická reakce, deprese, kolísání nálady, stav netečnosti s nedostatkem emocí, pocity emočního
a mentálního nepohodlí, změny nálady
• porucha spánku
• cenění zubů nebo svírání čelisti
• škytavka
• fixace očních bulev v jedné pozici, rozmazané vidění, bolest oka, dvojité vidění
• abnormální tlukot srdce, pomalá nebo rychlá tepová frekvence, abnormální elektrická vodivost v srdci, abnormální hodnoty EKG srdce
• závrať při vstávání z pozice vleže nebo vsedě v důsledku poklesu krevního tlaku, vysoký krevní tlak
• kašel
• žaludeční potíže, zažívací potíže, slinění, více slin v ústech než je běžné, zvracení, pocit na zvracení, průjem, zácpa, bolest nebo nepříjemný pocit v břiše, časté vyprazdňování střev
• abnormální krevní jaterní hodnoty
• abnormální padání vlasů
• akné, stav kůže, kdy jsou tváře a nos neobvykle červené, ekzém, zatvrdnutí kůže
• svalová ztuhlost, svalové křeče, svalové záškuby, tuhost svalů, bolest svalů (myalgie), bolest
v končetině, porucha chůze, bolest kloubů (artralgie), bolest zad, omezená kloubní hybnost, ztuhlá šíje, omezené otevírání úst
• ledvinové kameny, cukr (glukosa) v moči
• zvětšení prsu u mužů, citlivost prsu, suchost pochvy
• ztráta síly
• nepříjemné pocity na hrudi
• reakce v místě injekce, jako je zarudnutí, otok, nepříjemné pocity a svědění v místě injekce
• zvětšený obvod pasu
Od uvedení perorálního (užívaného ústy) aripiprazolu na trh byly hlášeny následující nežádoucí účinky, ale jejich frekvence není známa:
• nízké hodnoty bílých krvinek
• neobvyklý tlukot srdce, náhlá nevysvětlitelná smrt, srdeční příhoda
• alergická reakce (např. zduření v ústech, zduřelý jazyk, obličej a hrdlo, svědění, kopřivka), vyrážka
• ketoacidóza (ketony v krvi a moči) nebo kóma, nízká hodnota sodíku v krvi
• ztráta chuti k jídlu (anorexie), obtížné polykání
• agrese
• nervozita, nadměrné hráčství, pokus o sebevraždu a sebevražda; porucha řeči, záchvat, serotoninový syndrom (reakce, která může způsobit pocity velkého štěstí, ospalost, nemotornost, neklid, pocit opilosti, horečku, pocení nebo ztuhlé svaly), kombinace horečky, svalové ztuhlosti, zrychleného dýchání, pocení, sníženého vědomí a náhlých změn krevního tlaku a tepové frekvence (neuroleptický maligní syndrom)
• mdloba, křeče svalů okolo hrtanu, náhodné vdechnutí jídla s rizikem zápalu plic (plicní infekce), zánět slinivky břišní
• jaterní selhání, zánět jater, zežloutnutí kůže a bělma očí, citlivost na světlo, nadměrné pocení, ztuhlost nebo křeče, bolest svalů, slabost
• mimovolní únik moči (inkontinence), obtížné močení
• dlouhá a/nebo bolestivá erekce
• potíže s regulací tělesné teploty nebo přehřátí, bolest na hrudi a otok rukou, kotníků nebo nohou Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Abilify Maintena uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Chraňte před mrazem.
Uchovávejte předplněnou injekční stříkačku ve vnější krabičce, aby byl přípravek chráněn před světlem.
Pokud se injekce neaplikuje okamžitě po rekonstituci, injekční stříkačku lze uchovat při teplotě do 25 °C po dobu až 2 hodin.
Nevyhazujte žádné léčivé přípravky do odpadních vod. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Abilify Maintena obsahuje
- Léčivou látkou je aripiprazolum.
Jedna předplněná injekční stříkačka obsahuje aripiprazolum 300 mg. Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg. Jedna předplněná injekční stříkačka obsahuje aripiprazolum 400 mg. Po rekonstituci jeden ml suspenze obsahuje aripiprazolum 200 mg.
- Dalšími složkami jsou Prášek
Sodná sůl karmelosy, mannitol, monohydrát dihydrogenfosforečnanu sodného, hydroxid sodný
Rozpouštědlo
Voda na injekci
Jak přípravek Abilify Maintena vypadá a co obsahuje toto balení
Přípravek Abilify Maintena se dodává v předplněné injekční stříkačce obsahující bílý až téměř bílý prášek v přední komoře a čiré rozpouštědlo v zadní komoře. Lékař z něj vytvoří suspenzi, která Vám bude aplikována ve formě injekce.
Jednotlivé balení
Jedno jednorázové balení obsahuje jednu předplněnou injekční stříkačku a tři hypodermické bezpečnostní jehly: jednu 23G o délce 25 mm, jednu 22G o délce 38 mm a jednu 21G o délce 50 mm.
Multipack (vícečetné balení)
Balení 3 jednotlivých balení.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Otsuka Pharmaceutical Europe Ltd.
Gallions, Wexham Springs, Framewood Road,
Wexham, SL3 6PJ - Velká Británie
Výrobce
H. Lundbeck A/S Ottiliavej 9, 2500 Valby Dánsko
Elaiapharm
2881 Route des Cretes Z.I Les Bouillides Sophia Antipolis
06550 Valbonne
Francie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Lietuva
H. Lundbeck A/S Tel: +45 36301311
Belgie/Belgique/Belgien
Lundbeck S.A./N.V. Tél/Tel: +32 2 535 79 79
Bt^rapuu
Lundbeck Export A/S Representative Office
Tel: +359 2 962 4696
Luxembourg/Luxemburg
Lundbeck S.A.
Tél: +32 2 535 79 79
Česká republika
Lundbeck Česká republika s.r.o.
Tel: +36 1 4369980
Tel: +420 225 275 600
Magyarország
Lundbeck Hungaria Kft.
Malta
H. Lundbeck A/S Tel: +45 36301311
Danmark
Otsuka Pharma Scandinavia AB Tel: +46 8 54528660
Deutschland
Otsuka Pharma GmbH Tel: +49 69 1700860
Nederland
Lundbeck B.V.
Tel: +31 20 697 1901
Eesti
H. Lundbeck A/S
Norge
Otsuka Pharma Scandinavia AB
Tel: +45 36301311
Eiiába
Lundbeck Hellas S.A.
Tni: +30 210 610 5036
Espaňa
Otsuka Pharmaceutical S.A.
Tel: +34 93 208 10 20
France
Otsuka Pharmaceutical France SAS Tél: +33 (0)1 47 08 00 00
Hrvatska
Lundbeck Croatia d.o.o.
Tel.: +385 1 644 82 63
Ireland
Lundbeck (Ireland) Limited Tel: +353 1 468 9800
Island
Vistor hf.
Sími: +354 535 7000 Italia
Otsuka Pharmaceutical Italy S.r.l Tel: +39 02 00 63 27 10
Kórcpog
Lundbeck Hellas A.E Tni.: +357 22490305
Latvija
H. Lundbeck A/S Tel: +45 36301311
Tel: +46 8 54528660 Osterreich
Lundbeck Austria GmbH Tel: +43 1 266 91 08
Polska
Lundbeck Poland Sp. z o. o.
Tel.: +48 22 626 93 00
Portugal
Lundbeck Portugal Lda Tel: +351 21 00 45 900
Románia
Lundbeck Export A/S Reprezentanta din Romania Tel: +40 21319 88 26
Slovenija
Lundbeck Pharma d.o.o.
Tel.: +386 2 229 4500
Slovenská republika
Lundbeck Slovensko s.r.o.
Tel: +421 2 5341 42 18
Suomi/Finland
Otsuka Pharma Scandinavia AB Tel: +46 8 54528660
Sverige
Otsuka Pharma Scandinavia AB Tel: +46 8 54528660
United Kingdom
Otsuka Pharmaceuticals (UK) Ltd. Tel: +44 203 747 5300
Tato příbalová informace byla naposledy revidována {MM.RRRR}
Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
POKYNY PRO ZDRAVOTNICKÉ PRACOVNÍKY
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Abilify Maintena 300 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce
Abilify Maintena 400 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním v předplněné injekční stříkačce
aripiprazol
Krok 1: Příprava před rekonstitucí prášku
Rozložte jednotlivé součásti a ujistěte se, že máte všechny níže uvedené:
- Příbalová informace a informace pro zdravotnické pracovníky pro přípravek Abilify Maintena
- Jedna předplněná injekční stříkačka přípravku Abilify Maintena
- Jedna hypodermická bezpečnostní jehla 23G o délce 25 mm s ochranným obalem jehly
- Jedna hypodermická bezpečnostní jehla 22G o délce 38 mm s ochranným obalem jehly
- Jedna hypodermická bezpečnostní jehla 21G o délce 50 mm s ochranným obalem jehly
- Návod k použití stříkačky a jehly
Krok 2: Rekonstituce prášku
a) Mírně zatlačte pístovou tyč, až se zapojí závity. Poté pístovou tyčí otáčejte, dokud se tyč nepřestane otáčet a nezačne vytlačovat rozpuštěný přípravek. Poté, co se pístová tyč zcela zastaví, bude střední pojistka na značce.


b) Důkladně po dobu 20 sekund třepejte injekční stříkačkou ve vertikální poloze, dokud se
neobjeví jednotná rekonstituovaná suspenze. Suspenzi je nutné injekčně aplikovat okamžitě po rekonstituci.

20 sekund

Stejnoměrně mléčně bílá
c) Před podáním zrakem zkontrolujte rekonstituovanou suspenzi, zda neobsahuje nerozpuštěné kousky a nezměnila barvu. Rekonstituovaná suspenze přípravku musí být stejnoměrná, homogenní suspenze, která je neprůhledná a její barva je mléčně bílá.
d) Pokud se injekce neaplikuje okamžitě po rekonstituci, injekční stříkačku lze uchovat při teplotě do 25 °C po dobu až 2 hodin. Intenzivně stříkačkou třepejte minimálně po dobu 20 sekund, aby se před injekcí přípravek resuspendoval, pokud stříkačka ležela déle než 15 minut.
Krok 3: Příprava před injekcí
a) Otočte a vytáhněte hlavní kryt a kryt špičky.
t
Otočte a vytáhněte

Hlavní kryt Kryt špičky

Otočte a vytáhněte

b) Zvolte jednu z přiložených hypodermických bezpečnostních jehel v závislosti na místě aplikace injekce a hmotnosti pacienta.
|
Tělesný typ |
Místo aplikace injekce |
Velikost jehly |
|
Neobézní |
Deltový sval |
23G, 25 mm |
|
Hýžďový sval |
22G, 38 mm | |
|
Obézní |
Deltový sval |
22G, 38 mm |
|
Hýžďový sval |
21G, 50 mm |
c) Držte kryt jehly a zatlačením se ujistěte, že je jehla pevně posazená na bezpečnostním krytu. Otáčejte ve směru hodinových ručiček, dokud není pevně zasazená.

Kryt jehly
d) Poté vytáhněte kryt jehly rovně nahoru.
e) Držte stříkačku ve vzpřímené poloze a pomalu posouvejte pístovou tyč, abyste vytlačili
vzduch. Pokud není možné pístovou tyč posunout tak, abyste vytlačili vzduch, zkontrolujte, zda je pístová tyč otočená až do úplného zastavení. Není možno resuspendovat poté, co se vytlačí vzduch ze stříkačky.
*Pokud cítíte odpor nebo je obtížné vzduch vytlačit,
zkontrolujte, zda je pístová tyč otočená do úplného zastavení.

Kryt jehly

Vytáhněte
Vytlačujte vzduch, dokud suspenze nezaplní dolní část jehly*
f) Pomalu aplikujte injekci do hýžďového nebo deltového svalu. Místo injekce netřete. Je třeba dbát na to, aby se injekce náhodně neaplikovala do cévy. Neaplikujte injekci do místa, kde jsou známky zánětu, poškození kůže, boule a/nebo modřiny.
Pouze pro hlubokou intramuskulární injekci do hýždí nebo deltového svalu.


hýžďový sval
Pamatujte na to, že je třeba střídat injekce do obou hýžďových nebo deltových svalů. Sledujte, zda se neobjeví známky nebo příznaky náhodného podání do cévy.
Krok 4: Postupy po injekci
Nasaďte bezpečnostní kryt jehly. Po injekci vhodným způsobem zlikvidujte jehlu a předplněnou injekční stříkačku.


PŘÍLOHA IV
VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZMĚNY V REGISTRACI
Vědecké závěry
S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) aripiprazolu dospěl výbor CHMP k těmto vědeckým závěrům:
Po prověření bezpečnostních databází, klinické databáze a literatury byla většina hlášení týkající se škytavky nezávažné povahy a tyto případy odezněly spontánně bez jakékoliv intervence. S ohledem na počet hlášených případů škytavky spojených s užíváním aripiprazolu (primárně v perorální formě), s ohledem na dobu výskytu škytavky po zahájení léčby aripiprazolem, s ohledem na několik hlášení po vysazení podezřelého léčiva (pozitivní dechallenge) a hlášení po opakovaném užití léčiva (pozitivní rechallenge) se zdá, že existuje určitá míra příčinné souvislosti mezi expozicí aripiprazolu a škytavkou. Kromě toho skóre analýz disproporcionality v systému Food and Drug Administration (FDA) Adverse Event Reporting System (FAERS) a databáze VigiBase naznačují potenciální souvislost mezi aripiprazolem a škytavkou. Výbor PRAC rozhodl, že údaje o léčivém přípravku aripiprazol se mají aktualizovat tak, aby byl v bodě 4.8 SmPC uveden nežádoucí účinek „škytavka“, protože nelze vyloučit, že v hlášených případech k tomuto stavu přispěl aripiprazol. Příbalová informace se má aktualizovat obdobným způsobem.
Proto sS ohledem na údaje prezentované v revidovaných periodicky aktualizovaných zprávách o bezpečnosti (PSUR) výbor PRAC rozhodl, že změny v informacích o léčivých přípravcích obsahujících aripiprazol jsou opodstatněné.
Výbor CHMP souhlasí s vědeckými závěry výboru PRAC.
Zdůvodnění změny v registraci
Na základě vědeckých závěrů týkajících se aripiprazolu zastává výbor CHMP stanovisko, že poměr přínosů a rizik léčivého přípravku obsahujícího léčivou látku aripiprazol je příznivý pod podmínkou, že v údajích o přípravku budou provedeny navržené změny.
Výbor CHMP doporučuje změnit podmínky rozhodnutí o registraci.
82