Abasaglar 100 Jednotek/Ml
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
ABASAGLAR 100 jednotek/ml, injekční roztok v zásobní vložce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml obsahuje insulinum glarginum* 100 jednotek (odpovídá 3,64 mg).
Jedna zásobní vložka obsahuje 3 ml injekčního roztoku, to je 300 jednotek.
*Insulin glargin je vyráběn rekombinantní DNA technologií bakterií Escherichia coli. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok. (Injekce).
Čirý bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Léčba diabetes mellitus u dospělých, dospívajících a dětí ve věku od 2 let.
4.2 Dávkování a způsob podání
Dávkování
ABASAGLAR obsahuje inzulin glargin, inzulinový analog s prodlouženým trváním účinku.
Přípravek ABASAGLAR se má podávat jednou denně, v kteroukoliv denní dobu, ale každý den vždy ve stejnou dobu.
Dávkovací režim přípravku ABASAGLAR (dávka a doba podání) by měl být upraven individuálně. U pacientů s diabetes mellitus 2. typu se ABASAGLAR může podávat společně s perorálními antidiabetiky.
Síla tohoto přípravku se uvádí v jednotkách. Tyto jednotky se vztahují výhradně k insulinu glargin a liší se od IU nebo jednotek používaných k vyjádření síly jiných inzulinových analogů (viz bod 5.1).
Zvláštní populace
Starší populace (> 65 let)
U starších pacientů může postupné zhoršování funkce ledvin vést k ustálenému poklesu potřeby inzulinu. Porucha funkce ledvin
U pacientů s poruchou funkce ledvin se může potřeba inzulinu zmenšit kvůli sníženému metabolismu inzulinu.
Porucha funkce jater
U pacientů s poruchou funkce jater se může potřeba inzulínu zmenšit kvůli snížené kapacitě glukoneogeneze a sníženému metabolismu inzulínu.
Pediatrická populace
Bezpečnost a účinnost inzulinu glargin byla stanovena u dospívajících a dětí ve věku 2 roky a starších.
Údaje, které jsou v současné době dostupné, jsou uvedeny v bodech 4.8, 5.1 a 5.2.
Bezpečnost a účinnost inzulinu glargin u dětí ve věku pod 2 roky nebyla stanovena. Nejsou k dispozici žádné údaje.
Přechod z jiných inzulinů na přípravek ABASAGLAR
Při přechodu pacienta z léčebného režimu se středně nebo dlouhodobě účinkujícím inzulinem na režim s přípravkem ABASAGLAR, je nutno počítat se změnou předchozího dávkování bazálního inzulinu a úpravou doprovodné antidiabetické léčby (dávka a doba podání doplňkových pravidelných inzulinů nebo inzulinových analogů s rychlým nástupem účinku nebo dávka perorálních antidiabetik).
Pacienti, kteří přecházejí z režimu s dvakrát denně podávaným NPH inzulinem (bazální inzulin) na režim s jedenkrát denně podávaným přípravkem ABASAGLAR, by měli snížit svou denní dávku bazálního inzulinu o 20-30 % během prvních týdnů léčby, aby se snížilo riziko noční a časné ranní hypoglykémie.
Během prvních týdnů léčby by mělo být toto snížení dávky alespoň částečně kompenzováno zvýšením dávky inzulinu podávaného před jídlem, po této periodě by měl být režim individuálně upraven.
U pacientů, kteří používají vysoké dávky inzulinu z důvodu přítomnosti protilátek proti lidskému inzulinu, může stejně jako při používání ostatních inzulinových analogů dojít i při používání přípravku ABASAGLAR ke zlepšení inzulinové odpovědi.
Během přechodu a v počátečních týdnech terapie se doporučuje pečlivé metabolické sledování.
Zlepšení metabolické kontroly a výsledná zvýšená citlivost k inzulinu si může vyžádat další úpravu dávkovacího režimu. Úprava dávky může být nutná také například, když se změní tělesná hmotnost pacienta nebo jeho životní styl, pokud dojde ke změně času podání dávky inzulinu nebo nastanou-li další okolnosti, zvyšující sklon k hypoglykémii nebo hyperglykémii (viz bod 4.4).
Způsob podání
ABASAGLAR se podává subkutánní injekcí.
ABASAGLAR se nesmí podávat intravenózně. Prodloužený účinek inzulinu glargin závisí na injekční aplikaci do podkožní tkáně. Intravenózní podání obvyklé subkutánní dávky by mohlo vést k těžké hypoglykémii.
Nejsou klinicky významné rozdíly v sérových hladinách inzulinu nebo glukózy po podání inzulinu glargin do břišní stěny, do deltového svalu nebo do stehna. V rámci vybrané oblasti aplikace je nutno s každou injekcí střídat místo vpichu.
ABASAGLAR se nesmí míchat s žádnými jinými inzuliny ani ředit. Mísení nebo ředění může měnit jeho profil čas/účinek; míchání může způsobit vysrážení.
Další podrobnosti k použití viz bod 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
ABASAGLAR není inzulínem volby k léčbě diabetické ketoacidózy. Místo něj se v takových případech doporučuje běžný inzulín podávaný intravenózně.
V případě nedostatečné úpravy glykémie nebo sklonu k hyperglykemickým nebo hypoglykemickým epizodám je nezbytné zrevidovat předtím, než se zváží úprava dávky, zda pacient dodržuje předepsaný léčebný režim, místa pro aplikaci a vlastní techniku vpichu a ostatní relevantní faktory.
Převod pacienta na jiný typ nebo značku inzulinu musí proběhnout pod přísným lékařským dohledem. Po změně síly, značky (výrobce), typu (normální lidský inzulin, NPH, lente, dlouhodobě působící inzuliny atd.), původu (zvířecí, lidský, analoga lidského inzulinu) a/nebo výrobní metody může být zapotřebí upravit dávku.
Podání inzulinu může způsobit tvorbu protilátek proti inzulinu. Ve vzácných případech může přítomnost takových protilátek proti inzulinu vyžadovat úpravu dávky, aby byl korigován sklon k hyper- nebo hypoglykémii (viz bod 4.8).
Hypoglykémie
Doba výskytu hypoglykémie závisí na profilu účinku užívaných inzulinů a může se proto měnit při změně léčebného režimu. Vzhledem k déle trvajícím dodávkám bazálního inzulinu při užívání inzulinu glargin je možno očekávat menší výskyt nočních hypoglykémií, ale více hypoglykémií časně ráno.
Zvláštní opatrnost a intenzívní monitorování hladiny glukózy v krvi se doporučuje u těch pacientů, u kterých mohou být hypoglykemické epizody zvláště klinicky významné: u pacientů s významnými stenózami koronárních arterií nebo krevních cév zásobujících mozek (riziko kardiálních nebo cerebrálních komplikací hypoglykémie), stejně jako u pacientů s proliferativní retinopatií, zvláště není-li léčena fotokoagulací (riziko přechodné amaurózy vyvolané hypoglykémií).
Pacienti by měli být obeznámeni s okolnostmi, za kterých j sou varovné příznaky hypoglykémie oslabeny. Varovné symptomy hypoglykémie mohou být změněny, být méně výrazné nebo mohou zcela chybět u některých rizikových skupin. K nim patří pacienti:
- u kterých byla glykemická kontrola význačně zlepšena,
- u kterých se hypoglykémie vyvíjí postupně,
- starší pacienti,
- po převedení ze zvířecího inzulinu na lidský inzulin,
- u kterých je přítomna autonomní neuropatie,
- s dlouhou anamnézou diabetu,
- trpící psychiatrickým onemocněním,
- současně léčení některými dalšími léčivými přípravky (viz bod 4.5).
Takové situace mohou vést k těžké hypoglykémii (a možné ztrátě vědomí), dříve než si pacient hypoglykémii stihne uvědomit.
Prodloužený účinek inzulinu glargin podaného subkutánně může zpomalit dobu zotavení z hypoglykémie.
Pokud jsou zaznamenány normální nebo snížené hladiny glykovaného hemoglobinu, je nutno vzít v úvahu možnost rekurentních, nerozpoznaných (zejména nočních) epizod hypoglykémie.
Nezbytnými předpoklady pro snížení rizika hypoglykémie jsou dodržování dávky a dietního režimu pacientem, správné podávání inzulinu a schopnost pacienta rozpoznat příznaky hypoglykémie. Faktory zvyšující sklon k hypoglykémii vyžadují zvlášť pečlivé sledování a mohou si vynutit úpravu dávky.
Patří mezi ně:
- změna oblasti aplikace,
- zlepšení citlivosti k inzulinu (např. odstraněním stresových faktorů),
- nezvyklá, zvýšená nebo prodloužená fyzická aktivita,
- přidružené nemoci (např. zvracení, průjem),
- neadekvátní příjem potravy,
- vynechání jídla,
- konzumace alkoholu,
- některé nekompenzované poruchy endokrinního systému (např. u hypotyreózy a u nedostatečnosti adenohypofýzy nebo adrenokortikální nedostatečnosti),
- současná léčba některými jinými léčivými přípravky.
Interkurentní nemoci
Přidružené nemoci vyžadují intenzívní metabolický monitoring. V mnoha případech jsou indikovány testy na ketolátky v moči a často je nutná úprava dávky inzulinu. Potřeba inzulinu je často zvýšená. Pacienti s diabetem typu 1 musí pokračovat v pravidelném příjmu alespoň malého množství sacharidů dokonce i tehdy, když jsou schopni jíst pouze málo nebo nejí vůbec, nebo zvrací atd., a nesmějí nikdy vynechat inzulin úplně.
Pera určená k použití se zásobními vložkami ABASAGLAR
Tyto zásobní vložky mohou být použity pouze do per, doporučených k použití s inzulinovými zásobními vložkami firmy Lilly a nesmí být použity s jinými pery, protože u jiných per není zajištěna přesnost dávkování.
Chyby v medikaci
Byly hlášeny chyby v léčbě, kdy byly omylem podány jiné, zejména krátkodobě působící, inzuliny namísto inzulinu glargin. Před každým podáním injekce musí být vždy zkontrolován štítek inzulinu, aby nedošlo k záměně přípravku ABASAGLAR a jiných inzulinů.
Kombinace přípravku ABASAGLAR s pioglitazonem
Zejména u pacientů s rizikovými faktory pro vznik srdečního selhání byly při podávání pioglitazonu v kombinaci s inzulinem hlášeny případy srdečního selhání. To je třeba mít na paměti, pokud je zvažována léčba přípravkem ABASAGLAR v kombinaci s pioglitazonem. Jestliže je tato kombinace použita, je třeba pacienty sledovat, zda se u nich neobjevují známky a příznaky srdečního selhání, zvýšení tělesné hmotnosti a edém. Dojde-li k jakémukoli zhoršení srdečních příznaků, je zapotřebí léčbu pioglitazonem ukončit.
Pomocné látky
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) v jedné dávce, tj. „zanedbatelné množství sodíku“.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Rada látek ovlivňuje metabolismus glukózy a může vyžadovat úpravu dávky inzulinu glargin.
Mezi látky, které mohou zvýšit hypoglykemizující účinek a zvýšit náchylnost k hypoglykémii, patří perorální antidiabetika, inhibitory angiotenzin konvertujícího enzymu (ACE), disopyramid, fibráty, fluoxetin, inhibitory monoaminooxidázy (MAO), pentoxifylin, propoxyfen, salicyláty, analoga somatostatinu a sulfonamidová antibiotika.
Mezi látky, které mohou snižovat hypoglykemizující účinek, patří kortikosteroidy, danazol, diazoxid, diuretika, glukagon, isoniazid, estrogeny a progestogeny, deriváty fenothiazinu, somatropin, sympatomimetika (např. epinefrin [adrenalin], salbutamol, terbutalin), thyreoidní hormony, atypické antipsychotické léčivé přípravky (např. klozapin a olanzapin) a inhibitory proteáz.
Betablokátory, klonidin, soli lithia nebo alkohol mohou zesílit nebo zeslabit hypoglykemizující účinek inzulinu. Pentamidin může vyvolat hypoglykémii, po které může někdy následovat hyperglykémie.
Navíc vlivem sympatolytických léčivých přípravků, jako jsou betablokátory, klonidin, guanethidin a reserpin, mohou být známky adrenergní kontraregulace sníženy nebo mohou zcela chybět.
4.6 Fertilita, těhotenství a kojení
Nejsou k dispozici klinické údaje z kontrolovaných klinických studií o podávání inzulinu glargin během těhotenství. Velké množství údajů u těhotných žen (údaje od více než 1000 těhotenství) nenaznačuje žádné specifické nežádoucí účinky inzulinu glargin na těhotenství ani žádnou specifickou malformační či fetální/neonatální toxicitu inzulinu glargin.
Údaje získané u zvířat neodhalily reprodukční toxicitu.
V případě klinické potřeby je možné zvážit použití přípravku ABASAGLAR během těhotenství.
U pacientek s preexistujícím diabetem nebo s těhotenským diabetem je nutné během těhotenství udržovat dobrou metabolickou kontrolu, aby se předešlo nepříznivým důsledkům v souvislosti s hyperglykémií. Potřeba inzulinu může klesat během prvního trimestru a obecně se zvyšuj e během druhého a třetího trimestru. Okamžitě po porodu potřeba inzulinu rapidně poklesne (zvýšené riziko hypoglykémie). Pečlivý monitoring glukózy je nutný.
Kojení
Není známo, zda je inzulin glargin vylučován do mateřského mléka. Vzhledem k tomu, že jako peptid je inzulin glargin štěpen v lidském gastrointestinálním traktu na aminokyseliny, nepředpokládá se po požití inzulinu glargin žádný metabolický účinek na kojeného novorozence/kojené dítě.
Kojící ženy mohou vyžadovat úpravu dávky inzulinu a diety.
Fertilita
Studie na zvířatech neodhalily přímé škodlivé účinky týkající se fertility.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Schopnost koncentrace a reakce pacienta může být zhoršena následkem hypoglykémie, hyperglykémie nebo např. následkem poruchy zraku. To může představovat riziko v situacích, kde jsou tyto schopnosti zvláště důležité (např. při řízení vozidla nebo obsluze strojů).
Pacient by měl být obeznámen s opatřeními zabraňujícími vzniku hypoglykémie během řízení. To je důležité zejména u těch, kteří mají sníženou nebo chybějící vnímavost k varovným příznakům hypoglykémie nebo mají časté epizody hypoglykémie. Je třeba zvážit, zda řízení nebo obsluha strojů jsou za těchto okolností vhodné.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Hypoglykémie, obecně nejčastější nežádoucí účinek inzulinové terapie, se může objevit, jestliže je dávka inzulinu vzhledem k jeho potřebě příliš vysoká.
Tabulkový přehled nežádoucích účinků
V klinických studiích byly zaznamenány následující související nežádoucí účinky, které jsou seřazeny podle tříd orgánových systémů a podle klesající incidence (velmi časté: >1/10; časté: >1/100 až <1/10; méně časté: >1/1 000 až <1/100; vzácné >1/10 000 až <1/1 000; velmi vzácné: <1/10 000).
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Systém orgánových tříd MedDRA |
Velmi časté |
Časté |
Méně časté |
Vzácné |
Velmi vzácné |
|
Poruchy imunitního systému | |||||
|
Alergické reakce |
X | ||||
|
Poruchy metabolismu a výživy | |||||
|
Hypoglykémie |
X | ||||
|
Poruchy nervového systému | |||||
|
Dysgeuzie |
X | ||||
|
Poruchy oka | |||||
|
Zhoršení zraku |
X | ||||
|
Retinopatie |
X | ||||
|
Poruchy kůže a podkožní tkáně | |||||
|
Lipohypertrofie |
X | ||||
|
Lipoatrofie |
X | ||||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | |||||
|
Myalgie |
X | ||||
|
Celkové poruchy a reakce v místě aplikace | |||||
|
Reakce v místě vpichu |
X | ||||
|
Edém |
X | ||||
Popis vybraných nežádoucích účinků
Poruchy metabolismu a výživy
Těžké hypoglykemické ataky, zvláště pokud jsou rekurentního typu, mohou vést k neurologickému poškození. Dlouhotrvající nebo těžké hypoglykemické epizody mohou být život ohrožující. U mnoha pacientů předcházejí známky adrenergní kontraregulace známkám a příznakům neuroglykopenie. Obecně platí, že čím větší a rychlejší je pokles glukózy v krvi, tím výraznější je jev kontraregulace a jeho symptomy.
Poruchy imunitního systému
Reakce z přecitlivělosti okamžitého typu na inzulin jsou vzácné. Takové reakce na inzulin (včetně inzulinu glargin) nebo na pomocnou látku mohou být doprovázeny například generalizovanými kožními reakcemi, angioedémem, bronchospasmem, hypotenzí a šokem a mohou být život ohrožující.
Podávání inzulinu může vyvolat vznik protilátek proti němu. V klinických studiích byly protilátky, které zkříženě reagují s lidským inzulinem a s inzulinem glargin, pozorovány se stejnou četností jak u skupiny léčené inzulinem NPH tak u skupiny léčené inzulinem glargin. Ve vzácných případech si může přítomnost protilátek proti inzulinu vynutit úpravu dávky inzulinu za účelem korekce sklonu k hyper- nebo hypoglykémii.
Poruchy oka
Výrazná změna v glykémii může být příčinou přechodného zhoršení zraku, způsobeného přechodnou změnou napětí a indexu lomu čoček.
Dlouhodobé zlepšení glykemické kontroly snižuje riziko progrese diabetické retinopatie. Avšak intenzívní inzulínová terapie s prudkým zlepšením glykemické kontroly může být spojena s přechodným zhoršením diabetické retinopatie. U pacientů s proliferativní retinopatií, zvláště pokud nebyla léčena laserem, mohou těžké hypoglykemické epizody vyvolat přechodnou amaurózu.
Poruchy kůže a podkožní tkáně
Tak jako při každé inzulinové terapii, může se v místě vpichu vyvinout lipodystrofie vedoucí ke zpomalení lokální absorpce inzulinu. Plynulé střídání místa vpichu v oblasti aplikace může pomoci omezit tyto reakce nebo jim předejít.
Celkové poruchy a reakce v místě aplikace
Takové reakce zahrnují zčervenání, bolest, svědění, vyrážku, otok nebo zánět. Většina mírných reakcí na inzulin v místě vpichu obvykle odezní během několika dnů nebo několika týdnů.
Vzácně může být inzulin příčinou retence sodíku a vzniku otoků, zvláště je-li předchozí špatná metabolická kontrola zlepšena intenzívní inzulinovou terapií.
Pediatrická populace
Všeobecně je bezpečnostní profil u dětí a dospívajících (<18 let) podobný bezpečnostnímu profilu u dospělých. Zprávy o nežádoucích účincích, získané z pozorování po uvedení přípravku na trh, zahrnovaly relativně častější reakce v místě vpichu (bolest v místě vpichu, reakce v místě vpichu) a kožní reakce (vyrážka, kopřivka) u dětí a dospívajících (<18 let) než u dospělých. Nejsou dostupné žádné údaje o bezpečnosti z klinických studií u dětí mladších než 2 roky.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Příznaky
Předávkování inzulinu může vést k těžké a někdy dlouhodobé a život ohrožující hypoglykémii.
Léčba
Mírné hypoglykemické epizody mohou být obvykle zvládnuty perorálním podáním sacharidů. Může být potřeba upravit dávku, dietní režim nebo fyzickou aktivitu.
Závažnější epizody spojené s kómatem, křečemi nebo neurologickou poruchou mohou být léčeny intramuskulárně/subkutánně podaným glukagonem nebo intravenózně podanou koncentrovanou glukózou. Dlouhodobé podávání sacharidů a sledování stavu je nezbytné, protože hypoglykémie se může po zjevném klinickém zlepšení opakovat.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Léčiva k terapii diabetů, inzulíny a analogy dlouze působící, k injekční aplikaci, ATC kód: A10A E04.
ABASAGLAR je tzv. podobným biologickým léčivým přípravkem („biosimilar“). Podrobné informace jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Mechanismus účinku
Inzulin glargin je analog lidského inzulinu cíleně připravený tak, aby měl malou rozpustnost při neutrálním pH. Je úplně rozpustný při kyselém pH (pH 4) injekčního roztoku ABASAGLAR. Po aplikaci injekce do podkožní tkáně je kyselý roztok neutralizován, což vede ke vzniku mikroprecipitátů, ze kterých jsou plynule uvolňována malá množství inzulinu glargin, zajišťující hladký a předvídatelný profil koncentrace/čas bez vrcholového píku s prodlouženým trváním účinku.
Inzulin glargin je metabolizován na 2 aktivní metabolity, M1 a M2 (viz bod 5.2).
Vazba na inzulínový receptor
Podle studií in vitro je afinita inzulinu glargin a jeho metabolitů M1 a M2 k lidskému receptoru pro inzulin podobná, jako afinita humánního inzulinu.
Vazba na receptor pro IGF-1: Afinita inzulinu glargin k lidskému receptoru pro IGF-1 je přibližně 5krát až 8krát vyšší, než afinita humánního inzulinu (ale zhruba 70krát až 80krát nižší než afinita IGF-1), zatímco M1 a M2 metabolity se váží na receptor pro IGF-1 s o něco menší afinitou v porovnání s humánním inzulinem.
Celková terapeutická koncentrace inzulinu (inzulinu glargin a jeho metabolitů) zjištěná u pacientů s diabetem typu 1, byla výrazně nižší, než koncentrace potřebná pro obsazení poloviny maximálního počtu IGF-1 receptorů a následnou aktivaci mitogenně-proliferativní cesty spouštěné IGF-1 receptorem. Fyziologické koncentrace endogenního IGF-1 mohou aktivovat mitogenně-proliferativní cestu, nicméně terapeutické koncentrace při léčbě inzulinem, včetně léčby přípravkem ABASAGLAR, j sou značně nižší, než farmakologické koncentrace potřebné k aktivaci IGF-1 cesty.
Farmakodynamické účinky
Primárním účinkem inzulinu, včetně inzulinu glargin, je regulace metabolismu glukózy. Inzulin a jeho analoga snižují hladinu glukózy v krvi stimulací periferního vychytávání glukózy, zvláště kosterními svaly a tukem, a inhibicí glukoneogeneze v játrech. Inzulin inhibuje lipolýzu v tukových buňkách, inhibuje proteolýzu a podporuje syntézu proteinů.
V klinicko-farmakologických studiích se ukázalo, že při intravenózním podání jsou inzulin glargin a lidský inzulin ekvipotetntní, jsou-li podány ve stejných dávkách. Stejně jako u všech inzulinů průběh účinku inzulinu glargin může být ovlivněn fyzickou aktivitou a dalšími proměnnými faktory.
Ve studiích u zdravých dobrovolníků nebo u pacientů s diabetes mellitus 1. typu byl pomocí metody euglykemického clampu nástup účinku subkutánně podaného inzulinu glargin pomalejší než nástup účinku lidského inzulinu NPH. U inzulinu glargin byl profil účinku plynulý, bez vrcholu, a s prodlouženým trváním účinku.
Následující graf ukazuje výsledky ze studie u pacientů:
Obr. 1: Profil účinku u diabetiků 1. typu
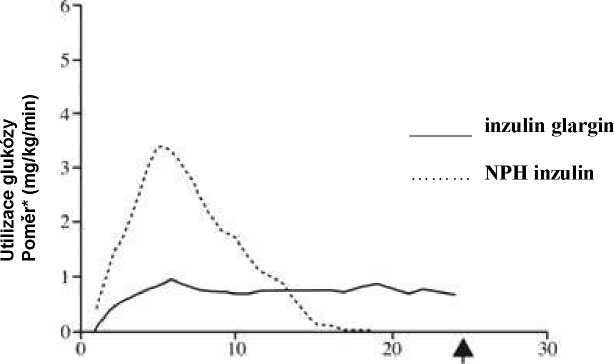
Čas (h) po s.c. podání
Ukončení doby pozorování
*Stanoveno jako množství glukózy podané infuzí k udržení konstantních hladin glukózy v plazmě (průměrné hodinové hodnoty)
Prodloužený účinek subkutánního inzulinu glargin je v přímém vztahu k jeho pomalejší absorpci a umožňuje podávání jednou denně. Doba trvání účinku inzulinu a inzulinových analogů jako je inzulin glargin může u různých jedinců nebo u téhož jedince značně kolísat.
V klinické studii byly příznaky hypoglykémie nebo kontraregulačních hormonálních odpovědí po intravenózně podaném inzulinu glargin a po intravenózně podaném lidském inzulinu podobné jak u zdravých dobrovolníků, tak u diabetiků 1. typu.
Klinická účinnost a bezpečnost
Účinky inzulinu glargin (jedenkrát denně) na rozvoj diabetické retinopatie byly hodnoceny v otevřené 5leté klinické studii kontrolované NPH (NPH dvakrát denně), která na základě snímků očního pozadí posuzovaných podle škály Early Treatment Diabetic Retinopathy Study (ETDRS) zjišťovala progresi retinopatie o 3 stupně nebo více celkem u 1024 pacientů s diabetem 2. typu. Z hlediska progrese diabetické retinopatie nebyl pozorován žádný rozdíl při srovnání inzulinu glargin a NPH inzulinu.
ORIGIN (Outcome Reduction with Initial Glargine INtervention) byla multicentrická randomizovaná studie s 2x2 faktoriálním uspořádáním, která zahrnovala 12537 účastníků s vysokým kardiovaskulárním (CV) rizikem se zvýšenou hladinou glukózy nalačno (IFG) nebo s poruchou glukózové tolerance (IGT) (12 % účastníků) nebo s diabetem mellitem typu 2 léčeným < 1 perorálním antidiabetikem (88 % účastníků). Účastnící byli randomizováni (1:1) buď do skupiny léčené inzulinem glargin (n=6264) titrovaným do dosažení FPG < 95 mg/dl (5,3 mmol/L) nebo do skupiny se standardní léčbou (n=6273).
Prvním primárním složeným cílovým parametrem účinnosti byla doba do prvního výskytu úmrtí z kardiovaskulárních příčin, nefatálního infarktu myokardu (IM) nebo nefatální cévní mozkové příhody; druhým primárním složeným cílovým parametrem účinnosti byla doba do prvního výskytu některého z nežádoucích účinků v prvním složeném cílovém parametru nebo doba do prvního revaskularizačního výkonu (věnčité tepny, karotidy nebo periferní cévy) nebo hospitalizace z důvodu srdečního selhání.
Sekundární cílové parametry zahrnovaly úmrtí z jakékoli příčiny a kombinované mikrovaskulární komplikace.
Při srovnání se standardní péčí se u inzulínu glargin nezměnilo relativní riziko CV onemocnění a CV mortalita. Ve dvou složených primárních cílových parametrech nebyly zjištěny žádné rozdíly mezi inzulínem glargin a standardní léčbou, v jakékoli dílčí složce zahrnující primární cíle; v úmrtí z jakékoli příčiny nebo pro kombinované mikrovaskulární komplikace.
Průměrná dávka inzulinu glargin na konci studie byla 0,42 U/kg. Ve výchozím bodě studie měli účastníci medián hodnoty HbA1c 6,4 %. Medián hodnoty HbA1c se během léčby pohyboval v rozmezí 5,9-6,4 % ve skupině s inzulinem glargin a 6,2 až 6,6 % ve skupině se standardní léčbou během následné doby sledování. Výskyt závažné hypoglykémie (počet postižených osob na 100 osob léčených po dobu 1 roku) byl 1,05 ve skupině s inzulinem glargin a 0,30 ve skupině se standardní léčbou, zatímco výskyt potvrzené nezávažné hypoglykémie byl 7,71 ve skupině s inzulinem glargin a 2,44 ve skupině se standardní léčbou. Během 6 let trvání této studie nebyl u 42 % účastníků ve skupině s inzulinem glargin zaznamenán žádný výskyt hypoglykemie.
Při poslední návštěvě lékaře v rámci studie bylo zjištěno průměrné zvýšení tělesné hmotnosti o 1,4 kg ve skupině s inzulinem glargin a průměrný pokles o 0,8 kg ve skupině se standardní léčbou.
Pediatrická populace
V randomizované kontrolované klinické studii byli pediatričtí pacienti (ve věku od 6 do 15 let) s diabetem typu 1 (n=349) léčeni 28 týdnů v režimu bazál-bolus, kde byl normální lidský inzulin užíván před každým jídlem. Inzulin glargin byl podáván jednou denně před ulehnutím a lidský NPH inzulin byl podáván jednou nebo dvakrát denně. U obou léčebných skupin byly pozorovány podobné účinky na glykovaný hemoglobin a incidenci symptomatické hypoglykémie, nicméně plazmatická hladina glukózy měřená nalačno se v porovnání s výchozí hodnotou více snížila ve skupině s inzulinem glargin, než ve skupině s NPH inzulinem. Kromě toho byla hypoglykémie ve skupině s inzulinem glargin méně závažná. Sto čtyřicet tři pacientů léčených v této studii inzulinem glargin pokračovalo v léčbě inzulinem glargin v nekontrolované prodloužené fázi studie s průměrnou dobou sledování 2 roky. Během tohoto období prodloužené léčby insulinem glargin nebyly pozorovány žádné nové bezpečnostní signály.
Byla provedena také zkřížená studie srovnávající inzulin glargin plus inzulin lispro oproti NPH inzulinu plus normální lidský inzulin (každá léčba byla podávána po dobu 16 týdnů randomizovaně), která zahrnovala 26 dospívajících s diabetem typu 1 ve věku 12 až 18 let. Stejně jako v pediatrické studii zmíněné výše bylo snížení plazmatické hladiny glukózy nalačno v porovnání s výchozí hodnotou větší ve skupině s inzulinem glargin než ve skupině s NPH. Změny HbA1c od výchozí hodnoty byly u obou léčebných skupin podobné, nicméně hodnoty glukózy v krvi zaznamenané v noci byly signifikantně vyšší ve skupině s inzulinem glargin/inzulinem lispro, než ve skupině s NPH/normálním lidským inzulinem, s průměrnou nejnižší dosaženou hodnotou 5,4 mM oproti 4,1 mM. Tomu odpovídají i incidence noční hypoglykémie, která byla 32 % ve skupině s inzulinem glargin/lispro a 52 % ve skupině s NPH/normálním lidským inzulinem.
Byla provedena 24týdenní klinická studie s paralelními skupinami, která zahrnovala 125 dětí s diabetem mellitem 1. typu ve věku 2 až 6 let. Studie porovnávala podávání inzulinu glargin jednou denně ráno a podávání NPH inzulinu jednou nebo dvakrát denně jako bazální inzulin. Obě skupiny dostávaly bolus inzulinu před jídlem. Primární cíl studie, tj. demonstrovat non-inferioritu inzulinu glargin vůči NPH podle výskytu všech hypoglykemických příhod nebyl dosažen, a u inzulinu glargin se prokázala tendence ke zvýšení počtu hypoglykemických příhod [poměr frekvence u inzulinu glargin vs. NPH (95% CI) = 1,18 (0,97-1,44)]. Hodnoty glykovaného hemoglobinu a variabilita glykémie byly srovnatelné v obou léčebných skupinách. V rámci této klinické studie nebyly zaznamenány žádné nové bezpečnostní signály.
5.2 Farmakokinetické vlastnosti
Absorpce
Koncentrace inzulinu v séru zdravých jedinců i diabetiků naznačují pomalejší a prolongovanější absorpci po subkutánní injekci inzulinu glargin a ukazují absenci vrcholového píku u inzulinu glargin v porovnání k lidskému inzulinu NPH. Koncentrace tedy byly ve shodě s časovým profilem farmakodynamického účinku inzulinu glargin. Obrázek 1 nahoře ukazuje profil účinek/čas u inzulinu glargin a inzulinu NPH.
Při podávání inzulínu glargin jednou denně dojde k ustálení hladiny za 2-4 dny po první dávce. Biotransformace
Po podkožní injekci diabetickým pacientům je inzulin glargin rychle metabolizován na karboxylovém konci beta řetězce, přičemž vznikají dva aktivní metabolity M1 (21A-Gly-inzulin) a M2 (21A-Gly-des-30B-Thr-inzulin). Převládajícím metabolitem v plazmě je M1. Expozice M1 se zvyšuje s podanou dávkou inzulinu glargin.
Zjištěné farmakokinetické a farmakodynamické údaje svědčí o tom, že účinek podkožní injekce inzulinu glargin vychází především z expozice M1. Inzulin glargin a metabolit M2 nebyly u velké většiny subjektů zjistitelné, a v případech, kdy se daly stanovit, jejich koncentrace nezávisela na podané dávce inzulinu glargin.
Eliminace
Při intravenózním podání byly poločasy eliminace inzulinu glargin a lidského inzulinu srovnatelné.
Zvláštní populace
V klinických studiích nenaznačují podskupinové analýzy založené na věku a pohlaví žádný rozdíl v bezpečnosti a účinnosti u pacientů léčených inzulinem glargin v porovnání k celé studované populaci.
Pediatrická populace
V klinické studii byla hodnocena farmakokinetika u dětí ve věku od 2 do 6 let s diabetem mellitem 1. typu (viz bod 5.1). Měřením nejnižších plazmatických hladin inzulinu glargin a jeho hlavních metabolitů M1 a M2 u dětí léčených inzulinem glargin bylo zjištěno, že plazmatické koncentrace jsou podobné jako u dospělých a nepotvrdily se žádné důkazy akumulace inzulinu glargin ani jeho metabolitů při dlouhodobém podávání.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu, reprodukční a vývojové toxicity neodhalily žádné zvláštní riziko pro člověka
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
oxid zinečnatý
metakresol
glycerol
kyselina chlorovodíková (k úpravě pH) hydroxid sodný (k úpravě pH) voda na injekci.
6.2 Inkompatibility
Tento léčivý přípravek se nesmí mísit s jinými léčivými přípravky.
6.3 Doba použitelnosti
2 roky.
Doba použitelnosti po prvním použití
Léčivý přípravek může být uchováván až 28 dnů při teplotě do 30°C a mimo přímé teplo nebo světlo. Používaná pera nesmí být uchovávána v chladničce.
Kryt pera musí být po každé injekci nasazen zpět na pero, aby byla zásobní vložka chráněna před světlem.
6.4 Zvláštní opatření pro uchovávání Neotevřené zásobní vložky Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem.
Neukládejte přípravek ABASAGLAR do blízkosti mrazicího boxu nebo mrazicí vložky.
Uchovávejte zásobní vložky v krabičce, aby byl přípravek chráněn před světlem.
Používané zásobní vložky
Podmínky uchovávání po prvním otevření tohoto léčivého přípravku jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
3 ml roztoku v zásobní vložce (bezbarvé sklo třídy 1) s pístem (chlorobutylová pryž) a diskovitou zátkou (vrstvenou z polyisoprenové a bromobutylové pryže) a s hliníkovým odtrhovacím uzávěrem.
Balení obsahuje 1, 2, 5 a 10 zásobních vložek a multipak obsahuje 10 (2 balení po 5) zásobních vložek. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
ABASAGLAR se nesmí míchat s žádným jiným inzulinem nebo léčivým přípravkem ani ředit. Mísení nebo ředění může změnit jeho profil čas/účinek a mísení může zapříčinit precipitaci.
Inzulínové pero
Zásobní vložky ABASAGLAR mohou být použity pouze do per k opakovanému použití, která jsou doporučena pro inzulinové zásobní vložky firmy Lilly (viz bod 4.4)
Pero je třeba používat podle doporučení v informaci, kterou poskytuje výrobce.
Je nutné pečlivě dodržovat pokyny výrobce týkající se vkládání zásobní vložky, upevnění jehly a podání injekce inzulínu uvedené v návodu pro použití pera
Dojde-li k poškození nebo k špatnému fungování pera (z důvodů mechanického poškození), musí být pero zlikvidováno a je třeba začít používat pero nové.
Pokud pero selže (viz Návod k použití pera), roztok může být natažen ze zásobní vložky do stříkačky (vhodné pro inzulin 100 jednotek/ml) a injikován.
Je nutné zajistit, aby injekční stříkačka neobsahovala stopy jiných látek.
Zásobní vložka
Prohlédněte zásobní vložku předtím, než ji použijete. Smí se použít pouze, pokud je roztok čirý, bezbarvý, bez viditelných pevných částic a má-li konsistenci vody. Vzhledem k tomu, že ABASAGLAR je roztok, není
třeba jej před použitím protřepat. Před injekcí musí být ze zásobní vložky odstraněny vzduchové bubliny (viz Návod k použití pera).
Aby se zabránilo možnému přenosu nemoci, musí být každé pero používáno pouze jedním pacientem.
Prázdné zásobní vložky nesmí znovu plněny a musí být zlikvidovány odpovídajícím způsobem. Před každým podáním injekce musí být vždy zkontrolován štítek inzulinu, aby nedošlo k záměně inzulinu glargin a jiných inzulinů (viz bod 4.4).
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Regional Operations GmbH., Kolblgasse 8-10, 1030, Vídeň, Rakousko.
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/14/944/001
EU/1/14/944/002
EU/1/14/944/003
EU/1/14/944/004
EU/1/14/944/009
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 9. září 2014
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
ABASAGLAR 100 jednotek/ml injekční roztok v předplněném peru
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml obsahuje insulinum glarginum* 100 jednotek (odpovídá 3,64 mg).
Jedno předplněné pero obsahuje3 ml injekčního roztoku, což odpovídá 300 jednotkám. *Insulin glargin je vyráběn rekombinantní DNA technologií bakterií Escherichia coli. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok. KwikPen. (Injekce).
Čirý bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Léčba diabetes mellitus u dospělých, dospívajících a dětí ve věku od 2 let.
4.2 Dávkování a způsob podání
Dávkování
ABASAGLAR obsahuje inzulin glargin, inzulinový analog s prodlouženým trváním účinku.
Přípravek ABASAGLAR se má podávat jednou denně, v kteroukoliv denní dobu, ale každý den vždy ve stejnou dobu.
Dávkovací režim přípravku ABASAGLAR (dávka a doba podání) by měl být upraven individuálně. U pacientů s diabetes mellitus 2. typu se ABASAGLAR může podávat společně s perorálními antidiabetiky.
Síla tohoto přípravku se uvádí v jednotkách. Tyto jednotky se vztahují výhradně k insulinu glargin a liší se od IU nebo jednotek používaných k vyjádření síly jiných inzulinových analogů (viz bod 5.1).
Zvláštní populace
Starší populace (> 65 let)
U starších pacientů může postupné zhoršování funkce ledvin vést k ustálenému poklesu potřeby inzulinu. Porucha funkce ledvin
U pacientů s poruchou funkce ledvin se může potřeba inzulinu zmenšit kvůli sníženému metabolismu inzulinu.
Porucha funkce jater
U pacientů s poruchou funkce jater se může potřeba inzulínu zmenšit kvůli snížené kapacitě glukoneogeneze a sníženému metabolismu inzulínu.
Pediatrická populace
Bezpečnost a účinnost inzulinu glargin byla stanovena u dospívajících a dětí ve věku 2 roky a starších.
Údaje, které jsou v současné době dostupné, jsou uvedeny v bodech 4.8, 5.1 a 5.2.
Bezpečnost a účinnost inzulinu glargin u dětí ve věku pod 2 roky nebyla stanovena. Nej sou k dispozici žádné údaje.
Přechod z jiných inzulinů na přípravek ABASAGLAR
Při přechodu pacienta z léčebného režimu se středně nebo dlouhodobě účinkujícím inzulinem na režim s přípravkem ABASAGLAR, je nutno počítat se změnou předchozího dávkování bazálního inzulinu a úpravou doprovodné antidiabetické léčby (dávka a doba podání doplňkových pravidelných inzulinů nebo inzulinových analogů s rychlým nástupem účinku nebo dávka perorálních antidiabetik).
Pacienti, kteří přecházejí z režimu s dvakrát denně podávaným NPH inzulinem (bazální inzulin) na režim s jedenkrát denně podávaným přípravkem ABASAGLAR, by měli snížit svou denní dávku bazálního inzulinu o 20-30 % během prvních týdnů léčby, aby se snížilo riziko noční a časné ranní hypoglykémie.
Během prvních týdnů léčby by mělo být toto snížení dávky alespoň částečně kompenzováno zvýšením dávky inzulinu podávaného před jídlem, po této periodě by měl být režim individuálně upraven.
U pacientů, kteří používají vysoké dávky inzulinu z důvodu přítomnosti protilátek proti lidskému inzulinu, může stejně jako při používání ostatních inzulinových analogů dojít i při používání přípravku ABASAGLAR ke zlepšení inzulinové odpovědi.
Během přechodu a v počátečních týdnech terapie se doporučuje pečlivé metabolické sledování.
Zlepšení metabolické kontroly a výsledná zvýšená citlivost k inzulinu si může vyžádat další úpravu dávkovacího režimu. Úprava dávky může být nutná také například, když se změní tělesná hmotnost pacienta nebo jeho životní styl, pokud dojde ke změně času podání dávky inzulinu nebo nastanou-li další okolnosti, zvyšující sklon k hypoglykémii nebo hyperglykémii (viz bod 4.4).
Způsob podání
ABASAGLAR se podává subkutánní injekcí.
ABASAGLAR se nesmí podávat intravenózně. Prodloužený účinek inzulinu glargin závisí na injekční aplikaci do podkožní tkáně. Intravenózní podání obvyklé subkutánní dávky by mohlo vést k těžké hypoglykémii.
Nej sou klinicky významné rozdíly v sérových hladinách inzulinu nebo glukózy po podání inzulinu glargin do břišní stěny, do deltového svalu nebo do stehna. V rámci vybrané oblasti aplikace je nutno s každou injekcí střídat místo vpichu.
ABASAGLAR se nesmí míchat s žádnými jinými inzuliny ani ředit. Mísení nebo ředění může měnit jeho profil čas/účinek; míchání může způsobit vysrážení.
Další podrobnosti k použití viz bod 6.6.
Před použitím přípravku ABASAGLAR KwikPen je třeba pozorně přečíst návod k použití, který je součástí příbalové informace (viz bod 6.6)
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
ABASAGLAR není inzulínem volby k léčbě diabetické ketoacidózy. Místo něj se v takových případech doporučuje běžný inzulín podávaný intravenózně.
V případě nedostatečné úpravy glykémie nebo sklonu k hyperglykemickým nebo hypoglykemickým epizodám je nezbytné zrevidovat předtím, než se zváží úprava dávky, zda pacient dodržuje předepsaný léčebný režim, místa pro aplikaci a vlastní techniku vpichu a ostatní relevantní faktory.
Převod pacienta na jiný typ nebo značku inzulinu musí proběhnout pod přísným lékařským dohledem. Po změně síly, značky (výrobce), typu (normální lidský inzulin, NPH, lente, dlouhodobě působící inzuliny atd.), původu (zvířecí, lidský, analoga lidského inzulinu) a/nebo výrobní metody může být zapotřebí upravit dávku.
Podání inzulinu může způsobit tvorbu protilátek proti inzulinu. Ve vzácných případech může přítomnost takových protilátek proti inzulinu vyžadovat úpravu dávky, aby byl korigován sklon k hyper- nebo hypoglykémii (viz bod 4.8).
Hypoglykémie
Doba výskytu hypoglykémie závisí na profilu účinku užívaných inzulinů a může se proto měnit při změně léčebného režimu. Vzhledem k déle trvajícím dodávkám bazálního inzulinu při užívání inzulinu glargin je možno očekávat menší výskyt nočních hypoglykémií, ale více hypoglykémií časně ráno.
Zvláštní opatrnost a intenzívní monitorování hladiny glukózy v krvi se doporučuje u těch pacientů, u kterých mohou být hypoglykemické epizody zvláště klinicky významné: u pacientů s významnými stenózami koronárních arterií nebo krevních cév zásobujících mozek (riziko kardiálních nebo cerebrálních komplikací hypoglykémie), stejně jako u pacientů s proliferativní retinopatií, zvláště není-li léčena fotokoagulací (riziko přechodné amaurózy vyvolané hypoglykémií).
Pacienti by měli být obeznámeni s okolnostmi, za kterých jsou varovné příznaky hypoglykémie oslabeny. Varovné symptomy hypoglykémie mohou být změněny, být méně výrazné nebo mohou zcela chybět u některých rizikových skupin. K nim patří pacienti:
- u kterých byla glykemická kontrola význačně zlepšena,
- u kterých se hypoglykémie vyvíjí postupně,
- starší pacienti,
- po převedení ze zvířecího inzulinu na lidský inzulin,
- u kterých je přítomna autonomní neuropatie,
- s dlouhou anamnézou diabetu,
- trpící psychiatrickým onemocněním,
- současně léčení některými dalšími léčivými přípravky (viz bod 4.5).
Takové situace mohou vést k těžké hypoglykémii (a možné ztrátě vědomí), dříve než si pacient hypoglykémii stihne uvědomit.
Prodloužený účinek inzulinu glargin podaného subkutánně může zpomalit dobu zotavení z hypoglykémie.
Pokud jsou zaznamenány normální nebo snížené hladiny glykovaného hemoglobinu, je nutno vzít v úvahu možnost rekurentních, nerozpoznaných (zejména nočních) epizod hypoglykémie.
Nezbytnými předpoklady pro snížení rizika hypoglykémie jsou dodržování dávky a dietního režimu pacientem, správné podávání inzulinu a schopnost pacienta rozpoznat příznaky hypoglykémie. Faktory zvyšující sklon k hypoglykémii vyžadují zvlášť pečlivé sledování a mohou si vynutit úpravu dávky.
Patří mezi ně:
- změna oblasti aplikace,
- zlepšení citlivosti k inzulinu (např. odstraněním stresových faktorů),
- nezvyklá, zvýšená nebo prodloužená fyzická aktivita,
- přidružené nemoci (např. zvracení, průjem),
- neadekvátní příjem potravy,
- vynechání jídla,
- konzumace alkoholu,
- některé nekompenzované poruchy endokrinního systému (např. u hypotyreózy a u nedostatečnosti adenohypofýzy nebo adrenokortikální nedostatečnosti),
- současná léčba některými jinými léčivými přípravky.
Interkurentní nemoci
Přidružené nemoci vyžadují intenzívní metabolický monitoring. V mnoha případech jsou indikovány testy na ketolátky v moči a často je nutná úprava dávky inzulinu. Potřeba inzulinu je často zvýšená. Pacienti s diabetem typu 1 musí pokračovat v pravidelném příjmu alespoň malého množství sacharidů dokonce i tehdy, když jsou schopni jíst pouze málo nebo nejí vůbec, nebo zvrací atd., a nesmějí nikdy vynechat inzulin úplně.
Chyby v medikaci
Byly hlášeny chyby v léčbě, kdy byly omylem podány jiné, zejména krátkodobě působící, inzuliny namísto inzulinu glargin. Před každým podáním injekce musí být vždy zkontrolován štítek inzulinu, aby nedošlo k záměně přípravku ABASAGLAR a jiných inzulinů.
Kombinace přípravku ABASAGLAR s pioglitazonem
Zejména u pacientů s rizikovými faktory pro vznik srdečního selhání byly při podávání pioglitazonu v kombinaci s inzulinem hlášeny případy srdečního selhání. To je třeba mít na paměti, pokud je zvažována léčba přípravkem ABASAGLAR v kombinaci s pioglitazonem. Jestliže je tato kombinace použita, je třeba pacienty sledovat, zda se u nich neobjevují známky a příznaky srdečního selhání, zvýšení tělesné hmotnosti a edém. Dojde-li k jakémukoli zhoršení srdečních příznaků, je zapotřebí léčbu pioglitazonem ukončit.
Pomocné látky
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) v jedné dávce, tj. „zanedbatelné množství sodíku“.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Rada látek ovlivňuje metabolismus glukózy a může vyžadovat úpravu dávky inzulinu glargin.
Mezi látky, které mohou zvýšit hypoglykemizující účinek a zvýšit náchylnost k hypoglykémii, patří perorální antidiabetika, inhibitory angiotenzin konvertujícího enzymu (ACE), disopyramid, fibráty, fluoxetin, inhibitory monoaminooxidázy (MAO), pentoxifylin, propoxyfen, salicyláty, analoga somatostatinu a sulfonamidová antibiotika.
Mezi látky, které mohou snižovat hypoglykemizující účinek, patří kortikosteroidy, danazol, diazoxid, diuretika, glukagon, isoniazid, estrogeny a progestogeny, deriváty fenothiazinu, somatropin, sympatomimetika (např. epinefrin [adrenalin], salbutamol, terbutalin), thyreoidní hormony, atypické antipsychotické léčivé přípravky (např. klozapin a olanzapin) a inhibitory proteáz.
Betablokátory, klonidin, soli lithia nebo alkohol mohou zesílit nebo zeslabit hypoglykemizující účinek inzulinu. Pentamidin může vyvolat hypoglykémii, po které může někdy následovat hyperglykémie.
Navíc vlivem sympatolytických léčivých přípravků, jako jsou betablokátory, klonidin, guanethidin a reserpin, mohou být známky adrenergní kontraregulace sníženy nebo mohou zcela chybět.
4.6 Fertilita, těhotenství a kojení
Nejsou k dispozici klinické údaje z kontrolovaných klinických studií o podávání inzulínu glargin během těhotenství. Velké množství údajů u těhotných žen (údaje od více než 1000 těhotenství) nenaznačuje žádné specifické nežádoucí účinky inzulinu glargin na těhotenství ani žádnou specifickou malformační či fetální/neonatální toxicitu inzulinu glargin.
Údaje získané u zvířat neodhalily reprodukční toxicitu.
V případě klinické potřeby je možné zvážit použití přípravku ABASAGLAR během těhotenství.
U pacientek s preexistujícím diabetem nebo s těhotenským diabetem je nutné během těhotenství udržovat dobrou metabolickou kontrolu, aby se předešlo nepříznivým důsledkům v souvislosti s hyperglykémií. Potřeba inzulinu může klesat během prvního trimestru a obecně se zvyšuje během druhého a třetího trimestru. Okamžitě po porodu potřeba inzulinu rapidně poklesne (zvýšené riziko hypoglykémie). Pečlivý monitoring glukózy je nutný.
Kojení
Není známo, zda je inzulin glargin vylučován do mateřského mléka. Vzhledem k tomu, že jako peptid je inzulin glargin štěpen v lidském gastrointestinálním traktu na aminokyseliny, nepředpokládá se po požití inzulinu glargin žádný metabolický účinek na kojeného novorozence/kojené dítě.
Kojící ženy mohou vyžadovat úpravu dávky inzulinu a diety.
Fertilita
Studie na zvířatech neodhalily přímé škodlivé účinky týkající se fertility.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Schopnost koncentrace a reakce pacienta může být zhoršena následkem hypoglykémie, hyperglykémie nebo např. následkem poruchy zraku. To může představovat riziko v situacích, kde jsou tyto schopnosti zvláště důležité (např. při řízení vozidla nebo obsluze strojů).
Pacient by měl být obeznámen s opatřeními zabraňujícími vzniku hypoglykémie během řízení. To je důležité zejména u těch, kteří mají sníženou nebo chybějící vnímavost k varovným příznakům hypoglykémie nebo mají časté epizody hypoglykémie. Je třeba zvážit, zda řízení nebo obsluha strojů jsou za těchto okolností vhodné.
4.9 Nežádoucí účinky
Souhrn bezpečnostního profilu
Hypoglykémie, obecně nejčastější nežádoucí účinek inzulinové terapie, se může objevit, jestliže je dávka inzulinu vzhledem k jeho potřebě příliš vysoká.
Tabulkový přehled nežádoucích účinků
V klinických studiích byly zaznamenány následující související nežádoucí účinky, které jsou seřazeny podle tříd orgánových systémů a podle klesající incidence (velmi časté: >1/10; časté: >1/100 až <1/10; méně časté: >1/1 000 až <1/100; vzácné >1/10 000 až <1/1 000; velmi vzácné: <1/10 000).
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
|
Systém orgánových tříd MedDRA |
Velmi časté |
Časté |
Méně časté |
Vzácné |
Velmi vzácné |
|
Poruchy imunitního systému | |||||
|
Alergické reakce |
X | ||||
|
Poruchy metabolismu a výživy | |||||
|
Hypoglykémie |
X | ||||
|
Poruchy nervového systému | |||||
|
Dysgeuzie |
X | ||||
|
Poruchy oka | |||||
|
Zhoršení zraku |
X | ||||
|
Retinopatie |
X | ||||
|
Poruchy kůže a podkožní tkáně | |||||
|
Lipohypertrofie |
X | ||||
|
Lipoatrofie |
X | ||||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | |||||
|
Myalgie |
X | ||||
|
Celkové poruchy a reakce v místě aplikace | |||||
|
Reakce v místě vpichu |
X | ||||
|
Edém |
X | ||||
Popis vybraných nežádoucích účinků
Poruchy metabolismu a výživy
Těžké hypoglykemické ataky, zvláště pokud jsou rekurentního typu, mohou vést k neurologickému poškození. Dlouhotrvající nebo těžké hypoglykemické epizody mohou být život ohrožující. U mnoha pacientů předcházejí známky adrenergní kontraregulace známkám a příznakům neuroglykopenie. Obecně platí, že čím větší a rychlejší je pokles glukózy v krvi, tím výraznější je jev kontraregulace a jeho symptomy.
Poruchy imunitního systému
Reakce z přecitlivělosti okamžitého typu na inzulin jsou vzácné. Takové reakce na inzulin (včetně inzulinu glargin) nebo na pomocnou látku mohou být doprovázeny například generalizovanými kožními reakcemi, angioedémem, bronchospasmem, hypotenzí a šokem a mohou být život ohrožující.
Podávání inzulinu může vyvolat vznik protilátek proti němu. V klinických studiích byly protilátky, které zkříženě reagují s lidským inzulinem a s inzulinem glargin, pozorovány se stejnou četností jak u skupiny léčené inzulinem NPH tak u skupiny léčené inzulinem glargin. Ve vzácných případech si může přítomnost protilátek proti inzulinu vynutit úpravu dávky inzulinu za účelem korekce sklonu k hyper- nebo hypoglykémii.
Poruchy oka
Výrazná změna v glykémii může být příčinou přechodného zhoršení zraku, způsobeného přechodnou změnou napětí a indexu lomu čoček.
Dlouhodobé zlepšení glykemické kontroly snižuje riziko progrese diabetické retinopatie. Avšak intenzívní inzulinová terapie s prudkým zlepšením glykemické kontroly může být spojena s přechodným zhoršením diabetické retinopatie. U pacientů s proliferativní retinopatií, zvláště pokud nebyla léčena laserem, mohou těžké hypoglykemické epizody vyvolat přechodnou amaurózu.
Poruchy kůže a podkožní tkáně
Tak jako při každé inzulínové terapii, může se v místě vpichu vyvinout lipodystrofie vedoucí ke zpomalení lokální absorpce inzulínu. Plynulé střídání místa vpichu v oblasti aplikace může pomoci omezit tyto reakce nebo jim předejít.
Celkové poruchy a reakce v místě aplikace
Takové reakce zahrnují zčervenání, bolest, svědění, vyrážku, otok nebo zánět. Většina mírných reakcí na inzulín v místě vpichu obvykle odezní během několika dnů nebo několika týdnů.
Vzácně může být inzulin příčinou retence sodíku a vzniku otoků, zvláště je-li předchozí špatná metabolická kontrola zlepšena intenzívní inzulinovou terapií.
Pediatrická populace
Všeobecně je bezpečnostní profil u dětí a dospívajících (<18 let) podobný bezpečnostnímu profilu u dospělých. Zprávy o nežádoucích účincích, získané z pozorování po uvedení přípravku na trh, zahrnovaly relativně častější reakce v místě vpichu (bolest v místě vpichu, reakce v místě vpichu) a kožní reakce (vyrážka, kopřivka) u dětí a dospívajících (<18 let) než u dospělých. Nejsou dostupné žádné údaje o bezpečnosti z klinických studií u dětí mladších než 2 roky.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
Příznaky
Předávkování inzulinu může vést k těžké a někdy dlouhodobé a život ohrožující hypoglykémii.
Léčba
Mírné hypoglykemické epizody mohou být obvykle zvládnuty perorálním podáním sacharidů. Může být potřeba upravit dávku, dietní režim nebo fyzickou aktivitu.
Závažnější epizody spojené s kómatem, křečemi nebo neurologickou poruchou mohou být léčeny intramuskulárně/subkutánně podaným glukagonem nebo intravenózně podanou koncentrovanou glukózou. Dlouhodobé podávání sacharidů a sledování stavu je nezbytné, protože hypoglykémie se může po zjevném klinickém zlepšení opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Léčiva k terapii diabetu, inzuliny a analogy dlouze působící, k injekční aplikaci, ATC kód: A10A E04.
ABASAGLAR je tzv. podobným biologickým léčivým přípravkem („biosimilar“). Podrobné informace jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
Mechanismus účinku
Inzulin glargin je analog lidského inzulínu cíleně připravený tak, aby měl malou rozpustnost při neutrálním pH. Je úplně rozpustný při kyselém pH (pH 4) injekčního roztoku ABASAGLAR. Po aplikaci injekce do podkožní tkáně je kyselý roztok neutralizován, což vede ke vzniku mikroprecipitátů, ze kterých jsou plynule uvolňována malá množství inzulinu glargin, zajišťující hladký a předvídatelný profil koncentrace/čas bez vrcholového píku s prodlouženým trváním účinku.
Inzulin glargin je metabolizován na 2 aktivní metabolity, M1 a M2 (viz bod 5.2).
Vazba na inzulínový receptor
Podle studií in vitro je afinita inzulinu glargin a jeho metabolitů M1 a M2 k lidskému receptoru pro inzulin podobná, jako afinita humánního inzulinu.
Vazba na receptor pro IGF-1: Afinita inzulinu glargin k lidskému receptoru pro IGF-1 je přibližně 5krát až 8krát vyšší, než afinita humánního inzulinu (ale zhruba 70krát až 80krát nižší než afinita IGF-1), zatímco M1 a M2 metabolity se váží na receptor pro IGF-1 s o něco menší afinitou v porovnání s humánním inzulinem.
Celková terapeutická koncentrace inzulinu (inzulinu glargin a jeho metabolitů) zjištěná u pacientů s diabetem typu 1, byla výrazně nižší, než koncentrace potřebná pro obsazení poloviny maximálního počtu IGF-1 receptorů a následnou aktivaci mitogenně-proliferativní cesty spouštěné IGF-1 receptorem. Fyziologické koncentrace endogenního IGF-1 mohou aktivovat mitogenně-proliferativní cestu, nicméně terapeutické koncentrace při léčbě inzulinem, včetně léčby přípravkem ABASAGLAR, jsou značně nižší, než farmakologické koncentrace potřebné k aktivaci IGF-1 cesty.
Farmakodynamické účinky
Primárním účinkem inzulinu, včetně inzulinu glargin, je regulace metabolismu glukózy. Inzulin a jeho analoga snižují hladinu glukózy v krvi stimulací periferního vychytávání glukózy, zvláště kosterními svaly a tukem, a inhibicí glukoneogeneze v játrech. Inzulin inhibuje lipolýzu v tukových buňkách, inhibuje proteolýzu a podporuje syntézu proteinů.
V klinicko-farmakologických studiích se ukázalo, že při intravenózním podání jsou inzulin glargin a lidský inzulin ekvipotetntní, jsou-li podány ve stejných dávkách. Stejně jako u všech inzulinů průběh účinku inzulinu glargin může být ovlivněn fyzickou aktivitou a dalšími proměnnými faktory.
Ve studiích u zdravých dobrovolníků nebo u pacientů s diabetes mellitus 1. typu byl pomocí metody euglykemického clampu nástup účinku subkutánně podaného inzulinu glargin pomalejší než nástup účinku lidského inzulinu NPH. U inzulinu glargin byl profil účinku plynulý, bez vrcholu, a s prodlouženým trváním účinku.
Následující graf ukazuje výsledky ze studie u pacientů:
Obr. 1: Profil účinku u diabetiků 1. typu
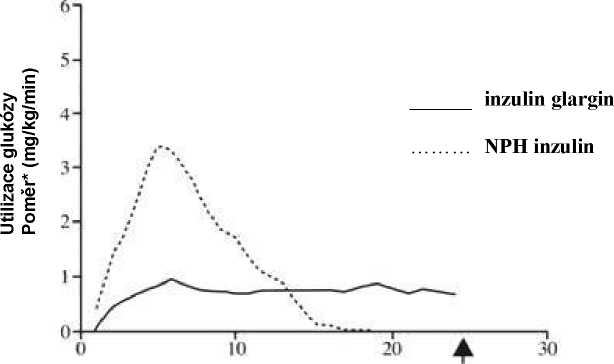
Čas (h) po s.c. podání
Ukončení doby pozorování
*Stanoveno jako množství glukózy podané infuzí k udržení konstantních hladin glukózy v plazmě (průměrné hodinové hodnoty)
Prodloužený účinek subkutánního inzulinu glargin je v přímém vztahu k jeho pomalejší absorpci a umožňuje podávání jednou denně. Doba trvání účinku inzulinu a inzulinových analogů jako je inzulin glargin může u různých jedinců nebo u téhož jedince značně kolísat.
V klinické studii byly příznaky hypoglykémie nebo kontraregulačních hormonálních odpovědí po intravenózně podaném inzulinu glargin a po intravenózně podaném lidském inzulinu podobné jak u zdravých dobrovolníků, tak u diabetiků 1. typu.
Klinická účinnost a bezpečnost
Účinky inzulinu glargin (jedenkrát denně) na rozvoj diabetické retinopatie byly hodnoceny v otevřené 5leté klinické studii kontrolované NPH (NPH dvakrát denně), která na základě snímků očního pozadí posuzovaných podle škály Early Treatment Diabetic Retinopathy Study (ETDRS) zjišťovala progresi retinopatie o 3 stupně nebo více celkem u 1024 pacientů s diabetem 2. typu. Z hlediska progrese diabetické retinopatie nebyl pozorován žádný rozdíl při srovnání inzulinu glargin a NPH inzulinu.
ORIGIN (Outcome Reduction with Initial Glargine INtervention) byla multicentrická randomizovaná studie s 2x2 faktoriálním uspořádáním, která zahrnovala 12537 účastníků s vysokým kardiovaskulárním (CV) rizikem se zvýšenou hladinou glukózy nalačno (IFG) nebo s poruchou glukózové tolerance (IGT) (12 % účastníků) nebo s diabetem mellitem typu 2 léčeným < 1 perorálním antidiabetikem (88 % účastníků). Účastnící byli randomizováni (1:1) buď do skupiny léčené inzulinem glargin (n=6264) titrovaným do dosažení FPG < 95 mg/dl (5,3 mmol/L) nebo do skupiny se standardní léčbou (n=6273).
Prvním primárním složeným cílovým parametrem účinnosti byla doba do prvního výskytu úmrtí z kardiovaskulárních příčin, nefatálního infarktu myokardu (IM) nebo nefatální cévní mozkové příhody; druhým primárním složeným cílovým parametrem účinnosti byla doba do prvního výskytu některého z nežádoucích účinků v prvním složeném cílovém parametru nebo doba do prvního revaskularizačního výkonu (věnčité tepny, karotidy nebo periferní cévy) nebo hospitalizace z důvodu srdečního selhání.
Sekundární cílové parametry zahrnovaly úmrtí z jakékoli příčiny a kombinované mikrovaskulární komplikace.
Při srovnání se standardní péčí se u inzulínu glargin nezměnilo relativní riziko CV onemocnění a CV mortalita. Ve dvou složených primárních cílových parametrech nebyly zjištěny žádné rozdíly mezi inzulínem glargin a standardní léčbou, v jakékoli dílčí složce zahrnující primární cíle; v úmrtí z jakékoli příčiny nebo pro kombinované mikrovaskulámí komplikace.
Průměrná dávka inzulinu glargin na konci studie byla 0,42 U/kg. Ve výchozím bodě studie měli účastníci medián hodnoty HbA1c 6,4 %. Medián hodnoty HbA1c se během léčby pohyboval v rozmezí 5,9-6,4 % ve skupině s inzulinem glargin a 6,2 až 6,6 % ve skupině se standardní léčbou během následné doby sledování. Výskyt závažné hypoglykémie (počet postižených osob na 100 osob léčených po dobu 1 roku) byl 1,05 ve skupině s inzulinem glargin a 0,30 ve skupině se standardní léčbou, zatímco výskyt potvrzené nezávažné hypoglykémie byl 7,71 ve skupině s inzulinem glargin a 2,44 ve skupině se standardní léčbou. Během 6 let trvání této studie nebyl u 42 % účastníků ve skupině s inzulinem glargin zaznamenán žádný výskyt hypoglykemie.
Při poslední návštěvě lékaře v rámci studie bylo zjištěno průměrné zvýšení tělesné hmotnosti o 1,4 kg ve skupině s inzulinem glargin a průměrný pokles o 0,8 kg ve skupině se standardní léčbou.
Pediatrická populace
V randomizované kontrolované klinické studii byli pediatričtí pacienti (ve věku od 6 do 15 let) s diabetem typu 1 (n=349) léčeni 28 týdnů v režimu bazál-bolus, kde byl normální lidský inzulin užíván před každým jídlem. Inzulin glargin byl podáván jednou denně před ulehnutím a lidský NPH inzulin byl podáván jednou nebo dvakrát denně. U obou léčebných skupin byly pozorovány podobné účinky na glykovaný hemoglobin a incidenci symptomatické hypoglykémie, nicméně plazmatická hladina glukózy měřená nalačno se v porovnání s výchozí hodnotou více snížila ve skupině s inzulinem glargin, než ve skupině s NPH inzulinem. Kromě toho byla hypoglykémie ve skupině s inzulinem glargin méně závažná. Sto čtyřicet tři pacientů léčených v této studii inzulinem glargin pokračovalo v léčbě inzulinem glargin v nekontrolované prodloužené fázi studie s průměrnou dobou sledování 2 roky. Během tohoto období prodloužené léčby insulinem glargin nebyly pozorovány žádné nové bezpečnostní signály.
Byla provedena také zkřížená studie srovnávající inzulin glargin plus inzulin lispro oproti NPH inzulinu plus normální lidský inzulin (každá léčba byla podávána po dobu 16 týdnů randomizovaně), která zahrnovala 26 dospívajících s diabetem typu 1 ve věku 12 až 18 let. Stejně jako v pediatrické studii zmíněné výše bylo snížení plazmatické hladiny glukózy nalačno v porovnání s výchozí hodnotou větší ve skupině s inzulinem glargin než ve skupině s NPH. Změny HbA1c od výchozí hodnoty byly u obou léčebných skupin podobné, nicméně hodnoty glukózy v krvi zaznamenané v noci byly signifikantně vyšší ve skupině s inzulinem glargin/inzulinem lispro, než ve skupině s NPH/normálním lidským inzulinem, s průměrnou nejnižší dosaženou hodnotou 5,4 mM oproti 4,1 mM. Tomu odpovídají i incidence noční hypoglykémie, která byla 32 % ve skupině s inzulinem glargin/lispro a 52 % ve skupině s NPH/normálním lidským inzulinem.
Byla provedena 24týdenní klinická studie s paralelními skupinami, která zahrnovala 125 dětí s diabetem mellitem 1. typu ve věku 2 až 6 let. Studie porovnávala podávání inzulinu glargin jednou denně ráno a podávání NPH inzulinu jednou nebo dvakrát denně jako bazální inzulin. Obě skupiny dostávaly bolus inzulinu před jídlem. Primární cíl studie, tj. demonstrovat non-inferioritu inzulinu glargin vůči NPH podle výskytu všech hypoglykemických příhod nebyl dosažen, a u inzulinu glargin se prokázala tendence ke zvýšení počtu hypoglykemických příhod [poměr frekvence u inzulinu glargin vs. NPH (95% CI) = 1,18 (0,97-1,44)]. Hodnoty glykovaného hemoglobinu a variabilita glykémie byly srovnatelné v obou léčebných skupinách. V rámci této klinické studie nebyly zaznamenány žádné nové bezpečnostní signály.
5.2 Farmakokinetické vlastnosti
Absorpce
Koncentrace inzulinu v séru zdravých jedinců i diabetiků naznačují pomalejší a prolongovanější absorpci po subkutánní injekci inzulinu glargin a ukazují absenci vrcholového píku u inzulinu glargin v porovnání k lidskému inzulinu NPH. Koncentrace tedy byly ve shodě s časovým profilem farmakodynamického účinku inzulinu glargin. Obrázek 1 nahoře ukazuje profil účinek/čas u inzulinu glargin a inzulinu NPH.
Při podávání inzulínu glargin jednou denně dojde k ustálení hladiny za 2-4 dny po první dávce. Biotransformace
Po podkožní injekci diabetickým pacientům je inzulin glargin rychle metabolizován na karboxylovém konci beta řetězce, přičemž vznikají dva aktivní metabolity M1 (21A-Gly-inzulin) a M2 (21A-Gly-des-30B-Thr-inzulin). Převládajícím metabolitem v plazmě je M1. Expozice M1 se zvyšuje s podanou dávkou inzulinu glargin.
Zjištěné farmakokinetické a farmakodynamické údaje svědčí o tom, že účinek podkožní injekce inzulinu glargin vychází především z expozice M1. Inzulin glargin a metabolit M2 nebyly u velké většiny subjektů zjistitelné, a v případech, kdy se daly stanovit, jejich koncentrace nezávisela na podané dávce inzulinu glargin.
Eliminace
Při intravenózním podání byly poločasy eliminace inzulinu glargin a lidského inzulinu srovnatelné.
Zvláštní populace
V klinických studiích nenaznačují podskupinové analýzy založené na věku a pohlaví žádný rozdíl v bezpečnosti a účinnosti u pacientů léčených inzulinem glargin v porovnání k celé studované populaci.
Pediatrická populace
V klinické studii byla hodnocena farmakokinetika u dětí ve věku od 2 do 6 let s diabetem mellitem 1. typu (viz bod 5.1). Měřením nejnižších plazmatických hladin inzulinu glargin a jeho hlavních metabolitů M1 a M2 u dětí léčených inzulinem glargin bylo zjištěno, že plazmatické koncentrace jsou podobné jako u dospělých a nepotvrdily se žádné důkazy akumulace inzulinu glargin ani jeho metabolitů při dlouhodobém podávání.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu, reprodukční a vývojové toxicity neodhalily žádné zvláštní riziko pro člověka
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
oxid zinečnatý
metakresol
glycerol
kyselina chlorovodíková (k úpravě pH) hydroxid sodný (k úpravě pH) voda na injekci.
6.2 Inkompatibility
Tento léčivý přípravek se nesmí mísit s jinými léčivými přípravky.
6.3 Doba použitelnosti
2 roky.
Doba použitelnosti po prvním použití
Léčivý přípravek může být uchováván až 28 dnů při teplotě do 30°C a mimo přímé teplo nebo světlo. Používaná pera nesmí být uchovávána v chladničce.
Kryt pera musí být po každé injekci nasazen zpět na pero, aby byla zásobní vložka chráněna před světlem.
6.4 Zvláštní opatření pro uchovávání Nepoužívaná pera
Uchovávejte v chladničce (2°C - 8°C).
Chraňte před mrazem.
Neukládejte přípravek ABASAGLAR do blízkosti mrazicího boxu nebo mrazicí vložky.
Uchovávejte předplněné pero v krabičce, aby byl přípravek chráněn před světlem.
Používaná pera
Podmínky uchovávání po prvním otevření tohoto léčivého přípravku jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
3 ml roztoku v zásobní vložce (bezbarvé sklo třídy 1) s pístem (chlorobutylová pryž) a diskovitou zátkou (vrstvenou z polyisoprenové a bromobutylové pryže) a s hliníkovým odtrhovacím uzávěrem.
Zásobní vložka je uzavřena v injekčním peru k jednorázovému použití.
Balení obsahuje 1, 2 a 5 per a multipak obsahuje 10 (2 balení po 5) per. Na trhu nemusí být všechny velikosti balení.
Jehly nejsou součástí balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
ABASAGLAR se nesmí míchat s žádným jiným inzulinem nebo léčivým přípravkem ani ředit. Mísení nebo ředění může změnit jeho profil čas/účinek a mísení může zapříčinit precipitaci.
ABASAGLAR KwikPen
Prohlédněte zásobní vložku předtím, než ji použijete. Smí se použít pouze, pokud je roztok čirý, bezbarvý, bez viditelných pevných částic a má-li konsistenci vody. Vzhledem k tomu, že ABASAGLAR je roztok, není třeba jej před použitím protřepat.
ABASAGLAR se nesmí míchat s žádnými jinými inzuliny ani ředit. Mísení nebo ředění může měnit jeho profil čas/účinek; míchání může způsobit vysrážení.
Prázdná pera nesmí být znovu použita a musí být zlikvidována odpovídajícím způsobem.
Aby se zabránilo možnému přenosu nemoci, musí být každé pero používáno pouze jedním pacientem.
Před každým podáním injekce musí být vždy zkontrolován štítek inzulinu, aby nedošlo k záměně inzulinu glargin a jiných inzulinů (viz bod 4.4).
Zacházení s perem
Pacientovi je třeba doporučit, aby si před použitím přípravku ABASAGLAR KwikPen pozorně přečetl návod k použití, který je součástí příbalové informace.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly Regional Operations GmbH., Kolblgasse 8-10, 1030, Vídeň, Rakousko.
8. REGISTRAČNÍ ČÍSLO(A)
EU/1/14/944/005
EU/1/14/944/006
EU/1/14/944/007
EU/1/14/944/008
EU/1/14/944/010
EU/1/14/944/011
EU/1/14/944/012
EU/1/14/944/013
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 9. záři 2014
10. DATUM REVIZE TEXTU
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu.
A. VÝROBCE/VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY /BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
A. VÝROBCE/VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY /BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobců biologické léčivé látky
Lilly del Caribe, Inc.
12.3 km 65th Infantry Road Carolina, PR 00985 Portoriko
Eli Lilly and Company Indianapolis Indiana 46285 USA
Název a adresa výrobce odpovědného za propouštění šarží
ABASAGLAR 100 jednotek/ml, injekční roztok v zásobní vložce a předplněném peru
Lilly France S.A.S.
2, rue du Colonel Lilly F-67640 Fegersheim Francie
ABASAGLAR 100 jednotek/ml, injekční roztok v zásobní vložce
Eli Lilly Italia S.p.A.,
Via Gramsci 731-733,
50019 Sesto Fiorentino, (FI)
Itálie
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE • Pravidelně aktualizované zprávy o bezpečnosti
Držitel rozhodnutí o registraci předkládá pravidelně aktualizované zprávy o bezpečnosti pro tento léčivý přípravek v souladu s požadavky uvedenými v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a zveřejněném na evropském webovém portálu pro léčivé přípravky.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
Pokud se shodují data předložení aktualizované zprávy o bezpečnosti (PSUR) a aktualizovaného RMP, je možné je předložit současně.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA - Zásobní vložky. Balení po 1,2, 5 a po 10
L NÁZEV LÉČIVÉHO PŘÍPRAVKU
ABASAGLAR 100 jednotek/ml injekční roztok v zásobní vložce Insulinům glarginum
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
Jeden ml obsahuje insulinům glarginum 100 jednotek (to odpovídá 3,64 mg).
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: oxid zinečnatý, metakresol, glycerol, kyselina chlorovodíková a hydroxid sodný (k úpravě pH), voda na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok
1 zásobní vložka s 3 ml
2 zásobní vložky s 3 ml
5 zásobních vložek s 3 ml 10 zásobních vložek s 3 ml
5 ZPŮSOB A CESTY PODÁNÍ
Tyto zásobní vložky jsou pro použití pouze v 3ml perech. Před použitím si přečtěte příbalovou informaci. Subkutánní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
Zlikvidujte 28 dnů po prvním použití.
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Neotevřené zásobní vložky:
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte v krabičce, aby byl přípravek chráněn před světlem.
Již používaná zásobní vložka:
Uchovávejte při teplotě do 30°C.
Neuchovávejte v chladničce, chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli LillyRegional Operations GmbH., Kolblgasse 8-10,
1030, Vídeň,
Rakousko.
12 REGISTRAČNÍ ČÍSLO
EU/1/14/944/001 1 zásobní vložka
EU/1/14/944/002 2 zásobní vložky
EU/1/14/944/003 5 zásobních vložek
EU/1/14/944/009 10 zásobních vložek
13 ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
ABASAGLAR
VNITŘNÍ KRABIČKA (bez blue boxu) součást multipaku - Zásobní vložky
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
ABASAGLAR 100 jednotek/ml injekční roztok v zásobní vložce Insulinům glarginum
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
Jeden ml obsahuje insulinům glarginum 100 jednotek (to odpovídá 3,64 mg).
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: oxid zinečnatý, metakresol, glycerol, kyselina chlorovodíková a hydroxid sodný (k úpravě pH), voda na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok
Multipak: 5 zásobních vložek o obsahu 3 ml. Součást multipaku, nesmí se prodávat samostatně.
5. ZPŮSOB A CESTY PODÁNÍ
Tyto zásobní vložky jsou pro použití pouze v 3ml perech. Před použitím si přečtěte příbalovou informaci. Subkutánní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
Neotevřené zásobní vložky:
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte v krabičce, aby byl přípravek chráněn před světlem.
Již používaná zásobní vložka:
Uchovávejte při teplotě do 30°C.
Neuchovávejte v chladničce a chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli LillyRegional Operations GmbH., Kolblgasse 8-10,
1030, Vídeň,
Rakousko.
12. REGISTRAČNÍ ČÍSLO
EU/1/14/944/004
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16 INFORMACE V BRAILLOVĚ PÍSMU
ABASAGLAR
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (s blue boxem) multipak - Zásobní vložky
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
ABASAGLAR 100 jednotek/ml injekční roztok v zásobní vložce Insulinům glarginum
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
Jeden ml obsahuje insulinům glarginum 100 jednotek (to odpovídá 3,64 mg).
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: oxid zinečnatý, metakresol, glycerol, kyselina chlorovodíková a hydroxid sodný (k úpravě pH), voda na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok
Multipak: 10 (2 balení po 5) zásobních vložek o obsahu 3 ml.
5. ZPŮSOB A CESTY PODÁNÍ
Tyto zásobní vložky jsou pro použití pouze v 3ml perech. Před použitím si přečtěte příbalovou informaci. Subkutánní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
Neotevřené zásobní vložky:
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte v krabičce, aby byl přípravek chráněn před světlem.
Již používaná zásobní vložka:
Uchovávejte při teplotě do 30°C.
Neuchovávejte v chladničce, chraňte před mrazem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli LillyRegional Operations GmbH., Kolblgasse 8-10,
1030, Vídeň,
Rakousko.
12. REGISTRAČNÍ ČÍSLO
EU/1/14/944/004
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16 INFORMACE V BRAILLOVĚ PÍSMU
ABASAGLAR
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA KwikPen. Balení po 1,2 a po 5
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
ABASAGLAR 100 jednotek/ml injekční roztok v předplněném peru Insulinům glarginum
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
Jeden ml obsahuje insulinům glarginum 100 jednotek (to odpovídá 3,64 mg).
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: oxid zinečnatý, metakresol, glycerol, kyselina chlorovodíková a hydroxid sodný (k úpravě pH), voda na injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Injekční roztok. KwikPen
1 pero s 3 ml
2 pera s 3 ml 5 per s 3 ml
5. ZPŮSOB A CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Subkutánní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
NOVĚ LZE NASTAVIT DÁVKU AŽ 80 jednotek
8. POUŽITELNOST
Zlikvidujte 28 dnů po prvním použití.
9 ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Nepoužívaná pera:
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte v krabičce, aby byl přípravek chráněn před světlem.
Již používané pero:
Uchovávejte při teplotě do 30°C.
Neuchovávejte v chladničce, chraňte před mrazem.
Po použití pera vraťte na pero kryt, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LECIVYCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli LillyRegional Operations GmbH., Kolblgasse 8-10,
1030, Vídeň,
Rakousko.
12. REGISTRAČNÍ ČÍSLO
|
EU/1/14/944/005 |
1 pero |
|
EU/1/14/944/006 |
2 pera |
|
EU/1/14/944/007 |
5 per |
|
EU/1/14/944/010 |
1 pero |
|
EU/1/14/944/011 |
2 pera |
|
EU/1/14/944/012 |
5 per |
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
ABASAGLAR
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
VNITŘNÍ KRABIČKA (bez blue boxu) součást multipaku - KwikPen
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
ABASAGLAR 100 jednotek /ml injekční roztok v předplněném peru Insulinům glarginum
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
Jeden ml obsahuje insulinům glarginum 100 jednotek (to odpovídá 3,64 mg).
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: oxid zinečnatý, metakresol, glycerol, kyselina chlorovodíková a hydroxid sodný (k úpravě pH), voda na injekci
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok. KwikPen
Multipak: 5 per o obsahu 3 ml. Součást multipaku, nesmí se prodávat samostatně.
5. ZPŮSOB A CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Subkutánní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
NOVĚ LZE NASTAVIT DÁVKU AŽ 80 jednotek
8 POUŽITELNOST
EXP
Nepoužívaná pera:
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte v krabičce, aby byl přípravek chráněn před světlem.
Již používané pero:
Uchovávejte při teplotě do 30°C.
Neuchovávejte v chladničce a chraňte před mrazem.
Po použití pera vraťte na pero kryt, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11 NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli LillyRegional Operations GmbH., Kolblgasse 8-10,
1030, Vídeň,
Rakousko.
12. REGISTRAČNÍ ČÍSLO
EU/1/14/944/008
EU/1/14/944/013
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
ABASAGLAR
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (s blue boxem) multipak - KwikPen
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU
ABASAGLAR 100 jednotek/ml injekční roztok v předplněném peru Insulinům glarginum
2 OBSAH LÉČIVÉ LÁTKY/LÁTEK
Jeden ml obsahuje insulinům glarginum 100 jednotek (to odpovídá 3,64 mg).
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: oxid zinečnatý, metakresol, glycerol, kyselina chlorovodíková a hydroxid sodný (k úpravě pH), voda na injekci
4. LÉKOVÁ FORMA A OBSAH
Injekční roztok. KwikPen
Multipak: 10 (2 balení po 5) per o obsahu 3 ml.
5. ZPŮSOB A CESTY PODÁNÍ
Před použitím si přečtěte příbalovou informaci. Subkutánní podání.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ZE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
NOVĚ LZE NASTAVIT DÁVKU AŽ 80 jednotek
8. POUŽITELNOST
EXP
Nepoužívaná pera:
Uchovávejte v chladničce.
Chraňte před mrazem.
Uchovávejte v krabičce, aby byl přípravek chráněn před světlem.
Již používané pero:
Uchovávejte při teplotě do 30°C.
Neuchovávejte v chladničce, chraňte před mrazem.
Po použití pera vraťte na pero kryt, aby byl přípravek chráněn před světlem.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKU NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
11 NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Eli LillyRegional Operations GmbH., Kolblgasse 8-10,
1030, Vídeň,
Rakousko.
12. REGISTRAČNÍ ČÍSLO
EU/1/14/944/008 EU/1/14/944/0013
13. ČÍSLO ŠARŽE
Č.š.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVE PÍSMU
ABASAGLAR
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
ABASAGLAR 100 j./ml, injekční roztok Insulinům glarginum SC podání
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4 ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
3 ml
6. JINÉ
1 NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
ABASAGLAR 100 j./ml injekční roztok KwikPen
Insulinům glarginum SC podání
2 ZPŮSOB PODÁNÍ
3 POUŽITELNOST
EXP
4. ČÍSLO SARZE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
3 ml
6. JINÉ
B. PŘÍBALOVÁ INFORMACE
ABASAGLAR 100 jednotek/ml injekční roztok v zásobní vložce
Insulinům glarginum
VTento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje. Návod k použití inzulinového pera je přiložen k Vašemu inzulinovému peru. Přečtěte si jej před použitím tohoto přípravku.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je ABASAGLAR a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek ABASAGLAR používat
3. Jak se ABASAGLAR používá
4. Možné nežádoucí účinky
5. Jak přípravek ABASAGLAR uchovávat
6. Obsah balení a další informace
1. Co je ABASAGLAR a k čemu se používá
ABASAGLAR je injekční roztok obsahující inzulin glargin. Inzulin glargin je pozměněný inzulin, velmi podobný lidskému inzulinu.
ABASAGLAR se používá k léčbě diabetu mellitu (cukrovky) u dospělých, dospívajících a dětí ve věku od 2 let.
Diabetes mellitus je onemocnění, při kterém organismus neprodukuje dostatek inzulinu ke kontrole hladiny cukru v krvi. Inzulin glargin má dlouhodobý a rovnoměrný účinek na snížení hladiny cukru v krvi.
2. Čemu musíte věnovat pozornost, než začnete přípravek ABASAGLAR používat Nepoužívejte přípravek ABASAGLAR
Jestliže jste alergický(á) na inzulin glargin nebo na kteroukoliv další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před použitím přípravku ABASAGLAR se poraďte se svým lékařem, lékárníkem nebo zdravotní sestrou. Dodržujte pečlivě pokyny pro dávkování, sledování (testy krve a moči), dietu a fyzickou aktivitu (fyzickou práci a cvičení), které jste projednali se svým lékařem.
Pokud máte příliš nízkou hladinu cukru v krvi (hypoglykémii), řiďte se pokyny pro hypoglykémii (viz
Cestování
Před cestou proberte se svým lékařem všechno, co souvisí s Vaší léčbou:
- dostupnost inzulínu v zemi, kterou navštívíte,
- dostatečné zásoby inzulinu, stříkaček atd.,
- správné uchovávání inzulinu během cesty,
- časový rozvrh jídel a podávání inzulinu během cesty,
- možné účinky změn různých časových pásem,
- možnost nových zdravotních rizik v zemích, které navštívíte,
- jak se zachovat v mimořádných situacích, tj. pokud se Vám udělá špatně nebo onemocníte.
Nemoci a zranění
V následujících situacích může léčba diabetu vyžadovat zvýšenou péči (například úpravu dávky inzulinu, testy z krve a z moči):
- při nemoci nebo větším zranění, kdy se může zvýšit hladina cukru v krvi (hyperglykémie).
- pokud dostatečně nejíte, může se hladina cukru v krvi velmi snížit (hypoglykémie). Ve většině případů budete potřebovat lékařskou péči. Zajistěte možnost rychlého kontaktu lékaře.
Pokud máte diabetes mellitus 1. typu (inzulin dependentní diabetes mellitus), nepřerušujte používání inzulinu a pokračujte v dostatečném přísunu sacharidů. Vždy řekněte lidem, kteří Vás ošetřují nebo léčí, že potřebujete inzulin.
U některých pacientů, kteří dlouhodobě trpěli cukrovkou typu 2 a onemocněním srdce, nebo prodělali cévní mozkovou příhodu, a kteří byli léčeni pioglitazonem a inzulinem, byl zaznamenán výskyt srdečního selhání. Jestliže zjistíte známky srdečního selhání jako je neobvyklá dušnost nebo náhlé zvýšení tělesné hmotnosti nebo lokalizovaný otok (edém), informujte co nejrychleji svého lékaře.
Další léčivé přípravky a ABASAGLAR
Některé léky způsobují změnu hladiny cukru v krvi (snížení nebo zvýšení nebo obojí v závislosti na situaci).
V každém případě může být nezbytné upravit Vaši dávku inzulinu, aby se zabránilo hladinám cukru v krvi, které jsou příliš nízké nebo příliš vysoké. Buďte opatrný(á), když začínáte nebo přestáváte užívat nějaký další lék.
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a), nebo které možná budete užívat. Zeptejte se svého lékaře předtím, než si lék vezmete, zda a jak jím může být ovlivněna hladina cukru v krvi, popř. co je třeba dělat.
Mezi léky, které mohou vyvolat pokles hladiny cukru v krvi (hypoglykémii), patří:
- všechny další léky k léčbě diabetu,
- inhibitory angiotenzin konvertujícího enzymu (ACE inhibitory) (používané k léčbě některých srdečních onemocnění, vysokého krevního tlaku),
- disopyramid (používaný k léčbě některých srdečních onemocnění),
- fluoxetin (používaný k léčbě depresí),
- fibráty (používané ke snížení vysokých hladin krevních lipidů),
- inhibitory monoaminooxidázy (MAO) (používané k léčbě depresí),
- pentoxifylin, propoxyfen, salicyláty (např. aspirin, používaný ke zmírnění bolesti a snížení horečky),
- analogy somatostatinů (např. oktreotid, užívaný k léčbě neobvyklých stavů, při kterých se tvoří nadměrné množství růstového hormonu)
- sulfonamidová antibiotika.
Mezi léky, které mohou vyvolat zvýšení hladiny cukru v krvi (hyperglykémii), patří:
- kortikosteroidy (např. „kortizon“ používaný k léčbě zánětu),
- danazol (lék pro navození ovulace),
- diazoxid (používaný k léčbě vysokého krevního tlaku),
- diuretika (používané k léčbě vysokého krevního tlaku nebo nadměrného zadržování tekutin),
- glukagon (hormon slinivky břišní používaný k léčbě závažné hypoglykémie),
- isoniazid (používaný k léčbě tuberkulózy),
- estrogeny a progestogeny (např. v antikoncepčních pilulkách užívaných k zamezení početí),
- deriváty fenothiazinu (používané k léčbě duševních poruch),
- somatropin (růstový hormon),
- sympatomimetika (např. epinefrin [adrenalin] nebo salbutamol, terbutalin používané k léčbě astmatu),
- hormony štítné žlázy (užívané k léčbě onemocnění štítné žlázy),
- atypické antipsychotické léky (např. klozapin a olanzapin),
- inhibitory proteáz (používané k léčbě HIV).
Hladina cukru v krvi může buď poklesnout, nebo vzrůst, pokud užíváte:
- betablokátory (používané k léčbě vysokého krevního tlaku),
- klonidin (používaný k léčbě vysokého krevního tlaku),
- soli lithia (používané k léčbě duševních poruch).
Pentamidin (používaný k léčbě některých infekcí způsobených parazity) může vyvolat hypoglykémii, po které může někdy následovat hyperglykémie.
Betablokátory stejně jako ostatní sympatolytika (např. klonidin, guanetidin a reserpin) mohou oslabit nebo úplně potlačit první varovné příznaky, které Vám mohou pomoci rozpoznat hypoglykemické reakce.
Pokud si nejste jist(a), zda neužíváte některý z takových léků, zeptejte se svého lékaře nebo lékárníka.
ABASAGLAR a alkohol
Hladiny cukru v krvi mohou buď vzrůst, nebo poklesnout, pokud konzumujete alkohol.
Těhotenství a kojení
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
Informujte svého lékaře, pokud plánujete těhotenství nebo pokud již jste těhotná. Je možné, že bude třeba změnit dávku inzulinu během těhotenství a po porodu. Zvláště pečlivá kontrola diabetu a prevence hypoglykémie jsou důležité pro zdraví Vašeho dítěte.
Pokud kojíte, poraďte se se svým lékařem, neboť může být nezbytné upravit Vám dávku inzulinu a Vaši dietu.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost soustředit se nebo reagovat může být snížena, jestliže:
- máte hypoglykémii (nízkou hladinu cukru v krvi)
- máte hyperglykémii (vysokou hladinu cukru v krvi)
- máte problémy se zrakem.
Myslete na tento možný problém ve všech situacích, kde byste mohl(a) dostat sebe nebo ostatní do nebezpečí (např. při řízení vozidla nebo při obsluze strojů). Měl(a) byste se poradit se svým lékařem o vhodnosti řízení vozidel, pokud:
- máte časté epizody hypoglykémie,
- jsou první varovné příznaky, které Vám pomohou rozpoznat hypoglykémii, omezené nebo chybějí. Důležité informace o některých složkách přípravku ABASAGLAR
Tento léčivý přípravek obsahuje méně než 1 mmol (23 mg) sodíku v jedné dávce, tj. v podstatě sodík neobsahuje.
Jak se ABASAGLAR používá
3.
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Dávkování
Na základě Vašeho životního stylu, výsledků testů cukru (glukózy) v krvi a Vašeho předchozího používání inzulínu lékař:
- určí, kolik přípravku ABASAGLAR denně budete potřebovat a v jakou dobu,
- řekne Vám, kdy kontrolovat hladinu cukru v krvi a zda potřebujete provádět testy moči,
- řekne Vám, kdy můžete potřebovat aplikovat vyšší nebo nižší dávku přípravku ABASAGLAR.
ABASAGLAR je dlouhodobě působící inzulin. Je možné, že Vám lékař řekne, abyste jej používal(a) v kombinaci s krátkodobě působícím inzulinem nebo s tabletami na snížení vysoké hladiny cukru v krvi.
Hladinu cukru v krvi může ovlivnit mnoho faktorů. Měl(a) byste znát tyto faktory, abyste byl(a) schopen(a) reagovat správně na změny hladiny cukru v krvi a předejít jejich přílišnému zvýšení nebo přílišnému snížení. Další informace si přečtěte v rámečku na konci této příbalové informace.
Použití u dětí a dospívajících
Přípravek ABASAGLAR mohou používat dospívající a děti ve věku 2 roky a starší. Nejsou žádné zkušenosti s podáváním přípravku ABASAGLAR dětem mladším 2 let.
Frekvence podávání
Potřebujete jednu injekci přípravku ABASAGLAR každý den, vždy ve stejnou denní dobu.
Způsob podání
Injekce přípravku ABASAGLAR se podává pod kůži. Přípravek ABASAGLAR NEPODÁVEJTE do žíly, protože by to změnilo jeho účinnost a mohlo by dojít k hypoglykémii.
Váš lékař Vám ukáže, do které oblasti kůže máte přípravek ABASAGLAR podávat. S každou injekcí měňte místo vpichu uvnitř vybrané oblasti kůže, kam injekci podáváte.
Jak se zachází se zásobními vložkami
Pro zajištění přesné dávky přípravku ABASAGLAR je možné používat zásobní vložky pouze s inzulinovými pery, doporučenými pro zásobní vložky firmy Lilly. Ne všechna tato pera musí být ve Vaší zemi na trhu.
Pero je třeba používat podle doporučení v informaci, kterou poskytuje výrobce.
Je nutné pečlivě dodržovat pokyny výrobce týkající se vkládání zásobní vložky, upevnění jehly a podání injekce inzulinu uvedené v návodu pro použití pera.
Aby se zabránilo možnému přenosu nemoci, musí být každé pero používáno pouze jedním určitým pacientem.
Zásobní vložku si prohlédněte ještě předtím, než ji použijete. Použijte pouze ty zásobní vložky, ve kterých je roztok čirý, bezbarvý, bez viditelných částic a který vypadá jako voda. Před použitím přípravek nemíchejte ani s ním netřepejte.
Vždy použijte novou zásobní vložku, pokud si všimnete, že se neočekávaně zhoršuje kontrola hladiny cukru v krvi. To je proto, že účinnost inzulinu se může do určité míry snižovat. Pokud si budete myslet, že máte problémy s přípravkem ABASAGLAR, nechte jej zkontrolovat svým lékařem nebo lékárníkem.
Zvláštní péče před aplikací injekce
Před injekcí odstraňte vzduchové bubliny (viz návod k používání pera).
Ujistěte se, že ani alkohol ani jiná dezinfekce nebo jiné látky nekontaminují inzulin.
Prázdné zásobní vložky znovu neplňte ani znovu nepoužívejte. Do zásobní vložky nepřidávejte žádný jiný inzulin. Nemíchejte přípravek ABASAGLAR s žádnými jinými inzuliny nebo s jinými léky. Neřeďte jej. Míchání s jinými léky nebo ředění může změnit účinek přípravku ABASAGLAR.
Problémy s inzulínovým perem?
Pročtěte si návod k použití pera, který poskytuje výrobce.
Je-li inzulínové pero poškozeno nebo nepracuje správně (z důvodu mechanické závady), musí se zlikvidovat a je nutné použít nové pero.
Pokud inzulinové pero nefunguje dobře, můžete natáhnout inzulin ze zásobní vložky do injekční stříkačky. Musíte mít proto trvale také injekční stříkačky i jehly v zásobě. Používejte však pouze injekční stříkačky určené pro inzulin o koncentraci 100 jednotek v mililitru.
Jestliže jste použil(a) více přípravku ABASAGLAR, než jste měl(a)
- Pokud jste podal(a) příliš mnoho přípravku ABASAGLAR, může se příliš snížit hladina Vašeho cukru v krvi (hypoglykémie). Často si kontrolujte hladinu cukru v krvi. Obecně platí, že pro prevenci hypoglykémie musíte jíst více jídla a sledovat hladinu cukru v krvi. Pro informace o léčbě hypoglykémie viz rámeček na konci této příbalové informace.
Jestliže jste zapomněl(a) použít ABASAGLAR
- Pokud j ste vynechal(a) dávku přípravku ABASAGLAR nebo j ste si neaplikoval(a) dostatečnou dávku, může se Vám příliš zvýšit hladina cukru v krvi (hyperglykémie). Často si kontrolujte hladinu cukru v krvi. Pro další informace o léčbě hyperglykémie viz rámeček na konci této příbalové informace.
- Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) používat přípravek ABASAGLAR
Ukončení užívání přípravku ABASAGLAR by mohlo vést k závažné hyperglykémii (velmi vysoká hladina cukru v krvi) a ketoacidóze (hromadění kyseliny v krvi, protože tělo rozkládá tuk místo cukru). Neukončujte léčbu přípravkem ABASAGLAR bez konzultace s lékařem, který Vám řekne, co byste měl(a) udělat.
Záměna inzulinů
Před každou injekcí musíte vždy zkontrolovat štítek na inzulinu, aby nedošlo k záměně léčivého přípravku ABASAGLAR za jiné inzuliny.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
Možné nežádoucí účinky
4.
Podobně jako všechny léky, může mít tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Hypoglykémie (nízká hladina cukru v krvi) může být velmi závažná. Jestliže Vám příliš klesne hladina cukru v krvi, mohl(a) byste ztratit vědomí. Těžká hypoglykémie může způsobit poškození mozku a může být život ohrožující. Pokud máte příznaky nízké hladiny cukru v krvi, okamžitě se snažte hladinu cukru v krvi zvýšit.
Pokud se u Vás vyskytnou následující příznaky, ihned kontaktujte svého lékaře: rozsáhlé kožní reakce (vyrážka a svědění po celém těle), závažný otok kůže nebo sliznic (angioedém), dušnost, pokles krevního tlaku se zrychleným tepem a pocení. Může se jednat o příznaky závažné alergické reakce na inzulin, která může být život ohrožující.
Velmi časté nežádoucí účinky (mohou postihnout více než 1 osobu z 10)
- Hypoglykémie
Jako při každé inzulinové léčbě je nejčastějším nežádoucím účinkem hypoglykémie.
Hypoglykémie (nízká hladina cukru v krvi) znamená, že nemáte dostatek cukru v krvi. Pro další informace o nežádoucích účincích nízké nebo vysoké hladiny krevního cukru viz rámeček na konci této příbalové informace.
Časté nežádoucí účinky (mohou postihnout nejvýše 1 osobu z 10)
- Změny kůže v místě aplikace injekce
Pokud podáváte inzulin příliš často do stejného místa na kůži, může se tuková tkáň pod kůží v tomto místě buď ztenčit (lipoatrofie), nebo zesílit (lipohypertrofie). Zesílení tukové tkáně se může objevit u 1 až 2 % pacientů, zatímco ztenčení se vyskytuje méně často. Inzulin podávaný do takto změněného místa nemusí správně působit. Takovým změnám na kůži lze zabránit střídáním místa vpichu při každé injekci.
- Kožní a alergické reakce
U 3 až 4 % pacientů se může objevit reakce v místě vpichu (např. zarudnutí, neobvykle intenzívní bolestivost injekce, svědění, vyrážka, otok nebo zánět). Tyto reakce se mohou také rozšířit kolem místa vpichu. Většina mírných reakcí na inzulin obvykle odezní během několika dnů až několika týdnů.
Vzácné nežádoucí účinky (mohou postihnout nejvýše 1 osobu z 1000)
Závažné alergické reakce na inzulin
Přidružené symptomy mohou zahrnovat rozsáhlé kožní reakce (vyrážka a svědění po celém těle), závažný otok kůže nebo sliznic (angioedém), dušnost, pokles krevního tlaku se zrychleným tepem a pocení. Může jít o příznaky závažné alergické reakce na inzulin, která může být život ohrožující.
Oční reakce
Význačné změny (zlepšení nebo zhoršení) v kontrole cukru v krvi mohou vyvolat přechodné změny vidění. Pokud máte proliferativní retinopatii (oční choroba související s diabetes mellitus), mohou těžké hypoglykemické ataky způsobit přechodnou ztrátu vidění.
Celkové poruchy
Ve vzácných případech může léčba inzulínem zapříčinit přechodné zadržování vody v těle s otoky lýtek a kotníků.
Velmi vzácné nežádoucí účinky (mohou postihnout nejvýše 1 osobu z 10 000)
Ve velmi vzácných případech se může vyskytnout dysgeuzie (porucha vnímání chuti) a myalgie (bolest svalů).
Ostatní nežádoucí účinky s neznámou frekvencí výskytu (z dostupných údajů nelze frekvenci určit)
Léčba inzulinem může zapříčinit, že si tělo vytváří proti inzulinu protilátky (látky, které působí proti inzulinu). Vzácně si to vynutí změnu dávky inzulinu.
Použití u dětí a dospívajících
Všeobecně jsou nežádoucí účinky u dětí a dospívajících ve věku 18 let nebo mladších podobné nežádoucím účinkům pozorovaným u dospělých.
Stížnosti na reakce v místě vpichu (bolest v místě vpichu, reakce v místě vpichu) a na kožní reakce (vyrážka, kopřivka) jsou relativně častěji hlášeny u dětí a dospívajících ve věku 18 let nebo mladších než u dospělých pacientů.
Nejsou dostupné žádné údaje o bezpečnosti z klinických studií u dětí mladších než 2 roky.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek ABASAGLAR uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti, uvedené na krabičce a na etiketě zásobní vložky za „EXP“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Neotevřené zásobní vložky
Uchovávejte v chladničce (2°C - 8°C). Chraňte před mrazem.
Neukládejte přípravek ABASAGLAR do blízkosti mrazicího boxu nebo mrazicí vložky.
Uchovávejte zásobní vložku v krabičce, aby byl přípravek chráněn před světlem.
Používané zásobní vložky
Zásobní vložky (v inzulinovém peru) nebo nošené jako náhradní můžete uchovávat po dobu maximálně 28 dnů při teplotě do 30°C a mimo přímé teplo nebo světlo. Používaná zásobní vložka se nesmí uchovávat v chladničce. Neužívejte ji po uplynutí této doby použitelnosti.
Nepoužívejte přípravek ABASAGLAR, jestliže v něm zaznamenáte viditelné částice. Přípravek ABASAGLAR smí být podán, pouze pokud je roztok čirý, bezbarvý a vypadá jako voda.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
Co ABASAGLAR obsahuje
- Léčivou látkou je insulinům glarginum. Jeden mililitr roztoku obsahuje 100 jednotek léčivé látky insulinům glarginum (to je 3,64 mg).
- Pomocnými látkami jsou: chlorid zinečnatý, metakresol, glycerol, hydroxid sodný (viz bod 2 „Důležité informace o některých složkách přípravku ABASAGLAR“), kyselina chlorovodíková, voda na injekci.
Jak ABASAGLAR vypadá a co obsahuje toto balení
ABASAGLAR 100 jednotek/ml injekční roztok v zásobní vložce je čirý a bezbarvý.
Přípravek ABASAGLAR je dodáván ve speciální zásobní vložce, která může být použita pouze do per, která jsou doporučena pro inzulinové vložky firmy Lilly. Jedna zásobní vložka obsahuje 3 ml injekčního roztoku (to je 300 jednotek) a dostupná jsou balení s 1, 2, 5 a 10 zásobními vložkami a multipak s 2x5 zásobními vložkami.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Eli Lilly Regional Operations GmbH., Kolblgasse 8-10, 1030, Vídeň, Rakousko.
Výrobce
Lilly France S.A.S., rue du Colonel Lilly, F-67640 Fegersheim, Francie.
Eli Lilly Italia S.p.A., Via Gramsci 731-733, 50019 Sesto Fiorentino, (FI) Itálie.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Lietuva
Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600
Luxembourg/Luxemburg
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Magyarország
Lilly Hungária Kft.
Tel: + 36 1 328 5100
Malta
Charles de Giorgio Ltd.
Tel: + 356 25600 500
Belgie/Belgique/Belgien
Eli Lilly Benelux S.A./N.V.
Tél/Tel: + 32-(0)2 548 84 84
Etarapnu
Tn "Eau Hunu HegepaaHg" E.B. - Etarapua Tea. +359 2 491 41 40
Česká republika ELI LILLY ČR, s.r.o.
Tel: + 420 234 664 111
Danmark
Eli Lilly Danmark A/S Tlf: +45 45 26 60 00
Boehringer Ingelheim Pharma GmbH & Co. KG Tel: +49 (0) 800 77 90 900
Eesti Norge
|
Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6 817 280 EkXába OAPMAIEPB-AIAAY A.E.B.E. Tr|k: +30 210 629 4600 |
Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 Osterreich Eli Lilly Ges.m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 Boehringer Ingelheim Espana S.A. Tel: +34 93 404 51 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France SAS Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Boehringer Ingelheim France S.A.S. Tél: +33 3 26 50 45 33 |
Boehringer Ingelheim, Lda. Tel: +351 21 313 53 00 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 Boehringer Ingelheim Ireland Ltd. Tel: +353 1 295 9620 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0)1 580 00 10 |
|
Ísland Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 Boehringer Ingelheim Italia S.p.A. Tel: +39 02 5355 1 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
|
Kónpog Phadisco Ltd Tnk: +357 22 715000 |
Sverige Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800 |
|
Latvija Eli Lilly Holdings Limited parstavnieciba Latvija Tel: +371 67364000 |
United Kingdom Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000 |
|
Boehringer Ingelheim Ltd. Tel: +44 1344 424 600 |
Tato příbalová informace byla naposledy revidována
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
HYPERGLYKÉMIE A HYPOGLYKÉMIE
Vždy u sebe mějte nějaký cukr (minimálně 20 gramů).
Noste u sebe nějakou informaci, která ukazuje, že jste diabetik.
HYPERGLYKÉMIE (vysoká hladina cukru v krvi)
Pokud je Vaše hladina cukru v krvi příliš vysoká (hyperglykémie), možná jste si aplikoval(a) málo inzulinu.
Proč vzniká hyperglykémie?
Příklady:
- nepodal(a) jste si injekci inzulinu nebo jste ho nepodal(a) dostatečné množství nebo se inzulin stal méně účinným, např. z důvodu nesprávného uchovávání,
- Vaše inzulinové pero nefunguje správně
- máte méně pohybu než obvykle, jste ve stresu (emocionální úzkost, rozrušení) nebo máte úraz, jste po operaci, máte infekci nebo horečku,
- užíváte nebo jste užíval(a) některé jiné léky (viz bod 2 „Další léčivé přípravky a ABASAGLAR“). Varovné příznaky hyperglykémie
Žízeň, zvýšené močení, únava, suchá pokožka, zčervenání obličeje, nechutenství, nízký krevní tlak, zrychlený tep a přítomnost glukózy a ketolátek v moči. Bolest břicha, rychlé a hluboké dýchání, ospalost nebo dokonce ztráta vědomí mohou být známkami vážného stavu (ketoacidózy) vyplývajícího z nedostatku inzulinu.
Co dělat v případě hyperglykémie?
Změřte si hladinu cukru v krvi a ketolátek v moči co nejdříve, jakmile se výše uvedené příznaky hyperglykémie objeví. Těžká hyperglykémie nebo ketoacidóza musí být vždy léčena lékařem, obvykle v nemocnici.
HYPOGLYKÉMIE (nízká hladina cukru v krvi)
Pokud je hladina cukru v krvi příliš nízká, můžete ztratit vědomí. Závažná hypoglykémie může vyvolat srdeční infarkt nebo poškození mozku a může být život ohrožující. Za normálních okolností byste měl(a) být schopen(na) rozpoznat přílišné snižování hladiny cukru v krvi, a proto můžete správně reagovat.
Proč vzniká hypoglykémie?
Příklady:
- aplikujete si příliš mnoho inzulinu,
- vynecháte nebo odložíte jídlo,
- nejíte dostatečně, nebo snědené jídlo obsahuje méně sacharidů (cukr a látky podobné cukru se nazývají sacharidy; umělá sladidla však NEJSOU sacharidy) než normálně,
- dochází u Vás ke ztrátě sacharidů zvracením nebo průjmem,
- pijete alkohol, a zvláště pokud nejíte dostatečně,
- cvičíte více než obvykle nebo vykonáváte jiný typ fyzické činnosti/pohybu,
- zotavujete se ze zranění, operace, nebo z jiných forem stresu,
- zotavujete se po nemoci nebo z horečky,
- užíváte nebo jste přestala užívat některé jiné léky (viz bod 2 „Další léčivé přípravky a ABASAGLAR“).
Výskyt hypoglykémie je také pravděpodobnější, pokud
- právě zahajujete léčbu inzulínem nebo přecházíte na jiný inzulínový přípravek (pokud se objeví hypoglykémie, když přecházíte z předchozího bazálního inzulinu na ABASAGLAR, je její výskyt pravděpodobnější ráno než v noci),
- j sou Vaše hladiny cukru v krvi téměř normální nebo j sou nestálé,
- změníte oblast kůže, kam podáváte injekci inzulinu (např. ze stehna do ramene),
- trpíte závažným onemocněním ledvin nebo jater, nebo některou jinou chorobou, jako je hypotyreóza (snížená funkce štítné žlázy).
Varovné příznaky hypoglykémie
- Ve Vašem těle
Příklady příznaků, které naznačují, že hladina cukru v krvi klesá příliš nízko nebo příliš rychle: pocení, vlhká pokožka, úzkost, zrychlený tep, vysoký krevní tlak, bušení srdce a nepravidelný srdeční rytmus. Často se tyto příznaky vyvinou dříve než příznaky spojené s nízkou hladinou cukru v mozku.
- Ve Vašem mozku
Příklady příznaků ukazujících nízkou hladinu cukru v mozku: bolest hlavy, intenzivní hlad, pocit na zvracení, zvracení, únava, ospalost, poruchy spánku, neklid, agresivní chování, pokles koncentrace, zhoršené reakce, deprese, zmatenost, poruchy řeči (někdy úplná ztráta řeči), poruchy vidění, třes, paralýza, pocity mravenčení (parestézie), brnění a pocity necitlivosti v oblasti úst, závrať, ztráta sebekontroly, neschopnost postarat se o sebe, křeče, ztráta vědomí.
První příznaky, které Vás varují před hypoglykémií („varovné příznaky“), mohou být pozměněny, mohou být slabší nebo mohou zcela chybět, pokud:
- jste starší; máte diabetes již dlouho nebo trpíte určitým typem nervového onemocnění (diabetická autonomní neuropatie),
- jste hypoglykémiiměl(a) nedávno (např. předchozí den) nebo se vyvíjí pomalu,
- máte téměř normální nebo alespoň hodně zlepšenou hladinu cukru v krvi,
- nedávno j ste byl(a) převeden(a) ze zvířecího inzulinu na lidský inzulin, j ako j e ABASAGLAR
- užíváte nebo jste užíval(a) některé jiné léky (viz bod 2 „Další léčivé přípravky a ABASAGLAR“).
V takových případech se u Vás může rozvinout těžká hypoglykémie (a dokonce mdloba), aniž byste si toho všiml(a) včas. Seznamte se co nejlépe se svými varovnými příznaky hypoglykémie. Je-li to nutné, častější měření cukru v krvi může pomoci odhalit mírné hypoglykemické epizody, které by jinak mohly být přehlédnuty. Pokud se nemůžete spolehnout na rozpoznání svých varovných příznaků, vyhněte se takovým situacím (např. řízení vozidla), při kterých by hypoglykémie pro Vás nebo pro ostatní představovala riziko.
Co dělat v případě hypoglykémie?
1. Nepodávejte inzulin. Okamžitě si vezměte asi 10 až 20 g cukru, např. glukózu, kostky cukru nebo cukrem oslazený nápoj. Upozornění: umělá sladidla a potraviny obsahující umělá sladidla místo cukru (např. dietní nápoje) při léčbě hypoglykémie nepomáhají.
2. Potom snězte něco s dlouhotrvajícím účinkem na nárůst cukru v krvi (např. chléb nebo těstoviny). Dbejte na to, abyste tyto záležitosti předem prohovořil(a) s lékařem nebo zdravotní sestrou.
Hypoglykémie může odeznívat déle, protože ABASAGLAR působí dlouhodobě.
3. Pokud se hypoglykémie znovu vrací, vezměte si dalších 10 až 20 g cukru.
4. Informujte okamžitě lékaře, jestliže hypoglykémii nebo její opakování nejste schopen(a) zvládnout. Oznamte příbuzným, přátelům a blízkým kolegům následující:
Pokud nemůžete polykat nebo upadnete do bezvědomí, budete potřebovat injekci glukózy nebo glukagonu (lék, který zvyšuje hladinu cukru v krvi). Tyto injekce jsou opodstatněné dokonce i tehdy, není-li jisté, že máte hypoglykémii.
Je vhodné změřit si hladinu cukru v krvi okamžitě po požití cukru, abyste zkontroloval(a), že máte skutečně hypoglykémii.
Příbalová informace: informace pro pacienta
ABASAGLAR 100 jednotek/ml injekční roztok v předplněném peru
Insulinům glarginum
VTento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně tuto příbalovou informaci včetně Návodu k použití předplněného pera ABASAGLAR KwikPen dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je ABASAGLAR a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek ABASAGLAR používat
3. Jak se ABASAGLAR používá
4. Možné nežádoucí účinky
5 Jak přípravek ABASAGLAR uchovávat
6. Obsah balení a další informace
1. Co je ABASAGLAR a k čemu se používá
ABASAGLAR je injekční roztok obsahující inzulin glargin. Inzulin glargin je pozměněný inzulin, velmi podobný lidskému inzulinu.
ABASAGLAR se používá k léčbě diabetu mellitu (cukrovky) u dospělých, dospívajících a dětí ve věku od 2 let.
Diabetes mellitus je onemocnění, při kterém organismus neprodukuje dostatek inzulinu ke kontrole hladiny cukru v krvi. Inzulin glargin má dlouhodobý a rovnoměrný účinek na snížení hladiny cukru v krvi.
2. Čemu musíte věnovat pozornost, než začnete přípravek ABASAGLAR používat Nepoužívejte přípravek ABASAGLAR
Jestliže jste alergický(á) na inzulin glargin nebo na kteroukoliv další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před použitím přípravku ABASAGLAR se poraďte se svým lékařem, lékárníkem nebo zdravotní sestrou. Dodržujte pečlivě pokyny pro dávkování, sledování (testy krve a moči), dietu a fyzickou aktivitu (fyzickou práci a cvičení), které jste projednali se svým lékařem.
Pokud máte příliš nízkou hladinu cukru v krvi (hypoglykémii), řiďte se pokyny pro hypoglykémii (viz rámeček na konci této příbalové informace).
Cestování
Před cestou proberte se svým lékařem všechno, co souvisí s Vaší léčbou:
- dostupnost inzulínu v zemi, kterou navštívíte,
- dostatečné zásoby inzulinu, stříkaček atd.,
- správné uchovávání inzulinu během cesty,
- časový rozvrh jídel a podávání inzulinu během cesty,
- možné účinky změn různých časových pásem,
- možnost nových zdravotních rizik v zemích, které navštívíte,
- jak se zachovat v mimořádných situacích, tj. pokud se Vám udělá špatně nebo onemocníte.
Nemoci a zranění
V následujících situacích může léčba diabetu vyžadovat zvýšenou péči (například úpravu dávky inzulinu, testy z krve a z moči):
- Při nemoci nebo větším zranění, kdy se může zvýšit hladina cukru v krvi (hyperglykémie).
- Pokud dostatečně nejíte, může se hladina cukru v krvi velmi snížit (hypoglykémie).
Ve většině případů budete potřebovat lékařskou péči. Zajistěte možnost rychlého kontaktu lékaře.
Pokud máte diabetes mellitus 1. typu (inzulin dependentní diabetes mellitus), nepřerušujte používání inzulinu a pokračujte v dostatečném přísunu sacharidů. Vždy řekněte lidem, kteří Vás ošetřují nebo léčí, že potřebujete inzulin.
U některých pacientů, kteří dlouhodobě trpěli cukrovkou typu 2 a onemocněním srdce, nebo prodělali cévní mozkovou příhodu, a kteří byli léčeni pioglitazonem a inzulinem, byl zaznamenán výskyt srdečního selhání. Jestliže zjistíte známky srdečního selhání jako je neobvyklá dušnost nebo náhlé zvýšení tělesné hmotnosti nebo lokalizovaný otok (edém), informujte co nejrychleji svého lékaře.
Další léčivé přípravky a ABASAGLAR
Některé léky způsobují změnu hladiny cukru v krvi (snížení nebo zvýšení nebo obojí v závislosti na situaci).
V každém případě může být nezbytné upravit Vaši dávku inzulinu, aby se zabránilo hladinám cukru v krvi, které jsou příliš nízké nebo příliš vysoké. Buďte opatrný(á), když začínáte nebo přestáváte užívat nějaký další lék.
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a), nebo které možná budete užívat. Zeptejte se svého lékaře předtím, než si lék vezmete, zda a jak jím může být ovlivněna hladina cukru v krvi, popř. co je třeba dělat.
Mezi léky, které mohou vyvolat pokles hladiny cukru v krvi (hypoglykémii), patří:
- všechny další léky k léčbě diabetu,
- inhibitory angiotenzin konvertujícího enzymu (ACE inhibitory) (používané k léčbě některých srdečních onemocnění, vysokého krevního tlaku),
- disopyramid (používaný k léčbě některých srdečních onemocnění),
- fluoxetin (používaný k léčbě depresí),
- fibráty (používané ke snížení vysokých hladin krevních lipidů),
- inhibitory monoaminooxidázy (MAO) (používané k léčbě depresí),
- pentoxifylin, propoxyfen, salicyláty (např. aspirin, používaný ke zmírnění bolesti a snížení horečky),
- analogy somatostatinů (např. oktreotid, užívaný k léčbě neobvyklých stavů, při kterých se tvoří nadměrné množství růstového hormonu)
- sulfonamidová antibiotika.
Mezi léky, které mohou vyvolat zvýšení hladiny cukru v krvi (hyperglykémii), patří:
- kortikosteroidy (např. „kortizon“ používaný k léčbě zánětu),
- danazol (lék pro navození ovulace),
- diazoxid (používaný k léčbě vysokého krevního tlaku),
- diuretika (používané k léčbě vysokého krevního tlaku nebo nadměrného zadržování tekutin),
- glukagon (hormon slinivky břišní používaný k léčbě závažné hypoglykémie),
- isoniazid (používaný k léčbě tuberkulózy),
- estrogeny a progestogeny (např. v antikoncepčních pilulkách užívaných k zamezení početí),
- deriváty fenothiazinu (používané k léčbě duševních poruch),
- somatropin (růstový hormon),
- sympatomimetika (např. epinefrin [adrenalin] nebo salbutamol, terbutalin používané k léčbě astmatu),
- hormony štítné žlázy (užívané k léčbě onemocnění štítné žlázy),
- atypické antipsychotické léky (např. klozapin a olanzapin),
- inhibitory proteáz (používané k léčbě HIV).
Hladina cukru v krvi může buď poklesnout, nebo vzrůst, pokud užíváte:
- betablokátory (používané k léčbě vysokého krevního tlaku),
- klonidin (používaný k léčbě vysokého krevního tlaku),
- soli lithia (používané k léčbě duševních poruch).
Pentamidin (používaný k léčbě některých infekcí způsobených parazity) může vyvolat hypoglykémii, po které může někdy následovat hyperglykémie.
Betablokátory stejně jako ostatní sympatolytika (např. klonidin, guanetidin a reserpin) mohou oslabit nebo úplně potlačit první varovné příznaky, které Vám mohou pomoci rozpoznat hypoglykemické reakce.
Pokud si nejste jist(a), zda neužíváte některý z takových léků, zeptejte se svého lékaře nebo lékárníka.
ABASAGLAR a alkohol
Hladiny cukru v krvi mohou buď vzrůst, nebo poklesnout, pokud konzumujete alkohol.
Těhotenství a kojení
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
Informujte svého lékaře, pokud plánujete těhotenství nebo pokud již jste těhotná. Je možné, že bude třeba změnit dávku inzulinu během těhotenství a po porodu. Zvláště pečlivá kontrola diabetu a prevence hypoglykémie jsou důležité pro zdraví Vašeho dítěte.
Pokud kojíte, poraďte se se svým lékařem, neboť může být nezbytné upravit Vám dávku inzulinu a Vaši dietu.
Řízení dopravních prostředků a obsluha strojů
Vaše schopnost soustředit se nebo reagovat může být snížena, jestliže:
- máte hypoglykémii (nízkou hladinu cukru v krvi)
- máte hyperglykémii (vysokou hladinu cukru v krvi)
- máte problémy se zrakem.
Myslete na tento možný problém ve všech situacích, kde byste mohl(a) dostat sebe nebo ostatní do nebezpečí (např. při řízení vozidla nebo při obsluze strojů). Měl(a) byste se poradit se svým lékařem o vhodnosti řízení vozidel, pokud:
- máte časté epizody hypoglykémie,
- jsou první varovné příznaky, které Vám pomohou rozpoznat hypoglykémii, omezené nebo chybějí. Důležité informace o některých složkách přípravku ABASAGLAR
Tento léčivý přípravek obsahuje méně než 1 mmol (23 mg) sodíku v jedné dávce, tj. v podstatě sodík neobsahuje.
Jak se ABASAGLAR používá
3.
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Dávkování
Na základě Vašeho životního stylu, výsledků testů cukru (glukózy) v krvi a Vašeho předchozího používání inzulínu lékař:
- určí, kolik přípravku ABASAGLAR denně budete potřebovat a v jakou dobu,
- řekne Vám, kdy kontrolovat hladinu cukru v krvi a zda potřebujete provádět testy moči,
- řekne Vám, kdy můžete potřebovat aplikovat vyšší nebo nižší dávku přípravku ABASAGLAR.
ABASAGLAR je dlouhodobě působící inzulin. Je možné, že Vám lékař řekne, abyste jej používal(a) v kombinaci s krátkodobě působícím inzulinem nebo s tabletami na snížení vysoké hladiny cukru v krvi.
Hladinu cukru v krvi může ovlivnit mnoho faktorů. Měl(a) byste znát tyto faktory, abyste byl(a) schopen(a) reagovat správně na změny hladiny cukru v krvi a předejít jejich přílišnému zvýšení nebo přílišnému snížení. Další informace si přečtěte v rámečku na konci této příbalové informace.
Použití u dětí a dospívajících
Přípravek ABASAGLAR mohou používat dospívající a děti ve věku 2 roky a starší. Nejsou žádné zkušenosti s podáváním přípravku ABASAGLAR dětem mladším 2 let.
Frekvence podávání
Potřebujete jednu injekci přípravku ABASAGLAR každý den, vždy ve stejnou denní dobu.
Způsob podání
Injekce přípravku ABASAGLAR se podává pod kůži. Přípravek ABASAGLAR NEPODÁVEJTE do žíly, protože by to změnilo jeho účinnost a mohlo by dojít k hypoglykémii.
Váš lékař Vám ukáže, do které oblasti kůže máte ABASAGLAR podávat. S každou injekcí měňte místo vpichu uvnitř vybrané oblasti kůže, kam injekci podáváte.
Jak se zachází s přípravkem ABASAGLAR KwikPen
ABASAGLAR KwikPen je předplněné pero pro jedno použití obsahující inzulin glargin.
Pečlivě si přečtěte “Návod k použití ABASAGLAR Kwikpen“ přiložený spolu s touto příbalovou informací. Pero musíte používat tak, jak je popsáno v tomto návodu k použití.
Před každým použitím vždy nasaďte novou jehlu. Používejte pouze jehly, které byly schváleny pro použití s přípravkem ABASAGLAR KwikPen (viz „Návod k použití ABASAGLAR KwikPen“).
Před každou injekcí se musí provést test bezpečnosti.
Zásobní vložku si prohlédněte ještě předtím, než pero použijete. Nepoužívejte ABASAGLAR KwikPen, pokud v něm zpozorujete částice. ABASAGLAR KwikPen použijte jen tehdy, je-li roztok čirý, bezbarvý a vypadá jako voda. Před použitím přípravek nemíchejte ani s ním netřepejte.
Aby se zabránilo možnému přenosu nemoci, musí být každé pero používáno pouze jedním pacientem. Ujistěte se, že ani alkohol ani jiná dezinfekce nebo jiné látky nekontaminují inzulin.
Použijte nové pero pokaždé, když si všimnete, že kontrola hladiny cukru v krvi se nečekaně zhoršila. Domníváte-li se, že problém může souviset s přípravkem ABASAGLAR KwikPen požádejte o radu svého lékaře, lékárníka, nebo zdravotní sestru.
Prázdná pera nesmí být znovu plněna a musí být řádně zlikvidována.
Nepoužívejte ABASAGLAR KwikPen, pokud je poškozen nebo nefunguje správně. Musí být znehodnocen a musí se použít nový KwikPen.
Jestliže jste užil(a) více přípravku ABASAGLAR, než jste měl(a)
- Pokud jste podal(a) příliš mnoho přípravku ABASAGLAR, může se příliš snížit hladina cukru v krvi (hypoglykémie). Často si kontrolujte hladinu cukru v krvi. Obecně platí, že pro prevenci hypoglykémie musíte jíst více jídla a sledovat hladinu cukru v krvi. Pro informace o léčbě hypoglykémie viz rámeček na konci této příbalové informace.
Jestliže jste zapomněl(a) použít ABASAGLAR
- Pokud j ste vynechal(a) dávku přípravku ABASAGLAR nebo jste si neaplikoval(a) dostatečnou dávku, může se Vám příliš zvýšit hladina cukru v krvi (hyperglykémie). Často si kontrolujte hladinu cukru v krvi. Pro další informace o léčbě hyperglykémie viz rámeček na konci této příbalové informace.
- Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) používat přípravek ABASAGLAR
Ukončení užívání přípravku ABASAGLAR by mohlo vést k závažné hyperglykémii (velmi vysoká hladina cukru v krvi) a ketoacidóze (hromadění kyseliny v krvi, protože tělo rozkládá tuk místo cukru). Neukončujte léčbu přípravkem ABASAGLAR bez konzultace s lékařem, který Vám řekne, co byste měl(a) udělat.
Záměna inzulínů
Před každou injekcí musíte vždy zkontrolovat štítek na inzulinu, aby nedošlo k záměně léčivého přípravku ABASAGLAR za jiné inzuliny.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Hypoglykémie (nízká hladina cukru v krvi) může být velmi závažná. Jestliže Vám příliš klesne hladina cukru v krvi, mohl(a) byste ztratit vědomí. Těžká hypoglykémie může způsobit poškození mozku a může být život ohrožující. Pokud máte příznaky nízké hladiny cukru v krvi, okamžitě se snažte hladinu cukru v krvi zvýšit.
Pokud se u Vás vyskytnou následující příznaky, ihned kontaktujte svého lékaře: rozsáhlé kožní reakce (vyrážka a svědění po celém těle), závažný otok kůže nebo sliznic (angioedém), dušnost, pokles krevního tlaku se zrychleným tepem a pocení. Může se jednat o příznaky závažné alergické reakce na inzulín, která může být život ohrožující.
Velmi časté nežádoucí účinky (mohou postihnout více než 1 osobu z 10)
- Hypoglykémie
Jako při každé inzulinové léčbě je nejčastějším nežádoucím účinkem hypoglykémie.
Hypoglykémie (nízká hladina cukru v krvi) znamená, že nemáte dostatek cukru v krvi. Pro další informace o nežádoucích účincích nízké nebo vysoké hladiny krevního cukru viz rámeček na konci této příbalové informace.
Časté nežádoucí účinky (mohou postihnout nejvýše 1 osobu z 10)
- Změny kůže v místě aplikace injekce
Pokud podáváte inzulin příliš často do stejného místa na kůži, může se tuková tkáň pod kůží v tomto místě buď ztenčit (lipoatrofie), nebo zesílit (lipohypertrofie). Zesílení tukové tkáně se může objevit u 1 až 2 % pacientů, zatímco ztenčení se vyskytuje méně často. Inzulin podávaný do takto změněného místa nemusí správně působit. Takovým změnám na kůži lze zabránit střídáním místa vpichu při každé injekci.
- Kožní a alergické reakce
U 3 až 4 % pacientů se může objevit reakce v místě vpichu (např. zarudnutí, neobvykle intenzívní bolestivost injekce, svědění, vyrážka, otok nebo zánět). Tyto reakce se mohou také rozšířit kolem místa vpichu. Většina mírných reakcí na inzulin obvykle odezní během několika dnů až několika týdnů.
Vzácné nežádoucí účinky (mohou postihnout nejvýše 1 osobu z 1000)
Závažné alergické reakce na inzulin
Přidružené symptomy mohou zahrnovat rozsáhlé kožní reakce (vyrážka a svědění po celém těle), závažný otok kůže nebo sliznic (angioedém), dušnost, pokles krevního tlaku se zrychleným tepem a pocení. Může jít o příznaky závažné alergické reakce na inzulin, která může být život ohrožující.
Oční reakce
Význačné změny (zlepšení nebo zhoršení) v kontrole cukru v krvi mohou vyvolat přechodné změny vidění. Pokud máte proliferativní retinopatii (oční choroba související s diabetes mellitus), mohou těžké hypoglykemické ataky způsobit přechodnou ztrátu vidění.
Celkové poruchy
Ve vzácných případech může léčba inzulinem zapříčinit přechodné zadržování vody v těle s otoky lýtek a kotníků.
Velmi vzácné nežádoucí účinky (mohou postihnout nejvýše 1 osobu z 10 000)
Ve velmi vzácných případech se může vyskytnout dysgeuzie (porucha vnímání chuti) a myalgie (bolest svalů).
Ostatní nežádoucí účinky s neznámou frekvencí výskytu (z dostupných údajů nelze frekvenci určit)
Léčba inzulinem může zapříčinit, že si tělo vytváří proti inzulinu protilátky (látky, které působí proti inzulinu). Vzácně si to vynutí změnu dávky inzulinu.
Použití u dětí a dospívajících
Všeobecně jsou nežádoucí účinky u dětí a dospívajících ve věku 18 let nebo mladších podobné nežádoucím účinkům pozorovaným u dospělých.
Stížnosti na reakce v místě vpichu (bolest v místě vpichu, reakce v místě vpichu) a na kožní reakce (vyrážka, kopřivka) jsou relativně častěji hlášeny u dětí a dospívajících ve věku 18 let nebo mladších než u dospělých pacientů.
Nejsou dostupné žádné údaje o bezpečnosti z klinických studií u dětí mladších než 2 roky.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek ABASAGLAR uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti, uvedené na krabičce a na štítku inzulinového pera za „EXP“. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívaná inzulínová pera
Uchovávejte v chladničce (2°C - 8°C). Chraňte před mrazem.
Neukládejte ABASAGLAR KwikPen do blízkosti mrazicího boxu nebo mrazicí vložky.
Uchovávejte předplněné pero v krabičce, aby byl přípravek chráněn před světlem.
Používaná inzulinová pera
Používaná předplněná pera nebo nošená jako náhradní mohou být uchovávána po dobu maximálně 28 dnů při teplotě do 30°C a mimo přímé teplo a světlo. Používané pero nesmí být uchováváno v chladničce. Nepoužívejte je po uplynutí této doby použitelnosti. Kryt pera musí být po každé injekci nasazen zpět na pero, aby byla zásobní vložka chráněna před světlem.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co ABASAGLAR obsahuje
- Léčivou látkou je insulinum glarginum. Jeden mililitr roztoku obsahuje 100 jednotek léčivé látky insulinum glarginum (to je 3,64 mg).
- Pomocnými látkami jsou: chlorid zinečnatý, metakresol, glycerol, hydroxid sodný (viz bod 2 „Důležité informace o některých složkách přípravku ABASAGLAR“), kyselina chlorovodíková, a voda na injekci.
Jak ABASAGLAR vypadá a co obsahuje toto balení
ABASAGLAR 100 jednotek/ml injekční roztok v injekční roztok v předplněném peru KwikPen je čirý a bezbarvý roztok.
Jedno pero obsahuje 3 ml injekčního roztoku (to je 300 jednotek). Dostupná jsou balení s 1, 2 a 5 předplněnými pery a multipak s 2x5 předplněnými pery o objemu 3 ml.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Eli Lilly Regional Operations GmbH., Kolblgasse 8-10, 1030, Vídeň, Rakousko.
Výrobce
Lilly France S.A.S., rue du Colonel Lilly, F-67640 Fegersheim, Francie.
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci
|
Belgie/Belgique/Belgien Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
Lietuva Eli Lilly Holdings Limited atstovybé Tel. +370 (5) 2649600 |
|
Etarapnu Tn "Enu Hunu HegepnaHg" E.B. - Etnrapua Ten. +359 2 491 41 40 |
Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0)2 548 84 84 |
|
Česká republika ELI LILLY ČR, s.r.o. Tel: + 420 234 664 111 |
Magyarország Lilly Hungária Kft. Tel: + 36 1 328 5100 |
|
Danmark Eli Lilly Danmark A/S Tlf: +45 45 26 60 00 |
Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
|
Deutschland Lilly Deutschland GmbH Tel. + 49-(0) 6172 273 2222 Boehringer Ingelheim Pharma GmbH & Co. KG Tel: +49 (0) 800 77 90 900 |
Nederland Eli Lilly Nederland B.V. Tel: + 31 -(0) 30 60 25 800 |
|
Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: +372 6 817 280 |
Norge Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
|
EkXába OAPMAIEPB-AIAAY A.E.B.E. Tr|k: +30 210 629 4600 |
Osterreich Eli Lilly Ges.m.b.H. Tel: + 43-(0) 1 711 780 |
|
Espaňa Lilly S.A. Tel: + 34-91 663 50 00 Boehringer Ingelheim Espana S.A. Tel: +34 93 404 51 00 |
Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) 22 440 33 00 |
|
France Lilly France SAS Tél: +33-(0) 1 55 49 34 34 |
Portugal Lilly Portugal Produtos Farmaceuticos, Lda Tel: + 351-21-4126600 |
|
Boehringer Ingelheim France S.A.S. Tél: +33 3 26 50 45 33 |
Boehringer Ingelheim, Lda. Tel: +351 21 313 53 00 |
|
Hrvatska Eli Lilly Hrvatska d.o.o. Tel: +385 1 2350 999 |
Románia Eli Lilly Románia S.R.L. Tel: + 40 21 4023000 |
|
Ireland Eli Lilly and Company (Ireland) Limited Tel: + 353-(0) 1 661 4377 Boehringer Ingelheim Ireland Ltd. Tel: +353 1 295 9620 |
Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0)1 580 00 10 |
|
Ísland Icepharma hf. Sími + 354 540 8000 |
Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: + 421 220 663 111 |
|
Italia Eli Lilly Italia S.p.A. Tel: + 39- 055 42571 Boehringer Ingelheim Italia S.p.A. Tel: +39 02 5355 1 |
Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: + 358-(0) 9 85 45 250 |
|
Kónpoq Phadisco Ltd Tn^: +357 22 715000 |
Sverige Eli Lilly Sweden AB Tel: + 46-(0) 8 7378800 |
|
Latvija Eli Lilly Holdings Limited parstavnieciba Latvija Tel: +371 67364000 |
United Kingdom Eli Lilly and Company Limited Tel: + 44-(0) 1256 315000 |
|
Boehringer Ingelheim Ltd. Tel: +44 1344 424 600 |
Tato příbalová informace byla naposledy revidována Další zdroje informací
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu
HYPERGLYKÉMIE A HYPOGLYKÉMIE
Vždy u sebe mějte nějaký cukr (minimálně 20 gramů).
Noste u sebe nějakou informaci, která ukazuje, že jste diabetik.
HYPERGLYKÉMIE (vysoká hladina cukru v krvi)
Pokud je Vaše hladina cukru v krvi příliš vysoká (hyperglykémie), možná jste si aplikoval(a) málo inzulinu.
Proč vzniká hyperglykémie?
Příklady:
- nepodal(a) jste si injekci inzulinu nebo jste ho nepodal(a) dostatečné množství nebo se inzulin stal méně účinným, např. z důvodu nesprávného uchovávání,
- Vaše inzulinové pero nefunguje správně
- máte méně pohybu než obvykle, jste ve stresu (emocionální úzkost, rozrušení) nebo máte úraz, jste po operaci, máte infekci nebo horečku,
- užíváte nebo jste užíval(a) některé jiné léky (viz bod 2 „Další léčivé přípravky a ABASAGLAR“). Varovné příznaky hyperglykémie
Žízeň, zvýšené močení, únava, suchá pokožka, zčervenání obličeje, nechutenství, nízký krevní tlak, zrychlený tep a přítomnost glukózy a ketolátek v moči. Bolest břicha, rychlé a hluboké dýchání, ospalost nebo dokonce ztráta vědomí mohou být známkami vážného stavu (ketoacidózy) vyplývajícího z nedostatku inzulinu.
Co dělat v případě hyperglykémie?
Změřte si hladinu cukru v krvi a ketolátek v moči co nejdříve, jakmile se výše uvedené příznaky hyperglykémie objeví. Těžká hyperglykémie nebo ketoacidóza musí být vždy léčena lékařem, obvykle v nemocnici.
HYPOGLYKÉMIE (nízká hladina cukru v krvi)
Pokud je hladina cukru v krvi příliš nízká, můžete ztratit vědomí. Závažná hypoglykémie může vyvolat srdeční infarkt nebo poškození mozku a může být život ohrožující. Za normálních okolností byste měl(a) být schopen(na) rozpoznat přílišné snižování hladiny cukru v krvi, a proto můžete správně reagovat.
Proč vzniká hypoglykémie?
Příklady:
- aplikujete si příliš mnoho inzulinu,
- vynecháte nebo odložíte jídlo,
- nejíte dostatečně, nebo snědené jídlo obsahuje méně sacharidů (cukr a látky podobné cukru se nazývají sacharidy; umělá sladidla však NEJSOU sacharidy) než normálně,
- dochází u Vás ke ztrátě sacharidů zvracením nebo průjmem,
- pijete alkohol, a zvláště pokud nejíte dostatečně,
- cvičíte více než obvykle nebo vykonáváte jiný typ fyzické činnosti/pohybu,
- zotavujete se ze zranění, operace, nebo z jiných forem stresu,
- zotavujete se po nemoci nebo z horečky,
- užíváte nebo jste přestala užívat některé jiné léky (viz bod 2 „Další léčivé přípravky a ABASAGLAR“).
Výskyt hypoglykémie je také pravděpodobnější, pokud
- právě zahajujete léčbu inzulínem nebo přecházíte na jiný inzulínový přípravek (pokud se objeví hypoglykémie, když přecházíte z předchozího bazálního inzulínu na ABASAGLAR, je její výskyt pravděpodobnější ráno než v noci),
- j sou V aše hladiny cukru v krvi téměř normální nebo j sou nestálé,
- změníte oblast kůže, kam podáváte injekci inzulinu (např. ze stehna do ramene),
- trpíte závažným onemocněním ledvin nebo jater, nebo některou jinou chorobou, jako je hypotyreóza (snížená funkce štítné žlázy).
Varovné příznaky hypoglykémie
- Ve Vašem těle
Příklady příznaků, které naznačují, že hladina cukru v krvi klesá příliš nízko nebo příliš rychle: pocení, vlhká pokožka, úzkost, zrychlený tep, vysoký krevní tlak, bušení srdce a nepravidelný srdeční rytmus. Často se tyto příznaky vyvinou dříve než příznaky spojené s nízkou hladinou cukru v mozku.
- Ve Vašem mozku
Příklady příznaků ukazujících nízkou hladinu cukru v mozku: bolest hlavy, intenzivní hlad, pocit na zvracení, zvracení, únava, ospalost, poruchy spánku, neklid, agresivní chování, pokles koncentrace, zhoršené reakce, deprese, zmatenost, poruchy řeči (někdy úplná ztráta řeči), poruchy vidění, třes, paralýza, pocity mravenčení (parestézie), brnění a pocity necitlivosti v oblasti úst, závrať, ztráta sebekontroly, neschopnost postarat se o sebe, křeče, ztráta vědomí.
První příznaky, které Vás varují před hypoglykémií („varovné příznaky“), mohou být pozměněny, mohou být slabší nebo mohou zcela chybět, pokud:
- jste starší; máte diabetes již dlouho nebo trpíte určitým typem nervového onemocnění (diabetická autonomní neuropatie),
- jste hypoglykémiiměl(a) nedávno (např. předchozí den) nebo se vyvíjí pomalu,
- máte téměř normální nebo alespoň hodně zlepšenou hladinu cukru v krvi,
- nedávno j ste byl(a) převeden(a) ze zvířecího inzulinu na lidský inzulin, j ako j e ABASAGLAR
- užíváte nebo jste užíval(a) některé jiné léky (viz bod 2 „Další léčivé přípravky a ABASAGLAR“).
V takových případech se u Vás může rozvinout těžká hypoglykémie (a dokonce mdloba), aniž byste si toho všiml(a) včas. Seznamte se co nejlépe se svými varovnými příznaky hypoglykémie. Je-li to nutné, častější měření cukru v krvi může pomoci odhalit mírné hypoglykemické epizody, které by jinak mohly být přehlédnuty. Pokud se nemůžete spolehnout na rozpoznání svých varovných příznaků, vyhněte se takovým situacím (např. řízení vozidla), při kterých by hypoglykémie pro Vás nebo pro ostatní představovala riziko.
Co dělat v případě hypoglykémie?
1. Nepodávejte inzulin. Okamžitě si vezměte asi 10 až 20 g cukru, např. glukózu, kostky cukru nebo cukrem oslazený nápoj. Upozornění: umělá sladidla a potraviny obsahující umělá sladidla místo cukru (např. dietní nápoje) při léčbě hypoglykémie nepomáhají.
2. Potom snězte něco s dlouhotrvajícím účinkem na nárůst cukru v krvi (např. chléb nebo těstoviny). Dbejte na to, abyste tyto záležitosti předem prohovořil(a) s lékařem nebo zdravotní sestrou.
Hypoglykémie může odeznívat déle, protože ABASAGLAR působí dlouhodobě.
3. Pokud se hypoglykémie znovu vrací, vezměte si dalších 10 až 20 g cukru.
4. Informujte okamžitě lékaře, jestliže hypoglykémii nebo její opakování nejste schopen(a) zvládnout. Oznamte příbuzným, přátelům a blízkým kolegům následující:
Pokud nemůžete polykat nebo upadnete do bezvědomí, budete potřebovat injekci glukózy nebo glukagonu (lék, který zvyšuje hladinu cukru v krvi). Tyto injekce jsou opodstatněné dokonce i tehdy, není-li jisté, že máte hypoglykémii.
Je vhodné změřit si hladinu cukru v krvi okamžitě po požití cukru, abyste zkontroloval(a), že máte skutečně hypoglykémii.
Návod k obsluze KwikPen
ABASAGLAR 100 jednotek/ml injekční roztok v předplněném peru
Insulinům glarginum

PŘED POUŽITÍM SI PROSÍM PŘEČTĚTE TENTO NÁVOD
Před tím, než začnete používat přípravek ABASAGLAR si pečlivě přečtěte návod k obsluze a přečtěte si jej pokaždé, když dostanete další pero ABASAGLAR KwikPen. Může obsahovat nové informace. Tyto informace nenahrazují konzultaci s Vaším lékařem o Vašem zdravotním stavu nebo Vaší léčbě.
ABASAGLAR KwikPen (“Pero”) je jednorázové pero obsahující 300 jednotek (3 ml) inzulinu glargin. Jedním perem si můžete podat více dávek. Dávka na peru se nastavuje po jedné jednotce. V jedné injekci můžete podat dávku od 1 do 60 80 jednotek. Potřebujete-li dávku vyšší než je 60 80 jednotek, budete si muset aplikovat více než jednu injekci. Při podání injekce se píst pohybuje jen velmi málo a vy jeho pohyb nemusíte zaznamenat. Píst se dostane na konec zásobní vložky pouze v případě, že využíváte všech 300 jednotek v peru.
Své pero nesdílejte s jinými osobami ani v případě, že jste vyměnil(a) jehlu. Jehly nepoužívejte opakovaně ani je nesdílejte s jinými osobami. Mohl(a) byste ne ně přenést infekci nebo od nich infekci dostat.
Pero není určeno osobám nevidomým nebo osobám s poškozeným zrakem, pokud jim nemůže pomoci osoba, která je s obsluhou pera seznámena.
Části pera KwikPen
Kryt pera
Držák zásobní vložky Štítek Ukazatel dávky

Spona krytu Pryžový uzávěr
Píst Tělo pera Dávkovací Dávkovací
okénko tlačítko
Dávkovací tlačítko se zeleným kroužkem
Části jehly
(Jehly nejsou součástí balení)
Jehla

Vnější kryt jehly Vnitřní kryt jehly Papírová folie

Jak rozlišíte Vaše pero ABASAGLAR KwikPen :
• Barva pera: Světle šedá
• Dávkovači tlačítko: Světle šedé se zeleným kroužkem na zadní ploše
• Štítek: Světle šedý s pruhy zelené barvy
K podání injekce potřebujete:
• ABASAGLAR KwikPen
• Jehly kompatibilní s perem ABASAGLAR KwikPen (doporučeny jsou jehly BD [Becton, Dickinson and Company]).
• Tampon s dezinfekcí
Příprava pera •
• Umyjte si ruce mýdlem a vodou.
• Zkontrolujte štítek pera a přesvědčte se, že používáte správný typ inzulínu. Je to zvlášť důležité, používáte-li víc než 1 typ inzulinu.
• Nepoužívejte pero, pokud již uplynula doba jeho použitelnosti uvedená na štítku pera nebo pokud uplynulo vice než 28 dní po jeho prvním použití.
• Pro každou injekci použijte novou jehlu. Tím pomůžete předejít infekcím a případnému ucpání jehel.
Krok 1:
• Přímým tahem odstraňte kryt pera.
- Neodstraňujte z pera štítek.
• Tamponem s dezinfekcí otřete pryžový uzávěr.
Přípravek ABASAGLAR by měl být čirý a bezbarvý. Nepoužívejte jej, jestliže je zakalený, zbarvený nebo obsahuje částice nebo shluky.
Krok 4:
• Odstraňte vnější kryt jehly. Nevyhazujte jej.
• Odstraňte vnitřní kryt j ehly a vyhoďte j ej.

V
r

Prostříknutí pera
Pero prostříkněte před každou injekcí.
• Prostříknutí pera odstraňuje vzduch z jehly a ze zásobní vložky s inzulínem, který se tam mohl nahromadit v průběhu normálního používání, a zajišťuje správnou funkci pera.
• Pokud neprostříknete pero před každou injekcí, můžete si aplikovat příliš velkou nebo příliš malou dávku inzulinu.

Krok 6:
• Otočte pero jehlou nahoru. Poklepávejte jemně na držák zásobní vložky tak, aby se vzduch shromáždil nahoře.

Krok 7:
• S jehlou směrem nahoru stiskněte dávkovací tlačítko nadoraz, až se v dávkovacím okénku objeví 0. Držte dávkovací tlačítko stlačené a pomalu počítejte do 5.
Ze špičky jehly byste měl(a) vidět vytékat inzulin.
- Pokud nevidíte vytékat inzulin, opakujte kroky prostříknutí, ale ne víc než 4 krát.
- Pokud stále nevidíte vytékat inzulin, vyměňte jehlu a opakujte kroky prostříknutí.
Malé vzduchové bublinky jsou normální a neovlivní velikost Vaší dávky._


Nastavení dávky
V jedné injekci můžete aplikovat dávku od 1 do 60 80 jednotek.
• Potřebujete-li dávku vyšší než je 60 80jednotek, budete si muset aplikovat více než jednu injekci.
- Potřebujete-li pomoc s rozhodnutím, jak svou dávku rozdělit, zeptejte se svého lékaře.
- Pro každou injekci byste měl(a) použít novou jehlu a znovu ji prostříknout.
Krok 8:
• Nastavte požadovanou dávku otáčením
dávkovacího tlačítka. Ukazatel dávky by
měl zobrazovat Vaši dávku.
- Dávka na peru se nastavuje po jedné jednotce.
- Při otáčení dávkovací tlačítko slyšitelně kliká.
- NENASTAVUJTE si velikost dávky počítáním kliků, mohl(a) byste si nastavit špatnou dávku.
- Dávka může být opravena otáčením dávkovacího tlačítka oběma směry, dokud není nastavena správná dávka, která se zobrazí na ukazateli dávky.
- Sudé hodnoty jsou na číselníku natištěny.


(Příklad: v dávkovacím okénku je 12 jednotek)
- Liché hodnoty jsou po čísle 1 zobrazeny jako celé čáry.
• Hodnotu dávky v dávkovacím okénku vždy zkontrolujte, abyste se ujistil(a), že _jste si nastavil(a) správnou dávku._

(Příklad: v dávkovacím okénku je 25 jednotek)
• Pero neumožňuje nastavení větší dávky, než je zbývající počet jednotek v peru.
• Pokud budete potřebovat podat více jednotek, než jich zbývá v peru, můžete buď:
- podat množství, které v peru zbývá a pro podání zbývající dávky použít nové pero nebo
- použít nové pero na podání celé dávky.
• Je normální, když v peru zůstane malé množství inzulinu, které nelze podat.
Podání dávky
• Injekci inzulinu podejte tak, jak Vám to ukázal Váš lékař.
• S každou injekcí měňte (rotujte) místo vpichu uvnitř vybrané oblasti kůže, kam injekci podáváte.
• Nepokoušejte se o úpravu dávky v průběhu jejího podání.
Krok 9:



Vyberte místo vpichu.
• Přípravek ABASAGLAR by měl být podán v injekci pod kůži (subkutánně) do oblasti břicha, hýždí, stehen nebo horních části paží.
• Připravte pokožku v místě vpichu tak, jak Vám to doporučil Váš lékař.
Krok 10:
• V píchněte j ehlu do kůže.
• Stiskněte dávkovací tlačítko a dokud se pohybuje, tiskněte jej.

Dávkovací tlačítko držte stále zmáčknuté a pomalu
napočítejte do 5;
teprve pak jehlu vytáhněte.
NESNAŽTE SE podat si inzulin otáčením dávkovacího tlačítka. K podání inzulinu otáčením dávkovacího tlačítka nedojde.
Krok 11:
• V ytáhněte j ehlu z kůže.
- Kapka inzulinu na konci jehly je normální. Neovlivní velikost Vaší dávky.
• Zkontrolujte číslici v dávkovacím okénku
- Vidíte-li v dávkovacím okénku „0”, podal(a) jste si celou dávku, kterou jste si nastavil(a).
- Pokud v dávkovacím okénku číslici „0” nevidíte, nenastavujte novou dávku. Vpíchněte jehlu do kůže a dokončete injekci.
- Pokud se stále domníváte, že jste si nepodal(a) celou dávku, kterou jste pro injekci nastavil(a), nezačínejte znovu ani tuto injekci neopakujte. Sledujte svou hladinu cukru tak, jak Vás instruoval Váš lékař.
- Pokud k podání své normální dávky potřebujete 2 injekce, nezapomeňte si podat druhou injekci.
Při podání injekce se píst pohybuje jen velmi málo a vy jeho pohyb nemusíte zaznamenat.
Obj eví-li se po vyndání jehly z kůže krev, jemně stlačte místo vpichu kouskem gázy nebo tamponem. Místo netřete.
Po podání injekce

Krok 13:
• Jehlu s nasazeným krytem odstraňte odšroubováním a znehodnoťte ji podle rady Vašeho lékaře.
• Neuchovávejte pero s nasazenou jehlou, předejdete tím vytékání, ucpání jehly a vnikání vzduchu do pera.

Krok 14:
• Sponu krytu s ukazatelem dávky natočte do zákrytu a přímým zatlačením nasaďte zpět kryt pera.

Likvidace per a jehel
• Jehlu vyhoďte do uzavíratelné nádoby, která nejde propíchnout.
• Nádobu na j ehly nerecyklujte.
• Zeptejte se svého lékaře nebo lékárníka na možnosti správné likvidace per a nádoby s jehlami.
• Pokyny k zacházení s jehlami nemají nahrazovat místní, zdravotnické nebo institucionální předpisy.
Uchovávání pera Nepoužívaná pera
• Nepoužitá pera uchovávejte v chladničce od 2°C do 8°C.
• Chraňte přípravek ABASAGLAR před mrazem. Pokud došlo k jeho zmrznutí, nepoužívejte jej.
• Nepoužitá pera můžete použít do data použitelnosti, uvedeného na obalu, pokud bylo pero uchováváno v chladničce.
Používané pero
• Pero, které právě používáte, uchovávejte při pokojové teplotě [do 30 ° C] mimo přímé teplo a světlo.
• Pero, které používáte, po 28 dnech zlikvidujte, a to i v případě, že je v něm ještě inzulin.
Obecné informace o bezpečném a efektivním používání Vašeho pera
• Uchovávejte pero a jehly mimo dohled a dosah dětí.
• Pero nepoužívejte, vypadá-li pero nebo některá jeho část rozbitá či zničená.
• Vždy při sobě noste náhradní pero pro případ ztráty nebo poruchy Vašeho pera.
Řešení problémů
• Nemůžete-li sundat z pera kryt, jemně krytem pera otáčejte tam a zpět a pak kryt sundejte přímým tahem.
• Jde-li dávkovací tlačítko stlačit těžce:
- Stlačujte dávkovací tlačítko pomaleji, injekce bude snazší.
- Jehla může být ucpaná. Nasaďte novou jehlu a pero prostříkněte.
- Do vnitřku pera se mohl dostat prach, jídlo nebo kapalina. Pero zlikvidujte a vezměte si pero nové.
Máte-li nějaké otázky nebo problémy s přípravkem ABASAGLAR KwikPen, kontaktujte svého lékaře.
Tato příbalová informace byla naposledy revidována
79