Votrient 200 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Votrient 200 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna potahovaná tableta obsahuje pazopanibum 200 mg (jako pazopanibi hydrochloridum). Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta.
Růžové podlouhlé potahované tablety s vyraženým GS JT na jedné straně.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Karcinom ledviny (RCC)
Přípravek Votrient je indikován u dospělých k podávání v první linii léčby pokročilého karcinomu ledviny (renal cell carcinoma, RCC) a k léčbě pacientů, kterým byly dříve podávány cytokiny pro pokročilé onemocnění.
Sarkom měkkých tkání (STS)
Přípravek Votrient je indikován k léčbě dospělých pacientů s vybranými subtypy pokročilého sarkomu měkkých tkání (soft tissue sarcoma, STS), kteří podstoupili chemoterapii pro metastazující onemocnění nebo u nich došlo k progresi onemocnění během 12 měsíců po (neo)adjuvantní terapii.
Účinnost a bezpečnost přípravku byly stanoveny pouze pro určité histologické subtypy STS (viz bod 5.1).
4.2 Dávkování a způsob podání
Léčba přípravkem Votrient má být zahájena pouze lékařem, který má zkušenosti s podáváním přípravků k léčbě nádorových onemocnění.
Dávkování
Dospělí
Doporučená dávka pazopanibu k léčbě RCC nebo STS je 800 mg jednou denně.
Úprava dávky
Dávka se upravuje postupným přidáváním 200 mg podle individuální snášenlivosti pacienta, aby bylo možné zvládnout nežádoucí účinky. Dávka pazopanibu nemá překročit 800 mg.
Pediatrická _ populace
Pazopanib nemá být podáván dětem mladším než 2 roky z důvodu bezpečnostního rizika pro růst a vývoj orgánů (viz body 4.4 a 5.3).
Bezpečnost a účinnost pazopanibu u dětí od 2 do 18 let nebyly dosud stanoveny (viz bod 5.1).
Starší _ pacienti
O použití pazopanibu u pacientů ve věku 65 let a starších jsou k dispozici pouze omezené údaje. Ve studiích s RCC nebyly pozorovány celkově žádné klinicky významné rozdíly v bezpečnosti pazopanibu mezi subjekty ve věku nejméně 65 let a subjekty mladšími. Klinické zkušenosti neodhalily rozdíly odpovědi mezi staršími a mladšími pacienty, ale u některých starších pacientů nemůže být vyloučena vyšší citlivost.
Porucha renálních _ funkcí
Vzhledem k nízké renální exkreci pazopanibu a metabolitů není pravděpodobné, že by porucha renálních funkcí měla klinicky významný vliv na farmakokinetiku pazopanibu (viz bod 5.2). Proto není u pacientů s clearance kreatininu nad 30 ml/min nutno dávku upravovat. Pacientům s clearance kreatininu nižší než 30 ml/min je třeba věnovat zvýšenou pozornost, protože u takovýchto pacientů nejsou s podáváním pazopanibu žádné zkušenosti.
Porucha jaterních funkcí
Doporučení týkající se dávkování u pacientů s poruchou jaterních funkcí jsou založena na farmakokinetických studiích s pazopanibem u pacientů s různým stupněm poškození jater (viz bod 5.2). U všech pacientů mají být před zahájením a v průběhu léčby provedeny jaterní testy, aby bylo možné určit, zda mají poruchu jaterních funkcí (viz bod 4.4). Podávání pazopanibu pacientům s mírnou až středně závažnou poruchou jaterních funkcí má být prováděno s opatrností a za pečlivého monitorování snášenlivosti. Doporučená denní dávka pazopanibu u pacientů s mírnými odchylkami v jaterních testech [definovanými buď jako normální hladina bilirubinu a jakkoli zvýšená hladina alaninaminotransferázy (ALT) nebo zvýšená hladina bilirubinu (> 35 % přímého) až do 1,5násobku horního limitu normálních hodnot (ULN) bez ohledu na hladinu ALT] je 800 mg jednou denně.
U pacientů se středně závažnou poruchou jaterních funkcí (definovanou jako zvýšení hladiny bilirubinu na > 1,5 až 3násobek ULN bez ohledu na hladinu ALT) je doporučena snížená dávka 200 mg pazopanibu jednou denně (viz bod 5.2).
Podávání pazopanibu se nedoporučuje u pacientů se závažnou poruchou jaterních funkcí (definovanou jako zvýšení hladiny celkového bilirubinu na > 3násobek ULN bez ohledu na hladinu ALT).
Monitorování jaterních funkcí a úprava dávky u pacientů s hepatotoxicitou vyvolanou léčivým přípravkem viz bod 4.4.
Způsob podání
Pazopanib se podává nalačno, alespoň jednu hodinu před jídlem nebo dvě hodiny po jídle (viz bod 5.2). Přípravek Votrient potahované tablety se užívá celý a zapije se dostatečným množstvím vody, nesmí se lámat ani drtit (viz bod 5.2).
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Účinky na játra
Při užívání pazopanibu byly hlášeny případy jaterního selhání (včetně případů končících úmrtím). Podávání pazopanibu pacientům s mírnou až středně závažnou poruchou jaterních funkcí má probíhat pouze za zvýšené opatrnosti a pečlivého monitorování. Doporučená dávka pazopanibu u pacientů s mírnými odchylkami v jaterních testech [definovanými buď jako normální hladina bilirubinu a jakkoli zvýšená hladina alaninaminotransferázy (ALT) nebo zvýšená hladina bilirubinu až do 1,5násobku ULN bez ohledu na hladinu ALT] je 800 mg jednou denně. U pacientů se středně závažnou poruchou jaterních funkcí (zvýšená hladina bilirubinu na > 1,5 až 3násobek ULN bez ohledu na hladinu ALT) je doporučena snížená dávka 200 mg pazopanibu jednou denně (viz body 4.2 a 5.2). Podávání pazopanibu se nedoporučuje u pacientů se závažnou poruchou jaterních funkcí (zvýšená hladina celkového bilirubinu na > 3násobek ULN bez ohledu na hladinu ALT) (viz body 4.2 a 5.2).
U těchto pacientů je expozice při dávce 200 mg výrazně snížena, i když s vysokou variabilitou, její hodnoty jsou považovány za nedostatečné k dosažení odpovídajícího klinického účinku.
V klinických studiích s pazopanibem bylo pozorováno zvýšení sérových transamináz (ALT, aspartátaminotransferázy [AST]) a bilirubinu (viz bod 4.8). Ve většině těchto případů bylo hlášeno izolované zvýšení ALT a AST bez současných elevací alkalické fosfatázy nebo bilirubinu. U pacientů ve věku nad 60 let může být větší riziko mírného (> 3násobek ULN) až závažného (> 8násobek ULN) zvýšení ALT. Pacienti, kteří jsou nositelé alely HLA-B *57:01, mají větší riziko zvýšení ALT asociované s léčbou pazopanibem. Vyšetření jaterních funkcí je třeba provádět u všech jedinců užívajících pazopanib, bez ohledu na genotyp nebo věk (viz bod 5.1).
Sérové jaterní testy je třeba provést před zahájením léčby pazopanibem a ve 3., 5., 7. a 9. týdnu léčby. Poté je monitorování prováděno ve 3. a ve 4. měsíci a podle klinického zvážení. Pravidelné monitorování má pokračovat po 4. měsíci.
Pokyny k úpravě dávky u pacientů s výchozími hodnotami celkového bilirubinu < 1,5násobku ULN a AST a ALT < 2násobku ULN jsou uvedeny v tabulce 1:
Tabulka 1: Úprava dávky při hepatotoxicitě vyvolané léky
|
Hodnoty jaterních testů |
Úprava dávky |
|
Zvýšení transamináz mezi 3 a 8x ULN |
Pokračujte v podávání pazopanibu s týdenními kontrolami jaterních funkcí, dokud se hladiny transamináz nevrátí na stupeň 1 nebo k výchozím hodnotám. |
|
Zvýšení transamináz > 8x ULN |
Přerušte léčbu pazopanibem, dokud se hladiny transamináz nevrátí na stupeň 1 nebo k výchozím hodnotám. Pokud je předpoklad, že možný prospěch ze znovuzahájení léčby pazopanibem převáží rizika hepatotoxicity, pak léčbu pazopanibem znovu zahajte sníženou dávkou 400 mg denně a jaterní testy provádějte každý týden po dobu 8 týdnů. Pokud po znovuzahájení léčby pazopanibem opět dojde ke zvýšení transamináz > 3x ULN, léčba pazopanibem má být trvale ukončena. |
|
Zvýšení transamináz > 3x ULN současně se zvýšením bilirubinu > 2x ULN |
Trvale ukončete léčbu pazopanibem. Pacienti mají být monitorováni až do návratu na stupeň 1 nebo k výchozím hodnotám. Pazopanib je inhibitorem UGT1A1. U pacientů s Gilbertovým syndromem se může vyskytnout mírná, nepřímá (nekonjugovaná) hyperbilirubinémie. Pacienti s pouze mírnou nepřímou hyperbilirubinémií, se známým nebo suspektním Gilbertovým syndromem a se zvýšením ALT > 3x ULN mají být léčeni podle doporučení uvedených pro samostatná zvýšení ALT. |
Současné užívání pazopanibu a simvastatinu zvyšuje riziko zvýšení hladin ALT (viz bod 4.5) a má probíhat s opatrností a za pečlivého monitorování.
Hypertenze
V klinických studiích s pazopanibem se objevily případy hypertenze, včetně nově diagnostikovaných symptomatických epizod zvýšení krevního tlaku (hypertenzní krize). Před zahájením léčby pazopanibem má být krevní tlak náležitě upraven. Pacienti mají být sledováni, zda se u nich neobjeví hypertenze časně po zahájení léčby (do jednoho týdne od zahájení léčby pazopanibem) a následně co nejčastěji, aby byla zajištěna kontrola krevního tlaku. Zvýšené hodnoty krevního tlaku (systolický krevní tlak > 150 nebo diastolický krevní tlak > 100 mm Hg) se objevily časně v průběhu léčby (přibližně 40 % případů se objevilo do 9. dne a přibližně 90 % případů se objevilo v průběhu prvních 18 týdnů). Krevní tlak musí být monitorován a co nejdříve normalizován pomocí kombinace antihypertenzní léčby a úpravy dávky pazopanibu (přerušení a opětovné zahájení podávání nižší dávky dle klinického posouzení) (viz body 4.2 a 4.8). Léčba pazopanibem má být ukončena v případě prokázané hypertenzní krize nebo pokud je hypertenze závažná a přetrvává i přes nasazení antihypertenzní léčby a snížení dávky pazopanibu.
Syndrom zadní reverzibilní encefalopatie (PRES)/syndrom zadní reverzibilní leukoencefalopatie (RPLS)
V souvislosti s užíváním pazopanibu byl hlášen výskyt PRES/RPLS. PRES/RPLS se může projevovat bolestí hlavy, hypertenzí, záchvaty, letargií, zmateností, slepotou a dalšími poruchami zraku a neurologickými poruchami a může být fatální. U pacientů, u kterých dojde k rozvoji PRES/RPLS, má být léčba pazopanibem trvale ukončena.
Intersticiální plicní nemoc (ILD)/pneumonitida
V souvislosti s užíváním pazopanibu byla hlášena ILD, která může být fatální (viz bod 4.8). Pacienty s plicními symptomy, které mohou svědčit o ILD/pneumonitidě, je nutné monitorovat a podávání pazopanibu ukončit u pacientů s rozvíjející se ILD nebo pneumonitidou.
U pacientů s již existující kardiální dysfunkcí je před zahájením léčby zapotřebí zvážit riziko a prospěch podávání pazopanibu. Bezpečnost a farmakokinetika pazopanibu nebyly studovány u pacientů se středně závažným až závažným srdečním selháním nebo pacientů s LVEF pod normálem.
V klinických studiích s pazopanibem se vyskytly případy kardiální dysfunkce, jako je městnavé srdeční selhání a snížení ejekční frakce levé komory (LVEF) (viz bod 4.8). V randomizované studii srovnávající pazopanib a sunitinib u pacientů s RCC (VEG108844) bylo u pacientů prováděno měření LVEF ve výchozím stavu a následné měření LVEF. Dysfunkce myokardu se vyskytla u 13 % (47/362) pacientů v rameni s pazopanibem oproti 11 % (42/369) pacientů v rameni se sunitinibem. Městnavé srdeční selhání bylo pozorováno u 0,5 %pacientů v každém léčebném rameni. Městnavé srdeční selhání bylo hlášeno u 3 z 240 pacientů (1 %) v STS studii fáze III VEG110727. Snížení LVEF u pacientů, u nichž bylo provedeno měření po výchozím stavu a následné měření LVEF, bylo zaznamenáno u 11 % (15/140) ve skupině s pazopanibem proti 3 % (1/39) ve skupině s placebem.
Rizikové faktory: Třináct z patnácti pacientů ve skupině s pazopanibem v STS studii fáze III mělo zároveň hypertenzi, která mohla způsobit zhoršení kardiální dysfunkce u rizikových pacientů zvýšením srdečního afterloadu. 99 % pacientů (243/246) zařazeným do STS studie fáze III, včetně těchto 15 pacientů, byl podáván antracyklin. Předchozí terapie antracyklinem může být rizikovým faktorem kardiální dysfunkce.
Výsledek: U čtyř z patnácti pacientů došlo k plnému zotavení (v rozmezí 5 % proti výchozímu stavu) a u pěti došlo k částečnému zotavení (v rozmezí normálních hodnot, ale s > 5% rozdílem proti výchozímu stavu). U jednoho pacienta nedošlo k zotavení a u dalších 5 pacientů nebyly údaje z následného sledování k dispozici.
Léčba: U pacientů s významným snížením LVEF má být přerušení podávání pazopanibu a/nebo snížení dávky kombinováno s léčbou hypertenze (pokud je přítomna, viz upozornění týkající se hypertenze výše) tak, jak je klinicky indikováno.
Pacienti mají být pečlivě monitorováni s ohledem na výskyt klinických známek nebo příznaků městnavého srdečního selhání. U pacientů s rizikem kardiální dysfunkce je doporučeno provádět vyhodnocení LVEF na začátku léčby a dále v pravidelných intervalech.
Prodloužení QT intervalu a torsade de pointes
V klinických studiích s pazopanibem se objevily případy prodloužení QT intervalu a torsade de pointes (viz bod 4.8). U pacientů s anamnézou prodloužení QT intervalu, u pacientů užívajících antiarytmika nebo další léčivé přípravky, které mohou prodlužovat QT interval, a u pacientů
s preexistujícím relevantním srdečním onemocněním má být pazopanib podáván s opatrností. Při podávání pazopanibu se doporučuje provést úvodní a pravidelné monitorování EKG a hladiny elektrolytů (tj. kalcium, magnezium, kalium) je třeba udržovat v rozmezí normálních hodnot.
Arteriální trombotické _příhody
V klinických studiích s pazopanibem byly pozorovány infarkt myokardu, ischemická cévní mozková příhoda a tranzitorní ischemická ataka (viz bod 4.8). Byly pozorovány fatální případy. Pazopanib má být podáván s opatrností u pacientů se zvýšeným rizikem trombotických příhod nebo u pacientů
s trombotickými příhodami v anamnéze. Pazopanib nebyl studován u pacientů, kteří měli tuto příhodu v předchozích 6 měsících. Rozhodnutí o léčbě má být založeno na zhodnocení prospěšnosti/rizika u každého jednotlivého pacienta.
V klinických studiích s pazopanibem se vyskytly žilní tromboembolické příhody včetně žilní trombózy a fatální plicní embolie. Byly zaznamenány jak v RCC, tak v STS studiích, ale incidence byla vyšší u populace s STS (5 %) než u populace s RCC (2 %).
Trombotická mikroangiopatie
V klinických studiích s pazopanibem v monoterapii, v kombinaci s bevacizumabem a v kombinaci
s topotekanem, byla hlášena trombotická mikroangiopatie (TMA) (viz bod 4.8). U pacientů, u kterých dojde k rozvoji TMA, má být léčba pazopanibem trvale ukončena. Po ukončení léčby pazopanibem bylo pozorováno odeznění projevů TMA. Pazopanib není indikován k použití v kombinaci s jinými léčivými látkami.
Hemoragické příhody
V klinických studiích s pazopanibem byly hlášeny hemoragické příhody (viz bod 4.8). Vyskytly se fatální hemoragické příhody. Podávání pazopanibu pacientům s anamnézou hemoptýzy, cerebrálního nebo klinicky významného gastrointestinálního krvácení v průběhu posledních 6 měsíců nebylo studováno. Pazopanib má být podáván s opatrností u pacientů s významným rizikem krvácení.
Gastrointestinální _perforace a _pištěl
V klinických studiích s pazopanibem se objevily gastrointestinální perforace nebo píštěle (viz bod 4.8). Vyskytly se fatální případy perforací. Pazopanib má být podáván pacientům s rizikem gastrointestinální perforace nebo vzniku píštělí s opatrností.
Hojení ran
Žádné formální studie účinku pazopanibu na hojení ran nebyly provedeny. Protože inhibitory VEGF (vascular endothelial growth factor - cévního endoteliálního růstového faktoru) mohou narušovat hojení ran, má být léčba pazopanibem ukončena alespoň 7 dní před plánovaným chirurgickým výkonem. Rozhodnutí o znovuzahájení léčby pazopanibem po chirurgickém výkonu má být založeno na klinickém zhodnocení dostatečného zhojení rány. Léčba pazopanibem má být u pacientů s dehiscencí rány přerušena.
Hypotyreóza
V klinických studiích s pazopanibem byly zaznamenány případy hypotyreózy (viz bod 4.8). Doporučuje se provést vstupní laboratorní vyšetření funkce štítné žlázy a pacienti s hypotyreózou mají být před zahájením léčby pazopanibem léčeni podle standardních lékařských postupů. Všichni pacienti by při léčbě pazopanibem měli být pečlivě klinicky sledováni, zda se u nich neobjevují známky a příznaky dysfunkce štítné žlázy. Je třeba opakovaně a v souladu se standardní lékařskou praxí provádět laboratorní monitorování funkce štítné žlázy.
Proteinurie
V klinických studiích s pazopanibem byly hlášeny případy proteinurie. Doporučuje se provést vstupní a opakované vyšetření moči v průběhu léčby a pacienti mají být sledováni, zda u nich nedochází ke zhoršení proteinurie. U pacientů s nefrotickým syndromem má být léčba pazopanibem ukončena.
V klinických studiích s pazopanibem u pokročilého sarkomu měkkých tkání se vyskytly případy pneumotoraxu (viz bod 4.8). Pacienti léčení pazopanibem mají být pečlivě monitorováni pro výskyt známek a příznaků pneumotoraxu.
Pediatrická _ populace
Protože mechanismus účinku pazopanibu může závažně ovlivnit růst a vývoj orgánů během časného postnatálního vývoje u hlodavců (viz bod 5.3), nemá být pazopanib podáván pediatrickým pacientům mladším než 2 roky.
Infekce
Byly hlášeny případy závažných infekcí (s neutropenií nebo bez neutropenie), v některých případech končící úmrtím.
Kombinace s _jinými systémovými _protinádorovými terapiemi
Klinické studie s pazopanibem v kombinaci s pemetrexedem [terapie nemalobuněčného karcinomu plic (non-small cell lung cancer (NSCLC)] a lapatinibem (terapie cervikálního karcinomu) byly ukončeny předčasně kvůli obavám ze vzrůstající toxicity a/nebo mortality a bezpečná a účinná dávka této kombinace nebyla v uvedených režimech stanovena.
Preklinické studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Pokud je pazopanib podáván v průběhu těhotenství, nebo pokud pacientka otěhotní během léčby pazopanibem, je nutné pacientce vysvětlit možná rizika pro plod. Ženy ve fertilním věku mají být poučeny, aby se v průběhu léčby pazopanibem vyvarovaly otěhotnění (viz bod 4.6).
Interakce
Vzhledem k možnému riziku zvýšení expozice pazopanibu je třeba se vyvarovat souběžné léčby silnými inhibitory CYP3A4, glykoproteinu P (P-gp) nebo BCRP (breast cancer resistance protein) (viz bod 4.5). Je třeba zvážit nasazení takových alternativních souběžně podávaných léčivých přípravků, které mají nulový nebo minimální potenciál inhibovat CYP3A4, P-gp nebo BCRP.
Vzhledem k riziku snížení expozice pazopanibu je třeba se vyvarovat souběžného podávání induktorů CYP3A4 (viz bod 4.5).
Při souběžné léčbě ketokonazolem byly pozorovány případy hyperglykémie.
Protože pazopanib je inhibitor UGT1A1, je při souběžném podávání pazopanibu a substrátů uridin difosfát-glukuronosyltransferázy 1A1 (UGT1A1) (např. irinotekan) nutno postupovat s opatrností (viz bod 4.5).
V průběhu léčby pazopanibem je nutné nepít grapefruitový džus (viz bod 4.5).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Účinky j jiných léčivých _přípravků na _pazopanib
Studie in vitro naznačují, že oxidativní metabolismus pazopanibu v lidských jaterních mikrozomech je zprostředkován primárně CYP3A4, s malým podílem CYP1A2 a CYP2C8. Proto mohou metabolismus pazopanibu ovlivňovat inhibitory i induktory CYP3A4.
Inhibitory CYP3A4, P-gp, BCRP:
Pazopanib je substrátem CYP3A4, P-gp a BCRP.
Současné podávání pazopanibu (400 mg jednou denně) a silného inhibitoru CYP3A4 a P-gp, ketokonazolu (400 mg jednou denně), po dobu 5 po sobě jdoucích dní vedlo k 66% zvýšení průměrné AUC(0-24) a 45% zvýšení průměrné Cmax pazopanibu v porovnání s podáváním samotného pazopanibu (400 mg jednou denně po 7 dní). Porovnání farmakokinetických parametrů pazopanibu Cmax (rozsah
27,5 až 58,1 pg/ml) a AUC(0-24) (rozsah 48,7 až 1040 pg*h/ml) po podání 800 mg samotného pazopanibu a po podání 400 mg pazopanibu plus 400 mg ketokonazolu (průměrná Cmax 59,2 pg/ml, průměrná AUC(0-24) 1300 pg*h/ml) ukázalo, že v přítomnosti silného inhibitoru CYP3A4 a P-gp vede snížení dávky pazopanibu na 400 mg jednou denně u většiny pacientů k systémové expozici srovnatelné s expozicí pozorovanou po podání 800 mg samotného pazopanibu jednou denně.
U některých pacientů však může být systémová expozice vyšší, než jaká je pozorována po podání 800 mg samotného pazopanibu.
Při společném podání pazopanibu s dalšími silnými inhibitory ze skupiny CYP3A4 (např. itrakonazol, klarithromycin, atazanavir, indinavir, nefazodon, nelfinavir, ritonavir, sachinavir, telithromycin, vorikonazol) může dojít ke zvýšení koncentrace pazopanibu. Grapefruitový džus obsahuje inhibitor CYP3A4 a může rovněž zvyšovat plazmatické koncentrace pazopanibu.
Podání 1500 mg lapatinibu (substrát a slabý inhibitor CYP3A4 a P-gp a silný inhibitor BCRP) s 800 mg pazopanibu vedlo k přibližně 50% až 60% zvýšení průměrné AUC(0-24) a Cmax pazopanibu v porovnání s podáním 800 mg pazopanibu samotného. Na zvýšení expozice pazopanibu se pravděpodobně podílela inhibice P-gp a/nebo BCRP lapatinibem.
Společné podání pazopanibu s inhibitorem CYP3A4, P-gp a BCRP, jako je např. lapatinib, povede ke zvýšení plazmatických koncentrací pazopanibu. Společné podání se silnými inhibitory P-gp nebo BCRP může rovněž ovlivnit expozici a distribuci pazopanibu, včetně distribuce do centrálního nervového systému (CNS).
Pazopanib nemá být podáván současně se silným inhibitorem CYP3A4 (viz bod 4.4). Pokud k léčbě silným inhibitorem CYP3A4 není dostupná alternativa akceptovatelná z lékařského hlediska, má být po dobu současného podávání dávka pazopanibu snížena na 400 mg denně. V takovém případě mají být pečlivě sledovány nežádoucí reakce, a pokud jsou pozorovány nežádoucí účinky, které mohou souviset s léčivou látkou, může být zváženo další snížení dávky.
Je třeba se vyvarovat kombinace se silnými inhibitory P-gp nebo BCRP, nebo se doporučuje zvolit alternativní souběžně podávané přípravky, které mají nulový nebo minimální potenciál inhibovat P-gp nebo BCRP.
Induktory CYP3A4, P-gp, BCRP:
Induktory CYP3A4, jako je např. rifampicin, mohou snižovat plazmatické koncentrace pazopanibu. Společné podávání pazopanibu se silnými induktory P-gp nebo BCRP může ovlivňovat expozici a distribuci pazopanibu, včetně distribuce do CNS. Je proto doporučeno zvolit alternativní souběžnou medikaci s nulovým nebo minimálním potenciálem indukovat enzymy nebo transportní systémy.
Ve studiích in vitro s lidskými jatemími mikrozomy bylo prokázáno, že pazopanib inhibuje enzymy CYP1A2, 3A4, 2B6, 2C8, 2C9, 2C19 a 2E1. Možná indukce CYP3A4 u člověka byla prokázána v testu in vitro s PXR. Klinické farmakologické studie s dávkou 800 mg pazopanibu jednou denně prokázaly, že pazopanib nemá u pacientů s karcinomem klinicky významné účinky na farmakokinetiku kofeinu (zkušební substrát CYP1A2), warfarinu (zkušební substrát CYP2C9) ani omeprazolu (zkušební substrát CYP2C19). Pazopanib měl za následek přibližně 30% zvýšení střední AUC a Cmax midazolamu (zkušební substrát CYP3A4) a 33% až 64% zvýšení poměru koncentrací dextromethorfanu k dextrorfanu v moči po perorálním podání dextromethorfanu (zkušební substrát CYP2D6). Společné podávání pazopanibu 800 mg jednou denně a paklitaxelu 80 mg/m2 (substrát CYP3A4 a CYP2C8) jednou týdně vedlo k střednímu zvýšení AUC paklitaxelu o 25 % a Cmax paklitaxelu o 31 %.
Na základě hodnot IC50 in vitro a plazmatické Cmax in vivo lze usoudit, že metabolity pazopanibu GSK1268992 a GSK1268997 se mohou podílet na čistém inhibičním účinku pazopanibu vůči BCRP. Kromě toho nemůže být vyloučena inhibice BCRP a P-gp pazopanibem v gastrointestinálním traktu. Pokud je pazopanib podáván společně s dalšími perorálními substráty BCRP a P-gp, je třeba postupovat s opatrností.
In vitro pazopanib inhibuje lidské organické aniontové transportní polypeptidy (OATP1B1). Nelze vyloučit, že pazopanib bude ovlivňovat farmakokinetiku substrátů OATP1B1 (např. statinů, viz „Účinky současného užívání pazopanibu a simvastatinu“ níže).
Pazopanib je in vitro inhibitorem enzymu uridin difosfát-glukuronosyltransferázy 1A1 (UGT1A1). Účinný metabolit irinotekanu, SN-38, je substrátem enzymů OATP1B1 a UGT1A1. Podávání 400 mg pazopanibu jednou denně zároveň s 250 mg/m2 cetuximabu a 150 mg/m2 irinotekanu vedlo k přibližně 20% zvýšení systémové expozice SN-38. Pazopanib může mít větší vliv na dispozici SN-38 u osob s polymorfismem UGT1A1*28 než u osob s divokou (wild type) alelou. Podle genotypu UGT1A1 však nebylo vždy možné předpovědět vliv pazopanibu na dispozici SN-38. Při současném podávání pazopanibu a substrátů UGT1A1 je třeba postupovat s opatrností.
Účinky současného užívání _pazopanibu a simvastatinu
Současné užívání pazopanibu a simvastatinu zvyšuje výskyt zvýšené hladiny ALT. Výsledky metaanalýz souhrnných údajů z klinických studií s pazopanibem ukazují, že zvýšení ALT> 3 x ULN bylo hlášeno u 126/895 (14 %) pacientů, kteří neužívali statiny, v porovnání s 11/41 (27 %) pacientů, kteří užívali zároveň simvastatin (p = 0,038). Jestliže u pacienta užívajícího zároveň simvastatin dojede ke zvýšení hladiny ALT, je zapotřebí postupovat podle pokynů týkajících se dávkování pazopanibu a léčbu simvastatinem ukončit (viz bod 4.4). Také současné užívání pazopanibu a jiných statinů má probíhat s opatrností, protože v současné době není k dispozici dostatek údajů, které by umožnily vyhodnotit jejich vliv na hladiny ALT. Nelze vyloučit, že pazopanib ovlivňuje farmakokinetiku jiných statinů (např. atorvastatinu, fluvastatinu, pravastatinu, rosuvastatinu).
Účinky j jídla na _pazopanib
Podávání pazopanibu s tučným nebo méně tučným jídlem vede k přibližně 2násobnému zvýšení AUC a Cmax. Proto by pazopanib měl být podáván alespoň 1 hodinu před jídlem nebo 2 hodiny po jídle.
Léky zvyšující žaludeční pH
Současné podávání pazopanibu s esomeprazolem snižuje biologickou dostupnost pazopanibu přibližně o 40 % (AUC a Cmax). Je zapotřebí se vyhnout souběžnému podávání pazopanibu s léky zvyšujícími žaludeční pH. Pokud je z lékařského hlediska nezbytné současné podávání pazopanibu s inhibitory protonové pumpy (proton-pump inhibitor, PPI), doporučuje se užívat dávku pazopanibu nalačno jednou denně večer společně s dávkou PPI. Pokud je z lékařského hlediska nezbytné současné podávání pazopanibu s antagonistou H2-receptoru, má být pazopanib užit nalačno nejméně 2 hodiny
před užitím nebo nejméně 10 hodin po užití dávky antagonisty H2-receptoru. Pazopanib má být podán nejméně 1 hodinu před podáním nebo 2 hodiny po podání krátkodobě působících antacid. Doporučení týkající se současného podávání PPI a antagonistů H2-receptoru vycházejí z fyziologického posouzení.
4.6 Fertilita, těhotenství a kojení
Adekvátní údaje o podávání pazopanibu těhotným ženám nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Možné riziko pro člověka není známo.
Pazopanib lze v těhotenství podat pouze v případě, že klinický stav ženy vyžaduje léčbu pazopanibem. Pokud je pazopanib podáván v průběhu těhotenství, nebo pokud pacientka během podávání pazopanibu otěhotní, je potřeba jí vysvětlit možné riziko pro plod.
Ženy ve fertilním věku by měly být poučeny, aby v průběhu léčby pazopanibem a nejméně 2 týdny po jejím ukončení užívaly vhodnou metodu antikoncepce a vyvarovaly se otěhotnění.
Kojení
Bezpečnost pazopanibu v průběhu kojení nebyla stanovena. Není známo, zda se pazopanib vylučuje do lidského mateřského mléka. O vylučování pazopanibu do mateřského mléka u zvířat nejsou k dispozici žádné údaje. Riziko pro kojené dítě nelze vyloučit. V průběhu léčby pazopanibem by mělo být kojení přerušeno.
Fertilita
Studie na zvířatech naznačují, že fertilita samců a samic může být léčbou pazopanibem ovlivněna (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie hodnotící účinky na schopnost řídit a obsluhovat stroje. Škodlivý účinek na tyto činnosti nelze z farmakologie pazopanibu předem určit. Při posuzování pacientovy schopnosti provádět úkony, které vyžadují rozhodovací, motorické nebo kognitivní schopnosti, je třeba vzít v úvahu klinický stav pacienta a profil nežádoucích účinků pazopanibu. Pacienti by neměli řídit a obsluhovat stroje, pokud pociťují závrať, jsou unavení nebo slabí.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
V celkovém hodnocení bezpečnosti a snášenlivosti pazopanibu (celkem n = 1149) u subjektů s RCC byly hodnoceny souhrnné údaje z pivotní studie RCC (VEG105192, n = 290), rozšířené studie (VEG107769, n = 71), podpůrné studie fáze II (VEG102616, n = 225) a randomizované, otevřené studie fáze III s paralelními skupinami k prokázání non-inferiority (VEG108844, n = 557) (viz
bod 5.1).
V celkovém hodnocení bezpečnosti a snášenlivosti pazopanibu (celková populace pro hodnocení bezpečnosti n = 382) u subjektů s STS byly hodnoceny souhrnné údaje z pivotní STS studie (VEG110727, n = 369) a podpůrné studie fáze II (VEG20002, n = 142) (viz bod 5.1).
Nejdůležitějšími závažnými nežádoucími účinky zaznamenanými v RCC nebo STS studiích byly tranzitorní ischemická ataka, ischemická cévní mozková příhoda, ischemie myokardu, infarkt myokardu, cévní mozková příhoda, kardiální dysfunkce, gastrointestinální perforace a píštěl, prodloužení QT intervalu a plicní, gastrointestinální a cerebrální krvácení. Všechny tyto nežádoucí účinky byly hlášeny u méně než 1 % léčených pacientů. Další významné závažné nežádoucí účinky
zaznamenané v STS studiích zahrnovaly žilní tromboembolické příhody, dysfunkci levé komory a pneumotorax.
Nežádoucí účinky, které vedly k úmrtí a které pravděpodobně souvisely s léčbou pazopanibem, zahrnovaly gastrointestinální krvácení, plicní krvácení/hemoptýzu, abnormální jaterní funkce, střevní perforaci nebo ischemickou cévní mozkovou příhodu.
Nejčastějšími nežádoucími účinky (které se objevily alespoň u 10 % pacientů) jakéhokoli stupně v RCC a STS studiích byly: průjem, změna barvy vlasů, hypopigmentace kůže, exfoliativní vyrážka, hypertenze, nauzea, bolest hlavy, únava, anorexie, zvracení, dysgeuzie, stomatitida, snížení tělesné hmotnosti, bolest, zvýšení hladiny alaninaminotransferázy a zvýšení hladiny aspartátaminotransferázy.
Nežádoucí účinky související s léčbou přípravkem (všech stupňů), které byly hlášeny u pacientů s RCC a STS nebo v průběhu postmarketingového sledování, jsou shrnuty níže podle MedDRA tříd orgánových systémů, frekvence a stupně závažnosti. Pro stanovení frekvence byla použita následující konvence:
Velmi časté Časté
Méně časté Vzácné Velmi vzácné Není známo
> 1/10
> 1/100 až < 1/10
> 1/1 000 až < 1/100
> 1/10 000 až < 1/1 000 < 1/10 000
(z dostupných údajů nelze určit)
Kategorie byly určeny podle absolutní frekvence z údajů v klinických studiích. Vyhodnoceny byly rovněž postmarketingové údaje týkající se bezpečnosti a snášenlivosti získané v rámci všech klinických studií a ze spontánních hlášení. V každé třídě orgánových systémů jsou nežádoucí účinky stejné frekvence řazeny podle klesající závažnosti.
Tabulkový seznam nežádoucích účinků
Tabulka 2: Nežádoucí účinky související s léčbou přípravkem hlášené ve studiích RCC (n = 1149) nebo během postmarketingového období
|
Třídy orgánových systémů |
Frekvence (všechny stupně) |
Nežádoucí účinky |
Všechny stupně n (%) |
Stupeň 3 n (%) |
Stupeň 4 n (%) |
|
Infekce a infestace |
Méně časté |
Infekce (s neutropenií nebo bez neutropenie) Ť |
není známo |
není známo |
není známo |
|
Méně časté |
Infekce dásní |
1 (< 1 %) |
0 |
0 | |
|
Méně časté |
Infekční peritonitida |
1 (< 1 %) |
0 |
0 | |
|
Novotvary benigní, maligní a blíže neurčené (zahrnující cysty a polypy) |
Méně časté |
Nádorová bolest |
1 (< 1 %) |
1 (< 1 %) |
0 |
|
Časté |
T rombocytopenie |
80 (7 %) |
10 (< 1 %) |
5 (< 1 %) | |
|
Časté |
Neutropenie |
79 (7 %) |
20 (2 %) |
4 (< 1 %) | |
|
Časté |
Leukopenie |
63 (5 %) |
5 (< 1 %) |
0 | |
|
Poruchy krve a lymfatického systému |
Vzácné |
Trombotická mikroangiopatie (včetně trombotické trombocytopenické purpury a hemolyticko-uremického syndromu)f |
není známo |
není známo |
není známo |
|
Endokrinní poruchy |
Časté |
Hypotyreóza |
83 (7 %) |
1 (< 1 %) |
0 |
|
Velmi časté |
Snížení chuti k jídlue |
317 (28 %) |
14 (1 %) |
0 | |
|
Časté |
Hypofosfatemie |
21 (2 %) |
7 (< 1 %) |
0 | |
|
Poruchy metabolismu a výživy |
Časté |
Dehydratace |
16 (1 %) |
5 (< 1 %) |
0 |
|
Méně časté |
Hypomagnesemie |
10 (< 1 %) |
0 |
0 | |
|
Psychiatrické poruchy |
Časté |
Insomnie |
30 (3 %) |
0 |
0 |
|
Velmi časté |
Dysgeuziec |
254 (22 %) |
1 (< 1 %) |
0 | |
|
Velmi časté |
122 (11%) |
11 (< 1 %) |
0 | ||
|
Časté |
Závratě |
55 (5 %) |
3 (< 1 %) |
1 (< 1 %) | |
|
Časté |
Letargie |
30 (3 %) |
3 (< 1 %) |
0 | |
|
Časté |
Parestezie |
20 (2 %) |
2 (< 1 %) |
0 | |
|
Časté |
Periferní senzorická neuropatie |
17 (1 %) |
0 |
0 | |
|
Méně časté |
Hypestézie |
8 (< 1 %) |
0 |
0 | |
|
Poruchy nervového systému |
Méně časté |
Tranzitorní ischemická ataka |
7 (< 1 %) |
4 (< 1 %) |
0 |
|
Méně časté |
Somnolence |
3 (< 1 %) |
1 (< 1 %) |
0 | |
|
Méně časté |
Cerebrovaskulární příhoda |
2 (< 1 %) |
1 (< 1 %) |
1 (< 1 %) | |
|
Méně časté |
Ischemická cévní mozková příhoda |
2 (< 1 %) |
0 |
1 (< 1 %) | |
|
Vzácné |
Zadní reverzibilní encefalopatie / syndrom zadní reverzibilní leukoencefalopatief |
není známo |
není známo |
není známo | |
|
Časté |
Rozostřené vidění |
19 (2 %) |
1 (< 1 %) |
0 | |
|
Poruchy oka |
Méně časté |
Odchlípení sítnicef |
1 (< 1 %) |
1 (< 1 %) |
0 |
|
Méně časté |
Trhlina v sítnicif |
1 (< 1 %) |
1 (< 1 %) |
0 | |
|
Méně časté |
Změna barvy řas |
4 (< 1 %) |
0 |
0 | |
|
Méně časté |
Bradykardie |
6 (< 1 %) |
0 |
0 | |
|
Srdeční poruchy |
Méně časté |
Infarkt myokardu |
5 (< 1 %) |
1 (< 1 %) |
4 (< 1 %) |
|
Méně časté |
Kardiální dysfunkcef |
4 (< 1 %) |
1 (< 1 %) |
0 | |
|
Méně časté |
Ischémie myokardu |
3 (< 1 %) |
1 (< 1 %) |
0 |
|
Cévní poruchy |
Velmi časté |
Hypertenze |
473 (41 %) |
115 (10 %) |
1 (< 1 %) |
|
Časté |
16 (1 %) |
0 |
0 | ||
|
Časté |
Žilní tromboembolická příhoda8 |
13 (1 %) |
6 (< 1 %) |
7 (< 1 %) | |
|
Časté |
Návaly horka se zrudnutím |
12 (1 %) |
0 |
0 | |
|
Méně časté |
Hypertenzní krize |
6 (< 1 %) |
0 |
2 (< 1 %) | |
|
Méně časté |
Krvácení |
1 (< 1 %) |
0 |
0 | |
|
Respirační, hrudní a mediastinální poruchy |
Časté |
Epistaxe |
50 (4 %) |
1 (< 1 %) |
0 |
|
Časté |
Dysfonie |
48 (4 %) |
0 |
0 | |
|
Časté |
42 (4 %) |
8 (< 1 %) |
1 (< 1 %) | ||
|
Časté |
Hemoptýza |
15 (1 %) |
1 (< 1 %) |
0 | |
|
Méně časté |
Výtok z nosu |
8 (< 1 %) |
0 |
0 | |
|
Méně časté |
Plicní krvácení |
2 (< 1 %) |
0 |
0 | |
|
Méně časté |
1 (< 1 %) |
0 |
0 | ||
|
Vzácné |
Intersticiální plicní nemoc/pneumonitidaf |
není známo |
není známo |
není známo | |
|
Gastrointestinální poruchy |
Velmi časté |
614 (53 %) |
65 (6 %) |
2 (< 1 %) | |
|
Velmi časté |
386 (34 %) |
14 (1%) |
0 | ||
|
Velmi časté |
225 (20 %) |
18 (2 %) |
1 (< 1 %) | ||
|
Velmi časté |
139 (12 %) |
15 (1 %) |
0 | ||
|
Časté |
Stomatitida |
96 (8 %) |
4 (< 1 %) |
0 | |
|
Časté |
83 (7 %) |
2 (< 1 %) |
0 | ||
|
Časté |
Flatulence |
43 (4 %) |
0 |
0 | |
|
Časté |
Abdominální distenze |
36 (3 %) |
2 (< 1 %) |
0 | |
|
Časté |
Vředy v ústech |
28 (2 %) |
3 (< 1 %) |
0 | |
|
Časté |
Sucho v ústech |
27 (2 %) |
0 |
0 | |
|
Méně časté |
Pankreatitida |
8 (< 1 %) |
4 (< 1 %) |
0 | |
|
Méně časté |
Rektální krvácení |
8 (< 1 %) |
2 (< 1 %) |
0 | |
|
Méně časté |
Hematochezie |
6 (< 1 %) |
0 |
0 | |
|
Méně časté |
Gastrointestinální krvácení |
4 (< 1 %) |
2 (< 1 %) |
0 | |
|
Méně časté |
Melena |
4 (< 1 %) |
1(< 1 %) |
0 | |
|
Méně časté |
Zvýšená střevní peristaltika |
3 (< 1 %) |
0 |
0 | |
|
Méně časté |
Anální krvácení |
2 (< 1 %) |
0 |
0 | |
|
Méně časté |
Perforace tlustého střeva |
2 (< 1 %) |
1 (< 1 %) |
0 | |
|
Méně časté |
Krvácení v ústech |
2 (< 1 %) |
0 |
0 | |
|
Méně časté |
Krvácení do horního gastrointestinálního traktu |
2 (< 1 %) |
1 (< 1 %) |
0 | |
|
Méně časté |
Enterokutánní pištěl |
1 (< 1 %) |
0 |
0 | |
|
Méně časté |
Hematemeza |
1 (< 1 %) |
0 |
0 | |
|
Méně časté |
Krvácení z hemoroidů |
1 (< 1 %) |
0 |
0 | |
|
Méně časté |
Perforace ilea |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Méně časté |
Jícnové krvácení |
1 (< 1 %) |
0 |
0 | |
|
Méně časté |
Retroperitoneální krvácení |
1 (< 1 %) |
0 |
0 |
|
Poruchy jater a žlučových cest |
Časté |
Hyperbilirubinémie |
38 (3 %) |
2 (< 1 %) |
1 (< 1 %) |
|
Časté |
Porucha j aterních funkcí |
29 (3 %) |
13 (1 %) |
2 (< 1 %) | |
|
Časté |
Hepatotoxicita |
18 (2 %) |
11(< 1 %) |
2 (< 1 %) | |
|
Méně časté |
Ikterus |
3 (< 1 %) |
1 (< 1 %) |
0 | |
|
Méně časté |
Poškození jater způsobené léky |
2 (< 1 %) |
2 (< 1 %) |
0 | |
|
Méně časté |
Jaterní selhání |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Poruchy kůže a podkožní tkáně |
Velmi časté |
Změna barvy vlasů |
404 (35 %) |
1 (< 1 %) |
0 |
|
Velmi časté |
Syndrom palmo- plantární erytrodysestezie |
206 (18 %) |
39 (3 %) |
0 | |
|
Velmi časté |
Alopecie |
130 (11%) |
0 |
0 | |
|
Velmi časté |
129 (11%) |
7 (< 1 %) |
0 | ||
|
Časté |
Hypopigmentace kůže |
52 (5 %) |
0 |
0 | |
|
Časté |
Suchá kůže |
50 (4 %) |
0 |
0 | |
|
Časté |
Pruritus |
29 (3 %) |
0 |
0 | |
|
Časté |
Erytém |
25 (2 %) |
0 |
0 | |
|
Časté |
Depigmentace kůže |
20 (2 %) |
0 |
0 | |
|
Časté |
Hyperhidróza |
17 (1 %) |
0 |
0 | |
|
Méně časté |
Poruchy nehtů |
11 (< 1 %) |
0 |
0 | |
|
Méně časté |
Exfoliace kůže |
10 (< 1 %) |
0 |
0 | |
|
Méně časté |
Fotosenzitivní reakce |
7 (< 1 %) |
0 |
0 | |
|
Méně časté |
Erytematózní vyrážka |
6 (< 1 %) |
0 |
0 | |
|
Méně časté |
Poruchy kůže |
5 (< 1 %) |
0 |
0 | |
|
Méně časté |
Makulární vyrážka |
4 (< 1 %) |
0 |
0 | |
|
Méně časté |
Svědící vyrážka |
3 (< 1 %) |
0 |
0 | |
|
Méně časté |
Vezikulární vyrážka |
3 (< 1 %) |
0 |
0 | |
|
Méně časté |
Generalizovaný pruritus |
2 (< 1 %) |
1 (< 1 %) |
0 | |
|
Méně časté |
Generalizovaná |
2 (< 1 %) |
0 |
0 | |
|
Méně časté |
Papulózní vyrážka |
2 (< 1 %) |
0 |
0 | |
|
Méně časté |
Plantární erytém |
1 (< 1 %) |
0 |
0 | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Časté |
Artralgie |
48 (4 %) |
8 (< 1 %) |
0 |
|
Časté |
Myalgie |
35 (3 %) |
2 (< 1 %) |
0 | |
|
Časté |
Svalové spasmy |
25 (2 %) |
0 |
0 | |
|
Méně časté |
Muskuloskeletální bolest |
9 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poruchy ledvin a močových cest |
Velmi časté |
Proteinurie |
135 (12 %) |
32 (3 %) |
0 |
|
Méně časté |
Krvácení do močových cest |
1 (< 1 %) |
0 |
0 | |
|
Poruchy reprodukčního systému a prsu |
Méně časté |
Menoragie |
3 (< 1 %) |
0 |
0 |
|
Méně časté |
Vaginální krvácení |
3 (< 1 %) |
0 |
0 | |
|
Méně časté |
Metroragie |
1 (< 1 %) |
0 |
0 | |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Únava |
415 (36 %) |
65 (6 %) |
1 (< 1 %) |
|
Časté |
Zánět sliznic |
86 (7 %) |
5 (< 1 %) |
0 | |
|
Časté |
Astenie |
82 (7 %) |
20 (2 %) |
1 (< 1 %) | |
|
Časté |
Otokb |
72 (6 %) |
1 (< 1 %) |
0 | |
|
Časté |
18 (2 %) |
2 (< 1 %) |
0 | ||
|
Méně časté |
4 (< 1 %) |
0 |
0 | ||
|
Méně časté |
Onemocnění sliznice |
1 (< 1 %) |
0 |
0 |
|
Vyšetření |
Velmi časté |
Zvýšení hladiny ALT |
246 (21 %) |
84 (7 %) |
14 (1 %) |
|
Velmi časté |
Zvýšení hladiny AST |
211 (18%) |
51 (4 %) |
10 (< 1 %) | |
|
Časté |
Snížení tělesné hmotnosti |
96 (8 %) |
7 (< 1 %) |
0 | |
|
Časté |
Zvýšení hladiny bilirubinu v krvi |
61 (5 %) |
6 (< 1 %) |
1 (< 1 %) | |
|
Časté |
Zvýšení hladiny kreatininu v krvi |
55 (5 %) |
3 (< 1 %) |
0 | |
|
Časté |
Zvýšení lipázy |
51 (4 %) |
21 (2 %) |
7 (< 1 %) | |
|
Časté |
Snížení počtu bílých krvinekd |
51 (4 %) |
3 (< 1 %) |
0 | |
|
Časté |
Zvýšení TSH v krvi |
36 (3 %) |
0 |
0 | |
|
Časté |
Zvýšení hladiny amylázy |
35 (3 %) |
7 (< 1 %) |
0 | |
|
Časté |
Zvýšení GMT |
31 (3 %) |
9 (< 1 %) |
4 (< 1 %) | |
|
Časté |
Zvýšení krevního tlaku |
15 (1 %) |
2 (< 1 %) |
0 | |
|
Časté |
Zvýšení urey v krvi |
12 (1 %) |
1 (< 1 %) |
0 | |
|
Časté |
Abnormální výsledky vyšetření jaterních funkcí |
12 (1 %) |
6 (< 1 %) |
1 (< 1 %) | |
|
Méně časté |
Zvýšení jaterních enzymů |
11 (< 1 %) |
4 (< 1 %) |
3 (< 1 %) | |
|
Méně časté |
Pokles hladiny glukózy v krvi |
7 (< 1 %) |
0 |
1 (< 1 %) | |
|
Méně časté |
Prodloužení QT intervalu |
7 (< 1 %) |
2 (< 1 %) |
0 | |
|
Méně časté |
Zvýšení hladin transamináz |
7 (< 1 %) |
1 (< 1 %) |
0 | |
|
Méně časté |
Abnormální výsledky vyšetření funkce štítné žlázy |
3 (< 1 %) |
0 |
0 | |
|
Méně časté |
Zvýšení diastolického krevního tlaku |
2 (< 1 %) |
0 |
0 | |
|
Méně časté |
Zvýšení systolického krevního tlaku |
1 (< 1 %) |
0 |
0 |
fNežádoucí účinky související s léčbou hlášené během postmarketingového období (spontánní hlášení a hlášení závažných nežádoucích účinků ze všech klinických studií s pazopanibem).
Následující termíny byly sloučeny:
a Bolest břicha, bolest horní části břicha a bolest dolní části břicha b Otok, periferní otok, otok oka, lokalizovaný otok a otok obličeje c Dysgeuzie, ageuzie a hypogeuzie
d Snížení počtu bílých krvinek, snížení počtu neutrofilů a snížení počtu leukocytů e Ztráta chuti k jídlu a anorexie
f Kardiální dysfunkce, dysfunkce levé komory, srdeční selhání a restriktivní kardiomyopatie g Žilní tromboembolická příhoda, hluboká žilní trombóza, plicní embolie a trombóza
Neutropenie, trombocytopenie a syndrom palmo-plantární erytrodysestézie byly častěji pozorovány u pacientů východoasijského původu.
Tabulka 3: Nežádoucí účinky související s léčbou přípravkem hlášené ve studiích STS (n = 382)
|
Třídy orgánových systémů |
Frekvence (všechny stupně) |
Nežádoucí účinky |
Všechny stupně n (%) |
Stupeň 3 n (%) |
Stupeň 4 n (%) |
|
Infekce a infestace |
Časté |
Infekce dásní |
4 (1 %) |
0 |
0 |
|
Novotvary benigní, maligní a blíže neurčené (zahrnující cysty a polypy) |
Velmi časté |
Nádorová bolest |
121 (32 %) |
32 (8 %) |
0 |
|
Poruchy krve a lymfatického systému |
Velmi časté |
Leukopenie |
106 (44 %) |
3 (1 %) |
0 |
|
Velmi časté |
T rombocytopenie |
86 (36 %) |
7 (3 %) |
2 (< 1 %) | |
|
Velmi časté |
Neutropenie |
79 (33 %) |
10 (4 %) |
0 | |
|
Méně časté |
Trombotická mikroangiopatie (včetně trombotické trombocytopenické purpury a hemolytického uremického syndromu)! |
1 (< 1 %) |
1 (< 1 %) |
0 | |
|
Endokrinní poruchy |
Časté |
Hypotyreóza |
18 (5 %) |
0 |
0 |
|
Poruchy metabolismu a výživy |
Velmi časté |
Snížení chuti k jídlu |
108 (28 %) |
12 (3 %) |
0 |
|
Velmi časté |
Hypoalbuminemie |
81 (34 %) |
2 (< 1 %) |
0 | |
|
Časté |
Dehydratace |
4 (1 %) |
2 (1 %) |
0 | |
|
Méně časté |
Hypomagnesemie |
1 (< 1 %) |
0 |
0 | |
|
Psychiatrické poruchy |
Časté |
Insomnie |
5 (1 %) |
1 (< 1 %) |
0 |
|
Poruchy nervového systému |
Velmi časté |
Dysgeuzie |
79 (21 %) |
0 |
0 |
|
Velmi časté |
54 (14 %) |
2 (< 1 %) |
0 | ||
|
Časté |
Periferní senzorická neuropatie |
30 (8 %) |
1 (< 1 %) |
0 | |
|
Časté |
Závratě |
15 (4 %) |
0 |
0 | |
|
Méně časté |
Somnolence |
3 (< 1 %) |
0 |
0 | |
|
Méně časté |
Parestezie |
1 (< 1 %) |
0 |
0 | |
|
Méně časté |
Cévní mozková příhoda |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Poruchy oka |
Časté |
Rozostřené vidění |
15 (4 %) |
0 |
0 |
|
Srdeční poruchy |
Časté |
Kardiální dysfunkce8 |
21 (5 %) |
3 (< 1 %) |
1 (< 1 %) |
|
Časté |
Dysfunkce levé komory |
13 (3 %) |
3 (< 1 %) |
0 | |
|
Časté |
Bradykardie |
4 (1 %) |
0 |
0 | |
|
Méně časté |
Infarkt myokardu |
1 (< 1 %) |
0 |
0 | |
|
Cévní poruchy |
Velmi časté |
Hypertenze |
152 (40 %) |
26 (7 %) |
0 |
|
Časté |
Žilní tromboembolické příhodyd |
13 (3 %) |
4 (1 %) |
5 (1 %) | |
|
Časté |
12 (3 %) |
0 |
0 | ||
|
Časté |
Návaly horka se zrudnutím |
4 (1 %) |
0 |
0 | |
|
Méně časté |
Krvácení |
2 (< 1 %) |
1 (< 1 %) |
0 |
|
Respirační, hrudní a mediastinální poruchy |
Časté |
Epistaxe |
22 (6 %) |
0 |
0 |
|
Časté |
Dysfonie |
20 (5 %) |
0 |
0 | |
|
Časté |
14 (4 %) |
3 (< 1 %) |
0 | ||
|
Časté |
12 (3 %) |
0 |
0 | ||
|
Časté |
7 (2 %) |
2 (< 1 %) |
1 (< 1 %) | ||
|
Časté |
Škytavka |
4 (1 %) |
0 |
0 | |
|
Časté |
Plicní krvácení |
4 (1 %) |
1 (< 1 %) |
0 | |
|
Méně časté |
Orofaryngeální bolest |
3 (< 1 %) |
0 |
0 | |
|
Méně časté |
Bronchiální krvácení |
2 (< 1 %) |
0 |
0 | |
|
Méně časté |
Výtok z nosu |
1 (< 1 %) |
0 |
0 | |
|
Méně časté |
Hemoptýza |
1 (< 1 %) |
0 |
0 | |
|
Vzácné |
Intersticiální plicní nemoc/pneumonitidaf |
není známo |
není známo |
není známo | |
|
Gastrointestinální poruchy |
Velmi časté |
174 (46 %) |
17 (4 %) |
0 | |
|
Velmi časté |
167 (44 %) |
8 (2 %) |
0 | ||
|
Velmi časté |
96 (25 %) |
7 (2 %) |
0 | ||
|
Velmi časté |
55 (14 %) |
4 (1 %) |
0 | ||
|
Velmi časté |
Stomatitida |
41 (11 %) |
1 (< 1 %) |
0 | |
|
Časté |
Abdominální distenze |
16 (4 %) |
2 (1 %) |
0 | |
|
Časté |
Sucho v ústech |
14 (4 %) |
0 |
0 | |
|
Časté |
12 (3 %) |
0 |
0 | ||
|
Časté |
Krvácení z úst |
5 (1 %) |
0 |
0 | |
|
Časté |
Flatulence |
5 (1 %) |
0 |
0 | |
|
Časté |
Anální krvácení |
4 (1 %) |
0 |
0 | |
|
Méně časté |
Gastrointestinální krvácení |
2 (< 1 %) |
0 |
0 | |
|
Méně časté |
Rektální krvácení |
2 (< 1 %) |
0 |
0 | |
|
Méně časté |
Enterokutánní pištěl |
1 (< 1 %) |
1 (< 1 %) |
0 | |
|
Méně časté |
Žaludeční krvácení |
1 (< 1 %) |
0 |
0 | |
|
Méně časté |
Melena |
2 (< 1 %) |
0 |
0 | |
|
Méně časté |
Jícnové krvácení |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Méně časté |
Peritonitida |
1 (< 1 %) |
0 |
0 | |
|
Méně časté |
Retroperitoneální krvácení |
1 (< 1 %) |
0 |
0 | |
|
Méně časté |
Krvácení do horního gastrointestinálního traktu |
1 (< 1 %) |
1 (< 1 %) |
0 | |
|
Méně časté |
Perforace ilea |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Poruchy jater a žlučových cest |
Méně časté |
Porucha j aterních funkcí |
2 (< 1 %) |
0 |
1 (< 1 %) |
|
Poruchy kůže a podkožní tkáně |
Velmi časté |
Změna barvy vlasů |
93 (24 %) |
0 |
0 |
|
Velmi časté |
Hypopigmentace kůže |
80 (21 %) |
0 |
0 | |
|
Velmi časté |
Exfoliativní vyrážka |
52 (14 %) |
2 (< 1 %) |
0 | |
|
Časté |
Alopecie |
30 (8 %) |
0 |
0 | |
|
Časté |
Poruchy kůžec |
26 (7 %) |
4 (1 %) |
0 | |
|
Časté |
Suchá kůže |
21 (5 %) |
0 |
0 | |
|
Časté |
Hyperhidróza |
18 (5 %) |
0 |
0 | |
|
Časté |
Poruchy nehtů |
13 (3 %) |
0 |
0 | |
|
Časté |
Pruritus |
11 (3 %) |
0 |
0 | |
|
Časté |
Erytém |
4 (1 %) |
0 |
0 | |
|
Méně časté |
Kožní vřed |
3 (< 1 %) |
1 (< 1 %) |
0 | |
|
Méně časté |
1 (< 1 %) |
0 |
0 | ||
|
Méně časté |
Papulární vyrážka |
1 (< 1 %) |
0 |
0 | |
|
Méně časté |
Fotosenzitivní reakce |
1 (< 1 %) |
0 |
0 | |
|
Méně časté |
Syndrom palmo- plantární erytrodysestezie |
2 (<1 %) |
0 |
0 | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Časté |
Muskuloskeletální bolest |
35 (9 %) |
2 (< 1 %) |
0 |
|
Časté |
Myalgie |
28 (7 %) |
2 (< 1 %) |
0 | |
|
Časté |
Svalové spazmy |
8 (2 %) |
0 |
0 | |
|
Méně časté |
Artralgie |
2 (< 1 %) |
0 |
0 | |
|
Poruchy ledvin a močových cest |
Méně časté |
Proteinurie |
2 (<1 %) |
0 |
0 |
|
Poruchy reprodukčního systému a prsu |
Méně časté |
Vaginální krvácení |
3 (< 1 %) |
0 |
0 |
|
Méně časté |
Menoragie |
1 (< 1 %) |
0 |
0 | |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Únava |
178 (47 %) |
34 (9 %) |
1 (< 1 %) |
|
Časté |
Otokb |
18 (5 %) |
1 (< 1 %) |
0 | |
|
Časté |
12 (3 %) |
4 (1 %) |
0 | ||
|
Časté |
10 (3 %) |
0 |
0 | ||
|
Méně časté |
Zánět sliznice |
1 (<1 %) |
0 |
0 | |
|
Méně časté |
Astenie |
1 (< 1 % |
0 |
0 |
|
Vyšetření |
Velmi časté |
Snížení tělesné hmotnosti |
86 (23 %) |
5 (1 %) |
0 |
|
Časté |
Abnormální výsledky vyšetření uší, nosu a krkue |
29 (8 %) |
4 (1 %) |
0 | |
|
Časté |
Zvýšení hladiny ALT |
8 (2 %) |
4 (1 %) |
2 (< 1 %) | |
|
Časté |
Abnormální cholesterol v krvi |
6 (2 %) |
0 |
0 | |
|
Časté |
Zvýšení hladiny AST |
5 (1 %) |
2 (< 1 %) |
2 (< 1 %) | |
|
Časté |
Zvýšení hladiny GMT |
4 (1 %) |
0 |
3 (< 1 %) | |
|
Méně časté |
Zvýšení hladiny bilirubinu v krvi |
2 (<1 %) |
0 |
0 | |
|
Méně časté |
Zvýšení hladiny AST |
2 (< 1 %) |
0 |
2 (< 1 %) | |
|
Méně časté |
Zvýšení hladiny ALT |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Méně časté |
Snížení počtu trombocytů |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Méně časté |
Prodloužení QT na EKG |
2 (< 1 %) |
1 (< 1 %) |
0 |
f Nežádoucí účinek v souvislosti s léčbou hlášen v postmaketingovém období (spontánní hlášení a závažné nežádoucí účinky ze všech klinických studií s pazopanibem).
Následující termíny byly sloučeny:
a Bolest břicha, bolest horní části břicha a gastrointestinální bolest b Otok, periferní otok a otok očních víček
c Většina těchto případů byl syndrom palmo-plantární erytrodysestezie
d Žilní tromboembolické příhody - zahrnují termíny hluboká žilní trombóza, plicní trombóza a trombóza e Většina těchto případů popisuje mukozitidu
f Četnost vychází z tabulek laboratorních hodnot ze studie VEG110727 (N = 240). Tyto nežádoucí účinky byly zkoušejícími hlášeny méně často, než vyplývá z tabulek laboratorních hodnot.
g Případy kardiální dysfunkce - zahrnují dysfunkci levé komory, srdeční selhání a restriktivní kardiomyopatii h Četnost vychází z hlášení nežádoucích účinků zkoušejícími. Abnormální laboratorní výsledky byly jako nežádoucí účinky hlášeny zkoušejícími méně často než vyplývá z tabulek laboratorních hodnot.
Neutropenie, trombocytopenie a syndrom palmo-plantární erytrodysestézie byly častěji pozorovány u pacientů východoasijského původu.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V.
4.9 Předávkování
V klinických studiích byl pazopanib hodnocen v dávkách až do 2000 mg. Únava stupně 3 (toxicita limitující dávku) a hypertenze stupně 3 byly pozorovány každá u 1 ze 3 pacientů, kterým byly podávány dávky 2000 mg, resp. 1000 mg.
Pro předávkování pazopanibem není k dispozici žádné specifické antidotum. Léčba předávkování by měla zahrnovat obecná podpůrná opatření.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Cytostatika, jiná cytostatika, inhibitory proteinkináz, ATC kód: L01XE11
Mechanismus účinku
Pazopanib je perorálně podávaný, silný inhibitor tyrosinkinázy, působící na více cílových místech (tyrosine kinase inhibitor, TKI), na receptorech pro vaskulární endotelový růstový faktor (Vascular Endothelial Growth Factor Receptors) VEGFR-1, -2 a -3, jako inhibitor destičkového růstového faktoru (platelet-derived growth factor) PDGFR-a a -p a receptoru pro SCF (stem cell factor) (c-KIT) s hodnotami IC50 10, 30, 47, 71, 84, resp. 74 nmol. V preklinických hodnoceních inhiboval pazopanib (v závislosti na dávce) ligandem indukovanou autofosforylaci receptorů VEGFR-2, c-Kit a PDGFR-p v buňkách. In vivo inhibuje pazopanib fosforylaci VEGFR-2 indukovanou VEGF v plicích u myší, angiogenezi u různých zvířecích modelů a růst mnohočetných lidských nádorových xenograftů u myší.
Farmakogenomika
Ve farmakogenetické metaanalýze údajů z 31 klinických studií, ve kterých byl podáván pazopanib buď v monoterapii, nebo v kombinaci s jinými léčivy, se vyskytla zvýšená hladina ALT > 5 x ULN (NCI CTC stupeň 3) u 19 % nositelů alely HLA-B*57:01 a u 10 % pacientů bez této alely. V tomto souboru bylo 133 z 2235 (6 %) pacientů nositelem alely HLA-B*57:01(viz bod 4.4).
Klinické studie
Karcinom ledviny (RCC)
Bezpečnost a účinnost pazopanibu u RCC byla hodnocena v randomizované, dvojitě zaslepené, placebem kontrolované multicentrické studii. Pacienti (N = 435) s lokálně pokročilým a/nebo metastazujícím RCC byli rozděleni do skupiny s pazopanibem v dávce 800 mg jednou denně nebo s placebem. Primárním cílem studie bylo zhodnocení a porovnání dvou ramen léčby, pokud jde o přežití bez progrese (progression-free survival, PFS), a hlavním sekundárním cílovým parametrem je celkové přežití (overall survival, OS). Další cílové parametry hodnotily celkovou míru odpovědi a trvání odpovědi.
Z celkového počtu 435 pacientů v této studii bylo 233 pacientů dříve neléčených a 202 pacientů bylo v druhé linii léčby, kteří již podstoupili jednu předchozí léčbu na bázi IL-2 nebo INFa. Výkonnostní stav (performance status dle ECOG) byl mezi skupinou s pazopanibem a placebem podobný (ECOG 0: 42 % vs. 41 %, ECOG 1: 58 % vs. 59 %). Většina pacientů byla ve skupině s nízkým rizikem (39 %) nebo středním rizikem (54 %) podle MSKCC (Memorial Sloan Kettering Cancer Centre)/prognostických faktorů podle Motzera. Všichni pacienti měli nádor histologicky tvořený světlými buňkami (clear cell) nebo s převahou světlých buněk. Přibližně polovina ze všech pacientů měla onemocněním postižené 3 nebo více orgánů a většina pacientů měla na počátku léčby metastatická ložiska v plicích (74 %) a/nebo lymfatických uzlinách (54 %).
V obou ramenech byl podobný poměr pacientů dosud neléčených a již dříve léčených cytokiny (53 % a 47 % v rameni s pazopanibem, 54 % a 46 % v rameni s placebem). V podskupině již dříve léčené cytokiny podstoupila většina pacientů (75 %) předchozí léčbu interferony.
V obou ramenech byl podobný poměr pacientů s předchozí nefrektomií (89 % ve skupině
s pazopanibem a 88 % ve skupině s placebem) a/nebo s předchozí radioterapií (22 % ve skupině s pazopanibem a 15 % ve skupině s placebem).
Primární analýza primárního cílového parametru PFS je založena na hodnocení onemocnění nezávislým radiologickým vyšetřením v celé studijní populaci (dosud neléčení pacienti a pacienti dříve léčení cytokiny).
|
Cílové parametry/Studijní populace |
Pazopanib |
Placebo |
HR (95% IS) |
Hodnota p (jednostranná) |
|
PFS Celková* ITT Medián (měsíce) |
N = 290 9,2 |
N = 145 4,2 |
0,46 (0,34; 0,62) |
< 0,0000001 |
|
Míra odpovědi % (95% IS) |
N = 290 30 (25,1;35,6) |
N = 145 3 (0,5; 6,4) |
< 0,001 |
HR = Relativní riziko (hazard ratio); ITT = Intent to treat; PFS = přežití bez progrese (progression-free survival). * - Populace dříve neléčená a dříve léčená cytokiny.
Obrázek 1: Kaplan-Meierova křivka přežití bez progrese podle nezávislého hodnocení u celkové populace (populace dosud neléčená a již dříve léčená cytokiny) (VEG105192)
Pazopanib irJ = 29Cj
f/nd nn 0.? mpnths
Placete IN - 145)
r/r:U nn mpnths
Ma-am P;itic - 0.46
K% Cl l.D.34, 0.62)
Pí 0.0000001
Mnnths
Osa x; Měsíce, osa y; Podíl pacientů bez progrese, Pazopanib — (N = 290) Medián 9,2 měsíce;
Placebo.....(N = 145) Medián 4,2 měsíce; Relativní riziko = 0,46, 95% interval spolehlivosti
(0,34, 0,62), P < 0,0000001.
Obrázek 2: Kaplan-Meierova křivka přežití bez progrese podle nezávislého hodnocení u populace dříve neléčených pacientů (VEG105192)
0.6
Paiupamb ih 55)
t.'edan Ii.l montiis
Placete (N - 7E)
Med an 2.3 manlhs
Hazaic Katíc - 0.40
P<O.DOODOm
0.0
Mnfiths
Osa x; Měsíce, osa y; Podíl pacientů bez progrese, Pazopanib ---- (N = 155) Medián 11,1 měsíce;
Placebo.....(N = 78) Medián 2,8 měsíce; Relativní riziko = 0,40, 95% Interval spolehlivosti (0,27,
0,60), P < 0,0000001.
Pajopann W -135
r/ed an 7.4 iranns
Piacebo(N = 67)
Hed an 4 2 momris
Hidzarí: Ftá io :: ).o4
m Cl IJ.35. 0.841
ji
HOdttlG
Osa x; Měsíce, osa y; Podíl pacientů bez progrese, Pazopanib — (N = 135) Medián 7,4 měsíce;
Placebo.....(N = 67) Medián 4,2 měsíce; Poměr rizik = 0,54, 95% interval spolehlivosti (0,35,
0,84), P < 0,001.
Podle nezávislého hodnocení byl u pacientů, kteří odpovídali na léčbu, medián doby k dosažení odpovědi 11,9 týdnů a medián trvání odpovědi 58,7 týdnů (VEG105192).
Medián celkového přežití (overall survival, OS), stanovený analýzou finálního přežití specifikovanou v protokolu, byl 22,9 měsíce u pacientů randomizovaných do větve s pazopanibem a 20,5 měsíce u pacientů randomizovaných do větve s placebem [HR = 0,91 (95% IS: 0,71, 1,16; p = 0,224)]. Výsledky OS mohou být zkreslené, protože 54 % pacientů zařazených do větve s placebem dostalo rovněž pazopanib v pokračovací fázi této studie po progresi onemocnění. Šedesát šest procent pacientů zařazených do větve s placebem, oproti 30 % pacientů zařazených do větve s pazopanibem, dostalo po ukončení studie další léčbu.
V dotaznících kvality života (EORTC QLQ-C30 a EuroQoL EQ-5D) nebyl mezi léčebnými skupinami pozorován žádný statisticky významný rozdíl.
Podle nezávislého hodnocení byla ve fázi 2 této studie zahrnující 225 pacientů s lokálně relabujícím nebo metastazujícím renálním karcinomem ze světlých buněk (clear cell CRR) objektivní míra odpovědi 35 % a medián trvání odpovědi 68 týdnů. Medián PFS byl 11,9 měsíců.
Bezpečnost, účinnost a kvalita života při podávání pazopanibu versus při podávání sunitinibu byly hodnoceny v randomizované, otevřené studii fáze III s paralelními skupinami k prokázání non-inferiority (VEG108844).
Ve studii VEG108844 byli pacienti (N = 1110) s lokálně pokročilým a/nebo metastazujícím RCC, kteří nedostávali předchozí systémovou léčbu, randomizováni buď do ramene, ve kterém dostávali pazopanib v dávce 800 mg jednou denně nepřetržitě, nebo do ramene, ve kterém dostávali sunitinib v dávce 50 mg jednou denně v 6týdenních cyklech sestávajících ze 4 týdnů léčby následovaných 2 týdny bez léčby.
Primárním cílem této studie bylo vyhodnotit a porovnat PFS u pacientů léčených pazopanibem proti pacientům léčeným sunitinibem. Demografické charakteristiky byly v obou ramenech obdobné. Charakteristiky onemocnění při úvodním stanovení diagnózy a při screeningu byly vyrovnané mezi oběma rameny, většina pacientů měla nádor histologicky tvořený světlými buňkami (clear cell) a onemocnění stupně IV.
Ve studii VEG108844 bylo dosaženo primárního cíle ve vztahu k PFS a studie prokázala, že pazopanib není horší než sunitinib, přičemž horní hranice 95% IS relativního rizika (HR) byla nižší než hranice non-inferiority 1,25 stanovená v protokolu. Celkové výsledky účinnosti jsou shrnuty v Tabulce 5.
Tabulka 5 Celkové výsledky účinnosti (VEG108844)
|
Cíl |
Pazopanib N = 557 |
Sunitinib N = 553 |
HR (95% IS) |
|
PFS Celkový Medián (měsíce) (95% IS) |
8,4 (8,3; 10,9) |
9,5 (8,3; 11,0) |
1,047 (0,898; 1,220) |
|
Celkové přežití Medián (měsíce) (95% IS) |
28,3 (26,0; 35,5) |
29,1 (25,4; 33,1) |
0,915a (0,786; 1,065) |
HR = relativní riziko (Hazard ratio); PFS = přežití bez progrese (Progression-free survival); P hodnota = 0,245 (2stranná)
Obrázek 4: Kaplan-Meierova křivka přežití bez progrese podle nezávislého hodnocení u celkové populace (VEG108844)
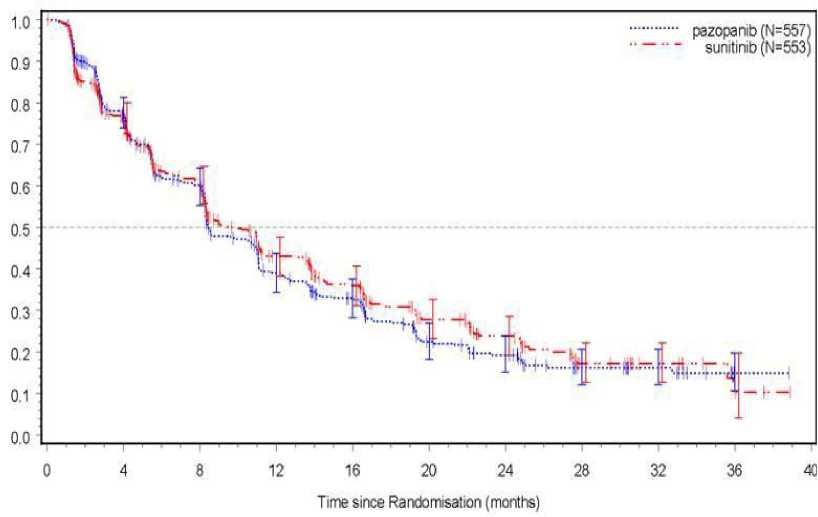
Analýza podskupin u PFS byla provedena pro 20 demografických a prognostických faktorů. 95% interval spolehlivosti pro všechny podskupiny zahrnoval relativní riziko (HR) 1. Ve třech nejmenších z těchto 20 podskupin byl odhad relativního rizika vyšší než 1,25, a to u pacientů bez předchozí nefrektomie [n = 186, HR = 1,403, 95% IS (0,955, 2,061)], s výchozí hodnotou LDH > 1,5x ULN [n = 68, HR = 1,72, 95% IS (0,943, 3,139)] a se špatnou prognózou podle MSKCC [n = 119,
HR = 1,472, 95% IS (0,937, 2,313)].
Účinnost a bezpečnost pazopanibu u STS byly hodnoceny v pivotní randomizované, dvojitě zaslepené, placebem kontrolované multicentrické studii fáze III (VEG110727). Pacienti v celkovém počtu 369 s pokročilým STS byli randomizováni do skupin, kterým byl podáván buď pazopanib v dávce 800 mg jednou denně nebo placebo. Důležité je, že do studie mohli být zařazeni pouze pacienti s vybranými histologickými subtypy STS, proto mohou být účinnost a bezpečnost pazopanibu považovány za potvrzené jen u těchto podskupin STS a léčba má být omezena pouze na tyto subtypy.
Následující typy nádorů splňovaly kritéria pro zařazení do studie:
Fibroblastické (fibrosarkom u dospělých, myxofibrosarkom, sklerotizující epiteloidní fibrosarkom, maligní solitární fibrózní tumory), tzv. fibrohistiocytární (pleomorfní maligní fibrózní histiocytom [MFH], MFH s obřími buňkami, zánětlivý MFH), leiomyosarkom, maligní glomus tumory, sarkomy kosterního svalstva (pleomorfní a alveolární rhabdomyosarkom), vaskulární (epiteloidní hemangioendoteliom, angiosarkom), neurčité diferenciace (synoviální, epiteloidní, alveolární sarkom měkkých tkání, světlobuněčný, desmoplastický tumor z malých kulatých buněk, extrarenální rhabdoidní tumor, maligní mesenchymom, PECom, intimální sarkom), maligní nádor z pochvy periferního nervu, nediferencované sarkomy měkkých tkání dále nespecifikované (not otherwise specified, NOS) a jiné typy sarkomů (neuvedené mezi typy nesplňujícími kritéria pro zařazení do studie).
Následující typy nádorů nesplňovaly kritéria pro zařazení do studie:
Sarkom tukových buněk (všechny subtypy), všechny rhabdomyosarkomy, které nebyly alveolární nebo pleomorfní, chondrosarkom, osteosarkom, Ewingovy sarkomy/primitivní neuroektodermální tumory (PNET), GIST, dermatofibrosarkoma protuberans, inflamatorní myofibroblastický tumor, maligní mezoteliom a smíšené mezodermální nádory dělohy.
Poznámka - pacienti se sarkomy tukových buněk byli vyřazeni z pivotní studie fáze III, protože v předchozí studii fáze II (VEG20002) pozorovaná účinnost pazopanibu (PFS ve 12. týdnu) nedosáhla u sarkomu tukových buněk předem stanoveného poměru, který by dovoloval další klinické zkoušení.
Dalšími klíčovými kritérii pro zařazení do studie VEG110727 byly: histologicky prokázaná přítomnost STS vysokého nebo středního stupně malignity a progrese onemocnění během 6 měsíců léčby metastazujícího onemocnění nebo návrat onemocnění během 12 měsíců (neo)adjuvantní terapie.
98 % pacientů byl předtím podáván doxorubicin, 70 % ifosfamid a 65 % pacientů byla před zařazením do studie podávána nejméně tři chemoterapeutika nebo více.
Pacienti byli rozděleni podle klinického stavu (WHO performance status, WHO, PS) (0 nebo 1) ve výchozím stavu a podle počtu linií předchozí systémové terapie pokročilého onemocnění (0 nebo 1 vs. 2+). V každé léčebné skupině bylo mírně vyšší procentuální zastoupení pacientů se 2+ liniemi předchozí systémové terapie pokročilého onemocnění (58 % ve skupině s placebem a 55 % ve skupině s pazopanibem) proti pacientům s 0 nebo 1 linií předchozí systémové terapie (42 % ve skupině s placebem a 45 % ve skupině s pazopanibem). Medián trvání sledování pacientů (definovaného jako doba od data randomizace do posledního kontaktu s pacientem nebo úmrtí) byl podobný pro obě léčebné skupiny (9,36 měsíců pro skupinu s placebem [rozsah 0,69 až 23,0 měsíců] a 10,04 měsíců pro skupinu s pazopanibem [rozsah 0,2 až 24,3 měsíců]).
Primárním cílem studie byl interval bez progrese (PFS, hodnocený v rámci nezávislého radiologického posouzení), sekundární cílový parametr zahrnoval celkové přežití (OS), celkovou míru odpovědi na léčbu (overall response rate) a dobu trvání odpovědi.
|
Cíl/studijní populace |
Pazopanib |
Placebo |
HR (95 % IS) |
P hodnota (oboustranná) |
|
PFS Celková ITT Medián (týdny) |
N = 246 20,0 |
N = 123 7,0 |
0,35 (0,26; 0,48) |
< 0,001 |
|
Leiomyosarkom Medián (týdny) |
N = 109 20,1 |
N = 49 8,1 |
0,37 (0,23; 0,60) |
< 0,001 |
|
Podskupiny synoviálního sarkomu Medián (týdny) |
N = 25 17,9 |
N = 13 4,1 |
0,43 (0,19; 0,98) |
0,005 |
|
Podskupiny „jiných STS“ Medián (týdny) |
N = 112 20,1 |
N = 61 4,3 |
0,39 (0,25; 0,60) |
< 0,001 |
|
OS | ||||
|
Celková ITT Medián (měsíce) |
N = 246 12,6 |
N = 123 10,7 |
0,87 (0,67; 1,12) |
0,256 |
|
Leiomyosarkom* Medián (měsíce) |
N = 109 16,7 |
N = 49 14,1 |
0,84 (0,56; 1,26) |
0,363 |
|
Podskupiny synoviálního sarkomu* Medián (měsíce) |
N = 25 8,7 |
N = 13 21,6 |
1,62 (0,79; 3,33) |
0,115 |
|
Podskupiny ,jiných“ STS* Medián (měsíce) |
N = 112 10,3 |
N = 61 9,5 |
0,84 (0,59; 1,21) |
0,325 |
|
Míra odpovědi (RR = CR+PR) % (95% IS) Trvání odpovědi Medián (týdny) (95% IS) |
4 (2,3; 7,9) 38,9 (16,7; 40,0) |
0 (0,0; 3,0) |
HR = relativní riziko (Hazard ratio); ITT = Intent to treat; PFS = přežití bez progrese (Progression-free survival); CR = plná odpověď (Complete Response); PR = parciální odpověď (Partial Response). OS = celkové přežití (Overall survival)
* Celkové přežití u konkrétních histologických podskupin STS (leiomyosarkom, synoviální sarkom a , jiné“ STS) je třeba interpretovat s opatrností, z důvodu malého počtu pacientů a širokých intervalů spolehlivosti.
Při hodnocení zkoušejícími bylo pozorováno srovnatelné zlepšení PFS ve prospěch pazopanibu (v celkové ITT populaci HR: 0,39, 95% IS, 0,30 až 0,52, p < 0,001).
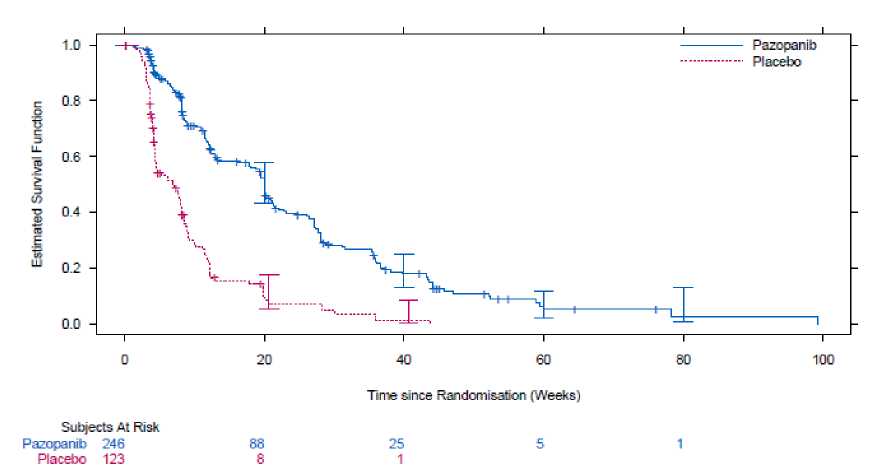
Poznámka: pro každou léčbu jsou znázorněna pásma 95% intervalu spolehlivosti.
V konečné analýze OS provedené po dosažení 76 % případů (280/369) nebyl mezi oběma léčebnými skupinami pozorován významný rozdíl v OS (HR 0,87; 95% IS 0,67; 1,12 p = 0,256).
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem Votrient u všech podskupin pediatrické populace pro léčbu karcinomu ledvin a ledvinné pánvičky (mimo nefroblastom, nefroblastomatózu, světlobuněčný sarkom, mesoblastický nefrom, renální medulární karcinom a rhabdoidní nádor ledvin).
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem Votrient u jedné nebo více podskupin pediatrické populace pro léčbu rhabdomyosarkomu, non rhabdomyosarkomu měkkých tkání a skupiny nádorů Ewingova sarkomu. Informace o použití u dětí viz bod 4.2.
5.2 Farmakokinetické vlastnosti
Absorpce
Po perorálním podání jednotlivé dávky 800 mg pazopanibu pacientům se solidními tumory bylo maximální plazmatické koncentrace (Cmax) s hodnotou přibližně 19 ± 13 pg/ml dosaženo po mediánu
3,5 hodiny (rozmezí 1,0 - 11,9 hodin) a dosažená AUC0-<X) byla přibližně 650 ± 500 pg.h/ml. Při denním podávání dochází k 1,23 až 4násobnému zvýšení AUC0-T.
Při dávkách nad 800 mg pazopanibu nebylo pozorováno žádné odpovídající zvýšení AUC ani Cmax.
Pokud je pazopanib podáván s jídlem, je jeho systémová expozice zvýšená. Podání pazopanibu s tučným nebo nízkotučným jídlem vede k přibližně 2násobnému zvýšení AUC a Cmax. Proto se pazopanib má podávat alespoň 2 hodiny po jídle nebo alespoň jednu hodinu před jídlem (viz bod 4.2).
Po podání rozdrcené 400mg tablety pazopanibu došlo ke zvýšení AUC(0-72) o 46 % a Cmax o přibližně 2násobek a ke zkrácení tmax přibližně o 2 hodiny v porovnání s těmito hodnotami po podání celé tablety. Tyto výsledky naznačují, že biologická dostupnost a rychlost perorální absorpce pazopanibu jsou po podání rozdrcené tablety vyšší než po podání celé tablety (viz bod 4.2).
Vazba pazopanibu na proteiny lidské plazmy in vivo je vyšší než 99 % bez ohledu na koncentraci v rozmezí 10 - 100 pg/ml. Studie in vitro naznačují, že pazopanib je substrátem P-gp a BCRP.
Biotransformace
Výsledky ze studií in vitro prokazují, že metabolismus pazopanibu je zprostředkován primárně CYP3A4 s malým podílem CYP1A2 a CYP2C8. Čtyři hlavní metabolity pazopanibu zodpovídají pouze za 6 % expozice v plazmě. Jeden z těchto metabolitů inhibuje proliferaci lidských endotelových buněk umbilikální žíly stimulovanou VEGF s podobnou účinností jako pazopanib, ostatní jsou 10- až 20násobně méně účinné. Proto je aktivita pazopanibu závislá hlavně na expozici původního pazopanibu.
Eliminace
Pazopanib je po podání doporučené dávky 800 mg eliminován pomalu se středním poločasem
30,9 hodiny. Eliminace probíhá převážně stolicí, renální cestou je eliminováno méně než 4 % podané
dávky.
Zvláštní _ populace
Porucha renálních funkcí: Výsledky naznačují, že méně než 4 % dávky perorálně podaného pazopanibu je vyloučeno močí ve formě pazopanibu a jeho metabolitů. Výsledky z farmakokinetického modelování populací (údaje od subjektů s výchozími hodnotami CLCR v rozmezí od 30,8 ml/min do 150 ml/min) naznačují, že je nepravděpodobné, aby porucha renálních funkcí měla klinicky významný vliv na farmakokinetiku pazopanibu. U pacientů s clearance kreatininu nad 30 ml/min není nutno dávku upravovat. Pacientům s clearance kreatininu pod 30 ml/min je třeba věnovat zvláštní pozornost, protože s podáváním pazopanibu této skupině pacientů nejsou žádné zkušenosti (viz bod 4.2).
Porucha jaterních funkcí:
Mírná:
Mediány Cmax a AUC(0-24) pazopanibu v ustáleném stavu u pacientů s mírnými odchylkami v parametrech jaterních funkcí (definovanými buď jako normální hladina bilirubinu a jakkoli zvýšená hladina ALT nebo zvýšená hladina bilirubinu až do 1,5násobku ULN bez ohledu na hladinu ALT) po podání dávky 800 mg jednou denně jsou srovnatelné s mediány u pacientů s normálními jaterními funkcemi (viz Tabulka 7). U pacientů s mírnými odchylkami v jaterních testech je doporučená denní dávka pazopanibu 800 mg jednou denně (viz bod 4.2).
Středně závažná:
Maximální tolerovaná dávka pazopanibu (MTD) byla u pacientů se středně závažnou poruchou jaterních funkcí (definovanou jako zvýšení hladiny bilirubinu na > 1,5 až 3násobek ULN bez ohledu na hladinu ALT) 200 mg jednou denně. Mediány hodnot Cmax a AUC(0-24) pazopanibu v ustáleném stavu po podání 200 mg pazopanibu jednou denně pacientům se středně závažnou poruchou jaterních funkcí byly na úrovni přibližně 44 %, resp. 39 % odpovídajících mediánů po podání 800 mg jednou denně pacientům s normálními jaterními funkcemi (viz Tabulka 7).
Na základě údajů o bezpečnosti a snášenlivosti by dávkování pazopanibu u subjektů se středně závažnou poruchou jaterních funkcí mělo být sníženo na 200 mg jednou denně (viz bod 4.2).
Mediány hodnot Cmax a ÁUC(0-24) pazopanibu v ustáleném stavu po podání 200 mg pazopanibu jednou denně pacientům se závažnou poruchou jaterních funkcí byly na úrovni přibližně 18 %, resp. 15 % odpovídajících mediánů po podání 800 mg jednou denně pacientům s normálními jaterními funkcemi. Z důvodu snížené expozice a omezené rezervy jater se podávání pazopanibu nedoporučuje u pacientů se závažnou poruchou jaterních funkcí (definovanou jako zvýšení hladiny celkového bilirubinu na > 3násobek ULN bez ohledu na hladinu ALT) (viz bod 4.2).
Tabulka 7: Mediány farmakokinetických parametrů pazopanibu v ustáleném stavu naměřené u subjektů s poruchou jaterních funkcí
|
Skupina |
Testovaná dávka |
Cmax (pg/ml) |
AUC (0-24) (pg x hod/ml) |
Doporučená dávka |
|
Normální jaterní funkce |
800 mg OD |
52,0 (17,1-85,7) |
888,2 (345,5-1482) |
800 mg OD |
|
Mírná porucha jaterních funkcí |
800 mg OD |
33,5 (11,3-104,2) |
774,2 (214,7-2034,4) |
800 mg OD |
|
Středně závažná porucha jaterních funkcí |
200 mg OD |
22,2 (4,2-32,9) |
256,8 (65,7-487,7) |
200 mg OD |
|
Závažná porucha jaterních funkcí |
200 mg OD |
9,4 (2,4-24,3) |
130,6 (46,9-473,2) |
Nedoporučuje se |
OD - jednou denně
5.3 Předklinické údaje vztahující se k bezpečnosti
Preklinický bezpečnostní profil pazopanibu byl hodnocen u myší, potkanů, králíků a opic. Ve studiích s opakovaným podáváním u hlodavců se zdálo, že účinky na různé tkáně (kostní, zubní, nehtová lůžka, reprodukční orgány, hematologické tkáně, ledviny a pankreas) odpovídaly farmakologii inhibice VEGFR a/nebo přerušení signalizační cesty VEGF, přičemž se nejvíce účinků objevovalo při plazmatických hladinách nižších, než jaké jsou pozorované v klinické praxi. Další pozorované účinky zahrnují snížení tělesné hmotnosti, průjem a/nebo morbiditu, a byly buď sekundární k lokálním gastrointestinálním účinkům způsobeným vyšší lokální expozicí sliznice léčivému přípravku (opice) nebo k farmakologickým účinkům (hlodavci). Proliferativní hepatální léze (eozinofilní ložiska a adenomy) byly pozorovány u samic myší při expozicích odpovídající 2,5násobku expozice u lidí podle AUC.
Ve studiích juvenilní toxicity, kdy byl podáván laboratorním potkanům před odstavením od 9. dne postpartum do 14. dne postpartum, způsoboval pazopanib mortalitu a abnormální orgánový růst a vývoj u ledvin, plic, jater a srdce v dávkách přibližně 0,1násobku klinické expozice u dospělého člověka podle AUC. Když byl pazopanib podáván laboratorním potkanům po odstavení ode dne 21 post partum do dne 62 post partum, byly toxikologické nálezy srovnatelné s nálezy u dospělých laboratorních potkanů při srovnatelných expozicích. U lidských pediatrických pacientů je větší riziko vlivu na kosti a zuby v porovnání s dospělými, protože tyto změny, včetně inhibice růstu (kratší končetiny), křehčích kostí a změny tvaru zubů, se vyskytly u juvenilních laboratorních potkanů při dávkách > 10 mg/kg/den (ekvivalentní přibližně 0,1 - 0,2násobku klinické expozice u dospělého člověka podle AUC) (viz bod 4.4).
Bylo prokázáno, že pazopanib je embryotoxický a teratogenní, pokud je podáván potkanům a králíkům při expozicích více než 300násobně nižších, než je expozice u člověka (podle AUC). Účinky zahrnovaly snížení fertility u samic, zvýšení pre a postimplantačních ztrát, časnou resorpci, embryonální letalitu, snížení hmotnosti plodů a kardiovaskulární malformace. U hlodavců byl rovněž pozorován úbytek žlutých tělísek, vyšší počet cyst a ovariální atrofie. Ve studii fertility u samců potkanů nebyly pozorovány žádné účinky na páření a fertilitu, ale byl zaznamenán pokles hmotnosti varlat a nadvarlat se snížením rychlosti tvorby spermií, pohyblivosti spermií a koncentrace spermií ve varlatech a nadvarlatech při expozicích odpovídajících 0,3násobku expozice u člověka podle AUC.
Genotoxicita
Při testech genotoxicity (Amesův test, test aberací chromozómů periferních lidských leukocytů a in vivo mikronukleární test u potkanů) nezpůsoboval pazopanib genetické poškození. Syntetický meziprodukt při výrobě pazopanibu, který je rovněž v malém množství přítomný v konečném léčivém přípravku, nebyl v Amesově testu mutagenní, ale byl genotoxický v testu s myšími lymfomy a v in vivo mikronukleárním testu u myší.
Kancerogenita
Ve dva roky trvajících studiích kancerogenity s pazopanibem byly zaznamenány zvýšené počty adenomů jater u myší a adenokarcinomů duodena u potkanů. Tyto nálezy nepředstavují